INTERKALASI XILENOL ORANGE PADA ZEOLIT DAN
APLIKASINYA SEBAGAI ELEKTRODA TERMODIFIKASI
ZEOLIT UNTUK PENGUKURAN Cd
FITRIYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Interkalasi Xilenol Orange pada Zeolit dan Aplikasinya sebagai Elektroda termodifikasi zeolit untuk Pengukuran Cd adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Fitriyah
SUMMARY
FITRIYAH. Intercalation Xilanol Orange on the Natural Zeolit and Their Application as the Zeolite Modified Electrode for Cd Measurement. Supervised by ETI ROHAETI and LATIFAH K. DARUSMAN.
Zeolite is a mineral inorganic micropores of alumina silicate hydrate compounds with alkali metals and alkaline that has a skeleton-shaped cavity. Zeolite mineral have a distinctive trait that matters, namely is high cation exchange capacity so the zeolite is not only used as nutrient sinks, but can be used to bind heavy metals ions. Zeolite is divided into natural zeolites and zeolite synthesis, generally adsorption capacity of natural zeolite is lower than the zeolite synthesis, so to enhance the capacity of the adsorption, the character of natural zeolite surfaces need to be modified with surface modification process through a variety of methods, one of the method is intercalation. Intercalation is the insertion of the guest species (ion, atom, or molecules ) between layer compound.
The purpose of this research is intercalated color substances is xilenol orange into natural zeolite Lampung and applying it as a selective electrode for the determination of the concntration of ions Cd. Through the process of intercalation is expected to improve the usefulness and added value of the zeolite. Modified zeolite is expected to have a specific surface properties of cadmium ions so that the adsorption can be used as a tools in the set up of selective ion electrode.
Electrode is made by mixing powder carbon, zeolite intercalated, mineral oil on a comparison of 6: 1: 3 so that a homogeneous paste is obtained. Paste is then packed in glass tubes with a diameter of 3 mm in copper wire as the tools which has give electrical contact. Zeolite intercalated xilenol orange prepared by mixing the two grams of zeolite (who had previously been activated) with 100 mL of orange xilenol in the range pH 5–10. Activation of the zeolite is carried out by means of washing away 60 mesh size zeolite with 1 M HCl and heating on temperatures 130o C.
insertion of xilanol orange at first, zeolite can be used as an ion detector electrode Cd2+.
RINGKASAN
FITRIYAH. Interkalasi Xilenol Orange pada Zeolit dan Aplikasinya Sebagai Elektroda Pasta Karbon Termodifikasi Zeolit untuk Pengukuran Cd. Dibimbing oleh ETI ROHAETI dan LATIFAH K. DARUSMAN.
Zeolit merupakan mineral anorganik mikropori berupa senyawa alumina silikat hidrat dengan logam alkali dan alkali tanah yang memiliki struktur kerangka berbentuk rongga. Mineral zeolit mempunyai sifat khas yang penting yaitu kapasitas tukar kation yang tinggi sehingga zeolit tidak hanya dimanfaatkan sebagai penyerap unsur hara, akan tetapi dapat dipergunakan untuk mengikat ion-ion logam berat. Zeolit terbagi menjadi zeolit alam dan zeolit sintesis, kapasitas adsorpsi zeolit alam umumnya lebih rendah daripada zeolit sintesis, sehingga untuk meningkatkan kapasitas adsorpsinya, karakter permukaan zeolit alam perlu diubah dengan melakukan proses modifikasi permukaan melalui berbagai metode, salah satunya dengan metode interkalasi. Interkalasi adalah suatu penyisipan spesies tamu (ion, atom, atau molekul) ke dalam antarlapis senyawa berstruktur lapis.
Tujuan penelitian ini yaitu menginterkalasi zat warna xilenol orange ke dalam zeolit asal daerah Lampung dan mengaplikasikannya sebagai elektroda yang selektif untuk penentuan kadar ion Cd. Melalui proses interkalasi diharapkan dapat meningkatkan kegunaan dan nilai tambah dari zeolit. Zeolit termodifikasi ini diharapkan memiliki sifat permukaan spesifik terhadap penjerapan ion kadmium sehingga dapat digunakan sebagai media pada pembuatan elektroda selektif ion.
Elektroda dibuat dengan mencampurkan serbuk karbon, zeolit terinterkalasi, minyak mineral pada perbandingan 6 : 1 : 3 sehingga diperoleh pasta homogen. Pasta ini selanjutnya dikemas dalam tabung gelas berdiameter 3 mm yang di beri kawat tembaga sebagai media kontak listrik. Zeolit terinterkalasi xilenol orange disiapkan dengan cara mencampurkan dua gram zeolit (yang sebelumnya telah diaktifasi) dengan 100 mL xilenol orange dalam rentang pH 5-10. Aktifasi zeolit dilakukan dengan cara mencuci zeolit ukuran lolos 60 mesh dengan HCl 1M dan memanaskannya pada temperatur 130o C.
Karena memiliki puncak utama XRD pada 22,5; 28,19 serta 30,12. Berdasarkan penelitian ini dapat disarikan bahwa ZMCPE dengan penyisipan xilanol orange pada zeolit terlebih dahulu, dapat digunakan sebagai elektroda pendeteksi ion Cd2+.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
INTERKALASI XILENOL ORANGE PADA ZEOLIT DAN
APLIKASINYA SEBAGAI ELEKTRODA TERMODIFIKASI
ZEOLIT UNTUK PENGUKURAN Cd
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
Judul Tesis : Interkalasi Xilenol Orange pada Zeolit dan Aplikasinya Sebagai Elektroda Termodifikasi Zeolit untuk Pengukuran Cd
Nama : Fitriyah NIM : G451090351
Disetujui oleh, Komisi Pembimbing
Dr. Dra. Eti Rohaeti Azis, M.S
Ketua Prof. Dr. Ir. Latifah K. Darusman, M.S Anggota
Diketahui oleh,
Ketua Program Studi Kimia
Prof. Dr. Dyah Iswantini, M.Agr.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
x
PRAKATA
Puji syukur kehadirat Allah SWT, zat pemilik alam karena atas berkat kemudahannya lah penulis dapat menyelesaikan tesis dengan judul Interkalasi Xilenol Orange pada Zeolit Alam dan Aplikasinya Sebagai Elektroda termodifikasi zeolit untuk Pengukuran Cd.
Pada kesempatan ini penulis ingin menyampaikan penghargaan dan terima kasih kepada semua pihak yang telah banyak memberikan bantuan dan dukungan kepada penulis hingga menyelesaikan studi ini, sebagai berikut :
Dr. Dra. Eti Rohaeti, MS; selaku ketua komisi pembimbing dan Prof.Dr.Ir.Latifah K. Darusman, MS; selaku anggota yang telah banyak
memberikan arahan dan bimbingan kepada penulis mulai dari penyusunan Proposal Penelitian sampai penulisan Tesis ini. Kepada Prof. Dr. Dyah Iswantini,
M.Agr.Sc selaku Ketua Program Studi Kimia atas segala arahan selama masa studi. Seluruh staf dosen kimia dan laboran atas segala arahan, sumbangsih, bantuan dan kerja sama yang baik selama masa studi. My beloved husband, Abdul Darda. Terima kasih untuk segala dukungan, bantuan, cinta dan kasih sayangmu. Special untuk pelita hati kami, my syakura. Sembah sujud dan penghargaan yang sebesar-besarnya penulis persembahkan kepada kedua orang tua, ayahanda H.M Suhaemi dan ibunda Hj.Laelah Hartini beserta seluruh kakak-kakak dan teteh teteh, keponakan-keponakanku tercinta.
Sebagai manusia biasa yang tidak luput dari kesalahan dan kekhilafan. Penulis menyadari sepenuhnya bahwa Tesis ini masih jauh dari kesempurnaan. Olehnya kritik dan saran sangat diharapkan dari semua pihak sehingga dapat menjadi motivasi bagi penulis. Semoga tesis ini dapat bermanfaat
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
DAFTAR PUSTAKA 20
LAMPIRAN
DAFTAR TABEL
Tabel 1. Identifikasi XRD pada puncak utama zeolit sebelum dan sesudah
diaktivasi 12
Tabel 2. Kebolehulangan Pengukuran Cd2+ 18
DAFTAR GAMBAR
Gambar 1. Struktur zeolit mordenit 4
Gambar 2. Struktur zeolit klinoptilolit 4
Gambar 3. Struktur kerangka zeolit dalam dua dan tiga dimensi 5
Gambar 4. Struktur xilenol orange 6
Gambar 5. Diagram Alir Penelitian 8
Gambar 6. Difraktogram sinar X pada zeolit sebelum dan sesudah aktivasi 11 Gambar 7. Difraktogram sinar X pada zeolit sebelum dan sesudah Interkalasi 13 Gambar 8. Profil Spektrum FTIR zeolit aktivasi dan zeolit diinterkalasi XO 15 Gambar 9. Voltamogram pulsa diferensial ZMCPE pada rentang pH 6-10 17 Gambar 10.Voltamogram pulsa diferensial elektroda pasta karbon 17 Gambar 11.Kurva kalibrasi pengukuran Cd(II) nitrat 10-6 M sebanyak 20 kali 19
DAFTAR LAMPIRAN
Lampiran 1. Kurva kalibrasi pulsa diferensial Lampiran 2. Potensiostat EDAQ
1
PENDAHULUAN
Latar Belakang
Zeolit merupakan mineral mikropori anorganik berupa senyawa alumina silikat hidrat dengan logam alkali dan alkali tanah yang memiliki struktur kerangka berbentuk rongga. Gugusan alumina dan silika pada zeolit saling bertaut silang melalui pengikatan atom oksigen sehingga menghasilkan struktur berpori dengan ukuran sekitar 2-4 nm. Kandungan utama zeolit adalah silikon, aluminium dan oksigen dalam kerangka, serta kation, air dan atau molekul lain dalam pori porinya. Mineral zeolit mempunyai sifat khas yang penting, yaitu (1) kapasitas tukar kation yang tinggi, (2) sifat penyaring molekuler, dan (3) dehidrasi dan rehidrasi. Sifat penting yang utama yaitu kapasitas tukar kation yang dimilikinya menyebabkan zeolit tidak hanya dimanfaatkan sebagai penyerap unsur hara, akan tetapi dapat dipergunakan untuk mengikat ion-ion logam berat, yaitu sebagai adsorben.
Berdasarkan asalnya, zeolit dibedakan menjadi dua, yaitu zeolit alam dan zeolit sintetik. Zeolit alam terbentuk selama ribuan tahun dalam bentuk sedimen yang terjadi karena pencampuran debu-debu vulkanis dengan air hujan, air tanah, atau air laut. Sementara zeolit sintetik dibuat di laboratorium. Zeolit alam maupun zeolit sintetik merupakan kristal dengan struktur yang padat. Deposit zeolit di seluruh dunia terdapat tiga jenis utama, yaitu klipnoptilolit, mordenit, dan apatit. Klasifikasi ini didasarkan perbedaan komposisi yaitu bentuk linear, lembaran, atau kristal zeolit (Ulfah et al. 2006).
Kerja adsorpsi zeolit alam umumnya lebih rendah daripada zeolit sintesis, sehingga untuk meningkatkan kapasitas adsorpsinya, karakter permukaan zeolit perlu diubah sifatnya dengan melakukan proses modifikasi permukaan melalui berbagai metode. Aktivasi permukaan zeolit merupakan salah satu metode untuk menghilangkan pengotor dan membuka pori zeolit agar kemampuannya sebagai adsorben dapat lebih optimum. Metode lain yang dapat dilakukan yaitu dengan memodifikasi permukaannnya yang bertujuan untuk mendapatkan sifat yang diinginkan dari suatu zeolit seperti kemampuan interaksi dengan senyawa lain, pengubahan ukuran pori, kemampuan adsorpsi terhadap molekul tertentu serta berbagai manfaat lainnya yaitu dengan modifikasi interkalasi (Mockovciakova et al. 2008).
Interkalasi adalah modifikasi permukaan dengan penyisipan spesies tamu (ion, atom, atau molekul) ke dalam antar lapis senyawa berstruktur lapis. Schubert (2002) mendefinisikan interkalasi merupakan suatu penyisipan suatu spesies pada ruang antarlapis dari padatan dengan tetap mempertahankan struktur berlapisnya. Atom-atom atau molekul-molekul yang akan disisipkan disebut sebagai interkalan, sedangkan yang merupakan tempat yang akan dimasuki atom-atom atau molekul-molekul disebut sebagai interkalat. Metode ini akan memperbesar pori material, karena interkalan akan mendorong lapisan atau membuka antarlapisan untuk mengembang.
Interkalasi pada zeolit yang mampu meningkatkan daya kerjanya sebagai elektroda telah dibuktikan beberapa peneliti. Zendehdel et al. (2007) melaporkan
2
terinterkalasi dengan pewarna morin, kalmagit dan xilenol orange (XO),
menunjukkan puncak yang terukur lebih tinggi dibanding dengan elektroda zeolit tanpa pewarna. Ini memperlihatkan bahwa pewarna berfungsi sebagai agen pengkelat untuk deteksi logam Cu(II). Pada konsentrasi logam Cu(II) yang sebanding, adanya modifikasi oleh zat pewarna pada zeolit NaY menyebabkan kemampuan deteksinya semakin meningkat dibandingkan dengan zeolit NaY tanpa dimodifikasi.
Modifikasi pada zeolit, dalam aplikasi pemanfaatannya selama ini, banyak digunakan pada industri katalisis, jerapan dan aplikasi pemisahan. Pemanfaatan zeolit ini sekarang semakin berkembang, misalnya pemanfataan zeolit sebagai membran pemisahan, sensor kimia, elektroda termodifikasi zeolit, dan aplikasi lainnya. Elektroda termodifikasi zeolit merupakan sensor kimia banyak dikembangkan (Walcarius 1998, Walcarius 1999). Elektroda termodifikasi zeolit yang dikenal dengan ZME (Zeolite Modified Electrode) merupakan suatu sensor
kimia yang memanfaatkan zeolit sebagai penyusunnya. Sifat yang menarik dari zeolit, misalnya kapasitas tukar ion, selektivitas muatan dan bentuk, kestabilan pada suhu tinggi, cenderung murah dan resisten terhadap kondisi suhu ekstrim menjadikan zeolit semakin dikembangkan penggunaannya sebagai ZME (Walcarius et al. 1997).
Elektroda pasta karbon yang termodifikasi zeolit, terutama diaplikasikan pada fotokimia, zeolit yang diinterkalasikan dengan zat pewarna merupakan potensi industri yang menjanjikan yaitu sebagai pigmen pada zeolit. Arvand et al.
(2003) melaporkan bahwa modifikasi elektroda semakin memperlihatkan suatu sifat yang menarik dan menguntungkan ketika metilen biru diimmobilisasi pada mordenit dan digunakan dalam pembuatan elektroda pasta karbon untuk mempelajari oksidasi elektrokatalisis dari asam askorbat. Hasil penelitian Zendehdel et al. (2007) menunjukkan bahwa elektroda termodifikasi zeolit untuk
deteksi logam Cu(II), diantara zeolit yang diinterkalasi dengan XO, morin dan kalmagit memiliki interaksi yang paling baik dimiliki oleh XO. Sampai saat ini, interkalasi XO pada zeolit alam dengan metode pertukaran ion belum dilaporkan. Diperlukan suatu pengetahuan mengenai kemampuan zat pewarna XO yang diinterkalasikan ke zeolit sebagai pigmen kemudian diaplikasikan sebagai elektroda termodifikasi zeolit untuk mendeteksi logam.
Logam yang menjadi target deteksi pada penelitian adalah adalah logam kadmium (Cd). Logam Cd dalam bentuk kation Cd2+ merupakan salah satu polutan utama yang menyebabkan penyakit serius termasuk diantaranya kecacatan mental (Senthilkumar dan Saraswathi 2009). Toksisitas Cd lebih tinggi dari Cu dengan kata lain ambang batas Cd2+lebih rendah dari ambang batas logam Cu2+ sehingga diperlukan alat untuk mendeteksi logam pada konsentrasi yang lebih rendah.
Tujuan Penelitian
Tujuan penelitian ini adalah menginterkalasikan zat warna xilenol orange
3
Manfaat Penelitian
Penelitian ini diharapkan bermanfaat memberikan informasi ilmiah mengenai kemampuan interkalasi XO pada zeolit. Informasi mengenai kinerja zeolit terinterkalasi XO sebagai pemodifikasi elektroda pasta karbon dalam deteksi logam Cd. Hal ini dimasa yang akan datang diharapkan menjadi tekn ologiuntuk mendeteksi logam Cd atau sensor Cd di lingkungan.
Hipotesis Masalah
Interkalasi zeolit alam oleh xilenol orange (XO) dapat dilakukan. Zeolit
terinterkalasi XO dapat diaplikasikan sebagai elektroda pada deteksi (sensor) logam kadmium.
TINJAUAN PUSTAKA
Zeolit
Zeolit merupakan senyawa alumino silikat terhidrasi, dengan unsur utama yang terdiri dari kation alkali dan alkali tanah. Senyawa ini berstruktur tiga dimensi dan mempunyai pori yang rapat berisi molekul air. Rumus empiris zeolit adalah M2/nO. Al2O3. X(SiO2). yH2O dengan (M) kation alkali atau alkali tanah, (n) valensi kation, (X) bernilai 2-10, dan (y) bernilai 2 -7. Muatan listrik yang dimiliki oleh kerangka zeolit, baik yang dimiliki oleh kerangka zeolit yang terdapat di permukaan maupun di dalam pori, menyebabkan zeolit dapat berperan sebagai penukar kation, penjerap dan katalis. Pembentukan zeolit mengandung perbandingan yang besar dari M2+ dan H+ pada Na+, K+ dan Ca2+. Pembentukan zeolit ini bergantung pada komposisi dari batuan induk, suhu, tekanan, tekanan parsial dari air, pH dan aktifitas dari ion-ion tertentu. (PPTM 1997).
Berdasarkan komposisi mineralnya zeolit terbagi menjadi beberapa jenis, diantara lebih dari 40 jenis zeolit alam dan 200 zeolit sintetis yang paling umum adalah mordenit, klinoptilolit, kabaksit, erionit dan pilifsit (Valdes et al. 2006).
Jenis umum yang ditemukan di Indonesia adalah jenis klinoptilolit dan mordenit (Sastiono 1993). Klinoptilolit dan mordenit merupakan alumina dengan kandungan silika yang paling tinggi. Struktur krisal klinoptilolit memiliki saluran yang terlihat dua dimensi, terbentuk melalui lapisan tetrahedral. Kristal mordenit walaupun tampilannya lebih sederhana, namun struktur kristalnya lebih rumit karena memiliki dua tipe yang berbeda pada saluran pori dan sistem ruang kosongnya (Korkuna et al. 2007). Struktur mordenit dan klinoptilolit ditunjukkan
pada Gambar 1 dan Gambar 2.
4
persamaan utama dua jenis tersebut adalah kemampuan pertukaran ion, adsorpsi, dan penyaring molekular.
Sifat dan Karakteristik Zeolit
Zeolit merupakan kelompok silikat yang dikenal dengan tektosilikat yaitu mineral berbasis silika yang hubungan tetrahedral SiO44- nya membangun pola tiga dimensi yang semua atom O nya digunakan bersama dengan tetrahedral tetangganya. Namun demikian beberapa atom Si dapat digantikan oleh atom Al sehingga menghasilkan pengurangan muatan positif pada kerangkanya (Valdes et al. 2006). Karena adanya pengurangan muatan positif, dengan demikian muatan
listrik kristal zeolit tersebut bertambah. Kelebihan muatan ini biasanya diimbangi oleh kation-kation logam K+, Na+, dan Ca2+ dan Mg2+ yang menduduki tempat tersebar dalam struktur zeolit yang bersangkutan. Pada susunan kristal zeolit terdapat dua jenis mordenit dan klinoptilolit. Struktur dari zeolit mordenit dan klinoptilolit ditampilkan pada Gambar 1 dan Gambar 2. Struktur kristal 3 dimensi disajikan di Gambar 3. Zeolit klinoptilolit memiliki kerangka struktur unit tetrahedral [AlO4]5- dan [SiO4] dengan unit bangun sekunder T10O20. Zeolit klinoptilolit alam pasda suhu 25oC dan pada tekanan 2,6666 kPa kapasitas adsorpsinya terhadap H2O dapat mencapai 16 gram H2O/100 gram (Inglezakis et
al. 2004).
Gambar 1Struktur zeolit mordenit (Su dan Norberg 2001)
5
Gambar 3 Struktur kerangka zeolit dalam dua dan tiga dimensi (Valdes et al.
2006)
Ikatan ion Si-O-Si atau Si-O-Al sebagai pembentuk struktur kristal dengan pengisi pori logam alkali sebagai kation yang mudah tertukar (exchangeable cation). Logam Al dalam bentuk tetrahedral sehingga atom Al akan bermuatan
negatif karena berkoordinasi dengan 4 atom oksigen dan selalu dinetralkan oleh kation alkali atau alkali tanah untuk mencapai senyawa yang stabil. Selain jumlah logam alkali yang dapat dipertukarkan (kapasitas tukar kation), jumlah molekul air juga menunjukkan jumlah pori-pori atau volume ruang h7mpa yang akan terbentuk bila unit sel kristal zeolit tersebut dipanaskan.
Sifat yang penting pada pemanfaatan zeolit sebagai elektroda salah satunya adalah kapasitas tukar kation (KTK) yaitu ukuran jumlah kation yang dapat dipertukarkan per berat atau volume. Sifat ini merupakan salah satu karakterisitik zeolit. Nilai KTK tersebut dipengaruhi oleh beberapa faktor antara lain konsentrasi kation yang dipertukarkan dan waktu kontak. Mordenit dan klinoptilolit mempunyai diameter rongga 3x6 Ǻdan 6x7 Ǻ dengan nilai kapasitas tukar kation (KTK) masing- masing sebesar 2,29 meq/g dan 2,54 meq/g. Kapasitas tukar kation pada zeolit bergantung pada beberapa faktor yaitu (1) topologi kerangka (konfigurasi saluran dan ukuran), (2) ukuran dan bentuk (kemampuan polarisasi) ion, (3) kerapatan muatan di saluran, (4) valensi dan kerapatan muatan ion, dan (5) komposisi elektrolit dan konsentrasi dalam larutan eksternal (Khaorapapong et al. 2007).
6
Zat Pewarna Xilenol Orange (XO)
Xilenol orange adalah pereaksi organik yang umumnya digunakan sebagai
indikator untuk titrasi logam. XO merupakan asam polibasa lemah yang tergolong pewarna trifenilmetana. Struktur ini dapat digambarkan dengan rumus H6X, yang menunjukkan adanya kehadiran enam hidrogen terionisasi. Pelarutan XO di dalam air menghasilkan enam ligan dari XO yang didistribusikan dalam kisaran pH 2 sampai 12. Pada pH<5 spektrum absorpsi XO menunjukkan karakteristik absorpsi pada 434 nm dan warna larutannya berwarna kuning. Pada pH>6.5 panjang gelombang yang menunjukan serapan maksimum ditunjukkan pada 580 nm. Xilenol orange menunjukkan perubahan warna sesuai dengan perubahan pH. Hal ini dikarenakan panjang gelombang dimana xilanol orange bekerja, puncak pada 433 nm mulai berkurang dan puncak akan muncul pada 578 nm, puncak ini sangat signifikan pada pH 7. Setelah pH >8 warna larutan menjadi ungu-merah, pada saat inilah XO bekerja maksimum. (lvsic et al. 2009).
XO termasuk indikator kompleksometri yang sangat baik, dan merupakan pereaksi potensiometrik untuk penentuan ion logam. Struktur kimia XO disajikan di Gambar 4.
Gambar 4. Struktur xilenol orange (Lvsic et al. 2009).
XO merupakan reagen pewarna yang non selektif dan bergantung pada pH. Hanya sedikit reagen pewarna yang bekerja spesifik. Madrakian et al. (2005)
melaporkan bahwa reaksi Be(II) dan Al(II) dengan XO membentuk kompleks warna dalam media larutan yang tersubstitusi sempurna. Pada penelitian yang lain, reaksi pengkompleksan antara Pb(II) dan XO telah dilakukan oleh Ensafi et al.
(2008) yang melaporkan bahwa XO merupakan indikator logam yang dapat digunakan untuk penentuan analitik. Pembentukan antara kompleks XO dengan logam Pb(II) cukup stabil. Sebagai agen pengkompleks, ligan pada XO bekerja selektif pada pH 6 dan adsorpsi maksimum XO pada permukaan karbon teraktifasi setelah interaksinya selama 36 jam.
Proses Interkalasi
7
interaksi dipol dan pembentukan ikatan hidrogen. Interkalasi terbentuk jika spesies tuan rumah (host) bersifat isolator dan tidak memiliki muatan permukaan.
Interaksi antara spesies tamu dan lapisan spesies tuan rumah hanya berupa interaksi dipol dan ikatan hidrogen. (3) Interkalasi yang dibentuk karena interaksi dipol antara spesies tamu dan ion-ion antar lapis. Interkalasi dapat terjadi melalui pertukaran molekul-molekul pelarut yang melarutkan ion-ion dalam antarlapis dengan molekul-molekul tamu. Hal tersebut terjadi jika molekul tamu mempunyai polaritas yang tinggi. (4) Senyawa interkalasi yang dibentuk dengan ikatan hidrogen Bila dibandingkan dengan senyawa interkalasi yang lain, maka spesies tamu akan terikat lebih kuat di dalam spesies induk, sehingga deinterkalasi lebih sulit terjadi. (5) Senyawa interkalasi yang dibentuk dari transfer muatan. Interkalasi ini terjadi jika lapisan bahan induk bersifat konduktif.
Elektroda Termodifikasi Zeolit
Zeolit umumnya mengandung silikon, aluminium, dan oksigen dalam kerangka dan kation, air dan atau molekul lain, dengan melakukan proses modifikasi permukaan melalui berbagai metode, karakter permukaan zeolit dapat diubah sifatnya. Cara yang dapat dilakukan adalah dengan memodifikasi pada permukaannya menggunakan senyawa seperti asam untuk membersihkan pori dari logam yang terjerap dan tambahan gugus lainnya. Untuk mendapatkan sifat yang diinginkan dari suatu zeolit misalnya kemampuannya berinteraksi dengan senyawa lainnya, perubahan ukuran pori, kemampuan adsorpsi terhadap suatu adsorbat tertentu dan berbagai hal lainnya, maka dilakukan pengubahan permukaan (Mockovciakova 2008). Pemanfaatan elektrode zeolit termodifikasi dilakukan melalui empat cara yaitu, (1) dispersi zeolit di suatu matriks padat, (2) pemampatan zeolit di substrat konduktif, (3) pelapisan zeolit dengan bentuk lapis tipis di permukaan elektroda padat, dan (4) ikatan kovalen zeolit dengan lapisan permukaan elektrode (Walcarius 1998, Walcarius 1999).
Salah satu sifat yang menguntungkan untuk pengembangan sensor dengan memanfaatkan ZME, yaitu kapasitas tukar ion dari zeolit dan juga selektivitas berupa ukuran, bentuk, muatan molekular zeolit (Zen et al. 2003). Royea (2006)
melaporkan bahwa penelitian yang menyangkut interaksi antara zeolit dan adanya kehadiran molekul selama proses reaksi redoks dan mekanisme promosi transfer elektron pada zeolit modifikasi elektroda merupakan hal yang sangat penting dalam pemisahan muatan fotokimia. Pemanfaatan elektroda termodifikasi zeolit dalam aplikasinya yang penting di bidang elektrokatalisis adalah sebagai sensor, serta nanoelektroda termodifikasi zeolit.
Kadmium (Cd)
8
kerusakan bila terkena uap amoniak dan sulfur hidroksida, titik didihnya 765oC, titik lelehnya 321oC (Palar 1994).
Logam kadmium mempunyai kemampuan untuk mengikat gugus sulfur dan karboksil (-COOH) dari molekul-molekul protein, asam amino dan amida. Zat pencemar Cd dalam air berasal dari buangan industri dan limbah pertambangan (Palar, 1994). Keputusan Menteri Negara Lingkungan Hidup tentang baku mutu limbah cair No.Kep-51/MENLH/10/1995 menyatakan bahwa batas maksimum untuk logam Cd adalah 0,05 mg/L sedangkan keputusan Menteri Kesehatan tentang air minum No.907/MENKES/SK/VII/2002 menyatakan bahwa batas maksimum untuk logam Cd adalah 0,005 mg/L. Menurut Senthilkumar & Saraswathi (2009) diantara kontaminan logam, ion-ion logam berat misalnya Cd2+ dan Pb2+ termasuk ke dalam dua polutan utama yang merupakan penyebab penyakit didalam kehidupan manusia, bahkan termasuk diantaranya kecacatan mental.
METODE Waktu dan Tempat
Penelitian dilaksanakan pada bulan Januari 2011 sampai dengan Juli 2011 bertempat di Laboratorium Bagian Kimia Analitik dan Laboratorium Bersama Departemen Kimia FMIPA IPB.
Penelitian meliputi beberapa tahap, yaitu karakterisasi zeolit, preparasi zeolit, interkalasi zeolit dengan xilenol orange, karakterisasi zeolit hasil
interkalasi dengan xilenol orange, aplikasinya sebagai elektroda zeolit termodikasi pasta karbon serta pengukuran elektrokimia. Diagram alir penelitian dapat dilihat pada Gambar 5. Prosedur untuk menginterkalasikan xilenol orange merujuk pada metode yang dikembangkan oleh Zendehdel et al.(2007) dengan modifikasi
beberapa aspek didalamnya.
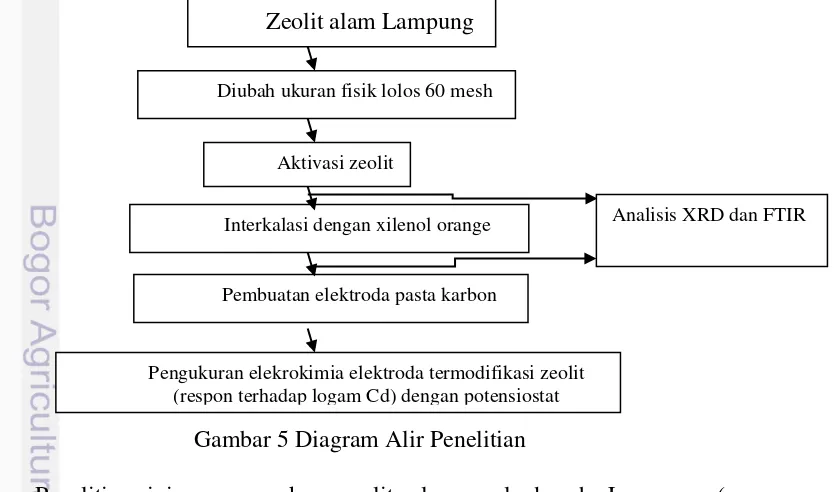
Gambar 5 Diagram Alir Penelitian
Penelitian ini menggunakan zeolit alam asal daerah Lampung (yang selanjutnya disebut zeolit alam) diubah ukuran fisiknya dengan menggiling dan
Zeolit alam Lampung
Aktivasi zeolit
Diubah ukuran fisik lolos 60 mesh
Pembuatan elektroda pasta karbon
Interkalasi dengan xilenol orange Analisis XRD dan FTIR
9
mengayaknya menjadi ukuran lolos 60 mesh. Kemudian untuk mengidentifikasi jenis zeolit yang terdapat dalam contoh dilakukan karakterisasi menggunakan difraksi sinar X.
Preparasi Interkalasi Zeolit dan Xilenol Orange
Sebanyak dua gram zeolit teraktivasi asam dicampurkan dengan 100 mL larutan xilenol orange pada konsentrasi 10-5 M distirer selama 24 jam pada suhu ruang, pH larutan dioptimasi dalam rentang pH antara 5-10 menggunakan larutan
buffer NH4Cl dan NH3. Campuran didekantasi dan padatan dikeringkan pada suhu 100o C selama 5 jam. (Zendehdel et al. 2007).
Pembuatan Elektroda
Zeolit sebanyak 100 mg terinterkalasi xilenol orange dicampur dengan
serbuk karbon sebanyak 600 mg (Zendehdel et al. 2007) dalam mortar.
Selanjutnya, 300 mg minyak mineral ditambahkan sampai diperoleh pasta homogen. Untuk pembuatan elektroda pasta karbon, elektroda kerja dibuat dengan cara mengemasnya ke dalam salah satu ujung tabung kaca yang berukuran diameter 3 mm, kemudian kawat tembaga dimasukkan ke dalam ujung yang lain agar terjadi kontak listrik. Permukaan elektroda dihaluskan menggunakan amplas dan kertas minyak.
Pengukuran Elektrokimia
Pengukuran elektrokimia zeolit (sebelumnya telah diinterkalasi dengan
xilenol orange) yang telah dimodifikasi dengan elektroda pasta karbon atau
dikenal dengan ZMCPE (Zeolit Modified Carbon Paste Electrode). Elektroda
yang telah dibuat direndam dalam 50 mL larutan 5×10-6 M kadmium(II) nitrat dan larutan elektrolit natrium nitrat 0.05 M selama 15 menit, pada rangkaian terbuka. Selanjutnya elektroda dikeluarkan dari larutan dan dicuci dengan air suling triple
destilat. Selanjutnya untuk memperoleh data voltamogram elektroda dicelupkan kembali ke dalam 50 mL 0.05 M larutan natrium nitrat untuk memperoleh data voltamogramnya.Voltamogram dicatat pada diferensial negatif yang berkisar pada skala 0.3V-0.2V.
10
50 mv, kecepatan analisis pada 20 mv s-1, dan pulsa internal pada 0,3 s (Walcarius 1999)
Kebolehulangan Pengukuran
Kebolehulangan pengukuran dari elektroda zeolit terinterkalasi XO ditentukan dengan melakukan pengukuran sebanyak 10 kali terhadap larutan Cd(II) nitrat 10-6 M dalam Na nitrat 0,1 M. (Horta et al. 2005)
HASIL DAN PEMBAHASAN
Preparasi Zeolit dan Aktivasi Zeolit
Zeolit alam umumnya mempunyai ukuran pori yang tidak seragam dan mengandung banyak pengotor. Oleh karenanya, perlu dilakukan proses preparasi dan aktivasi zeolit. Proses aktivasi dapat meningkatkan kemampuan zeolit sebagai adsorben maupun penukar ion (Fatimah 2000). Pada proses preparasi zeolit diayak menggunakan ayakan 60 mesh, untuk kemudian diaktivasi melalui penambahan HCl.
Aktivasi yang dilakukan antara lain, aktivasi secara kimia dan aktivasi secara fisika. Aktivasi secara kimia bertujuan untuk membersihkan permukaan pori, membuang senyawa pengotor, mengatur kembali letak atom yang dipertukarkan. Penambahan pereaksi tertentu sehingga diperoleh pori-pori zeolit yang bersih merupakan prinsip dari aktivasi secara kimia (Fatimah 2000). Proses aktivasi menyebabkan nisbah Si/Al mencapai optimum sehingga zeolit alam mengalami peningkatan luas permukaan dan tidak mengalami kerusakan struktural yang besar. (Weitkamp dan Puppe. 1999). Aktivasi secara kimia
dilakukan dengan penambahan asam HCl 1 M. Aktivasi secara fisik pada zeolit dilakukan dengan pemanasan pada suhu 130 oC selama 3 jam. Proses ini bertujuan menguapkan air yang terperangkap dalam pori-pori zeolit sehingga luas permukaan meningkat (Venglovsky et al. 2005).
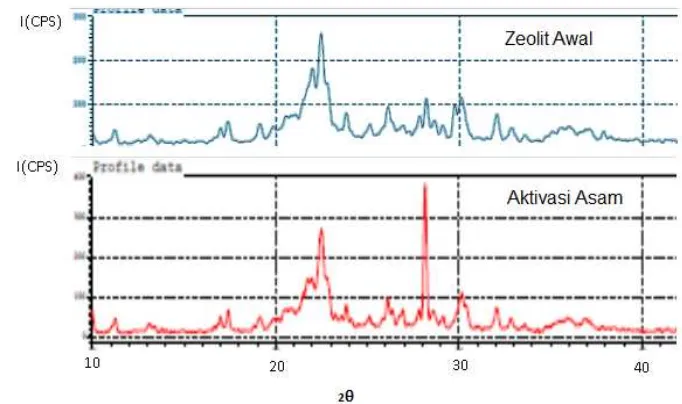
Banyak analisis yang dapat digunakan untuk mengidentifikasi zeolit. Pada penelitian ini, identifikasi zeolit dilakukan melalui analisis XRD dan analisis FTIR. Identifikasi dengan XRD dilakukan pada zeolit sebelum dan setelah aktivasi untuk mengetahui jenis mineral zeolit. Puncak-puncak khas 2θ yang diperoleh dibandingkan dengan data-data nilai 2θ puncak standar. Hasil
11
Aktivasi zeolit menggunakan zeolit yang sebelumnya telah digiling menjadi ukuran lolos 60 mesh. Ukuran ini merujuk pada penelitian yang telah dilakukan oleh Handoko (2001). Struktur kristal serta komposisi utama mineral zeolit sebelum dan sesudah diaktivasi dapat diamati dari difraktogram difraksi sinar X, sebagaimana diperlihatkan pada Gambar 6. Terdapat perbedaan pada difraktogram sebelum dan sesudah aktivasi. Perbedaan terutama pada puncak 2θ = 28.5, pada
zeolit setelah aktivasi nampak bahwa intensitas puncak ini meningkat. Rohaeti (2007) menyatakan bahwa zeolit asal Lampung berjenis klinoptilolit, analisis ini berdasarkan jenis dan komposisi zeolit dari difraksi sinar X.
Menurut Castaldi et al. (2008) puncak utama klinoptilolit terjadi pada 2θ 22.36° dan 22.5° atau dengan λ = 1.54 Ǻ. Puncak tersebut menunjukkan jarak bidang d 3.98 Ǻ dan 3.95Ǻ. Berdasarkan analisis kedua puncak tersebut dapat
dikatakan zeolit asal Lampung ini memiliki jenis klinoptilolit.
Gambar 6 Difraktogram sinar X pada zeolit sebelum dan sesudah aktivasi
Difraktogram difraksi sinar-X sampel zeolit memberikan informasi tentang jenis mineral dan tingkat kristalinitas struktur komponen penyusun sampel. Jenis
mineral penyusun sampel ditunjukan oleh daerah munculnya puncak (2θ).
Sedangkan tingkat kristalinitas struktur komponen ditunjukkan oleh tinggi rendahnya intensitas puncak. Puncak (2θ) 22,50 pada zeolit sebelum aktivasi intensitas I/I0 mengalami penurunan intensitas dari 100 menjadi 54. Penurunan I/I0 dikarenakan ada kenaikan intensitas pada puncak (2θ) 28,17 (d=3.16 Å) dari 39 menjadi 100, meningkatnya intensitas puncak pada zeolit memperlihatkan bahwa dengan adanya proses aktivasi asam kemurnian zeolit menjadi semakin bertambah.
Berdasarkan penelitian, diketahui bahwa puncak puncak utama dari hasil XRD yaitu pada 2θ: 22,50o (d=3.95 Å), 28,19o (d=3,16 Å), dan 30,12o (d=2,96 Å). Menurut Castaldi et al. (2008) puncak spesifik klinoptilolit yaitu 2θ pada 22,36o
(d=3,98 Å) dan 22,50o (d=3.95 Å). Oleh karena itu berdasarkan data pada puncak B
12
utama XRD yang ada pada Tabel 1, dan merujuk pada data sekunder (lampiran 3) zeolit yang digunakan dalam penelitian pada sebelum ataupun sesudah aktivasi ini adalah jenis mineral klinoptilolit. Namun demikian karena zeolit yang digunakan adalah zeolit alam, ada beberapa kemungkinan ketidakmurnian pada kandungan zeolit yang digunakan, sehingga kandungan klinoptilolitnya bukanlah klinoptilolit murni. Hal ini dapat dilihat dari hasil analisis XRD yang menunjukkan adanya pergeseran puncak utama zeolit antara sebelum aktivasi dan sesudah aktivasi yaitu pada puncak pada 2θ=28,17, pergeseran puncak tersebut kemungkinan dikarenakan adanya proses pemanasan pada saat aktivasi yang mengakibatkan adanya kandungan mineral zeolit selain klinoptilolit yaitu puncak mordenit. Pada saat sebelum aktivasi puncak mineral mordenit 2θ=28,17 belum terlihat dikarenakan porinya belum terbuka kemungkinan karena adanya pengotor maupun kandungan air yang terdapat dalam zeolit, namun setelah diaktivasi puncak tersebut baru dapat terlihat (Treacy dan Higgins, 2001).
Berdasarkan analisis tersebut kandungan zeolit alam Lampung mineral utamanya yaitu klinoptilolit yang mengandung mineral mordenit. Zeolit klinoptilolit merupakan zeolit alam yang mengandung kadar silika yang tinggi, daya tukar kationnya relatif besar sedangkan zeolit modernit memiliki sistem kristal ortorombik. Zeolit modernit memiliki sifat-sifat sebagai berikut, struktur kristal kerangka berbentuk tiga dimensi, swelling sangat kecil, kestabilan panas
tinggi, kestabilan radiasi sedang, adsorpsi tinggi, penukar kation sedang, penyaring molekul tinggi, dan sifat katalis yang tinggi (Rahmawati et al. 1994).
Zeolit modernit seperti halnya klinoptilolit memiliki potensi yang besar untuk dikembangkan sebagai elektroda selektif ion karena memiliki sifat adsporsinya yang tinggi. Dengan melihat potensi yang dimiliki zeolit alam yang digunakan dalam penelitian, maka elektroda ini diharapkan berpotensi menjadi elektroda kerja yang selektif dan memiliki sensitifitas yang tinggi.
13
Interkalasi Xilenol Orange pada Zeolit
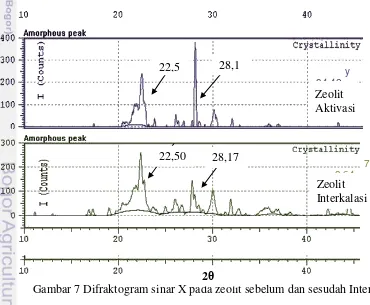
Karakterisasi struktur zeolit pada zeolit yang belum dan telah diinterkalasi dilakukan menggunakan XRD. Difraktogram sinar-X sampel zeolit memberikan informasi tentang jenis mineral dan tingkat kristalinitas struktur komponen penyusun sampel, sehingga dengan adanya senyawa yang bergabung dengan senyawa tertentu, dapat diamati dari adanya pergeseran puncak. Adanya interkalasi dari senyawa XO terhadap zeolit, diharapkan dapat teramati dari pergeseran puncak XRD zeolit sebelum dan sesudah interkalasi. Hasil analisa XRD pada penelitian ini dapat dilihat pada Gambar 7.
Berdasarkan Gambar 7 perbedaan yang cukup signifikan pada puncak utama XRD 2θ 28,17(d=3,95 Å) pada saat zeolit sebelum dan sesudah interkalasi, yaitu terlihat dari intensitas puncak (I/I0). Intensitas yang semula bernilai 100 kemudian setelah zeolit diinterkalasi mengalami penurunan menjadi 30.
Penurunan intensitas ini kemungkinan dikarenakan adanya jerapan XO ke dalam zeolit sehingga kemurnian zeolit mengalami penurunan, masuknya suatu senyawa tertentu pada zeolit menyebabkan kristalinitas mengalami penurunan. Ini dapat terlihat pada zeolit aktivasi nilai kristalinitas adalah 94,42 sedangkan setelah diinterkalasi dengan XO kristalinitas mengalami penurunan menjadi 73,64. Pada puncak utama yang mencirikan jenis mineral klinoptilolit yaitu pada 2θ
22,50(d=3,95 Å sebelum aktivasi), setelah diinterkalasi mengalami pergeseran menjadi 2θ 22,42 (d=3,95 Å).
Gambar 7 Difraktogram sinar X pada zeolit sebelum dan sesudah Interkalasi 2θ
14
Adanya pergeseran tinggi puncak puncak pada XRD serta intensitas yang mengalami perubahan pada puncak utama 2θ dapat membuktikan bahwa XO telah terinterkalasi pada zeolit. Hal ini dapat menjelaskan bahwa XO yang terinterkalasi pada zeolit menyebabkan intensitas kemurnian zeolit mengalami penurunan. Oleh karena itu dapat dsimpulkan bahwa XO dapat masuk ke dalam zeolit melalui metode interkalasi.
Dari Gambar 7 dan dengan merujuk kepada data sekunder (lampiran 3) juga dapat disimpulkan bahwa zeolit yang digunakan merupakan zeolit alam yang mengandung kemungkinan ketidakmurnian pada kandungan zeolit yang digunakan, sehingga kandungan klinoptilolitnya bukanlah klinoptilolit murni. Hal ini dapat dilihat dari hasil analisis XRD yang menunjukkan adanya pergeseran puncak utama zeolit antara sebelum aktivasi dan sesudah aktivasi yaitu pada puncak pada 2θ=28,17, pergeseran puncak tersebut kemungkinan dikarenakan adanya proses pemanasan pada saat aktivasi yang mengakibatkan adanya kandungan mineral zeolit selain klinoptilolit yaitu puncak mordenit. Selain klinoptilolit, mineral mordenit juga terkandung pada zeolit alam Lampung namun pada saat sebelum aktivasi melalui proses pengasaman puncak mineral mordenit 2θ=28,17 belum terlihat dikarenakan porinya belum terbuka atau karena tertutupi mineral pengotor lainnya.
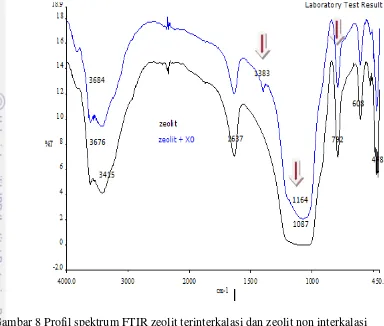
Analisis FTIR Interkalasi Xilenol Orange pada Zeolit
Untuk memperkuat hasil analisa, spektrofotometri FTIR juga digunakan untuk mengidentifikasi zeolit. Hasil analisis dapat dilihat pada Gambar 8. Secara
spektroskopis, zeolit dapat diamati pada rentang bilangan gelombang 300˗1300
cm-1. Bilangan gelombang tersebut merupakan daerah utama serapan ikatan tetrahedral dari komponen utama penyusun zeolit, SiO44- dan AlO45-. Rentangan simetri O-Al-O atau O-Si-O pada internal tetrahedral akan muncul pada daerah 650-720 cm-1 sedang untuk pertautan eksternal akan muncul pada daerah 750-820 cm-1. Tekukan Si-O atau Al-O akan muncul pada daerah 420-500 cm-1, sedangkan serapan pada daerah 950-1250 cm-1 menunjukkan rentangan asimetri (Wietkamp dan Puppe 1999), sedangkan menurut Mutngimaturohmah et al (2005) bahwa pada zeolit rentangan asimetri ditunjukkan pada pita 1076,2 cm-1
dan pada zeolit aktivasi ditunjukkan pada pita 1087,8 cm.
Hasil penelitian menunjukkan tekukan Si-O atau Al-O terdapat pada daerah 458 dan 608 cm-1 untuk zeolit (sebelum interkalasi) serta daerah 466.46 cm-1 dan 461 cm-1 untuk zeolit+XO (interkalasi), ini menunjukkan adanya rentangan asimetri zeolit yang telah teraktivasi yaitu pada pita antara 1087 cm-1. Sedangkan menurut Wietkamp dan Puppe (1999), untuk serapan external linkage akan
15
Gambar 8 Profil spektrum FTIR zeolit terinterkalasi dan zeolit non interkalasi Li et al (2005) melakukan penelitian dengan memasukan TiO2 pada zeolit. Hasil penelitiannya menunjukkan bahwa pita serapan pada daerah antara zeolit yang diaktivasi dengan zeolit yang sudah terinterkalasi dengan TiO2 menunjukkan bahwa bilangan gelombang 3610 cm-1 (vibrasi stretching OH), antara zeolit murni dan zeolit-TiO2 pita spektrum menjadi lebih sempit karena adanya geseran dari TiO2 terhadap OH. Pada penelitian ini daerah serapan OH yaitu pada 3676 cm -1pada zeolit yang teraktivasi juga mengalami pergeseran pita menjadi lebih sempit dibandingkan setelah diinterkalasi begitu juga pada daerah 950-1250 cm-1. Pita-pita serapan menjadi lebih lemah setelah adanya interkalasi. Hal ini kemungkinan dikarenakan adanya yang gugus yang masuk pada zeolit sehingga mengubah struktur senyawa semula.
16
diduga dapat terjadi karena XO memiliki gugus SO3 sehingga menyebabkan adanya serangan HSO3 dari XO pada proton H dari zeolit. Atom S pada SO3 memiliki momen dipol positif karena kerapatan elektron ditarik ke atom O yang memiliki nilai kelektronegatifan 3,5 sedangkan keelektronegatifan S hanya 2,5 (Sykes, 1996). Sehingga terjadi serangan elektron π dari ikatan aromatik (dari gugus XO) ke elektrofil sulfur, mendorong muatan keluar dari elektronegatif O membentuk senyawa antara dan kemudian menyerang gugus hidrogen pada zeolit. Oleh karena itu, hal ini memperlihatkan bahwa telah terjadi interkalasi XO ke dalam zeolit dengan adanya gugus sulfat dari XO melalui mekanisme pertukaran dengan gugus hidrogen (H).
Aplikasi Zeolit Sebagai Elektroda Untuk Menentukan Logam Cd
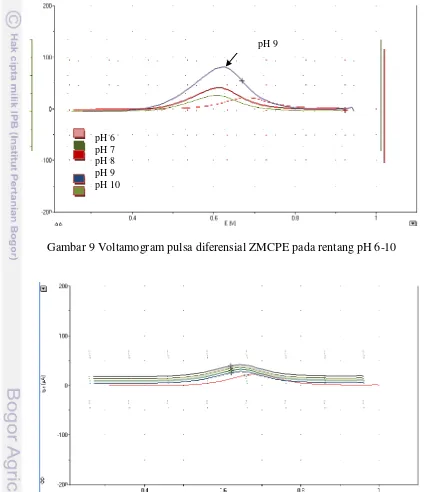
Pada penelitian ini dibuat dua macam elektroda kerja yaitu elektroda kerja pasta karbon dan elektroda kerja pasta karbon termodifikasi, hal ini untuk membandingkan pengaruh keberadaan zeolit dan XO. Elektroda kerja dibuat dalam berbagai variasi pH dengan tujuan untuk melihat dalam rentang pH manakah elektroda kerja tersebut bekerja optimal, selain itu elektroda kerja dibuat dalam beberapa variasi, Gambar 9 menampilkan voltammogram pulsa diferensial pengukuran dari 5.10-6 M Cd (II) pada pH 6 sampai10 menggunakan potensiostat EDAQ. ZMCPE sebagai elektroda kerja. Untuk pengukuran dengan elektroda pasta karbon ditunjukan pada Gambar 10. Dari kedua Gambar tersebut dapat terlihat adanya perbedaan puncak arus.
Berdasarkan Gambar 9, arus puncak terendah untuk elektroda zeolit yang diinterkalasi dengan XO yaitu pada pH 6, namun jika dibandingkan dengan elektroda pasta karbon tanpa adanya interkalasi (Gambar 10) puncak arus voltammogramnya lebih tinggi dibandingkan yang tanpa adanya interkalasi. Arus puncak untuk pengukuran Cd (II) ini diperoleh pada masing-masing kondisi dengan voltammetri dengan scan pulsa w 50 ms-1 dan pulsa H 100 mV, rate 10
mVs-1
Dari Gambar 9, dan 10 dapat dilihat bahwa dengan adanya interkalasi menunjukkan perubahan arus yang lebih besar, pada Gambar 9 pengukuran antara pH 6 sampai 10 memperlihatkan adanya kenaikan puncak arus yang signifikan. Kenaikan puncak linier dengan kenaikan pH, namun demikian ketika pH mencapai 9, di titik inilah kurva mencapai puncak maksimum. Sehingga ketika pH mencapai pH 10 puncak arus mengalami penurunan kembali. Berdasarkan kenaikan serta penurunan kembali puncak yang cukup signifikan, memperlihatkan bahwa XO bekerja maksimum pada pH 9.
Berdasarkan hasil voltamogram, adanya kenaikan dan kemudian diikuti dengan penurunan kembali puncak kemungkinan dikarenakan dalam larutan air terjadi pembentukan ligan XO, dimana pembentukan ligan tersebut bekerja optimum dalam kisaran pH 2 sampai pH 12 (Lvsic et al. 2009). Penelitian ini
17
Zeolit memiliki kemampuan dalam menjerap dan menukar ion dari suatu larutan yang bersifat spesifik. Akan tetapi, kemampuan zeolit sebagai penukar ion perlu ditingkatkan. Proses interkalasi menggunakan XO mampu meningkatkan kemampuan zeolit sebagai penukar dan penjerap ion. Xilenol Orange sebagai chemical modifier pada zeolit alam diharapkan dapat meningkatkan pengukuran
ion Cd2+ disebabkan meningkatnya sensitivitas penjerapan terhadap ion Cd.
Gambar 9 Voltamogram pulsa diferensial ZMCPE pada rentang pH 6-10
Gambar 10 Voltamogram pulsa diferensial elektroda pasta karbon
pH 6 pH 7 pH 8 pH 9 pH 10
18
Kebolehulangan Pengukuran
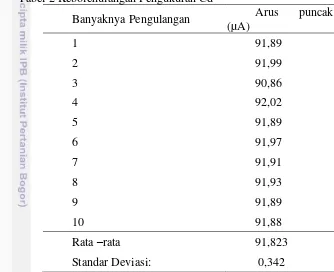
Kebolehulangan pengukuran dari elektroda zeolit terinterkalasi XO ditentukan dengan melakukan pengukuran sebanyak 10 kali terhadap larutan Cd nitrat 10-6 M dalam Na nitrat 0,1 M. Hasil pengukuran ditunjukkkan pada Tabel 2 dan Gambar 11.
Tabel 2 Kebolehulangan Pengukuran Cd2+
Banyaknya Pengulangan (µA) Arus puncak
1 91,89
Tabel 2 memperlihatkan bahwa hasil kebolehulangan pengukuran ion Cd dalam larutan elektrolit pendukung NaNO3 dengan elektroda zeolit terinterkalasi XO mampu memberikan hasil pengukuran yang konsisten dan linier. Kekonsistenan dan kelinieran ini ditunjukkan oleh hasil pengukuran dengan beberapa elektroda nilainya tidak banyak bergeser. Syarat kebolehulangan yang baik adalah jika hasil pengukuran menunjukkan nilai yang relatif konstan. Selain itu, dapat pula dilihat dari nilai standar deviasi yang relatif kecil, yaitu sebesar 0,342. Oleh karena itu, berdasarkan pengukuran Cd2+10-6M menggunakan elektroda zeolit terinterkalasi XO, memperlihatkan kebolehulangan yang relatif baik dan stabil.
Variasi Amplitudo pada Pengukuran Elektroda Zeolit pH 9
19
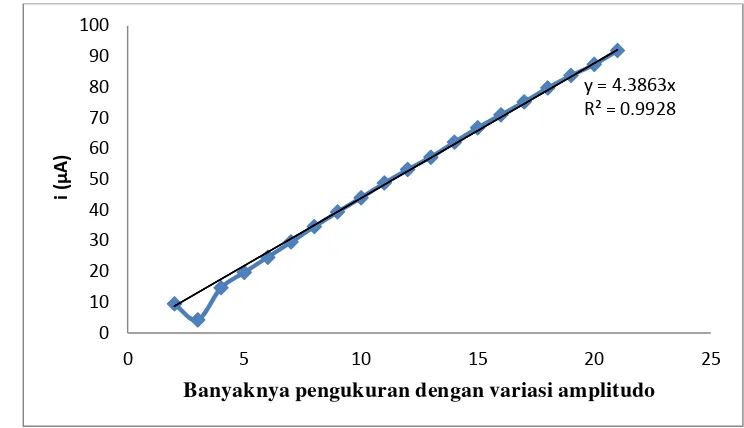
Nampak bahwa nilai R2 adalah sebesar 0,992. Hal ini menunjukkan bahwa elektroda yang dibuat menunjukkan kelinieran yang baik pada konsentrasi 10-6 M dan pada pengukuran dengan voltammetri pulsa diferensial dengan variasi amplitudo 10-100 mV, frekuensi 15 Hz, dan E 300-1000mV. Voltamogram pulsa diferensialnya dapat dilihat pada lampiran 1.
Gambar 11 Kurva kalibrasi pengukuran Cd(II) nitrat 10-6 M sebanyak 20 kali adanya penurunan kristalinitas dibandingkan zeolit tanpa interkalasi. Zeolit terinterkalasi ini telah meningkatkan kemampuan deteksi elektroda pasta karbon untuk pengukuran Cd2+. Arus puncak tertinggi dicapai pada interkalasi pH 9, dihasilkan arus puncak sebesar 92µA untuk pengukuran Cd2+ 1×10-6M.
Saran
Perlu penelitian lanjutan mengenai keselektifan dari elektroda termodifikasi zeolit xilenol orange dengan menggunakan beberapa macam larutan logam berat.
20
DAFTAR PUSTAKA
Alam, BRN. 2009. Pembuatan katalis H-zeolit dari zeolit untuk reaksi metanol menjadi gasoline [tesis]. Semarang (ID): Institut Teknologi Semarang. Arvand M, Sohrabnejad SH, Mousavi MF, Shamsipour M, Zanjanchi MA. 2003.
Electrochemical study of methilene blue incorporated into mordenite type zeolite and its application for amperometric determination of ascorbic acid in real samples. Anal Chim Act 491:193-201.
Castaldi S, Rizzo M, Cacco G. 2008. Cadmium adsorption on vermiculite, zeolite and pumice: Batch experimental studies. Anal Chim Act 593:198-206.
Ensafi AA, Shiraz Z. 2008. On-line separation and preconcentration of lead(II) by solid-phase extraction using activated carbon loaded with xylenol orange and its determination by flame atomic absorption spectrometry. J hazard Mater 150: 554-559.
Fatimah Iis. 2000. Penggunaan Na-zeolit alam teraktivasi sebagai penukar ion Cr (III) dalam larutan. Logika 4(5):25-34
Handoko SD. 2001. Preparasi katalis Cr/zeolit melalui modifikasi zeolitalam. [tesis]. Jember (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Jember.
Horta,DG.,et al. 2005 Cyclic Voltammetry of carbon paste electrode
(CPE-Chalcopyrite): Evaluation of the repeatability. J Spectrochi Act Part A
61:1938-1944.
Inglezakis, V.J, Grigoropoulou,H. 2004. Effects of operating condistions on The Removal of heavy metals by zeolite in fixed bed reactors. J hazard Mater
112: 37-43.
Kazemian H, Modarress H, Kazemi M, Farhadi F. 2009. Synthesis of submicron zeolite LTA particles from natural clinoptilolite and industrial grade chemicals using one stage procedure. J Powder Tech 196:22-25.
Khaorapapong N, Ogawa M. 2007. Solid-state intercalation of 8-Hydroxyquinoline into Li(I), Zn(II)- and Mn(II)-montmorillonites. J App Sci 35:31-38.
Korkuna O, Leboda R, Skubiszewska-Zieba J, Vrublevs’ka T, Gun’ko VM,
Ryczowski J. 2006. Structural and physicochemical properties of natural zeolites: clinoptilolite and mordenite. J micropore mesopors mater.
87:243-254.
Li et al. 2005. Surface effect of natural zeolite (clinoptilolite) on thephotocatalytic activity of TiO2. App surf Sci. 252:1410–1416.
Lvšić AG, Jovic O, puac RM, Hrenar T. 2009. Spectroscopic studies of interaction between xylenol orange and cationic surfactant in aqueous solution. J molec struc. 929: 149-153.
Madrakian T, Afkhami A, Borazjani M, Bahram M. 2005. Partial least-squares regression for the simultaneous determination of aluminum and beryllium in geochemical samples using xylenol orange. J Spectrochi Act Part A
61:2988-2994.
Močkovciakovă A, Matik M, Orolinovă Z, Hudec P, Kmecovă E. 2008. Structural
21
Mutngimaturrohmah, Gunawan, Khabibi. 2005. Aplikasi zeolit alam terdealuminasi dan termodifikasi HDTMA sebagai adsorben fenol. J Ilmu Dasar 5:108-113.
Palar H. 1994. Pencemaran dan toksikologi logam berat. Jakarta (ID): Rineka
Cipta.
PPTM. 1997. Bahan galian industri. Bandung (ID): PPTM.
Rahmawati, Sutarti. 1994. Zeolit. Yogyakarta: Direktorat Jendral Pertambangan
Umum Pusat Pengembangan Teknologi Mineral.
Rohaeti E. 2007. Pencegahan Pencemaran lingkungan oleh logam berat krom limbah cair penyamakan kulit (studi kasus di kabupaten Bogor) [disertasi]. Bogor (ID). Sekolah Pascasarjana IPB.
Royea WJ, Hamann TW, Brunschwig BS, Lewis NS. 2006. J Phys Chem B
110:19433.
Rusman, Falah II, Alim DRS. 1999. Interkalasi Cu Pada karbon Aktif dan Pemanfaatannya Sebagai Katalis Dehidrasi Amilalkohol. Indonesia J Chem
1:23-29.
Sastiono A. 1993. Perilaku mineral zeolit dan pengaruhnya terhadap perkembangan tanah [disertasi]. Bogor (ID): Program Pascasarjana IPB. Sykes. 1996. Estimation of crystallinity in flyash-based zeolite-A using XRD and
IR spectroscopy. Environmental Materials Unit, National Environmental Engineering Research Institute. India. Nagpur :2147-2151.
Schubert U. 2002. Synthesis of Inorganic Materials. London. Willey-VCH:45-59.
Shentilkumar S, Saraswati R. 2009. Electrochemical sensing of cadmium and lead ions at zeolite modified electrodes: optimization and field measurements.
Sensor and actuators 2:65-75.
Su Bao-Lian, Norberg V. 2001. Quantitative characterisation of H-Mordenite zeolite structure by infrared spectroscopy using benzene adsorption. J Coll Surf 187-188:311-318.
Treacy M.M.J, Higgins J.B. 2001. Collection of Simulated XRD powder patterns for zeolites. Published on behalf of the structure commision of the international zeolit association:184-186.
Ulfah EM, Yasnur FA, Istadi. 2006. Optimasi pembuatan katalis zeolit x dari tawas, NaOH, dan water glass dengan response surface methodology. Bull Chem Reac Eng Cat 1:26-32.
Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and zeolit-based materials in analytical chemistry. Trends in Analytical Chem 25.1:24-30.
Venglovsky. J. et al. 2005. Evolution of temperature and chemical parameters during composting of the pig slurry solid fraction amended with natural zeolite. Biores Technol 96: 181-189.
Walcarius A. 1998. Factors affecting the analytical applications of zeolite modified electrodes: indirect detection of non electroactive cations. J Anal Chim Act 388:79-91.
Walcarius A. 1999. Zeolite modified electrodes in electro analytical chemistry: review. J Anal Chim Act 384: 1-16.
22
Weitkamp J, Puppe L. 1999. Catalysis and Zeolites: Fundamental and Applications. Berlin: Spinger-Verlag
Zen J-M, Kumar AS, Tsai D-M. 2003. Recent updates of chemically modified electrodes chemistry. Review department of chemistry national Chung Hsing University Taichung 402.
23
24
Lampiran 1. Kurva kalibrasi pulsa diferensial
25
Lampiran 2. Potensiostat EDAQ
Gambar (a). Detektor potensiostat EDAQ (Dokumen pribadi 2010)
26
28
RIWAYAT HIDUP
Penulis dilahirkan di Serang Banten pada tanggal 18 Mei 1985. Penulis merupakan anak ke 5 dari 6 bersaudara dari orang tua bernama H. Marsaid Suhaemi dan ibunda bernama Hj. Laelah Hartini. Saat ini penulis bekerja sebagai staf pengajar di Fakultas Teknik Universitas Banten Jaya. Pendidikan S1 penulis selesaikan di Universitas Lampung pada tahun 2007 jurusan Kimia. Selama masa studi penulis pernah mengikuti seminar di Kasetsart University Thailand, Bangkok. Selain itu penulis juga aktif pada DEMA Pascasarjana dan HIMPAS IPB.