AKTIVITAS SELULOLITIK DAN KARAKTERISASI
AKTINOMISET ASAL TANAH GAMBUT
EKA ASTUTY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Aktivitas Selulolitik dan
Karakterisasi Aktinomiset Asal Tanah Gambut adalah karya saya dengan arahan
dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada
perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya
yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam
teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
ABSTRACT
EKA ASTUTY. Activityof Cellulolytic and Characterization Actinomycetes from Peat Soils. Under direction of YULIN LESTARI and ANJA MERYANDINI.
In the peat soil, various groups of microorganism decomposing peat are present, including actinomycetes. Eighty isolates of actinomycetes were isolated from peat soil samples. Congo red clearing zone assay was used for qualitative observation of cellulolytic activity and it was found that 20 isolates showed positive results with clear zone around the colony. Cellulase production was assayed by measuring the amount of glucose liberated in µ mol mL-1 min-1 by using the dinitrosalicylic acid assay method. Among the twenty isolates, the isolates 15 and 42 were found to have relatively higher cellulase enzyme activity both qualitatively and quantitatively compared with the others. Maximum production of cellulase by isolate 15 and 42 were detected on day-30 and day-15, respectively, and showed CMCase, Avicel, and FPase activities which indicated a synergy of endoglucanase and exoglucanase in the cellulase enzyme system of the tested isolates. Furthermore, morphological characteristics of 15 and 42 isolates were compared to other reference strains, belongs to Streptomyces species. The analysis of nucleotida of 16S rRNA showed that isolate 15 were closely related to the Streptomyces diastaticus with maximum identity 98% and isolate 42 were closely related to the Streptomyces exfoliatus with maximum identity 94%. Meanwhile phylogenetic analysis showed that isolate 15 homologous to isolate 42 with a bootstrap value of 100%. This study provided important basic information on potential cellulolytic from actinomycetes group.
RINGKASAN
EKA ASTUTY. Aktivitas Selulolitik dan Karakterisasi Aktinomiset Asal Tanah Gambut. Dibimbing oleh YULIN LESTARI dan ANJA MERYANDINI.
Gambut di Indonesia umumnya merupakan gambut ombrogen yaitu gambut yang pembentukannya dipengaruhi curah hujan. Gambut seperti ini tergolong kurang subur karena terbentuk dari tanaman pepohonan yang kadar kayunya tinggi. Pengaruh pasang surut air sungai atau laut yang tidak mencapai lahan dapat menyebabkan gambut ini memiliki kondisi lahan miskin hara. Tanah gambut terbentuk dari akumulasi bahan organik yang dihasilkan dari dekomposisi bahan tanaman yang tidak sempurna, sehingga kandungan bahan organik tanah gambut tinggi dan tidak mudah terdegradasi di alam. Akumulasi bahan organik sebagai hasil perombakan tidak sempurna sisa jaringan tanaman yg mati dipacu oleh faktor-faktor lingkungan antara lain suhu rendah, pH rendah, dan pasokan hara yang sedikit sehingga proses perombakan berjalan lambat dan sisa tumbuhan terus menimbun tahun demi tahun dan terjadilah deposit gambut.
Selulosa merupakan komponen utama penyusun dinding sel tanaman dan hampir tidak pernah ditemui dalam keadaan murni di alam. Secara alami selulosa terproteksi dari degradasi dengan adanya hemiselulosa dan lignin. Biodegradasi selulosa di alam dilakukan oleh mikroorganisme yang memiliki kemampuan mendegradasi selulosa melalui aktivitas enzim selulolitik yang terdiri atas tiga tipe enzim utama yaitu ekso-β-glukanase (selobiohidrolase), endo-β-glukanase dan β -glukosidase yang secara sinergis bekerja dalam hidrolisis selulosa. Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikroba selulolitik menjadi senyawa sederhana berupa glukosa, CO2 dan hidrogen yang sangat berguna
sebagai zat hara bagi tumbuhan dan organisme tanah lainnya. Aktinomiset merupakan kelompok mikroorganisme yang tersebar luas di lingkungan darat, air tawar dan laut. Aktinomiset memainkan peran penting dalam dekomposisi bahan organik dan dengan demikian mengisi pasokan nutrisi dalam tanah dan diantara berbagai genera aktinomiset yang telah diidentifikasi sejauh ini, Streptomyces dinilai cukup signifikan mampu mengurai bahan organik dengan memproduksi enzim hidrolitik, seperti selulase dan xilanase. Penelitian ini bertujuan untuk mengkaji aktivitas selulolitik aktinomiset indigenous asal tanah gambut, karakterisasi morfologi dan identifikasi isolat terpilih berdasarkan 16S rRNA.
isolat-isolat aktinomiset yang diperoleh memiliki 3 tipe penataan rantai sporayang dimiliki genus Streptomyces yaitu rectiflexibiles(RF), retinaculiaperti(RA) dan spirales(S). Sebagian besar isolat memiliki tipe penataan rantai spora spirales, kemudian rectiflexibiles dan terakhir retinaculiaperti. Penataan rantai spora dapat digunakan untuk membedakan morfologi antar isolat.
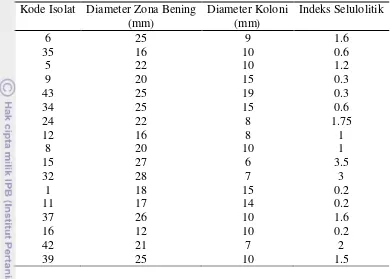
Pengujian kemampuan selulolitik 20 isolat aktinomiset dilakukan dengan menggunakan uji merah kongo sebagai langkah penapisan awal untuk identifikasi kemampuan kualitatif selulolitik isolat. Hasil uji menunjukkan bahwa setelah inkubasi selama 4 hari, 20 isolat aktinomiset menunjukkan hasil positif dengan terbentuknya zona bening yang ukurannya berkisar antara 16-25 mm sehingga diperoleh nilai indeks selulolitik yang berkisar antara 0.3-3.5. Aktivitas spesifik enzim selulase ini ditandai dengan nisbah diameter zona bening terhadap diameter koloni isolat yang ditumbuhkan pada media agar bersumber karbon CMC. Isolat 15 dan 42 merupakan dua isolat dengan nilai indeks selulolitik masing-masing 3.5 dan 2 yang lebih tinggi dibandingkan isolat-isolat uji lainnya. Pengukuran aktivitas selulase berdasarkan zona bening yang terbentuk bersifat kualitatif, lebar zona bening tidak menunjukkan jumlah aktivitas selulase, sehingga diperlukan uji aktivitas selulase secara kuantitatif.
Pengukuran aktivitas enzim selulase dilakukan dengan menggunakan enzim ekstrak kasar dan glukosa sebagai standar pada konsentrasi 0.02 mg/ml - 0.2 mg/ml. Aktivitas selulase isolat 15 dan 42 meningkat seiring dengan meningkatnya biomassa sel, namun masing-masing isolat menunjukkan aktivitas selulase dan kemampuan tumbuh yang berbeda. Aktivitas selulase tertinggi isolat 15 diperoleh pada hari ke-30 sebesar 0.3 nKat/ml sedangkan isolat 42 memiliki aktivitas selulase yang lebih tinggi yaitu sebesar 0.8 nKat/mL yang diperoleh pada hari ke-15. Produksi metabolit sekunder oleh Streptomyces umumnya bertepatan dengan, atau sedikit mendahului, perkembangan miselia udara di permukaan kultur padat sedangkan pada kultur cair, umumnya terbatas hingga fase stasioner. Setiap bakteri selulolitik memiliki aktivitas enzim selulase yang berbeda-beda, tergantung pada hubungan kompleks yang melibatkan berbagai faktor seperti sumber karbon, kualitas selulosa, nilai pH, suhu, ketersediaan induser, aditif medium, aerasi dan waktu pertumbuhan. Kedua isolat uji juga diketahui dapat memanfaatkan ketiga substrat uji yakni Carboxymethyl cellulose, Avicel, dan Whatmann Filter Paper No.1, yang menunjukkan bahwa kedua isolat tersebut memiliki aktivitas selulolitik melalui CMCase, Avicel, dan FPase. Hal ini menunjukkan adanya sinergi dalam sistem enzim selulase yang dihasilkan isolat uji. Dalam hal ini, disebut endo-ekso sinergi antara endoglukanase dan eksoglukanase karena selulase yang disekresikan memiliki aktivitas pada CMCase dan Avicel.
nilai Max Identity kurang dari 97%. Namun, idealnya, identifikasi taksonomi bakteri untuk validitas dan akurasi ilmiah perlu dilakukan berdasarkan polyphasic approach yaitu pendekatan dengan menggunakan kombinasi dari metode pengujian fenotip (uji biokimia, analisis asam lemak, dan analisis numerik) dan metode pengujian genotip (hibridisasi DNA, analisis kandungan G+C, dan analisis 16S rRNA). Berdasarkan hasil konstruksi filogenetik yang menggunakan metode neighbor-joining, menunjukkan isolat 15 dan 42 memiliki percabangan yang sama dengan nilai bootstrap sebesar 100%. Kedua isolat berada pada satu clade (kelompok) yang sama dan berada diluar clade Streptomyces hasil blast dan outgroup-nya. Nilai bootstrap >95% adalah signifikan secara statistik dan
mengindikasikan “support” untuk membentuk sebuah clade. Nilai bootsrap
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
AKTIVITAS SELULOLITIK DAN KARAKTERISASI
AKTINOMISET ASAL TANAH GAMBUT
EKA ASTUTY
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Aktivitas Selulolitik dan Karakterisasi Aktinomiset Asal
Tanah Gambut
Nama : Eka Astuty
NIM : G351090181
Disetujui
Komisi Pembimbing
Dr. Ir. Yulin Lestari Prof. Dr. Anja Meryandini, M.S.
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB
Mikrobiologi
Prof. Dr. Anja Meryandini, M.S. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan
sejak bulan Januari 2011 ini berjudul Aktivitas Selulolitik dan Karakterisasi
Aktinomiset Asal Tanah Gambut. Terima kasih penulis ucapkan kepada Dr. Ir.
Yulin Lestari dan Prof. Dr. Anja Meryandini, M.S. selaku pembimbing.
Penghargaan penulis sampaikan kepada staf dan laboran di laboratorium
Mikrobiologi IPB dan laboratorium Bioteknologi Hewan dan Biomedis, PPSHB
IPB yang telah membantu selama penelitian. Ucapan terima kasih penulis
sampaikan kepada Dr. Suryani, M.Sc. sebagai penguji ujian tesis atas saran dan
masukan yang diberikan.Ucapan terima kasih juga penulis sampaikan kepada
Mikrotropisian 2009 dan Mikrotropisian 2010 yang telah banyak membantu dalam
pelaksanaan penelitian. Terima kasih tak terhingga juga penulis sampaikan kepada
Ayahanda tercinta H.Abd.Rachman, Ibunda tercinta Hj. Nur Azijah, juga
adik-adikku tercinta, Muh. Azwan Rachman, Muh. Azwar Rachman, dan Muh. Aslam
Rachman atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2012
RIWAYAT HIDUP
Penulis dilahirkan di Rappang pada tanggal 31 Oktober 1985 sebagai anak
pertama dari empat bersaudara dari pasangan Abd.Rachman dan Nur Azijah.
Pendidikan Sarjana ditempuh di Program Studi Biologi, Fakultas MIPA UNHAS
Makassar, lulus tahun 2009. Kesempatan untuk melanjutkan ke program Magister
DAFTAR ISI
Halaman
DAFTAR TABEL………...…….. xiv
DAFTAR GAMBAR……… xv
DAFTAR LAMPIRAN………... xvi
PENDAHULUAN Latar Belakang………... 1
Tujuan Penelitian………... 2
Manfaat Penelitian……… 2
Waktu dan Tempat Penelitian………..… 3
TINJAUAN PUSTAKA Lahan Gambut……….. 5
Karakter Fisik Gambut………. 5
Karakter Kimia Gambut………... 6
Selulosa ……… 6
Selulase ………... 8
Akinomiset ………... 8
Aktinomiset sebagai Penghasil Enzim Pendegradasi Selulosa ……….. 9
16S rRNA ……… 10
BAHAN DAN METODE Isolasi Aktinomiset……….. 11
Pengelompokan berdasarkan Warna Koloni (Colour Grouping)……. 11
Uji Kemampuan Selulolitik……….. 11
Pengukuran Aktivitas Selulase Aktinomiset ………... 11
Pengukuran Aktivitas Selulase pada Substrat Spesifik ………. 12
Identifikasi Isolat Aktinomiset Terpilih………..……….. 13
HASIL DAN PEMBAHASAN Morfologi Aktinomiset Asal Tanah Gambut………... 15
Pengelompokan berdasarkan Warna Koloni (Colour Grouping).…… 15
Kemampuan Selulolitik Aktinomiset Asal Tanah Gambut ……… 17
Pengukuran Aktivitas Selulase pada Substrat Spesifik 21
Identifikasi Isolat Aktinomiset Terpilih……… 24
KESIMPULAN………...…….. 27
DAFTAR PUSTAKA……… 29
DAFTAR TABEL
Halaman
1 Kemampuan selulolitik isolat aktinomiset asal tanah gambut …………. 19
2 Hasil BlastN sekuens 16S rRNA isolat 15 dan 42 ……… 24
DAFTAR GAMBAR
Halaman 1 Keragaman penataan rantai spora dari 20 isolat aktinomiset ………… 172 Aktivitas selulase isolat 15 dalam media cair CMC ……… 20
3 Aktivitas selulase isolat 42 dalam media cair CMC ……… 21
4 Aktivitas selulase isolat 15 pada substrat spesifik ……….. 23
5 Aktivitas selulase isolat 42 pada substrat spesifik ……….. 23
6 Profil DNA hasil amplifikasi gen penyandi 16S rRNA dengan PCR pada Isolat 15 dan 42 ………. 24
7 Pohon filogenetik dari sekuens 16S rRNA isolat 15 dan 42 ………….. 25
DAFTAR LAMPIRAN
Halaman 1 Komposisi media ……….. 362 Morfologi koloni isolat-isolat aktinomiset berdasarkan perubahan warna pada media Oatmeal, YMA, dan YSA ……… 38
PENDAHULUAN
Latar Belakang
Indonesia memiliki areal hutan gambut seluas kurang lebih 19.7 juta
hektar yang terdapat di Sumatera 8.3 juta hektar, Kalimantan 6.8 juta hektar dan
Irian Jaya 4.6 juta hektar (Page et al. 1999). Gambut di Indonesia umumnya merupakan gambut ombrogen yaitu gambut yang pembentukannya dipengaruhi
curah hujan. Gambut seperti ini tergolong kurang subur karena terbentuk dari
tanaman pepohonan yang kadar kayunya tinggi. Pengaruh pasang surut air sungai
atau laut yang tidak mencapai lahan dapat menyebabkan gambut ini memiliki
kondisi lahan miskin hara (Radjaguguk 1997). Tanah gambut terbentuk dari
akumulasi bahan organik yang dihasilkan dari dekomposisi bahan tanaman yang
tidak sempurna, sehingga kandungan bahan organik tanah gambut tinggi dan
tidak mudah terdegradasi di alam. Menurut Maltby (1992), akumulasi bahan
organik sebagai hasil perombakan tidak sempurna sisa jaringan tanaman yg mati
dipacu oleh faktor-faktor lingkungan antara lain suhu rendah, pH rendah, dan
pasokan hara yang sedikit sehingga proses perombakan berjalan lambat dan sisa
tumbuhan terus menimbun tahun demi tahun dan terjadilah deposit gambut.
Beberapa sifat kimia tanah gambut yang berpengaruh terhadap dinamika dan
penyediaan hara bagi tanaman adalah memiliki pH rendah dan kapasitas tukar
kation yang tinggi serta kejenuhan basa rendah (Koesnandar et al. 2005). Pada kondisi ini ketersediaan nutrisi terutama K, Ca, dan Mg rendah karena berada
dalam bentuk yang terikat sehingga sulit dimanfaatkan tanaman.
Selulosa merupakan komponen utama penyusun dinding sel tanaman dan
hampir tidak pernah ditemui dalam keadaan murni di alam, secara alami
terproteksi dari degradasi dengan adanya hemiselulosa dan lignin. Biodegradasi
selulosa di alam dilakukan oleh mikroorganisme yang memiliki kemampuan
mendegradasi selulosa melalui aktivitas enzim selulolitik yang terdiri atas tiga tipe
enzim utama yaitu ekso-β-glukanase (selobiohidrolase), endo-β-glukanase dan β
-glukosidase yang secara sinergis bekerja dalam hidrolisis selulosa (Malherbe &
Cloete 2002). Selobiohidrolase I dan II dari ekso-β-glukanase menghidrolisis
selulosa yang tidak larut menjadi selodekstrin dan selobiosa yang terlarut.
Selobiosa kemudian dipecah menjadi 2 unit glukosa oleh β-glukosidase. Sistem
enzim ini memiliki spesifikasi yang berbeda, namun bekerja bersama
mendegradasi selulosa menjadi monomer (Lynd et al. 2002). Selulosa dari sisa tumbuhan dan organisme lain diurai oleh mikrob selulolitik menjadi senyawa
sederhana berupa glukosa, CO2 dan hidrogen yang sangat berguna sebagai zat
hara bagi tumbuhan dan organisme tanah lainnya (Nannipieri et al. 2003). Nurani
et al. (2007) melaporkan bahwa perlakuan menggunakan limbah dari industri minyak sawit yang dijadikan lapisan atas pada tanah gambut dan diinokulasi
dengan konsorsium mikrob dapat meningkatkan pH dari 3.50 menjadi 5.47,
menurunkan kapasitas tukar kation hingga 73% dan meningkatkan kejenuhan basa
hingga 40% serta mengoptimalkan rasio C/N.
Aktinomiset merupakan kelompok mikroorganisme yang tersebar luas di
lingkungan darat, air tawar dan laut. Menurut Hamedani et al. (2012) aktinomiset
memainkan peran penting dalam dekomposisi bahan organik dan dengan
demikian mengisi pasokan nutrisi dalam tanah. Diantara berbagai genera
aktinomiset yang telah diidentifikasi sejauh ini, Streptomyces dinilai cukup signifikan mampu mengurai bahan organik dengan memproduksi enzim hidrolitik,
seperti selulase dan xilanase. Isolat aktinomiset dari genus Streptomyces yang berasal dari Taman Nasional Bukit Duabelas Jambi, diketahui memiliki aktivitas
enzim CMC-ase sekitar 7.2-7.3 unit enzim (Kanti 2005). Potensi aktinomiset asal
tanah gambut dalam mendegradasi selulosa belum banyak dikaji. Oleh karena itu,
penelitian untuk menguji potensi isolat aktinomiset indigenous yang berasal dari
tanah gambut, penting untuk dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji aktivitas selulolitik aktinomiset
indigenus asal tanah gambut, karakterisasi morfologi, dan identifikasi isolat
terpilih berdasarkan 16S rRNA.
Manfaat Penelitian
Penelitian ini diharapkan mampu mendapatkan isolat aktinomiset dari
tanah gambut yang memiliki aktivitas selulolitik dan isolat tersebut
diharapkan dapat dikembangkan lebih lanjut untuk mengetahui kemampuannya
mendegradasi selulosa dari biomassa tanaman yang banyak melimpah di alam,
salah satunya di lahan gambut. Kajian pemanfaatan enzim selulase dalam bidang
industri misalnya industri deterjen, tekstil dan kertas juga penting dilakukan.
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Januari 2011 sampai dengan Maret
2012. Bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas
MIPA, Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB-LPPM, Institut
TINJAUAN PUSTAKA
Lahan Gambut
Lahan gambut merupakan suatu ekosistem lahan basah yang dibentuk oleh
adanya penimbunan atau akumulasi bahan organik yang berasal dari reruntuhan
vegetasi dalam kurun waktu lama. Akumulasi ini terjadi karena lambatnya laju
dekomposisi dibandingkan dengan laju penimbunan bahan organik. Seperti
gambut tropis lainnya, gambut di Indonesia dibentuk oleh akumulasi residu
vegetasi tropis yang kaya akan kandungan lignin dan nitrogen. Karena lambatnya
proses dekomposisi, di lahan gambut masih dapat dijumpai batang, cabang dan
akar yang berukuran besar (Page et al. 2002).
Lahan gambut dalam keadaan alami selalu tergenang air sepanjang tahun
sehingga tidak memungkinkan untuk digunakan sebagai lahan budidaya, kecuali
terlebih dahulu diadakan reklamasi. Dengan kondisi alami yang selalu basah maka
proses perombakan atau pematangan tanah gambut menjadi terhambat. Oleh
karena itu diperlukan perbaikan tata air dengan tujuan memberikan suasana yang
kondusif bagi proses perombakan atau pematangan tanah gambut dengan
masuknya oksigen. Proses perombakan atau pematangan tanah penting untuk
meningkatkan kesuburan tanah (Moorer & Shearer 1997).
Karakter Fisik Gambut
Kadar air tanah gambut berkisar antara 100-1.300% dari berat keringnya,
artinya gambut mampu menyerap air hingga 13 kali bobotnya. Kadar air yang
tinggi menyebabkan BD menjadi rendah, gambut menjadi lembek dan daya
menahan bebannya rendah. BD tanah gambut lapisan atas bervariasi antara 0.1-0.2
g cm-3 tergantung pada tingkat dekomposisinya (Mutalib et al. 1991). Sifat fisik tanah gambut lainnya adalah sifat mengering tidak balik. Gambut yang telah
mengering, dengan kadar air kurang dari 100% (berdasarkan berat), tidak bisa lagi
menyerap air jika dibasahi. Gambut yang mengering ini sifatnya sama dengan
kayu kering yang mudah hanyut dibawa aliran air dan mudah terbakar. Dalam
keadaan kering gambut yang terbakar menghasilkan energi panas yang lebih besar
apinya bisa merambat di bawah permukaan sehingga kebakaran lahan bisa meluas
tidak terkendali (Nugroho et al. 1997).
Karakter Kimia Gambut
Lahan gambut umumnya mempunyai tingkat kemasaman yang relatif
tinggi dengan kisaran pH 3-5. Gambut oligotropik yang memiliki substratum pasir
kuarsa di Berengbengkel, Kalimantan Tengah memiliki kisaran pH 3.25-3.75
(Salampak 1999). Sementara itu gambut di sekitar Air Sugihan Kiri, Sumatera
Selatan memiliki kisaran pH yang lebih tinggi yaitu antara 4.1-4.3 (Hartatik et al.
2004).
Karakteristik kimia lahan gambut di Indonesia sangat ditentukan oleh
kandungan mineral, ketebalan, jenis mineral pada substratum (di dasar gambut),
dan tingkat dekomposisi gambut. Kandungan mineral gambut di Indonesia
umumnya kurang dari 5% dan sisanya adalah bahan organik. Fraksi organik
terdiri atas senyawa-senyawa humat sekitar 10-20% dan sebagian besar lainnya
adalah senyawa lignin, selulosa, hemiselulosa, lilin, tannin, resin, suberin, protein,
dan senyawa lainnya.
Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tumbuhan.
Kandungan selulosa pada dinding sel tumbuhan tingkat tinggi sekitar 35-50% dari
berat kering tanaman (Lynd et al. 2002). Selulosa merupakan polimer glukosa
dengan ikatan β-1.4 glukosida dalam rantai lurus. Bangun dasar selulosa berupa
suatu selobiosa yaitu dimer dari glukosa. Rantai panjang selulosa terhubung
secara bersama melalui ikatan hidrogen dan gaya van der Waals (Perez et al. 2002). Selulosa mengandung sekitar 50-90% bagian berkristal dan sisanya bagian
amorf (Aziz et al. 2002). Selulosa tidak memiliki rasa, tidak berbau, hidrofilik,
tidak larut dalam air, bersifat chiral dan biodegradable (dapat didegradasi). Selulosa dapat dipecah menjadi unit-unit glukosa dengan perlakuan kimia dengan
asam konsentrat pada suhu tinggi. Selulosa berasal dari unit D-glukosa, yang
terkondensasi melalui ikatan glikosidik- β (1 → 4). Motif ikatan ini kontras
dengan ikatan glikosidik-α (1 → 4) yang terdapat pada pati, glikogen, dan
tidak melingkar atau tidak terjadi percabangan. Dibandingkan dengan pati,
selulosa juga jauh lebih kristal. Pati mengalami transisi dari kristal menjadi amorf
jika dipanaskan melampaui 60-70°C dalam air (seperti dalam memasak), selulosa
membutuhkan suhu 320°C dan tekanan 25 MPa untuk menjadi amorf dalam air
(Nishiyama et al. 2002)
Banyak sifat selulosa tergantung pada panjang rantai atau derajat
polimerisasi, jumlah unit glukosa yang membentuk satu molekul polimer.
Selulosa dari pulp kayu memiliki panjang rantai yang khas antara 300 dan 1700
unit; kapas dan serat tanaman lainnya serta selulosa bakteri memiliki panjang
rantai berkisar dari 800-10.000 unit. Molekul dengan panjang rantai yang sangat
kecil yang dihasilkan dari pemecahan selulosa yang dikenal sebagai selodekstrin;
berbeda dengan selulosa berantai panjang, selodekstrin biasanya larut dalam air
dan pelarut organik. Tanaman yang berasal dari selulosa biasanya terkontaminasi
dengan hemiselulosa, lignin, pektin dan zat lainnya, sedangkan selulosa mikrob
cukup murni, memiliki kadar air jauh lebih tinggi, dan terdiri dari rantai panjang
(Klemm et al. 2005).
Selulosa telah menarik perhatian dunia sebagai sumber daya yang dapat
dikonversi menjadi produk berbasis bio dan bioenergi. Namun saat ini, sejumlah
besar limbah selulosa pertanian, industri dan kota telah terakumulasi atau tidak
digunakan secara efisien karena tingginya biaya proses pemanfaatannya (Kim et al. 2003). Oleh karena itu, telah menjadi lebih dari cukup menarik minat secara ekonomi untuk mengembangkan proses perlakuan efektif dan pemanfaatan limbah
selulosa sebagai sumber karbon murah.
Selulosa digunakan secara luas sebagai sumber makanan oleh berbagai
organisme termasuk jamur dan bakteri (Davison & Blaxter 2005). Jamur dan
bakteri memiliki sistem enzimatik selulase yaitu, ekso-β-1.4-glukanase (EC
3.2.1.91), endo-β-1.4-glukanase (EC3.2.1.4), dan β-1.4-glukosidase (EC 3.2.1.21).
Komponen-komponen enzimatik bertindak secara berurutan dalam sistem yang
sinergis untuk memfasilitasi pemecahan selulosa dan konversi biologis menjadi
sumber energi, berupa glukosa (Beguin & Aubert 1994). Endo-β-1.4-glukanase
secara acak menghidrolisis ikatan β -1.4 dalam molekul selulosa dan ekso-β
menjadi glukosa oleh β-1.4-glukosidase (Bhat & Bhat 1997). Secara keseluruhan,
proses enzimatik untuk menghidrolisis bahan selulosa dapat dicapai melalui reaksi
kompleks yang sinergis dari berbagai komponen enzimatik dalam proporsi
optimal (Tomme et al. 1995).
Selulase
Selulase adalah enzim kompleks yang memotong secara bertahap rantai
selulosa menjadi glukosa. Enzim ini terdiri dari eksoselulase atau
eksobiohidrolase, endoselulase atau endo β-1,4-glukanase dan β-1,4-glukosidase
atau selobiase. Selulase terdiri dari selobiohidrolase (CBH atau 1,4, β-D-glukan
selobiohidrolase, E.C 3.2.1.91), endo-β-1,4-glukanase (EG atau endo-2,4-β
-D-glukan 4 -D-glukanohidrolase, EC 3.2.1.4) dan β-glukosidase (BG, EC 3.2.1.21).
Selulase menghidrolisis selulosa dengan produk utama glukosa, selobiosa dan
selooligosakarida (Anindyawati 2010).
Berbagai kelompok mikroorganisme dari kapang, bakteri dan
aktinomisetes dapat menghasilkan selulase. Kapang dari jenis Trichoderma dan Aspergillus sangat banyak ditemui sebagai penghasil hemiselulase. Selain itu, menurut Chandel et al. (2007), beberapa kelompok mikroorganisme seperti Clostridium, Cellulomonas, Trichoderma, Penicillium, Neurospora, Fusarium, Aspergillus dan sebagainya mempunyai aktivitas selulolitik dan hemiselulolitik yang tinggi.
Aktinomiset
Berdasarkan klasifikasinya, Aktinomiset termasuk kelas Schizomycetes,
ordo Actinomycetales yang dikelompokkan menjadi empat familia, yaitu:
Mycobacteriaceae, Actinomycetaceae, Streptomyceae, dan Actinoplanaceae.
Genus yang paling banyak dijumpai hampir 70% adalah Streptomyces, sedangkan
genus lain Nocardia, dan Micromonospora. Genus Streptomyces memiliki kemampuan untuk mendegradasi selulosa, hemiselulosa, dan lignin yang banyak
terdapat pada tanaman (Holt et al. 1994; Madigan et al. 2000)
Aktinomiset termasuk dalam kelompok bakteri berfilamen, gram positif
dengan % GC tertinggi diantara bakteri lainnya, yaitu sebesar 63-78% (Madigan
fragmentasi miselia. Aktinomiset memiliki dua macam miselia, yaitu miselia
aerial dan miselia substrat, kedua miselia ini mampu menghasilkan pigmen yang
menyebabkan perbedaan warna pada masing-masing koloni.
Aktinomiset sebagai Penghasil Enzim Pendegradasi Selulosa
Lignin adalah polimer kompleks yang terdiri dari unit fenilpropan yang
dihubungkan oleh berbagai ikatan karbon dan eter. Di alam, secara fisik, lignin
merupakan kerak selulosa dan resisten untuk didegradasi oleh kebanyakan
organisme. Streptomyces viridosporus T7A (ATCC 39115) melakukan depolimerisasi lignin dalam mendegradasi selulosa dan memproduksi APPL
(acid-precipitable polymeric lignin) yang larut dalam air sebagai produk utama
degradasi lignin (Ramachandra 1988). Streptomyces viridosporus telah dikonfirmasi sebagai organisme yang aktif mendegradasi lignin bersama isolat
Streptomyces sp. UAH 15 (selanjutnya diklasifikasikan sebagai Streptomyces cyaneus CECT 3335), organisme ini memiliki kemampuan untuk melakukan mineralisasi dan solubilisasi fraksi lignin dari lignoselulosa. Identifikasi dari
enzim ekstraselular yang diproduksi S. cyaneus CECT 3335 selama pertumbuhannya menunjukkan terdapat aktivitas ekstraselular peroksidase dan
fenol oksidase, dengan aktivitas fenol oksidase yang seratus kali lebih besar
dibandingkan aktivitas peroksidase. Aktivitas kedua enzim ini ditemukan
memiliki korelasi dengan kecepatan mineralisasi dan solubilisasi (Berrocal et al. 1997).
Kukolya et al. (2002) mendapatkan empat galur (K21, TB100T, TB108, TB110) yang secara struktur morfologi digolongkan ke dalam genus
Thermobifida lignoselulolitik dari kompos “hot core”. Semua galur menunjukkan aktivitas selulase (termasuk selobiohidrolase and endoglukanase), endoxilanase,
manosidase, protease, amilase dan memiliki kemampuan yang baik dalam
mendegradasi lignin. Streptomyces drozdowiczii M7aT yang diisolasi dari sampel tanah Atlantica Mata Forest di Rio de Janeiro, Brazil, menunjukkan aktivitas
16S rRNA
Di antara berbagai teknik yang digunakan, RNA ribosomal paling banyak
digunakan sebagai penanda molekuler. Pada prokaryot terdapat tiga jenis RNA
ribosomal, yaitu 5S, 16S, dan 23S rRNA. Di antara ketiganya, 16S rRNA yang
paling sering digunakan. Molekul 5S rRNA memiliki urutan basa terlalu pendek,
sehingga tidak ideal dari segi analisis statistika, sementara molekul 23S rRNA
memiliki struktur sekunder dan tersier yang cukup panjang sehingga menyulitkan
analisis (Stackebrandt & Goebel 1995). Analisis gen penyandi 16S rRNA telah
menjadi prosedur baku untuk menentukan hubungan filogenetik dan menganalisis
suatu ekosistem. 16S rRNA dapat digunakan sebagai penanda molekuler karena
molekul ini bersifat ubikuitus dengan fungsi yang identik pada seluruh organisme.
Molekul ini juga dapat berubah sesuai jarak evolusinya, sehingga dapat digunakan
sebagai kronometer evolusi yang baik. Molekul 16S rRNA memiliki beberapa
daerah yang memiliki urutan basa yang relatif konservatif dan beberapa daerah
urutan basanya variatif (Pangastuti 2006).
Perbandingan urutan basa yang konservatif berguna untuk mengkonstruksi
pohon filogenetik universal karena mengalami perubahan relatif lambat dan
mencerminkan kronologi evolusi bumi. Sebaliknya, urutan basa yang bersifat
variatif dapat digunakan untuk melacak keragaman dan menempatkan galur-galur
dalam satu spesies. Jika urutan basa 16S rRNA menunjukkan derajat kesamaan
yang rendah antara dua taksa, deskripsi suatu takson baru dapat dilakukan tanpa
hibridisasi DNA-DNA (Stackebrandt & Goebel 1995). Biasanya jika derajat
kesamaan urutan basa gen penyandi 16S rRNA kurang dari 97% dapat dianggap
BAHAN DAN METODE
Isolasi Aktinomiset
Isolasi aktinomiset dari contoh tanah gambut yang memiliki karakteristik
pH 4.7, rasio C/N 38 dan nilai KTK 70.5 asal Tanjung Jabung Barat, Jambi,
dilakukan dengan terlebih dahulu mengencerkan contoh tanah gambut hingga 10-5
dan disebar sebanyak 100 µ l pada media agar-agar Humic Vitamin (HV) yang ditambahkan antibiotik asam nalidiksat sebanyak 20 µg/L media dan
cyclohexamide 0.05 g/L media kemudian diinkubasi selama tiga minggu pada suhu ruang. Isolat yang diperoleh dimurnikan dan diremajakan kembali pada
media Yeast Malt Agar (YMA).
Pengelompokan Berdasarkan Warna Koloni (Colour Grouping)
Isolat aktinomiset yang telah murni ditumbuhkan pada tiga jenis media
pertumbuhan yaitu Yeast Malt Agar (YMA), Yeast Starch Agar (YSA), dan Oatmeal Agar (OM) selama ±10 hari pada suhu ruang. Selanjutnya, dilakukan pengelompokan isolat aktinomiset berdasarkan warna koloninya.
Uji Kemampuan Selulolitik
Isolat aktinomiset yang diperoleh diuji aktivitas selulolitiknya dengan cara
menginokulasikan koloni aktinomiset pada media Carboxy Methyl Cellulose (CMC) 1% dan diinkubasi pada suhu ruang selama 4 hari. Setelah itu dilakukan
pengamatan terhadap adanya zona bening yang terbentuk, yang mengindikasikan
aktivitas enzim selulase dari isolat aktinomiset. Penambahan larutan merah kongo
1 M dan NaCl 0.1 N sebagai larutan pencuci dilakukan untuk memperjelas
keberadaan zona bening tersebut. Indeks selulolitik didapatkan melalui
pengukuran zona bening yang terbentuk di sekitar koloni, dengan rumus sebagai
berikut :
Ø zona bening – Ø koloni
Indeks selulolitik =
Pengukuran Aktivitas Selulase Aktinomiset
Dua isolat aktinomiset dengan aktivitas selulolitik tinggi berumur 10 hari
yang ditumbuhkan pada media agar-agar CMC, diinokulasikan masing-masing
sebanyak 2 corkborer ke dalam 10 ml media CMC 1% cair dan ditempatkan pada
shaker dengan kecepatan 100 rpm dan diinkubasi selama 35 hari pada suhu ruang. Setiap 5 hari sekali dilakukan pengukuran aktivitas enzim selulase.
Pengukuran aktivitas enzim selulase dilakukan berdasarkan metode Miller
(1959) dengan menggunakan enzim ekstrak kasar dan glukosa sebagai standar
pada konsentrasi 0.02 mg/ml - 0.2 mg/ml. Aktivitas enzim selulase diuji terhadap
substrat CMC 1% dalam bufer sitrat 0.2 M. Perhitungan aktivitas enzim selulase
dinyatakan dengan nkat/ml, yang diacu berdasarkan Dybkaer (2001). Satu unit
aktivitas enzim selulase adalah jumlah enzim yang dibutuhkan untuk melepas 1
µ mol gula pereduksi per menit. Satu unit aktivitas enzim setara dengan 16.67
nkat/ml. Aktivitas enzim selulase dinyatakan dengan rumus di bawah ini :
(Xs– Xk) x 1000 x fp
nkat/ml = x 16.67
BM glukosa x t
Keterangan :
Xs : Kadar gula sampel (mg/ml)
Xk : Kadar gula kontrol (mg/ml)
t : Waktu inkubasi (menit)
fp : Faktor pengenceran
Pengukuran Aktivitas Selulase pada Substrat Spesifik
Aktivitas Carboxy Methyl Cellulase (CMCase), aviselase, dan Filter Paperase (Fpase) diukur dengan metode DNS (Miller 1595) dengan glukosa sebagai standar dan dilakukan sebanyak dua kali ulangan. Gula pereduksi yang
dihasilkan diukur dengan spektrofotometer pada panjang gelombang 540 nm.
Pengukuran aktivitas CMCase dilakukan dengan menambahkan sebanyak
1 ml filtrat ekstrak kasar enzim dengan 1 ml CMC 1% dalam bufer sitrat 0.2 M
pH 4.7, diinkubasi selama 1 jam pada suhu ruang. Pengukuran aviselase dilakukan
avisel 2% dalam buffer sitrat 0.2 M, pH 4.7, diinkubasi selama 1 jam pada suhu
ruang. Reaksi dihentikan dengan penambahan 20 µ l NaOH 2 M, kemudian
disentrifugasi pada kecepatan 1500 xg selama 15 menit (Okada 1999).
Pengukuran Fpase dilakukan dengan menambahkan sebanyak 1 ml filtrat ekstrak
kasar enzim dengan 0.5 g kertas saring Whatman no.1 (1 x 6 cm), diinkubasi
selama 1 jam pada suhu ruang (Alam et al. 2004).
Identifikasi Isolat Aktinomiset Terpilih
Identifikasi isolat aktinomiset dilakukan berdasarkan analisis urutan
nukleotida pada 16S rRNA. Ekstraksi DNA bakteri dilakukan dengan
menggunakan GES method (Pitcher et al. 1989). Amplifikasi PCR menggunakan Takara Taq polimerase (Takara Shuzo, Kyoto, Jepang). Komponen reaksi PCR untuk 40 μl volume total terdiri atas 4 μl DNA isolat aktinomiset, 0.4 μl ex Taq,
0.8 μl primer hulu 9F(5’GAGTTTGATCCTGGCTCAG-3’) dan primer hilir
1541R(5- AAGGAGGTGATCCAACC-3’), 1.6 μl dNTP, 4 μl bufer PCR, 5 μl
MgCl2dan 23.4 μl akuabides steril dengan kondisi denaturasi DNA target pada 95
°C selama 1 menit, diikuti oleh 30 siklus yang terdiri atas denaturasi pada 95 °C
selama 1 menit, annealing primer pada 50°C selama 1 menit, dan ekstensi primer
pada 72°C selama 1.5 menit. Pada akhir siklus, campuran reaksi dijaga pada 72 °C
selama 5 menit dan kemudian didinginkan sampai suhu 4 °C (Tamura et al. 1997).
Purifikasi PCR product dilakukan dengan PEG precipitation method (Hiraishi et al. 1995) dan dilanjutkan dengan sekuensing. Hasil sekuensing dipurifikasi kembali dengan ethanol purification method. Analisis pembacaan urutan basa nitrogen menggunakan automated DNA sequencer (ABI PRISM 3130
Genetic Analyzer) (Applied Biosystems). Hasil sekuensing DNA dalam bentuk
HASIL DAN PEMBAHASAN
Morfologi Aktinomiset Asal Tanah Gambut
Terdapat 80 koloni aktinomiset yang berhasil diisolasi dari contoh tanah
gambut, yang tumbuh pada media agar-agar HV dan dimurnikan di media YMA.
Hasil seleksi berdasarkan keragaman bentuk koloni dari 80 isolat diperoleh 20
isolat murni yang memiliki beragam morfologi koloni, menghasilkan miselia
aerial dan mampu tumbuh baik serta bersporulasi pada umur 7-14 hari.
Karakteristik morfologi ini mengindikasikan isolat-isolat tersebut adalah
Streptomyces sp. Zenova et al. (2008) menyatakan bahwa karakteristik tanah gambut sebagai habitat yang memiliki penampakan zona anaerob dan aerob serta
mampu menahan cadangan air yang besar kemungkinan merupakan faktor yang
mendukung kelompok mikrob pengurai yang bersifat aerob atau mikroaerofilik,
termasuk aktinomiset dan genus Streptomyces secara alamiah dapat hidup.
Jumlah dan jenis aktinomiset yang terdapat dalam tanah tertentu akan
sangat dipengaruhi oleh lokasi geografis seperti letak, suhu, jenis tanah, pH tanah,
kandungan bahan organik, budidaya, aerasi dan kadar air. Populasi aktinomiset
relatif lebih rendah dari mikrob tanah lain tetapi didominasi Streptomyces yang toleran terhadap kondisi asam (Arifuzzaman et al. 2010). Tanah kering dengan pH
basa cenderung mengandung Streptomyces yang lebih sedikit dan dan lebih banyak dari genera langka seperti Actinoplanes dan Streptosporangium (Tsujibo et al. 2003).
Pengelompokan berdasarkan Warna Koloni (Colour Grouping)
Berdasarkan morfologi koloni pertumbuhan isolat pada media YMA,
YSA, dan OM selama 10 hari pada suhu ruang, 20 isolat yang diperoleh dapat
dikelompokkan menjadi 3 kelompok warna miselium udara dan sporanya yaitu
putih, abu-abu dan coklat. Ambarwati et al. (2011) menyatakan bahwa karakteristik Streptomycetes memiliki hifa vegetatif dan miselium udara, dimana hifa vegetatif (dengan diameter 0.5 hingga 2.0 µ m) menghasilkan miselium
bercabang luas yang jarang memiliki fragmen. Miselium udara pada fase dewasa
membentuk tiga hingga banyak spora (lebih dari 50 spora). Beberapa spesies
Koloni yang muncul relatif halus, tetapi kemudian terjadi perkembangan yang
menampakkan miselium udara dalam bentuk floccose, butiran bubuk, atau beludru
(Korn Wendisch & Kutzner 1992).
Sebagian besar isolat dalam penelitian ini termasuk ke dalam kelompok
warna abu-abu, warna putih dan warna coklat (Lampiran 2). Warna-warna ini
disebabkan oleh pembentukan metabolit khusus yang disebut pigmen, beberapa
pigmen terdiri atas 2 sampai 3 senyawa, sementara yang lain dapat terdiri atas 7
sampai 10 atau bahkan 15 senyawa (Abdulla et al. 2008). Data yang tersedia mengenai sifat kimia dari sekitar 200 pigmen aktinomiset telah dibagi ke dalam
beberapa produk yaitu senyawa asiklik, senyawa aromatik, quinon, oksigen yang
mengandung senyawa heterosiklik, nitrogen yang mengandung senyawa
heterosiklik, sidromisin. Setiap jenis pigmen ini dapat memberikan warna tertentu
dan dapat digunakan untuk mengklasifikasi Streptomyces. Pigmen kehijauan yang
dapat mengindikasikan viridomisin dihasilkan oleh Streptomyces dengan miselia udara berwarna abu-abu, merah muda, dan kuning-kehijauan. Pigmen yang terkait
dengan antibiotik dari jenis rodomisin, griseorodin-rubromisin dan litmosidin
diproduksi oleh Streptomyces dengan miselia udara berwarna abu-abu juga merah
muda (Salvameenal et al. 2009).
Warna miselium udara adalah salah satu karakter menonjol dari
identifikasi isolat Streptomyces di tingkat spesies. Internasional Streptomyces Project (ISP) telah merekomendasikan warna miselium udara di media yang berbeda untuk digunakan sebagai karakter taksonomi (Oskay 2009). Karakterisasi
morfologi adalah informasi dasar dalam mendeskripsikan aktinomiset yang
meliputi pembentukan miselium substrat, miselium udara, dan dihasilkannya
pigmen terlarut (Wink 2011).
Berdasarkan pengamatan mikroskopis diketahui bahwa isolat-isolat
aktinomiset yang diperoleh dari isolasi tanah gambut ini memiliki 3 tipe penataan
rantai spora yang dimiliki genus Streptomyces yaitu rectiflexibiles (RF), retinaculiaperti (RA) dan spirales (S). Sebagian besar isolat dalam penelitian ini memiliki tipe penataan rantai spora spirales, kemudian rectiflexibiles dan terakhir
Streptomyces dapat memiliki penataan rantai spora rectiflexibiles (RF), retinaculiaperti (RA) dan Spirales (S) (Jeffrey 2008).
Gambar 1 Keragaman penataan rantai spora dari 20 isolat aktinomiset. Spirales (isolat 1, 4, 5, 9, 16, 25, 34, 37, 39, ), Rectiflexibiles (isolat 8, 11, 12, 15, 32, 35, 42), dan Retinaculiaperti (isolat 6, 10, 24, 43).
Kemampuan Selulolitik Aktinomiset Asal Tanah Gambut
Pengujian kemampuan selulolitik 20 isolat aktinomiset dilakukan dengan
menggunakan uji pembentukan zona bening sebagai langkah penapisan awal
untuk identifikasi kemampuan kualitatif selulolitik isolat. Hasil uji menunjukkan
bahwa setelah inkubasi selama 4 hari, 20 isolat aktinomiset menunjukkan hasil
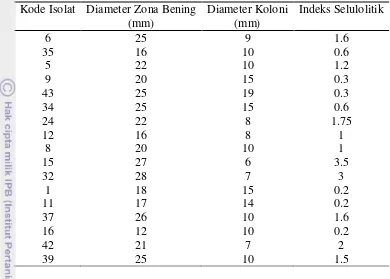
positif dengan terbentuknya zona bening yang ukurannya berkisar antara 16-25
mm sehingga diperoleh nilai indeks selulolitik yang berkisar antara 0.3-3.5
(Tabel 1). Indeks selulolitik adalah rasio diameter zona bening terhadap diameter
1 4 5
6
8
9
10
11 12
15 16
24 25
32
34
35
37
39
42
koloni. Sumber karbon tunggal pada media Carboxy Methyl Cellulose (CMC) 1%
adalah selulosa, sehingga indeks selulolitik tersebut menunjukkan aktivitas
selulolitik aktinomiset uji yang beragam. Aktivitas spesifik enzim selulase ini
ditandai dengan nisbah diameter zona bening terhadap diameter koloni isolat yang
ditumbuhkan pada media agar-agar bersumber karbon CMC (Fikrinda et al. 2000).
Hasil telaah literatur menunjukkan bahwa Streptomyces sp. galur J2 dari sampel tanah di Yordania yang diisolasi dengan medium Cellulose Agar (CA) mampu memproduksi enzim selulase setelah 4 hari inkubasi dengan
memperlihatkan diameter zona bening berukuran 22 mm (Jaradat et al. 2008). Streptomyces noboritoensis TBG-V20 yang diisolasi dari tanah di daerah Tamilnadu, India, setelah ditumbuhkan pada media agar Inorganic Salt Cellulose
selama 7 hari inkubasi memperlihatkan diameter zona bening berukuran 26 mm
(Arunachalam et al. 2010). Waktu inkubasi yang optimal memberikan rasio yang
tinggi dari diameter zona bening terhadap diameter koloni. Pada inkubasi dua
hari, zona bening hanya terlihat samar-samar dan rasio maksimal diameter zona
bening terhadap diameter koloni terjadi antara 4 dan 9 hari (Ibrahim & El Diwany
2007). Kemampuan membentuk zona bening pada media CMC menunjukkan
adanya enzim endo-β-1.4-glukanase yang dapat memutuskan ikatan β-1.4
glikosida pada serat selulosa secara acak dan banyaknya daerah amorf pada
substrat tersebut menyebabkan CMC dapat dihidrolisis dengan lebih efisien (Goto
Tabel 1 Kemampuan selulolitik isolat aktinomiset asal tanah gambut
Kode Isolat Diameter Zona Bening (mm)
masing-masing 3.5 dan 2 yang lebih tinggi dibandingkan isolat-isolat uji lainnya
(Lampiran 3). Pengukuran aktivitas selulase berdasarkan zona bening yang
terbentuk bersifat kualitatif, lebar zona bening tidak menunjukkan jumlah
aktivitas selulase, sehingga diperlukan uji aktivitas selulase secara kuantitatif.
Aktivitas Selulase
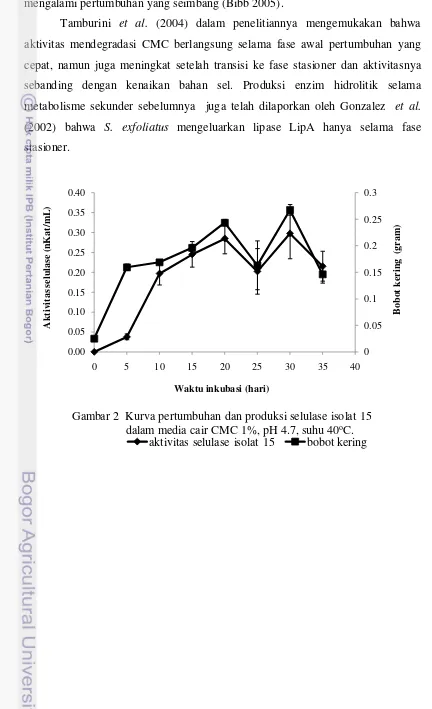
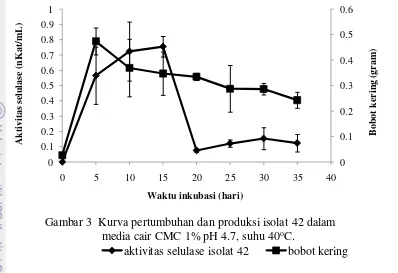
Aktivitas selulase isolat 15 dan 42 meningkat seiring dengan
meningkatnya biomassa sel, namun masing-masing isolat menunjukkan aktivitas
selulase dan kemampuan tumbuh yang berbeda. Untuk isolat 15, aktivitas selulase
tertinggi diperoleh pada hari ke-30 sebesar 0.3 nKat/ml (Gambar 2), sedangkan
isolat 42 memiliki aktivitas selulase yang lebih tinggi yaitu sebesar 0.8 nKat/mL
yang diperoleh pada hari ke 15 (Gambar 3). Produksi metabolit sekunder oleh
Streptomyces umumnya bertepatan dengan, atau sedikit mendahului, perkembangan miselia udara di permukaan kultur padat sedangkan pada kultur
cair, umumnya terbatas hingga fase stasioner. Metabolit sekunder dihasilkan
utama habis, disintesis untuk jangka waktu yang terbatas oleh sel yang tidak lagi
mengalami pertumbuhan yang seimbang (Bibb 2005).
Tamburini et al. (2004) dalam penelitiannya mengemukakan bahwa aktivitas mendegradasi CMC berlangsung selama fase awal pertumbuhan yang
cepat, namun juga meningkat setelah transisi ke fase stasioner dan aktivitasnya
sebanding dengan kenaikan bahan sel. Produksi enzim hidrolitik selama
metabolisme sekunder sebelumnya juga telah dilaporkan oleh Gonzalez et al. (2002) bahwa S. exfoliatus mengeluarkan lipase LipA hanya selama fase stasioner.
Gambar 2 Kurva pertumbuhan dan produksi selulase isolat 15 dalam media cair CMC 1%, pH 4.7, suhu 40oC.
Setiap bakteri selulolitik memiliki aktivitas enzim selulase yang
berbeda-beda, tergantung pada hubungan kompleks yang melibatkan berbagai faktor
seperti sumber karbon, kualitas selulosa, nilai pH, suhu, ketersediaan induser,
aditif medium, aerasi dan waktu pertumbuhan (Immanuel et al. 2006). Ukuran partikel dari selulosa dapat mempengaruhi produksi selulase oleh
mikroorganisme, dengan pelepasan enzim berbanding terbalik dengan ukuran
partikel substrat yang digunakan yaitu enzim yang dilepaskan meningkat, ketika
ukuran partikel substrat menurun (Zhang et al. 2006)
Pengukuran Aktivitas Selulase pada Substrat Spesifik
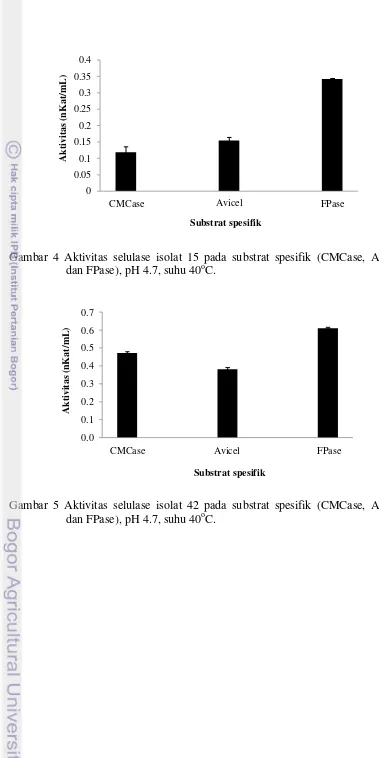
Isolat 15 dan 42 dapat memanfaatkan ke tiga substrat uji yakni
Carboxymethyl cellulose, Avicel, dan Whatmann Filter Paper No.1, yang menunjukkan bahwa kedua isolat tersebut memiliki aktivitas selulolitik melalui
CMCase, Avicel, dan FPase. Hal ini menunjukkan adanya sinergi dalam sistem
enzim selulase yang dihasilkan isolat uji. Dalam hal ini, disebut endo-ekso sinergi
antara endoglukanase dan eksoglukanase (Mehdi et al. 2010) karena selulase yang
disekresikan memiliki aktivitas pada CMCase dan Avicel. Maki et al. (2011) menyatakan bahwa untuk membandingkan efektivitas aktivitas enzim selulase
yang dilepaskan, dibutuhkan teknik untuk mengukur aktivitas selulase total. FPase
0
Gambar 3 Kurva pertumbuhan dan produksi isolat 42 dalam media cair CMC 1% pH 4.7, suhu 40oC.
adalah metode utama untuk analisis aktivitas selulase total sedangkan aktivitas
endoglukanase dapat diukur dengan menggunakan derivat selulosa terlarut dengan
derajat polimerisasi tinggi seperti CMCase. Avicel digunakan untuk mengukur
aktivitas eksoglukanase karena memiliki selulosa dengan derajat polimerisasi
rendah yang relatif tidak memiliki akses untuk diputus endoglukanase.
Aktivitas CMCase, Avicel, dan FPase dari isolat 15 masing-masing
sebesar 0.12, 0.15, dan 0.34 nKat/mL. Aktivitas terhadap substrat Avicel lebih
besar dibandingkan aktivitas terhadap substrat CMCase (Gambar 4) sedangkan
untuk isolat 42 aktivitas CMCase, Avicel, dan FPase masing-masing sebesar 0.47,
0.38, dan 0.61 nKat/mL. Berbeda dengan isolat 15, aktivitas isolat 42 terhadap
substrat CMCase lebih besar dibandingkan terhadap substrat Avicel (Gambar 5).
Meryandini et al. (2009) dalam penelitiannya mengungkapkan bahwa 4 isolat bakteri selulolitik yang digunakan memiliki aktivitas selulase yang berbeda
terhadap substrat sintetik yang berbeda. Selain itu juga memiliki aktivitas enzim
selulase pada substrat kertas saring, yaitu selulosa sintetik campuran antara
selulosa amorphous dan kristalin. Berbeda dengan hasil penelitian yang dilakukan
oleh Das et al. (2007), isolat selulolitik mesofilik Streptomyces olbolongus menunjukkan aktivitas enzim selulase yang tinggi yaitu 120.2 U/mL pada substrat
CMC, 49.2 U/mL pada substrat avicel, dan 46.9 U/mL pada substrat FPase.
Schlochtermeier et al. (1992) menyatakan bahwa kekhasan enzim selulolitik seringkali sulit untuk ditentukan karena heterogenitas dan
ketidakmurnian dari substrat yang tersedia. Enzim yang menunjukkan aktivitas
tinggi pada substrat avicel dan aktivitas kecil pada CMCase diidentifikasi sebagai
eksoglukanase. Aktivitas tinggi terhadap substrat CMCase menunjukkan adanya
enzim endo-β-glukanase yang dapat memutus ikatan β-1.4 glikosida pada daerah
amorf selulosa (Maki et al. 2009). Enzim yang mampu menghidrolisis kristal ini
menjadi penting karena kristalinitas selulosa merupakan penghambat utama dalam
hidrolisis selulosa alami. Jager et al. (2010) menyatakan bahwa kristalinitas selulosa merupakan faktor utama yang menentukan penguraian selulosa secara
hayati oleh enzim selulolitik sehingga mikrob yang memiliki kemampuan
menghidrolisis kristal yang tinggi berpotensi menghidrolisis selulosa yang
Identifikasi Isolat Aktinomiset Terpilih
Gen penyandi 16S rRNA teramplifikasi pada ke dua isolat aktinomiset
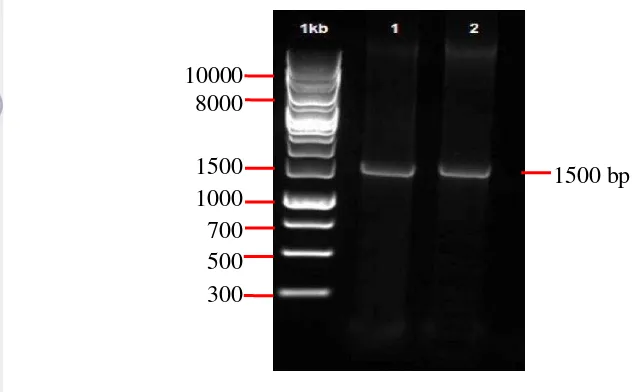
terpilih dengan ukuran pita yang dihasilkan sekitar 1500 bp (Gambar 6).
10000 8000
1500 1000 700 500 300
Gambar 6 Profil DNA hasil amplifikasi gen penyandi 16S rRNA dengan PCR pada isolat 15 (1) dan 42 (2).
Pensejajaran (alignment) sekuens nukleotida isolat 15 dan 42, diperoleh
pasangan basa sepanjang 1504 bp, dilakukan melalui penyesuaian dengan sekuens
gen 16S rRNA yang telah dilaporkan di GeneBank. Database dari NCBI Blast yang tersedia di www.ncbi-nlm-nih.gov. Data tersebut digunakan untuk
membandingkan homologi sekuens nukleotida 16S rRNA isolat 15 dan 42.
Tabel 2 Hasil BlastN sekuens 16S rRNA isolat 15 dan 42
Isolat Kemiripan Identitas maksimum
Nilai E- value
No. Akses
15 Streptomyces diastaticus galur NRRL B-1773
98% 0.0 NR.043486.1
42 Streptomyces exfoliatus galur NBRC-13475
94% 0.0 NR.041229.1
Hasil blast sekuens gen 16S rRNA dari kedua isolat aktinomiset
menunjukkan bahwa isolat 15 berkerabat dengan Streptomyces diastaticus NRRL B-1773 dengan nilai Max Identity 98%. Streptomyces diastaticus var. 108 diketahui mampu menghasilkan dua antibiotik polyene macrolide (rimosidin dan
CE-108) (Seco et al. 2005).
Isolat 42 berkerabat dengan Streptomyces exfoliatus NBRC-13475 dengan
nilai Max Identity 94%. Sreenath dan Joseph (1982) dalam penelitiannya menyatakan bahwa fraksinasi dari xilan ekstraseluler dari galur Streptomyces exfoliatus MC1 mengungkapkan adanya lima jenis enzim. Salah satu endo-enzim adalah spesifik untuk xilan sementara yang lain juga bisa menghidrolisis selulosa,
inulin dan pektin sedangkan ekso-enzim menunjukkan fungsi xilanolitik dan
selulolitik saja. Berbeda galur, Streptomyces exfoliatus K10 juga diketahui menghidrolisis senyawa polimer seperti selulosa, kitin, xilosa, pullulan (Klingbeil
et al. 1996).
Isolat 42 diprediksi sebagai novel spesies karena memiliki kekerabatan
dengan galur rujukan dengan nilai Max Identity kurang dari 97%. Namun, idealnya, identifikasi taksonomi bakteri untuk validitas dan akurasi ilmiah perlu
dilakukan berdasarkan polyphasic approach yaitu pendekatan dengan menggunakan kombinasi dari metode pengujian fenotip (uji biokimia, analisis
asam lemak, dan analisis numerik) dan metode pengujian genotip (hibridisasi
DNA, analisis kandungan G+C, dan analisis 16S rRNA) (Janda & Abbott 2002).
Gambar 7 Pohon filogenetik dari sekuens 16 rRNA isolat 15 dan 42.
Hasil konstruksi filogenetik (Gambar 7) yang menggunakan metode
neighbor-joining, menunjukkan isolat 15 dan 42 memiliki percabangan yang sama dengan nilai bootstrap sebesar 100. Kedua isolat berada pada satu clade (kelompok) yang sama dan berada di luar clade Streptomyces hasil blast dan outgroup-nya. Nilai bootstrap > 95% adalah signifikan secara statistik dan
Pseudomonas aeruginosa strain BP C2 isolat 42
isolat 15
Streptomyces fradiae strain RMS4
Streptomyces diastaticus subsp. ardesiacus strain NRRL B-1773 Streptomyces griseoaurantiacus strain NBRC 15440
mengindikasikan “support” untuk membentuk sebuah clade (Soltis PS & Soltis DE 2003). Nilai bootsrap menunjukkan konsistensi data dalam penentuan takson,
hanya memberikan informasi tentang stabilitas topologi, dan bukan menunjukkan
SIMPULAN
Uji terhadap 20 isolat aktinomiset yang diisolasi dari tanah gambut
menunjukkan kemampuan selulolitik. Isolat 15 dan 42 merupakan dua isolat
dengan nilai indeks selulolitik tinggi dengan nilai aktivitas selulase
masing-masing sebesar 0.3 nKat/mL dan 0.8 nKat/mL. Isolat 15 dan 42 memiliki aktivitas
selulolitik pada CMCase, Avicel, dan FPase. Kedua isolat memiliki aktivitas
selulolitik yang lebih besar pada substrat FPase dibandingkan CMCase dan
Avicel. Hasil sekuensing gen 16S rRNA menunjukkan bahwa isolat 15 homolog
dengan Streptomyces diastaticus dengan nilai identitas maksimum 98% sedangkan isolat 42 homolog dengan Streptomyces exfoliatus dengan nilai identitas maksimum 94%. Analisis filogenetik menunjukkan isolat 15 dan 42
memiliki hubungan kekerabatan yang sangat dekat dengan nilai bootstrap sebesar
DAFTAR PUSTAKA
Abdulla H, May E, Bahgat M, Dewedar A. 2008. Characterization of actinomycetes isolated from ancient stone and their potential for deterioration. Polish J Microbiol 57:213-220.
Alam MZ, Manchur MA, Anwar MN. 2004. Isolation, purification, characterization of cellulolytic enzymes produced by Streptomyces omiyaensis. J Biol Sci 10:1647-1653.
Ambarwati A, Sembiring L, Soegihardjo CJ. 2011. Antibiotic produced by streptomycetes associated with rhizosphere of purple nut sedge (Cyperus rotundus L.) in Surakarta, Indonesia. Afr J Biotechnol 6:52-52.
Anindyawati T. 2010. Potensi selulase dalam mendegradasi lignoselulosa limbah pertanian untuk pupuk organik. Berita selulosa 45:70-77.
Arifuzzaman A, Khatun MR, Rahman A. 2010. Isolation and screening of actinomycetes from Sundarbans soil for antibacterial activity. Afr J Biotechnol 9:4615-4619.
Arunachalam R, Wesely EG, George J, Annadurai G. 2010. Novel approach for identification of Streptomyces noboritoensis TBG-V20 with cellulase production. Curr Res Bacteriol 3:15-26.
Aziz AA, Husin M, Mokhtar A. 2002. Preparation of cellulose from oil palm empty fruit bunches via ethanol digestion: effect of acid and alkali catalysts. J Oil Palm Res 14:9-14.
Berrocal M, Rodriguez J, Ball AS, Leblic P. 1997. Solubilisation and mineralisation of lignocellulose from wheat straw by Streptomyces cyaneus CECT 3335 during growth in solid-state fermentation. Appl Microbiol Biotechnol 48:379-384.
Beguin P, Aubert JP .1994. The biological degradation of cellulose. FEMS Microbiol Rev 13:25-58.
Bhat MK, Bhat S. 1997. Cellulose degrading enzymes and their potential industrial applications. Biotechnol Adv 15:583-620.
Bibb MJ. 2005. Regulation of secondary metabolism in Streptomycetes. Curr Opin Microbiol 8:208-215.
Chandel et al. 2007. Economics and Environmental impact of Bioetanol Production Technologies : An Appraisal. Biotechnol Mol Biol Rev 2:14-32.
Das SK, Alam MZ, Manchur MA, Anwar MN. Effect of nutrients and cellobiose octaacetate on cellulolytic enzyme productions by Streptomyces
albolongus. Bangladesh J Microbiol 24:70-72.
Davison A, Blaxter M. 2005. Ancient origin of glycosyl hydrolase family 9 cellulase genes. Mol Biol Evol 22:1273-1284.
Dybkaer R. 2001. Unit “katal” for catalytic activity. J Pure Appl Chem 73:927-931.
Gonzalez SL, Castro C, Perez C, Rubio M, Valdez F. 2002. bldA-dependent expression of the Streptomyces exfoliatus M11 lipase gene (lipA) is mediated by the product of a contiguous gene, lipR, encoding a putative transcriptional activator. J Bacteriol 179:7816-7826.
Goto M, Furukawa K, Hayashida S. 1992. An affinity site in an avicel-digesting exocellulase from a Trichoderma viride mutant. Biosci Biotech Biochem 56:1523-1528.
Hartatik W, Idris K, Sabiham S, Djuniwati S, Adiningsih JS. 2004. Di dalam: Pengaruh pemberian fosfat alam dan SP-36 pada tanah gambut yang diberi bahan amelioran tanah mineral terhadap serapan P dan efisiensi pemupukan P. Prosiding Kongres Nasional VIII HITI. Universitas Andalas. Padang, 6-11 Juni 2004. hlm 19-37.
Hamedani K, Soudbakhsh N, Das A, Prashanthi K, Bhattacharya S, Suryan S. 2012. Enzymatic screening, antibacterial potential and molecular characterization of Streptomycetes isolated from Wayanad District in Kerala, India. Biol Sci 2:201-210.
Hiraishi A, Kamagata Y, Nakamura N. 1995. Polymerase chain reaction amplification and restriction fragment length polymorphism analysis of 16S rRNA genes from methanogens. J Ferm Bioeng 79:523-529.
Holmes S. 2003. Bootstrapping phylogenetic trees: theory and methods. Stat Sci 18:241-255.
Holt et al. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore: Science Publishers, Inc.
Ibrahim ASS, El Diwany AI. 2007. Isolation and identification of new cellulases producing thermophilic bacteria from an egyptian hot spring and some properties of the crude enzyme. Aust J Appl Sci 1:473-478.
Immanuel G, Dhanusa R, Prema P, Palavesa A. 2006. Effects of different growth parameters on endoglucanase enzyme activity by bacteria isolated from coir retting effluents of estuarine environment. Int J Environ Sci Tech 3:2534.
Jager et al. 2010. Practical screening of purified cellobiohydrolases and
endoglucanases with α-cellulose and specification of hydrodynamics.
Biotech Biofuels 3:18 http://www.biotechnologyforbiofuels.com/content/3/ [17 Januari 2012]
Jaradat Z, Dawagreh A, Ababneh Q, Saadoun I. 2008. Influence of culture conditions on cellulase production by Streptomyces sp. (Strain J2). Jordan J Biol Sci 4:141-146.
Janda JM, Abbott SL. 2002. Bacterial identification for publication: when is enough enough. J Clin Microbiol 40:1887-1891.
Jeffrey LSH. 2008. Isolation, characterization and identification of actinomycetes from agriculture soils at Semongok, Sarawak. Afr J Biotechnol 7:3697-3702.
Kanti A. 2005. Actinomycetes selulolitik dari tanah hutan Taman Nasional Bukit Duabelas, Jambi. Biodiversitas 2:85-89.
Klemm D, Heublein B, Fink HP, Bohn A. 2005. Cellulose: fascinating biopolymer and sustainable raw material. Chem Inform 44:3358-3393. Klingbeil B, Kroppenstedt RM, Jendrossek D. 1996. Taxonomic identification of
Streptomyces exfoliatus K10 and characterization of its poly(3-hydroxybutyrate) depolymerase gene. Res Lett 142:215-221.
Koesnandar, Parmiyatni S, Nurani D, Wahyono E. 2006. Government role on research and application of technology for peatland utilization. Di dalam: Koesnandar et al., editor. National Seminar on peatlands and their problems; Pontianak, 21 Mar 2006. Pontianak: Universitas Tanjungpura. Korn-Wendisch F, Kutzner HJ. 1992. The family Streptomycetaceae. Di dalam:
A. Balows HG, Truper M, Dworkin, W. Harder, Karl-Heinz Schleife, editors. The Prokaryotes. A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications. Second Edition. New York: Springer-Verlag.
Kukolya et al. 2002. Thermobifida cellulolytica sp. nov., a novel lignocellulose-decomposing actinomycete. Int J Syst Evolution Microbiol 52:1193–1199. Li Xianzhen. 1997. Streptomyces cellulolyticus sp. nov., a new cellulolytic
member of the genus Streptomyces. Int J Syst Bacteriol 47:443-445.
Lynd LR, Weimer PJ, Zyl WH, Pretorius IS. 2002. Microbial cellulose utilization: fundamentals and biotechnology. Microbiol Mol Biol Rev 66:506-577. Maki ML, Leung KT, Qin W. 2009. The prospects of cellulase-producing bacteria
for the bioconversion of lignocellulosic biomass. Int J Biol Sci 5:500-516. Maki ML, Broere M, Leung KT, Qin W. 2011. Characterization of some efficient
cellulase producing bacteria isolated from paper mill sludges and organic fertilizers. Int J Biochem Mol Biol 2:146-154.
Malherbe S, Cloete TE. 2002. Lignocellulose biodegradation: fundamentals and applications. Rev Envir Sci Biotecnol 1:105-114.
Madigan MT, Martinko JM, Parker J. 2000. Brock Biology of Microorganisms. Ed. Ke-9. Upper Saddle River : Prentice Hall.
Maltby E. 1992. Microbiological changes resulting from human impacts on peat and organic soil horizons. Di dalam: Bragg OM, Hulme PD, Ingram HAP, Robertson RA, editors. Peatland Ecosystems and Man: An Impact Assessment, Dundee: International Peat Society, Department of Biological Sciences, University of Dundee. hlm 45–58.
Mehdi D, Miranda M, Leung KT, Mao C, Qin W. 2010. Cellulase activities in biomass conversion: measurement methods and comparison. Cri Rev Biotechnol :1-8. http://www.informahealthcare.com/bty [17 Januari 2012]. Meryandini et al. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya.
Makara Sains 13:33-38.
Miller GL. 1959. Dinitrosalisic assay. Anal Chem 31: 426-428.
Moore TA, Shearer JC. 1997. Evidence of aerobic degradation of Palangka Raya Peat and Implication for its Sustainability. Di dalam: Proceedings of the international Symposium on Biodiversity, Environmental importance and sustainability of Tropical Peat and Peatlands; Palangkaraya, 4-8 sept 1997. Palangkaraya, Central Kalimantan, Indonesia.
International Symposium on tropical peatland; Kuching, Malaysia, 6-10 May 1991. hlm 267-280.
Nannipieri et al. 2003. Microbial diversity and soil function. Eur J Soil Sci 54:655-670.
Nishiyama Y, Langan P, Chanzy H. 2002. Crystal structure and
hydrogen-bonding system in cellulose Iβ from synchrotron x-ray and neutron fiber
diffraction. J Am Chem Soc 124:9074-82.
Nurani D, Parmiyatni S, Purwanta H, Angkoso G, Koesnandar. 2007. Increase In pH of Peat Soil by Microbial Treatment. Di dalam: Carbon-Climate-Human Interactions on Tropical Peatland: Carbon Pools, Fire, Mitigation, Restoration and Wise Use. Proceedings of the International Symposium and Workshop on Tropical Peatland; Yogyakarta, 27-29 Agu 2007. Yogyakarta: Department of Soil Science, Faculty of Agriculture, Gadjah Mada University. hlm 86-93.
Nugroho KG, Gianinazzi, Widjaja A. 1997. Soil hidraulic properties of and Ecology of Cellulose Degradation Cel. Tokyo: Uni Publisher. hlm 76-85.
Oskay M. 2009. Comparison of Streptomyces diversity between agricultural and non-agricultural soils by using various culture media. Sci Res 4:997-1005. Page SE, Wust, Banks C. 1999. Past and present carbon accumulation and loss in
Southeast Asian peatlands. PAGES News 18:234-237.
Page SE, Rieley JO, Boehm HDV, Jaya A, Limin SH. 2002. The amount of carbon released from peat and forest fires in Indonesia during 1997. Nature 420:61-65.
Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16S rRNA dan gen penyandi protein. Biodiversitas 7:292-296. Perez J, Dorado JM, Rubia T, Martinez J. 2002. Biodegradation and biological
treatments of cellulose, hemicellulose and lignin: an overview. Int Microbiol 5:53-63.
Pitcher DG, Saunders NA, Owen RJ. 1989. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate. Lett Appl Microbiol 8:109-114.
Radjagukguk B. 1997. Peat soil of Indonesia: Location, classification, and problems for sustainability. Di dalam: Proceedings of the International Symposium on Biodiversity, Environmental Importance and Sustainability of Tropical Peat and Peatlands; Palangkaraya, Central Kalimantan 4-8 Sept 1999. Cardigan: Samara Publishing Ltd. hlm 45-54.
Ramachandra M, Crawford DL, Hertel G. 1988. Characterization of an extracellular lignin peroxidase of the lignocellulolytic Actinomycete Streptomyces viridosporus. Appl Environ Microbiol 54:3057-3063.