FIRDAUS SYAFII. Modifikasi Zeolit melalui Interaksi dengan Fe(OH)
3untuk
Meningkatkan Kapasitas Tukar Anion. Dibimbing oleh CHARLENA dan SRI
SUGIARTI.
Struktur zeolit yang bermuatan negatif yang diakibatkan penggantian atom Si
oleh atom Al pada proses pembentukannya, membuat zeolit berfungsi sebagai
penukar kation dan sedikit sebagai penukar anion. Peningkatan kemampuan zeolit
sebagai penukar anion dapat ditingkatkan melalui modifikasi zeolit. Salah satu
caranya adalah dengan penambahan Fe(OH)
3. Prinsipnya adalah ion Fe masuk
dalam rongga zeolit dan membentuk kompleks dengan senyawa anion (ligan).
Berdasarkan hasil penelitian, modifikasi zeolit dengan Fe(OH)
3dapat dilakukan
pada zeolit alam dan zeolit alam teraktivasi sehingga kapasitas tukar anion zeolit
semakin meningkat. Kapasitas tukar anion zeolit termodifikasi lebih tinggi
dibandingkan zeolit sebelum modifikasi, berturut turut sebesar 5.064 dan 17.449
mek/100 g. Modifikasi zeolit dengan Fe(OH)
3menghambat proses adsorpsi
terhadap biru metilena, hal ini karena perubahan struktur sifat zeolit setelah
dimodifikasi. Kapasitas adsorpsi zeolit terhadap biru metilena terbesar terdapat
pada zeolit aktif yang tidak dimodifikasi sebesar 0.7199 mg/g
FIRDAUS SYAFI’I. Zeolite Modification by Interaction with Fe(OH)
3to Increase
Anion Exchange Capacity. Supervised by CHARLENA and SRI SUGIARTI
Zeolite structure, that bears negative charge caused by replacement of Si with
Al in the process of its formation, makes the zeolite has a function as cation
exchanger and some anion exchange. To improve its anion exchange properties,
zeolite can be modified by addition of Fe(OH)
3. Fe
3+ions will enter empty cavities
of the zeolite and bind the anions (ligands) to form complexes. Based on the
esperiment, the modified zeolite with Fe(OH)
3can be made from both natural and
active zeolites, increasing the anion exchange capacity of the zeolite. The anion
exchange capacity of the modified zeolite was higher that of the zeolite before
modification,i.e. 5.064 and 17.449 meq/100 g, respectively. Modification of
zeolite with Fe(OH)
3inhibited adsorption of methylene blue, due to structural
1
Kegiatan industri menghasilkan limbah yang mencemari lingkungan. Bahan pencemar yang dihasilkan berwujud cairan yang sebagian besar mengandung polutan organik. Salah satu cara menurunkan kandungan pencemar dalam air limbah adalah perlakuan sorpsi melalui pertukaran ion. Metode sorpsi melibatkan interaksi antara analit dan permukaan zat padat (adsorben) (Diantariani 2008). Adsorben yang sekarang ini banyak digunakan adalah zeolit alam.
Zeolit merupakan senyawa alam yang banyak terdapat di wilayah Indonesia. Zeolit ini memiliki berbagai macam kegunaan. Salah satunya adalah untuk penjerap senyawa organik, misalnya fenol (Bouffard dan Duff, 2000). Zeolit mempunyai struktur tiga dimensi unik yang berperan penting terhadap penyaringan molekul. Zeolit terdiri atas gugusan alumina dan gugusan silika-oksida yang masing-masing berbentuk tetrahedral dan saling dihubungkan oleh atom oksigen sehingga membentuk kerangka tiga dimensi. Zeolit digunakan sebagai adsorben karena struktur kristalnya berpori dan memiliki luas
permukaan yang besar, tersusun oleh
kerangka silika–alumina, mengandung ion Na, K, Mg, Ca yang dapat dipertukarkan dan molekul air, memiliki stabilitas termal yang tinggi, harganya murah, serta keberadaannya cukup melimpah.
Zeolit alam pada umumnya memiliki kristalinitas yang tidak terlalu tinggi, ukuran porinya sangat tidak seragam, aktivitas katalitiknya rendah, dan mengandung banyak pengotor. Kandungan zeolit alam di Indonesia pada umumnya terdiri atas jenis mordenit dan klinoptilolit yang kadarnya bervariasi. Salah satu cara untuk meningkatkan daya guna zeolit alam adalah dengan aktivasi dan modifikasi (Setyawan dan Handoko 2003). Aktivasi zeolit pada umumnya dilakukan dengan kalsinasi, penambahan asam, atau penambahan basa. Asam yang digunakan adalah H2SO4, HF, dan HCl, sedangkan basa
yang digunakan adalah NaOH. Perendaman zeolit alam dengan larutan HCl 4 M dapat menghilangkan oksida-oksida pengotor, tetapi tidak merusak struktur kristal mordenit
sehingga kristalinitas zeolit secara
keseluruhan meningkat (Setyawan dan
Handoko 2003).
Salah satu cara untuk melihat kualitas dari zeolit adalah dari kemampuan pertukaran ion, yang dinyatakan sebagai nilai KTK (kapasitas tukar kation). KTK adalah jumlah miligram
ekuivalen (mek) ion logam yang dapat dipertukarkan maksimum oleh 100 g bahan
penukar ion (zeolit) dalam kondisi
kesetimbangan. Nilai KTK zeolit bergantung pada derajat substitusi jumlah ion Al3+ terhadap Si4+ yang menghasilkan muatan negatif pada kerangka zeolit. Semakin besar derajat substitusi, semakin banyak kation alkali atau alkali tanah yang diperlukan untuk menetralkan muatan negatif pada kerangka sehingga nilai KTK makin besar (Ming dan Mumpton 1989). Semakin tinggi nilai KTK, semakin bagus kualitas dari zeolit. Oleh karena itu, besarnya nilai KTK zeolit dapat digunakan untuk menduga kandungan mineral zeolit (Suwardi 1998).
Penggantian atom Si oleh atom Al mengakibatkan struktur zeolit bermuatan negatif menyebabkan zeolit berfungsi sebagai penukar kation dan sedikit sebagai penukar anion. Untuk meningkatkan sebagai penukar anion, zeolit dimodifikasi. Salah satunya adalah dengan penambahan senyawa kation hidroksida. Prinsipnya adalah kation yang digunakan dalam modifikasi ini akan masuk ke dalam rongga kosong zeolit dan juga bisa menggantikan susunan atom Al pada kerangka utama zeolit. Senyawa kation hidroksida yang digunakan adalah Fe(OH)3. Ion Fe
3+
memiliki bilangan koordinasi 6 dan dapat mengikat senyawa anion (ligan) membentuk kompleks.
Senyawa kompleks dengan bilangan
koordinasi 6 paling stabil, sebab pada pembentukan kompleks itu dilepas sejumlah besar energi ikatan membentuk ikatan dengan ligan (Cotton dan Wilkinson 1989). Pada proses ini diharapkan interaksi zeolit dengan senyawa Fe(OH)3 meningkatkan KTA zeolit.
Penelitian ini bertujuan meningkatkan KTA zeolit dengan memodifikasi zeolit melalui penambahan Fe(OH)3
#
$ %&
Zeolit memiliki kerangka struktur
berongga yang ditempati oleh molekul-molekul air dan kation. Kation pada rongga zeolit dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit (Ming dan Mumpton 1989). Oleh karena itu zeolit dapat dimanfaatkan
sebagai penyaring molekular, senyawa
1
Kegiatan industri menghasilkan limbah yang mencemari lingkungan. Bahan pencemar yang dihasilkan berwujud cairan yang sebagian besar mengandung polutan organik. Salah satu cara menurunkan kandungan pencemar dalam air limbah adalah perlakuan sorpsi melalui pertukaran ion. Metode sorpsi melibatkan interaksi antara analit dan permukaan zat padat (adsorben) (Diantariani 2008). Adsorben yang sekarang ini banyak digunakan adalah zeolit alam.
Zeolit merupakan senyawa alam yang banyak terdapat di wilayah Indonesia. Zeolit ini memiliki berbagai macam kegunaan. Salah satunya adalah untuk penjerap senyawa organik, misalnya fenol (Bouffard dan Duff, 2000). Zeolit mempunyai struktur tiga dimensi unik yang berperan penting terhadap penyaringan molekul. Zeolit terdiri atas gugusan alumina dan gugusan silika-oksida yang masing-masing berbentuk tetrahedral dan saling dihubungkan oleh atom oksigen sehingga membentuk kerangka tiga dimensi. Zeolit digunakan sebagai adsorben karena struktur kristalnya berpori dan memiliki luas
permukaan yang besar, tersusun oleh
kerangka silika–alumina, mengandung ion Na, K, Mg, Ca yang dapat dipertukarkan dan molekul air, memiliki stabilitas termal yang tinggi, harganya murah, serta keberadaannya cukup melimpah.
Zeolit alam pada umumnya memiliki kristalinitas yang tidak terlalu tinggi, ukuran porinya sangat tidak seragam, aktivitas katalitiknya rendah, dan mengandung banyak pengotor. Kandungan zeolit alam di Indonesia pada umumnya terdiri atas jenis mordenit dan klinoptilolit yang kadarnya bervariasi. Salah satu cara untuk meningkatkan daya guna zeolit alam adalah dengan aktivasi dan modifikasi (Setyawan dan Handoko 2003). Aktivasi zeolit pada umumnya dilakukan dengan kalsinasi, penambahan asam, atau penambahan basa. Asam yang digunakan adalah H2SO4, HF, dan HCl, sedangkan basa
yang digunakan adalah NaOH. Perendaman zeolit alam dengan larutan HCl 4 M dapat menghilangkan oksida-oksida pengotor, tetapi tidak merusak struktur kristal mordenit
sehingga kristalinitas zeolit secara
keseluruhan meningkat (Setyawan dan
Handoko 2003).
Salah satu cara untuk melihat kualitas dari zeolit adalah dari kemampuan pertukaran ion, yang dinyatakan sebagai nilai KTK (kapasitas tukar kation). KTK adalah jumlah miligram
ekuivalen (mek) ion logam yang dapat dipertukarkan maksimum oleh 100 g bahan
penukar ion (zeolit) dalam kondisi
kesetimbangan. Nilai KTK zeolit bergantung pada derajat substitusi jumlah ion Al3+ terhadap Si4+ yang menghasilkan muatan negatif pada kerangka zeolit. Semakin besar derajat substitusi, semakin banyak kation alkali atau alkali tanah yang diperlukan untuk menetralkan muatan negatif pada kerangka sehingga nilai KTK makin besar (Ming dan Mumpton 1989). Semakin tinggi nilai KTK, semakin bagus kualitas dari zeolit. Oleh karena itu, besarnya nilai KTK zeolit dapat digunakan untuk menduga kandungan mineral zeolit (Suwardi 1998).
Penggantian atom Si oleh atom Al mengakibatkan struktur zeolit bermuatan negatif menyebabkan zeolit berfungsi sebagai penukar kation dan sedikit sebagai penukar anion. Untuk meningkatkan sebagai penukar anion, zeolit dimodifikasi. Salah satunya adalah dengan penambahan senyawa kation hidroksida. Prinsipnya adalah kation yang digunakan dalam modifikasi ini akan masuk ke dalam rongga kosong zeolit dan juga bisa menggantikan susunan atom Al pada kerangka utama zeolit. Senyawa kation hidroksida yang digunakan adalah Fe(OH)3. Ion Fe
3+
memiliki bilangan koordinasi 6 dan dapat mengikat senyawa anion (ligan) membentuk kompleks.
Senyawa kompleks dengan bilangan
koordinasi 6 paling stabil, sebab pada pembentukan kompleks itu dilepas sejumlah besar energi ikatan membentuk ikatan dengan ligan (Cotton dan Wilkinson 1989). Pada proses ini diharapkan interaksi zeolit dengan senyawa Fe(OH)3 meningkatkan KTA zeolit.
Penelitian ini bertujuan meningkatkan KTA zeolit dengan memodifikasi zeolit melalui penambahan Fe(OH)3
#
$ %&
Zeolit memiliki kerangka struktur
berongga yang ditempati oleh molekul-molekul air dan kation. Kation pada rongga zeolit dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit (Ming dan Mumpton 1989). Oleh karena itu zeolit dapat dimanfaatkan
sebagai penyaring molekular, senyawa
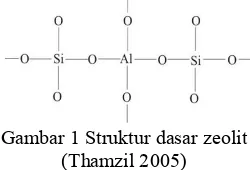
kelebihan muatan negatif. negatif dapat dinetralkan o kation yang didominasi ol untuk membentuk senyawa dan Pumpton 1989). Katio struktur rongga zeolit tidak yang tetap, tetapi dapat ber rongga zeolit dan bertinda ion yang dapat dipertukar lainnya. Sifat tersebut me berfungsi sebagai penuk 2005).
Gambar 1 Struktur (Thamzil 20
Berbagai jenis zeolit ala dan dianalisis rumus kimia saat ini dikenal sekitar 40 meskipun yang mempuny ada sekitar 12 jenis, dianta mordernit, filipsit, kabasit 1). Zeolit sintetik dihasil perusahaan seperti Union Mobil Oil dan lebih dar dikenal strukturnya antara la dan L seperti tertera pada 2005).
Tabel 1 Jenis mineral terdapat dalam b
Nama Rumus
Faujasit Na58(Al58Si
Ferrierit (Na2Mg2)(A
Hulandit Ca4(Al8Si28
Klinoptilolit (Na4K4)(Al
Mordenit Na8(Al8Si40
Natrolit Na4(Al4Si6
Scolecit Ca2(Al4Si6
Thomsonit (Na4K4)(Al
Wairakit Ca(Al2Si4O
Yugawaralit Ca(Al4Si6O
Kabasit Ca2[Al4Si8
Sumber: Hay (1966)
Tabel 2 Jenis-jenis zeolit sinte
Nama Rumus M
A Na12[(AlO2)12(SiO
X Na86[(AlO2)86(SiO
Y Na56[(AlO2)56(SiO
L K9[(AlO2)9(SiO2)27
Sumber: Hay (1966)
gatif. Kelebihan muatan lkan oleh adanya
kation-asi oleh Na, K, Mg, Ca nyawa yang stabil (Ming Kation-kation ini dalam t tidak terikat pada posisi at bergerak bebas dalam ertindak sebagai penukar rtukarkan dengan kation ut memungkinkan zeolit penukar ion (Thamzil
uktur dasar zeolit zil 2005)
olit alam telah ditemukan kimia unit selnya. Pada itar 40 jenis zeolit alam, punyai nilai komersial diantaranya klinoptilolit, abasit dan erionit (Tabel ihasilkan dari beberapa Union Carbide, ICI dan ih dari 100 jenis telah ntara lain zeolit A, X, Y, pada Tabel 2 (Thamzil
eral zeolit alam yang lam batuan zeolit
Rumus Kima Unit Sel Si134O384).18H2O
)(Al6Si30O72).18H2O
28O72).24H2O
)(Al8Si40O96).24H2O
40O96).24H2O 6O20).4H2O 6O20).6H2O
)(Al8Si40O96).24H2O
O12).2H2O
O20).6H2O
8O24].13H2O
it sintetik
Rumus Molekul
(SiO2)12].27H2O
(SiO2)106].264H2O
6(SiO2)136].250H2O
27].22H2O
&'(&') $
Zeolit merupakan aluminosilikat terhidrat y satuan-satuan tetrahedral SiO saling berhubungan satu sa penggunaan bersama atom penghubung antara atom S membentuk rongga-rongga saluran yang teratur. Seca kimia untuk zeolit adalah [MxDy] [Alx+2y Sin-(x+2y)O2n].
M : K+, Na+, atau kation m D : Mg2+, Ca2+, atau kation x, y, z : bilangan tertentu; m : jumlah mol air. Kation-kation yang terda kurung pertama adalah ka ditukar (
yang kedua adalah kation s struktural (penyusun dasar) sama dengan atom O me zeolit (Gottardi 1976). Be zeolit berwarna putih, kebir dan coklat. Hal ini disebabk oksida besi atau logam lainn dapat dibedakan dalam tiga rangka aluminosilikat, ruan berhubungan yang berisi k molekul air (Flanigen, 1981 Kuzvart 1996).
Kerangka aluminasilikat unit bangun primer, sekunde sebagaimana terlihat pad Struktur kristal zeolit diman dan Al dalam bentuk tetrahed Unit Bangun Primer. Unit terdiri dari unit tetrahedral yang saling berhubungan d bersama atom oksigen me seperti cincin tunggal jenis bentuk kubus, cincin ganda heksagonal dan dua cincin hanya dapat diidentifikasi Bangun Sekunder (UBS) polihedral terdiri dari unit (Thamzil 2005).
Gambar 2 Tetrahedral alu (TO4) pada struktu
(Thamzil 200
2
$ %&
an kristalin dari
rat yang terdiri atas ral SiO4 dan AlO4 yang
atu sama lain melalui atom oksigen sebagai tom Si dan atom Al rongga dan
saluran-Secara umum rumus
]. mH2O, dengan
tion monovalen lainnya; kation bivalen lainnya; tentu;
l air.
terdapat dalam tanda lah kation yang dapat ) sedangkan tion struktural, disebut dasar) karena bersama-O menyusun kerangka
). Beberapa spesimen , kebiruan, kemerahan, isebabkan oleh hadirnya lainnya. Struktur zeolit tiga komponen, yaitu t, ruang kosong saling risi kation logam, dan , 1981 dalam Harben &
ilikat zeolit terdiri atas ekunder, dan polihedral t pada Gambar 2-4.
dimana semua atom Si tetrahedral (TO4) disebut
Unit bangun sekunder hedral SiO4 dan AlO4
gan dengan pemakain en membentuk cincin, nis lingkar 4, 6, 8, ganda lingkar 4, prisma incin lingkar 6. Zeolit ikasi berdasarkan Unit (UBS). Unit bangun i unit bangun sekunder
ral alumina dan silika struktur zeolit
Gambar 3 Unit bangun zeolit:
- 4-(Thamzil 20
Gambar 4 Unit bangun polih Zeolit (Thamzil 2
(&%* +%
Aktivasi zeolit adalah sebelum zeolit digunakan. untuk menghilangkan p penggangu) yang berupa alam yang menutupi kapasitas tukar ion dan menjadi optimal. Proses a dapat dilakukan dengan 2 yaitu secara fisika melalui
tujuan untuk menguap
terperangkap di dalam pori sehingga luas permuka (Khairinal, 2000). Prose dikontrol, karena pemanasa
kemungkinan akan me
tersebut rusak. Proses pem dilakukan pada suhu 300 4 jam (Suwardi 2000). adalah aktivasi zeolit sec tujuan untuk membersihka membuang senyawa pengo kembali letak atom yang d Aktivasi secara kimia dapa penambahan asam dan p Penambahan asam yaitu me
asam klorida atau as
Penambahan basa yaitu me natrium hidroksida (Suyar 1991).
Proses aktivasi zeolit asam HCl pada kons
angun sekunder struktur
-4- (S4R),
(D4R), dan
1 (T5O10)
zil 2005).
n polihedral struktur amzil 2005).
+% $ %&
adalah proses persiapan akan. Aktivasi bertujuan an pengotor (mineral rupa oksida logam dari tupi rongga, sehingga dan kapasitas adsorpsi oses aktivasi zeolit alam an 2 cara, yang pertama elalui kalsinasi dengan
enguapkan air yang
m pori-pori kristal zeolit, rmukaannya bertambah Proses kalsinasi zeolit anasan yang berlebihan menyebabkan zeolit es pemanasan (kalsinasi) °C-375 °C selama 3-00). Cara yang kedua lit secara kimia dengan rsihkan permukaan pori, pengotor dan mengatur ang dapat dipertukarkan. ia dapat dilakukan dengan dan penambahan basa. itu menggunakan larutan
u asam sulfat dan
itu menggunakan larutan (Suyartono dan Husaini
olit dengan perlakuan konsentrasi 0.1N-11N
menyebabkan zeolit menga dan dekationisasi, yaitu k
kation-kation dalam k
Aktivasi asam menyebabka luas permukaan zeolit kare pengotor yang menutupi por
permukaan yang bertam
meningkatkan kemampuan
proses penjerapan (We
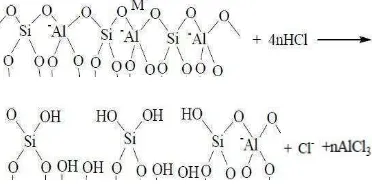
Tingginya kandungan Al zeolit menyebabkan kerang hidrofilik. Sifat hidrofilik da ini merupakan hambatan da penjerapannya. Proses aktiv dapat meningkatkan kristali dan luas permukaan. Pros dalam kerangka menjadi A ditunjukan pada persamaan b
Gambar 5 Reaksi zeolit (Weitkamp 19
$,%-%( +% $ %& , ".
Zeolit memiliki muata struktur jaringan yang meru isomorfik kation dalam j kristal, karena adanya muata zeolit memiliki kemampuan bahkan tidak memiliki day anion, sehingga memiliki anion yang rendah. Untu fungsi zeolit sebagai penu zeolit perlu dimodifikasi. Modifikasi zeolit me perlakuan terhadap zeolit diperoleh zeolit yang mem yang lebih baik (Sutarti R Salah satu cara modifika meningkatkan kemampuan melalui interaksi dengan F
memiliki bilangan koord
mengikat senyawa anion
membentuk kompleks. Sen dengan bilangan koordina kompleks yang paling sta pembentukan kompleks itu besar energi ikatan memben ligan.
3
mengalami dealuminasi itu keluarnya Al dan
kerangka zeolit. ebabkan bertambahnya lit karena berkurangnya pi pori-pori zeolit. Luas ertambah diharapkan
mpuan zeolit dalam
(Weitkamp 1999).
Al dalam kerangka kerangka zeolit sangat ilik dan polar dari zeolit tan dalam kemampuan aktivasi dengan asam kristalinitas, keasaman Proses pelepasan Al adi Al diluar kerangka
aan berikut
zeolit dengan asam 1999).
%& , ". "
muatan negatif dalam merupakan hasil dari lam jaringan kisi-kisi muatan negatif ini maka mpuan yang kecil atau iki daya jerap terhadap miliki kapasitas tukar Untuk meningkatkan i penukar anion maka
lit merupakan sebuah zeolit alam sehingga memiliki kemampuan tarti Rahmawati, 1994). odifikasi zeolit untuk mpuan zeolit adalah gan Fe(OH)3. Ion Fe3+
koordinasi 6 dapat anion (ligan) yang s. Senyawa kompleks ordinasi 6 merupakan g stabil, sebab pada ks itu dilepas sejumlah
4
Zeolit memiliki rongga-rongga yang berisi air dan kation-kation logam yang dapat dipertukarkan. Penambahan senyawa Fe(OH)3
terhadap zeolit menjadikan ion Fe3+ dapat memasuki rongga-rongga zeolit yang masih kosong dan menggantikan kation-kation dalam rongga yang didapat dipertukarkan. Ion Fe3+ yang memasuki rongga zeolit dapat membentuk kompleks dengan senyawa anion. Oleh karena ukuran rongga zeolit yang tidak terlalu besar, maka anion-anion yang dapat dipertukarkan hanya dalam ukuran kecil seperti ion klor, nitrat, pospat dan lain-lain. Agar dapat mengikat anion yang ukurannya lebih besar seperti senyawa fenol, maka atom Fe juga dapat menggantikan susunan atom Al pada kerangka utama zeolit yang menjadikan ukuran pori besar sehingga Fe dapat mengikat anion-anion yang ukuranya lebih besar. Pada proses ini interaksi zeolit dengan senyawa Fe(OH)3 juga dapat membentuk hidroksida
bilayer yang mengakibatkan zeolit lebih bermuatan positif. Jadi, dengan adanya interaksi zeolit dengan senyawa Fe(OH)3
menjadikan KTA pada zeolit semakin meningkat.
/ (&)$+($/% %-) (+% %" )01
Spektroskopi difraksi sinar-X merupakan salah satu metoda karakterisasi material yang paling tua dan paling sering digunakan hingga sekarang. Teknik ini digunakan untuk mengidentifikasi fasa kristalin padatan dengan cara menentukan parameter struktur kisi serta
untuk mendapatkan ukuran partikel
(Chorkendroff JW, Niemantsverdiet, 2003). Berdasarkan persamaan Bragg, jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat
dalam sampel, makin kuat intensitas
pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua jenis material. Keuntungan utama penggunaan sinar-X
dalam karakterisasi material adalah
kemampuan penetrasinya, sebab sinar-X memiliki energi sangat tinggi akibat panjang
gelombangnya yang pendek (0.5-2.0 Å). Sinar ini dihasilkan dari penembakan logam dengan elektron berenergi tinggi. Elektron itu mengalami perlambatan saat masuk ke dalam logam dan menyebabkan elektron pada kulit atom logam tersebut terpental membentuk kekosongan. Elektron dengan energi yang lebih tinggi masuk ke tempat kosong dengan memancarkan kelebihan energinya sebagai
foton sinar-X (Chorkendroff JW,
Niemantsverdiet, 2003).
2 " , " &
Bahan-bahan yang digunakan adalah zeolit klinoptilolit asal Gunung Kidul Yogyakarta, FeCl3 2M, H3BO3, AgNO3, CH3COONH4 pH
7, etanol 96%, dan biru metilena.
Analisis penelitian ini dilakukan dengan menggunakan spektroksokpi Difraksi sinar-X (XRD).
&$, " %&% "
Penelitian ini terdiri atas lima tahap (lampiran 1). Tahap pertama ialah preparasi zeolit pengukuran KTK, KTA dan uji adsoprsi, Tahap kedua adalah modifikasi zeolit dengan Fe(OH)3 serta pengukuran KTK,
KTA, dan uji adsoprsi. Tahap ketiga mencakup aktivasi zeolit alam dengan pengasaman, pengukuran KTK, KTA dan uji adsorpsi. Tahap keempat adalah modifikasi dengan Fe(OH)3, penentuan KTK dan KTA,
dan uji adsorpsi. Tahap kelima adalah pencirian zeolit tahap satu sampai empat dengan menggunakan XRD untuk mengetahui komposisi mineral zeolit.
Preparasi zeolit meliputi proses pencucian, penggerusan, pengayakan dengan ayakan 100 mesh, dan pemanasan dalam oven 300°C selama 3 jam. Aktivasi zeolit dengan pengasaman menggunakan HCl 4.0 Mdiikuti pencucian dengan akuades dan pemanasan dalam oven 300 °C selama 1 jam3 Selanjutnya, zeolit siap pakai disimpan dalam wadah tertutup terhadap zeolit yang telah dipreparasi, sebelum dan sesudah aktivasi dilakukan pencirian KTK dan uji adsorpsi dengan biru metilena.
Zeolit sebelum dan sesudah diaktivasi dimodifikasi dengan Fe(OH)3. Modifikasi
dilakukan dengan mencampurkan zeolit dalam larutan Fe(OH)3 dengan konsentrasi yang
4
Zeolit memiliki rongga-rongga yang berisi air dan kation-kation logam yang dapat dipertukarkan. Penambahan senyawa Fe(OH)3
terhadap zeolit menjadikan ion Fe3+ dapat memasuki rongga-rongga zeolit yang masih kosong dan menggantikan kation-kation dalam rongga yang didapat dipertukarkan. Ion Fe3+ yang memasuki rongga zeolit dapat membentuk kompleks dengan senyawa anion. Oleh karena ukuran rongga zeolit yang tidak terlalu besar, maka anion-anion yang dapat dipertukarkan hanya dalam ukuran kecil seperti ion klor, nitrat, pospat dan lain-lain. Agar dapat mengikat anion yang ukurannya lebih besar seperti senyawa fenol, maka atom Fe juga dapat menggantikan susunan atom Al pada kerangka utama zeolit yang menjadikan ukuran pori besar sehingga Fe dapat mengikat anion-anion yang ukuranya lebih besar. Pada proses ini interaksi zeolit dengan senyawa Fe(OH)3 juga dapat membentuk hidroksida
bilayer yang mengakibatkan zeolit lebih bermuatan positif. Jadi, dengan adanya interaksi zeolit dengan senyawa Fe(OH)3
menjadikan KTA pada zeolit semakin meningkat.
/ (&)$+($/% %-) (+% %" )01
Spektroskopi difraksi sinar-X merupakan salah satu metoda karakterisasi material yang paling tua dan paling sering digunakan hingga sekarang. Teknik ini digunakan untuk mengidentifikasi fasa kristalin padatan dengan cara menentukan parameter struktur kisi serta
untuk mendapatkan ukuran partikel
(Chorkendroff JW, Niemantsverdiet, 2003). Berdasarkan persamaan Bragg, jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat
dalam sampel, makin kuat intensitas
pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua jenis material. Keuntungan utama penggunaan sinar-X
dalam karakterisasi material adalah
kemampuan penetrasinya, sebab sinar-X memiliki energi sangat tinggi akibat panjang
gelombangnya yang pendek (0.5-2.0 Å). Sinar ini dihasilkan dari penembakan logam dengan elektron berenergi tinggi. Elektron itu mengalami perlambatan saat masuk ke dalam logam dan menyebabkan elektron pada kulit atom logam tersebut terpental membentuk kekosongan. Elektron dengan energi yang lebih tinggi masuk ke tempat kosong dengan memancarkan kelebihan energinya sebagai
foton sinar-X (Chorkendroff JW,
Niemantsverdiet, 2003).
2 " , " &
Bahan-bahan yang digunakan adalah zeolit klinoptilolit asal Gunung Kidul Yogyakarta, FeCl3 2M, H3BO3, AgNO3, CH3COONH4 pH
7, etanol 96%, dan biru metilena.
Analisis penelitian ini dilakukan dengan menggunakan spektroksokpi Difraksi sinar-X (XRD).
&$, " %&% "
Penelitian ini terdiri atas lima tahap (lampiran 1). Tahap pertama ialah preparasi zeolit pengukuran KTK, KTA dan uji adsoprsi, Tahap kedua adalah modifikasi zeolit dengan Fe(OH)3 serta pengukuran KTK,
KTA, dan uji adsoprsi. Tahap ketiga mencakup aktivasi zeolit alam dengan pengasaman, pengukuran KTK, KTA dan uji adsorpsi. Tahap keempat adalah modifikasi dengan Fe(OH)3, penentuan KTK dan KTA,
dan uji adsorpsi. Tahap kelima adalah pencirian zeolit tahap satu sampai empat dengan menggunakan XRD untuk mengetahui komposisi mineral zeolit.
Preparasi zeolit meliputi proses pencucian, penggerusan, pengayakan dengan ayakan 100 mesh, dan pemanasan dalam oven 300°C selama 3 jam. Aktivasi zeolit dengan pengasaman menggunakan HCl 4.0 Mdiikuti pencucian dengan akuades dan pemanasan dalam oven 300 °C selama 1 jam3 Selanjutnya, zeolit siap pakai disimpan dalam wadah tertutup terhadap zeolit yang telah dipreparasi, sebelum dan sesudah aktivasi dilakukan pencirian KTK dan uji adsorpsi dengan biru metilena.
Zeolit sebelum dan sesudah diaktivasi dimodifikasi dengan Fe(OH)3. Modifikasi
dilakukan dengan mencampurkan zeolit dalam larutan Fe(OH)3 dengan konsentrasi yang
5
hasilnya diukur nilai KTK, KTA, dan diuji
adsorpsi. Untuk penentuan komposisi
mineralnya dilakukan analisis dengan difraksi sinar-X.
) / ) +% $ %&
(SNI 13-3494-1994)
Zeolit dicuci dengan akuades, digiling dengan mortar, lalu diayak sehingga diperoleh zeolit dengan ukuran butir lolos ayakan 100 mesh. Setelah itu dilakukan pemanasan dalam oven bersuhu 300°C selama 3 jam (Suwardi 2000).
(&%* +% 4 $ %&
(SNI 13-3494-1994)
Aktivasi zeolit dilakukan secara kimia, yaitu dengan cara pengasaman. Sampel zeolit siap pakai ditimbang sebanyak 100 gram, dan ditambah larutan HCl 4.0 M sebanyak 250 mL. Campuran diaduk dengan pengaduk magnet selama 60 menit dan kemudian disaring dan dibilas dengan akuades sampai pH netral dan dikeringkan dalam oven pada suhu 300°C selama 3 jam. Pencucian dihentikan apabila sudah tidak terdapat endapan pada filtrat ketika ditambah dengan AgNO3 (Setyawan dan Husaini 1991).
!5' & " $ %& $,%-%( +%
Sebanyak 1 g zeolit dan dimasukan dalam tabung reaksi, lalu ditambahkan 5 mL larutan Fe(OH)3.0.025M Kemudian larutan di kocok
selama 2 jam dan di diamkan selam 1 hari. Hasilnya lalu disaring dan dikering udarakan dalam oven pada suhu 105 0C selama 1 jam.
Dibuat perlakuan yang sama dengan
perbandingan 1 g zeolit dengan Fe(OH)3
0.005M, 1.5 g zeolit dengan Fe(OH)3 0.025M,
1.5 g zeolit dengan Fe(OH)3 0.005M, 2 g
zeolit dengan Fe(OH)3 0.025M, dan 2 g zeolit
dengan Fe(OH)3 0.005M. perlakuan dilakukan
terhadap zeolit sebelum dan sesudah aktivasi.
" "&' " / +%& + '( ) &%$"
(SNI 13-3494-1994)
Sebanyak 2,5 g contoh butiran zeolit, lalu dimasukkan ke dalam tabung perkolasi yang telah dilapisi berturut-turut dengan
dan pasir terlebih dahulu dengan susunan
bagian bawah adalah untuk
menutup lubang pada dasar tabung dan
diatasnya 2.5 g pasir kuarsa, bagian tengah diisi 2.5 g zeolit, lalu bagian atas ditutup dengan penambahan 2.5 g pasir. Ketebalan setiap lapisan pada sekeliling tabung
diupayakan supaya sama. Selanjutnya
diperkolasi dengan amonium asetat pH 7 sebanyak 2 x 25 mL dengan selang waktu 30 menit. Setelah itu tabung perkolasi yang masih berisi contoh diperkolasi dengan 100
mL etanol 96% untuk menghilangkan
kelebihan amonium dan perkolat ini dibuang. Sisa etanol dalam tabung perkolasi dibuang dengan pompa isap dari bawah tabung perkolasi atau pompa tekan dari atas tabung perkolasi. Selanjutnya zeolit diperkolasi dengan NaCl 10 % sebanyak 50 mL, filtrat ditampung dalam labu takar 50 mL dan diimpitkan dengan larutan NaCl 10 %. Setelah itu dipindahkan secara kuantitatif ke dalam
labu didih. Digunakan akuades untuk
membilas labu takar. Selanjutnya
ditambahkan sedikit batu didih dan akuades sampai setengah volume labu didih. Disiapkan pula penampung untuk NH3 yang dibebaskan,
yaitu erlenmeyer yang berisi 10 mL H3BO3 1
% yang ditambahkan 3 tetes indikator
(berwarna merah) dan dihubungkan dengan alat destilasi. Dengan gelas ukur, ditambahkan NaOH 40% sebanyak 10 mL ke dalam labu didih yang berisi contoh dan secepatnya ditutup. Destilasi dilanjutkan sampai volume penampung mencapai 75 mL (berwarna hijau). Destilat dititrasi dengan HCl 0.05 N hingga warna merah muda. Disiapkan pula blanko dengan pengerjaan seperti contoh tetapi tanpa contoh butiran zeolit. Volume hasil titrasi contoh dan blanko dicatat
(Peraturan Menteri Pertanian
No.02/Pert/HK.060/2/2006, diacu dalam
Al-Jabri 2008). KTK zeolit dihitung
menggunakan rumus sebagai berikut:
KTK (mek/100 g) = #! −! " × 6 100 Keterangan:
Vb = volume HCl yang dibutuhkan
pada titrasi blanko (mL)
Vc = volume HCl yang dibutuhkan
pada titrasi contoh (mL) N HCl = normalitas HCl
" "&' " / +%& + '( ) "%$"
(SNI 13-3494-1994)
6
diaduk dan $ r selama 12 jam. Hasilnya disaring/disentrifusa dan diambil filtratnya. Tempatkan 10 mL filtrat pada erlenmeyer, dan dititrasi dengan NaOH 0.1 M menggunakan indikator phenolfthelein dan dibuat pula
blanko. (Peraturan Menteri Pertanian
No.02/Pert/HK.060/2/2006, diacu dalam Al-Jabri 2008). Kapasitas tukar anion zeolit dihitung menggunakan rumus sebagai berikut:
KTA (mek/100 g) = #! −! " × % 6 100
Keterangan :
Vb = volume NaOH yang dibutuhkan
pada titrasi blanko (mL)
Vc = volume NaOH yang dibutuhkan
pada titrasi contoh (mL) N NaOH = normalitas NaOH
7% ,+$)/+% $ %& ". " )'& " %)' &% "
Uji adsorpsi biru metilena dibuat dengan beragam konsentrasi masing-masing 10 ppm, 20 ppm, dan 30 ppm. Sebanyak 25 mL larutan metilen biru yang diketahui konsentarsinya
dicampurkan dengan 1 g zeolit dan
ditempatkan pada $ selama 3 jam.
Setelah itu campuran disaring, dan filtratnya dianalisis dan ditentukan konsentrasinya dengan spektrofotometer &!'! pada rentang panjang gelombang 600-700 nm. Dibuat kurva standar larutan metilen biru dengan konsentrasi 0.1, 0.2, 0.4, 0.8, 1.2, 1.6, dan 2 ppm untuk mengetahui konsentrasi metilena biru yang telah diadsorpsi (Clesceri . 2005). Kapasitas adsorpsi dihitung tiap perlakuan, dengan cara :
Q =
!
(
−
)
Keterangan:
Q = kapasitas adsorpsi (mg/g) V = volume larutan (L)
Co = konsentrasi metilena biru awal (ppm)
C = konsentrasi metilena biru sisa (ppm) m = massa zeolit (g)
"8%)% " $ %&
Kandungan mineral Zeolit dari kondisi awal sampai akhir perlakuan dikarakterisasi XRD untuk mengetahui komposisi mineral zeolit.
)$+ + (&%* +% $ %&
Proses aktivasi zeolit alam dilakukan menggunakan HCl 4 M selama 1 jam yang merupakan konsentrasi dan waktu optimum untuk proses aktivasi. Pada proses ini nisbah Si/Al mencapai optimum sehingga zeolit alam mengalami peningkatan luas permukaan dan tidak mengalami kerusakan struktural yang besar. Pelarut yang digunakan dalam proses adalah adalah air. Hal ini bertujuan untuk mengoptimalkan Si (dalam bentuk Si(OH)4)
yang akan dimasukkan untuk menggantikan atom-atom Si pada kerangka struktur zeolit. (Weitkamp, J and Puppe, L 1999). Mekanisme reaksinya dapat dilihat pada Gambar 6.
Gambar 6 Reaksi Aktivasi Zeolit (Flanigen, 1971)
Pada proses aktivasi, ion H+ yang dihasilkan dari reaksi penguraian HCl dalam medium air akan mengurai ikatan atom Al yang ada pada struktur zeolit. Ion H+ ini akan diserang oleh atom oksigen yang terikat pada Si dan Al. Harga energi dissosiasi ikatan Al-O
(116 kkal/mol) jauh lebih rendah
6
diaduk dan $ r selama 12 jam. Hasilnya disaring/disentrifusa dan diambil filtratnya. Tempatkan 10 mL filtrat pada erlenmeyer, dan dititrasi dengan NaOH 0.1 M menggunakan indikator phenolfthelein dan dibuat pula
blanko. (Peraturan Menteri Pertanian
No.02/Pert/HK.060/2/2006, diacu dalam Al-Jabri 2008). Kapasitas tukar anion zeolit dihitung menggunakan rumus sebagai berikut:
KTA (mek/100 g) = #! −! " × % 6 100
Keterangan :
Vb = volume NaOH yang dibutuhkan
pada titrasi blanko (mL)
Vc = volume NaOH yang dibutuhkan
pada titrasi contoh (mL) N NaOH = normalitas NaOH
7% ,+$)/+% $ %& ". " )'& " %)' &% "
Uji adsorpsi biru metilena dibuat dengan beragam konsentrasi masing-masing 10 ppm, 20 ppm, dan 30 ppm. Sebanyak 25 mL larutan metilen biru yang diketahui konsentarsinya
dicampurkan dengan 1 g zeolit dan
ditempatkan pada $ selama 3 jam.
Setelah itu campuran disaring, dan filtratnya dianalisis dan ditentukan konsentrasinya dengan spektrofotometer &!'! pada rentang panjang gelombang 600-700 nm. Dibuat kurva standar larutan metilen biru dengan konsentrasi 0.1, 0.2, 0.4, 0.8, 1.2, 1.6, dan 2 ppm untuk mengetahui konsentrasi metilena biru yang telah diadsorpsi (Clesceri . 2005). Kapasitas adsorpsi dihitung tiap perlakuan, dengan cara :
Q =
!
(
−
)
Keterangan:
Q = kapasitas adsorpsi (mg/g) V = volume larutan (L)
Co = konsentrasi metilena biru awal (ppm)
C = konsentrasi metilena biru sisa (ppm) m = massa zeolit (g)
"8%)% " $ %&
Kandungan mineral Zeolit dari kondisi awal sampai akhir perlakuan dikarakterisasi XRD untuk mengetahui komposisi mineral zeolit.
)$+ + (&%* +% $ %&
Proses aktivasi zeolit alam dilakukan menggunakan HCl 4 M selama 1 jam yang merupakan konsentrasi dan waktu optimum untuk proses aktivasi. Pada proses ini nisbah Si/Al mencapai optimum sehingga zeolit alam mengalami peningkatan luas permukaan dan tidak mengalami kerusakan struktural yang besar. Pelarut yang digunakan dalam proses adalah adalah air. Hal ini bertujuan untuk mengoptimalkan Si (dalam bentuk Si(OH)4)
yang akan dimasukkan untuk menggantikan atom-atom Si pada kerangka struktur zeolit. (Weitkamp, J and Puppe, L 1999). Mekanisme reaksinya dapat dilihat pada Gambar 6.
Gambar 6 Reaksi Aktivasi Zeolit (Flanigen, 1971)
Pada proses aktivasi, ion H+ yang dihasilkan dari reaksi penguraian HCl dalam medium air akan mengurai ikatan atom Al yang ada pada struktur zeolit. Ion H+ ini akan diserang oleh atom oksigen yang terikat pada Si dan Al. Harga energi dissosiasi ikatan Al-O
(116 kkal/mol) jauh lebih rendah
7
$,%-%( +% $ %& ! ". "
Zeolit alam dimodifikasi dengan Fe(OH)3
untuk meningkatkan KTA zeolit. Prinsipnya adalah melalui pembentukan kompleks antara ion Fe3+ yang mengisi rongga-rongga kosong zeolit dan senyawa anion (ligan). Kompleks dengan ligan ini meningkatkan kebolehjadian tukar anion zeolit.
Ion Fe3+ yang memasuki rongga-rongga kosong zeolit harus dikondisikan atau diperhitungkan jumlahnya supaya struktur zeolit tidak rusak dan ion Fe3+ bisa masuk dalam rongga-rongga zeolit . Pada penelitian ini digunakan beberapa nisbah antara jumlah zeolit dan larutan Fe(OH)3 untuk memperoleh
kondisi modifikasiyang baik dan optimum. Zeolit yang termodifikasi dengan Fe(OH)3
dilakukan berbagai kondisi sampel.
Keberhasilan modifikasi ini ditentukan oleh masuk atau tidaknya ion Fe dari larutan Fe(OH)3 ke dalam rongga zeolit. Masuknya
ion Fe3+ dapat dilihat dari warna larutan Fe(OH)3 dan endapan Fe yang terbentuk
(Tabel 3). Jika larutan menjadi tidak berwarna dan tidak timbul endapan, maka ion Fe3+ kemungkinan masuk dalam rongga zeolit. Struktur zeolit yang dimodifikasi dengan Fe(OH)3 harus dijaga supaya tidak rusak.
Zeolit mudah rusak jika memliki pH yang rendah (Flanigen, 1971).
Tabel 3 Hasil modifikasi zeolit
Ion Fe3+ yang masuk dalam rongga zeolit akan mengasamkan zeolit sehingga jumlahnya harus diperhitungkan supaya tidak merusak zeolit. Pada penelitian ini modifikasi zeolit yang paling baik adalah pada sampel 1 g zeolit teraktivasi modifikasi Fe(OH)3 0.025M,
dan1 g zeolit teraktivasi modifikasi Fe(OH)3
0.005M, serta 1.5 g zeolit teraktivasi modifikasi Fe(OH)3 0.005. Pada sampel ini
warna larutan Fe(OH)3 tidak berwarna, tidak
terbentuk endapan, dan pH yang tidak terlalu rendah yaitu 4
" "&' " / +%& + '( ) &%$"
Nilai KTK lazim digunakan sebagai parameter kualitas zeolit sebagai penukar ion. Kation-kation yang dapat dipertukarkan dari zeolit adalah yang tidak terikat kuat di dalam kerangka tetrahedral zeolit sehingga mudah dipertukarkan melalui penggantian oleh H+ pada pencucian asam.
Pertukaran kation pada zeolit ditunjukkan dari kemampuan tingkat substitusi Al terhadap Si yang menghasilkan muatan negatif. Semakin banyak Si yang digantikan oleh Al, muatan negatif zeolit yang semakin banyak, sehingga semakin banyak pula jumlah kation NH4+ yang diperlukan untuk menetralkannya.
Oleh karena itu, nilai KTK akan meningkat. Hal ini dilihat bahwa nilai KTK zeolit teraktivasi lebih besar dibandingkan dengan zeolit awal sebelum diaktivasi (Tabel 4). Hasil ini mendukung simpulan Haryati (2007)
bahwa aktivasi oleh asam, dapat
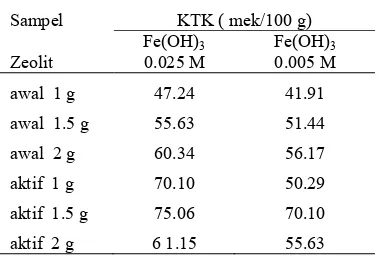
meningkatkan KTK. Modifikasi zeolit dengan Fe(OH)3 akan memengaruhi nilai KTK zeolit.
Ion besi yang masuk dalam rongga zeolit akan mengurangi muatan negatif dan karena itu nilai KTK menurun (tabel 5).
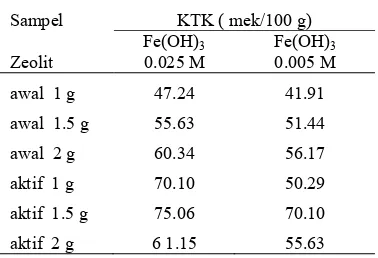
Tabel 4 Data kapasitas tukar kation zeolit sebelum modifikasi
Sampel KTK (mek/100 g)
zeolit awal 81.15
zeolit aktif 91.44
Tabel 5 Data kapasitas tukar kation zeolit setelah modifikasi
Sampel KTK ( mek/100 g)
Zeolit
Fe(OH)3
0.025 M
Fe(OH)3
0.005 M
awal 1 g 47.24 41.91
awal 1.5 g 55.63 51.44
awal 2 g 60.34 56.17
aktif 1 g 70.10 50.29
aktif 1.5 g 75.06 70.10
aktif 2 g 6 1.15 55.63
Sampel Warna
Endapan pH Zeolit Fe(OH)3 Larutan
awal 1 g
0.025 M kuning seulas sedikit 5 0.005 M kuning seulas sedikit 4 awal
1.5 g
0.025 M kuning seulas sedikit 5 0.005 M kuning seulas sedikit 5 awal
2 g
0.025 M kuning seulas sedikit 5 0.005 M kuning seulas sedikit 5 aktif
1g
0.025 M tidak berwarna tidak ada 4 0.005 M tidak berwarna tidak ada 4 aktif
1.5 g
0.025 M kuning seulas tidak ada 4 0.005 M tidak berwarna tidak ada 4 aktif
2 g
8
Hasil pengujian nilai KTK zeolit tertinggi yaitu pada zeolit aktivasi sebelum modifikasi sebesar 99.44 mek/100g. Modifikasi zeolit
dengan Fe(OH)3 secara umum dapat
menurunkan nilai KTK
" "&' " / +%& + '( ) "%$"
Kapasitas tukar anion (KTA) merupakan jumlah miligram ekuivalen (mek) anion yang dapat dipertukarkan maksimum oleh 100 g zeolit. Nilai KTA zeolit dilihat dari tingkat kemampuan ion Fe3+ yang masuk dalam rongga zeolit pada proses modifikasi dengan Fe(OH)3. Ion Fe3+ tersebut akan terikat kuat
dan membentuk kompleks koordinasi dengan mengikat ligan (anion). Kompleks koordinasi ini akan meningkatkan nilai tukar zeolit terhadap anion. Semakin banyak ion Fe3+ yang masuk dalam rongga zeolit (pada kondisi optimum), semakin banyak kemungkinan anion yang dapat terkompleks oleh Fe sehingga KTA zeolit semakin meningkat ( Tabel 7).
Tabel 6 Data kapasitas tukar Anion zeolit sebelum modifikasi
sampel KTA (mek/100 g)
zeolit awal 5.064
zeolit aktif 7.193
Tabel 7 Data kapasitas tukar Anion zeolit setelah modifikasi
Sampel KTA (mek/100 g)
Zeolit
Fe(OH)3
0.025 M
Fe(OH)3
0.005 M
awal 1 g 14.055 13.656
awal 1.5 g 17.449 16.889
awal 2 g 11.598 11.598
aktif 1 g 18.131 17.119
aktif 1.5 g 19.695 19.338
aktif 2 g 13.835 12.695
Proses aktivasi juga dapat meningkatkan nilai KTA zeolit, karena dapat menghilangkan
oksida-oksida pengotor yang menutupi
rongga. Luas permukaan rongga zeolit yang akan memperbesar kemungkinan ion Fe3+ masuk dalamnya sehingga nilai KTA zeolit meningkat. Hal ini terliahat bahwa nilai KTA zeolit awal nilainya lebih rendah sebesar 5.064 mek/100g dibandingkan zeolit yang sudah diaktivasi sebesar 7.193 mek/100 g
Modifikasi dengan Fe(OH)3 secara umum
juga dapat meningkatkan nilai KTA zeolit. Nilai KTA tertinggi yaitu pada 1.5 gram zeolit teraktivasi termodifikasi Fe(OH)3 0.025M,
yaitu sebesar 19.695 mek/100 g
" "&' " 7% ,+$)/+% $ %&
Salah satu metode yang digunakan untuk menghilangkan zat pencemar dari limbah cair
adalah adsorpsi (Diantariani 2008).
Adsorpsi merupakan terjerapnya suatu zat (molekul atau ion) pada permukaan adsorben. Zat yang diadsorpsi disebut fase teradsorpsi (adsorbat) dan zat yang mengadsorpsi disebut adsorben. Adsorben pada umumnya adalah zat padat yang berongga, yaitu zeolit. Adsorbat yang digunakan pada penelitian ini adalah zat warna metilena biru. Zat warna yang memiliki struktur bermuatan positif, sehingga cocok digunakan sebagai adsorbat pada zeolit yang memiliki struktur negatif.
Pada penelitian ini digunakan metode tumpak. Larutan contoh dicampur dan dikocok bersama-sama dengan adsorben sampai tercapainya kesetimbangan. Zat yang tidak teradsorpsi dipisahkan dari adsorben
dengan cara penyaringan. Kemudian
dilakukan pengukuran konsentrasi sisa larutan.
Kondisi adsorpsi zeolit terhadap biru metilena dilakukan pada konsentrasi metilena biru 10, 20, dan 30 ppm. Kondisi optimum pada Tabel 6 adalah pada konsentrasi 30 ppm. Modifikasi zeolit dengan Fe(OH)3 akan
menghambat proses adsorpsi terhadap
metilena biru. Hal ini dikarenakan adanya perubahan struktur sifat zeolit setelah dimodifikasi. Kapasitas adsorpsi zeolit terhadap metilena biru terbesar terdapat pada zeolit aktif yang tidak dimodifikasi sebesar 0.7199 mg/g (Tabel 8).
Tabel 8 Kondisi optimum adsorpsi zeolit
Sampel
Biru metilena teradsorpsi (ppm)
)
mg/g
Zeolit awal 27.907 0.6949
Zeolit aktif 28.937 0.7199
Zeolit awal modifikasi
22.656 0.5658
Zeolit aktif modifikasi
22.909 0.5710
"8%)% " $ %&
9
mineral zeolit. Prinsipnya adalah Jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal akan membiaskan sinar-X dan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar. Hasil analisis pencirian zeolit alam, dan zeolit sebagai standar.
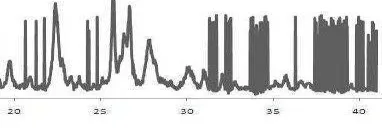
Gambar 7 dan 8 menunjukkan spektrum XRD zeolit alam. Secara jelas dapat diketahui berbagai posisi puncak-puncaknya berada pada rentang sudut difraksi (2θ) antara 20-40° (Pertiwi, A 2007) Penentuan stuktur zeolit alam dilakukan dengan membandingkan posisi puncak zeolit yang dianalisis dengan puncak zeolit standar.
Spektrum standar menunjukan Intensitas tertinggi muncul pada sudut 27.82 (°2θ) dengan puncak sebesar 1963.33, sedangkan spektrum pada zeolit alam menunjukan intensitas tertinggi muncul pada sudut 27.72 (°2θ) dengan puncak sebesar 1672. hal ini
menunjukan bahwa kristalinitas yang
terbentuk pada zeolit alam adalah klinoptilolit dan tercampur dengan beberapa senyawa pengotor.
Gambar 7 Spektrum difraksi sinar-X zeolit sebagai standar
Gambar 8 Spektrum difraksi sinar-X zeolit alam
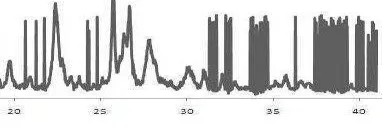
Zeolit hasil modifikasi dengan Fe(OH)3
menunjukan spektrum difraksi sinar-X yang ditunjukan pada Gambar 9. Berdasarkan gambar tersebut, spektrum difraksi sinar-X memiliki puncak yang berbeda dengan zeolit
awal sebelum modifikasi. Hal ini dikarenakan dari jumlah logam Fe yang terkandung dalam zeolit. Zeolit sebelum modifikasi memiliki puncak intensitas yang rendah terhadap Fe, sedangkan zeolit modifikasi memiliki puncak intensitas yang tinggi terhadap Fe (terlihat pada sudut 36.3° (2θ) ). Hal ini menunjukan keberhasilan modifikasi zeolit dengan
Fe(OH)3 yang menunjukan jumlah Fe
modifikasi lebih banyak dibandingkan
sebelum modifikasi.
Gambar 9 Spektrum difraksi sinar-X zeolit alam termodifikasi Fe(OH)3
%!/' "
Berdasarkan hasil penelitian diambil kesimpulan bahwa modifikasi zeolit dengan Fe(OH)3 dapat dilakukan terhadap zeolit alam
dan zeolit alam teraktivasi sehingga kapasitas tukar anion zeolit semakin meningkat. Kapasitas tukar kation zeolit sebelum modifikasi lebih tinggi lebih tinggi dibandingkan zeolit modifikasi berturut-turut sebesar 81.15 dan 41.91 mek/100 g. Kapasitas tukar anion zeolit modifikasi lebih tinggi dibandingkan zeolit sebelum modifikasi berturut turut sebesar 5.064 dan 17.449 mek/100 g. Proses aktivasi dapat meningkat-kan nilai KTK dan KTA zeolit. Nilai KTK sebelum dan sesudah aktivasi berturut-turut sebesar 81.15 dan 99.44 mek/100 g,dan nilai KTA zeolit modifikasi sebelum dan sesudah aktivasi berturut-turut sebesar 17.449 dan 19.695 mek/100 g. Modifikasi zeolit dengan Fe(OH)3 akan menghambat proses adsorpsi
terhadap metilena biru, hal ini dikarenakan adanya perubahan struktur sifat zeolit setelah dimodifikasi. Kapasitas adsorpsi zeolit terhadap metilena biru terbesar terdapat pada zeolit aktif yang tidak dimodifikasi sebesar 0.7199 mg/g
) "
9
mineral zeolit. Prinsipnya adalah Jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal akan membiaskan sinar-X dan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar. Hasil analisis pencirian zeolit alam, dan zeolit sebagai standar.
Gambar 7 dan 8 menunjukkan spektrum XRD zeolit alam. Secara jelas dapat diketahui berbagai posisi puncak-puncaknya berada pada rentang sudut difraksi (2θ) antara 20-40° (Pertiwi, A 2007) Penentuan stuktur zeolit alam dilakukan dengan membandingkan posisi puncak zeolit yang dianalisis dengan puncak zeolit standar.
Spektrum standar menunjukan Intensitas tertinggi muncul pada sudut 27.82 (°2θ) dengan puncak sebesar 1963.33, sedangkan spektrum pada zeolit alam menunjukan intensitas tertinggi muncul pada sudut 27.72 (°2θ) dengan puncak sebesar 1672. hal ini
menunjukan bahwa kristalinitas yang
terbentuk pada zeolit alam adalah klinoptilolit dan tercampur dengan beberapa senyawa pengotor.
Gambar 7 Spektrum difraksi sinar-X zeolit sebagai standar
Gambar 8 Spektrum difraksi sinar-X zeolit alam
Zeolit hasil modifikasi dengan Fe(OH)3
menunjukan spektrum difraksi sinar-X yang ditunjukan pada Gambar 9. Berdasarkan gambar tersebut, spektrum difraksi sinar-X memiliki puncak yang berbeda dengan zeolit
awal sebelum modifikasi. Hal ini dikarenakan dari jumlah logam Fe yang terkandung dalam zeolit. Zeolit sebelum modifikasi memiliki puncak intensitas yang rendah terhadap Fe, sedangkan zeolit modifikasi memiliki puncak intensitas yang tinggi terhadap Fe (terlihat pada sudut 36.3° (2θ) ). Hal ini menunjukan keberhasilan modifikasi zeolit dengan
Fe(OH)3 yang menunjukan jumlah Fe
modifikasi lebih banyak dibandingkan
sebelum modifikasi.
Gambar 9 Spektrum difraksi sinar-X zeolit alam termodifikasi Fe(OH)3
%!/' "
Berdasarkan hasil penelitian diambil kesimpulan bahwa modifikasi zeolit dengan Fe(OH)3 dapat dilakukan terhadap zeolit alam
dan zeolit alam teraktivasi sehingga kapasitas tukar anion zeolit semakin meningkat. Kapasitas tukar kation zeolit sebelum modifikasi lebih tinggi lebih tinggi dibandingkan zeolit modifikasi berturut-turut sebesar 81.15 dan 41.91 mek/100 g. Kapasitas tukar anion zeolit modifikasi lebih tinggi dibandingkan zeolit sebelum modifikasi berturut turut sebesar 5.064 dan 17.449 mek/100 g. Proses aktivasi dapat meningkat-kan nilai KTK dan KTA zeolit. Nilai KTK sebelum dan sesudah aktivasi berturut-turut sebesar 81.15 dan 99.44 mek/100 g,dan nilai KTA zeolit modifikasi sebelum dan sesudah aktivasi berturut-turut sebesar 17.449 dan 19.695 mek/100 g. Modifikasi zeolit dengan Fe(OH)3 akan menghambat proses adsorpsi
terhadap metilena biru, hal ini dikarenakan adanya perubahan struktur sifat zeolit setelah dimodifikasi. Kapasitas adsorpsi zeolit terhadap metilena biru terbesar terdapat pada zeolit aktif yang tidak dimodifikasi sebesar 0.7199 mg/g
) "
10
kondisi optimum modifikasi. Perlu dilakukan uji adsorpsi menggunakan larutan yang bermuatan negatif seperti fenol untuk lebih membuktikan peningkatan kapasitas anion pada zeolit.
Peningkatan nilai KTA zeolit setelah
dimodifikasi membuka peluang bagi
penerapan zeolit termodifikasi Fe(OH)3
sebagai penjerap bahan pencemar berbahaya yang memiliki muatan formal negatif. Salah satu contoh senyawa berbahaya yang dapat dijerap dengan zeolit termodifikasi ini adalah fenol. Meski demikian modifikasi ini dapat dikembangkan sedemikian rupa baik dengan mengubah komposisi zeolit maupun dengan
mengubah sumber mineral bahan
pemodifikasi.
Al-Jabri M. 2008. Kajian Metode Penetapan Kapasitas Tukar Kation Zeolit Sebagai Pembenah Tanah untuk Lahan Pertanian
Terdegradasi. * 10 :
56-59.
Anwar S, Sudadi S. 2007. + ,
Bogor: Departemen Manajemen
Sumber Daya Lahan, Fakultas Pertanian, IPB.
Atkins PW. 1999. + $ Irma IK,
penerjemah. Jakarta: Erlangga.
Terjemahan dari:
-Augustine RL. 1996.
, Marcel Dekker Inc, New York.
Bouffard SC, Duff SJB. 2000. & $
. & % '
/ . New York: Elsevier Science
Publishers B.V. Barrer, R.M. 1987. /
0 0
1 . London : Academic Press
Clesceri LS, Greenberg AE, Eaton AD. 2005.
0 2
3 3 Ed ke-21.
Washington DC: American Public Health Association.
Chorkendroff JW, Niemantsverdiet. 2003.
0 + .
New York : Wliey.
Cotton FA and Wilkinson G. 1989. +
. $ . Sahati Suharto,
penerjemah. Jakarta: UI Press. Terjemahan
dari : 4 5
Diantariani NP . 2008. Proses biosorpsi dan desorpsi ion Cr (VI) pada biosorben
rumput laut Eucheuma spinosum *
+ 2: 45-52.
Ermawati, Y. 2003. Pengaruh konsentrasi HCl dan NH4NO3 Terhadap Dealuminasi Zeolit
Alam Wonosari Wliey-VCH GmbH&Co [skripsi]. Semarang: UNDIP
Flanigen EM. 1991. / 0
1 . - 1 . New
York: Elsevier, Science Publishers B.V. Gottardi G. 1976. Mineralogy and crystal
chemistry of zeolites. p.31-44. In Natural Zeolites: Occurrence, Properties, Use (Sand, L.B. and Mumpton, F.A., eds.). New York : Pergamon Press.
Hamdan, H., 1992, 5 / 6
7 7
0 . Kuala Lumpur: Universitas
Teknologi Malaysia.
Haryati A. 2007. Perilaku krom heksavalen
krom trivalen dan krom limbah
penyamakan kulit dalam interaksinya dengan zeolit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Hay RL. 1966. /
$. California:
Department Geology and
Geophysics,University of Califonia, Berkeley.
Khairinal, Trisunaryanti, W. 2000.
Dealuminasi Zeolit Alam Wonosari
dengan Perlakuan asam dan Proses
Hidrotermal. Yogyakarta: Prosiding
Seminar Nasional Kimia VIII. Yogyakarta. Ming DW, Mumpton. 1989. Zeolites in Soils. Di dalam: Dixon JB, Weed SB, editor.
0 2 1 . Ed ke-2.
Madison: Solid Science Society of America.
Pertiwi A, Setiadi. 2007. Preparasi dan Karakterisasi zeolit alam untuk konversi senyawa ABE menjadi hidrokarbon
Jakarta: Prosiding kongres dan
simposium nasional kedua MKICS. Setyawan D, Handoko P. 2003. Aktivitas
katalis Cr/zeolit dalam reaksi konversi katalitik fenol dan metil isobutil keton
* 5 4: 70-76.
Suyartono dan Husaini. 1991. Tinjauan terhadap kegiatan penelitian karakterisasi dan pemanfaatan zeolit Indonesia yang dilakukan PPTM Bandung Periode 1890-1991. Bandung: Buletin PPTM. JPPSH.
Suwardi. 1998. - + 0
/ - $ 4
- . Bogor: Departemen
10
kondisi optimum modifikasi. Perlu dilakukan uji adsorpsi menggunakan larutan yang bermuatan negatif seperti fenol untuk lebih membuktikan peningkatan kapasitas anion pada zeolit.
Peningkatan nilai KTA zeolit setelah
dimodifikasi membuka peluang bagi
penerapan zeolit termodifikasi Fe(OH)3
sebagai penjerap bahan pencemar berbahaya yang memiliki muatan formal negatif. Salah satu contoh senyawa berbahaya yang dapat dijerap dengan zeolit termodifikasi ini adalah fenol. Meski demikian modifikasi ini dapat dikembangkan sedemikian rupa baik dengan mengubah komposisi zeolit maupun dengan
mengubah sumber mineral bahan
pemodifikasi.
Al-Jabri M. 2008. Kajian Metode Penetapan Kapasitas Tukar Kation Zeolit Sebagai Pembenah Tanah untuk Lahan Pertanian
Terdegradasi. * 10 :
56-59.
Anwar S, Sudadi S. 2007. + ,
Bogor: Departemen Manajemen
Sumber Daya Lahan, Fakultas Pertanian, IPB.
Atkins PW. 1999. + $ Irma IK,
penerjemah. Jakarta: Erlangga.
Terjemahan dari:
-Augustine RL. 1996.
, Marcel Dekker Inc, New York.
Bouffard SC, Duff SJB. 2000. & $
. & % '
/ . New York: Elsevier Science
Publishers B.V. Barrer, R.M. 1987. /
0 0
1 . London : Academic Press
Clesceri LS, Greenberg AE, Eaton AD. 2005.
0 2
3 3 Ed ke-21.
Washington DC: American Public Health Association.
Chorkendroff JW, Niemantsverdiet. 2003.
0 + .
New York : Wliey.
Cotton FA and Wilkinson G. 1989. +
. $ . Sahati Suharto,
penerjemah. Jakarta: UI Press. Terjemahan
dari : 4 5
Diantariani NP . 2008. Proses biosorpsi dan desorpsi ion Cr (VI) pada biosorben
rumput laut Eucheuma spinosum *
+ 2: 45-52.
Ermawati, Y. 2003. Pengaruh konsentrasi HCl dan NH4NO3 Terhadap Dealuminasi Zeolit
Alam Wonosari Wliey-VCH GmbH&Co [skripsi]. Semarang: UNDIP
Flanigen EM. 1991. / 0
1 . - 1 . New
York: Elsevier, Science Publishers B.V. Gottardi G. 1976. Mineralogy and crystal
chemistry of zeolites. p.31-44. In Natural Zeolites: Occurrence, Properties, Use (Sand, L.B. and Mumpton, F.A., eds.). New York : Pergamon Press.
Hamdan, H., 1992, 5 / 6
7 7
0 . Kuala Lumpur: Universitas
Teknologi Malaysia.
Haryati A. 2007. Perilaku krom heksavalen
krom trivalen dan krom limbah
penyamakan kulit dalam interaksinya dengan zeolit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Hay RL. 1966. /
$. California:
Department Geology and
Geophysics,University of Califonia, Berkeley.
Khairinal, Trisunaryanti, W. 2000.
Dealuminasi Zeolit Alam Wonosari
dengan Perlakuan asam dan Proses
Hidrotermal. Yogyakarta: Prosiding
Seminar Nasional Kimia VIII. Yogyakarta. Ming DW, Mumpton. 1989. Zeolites in Soils. Di dalam: Dixon JB, Weed SB, editor.
0 2 1 . Ed ke-2.
Madison: Solid Science Society of America.
Pertiwi A, Setiadi. 2007. Preparasi dan Karakterisasi zeolit alam untuk konversi senyawa ABE menjadi hidrokarbon
Jakarta: Prosiding kongres dan
simposium nasional kedua MKICS. Setyawan D, Handoko P. 2003. Aktivitas
katalis Cr/zeolit dalam reaksi konversi katalitik fenol dan metil isobutil keton
* 5 4: 70-76.
Suyartono dan Husaini. 1991. Tinjauan terhadap kegiatan penelitian karakterisasi dan pemanfaatan zeolit Indonesia yang dilakukan PPTM Bandung Periode 1890-1991. Bandung: Buletin PPTM. JPPSH.
Suwardi. 1998. - + 0
/ - $ 4
- . Bogor: Departemen
11
Suwardi. 2000. - $ - /
5 . Bogor: Departemen
Manajemen Sumber Daya Lahan, Fakultas Pertanian, IPB.
Thamzil. 2005. - / $ 0
8 5 $ . Tanggerang:
Pusat Pengembangan Pengelolaan Limbah Radioaktif Badan Tenaga Nuklir Nasional
(P2PLR BATAN), Kawasan Puspiptek
Serpong.
FIRDAUS SYAFII. Modifikasi Zeolit melalui Interaksi dengan Fe(OH)
3untuk
Meningkatkan Kapasitas Tukar Anion. Dibimbing oleh CHARLENA dan SRI
SUGIARTI.
Struktur zeolit yang bermuatan negatif yang diakibatkan penggantian atom Si
oleh atom Al pada proses pembentukannya, membuat zeolit berfungsi sebagai
penukar kation dan sedikit sebagai penukar anion. Peningkatan kemampuan zeolit
sebagai penukar anion dapat ditingkatkan melalui modifikasi zeolit. Salah satu
caranya adalah dengan penambahan Fe(OH)
3. Prinsipnya adalah ion Fe masuk
dalam rongga zeolit dan membentuk kompleks dengan senyawa anion (ligan).
Berdasarkan hasil penelitian, modifikasi zeolit dengan Fe(OH)
3dapat dilakukan
pada zeolit alam dan zeolit alam teraktivasi sehingga kapasitas tukar anion zeolit
semakin meningkat. Kapasitas tukar anion zeolit termodifikasi lebih tinggi
dibandingkan zeolit sebelum modifikasi, berturut turut sebesar 5.064 dan 17.449
mek/100 g. Modifikasi zeolit dengan Fe(OH)
3menghambat proses adsorpsi
terhadap biru metilena, hal ini karena perubahan struktur sifat zeolit setelah
dimodifikasi. Kapasitas adsorpsi zeolit terhadap biru metilena terbesar terdapat
pada zeolit aktif yang tidak dimodifikasi sebesar 0.7199 mg/g
FIRDAUS SYAFI’I. Zeolite Modification by Interaction with Fe(OH)
3to Increase
Anion Exchange Capacity. Supervised by CHARLENA and SRI SUGIARTI
Zeolite structure, that bears negative charge caused by replacement of Si with
Al in the process of its formation, makes the zeolite has a function as cation
exchanger and some anion exchange. To improve its anion exchange properties,
zeolite can be modified by addition of Fe(OH)
3. Fe
3+ions will enter empty cavities
of the zeolite and bind the anions (ligands) to form complexes. Based on the
esperiment, the modified zeolite with Fe(OH)
3can be made from both natural and
active zeolites, increasing the anion exchange capacity of the zeolite. The anion
exchange capacity of the modified zeolite was higher that of the zeolite before
modification,i.e. 5.064 and 17.449 meq/100 g, respectively. Modification of
zeolite with Fe(OH)
3inhibited adsorption of methylene blue, due to structural
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul Skripsi : Modifikasi Zeolit melalui Interaksi dengan Fe(OH)
3untuk
Meningkatkan Kapasitas Tukar Anion
Nama
: Firdaus Syafii
NIM
: G44062014
Menyetujui
Pembimbing I,
Pembimbing II,
Dr. Charlena, M.Si
Dr. Sri Sugiarti
NIP 1967 1222 199403 2 002
NIP
19701225 199512 2 001
Mengetahui
Ketua Departemen Kimia,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala kasih
sayang, nikmat, rahmat, dan karunia-Nya sehingga penulis dapat menyelesaikan
karya ilmiah ini. Karya ilmiah yang berjudul Modifikasi Zeolit Melalui Interaksi
dengan Fe(OH)
3Untuk Meningkatkan Kapasitas Tukar Anion ini merupakan
salah satu syarat untuk memperoleh gelar sarjana sains pada Departemen Kimia
FMIPA IPB.
Penulis mengucapkan terima kasih kepada Ibu Dr. Charlena, M.Si dan Dr. Sri
Sugiarti sebagai pembimbing yang telah memberikan arahan, saran, dan dorongan
selama pelaksanaan penelitian dan penulisan karya ilmiah ini.
Ungkapan terima kasih penulis berikan kepada keluarga tercinta, Bapak, Ibu,
yang selalu memberikan semangat, doa, dan kasih sayang dalam berbagai bentuk
yang tak pernah putus. Terima kasih juga kepada Pak syawal, Pak Mul, Nurul,
dan seluruh staf Laboratorium Kimia Anorganik atas fasilitas dan bantuan yang
diberikan selama penelitian. Ucapan terima kasih tak lupa penulis berikan kepada
Ughie, Mamade, Dinda, dan teman seperjuangan Kimia 43, dan
teman-teman , memberikan semangat, dan dukungannya dalam penyusunan karya ilmiah.
Semoga karya ilmiah ini dapat bermanfaat.
Penulis dilahirkan di Subang pada tanggal 05 November 1987 sebagai putra
pertama dari tiga bersaudara dari pasangan Muhammad Ocin Firdaus dan
Maryami.
Tahun 2006 penulis lulus dari SMA Negeri 1 Palimanan Cirebon dan pada
tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia,
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
! "
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Zeolit ... 1
Struktur Zeolit ... 2
Aktivasi Zeolit ... 3
Modifikasi Zeolit dengan Fe(OH)3
...3
Spektroskopi Difraksi Sinar-X ... 4
METODE
Alat dan Bahan ... 4
Metode Penelitian ... …… 4
HASIL DAN PEMBAHASAN
Proses Aktivasi Zeolit ... 6
Modifikasi Zeolit Alam Dengan Fe(OH)
3... 7
Penentuan Kapasitas Tukar Kation ... 7
Penentuan Kapasitas Tukar Anion ... 8
Penentuan Uji Adsorpsi Zeolit ... 8
Pencirian Zeolit ... 8
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 9
! "
1 Struktur dasar zeolit ... 2
2 Tetrahedral alumina dan silikon (TO) pada struktur zeolit ... 3
3 Unit bangun sekunder struktur zeolit:
-4-
(S4R),
-4-
(D4R), dan
4-1 (T
5O
10) ... 3
4 Unit bangun polihedral struktur zeolit ... 3
5 Reaksi zeolit dengan asam (dealuminasi) ... 4
6 Reaksi aktivasi zeolit... 7
7 Spektrum difraksi sinar-X zeolit sebagai standar... .... 10
8 Spektrum difraksi sinar-X zeolit alam.. ... 10
9 Spektrum difraksi sinar-X zeolit alam termodifikasi Fe(OH)
3... 10
! "
1 Jenis mineral zeolit yang terdapat dalam batuan zeolit ... 2
2 Jenis-jenis zeolit sintetis ... 2
3 Hasil modifikasi zeolit………. 8
4 Data kapasitas tukar kation zeolit sebelum modifikasi ... 8
5 Data kapasitas tukar kation zeolit sesudah modifikasi… ... 8
6 Data kapasitas tukar kation zeolit sebelum modifikasi… ... 9
7 Data kapasitas tukar kation zeolit sesudah modifikasi.. ... 9
8 Kondisi optimum adsorpsi zeolit.. ... 9
! "
1 Diagram alir penelitian ... 14
2 Proses pembuatan Fe(OH)
3……….15
3
Hasil modifikasi zeolit alam dengan Fe(OH)
3... 16
4 Data hasil kapasitas tukar kation zeolit... 16
5 Penentuan kapasitas tukar anion zeolit termodifikasi Fe(OH)
3………… 17
6 Penentuan kapasitas tukar anion zeolit aktivasi termodifikasi Fe(OH)
3... 18
1
Kegiatan industri menghasilkan limbah yang mencemari lingkungan. Bahan pencemar yang dihasilkan berwujud cairan yang sebagian besar mengandung polutan organik. Salah satu cara menurunkan kandungan pencemar dalam air limbah adalah perlakuan sorpsi melalui pertukaran ion. Metode sorpsi melibatkan interaksi antara analit dan permuka