i
SINTESIS α
-Fe
2O
3MENGGUNAKAN METODE SOL-GEL
PANDU PURNOMO
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
PANDU PURNOMO. Sintesis α-Fe2O3 Menggunakan Metode Sol-Gel.
Dibimbing oleh MOH. NUR INDRO M,Sc.
Pada penelitian ini telah berhasil membuat serbuk α-Fe2O3 dengan ukuran partikel
202.64 nm. Sintesis menggunakan metode Sol-Gel dengan pelapisan SiO2 yang
berasal dari Si(OC2H5)4 pada suhu 750 oC selama 5 jam. Karakterisasi XRD membuktikan sampel yang terbentuk adalah α-Fe2O3 (11 puncak) dan -Fe2O3
(2 puncak) dengan ukuran kristal 20.69125 nm dan derajat kristalitas 44 %. Struktur kristal yang terbentuk α-Fe2O3 adalah rhombohedral dan -Fe2O3 adalah
heksagonal. Karakterisasi sifat optic memperlihatkan sampel menyerap cahaya dengan baik pada panjang gelombang kurang dari 480 nm. Energi bandgap dari pengukuran karakterisasi optik adalah 2.74 eV.
Kata kunci: α-Fe2O3, annealing, energi bandgap, sol-gel, struktur kristal
ABSTRAC
PANDU PURNOMO. Synthesis of α-Fe2O3 Using Sol-Gel Method. Guided by MOH. NUR INDRO M,Sc.
In this reseach was succeeded make powder α-Fe2O3 with particle size 202.64 nm.
Synthesis using Sol-Gel method with SiO2 coating derived from Si(OC2H5)4 at temperature of 750 oC for 5 hours. Characterization XRD prove that sample form is α-Fe2O3 (11 peaks) and -Fe2O3 (2 peaks) with crystal size 20.69125 nm and
crystallization 44 %. The cystal structure of α-Fe2O3 is rhombohedral and -Fe2O3
is hexsagonal. Optic characterization show that the sample absorbing light at wavelength less than 480 nm. Bandgap energy of the optical characterization measurments is 2.74 eV.
iii
SINTESIS α
-Fe
2O
3MENGGUNAKAN METODE SOL-GEL
PANDU PURNOMO
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Fisika
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
NRP : G74080037
Disetujui oleh
Drs. M. Nur lndro, M.Sc
Pembimbing
Diketahui oleb
iv
Judul : Sintesis α-Fe2O3 menggunakan metode sol gel
Nama : Pandu Purnomo
NRP : G74080037
Disetujui oleh
Drs. M. Nur Indro, M.Sc
Pembimbing
Diketahui oleh
Dr. Akhiruddin Maddu, M.Si
Ketua Departemen Fisika
KATA PENGANTAR
Puji syukur saya panjatkan kepada Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan hidayahNya kepada saya sebagai penulis sehingga saya dapat menyelesaikan penelitian yang berjudul Sintesis dan Karakterisasi α-Fe2O3
menggunakan metode sol gel sebagai bahan fotokatalis. Skripsi ini disusun sebagai salah satu syarat kelulusan untuk memperoleh gelar Sarjana Sains program sarjana di Departemen Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Penulis ingin mengucapkan terima kasih kepada :
1. Orang tua saya yang senantiasa mendoakan saya dan umi tercinta yang senantiasa memberikan semangat.
2. Drs. M. Nur Indro, M.Sc dan Dra. Mujamilah, M.Sc sebagai dosen pembimbing yang selalu mendorong dan memotivasi saya untuk menyelesaikan usulan penelitian ini.
3. Rekan-rekan fisika angkatan 43, 44, dan 45.
4. Semua teman-teman civitas IPB yang selalu mendorong dan memberikan semangat serta semua pihak yang tidak dapat saya sebutkan satu persatu yang telah banyak membantu dan mendoakan saya.
Akhir kata, semoga tulisan ini dapat memberikan manfaat untuk kita semua. Saya menyadari bahwa tulisan ini masih jauh dari sempurna, sehingga kritik dan saran yang membangun sangat penulis harapkan.
Bogor, Agustus 2013
vi
DAFTAR ISI
DAFTAR TABEL
vii
DAFTAR GAMBAR
vii
DAFTAR LAMPIRAN
vii
PENDAHULUAN
1
Latar Belakang 1
Tujuan 1
Rumusan Masalah 1
Hipotesis 2
TINJAUAN PUSTAKA
2
Oksida Besi, Hematit (α-Fe2O3) 2
Metode Sol-Gel 2
Bandgap 3
X-ray diffraction (XRD) 3
METODE PENELITIAN
4
Tempat dan waktu penelitian 4
Bahan dan alat 4
Prosedur penelitian 4
HASIL DAN PEMBAHASAN
6
Serbuk α-Fe2O3 6
Hasil XRD 8
Hasil Sifat Optik 9
Hasil PSA 11
SIMPULAN DAN SARAN
11
Simpulan 11
Saran 12
DAFTAR TABEL
Tabel 4.1 Parameter kisi α-Fe2O3 (Rhombohedral) 9
Tabel 4.β Parameter kisi -Fe2O3 (Heksagonal) 9
DAFTAR GAMBAR
Gambar 2.1 Struktur kristal rhombohedral 4
Gambar 2.2 Struktur kristal heksagonal 4
Gambar 3.1 Hubungan suhu dan waktu selama proses annealing 5
Gambar 4.1 Hasil akhir α-Fe2O3 setelah annealing 750 0C 7
Gambar 4.β Grafik XRD α-Fe2O3 8
Gambar 4.γ Hubungan Absorbansi dan panjang gelombang α-Fe2O3 5 jam 10
Gambar 4.4 Hubungan Reflektansi dan panjang gelombang α-Fe2O3 5 jam 10
Gambar 4.5 Bandgapα-Fe2O3 reflektansi 11
DAFTAR LAMPIRAN
Lampiran 1 Hasil Perhitungan paramaeter kisi α-Fe2O3 14
Lampiran β Perhitungan parameter kisi α-Fe2O3 15
PENDAHULUAN
Latar Belakang
Nanopartikel oksida besi Fe2O3 memiliki potensi besar dalam aplikasi
teknologi seperti biosensor, passive dan active targeting, optical power limiting agent, biogeochemical process asrecording media, biomedical application dan ferrofluid.1,2 Fe2O3 dapat dimanfaatkan juga sebagai fotokatalis, pemisah atau
amobilitas enzim, transport obat, serapan gelombang mikro, pemisahan logam, MRI, dll.2,3
Hematite(α–Fe2O3) menjadi prototype yang dapat digunakan sebagai katalis
dan fotokatalis untuk biodegradasi karena memiliki band gap rata-rata 2 eV, harganya murah, tahan tehadap korosi, ramah lingkungan (non-toxic), dan memiliki stabilitas kimia yang baik dalam air.4-14
Ada beberapa metode pembuatan nanopartikel, diantaranya dengan metode basah, proses mekanik, dan form-processes. Proses basah seperti metode kimia koloid, hidrotermal, sol-gel, presipitasi, sono kimia, dan emulsifikasi.15,16 Proses mekanik seperti grinding, milling, dan spray coating.16 Untuk membuat nanostructure α–Fe2O3 dapat digunakan teknik spray pyrolysis, sol-gel, template,
dan hydrothermal.5
Pada penelitian ini, pembuatan α–Fe2O3 menggunakan metode sol-gel.
Metode sol-gel dipilih karena memiliki beberapa keuntungan antara lain dapat diaplikasikan pada berbagai partikel atau bersifat serba guna, kehomogenan yang bagus dari campuran, ukuran partikel seragam, tidak menghasilkan gumpalan-gumpalan besar, prosesnya relative mudah, biaya murah, dan nanopartikelnya memiliki kristalitas tinggi.3
Pada penelitian ini dilakukan uji XRD, untuk identifikasi struktur kristal hematite, uji sifat optik untuk menghitung band gap, serta uji PSA untuk
menghitung ukuran partikel α–Fe2O3.
Tujuan
Tujuan penelitian ini adalah untuk membuat serbuk α–Fe2O3 berukuran nano
kemudian menguji sifat optiknya
Rumusan Masalah
1. Apakah dengan metode sol-geldapat menghasilkan nanopartikel α–Fe2O3?
2
Hipotesis
Pembuatan serbuk α–Fe2O3 dari bahan FeCl3.6H2O menggunakan metode
sol gel dan di annealing pada suhu 750 oC dapat menghasilkan ukuran kristal antara ± 20 nm.
TINJAUAN PUSTAKA
Oksida Besi, Hematit (α-Fe2O3)
Bahan oksida besi tersedia di alam dalam jumlah yang sangat besar. Ada 4 fasa oksida besi yang dapat terbentuk meliputi fasa magnetite (Fe3O4), fasa
maghemite ( -Fe2O3), hematite (α-Fe2O3) dan wustite (FeO).3,17,18,19 Selain proses
sintesis secara alami (natural), bahan ini juga secara terkontrol dapat disintesis di laboratorium.17 Perbedaan suhu kalsinasi akan menghasilkan berbagai bentuk fasa oksida besi,3 Fe3O4 dapat terbentuk pada suhu ruang, -Fe2O3 pada kalsinasi
200 oC, α-Fe2O3 pada kalsinasi 300 oC – 600 oC dan FeO pada kalsinasi diatas
570 oC.20 Hematite (α-Fe2O3) merupakan fasa oksida besi yang paling stabil dan
termasuk dalam magnet ferrite. 4,5,13 Hematite mempunyai struktur heksagonal atau rhombohedral.5,12,13 Hematite memiliki sifat anti ferromagnetik pada suhu dibawa 260 K5,7 dan ferromagnetik lemah di atas 260 K.7
Hematite termasuk semikonduktor dengan bandgap rata-rata 2 eV, menyerap 40 % - 45 % energi cahaya mataharipada spektrum cahaya tampak antara 295 nm - 600 nm sehingga membuat α-Fe2O3 dapat diaplikasikan sebagai
fotokatalis.4,6-12 Koefisien absorbansi α-Fe2O3 sebesar 104 cm-1 sehingga α-Fe2O3
dapat digunakan sebagai elektroda semikonduktor8. Hematite juga memiliki indeks bias yang tinggi 2.31, sehingga dapat menyerap panjang gelombang pendek dan dapat diaplikasikan untuk filter interferensi optik, terutama filter untuk gelombang panjang tertentu.14
Metode Sol-Gel
Untuk partikel halus, mudah dalam kontrol komposisi (kehomogenan komposisi kimia baik), temperatur proses rendah, biaya murah.
Bandgap
Sifat optik material dapat diketahui dari lebar celah pita energinya (bandgap) menggunakan prinsip penyerapan cahaya. Prinsip ini sangat berguna dalam mempelajari dasar mekanisme optik induksi transisi dari material kristal dan non kristal. Bandgap α-Fe2O3 diperoleh dengan perhitungan reflektansi
menggunakan hubungan [ln(Rmax-Rmin)/(R-Rmin)]2 dan energi foton yang datang di tunjukkan pada persamaan :
= [(Rmax-Rmin)/(R-Rmin)]2 (2.1)
keterangan: adalah koefisien absorbansi (cm-1), R adalah nilai reflektansi (%), dan d adalah ketebalan film (cm).
Jika bandgap antara 1 eV - 6 eV termasuk bahan semikonduktor. Jika bandgap-nya lebih dari 6 eV termasuk bahan isolator.
X-ray diffraction (XRD)
Struktur kristal dipelajari menggunakan metode x-ray diffraction (XRD). Orde panjang gelombang sinar-x hampir sama dengan jarak antar atom pada kristal, maka sinar-x dapat didifraksi oleh kristal.
Difraksi sinar-x oleh atom-atom yang tersusun di dalam kristal akan menghasilkan pola yang berbeda bergantung pada konfigurasi atom-atom pembentuk kristal. Elektron yang dipancarkan dengan tegangan yang sangat tinggi menumbuk target Cu. Sebagian energi kinetik elektron yang menumbuk target berubah menjadi sinar-x.21
Syarat terjadinya difraksi harus memenuhi hukum difraksi Bragg,
(2.2)
keterangan: d adalah jarak antar bidang, adalah sudut difraksi dan adalah panjang gelombang (Cu = 1,50546 Å).
Untuk mencari parameter kisi dapat digunakan metode Cohen. Metode ini sangat akurat karena kesalahan sistematis tereliminasi oleh pemilihan fungsi ekstrapolasi yang tepat dan kesalahan acak dikurangi dengan metode kuadrat terkecil. Struktur kristal α-Fe2O3 memiliki struktur rhombohedral dan heksagonal
4
Gambar 2.1 Struktur kristal rhombohedral.21 Gambar 2.2 Struktur kristal heksagonal.20
METODE PENELITIAN
Tempat dan waktu penelitian
Penelitian dilakukan di Laboratorium Material dan Biofisika Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Petanian Bogor dari bulan Maret 2012 sampai dengan bulan Januari 2013.
Bahan dan alat
Bahan yang digunakan dalam penelitian ini adalah FeCl3.6H2O, NaOH,
alkohol, aquades, deionized water, TEOS (Si(OC2H5)4), amoniak, dan HCL.
Alat yang digunakan pada penelitian ini adalah gelas ukur, elemeyer, magnetic stirrer, pinset, beaker glass, bransonic 2510, neraca analitik, spatula, tabung reaksi, pipet, tissue, furnace Vulcan TM 3-130, Spectrophotometer UV-VIS ocean optic USB 1000, Shimadzu XRD-7000, dan PSA 114102.
Prosedur penelitian
Pembuatan Fe2O3
Sumber Fe berasal dari FeCl3.6H2O 99 %. Sebanyak 3 gram FeCl3.6H2O
diexstrak FeCl3. FeCl3 yang terbentuk kemudian di tambah dengan NaOH sedikit
demi sedikit sambil stiring pada kecepatan 1200 rpm hingga terbentuk presipitat. Presipitat yang terbentuk dicuci menggunakan aquades murni untuk menghilangkan NaCl. Setelah dicuci dilakukan proses kalsinasi pada suhu 60 oC
Penglapisan Fe2O3 dengan SiO2
Tujuan pelapisan ini agar Fe2O3 yang terbentuk menjadi stabil dari
lingkungan dimana tidak terjadi oksidasi lebih lanjut dan mudah dalam aplikasinya. Proses pelapisan meliputi beberapa proses: 1. serbuk Fe2O3 dilarutkan
dalam etanol 90 % dibantu dengan sonikasi dan stiring agar terbentuk larutan yang homogen dan ukuran partikel lebih kecil. 2.Setelah sonikasi selama 1 jam, TEOS (Si(OC2H5)4) sebagai sumber SiO2 dan amoniak 25 % ditambahkan hingga
mencapai PH 10 kemudian dilanjutkan stiring selama 24 jam agar tercampur sempurna. 3. Proses selanjutnya yaitu aging, yaitu mendiamkan endapan yang terbentuk dalam waktu tertentu, aging yang dilakukan adalah 98 jam. 4. Setelah 98 jam akan terlihat endapan berwarna gelap, endapan kemudian dicuci dengan dionized water beberapa kali hingga bersih dari amoniak.
Proses annealing
Proses annealing dilakukan agar orientasi krsital α-Fe2O3 akan semakin
teratur. Proses ini menggunakan Vulcan TM 3-130 pada suhu 750 oC selama 5 jam. Proses annealing dimulai pada suhu ruang hingga 750 oC dengan kenaikan 5 oC/menit. Setelah annealing dilakukan pendinginan hingga suhu ruang
6
Karakterisasi serbuk Fe
2O
3Karakterisasi XRD
Karakterisasi XRD digunakan untuk mengetahui susunan atom-atom dalam suatu kristalin sehingga akan diketahui struktur kristal, orientasi dan ukuran kristal3. Data dari karakterisasi kemudian diolah dengan bantuan Microsoft excel luntuk menentukan indeks Miller dari pola difraksi sinar-x, menghitung parameter kisi dan menghitung parameter kristal.
Ukuran kristal dihitung menggunakan persamaan Debye-Scherrer.
(3.1)
Dimana D adalah ukuran kristal (nm), λ adalah panjang gelombang Cu (0.154056 nm), adalah FWHM (rad), dan θ adalah sudut difraksi Bragg (o).
Karakterisasi Sifat Optik
Karakterisasi sifat optik dilakukan untuk mempelajari tingkatan absorbansi dan reflektansi data yang diperoleh berupa kurva absorbansi dan reflektansi terhadap panjang gelombang. Data tersebut kemudian diolah untuk menentukan energi bandgap.
Dari kurva hubungan reflektansi, absorbansi terhadap panjang gelombang dapat ditentukan bandgap. Pada kurva reflektansi band gap diperoleh dengan melakukan ekstrapolasi [ln(Rmax-Rmin)/(R-Rmin)]2 ke 0 dengan sumbu x adalah hv dan sumbu y adalah [ln(Rmax-Rmin)/(R-Rmin)]2.
Karakterisasi PSA
Karakterisasi PSA dilakukan untuk mengetahui sebaran ukuran partikel
α-Fe2O3 yang terbentuk. Ukuran partikel ini digunakan sebagai acuan bila
material ini akan diaplikasikan.
HASIL DAN PEMBAHASAN
Serbuk α
-Fe
2O
3Hidrolisis FeCl3.6H2O berwarna kuning sebanyak 3 gram menghasilkan
1.8 gram FeCl3. Proses pemanasan 100 oC dilakukan untuk menghilangkan gugus
pencampurkan FeCl3 dengan NaOH 5M sedikit demi sedikit sambil stiring
menghasilkan presipitasi berwarna coklat kehitaman sebagai hasil reaksi FeCl3
-dan NaOH membentuk Fe(OH)3, sedikit panas akan terasa dari bejana sebagai
efek reaksi. Selain Fe(OH)3 terdapat NaCl sebagai hasil lainnya, NaCl yang
terbentuk berada di atas larutan, sedang Fe(OH)3 mengendap di bawah, sehingga
proses penghilangan NaCl cukup dengan pencucian larutan dengan aquades hingga bersih. Saat pencucian hendaknya dilakukan secara hati hati agar tidak ada sampel yang ikut hilang terbuang.
FeCl3 . 6H2O → FeCl3 + 6H2O
FeCl3 +γ NaOH → Fe(OH)3 + 3NaCl
2Fe(OH)3→ Fe2O3 + 3 H2O
Proses selanjutnya yaitu pembentukan Fe2O3 dari Fe(OH)3 dengan bantuan
kalsinasi pada suhu 60 oC selama 2 jam. Pada proses ini Fe(OH)3 bereaksi dengan
Fe(OH)3 serta kehilangan H2O. faktor kelembaban serta suhu mempengaruhi
proses pembentukan Fe2O3. Setelah 2 jam sebuk hitam diperoleh. Serbuk ini
adalah seed Fe2O3 yang masih memungkinkan terjadi oksidasi lanjut dengan
lingkungan sekitar. Peningkatan panas dapat merubah fasa Fe2O3 sedangkan
kelembaban dapat memicu terjadinya oksidasi lebih lanjut.
Bahan SiO2 digunakan sebagai bahan pelapis karena sifatnya SiO2 yang
mudah diaplikasikan dan bersifat biocompatible. Selain itu pemilihan bahan SiO2
disebabkan perubahan sifat logam Fe menjadi oksida Fe2O3 yang awalnya bersifat
vitreophobe menjadi vitreophilic yang memungkinkan ikatan antara logam dengan silica. Pelapisan dilakukan pada PH 10 sebagai katalis agar proses pelapisan berlangsung cepat. Hal ini akan berpengaruh waktu aging yang diberikan lebih singkat. Proses aging dimaksudkan agar pelapisan SiO2 pada permukaan merata
dan memiliki ketebalan yang cukup.
Setelah aging sampel dilakukan proses annealing untuk pembentukan fasa. Fe2O3 memiliki 4 bentuk fasa yang di pengaruhi oleh suhu, pada suhu annealing
diatas 400 oC akan terbentuk fasa α-Fe
2O3 (hematite). Proses annealing pada
penelitian ini dilakukan pada suhu 750 oC selama 5 jam sehingga terbentuk serbuk
α-Fe2O3 yang dibuat dengan metode sol-gel.
8
Hasil XRD
Serbuk α-Fe2O3– SiO2 dikarakterisasi dari sudut βθ= 10o sampai 80o dengan
step size 0.02o. Berdasarkan data hasil karakterisasi serbuk α-Fe2O3– SiO2 setelah
proses annealing 750 oC selama 5 jam memiliki puncak α-Fe2O3, -Fe2O3 (105)
(ββ6). Munculnya puncak -Fe2O3 disebabkan suhu annealing yang melebihi
suhu literature (400 oC).3 Gambar 4.1 menunjukkan pola XRD darri α-Fe2O3
beserta data standar JCPDS No. 33-0664. Dengan mengacu pada data standar ,struktur kristal α-Fe2O3 yang terbentuk adalah rhombohedral. Sedangkan struktur
kristal -Fe2O3 adalah hexagonal dan terbentuk amorf SiO2
Berdasarkan pola difraksi yang terbentuk, dapat diperoleh indeks Miller dengan mencocokkan data hasil karakterisasi XRD dengan data standar JCPDS. Dawny et al tellah mensintesis nanopartikel α-Fe2O3 menggunakan behan FeCl3
dengan metode hidrotermal pada suhu annealing 600 oC selama 2 jam, diperoleh
7 puncak difraksi α-Fe2O3 yang bersesuaian juga dengan data standar JCPDS No.
33-0664.4 α-Fe2O3 yang ditumbuhkan oleh Avila-Gracia et al dengan metode
sol-gel deposition juga telah terbentuk pada suhu annealing 500 oC selama 2 jam.11 begitu pun dengan Wenting Dong et al15 dan Doruk22 yang mendapatkan
α-Fe2O3 dengan metode sol-gel dan mikroemulsi pada suhu dan lama annealing
masing-masing 500 oC dan 600 oC selama 6 jam.
Parameter kisi diperoleh dengan menggunakan metode Cohen. Berdasarkan metode tersebut, parameter kisi a dan c dari α-Fe2O3 dihitung dari analisis pola
difraksi sinar-x dan diperkirakan dari persamaan sistem heksagonal,
(4.1)
Dimana d adalah jarak antar bidang dan h k l adalah indeks Miller.
Nilai perhitungan parameter kisi a dan c untuk α-Fe2O3 yaitu a=4.9160 dan
c=1γ.5858. Sedangkan nilai parameter kisi untuk -Fe2O3 adalah a=5.9255 dan
c=33.6505. Parameter kisi α-Fe2O3 dan -Fe2O3dapat dilihat pada Tabel 4.1 dan
Tabel 4.2.
Gambar 4.β Grafik XRD α-Fe2O3 α-Fe2O3
-Fe2O3
Tabel 4.1 Parameter kisi α-Fe2O3 (Rhombohedral)
Parameter Kisi Data JCPDS
a (Å) 4.9160 5.035
c (Å) 13.5858 13.74
Tabel 4.2 Parameter kisi -Fe2O3 (Heksagonal)
Parameter Kisi Data JCPDS
a (Å) 5.9255 5.92
c (Å) 33.6505 35.69
Berdasarkan pola difraksi dari α-Fe2O3 gambar 4.1, intensitas puncak (110)
relatif lebih tinggi dari puncak yang lain. Hal tersebut menunjukkan α-Fe2O3
memiliki kristalitas lebih baik. Ketajaman dan intensitas puncak pada spektrum menunjukkan kualitas kristal berupa puncak tajam (sharp) dan meiliki derajat keteraturan yang tinggi. Sedangkan pada amorf , puncak-puncak yag dihasilkan sangat landai karena memiliki derajat keteraturan yang sangat rendah. Proses annealing dilakukan agar orientasi kristal α-Fe2O3 semakin teratur. Proses
aneealing juga dapat mempengaruhi ukuran grain kristal.
Ukuran kristal dihitung menggunakan persamaan Debye-Scherrer. Dari perhitungan Debye-Scherrer diperoleh ukuran kristal α-Fe2O3 untuk puncak (104)
dan (110) masing masing sebesar 20.8971 nm dan 20.6922 nm. Benny et al3telah mensintesis α-Fe2O3 dengan metode sol-gel pada suku kalsinasi 400 oC selama
3 jam, diperoleh ukuran kristal sebesar 5.4 nm. Perhitungan ukuran kristal berdasarkan puncak difraksi (012) pada α-Fe2O3 juga dilakukan oleh Mammah et
al5 menggunakan metode ACG pada suhu 350 oC sebesar 17.4 nm. Sedangkan ukuran kristal α-Fe2O3 yang disintesis Dawny et al4 mengggunakan metode
hidrotermal pada suhu annealing 600 oC selama 2 jam sebesar 12.76 nm.Semakin tinggi suhu annealing, semakin besar ukuran grain.15 Pertumbuhan grain terjadi karena peningkatan suhu memperbesar energy vibrasi termal, yang kemudian mempercepat difusi atom melintasi batas grain dari grain yang kecil menuju grain yang besar. Selain itu, faktor yang mempengaruhi pertumbuhan kristal adalah adanya pertumbuhan kristal lain (crystal growth), sehingga pertumbuhan kristal terhambat. Hal ini terlihat dari data XRD dimana tumbuhnya puncak
-Fe2O3 dan beberapa puncak α-Fe2O3 (polikristal). Selain mempengaruhi
pertumbuhan kristal, suhu annealing dapat juga menyebabkan perubahan fasa. Perubahan fasa dari Fe2O3 dari suhu rendah ke tinggi mengikuti alur →δ→α.
memiliki puncak yang hampir sama dengan Fe3O4.
Hasil Sifat Optik
Karakterisasi sifat optik dilakukan untuk mempelajari tingkat absorbi dan
reflektansi α-Fe2O3 terhadap panjang gelombang 450 nm ~ 850 nm. Kurva
10
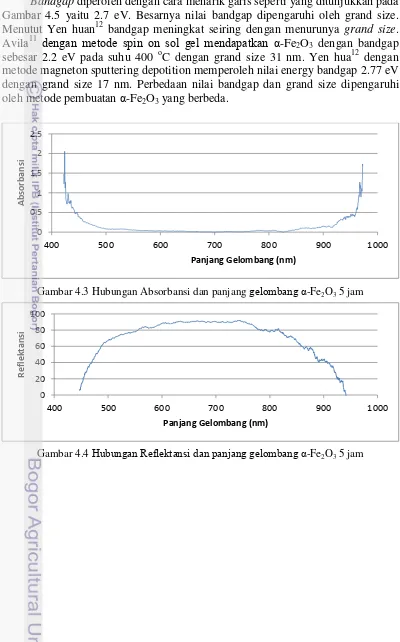
memiliki absorbansi yang baik pada panjang gelombangdi bawah 500 nm dan di atas 900 nm seperti yang diperlihatkan pada Gambar 4.3.
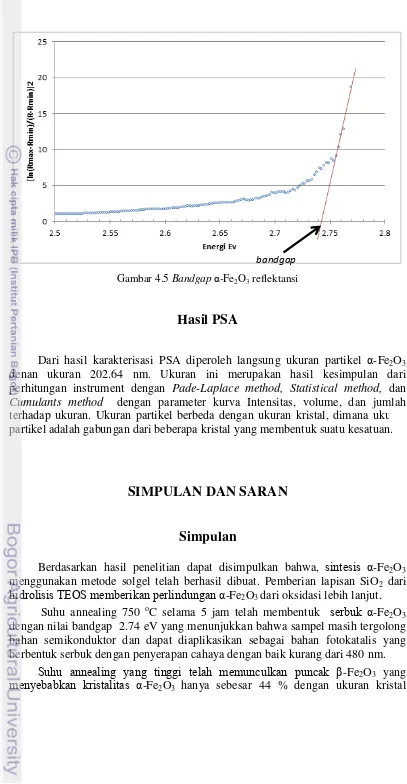
Bandgap diperoleh dengan cara menarik garis seperti yang ditunjukkan pada Gambar 4.5 yaitu 2.7 eV. Besarnya nilai bandgap dipengaruhi oleh grand size. Menutut Yen huan12 bandgap meningkat seiring dengan menurunya grand size. Avila11 dengan metode spin on sol gel mendapatkan α-Fe2O3 dengan bandgap
sebesar 2.2 eV pada suhu 400 oC dengan grand size 31 nm. Yen hua12 dengan metode magneton sputtering depotition memperoleh nilai energy bandgap 2.77 eV dengan grand size 17 nm. Perbedaan nilai bandgap dan grand size dipengaruhi oleh metode pembuatan α-Fe2O3 yang berbeda.
Gambar 4.3 Hubungan Absorbansi dan panjang gelombang α-Fe2O3 5 jam
Gambar 4.4 Hubungan Reflektansi dan panjang gelombang α-Fe2O3 5 jam
0 0.5 1 1.5 2 2.5
400 500 600 700 800 900 1000
A b sor b an si
Panjang Gelombang (nm)
0 20 40 60 80 100
400 500 600 700 800 900 1000
R e fl e kt an si
Gambar 4.5 Bandgap α-Fe2O3 reflektansi
Hasil PSA
Dari hasil karakterisasi PSA diperoleh langsung ukuran partikel α-Fe2O3
denan ukuran 202.64 nm. Ukuran ini merupakan hasil kesimpulan dari perhitungan instrument dengan Pade-Laplace method, Statistical method, dan Cumulants method dengan parameter kurva Intensitas, volume, dan jumlah terhadap ukuran. Ukuran partikel berbeda dengan ukuran kristal, dimana ukuran partikel adalah gabungan dari beberapa kristal yang membentuk suatu kesatuan.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa, sintesis α-Fe2O3
menggunakan metode solgel telah berhasil dibuat. Pemberian lapisan SiO2 dari
hidrolisis TEOS memberikan perlindungan α-Fe2O3 dari oksidasi lebih lanjut.
Suhu annealing 750 oC selama 5 jam telah membentuk serbuk α-Fe2O3
dengan nilai bandgap 2.74 eV yang menunjukkan bahwa sampel masih tergolong bahan semikonduktor dan dapat diaplikasikan sebagai bahan fotokatalis yang berbentuk serbuk dengan penyerapan cahaya dengan baik kurang dari 480 nm.
Suhu annealing yang tinggi telah memunculkan puncak -Fe2O3 yang
menyebabkan kristalitas α-Fe2O3 hanya sebesar 44 % dengan ukuran kristal
12
20.69125 nm. Struktur kristal α-Fe2O3 yang telah disesuaikan dengan data JCPDS
menunjukkan struktur rhombohedral dengan parameter kisi yang mendekati data JCPDS (a=5.035, c=13.74), selain itu puncak -Fe2O3 memiliki struktur
heksagonal.
Ukuran partikel yang diperoleh dari penelitian ini masih tergolong besar yaitu 202.64 nm. Ukuran ini adalah hasil dari perhitungan antara alat dan program PSA.
Saran
Pada penelitian selanjutnya diharapkan suhu annealing tidak melebihi 750 oC untuk memperoleh ukuran kristal yang optimal. Proses milling bisa di terapkan untuk memperkecil ukuran partikel sebelum dilakukan proses pelapisan dengan TEOS. Ukuran kristal 20.69125 nm dan penyerapan cahaya dengan baik kurang dari 480 nm dapat diaplikasikan sebagai bahan fotokatalis.
DAFTAR PUSTAKA
1. Hasanzadeh J, Kalandaragh Y, Khodayari A. Preparation of α-Fe2O3
nanostructure via sample ultrasound-assisted method. Journal of optoelectronics and advanced material, 2012; 14, 473-477.
2. Yuang Ming-liang. et al. Preparation and characterization of Fe/SiO2
core/shell nanocomposites. Trans, Nonferrous Met. Soc, 2009;20, 632-636. 3. Rio F, Jamarun N, Arief S. Sintesis, Pelapisan dan Stabilitas Senyawa
Oksida Besi Oleh Silika Dan Aplikasinya Untuk Amobilitas Protein. 2012; PPs-Unand.
4. Dawy M, Safaa K, Aziz. Synthesis, Characterization and Electrical
Properties of α-Fe2O3 Nanoparticle. Journal of Basic and Applied Sciences,
2012;6(4), 55-62.
5. Mammah S L et al. Annealing Effect on the Solid State and Optical
Properties of of α-Fe2O3 Thin Films Deposited Using the Aqueius
Chemical Growth Method. Material Sciences and Aplication, 2012; 3, 793-801.
6. Shinde, S. S. et al. Physics Properties of Hematite of α-Fe2O3 thin films:
application to photoelectrochemical solar cells. Journal of Semiconductors, 2011; 32, 1.
7. Chirita M, Grozescu. Fe2O3 – Nanoparticle, Physical Properties and Their
Photochemical and Photoelectrochemical Applications. Bull. Chem, 2009; 54, 68.
9. Flavio L. et al. The Influence of the Film Thickness of Nanostructured α -Fe2O3 on Water Photooxidation. Physical Chemistry Chemical Physic.,
2009;11, 1215-1219.
10. Qurashi A, Zhong Z, Wakas A. Synthesis and Photocatcalytic Properties of
α-Fe2O3 Nanoellipsoids. Solid State Sciences, 2010; 12, 1516-1519.
11. Avila G. et al. α-Fe2O3 Films Grown by the Spin-on Sol-gel Deposition
Method. Rev. Mex. Fis, 2003;49(3), 219-233.
12. Yen-Huan C, Kuo-Jui T. Thickness Dependent on Photocatalytic Activity of Hematite Thin Films. International Journal of Photoenergy. 2012(980595). 13. Yashita M. 2011. Analisis Stuktur Kristalin Hematite yang Disubstitusi Ion
Manganes dan Ion Titanium. [skripsi]. Semarang: Departemen Fisika, Universitas Diponegoro.
14. Jun P, Sobahan K.MA., Kwon H. Optical and Structural Properties of α -Fe2O3 Thin Films Prepared by Ion-beam Assisted Deposition. Surface and
Coating Technology, 2009; 203, 2646-2650.
15. Wenting D. et al. Preparation of α-Fe2O3 Nanoparticles by Sol-gel Process
With Inorganic Iron Salt. Chemistry Letters. 2000(000034).
16. Wardiyati S, Yusuf S, Handayani A. Sintesis Nano Partikel Oksida Besi dengan Metode Emulsi Menggunakan Surfaktan Cetyl Trimethyl Ammonium Bromide. Jurnal Sains Material Indonesia, 2007; 10, 151-155. 17. Grace. et al. Sintesis -Fe2O3/ Fe3O4 dari Mill Scale Pabrik Baja dengan
Metode Presipitasi. Jurnal Sains Material Indonesia, 2005; 7, 47-51.
18. Grace. et al. Variasi Komposisi Fe(II)/Fe(III) Pada Proses Sintesis Spion dengan Metode Presipitasi. Jurnal Sains Material Indonesia, 2006; 8, 31-34.
19. Yang-su H, Seon-Mi, Dong-Kuk. Synthesis of Monodispresed and Spherical SiO2-coated Fe2O3 Nanoparticle. Bull. Korean Chem. So., 2000; 21,
1193-1197.
20. Bruce D, Hancock, P. Note on the Temperature Stability of Wüstite in Surface Oxide Films on iron. British Corrosion Journal, 1969; 4(4), 221-222.
21. Yuli A. Pembuatan dan Karakterisasi Film LiTaO3 Terhadap Variasi Suhu
dan Waktu Annealing. 2012. [Skripsi]. Bogor: Departemen Fisika, Institut Pertanian Bogor.
14
Lampiran 1. Hasil Perhitungan paramaeter kisi
α
-Fe
2O
3peak
no h k l 2Ѳ Ѳ α α² Γ ² α sin²2Ѳ sin²Ѳ ² α αsin²Ѳ sin²Ѳ sin²Ѳ
1 0 1 2 24.192 12.096 1 1 4 16 4 0.1678 0.0439 1.6777 2.8148 6.7109 1.6777 0.0439 0.1755 0.0736 2 1 0 4 33.192 16.596 1 1 16 256 16 0.2994 0.0815 2.9943 8.9657 47.9086 2.9943 0.0815 1.3040 0.2440 3 1 1 0 35.622 17.811 3 9 0 0 0 0.3389 0.0935 3.3893 11.4875 0.0000 10.1680 0.2804 0.0000 0.3168 4 1 1 3 40.878 20.439 3 9 9 81 27 0.4279 0.1218 4.2795 18.3139 38.5153 12.8384 0.3655 1.0965 0.5214
5 0 2 4 49.500 24.750 4 16 16 256 64 0.5778 0.1751 5.7778 33.3835 92.4455 23.1114 0.7004 2.8018 1.0118 6 1 1 6 54.198 27.099 3 9 36 1296 108 0.6573 0.2073 6.5734 43.2091 236.6411 19.7201 0.6219 7.4633 1.3627 7 0 1 8 57.384 28.692 1 1 64 4096 64 0.7090 0.2303 7.0901 50.2697 453.7673 7.0901 0.2303 14.7381 1.6327 8 2 1 4 62.622 31.311 7 49 16 256 112 0.7881 0.2698 7.8808 62.1066 126.0923 55.1654 1.8888 4.3172 2.1264 9 3 0 0 63.936 31.968 9 81 0 0 0 0.8065 0.2801 8.0650 65.0447 0.0000 72.5853 2.5205 0.0000 2.2587
10 1 0 10 72.000 36.000 1 1 100 10000 100 0.9041 0.3452 9.0413 81.7458 904.1337 9.0413 0.3452 34.5189 3.1210 11 3 0 6 78.192 39.096 9 81 36 1296 324 0.9578 0.3973 9.5785 91.7473 344.8252 86.2063 3.5761 14.3044 3.8060
Σ 258 17553 819 469.0885 2251.0399 300.5983 10.6545 80.7195 16.4751
Lampiran 2
Perhitungan parameter kisi α
-Fe
2O
3Mencari parameter kisi rhombohedral untuk puncak banyak Jarak antar bidang, d
(1)
Menurut Bragg:
(2)
Penggabungan persamaan (1) dan (2) menghasilkan:
atau
Untuk memperoleh nilai parameter kisi menggunakan hubungan,
akan diperoleh bentuk
Keterangan:
Nilai C, B, dan A dapat diperoleh dari 3 persamaan :
16
[1] Nilai parameter kisi α-Fe2O3
10.6545 = 258.0000 C + 819.0000 B + 300.5983 A 80.7195 = 819.0000 C + 17553.0000 B + 2251.0399 A 16.4751 = 300.5983 C + 2251.0399 B + 469.0885 A
Menjadi bentuk matriks A x = B
[
] [ ] [
]
Mencari determinan matriks A
| | |
|
Mencari determinan matriks A1
| | |
|
Mencari determinan matriks A2
| | |
|
Nilai C diperoleh dari
| | | |
Nilai B diperoleh dari
| | | |
Nilai parameter kisi a
√ √ Nilai parameter kisi c
Lampiran 3
Perhitungan parameter kisi
-Fe
2O
3Mencari parameter kisi heksagonal untuk 2 puncak Jarak antar bidang, d
(3)
Menurut Bragg:
(4)
Penggabungan persamaan (3) dan (4) menghasilkan:
atau
Untuk memperoleh nilai parameter kisi menggunakan hubungan,
Untuk hkl (1 0 5) βθ=β1.76β
akan diperoleh bentuk
( )
(5)
Untuk hkl (2 2 6) βθ=65.07
akan diperoleh bentuk
18
(6)
Eliminasi persamaan (5) dan (6)
Nilai parameter kisi a
Nilai parameter kisi c Subsitusi a ke persamaan 1
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, tanggal 02 Maret 1991 dari pasangan Nono Priyatno dan Suwartiningsih. Penulis merupakan anak pertama dari dua bersaudara. Penulis menyelesaikan masa studi di SDN 1 Cilangkap selama enam tahun, kemudian melanjutkan studi di SMPN 2 Cibinong selama tiga tahun, dan melanjutkan studi di SMAN 1 Cibinong selama tiga tahun. Penulis kemudian melanjutkan pendidikan program sarjana strata satu di Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB.