INHIBISI HISTON ASETILTRANSFERASE OLEH
KUERSETIN SEBAGAI KANDIDAT ANTIKANKER SECARA
In Silico DAN In Vitro
RABIATUL ADAWIYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Inhibisi Histon Asetiltransferase oleh Kuersetin sebagai Kandidat Antikanker secara In Silico dan In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RABIATUL ADAWIYAH. Inhibisi Histon Asetiltransferase oleh Kuersetin sebagai Kandidat Antikanker secara In Silico dan In Vitro. Dibimbing oleh SURYANI dan I MADE ARTIKA.
Histon asetiltranferase p300-CBP-associated factor (HAT PCAF) mengkatalisis transfer asetil dari asetil KoA ke residu lisin pada histon. Asetilasi histon berperan penting dalam aktivasi transkripsi DNA. Kesalahan pada enzim ini, seperti hiperasetilasi, dapat menyebabkan peningkatan proliferasi sel yang menyebabkan perkembangan sel kanker. Jenis HAT yang paling banyak terdapat pada manusia adalah HAT p300 dan PCAF. Kuersetin menunjukkan potensi penghambatan terhadap HAT p300 pada penelitian sebelumnya, namun pengaruhnya terhadap HAT PCAF belum dilakukan. Oleh karena itu, penelitian ini menggunakan kuersetin untuk menghambat aktivitas HAT PCAF.
Penelitian ini menggunakan teknik in silico dan in vitro untuk menguji potensi kuersetin sebagai inhibitor HAT PCAF. Uji in silico menggunakan penambatan molekuler untuk mendapatkan informasi mengenai model pengikatan kuersetin pada HAT PCAF. Selain itu, studi kinetika juga menghasilkan nilai konstanta inhibisi (Ki) kuersetin dan jenis inhibisinya. Penelitian kinetika inhibisi menggunakan metode fluorometri untuk mengukur inhibisi HAT PCAF oleh kuersetin.
Hasil penambatan molekuler menunjukkan bahwa kuersetin dapat terikat pada situs pengikatan asetil KoA sehingga dapat menghambat aktivitas asetilasi histon oleh HAT PCAF. Kuersetin berinteraksi dengan asam amino Gln525 dan Cys574 pada rantai A, serta Cys574 and Gln581 pada rantai B HAT PCAF. Kuersetin juga terikat pada situs aktif histon melalui Asp610. Hasil uji kinetika inhibisi HAT PCAF menunjukkan bahwa kuersetin dapat menghambat reaksi asetilasi histon yang diamati dari intensitas fluoresens yang rendah. Analisis dengan plot Dixon menunjukkan bahwa kuersetin dapat berkompetisi dengan histon sehingga memiliki jenis inhibisi kompetitif, dengan nilai konstanta inhibisi (Ki) sebesar 9.575 µM. Hasil uji kinetika inhibisi menunjukkan kesesuaian dengan hasil penambatan molekuler, yaitu kuersetin memiliki kemampuan sebagai inhibitor kompetitif bagi HAT PCAF.
SUMMARY
RABIATUL ADAWIYAH. Histone Acetyltransferase Inhibition by Quersetin as Anti Cancer Candidate In Silico and In Vitro Approach. Supervised by SURYANI and I MADE ARTIKA.
Histone acetyltransferase p300-CBP association factor (HAT PCAF) catalyses acetyl transfer from acetyl CoA to lysine residue on histone. Histone acetylation plays a crucial role in DNA transcription activation. Dysfunction of this enzyme, such as hyperacetylation, could increase cell proliferation that causes progression of cancer cell. The types of HAT found in human are p300 and PCAF. Quercetin showed inhibition potency towards HAT p300 on the previous study, but its effects towards HAT PCAF is still unknown. Therefore, this study used quercetin to inhibit HAT PCAF activity.
This study used in silico and in vitro technique to test quercetin potency as HAT PCAF inhibitor. In silico approachused molecular docking study to provide information on molecular binding model of quercetin to HAT PCAF. In addition, kinetic study was also conducted to provide information about inhibition constant (Ki) of quercetin. Kinetic study used fluorometric method to measure HAT PCAF inhibition by quercetin.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
INHIBISI HISTON ASETILTRANSFERASE OLEH
KUERSETIN SEBAGAI KANDIDAT ANTIKANKER SECARA
In Silico DAN In Vitro
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT. yang telah melimpahkan berkah, rahmat, dan ridho-Nya sehingga penulis dapat menyelesaikan karya ilmiah pada program Magister Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Shalawat serta salam selalu tercurahkan kepada Nabi Muhammad SAW, keluarga, dan para sahabat. Penelitian
yang dilakukan berjudul “Inhibisi Histon Asetiltransferase oleh Kuersetin sebagai Kandidat Antikanker secara In Silico dan In Vitro”. Penelitian ini dilakukan dari bulan Februari hingga April 2015 di Laboratorium Penelitian, Departemen Biokimia, dan Laboratorium Spektroskopi, Departemen Fisika, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan dukungan selama proses penulisan tesis ini. Ucapan terima kasih penulis sampaikan terutama kepada Ibu Dr. Suryani, M.Sc selaku pembimbing utama dan Dr. Ir. I Made Artika, M. App. Sc selaku pembimbing kedua yang telah memberikan saran, kritik, dan bimbingannya.
Penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan dukungan selama proses penulisan karya ilimiah ini, yaitu Nenek Siti Sanariah tercinta, Ayahanda Alimuddin Paada dan Ibunda Elfira Abubakar, serta Kakak Nona, Kakak Ayu, dan Adik Adit atas segala doa yang telah diberikan kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Arta rekan kerja saya selama penelitian, Tika, Mumo, Sendhy yang selalu memberikan dukungan di masa sulit penulis, serta Shelly, Eka, Via, dan Lia yang selalu membantu penulis.
Penulis berharap tesis ini dapat bermanfaat bagi berbagai pihak dan ilmu pengetahuan, khususnya ilmu Biokimia.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE 2
Bahan 2
Alat 3
Prosedur Analisis Data 3
Preparasi Struktur Kuersetin 3
Preparasi Struktur HAT p300/CBP-associated factor (PCAF) 4 Simulasi Interaksi antara Histon Asetiltransferase dan Kuersetin 4
Pembuatan Kurva Standar 4
Uji Kinetika Inhibisi Histon Asetiltransferase 4 Analisis Kinetika Inhibisi Histon Asetiltransferase 5
3 HASIL 5
Karakteristik Kuersetin 5
Energi Bebas Gibbs (G) HAT PCAF dengan Kuersetin 6 Interaksi Nonkovalen Kuersetin dengan HAT PCAF 6
Kinetika Inhibisi Histon Asetiltransferase 8
4 PEMBAHASAN 9
Karakteristik Kuersetin 9
Energi Bebas Gibbs (G) HAT PCAF dengan Kuersetin 11 Interaksi Nonkovalen Kuersetin dengan HAT PCAF 12
Kinetika Inhibisi Histon Asetiltransferase 14
5 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Karakteristik kuersetin 5
2 Interaksi antara kuersetin dan HAT PCAF dengan radius <5 Å 7
3 Nilai Ki inhibitor HAT PCAF 8
DAFTAR GAMBAR
1 Struktur kuersetin 3
2 Struktur HAT PCAF 1CM0 4
3 Energi bebas Gibbs (G) hasil penambatan HAT PCAF terhadap KoA
dan kuersetin 6
4 Interaksi rantai A HAT PCAF dengan kuersetin 7
5 Interaksi rantai B HAT PCAF dengan kuersetin 8
6 Plot Dixon 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 19
2 Komposisi kurva standar KoA 20
3 Kurva standard KoA 20
4 Kinetika inhibisi S1 H3 10 µM 20
5 Kinetika inhibisi S2 H3 15 µM 21
6 Nilai ΔG rantai A PCAF dan kuersetin 21
7 Nilai ΔG rantai B PCAF dan kuersetin 21
1
PENDAHULUAN
Latar Belakang
Asetilasi histon merupakan salah satu modifikasi epigenetik, dan pengaruhnya sangat penting untuk perkembangan dan diferensiasi, serta proses seluler suatu organisme (Eccleston et al. 2007). Reaksi asetilasi histon dikatalisis oleh histon asetiltransferase (HAT) dengan memindahkan gugus asetil dari asetil-KoA ke gugus-amino lisin pada histon sehingga struktur kromatin menjadi berelaksasi yang menyebabkan terjadinya penggabungan faktor transkripsi dan aktivasi transkripsi DNA, serta mempengaruhi tingkat ekspresi gen (Arrowsmith et al. 2012; Balasubramanyam 2004; Dekker &Haisma 2009), selain itu juga mempengaruhi informasi epigenetik yang lain, seperti mitosis dan meiosis, diferensiasi sel, dan replikasi DNA (Laura et al. 2008). Kesalahan yang terjadi pada modifikasi ini sangat rentan sebagai salah satu penyebab terjadinya kanker, inflamasi, maupun infeksi virus (Dekker & Haisma 2009). Reaksi asetilasi dikatalisis oleh HAT. Enzim ini memiliki jenis yang beragam, namun yang terdapat pada manusia adalah p300 dan CREB-binding protein (CBP) (p300/CBP) dan p300/CBP-associated factor (PCAF) (Marmorstein 2001; Balasubramanyam 2004). Substrat dari HAT dapat berupa histon maupun nonhiston, seperti p53 dan nuclear factor-kappa beta (NF-B) (Poux & Marmorstein 2003). Hiperasetilasi histon dapat menyebabkan terjadinya peningkatan proliferasi sel. Asetilasi PCAF terhadap p53 menyebabkan tumor supresor ini menjadi tidak aktif yang mengakibatkan p53 tidak dapat berfungsi dalam perbaikan DNA, dan menghambat terjadinya apoptosis (Ott & Verdin 2010). Asetilasi histon yang tinggi menghambat supresor tumor dan meningkatkan proliferasi sel ini menjadi manifestasi terjadinya kanker karena sel berproliferasi tanpa adanya penekan dari supresor tumor. HAT sebagai koaktivator mempunyai peranan yang sangat penting dalam regulasi transkripsi melalui pengikatan faktor transkripsi sehingga adanya gangguan pada enzim ini dapat mengakibatkan beberapa penyakit, mulai dari kanker sampai neurodegeneratif. Oleh karena itu, HAT PCAF dapat digunakan sebagai target antikanker.
Pengembangan obat epigenetik sangat pesat, dan ditujukan sebagai alternatif terapi kanker. Obat epigenetik yang telah diterima oleh Food and Drug Administration (FDA), yaitu Dacogen dan Vidaza untuk penghambatan metilasi DNA, dan Vorinostat dan Romidepsin sebagai inhibitor histon deasetiltransferase (HDAC) (Campbell & Tummino 2014), sedangkan inhibitor histon asetiltransferase yang berperan dalam asetilasi histon masih dalam tahap pra klinis (Manzo et al. 2009). Inhibitor HAT yang dikembangkan baik produk alami maupun sintetik, seperti kurkumin, garcinol, isotiazolon, asam anakardat, C646, H3-CoA-20, dan Lys-20. Masalah yang sama dihadapi dalam pengembangan inhibitor ini, yaitu permeabilitas sel ataupun spesifisitas yang rendah (Dekker & Haisma 2009; Lau et al. 2000; Balasubramanyam 2004; Ghizzoni et al. 2011). Oleh karena itu, pengembangan inhibitor kecil dengan permeabilitas sel dan spesifisitas yang tinggi terhadap HAT PCAF perlu dilakukan lagi.
2
dan nuclear factor B (NF- B) yang diinduksi lipopolisakarida (Comalada et al. 2005). Ruiz et al. (2007) menunjukkan bahwa kuersetin menghambat pengerahan faktor transkripsi NF- B (yang diinduksi oleh TNF-α) ke promotor gen inflamasi pada alur sel epitel usus halus murine. Xiao et al. (2011) melaporkan bahwa kuersetin dapat menghambat HAT p300 pada kanker payudara.
Perumusan Masalah
Penelitian terkait potensi kuersetin sebagai inhibitor HAT p300 telah dilakukan menggunakan alur sel kanker payudara, namun penelitian mengenai potensi kuersetin terhadap HAT PCAF belum dilakukan. Model interaksi kuersetin dengan HAT PCAF, serta kinetika inhibisinya juga belum diketahui.
Tujuan Penelitian
Penelitian ini bertujuan menguji potensi kuersetin sebagai inhibitor HAT PCAF baik secara in silico maupun in vitro. Teknik penambatan molekuler digunakan untuk memprediksi model interaksi antara kuersetin dengan HAT PCAF secara in silico. Uji potensi kuersetin secara in vitro menggunakan uji kinetika inhibisi yang akan memberikan informasi mengenai jenis inhibisi dan nilai konstanta inhibisi yang juga merupakan parameter yang perlu diperhatikan untuk menentukan potensi kuersetin dalam menghambat aktivitas HAT PCAF.
Manfaat Penelitian
Informasi mengenai kinetika inhibisi kuersetin terhadap HAT dapat digunakan sebagai acuan untuk uji in vitro dalam pengembangan kuersetin sebagai obat antikanker, serta informasi mengenai jenis inhibisinya dapat menentukan kemampuan kuersetin untuk dijadikan sebagai obat antikanker.
Ruang Lingkup Penelitian
Penelitian ini mencakup prediksi model pengikatan kuersetin terhadap HAT PCAF dan afinitas pengikatannya secara in silico, serta uji kinetika inhibisi kuersetin terhadap HAT PCAF secara in vitro.
2
METODE
Bahan
3
1CM0) yang diperoleh dari http://www.rscb.org/pdb. Uji inhibisi kinetika menggunakan enzim HAT (PCAF) human recombinant dengan pemurnian 95% melalui SDS-PAGE yang diekspresikan pada Escherichia coli, kuersetin dengan pemurnian 95% melalui HPLC, peptida Histon3 (H3) Sigma dengan pemurnian 90%, asetil KoA dengan kemurnian 93% melalui HPLC, CPM diperoleh dari Sigma, dan Koenzim A. Bahan-bahan tersebut diperoleh dari Sigma-Aldrich, sedangkan Bufer HAT (5x) yang digunakan terdiri atas bufer HEPES, dan Triton-X. Selain itu juga digunakan ultrapure water yang diperoleh dari Caymandan dimetil sulfoksida (DMSO) sebagai pelarut, dan isopropanol untuk menghentikan reaksi.
Alat
Alat-alat yang digunakan pada uji in silico adalah komputer dan perangkat lunak. Komputer yang digunakan memiliki Random Access Memory (RAM) 4 gigabyte, Intel® Core ™ i5, Graphic card NVIDIA Ge Force 840M, dan sistem operasi Windows 8.1. Perangkat lunak yang digunakan, yaitu Marvin Sketch, Discovery Studio 3.5 Client, AutoDock Tools 1.5.6, AutoDock Vina, dan Ligplot+ 1.5.4. Sedangkan alat-alat yang digunakan pada uji kinetika inhibisi enzim adalah Fluoremeter FluoStar Omega, lemari pendingin, pipet mikro, pipet tetes, microplate CoStar 96, dan timbangan digital.
Prosedur Analisis Data
Preparasi Struktur Kuersetin (Modifikasi Singh et al. 2012)
Kuersetin sebagai inhibitor HAT PCAF dibuat strukturnya dengan Marvinsketch 6.0 (Gambar 1). Kemampuan bioavabilitasnya dianalisis dengan parameter berdasarkan aturan Lipinski.
4
Gambar 2 Struktur HAT PCAF 1CM0 (Clement et al. 1999)
Preparasi Struktur HAT p300/CBP-associated factor (PCAF) (Modifikasi Singh et al. 2012)
Struktur PCAF yang digunakan diperoleh dari Protein Data Bank (PDB) dengan kode PDB: 1CM0 (Gambar 2) yang diakses dari situs www.rscb.org/pdb. Struktur HAT PCAF ini terdiri atas dua rantai (A dan B), dan berikatan dengan koenzim A (KoA). Simulasi interaksi PCAF dengan kuersetin dilakukan pada kedua rantai HAT PCAF dengan dan tanpa koenzim A.
Simulasi Interaksi antara Histon Asetiltransferase dan Kuersetin (Modifikasi Singh et al. 2012)
Simulasi interaksi antara HAT PCAF dan kuersetin dilakukan dengan mempersiapkan struktur enzim HAT PCAF (kode PDB: 1CM0), dan kuersetin. Simulasi ini menggunakan AutoDock Vina. Hasil penambatan dinilai berdasarkan
ΔG dan diperoleh nilai terbaik (ΔG paling negatif). Interaksi berupa ikatan hidrogen,
interaksi hidrofobik, dan jarak ikatan dari hasil docking AutoVina divisualisasikan dengan menggunakan LigPLot+ 1.5.4.
Pembuatan Kurva Standar (Modifikasi Lau et al. 2000)
Larutan standar KoA dibuat dengan berbagai konsentrasi, yaitu 0, 200, 400, 600, 800, 1000, dan 1200 pmol KoA yang dilarutkan dalam bufer HAT, dan
direaksikan dengan 50 M CPM. Intensitas fluoresens (relative fluorescence unit - RFU) diukur dengan FluoroStar Omega pada panjang gelombang Eksitasi 392 nm dan emisi 482 nm. RFU (y) dan konsentrasi KoA (x) dihubungkan dalam kurva standar, dan dicari persamaan garis linearnya. Persamaan tersebut digunakan untuk menghitung konsentrasi produk yang terbentuk.
Uji Kinetika Inhibisi Histon Asetiltransferase (Modifikasi Lau et al. 2000)
Komponen pereaksi untuk uji inhibisi HAT, terdiri atas Histon 3 dengan
konsentrasi 10 dan 15 M, asetil KoA 2 M, kuersetin dengan konsentrasi 0 (blanko), 10, 20, 30, 40, dan 50 M, PCAF 5 nM, dan bufer HAT. Reaksi
5
berlangsung pada suhu 30C, selama 10 menit. Reaksi dihentikan dengan
penambahan isopropanol sebanyak 10 L dan CPM 50 M, kemudian diinkubasi
lagi selama 10 menit dalam keadaan gelap. Volume total reaksi ini adalah 100 L.
Intensitas fluoresens (RFU) diukur pada panjang gelombang eksitasi dan emisi sebesar 392 nm dan 482 nm, secara berturut dengan Fluostar Omega. Uji inhibisi ini dilakukan sebanyak dua kali pengulangan.
Analisis Kinetika Inhibisi Histon Asetiltransferase (Balasubramanyam et al. 2004; Lau et al. 2000)
Konsentrasi produk akhir reaksi enzimatis HAT dihitung dari intensitas emisi fluoresens yang terukur, dan dimasukkan ke dalam persamaan linier yang diperoleh dari kurva standar. Intensitas fluoresens yang tinggi mengindikasikan tingginya aktivitas HAT, sedangkan intensitas yang rendah mengindikasikan aktivitas HAT yang rendah karena inhibisi oleh kuersetin.
Plot Dixon digunakan untuk analisis inhibisi HAT. Data yang diperoleh dari hasil pengukuran emisi fluoresens dimasukkan ke dalam plot dengan konsentrasi kuersetin [I] sebagai sumbu x (variasi kuersetin) dan 1/V sebagai sumbu y.
3
HASIL
Karakteristik Kuersetin
Karakteristik kuersetin perlu dianalisis terlebih dahulu sebelum digunakan dalam penambatan dengan protein target. Hal ini terkait dengan bioavailibitasnya sebagai obat. Karakteristik ini dapat dianalisis menggunakan aturan Lipinski. Aturan Lipinski terdiri atas empat karakter yang masing-masing memiliki batasan nilai, yakni 1) berat molekul yang tidak lebih besar dari 500 Da; 2) koefisien partisi oktanol – hidrogen yang dinyatakan dalam log P dengan nilai yang tidak lebih dari 5; 3) jumlah donor ikatan hidrogen tidak lebih dari 5; dan 4) jumlah akseptor ikatan hidrogen tidak lebih dari 10. Karakteristik kuersetin telah memenuhi batasan nilai dari aturan Lipinski tersebut. Karakteristik kuersetin dapat dilihat pada Tabel 1. Tabel 1 Karakteristik kuersetin
Karakteristik Kuersetin
Berat molekul (< 500 Da) 316 Da
6
Energi Bebas Gibbs (G) HAT PCAF dengan Kuersetin
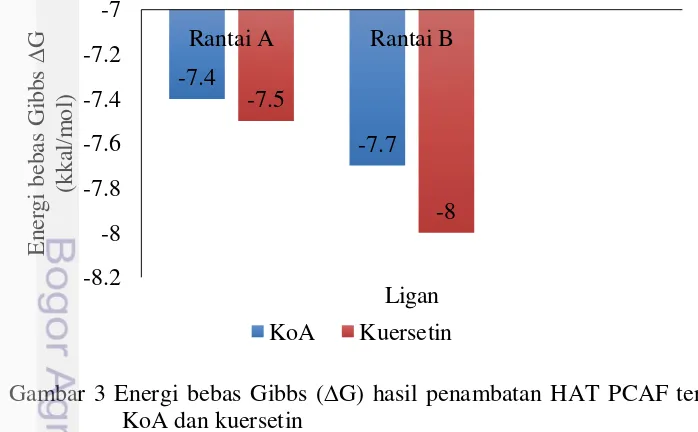
Penambatan molekuler antara HAT PCAF dengan kuersetin menggunakan AutoDock Vina memberikan beberapa informasi. Informasi tersebut meliputi beberapa mode pengikatan kuersetin pada HAT PCAF, nilai energi bebas Gibbs (G), dan root mean square deviation (RMSD). Mode pengikatan terbaik dipilih berdasarkan nilai energi bebas Gibbs (G) yang paling negatif. Nilai pengikatan kuersetin pada rantai A HAT PCAF sebesar -7.5 kcal/mol, sedangkan pada rantai B HAT PCAF sebesar -8.0 kcal/mol. Nilai ini lebih negatif dibandingkan ligan alami HAT PCAF, yaitu KoA (Gambar 3). Hasil ini memprediksikan bahwa reaksi pengikatan kuersetin terhadap HAT PCAF dapat terjadi secara spontan dengan energi pengikatan yang lebih kuat jika dibandingkan dengan ligan alami HAT PCAF, yakni asetil KoA.
Interaksi Nonkovalen Kuersetin dengan HAT PCAF
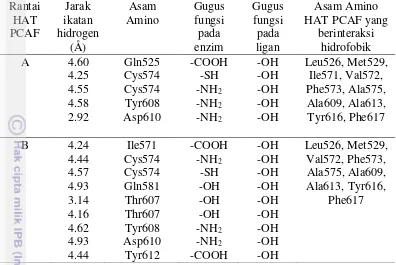
Visualisasi penambatan HAT PCAF dan kuersetin oleh Ligplot+ menunjukkan interaksi molekuler yang terjadi antara residu asam amino HAT PCAF dengan kuersetin. Interaksi molekuler yang terjadi antara kuersetin dengan rantai A HAT PCAF ditunjukkan pada Gambar 4. Residu asam amino yang membentuk ikatan hidrogen dengan kuersetin pada rantai A adalah Gln525, Cys574, Tyr608, dan Asp610. Ikatan ini distabilkan oleh interaksi hidrofobik. Asam amino lain yang terlibat dapat dilihat pada Tabel 2.
Residu asam amino yang terlibat dalam interaksi KoA dan rantai A HAT PCAF, seperti Ala575, Ala613, Tyr616, dan Phe617 juga terlibat dalam interaksi hidrofobik antara kuersetin dan rantai A HAT PCAF. Situs pengikatan histon pada rantai A HAT PCAF, seperti Ile571 dan Val572 juga berinteraksi hidrofobik dengan kuersetin. Interaksi kuersetin dengan rantai B HAT PCAF juga menunjukkan hasil yang serupa, yakni asam amino yang terlibat dalam pengikatan KoA dan histon pada rantai B HAT PCAF juga terlibat dalam interaksi hidrofobik antara kuersetin
7
Tabel 2 Interaksi antara kuersetin dan HAT PCAF dengan radius <5 Å Rantai
dan rantai B HAT PCAF. Hasil ini juga mengindikasikan bahwa kuersetin memiliki kemampuan untuk berkompetisi baik dengan KoA maupun histon dalam berinteraksi dengan residu-residu asam amino tersebut.
Gambar 4 Interaksi rantai A HAT PCAF dengan kuersetin a) ikatan hidrogen; b) interaksi hidrofobik. Lingkaran merah menunjukkan asam amino yang terlibat dalam pengikatan KoA, sedangkan lingkaran hijau menunjukkan asam amino yang terlibat dalam pengikatan histon.
8
Ikatan hidrogen yang terjadi antara kuersetin dengan HAT PCAF pada rantai B lebih banyak dibandingkan dengan rantai A. Asam amino yang terlibat pada ikatan ini adalah Ile571, Cys574, Gln581, Thr607, Tyr608, Asp610, dan Tyr612. Interaksi kuersetin dengan rantai B HAT PCAF juga memiliki situs pengikatan yang sama dengan KoA, yaitu Gln581 dan Cys574. Ikatan ini juga distabilkan oleh interaksi hidrofobik, seperti yang terjadi pada rantai A. Asam amino lain yang terlibat juga dapat dilihat pada Tabel 2.
Gambar 5 Interaksi rantai B HAT PCAF dengan kuersetin a) ikatan hidrogen; b) interaksi hidrofobik. Lingkaran merah menunjukkan asam amino yang terlibat dalam pengikatan KoA, sedangkan lingkaran hijau menunjukkan asam amino yang terlibat dalam pengikatan histon.
Kinetika Inhibisi Histon Asetiltransferase
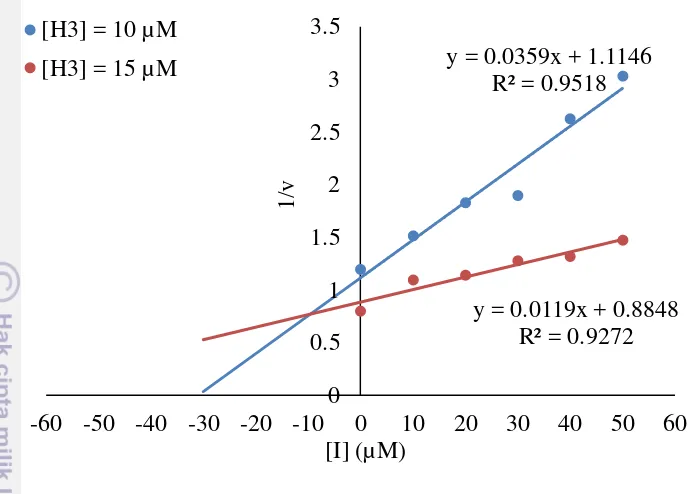
Aktivitas inhibisi HAT oleh kuersetin dianalisis dengan menggunakan plot Dixon. Hasil analisis dengan plot Dixon memberikan informasi mengenai jenis inhibisi enzim HAT oleh kuersetin. Jenis inhibisi dilihat dari perpotongan kedua garis inhibisi linear (Gambar 6). Perpotongan garis di atas sumbu x (konsentrasi inhibitor) menunjukkan bahwa jenis inhibisi enzim ini adalah inhibisi kompetitif (Kakkar et al. 1999). Informasi lain yang didapat dari studi kinetika ini, yakni nilai dari konstanta inhibisi (Ki) Nilai Ki kuersetin dan inhibitor lainnya terhadap HAT PCAF ditunjukkan oleh Tabel 3.
Tabel 3 Nilai Ki inhibitor HAT PCAF
Inhibitor Jenis Inhibisi Ki (µM)
Kuersetin Kompetitif 9.575
Desulfo-KoA* Kompetitif 6.2
H3-20 K14A* Kompetitif 225
H3-KoA-20* Nonkompetitif 0.5
Keterangan: * sumber : Lau et al. (2000)
9
Gambar 6 Plot Dixon dari timbal balik laju pembentukan produk (1/v) sebagai fungsi konsentrasi inhibisi [I]
4
PEMBAHASAN
Karakteristik Kuersetin
10
Lipofilisitas merupakan parameter penting dalam pengembangan obat. Lipofilisitas berdampak pada semua bagian profil farmakokinetik obat oral, seperti kelarutan, absorpsi, permeabilitas seluler, pengikatan ke protein plasma, metabolisme, dan ekskresi akhir (Edwards & Price 2010). Rentang lipofilisitas optimum, beserta berat molekul yang rendah dan luas permukaan polar yang sempit sangat mempengaruhi tingkat absorpsi suatu substansi kimia pada usus melalui difusi pasif. Lipofilisitas berperan penting dalam mengatur aspek kinetika dan dinamika obat (Mannhold et al. 2009). Lipofilisitas merupakan sifat penting suatu obat yang mempengaruhi transpor pasif (cara absorpsi obat yang paling sering terjadi) untuk melewati membran sel. Molekul obat harus cukup lipofilik untuk melewati inti lipid pada membran sel, tetapi tidak terlalu lipofilik agar tidak tetap tertinggal pada inti lipid dan tidak melewati membran sel. Lipofilisitas suatu obat dinyatakan dalam logaritma koefisien partisi (logP) antara 1-oktanol dan air (1-oktanol/air). Koefisien partisi merupakan rasio konsentrasi suatu komponen dalam campuran yang tidak saling bercampur di bawah kondisi setimbang (Lipinski et al. 2001). Nilai koefisien partisi tersebut dapat dijadikan sebagai parameter distribusi suatu komponen kimia pada larutan hidrofilik yang diwakilkan oleh air, dan fosfolipid membran sel diwakilkan oleh oktanol. Suatu komponen kimia yang memiliki nilai koefisien partisi lebih satu bersifat lipofilik, sedangkan kurang sari satu berarti kurang lipofilik atau bersifat hidrofilik. Obat yang bersifat lipofilik dengan koefisien partisi yang tinggi akan terdistribusi pada kompartemen hidrofobik, seperti membran sel, sedangkan obat yang bersifat hidrofilik dengan nilai koefisien partisi yang rendah akan terdistribusi pada kompartemen hidrofilik, seperti serum darah (Kramer 1992). Nilai koefisien kuersetin sebesar 2.16 (<5) menunjukkan bahwa kuersetin bersifat lipofilik, dan memiliki permeabilitas yang cukup tinggi untuk melewati membran sel. Nilai tersebut juga menunjukkan bahwa kuersetin memenuhi aturan Lipinski.
Berat molekuler juga mempengaruhi tingkat penyerapan suatu obat dalam tubuh. Berat molekul yang semakin tinggi berhubungan dengan buruknya permeabilitas melewati usus (Lipinski et al. 2001). Berat molekul kuersetin sebesar 316 Da menunjukkan bahwa kuersetin memenuhi syarat berat molekul aturan Lipinski, yaitu kurang dari 500 Da sehingga kuersetin dianggap cukup mudah untuk diserap oleh tubuh.
11
membalikkan komponen tersebut keluar sel. Jika suatu komponen berdifusi dengan cepat melewati membran, komponen tersebut dapat menembus sampai ke sitosol sebelum ditangkap oleh P-gp. Oleh karena itu, efisiensi efluks transpor P-gp dapat berkurang dengan peningkatan permeabilitas pasif. Komponen dengan jumlah donor dan akseptor ikatan hidrogen yang terlalu banyak dapat berpengaruh pada afinitas pengikatannya yang terlalu tinggi pada membran lipid sehingga kecepatan difusinya menuju sitosol melambat yang mengakibatkan komponen tersebut mudah ditangkap oleh P-gp dan dipompa keluar sel (Desai et al. 2012).
Parameter Lipinski yang lain adalah jumlah donor dan akseptor proton. Jumlah donor dan akseptor ikatan hidrogen yang berlebih dapat mengganggu permeabilitas obat melewati membran bilayer (Lipinski et al. 2001). Jumlah donor dan akseptor ikatan hidrogen kuersetin secara berturut sebesar 5 dan 6 juga memenuhi parameter Lipinski ini. Jumlah donor dan akseptor ikatan hidrogen yang tidak terlalu banyak dan memenuhi aturan Lipinski ini menunjukkan bahwa kuersetin cukup kuat untuk berikatan dengan membran lipid, tetapi tidak terlalu kuat sehingga dapat berdifusi dengan cepat menuju sitosol. Oleh karena itu kuersetin dapat digunakan untuk simulasi interaksi dengan histon asetiltransferase. Kuersetin memenuhi semua aturan Lipinski, oleh karena itu dapat dijadikan sebagai ligan pada penambatan dengan enzim target.
Energi Bebas Gibbs (G) HAT PCAF dengan Kuersetin
Penambatan molekuler atau Docking merupakan metode yang menduga orientasi terbaik dari suatu molekul yang satu terhadap molekul lainnya ketika kedua molekul tersebut saling berikatan satu sama lain secara stabil. Orientasi atau mode ikatan dari beberapa prediksi yang ada dipilih melalui scoring. Salah satu jenis scoring yang digunakan untuk memilih mode pengikatan ligan, yakni berdasarkan energi bebas Gibbs (G).
Aturan kedua dari hukum termodinamika adalah kecenderungan alam terhadap ketidakteraturan dalam alam semesta: total ketidakteraturan alam semesta meningkat terus-menerus. Ketidakteraturan atau keacakan suatu komponen kimia terekspresikan dalam entropi (S). Setiap perubahan dalam sistem terekspresikan dalam S yang biasanya memiliki nilai positif ketika ketidakteraturan meningkat. Entalpi, H, mencerminkan jumlah dan jenis ikatan kimia, dan interaksi nonkovalen yang terbentuk dan terputus (Nelson & Cox 2008). Kontribusi entalpi terhadap energi bebas mencerminkan spesifisitas dan kekuatan interaksi antara kedua molekul yang berinteraksi. Hal ini meliputi ikatan ionik, halogen, ikatan hidrogen, interaksi van der Waals, dan polarisasi gugus fungsi dari molekul yang berinteraksi (MacRaild et al. 2007). Perubahan energi bebas juga ditentukan oleh perubahan entropi, S, yang mencerminkan perubahan ketidakteraturan sistem.
G = H – TS
12
sebaliknya. Kecenderungan reaksi kimia untuk menuju kesetimbangan dapat diekspresikan sebagai perubahan energi bebas, G. Setiap komponen yang terlibat dalam reaksi kimia mengandung sejumlah energi potensi tertentu, berhubungan dengan jenis dan jumlah ikatannya. Produk memiliki energi bebas yang lebih rendah dibandingkan dengan reaktan pada reaksi yang terjadi secara spontan, oleh karena itu terjadi pelepasan energi bebas yang menyebabkan terjadinya reaksi. Reaksi tersebut disebut reaksi eksergonik, penurunan energi bebas dari reaktan ke produk bernilai negatif. Pada proses mekanis, hanya bagian dari energi yang dilepaskan dari reaksi kimia eksergonik yang dapat digunakan untuk terjadinya reaksi kimia (Nelson & Cox 2008).
Energi bebas Gibbs juga berhubungan dengan afinitas ikatan molekul satu dengan lainnya yang dapat dinyatakan dalam rumus (MacRaild et al. 2007):
G = - RT ln Kd
Nilai nilai konstanta pengikatan, Kd, yang tinggi berarti reaksi cenderung ke arah kanan hingga hampir semua reaktan telah dikonversi menjadi produk. Berdasarkan rumus tersebut, dapat dilihat bahwa semakin tinggi nilai Kd maka semakin negatif nilai delta G, oleh karena itu dapat disimpulkan bahwa semakin negatif nilai delta G, maka semakin tinggi afinitas pengikatan suatu molekul terhadap molekul lainnya. Hal ini yang menjadi dasar pemilihan mode pengikatan terbaik dari hasil docking, bahwa semakin negatif nilai delta G, maka mode pengikatan tersebut semakin mungkin terjadi karena afinitas pengikatan ligan terhadap proteinnya semakin kuat.
Simulasi interaksi molekuler antara kuersetin dengan HAT PCAF menggunakan AutoDock Vina memberikan informasi mengenai nilai energi bebas Gibbs (G) dari mode pengikatan antara ligan dan reseptornya, yaitu antara kuersetin dengan HAT PCAF. Nilai G menunjukkan kestabilan konformasi antara kuersetin dan HAT PCAF. Interaksi kuersetin dan HAT PCAF dapat terjadi bila nilai G < 0 yang berarti reaksi pembentukan kompleks terjadi secara spontan (Oliveira et al. 2006), dan juga afinitas pengikatannya lebih tinggi (MacRaild et al. 2007).
Hasil penambatan molekuler kuersetin dengan HAT PCAF ini menghasilkan G yang bernilai negatif, yaitu -7.5 kkal/mol untuk rantai A HAT PCAF, dan -8.0 kkal/mol untuk rantai B HAT PCAF (Gambar 1). Nilai G dari kuersetin ini menunjukkan nilai yang lebih negatif daripada KoA yang merupakan ligan alami dari HAT PCAF. Hal ini menunjukkan bahwa ikatan kuersetin terhadap HAT PCAF lebih stabil dan lebih spontan jika dibandingkan dengan KoA terhadap PCAF.
Interaksi Nonkovalen Kuersetin dengan HAT PCAF
13
hidrogen, sedangkan Gln525, Cys574, Ala575, Val576, Gln581, Gly586, Ala613, Tyr616, dan Phe617 berinteraksi melalui interaksi van der Waals. Situs pengikatan lainnya, yaitu pengikatan terhadap substrat histon. Clement et al. (1999) mengajukan bahwa Glu570 merupakan situs pengikatan residu lisin dari substrat histon, dan distabilkan oleh Asp610. Residu Glu570 dikelilingi oleh beberapa residu hidrofobik, yaitu Phe563, Phe568, Ile571, Val572, Leu606, Ile637, dan Tyr640. Residu ini berperan dalam menciptakan daerah asam untuk membentuk permukaan yang dapat menarik substrat lisin yang bersifat basa sehingga dapat menjadi fasilitas untuk ekstraksi proton dari substrat lisin. Molekul lain yang dapat berinteraksi secara nonkovalen dengan residu asam amino yang terlibat tersebut dapat dijadikan sebagai inhibitor enzim HAT PCAF. Simulasi interaksi antara kuersetin dengan HAT PCAF dianalisis dengan menggunakan LigPlot. Hasil analisis tersebut menunjukkan bahwa kuersetin dapat berinteraksi dengan HAT PCAF melalui ikatan hidrogen dan interaksi hidrofobik.
Mekanisme reaksi asetilasi histon oleh HAT PCAF ini diawali dengan pembentukan kompleks ternary antara PCAF, asetil-KoA, dan histon. Gugus -amino dari Lys14 histon kemudian menyerang karbonil dari asetil-KoA, memindahkan gugus asetil ke peptida akseptor. Pelepasan produk sesuai urutan, dimulai dari histon terasetilasi, dan diikuti oleh KoA (Roth et al. 2001). Oleh karena itu, pengembangan inhibitor HAT PCAF dapat dilakukan berdasarkan mekanisme asetilasinya. Inhibitor dapat menghambat aktivitas HAT PCAF melalui pengikatan baik pada situs aktif asetil-KoA maupun histon. Molekul yang dapat berikatan dengan kedua situs aktif tersebut memiliki potensi sebagai inhibitor HAT PCAF.
14
Ikatan hidrogen antara kuersetin dengan situs pengikatan KoA juga terjadi pada HAT PCAF rantai B, yaitu melalui asam amino Cys574, dan Gln581. Gugus hidroksil dari kuersetin berikatan hidrogen dengan gugus amida (-NH2) Cys574 dan gugus tiol (-SH) Cys574 dengan jarak 4.44 dan 4.57 Å secara berturut, serta berikatan dengan gugus hidroksil (-OH) Gln581. Kuersetin juga berinteraksi dengan situs pengikatan KoA melalui interaksi hidrofobik yang melibatkan asam amino Ala575, Ala613, Tyr616, dan Phe617. Kuersetin pada rantai B juga menunjukkan kemampuannya untuk terikat pada situs pengikatan histon, seperti pada rantai A, yakni berikatan hidrogen dengan Asp610. Ikatan tersebut juga distabilkan oleh interaksi hidrofobik kuersetin dengan asam amino Val572 (Gambar 5). Interaksi molekuler yang terjadi antara kuersetin dengan HAT PCAF ini menunjukkan bahwa kuersetin diduga dapat terikat pada situs pengikatan KoA dan histon. Hal ini menunjukkan bahwa kuersetin dapat berkompetisi dengan asetil KoA dan histon yang merupakan substrat dari HAT PCAF. Pengujian lebih lanjut dibutuhkan untuk melengkapi dugaan ini, yaitu melalui uji kinetika inhibisi kuersetin terhadap HAT PCAF.
Kinetika Inhibisi Histon Asetiltransferase
Studi mengenai kemampuan suatu inhibitor dalam menghambat aktivitas enzim targetnya dapat menggunakan uji kinetika inhibisi. Uji ini dapat memberikan informasi mengenai konstanta inhibisi (Ki) dan jenis inhibisinya. Informasi ini dapat digunakan untuk memahami interaksi inhibitor dengan enzim targetnya dalam pengembangan inhibitor tersebut sebagai obat.
Kinetika inhibisi HAT PCAF oleh kuersetin menunjukkan bahwa kuersetin dapat menghambat aktivitas HAT PCAF berdasarkan pengamatan terhadap fluorosens menggunakan metode fluorometri. Metode ini menggunakan CPM sebagai probe fluorogenik untuk mengukur aktivitas HAT. Pengukuran aktivitas HAT dengan mendeteksi KoA yang terbentuk. Reaksi enzimatis HAT, yakni memindahkan gugus asetil dari asetil KoA ke residu lisin dari histon sehingga menghasilkan histon yang terasetilasi dan KoA. Probe CPM akan berikatan dengan KoA dan dapat berfluoresens (Lampiran 8). Intensitas fluoresens tersebut diukur untuk menghitung konsentrasi produk yang terbentuk dari reaksi enzimatis HAT. Konsentrasi produk ini dapat menurun jika terdapat inhibitor yang dapat berinteraksi dengan situs aktif HAT. Penghambatan aktivitas HAT ini dapat dilihat dari intensitias fluoresensnya yang menurun karena tidak terjadinya pembentukan produk reaksi enzimatis HAT, yaitu histon terasetilasi dan KoA yang menyebabkan KoA tidak dapat berikatan dengan CPM (Gao et al. 2013).
Inhibisi HAT menggunakan kuersetin sebagai inhibitornya menunjukkan bahwa intensitas fluoresens semakin rendah seiring dengan meningkatnya konsentrasi kuersetin (Lampiran 4 dan 5). Kecepatan reaksi HAT dalam mengubah substratnya menjadi produk juga semakin menurun dengan meningkatnya konsentrasi kuersetin. Hal ini mengindikasikan bahwa kuersetin memiliki potensi sebagai inhibitor HAT.
15
KoA sehingga dapat menghambat aktivitas HAT PCAF. Nilai Ki menunjukkan afinitas kuersetin terhadap HAT PCAF, semakin kecil nilai Ki maka semakin tinggi afinitasnya terhadap enzim target, dan sebaliknya. Nilai Ki dapat digunakan sebagai pembanding kuantitatif afinitas dengan komponen inhibitor lain, juga dapat dibandingkan dengan afinitas substrat enzim (Copeland 2013). Nilai Ki kuersetin ini lebih besar jika dibandingkan dengan desulfo-KoA, dan jauh lebih kecil jika dibandingkan dengan H3-20 K14A yang telah dilakukan pada penelitian sebelumnya oleh Lau et al. (2000) (Tabel 3). Perbandingan afinitas kuersetin dan histon dapat dibandingkan berdasarkan nilai Ki kuersetin (9.575 µM) dengan nilai KM histon (10 µM) yang menunjukkan afinitasnya terhadap HAT PCAF (Lau et al. 2000). Berdasarkan perbandingan tersebut dapat dilihat bahwa afinitas kuersetin sedikit lebih tinggi daripada histon sehingga dapat berkompetisi dengan histon dalam interaksinya dengan HAT PCAF.
5
SIMPULAN DAN SARAN
Simpulan
Kuersetin memiliki potensi sebagai inhibitor HAT PCAF yang dibuktikan dari hasil secara in silico maupun in vitro. Model pengikatan kuersetin pada HAT PCAF menggunakan penambatan molekuler. Kuersetin terikat pada situs aktif KoA melalui asam amino Gln525 dan Cys574 pada rantai A, serta Cys574 dan Gln581 pada rantai B HAT PCAF. Kuersetin juga terikat pada situs aktif histon, yakni Asp610, Ile571, dan Val572. Kuersetin dapat berkompetisi baik dengan KoA maupun histon berdasarkan model penambatan molekuler. Afinitas kuersetin terhadap HAT PCAF lebih besar dibandingkan dengan afinitas histon terhadap HAT PCAF. Analisis dengan plot Dixon menunjukkan bahwa kuersetin berkompetisi dengan histon untuk menghambat aktivitas HAT PCAF dengan nilai Ki sebesar 9.575 µM.
Saran
Kuersetin dapat berkompetisi dengan KoA dan histon sehingga berpotensi untuk dikembangkan sebagai obat antikanker. Perlu pengembangan lebih jauh mengenai kuersetin dan turunannya dalam menghambat aktivitas HAT PCAF, terutama pengembangan peran dari gugus hidroksil kuerestin. Penelitian selanjutnya dengan menggunakan sel kanker dan juga secara in vivo perlu dilakukan untuk melihat potensi kuersetin pada tahap pengujian yang lebih tinggi.
DAFTAR PUSTAKA
Arrowsmith CH, Bountra C, Fish PV, Lee K, Schapira M. 2012. Epigenetic protein families: a new frontier for drug discovery. Nature 11: 384 – 400.
16
proteins and histone acetyltransferase-dependent chromatin transcription. J Biol Chem 281: 40292-40301.
Campbell RM, Tummino PJ. 2014. Cancer epigenetics drug discovery and development: the challenge of hittin the mark. J Clin. Investiga. 124: 64 – 69.
Clements A, Rojas J, Trievel RC, Wang L, Berger SL, Marmorstein R. 1999. Crystal structure of the histone acetyltransferase domain of the human PCAF transcriptional regulator bound to coenzyme A. EMBO J 18: 3521 – 3532. Comalada M, Camuesco D, Sierra S, Ballester I, Xaus J, Galvez J, Zarzuelo A.
2005. In vivo quercitrin anti-inflammatory effect involves release of quercetin, which inhibits inflammation through down-regulation of the NF-kappaB pathway. Eur J Immunol. 35:584–92.
Copeland RA. 2013. Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists, Edisi ke-2. New Jersey: John Wiley & Sons, Inc.
Dekker FJ, Haisma HJ. 2009. Histone acetyltransferase as emerging drug target. Drug Discovery Today 00: 1-7.
Desai PV, Raub TJ, Blanco MJ. 2012. How hydrogen bonds impact P-glycoprotein transport and permeability. BMCL 22: 6540-6548.
Eccleston A, DeWitt N, Gunter C, Marte B, Nath D. 2007. Epigenetics. Insight 447: 395.
Edwards MP, Price DA. 2010. Role of physicochemical properties and ligand lipophilicity efficiency in addressing drug safety risks. Annu. Report. Med. Chem 45: 381 – 391.
Gao T, Yang C, Zheng YG. 2013. Comparative study of thiol-sensitive fluorogenic probes for HAT assay. Anal. Bional. Chem. 405: 1361 – 1371.
Ghizzoni M, Boltjes A, de Graaf C, Haisma HJ, Dekker FJ. 2010. Improved inhibition of the histone acetyltransferase PCAF by an anarcidic acid derivative. Bioorg. Med. Chem. 1-9.
Hitchcock SA. 2012. Structural modifications that alter the P-glycoprotein efflux properties of compunds. J Med Chem 55: 4877 – 4895.
Kakkar T, Boxenbaum H, Mayersohn M. 1999. Estimation of ki in a competitive enzyme-inhibition model: comparisons among three methods of data analysis. Drug Metabol. Disp. 27: 756 – 762.
Kramer, S.D., Absorption prediction from physicochemical parameters. Pharmaceutical Science & Technology Today, 1999. 2: 373-380.
Lau OD, Courtney AD, Vassilev A, Marzilli LA, Cotter RJ, Nakatani Y, Cole PA. 2000. p300/CBP-associated factor histone acetyltransferase processing of peptide substrate: kinetic analysis of the catalytic mechanism. J Biol Chem 275: 21953–21959.
Laura LH, Maria VDT, Leticia MA. 200. Chromatin-remodelling mechanisms in cancer. Mutation Research 7881: 1-24.
Lipinski CA, Lombardo F, Dominy BW, Feeney PJ. 2001. Experimental and computational approaches to estimates solubility and permeability in drug discovery and development settings. Advanced Drug Reviews 46: 3 – 26. MacRaild CA, Daranas AH, Bronowska A, Homans SW. 2007. Global changes in
17
Manzo F, Tambaro FP, Mai A, Altucci L. 2009. Histone acetyltransferase inhibitors and preclinical studies. Expert Opin. Ther. Patents 19: 761 – 774.
Mannhold R, Poda GI, Ostermann C, Tetko IV. 2007. Calculation of molecular lipophilicity: state of the art and comparison of log P methods on more than 96000 compounds. J Pharm. Sci. 98: 861 – 893.
Marmorstein R. 2001. Structure and function of histone acetyltransferases. Cell Mol Life Sci 58: 693–703.
Nelson DL, Cox MM. 2008. Lehninger Principles of Biochemistry, Edisi ke-5. New York: W.H. Freeman and Company.
Oliveira FG, Sant’Anna CM, Caffarena ER, Dardenne LE, Barreiro EJ. 2009. Molecular docking study and development of empirical binding free energy model for phosphodiesterase 4 inhibitors. Bioorg. Med. Chem. 14: 6001 – 6011.
Ott M, Verdin E. 2010. HAT trick: p300, small molecule, inhibitor. Chem. Biol. 417–418.
Poux AN, Marmorstein R. 2003. Molecular basis for Gcn5/PCAF Histone Acetyltransferase selectivity for histone and nonhistone substrates. Biochemistry: 14366-14374.
Roth S.Y., Denu J.M., Allis C.D. (2001) Histone acetyltransferase. Annu. Rev. Biochem.70: 81-120.
Ruiz P.A., Braune A., Holzlwimmer G., Fend L.Q., Haller D. (2007) Quercetin inhibits TNF-Induced NF-B transcription factor recruitment to proinflammator gene promoters in murine intestinal epithelial cells. J Nutr. 137: 1208 – 1215.
Singh R, Chaturvedi N, Singh VK. 2012. In-silico study of herbal compounds
(baicalin, curcumin, dronabinol) as novel mao inhibitors for Parkinson’s
disease treatment). Int. J. Life Sci. Pharm. Res. 2: 81 – 98.
Xiao X, Shi D, Liu L, Wang J, Xie X, Kang T, Deng W. 2011. Quercetin supress cyclooxygenase-2 expression and angiogenesis through inactivation of p300 signaling. Pplos One 6: 1-10.
19
Lampiran 1 Diagram alir penelitian
Preparasi kuersetin (Marvin Sketch dan Open
Babel)
Preparasi Enzim HAT PCAF (Discovery Studio 3.5 Client)
Docking Kuersetin dan HAT PCAF (AutoDock Vina)
Visualisasi interaksi HAT PCAF-kuersetin
(Ligplot plus)
Analisis data
(Interaksi HAT-Kuersetin, poteins kuersetin sebagai inhibitor HAT
Preparasi Pereaksi
Uji Inhibisi HAT PCAF oleh Kuersetin (inkubasi 10 menit
pada 30C)
Penghentian reaksi dengan isopropanol
Intensitas fluoresens diukur pada eksitasi (392 nm) dan
emisi (482 nm)
Intensitas fluoresens Situs pengikatan
kuersetin pada HAT PCAF
Analisis data (Konsentrasi produk, kecepatan reaksi, konstanta
inhibisi, jenis inhibisi)
Hasil uji potensi kuersetin sebagai inhibitor HAT PCAF
20
Lampiran 2 Komposisi kurva standar KoA
Bahan Komposisi (µL)
Bufer HAT 0.5x KoA CPM
95; 93; 91; 89, 87; 85; 83 µL 0; 2; 4; 6; 8; 10; 12 µL 5 µL (per sampel sama)
Lampiran 3 Kurva standard
Lampiran 4 Kinetika inhibisi S1 H3 10 µM
[Kuersetin] terkoreksi RFU [H3] akhir (µM) v (x/t) 1/v
0 68402 8.388723032 0.838872303 1.192076549
10 53182.5 6.613854227 0.661385423 1.511977684
20 43380 5.470705539 0.547070554 1.827917794
30 41711.5 5.27612828 0.527612828 1.895329202
40 29155 3.811813411 0.381181341 2.623423269
50 24794 3.303241983 0.330324198 3.027328925
Keterangan:
v = laju reaksi
x = [KoA] [Histon 3 terasetilasi]
y = 85.75x - 3531.3 R² = 0.9886
-20000 0 20000 40000 60000 80000 100000 120000
0 200 400 600 800 1000 1200 1400
KURVA STANDARD KOA
[KoA] (pmol) KoA
21
Lampiran 5 Komposisi kinetika inhibisi S2 H3 15 µM
[Kuersetin] terkoreksi RFU [H3] akhir (µM) v (x/t) 1/v 0 104069.5 12.54819825 1.254819825 0.79692716
10 74678 9.120618076 0.912061808 1.096416922
20 71810.5 8.786215743 0.878621574 1.138146421
30 63704 7.840851312 0.784085131 1.275371717
40 61483.5 7.581900875 0.758190087 1.318930459
50 54801 6.802600583 0.680260058 1.47002604
Lampiran 6 Nilai ΔG rantai A PCAF dan kuersetin mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b. ---+---+---+--- 1 -7.5 0.000 0.000 2 -7.4 4.715 9.907 3 -7.4 5.321 9.106 4 -7.3 3.672 9.684 5 -7.3 1.567 7.424 6 -7.3 1.549 3.371 7 -7.2 4.095 9.798 8 -7.0 3.838 5.255 9 -7.0 2.998 8.912
Lampiran 7 Nilai ΔG rantai B PCAF dan kuersetin mode | affinity | dist from best mode
22
Lampiran 8 Skema deteksi aktivitas HAT menggunakan CPM
23