i
PENGARUH STERILISASI DAN KOMBINASI HORMON PADA
EKSPLAN KANTONG SEMAR (
Nepenthes mirabilis
Lour.)
SECARA IN VITRO
VITA MEILANI
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Sterilisasi dan Kombinasi Hormon pada Eksplan Kantong Semar (Nepenthes mirabilis Lour.) secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
ii
ABSTRAK
VITA MEILANI. Pengaruh Sterilisasi dan Kombinasi Hormon pada Eksplan Kantong Semar (Nepenthes mirabilis Lour.) secara In Vitro. Dibimbing oleh EDHI SANDRA dan SISWOYO.
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Esha Flora Bogor, dari bulan Juni sampai November 2013 dengan tujuan mempelajari pengaruh sterilisasi dan pemberian kombinasi hormon sitokinin BAP, auksin 2,4-D, dan giberelin GA terhadap keberhasilan induksi kalus pada Nepenthes mirabilis Lour. secara in-vitro. Data perlakuan sterilisasi dan kombinasi hormon diolah secara statistik menggunakan Rancangan Acak Lengkap terdiri atas 10 perlakuan dan 3 ulangan. Prosedur sterilisasi yang dianjurkan sesuai penelitian ini adalah menggunakan eksplan bagian daun tanaman dewasa dengan potongan 1-1,5 cm dan melewati masa karantina 21 hari, bahan sterilan berupa detergen 1 gr/100 ml selama 5 menit, fungisida sistemik 1gr/100ml selama 15 menit, bakterisida sistemik 1gr/100ml selama 15 menit, antibiotik 20ml/100ml selama 17 jam, HgCl₂ 10ml/100ml selama 5 menit, clorox 5% selama 5 menit, pembilasan masing-masing 3 menit serta pembilasan akhir sebanyak 5 kali dengan durasi 3 menit. Media tanam paling baik dan cocok untuk induksi kalus N. mirabilis adalah media 1/5 MS + 1 BAP + 1 2,4-D + 2 ml glycine + 200 mg casein.
Kata kunci: induksi kalus, kantong semar, kultur jaringan, sterilisasi
ABSTRACT
VITA MEILANI. (Sterilization and Hormone Combinations Effect of Kantong Semar Explant (Nepenthes mirabilis Lour.) in Aseptic Condition. Supervised by EDHI SANDRA and SISWOYO.
The experiment was conducted at Laboratory of Tissue Culture Esha Flora Bogor, from June until November 2013 to study the sterilization and the combination hormone cytokinin BAP, 2,4-D auxin, and gibberellins GA effect to successful callus induction of Nepenthes mirabilis Lour. in aceptic condition. Statistical processing performed to sterilization treatment and the combination of hormones used randomized complete design consisting of 10 treatments 3 replications. Sterilization procedures are recommended from this study is that using leaf of adult plants with 1-1.5 cm pieces for explants and passed through a quarantine period of 21 days, sterilizing materials such as detergents 1gr/100ml for 5 minutes, systemic fungicides 1gr/100ml for 15 minutes, systemic bactericidal 1gr/100ml for 15 minutes, 20ml/100ml antibiotics for 17 hours, HgCl₂ 10ml/100ml for 5 minutes, 5% clorox for 5 minutes, flushing each 3 minutes and final flushing 5 times each 3 minutes. The best planting medium and suitable for callus induction of N. mirabilis is 1/5 MS + 1 BAP + 1 2,4-D + 2 ml glycine + 200 mg casein.
iii
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Konservasi Sumberdaya Hutan dan Ekowisata
PENGARUH STERILISASI DAN KOMBINASI HORMON PADA
EKSPLAN KANTONG SEMAR (
Nepenthes mirabilis
Lour.)
SECARA IN VITRO
VITA MEILANI
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR BOGOR
v Judul Skripsi : Pengaruh Sterilisasi dan Kombinasi Hormon pada Eksplan Kantong
Semar (Nepenthes mirabilis Lour.) secara In Vitro Nama : Vita Meilani
NIM : E34090060
Disetujui oleh
Ir Edhi Sandra, MSi Pembimbing I
Ir Siswoyo, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Sambas Basuni, MS Ketua Departemen
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 ini ialah kultur jaringan, dengan judul Pengaruh Sterilisasi dan Kombinasi Hormon pada Eksplan Kantong Semar (Nepenthes mirabilis Lour.) secara In Vitro.
Terima kasih penulis ucapkan kepada Ir Edhi Sandra, MSi dan Ir Siswoyo, MSi selaku pembimbing skripsi. Ibu Hafsiati, Denish Andri, Shut dan Endro Priherdityo, SP yang telah banyak membantu selama penelitian, keluarga Fahutan IPB serta seluruh teman dan sahabat penulis Lina Mahrunnisa, Ayu Alhidayati, Dwi Budi Siswantono, Amalia Aldina Thoha, Annisa Sendikia, Yuliani Indrawati, Achmad Robyantoro, Iga Darmeydi, Aria Nusantara, dan yang tidak dapat penulis ucapkan satu persatu yang telah memberikan semangat. Ungkapan terima kasih juga disampaikan kepada orang tua H. Pem Evendye dan Hj. Ismawirta Zanur, adik Vito Wira Evendye, serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
vii
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
METODE 2
Lokasi dan Waktu 2
Bahan 2
Alat 2
Prosedur Kerja 3
Analisis Data 4
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 11
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
DAFTAR PUSTAKA 16
viii
DAFTAR TABEL
1 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang
terkontaminasi 6
2 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan
yang terkontaminasi 6
3 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang mati 7 4 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan
yang mati 8
5 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang
hidup 8
6 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan
yang hidup 9
7 Data hasil uji beda nyata pengaruh kombinasi hormon terhadap persentase induksi kalus pada eksplan N. mirabilis 10
DAFTAR GAMBAR
1 Bagian daun N. mirabilis yang digunakan sebagai eksplan 2 2 Grafik persentase kontaminan cendawan, bakteri, cendawan & bakteri 6 3 Sumber kontaminan (a) bersumber pada eksplan dan (b) bersumber pada
media 7
4 Persentase eksplan yang mati 8
5 Persentase eksplan yang hidup 9
6 (a) tahap awal induksi kalus pada 3 MST; (b) kalus pada 4 MST.
2 Konsentrasi media MS dan kombinasi hormon 19
3 Konsentrasi dan durasi bahan sterilan 20
4 Perlakuan sterilisasi eksplan 22
5 Jadwal karantina tanaman 24
6 Kontaminan yang ditemukan selama pengamatan 24
7 Rata-rata persentase eksplan yang terkontaminasi, mati, dan hidup pada
setiap perlakuan 26
PENDAHULUAN
Latar Belakang
Nepenthes atau Kantong Semar (pitcher plant) adalah tumbuhan karnivora yang memiliki keunikan pada bentuk kantong dan warnanya. Indonesia merupakan habitat lebih dari 70% spesies Nepenthes. Borneo (Kalimantan, Serawak, Sabah dan Brunei) merupakan pusat penyebaran Nepenthes di dunia. Menurut Mansur (2007), terdapat 64 jenis Nepenthes yang hidup di Indonesia dari sekitar 82 jenis yang ada di dunia, salah satunya adalah Nepenthes mirabilis.
Dewasa ini kelestarian Nepenthes di Indonesia terancam karena konversi hutan dan lahan secara besar-besaran. Kantong semar termasuk tumbuhan langka berdasarkan kategori IUCN (International Union for Conservation of Nature) dan WCMC (World Conservation Monitoring Centre). Di Indonesia tumbuhan ini dilindungi menurut PP No. 7 tahun 1999 tentang Pengawetan dan Pelestarian Tumbuhan dan Satwa Liar, dan termasuk dalam daftar CITES Appendix I (N. rajah dan N. khasiana) dan Appendix II (selain kedua jenis tersebut). Untuk menjaga kelestarian tanaman ini di alam, diperlukan tindakan budidaya, salah satunya adalah tindakan budidaya dengan teknik culture In Vitro.
Penelitian tentang sterilisasi dan kombinasi hormon untuk induksi kalus pada Nepenthes secara umum telah banyak dilakukan, namun untuk N. mirabilis khusunya masih dibutuhkan penelitian. Adapun kendala yang sering ditemukan dalam teknik kultur jaringan adalah sulitnya mendapatkan tanaman dengan kondisi yang steril sehingga menimbulkan tingginya tingkat kontaminasi yang menyebabkan kematian pada eksplan. Selain itu, pemberian konsentrasi hormon untuk induksi kalus yang tidak cocok juga dapat berpengaruh pada kematian eksplan.
Sehubungan dengan hal tersebut di atas dan dalam rangka mengetahui sejauh mana pengaruh sterilisasi dalam menciptakan eksplan yang steril dan pengaruh kombinasi hormon dalam induksi kalus, maka penelitian ini perlu dilakukan.
Tujuan Penelitian
1. Mendapatkan informasi pengaruh sterilisasi terhadap keberhasilan embrio somatik (induksi kalus) pada N. mirabilis.
2. Mendapatkan informasi pengaruh pemberian kombinasi hormon sitokinin BAP, auksin 2,4-D, dan giberelin GA dalam embrio somatik (induksi kalus) pada N. mirabilis.
Manfaat Penelitian
2
METODE
Lokasi dan Waktu
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Esha Flora Bogor, dari bulan Juni sampai dengan November 2013.
Bahan
Bahan utama dalam penelitian ini berupa eksplan daun kantong semar yaitu jenis N. mirabilis yang berasal dari koleksi Garden Shop Kebun Raya Bogor. Untuk media yang digunakan adalah media Murashige & Skoog, komposisi media terdapat pada Lampiran 1. Hormon yang digunakan adalah sitokinin BAP, auksin 2,4-D, dan giberelin GA yang masing-masing konsentrasinya tersaji pada Lampiran 2.
Bahan sterilan yang digunakan adalah detergen, fungisida, bakterisida, antibiotik, HgCl₂, Clorox, dan air steril untuk pembilasan. Konsentrasi dan durasi bahan sterilan yang digunakan terdapat pada Lampiran 3.
Alat
Alat yang digunakan untuk pembuatan media antara lain gelas ukur, gelas piala, pipet volumetrik, neraca analitik, pH meter, pengaduk, panci, autoclave, timbangan analitik, mangnetic stirer, labu erlenmeyer, botol kultur, aluminium foil, dan karet gelang. Proses penanaman menggunakan alat-alat, antara lain cawan petri, pisau, pinset, lampu bunsen, scalpel, tisu, laminar air flow cabinet, dan plastic wrap. Sementara itu alat untuk pengamatan adalah tally sheet, alat tulis, dan kamera.
3
Prosedur Kerja
Penelitian ini dilakukan dalam beberapa tahap dikarenakan hasil penelitian pada percobaan pertama tidak mencapai target yaitu eksplan yang steril dan hidup sampai muncul kalus, sehingga perlu dilakukan percobaan kedua dan seterusnya sebagai tindak lanjut dari evaluasi yang sudah dilakukan pada percobaan sebelumnya.
Sterilisasi Alat
Sterilisasi merupakan kunci keberhasilan dari pelaksanaan kultur jaringan. Botol dan alat-alat yang akan dipakai dalam pembuatan media dan penanaman dicuci hingga bersih kemudian disterilkan ke dalam autoclave pada temperatur 121ºC dengan tekanan 17,5 psi dan dalam waktu satu jam. Penghitungan waktu dimulai saat suhu dan tekanan yang diinginkan telah dicapai. Alat-alat yang perlu disterilkan yaitu pinset, gunting, pengaduk, erlenmeyer, botol kultur, gelas piala dan cawan petri.
Sterilisasi Media
Botol-botol kultur yang sudah berisi media disterilkan dengan menggunakan autoclave selama 25 menit dengan suhu dan tekanan konstan yaitu 121ºC dan 17,5 psi.
Sterilisasi Air
Air yang digunakan adalah air mineral dan aquades. Air dimasukkan ke dalam botol dan siterilkan dengan menggunakan autoclave selama 45 menit sampai 1 jam dengan suhu dan tekanan konstan yaitu 121ºC dan 17,5 psi.
Serilisasi Tanaman
Dalam inisisasi, tahapan sterilisasi tanaman merupakan tahapan yang terpenting setelah sterilisasi alat, media dan air karena harus menciptakan eksplan yang benar-benar steril sesuai dengan prinsip utama dalam kultur jaringan. Pada penelitian ini terdapat 10 macam perlakuan sterilisasi yang tersaji dalam Lampiran 4. Idealnya konsentrasi setiap larutan yang digunakan dalam sterilisasi tanaman bersifat mematikan untuk bakteri dan cendawan namun tidak mematikan terhadap tanaman itu sendiri.
Penanaman
Alat dan bahan yang akan digunakan untuk penanaman terlebih dahulu disiapkan dalam laminar air flow. Alat-alat tersebut berupa api bunsen, cawan petri, pinset dan pisau, botol yang sudah berisi tanaman setelah proses sterilisasi, dan botol-botol yang sudah berisi media tanam untuk menanam eksplan.
Eksplan berupa potongan daun N. mirabilis dikeluarkan dari botol kemudian dipindahkan ke dalam cawan petri dan dipotong-potong lalu ditanam pada media kultur. Sebelum menanamkan eksplan, botol kultur terlebih dahulu dipanaskan di atas api bunsen. Pengerjaan penanaman harus berlangsung cepat untuk meminimalkan kontaminasi.
4
lagi dengan plastik, aluminium foil, diikat dengan karet, kemudian dibalut dengan plastik wrap sehingga tidak ada lagi ruang yang memungkinkan kontaminan masuk ke adalah botol kultur.
Pengamatan
Pengamatan dilakukan setiap hari pada seluruh eksplan dan disajikan dalam persentase yang meliputi: dilakukan dalam rangkaian waktu yang sama, percobaan pertama mengenai pengaruh sterilisasi dan percobaan kedua mengenai pengaruh kombinasi hormon terhadap embrio somatik (induksi kalus) eksplan N. mirabilis.
Penelitian ini terdiri atas 10 perlakuan yang berbeda yaitu perlakuan A sampai J yang masing-masing terdiri atas 10 botol kultur dengan 3 ulangan. Satuan percobaan tersaji pada Lampiran 4. Pengolahan secara statistik dilakukan terhadap data perlakuan sterilisasi dan kombinasi hormon, sedangkan untuk kandungan bahan sterilan dan hormon dianalisis secara deskriptif. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL). Model yang digunakan adalah (Heryanto 1996):
Keterangan:
Yij = nilai pengamatan pada satuan percobaan ke-j yang mendapatkan perlakuan ke-i
µ = nilai tengah umum τi = pengaruh perlakuan ke-i
ϵij = galat percobaan pada satuan percobaan ke-j dalam perlakuan ke-i
t = jumlah perlakuan
rᵢ = jumlah ulangan pada perlakuan ke-i
Data diolah menggunakan SAS 9.0.1 guna mengetahui respon eksplan dari perlakuan sterilisasi dan perlakuan media dengan menggunakan uji-F dan dilanjutkan dengan uji Duncan dengan taraf 5% jika F-hitung berbeda nyata. Data mengenai kontaminan dan sumber kontaminasi diolah menggunakan Microsoft Excel 2007.
5
Percobaan sterilisasi pada eksplan N. mirabilis dilakukan dengan 10 perlakuan berbeda dengan masing-masing berjumlah 10 botol kultur dengan 3 ulangan yang dikelompokkan menjadi dua, yang pertama terdiri atas perlakuan sterilisasi A sampai E menggunakan eksplan berupa bagian daun tanaman N. mirabilis berusia muda di dalam botol media moss dengan ukuran 0,5-1 cm dan tanpa melewati proses karantina, sedangkan kelompok yang kedua adalah perlakuan sterilisasi F sampai J yang menggunakan eksplan berupa daun tanaman N. mirabilis berusia dewasa di dalam pot media sekam bakar dan cocopeat dengan ukuran 1-1,5 cm dan melewati masa karantina sebelum penanaman. Jadwal karantina tanaman tersaji pada Lampiran 5.
Parameter yang diamati adalah jumlah eksplan yang terkontaminasi dan tidak terkontaminasi. Eksplan yang terkontaminasi dibedakan atas kontaminannya dan sumber kontaminasi. Eksplan yang tidak terkontaminasi lebih lanjut dibedakan antara eksplan yang hidup dan eksplan yang mati. Uji statistik dilakukan pada ekplan yang terkontaminasi, mati, dan hidup. Berdasarkan hasil analisis ragam menunjukkan bahwa perlakuan sterilisasi berpengaruh sangat nyata pada taraf α = 5% dan α = 1% terhadap jumlah eksplan yang terkontaminasi, seperti tersaji pada Tabel 1.
6
Tabel 1 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang terkontaminasi
**berbeda sangat nyata pada taraf α = 5% dan α = 1%
Terkontaminasinya eksplan pada perlakuan kelompok pertama (perlakuan A sampai E) langsung terlihat pada 1 MST, sementara perlakuan kelompok kedua laju kontaminasi berlangsung lambat pada 1 MST sampai 2 MST kemudian terkontamiasi banyak pada 3 MST. Kontaminan berupa cendawan terjadi paling banyak pada perlakuan A dan B yaitu 70% dan 63,33%, kontaminan bakteri paling banyak pada perlakuan D dan E yaitu 75% dan 60%, serta kontaminan cendawan dan bakteri yang terdapat dalam satu botol eksplan yang sama paling banyak pada perlakuan B yaitu 20% (Gambar 2).
Tabel 2 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan yang terkontaminasi
*angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak
berbeda nyata berdasarkan DMRT pada taraf α = 5% dan α = 1%
Sumber
Perlakuan Rata-rata persentase eksplan yang terkontaminasi (%)*
7 Cendawan yang ditemukan pada saat pengamatan, secara visual dapat dibedakan menjadi cendawan berwarna coklat, cendawan berwarna hitam, dan cendawan berwarna putih. Bakteri yang ditemukan terdiri atas bakteri berwarna pink, bakteri berwarna putih, dan bakteri berwarna kuning kehijauan. Pengelompokan kontaminan tersaji pada Lampiran 6. Rata-rata dari keseluruhan kontaminan, di atas 70% bersumber pada eksplan. Secara visual hal ini dapat dilihat kontaminan berawal muncul disekitar eksplan kemudian perlahan menyebar sampai menutupi seluruh eksplan (Gambar 3).
Berdasarkan hasil analisis sidik ragam menunjukkan bahwa perlakuan sterilisasi berpengaruh sangat nyata pada taraf α = 5% dan α = 1% terhadap jumlah eksplan yang mati, seperti tersaji pada Tabel 3. Uji statistik Duncan pada pengamatan eksplan yang mati pada 4 minggu setelah tanam (MST) menunjukkan perlakuan F dan G berbeda secara nyata terhadap perlakuan lainnya namun perlakuan F dan G tidak saling berbeda nyata (Tabel 4). Perlakuan F dan G menunjukkan angka kematian eksplan tertinggi. Meskipun perlakuan F dan G dapat menciptakan eksplan yang tidak terkontaminasi atau steril, namun kemudian banyak dari eksplan tersebut mengalami kematian pada 2 MST, hal ini diduga karena media MS yang digunakan tidak ditambahkan glycine dan casein yang merupakan asam amino sebagai sumber nitrogen organik, sehingga kemampuan eksplan untuk hidup sangat kecil. Meskipun perlakuan F dan G adalah perlakuan sterilisasi yang dianjurkan, namun media yang digunakan perlu ditambahkan glycine dan casein.
Tabel 3 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang mati Sumber
8
Tabel 4 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan yang mati
*angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak
berbeda nyata berdasarkan DMRT pada taraf α = 5% dan α = 1%
Angka kematian eksplan mengalami penurunan dari perlakuan G sampai J dan penurunan yang sangat drastis terjadi pada perlakuan G ke perlakuan H, hal ini dikarenakan pada perlakuan H, I, dan J media MS ditambahkan 2 ml glycine dan 200 mg casein sehingga kebutuhan sumber nitrogen oleh eksplan terpenuhi.
Berdasarkan hasil analisis sidik ragam menunjukkan bahwa perlakuan sterilisasi berpengaruh sangat nyata pada taraf α = 5% terhadap jumlah eksplan yang hidup, seperti tersaji pada Tabel 5.
Tabel 5 Analisis ragam pengaruh perlakuan sterilisasi terhadap eksplan yang hidup
*berbeda sangat nyata pada taraf α = 5%
Perlakuan Rata-rata persentase eksplan yang mati (%)*
A 00,00 c
9 Uji statistik pada pengamatan eksplan yang hidup pada 4 minggu setelah tanam (MST) menunjukkan perlakuan F,G,H, dan I saling tidak berbeda nyata, tetapi berbeda secara nyata dengan perlakuan J (Tabel 6). Perlakuan J adalah perlakuan sterilisasi yang terbaik karena 33,33% eksplan yang dapat bertahan hidup, sehingga perlakuan J adalah perlakuan sterilisasi yang dianjurkan. Secara umum dari keseluruhan perlakuan sterilisasi pada eksplan, persentase eksplan yang hidup mengalami peningkatan disetiap perlakuan (Gambar 5). Rata-rata persentase eksplan yang terkontaminasi, hidup, dan mati pada setiap perlakuan tersaji pada Lampiran 7.
Tabel 6 Data hasil uji beda nyata pengaruh perlakuan sterilisasi terhadap eksplan yang hidup
*angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak
berbeda nyata berdasarkan DMRT pada taraf α = 5%
Perlakuan Rata-rata persentase eksplan yang hidup (%)*
A 00,00 b
10
Induksi Kalus
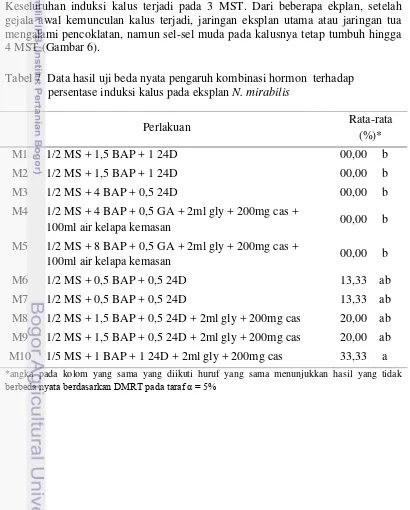
Kalus muncul pada eksplan yang tidak terkontaminasi dan bertahan hidup. Uji statistik pada pengamatan eksplan yang berkalus pada 4 MST menunjukkan hasil yang sama dengan eksplan yang hidup, karena keseluruhan eksplan yang hidup memunculkan kalus. Perlakuan untuk induksi kalus dibedakan berdasarkan kandungan hormon pada media saja. Secara umum kalus yang muncul dari seluruh perlakuan mengalami peningkatan. Kalus yang muncul terjadi pada perlakuan M6, M7, M8, M9, dan M10 dengan kandungan hormon yang sama, yaitu BAP dan 24D namun konsentrasinya berbeda. Kalus paling banyak muncul pada perlakuan M10 dengan menggunakan media 1/5 MS + 1 BAP + 1 24D dengan menambahkan 2ml glycine + 200 mg casein, sehingga perlakuan M10 adalah media terbaik untuk menginduksi kalus pada eksplan N. mirabilis (Tabel 7).
Induksi kalus diawali dengan terjadinya pembengkakan di sekitar eksplan kemudian muncul sel-sel yang bentuknya tidak beraturan dan berwarna keputihan. Keseluruhan induksi kalus terjadi pada 3 MST. Dari beberapa ekplan, setelah gejala awal kemunculan kalus terjadi, jaringan eksplan utama atau jaringan tua mengalami pencoklatan, namun sel-sel muda pada kalusnya tetap tumbuh hingga 4 MST (Gambar 6).
Tabel 7 Data hasil uji beda nyata pengaruh kombinasi hormon terhadap persentase induksi kalus pada eksplan N. mirabilis
*angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak
berbeda nyata berdasarkan DMRT pada taraf α = 5%
11
Gambar 6 (a) tahap awal induksi kalus pada 3 MST; (b) kalus pada 4 MST. Jaringan tua mulai mati
Pembahasan
Sterilisasi Eksplan
Sterilisasi adalah proses untuk mematikan mikroorganisme sampai pada tingkatan yang tidak memungkinkan lagi untuk berkembangbiak dan menjadi sumber kontaminan bagi eksplan. Kontaminasi dapat mengakibatkan kematian pada eksplan karena mikroorganisme ini dapat tumbuh dan berkembang dengan cepat pada media tanam dan dalam waktu singkat akan menutupi permukaan media dan eksplan, mikroorganisme ini mengeluarkan senyawa beracun ke dalam media kultur yang dapat menyebabkan kematian eksplan (Zulkarnain 2009). Menurut Leifert dan Cassels (2001) untuk mengatasi adanya kontaminasi dapat menggunakan antibiotik karena cukup efektif terhadap beberapa bakteri termasuk Bacillus sp. Selain itu dapat menggunakan Clorox (NaOCl) untuk sterilisasi permukaan. Santoso dan Nursandi (2003) menyebutkan bahwa Clorox terdiri dari Natrium hipoklorit yang dapat membersihkan mikroorganisme dalam bahan tanaman, menghilangkan partikel-partikel tanah, debu dan lain-lain.
Perlakuan sterilisasi A bahan sterilan yang digunakan hanya detergen sebanyak 1 gr/100 ml dengan durasi pengocokan selama 7 menit dan seluruh eksplan terkontaminasi oleh cendawan dan bakteri. Menurut Aishah dan Rosli (2013), cendawan pada dasarnya adalah jamur yang memiliki isi atau berdaging dan struktur badannya yang mengandung spora. Keluarga dari jamur ini diketahui memiliki ribuan varietas di seluruh dunia. Wudianto (2002) juga menyebutkan cendawan pada umumnya berbentuk seperti benang halus yang tidak bisa dilihat dengan mata telanjang. Penampakan visual yang dapat dilihat langsung berupa misellium yaitu kumpulan dari benang-benang halus yang dsebutkan di atas. Kontaminan berikutnya adalah bakteri, Darmono (2003) menyebutkan kontaminasi bakteri yang menyerang eksplan umumnya ditandai dengan keluarnya cairan berwarna putih keruh seperti susu dan berbau busuk. Terkontaminasinya seluruh eksplan karena detergen saja tidak mampu untuk membunuh kontaminan, detergen hanya mampu merontokkan debu dan kotoran yang menempel pada permukaan eksplan.
Perlakuan sterilisasi B menambahkan penggunaan clorox 10% dan 5%. Hal ini ternyata tidak berpengaruh untuk dapat menghilangkan kontaminan pada eksplan. Pada perlakuan sterilisasi C ditambahkan bahan sterilan berupa fungisida, antibiotik, dan HgCl₂. Menurut Cantika (2006) antibiotik adalah antimikroba yang selektif yang diaplikasikan pada jaringan hidup atau secara sistemik membunuh
12
atau menghambat pertumbuhan bakteri. Antibiotik dalam kultur jaringan memiliki efek positif dan negatif. Efek positif dari penggunaan antibiotik adalah membantu mempercepat pertumbuhan jaringan yang dikulturkan, meningkatkan morfogenesis kalus dan mempercepat perakaran. Efek negatif dari antibiotik adalah bersifat toksik pada plastida dan mitokondria, mengurangi pembentukan klorofil dan menghambat pembentukan asam amino. Penggunaan antibiotik seringkali menyebabkan fenomena yang berbahaya terhadap bahan tanaman. Penggunaan yang berlebihan dapat menghambat pertumbuhan dan perkembangan eksplan.
Penggunaan bahan sterilan tersebut mampu menciptakan 40% eksplan yang steril, namun diduga karena konsentrasinya terlalu kuat dan eksplan tidak mampu menerima reaksi tersebut, seluruh eskplan yang tidak terkontaminasi ini mati pada 2 MST. Menurut Hendaryono dan Wijayani (1994), HgCl₂ merupakan bahan kimia yang bersifat keras dan beracun. Apabila sterilisasi terlalu lama akan menyebabkan kerusakan pada eksplan, secara visual warna eksplan berubah menjadi kecoklatan. Oleh karena itu dilakukan penurunan konsentrasi HgCl₂ dan clorox pada perlakuan sterilisasi D dan E. Namun, hasil perlakuan ini menunjukkan angka kontaminasi meningkat menjadi 93,33% dan 83,33% dengan kontaminan terbanyak berupa bakteri (Lampiran 8). Hal ini diduga campuran air kelapa dalam kemasan pada media yang sebelumnya dimaksudkan untuk menggantikan peran air kelapa muda sebagai hara organik, justru mengandung bakteri.
Eksplan yang digunakan pada perlakuan sterilisasi kelompok pertama (A sampai E) adalah tanaman muda di dalam botol dengan media moss dan dipotong dengan ukuran 0,5-1 cm. Menurut Gunawan (1987), ukuran eksplan turut menjadi faktor keberhasilan dari suatu teknik kultur jaringan. Ukuran eksplan yang terlalu kecil akan kurang daya tahannya bila dikulturkan, sedangkan ukurannya terlalu besar akan sulit didapatkan eksplan yang steril. Oleh karena itu perlakuan sterilisasi kelompok kedua ekplan diganti menjadi tanaman yang dewasa di dalam pot dengan media sekam bakar dan cocopeat dengan potongan yang lebih besar
(a) (b)
13 yaitu 1-1,5 cm. Hal ini berdampak baik karena terdapat eksplan yang bertahan hidup pada perlakuan sterilisasi kelompok kedua (F sampai J).
Evaluasi pada perlakuan sterilisasi kelompok pertama, selain mengganti eksplan kepada tanaman dewasa dan memperbesar potongannya, juga dilakukan penambahan pada bahan sterilan berupa bakterisida sistemik dan mengganti fungisida yang sebelumnya menjadi fungisida sistemik juga. Selain itu pembilasan akhir yang sebelumnya dilakukan sebanyak tiga kali dengan durasi masing 3 dan 5 menit, ditingkatkan menjadi lima kali dengan durasi masing-masing 3 menit. Gunawan (1987) menyebutkan bahan-bahan sterilisasi yang biasa digunakan umumnya bersifat toksik terhadap jaringan. Pembilasan yang berkali-kali sesudah perendaman dalam larutan bahan sterilisasi sangat diperlukan untuk menghilangkan sisa-sisa bahan aktif yang masih menempel.
Mengingat tanaman yang digunakan berasal dari luar, maka perlu dilakukan karantina sebelum penanaman. Karantina tanaman induk bertujuan untuk mempersiapkan eksplan yang sehat dan bebas dari kontaminan internal. Karantina penting karena sterilisasi permukaan eksplan saja tidak cukup membunuh mikroba terlebih mikroba yang bersifat endofit.
Hasil pada perlakuan sterilisasi kelompok kedua (F sampai J) ini menunjukkan hasil yang baik. Persentase eksplan yang hidup semakin tinggi, dan yang paling tinggi sebesar 33,33% adalah percobaan dengan perlakuan karantina selama 21 hari. Pada percobaan ini juga rata-rata eksplan yang steril dan mengalami kematian terjadi pada 3 MST. Dugaan bahwa kontaminannya adalah mikroba yang bersifat endofit. Menurut Durham (2004), cendawan endofit adalah fungi yang menginfeksi jaringan tanaman yang sehat tanpa menyebabkan penyakit. Petrini (1992) menambahkan cendawan endofit disebut juga sebagai mikosimbion endofitik yang merupakan cendawan yang melakukan kolonisasi dalam jaringan tanaman tanpa menimbulkan gejala penyakit. Clay (1988) mengatakan bahwa cendawan endofit terdapat dalam sistem jaringan tumbuhan seperti daun, bunga, ranting, ataupun akar. Istilah endofit selama ini masih diasosiasikan dengan cendawan, tetapi endofit juga mencakup bakteri. Bakteri endofit dilaporkan merupakan salah satu bakteri yang mempunyai pengaruh positif terhadap pertumbuhan tanaman (Kobayashi dan Palumbo 2000). Mikroba yang bersifat endofit laju pertumbuhannya lebih lambat dibandingkan mikroba yang berada pada permukaan eksplan.
14
5 menit, dan pembilasan masing-masing 3 menit serta pembilasan akhir sebanyak 5 kali dengan durasi 3 menit.
Fenomena browning tidak ditemukan pada seluruh perlakuan sterilisasi karena eksplan yang digunakan berusia muda dan dewasa. Browning terjadi umumnya pada tanaman yang sudah tua, karena pada tanaman yang sudah tua dapat mengeluarkan larutan fenol yang akan bereaksi dengan udara (oksigen) sehingga menghasilkan larutan yang berwarna coklat yang disebut quinon (Sandra 2002). Darmono (2003) menambahkan senyawa fenol yang berwarna coklat atau hitam itu muncul pada bekas sayatan atau potongan eksplan yang akan ditanam.
Induksi Kalus
Prinsip dasar dari kultur jaringan adalah totipotensi cell yaitu di dalam tubuh multiseluler, setiap sel memiliki potensi genetik seperti zigotnya yang mampu memperbanyak diri dan berdiferensiasi menjadi tanaman lengkap (George dan Sherrington 1984). Daun dapat dikulturkan sehingga menjadi tanaman lengkap, namun terlebih dahulu melewati proses embriogenesis somatik membentuk kalus, dari kalus kemudian akan muncul tunas dan tumbuh membentuk organ-organ lainnya sehingga menjadi tanaman yang sempurna.
Media yang digunakan pada perlakuan M1 sampai M10 adalah media Murashige dan Skoog (MS). Media MS adalah media yang paling banyak digunakan untuk berbagai kultur, media ini mengandung garam-garam mineral dalam konsentrasi yang tinggi (Gamborg dan Shyluk 1981). Keberhasilan dalam teknik kultur jaringan ditentukan oleh penggunaan media dengan komposisi hara yang tepat. Menurut Evans et al. (2003) secara umum kebutuhan hara pada kultur jaringan dibagi menjadi tiga kelompok, yaitu hara anorganik (mineral), hara organik, dan zat pengatur tumbuh. Unsur hara anorganik sudah terdapat dalam media MS. hara organik berupa sukrosa, vitamin, asam amino dan kompleks organik.
Zat pengatur tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (< 1 mM) mampu mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Santoso dan Nursandi 2003). ZPT dalam kultur jaringan secara garis besar dibagi atas dua yaitu auksin dan sitokinin. Menurut Collin dan Edward (1998) ZPT merupakan faktor yang sangat penting dalam keberhasilan kultur jaringan, baik untuk induksi kalus maupun mengatur arah diferensiasi sel. Auksin yang digunakan dalam penelitian ini adalah 24 D (2,4-dichlorophenoxy acetic acid), sitokinin BAP (6-benzenyl aminopurine), selain itu digunakan juga giberelin. Asam amino merupakan sumber nitrogen organik yang siap dipakai oleh sel tanaman. Oleh karena itu asam amino sering ditambahkan pada media kultur jaringan untuk pembentukan embrio somatik. Glycine dan casein hidrolisat adalah beberapa dari asam amino yang kadang diperlukan sebagai sumber nitrogen.
15 Kalus dapat diinisiasi dari hampir semua bagian tanaman tetapi organ yang berbeda menunjukkan kecepatan pembelahan sel yang berbeda pula. Membuat kalus berarti menginduksi dari bagian tanaman tertentu, biasanya dengan jalan dirangsang secara hormonal. Hormon yang paling banyak digunakan untuk induksi kalus adalah auksin. Hal ini juga diperkuat oleh Loiseau et al. (1995), Sharp et al. (1982), Baker dan Wetzstein (1995), serta Pierik (1987) dalam Santoso (2003). Penggunaan auksin dan sitokinin berupa 24 D dan BAP terbukti mampu membantu dalam induksi kalus.
Embriogenesis somatik merupakan istilah yang digunakan untuk menyatakan perkembangan embrio lengkap dari sel-sel vegetatif yang dihasilkan dari berbagai sumber eksplan yang ditumbuhkan pada sistem kultur jaringan. Selanjutnya Rice et al. (1992) dalam Zulkarnain (2009) menyatakan bahwa embriogenesis somatik merupakan teknik yang paling menjanjikan untuk perbanyakan dalam waktu cepat. Embrio-embrio somatik dapat muncul langsung dari permukaan eksplan.
Dengan kemunculan kalus yang rata-rata terjadi pada 4 MST sudah merupakan satu langkah yang sangat baik dalam kultur jaringan secara umum dan penelitian ini khususnya, karena satu titik tersulit dari proses inisisasi sudah dapat terlewati yaitu sterilisasi eksplan. Dari keseluruhan perlakuan kombinasi hormon pada penelitian ini media yang paling baik dan cocok untuk induksi kalus adalah pada perlakuan M10 yaitu kombinasi antara 1/5 MS + 1 BAP + 1 24 D + 2 ml Glycine + 200 mg Casein, berbeda dengan media pada 9 perlakuan yang sebelumnya yang menggunakan media ½ MS. Menurut Mansur (2007) umumnya Nepenthes hidup di tempat-tempat terbuka atau agak terlindung di habitat yang miskin unsur hara dan memiliki kelembaban udara cukup tinggi. Berdasarkan pernyataan tersebut kemudian pada perlakuan M10 digunakan media 1/5 MS dan hal ini sangat berdampak positif terhadap persentase eksplan yang hidup dan induksi kalus semakin tinggi mencapai 33,33%.
Apabila sudah terjadi kemunculan kalus, langkah selanjutnya adalah memindahkan kalus ke media tanam berbeda dan biasanya tanpa mengandung ZPT untuk kemudian kalus ini dapat berubah bentuk menjadi bipolar (tunas dan akar) sampai pada akhirnya dapat tumbuh menjadi tanaman yang lengkap.
SIMPULAN DAN SARAN
Simpulan
16
HgCl₂ 10 ml/100 ml selama 5 menit, clorox 5% selama 5 menit, dan pembilasan masing-masing 3 menit serta pembilasan akhir sebanyak 5 kali dengan durasi 3 menit yang mampu menghasilkan eksplan steril dan hidup sebesar 33,33%.
Penggunaan sitokinin BAP dan auksin 24 D terbukti mampu membantu dalam induksi kalus. Media tanam paling baik dan cocok untuk induksi kalus N. mirabilis adalah media 1/5 MS + 1 BAP + 1 24 D + 2 ml glycine + 200 mg casein.
Saran
Diperlukan penelitian lebih lanjut mengenai bahan sterilan, konsentrasi, dan durasinya untuk mematikan mikroba tanpa mematikan eksplan dan menciptakan eksplan yang mampu bertahan hidup hingga muncul kalus. Selain itu diperlukan tindaklanjut dari kemunculan kalus ini agar dapat dipindahkan pada media tanam yang baru sebagai media perkecambahan dan dapat menjadi sebuah penelitian yang sinergis sampai tanaman tersebut dapat diaklimatisasi.
DAFTAR PUSTAKA
Aishah MS, Rosli WIW. 2013. Effect of different drying techniques on the nutritional values of oyster mushroom (Pleurotus sajor-caju). Sains Malaysiana 42(7)(2013):937-941.
Cantika. 2006. Pengaruh jenis dan konsentrasi antibiotik terhadap kontaminasi dan perkembangan eksplan Heliconia psittacorum L.f cv. Lady Di [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Clarke C. 1997. Nepenthes of Borneo. Di dalam Natural History Publications Kota Kinabalu. Sabah (MY).
Clay K. 1988. Clavicipitaceous fungal endophytes of grasses coevolution and the change from parasitism to mutualism. Di dalam: Pirozinsky KA, Hawksworth, DL, editor. Coevolution of fungi with plant and animals. London (GB): Academic Pr.
Collin HA, Edwards. 1998. Plant Cell Culture. Singapore (SG): Bios Scientific. Darmono DW. 2003. Menghasilkan Anggrek Silangan. Jakarta (ID): Penebar
Gamborg OL, Shyluk JK. 1981. Nutrition, media and characteristic of Plant Cell and Tissue Culture. New York (US): Academic Pr.
17 Gunawan LW. 1987. Teknik Kultur Jaringan. Bogor (ID): Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor.
Hendaryono DPS, Wijayani. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern. Yogyakarta (ID): Kanisius.
Heryanto E. 1996. Rancangan Percobaan pada Bidang Pertanian. Ungaran (ID): Trubus Agriwidya
James, Pietropaolo P. 1986. Carnivorous Plants of The World. New York (US): Timber Pr.
Kobayashi DY, Palumbo JD. 2000. Bacterial endophytes and their effect on plant and uses in agriculture. Di dalam: Bacon CW, White JF, editor. Microbial Endophytes. New York (US): Marcel Dekker.
Leifert C, Cassels AC. 2001. Microbial hazard in plant tissue and cell cultures. In Vitro Cell,Dev. Biol. Plant. 37:133-138.
Mansur M. 2007. Nepenthes Kantong Semar yang Unik. Jakarta (ID): Penebar Swadaya.
Pancaningtyas S, Ismayadi C. 2011. Sterilisasi Ulang pada Perbanyakan Somatic Embryogenesis Kakao (Theobroma cacao L.) untuk Penyelamatan Embrio Terkontaminasi. Pelita Perkebunan. 27(1): 1-10.
Petrini O. 1992. Fungal endiphytes of tree leaves. Di dalam: Andrew JH, Hirano SS, editor. Microbial Ecology of Leaves. New York (US): Springer-Verlag. Purnamaningsih R. 2002. Regenerasi tanaman melalui embriogenesis somatik dan
beberapa gen yang mengendalikannya. Buletin AgroBio 5(2)
Purwanto AW. 2011. Budi Daya Ex-Situ Nepenthes Kantong Semar nan Eksotis. Yogyakarta (ID): Kanisius.
Sandra E. 2002. Kultur Jaringan Anggrek Skala Rumah Tangga. Jakarta (ID): AgroMedia Pustaka.
Santoso U, Nursandi F. 2003. Kultur Jaringan Tanaman. Malang (ID): UMM Pr. Wetter LR, Constabel F. 1991. Metode Kultur Jaringan Tanaman. Widianto MB,
editor. Bandung (ID): Penerbit ITB.
Wudianto R. 2002. Petunjuk Penggunan Pestisida. Jakarta (ID): Penebar Swadaya. Zulkarnain. 2009. Kultur Jaringan Tanaman: Solusi Perbanyakan Budi Daya.
18
Lampiran 1 Komposisi media Murashige dan Skoog
19 Lampiran 2 Konsentrasi media MS dan kombinasi hormon
Perlakuan Media
M1 1/2 MS
M2 1/2 MS + 1,5 BAP + 1 24D
M3 1/2 MS + 4 BAP + 0,5 24D
M4 1/2 MS + 4 BAP + 0,5 GA + 2ml gly + 200mg cas + 100ml air kelapa kemasan M5 1/2 MS + 8 BAP + 0,5 GA + 2ml gly + 200mg cas + 100ml air kelapa kemasan
M6 1/2 MS + 0,5 BAP + 0,5 24D
M7 1/2 MS + 0,5 BAP + 0,5 24D
M8 1/2 MS + 1,5 BAP + 0,5 24D + 2ml gly + 200mg cas
M9 1/2 MS + 1,5 BAP + 0,5 24D + 2ml gly + 200mg cas
20
22
Lampiran 4 Perlakuan sterilisasi eksplan A = Bahan sterilan:
23
Lampiran 4 Perlakuan sterilisasi eksplan (lanjutan) G = Bahan sterilan:
Detergen (1 gr/100 ml, 10'); Pembilasan (100 ml, 5'); Fungisida (1 gr/100 ml, 30'); Pembilasan (100 ml, 5'); Streptomycin (25 ml/100 ml, 21jam); Pembilasan (100 ml, 5'); HgCl (10ml/100ml, 8’); Pembilasan (100 ml, 5'); Bayclin 5% (5 ml/95 ml, 11'); Pembilasan akhir 5x (@ 100 ml, 3')
Media : 1/2 MS + 0,5 BAP + 0,5 24D H = Bahan sterilan:
Detergen (1 gr/100 ml, 10'); Pembilasan (100 ml, 5'); Fungisida (1 gr/100 ml, 30'); Pembilasan (100 ml, 5'); Streptomycin (25 ml/100 ml, 17jam); Pembilasan (100 ml, 5'); HgCl (10ml/100ml, 9’); Pembilasan (100 ml, 5'); Bayclin 5% (5 ml/95 ml, 10'); Pembilasan akhir 5x (@ 100 ml, 3')
Media : 1/2 MS + 1,5 BAP + 0,5 24D + 2ml gly + 200mg cas I = Bahan sterilan:
Detergen (1 gr/100 ml, 10'); Pembilasan (100 ml, 5'); Fungisida (1 gr/100 ml, 30'); Pembilasan (100 ml, 5'); Streptomycin (25 ml/100 ml, 21jam); Pembilasan (100 ml, 5'); HgCl (10ml/100ml, 10’); Pembilasan (100 ml, 5'); Bayclin 5% (5 ml/95 ml, 9'); Pembilasan akhir 5x (@ 100 ml, 3')
Media : 1/2 MS + 1,5 BAP + 0,5 24D + 2ml gly + 200mg cas J = Bahan sterilan:
24
Lampiran 5 Jadwal karantina tanaman
Senin Selasa Rabu Kamis Jumat Sabtu Minggu
Penyiraman √ √ √ √ √ √ √
Fungisida √ √ √
Bakterisida √ √ √
Antibiotik √ √ √ √
Lampiran 6 Kontaminan yang ditemukan selama pengamatan
Cendawan coklat 1 Cendawan coklat 2
Cendawan hitam 1 Cendawan hitam 2
Cendawan hitam 3 Cendawan hitam 4
25
Lampiran 6 Kontaminan yang ditemukan selama pengamatan (lanjutan)
Cendawan hitam 7 Cendawan hitam 8
Cendawan merah Cendawan putih 1
Cendawan putih 2 Cendawan putih 3
Cendawan putih 4 Cendawan putih 5
26
Lampiran 7 Rata-rata persentase eksplan yang terkontaminasi, mati, dan hidup pada setiap perlakuan
rata-rata 13,33333 73,33333 13,33333
G 1 30 60 10
2 0 90 10
3 30 50 20
∑ 60 200 40
rata-rata 20 66,66667 13,33333
H 1 80 10 10
2 80 0 20
3 40 30 30
∑ 200 40 60
27
Lampiran 7 Rata-rata persentase eksplan yang terkontaminasi, mati, dan hidup pada setiap perlakuan (lanjutan)
Lampiran 8 Rata-rata persentase eksplan pada setiap perlakuan
Parameter Perlakuan
rata-rata 73,33333 6,666667 20
J 1 50 0 50
2 50 0 50
3 90 10 0
∑ 190 10 100
28
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi, 26 Mei 1991 dan merupakan anak pertama dari 2 bersaudara pasangan H. Pem Evendye dan Hj. Ismawirta, SPAg. Penulis merupakan lulusan dari SD PIUS Payakumbuh pada tahun 2003, SMP Negeri 1 Payakumbuh pada tahun 2006, dan lulus dari SMA Negeri 2 Payakumbuh pada tahun 2009. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB pada tahun 2009 di Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan.