INDUKSI KANTONG DENGAN PERLAKUAN BERBAGAI
KONSENTRASI MEDIA Murashige & Skoog PADA
BEBERAPA UKURAN EKSPLAN KANTONG SEMAR
(Nepenthes gracilis Korth.) SECARA IN VITRO
FITRIYANA INSANI
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INDUKSI KANTONG DENGAN PERLAKUAN BERBAGAI
KONSENTRASI MEDIA Murashige & Skoog PADA
BEBERAPA UKURAN EKSPLAN KANTONG SEMAR
(Nepenthes gracilis Korth.) SECARA IN VITRO
FITRIYANA INSANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Departemen Konservasi Sumberdaya Hutan dan Ekowisata
Fakultas Kehutanan Institut Pertanian Bogor
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
RINGKASAN
FITRIYANA INSANI. Induksi Kantong dengan Perlakuan Berbagai Konsentrasi Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong Semar (Nepenthes gracilis Korth.) secara In Vitro. Dibimbing oleh EDHI SANDRA dan
YUPI ISNAINI.
Kantong semar merupakan salah satu jenis tumbuhan yang digolongkan menjadi tanaman hias unik yang memiliki kemampuan adaptasi terhadap lingkungan yang miskin hara dengan membentuk kantong (Mansur 2007). Salah satu Nepenthes yang memiliki kemampuan adaptasi cukup tinggi adalah
Nepenthes gracilis. Nepenthes memiliki manfaat sebagai tanaman obat dan tanaman hias unik. Keunikan ini terletak pada bagian kantong yang merupakan modifikasi dari tulang daun bagian tengah daun Nepenthes. Kantong sebagai bagian yang paling banyak dimanfaatkan merupakan suatu bentuk adaptasi yang dilakukan oleh Nepenthes, dan belum diketahui secara pasti cara induksi pembentukan kantong. Oleh karena itu, penelitian untuk mengetahui hal tersebut perlu dilakukan untuk mempelajari respon pembentukan kantong pada berbagai konsentrasi media dasar Murashige & Skoog dengan beberapa ukuran eksplan N. gracilis Korth. Penelitian ini bertujuan untuk mempelajari respon pembentukan kantong pada beberapa konsentrasi media dasar Murashige & Skoog (MS) dengan beberapa ukuran eksplan N. gracilis Korth.
Penelitian dilaksanakan pada bulan Juni hingga Desember 2012 di Laboratorium Kultur Jaringan, Pusat Konservasi Tumbuhan, Kebun Raya Bogor. Perlakuan dalam penelitian ini adalah konsentrasi media dasar MS dan ukuran eksplan. Konsentrasi media dasar MS yang digunakan adalah 1/2MS, 1/4MS, 1/8MS, 1/16MS dan 1/32MS. Eksplan N. gracilis yang digunakan berukuran < 2 cm, 2-4 cm dan > 4 cm. Pengamatan rutin dilakukan selama 12 MSP dan pengamatan visual dilakukan hingga bulan Desember 2012. Parameter pengukuran yang diamati setiap minggu adalah tinggi tanaman, jumlah daun dan jumlah kantong. Parameter pengukuran yang diamati pada akhir pengamatan yaitu warna daun, warna kantong, persentase planlet hidup dan berkantong.
Hasil penelitian menunjukkan bahwa konsentrasi media dasar MS dan ukuran eksplan berpengaruh terhadap pertambahan jumlah daun, tinggi eksplan, dan jumlah kantong. Konsentrasi media 1/2MS, 1/4MS pada ukuran eksplan < 2 cm dan media 1/8MS pada ukuran eksplan 2-4 cm merupakan perlakuan yang memberikan pengaruh paling baik pada pembentukan kantong.Perlakuan tersebut menunjukkan rata-rata pembentukan kantong terbanyak yakni 3,00-3,50 kantong.
Kata kunci : Kantong, Nepenthes gracilis, konsentrasi media MS, ukuran eksplan,
SUMMARY
FITRIYANA INSANI. Pitcher Induction with Various Concentration Treatments of Murashige & Skoog Medium on Multiple Size of Kantong Semar (Nepenthes gracilis Korth.) Explants using In Vitro Technique. Under Supervision of EDHI SANDRA and YUPI ISNAINI.
Nepenthes is a plant species which is classified as a unique ornamental plant that has the capability of adaptation to environments with poor nutrients by forming pitcher (Mansur 2007). Nepenthes gracilis is an example of Nepenthes
species with high capability of adaptation. Nepenthes have benefits as medicinal and unique ornamental plant. This uniqueness lies in the pitcher which is a modification of the center part of the leaf. Pitcher as the most widely used part is a form of adaptation by Nepenthes, and it is not yet known for certain how the induction of the formation of a pitcher. Therefore, the research to know the response of pitcher formation in various concentrations of Murashige & Skoog medium on multiple size of N. gracilis Korth explants is needed. The aim of this research is to study the response of pitcher formation on various concentration of Murashige & Skoog medium on multiple size of N. gracilis Korth explants.
This research was conducted on June until December 2012 at the Tissue Culture Laboratory, Center for Plant Conservation, Bogor Botanical Garden. The treatment in this study is the concentration of MS basic medium and explant size. The concentration of MS basic medium which is used are 1/2MS, 1/4MS, 1/8MS, 1/16MS and 1/32MS. The explant size of N. gracilis are < 2 cm, 2-4 cm and > 4 cm. Routine observations was done for 12 MSP and visual observations was done until December 2012. Parameter measurement which is observed every week are plant height, number of leaves and number of pitcher. Parameter measurement which is observed at the end of observation are the color of the leaf, the color of the pitcher, and the percentage of living and pitched planlet.
The result shows that the concentration of MS basic medium and explant size influenced the number of leaves, explant height, and the number of pitcher. The concentration of 1/2MS and 1/4MS with the explant size < 2 cm, and 1/8MS with explant size 2-4 cm are treatments that gave the best influence on the formation of pitchers. Those treatments shows the average of the highest pitcher formation which is 3,00 to 3,50 pitchers.
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul Induksi Kantong dengan Perlakuan Berbagai Konsentrasi Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong Semar (Nepenthes gracilis Korth.) secara In Vitro adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada
perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain
telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian
akhir skripsi ini.
Bogor, Februari 2013
Fitriyana Insani
Menyetujui,
Pembimbing I, Pembimbing II,
Ir. Edhi Sandra, M.Si Yupi Isnaini, S.Si, M.Si NIP. 196610 19 199303 1 002 NIP. 197112 27 200604 2 002
Mengetahui,
Ketua Departemen Konsevasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan Institut Pertanian Bogor
Prof. Dr. Ir. Sambas Basuni, MS. NIP. 195809 15 198403 1 003
Tanggal Lulus:
Judul Skripsi : Induksi Kantong dengan Perlakuan Berbagai Konsentrasi Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong Semar (Nepenthes gracilis Korth.) secara In Vitro
Nama : Fitriyana Insani
KATA PENGANTAR
Penulis memanjatkan puji dan syukur ke hadirat Allah SWT atas segala
curahan rahmat dan kasih sayang-Nya sehingga karya ilmiah ini berhasil
diselesaikan. Skripsi dengan judul Induksi Kantong dengan Perlakuan Berbagai
Konsentrasi Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong
Semar (Nepenthes gracilis Korth.) secara In Vitro dilaksanakan pada bulan Juni
hingga Desember.
Penulis mengucapkan terima kasih kepada Bapak Ir. Edhi Sandra, M.Si dan
Ibu Yupi Isnaini, S.Si, M.Si selaku pembimbing. Selain itu, terima kasih juga
penulis sampaikan kepada seluruh bapak dan ibu yang terdapat di Laboratorium
Kultur Jaringan Kebun Raya Bogor atas bantuannya selama penelitian
berlangsung. Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 08 Juni 1990 sebagai anak
kedua dari tiga bersaudara pasangan Abdullah Sani Asnawi dan Yuli Indrayati.
Riwayat pendidikan penulis yaitu pada tahun 2002 lulus dari SD
Muhamadiyah 1 Pangkal pinang dan melanjutkan pendidikan di SMP Negeri 1
Pangkal Pinang. Selanjutnya setelah lulus pada tahun 2005, penulis melanjutkan
pendidikan di SMA Negeri 1 Pemali dan lulus pada tahun 2008. Pada tahun yang
sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
dengan program studi Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas
Kehutanan.
Selama di IPB, penulis aktif di sejumlah organisasi kemahasiswaan.
Organisasi tersebut antara lain wakil bendahara Himpunan Mahasiswa Konservasi
Sumberdaya Hutan dan Ekowisata (HIMAKOVA) tahun 2009-2010, anggota Biro
Kekeluargaan HIMAKOVA (2010-2011), anggota Kelompok Pemerhati Flora
(KPF) Raflesia HIMAKOVA, anggota Divisi Kesekretariatan International Forestry Students’ Association (IFSA LC IPB) (2009-2010), Kepala Divisi Kesekretariatan IFSA LC IPB (2010-2011), panitia Bina Corp Rimbawan (BCR)
Fakultas Kehutanan tahun 2010, panitia Gebyar HIMAKOVA tahun 2009, dan
panitia International Forestry Students’ Symposium (IFSS) IFSA tahun 2009 di
Indonesia. Selain itu, penulis mengikuti Praktik Pengenalan Ekosistem Hutan
(PPEH) di Jalur Sancang Timur-Papandayan, Praktik Pengelolaan Hutan (PPH) di
Hutan Pendidikan Gunung Walat dan Praktik Kerja Lapang (PKL) di Taman
Nasional Kelimutu, Ende, Flores, Nusa Tenggara Timur.
Untuk memperolah gelar Sarjana Kehutanan IPB, penulis menyelesaikan
skripsi dengan judul Induksi Kantong dengan Perlakuan Berbagai Konsentrasi
Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong Semar
(Nepenthes gracilis Korth.) secara In Vitro dibawah bimbingan Ir. Edhi Sandra,
UCAPAN TERIMA KASIH
Penulisan skripsi dengan judul Induksi Kantong dengan Perlakuan Berbagai
Konsentrasi Media Murashige & Skoog pada Beberapa Ukuran Eksplan Kantong
Semar (Nepenthes gracilis Korth.) secara In Vitro ini akhirnya dapat penulis
selesaikan dengan baik. Tersusunnya skripsi ini adalah atas bantuan dan dorongan
dari berbagai pihak, oleh sebab itu penulis mengucapkan terima kasih kepada:
1. Keluarga tercinta Abdullah Sani Asnawi, Yuli Indrayati, Zahir Insani dan
Nia Darniati, Zahrotunissa Insani dan Caesar Fildza Ramadhan yang
senantiasa mendukung penulis dengan doa, motivasi dan dukungan.
2. Bapak Ir. Edhi Sandra, M.Si selaku dosen pembimbing I dan ibu Yupi
Isnaini, S.Si, M.Si selaku dosen pembimbing II atas bimbingan selama ini.
3. Ibu Eva Rachmawati S.Hut, M.Si selaku moderator pada seminar, bapak
Dr. Ir. Tutut Sunarminto, M.Si selaku ketua sidang dan ibu Dr. Ir. Arum
Sekar Wulandari, MS selaku dosen penguji atas masukan dan sarannya.
4. Seluruh staf Laboratorium Kultur Jaringan Pusat Konservasi Tumbuhan
Kebun Raya Bogor.
5. Seluruh staf Laboratorium Konservasi Tumbuhan Departemen Konservasi
Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan Institut Pertanian
Bogor.
6. Teman seperjuangan Tantri Andari atas kebersamaanya selama penelitian.
7. Sahabat-sahabatku Ajeng Miranti Putri, Soraya Nurul Ichwani, Ririn
Rihatni, Siti Munawaroh, Nur Sofia Wardani Yahya, Dina Oktavia, Rina
Lumbantobing, Rissa Rahmadwiati, Edelweis 45 dan Fahutan 45.
8. Bayu Pradana yang telah mendampingi dan memotivasi selama penelitian
serta penulisan skripsi.
9. Serta banyak pihak yang telah membantu penulis dan tidak dapat penulis
sebutkan satu-persatu.
Semoga tersusunnya skripsi ini dapat bermanfaat bagi penulis dan pihak lain
yang memerlukannya.
Bogor, Februari 2013
DAFTAR ISI
3.3 Pelaksanaan Penelitian ... 11
3.3.1 Sterilisasi alat ... 11
3.3.2 Pembuatan media tanam ... 11
3.3.3 Penanaman/subkultur ... 12
3.4 Rancangan Percobaan ... 14
3.5 Analisis Data ... 14
BAB IV HASIL DAN PEMBAHASAN 4.1 Pertambahan Jumlah Daun ... 17
4.2 Pertambahan Tinggi ... 19
4.3 Jumlah Kantong yang Terbentuk ... 20
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 26
5.2 Saran ... 26
DAFTAR TABEL
No. Halaman
1 Morfologi warna daun dan kantong dengan bagan warna daun
(BWD)... 13 2 Kombinasi perlakuan konsentrasi media MS dan ukuran
eksplan... 14
3 Pengaruh perbedaan konsentrasi media terhadap rata-rata
pertambahan jumlah daun N. gracilis... 17 4 Rata-rata pertambahan jumlah daun (helai/minggu) pada
berbagai perlakuan... 17
5 Persentase warna daun pada planlet N. gracilis pada MSP
12... 19
6 Pengaruh ukuran eksplan N. gracilis terhadap rata-rata jumlah
kantong yang terbentuk... 21 7 Rata-rata jumlah kantong yang terbentuk pada berbagai
perlakuan... 21
8 Persentase planlet hidup dan berkantong N. gracilis pada setiap
DAFTAR GAMBAR
No. Halaman
1 Batang (A) dan daun N. gracilis (B)... 4
2 Bunga jantan N.maxima (A) dan bunga betina N. spathulata (B) (Rice 2006)... 5
3 Kantong N. gracilis yang berwarna merah maron dan hijau... 6
4 Buah (A) dan biji Nepenthes (B)... 6
5 Bahan tanam N.gracilis (A) dan komponen media dasar MS yang digunakan (B)... 11
6 Bagan warna daun (BWD)... 13
7 Kontaminasi pada botol perlakuan... 17
8 Daun yang tumbuh setelah ditanam pada media perlakuan... 19
9 Pertambahan tinggi planlet per perlakuan... 20
10 Ukuran kantong masing-masing konsentrasi media pada 12 MSP... 23
DAFTAR LAMPIRAN
No. Halaman
1 Komposisi media Murashige & Skoog... 31
2 Sidik ragam pertambahan jumlah daun N. gracilis... 32
3 Sidik ragam pertambahan tinggi eksplan N. gracilis... 32
4 Sidik ragam jumlah kantong N. gracilis... 32
BAB I PENDAHULUAN
1.1 Latar Belakang
Kantong Semar, Pitcher plant atau Nepenthes yang memiliki banyak
sebutan di beberapa daerah seperti Periuk Monyet (Riau), Kantong Beruk (Jambi),
Ketakung (Bangka), dan Sorok Raja Mantri (Jawa Barat) merupakan salah satu
jenis tumbuhan yang digolongkan menjadi tanaman hias unik (Mansur 2007).
Kantong semar yang kebanyakan berasal dari Indonesia ini memiliki bentuk,
ukuran, dan corak warna kantong yang unik. Nepenthes gracilis merupakan salah
satu jenis dengan keunikan berupa bentuk kantong yang langsing (bentuk
pinggang) dengan kemampuan adaptasi lingkungan cukup tinggi (Mansur 2007).
Kantong semar umumnya hidup di tempat-tempat yang miskin unsur hara
dan memiliki kelembapan yang cukup tinggi. N. gracilis dapat hidup di hutan
dataran rendah, hutan rawa gambut, dan hutan kerangas pada ketinggian 0-1100
mdpl (Hernawati & Akhriadi 2006; Mansur 2007). Bentuk adaptasi yang
dilakukan oleh Nepenthes adalah dengan pembentukan kantong.
Kantong yang keluar dari bagian ujung daun menjadi daya tarik tersendiri
dalam pemanfaatan tumbuhan tersebut. Hal ini dapat dilihat dari perhatian
masyarakat terhadap jenis tersebut lebih besar dibandingkan dengan jenis lain
yang dipasarkan. Dari keseluruhan jenis yang dipasarkan secara terbatas di
Garden Shop dan Griya Anggrek Kebun Raya Bogor, 25% perhatian masyarakat
tertuju pada Nepenthes hasil perbanyakan yang telah dikemas (Isnaini 2011).
Selain sebagai tanaman hias, Nepenthes juga dapat dijadikan obat dari penyakit
tertentu. Cairan dalam kantong muda yang masih tertutup dapat mengobati batuk,
kulit yang terbakar dan sebagai obat mata (Mansur 2007). Air rebusan akar
N.gracilis di wilayah Semenanjung Malaysia digunakan untuk mengobati disentri
dan sakit perut (Astuti et al. 2003). Batang tumbuhan ini juga biasa digunakan
sebagai bahan pengikat dengan kekuatan yang hampir sama dengan rotan (Heyne
1987). Selain manfaat tersebut, sebagai tanaman yang biasa tumbuh merambat di
2
tanah di dalam hutan, Nepenthes dapat berfungsi menjaga kelembaban tanah,
mencegah erosi pada lantai hutan, dan juga dapat menjadi naungan bagi anakan
tanaman lain yang baru tumbuh.
Potensi sebagai tanaman hias dan manfaat lain yang dimiliki oleh Nepenthes
menjadikannya tanaman yang cukup banyak dicari. Akibatnya, keberadaannya di
alam menjadi terancam karena banyaknya ancaman berupa kebakaran hutan dan
lahan, konversi lahan dan pelebaran jalan (Hernawati & Akhriadi 2006). Oleh
karena itu, seluruh spesies kantong semar memiliki status perlindungan
Appendiks II CITES dan pada PP No. 7 tahun 1999 tentang pengawetan jenis
tumbuhan dan satwa termasuk ke dalam jenis tumbuhan yang dilindungi (CITES
2012; DEPHUT 1999).
Perbanyakan Nepenthes dapat dilakukan dengan biji, stek batang dan
pemisahan anakan (Mansur 2007; Handoyo & Sitanggang 2006). Namun, ketiga
cara tersebut memiliki kelemahan pada sedikitnya jumlah anakan yang dihasilkan.
Perbanyakan lain yang dapat dijadikan alternatif adalah kultur jaringan. Kultur
jaringan (in vitro) memiliki kelebihan yakni dengan sejumlah kecil bahan material
awal dapat dihasilkan banyak klon dengan sifat genetik identik antara satu dan
lainnya (Zulkarnain 2009).
Kantong pada Nepenthes merupakan daya tarik dalam pemanfaatannya, baik
sebagai tanaman hias maupun tanaman obat-obatan. Namun, cara induksi
pembentukan kantong belum diketahui secara pasti. Penelitian terkait kantong pun
lebih kepada cairan yang ada di dalam kantong (Yogiara 2004). Oleh karena itu,
diperlukan penelitian untuk mengetahui cara menginduksi kantong pada
Nepenthes dengan membuat kondisi seperti habitat aslinya agar kantong
terbentuk.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari respon pembentukan kantong
pada berbagai modifikasi konsentrasi media dasar Murashige & Skoog dengan
beberapa ukuran eksplan N. gracilis.
1.3 Hipotesis Penelitian
3
1. Terdapat pengaruh modifikasi konsentrasi media dasar MS yang
diberikan terhadap pembentukan kantong pada kultur N. gracilis.
2. Terdapat pengaruh ukuran eksplan N. gracilis terhadap pembentukan
kantong pada kultur N. gracilis.
3. Terdapat interaksi antara modifikasi konsentrasi media dasar MS dan
BAB II
TINJAUAN PUSTAKA
2.1 Botani dan Morfologi
Kantong semar merupakan tumbuhan tahunan memanjat yang memiliki
kantong berupa periuk di ujung daun-daun sebagai bentuk adaptasi terhadap
lingkungannya. Tumbuhan dikotil ini dapat diklasifikasikan sebagai berikut
(Suhono et al. 2010):
Kingdom : Plantae
Divisi : Magnoliophyta
Subdivisi : Magnoliophyta
Class : Choripetaleae
Ordo : Caryophyllales
Famili : Nepenthaceae
Genus : Nepenthes
Spesies : N. gracilis Korth.
Jenis ini merupakan tumbuhan memanjat dengan tinggi 2-5 m. Batang
berbentuk segitiga, berdiameter 2-4 mm, dengan sudut daun berbentuk bulat,
dengan sayap selebar 1-3,5 mm, dan panjang ruas 2,5-9 cm. Daun tidak
bertangkai, posisi duduk, dengan panjang 12-19 cm (Gambar 1). Lebar daun
1,5-3,7 cm dengan bentuk lanset, panjang sulur 15 cm, ujung daun runcing dan sayap
batang agak ramping pada pangkal daun (Cheek & Jebb 2001).
(A) (B)
5
Nepenthes termasuk jenis tanaman berumah dua, yaitu tanaman dengan
bunga jantan dan bunga betina yang terpisah (Suhono et al. 2010) (Gambar 2).
Bunga pada Nepenthes memiliki 4 sepal tetapi tidak memiliki petal. Bunga jantan
memiliki sebuah lajur dengan sebuah ulir kepala putik pada bagian ujung,
sedangkan bunga betina memiliki sebuah indung telur elipsoid yang terbagi ke
dalam empat bilik (Clarke 2001).
Gambar 2 Bunga jantan N.maxima (A) dan bunga betina
N. spathulata (B) (Rice 2006).
Kantong N.gracilis berwarna hijau, merah maron, atau terkadang coklat
kemerah-merahan (Mansur 2007). Kantong bawah berbentuk oval, bagian atas
silindris, lebar pada bagian tengah atas dengan ukuran 1,4-2,4 cm, lebar pada
bagian tengah bawah dengan ukuran 1,7-3,7 cm, terdapat dua sayap tepi dengan
lebar 3-5 mm, panjang struktur tepi 1-2,5 mm, bagian tengah 0,5-2 mm, mulut
kantong berbentuk oval, dengan bibir berbentuk silindris, lebar 0,5 mm (Gambar
3). Kantong atas N.gracilis sama dengan kantong bawah namun setengah silindris
dan mengecil pada bagian pinggang, dengan panjang 7-14,5 cm dan lebar 1,8-4
cm. Lebar pada bagian basal hampir sampai 1,5-2,9 cm pada bagian pinggang
6
Gambar 3 Kantong N. gracilis yang berwarna merah maron dan hijau.
2.2 Penyebaran dan Habitat
N. gracilis Korth merupakan salah satu jenis yang tersebar di Thailand,
Semenanjung Malaysia, Singapura, Sulawesi, Kalimantan dan Sumatera. Habitat
yang dimiliki oleh N. gracilis adalah di hutan dataran rendah, hutan rawa gambut,
hutan kerangas, di bagian tepi gambut atau daerah yang sudah terganggu seperti
tepi jalan, dan tanah yang miskin hara (Cheek & Jebb 2001).
2.3 Perbanyakan Nepenthes
Nepenthes dapat diperbanyak dengan cara pemisahan anakan, stek batang
dan juga dengan cara penyemaian biji (Handoyo & Sitanggang 2006). Buah
Nepenthes terdiri dari empat bilik dimana terdapat retakan sepanjang garis tepi
saat buah masak untuk mengeluarkan biji yang berbentuk seperti kawat (Clarke
2001). Bijinya berukuran kecil dan tipis mirip benang (filamen) (Gambar 4).
Gambar 4 Buah (A) dan biji Nepenthes (B).
Selain perbanyakan secara konvensional yang telah disebutkan di atas,
Nepenthes juga dapat diperbanyak dengan kultur jaringan.
7
2.4 Kultur Jaringan pada Nepenthes
Saat ini, pembudidayaan tumbuhan tidak hanya dilakukan secara
konvensional saja namun juga telah menggunakan cara in vitro atau kultur
jaringan. Kultur jaringan merupakan suatu metode untuk mengisolasi bagian dari
tumbuhan seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta
menumbuhkannya dalam kondisi aseptik, sehingga bagian tersebut dapat
beregenerasi menjadi tanaman yang lengkap kembali (Gunawan 1987). Teori
yang mendasari kultur jaringan adalah sifat totipotensi yang dimiliki oleh sel
tanaman. Totipotensi sel adalah kemampuan sel organ tanaman untuk tumbuh
menjadi tanaman yang sempurna dan utuh saat ditempatkan pada lingkungan yang
sesuai untuk tumbuh.
Kultur jaringan memiliki beberapa keuntungan dan kelebihan jika
dibandingkan dengan teknik perbanyakan secara konvensional. Keuntungan
tersebut antara lain banyak jumlah klon yang dapat dihasilkan dari sejumlah kecil
material awal yang dimiliki, faktor-faktor lingkungan dapat dimanipulasi untuk
mengatasi jenis tanaman yang resisten terhadap perbanyakan konvensional, teknik
ini tidak bergantung pada musim dan memungkinkan untuk pertukaran bahan
tanaman di tingkat internasional. Kelebihan-kelebihan yang dimiliki tersebut
tentunya memberikan manfaat tersendiri selain manfaat utama dari aplikasi teknik
kultur jaringan tanaman yakni perbanyakan massal dari tanaman yang memiliki
sifat genetik identik antara satu dan lainnya (Zulkarnain 2009).
Kultur jaringan memiliki banyak aspek yang mempengaruhi
keberhasilannya dan perkembangan tumbuhan yang dikulturkan. Aspek-aspek
tersebut antara lain cara budidayanya, eksplan yang digunakan, bahan sterilisasi,
kandungan unsur kimia dalam media, hormon yang digunakan, substansi organik
yang ditambahkan dan terang gelapnya saat inkubasi. Komposisi media bagi
pertumbuhan eksplan merupakan aspek yang paling banyak diteliti dan dicoba
(Hendaryono & Wijayani 1994).
Perbanyakan Nepenthes dengan kultur jaringan belum banyak dilakukan.
Publikasi mengenai penelitian terkait kultur jaringan Nepenthes juga belum
banyak ditemukan. Penelitian yang telah ada diantaranya penelitian pada jenis N.
8
mirabilis (Khompat et al. 2007), N. rafflesiana (Rahayu & Isnaini 2009; Kunita
2011), N. macfarlanei (Chua & Henshaw 1999) dan N. gracilis (Isnaini &
Handini 2007; Fong 2008).
Penelitian jenis N. khasiana yang dilakukan oleh Rathore et al. (1991)
sebanyak 80% tunas dalam kultur in vitro memiliki akar pada media MS dengan
penambahan 2 mg/l NAA dan 0,1 mg/l kinetin. Penelitian yang dilakukan Latha &
Seeni (1994) menghasilkan kantong pada ujung daun jenis tersebut dari tunas
yang ditanam pada media WPM (Woody Plant Medium) ditambah 2.7 μM NAA.
Menurut Nongrum et al. (2009), kantong N. khasiana ditemukan baru
berkembang pada 150 hari setelah penanaman dalam botol kultur yang disemai
pada media 1/4MS tanpa penambahan zat pengatur tumbuh. Kantong yang sehat
dan berkembang dengan baik terlihat pada hari ke-120 kultur pada media 1/4MS
ditambah 2.68 μM NAA.
Bagian yang diteliti pada jenis N. mirabilis adalah biji yang telah dewasa
dan tunasnya. Menurut Khompat et al. (2007), biji N. mirabilis yang dikulturkan
pada media padat MS dengan 3 mg/l BA di bawah lampu inkubasi menghasilkan
kecambah terbanyak yakni 26% dengan perkembangan semaian yang baik.
Multiplikasi tunas dapat dikembangbiakan pada semua konsentrasi BA (1, 3 dan 5
mg/l) setelah 6 minggu pemindahan dan semakin tinggi konsentrasi BA maka
tunas yang dihasilkan semakin banyak.
Media dasar 1/2MS dengan penambahan 5 μM BAP digunakan untuk
multiplikasi tunas N. macfarlanei dari semaian kotiledonnya. Semaian dari
kotiledon menghasilkan tunas lebih banyak dibandingkan dengan menggunakan
tunas apikal dan bagian nodal (Chua & Henshaw 1999). Chua dan Henshaw
(1999) juga menyebutkan bahwa media 1/2MS ditambah dengan berbagai
konsentrasi NAA baik digunakan untuk pertumbuhan akar pada pucuk.
Pada jenis N. rafflesiana telah dilakukan penelitian mengenai induksi
kantong dengan perlakuan perbedaan konsentrasi media dengan ukuran wadah
(Rahayu & Isnaini 2009) dan modifikasi konsentrasi media dengan pH yang
digunakan (Kunita 2011). Rahayu dan Isnaini (2009) menyebutkan bahwa pada
media dasar 1/2MS menghasilkan jumlah daun dan kantong yang paling banyak
9
dengan konsentrasi 1/4MS dan 1/8MS kantong yang terbentuk memiliki ukuran
yang lebih besar. Perbedaan ukuran wadah yang digunakan dalam penelitian
tersebut tidak terlalu memberikan dampak yang signifikan terhadap jumlah daun
dan kantong. Penelitian Kunita (2011) juga menunjukan hasil yang sama yakni
pada media 1/2MS dan 1/8MS dengan perlakuan pH pada media yang digunakan.
Penelitian jenis N.gracilis yang telah dilakukan yakni perkecambahan biji,
perbesarannya dan induksi poliploid. Hasil penelitian Isnaini dan Handini (2007)
menunjukan bahwa media terbaik untuk perkecambahan biji dan pembesaran
N.gracilis adalah media dasar 1/4MS. Penelitian induksi poliploid yang dilakukan
oleh Fong (2008) menunjukkan dampak awal yang mungkin terjadi pada
N.gracilis adalah pertumbuhan tunas yang terhambat dan penyimpangan
morfologi. Ukuran panjang dan lebar stomata yang terbentuk pada tetraploid lebih
besar dibandingkan dengan diploidnya. Namun, jumlah stomata pada tetraploid
lebih sedikit dibandingkan dengan diploidnya. Fong (2008) juga menyebutkan
bahwa kromosom N.gracilis yang terbentuk memiliki ukuran yang kecil namun
BAB III
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan, Pusat Konservasi
Tumbuhan Kebun Raya Bogor. Penelitian dilakukan dari bulan Juni-Desember
2012. Pengamatan rutin dilakukan selama 4 (empat) bulan yakni bulan
Juni-September 2012. Namun, pengamatan visual tetap dilakukan hingga bulan
Desember 2012.
3.2 Alat dan Bahan Penelitian
Alat yang digunakan untuk pembuatan media antara lain gelas piala, gelas
ukur biasa, pipet volumetrik, neraca analitik, pH meter, panci, pengaduk,
autoclave, karet gelang, timbangan analitik, magnetic stirer, labu erlenmeyer,
botol kultur, dan alumunium foil. Proses penanaman menggunakan alat-alat antara
lain scalpel, tisu, cawan petri, pisau, pinset, lampu Bunsen, laminar air flow
cabinet,dan wrap plastic. Alat untuk pengamatan diantaranya alat tulis, tally
sheet, dan kamera.
Bahan tanam (eksplan) yang digunakan adalah kultur kantong semar
(Nepenthes gracilis Korth) koleksi Laboratorium Kultur Jaringan, Pusat
Konservasi Tumbuhan, Kebun Raya Bogor, yang berasal dari pulau Batam dan
telah disubkultur secara in vitro dengan ukuran < 2 cm, 2-4 cm dan > 4 cm pada
media dasar 1/2MS (Gambar 5a). Media dasar yang digunakan adalah media
Murashige & Skoog dengan berbagai konsentrasi yakni 1/2MS, 1/4MS, 1/8MS,
1/16MS dan 1/32MS. 1/2MS berarti bahwa seluruh komponen unsur yang
terkandung dalam media dasar seperti unsur makro, mikro, vitamin (Gambar 5b)
dan gula berjumlah setengah dari konsentrasi keseluruhan pada media dasar MS
11
Gambar 5 Bahan tanam N.gracilis (A) dan komponen media dasar MS yang digunakan (B).
3.3 Pelaksanaan Penelitian 3.3.1 Sterilisasi alat
Peralatan berupa botol kultur, cawan petri, scalpel, pinset dicuci dengan
menggunakan detergen untuk menghilangkan kotoran yang masih melekat pada
peralatan tersebut. Setelah dicuci dan dibersihkan kemudian botol dan peralatan
dibilas dengan air. Peralatan tersebut kemudian ditiriskan untuk menghilangkan
sisa air dengan posisi terbalik (mulut botol berada di bawah). Khusus unttuk
peralatan berbahan besi, setelah pembilasan sebaiknya langsung dikeringkan
dengan menggunakan tisu untuk menghindari timbulnya karat.
Sterilisasi selanjutnya menggunakan autoclave. Peralatan dimasukkan ke
dalam autoclave dengan penataan yang sesuai. Botol kultur disusun dengan rapi
dan rapat dalam kondisi terbalik. Sterilisasi peralatan dilakukan selama satu jam
pada suhu 121ºC dan tekanan 1 atm. Kemudian peralatan tersebut disimpan di
dalam oven.
3.3.2 Pembuatan media
Media dasar Murashige & Skoog (MS) dibuat menjadi beberapa modifikasi
konsentrasi tanpa penambahan zat pengatur tumbuh (ZPT) (Lampiran 1).
Pembuatan media modifikasi konsentrasi sebanyak 1 liter pada masing-masing
modifikasi dilakukan dengan cara pengenceran bertingkat. Pertama-tama dibuat
media MS penuh dengan mencampurkan seluruh komponen unsur makro, mikro,
vitamin dan gula misalnya didapatkan volume larutan sebanyak 500 ml. Volume
tersebut kemudian dibagi menjadi dua bagian masing-masing 250 ml yang
kemudian salah satunya ditambahkan aquades hingga mencapai volume total 1
12
liter. Media tersebut merupakan media dengan konsentrasi 1/2 MS. Volume media
sebanyak 250 ml yang masih tersisa dibagi lagi menjadi dua bagian menjadi 125
ml yang kemudian salah satunya ditambah aquades hingga volume total 1 liter.
Media tersebut merupakan media dengan konsentrasi 1/4 MS. Volume yang
masih tersisa diencerkan kembali hingga didapat keseluruhan modifikasi
konsentrasi.
Modifikasi konsentrasi media yang telah didapat kemudian diukur pH
dengan menggunakan pH meter. Tingkat keasaman yang digunakan adalah 5,7.
Jika pH pada pengukuran awal lebih tinggi maka larutan ditetesi dengan HCL 0,1
N, sedangkan apabila pH awal lebih rendah maka larutan ditetesi dengan KOH 0,1
N hingga didapat pH yang digunakan pada penelitian.
Sebelum pemanasan, masing-masing modifikasi konsentrasi media
ditambahkan terlebih dahulu agar gelrite sebanyak 2,01 mg/l. Setelah mendidih,
larutan dituang ke dalam botol kecil masing-masing sebanyak 20 ml kemudian
ditutup dengan alumunium foil berukuran 10 cm × 10 cm dan diikat dengan karet
gelang.
Langkah sterilisasi media dasar dan perlakuan hampir sama dengan
sterilisasi alat. Sterilisasi dilakukan dengan autoclave pada suhu 121ºC dan
tekanan 1 atm selama 15 menit. Media yang telah steril kemudian disimpan di
dalam ruang media dan dibiarkan selama 3 hari untuk memastikan tidak terjadi
kontaminasi pada media tanam.
3.3.3 Penanaman/subkultur
Bahan dan alat penanaman disiapkan dalam laminar air flow cabinet. Bahan
tanam (eksplan) berupa planlet N.gracilis dikeluarkan dari botol kultur dan
dipindahkan ke cawan petri untuk dibersihkan akar tanaman dengan
menggunakan gunting kultur. Eksplan tersebut kemudian ditanam pada media
perlakuan. Sebelum botol ditutup, bagian bibir botol dan tutup aluminium foil
terlebih dahulu dibakar dengan lampu bunsen untuk mencegah kontaminasi.
Proses penanaman dilakukan dengan cepat dan hati-hati karena semakin lama
botol terbuka, semakin besar pula peluang kontaminan masuk ke dalam botol.
Selain itu, Nepenthes mudah layu sehingga semakin singkat proses penanaman
13
3.3.4 Pengamatan
Pengamatan dilakukan setiap minggu selama dua belas minggu setelah
penanaman (MSP) untuk parameter tinggi tanaman, jumlah daun, dan jumlah
kantong. Parameter lain berupa warna daun dan kantong, persentase planlet hidup
dan persentase planlet berkantong dilakukan pada minggu terakhir pengamatan.
a. Tinggi tanaman (cm): diukur dari pangkal sampai titik tumbuh
b. Jumlah daun (helai): dihitung jumlah daun yang terbentuk pada setiap
eksplan
c. Jumlah kantong (buah): dihitung jumlah kantong yang terbentuk pada setiap
eksplan
d. Warna daun dan kantong diamati secara kualitatif seperti pada Tabel 1.
Tabel 1 Morfologi warna daun dan kantong dengan bagan warna daun (BWD)
Morfologi BWD
Pengukuran warna daun dilakukan dengan menggunakan bagan warna daun
(BWD) seperti pada Gambar 6.
Sumber: Anonim (2012)
Gambar 6 Bagan warna daun (BWD).
e. Persentase planlet hidup (%): dihitung dari total eksplan yang hidup per
14
f. Persentase planlet berkantong (%): dihitung dari total eksplan yang
berkantong per total keseluruhan eksplan setiap kombinasi perlakuan
kemudian dikali 100%.
3.4 Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah
Rancangan Faktorial dengan Acak Lengkap (RAL-F). Jumlah faktor dalam
penelitian ini terdiri dari konsentrasi media dasar dan ukuran planlet. Kombinasi
perlakuan digunakan sebanyak 15 kombinasi dengan 3 ulangan sehingga didapat
45 unit percobaan. Satu unit percobaan terdapat 4 botol yang masing-masing botol
ditanam 1 planlet. Jumlah total botol kombinasi yang digunakan dalam penelitian
ini adalah sebanyak 180 botol. Kombinasi perlakuan dapat dilihat pada Tabel 2.
Tabel 2 Kombinasi perlakuan konsentrasi media MS dan ukuran eksplan
Media MS Ukuran eksplan
Adapun model umum faktorial tersebut adalah sebagai berikut (Mattjik &
Sumertawijaya 2002) :
dan ukuran eksplan ke-j pada ulangan ke-k
µ : Rataan nilai tengah populasi
Ai : Pengaruh faktor perbedaan modifikasi konsentrasi media dasar MS ke-i
Pj : Pengaruh ukuran eksplan ke-j
15
(AP)ij : Pengaruh interaksi antara perbedaan modifikasi konsentrasi media dasar
MS ke-i dan ukuran eksplan ke-j
Ɛijk : Nilai galat/error percobaan pada modifikasi konsentrasi media dasar MS
ke-i dan ukuran eksplan ke-j pada ulangan ke-k
Data yang diperoleh dari hasil pengamatan diolah dengan menggunakan uji F
pada SAS (Statistical Analysis System) dan SPSS 17.0. Perlakuan yang
berpengaruh nyata pada uji F diuji lanjut dengan menggunakan DMRT (Duncan
BAB IV
HASIL DAN PEMBAHASAN
Pemilihan media yang tepat untuk kultur jaringan dipengaruhi oleh
komponen penyusun media tersebut yang disesuaikan dengan pertumbuhan
tanaman yang dikulturkan. Media yang digunakan dalam penelitian ini adalah
media MS (Murashige & Skoog) dengan berbagai perbedaan konsentrasi media.
Media MS merupakan jenis media yang digunakan untuk hampir semua jenis
kultur, terutama tanaman herbaceus (Gunawan 1987). Pada proses membuatan
media tanam, media dengan konsentrasi 1/8 MS, 1/16MS dan 1/32MS tidak
mengalami pemadatan. Hal ini terjadi terkait dengan sifat yang dimiliki oleh agar
gelrite dengan jumlah unsur yang terdapat dalam media. Gunawan (1987)
menyebutkan bahwa gelrite memiliki sifat yang berlainan dengan agar. Kekerasan
gel pada gelrite dipengaruhi oleh kehadiran garam-garam seperti NaCl, KCl,
MgCl2.6H2O dan CaCl2. Garam NaCl dan KCl menurunkan kekerasan gel
sedangkan MgCl2 dan CaCl2 meningkatkan kekerasan gel. Komposisi media MS
(Lampiran 1) mengandung unsur makro berupa CaCl2.2H2O yang mempengaruhi
kekerasan gel. Diduga pada konsentrasi media 1/8MS, kurangnya jumlah CaCl2
mulai mempengaruhi kekerasan gel pada media tanam. Media yang tidak
mengalami pemadatan tersebut tetap digunakan dalam penelitian ini dan hingga
akhir pengamatan eksplan yang ditanam pada media tersebut tetap dapat tumbuh
dengan baik.
Hasil penelitian menunjukkan bahwa planlet tumbuh dengan baik hingga
akhir pengamatan (12 minggu setelah penanaman). Namun, terdapat kontaminasi
sebesar 1,67% yang terjadi pada minggu kedua setelah penanaman (Gambar 7).
Terjadinya kontaminasi diduga karena beberapa hal, antara lain kurang sterilnya
ruang tanam maupun laminar air flow cabinet saat digunakan, dan kurangnya
kebersihan penanam pada saat penanaman. Kontaminasi yang ditemukan selama
penelitian adalah jamur (cendawan). Kultur yang terkontaminasi ini ditandai
dengan munculnya benang-benang hifa pada media. Menurut Gunawan (1992)
17
yang mengandung gula, vitamin dan mineral dapat mendukung pertumbuhan
kontaminan dengan cepat apabila faktor penyebab kontaminasi tidak dihilangkan.
Gambar 7 Kontaminasi pada botol perlakuan.
4.1 Pertambahan Jumlah Daun
Perbedaan konsentrasi media sebagai faktor tunggal memberikan pengaruh
terhadap pertambahan jumlah daun N. gracilis (Tabel 3).
Tabel 3 Pengaruh perbedaan konsentrasi media terhadap rata-rata pertambahan jumlah daun N. gracilis
Media Pertambahan jumlah daun (helai/minggu)
1/2MS 2,556a
1/4MS 2,3144ab
1/8MS 2,1389ab
1/16MS 1,7967ab
1/32MS 1,4633b
Keterangan: Nilai yang diikuti oleh huruf yang sama menunjukan tidak beda nyata pada taraf 95%
Kombinasi perlakuan antara perbedaan konsentrasi media dengan ukuran
eksplan berpengaruh terhadap pertambahan jumlah daun. Jika dilihat secara
keseluruhan, semakin kecil konsentrasi media MS maka semakin sedikit
pertambahan jumlah daunnya (Tabel 4). Nilai pertambahan daun terendah sebesar
1,06 helai/minggu yakni pada media 1/16MS ukuran eksplan > 4 cm dan tertinggi
adalah 3,00 helai/minggu yakni media 1/2MS dengan ukuran eksplan < 2 cm.
Tabel 4 Rata-rata pertambahan jumlah daun (helai/minggu) pada berbagai perlakuan
Media
Pertambahan jumlah daun (helai/minggu) pada ukuran
eksplan Rata-rata
18
Hasil penelitian juga menunjukkan bahwa pada media MS dengan
konsentrasi ½ (1/2MS) pada keseluruhan ukuran eksplan memiliki pertambahan
jumlah daun yang tidak berbeda jauh yakni 2,1-3 helai/minggu (Tabel 4). Hasil
yang sama juga dapat terlihat pada rata-rata pertambahan jumlah daun pada faktor
tunggal konsentrasi media (Tabel 3). Hal ini mengindikasikan bahwa 1/2MS
cukup sesuai untuk pertumbuhan vegetatif pada N. gracilis. Hasil ini sesuai
dengan hasil penelitian Khompat et al. (2007) pada jenis N. mirabilis (Lour.)
Druce. Media 1/2MS memberikan hasil pertumbuhan daun terbaik jika
dibandingkan dengan konsentrasi media lain yang juga diteliti. Penelitian pada
jenis Nepenthes yang sama oleh Jala (2012) juga menunjukkan hasil yang sama
namun dengan penambahan BA (Benzyladenine) sebanyak 1, 2 dan 3 mg/l. Hasil
penelitian Chua dan Henshaw (1999) juga menunjukkan hal yang sama pada N.
macfarlanei yang menunjukkan pertumbuhan tunas terbaiknya terdapat pada
media 1/2MS.
Secara keseluruhan, semakin kecil konsentrasi media MS maka semakin
sedikit pertambahan jumlah daun. Hal ini diduga terjadi karena konsentrasi unsur
yang semakin sedikit dapat mempengaruhi proses fotosintesis pada tanaman
tersebut. Santoso dan Nursandi (2001) menyebutkan bahwa terdapat beberapa
unsur yang memiliki peran dalam proses fotosintesis. Unsur tersebut antara lain
Mangan (Mn) dan Tembaga (Cu). Jumlah unsur hara pendukung fotosintesis yang
semakin berkurang tentunya memberikan pengaruh pertumbuhan vegetatif pada
tanaman yang digambarkan dengan pertambahan daun. Jumlah unsur hara yang
sedikit maka pertambahan jumlah daun yang terbentuk pada tanaman juga sedikit.
Warna daun yang diamati selama penelitian menunjukkan perbedaan antara
daun yang tumbuh sebelum ditanam dalam media perlakuan dengan daun yang
tumbuh setelah ditanam dalam media perlakuan. Perbedaan warna tersebut
diamati dengan mencocokan daun dengan bagan warna daun (BWD). Bagan
warna dengan nomor 5 menunjukkan warna hijau tua, nomor 4 warna hijau,
nomor 3 warna hijau muda dan nomor 2 menunjukkan warna hijau kekuningan.
Secara keseluruhan, pada minggu akhir pengamatan (12 minggu setelah
penanaman) warna daun yang baru tumbuh didominasi oleh daun berwarna hijau
19
Namun, jika dibandingkan antara daun yang tumbuh setelah dan sebelum
perlakuan, persentase warna hijau - hijau muda pada daun setelah perlakuan lebih
besar. Hal ini menunjukkan bahwa media perlakuan yang memiliki jumlah unsur
hara yang lebih sedikit dibandingkan dengan keadaan media tanam yang
sebelumnya membuat warna daun yang muncul kurang hijau. Hal ini diduga
dipengaruhi oleh jumlah unsur hara pembentuk klorofil yang sedikit. Santoso dan
Nursandi (2001) menyebutkan bahwa terdapat 6 (enam) unsur yang berpengaruh
dalam pembentukan klorofil antara lain Nitrogen (N), Magnesium (Mg), Besi
(Fe), Mangan (Mn), Zink (Zn), dan Tembaga (Cu). Kurangnya unsur tersebut
dapat menyebabkan warna daun yang terbentuk tidak berwarna hijau.
Tabel 5 Persentase warna daun pada planlet N. gracilis pada MSP 12
Warna Daun Persentase warna daun (%) Daun yang tumbuh sebelum
perlakuan
Daun yang tumbuh setelah perlakuan
Hijau Muda 8.09 20.23
Hijau 91.91 79.77
Selain warna daun, pada akhir pengamatan (12 MSP) juga terlihat bahwa
terdapat perbedaan ukuran daun antara daun yang tumbuh sebelum dan setelah
pemberian perlakuan. Daun yang tumbuh setelah ditanam pada media perlakuan
memiliki ukuran yang lebih besar dan lebar, namun lebih tipis dibandingkan
dengan daun yang telah ada sejak awal digunakan sebagai eksplan (Gambar 8).
Perbedaan ukuran daun ini terjadi hampir pada keseluruhan eksplan berukuran > 4
cm dengan media 1/8, 1/16 dan 1/32MS.
20
4.2 Pertambahan Tinggi
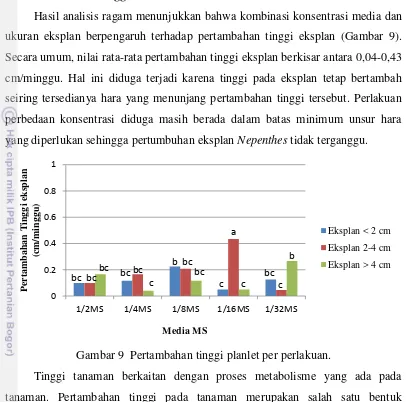
Hasil analisis ragam menunjukkan bahwa kombinasi konsentrasi media dan
ukuran eksplan berpengaruh terhadap pertambahan tinggi eksplan (Gambar 9).
Secara umum, nilai rata-rata pertambahan tinggi eksplan berkisar antara 0,04-0,43
cm/minggu. Hal ini diduga terjadi karena tinggi pada eksplan tetap bertambah
seiring tersedianya hara yang menunjang pertambahan tinggi tersebut. Perlakuan
perbedaan konsentrasi diduga masih berada dalam batas minimum unsur hara
yang diperlukan sehingga pertumbuhan eksplan Nepenthes tidak terganggu.
Gambar 9 Pertambahan tinggi planlet per perlakuan.
Tinggi tanaman berkaitan dengan proses metabolisme yang ada pada
tanaman. Pertambahan tinggi pada tanaman merupakan salah satu bentuk
terjadinya proses pertumbuhan vegetatif dan berjalannya metabolisme.
Bertambahnya tinggi pada tanaman mengindikasikan adanya pertumbuhan
vegetatif berupa pertambahan jumlah sel pada bagian batang. Pertambahan
tersebut didukung oleh unsur yang memiliki peran dalam pembentukan sel.
Hendaryono dan Wijayani (1994) menyebutkan bahwa Nitrogen (N) bagi tanaman
berfungsi sebagai pembentuk protein sehingga unsur tersebut berguna terutama
untuk pertumbuhan vegetatif tanaman termasuk didalamnya pertambahan tinggi
tanaman. Unsur Mangan (Mn) juga merupakan unsur yang berperan aktif dalam
proses fotosintesis dan metabolisme protein (Santoso & Nursandi 2001).
Hasil penelitian Jala (2012) pada N.mirabilis menunjukkan bahwa ujung
21
BA (Benzyladenine) menunjukkan hasil yang terbaik pada tinggi tanaman. Tinggi
rata-rata tanaman yang dihasilkan adalah sebesar 0,3 cm/minggu.
4.3 Jumlah Kantong yang Terbentuk
Perbedaan konsentrasi media dan ukuran eksplan secara tunggal
memberikan pengaruh terhadap rata-rata jumlah kantong yang terbentuk pada N.
gracilis. Kombinasi perlakuan perlakuan perbedaan konsentrasi media MS dengan
ukuran eksplan berpengaruh terhadap jumlah kantong yang terbentuk.
Tabel 6 Pengaruh ukuran eksplan N. gracilis terhadap rata-rata jumlah kantong yang terbentuk
Ukuran eksplan Jumlah kantong yang terbentuk (kantong)
< 2 cm 2,8667a
2-4 cm 2,1947b
> 4 cm 0,7167c
Keterangan: Nilai yang diikuti oleh huruf yang sama menunjukan tidak beda nyata pada taraf 95%
Secara umum, jumlah kantong yang terbentuk berkisar antara 0,33-3,50
kantong (Tabel 7). Jumlah kantong terendah terdapat pada media 1/8MS dengan
ukuran eksplan > 4 cm dan tertinggi terdapat pada media 1/2MS dengan ukuran
eksplan < 2 cm.
Tabel 7 Rata-rata jumlah kantong yang terbentuk pada berbagai perlakuan
Media MS
Rata-rata jumlah kantong yang terbentuk pada ukuran eksplan (kantong)
Keterangan: Nilai yang diikuti oleh huruf yang sama menunjukan tidak beda nyata pada taraf 95%
Jumlah kantong yang terbentuk dapat dikaitkan dengan jumlah daun yang
ada. Kantong Nepenthes muncul dari bagian ujung daun sehingga daun yang baru
tumbuh memberikan pengaruh pada jumlah kantong yang terbentuk. Keterkaitan
antara jumlah daun dan kantong kemudian diuji korelasinya dengan uji korelasi
bivariat. Hasil uji tersebut menunjukan bahwa korelasi antara pertambahan jumlah
daun dengan jumlah kantong adalah sebesar 0,377* dengan signifikan atau
probabilitas 0,011 (Lampiran 5). Nilai probabilitas ini lebih kecil dari 0,05
sehingga dapat dikatakan bahwa hubungan keduanya sangat erat. Hal ini terjadi
karena kantong merupakan modifikasi tulang daun bagian tengah yang tumbuh
22
kantong berhubungan sangat erat dengan daun. Nilai 0,377* menunjukkan
hubungan pertambahan jumlah daun dengan jumlah kantong adalah tinggi (yang
ditunjukan dengan tanda *). Hal ini terjadi karena ada faktor-faktor lain yang
mempengaruhi pembentukkan kantong pada Nepenthes. Faktor tersebut adalah
kondisi tempat tumbuh yang miskin hara, kelembaban dan intensitas cahaya.
Kantong merupakan bentuk adaptasi yang dilakukan oleh Nepenthes pada
kondisi yang miskin hara agar kebutuhan nutrisi tetap dapat terpenuhi. Kantong
tersebut berasal dari tulang daun bagian tengah yang tumbuh memanjang lalu
membentuk kantong seperti periuk (Suhono et al. 2010). Hasil penelitian
menunjukkan bahwa MS dengan konsentrasi 1/8, 1/16, dan 1/32 (1/8MS, 1/16MS,
dan 1/32MS) mempengaruhi jumlah kantong yang terbentuk. Konsentrasi tersebut
merupakan konsentrasi yang lebih rendah dibandingkan dengan konsentrasi lain
yang digunakan. Hal ini diduga karena ada kaitan antara kondisi lingkungan yang
miskin hara dengan kemampuan N.gracilis dalam membuat kantong. Menurut
Hernawati dan Akhriadi (2006), kantong yang terbentuk dimanfaatkan untuk
mendukung kehidupan Nepenthes. Proteolase atau yang juga disebut dengan
nepenthesin merupakan enzim yang dikeluarkan oleh Nepenthes (Mansur 2007).
Enzim tersebut dikeluarkan oleh kelenjar yang terdapat pada dinding kantong
yang berfungsi sebagai enzim pengurai. Protein yang terdapat pada serangga atau
hewan kecil yang terperangkap kemudian diuraikan menjadi zat-zat yang lebih
sederhana seperti nitrogen, fosfor, kalium, dan garam-garam mineral lain (Mansur
2007).
Penelitian Nepenthes lain juga menunjukkan bahwa pada konsentrasi yang
lebih rendah, pertumbuhan Nepenthes terlihat cukup baik. Nongrum et al. (2009)
menyebutkan bahwa semai N. khasiana menghasilkan kantong pada media 1/4MS
tanpa penambahan zat pengantur tumbuh dibandingkan dengan konsentrasi lain
yang digunakan dalam penelitian tersebut yakni 1/2MS. Latha dan Seeni (1994)
menyebutkan bahwa dari berbagai jenis media yang digunakan yakni Woody
Plant Medium (WPM), Murashige & Skoog (MS), dan Knudson-C (KC), tunas
N.khasiana menghasilkan kantong pada media WPM (Woody Plant Medium)
23
Kantong yang terbentuk pada media perlakuan memiliki perbedaan pada
ukuran kantongnya. Media dengan konsentrasi lebih rendah memiliki ukuran
kantong yang lebih besar dibandingkan dengan media dengan konsentrasi lebih
tinggi (Gambar 10). Hal ini sesuai dengan pernyataan Hernawati dan Akhriadi
(2006) bahwa Nepenthes yang tumbuh dan berkembang pada tanah miskin nutrisi
pada umumnya memiliki ukuran kantong yang besar dengan warna mencolok.
Namun, pada tanah yang subur, kantong yang terbentuk pada umumnya berukuran
kecil.
Nongrum et al. (2009) menyebutkan bahwa semai N. khasiana
menghasilkan kantong pada media 1/4MS tanpa penambahan zat pengatur tumbuh
dengan hasil kantong yang kurang sehat. Kantong yang baik dan sehat dihasilkan
dari semai pada media 1/4MS ditambah 2,68 μM NAA. Jenis N. rafflesiana yang diteliti oleh Rahayu dan Isnaini (2009) menghasilkan kantong dengan ukuran
yang besar pada media tanam 1/4MS dan 1/8MS tanpa zat pengatur tumbuh.
Gambar 10 Ukuran kantong masing-masing konsentrasi media pada 12 MSP.
Ukuran kantong yang diamati pada pengamatan visual yakni pada 25 MSP
terlihat bahwa media yang memiliki ukuran kantong yang paling besar adalah (D) 1/16MS (E) 1/32MS
24
kantong pada media 1/8MS (Gambar 11a). Selain itu, pada pengamatan tersebut
juga teramati kantong yang telah layu dan berubah warna menjadi cokelat
(Gambar 11b). Kondisi tersebut diduga terjadi karena usia kantong pada
N.gracilis yang berkisar antara 1-2 bulan. Kantong yang telah berusia lebih dari 2
bulan tersebut kemudian akan layu dan berubah warna menjadi kecokelatan.
Gambar 11 Kantong dengan ukuran terbesar (A) dan kantong yang telah layu (B).
4.4 Persentase Planlet Hidup dan Berkantong
Hasil penelitian menunjukkan bahwa pada keseluruhan perlakuan rata-rata
persentase planlet yang hidup hingga akhir pengamatan adalah sebesar 98,33%.
Planlet yang mati sebesar 1,67% disebabkan oleh kontaminasi oleh jamur yang
terjadi pada minggu kedua setelah penanaman. Walaupun perlakuan berupa
perbedaan konsentrasi media dilakukan hingga konsentrasi yang semakin sedikit
kandungan nutrisinya, namun pertumbuhan planlet tetap tinggi.
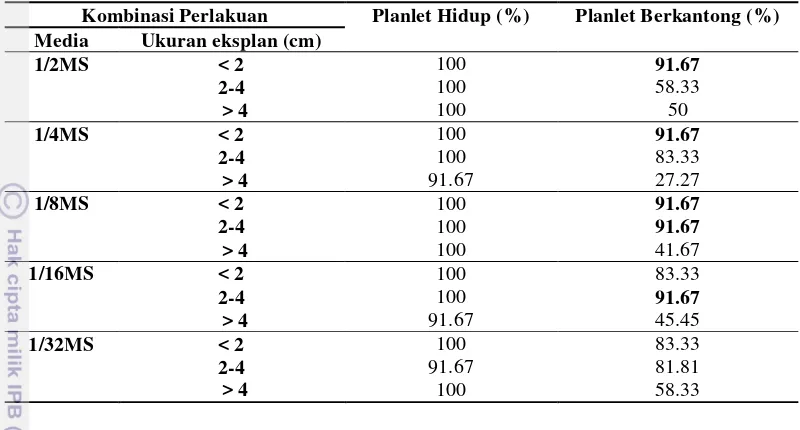
Nilai persentase planlet yang berkantong secara umum pada keseluruhan
perlakuan berkisar antara 27,27% hingga 91,67% (Tabel 8). Persentase tertinggi
terdapat pada kombinasi perlakuan media 1/2MS dengan eksplan < 2 cm, media
1/4MS dengan eksplan < 2 cm, media 1/8MS dengan eksplan < 2 cm dan 2-4 cm,
dan media 1/16MS dengan eksplan 2-4 cm yakni sebesar 91,67%. Persentase
terendah terdapat pada kombinasi perlakuan media 1/4MS dengan eksplan > 4 cm
sebesar 27,27%. Hal ini diduga terjadi karena eksplan dengan ukuran > 4 cm
menggunakan unsur hara dari media untuk menunjang pertumbuhan tubuh planlet
tersebut.
25
Tabel 8 Persentase planlet hidup dan berkantong N. gracilis pada setiap kombinasi perlakuan
Kombinasi Perlakuan Planlet Hidup (%) Planlet Berkantong (%) Media Ukuran eksplan (cm)
Persentase planlet berkantong yang berbeda-beda diduga terjadi karena
tendril gagal berkembang menjadi kantong. Tendril atau sulur pada daun yang
muncul berasal dari perpanjangan tulang daun utama dan pada akhirnya akan
membentuk kantong (Hernawati & Akhriadi 2006). Tendril akan berkembang
menjadi kantong apabila fungsi fisiologisnya aktif sehingga tidak semua kuncup
daun pada tanaman ini berubah menjadi kantong. Pada perkembangannya, kuncup
dapat gagal berkembang apabila kekurangan intensitas cahaya dan kelembaban.
Selain itu, kerusakan pada fisik tendril juga dapat menyebabkan tendril gagal
berkembang menjadi kantong (Clarke 2001). Pada penelitian ini, tendril yang
muncul diduga gagal berkembang karena tendril mengalami kerusakan fisik.
Kerusakan tersebut terjadi karena sebagian besar media perlakuan yang tidak
membeku membuat kondisi planlet yang ditanam tidak berdiri kokoh seperti pada
media tanam yang beku dan padat. Tendril diduga membentur kaca dinding botol
26
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Perlakuan yang memberikan pengaruh paling baik pada pembentukan
kantong N. gracilis adalah media dengan konsentrasi 1/2MS, 1/4MS pada ukuran
eksplan < 2 cm dan media 1/8MS dengan ukuran eksplan 2-4 cm. Perlakuan
tersebut menunjukkan rata-rata pembentukan kantong terbanyak yakni 3,00-3,50
buah. Jumlah kantong terendah terdapat pada media 1/8MS dengan ukuran
eksplan > 4 cm dan tertinggi terdapat pada media 1/2MS dengan ukuran eksplan <
2 cm. Hasil tersebut dapat menjadi pertimbangan konsentrasi media yang akan
digunakan dalam kultur jaringan Nepenthes dengan menyesuaikan pada hasil yang
ingin dicapai.
5.2 Saran
Penelitian selanjutnya perlu dimodifikasi konsentrasi media dengan tingkat
kandungan unsur hara yang lebih sedikit dari konsentrasi telah yang digunakan
dalam penelitian ini hingga pada media yang hanya mengandung bahan pemadat
dan gula saja untuk mengetahui perkembangan kantong Nepenthes. Disarankan
pula penelitian yang memodifikasi konsentrasi unsur makro pada konsentrasi
media tertentu untuk mengetahui unsur yang memperngaruhi dalam pembentukan
27
DAFTAR PUSTAKA
[Anonim]. 2012. Gambar BWD (Bagan Warna Daun). http://cms.1m-bio.com/bagan-warna-daun-bwd/bwd-single-2/. [ Juli 2012]
Astuti IP, Kalsom YU, Taha RM. 2003. Nepenthes L. Dalam : Brink M, Escobin RP (Editor). Plant Resources of South-East Asia 17 Fibre Plant. Bogor: PROSEA. Hal 196.
Clarke C. 2001. Nepenthes of Sumatra and Peninsulas Malaysia. Kota Kinabalu: Natural History Publications (Borneo).
Cheek M, Jebb M. 2001. Flora Malesiana Series-I Seed Plants. Vol 15: 67-69. Foundation Flora Malesiana.
Chua LSL, Henshaw G. 1999. In vitro propagation of Nepenthes macfarlanei.
Jurnal of Tropical Forest Science 11 (3): 631-638.
CITES. 2012. The CITES Appendices. http://www.cites.org/eng/resources/ species.html. [31 Juli 2012].
[DEPHUT] Departemen Kehutanan. 1999. Peraturan Pemerintah RI Nomor 7 tahun 1999 tentang pengawetan jenis tumbuhan dan satwa. http://www.dephut.go.id/files/LAMPIRAN%20PERATURAN%20PEM ERINTAH%20REPUBLIK%20INDONESIA%20NOMOR%207%20TA HUN%201999.pdf [31 Juli 2012].
Fong SW. 2008. In vitro induction of polyploidy in Nepenthes gracilis [abstrak]. University Malaya.
Gunawan LW. 1987. Teknik Kultur Jaringan. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas (PAU). Bioteknologi. Institut Pertanian Bogor.
__________. 1992. Teknik Kultur Jaringan Tanaman. Departemen Pendidikan Tinggi. Pusat Antar Universitas (PAU). Bioteknologi. Institut Pertanian Bogor.
Handoyo F, Sitanggang M. 2006. Petunjuk Praktis Perawatan Nepenthes. Jakarta: Agromedia Pustaka.
Hendaryono DPS, Wijayani A. 1994. Teknik Kultur Jaringan. Jakarta: Penerbit Kanisius.
28
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid II. Jakarta: Badan Litbang Kehutanan.
Isnaini Y, Handini E. 2007. Perkecambahan biji kantong semar (Nepenthes gracilis Korth.) secara in vitro. Buletin Kebun Raya Indonesia 10 (2): 40-46.
Isnaini Y. 2011. Penelitian dan pengembangan tanaman hias unik kantong semar (Nepenthes spp.) secara in vitro di Kebun Raya Bogor. Di dalam: Prosiding Seminar Nasional Perhorti; Lembang, 23-24 November 2011. Bogor: hal 1170-1177.
Jala A. 2012. Types of media for seeds germination and effect of BA on mass propagation of Nepenthes mirabilis Druce. American Transactions on Engineering & Applied Sciences. 1(2): 163-171.
Khompat K, Tokhao W, Jantasilp A. 2007. Factors affecting in vitro seed germination and shoot multiplication of a pitcher plant (Nepenthes mirabilis
(Lour.)Druce). Songklanakarin J.Sci. Technol. 29(2): 253-260.
Kunita LY. 2011. Pertumbuhan tanaman Kantong Semar (Nepenthes rafflesiana
Jack.) dengan modifikasi konsentrasi media dan pH secara in vitro [skripsi]. Serang: Fakultas Pertanian. Universitas Sultan Ageng Tirtayasa.
Latha PG, Seeni S. 1994. Multiplication of the endangered Indian pitcher plant (Nepenthes khasiana) through enhanced axillary branching in vitro. Plant Cell, Tissue and Organ Culture 38: 69-71.
Mansur M. 2007. Nepenthes Kantong Semar yang Unik. Jakarta: Penebar Swadaya.
Mattjik AA, Sumertasijaya M. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. IPB Press. Bogor.
Nongrum I, Kumaria S, Tandon P. 2009. Multiplication through in vitro seed germination and pitcher development in Nepenthes khasiana Hook. F., a unique insectivorous plant of India. The Jurnal of Horticultural Science & Biotechnology 84(3): 329-332. abstrak [pdf].
Rahayu EMD, Isnaini Y. 2009. Induksi pembentukan kantong tanaman Nepenthes
rafflesiana Jack pada berbagai konsentrasi media dan ukuran wadah kultur. Di
dalam: Prosiding Seminar Peranan Konservasi Flora Indonesia Dalam Mengatasi Dampak Pemanasan Global. UPT BKT Kebun Raya Eka Karya Bali-LIPI dan PTTI, FMIPA Universitas Udayana dan BLH Prov Bali hal:436-441.
29
Rice BA. 2006. Growing Carnivorous Plants. Portland: Timber Press.
Santoso U, Nursandi F. 2001. Kultur Jaringan Tumbuhan. Malang: Penerbit Universitas Muhamadiyah Malang.
Suhono B, Yuzammi, Witono JR, Hidayat S, Handayani T, Sugiarti, Mursidawati S, Triono T, Astuti IP, Sudarmono, Wawangningrum H. 2010. Ensiklopedia Flora. Bogor: PT Kharisma Ilmu.
Yogiara. 2004. Analisis Komunitas Bakteri Cairan Kantong Semar (Nepenthes
spp.) Menggunakan Teknik Terminal Restriction Fragment Length Analysis
(ARDRA) [tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor.
30
31
LAMPIRAN
Lampiran 1 Komposisi Media Murashige and Skoog
32
Lampiran 2 Sidik ragam pertambahan jumlah daun N. gracilis
SK db F Hit Pr > F KK(%)
Media 4 (2,17) (0,0967) (42,715)
Ukuran eksplan 2 (0,76) (0,4744)
Media*Ukuran eksplan 8 (0,93) (0,5037)
Galat 30
Total koreksi 44
Keterangan:
Media : Konsentrasi Media MS Ukuran Eksplan : Ukuran Eksplan N. gracilis
KK : Koefisien Keragaman (...) : Hasil transformasi √(x+0,5)
Lampiran 3 Sidik ragam pertambahan tinggi eksplan N. gracilis
SK db F Hit Pr > F KK(%)
Media 4 (1.34) (0,2783) (58,081)
Ukuran eksplan 2 (2,91) (0,0698)
Media*Ukuran eksplan 8 (6,43) (0,0001)**
Galat 30
Total koreksi 44
Keterangan:
Media : Konsentrasi Media MS Ukuran Eksplan : Ukuran Eksplan N. gracilis
KK : Koefisien Keragaman (...) : Hasil transformasi √(x+0,5) ** : Sangat nyata pada uji F 5%
Lampiran 4 Sidik ragam jumlah kantong N. gracilis
SK db F Hit Pr > F KK(%)
Media 4 (0,57) (0,6830) (42,075)
Ukuran eksplan 2 (27,63) (0,0001)**
Media*Ukuran eksplan 8 (1,73) (0,1328)
Galat 30
Total koreksi 44
Keterangan:
Media : Konsentrasi Media MS Ukuran Eksplan : Ukuran Eksplan N. gracilis
33
Lampiran 5 Nilai uji korelasi bivariat antara pertambahan jumlah daun dengan jumlah kantong
Descriptive Statistics
Mean Std. Deviation N Pertambahan Jumlah Daun 2.0538 .91315 45
Pertambahan Jumlah Kantong 1.9260 1.23009 45
Correlations parametric
*. Correlation is significant at the 0.05 level (2-tailed).
Correlations Non-parametric (Spearman’rho)