TERHADAP PERTUMBUHAN DAN PERKEMBANGAN
TUNAS MIKRO KANTONG SEMAR (Nepenthes mirabilis)
SECARA IN VITRO
Oleh:
YAYU ALITALIA A34304025
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
YAYU ALITALIA. Pengaruh Pemberian BAP dan NAA Terhadap Pertumbuhan dan Perkembangan Tunas Mikro Kantong Semar (Nepenthes Mirabilis) Secara In Vitro. (Dibimbing oleh DINY DINARTI)
Penelitian ini bertujuan untuk mempelajari pengaruh jenis dan konsentrasi zat pengatur tumbuh BAP dan NAA yang sesuai untuk pertumbuhan dan perkembangan tunas mikro kantong semar (Nepenthes mirabilis) secara in vitro. Penelitian dilaksanakan pada bulan Oktober 2007 hingga Maret 2008 di Laboratorium Bioteknologi Tanaman Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penelitian ini disusun menggunakan Rancangan Acak Lengkap (RAL) dua faktor yaitu konsentrasi BAP dan NAA pada media dasar yaitu ½ MS. Faktor pertama adalah BAP yang terdiri dari empat taraf konsentrasi, yaitu 0; 0.5; 1.0 dan 2.0 ppm. Faktor kedua adalah NAA dengan empat taraf konsentrasi, yaitu 0; 0.1; 0.2 dan 0.5 ppm. Penelitian ini terdiri dari 16 kombinasi perlakuan masing-masing diulang sebanyak 10 kali, sehingga terdapat 160 satuan percobaan dengan 1 eksplan untuk setiap satu satuan percobaan (1 botol kultur).
Pengamatan dilakukan setiap hari dan minggu selama 16 minggu setelah tanam. Peubah yang diamati setiap hari yaitu: waktu inisiasi tunas, waktu inisiasi daun, waktu inisiasi kantong dan waktu inisiasi akar. Peubah yang diamati setiap minggu yaitu: jumlah tunas, jumlah daun, jumlah kantong dan jumlah akar. Peubah yang diamati pada akhir pengamatan yaitu: panjang daun terpanjang, panjang akar terpanjang dan tinggi tanaman.
Sidik ragam menunjukkan pengaruh BAP nyata terhadap inisiasi tunas dan inisiasi daun dan sangat nyata terhadap inisiasi kantong, panjang daun terpanjang dan tinggi tanaman. BAP memberikan pengaruh yang nyata pada 2 MST dan sangat nyata pada 3 hingga 16 MST terhadap jumlah tunas yang terbentuk. BAP juga memberikan pengaruh yang nyata pada 3 MST dan sangat nyata pada 4 hingga 16 MST terhadap jumlah daun dan pengaruh sangat nyata terhadap jumlah kantong pada 5-16 MST.
NAA memberikan pengaruh yang sangat nyata terhadap panjang akar terpanjang, panjang daun terpanjang, tinggi tanaman dan jumlah akar pada 10 hingga 16 MST. NAA memberi pengaruh nyata terhadap jumlah tunas pada 3 hingga 7 MST dan terhadap jumlah kantong pada 5 MST. NAA juga menunjukkan pengaruh sangat nyata terhadap jumlah daun pada 4 hingga 8 MST dan pengaruh nyata pada 9-14 MST dan 16 MST.
Kombinasi antara BAP dan NAA hanya memberikan pengaruh sangat nyata terhadap panjang daun terpanjang (30.9 mm), jumlah tunas pada 2 MST (1.6 tunas per eksplan) dan jumlah daun pada 4 MST (4.1 daun per eksplan).
TERHADAP PERTUMBUHAN DAN PERKEMBANGAN
TUNAS MIKRO KANTONG SEMAR (
Nepenthes mirabilis
)
SECARA
IN VITRO
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
Oleh: Yayu Alitalia
A34304025
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
PERTUMBUHAN DAN PERKEMBANGAN TUNAS MIKRO KANTONG SEMAR (Nepenthes mirabilis) SECARA IN VITRO Nama : Yayu Alitalia
NRP : A34304025
Menyetujui, Dosen Pembimbing
Ir. Diny Dinarti, MSi NIP. 131 999 963
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Didy Sopandie, M.Agr. NIP. 131 124 019
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 13 maret 1986. Penulis merupakan putri pertama dari Bapak Lili Hanapi dan Ibu Aminah.
Riwayat pendidikan penulis yaitu pada tahun 1998 lulus dari SD Negeri Puspanegara 03 Citeureup-Bogor, pada tahun 2001 lulus dari SLTP Negeri 1 Cibinong-Bogor, pada tahun 2004 lulus dari SMU Negeri 3 Bogor dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Program Studi Hortikultura.
Selama kuliah penulis sempat menjadi panitia Festival Tanaman (FESTA) yang diadakan oleh Himpunan Mahasiswa Agronomi (Himagron) ke-XXVI (2005), FESTA ke-XXVII (2006), Panitia Pelatihan Terarium (2006) dan menjadi panitia pada Hard Launching Indo Flower Nursery IPB (2008). Pada tahun 2005 penulis juga mendapat kesempatan magang di Agrowisata Strawberry Petik Sendiri di “Kurnia Strawberry” Ciwidey, Bandung selama 1 bulan.
Puji syukur penulis panjatkan ke hadirat Allah SWT atas berkat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Pengaruh Pemberian BAP dan NAA Terhadap Pertumbuhan dan Perkembangan Tunas Mikro Kantong Semar (Nepenthes Mirabilis) Secara In Vitro” ini. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Ir Diny Dinarti, MSi selaku dosen pembimbing akademik dan pembimbing skripsi atas bimbingan, kesabaran, motivasi dan waktu hingga terselesaikannya skripsi ini.
2. Dr Ir Nurul Khumaida, MSi dan Ir Megayani Sri Rahayu, MS sebagai penguji atas masukan ilmu serta kritik dan sarannya.
3. Papa dan Mama tercinta yang telah memberikan segala kasih sayang, doa dan cinta yang tidak akan pernah terbalaskan.
4. M. Reza Cordova atas segala motivasi, semangat, bantuan dan dorongan yang telah diberikan.
5. Urip Sayekti, atas semua arahan dalam pelaksanaan penelitian ini.
6. Purnawati, Ardhanariswari, Rima dan Rini Riestiani atas semua bantuan dan waktu untuk saling berbagi suka dan duka.
7. Melly, Aji, Hanna, Mbak Retno, Mbak Ella, Doni, Eneng dan teman-teman di Laboratorium Kultur Jaringan.
8. Noni, Kiki, Yesa, Heni, Rini, Mbak Ayi, Enggar, Nika, Roy, Mega dan teman-teman yang telah membantu dalam setiap kegiatan.
9. Teman-teman Hortikultura angkatan 41 serta semua pihak yang tidak bisa penulis sebutkan satu per satu.
Semoga tulisan ini dapat bermanfaat bagi yang memerlukan.
Bogor, Mei 2008 Penulis
Halaman PENDAHULUAN ... 1 Latar belakang ... 1 Tujuan ... 3 Hipotesis ... 4 TINJAUAN PUSTAKA ... 5
Botani dan Morfologi Kantong Semar ... 5
Ekologi ... 10
Kultur Jaringan Tanaman ... 11
Faktor-faktor yang Mempengaruhi Keberhasilan Kultur Jaringan ... 12
Eksplan ... 12
Media Kultur ... 13
Zat Pengatur Tumbuh ... 14
Kultur JaringanTanaman Karnivora ... 17
BAHAN DAN METODE ... 18
Waktu dan Tempat ... 18
Bahan dan Alat ... 18
Metode Penelitian ... 18
Pelaksanaan ... 19
Sterilisasi Alat, Botol dan Media Tanam ... 19
Pembuatan Larutan Stok ... 19
Pembuatan Media Kultur ... 20
Persiapan Ruang Tanam ... 20
Penanaman ... 21
Pemeliharaan ... 21
Pengamatan ... 22
HASIL DAN PEMBAHASAN ... 23
Kondisi Umum ... 23
Waktu Inisiasi Tunas ... 27
Waktu Inisiasi Daun... 28
Waktu Inisiasi Kantong ... 30
Waktu Inisiasi Akar ... 30
Jumlah Tunas ... 32
Jumlah Daun ... 35
Jumlah Kantong ... 38
Jumlah Akar ... 40
Tinggi Tanaman ... 42
Panjang Daun Terpanjang ... 44
Kesimpulan ... 47
Saran ... 47
DAFTAR PUSTAKA ... 48
Nomor Halaman Teks
1. Rekapitulasi Sidik Ragam Respon Peubah yang Diamati pada Kultur
Nepenthes mirabilis ... 26 2. Pengaruh Pemberian BAP terhadap Waktu Inisiasi Tunas, Inisiasi Daun,
dan Inisiasi Kantong Nepenthes mirabilis ... 27 3. Pengaruh Pemberian BAP dan NAA terhadap Waktu Inisiasi Akar
Nepenthes mirabilis ... 31 4. Pengaruh Pemberian BAP terhadap Rata-rata Jumlah Tunas
Nepenthes mirabilis pada 2-16 MST ... 32 5. Pengaruh Pemberian NAA terhadap Rata-rata Jumlah Tunas
Nepenthes mirabilis pada 2-8 MST ... 34 6. Pengaruh Interaksi BAP dan NAA terhadap Rata-rata Jumlah Tunas
Nepenthes mirabilis pada 2 MST ... 35 7. Pengaruh Pemberian BAP terhadap Rata-rata Jumlah Daun
Nepenthes mirabilis pada 3-16 MST ... 36 8. Pengaruh Pemberian NAA terhadap Rata-rata Jumlah Daun
Nepenthes mirabilis pada 3-16 MST ... 36 9. Pengaruh Interaksi BAP dan NAA terhadap Rata-rata Jumlah Daun
Nepenthes mirabilis pada 4 MST ... 37 10. Pengaruh Pemberian BAP terhadap Rata-rata Jumlah Kantong
Nepenthes mirabilis pada 5-16 MST ... 39 11. Pengaruh Pemberian NAA terhadap Rata-rata Jumlah Kantong
Nepenthes mirabilis pada 5-16 MST ... 39 12. Pengaruh Pemberian NAA terhadap Rata-rata Jumlah Akar
Nepenthes mirabilis pada 10-16 MST ... 41 13. Pengaruh Pemberian BAP dan NAA terhadap Rata-rata Tinggi Tanaman
Nepenthes mirabilis ... 43 14. Pengaruh Pemberian BAP dan NAA terhadap Rata-rata Panjang Daun
Terpanjang Nepenthes mirabilis ... 44 15. Pengaruh Interaksi BAP dan NAA terhadap Rata-rata Panjang Daun
Terpanjang Nepenthes mirabilis ... 45 18. Pengaruh Pemberian NAA terhadap Rata-rata Panjang Akar Terpanjang
Lampiran
1. Komposisi Media Murashige-Skoog ... 51
2. Sidik Ragam Waktu Inisiasi Tunas N.mirabilis ... 52
3. Sidik Ragam Waktu Inisiasi Daun N.mirabilis ... 52
4. Sidik Ragam Waktu Inisiasi Kantong N.mirabilis ... 52
5. Sidik Ragam Waktu Inisiasi Akar N.mirabilis ... 53
6. Sidik Ragam Panjang Daun Terpanjang N.mirabilis ... 53
7. Sidik Ragam Panjang Akar Terpanjang N.mirabilis ... 53
8. Sidik Ragam Tinggi Tanaman N.mirabilis ... 54
9. Sidik Ragam Jumlah Tunas N.mirabilis pada 2-16 MST ... 54
10. Sidik Ragam Jumlah Daun N.mirabilis pada 3-16 MST ... 56
11. Sidik Ragam Jumlah Kantong N.mirabilis pada 5-16 MST ... 58
Nomor Halaman Teks
1. (A) Nepenthes yang Merambat di Pohon ... 5
(B) Menyemak Diatas Permukaan Tanah ... 5
2. (A) Bunga Jantan N.mirabilis ... 6
(B) Bunga Betina N.gracilis ... 6
3. (A) Struktur Bunga Jantan ... 6
(B) Struktur Bunga Betina ... 6
4. (A) Buah N.mirabilis ... 7
(B) Buah yang Telah Merekah ... 7
5. (A) Biji yang Berasal dari Buah yang Matang ... 7
(B) Biji yang Siap Ditanam ... 7
6. (A) Tipe Kantong Atas ... 8
(B) Tipe Kantong Bawah ... 8
7. Serangga yang Terjebak di dalam Kantong ... 9
8. (A) N.hookeriana x N.mirabilis ... 10
(B) N.gracilis x N.mirabilis ... 10
9. Struktur Molekul NAA ... 15
10. Struktur Molekul BAP ... 16
11. Tanaman Induk yang Digunakan Sebagai Eksplan ... 23
12. (A) Kontaminasi yang Disebabkan oleh Cendawan ... 24
(B) Kontaminasi yang Disebabkan oleh Bakteri ... 24
13. Kantong yang Terbentuk pada Eksplan N.mirabilis. ... 24
14. (A) Tahap Perkembangan Eksplan dari Sebelum Bertunas ... 28
(B) Tahap Perkembangan Eksplan Setelah 2 MST ... 28
15. Inisiasi Daun pada Eksplan Nepenthes. ... 29
16. (A) Ukuran Daun Nepenthes pada Perlakuan NAA 0.2 ppm ... 29
(B) Ukuran Daun Nepenthes pada Perlakuan NAA 0.5 ppm ... 29
17. Inisiasi Kantong pada Eksplan Nepenthes. ... 30
18. Inisiasi Akar pada Eksplan Nepenthes. ... 31
19. (A) Jumlah Tunas yang Dihasilkan pada Perlakuan BAP 1 ppm ... 33
(B) Jumlah Tunas yang Dihasilkan pada Perlakuan BAP 2 ppm ... 33
20. (A) Jumlah Tunas yang Dihasilkan pada Perlakuan NAA 0.1 ppm ... 34
22. Jumlah Daun Nepenthes pada Perlakuan Tanpa Penambahan Zat
Pengatur Tumbuh ... 37
23. Warna Daun pada Eksplan Nepenthes mirabilis ... 38
24. Kantong yang Terbentuk pada Eksplan Nepenthes mirabilis ... 40
25. Jumlah Akar dilihat dari Bagian Bawah Botol Kultur ... 41
26. Bulu Akar pada Akar Nepenthes mirabilis ... 42
27. (A) Tinggi Tanaman Nepenthes pada Perlakuan BAP 2 ppm ... 43
(B) Perlakuan NAA 0.2 ppm + BAP 1 ppm ... 43
28. Panjang Daun Terpanjang pada Perlakuan BAP 1 ppm + NAA 0.2 ppm ... 44
29. Panjang Akar Terpanjang pada Perlakuan Tanpa Penambahan Zat Pengatur Tumbuh ... 46
PENDAHULUAN
Latar Belakang
Nepenthes atau yang lebih dikenal dengan sebutan kantong semar merupakan salah satu tanaman unik dan langka yang ada di Indonesia. Menurut Direktorat Budidaya Tanaman Hias (2006), nepenthes merupakan jenis tumbuhan yang termasuk dalam CITES Appendix 1 Tahun 2003. Tanaman yang termuat di dalamnya merupakan jenis-jenis yang telah terancam punah (endangered) sehingga perdagangan internasional spesimen yang berasal dari habitat alam harus dikontrol dengan ketat dan hanya diperkenankan untuk kepentingan non komersial tertentu dengan izin khusus.
Menurut Mansur (2007), terdapat 64 jenis nepenthes yang hidup di Indonesia dari sekitar 82 jenis yang ada di dunia. Borneo (Kalimantan, Serawak, Sabah dan Brunei) merupakan pusat penyebaran nepenthes di dunia dan saat ini terdapat sekitar 32 jenis nepenthes yang hidup disana. Sumatera menempati urutan kedua dengan jumlah sebanyak 29 jenis. Berdasarkan hasil penelusuran spesimen herbarium di Herbarium Bogorinse-Bogor, ditemukan bahwa di Sulawesi terdapat minimum 10 jenis, New Guinea 9 jenis, Maluku 4 jenis dan Jawa hanya terdapat 2 jenis nepenthes.
Nepenthes diberi sebutan kantong semar karena ujung daunnya termodifikasi menjadi kantong seperti perut semar yang buncit. Kantong-kantong ini sangat menarik, karena bentuk dan warnanya yang indah. Keunikan lainnya terdapat pada kantung yang berbentuk corong berisi cairan yang di dalamnya dapat ditemukan berbagai jenis serangga. Penampilannya yang seperti ini menjadikannya sebagai tanaman yang unik jika dibandingkan dengan tanaman yang lain. Menurut Handayani (2006), tanaman ini memiliki potensi untuk dijadikan tanaman hias ornamental karena bentuk, warna dan ukurannya yang menarik.
Tanaman nepenthes sebenarnya hanya menjadi tanaman liar di hutan-hutan tempat asalnya. Kelestarian nepesthes semakin terancam akhir-akhir ini karena adanya konversi lahan. Keadaan ini justru sangat berbeda dengan kondisi
nepenthes di luar negeri. Tanaman ini banyak digemari dan bahkan pengembangan budidayanya jauh lebih maju.
Semakin menyusutnya luasan hutan yang disertai kerusakan pada beberapa waktu ini, dikhawatirkan akan berdampak langsung terhadap berkurangnya populasi dan keanekaragaman nepenthes. Kepunahan nepenthes pun bisa terjadi jika hal ini tidak ditanggulangi. Usaha konservasi ex-situ perlu dilakukan dengan cara domestikasi melalui mekanisme budidaya dan pemuliaan (Mansur, 2007).
Metode perbanyakan tanaman nepenthes yang banyak dilakukan selama ini adalah dengan menggunakan biji, stek dan pemisahan anakan. Cara perbanyakan melalui stek terbatas dari jumlah buku dan waktu yang relatif lama untuk menyiapkan tanaman induk siap stek (Sayekti, 2007). Suska (2006) dalam Sayekti (2007) juga menyatakan bahwa untuk mempersiapkan tanaman induk siap stek pada Nepenthes mirabilis yang berasal dari semai biji diperlukan waktu sekitar dua tahun. Metode perbanyakan dengan pemisahan anakan terbatas oleh sedikitnya jumlah anakan yang terbentuk. Pada Nepenthes mirabilis juga anakan jarang terbentuk.
Salah satu alternatif metode perbanyakan yang dapat ditempuh adalah melalui kultur in vitro. Metode ini diharapkan mampu menghasilkan tanaman dalam skala besar dengan waktu yang relatif cepat serta kualitas tanaman yang dihasilkan menjadi lebih baik. Menurut Gunawan (1992), melalui kultur jaringan kebutuhan ketersediaan bibit tanaman dalam jumlah yang banyak dapat terpenuhi. Sudarmonowati et al. (2002) juga menambahkan bahwa perbanyakan tanaman dengan teknik kultur jaringan (in vitro) telah banyak dilakukan untuk tanaman yang bernilai ekonomi tinggi atau tanaman yang tergolong langka dan sulit dipropagasi dengan cara konvensional.
Penelitian tentang pengaruh media terhadap pertumbuhan dan perkembangan Nepenthes mirabilis secara in vitro telah dilakukan sebelumnya oleh Sayekti (2007) dengan menghasilkan media perkecambahan yang terbaik adalah ¼ KC dan ½ MS. Pada penelitian ini juga diperoleh tanaman yang membentuk kalus dan multiplikasi tunas pada minggu ke-8 setelah berkecambah. Media yang mampu memberikan respon pertumbuhan tersebut adalah ¼ KC + Thidiazuron (TDZ) dan ½ MS + TDZ. Pertumbuhan tanaman pada media ini
berbeda dengan yang lain. Tanaman menjadi kerdil (abnormal), daun tidak berkantong, roset, berukuran kecil dengan jumlah yang banyak. Hal ini diduga disebabkan oleh aktivitas TDZ sebagai sitokinin yang sangat aktif walaupun dalam konsentrasi yang sangat rendah.
Menurut Maryani dan Zamroni (2005), perbanyakan krisan secara kultur jaringan melalui multiplikasi tunas dapat menghemat waktu dan dapat diperoleh bibit dalam jumlah banyak. Keseimbangan antara BAP dan IAA juga sangat penting dalam menginduksi tunas karena masing-masing zat pengatur tumbuh tersebut mempunyai peranan dalam menginduksi tunas. Hal ini menunjukkan bahwa sitokinin (termasuk BAP) dan auksin (termasuk IAA) berperanan saling melengkapi dalam menginduksi tunas. Keadaan ini juga dibuktikan oleh kombinasi BAP 1 ppm dan IAA 1 ppm yang memberikan penggandaan tunas krisan terbanyak. Sudarmonowati et al. (2002) juga menyatakan, respon tanaman untuk menghasilkan tunas baru (multiplikasi tunas) atau kalus embriogenik bervariasi dipengaruhi oleh banyak faktor antara lain bagian tanaman yang digunakan, umur fisiologis bagian tersebut atau umur pohon induk, jenis (spesies) tanaman dan prosedur perbanyakan termasuk jenis zat pengatur tumbuh yang ditambahkan pada media.
Tujuan
1. Mempelajari pengaruh BAP pada pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
2. Mempelajari pengaruh NAA pada pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
3. Mendapatkan perlakuan terbaik untuk pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
Hipotesis
1. Terdapat pengaruh BAP pada pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
2. Terdapat pengaruh NAA pada pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
3. Terdapat interaksi BAP dan NAA terbaik untuk pertumbuhan dan perkembangan tunas mikro Nepenthes mirabilis.
TINJAUAN PUSTAKA
Botani dan Morfologi Kantong Semar
Nepenthes pada sistem klasifikasi tanaman termasuk dalam kerajaan Plantae, filum Magnoliophyta, kelas Magnoliopsida, Subkelas Dilleniidae, Ordo Nepenthales, famili Nepenthaceae, dan genus Nepenthes (Mansur, 2007).
Menurut James dan Pietropaolo (1996), tanaman nepenthes merupakan herba tahunan yang mempunyai batang sangat kasar dengan diameter lebih dari 2 inchi (5 cm). Pada beberapa spesies panjang batang nepenthes dapat mencapai hingga 66 kaki (20 m). Batang tersebut merambat diantara semak belukar dan pohon atau dapat juga menyemak di atas permukaan tanah (Gambar 1).
(A) (B)
Gambar 1. Nepenthes yang Merambat di Pohon (Mansur, 2007) (A), dan Menyemak Diatas Permukaan Tanah (Tim Redaksi, 2006) (B).
Nepenthes termasuk jenis tanaman berumah dua. Satu tanaman berupa tanaman jantan dan yang lainnya betina, tidak keduanya. Bunga dihasilkan dari bagian apex pada batang tanaman yang telah dewasa (Gambar 2). Untuk menghasilkan biji pada tanaman ini dibutuhkan pollen dari tanaman jantan untuk di transfer ke stigma pada tanaman betina (Gambar 3). Ovary akan berkembang menjadi buah setelah fertilisasi berlangsung (Clarke, 1997).
(A) (B)
Gambar 2. Bunga Jantan N.mirabilis (Mansur, 2007) (A), dan Bunga Betina N.gracilis (Tim Redaksi, 2006) (B).
(A) (B) Gambar 3. Struktur Bunga Jantan (A), dan
Bunga Betina (B) (Clarke , 1997)
Buah nepenthes membutuhkan waktu sekitar 3 bulan untuk berkembang penuh hingga masak setelah masa fertilisasi (Gambar 4.A). Ketika masak, buah akan retak menjadi empat bagian dan biji-bijinya akan terlepas (Gambar 4.B). Penyebaran biji biasanya dengan bantuan angin. Kapsul buah nepenthes tersebut banyak yang rusak karena gigitan ngengat. Ngengat biasanya memakan buah nepenthes yang sedang berkembang (Clarke, 1997).
anters stigma
ovary column
sepal
(A) (B)
Gambar 4. Buah N.mirabilis (Mansur, 2007) (A), dan Buah yang Telah Merekah (Tim Redaksi, 2006) (B).
Biji yang dihasilkan tanaman nepenthes memiliki sayap yang panjangnya dapat mencapai 30 mm, sangat ringan dengan endosperm yang kecil (Gambar 5). Terdapat lebih dari 500 biji dalam satu kapsul biji yang masak, tapi diantaranya banyak yang merupakan biji-biji steril. Biji-biji tersebut juga hanya sedikit yang mampu bertahan hidup hingga menjadi tanaman dewasa.
(A) (B) Gambar 5. Biji yang Berasal dari Buah yang Matang
(http://rumputijo.wordpress.com/) (A), dan Biji yang Siap Ditanam (B).
Bentuk batang dari tiap tanaman kantong semar berbeda tergantung dari spesiesnya. Batang berbentuk segitiga dimiliki oleh N. gracillis dan N. reinwardtiana; batang segi empat dimiliki oleh N. spathulata; dan batang bersudut dimiliki oleh N. andrianii. Batang ini berwarna hijau, kadang-kadang ungu tua atau merah tua. Daun kantong semar akan muncul di ruas-ruas batang
dengan jarak tetap, pada ujung daun tersebut akan muncul sulur panjang yang tipis, sulur ini menjadi penopang ketika ia merambat ke pohon lain dan di ujung sulur inilah akan muncul kantong-kantong yang sangat unik (Tim Redaksi, 2006). Daun nepenthes mempunyai helaian yang panjang berwarna hijau sampai hijau kekuningan dengan calon kantong terdapat di luar helaian daun keluar dari sulur berbentuk silinder dengan ukuran sama panjang atau lebih panjang dari daun. Ujung sulur yang berwarna kuning kehijauan berkembang menjadi kantong pada lingkungan yang sesuai (James dan Pietropaolo, 1996).
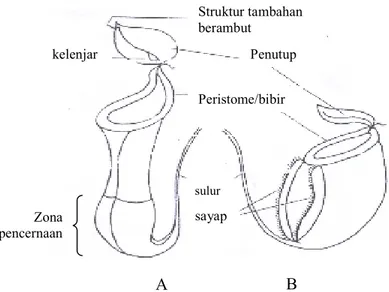
Tiap spesies tanaman nepenthes memiliki tipe kantong yang berbeda. Secara umum tanaman ini memiliki dua tipe kantong, yaitu kantong atas dan bawah (Gambar 6). Kantong bawah (kantong roset) biasanya memiliki mulut yang lebar. Kantong roset muncul pada tanaman yang relatif muda atau yang sudah dipangkas. Kantong atas bentuknya cenderung seperti corong jika dibandingkan kantong bawah. Kantong atas juga menyimpan cairan dalam jumlah sedikit dibandingkan kantong bawah sehingga lebih ringan. Kantong tersebut muncul pada ujung sulur yang memiliki warna dan bentuk yang beragam. Kantong itu juga berlubang dan terbuka, dengan tepi lubang yang disebut peristome. Kantong tertutup oleh penutup yang beraneka macam bentuknya pada awal pembentukan (Tim Redaksi, 2006).
Gambar 6. Tipe Kantong Nepenthes, Tipe Kantong Atas (A), dan Tipe Kantong Bawah (B) (Clarke, 1997).
A B kelenjar sulur Peristome/bibir sayap Penutup Struktur tambahan berambut Zona pencernaan
Biasanya serangga-serangga mendatangi kantong nepenthes karena tertarik oleh bentuk, warna dan aroma dari cairan nepenthes yang khas (Gambar 7). Cairan ini berguna untuk menjebak serangga atau binatang kecil lainnya yang terbang mengerumuni, sehingga terjerumus masuk ke dalam kantung (Pudjiastuti et al., 1997). Cairan khas ini sebenarnya merupakan enzim yang disebut proteolase. Enzim ini dikeluarkan oleh kelenjar yang ada pada dinding kantong di zona pencernaan yang berfungsi sebagai enzim pengurai. Enzim ini juga dikenal dengan sebutan nepenthesin, bekerja dengan cara menguraikan protein serangga atau binatang lain yang terperangkap di dalam cairan kantong menjadi zat-zat yang lebih sederhana, seperti nitrogen, fosfor, kalium dan garam-garam mineral. Zat-zat sederhana inilah yang kemudian diserap oleh tanaman untuk kebutuhan hidupnya. Aktivitas enzim ini sangat dipengaruhi oleh pH (keasaman) cairan kantong dan setiap jenis nepenthes memiliki nilai pH yang berbeda, umumnya di bawah 4 (Mansur, 2007).
Ekologi
Seperti kebanyakan carnivorous plant lainnya, nepenthes tumbuh pada tanah yang miskin unsur hara, seperti tanah kapur, tanah pasir, tanah merah dan tanah gambut. Umumnya, tanah-tanah tersebut kekurangan unsur nitrogen dan fosfor. Dengan kondisi ini sering kali nepenthes dijadikan sebagai indikator bahwa tempat tersebut merupakan tanah marginal (Mansur, 2007).
Dilihat dari segi geografis, tanaman ini tumbuh di daerah tropis yang basah dan tersebar mulai dari Madagaskar, Kepulauan Seychelles, Srilanka, India, menyebrang ke Cina, Asia Tenggara, Papua, Australia dan Kaledonia Baru. Menurut James dan Pietropaolo (1996), penyebaran nepenthes juga terbatas di daerah-daerah tropis di dunia. Clarke (1997) menambahkan bahwa populasi paling banyak terdapat di Pulau Kalimantan dan Sumatra.
Menurut Mansur (2007), N. mirabilis memiliki daya adaptasi lebih tinggi daripada N. gracilis dan jenis nepenthes lainnya. Jenis ini dapat hidup di berbagai habitat pada tempat-tempat yang basah dan kering. Penyebaran N. mirabilis juga sangat luas di Asia Tenggara. Di Indonesia tumbuh mulai dari Sumatera, Jawa, Kalimantan, Sulawesi hingga ke Irian Jaya. N. mirabilis umumnya ditemukan tumbuh baik di bawah ketinggian 500 m dpl pada tanah podsolik merah, tanah liat, tanah gambut, maupun tanah kapur. Tanaman ini juga sering tumbuh bersama dengan jenis nepenthes lainnya, khususnya N. reinwardthiana, N. rafflesiana, N. gracilis, N. ampullaria dan N. bicalcarata sehingga sering terjadi silang alami antara N. mirabilis dan jenis nepenthes lain (Gambar 8).
(A) (B)
Gambar 8. N.hookeriana x N.mirabilis (Tim Redaksi, 2006), dan N.gracilis x N.mirabilis (Mansur, 2007) (B).
Kultur Jaringan Tanaman
Kultur jaringan merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi yang aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap kembali. Pada mulanya, orientasi teknik kultur jaringan hanya pada pembuktian teori totipotensi sel. Kemudian hal ini menjadi sarana penelitian di bidang fisiologi tanaman dan aspek-aspek biokimia tanaman (Gunawan, 1987).
Perbanyakan mikro beberapa tanaman yang biasa diperbanyak secara vegetatif, merupakan contoh aspek yang menarik dari penerapan kultur jaringan. Teknik kultur jaringan juga dapat diterapkan dalam pemuliaan tanaman untuk mempercepat pencapaian tujuan dan membantu dimana cara-cara konvensional menemui rintangan alamiah (Gunawan, 1987).
Teknik kultur jaringan tanaman terdiri dari beberapa tahapan yang secara umum terdiri dari: tahap persiapan, tahap inisiasi kultur, tahap multiplikasi tunas, tahap pemanjangan tunas, induksi akar dan perkembangan akar dan tahap terakhir berupa pemindahan ke rumah kaca (aklimatisasi).
Salah satu teknik yang dilakukan di kultur jaringan yaitu subkultur. Subkultur merupakan pemindahan kultur ke media yang baru, baik media yang sama maupun media yang komposisi kimianya berbeda (Gunawan, 1992). Subkultur dapat menjadi kebutuhan untuk memperbanyak tanaman dan mempertahankan kultur (George dan Sherrington, 1984). Pierik (1987) juga menyatakan bahwa subkultur perlu dilakukan jika unsur hara dan hormon yang terdapat pada media telah berkurang atau habis, untuk merubah pola pertumbuhan dan perkembangan kultur, serta bila kultur telah memenuhi botol kultur.
Cahaya dalam kultur jaringan berguna untuk mengatur proses-proses morfogenik tertentu seperti pembentukan pucuk dan akar, dan tidak untuk fotosintesis karena sumber energi bagi eksplan telah disediakan oleh sukrosa (George dan Sherrington, 1984). Cahaya juga penting dalam pengendalian perkembangan eksplan dan unsur-unsur cahaya yang perlu diperhatikan adalah kualitas cahaya, panjang penyinaran dan intensitas cahaya. Temperatur ruang kultur juga menentukan respon fisiologi kultur dan kecepatan pertumbuhannya
(Gunawan, 1987). Armini et al. (1991), menambahkan bahwa fotosintesis jaringan sebagian besar jenis tanaman secara in vitro sangat rendah dan sebagian besar tergantung pada suplai sukrosa dari luar (medium kultur). Dalam hal ini cahaya sangat penting untuk fotomorfogenesis. Fotomorfogenesis merupakan proses menginduksi perkembangan suatu tanaman dan tidak melibatkan energi cahaya dalam jumlah besar. Reaksi fotomorfogenesis dibagi menurut tipe bagian spektrum yang menghasilkan respon. Respon yang utama adalah yang diinduksi oleh spekrum cahaya merah atau biru.
Faktor-faktor yang Mempengaruhi Keberhasilan Kultur Jaringan
Faktor-faktor yang berpengaruh terhadap pertumbuhan dan perkembangan propagul in vitro adalah eksplan, media tanam, kondisi fisik media, Zat Pengatur Tumbuh (ZPT) dan lingkungan tumbuh (Wattimena et al., 1992).
Eksplan
Eksplan merupakan sebutan bagi bahan tanaman yang dikulturkan. Menurut Harjadi (1989) bagian tanaman yang dijadikan sebagai eksplan mencakup ujung pucuk (shoot tips), irisan-irisan batang, daun, daun bunga, daun keping biji, akar, buah, embrio, meristem pucuk apikal (yang betul-betul merupakan titik tumbuh) dan jaringan nuselar. Rasco jr dan Maquilan (2005) menggunakan eksplan biji pada studi perkecambahan N. truncata, dan Sayekti (2007) juga menggunakan eksplan biji pada studi perkecambahan N. mirabilis dan N. ampularia.
Menurut Gunawan (1987), eksplan harus diusahakan agar dalam keadaan aseptik melalui prosedur sterilisasi dengan berbagai bahan kimia. Melalui eksplan yang aseptik kemudian diperoleh kultur yang axenik yaitu kultur dengan hanya satu macam organisme yang diinginkan.
Eksplan yang ditanam pada media tumbuh yang tepat dapat beregenerasi melalui proses yang disebut organogenesis atau embriogenesis. Organogenesis merupakan suatu proses terbentuknya organ-organ seperti pucuk dan akar. Sedangkan embriogenesis merupakan suatu proses terbentuknya embrio somatik.
Embrio yang terbentuk ini bukan dari zigot, melainkan dari sel biasa dari tubuh tanaman (Gunawan, 1987).
Menurut Gunawan (1987), ukuran eksplan yang dikulturkan turut menentukan keberhasilan dari suatu teknik kultur jaringan. Ukuran eksplan yang terlalu kecil akan kurang daya tahannya bila dikulturkan. Sedangkan bila ukurannya terlalu besar akan sulit didapatkan eksplan yang steril. Mariska dan Sukmadjaja (2003) juga menambahkan bahwa ukuran eksplan yang dapat digunakan dalam teknik kultur jaringan bervariasi dari ukuran mikroskopik (± 0,1 mm) hingga 5 cm.
Media Kultur
Gunawan (1987) menyatakan bahwa keberhasilan dalam penggunaan metode kultur jaringan sangat bergantung pada media yang digunakan. Media ini tidak hanya menyediakan unsur hara (makro dan mikro) tetapi juga karbohidrat (gula) untuk menggantikan karbon yang biasanya didapat dari atmosfer melalui fotosintesis. Hasil yang lebih baik akan kita peroleh, bila ke dalam media tersebut ditambahkan vitamin, asam amino dan zat pengatur tumbuh.
Umumnya media kultur jaringan tersusun atas komposisi hara makro, hara mikro, vitamin, gula, asam amino dan N-organik, persenyawaan kompleks alamiah (air kelapa, ekstak ragi, juice tomat, dsb), buffer, arang aktif, zat pengatur tumbuh (terutama auksin dan sitokinin) dan bahan pemadat. Faktor lain yang tidak kalah penting dalam teknik kultur jaringan adalah pengaturan pH media. Tingkat kemasaman media harus diatur supaya tidak mengganggu fungsi membran sel dan pH sitoplasma (Gunawan, 1987). Gamborg dan Shyluk (1981) menambahkan bahwa sel-sel tanaman membutuhkan pH yang sedikit asam berkisar antara 5.5-5.8.
Secara umum menurut Armini (1991), pembentukan tunas secara in vitro baik melalui morfogenesis langsung maupun tidak langsung sangat tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, in-organik dan zat pengatur tumbuh. Namun tidak berarti bahwa suatu kombinasi medium hanya untuk satu jenis tanaman.
Penambahan agar-agar ke dalam kultur bertujuan agar terjadinya kontak antara jaringan tanaman, media dan udara. Jika media berbentuk cair, kultur harus selalu digoyangkan dengan shaker agar aerasi yang baik tetap terjaga. Jika media tersebut tidak digoyang-goyangkan, eksplan akan tenggelam seluruhnya yang dapat menyebabkan terjadinya kematian eksplan karena kondisi anaerobik (Wetherell, 1982).
Sayekti (2007) menyatakan media ½ MS mampu menghasilkan waktu inisiasi berkecambah tercepat pada perkecambahan Nepenthes mirabilis (37.61 HST), jumlah daun terbanyak dan tanaman paling tinggi (3.99 mm). Tinggi tanaman terendah (1.07 mm) diperoleh pada media MS. Hal ini diduga terjadi karena adanya penghambatan pertumbuhan pada media MS yang disebabkan oleh konsentrasi garam yang tinggi.
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis (Wattimena, 1988). Dua golongan zat pengatur tumbuh yang penting dalam kultur jaringan yaitu auksin dan sitokinin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen menentukan arah perkembangan suatu kultur (Gunawan, 1987). Armini et al. (1991) menambahkan bahwa untuk pertumbuhan dan perkembangan kultur in vitro diperlukan komposisi dan atau konsentrasi zat pengatur tumbuh yang berbeda untuk satu varietas dengan varietas lain dari suatu tanaman. Penentuan taraf konsentrasi juga disesuaikan dengan tipe organ atau eksplan, metode kultur jaringan dan tingkat kultur jaringan (pembuatan kalus, induksi tunas, induksi akar, dan lain-lain).
Auksin banyak digunakan secara luas pada kultur jaringan dalam merangsang pertumbuhan kalus, suspensi sel dan organ (Gunawan, 1987). Bentuk-bentuk auksin yang biasa ditambahkan ke dalam media kultur adalah 2.4-D (2.4 2.4-Diclorophenoxy Asetic Acid), IBA (Indole Butyric Acid), NAA (Naphthalene Asetic Acid) dan IAA (Indole-3-Acetic Acid). Auksin yang secara alami terdapat dalam tumbuhan adalah IAA. Menurut Wattimena (1988), setelah ditemukan IAA sebagai salah satu fitohormon yang penting, maka disintesis senyawa-senyawa serupa dan diuji keaktifan biologis dari senyawa-senyawa tersebut. Asam naftalena asetat (NAA) dan 2.4-D merupakan senyawa tanpa ciri indol tapi mempunyai aktivitas biologis seperti IAA. NAA banyak digunakan sebagai hormon akar dan selang konsentrasi yang mendorong pembesaran sel-sel pada akar adalah sangat rendah. Menurut Zaer dan Mapes (1985), NAA memiliki sifat kimia lebih stabil dibanding IAA dan tidak mudah teroksidasi oleh enzim. Anwar (2007) menambahkan bahwa NAA merupakan IAA sintetik yang sering digunakan karena memiliki sifat yang lebih tahan, tidak terdegradasi dan lebih murah. Naphthalene Asetic Acid/Naphtyl Acetic Acid (NAA) memiliki berat molekul 186.21 dengan rumus molekul C12H10O2 (Gambar 9).
Gambar 9. Struktur Molekul NAA
Sitokinin merupakan senyawa organik yang menyebabkan pembelahan sel yang dikenal dengan proses sitokinesis. Menurut Wattimena (1988), sitokinin mempengaruhi berbagai proses fisiologis di dalam tanaman terutama mendorong pembelahan sel. Selain itu menurut Armini (1991), sitokinin juga berpengaruh dalam ploriferasi tunas ketiak, penghambatan pertumbuhan akar dan induksi umbi mikro pada kentang. Sitokinin yang biasa digunakan adalah kinetin, zeatin, 2iP (N6-2-Isopentanyl Adenin) , BAP (6-Benzyl Amino Purin), PBA, 2C 1-4 PU, 2.6-C1-4 dan TDZ (thidiazuron) (Gunawan, 1987).
6-Benzyl amino purine (BAP) merupakan sitokinin sintesis yang memiliki berat molekul sebesar 225.26 dengan rumus molekul C12H11N5. Wattimena (1988) menambahkan bahwa BAP merupakan turunan adenin yang disubstitusi pada posisi 6 adalah yang memiliki aktivitas kimia paling aktif (Gambar 10).
Gambar 10. Stuktur Molekul BAP (www.wuzhouchem.com)
Hasil penelitian Maryani dan Zamroni (2005), pada penggandaan tunas krisan secara in vitro apabila perlakuan tanpa BAP (0 ppm) ternyata memberikan jumlah akar banyak dan kecenderungan jumlah akar menurun dengan meningkatnya konsentrasi BAP. Keadaan ini membuktikan bahwa BAP mampu menekan pertumbuhan akar. Kemampuan menghambat pertumbuhan akar ini sangat penting dalam penggandaan tunas atau (multiplikasi). Nursandi (2006) juga menambahkan bahwa BAP dan TDZ bisa menghambat pembentukan akar nenas secara spontan pada konsentrasi yang berbeda, yaitu BAP dengan konsentrasi 17.76 µM sedangkan TDZ dengan konsentrasi 4.54 x 10-2 µM. Menurut Supriati et al., (2006), zat pengatur tumbuh BAP juga telah banyak digunakan pada berbagai spesies tanaman karena dapat meningkatkan multiplikasi tunas secara langsung maupun tidak langsung.
Aktivitas sitokinin tergantung juga dari aktivitas fitohormon yang lainnya, terutama auksin baik dalam efek menghambat maupun efek yang mendorong pembelahan sel (Wattimena, 1988). Sitokinin dan auksin memiliki peran yang sangat penting dalam hal menginduksi tunas adventif. Nisbah keduanya akan menentukan apakah suatu kalus akan membentuk tunas adventif, akar, atau tunas adventif dan akar (Armini et al., 1991). Menurut Gunawan (1992), nisbah auksin-sitokinin yang tinggi akan mendorong morfogenesis akar, sebaliknya nisbah sitokinin-auksin yang tinggi akan mendorong pembentukan tunas.
Kultur Jaringan Tanaman Karnivora
Salah satu yang meneliti perbanyakan tanaman karnivora secara in vitro yaitu Rasco dan Maquilan (2005) tentang perkecambahan Nepenthes truncata secara in vitro yang menghasilkan waktu inisiasi perkecambahan tercepat 18 hari setelah tanam (HST). Pada peubah persentase inisiasi perkecambahan hasil yang terbaik yaitu pada perlakuan media ¼ WPM (17.5%) diikuti ¾ KC (14 %) dan KC (13.8 %). Pada peubah rata-rata perkecambahan terbaik pada media MS (1.8 % perkecambahan per hari) dan peubah perkecambahan akhir terbaik pada media KC (95 %). Pada peubah bentuk kantong, kondisi daun dan panjang pucuk terbaik pada media ¼ KC.
Penelitian tentang pengaruh media terhadap pertumbuhan dan perkembangan Nepenthes mirabilis secara in vitro telah dilakukan oleh Sayekti (2007) dengan menghasilkan media perkecambahan yang terbaik adalah ¼ KC dan ½ MS. Media ½ MS mampu menghasilkan waktu inisiasi berkecambah tercepat yaitu pada 37.61 HST, tanaman tertinggi dengan nilai 3.99 mm dan jumlah daun terbanyak setiap minggu. Media ¼ KC menghasilkan waktu inisiasi kecambah pada 40.56 HST dan terbukti dapat menghasilkan jumlah akar terbanyak pada setiap minggu selama 12 minggu setelah tanaman berkecambah dan daun terpanjang (9.11 mm). Perbedaan waktu inisiasi diduga dipengaruhi oleh perbedaan spesies dan perbedaan masa simpan sebelum biji dikecambahkan.
Waktu dan Tempat
Penelitian ini berlangsung mulai bulan Oktober 2007 hingga Maret 2008. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan adalah tunas mikro Nepenthes mirabilis.
yang merupakan hasil dari penelitian Sayekti (2007) di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Media yang digunakan adalah ½ MS ditambah dengan zat pengatur tumbuh, yaitu sitokinin (BAP) dan auksin (NAA). Pengaturan pH media dengan menambahkan KOH (1 N) atau HCl (1 N). Bahan yang digunakan untuk sterilisasi berupa alkohol 70%. Bahan lainnya adalah agar-agar, gula pasir, aquades, karet gelang, plastik, tissue, spirtus dan label.
Alat yang digunakan antara lain botol kultur, pipet, cawan petri, labu takar, alat ukur gelas, pinset, gunting, scalpel, mata pisau, timbangan, pH paper, hand sprayer, bunsen, autoklaf dan laminar air flow cabinet. Rak penyimpanan kultur dilengkapi dengan lampu fluorescence yang mempunyai intensitas 1500-2000 lux sebagai sumber penyinaran dengan suhu ruang 20°-22°C.
Metode Penelitian
Penelitian ini disusun menggunakan Rancangan Acak Lengkap (RAL) dengan dua faktor yaitu konsentrasi BAP dan NAA pada media dasar yaitu ½ MS. Faktor pertama adalah BAP yang terdiri dari empat taraf konsentrasi, yaitu 0 ppm; 0.5 ppm; 1.0 ppm dan 2.0 ppm. Faktor kedua adalah NAA dengan empat taraf konsentrasi, yaitu 0 ppm; 0.1 ppm; 0.2 ppm dan 0.5 ppm. Penelitian ini terdiri dari 16 kombinasi perlakuan, masing-masing diulang sebanyak 10 kali sehingga terdapat 160 satuan percobaan dengan 1 eksplan untuk setiap ulangannya (1 botol kultur).
Model statistika yang digunakan sebagai berikut: Yijk = µ + αi + βj + (αβ)ij + ε ijk
Dimana:
Yijk = Nilai pengamatan unit percobaanpada taraf perlakuan BAP ke-i,
NAA ke-j, dan ulangan ke-k µ = Nilai tengah umum αi = Pengaruh BAP ke-i
βj = Pengaruh NAA ke-j
(αβ)ij = Nilai tambah pengaruh interaksi BAP ke-i dan NAA ke-j
εijk = Galat percobaan
i = 1, 2, 3 dan 4 j = 1, 2, 3 dan 4 k = 1, 2, … dan 10
Pengolahan data dilakukan dengan menggunakan uji F pada sistem SAS (Statistical Analysis Sistem). Perlakuan yang berpengaruh nyata pada uji F diuji lanjut menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5%.
Pelaksanaan Sterilisasi Alat, Botol dan Media Tanam
Sterilisasi merupakan kunci keberhasilan dari pelaksanaan kultur jaringan. Botol dan alat-alat yang akan dipakai dalam pembuatan media dan penanaman tunas nepenthes dicuci hingga bersih kemudian disterilkan ke dalam autoklaf pada temperatur 1210C dengan tekanan 17.5 psi dengan waktu satu jam. Penghitungan waktu dimulai saat tekanan yang diinginkan telah dicapai. Alat-alat yang perlu disterilkan yaitu pinset, gunting, pengaduk, erlenmeyer, botol kultur, gelas piala dan cawan petri.
Pembuatan larutan stok
Larutan stok dibuat sesuai dengan komposisi media MS yang disimpan dalam erlenmeyer dengan konsentrasi yang lebih pekat. Larutan stok F, vitamin dan myo-inositol disimpan dalam lemari es sedangkan stok A, B, C, D dan E disimpan dalam suhu kamar. Pembuatan larutan stok ini bertujuan untuk
memudahkan pekerjaan dalam pembuatan media. Larutan stok ini kemudian disimpan dalam lemari es.
Pembuatan Media Kultur
Media yang diperlukan dalam penelitian ini yaitu media ½ MS. Media ½ MS dibuat dengan memipet 10 ml larutan stok A, 10 ml larutan stok B, 2.5 ml larutan stok C, D dan E, 5 ml larutan stok F, 10 ml vitamin, 5 ml larutan stok myo-inositol ke dalam labu takar satu liter (Tabel Lampiran 1). Setelah itu ditambahkan NAA sebanyak 1 ml untuk mendapatkan media dengan konsentrasi 0.1 mg/l dari stok 100 mg/l NAA dan BA sebanyak 1 ml untuk mendapatkan media dengan konsentrasi 0.1 mg/l dari stok 100 mg/l BA. Kemudian gula dilarutkan sebanyak 20 gram dalam aquades dan dimasukkan ke dalam larutan media setelah disaring lebih dahulu. Volume ditetapkan dengan menambahkan aquades hingga 1 liter. Kemasaman media diukur menggunakan pH meter 6.0 diatur dengan penambahan KOH atau HCl.
Larutan media tersebut dipindahkan ke panci pemanas yang volumenya 1 liter lalu ditambahkan agar-agar sebanyak 6 gram. Larutan media tersebut di panaskan sambil diaduk-aduk. Botol kultur yang telah steril disiapkan untuk menempatkan larutan agar-agar tersebut. Larutan media yang telah mendidih dituang ke botol kultur yang telah disiapkan. Botol ditutup rapat dengan plastik setelah semua media dituang ke botol kultur. Botol-botol yang telah terisi media disterilkan dengan autoklaf pada suhu 1210 C dan tekanan 17.5 psi selama 30 menit. Media steril disimpan dalam ruang penyimpan media. Media ini dapat digunakan setelah diinkubasi selama 4 hari dan bebas dari kontaminasi.
Persiapan Ruang Tanam
Seluruh permukaan laminar air flow cabinet sebelumnya dibersihkan terlebih dahulu dengan di lap menggunakan alkohol 70% lalu di sterilkan dengan sinar Ultra Violet selama 1 jam sebelum proses penanaman dilakukan. Semua alat dan bahan yang akan dipakai harus disemprot dengan alkohol 70% sebelum dimasukkan ke dalam laminar air flow cabinet. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi.
Penanaman
Eksplan tunas Nepenthes mirabilis dikeluarkan dari botol kultur dan dipilih yang memiliki penampilan baik. Kriteria tunas yang baik yaitu tanaman
Nepenthes mirabilis yang pertumbuhannya baik, daunnya hijau cerah tidak berwarna kuning, tidak vitrus, pertumbuhannya tidak merana seperti kekurangan hara dan tidak berbentuk kalus. Eksplan diperoleh dari tunas yang dipotong dari pangkal batang tanpa akar, tiap potongan masing-masing memiliki 5 buku. Ujung tanaman yang memiliki tunas apikal di potong agar semua eksplan seragam. Hal ini dilakukan untuk menghilangkan dominasi tunas apikal pada pucuk tersebut. Potongan kecil ini kemudian ditanam di media perlakuan. Setiap botol kultur terdiri dari 1 eksplan. Botol kultur diletakkan di rak kultur di bawah cahaya penuh.
Pemeliharaan
Botol kultur diletakkan pada rak kultur selama 16 minggu. Kondisi ruang kultur dijaga pada suhu 20-22 °C dan dijaga kebersihannya agar terhindar dari kontaminasi.
Pengamatan
Pengamatan dilakukan setiap hari dan minggu selama 16 minggu setelah tanam. Peubah yang diamati:
1. Waktu inisiasi tunas, diamati setiap hari setelah tanam.
2. Waktu inisiasi daun, diamati setiap hari setelah eksplan bertunas.
3. Waktu inisiasi kantong, diamati setiap hari setelah eksplan memiliki daun. 4. Waktu inisiasi akar, diamati setiap hari selama 16 minggu setelah tanam. 5. Jumlah tunas diamati setiap minggu setelah tanam.
6. Jumlah daun diamati setiap minggu dimulai setelah munculnya tunas. 7. Jumlah kantong diamati setiap minggu dimulai setelah munculnya daun. 8. Jumlah akar diamati setiap minggu dimulai setelah munculnya tunas. 9. Panjang daun terpanjang, panjang akar terpanjang dan tinggi tanaman
diamati pada minggu terakhir pengamatan dengan cara mengeluarkan tanaman dari botol kultur kemudian diukur menggunakan milimeter block.
HASIL DAN PEMBAHASAN
Kondisi Umum
Eksplan (tunas mikro Nepenthes mirabilis) yang digunakan dalam
penelitian ini berasal dari penelitian sebelumnya yang telah dilakukan oleh Sayekti (2007) di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Ekplan tersebut telah berumur sekitar satu tahun (Gambar 11).
Gambar 11. Tanaman Induk yang Digunakan Sebagai Eksplan.
Kontaminasi terjadi pada minggu ketiga setelah tanam (MST) sebesar 15%. Terjadinya kontaminasi pada eksplan diduga karena beberapa hal, antara lain kurang sterilnya ruang tanam maupun laminar air flow cabinet saat penanaman dan ruang kultur yang terekspos lingkungan luar yang tidak steril serta kurangnya perlakuan sterilisasi pada ruang kultur. Kontaminan yang ditemukan selama pengamatan yaitu cendawan dan bakteri (Gambar 12). Kultur yang terkontaminasi cendawan ditandai dengan adanya benang-benang hifa maupun spora cendawan pada tunas, media ataupun botol kultur, sedangkan tunas yang terkontaminasi oleh bakteri ditandai dengan munculnya lendir pada eksplan maupun pada media perlakuan. Menurut Gunawan (1992), inisiasi kultur yang bebas kontaminasi merupakan langkah yang sangat penting. Kontaminan akan tumbuh dengan cepat pada media yang mengandung gula, vitamin dan mineral
bila faktor kontaminasi tidak dihilangkan. Eksplan dapat mati sebagai akibat langsung dari serangan cendawan atau bakteri atau secara tidak langsung akibat persenyawaan toksik yang diproduksi cendawan atau bakteri.
(A) (B)
Gambar 12. Kontaminasi yang Disebabkan oleh Cendawan (A); dan yang Disebabkan oleh Bakteri (B).
Eksplan pada penelitian ini menghasilkan kantong seperti tanaman yang berada di lapang. Kantong terbentuk di setiap ujung daun. Kantong-kantong tersebut memiliki ukuran yang beragam menyesuaikan dengan bentuk daun yang ada (Gambar 13).
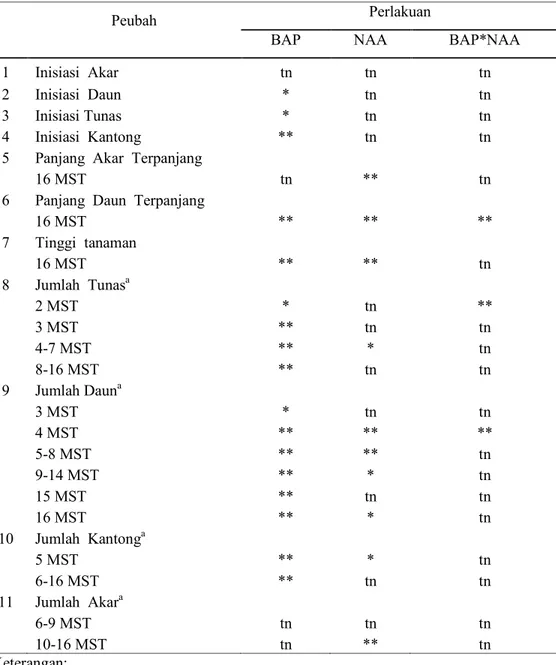
Rekapitulasi sidik ragam (Tabel 1) menunjukkan pengaruh BAP nyata terhadap inisiasi tunas dan inisiasi daun dan sangat nyata terhadap inisiasi kantong, panjang daun terpanjang dan tinggi tanaman. BAP memberikan pengaruh yang nyata pada 2 MST dan sangat nyata pada 3 hingga 16 MST terhadap jumlah tunas yang terbentuk. BAP juga memberikan pengaruh yang nyata pada 3 MST dan sangat nyata pada 4 hingga 16 MST terhadap jumlah daun dan pengaruh sangat nyata terhadap jumlah kantong pada 5-16 MST.
NAA memberikan pengaruh yang sangat nyata terhadap panjang akar terpanjang, panjang daun terpanjang, tinggi tanaman dan jumlah akar pada 10 hingga 16 MST. NAA memberi pengaruh nyata terhadap jumlah tunas pada 3 hingga 7 MST dan terhadap jumlah kantong pada 5 MST. NAA juga menunjukkan pengaruh sangat nyata terhadap jumlah daun pada 4 hingga 8 MST dan pengaruh nyata pada 9-14 MST dan 16 MST.
Kombinasi antara BAP dan NAA memberikan pengaruh sangat nyata terhadap panjang daun terpanjang, jumlah tunas pada 2 MST dan jumlah daun pada 4 MST.
Tabel 1. Rekapitulasi Sidik Ragam Respon Peubah yang Diamati pada Kultur Nepenthes mirabilis
Peubah Perlakuan
BAP NAA BAP*NAA
1 Inisiasi Akar tn tn tn 2 Inisiasi Daun * tn tn 3 Inisiasi Tunas * tn tn 4 Inisiasi Kantong ** tn tn 5 Panjang Akar Terpanjang
16 MST tn ** tn
6 Panjang Daun Terpanjang
16 MST ** ** ** 7 Tinggi tanaman 16 MST ** ** tn 8 Jumlah Tunasa 2 MST * tn ** 3 MST ** tn tn 4-7 MST ** * tn 8-16 MST ** tn tn 9 Jumlah Dauna 3 MST * tn tn 4 MST ** ** ** 5-8 MST ** ** tn 9-14 MST ** * tn 15 MST ** tn tn 16 MST ** * tn 10 Jumlah Kantonga 5 MST ** * tn 6-16 MST ** tn tn 11 Jumlah Akara 6-9 MST tn tn tn 10-16 MST tn ** tn Keterangan:
tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5% ** : Sangat nyata pada uji F 5% a : Hasil Transformasi √(x+0.5) MST : Minggu Setelah Tanam
Waktu Inisiasi tunas
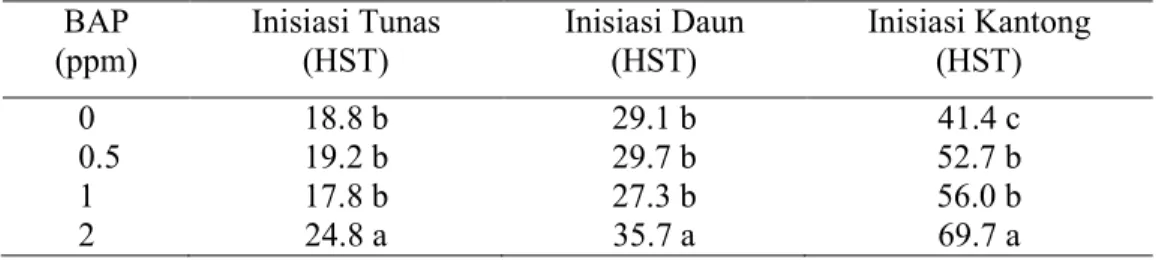
Berdasarkan hasil sidik ragam, pemberian kombinasi BAP dan NAA tidak memberikan pengaruh yang nyata terhadap waktu inisiasi tunas mikro Nepenthes mirabilis. Pengaruh yang nyata diperoleh dari pemberian BAP secara tunggal
(Tabel 2). Pemberian BAP hingga 1 ppm mampu menghasilkan waktu inisiasi tunas tercepat. Peningkatan konsentrasi BAP menjadi 2 ppm justru memperlambat waktu inisiasi tunas.
Tabel 2. Pengaruh Pemberian BAP terhadap Waktu Inisiasi Tunas, Inisiasi Daun dan Inisiasi kantong Nepenthes mirabilis.
BAP
(ppm) Inisiasi Tunas (HST) Inisiasi Daun (HST) Inisiasi Kantong (HST)
0 18.8 b 29.1 b 41.4 c
0.5 19.2 b 29.7 b 52.7 b
1 17.8 b 27.3 b 56.0 b
2 24.8 a 35.7 a 69.7 a
Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Data pada tabel 2 memperlihatkan waktu inisiasi tunas terjadi pada konsentrasi BAP rendah atau tanpa pemberian BAP. Hal ini diduga adanya akumulasi sitokinin endogen yang cukup tinggi pada tanaman induk nepenthes yang dijadikan eksplan, sehingga dengan pemberian BAP lebih dari 1 ppm akan menghambat inisiasi tunas. Pada perbanyakan klon lili yang dilakukan oleh Setiawati (2003), konsentrasi sitokinin yang tinggi akan mempercepat inisiasi tunas. Waktu inisiasi tunas lili paling cepat terjadi pada klon 500-2 pada media MS + BA 2 mg/l + NAA 1 mg/l (13 HST). Klon yang paling lambat bertunas yaitu klon 500-3, pada media MS + BA 1 mg/l + NAA 1 mg/1 (23 HST).
Menurut Gunawan (1992), sitokinin sering berperan penting dalam pengaturan pembelahan sel. Mufa’adi (2003) juga menyatakan tanaman terpacu untuk lebih cepat melakukan multiplikasi tunas disebabkan oleh pemberian sitokinin BAP. Pada penelitian ini pengaruh BAP 0, 0.5 dan 1 ppm tidak menghasilkan perbedaan yang nyata dalam mempercepat waktu munculnya tunas sehingga tanpa pemberian BAP pun dapat menginisiasi tunas mikro Nepenthes dengan cepat. Menurut Sudarmonowati et al. (2002), apabila penggunaan tanpa
hormon tidak berpengaruh nyata maka tidak diperlukan penggunaan BAP sehingga biaya produksi akan jauh lebih murah.
Tahap inisiasi tunas diawali dengan munculnya calon tunas berupa tonjolan kecil menyerupai calon batang berwarna hijau (Gambar 14). Umumnya inisiasi tunas ini terjadi pada minggu kedua setelah tanam, sekitar satu minggu kemudian muncul daun pertama yang berukuran sangat kecil pada tunas tersebut.
(A) (B)
Gambar 14. Tahap Perkembangan Eksplan dari Sebelum Bertunas (A) dan Setelah 2 MST (B).
Waktu Inisiasi Daun
Berdasarkan hasil sidik ragam, kombinasi BAP dan NAA tidak memberikan pengaruh yang nyata terhadap waktu inisiasi daun. Pemberian BAP secara tunggal memberikan pengaruh yang nyata terhadap waktu inisiasi daun (Tabel 2). Pemberian BAP hingga 1 ppm mampu menghasilkan waktu inisiasi daun tercepat. Hasil ini sesuai dengan waktu inisiasi tunas pada tabel 2, karena inisiasi daun terjadi setelah inisiasi tunas sebelumnya.
Inisiasi daun terbentuk sekitar satu minggu setelah adanya inisiasi tunas pada eksplan. Daun pertama yang terbentuk berukuran sangat kecil (Gambar 15). Daun pertama ukurannya seperti tereduksi dan belum memiliki kantong di ujungnya. Daun yang terbentuk berikutnya memiliki ukuran dan bentuk yang normal.
Gambar 15. Inisiasi Daun pada Eksplan Nepenthes.
Bentuk dan ukuran daun eksplan umumnya normal seperti tanaman induk. Pada perlakuan NAA 0.1 ppm, NAA 0.2 ppm dan NAA 0.5 ppm ukuran daun seperti tereduksi sehingga berukuran kecil (Gambar 16). Hal ini mengindikasikan bahwa pertumbuhan eksplan tersebut lambat. Keadaan ini diduga karena perlakuan tersebut tidak mendapat tambahan sitokinin eksogen, yaitu BAP.
(A) (B)
Gambar 16. Ukuran Daun Nepenthes pada Perlakuan NAA 0.2 ppm (A) dan Perlakuan NAA 0.5 ppm (B).
Waktu Inisiasi Kantong
Pemberian BAP secara tunggal memberikan pengaruh yang sangat nyata terhadap waktu inisiasi kantong Nepenthes mirabilis. Data pada tabel 2
memperlihatkan perlakuan tanpa pemberian BAP mampu memberikan waktu inisiasi kantong tercepat. Pemberian BAP 2 ppm justru memberikan waktu inisiasi kantong paling lama. Hal ini terjadi karena BAP 2 ppm memiliki waktu inisiasi daun terlama sehingga proses pembentukan kantong pun menjadi terhambat.
Inisiasi kantong nepenthes terjadi setelah daun terbentuk sempurna. Kantong-kantong tersebut umumnya mulai terbentuk pada daun kedua di setiap eksplan (Gambar 17). Kantong yang terbentuk mulanya berukuran sangat kecil dan lama-kelamaan akan membesar menyesuaikan dengan ukuran daunnya.
Gambar 17. Inisiasi Kantong pada Eksplan Nepenthes.
Waktu Inisiasi Akar
Berdasarkan hasil sidik ragam, pemberian BAP dan NAA memberikan pengaruh yang tidak berbeda nyata terhadap waktu inisiasi akar tunas Nepenthes mirabilis, baik secara tunggal maupun kombinasi. Umumnya akar akan terbentuk
apabila nisbah konsentrasi sitokinin dan auksin rendah. Menurut Sukawan (2000), pembentukan akar selain dipengaruhi oleh pemberian auksin eksogen juga dipengaruhi oleh perbedaan genetik yang disebabkan oleh eksplan yang digunakan dan kandungan sitokinin endogennya.
Tabel 3. Pengaruh Pemberian BAP dan NAA terhadap Waktu Inisiasi Akar Nepenthes mirabilis
Perlakuan Waktu Inisiasi Akar (HST)
BAP (ppm) 0 70.7 0.5 80.2 1 74.0 2 77.7 NAA (ppm) 0 0.1 0.2 0.5 74.2 82.7 73.8 91.5
Menurut Sukawan (2000), pembentukan akar ditentukan oleh keseimbangan yang tepat antara auksin dan nutrisi. Auksin bertindak sebagai
trigger pada level transkripsi dan nutrisi sebagai sumber karbon untuk mengatur
translasi dalam sintesis protein yang diperlukan untuk diferensiasi aktivitas kambium menjadi primordial akar dan perkembangan dari primordial akar.
Inisiasi akar yang terjadi pada penelitian ini membutuhkan waktu yang cukup lama (Gambar 18). Menurut Pierik (1987), sitokinin efektif dalam menghambat inisiasi akar. Rasco jr dan Maquilan (2005) juga menambahkan bahwa untuk menghindari tekanan osmotik, kekurangan air dan nutrisi memungkinkan terjadinya penghambatan pertumbuhan akar pada perkecambahan
Nepenthes truncata di media MS.
Jumlah Tunas
Pemberian BAP dan NAA secara tunggal memberikan pengaruh nyata terhadap rata-rata jumlah tunas Nepenthes mirabilis pada 2-16 MST. Kombinasi
pemberian NAA dan BAP hanya memberikan hasil yang nyata terhadap jumlah tunas pada 2 MST.
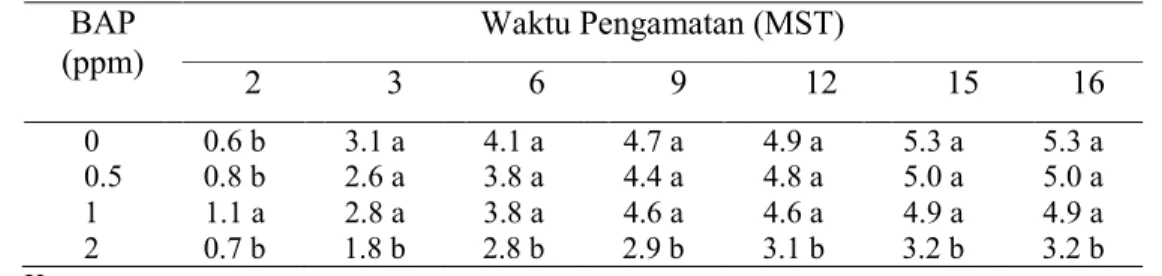
Rata-rata jumlah tunas umumnya meningkat pada semua perlakuan BAP setiap minggunya (Tabel 4). Penggunaan 0, 0.5 dan 1 ppm BAP tidak berbeda nyata terhadap rata-rata jumlah tunas yang dihasilkan. Pemberian BAP 2 ppm menghasilkan jumlah tunas yang lebih rendah daripada pemberian konsentrasi BAP yang lain.
Tabel 4. Pengaruh Pemberian BAP Terhadap Rata-rata Jumlah Tunas Nepenthes mirabilis pada 2-16 MST
BAP (ppm) 2 3 Waktu Pengamatan (MST) 6 9 12 15 16 0 0.6 b 3.1 a 4.1 a 4.7 a 4.9 a 5.3 a 5.3 a 0.5 0.8 b 2.6 a 3.8 a 4.4 a 4.8 a 5.0 a 5.0 a 1 1.1 a 2.8 a 3.8 a 4.6 a 4.6 a 4.9 a 4.9 a 2 0.7 b 1.8 b 2.8 b 2.9 b 3.1 b 3.2 b 3.2 b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Data merupakan hasil transformasi √(x+0.5).
Data pada tabel 4 memperlihatkan bahwa nepenthes sudah mampu menghasilkan rata-rata jumlah tunas yang banyak dengan konsentrasi BAP yang rendah atau tanpa penambahan BAP. Pemberian BAP hingga 1 ppm menghasilkan jumlah tunas yang banyak, sedangkan BAP 2 ppm menunjukkan penurunan jumlah tunas (Gambar 19). Hal ini diduga karena adanya kandungan sitokinin endogen yang cukup tinggi pada eksplan, sehingga dengan penambahan BAP berkonsentrasi rendah sudah mampu merangsang tanaman untuk manghasilkan tunas yang banyak.
(A) (B)
Gambar 19. Jumlah Tunas yang Dihasilkan pada Perlakuan BAP 1 ppm (A) dan Perlakuan BAP 2 ppm (B).
Penelitian kultur kaspea yang telah dilakukan oleh Wydiastuti (2001), juga menghasilkan jumlah tunas yang semakin banyak dengan meningkatnya konsentrasi BAP hingga 1 ppm, sedangkan BAP 2 ppm menunjukkan penurunan jumlah tunas. Menurut Wydiastuti (2001), diduga pada konsentrasi 2 ppm tanaman sudah tidak responsif terhadap penambahan BAP dan pertumbuhannya menjadi terhambat.
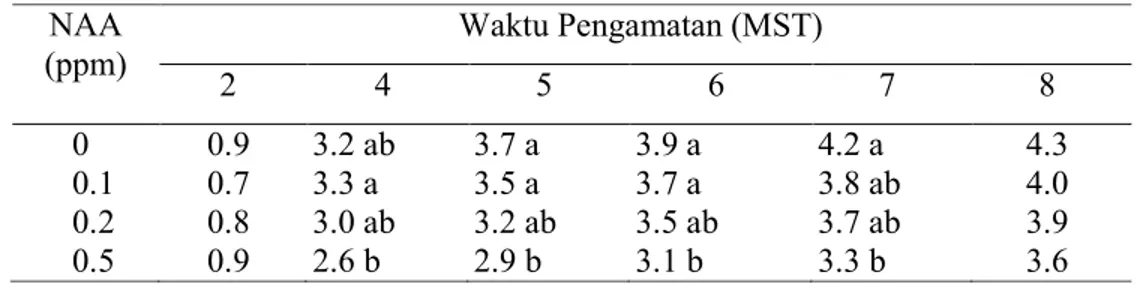
Tanaman yang tidak diberikan NAA mampu menghasilkan jumlah tunas paling banyak pada 5 hingga 8 MST (Tabel 5). Semakin meningkatnya konsentrasi NAA, jumlah tunas yang dihasilkan semakin sedikit (Gambar 20). Keadaan ini terjadi karena pada konsentrasi yang tinggi auksin akan menghambat pertumbuhan tunas. Hal ini sesuai dengan yang diutarakan oleh Gunawan (1992), dimana nisbah auksin-sitokinin yang tinggi akan mendorong morfogenesis akar, sebaliknya nisbah sitokinin-auksin yang tinggi akan mendorong pembentukan tunas.
Tabel 5. Pengaruh Pemberian NAA Terhadap Rata-rata Jumlah Tunas Nepenthes mirabilis pada 2-8 MST
NAA (ppm) Waktu Pengamatan (MST) 2 4 5 6 7 8 0 0.9 3.2 ab 3.7 a 3.9 a 4.2 a 4.3 0.1 0.7 3.3 a 3.5 a 3.7 a 3.8 ab 4.0 0.2 0.8 3.0 ab 3.2 ab 3.5 ab 3.7 ab 3.9 0.5 0.9 2.6 b 2.9 b 3.1 b 3.3 b 3.6 Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT
Data merupakan hasil transformasi √(x+0.5).
(A) (B)
Gambar 20. Jumlah Tunas yang Dihasilkan pada Perlakuan NAA 0.1 ppm (A) dan Perlakuan NAA 0.5 ppm (B).
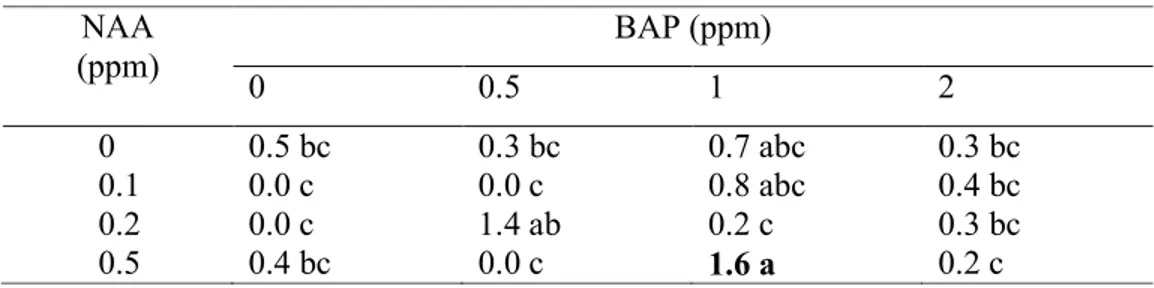
Data pada tabel 6 memperlihatkan pengaruh interaksi BAP dan NAA, perlakuan BAP 1 ppm + NAA 0.5 ppm merupakan perlakuan yang mampu menghasilkan jumlah tunas terbanyak pada 2 MST yaitu 1.6 tunas per eksplan (Gambar 21). Menurut Sayekti (2007), pertumbuhan nepenthes setelah berkecambah relatif lambat jika dibandingkan dengan pertumbuhan tanaman
herbaceous lain secara in vitro tetapi jauh lebih cepat jika dibandingkan dengan
Tabel 6. Pengaruh Interaksi BAP dan NAA Terhadap Rata-rata Jumlah Tunas Nepenthes mirabilis pada 2 MST
NAA (ppm) BAP (ppm) 0 0.5 1 2 0 0.5 bc 0.3 bc 0.7 abc 0.3 bc 0.1 0.0 c 0.0 c 0.8 abc 0.4 bc 0.2 0.0 c 1.4 ab 0.2 c 0.3 bc 0.5 0.4 bc 0.0 c 1.6 a 0.2 c Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT 5%
Data merupakan hasil transformasi √(x+0.5).
Gambar 21. Jumlah Tunas pada Perlakuan BAP 1 ppm + NAA 0.5 ppm.
Jumlah Daun
Pemberian BAP dan NAA sebagai faktor tunggal memberikan pengaruh yang nyata terhadap jumlah daun Nepenthes mirabilis. Kombinasi pemberian
BAP dan NAA memberikan pengaruh yang nyata hanya pada 4 MST.
Rata-rata jumlah daun umumnya meningkat untuk perlakuan BAP setiap minggu (Tabel 7). Jumlah daun terbanyak dihasilkan oleh perlakuan tanpa pemberian BAP pada 6 hingga 16 MST. Seperti halnya jumlah tunas pada tabel 4, pemberian BAP 0, 0.5 dan 1 ppm mampu menghasilkan rata-rata jumlah daun paling banyak. Penggunaan BAP dalam konsentrasi rendah atau tidak ditambahkan BAP cukup efisien untuk menghasilkan jumlah daun yang banyak.
Tabel 7. Pengaruh Pemberian BAP Terhadap Rata-rata Jumlah Daun Nepenthes mirabilis pada 3-16 MST
BAP (ppm) Waktu Pengamatan (MST) 3 6 9 12 15 16 0 0.4 b 1.5 a 10.8 a 13.6 a 15.5 a 16.1 a 0.5 0.9 a 5.9 a 9.5 a 12.2 a 15.3 a 15.8 a 1 0.7 ab 6.4 a 9.9 a 12.8 a 14.7 a 15.7 a 2 0.3 b 2.7 b 4.6 b 6.4 b 8.1 b 8.5 b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Data merupakan hasil transformasi √(x+0.5).
Pertumbuhan daun pada nepenthes tergolong cukup lambat. Keadaan ini diindikasikan dari sedikitnya jumlah daun yang terbentuk setiap minggunya. Menurut Sayekti (2007), jumlah daun pada tanaman Nepenthes dapat dijadikan sebagai indikator jumlah buku dimana dalam tiap buku tersebut terdapat satu helai daun. Sedikitnya jumlah buku mempengaruhi jumlah bagian tanaman untuk disubkultur atau diperbanyak pada tahapan berikutnya.
Data pada tabel 8 memperlihatkan tanpa pemberian NAA mampu memberikan jumlah daun terbanyak pada setiap minggu pengamatan. Pemberian NAA 0.5 ppm menghasilkan jumlah daun lebih sedikit dari perlakuan lain
Tabel 8. Pengaruh Pemberian NAA Terhadap Rata-rata Jumlah Daun Nepenthes mirabilis pada 3-16 MST
NAA (ppm) Waktu Pengamatan (MST) 3 6 9 12 15 16 0 1.0 6.8 a 10.3 a 12.9 a 15.1 16.1 a 0.1 0.8 5.1 b 8.8 ab 11.4 ab 13.5 14.0 ab 0.2 0.9 5.3 b 8.2 b 10.7 ab 13.0 13.6 ab 0.5 0.6 4.3 b 7.6 b 10.0 b 12.0 12.4 b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT
Data pada tabel 9 memperlihatkan interaksi BAP dan NAA yang mampu memberikan jumlah daun terbanyak pada 4 MST yaitu perlakuan tanpa pemberian BAP dan NAA (4.1 daun per eksplan). Hal ini diduga karena tanaman memiliki kandungan sitokinin endogen yang cukup tinggi, sehingga tanpa penambahan BAP dan NAA tanaman dapat menghasilkan jumlah daun yang banyak (Gambar 22).
Tabel 9. Pengaruh Interaksi BAP dan NAA Terhadap Rata-rata Jumlah Daun Nepenthes mirabilis pada 4 MST
NAA (ppm) BAP (ppm) 0 0.5 1 2 0 4.1 a 2.7 ab 2.7 abc 1.0 cde 0.1 0.0 e 1.7 bcd 2.7 abc 0.9 cde 0.2 0.4 de 3.5 ab 2.0 abc 0.4 de 0.5 1.2 bcde 0.4 de 1.9 bcd 0.4 de Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT 5%
Data merupakan hasil transformasi √(x+0.5).
Gambar 22. Jumlah Daun Nepenthes pada Perlakuan Tanpa Penambahan Zat Pengatur Tumbuh.
Warna daun yang terbentuk secara umum tidak berbeda untuk semua perlakuan yaitu hijau kekuningan (Gambar 23). Warna kekuningan daun ini diduga karena tanaman kekurangan unsur besi dan magnesium pada media. Salisbury dan Ross (1995) menyatakan bahwa belum diketahui dengan jelas mengapa kekahatan besi dengan cepat dapat menghambat pembentukan klorofil. Tapi ada dua atau tiga macam enzim yang mengkatalis reaksi tertentu dalam
sintesis klorofil tampaknya memerlukan Fe2+. Salah satu bentuk besi yang mantap dan banyak terdapat di daun disimpan dalam kloroplas sebagai kompleks besi-protein yang disebut fitoferitin. Lakitan (2004) menambahkan bahwa
kekurangan magnesium juga dapat menyebabkan tanaman tidak dapat membentuk klorofil dengan sempurna. Magnesium merupakan unsur penyusun klorofil dan aktivator dari berbagai enzim dalam reaksi fotosintesis, respirasi, dan pembentukan DNA dan RNA.
Gambar 23. Warna Daun pada Eksplan Nepenthes mirabilis.
Sayekti (2007) juga mengemukakan warna kuning pada daun tanaman nepenthes disebabkan oleh pertumbuhan sel yang terlalu cepat tetapi tidak diikuti oleh pembentukan klorofil yang cepat. Selain itu diduga kandungan sukrosa pada media juga telah habis diserap tanaman, sehingga tanaman kekurangan sukrosa yang mengakibatkan daun berwarna kekuningan.
Jumlah Kantong
Pemberian BAP secara tunggal memberikan pengaruh yang sangat nyata terhadap jumlah kantong pada 5 hingga 16 MST. Jumlah kantong umumnya meningkat pada semua perlakuan BAP setiap minggunya (Tabel 10). Pemberian BAP hingga 1 ppm mampu menghasilkan jumlah kantong paling banyak. Hal ini sesuai dengan tabel 7, pemberian BAP hingga 1 ppm menghasilkan jumlah daun paling banyak sehingga akan menghasilkan jumlah kantong yang banyak juga.