MIKROPROPAGASI TUNAS STROBERI (Fragaria sp.) DENGAN PEMBERIAN NAA DAN BAP PADA MEDIA MS
SKRIPSI
Oleh :
HENDRI GUNAWAN SITEPU 020307013
BDP-PET
PROGRAM STUDI PEMULIAAN TANAMAN
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
MIKROPROPAGASI TUNAS STROBERI (Fragaria sp.) DENGAN PEMBERIAN NAA DAN BAP PADA MEDIA MS
SKRIPSI
Oleh :
HENDRI GUNAWAN SITEPU 020307013
BDP-PET
Skripsi Sebagai Salah Satu Syarat untuk Dapat Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI PEMULIAAN TANAMAN
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Skripsi : Mikropropagasi Tunas Stroberi dengan Pemberian NAA dan BAP pada Media MS
Nama : Hendri Gunawan Sitepu
NIM : 020307013
Departemen : Budidaya Pertanian Program Studi : Pemuliaan Tanaman
Disetujui oleh Komisi Pembimbing
Khairunnisa Lubis, SP, MP Ketua
Luthfi A M. Siregar, SP, MSc, PhD Anggota
Mengetahui
Ketua Jurusan
Ir. Edison Purba, Ph.D.
ABSTRACT
The objective of this research was to know the effect of strawberry bud micropropagation to BAP and NAA in MS medium. The research took place in Tissue Culture Laboratory on Kebun Percontohan Tanaman Buah, Tongkoh Berastagi + 1430 metres above sea surface from March until Mei 2007. The research was using randomized block design factorial with two factors. The first factor was NAA with three levels : 0, 0.5 and 1 ppm. The second factor was BAP with five levels : 0, 0.5, 1, 1.5 and 2 ppm. The result showed BAP gave that total bud, total roots, total leafs and explant weight significant affected, but no significant to age of bud initiation, age of roots initiation, hight bud, length of roots. NAA gave that age of roots initiation, total bud, total roots, total leafs, hight bud, length of roots, explant weight significant affected, but no significant to age of bud initiation. The interaction between BAP and NAA has significant for parameters total roots, total leafs, hight bud, but no significant to age of bud initiation, age of roots initiation, total bud, length of roots and explant weight.
ABSTRAK
Tujuan penelitian ini adalah untuk mengetahui adanya pengaruh konsentrasi zat pengatur tumbuh NAA dan BAP terhadap multiplikasi tunas stroberi pada media MS. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Kebun Percontohan Tanaman Buah, Tongkoh Berastagi yang berada + 1430 meter diatas permukaan laut dari bulan Maret sampai Mei 2007. Sedangkan penelitian ini menggunakan rancangan acak kelompok faktorial dengan dua faktor perlakuan. Faktor pertama adalah pemberian zat pengatur tumbuh NAA dengan tiga taraf yaitu : 0, 0.5 dan 1 ppm, serta faktor kedua adalah pemberian zat pengatur tumbuh BAP dengan lima taraf yaitu : 0, 0.5, 1, 1.5 dan 2 ppm. Hasil penelitian menunjukkan bahwa pemberian zat pengatur tumbuh BAP berpengaruh nyata terhadap parameter jumlah tunas, jumlah akar, jumlah daun, berat eksplan namun tidak berpengaruh nyata terhadap parameter umur muncul tunas, umur muncul akar, tinggi tunas, panjang akar. Pemberian zat pengatur tumbuh NAA berpengaruh nyata terhadap parameter umur muncul akar, jumlah tunas, jumlah akar, jumlah daun, tinggi tunas, panjang akar, berat eksplan namun berpengaruh tidak nyata terhadap parameter umur muncul tunas. Interaksi antara kedua perlakuan berpengaruh nyata terhadap parameter jumlah akar, jumlah daun, tinggi tunas namun berpengaruh tidak nyata terhadap parameter umur muncul tunas, umur muncul akar, jumlah tunas, panjang akar, berat eksplan.
RIWAYAT HIDUP
Hendri Gunawan Sitepu dilahirkan di Berastagi pada tanggal 8 Agustus
1984 dari Ayahanda (Alm) K. Sitepu dan Ibunda W. Br. Ginting. Penulis
merupakan putra ketiga dari 4 bersaudara.
Adapun pendidikan yang pernah ditempuh adalah SD Inpres di Perumahan
Korpri lulus tahun 1996, SLTP Negeri 1 Berastagi lulus tahun 1999, SMUN 1
Berastagi lulus pada tahun 2002. Terdaftar sebagai mahasiswa Pemuliaan
Tanaman Departemen Budidaya Pertanian, Fakultas Pertanian Universitas
Sumatera Utara pada tahun 2002 melalui jalur PMP.
Selama perkuliahan aktif dalam organisasi Ikatan Mahasiswa Karo (IMKA
Mbuah Page FP USU) dari tahun 2003-2007, pernah menjabat sebagai ketua
Badan Pengurus Harian periode 2005-2007. Menjabat sebagai Asisten
Laboratorium Pengantar Pemuliaan Tanaman tahun 2004-2006. Penulis
melaksanakan Praktek Kerja Lapangan (PKL) di PTPN IV Kebun Balimbingan
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT, atas berkat dan
rahmatnya penulis dapat menyelesaikan skripsi yang berjudul ” Mikropropagasi
Tunas Stroberi Dengan Pemberian BAP dan NAA Pada Media MS ” yang
merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas
Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini tidak lupa penulis mengucapkan terima kasih
yang sebesar-besarnya kepada Ibu Khairunnisa Lubis, SP, MP dan
Bapak Luthfi Aziz M. Siregar, SP, MSc, PhD selaku dosen pembimbing. Penulis
juga mengucapkan banyak terima kasih kepada Kepala BPTP Tongkoh,
Ibu Karsina SP, MS, Kak Rina, Kak Fetri, Kak Siska, Kak Ruth, dan staff yang
telah banyak membantu penulis dalam melaksanakan penelitian. Ucapan terima
kasih sebesar-besarnya yang tulus dan tak dapat diungkap dengan apapun penulis
sampaikan kepada Ayahanda (Alm) K. Sitepu dan Ibunda W. Ginting tercinta
yang telah membesarkan penulis dengan segenap cinta, kasih sayang dan
pengertian serta pengorbanan yang tak terhingga, juga kepada kakak tercinta
Juliawati Br Sitepu beserta abang iparku Jusman Riadi Sembiring, Desfitria Br
Sitepu dan adikku tersayang Muhammad Ridwan Sitepu serta keponakanku Via
yang telah memberikan dukungan kepada penulis selama melakukan studi.
Penulis sadar skripsi ini masih jauh dari sempurna, oleh karena itu penulis
mengharapkan kritik dan saran yang sifatnya membangun guna kesempurnaan
kepada seluruh pihak yang telah ikut membantu dalam melaksanakan penelitian
dan penulisan skripsi ini.
Medan, Oktober 2007
DAFTAR ISI
Hal.
ABSTRACT ... i
ABSTRAK ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian... 4
Hipotesis Penelitian ... 4
Kegunan Penelitian... 5
TINJAUAN PUSTAKA ... 6
Botani Tanaman ... 6
Syarat Tumbuh ... 10
Iklim ... 10
Tanah ... 10
Metoda Kultur Jaringan ... 11
Zat Pengatur Tumbuh dalam Kultur Jaringan ... 13
Auksin ... 14
Sitokinin ... 16
Kultur Jaringan Stroberi ... 17
BAHAN DAN METODE ... 19
Tempat dan Waktu Penelitian ... 19
Bahan dan Alat ... 19
Metode Penelitian ... 19
PELAKSANAAN PENELITIAN ... 22
Sterilisasi Bahan dan Alat ... 22
Pembuatan Media ... 22
Penanaman ... 23
Pemeliharaan ... 24
Parameter Yang Diamati ... 24
Saat Muncul Tunas ... 24
Saat Muncul Akar ... 24
Jumlah Tunas ... 24
Jumlah Akar ... 24
Tinggi Tunas ... 25
Panjang Akar ... 25
Berat Planlet ... 25
HASIL DAN PEMBAHASAN ... 26
Hasil ... 26
Pembahasan... 41
KESIMPULAN DAN SARAN ... 53
Kesimpulan ... 53
Saran ... 54
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
No Hal.
1. Rataan Umur Muncul Tunas Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 27
2. Rataan Umur Muncul Akar Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 27
3. Rataan Jumlah Tunas Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 29
4. Rataan Jumlah Akar Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 30
5. Rataan Jumlah Daun Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 33
6. Rataan Tinggi Tunas Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 36
7. Rataan Panjang Akar Pada Berbagai Konsentrasi NAA dan BAP (Transformasi √X + 0.5) ... 38
DAFTAR GAMBAR
No. Hal.
1. Struktur Senyawa Auksin Tiruan ... 15
2. Struktur Senyawa Sitokinin Sintetik Benziadeninpurin ... 16
3. Hubungan Antara Umur Muncul Akar dengan Konsentrasi NAA ... 28
4. Hubungan Antara Jumlah Tunas dengan Konsentrasi NAA ... 29
5. Hubungan Antara Jumlah Tunas dengan Konsentrasi BAP ... 30
6. Hubungan Interaksi Jumlah Akar dengan Konsentrasi NAA ... 31
7. Hubungan Interaksi Jumlah Akar dengan Konsentrasi BAP ... 32
8. Hubungan Antara Jumlah Akar dengan Konsentrasi NAA ... 32
9. Hubungan Antara Jumlah Akar dengan Konsentrasi BAP ... 33
10.Hubungan Interaksi Jumlah Daun dengan Konsentrasi NAA ... 34
11.Hubungan Interaksi Jumlah Daun dengan Konsentrasi BAP ... 34
12.Hubungan Antara Jumlah Daun dengan Konsentrasi NAA ... 35
13.Hubungan Antara Jumlah Daun dengan Konsentrasi BAP ... 35
14.Hubungan Interaksi Tinggi Tunas dengan Konsentrasi NAA ... 36
15.Hubungan Interaksi Tinggi Tunas dengan Konsentrasi BAP ... 37
16.Hubungan Antara Tinggi Tunas dengan Konsentrasi NAA ... 37
17.Hubungan Antara Panjang Akar dengan Konsentrasi NAA ... 39
18.Hubungan Antara Berat Eksplan dengan Konsentrasi NAA ... 40
DAFTAR LAMPIRAN
No Hal.
1. Data Pengamatan Umur Muncul Tunas ... 58
2. Data Transformasi Umur Muncul Tunas √ X + 0.5 ... ... 58
3. Daftar Sidik Ragam Data Transformasi Umur Muncul Tunas √X+0.5 ... 59
4. Data Pengamatan Umur Muncul Akar ... 60
5. Data Transformasi Umur Muncul Akar √ X + 0.5 ... ... 60
6. Daftar Sidik Ragam Data Transformasi Umur Muncul Akar √X+0.5.. 61
7. Data Pengamatan Jumlah Tunas ... 62
8. Data Transformasi Jumlah Tunas √ X + 0.5 ... ... 62
9. Daftar Sidik Ragam Data Transformasi Jumlah Tunas √X+0.5 ... 63
10.Data Pengamatan Jumlah Akar ... 64
11.Data Transformasi Jumlah Akar √ X + 0.5 ... ... 64
12.Daftar Sidik Ragam Data Transformasi Jumlah Akar √X+0.5 ... 65 13.Data Pengamatan Jumlah Daun ... 66
14.Data Transformasi Jumlah Daun √ X + 0.5 ... 66
15.Daftar Sidik Ragam Data Transformasi Jumlah Daun √X+0.5 ... 67
16.Data Pengamatan Tinggi Tunas ... 68
17.Data Transformasi Tinggi Tunas √ X + 0.5 ... ... 68
18.Daftar Sidik Ragam Data Transformasi Tingg i Tunas √X+0.5 ... 69
19.Data Pengamatan Panjang Akar ... 70
20.Data Transformasi Panjang Akar √ X + 0.5 ... ... 70
22.Data Pengamatan Berat Eksplan ... 72
23.Data Transformasi Berat Eksplan √ X + 0.5 ... ... 72
24.Daftar Sidik Ragam Data Transformasi Berat Eksplan √X+0.5 ... 73
25.Rangkuman Uji Beda Rataan ... 74
26.Komposisi Media Murashige Skoog... 75
27.Bagan Penelitian ... 76
28.Jadwal Kegiatan Penelitian ... 77
PENDAHULUAN
Latar Belakang
Tanaman stroberi telah dikenal sejak zaman Romawi, tetapi bukan jenis
yang dikenal saat ini. Stroberi yang dibudidayakan saat ini disebut juga stroberi
modern (komersial) dengan nama ilmiah Fragaria x ananassa L. var Duschene
dari Amerika Utara dengan Fragaria chiloensis L. var Duschene dari Chili,
Amerika Latin. Persilangan kedua jenis stroberi tersebut dilakukan pada tahun
1750. Persilangan-persilangan lebih lanjut menghasilkan jenis stroberi dengan
buah berukuran besar, harum dan manis (Budiman dan Saraswati, 2006).
Stroberi merupakan tanaman buah yang berupa herba dan ditemukan
pertama kali di Chili, Amerika Latin. Salah satu species tanaman stroberi,
Fragaria chiloensis L. telah menyebar ke berbagai negara di Amerika, Eropa dan
Asia. Sementara itu, species Fragaria vesca L. menyebar lebih luas dibanding
dengan species lainnya. Jenis stroberi ini pula yang pertama kali masuk ke
Indonesia. Di Indonesia, stroberi dikenal juga dengan nama arbei. Stroberi ini
dibudidayakan secara besar-besaran di sebagian negara besar (Kurnia, 2005).
Selain mengandung berbagai vitamin dan mineral, buah stroberi terutama
biji dan daunnya diketahui mengandung ellagic acid. Senyawa ini ternyata
berperan sebagai anti karsinogen dan anti mutagen yang sangat penting untuk
kesehatan manusia. Ellagic acid adalah suatu persenyawaan fenol yang berpotensi
sebagai penghambat kanker akibat dari persenyawaan-persenyawaan kimia
Dua studi terkini yang dipresentasikan pada konferensi dan pameran
American Dietelic Association Food and Nutrition menunjukkan bahwa selain
rendah lemak dan kalori, stroberi secara alami mengandung serat, vitamin C, asam
folat, kalium dan anti oksidan dalam jumlah tinggi. Kandungan tersebut
menjadikan alternatif yang bagus untuk meningkatkan kesehatan jantung,
mengurangi resiko terserang beberapa kanker, dan memberikan dorongan positif
terhadap kesehatan tubuh (Kurnia, 2005).
Tanaman stroberi diperbanyak dengan stolon/sulur. Namun untuk tanaman
hibrida tidak layak diperbanyak karena kualitas dan kuantitas hasilnya tidak
sebaik tanaman induk. Stolon sebenarnya tunas yang tumbuh dari bonggol batang
yang menjalar hingga mencapai 30 cm. Pada satu stolon biasanya muncul 4-5
anakan. Namun, yang baik digunakan untuk bibit adalah stolon pertama dan kedua
dari induknya. Stolon berikutnya tidak baik karena sifatnya sudah tidak sama lagi
dengan induknya (Budiman dan Saraswati, 2006).
Salah satu kelemahan perbanyakan secara vegetatif ini adalah masalah
potensi produktivitasnya dan daya tumbuh yang terus menerus menurun pada
generasi berikutnya. Hal ini disebabkan tanaman hasil perbanyakan vegetatif
adalah bagian dari tanaman induk yang tumbuh memisah. Jadi, jika perbanyakan
terus-menerus dilakukan, akan muncul tanaman baru yang sudah berumur tua.
Karena itu, sebaiknya ada batasan perlakuan perbanyakan vegetatif yang
dilakukan dari satu indukan (Kurnia, 2005).
Untuk memperbanyak tanaman stroberi sulit atau lambat diperbanyak
secara konvensional. Perbanyakan tanaman secara kultur jaringan menawarkan
waktu yang relatif singkat sehingga lebih ekonomis. Dari satu pucuk kecil dapat
dihasilkan rata-rata 15-20 pucuk per-8 minggu, tergantung kultivar. Pucuk akan
membentuk akar sehingga diperoleh tanaman lengkap. Ukuran tanaman lengkap
yang dihasilkan jauh lebih kecil dibandingkan tanaman dari anakan tinggi
tanaman kira-kira 2,5-3 cm dengan 4-6 helai daun. Namun, setelah beberapa
minggu ditanam dilapangan, tanaman hasil teknik in vitro dapat mengejar
pertumbuhan tanaman hasil anakan. Pucuk yang diperoleh dapat dipecah dan
ditanam lagi. Demikian seterusnya hingga dari satu pucuk diperoleh
berpuluh-puluh tanaman baru (Budiman dan Saraswati, 2006).
Pada tahun 1957, Skoog dan Miller mengemukakan bahwa regenerasi
tunas dan akar in vitro melalui proses organogenesis atau morfogenesis dikontrol
secara hormonal oleh zat pengatur tumbuh sitokinin dan auksin. Organogenesis
adalah proses terbentuknya organ seperti tunas atau akar, baik secara langsung
maupun melalui pembentukan kalus terlebih dahulu (Yusnita, 2003).
Media tumbuh berupa gula, vitamin, asam-asam amino, garam-garam
anorganik, air, fitohormon, dan bahan pemadat media berupa agar-agar.
Media tumbuh untuk kultur stroberi terdiri dari 4 macam yaitu:
media untuk inisiasi yang terdiri dari garam makro dari media Knop
(Knop didalam Budiman dan Saraswati, 2006) ditambahkan garam mikro dari
media MS. Media multiplikasi terdiri dari garam-garam makro dan mikro dari
media MS. Media pengakaran berupa media MS dan zat pengatur tumbuh yang
digunakan berupa 6-benzylamino purine (BAP), naphtaleneacetic acid (NAA),
Berdasarkan uraian diatas, maka penulis ingin melakukan penelitian untuk
mengetahui pengaruh kombinasi zat pengatur tumbuh terhadap mikropropagasi
tunas stroberi secara in vitro.
Tujuan Penelitian
Untuk mengetahui adanya pengaruh konsentrasi zat pengatur tumbuh BAP
dan NAA terhadap mikropropagasi tunas stroberi pada media MS.
Hipotesis Penelitian
1. Ada hubungan pemberian konsentrasi auksin NAA terhadap pertumbuhan
tunas pada kultur jaringan stroberi.
2. Ada hubungan pemberian konsentrasi sitokinin BAP terhadap
pertumbuhan tunas stroberi pada kultur jaringan.
3. Ada hubungan pemberian konsentrasi sitokinin dan konsentrasi auksin
NAA terhadap pertumbuhan tunas stroberi pada kultur jaringan.
Kegunaan Penelitian
1. Sebagai bahan penyusunan skripsi yang merupakan salah satu syarat untuk
memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera
Utara, Medan.
2. Sebagai bahan informasi bagi pihak yang membutuhkan dalam kultur
TINJAUAN PUSTAKA
Botani Tanaman
Menurut Lawrence (1960) tanaman stroberi diklasifikasikan kedalam:
Divisio : Spermatophyta
Sub divisio : Angiospermae
Kelas : Dicotyledonae
Family : Rosaceae
Genus : Fragaria
Species : Fragaria sp.
Tanaman stroberi dewasa biasanya memiliki 20 - 35 akar primer,
meskipun ada beberapa jenis yang memiliki akar primer lebih dari itu. Akar
primer ini umumnya berfungsi sekitar satu tahun dan selanjutnya akan muncul
akar-akar baru yang tumbuh dari ruas yang paling dekat dengan akar primer.
Akar-akar tanaman stroberi dewasa bisa mencapai kedalaman satu meter,
meskipun sebagian besar tidak berada jauh dari bagian atas tanaman
(Kurnia, 2005).
Tanaman stroberi dewasa umumnya mempunyai 20 - 35 akar primer
dengan panjang akar sekitar 40 cm. Namun, ada juga jenis stroberi yang
mempunyai 100 akar primer. Akar primer dapat bertahan lebih dari 1 tahun.
Akar-akar baru menggantikan Akar-akar primer tumbuh dari ruas paling dekat dengan Akar-akar
primer. Hal ini dapat mengurangi kontak akar dengan tanah pada
akar berkumpul pada lapisan atas media tanam dengan kedalaman sekitar 15 cm.
Pada media yang berdrainase baik, 50% dari akar berkumpul pada kedalaman
antara 15 - 45 cm (Budiman dan Saraswati, 2005).
Tanaman stroberi berbatang pendek sekali seolah-olah tidak berbatang,
bersifat merayap dan dapat hidup sampai bertahun-tahun. Namun, kadang-kadang
hanya ditumbuhkan sebagai tanaman semusim. Beberapa jenis ada yang selalu
berdaun, namun ada juga yang meranggas, tergantung tempat dibudidayakan
(Ashari, 1995).
Batang yang dimaksud disini adalah batang utama tempat daun-daun
tersusun. Stroberi memiliki batng utama yang tersusun dengan daun-daun yang
melingkari batang dengan jarak yang sangat rapat. Batang stroberi sangat pendek,
bertekstur lunak dan tidak berkayu. Batang ini tersembunyi diantara
tangkai-tangkai daun stroberi (Kurnia, 2005).
Daun stroberi berupa daum majemuk trifoliat atau terdiri dari satu daun
dan 3 anakan daun dengan tepi bergerigi. Daun majemuk yang beranak daun 3,
mempunyai panjang tangkai 1.5 - 1.7 cm dan berbulu halus, anakan daun
berukuran (1.8 - 7) cm x (1.3 - 6) cm. tangkai daun pendek atau hampir tidak ada,
pinggiran anak daun bergerigi, lembaran bawah berwarna hijau tua. Permukaan
atas berbulu halus berwarna hijau dan hijau tua (Prihatman, 2005). Permukaan
bawah berwarna hijau keabu-abuan dan memiliki 300 - 400 stomata per mm2.
Artinya, tanaman ini sangat mudah kekurangan air karena tinggi laju transpirasi
pada saat udara panas. Tajuk daun di batangnya cukup unik, yakni melingkari
batang secara spiral dengan jarang yang sangat rapat. Susunan ini dikenal
meristem apikal membentuk daun-daun baru setiap 8 - 12 hari pada suhu
rata-rata 220 C. Daunnya dapat bertahan selama 1 - 3 bulan, kemudian kering
(Budiman dan Saraswati, 2006).
Stolon adalah perpanjangan tunas yang tumbuh horizontal sejajar dengan
permukaan tanah (menjalar) yang merupakan organ perbanyakan vegetatif. Pada
stolon terdapat ruas yang dapat mencapai 30 cm. pada ruas terdapat tunas/pucuk
aksilar yang dilindungoi oleh bractea yang berkembang menjadi anakan-anakan
stroberi. Anakan ini membentuk akar pada saat pucuk membentuk daun trifoliat
(Budiman dan Saraswati, 2006). Anakan yang terbentuk dari stolon adalah anakan
vegetatif yang karakter dan sifatnya akan sama dengan induknya (true to type)
(Kurnia, 2005).
Bunga stroberi berbentuk klaster (tandan) pada beberapa tangkai bunga.
Biasanya bunga mekar tidak bersamaan, bunga yang terbuka awal biasanya lebih
besar ukurannya. Individu bunga berwarna putih, 2.5 - 3.5 cm diameternya terdiri
dari 5 - 10 kelopak bunga berwarna hijau, 5 mahkota bunga, sejumlah tangkai
putik dan 2 - 3 lusin benang sari. Benangsari tumbuh pada 3 lingkaran kedudukan.
Jika benang sari berisi tepung sari fertil, benangsari tersebut berwarna kuning
emas. Sementara itu, cairan nektar dihasilkan didaerah tangkai buah, bagian dasar
benangsari atau disebelah luar bunga betina (Ashari, 1995).
Pembungaanya tegak, panjangnya 0 - 14 cm, gagang bunga sampai 9 cm
panjangnya. Bunga secara fungsional berkelamin tunggal atau ganda.
Cawan bunga berdiameter 4-6 mm, daun kelopak tambahan berukuran
5 - 8 mm x 2.5 - 3.5 mm. Daun kelopak berukuran 7 - 12 mm x 3 - 4.5 mm.
Benangsarinya berjumlah 25 - 37 helai. Pada bunga betina benangsari itu steril.
Cakramnya berupa cincin yang menebal. Bercuping 5 - 6, putiknya banyak, pada
bunga jantan bakal buah tidak berkembang. Buah sejati tenggelam dalam torus
yang halus dan membengkak (Prihatman, 2005).
Buah stroberi berwarna merah. Buah yang biasa dikenal adalah buah
semu, yang sebenarnya merupakan receptacle yang membesar. Buah sejati yang
berasal dari ovul yang diserbuki berkembang menjadi buah kering dengan biji
keras. Struktur buah keras ini disebut achene yang terbentuk ditentukan oleh
jumlah pistil dan keefektifan penyerbukan. Bunga primer mempunyai pistil
terbanyak, yaitu lebih dari 400 buah, jumlah pistil pada bunga sekunder
antara 200 - 300 buah, sedangkan pada bunga tersier hanya 50 - 150 buah
(Budiman dan Saraswati, 2006).
Buah yang sebenarnya adalah biji-biji kecil yang berwarna putih yang
disebut achene. Achene berasal dari ovul yang diserbuki dan kemudian
berkembang menjadi buah kerdil. Struktur achene kerdil dan keras. Achene
menempel dipermukaan receptacle yang membesar (Kurnia, 2005).
Buahnya berukuran 2.5 - 5 cm berwarna agak merah hingga merah gelap.
Buah tersebut merupakan buah agregat yang terdiri dari beberapa achene (biji).
Masing-masing achene berisi satu biji. Apabila achene tersebut tidak diserbuki
buah tidak akan terbentuk. Ukuran dan berat buahnya berkorelasi dengan
Syarat Tumbuh
Iklim
Stroberi adalah tanaman subtropis yang dapat beradaptasi dengan baik
didataran tinggi tropis. Ketinggian tempat yang memenuhi syarat iklim tersebut
adalah 1000 – 1500 meter diatas permukaan laut dengan curah hujan adalah 600 –
700 mm/tahun. Lama penyinaran matahari yang dibutuhkan adalah 8 – 10 jam per
hari. Sedangkan kelembaban udara yang baik untuk pertumbuhan tanaman
stroberi antara 80 – 90% (Budiman dan Saraswati, 2006).
Tanaman stroberi dapat tumbuh dengan didaerah tropis pada ketinggian
lebih dari 600 meter diatas permukaan laut. Diketinggian ini suhu udara pada
siang hari 22 – 250 C dan malam hari 14 – 180 C. Pada suhu sejuk dan
kelembaban udara relatif yang tinggi atau 80 – 90% (Kurnia, 2005)
Tanaman ini menghendaki suhu sejuk dan dingin, sehingga di Indonesia
ditanam pada lahan dataran tinggi, seperti dipegunungan (hingga diatas 1000
meter diatas permukaan laut). Fotoperioditas (panjang penyinaran) sangat
berpengaruh terhadap pertumbuhan vegetatif dan generatif tanaman. Suhu tinggi
dengan lama penyinaran panjang mendorong pembentukan stolon, sebaliknya
pada hari pendek dan suhu rendah akan membantu pembungaan (Ashari, 1995).
Tanah
Tanah yang dibutuhkan adalah tanah liat berpasir, subur, gembur,
mengandung banyak bahan organik, tata air dan udara yang baik. Derajat
sedangkan di pot adalah 6.5 - 7. Kedalaman air tanah yang disyaratkan adalah
50 - 100 cm dari permukaan tanah (Anonimous, 2006).
Tanaman ini akan tumbuh baik jika ditanam dengan tanah yang kaya
bahan organik yang memiliki porositas yang baik, sehingga akar bisa tumbuh
dengan optimal (Kurnia, 2005).
Tempat yang cocok untuk bertanam stroberi adalah lahan berpasir yang
mengandung tanah liat dilereng pegunungan. Bila ditanam dikebun, tanah yang
dibutuhkan adalah tanah liat berpasir, subur, gembur, dan mengandung banyak
bahan organik. Pengairan dan sirkulasi udara yang baik juga dibuthkan agar
pertumbuhan tanaman optimal (Budiman dan Saraswati, 2006).
Metoda Kultur Jaringan
Kultur jaringan pada dasarnya merupakan suatu sistem pertumbuhan
sel-sel yang belum berdiferensiasi, sehingga mampu menghasilkan bagian-bagian
tanaman antara lain daun, batang dan akar (Welsh, 1991).
Kultur meristem pertama kali ditemuka n oleh Dr. G. Morel dari INRA,
Versailles, Prancis pada tanaman anggrek, bunga dahlia dan kentang.
Ia menyerang jaringan muda dari tanaman meninggalkan infeksi dari virus atau
bagian yang bertahan dari serangan patogen. Berasal dari kondisi ini tanaman
bebas virus diperoleh dengan menggunakan tunas untuk inokulasi. Selain itu
diperoleh klon bebas virus dari kultur meristem yang digunakan untuk tanaman
komersial karena waktu yang relatif singkat (Reinert dan Bajaj, 1989).
Potensi kultur jaringan dalam pemuliaan tanaman somaklonal mencakup
manipulasi genetik tanaman tanpa melibatkan siklus seksual. Pada dasarnya kultur
somaklonal merupakan suatu proses perbanyakan sel, jaringan organ atau
protoplas dengan teknik steril (Nasir, 2002).
Media tumbuh berupa hara makro, hara mikro dan gula serta yang lain
perlu disterilisasi. Hal ini karena media tersebut merupakan tempat pertumbuhan
yang baik bagi cendawan dan bakteri. Bila lingkungan mendukung,
mikroorganisme akan tumbuh dengan cepat dan menutupi permukaan kultur
bahan tanaman. Disamping itu, mikroorganisme juga akan merusak bahan
tanaman yang menyebabkan kematian tanaman (Budiman dan Saraswati, 2006).
Media kultur fisiknya dapat berbentuk padat dan cair. Media berbentuk
padat menggunakan pemadat media, seperti agar-agar atau gelrite. Komponen
media kultur yang lengkap sebagai berikut: aquades, hara makro, hara mikro, gula
sebagai sumber energi (umumnya sukrosa), vitamin, asam amino, zat pengatur
tumbuh. Suplemen berupa bahan-bahan alami, dan agar-agar atau gelrite sebagai
pemadat media (Yusnita, 2003).
Media padat maupun cair disiapkan dalam botol Erlenmeyer yang ditutup
dengan kasa steril dan aluminium foil. Botol yang berisi media disterilkan dengan
cara memanaskan dalam autoklaf yang bersuhu 1210 C dan tekanan 17.5 psi
selama 20 menit. Setelah disterilkan, media kultur disimpan dalam tempat steril
atau kulkas. Ruangan dan peralatan yang dipakai harus disterilkan dengan larutan
antiseptik atau alkohol. Lampu ultra violet dalam ruangan enkas atau laminar air
flow dinyalakan 1 jam sebelum digunakan, tujuannya untuk mensterilkan ruangan
Untuk mendukung keberhasilan kultur tanaman yang akan dikulturkan
berupa jaringan muda yang sedang dalam kondisi tumbuh. Jaringan yang akan
dikulturkan biasanya berupa ujung akar, tunas atau daun muda. Jaringan yang
diambil dan ditumbuhkan melalui kultur jaringan disebut eksplan. Sejak diambil
dari tumbuhan induk sampai dengan dikulturkan, eksplan harus berada dalam
keadaan steril. Persiapan eksplan sampai penanaman dalam media buatan harus
dilakukan di dalam enkas atau laminar air flow (Rahardja dan Wiryanata, 2003).
Umur fisiologis dan umur eksplan sangat berpengaruh terhadap
keberhasilan perbanyakan tanaman secara kultur jaringan. Eksplan dari jaringan
tanaman yang masih muda secara fisiologis, umumnya lebih baik daripada
jaringan tanaman tua. Eksplan dari dari tanaman muda juga mempunyai daya
regenerasi yang lebih tinggi daripada eksplan tanaman dewasa. Kondisi
lingkungan yang menentukan keberhasilan pembiakan tanaman dengan kultur
jaringan meliputi cahaya, suhu dan komponen atmosfer. Cahaya dibutuhkan untuk
mengatur proses morfogenetik tertentu (Yusnita, 2003).
Zat Pengatur Tumbuh dalam Kultur Jaringan
Hormon (dari kata Yunani hormaein yang berarti menguatkan) pada
khususnya dibentuk disuatu tempat, akan tetapi melaksanakan fungsinya ditempat
lain. Pada tumbuhan tidak diketahui adanya berjenis-jenis hormon seperti pada
hewan dan manusia. Diantara zat-zat yang telah agak banyak diketahui ialah
auksin, hetero-auksin, asam indol asetat, asam traumatat, kinin, giberelin,
Zat tumbuh nabati, sebagai istilah kolektif untuk hormon dan pengatur
zat-zat itu pada proses fisiologi tertentu. Hal ini secara tidak langsung dinyatakan
dengan nama beberapa kelompok misalnya absisin (absisins) mengatur absisi,
auksin mengatur perpanjangan sel, sitokinin mempengaruhi sitokinesis dan
florigen terlibat dalam menginduksi pertumbuhan bunga (Loveless, 1991).
Pola perkembangan tanaman kultur jaringan dipengaruhi oleh jenis,
jumlah dan perbandingan zat-zat pengatur tumbuh yang digunakan. Zat pengatur
tumbuh auksin dan sitokinin tidak hanya menentukan tumbuhnya jaringan yang
dikulturkan, tetapi bagaimana jaringan itu tumbuh (Yusnita, 2003).
Agar hormon tumbuh yang terdapat dalam mikrometer atau sub
mikromolar itu bersifat aktif dan khas, dapat dipastikan harus ada tiga bagian
utama pada sistem respirasi. Yang pertama, hormon harus ada dalam jumlah yang
cukup disel yang tepat. Yang kedua, hormon harus dikenali dan diikat erat oleh
setiap sekelompok sel yang tanggap terhadap hormon (sel sasaran). Yang ketiga,
protein penerima tersebut (konfigurasinya diduga berubah saat mengikat hormon)
harus menyebabkan perubahan metabolik lain yang mengarah pada penguatan
isyarat atau kurir hormon (Salisbury dan Ross, 1995).
Auksin
Istilah auksin (dari bahasa Yunani auxein, meningkatkan) pertama kali
digunakan oleh Frits Went, seorang mahasiswa pasca sarjana di negeri Belanda
pada tahun 1926, yang menemukan bahwa suatu senyawa yang belum dapat
dicirikan mungkin menyebabkan pembengkokan ini, yang disebut fotoperiodisme
Auksin dan kadang-kadang sitokinin dibutuhkan untuk merangsang
pembelahan sel dan pembentukan kalus. Untuk merangsang terbentuknya
embrio somatik umumnya digunakan auksin yang kuat, seperti 2.4-D, picloram
atau NAA (Yusnita, 2003).
Nishi dan Osawa (1973) menambahkan auksin (10-5 M - 10-6 M IAA, NAA
atau 2.4 - D) atau BAP (10-5 M) ke media tanam mereka, meristem terbentuk
2 sampai 3 minngu kemudian dan membentuk kalus yang disubkulturkan dan
tunas terbentuk dari kalus 10 - 12 minggu kemudian (Reinert dan Bajaj, 1989).
IAA memacu pertumbuhan awal akar pada stek batang, dan dari situlah
berkembang pertama kali penggunaan auksin dalam praktek. Auksin tiruan NAA
biasanya lebih efektif daripada IAA, tampaknya karena NAA tidak dirusak oleh
IAA oksidase atau enzim lain, masih dalam fase juwana (yang menjelang
berbunga), stek batangnya jauh lebih mudah berakar dengan adanya auksin,
khususnya IBA (Salisbury dan Ross, 1995).
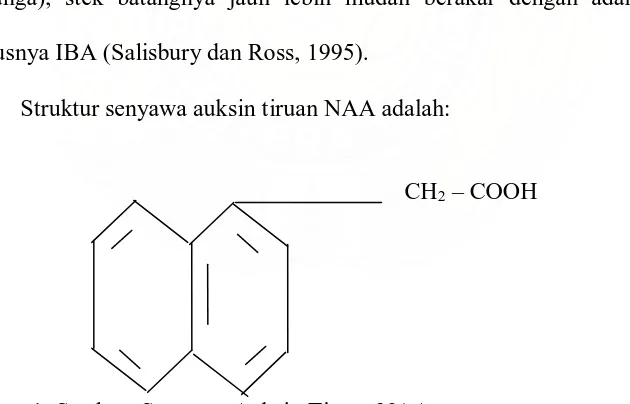
Struktur senyawa auksin tiruan NAA adalah:
CH2 – COOH
Gambar 1. Struktur Senyawa Auksin Tiruan NAA
Menurut Sommer dan Caldas (1981) pada kultur jaringan tanaman tropik,
Sitokinin
Sitokinin ditemukan pada tahun 1950-an, dan Skoog (1957) berhasil
mengungkap, bahwa bukanlah suatu zat tunggal, melainkan kumpulan
senyawa-senyawa yang fungsinya mirip satu dengan yang lainnya. Zat ini meningkatkan
pembelahan sel. Jelas juga pengaruhnya terhadap pertumbuhan tunas-tunas serta
akar-akar (Dwidjoseputro, 1980).
Sitokinin adalah senyawa-senyawa yang berasal dari senyawa yang
mengandung nitrogen, yaitu adenin. Senyawa-senyawa ini ditemukan ketika sel
tumbuhan dalam kultur membesar tetapi gagal membelah diri bila hanya auksin
yang hadir. Pembelahan sel ternyata dirangsang oleh berbagai ekstrak alami yang
kegiatannya sekarang diketahui disebabkan sitokinin (Loveless, 1991).
Golongan sitokinin yang aktif adalah BAP dan thidiazuron. Penggunaan
BAP dengan konsentrasi tinggi dalam waktu yang lama seringkali menyebabkan
regeneran sulit berakar dan dapat menyebabkan penampakan pucuk abnormal.
Secara umum konsentrasi sitokinin yang digunakan berkisar dari 0.1 - 10 mg/l
(Gunawan, 1992).
Struktur sitokinin benziladenin menurut Salisbury dan Ross (1995)
NH – CH2
N
CH
NH
Pada irisan kotiledon tanaman labu kuning benziladenin mengubah jenis
mRNA yang terbentuk. Disitu sitokinin mendorong pembesaran sel dan
pembentukan sel. Jumlah beberapa jenis mRNA ditingkatkan oleh benziladenin,
sementara jenis lainnya diturunkan (Salisbury dan Ross, 1995).
Kultur Jaringan Stroberi
Perbanyakan secara vegetatif dapat dilakukan secara konvensional dan
nonkonvensional. Melalui perbanyakan ini dapat diperoleh tanaman yang
seragam. Namun demikian, untuk menghasilkan bibit dalam jumlah besar,
perbanyakan vegetatif secara konvensional, misalnya dengan menggunakan umbi
lili, memerlukan waktu lama. Oleh karena itu, perbanyakan vegetatif dapat
dilakukan secara nonkonvensional, yaitu teknik in vitro (Suyadi, dkk, 2007).
Salah satu tahapan dalam teknik kultur in-vitro adalah penggandaan tunas.
Tunas yang digandakan dapat berasal dari tunas mikro hasil induksi meristem
apikal sebagai sumber eksplan, sehingga disebut kultur meristem. Kelebihan
kultur meristem adalah mampu menghasilkan bibit tanaman yang identik dengan
induknya dan bebas virus. Rice et al. (1992) mengatakan bahwa kultur meristem
mampu meningkatkan laju induksi dan penggandaan tunas, mampu memperbaiki
mutu bibit yang dihasilkan, mampu mempertahankan sifat-sifat morfologi yang
positif (Suyadi, dkk, 2007).
Tanaman stroberi dapat diperbanyak dengan cara kultur jaringan
menggunakan bagian kecil dari tanaman dengan memanfaatkan sifat totipotensi
sel tanaman, yaitu bagian tanaman yang memiliki potensi menjadi sebuah
tanam buatan yang aseptik (steril) didalam wadah berupa botol kecil, tabung selai
yang terbuat dari gelas/kaca, atau wadah plastik (Kurnia, 2005).
Dari satu pucuk kecil dapat dihasilkan rata-rata 15-20 pucuk per 8 minggu,
tergantung kultivar. Pucuk akan membentuk akar sehingga diperoleh tanaman
lengkap. Ukuran tanaman lengkap yang dihasilkan jauh lebih kecil dibandingkan
dari anakan. Tinggi tanaman kira-kira 2.5 – 3 cm dengan 4 – 6 lembar daun
(Budiman dan Saraswati, 2006).
Dalam media multiplikasi, pucuk kecil akan membentuk tunas-tunas baru
dalam 12-15 hari. Multiplikasi pertama menghasilkan 5-7 tunas. Tunas yang
diperoleh kemudian dipecah dan ditanam secara terpisah dan ditanam secara
terpisah pada media multiplikasi. Proses pemecahan dan penanaman dalam media
baru disebut subkultur. Dalam subkultur, pelipatan tunas berulang kembali
(Budiman dan Saraswati, 2006).
Gunawan (1992) menyatakan bahwa salah satu faktor penting yang
berpengaruh terhadap keberhasilan kultur jaringan tunas adalah keseimbangan
antara ZPT (auksin dan sitokinin), di dalam media. Percobaan ini bertujuan untuk
mencari konsentrasi benzylamino purine (BA) dan naphthylacetic acid (NAA)
yang tepat untuk perbanyakan.
Keberhasilan penggandaan tunas melalui kultur meristem sangat
tergantung pada keseimbangan ZPT auksin dan sitokinin, terutama keseimbangan
antara 6-Benzilamino Purin (BAP) dan Asam Naftalen Asetat (NAA). BAP adalah
ZPT sintetik yang berperan dalam pembelahan sel dan morfogenesis sedangkan
NAA adalah ZPT sintetik yang mampu mengatur berbagai proses pertumbuhan
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Kebun Percobaan
Tanaman Buah, Berastagi. Mulai bulan Maret sampai Mei 2007, pada ketinggian
1430 meter diatas permukaan laut.
Bahan dan Alat
Bahan-bahan yang digunakan adalah tunas stroberi umur + 3 bulan yang
diinisiasi pada media MS (Murashige and Skoog, 1962) dari eksplan luar,
media MS, zat pengatur tumbuh NAA dan BAP, Betadhine© 10%, alkohol 70%,
HCl 0.1 N, NaOH 0.1 N, agar sukrosa, aquades, detergen, spiritus dan
bahan-bahan lain yang dibutuhkan dalam penelitian.
Alat-alat yang digunakan adalah autoklaf, gelas ukur, petridish, scalpel,
pinset, lampu bunsen, laminar air flow cabinet (LAFC), handsprayer, timbangan,
pemanas, kertas pH, batang pengaduk, gelas Erlenmeyer, botol kultur, aluminium
foil, kertas steril, label, penggaris, dan alat-alat lain yang dibutuhkan dalam
Metode Penelitian
Penelitian menggunakan Rancangan Acak Kelompok (RAK) faktorial
dengan 2 faktor, yaitu:
I. Faktor konsentrasi Zat Pengatur Tumbuh NAA dengan 3 taraf, yaitu
N0 = 0 ppm
N1 = 0.5 ppm
N2 = 1 ppm
II. Faktor konsentrasi Zat Pengatur Tumbuh BAP dengan 5 taraf, yaitu:
B0 = 0 ppm
B1 = 0.5 ppm
B2 = 1 ppm
B3 = 1.5 ppm
B4 = 2 ppm
Dengan kombinasi perlakuan
N0B0 NOB1 N0B2 N0B3 N0B4
N1B0 N1B1 N1B2 N1B3 N1B4
N2B0 N2B1 N2B2 N2B3 N2B4
Dari kombinasi perlakuan maka diperoleh:
Jumlah Ulangan : 3 ulangan
Jumlah Eksplan/Botol : 1 eksplan
Jumlah Perlakuan : 15 perlakuan
Jumlah Plot : 45 Plot
Jumlah Eksplan/Perlakuan : 5 eksplan
Jumlah Sampel/Perlakuan : 5 eksplan
Jumlah Eksplan Sampel : 225 eksplan
Hasil penelitian dianalisis dengan menggunakan sidik ragam dengan
model linear sebagai berikut:
Y
ijk=
µ
+
ρ
i+
α
j+
k+ (
α
)
jk+
ε
ijkDimana :
Yijk = Data pengamatan pada plot di blok ke-i yang mendapat perlakuan zat
pengatur tumbuh NAA pada taraf ke-j dan konsentrasi BAP pada taraf
ke-k.
µ = Nilai tengah
ρi = Efek blok ke-i
αj = Efek zat pengatur tumbuh NAA pada taraf ke-j
k = Efek zat pengatur tumbuh BAP pada taraf ke-k
(α )jk = Efek interaksi antara konsentrasi zat pengatur tumbuh NAA pada taraf
ke-j dan konsentrasi zat pengatur tumbuh BAP pada taraf ke-k.
εijk = Efek galat percobaan pada blok ke-i dengan konsentrasi zat pengatur
tumbuh NAA pada taraf ke-j dan konsentrasi zat pengatur tumbuh BAP
pada taraf ke-k.
Data penelitian dianalisis dengan metode analisis rataan, uji beda nyata
PELAKSANAAN PENELITIAN
Sterilisasi Bahan dan Alat
Bahan yang digunakan seperti aquades dimasukkan kedalam gelas
Erlenmeyer dan ditutup dengan aluminium foil, kemudian disterilisasi di dalam
autoklaf pada tekanan 17.5 psi, pada suhu 1210 C selama 30 menit.
Alat-alat yang digunakan pada penanaman harus dalam keadaan steril agar
terbebas dari hal-hal yang dapat menimbulkan kontaminasi. Sterilisasi diawali
dengan pencucian semua alat dengan detergen dan dicuci dengan air mengalir.
Setelah dikeringkan, alat-alat seperti scalpel, pinset, cawan petri, kertas merang,
kertas tisu, aluminium foil terlebih dahulu dibungkus dengan kertas sampul
setelah itu disterilisasikan dalam autoklaf dengan suhu 1210 C, pada tekanan
17.5 psi selama + 30 menit. Alat tanam seperti pinset dan gunting serta pisau
dapat juga disterilkan dengan pembakaran atau pemanasan dalam oven pada suhu
1210 C selama 4 jam, sementara untuk laminar air flow (LAF) dapat disterilkan
dengan menggunakan alkohol 70% dan lampu ultra violet.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS yang
dikombinasikan dengan perlakuan zat pengatur tumbuh BAP dan NAA.
Untuk mempermudah pembuatan media maka bahan-bahan yang akan
digunakan dibuat dalam larutan stok. Larutan stok ini terdiri dari unsur makro,
pengatur tumbuh NAA. Untuk sukrosa, myoinositol dan agar ditimbang sesuai
kebutuhan perlakuan. Setelah selesai pembuatan larutan stok maka media kultur
dapat dibuat dimana untuk pembuatan media 1 liter dilakukan dengan mengisi
beaker glass dengan aquades sebanyak 500 ml. Kemudian ditambahkan 40 gram
gula pasir dan 0.1 gram myoinositol. Setelah itu ditambahkan hara makro, mikro,
iron, dan vitamin secara berurutan sesuai dengan ketentuan dalam pembuatan
stok, beberapa yang harus dipipet untuk pembuatan 1 liter media. Kemudian
ditambahkan lagi aquades hingga volume mencapai 1 liter dam diaduk hingga
merata. Larutan kemudian dibagi dan ditambahkan zat pengatur tumbuh BAP dan
NAA sesuai perlakuan masing-masing. Larutan diukur pH-nya sebesar 5.8 dengan
penambahan NaOH 0.1 N, jika pH media terlalu rendah dan penambahan
HCl 0.1 N jika pH-nya terlalu tinggi. Terakhir ditambahkan agar sebanyak
7 gram. Kemudian diaduk hingga merata dan dipanaskan hingga air menjadi larut
dan larutan terlihat bening. Setelah bening + 30 ml media larutan dipindahkan
kedalam botol kultur yang telah diberi label secara merata dan ditutup dengan
alumunium foil. Media dalam botol kemudian disterilkan di dalam autoklaf pada
suhu 1210 C dan tekanan 17.5 psi selama 30 menit. Setelah itu ditempatkan di
rak-rak kulur.
Penanaman
Laminar Air Flow (LAF) disterilkan terlebih dahulu dengan alkohol 70%
dengan menggunakan kertas tisu yang bersih. Penanaman dilakukan dengan
menggunakan pinset untuk mengeluarkan bahan eksplan berupa tunas stroberi dari
Bethadine10% dan dibilas kembali, selanjutnya ditiris pada kertas tisu didalam
cawan petri. Setiap botol kultur berisi satu eksplan stroberi. Kemudian ditutup
dengan menggunakan kertas alumunium foil demikian seterusnya.
Pemeliharaan
Botol-botol kultur disusun dirak kultur didalam ruangan inkubasi.
Ruangan ini tetap dijaga agar tetap steril, botol-botol kultur dan rak-rak kultur
disemprotkan dengan alkohol 70% setiap hari agar terhindar dari kontaminasi.
Kultur diinkubasi pada ruang yang bersuhu 19 - 230 C dengan penyinaran lampu.
Peubah Amatan
1. Saat Muncul Tunas (HST)
Eksplan diamati setiap hari hingga hari pertama terbentuk tunas, dengan
kriteria telah memiliki satu helai daun yang membuka sempurna.
2. Saat Muncul Akar (HST)
Eksplan diamati setiap hari hingga hari pertama terbentuk akar. Dengan
kriteria telah memiliki tonjolan berwarna merah.
3. Jumlah Tunas (Buah)
Jumlah tunas dihitung dengan cara menghitung jumlah tunas yang tumbuh
dari seluruh eksplan, dilakukan pada akhir penelitian, dengan kriteria telah
mempunyai satu helai daun yang telah membuka sempurna.
4. Jumlah Akar (Buah)
Jumlah akar dihitung secara visual dengan menghitung jumlah akar
5. Jumlah Daun (Helai)
Jumlah daun dihitung dengan cara menghitung jumlah daun yang
terbentuk dari satu eksplan, dengan kriteria telah membuka sempurna,
dilakukan pada akhir penelitian.
6. Tinggi Tunas (cm)
Tinggi tunas dihitung dengan menggunakan kertas milimeter, pengukuran
dilakukan dari pangkal tunas tempat munculnya tunas sampai ujung tunas
yang tertinggi, dilakukan pada akhir penelitian.
7. Panjang Akar (cm)
Panjang akar diukur dengan menggunakan kertas milimeter yang diukur
mulai pangkal akar sampai ujung akar yang terpanjang, dilakukan pada
akhir penelitian.
8. Berat Planlet (g)
Berat planlet diambil dengan cara menimbang planlet yang telah
dibersihkan dari kotoran-kotoran dan sisa media yang melekat pada
HASIL DAN PEMBAHASAN
Hasil
Dari hasil analisis data secara statistik diperoleh bahwa pemberian
perlakuan NAA berpengaruh nyata terhadap peubah amatan umur muncul akar,
jumlah tunas, jumlah akar, tinggi tunas, jumlah daun, panjang akar, berat eksplan
namun berpengaruh tidak nyata terhadap peubah amatan umur muncul tunas.
Sedangkan pemberian perlakuan BAP berpengaruh nyata terhadap peubah amatan
jumlah tunas, jumlah akar, jumlah daun, berat eksplan namun berpengaruh tidak
nyata terhadap peubah amatan umur muncul tunas, umur muncul akar, tinggi
tunas, panjang akar. Interaksi antara pemberian perlakuan NAA dan pemberian
perlakuan BAP berpengaruh nyata terhadap peubah amatan jumlah akar, jumlah
daun, tinggi tunas namun tidak berpengaruh nyata terhadap peubah amatan umur
muncul tunas, umur muncul akar, jumlah tunas, panjang akar, berat eksplan.
Umur Muncul Tunas
Hasil pengamatan umur muncul tunas pada akhir penelitian disajikan pada
Lampiran 1, 2 sedangkan daftar sidik ragamnya disajikan pada Lampiran 3 yang
menunjukkan bahwa pemberian perlakuan NAA dan pemberian perlakuan BAP
Tabel 1. Rataan Umur Muncul Tunas pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 3.55 3.56 3.47 3.24 3.52 17.33 3.47
N1 3.38 3.62 3.59 3.54 3.35 17.49 3.50
N2 3.33 3.23 3.36 3.21 3.29 16.42 3.28
TOTAL 10.26 10.41 10.42 9.99 10.16
RATAAN 3.42 3.47 3.47 3.33 3.39
Keterangan : Angka-angka yang diikuti huruf yang sama pada setiap kolom dan baris menunjukkan beda nyata pada taraf 5% pada Uji Beda Nyata Terkecil
Umur muncul tunas tercepat untuk perlakuan NAA yaitu pada perlakuan
N2 (3.28 hari) dan terlama pada perlakuan N1 (3.50 hari). Umur muncul tunas
tercepat pada perlakuan BAP pada perlakuan B3 (3.33 hari) dan terlama pada
perlakuan B1 dan B2 (3.47 hari). Sedangkan kombinasi kedua perlakuan, umur
muncul tunas tercepat pada perlakuan N2B3 (3.21 hari) sedangkan terlama pada
perlakuan N1B2 (3.59 hari).
Umur Muncul Akar
Hasil pengamatan umur muncul akar pada akhir penelitian disajikan pada
Lampiran 4, 5 sedangkan daftar sidik ragamnya disajikan pada Lampiran 6 yang
menunjukkan bahwa pemberian perlakuan NAA berpengaruh nyata dan
pemberian perlakuan BAP berpengaruh tidak nyata serta interaksi kedua
[image:40.595.115.442.375.454.2]perlakuan berpengaruh tidak nyata.
Tabel 2. Rataan Umur Muncul Akar pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 3.79 3.90 3.48 3.31 3.38 17.85 3.57b
N1 3.49 3.35 3.18 3.16 3.09 16.26 3.25a
N2 3.19 3.28 3.15 3.55 3.54 16.71 3.34a
TOTAL 10.46 10.52 9.81 10.02 10.01
RATAAN 3.49 3.51 3.27 3.34 3.34
Umur muncul akar tercepat untuk perlakuan NAA yaitu pada perlakuan
N1 (3.25 hari) dan terlama pada perlakuan N0 (3.57 hari). Umur muncul akar
tercepat pada perlakuan BAP pada perlakuan B2 (3.27 hari) dan terlama pada
perlakuan B1 (3.51). Sedangkan kombinasi kedua perlakuan, umur muncul akar
tercepat pada perlakuan N1B4 (3.09 hari) sedangkan terlama pada perlakuan
N0B1 (3.90 hari).
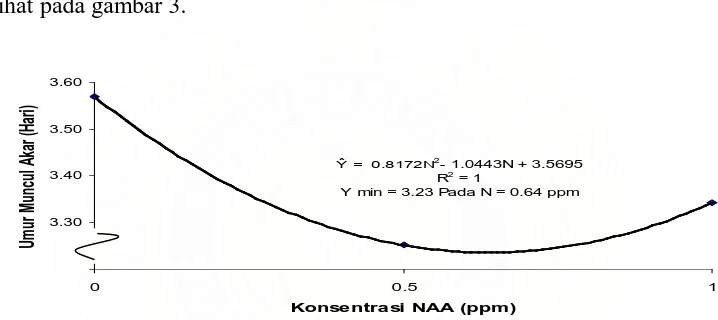
Hubungan antara umur muncul akar pada berbagai perlakuan NAA dapat
dilihat pada gambar 3.
= 0.8172N2- 1.0443N + 3.5695
R2 = 1
Y min = 3.23 Pada N = 0.64 ppm
3.20 3.30 3.40 3.50 3.60
0 0.5 1
Konse ntra si NAA (ppm)
Um
ur
M
un
cu
l A
kar
(H
ar
[image:41.595.127.486.302.462.2]i)
Gambar 3. Hubungan Antara Umur Muncul Akar dengan Konsentrasi NAA
Hubungan antara umur muncul akar dengan konsentrasi NAA bersifat
parabola terbuka dengan persamaan = 0.8172N2 - 1.0443N + 3.5695, dan
diperoleh titik minimum 3.23 pada N = 0.64 ppm dengan R2 = 1.
Jumlah Tunas
Hasil pengamatan jumlah tunas pada akhir penelitian disajikan pada
Lampiran 7, 8 sedangkan daftar sidik ragamnya disajikan pada Lampiran 9 yang
pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan
[image:42.595.105.518.175.264.2]berpengaruh tidak nyata.
Tabel 3. Rataan Jumlah Tunas pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 1.31 1.37 1.61 1.80 1.65 7.74 1.55a
N1 1.69 2.22 1.89 1.83 1.80 9.44 1.89b
N2 1.43 1.95 2.16 2.09 2.29 9.92 1.98b
TOTAL 4.43 5.55 5.66 5.72 5.74
RATAAN 1.48a 1.85b 1.89b 1.91b 1.91b
Keterangan : Angka-angka yang diikuti huruf yang sama pada setiap kolom dan baris menunjukkan beda nyata pada taraf 5% pada Uji Beda Nyata Terkecil
Untuk perlakuan NAA, jumlah tunas terbanyak terdapat pada perlakuan
N2 (1.98 buah) dan paling sedikit pada perlakuan N0 (1.55 buah). Jumlah tunas
terbanyak pada perlakuan BAP pada perlakuan B3 dan B4 (1.91 buah) dan paling
sedikit pada perlakuan B0 (1.48 buah). Sedangkan kombinasi kedua perlakuan,
jumlah tunas terbanyak pada perlakuan N2B4 (2.29 buah) sedangkan paling
sedikit pada perlakuan N0B0 (1.31 buah).
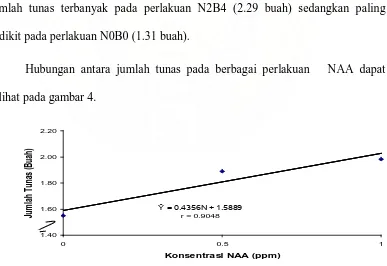
Hubungan antara jumlah tunas pada berbagai perlakuan NAA dapat
dilihat pada gambar 4.
= 0.4356N + 1.5889
r = 0.9048
1.40 1.60 1.80 2.00 2.20
0 0.5 1
Konsentrasi NAA (ppm)
Ju
m
la
h T
un
as
(B
ua
h)
[image:42.595.124.511.408.674.2]Hubungan antara jumlah tunas dengan konsentrasi NAA bersifat linear
positif dengan persamaan garis = 0.4356N + 1.5889 dan diperoleh nilai
r sebesar 0.9048
Hubungan antara jumlah tunas pada berbagai perlakuan BAP dapat dilihat
pada gambar 5.
= -0.2154B2
+0.6177B + 1.5121
R2 = 0.9168
Ymaks = 1.95 P ada B = 1.43 ppm
1.00 1.50 2.00
0 0.5 1 1.5 2
Konse ntra si BAP (ppm)
Ju
m
la
h T
un
as
(B
ua
[image:43.595.128.494.235.353.2]h)
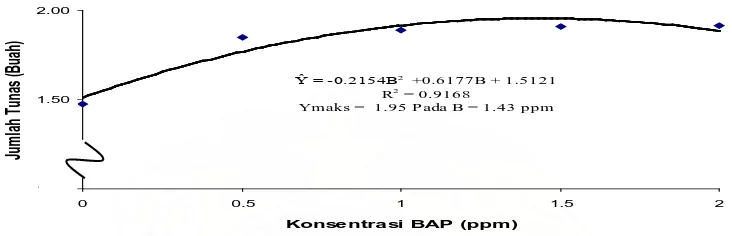
Gambar 5. Hubungan Antara Jumlah Tunas dengan Konsentrasi BAP
Hubungan antara jumlah tunas dengan konsentrasi BAP bersifat parabola
tertutup dengan persamaan garis = -0.2154B2 + 0.6177B + 1.5121, maka
diperoleh titik maksimum 1.95 pada B = 1.43 ppm dengan nilai R2 = 0.9168
Jumlah Akar
Hasil pengamatan jumlah akar pada akhir penelitian disajikan pada
Lampiran 10, 11 sedangkan daftar sidik ragamnya disajikan pada Lampiran 12
yang menunjukkan bahwa pemberian perlakuan NAA berpengaruh nyata dan
pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan
berpengaruh nyata.
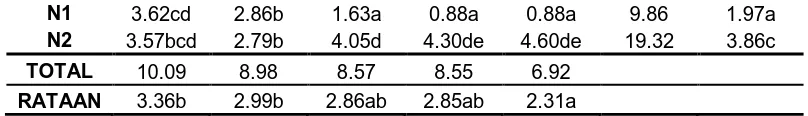
Tabel 4. Rataan Jumlah Akar pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N1 3.62cd 2.86b 1.63a 0.88a 0.88a 9.86 1.97a
N2 3.57bcd 2.79b 4.05d 4.30de 4.60de 19.32 3.86c
TOTAL 10.09 8.98 8.57 8.55 6.92
RATAAN 3.36b 2.99b 2.86ab 2.85ab 2.31a
Keterangan : Angka-angka yang diikuti huruf yang sama pada setiap kolom dan baris menunjukkan beda nyata pada taraf 5% pada Uji Beda Nyata Terkecil
Untuk perlakuan NAA, jumlah akar terbanyak terdapat pada perlakuan
N2 (3.86 buah) dan paling sedikit pada perlakuan N1 (1.97 buah). Jumlah akar
terbanyak pada perlakuan BAP pada perlakuan B0 (3.36 buah) dan paling sedikit
pada perlakuan B4 (2.31 buah). Sedangkan kombinasi kedua perlakuan, jumlah
akar terbanyak pada perlakuan N2B4 (4.60 buah) sedangkan paling sedikit pada
[image:44.595.110.514.85.143.2]perlakuan N1B3 dan N1B4 (0.88 buah).
Grafik interaksi antara perlakuan NAA terhadap jumlah akar dapat dilihat
pada gambar 6.
= -1.5173N2
+ 2.1833N + 2.905 R2
= 1
= -0.5414N + 3.2634 r = 0.8401
= 7.3869N2 - 6.2277N + 2.8921
R2 = 1
= 8.5643N2 - 5.3962N + 1.4367
R2 = 1
= 11.829N2
- 10.903N + 3.3738 R2 = 1 0.00 1.00 2.00 3.00 4.00 5.00
0 0.5 1
Konsentrasi NAA (ppm)
Ju m lah A kar ( B u ah ) B0 B1 B2 B3 B4 Poly. (B0) Linear (B1) Poly. (B2) Poly. (B4) Poly. (B3)
Gambar 6. Hubungan Interaksi Jumlah Akar dengan Konsentrasi NAA
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
antara garis B0 dengan B1 pada NAA 0.14 ppm, B0 dengan B2 pada NAA 0.94
ppm, B0 dengan B3 pada NAA 0.94 ppm, B0 dengan B4 pada NAA 0.91 ppm,
[image:44.595.115.507.376.603.2]B1 dengan B4 pada NAA 0.825 ppm, B2 dengan B3 pada NAA 0.92 ppm,
B2 dengan B4 pada NAA 0.81 ppm dan garis B3 dengan B4 pada NAA 0.51 ppm.
Grafik interaksi antara perlakuan BAP terhadap jumlah akar dapat dilihat
pada gambar 7.
=0.7155B + 3.1479
r = 0.6358
= -1.0875B2 + 1.5962B + 2.8229
R2 = 0.7523
=0.5737B2 - 2.6378B + 3.7488
R2 = 0.9742
0.00 1.00 2.00 3.00 4.00 5.00
0 0.5 1 1.5 2
Konse ntra si BAP (ppm)
[image:45.595.125.512.210.313.2]Ju m lah A kar (B uah ) N0 N1 N2 Linear (N2) Poly. (N0) Poly. (N1)
Gambar 7. Hubungan Interaksi Jumlah Akar dengan Konsentrasi BAP
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
garis. Adapun perpotongan antara N0 dengan N1 yaitu pada BAP 0.35 ppm
sedangkan perpotongan antara N1 dengan N2 pada BAP 0.19 ppm.
Hubungan antara jumlah akar pada berbagai perlakuan NAA dapat dilihat
pada gambar 8.
=5.4161N2 - 4.3406N + 2.7878
R2 = 1
Y min = 1.92 Pada N = 0.40 ppm
0.00 1.00 2.00 3.00 4.00
0 0.5 1
Konse ntra si NAA (ppm)
[image:45.595.120.503.457.621.2]Ju m lah A kar (B uah )
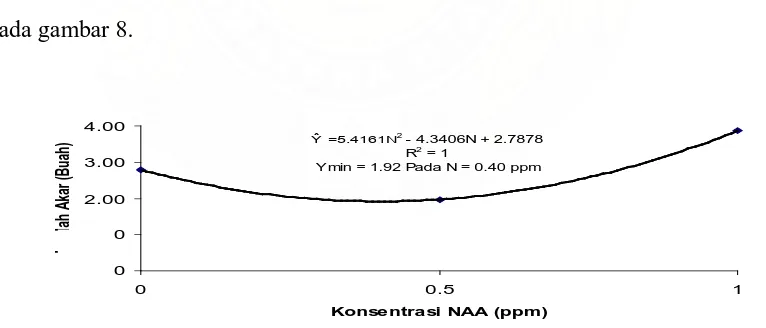
Gambar 8. Hubungan Antara Jumlah Akar dengan Konsentrasi NAA
Hubungan antara jumlah akar dengan konsentrasi NAA bersifat parabola
terbuka dengan persamaan garis = 5.4161N2 - 4.3406N + 2.7878, dan diperoleh
Hubungan antara jumlah akar pada berbagai perlakuan BAP dapat dilihat
pada gambar 9.
= -0.4513B +3.3255
r =0.8825
2.00 2.50 3.00 3.50
0 0.5 1 1.5 2
Konse ntra si BAP (ppm)
Ju
m
lah
A
kar
(B
uah
[image:47.595.115.504.144.246.2])
Gambar 9. Hubungan Antara Jumlah Akar dengan Konsentrasi BAP
Hubungan antara jumlah akar dengan konsentrasi BAP bersifat linear
negatif dengan persamaan garis = -0.4513B + 3.3255 dengan nilai r = 0.8825.
Jumlah Daun
Hasil pengamatan jumlah daun pada akhir penelitian disajikan pada
Lampiran 13, 14 sedangkan daftar sidik ragamnya disajikan pada Lampiran 15
yang menunjukkan bahwa pemberian perlakuan NAA berpengaruh nyata dan
pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan
berpengaruh nyata.
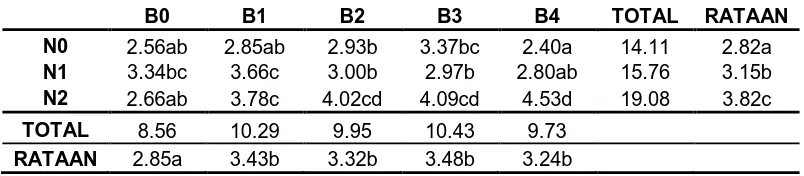
Tabel 5. Rataan Jumlah Daun pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 2.56ab 2.85ab 2.93b 3.37bc 2.40a 14.11 2.82a
N1 3.34bc 3.66c 3.00b 2.97b 2.80ab 15.76 3.15b
N2 2.66ab 3.78c 4.02cd 4.09cd 4.53d 19.08 3.82c
TOTAL 8.56 10.29 9.95 10.43 9.73
RATAAN 2.85a 3.43b 3.32b 3.48b 3.24b
[image:47.595.112.514.584.672.2]Untuk perlakuan NAA, jumlah daun terbanyak terdapat pada perlakuan N2
(3.82 buah) dan paling sedikit pada perlakuan N0 (2.82 buah). Jumlah daun
terbanyak pada perlakuan BAP pada perlakuan B3 (3.48 buah) dan paling sedikit
pada perlakuan B0 (2.85 buah). Sedangkan kombinasi kedua perlakuan, jumlah
daun terbanyak pada perlakuan N2B4 (4.53 buah) sedangkan paling sedikit pada
[image:48.595.116.504.284.437.2]perlakuan N0B4 (2.40 buah).
Grafik interaksi antara perlakuan NAA terhadap jumlah daun dapat dilihat
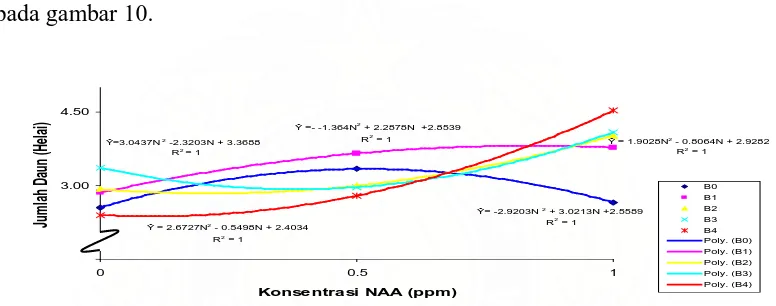
pada gambar 10.
= -2.9203N2
+ 3.0213N +2.5589 R2 = 1 =- -1.364N2 + 2.2878N +2.8539
R2 = 1
= 1.9028N2 - 0.8064N + 2.9282 R2
= 1 =3.0437N2
-2.3203N + 3.3688 R2 = 1
= 2.6727N2
- 0.5498N + 2.4034 R2
= 1
1.50 3.00 4.50
0 0.5 1
Konse ntra si NAA (ppm)
Ju m lah D au n ( Hel ai ) B0 B1 B2 B3 B4 Poly. (B0) Poly. (B1) Poly. (B2) Poly. (B3) Poly. (B4)
Gambar 10. Hubungan Interaksi Jumlah Daun dengan Konsentrasi NAA
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
antara garis B0 dengan B2 pada NAA 0.68 ppm, B0 dengan B3 pada NAA 0.70
ppm, B0 dengan B4 pada NAA 0.68 ppm, B1 dengan B2 pada NAA 0.92 ppm,
B1 dengan B3 pada NAA 0.92 ppm, B1 dengan B4 pada NAA 0.83 ppm,
B2 dengan B3 pada NAA 0.89 ppm, B2 dengan B4 pada NAA 0.68 ppm dan garis
Grafik interaksi antara perlakuan BAP terhadap jumlah daun dapat dilihat
pada gambar 11.
= -0.4419B2 + 1.6933B + 2.7857
R2 = 0.9218
= -0.3546B + 3.5072
r = 0.6653
= -0.6156B2
+ 1.2719B + 2.4741 R2
= 0.6041
0.00 2.50 5.00
0 0.5 1 1.5 2
Konse ntra si BAP (ppm)
[image:49.595.125.507.127.245.2]Ju m lah D au n ( Hel ai ) N0 N1 N2 Poly. (N2) Linear (N1) Poly. (N0)
Gambar 11. Hubungan Interaksi Jumlah Daun dengan Konsentrasi BAP
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
garis. Adapun perpotongan antara N0 dengan N2 yaitu pada BAP 1.06 ppm
sedangkan perpotongan antara garis N1 dengan N2 pada BAP 0.38 ppm.
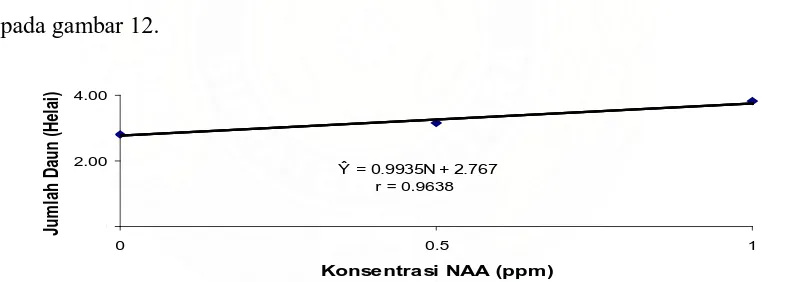
Hubungan antara jumlah daun pada berbagai perlakuan NAA dapat dilihat
pada gambar 12.
= 0.9935N + 2.767
r = 0.9638
0.00 2.00 4.00
0 0.5 1
Konsentrasi NAA (ppm)
Ju m lah D au n ( H el ai )
Gambar 12. Hubungan Antara Jumlah Daun dengan Konsentrasi NAA
Hubungan antara jumlah daun dengan konsentrasi NAA bersifat linear
[image:49.595.113.507.404.545.2]Hubungan antara jumlah daun pada berbagai perlakuan BAP dapat dilihat
pada gambar 13.
= -0.3864B2
+ 0.9379B+ 2.9054
R2
= 0.811
Ymaks = 3.47 pada B = 1.21 ppm
2.00 2.50 3.00 3.50
0 0.5 1 1.5 2
Konse ntrasi BAP (ppm)
[image:50.595.116.501.144.251.2]Ju m lah D au n ( H el ai )
Gambar 13. Hubungan Antara Jumlah Daun dengan Konsentrasi NAA
Hubungan antara jumlah daun dengan konsentrasi NAA bersifat parabola
tertutup dengan persamaan garis = -0.3864B2 + 0.9379B + 2.9054, titik
maksimum 3.47 pada B = 1.21 ppm dan nilai R2 = 0.811
Tinggi Tunas
Hasil pengamatan jumlah daun pada akhir penelitian disajikan pada
Lampiran 16, 17 sedangkan daftar sidik ragamnya disajikan pada Lampiran 18
yang menunjukkan bahwa pemberian perlakuan NAA berpengaruh tidak nyata
dan pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan
[image:50.595.112.516.645.732.2]berpengaruh nyata
Tabel 6. Rataan Tinggi Tunas pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 2.52bc 2.26b 1.95ab 2.27b 2.02ab 11.01 2.20b
N1 2.31b 1.87a 1.96ab 1.76a 2.04ab 9.94 1.99a
N2 2.07ab 1.88a 2.34b 2.31b 2.42bc 11.03 2.21b
TOTAL 6.90 6.01 6.24 6.34 6.48
Keterangan : Angka-angka yang diikuti huruf yang sama pada setiap kolom dan baris menunjukkan beda nyata pada taraf 5% pada Uji Beda Nyata Terkecil
Untuk perlakuan NAA, tinggi tunas tertinggi terdapat pada perlakuan
N2 (2.21 cm) dan paling rendah pada perlakuan N1 (1.99 cm). Tinggi tunas
tertinggi pada perlakuan BAP pada perlakuan B0 (2.30 cm) dan paling rendah
pada perlakuan B1 (2.00 cm). Sedangkan kombinasi kedua perlakuan, tinggi tunas
tertinggi pada perlakuan N0B0 (2.52 cm) sedangkan paling rendah pada perlakuan
[image:51.595.130.511.327.474.2]N1B3 (1.76 cm).
Grafik interaksi antara perlakuan NAA terhadap tinggi tunas dapat dilihat
pada gambar 14.
= -0.4482N + 2.5253 r =0.999
= 0.8074N2 - 1.1886N + 2.2626
R2
= 1 = 0.7188N2 - 0.3306N + 1.9469
R2 = 1 = 2.1312N
2 -2.085N +2.2673
R2 = 1
=0.702N2 -0.2963N + 2.0167
R2 = 1
1.40 1.80 2.20 2.60
0 0.5 1
Konse ntra si NAA (ppm)
Ti ng gi T un as (c m ) B0 B1 B2 B3 B4 Linear (B0) Poly. (B1) Poly. (B2) Poly. (B3) Poly. (B4)
Gambar 14. Hubungan Interaksi Tinggi Tunas dengan Konsentrasi NAA
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
antara garis B0 dengan B2 pada NAA 0.82 ppm, B0 dengan B3 pada NAA 0.90
ppm, B0 dengan B4 pada NAA 0.75 ppm, B1 dengan B2 pada NAA 0.38 ppm, B1
dengan B3 pada NAA 0.005 ppm, B1 dengan B4 pada NAA 0.28 ppm, B2 dengan
B3 pada NAA 0.22 ppm, dan garis B3 dengan B4 pada NAA 0.16 ppm.
Grafik interaksi antara konsentrasi BAP terhadap tinggi tunas dapat dilihat
= 0.2262B + 1.9789
r =0.6456
=0.1863B2 - 0.5734B +2.4969
R2 = 0.6272
= 0.3305B2 -0.7897B + 2.2825
R2 = 0.7864
1.50 2.00 2.50 3.00
0 0.5 1 1.5 2
Konse ntra si BAP (ppm)
[image:52.595.129.506.92.203.2]Ti ng gi T un as (c m ) N0 N1 N2 Linear (N2) Poly. (N0) Poly. (N1)
Gambar 15. Hubungan Interaksi Tinggi Tunas dengan Konsentrasi BAP
Hubungan interaksi perlakuan dapat kita lihat dengan adanya perpotongan
garis. Adapun perpotongan antara N0 dengan N2 yaitu pada BAP 0.79 ppm
sedangkan perpotongan antara garis N1 dengan N2 pada BAP 0.34 ppm.
Hubungan antara tinggi tunas pada berbagai perlakuan BAP dapat dilihat
pada gambar 16.
=0.8454N2
-0.8533N + 2.2038 R2
= 1
Ymin = 1.99 Pada N = 0.50 ppm
1.50 2.00 2.50
0 0.5 1
Konsentrasi NAA (ppm)
T in g g i T u n as ( cm )
Gambar 16. Hubungan Antara Tinggi Tunas dengan Konsentrasi NAA
Hubungan antara tinggi tunas dengan konsentrasi NAA bersifat parabola
terbuka dengan persamaan garis = 0.8454N2 - 0.8533N + 2.2038, dengan titik
minimum 1.99 pada N = 0.50 ppm, dengan nilai R2 = 1.
Panjang Akar
Hasil pengamatan panjang akar pada akhir penelitian disajikan pada
yang menunjukkan bahwa pemberian perlakuan NAA berpengaruh nyata dan
pemberian perlakuan BAP berpengaruh tidak nyata serta interaksi kedua
[image:53.595.112.514.203.296.2]perlakuan berpengaruh tidak nyata
Tabel 7. Rataan Panjang Akar pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 2.93 2.84 2.45 2.69 2.16 13.08 2.62b
N1 2.61 2.19 1.50 0.80 1.93 9.03 1.81a
N2 2.96 2.10 2.96 2.77 2.99 13.78 2.76b
TOTAL 8.50 7.13 6.92 6.26 7.08
RATAAN 2.83 2.38 2.31 2.09 2.36
Keterangan : Angka-angka yang diikuti huruf yang sama pada setiap kolom dan baris menunjukkan beda nyata pada taraf 5% pada Uji Beda Nyata Terkecil
Untuk perlakuan NAA, panjang akar terpanjang terdapat pada perlakuan
N2 (2.76 cm) dan paling pendek pada perlakuan N1 (1.81 cm). Panjang akar
terpanjang pada perlakuan BAP pada perlakuan B0 (2.83 cm) dan paling pendek
pada perlakuan B3 (2.09 cm). Sedangkan kombinasi kedua perlakuan, panjang
akar terpanjang pada perlakuan N2B4 (2.99 cm) sedangkan paling pendek pada
Hubungan antara panjang akar pada berbagai konsentrasi NAA dapat
dilihat pada gambar 17.
= 3.5209N2
- 3.381N + 2.6164 R2 = 1
Y min = 1.80 Pada N = 0.48 ppm
1.50 2.00 2.50 3.00
0 0.5 1
Konse ntra si NAA (ppm)
Pan
jan
g A
kar
(cm
[image:54.595.144.500.149.258.2])
Gambar 17. Hubungan Antara Panjang Akar dengan Konsentrasi NAA
Hubungan antara panjang akar dengan konsentrasi NAA bersifat parabola
terbuka dengan persamaan garis = 3.5209N2 - 3.381N + 2.6164, dengan titik
minimum 1.80 pada N = 0.48 ppm dan nilai R2 = 1.
Berat Eksplan
Hasil pengamatan berat eksplan pada akhir penelitian disajikan pada
Lampiran 22, 23 sedangkan daftar sidik ragamnya disajikan pada Lampiran 24
yang menunjukkan bahwa pemberian perlakuan NAA berpengaruh nyata dan
pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan
[image:54.595.110.514.614.701.2]berpengaruh tidak nyata
Tabel 8. Rataan Berat Eksplan pada Berbagai Konsentrasi NAA dan BAP (Transformasi √ X + 0.5)
B0 B1 B2 B3 B4 TOTAL RATAAN
N0 1.07 1.14 1.11 1.18 1.42 5.92 1.18a
N1 1.19 1.44 1.41 1.49 1.46 6.99 1.40c
N2 1.12 1.37 1.37 1.36 1.45 6.65 1.33b
TOTAL 3.37 3.95 3.88 4.03 4.33
RATAAN 1.12a 1.32b 1.29b 1.34b 1.44c
Untuk perlakuan NAA, berat eksplan terberat terdapat pada perlakuan
N1 (1.40 g) dan paling ringan pada perlakuan N0 (1.18 g). Berat eksplan terberat
pada perlakuan BAP pada perlakuan B4 (1.44 g) dan paling ringan pada perlakuan
B0 (1.12 g). Sedangkan kombinasi kedua perlakuan, berat eksplan terberat pada
perlakuan N1B3 (1.49 g) sedangkan paling ringan pada perlakuan N0B0 (1.07 g).
Hubungan antara berat eksplan pada berbagai konsentrasi NAA dapat
dilihat pada gambar 19.
= -0.5613N2 +0.7083N + 1.1839
R2 = 1
Y maks = 1.41 Pada N = 0.63
1.00 1.25 1.50
0 0.5 1
Konse ntra si NAA (ppm)
Ber
at
eksp
lan
(g
[image:55.595.143.506.283.411.2])
Gambar 19. Hubungan Antara Berat Eksplan dengan Konsentrasi NAA
Hubungan antara berat eksplan dengan konsentrasi NAA bersifat parabola
tertutup dengan persamaan garis = -0.5613N2 + 0.7083N + 1.1839, dengan
titik maksimum 1.41 pada N = 0.63, dan R2 = 1.
Hubungan antara berat eksplan pada berbagai konsentrasi BAP dapat
= 0.1326B + 1.1716
r = 0.8268
0.60 1.10 1.60
0 0.5 1 1.5 2
Konsentrasi BAP (ppm)
B
er
at
E
ksp
lan
(
g
[image:56.595.131.491.99.239.2])
Gambar 18. Hubungan Antara Berat Eksplan dengan Konsentrasi BAP
Hubungan antara berat eksplan dengan konsentrasi BAP bersifat linear