PERBEDAAN DAN HUBUNGAN EKSPRESI VEGF
ANTARA TUMOR OVARI UM GANAS DAN JI NAK
TESIS
Oleh
ANINDITA NOVINA
DEPARTEMEN OBSTETRI DAN GINEKOLOGI
PROGRAM PENDIDIKAN DOKTER SPESIALIS
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
RSUP H.ADAM MALIK – RSUD DR.PIRNGADI MEDAN
PENELITIAN INI DIBAWAH BIMBINGAN TIM 5
Pembimbing : dr. Deri Edianto, M. Ked(OG), SpOG(K)
dr. Muhammad Rusda, M. Ked(OG), SpOG(K)
Penyanggah :dr. Ichwanul Adenin M. Ked(OG), SpOG(K)
Dr. dr. Sarma N. Lumbanraja M.Ked(OG), SpOG(K)
dr. Edy Ardiansyah, M. Ked(OG), SpOG(K)
Diajukan Untuk Melengkapi Tugas-tugas dan
Memenuhi Salah Satu Syarat Untuk Mencapai
Gelar Keahlian Dalam Program Studi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA
ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
Nama : dr. Anindita Novina, M.Ked(OG) NIM : 097104017
Program Studi : Program Pendidikan Dokter Spesialis Konsentrasi : Obstetri Dan Ginekologi
Jenis Karya : Tesis
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-eksklusif (Non-exclusive Royalty Free Right ) atas tesis saya yang berjudul :
PERBEDAAN DAN HUBUNGAN EKSPRESI VEGF ANTARA TUMOR OVARIUM GANAS DAN JINAK
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalihmedia/formatkan, mengelola dalam bentuk database, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Medan
Pada Tanggal : 10 Oktober 2013 Yang menyatakan
KATA PENGANTAR
Dengan nama Allah Yang Maha Pengasih Lagi Maha Penyayang.
Segala puji dan syukur Saya panjatkan kepada Allah SWT, karena berkat rahmat dan hidayah-Nya penulisan tesis ini dapat diselesaikan.
Tesis ini disusun untuk melengkapi tugas-tugas dan memenuhi salah satu syarat untuk memperoleh gelar keahlian dalam bidang Obstetri dan Ginekologi. Sebagai manusia biasa Saya menyadari bahwa tesis ini banyak kekurangannya dan masih jauh dari sempurna, namun demikian besar harapan Saya kiranya tesis ini dapat bermanfaat dalam menambah perbendaharaan bacaan khususnya tentang :
“
PERBEDAAN DAN HUBUNGAN EKSPRESI VEGF ANTARA TUMOR OVARIUM GANAS DAN JINAK”Dengan selesainya laporan penelitian ini, perkenankanlah Saya menyampaikan rasa terima kasih dan penghargaan yang setinggi-tingginya kepada yang terhormat :
1. Rektor Universitas Sumatera Utara, Prof. Dr. Syahril Pasaribu, DTM&H (CTM&H), SpA(K) dan Dekan Fakultas Kedokteran Universitas Sumatera Utara, Prof. Dr. Gontar Alamsyah Siregar, SpPD (KGEH), yang telah memberikan kesempatan kepada Saya untuk mengikuti Program Pendidikan Dokter Spesialis di Fakultas Kedokteran USU Medan
Haryono Roeshadi, SpOG (K); Prof. dr. T. M. Hanafiah, SpOG (K); Prof. dr. Budi R. Hadibroto, SpOG (K); Prof. dr. M. Fauzie Sahil, SpOG(K); Prof. dr. Daulat H. Sibuea, SpOG (K); yang telah bersama-sama berkenan menerima Saya untuk mengikuti pendidikan di Departemen Obstetri dan Ginekologi.
3. Terima Kasih Yang sebesar-besarnya saya ucapkan kepada dr. Deri Edianto, M.Ked(OG), SpOG(K) dan dr. Muhammad Rusda M.Ked(OG), SpOG(K), selaku pembimbing tesis Saya, bersama dr. Ichwanul Adenin, M.Ked(OG), SpOG(K), Dr. dr. Sarma N. Lumbanraja, M.Ked(OG), SpOG(K), dan dr. Edy Ardiansyah, M.Ked(OG), SpOG(K), selaku pembanding dan nara sumber yang penuh dengan kesabaran telah meluangkan waktu yang sangat berharga untuk membimbing, memeriksa dan melengkapi penulisan tesis ini hingga selesai.
4. Prof. dr. M. Fauzie Sahil, SpOG(K) selaku Bapak Angkat Saya selama menjalani masa pendidikan, yang telah banyak mengayomi, membimbing dan memberikan nasehat yang bermanfaat kepada Saya selama dalam pendidikan.
5. dr. Putri C. Eyanoer, MSEpi, Phd sebagai pembimbing statistik yang telah banyak membantu Saya dalam penyelesaian tesis ini.
6. Seluruh Staf Pengajar Departemen Obstetri dan Ginekologi FK-USU Medan, yang secara langsung telah banyak membimbing dan mendidik Saya sejak awal hingga akhir pendidikan. Semoga Allah SWT membalas budi baik Guru-guru Saya tersebut.
7. dr. Christoffel L. Tobing, SpOG(K) dan dr. Herbert Sihite, SpOG, sebagai pembimbing tesis magister saya bersama dengan Prof. dr. Daulat H. Sibuea, SpOG(K), dr. Henry Salim Siregar, M.Ked(OG), SpOG(K) dan dr. Deri Edianto, M.Ked(OG), SpOG(K); selaku penyanggah dan narasumber dalam penulisan tesis magister Saya.
9. Ketua Departemen Anestesiologi dan Reanimasi FK-USU Medan beserta staf, atas kesempatan dan bimbingan yang telah diberikan selama Saya bertugas di Departemen tersebut.
10. Direktur RSUP H. Adam Malik Medan yang telah memberikan kesempatan dan sarana kepada Saya selama mengikuti pendidikan di Departemen Obstetri dan Ginekologi.
11. Direktur RSUP dr. Pirngadi Medan, dr. Amran Lubis, SpJP; dan khususnya Kepala SMF Obstetri dan Ginekologi RSUD dr. Pirngadi Medan, dr. Syamsul Arifin Nasution, SpOG(K), beserta seluruh staf yang telah memberikan kesempatan dan sarana kepada Saya selama menempuh pendidikan di Departemen Obstetri dan Ginekologi.
12. Direktur Rumkit Tk. II Puteri Hijau KESDAM II/BB Medan, dr. Gunawan Rusuldi, SpOG, dr. Yazim Yaqub, SpOG, dr. Agnes D. H, SpOG(K) dan dr. Santa M.J.S, SpOG yang telah memberi kesempatan dan sarana serta bimbingan selama Saya bertugas di Rumah Sakit tersebut.
13. Direktur Rumah Sakit Umum PTPN II Tembakau Deli; dr. Sofyan Abdul Ilah, SpOG dan dr. Nazaruddin Jaffar, SpOG (K) beserta staf yang telah memberikan kesempatan dan bimbingan selama Saya bertugas menjalani pendidikan di Rumah Sakit tersebut.
14. Direktur RSU Haji Medan dan Kepala SMF Obstetri dan Ginekologi RSU Haji Medan dr. Muslich Perangin-angin, SpOG beserta staf yang telah memberi kesempatan dan sarana serta bimbingan kepada Saya selama bertugas di Rumah Sakit tersebut.
15. Direktur RSU Sundari Medan dan Kepala SMF Obstetri dan Gnekologi RSU Sundari Medan dr. H. M. Haidir, MHA, SpOG dan Ibu Sundari, Am.Keb beserta staf yang telah memberi kesempatan dan bimbingan selama Saya bertugas di Rumah Sakit tersebut.
16. Direktur RSUD Kab. Padang Lawas beserta staf yang telah memberikan kesempatan untuk bekerja dan sarana selama Saya bertugas di Rumah Sakit tersebut.
SpOG; dr. Anggia M. L., SpOG; dr. Maya Hasmita, SpOG; dr. David Luther, SKM, Mked(OG), SpOG; dr. Riza H. Nasution, SpOG; dr. Lili Kuswani, SpOG; dr. M. Ikhwan, SpOG; dr. Edward Muldjadi, SpOG; dr. Ari Abdurrahman Lubis, SpOG; dr. Zilliyadein R., SpOG; dr. Benny J., SpOG; dr. M. Rizki Yaznil, Mked(OG), SpOG; dr. Yuri Andriansyah, SpOG; dr. T. Jeffrey A., SpOG; dr. Made S. Kumara, SpOG; dr. Sri Jauharah L., SpOG; dr. M. Jusuf R., Mked(OG), SpOG; dr. Boy P. Siregar, SpOG; dr. Hedy Tan, dr. G. Joshimin F, dr. Firman A, SpOG; dr. Aidil A., SpOG; dr. Rizka H., SpOG; dr. Hatsari, SpOG; dr. Andri P. Aswar, SpOG; dr. Alfian, SpOG; dr. Errol, SpOG; dr. T. Johan A., Mked(OG) , SpOG; dr. Tigor P. H., Mked(OG), SpOG; dr. Elvira M.S., Mked(OG), SpOG; dr. Hendry A.S., Mked(OG), SpOG; dr. Heika NS, Mked(OG), SpOG; dr. Riske E.P.; dr. Ali Akbar, Mked(OG), SpOG; dr. Arjuna S, Mked(OG), SpOG; dr. Janwar S, Mked(OG), SpOG; dr. Irwansyah P, Mked(OG), SpOG; dr. Ulfah W.K., Mked(OG), SpOG; dr. Ismail Usman, Mked(OG), SpOG; dan dr. Aries M., dr. Hendri Ginting, Mked(OG) SpOG; dr. Robby Pakpahan; dr. Meity Elvina, Mked(OG) SpOG; dr. M. Yusuf, Mked(OG) SpOG; dr. Dany Aryani, Mked(OG) SpOG; dr. Fatin Atifa, Mked(OG) SpOG; dr. Pantas S Siburian; dr. Morel Sembiring; dr. Sri Damayana H., Mked(OG); dr. Eka Handayani, Mked(OG); dr. Liza Marosa; dr. M Rizki P. Yudha; dr. Arief Siregar; dr. Ferdiansyah Putra Hrp Mked(OG); dr. Yudha Sudewo dan dr. Henry Gunawan, Saya berterima kasih atas segala bimbingan, bantuan dan dukungannya yang telah diberikan selama ini.
18. Kepada sahabat-sahabat saya sejawat angkatan: dr. Ika Sulaika; dr. Edy Rizaldy; dr. Hotbin P; dr. Kiko M; dr. Edward S M; dr Abdurrohim L; dr. Edwin E.H; dr. M. Rizal S; dr. Ricca PR; dr. Julita A; dr. M. Wahyu W; dr. Novrial; dr. Nureliani Amni; dr. Ivo FC; dr. Ray C.B; dr. Fifianti P.A; dr. Hiro H.N.; terima kasih untuk kebersamaan dan kerjasamanya selama pendidikan hingga saat ini.
atas kebersamaan kita selama ini, kenangan indah akan Saya ingat selamanya.
20. Kepada almh. Ibu Hj. Asnawati Hsb, Ibu Hj. Sosmalawaty, Ibu Zubaedah, Mimi, Kak Asih, Kak Yus, Fina, Anggi, Dewi dan seluruh Pegawai di lingkungan Departemen Obstetri dan Ginekologi RSUP H. Adam Malik Medan terima kasih atas bantuan dan dukungannya.
21. Dokter muda, Bidan, Paramedis, karyawan/karyawati, serta para pasien di Departemen Obstetri dan Ginekologi FK-USU/RSUP. H. Adam Malik-RSUD dr. Pirngadi Medan, RS. Haji Medan, RS. Sundari yang dari padanya Saya banyak memperoleh pengetahuan baru, terima kasih atas kerja sama dan saling pengertian yang diberikan kepada Saya sehingga dapat sampai pada akhir program pendidikan ini.
Tiada kata yang dapat Saya ucapkan selain rasa syukur kepada Allah SWT dan sembah sujud serta terima kasih yang tidak terhingga Saya sampaikan kepada kedua orangtua Saya yang sangat Saya cintai, Ayahanda dr. H. Einil Rizar, SpOG(K) dan ibunda Hj. Dwi Satelita yang telah membesarkan, membimbing, mendoakan, serta mendidik Saya dengan penuh kesabaran dan kasih sayang dari sejak kecil hingga kini, memberi contoh yang baik dalam menjalani hidup serta memberikan motivasi dan semangat kepada Saya selama mengikuti pendidikan ini.
Kepada Ayah dan Ibu Mertua Saya; Bapak Drs. H. Thamrin Mardia dan Ibu Hj. Gusti N. Lintang, kepada Suami tercinta dr. Andri Iskandar Mardia dan adik-adik kami dr. M. Bayu Rizaldy; Andara Livia, S.T; dr. Indra K. Mardia, dr. Martua Mardia; Intan S. Mardia dan Rina S Mardia yang merupakan inspirasi dan pendorong motivasi Saya dalam menyelesaikan pendidikan saya selama ini. Semoga ilmu yang saya peroleh dapat memberikan manfaat kepada kita semua.
banyak memberikan bantuan, baik moril maupun materil, Saya ucapkan terima kasih yang sebesar-besarnya.
Semoga Allah SWT senantiasa memberikan rahmat dan hidayah-Nya kepada kita semua. Amin Ya Rabbal ‘Alamin.
Medan, 10 Oktober 2013
dr. Anindita Novina,
DAFTAR ISI
Halaman Halaman Pernyataan Persetujuan Publikasi Karya Ilmiah Untuk
Kepentingan Akademis ... i
Kata Pengantar ... ii 1.1. Latar Belakang Penelitian ... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 4
1.4. Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA 5 2.1. Kanker Ovarium ... 5
2.2. Angiogenesis pada tumor ovarium ... 7
2.5.4. Neurophilin-1 dan -2 ... 2.6. VEGF Sebagai Faktor Pro Angiogenik ... 2.7. Regulasi VEGF ... 2.7.1 Hipoksia ... ... 2.7.2 Growth factors dan sitokin inflamasi ... 2.7.3 Hormon ... 2.7.4 Onco-genes dan tumor suppressor ganas ... 2.8. Ekspresi kuat VEGF ... 2.9. Terapi antiangiogenik ... 2.9.1 Bevazicumab ... 2.9.2 VEGF Trap (Aflibercept)...
2.9.3 Inhibitor Reseptor Tyrosine Kinase... 2.10. Kerangka teori ...
36 37 39
BAB III Kerangka konsep dan hipotesis ... 40
3.1. Kerangka konsep ... 40
3.2. Hipotesis ... 41
BAB IV Metode Penelitian ... 42
4.1. Rancangan penelitian ... 42
4.2. Tempat dan waktu penelitian ... 42 4.3. Populasi penelitian ...
DAFTAR GAMBAR
Nomor Judul Halaman
2.1. Mekanisme neovaskularisasi tumor ... 10 2.2. VEGF sebagai mediator angiogenesis dan faktor-faktor yang
mempengaruhi ekspresi VEGF ...
31
2.3. Berbagai pendekatan targeted therapy ... 34
DAFTAR TABEL
Nomor Judul Halaman
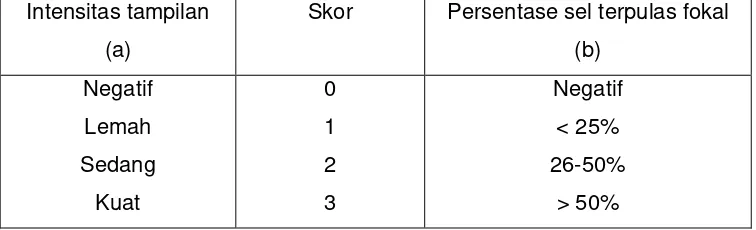
2.1. Faktor pro-angiogenik endogen ... 12 2.2. Faktor anti-angiogenik ... 14 4.1. Histocore VEGF untuk penilaian imunohistokimia ... 47 5.1.
5.2. 5.3.
5.4.
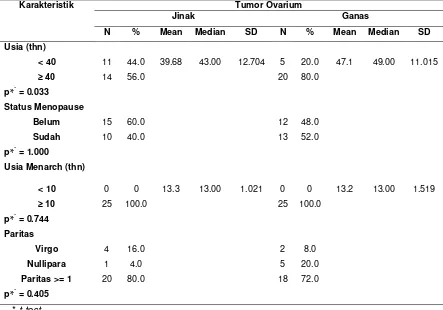
Distribusi karakteristik pasien dengan tumor ovarium ... Distribusi hasil histopatologi tumor ovarium jinak dan ganas.. Perbedaan rerata skor ekspresi VEGF antara tumor ovarium ganas dan jinak ... Hubungan antara ekspresi kuat VEGF dengan kejadian tumor ovarium ganas ...
52 55
57
57 4.6.4 Instrumen penilaian ...
4.7. Definisi operasional ... 4.8. Alur penelitian ... 4.9. Analisis data ...
Hasil dan Pembahasan ... Kesimpulan dan saran ... PUSTAKA ...
DAFTAR SINGKATAN
VEGF : Vascular Endothelial Growth Factor VPF : Vascular Permeability Factor
FGF : Fibroblast Growth Factor
mRNA : messenger Ribonucleatide Acid
VEGFR : Vascular Endothelial Growth Factor Receptor PIGF : Placenta Growth Factor
Flk-1/KDR : Fetal liver kinase-1/Kinase Domain-containing Receptor
uPA : urokinase-type Plasminogen Activator TTPA : Tissue-Type Plasminogen Activator FAK : Focal Adhesion Kinase
MAPK : Mitogen-Activated Protein Kinase PI3K : Phosphoinositol-3 Kinase
XIAP : X-linked Inhibitor of Apoptosis Protein EPO : Erythropoietin Glycoprotein
HIF-1 : Hypoxia inducible factor-1 TNF-α : Tumor Necrosis Factor-alpha PAF : Platelet Activating Factor TGF-β : Tissue Growth Factor-beta EGF : Epidermal Growth Factor PDGF : Platelet-Derived Growth factor
IL : Interleukin
MDGF : Macrophage-Derived Growth Factor IgG : Immunoglobulin G
TKls : Tyrosine kinases
RSUP : Rumah Sakit Umum Pusat DAB : Diaminobenzidine
Abstrak
PERBEDAAN DAN HUBUNGAN EKSPRESI VEGF ANTARA TUMOR OVARIUM GANAS DAN JINAK
Novina A, Edianto D, Rusda M, Adenin I, Lumbanraja S N, Ardiansyah E
Tujuan : Untuk mengetahui gambaran karakteristik pasien dengan tumor ovarium ganas dan jinak, jenis histopatologi, serta perbedaan dan hubungan ekspresi VEGF antara kasus-kasus tumor ovarium ganas dan jinak
Metode : Melalui pemilihan secara acak sederhana diperoleh 25 pasien yang memenuhi kriteria penelitian pada masing-masing kelompok tumor ovarium ganas dan jinak. Penelitian dilakukan dengan melihat catatan rekam medis dan menilai ekspresi VEGF sel tumor dari blok parafin pada pemeriksaan imunohistokimia.
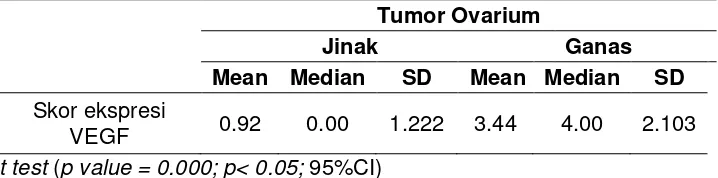
Hasil : Berdasarkan usia, penderita tumor ovarium jinak maupun ganas terbanyak adalah kelompok usia ≥ 40 tahun, namun uji t menunjukkan terdapat perbedaan rerata usia yang bermakna antara kedua kelompok (P=0.033; 95% Cl, -14.161 - -0.639). Karakteristik lain yang terbanyak adalah usia menarche ≥10 tahun, sudah menopause dan memiliki paritas ≥1. Tidak terdapat perbedaan antara kedua kelompok berdasarkan usia menarche, status menopause dan paritas. Jenis histopatologi terbanyak adalah Adenocarcinoma serosum (32%). Tumor ovarium ganas paling banyak menunjukkan ekspresi kuat VEGF (skor 3-6); rata-rata skor 3,44±SD2,103 sedangkan tumor ovarium jinak kebanyakan menunjukkan ekspresi lemah (skor 0-2); rata-rata skor 0,92±SD1,222. Terdapat perbedaan bermakna antara kedua kelompok berdasarkan ekspresi VEGF (P=0.000;95%Cl,-3.498 - -1.542). Dijumpai hubungan bermakna antara ekspresi kuat VEGF dengan kejadian tumor ovarium ganas (P=0.000), dimana 60% tumor ovarium ganas menunjukkan ekspresi kuat VEGF, sedangkan hanya 8% kasus tumor ovarium jinak yang menunjukkan ekspresi kuat VEGF.
Kata kunci : tumor ovarium ganas, tumor ovarium jinak, ekspresi VEGF, imunohistokimia.
Abstract
DIFFERENCES AND ASSOCIATION OF VEGF EXPRESSION BETWEEN MALIGNANT AND BENIGN OVARIAN TUMORS
Novina A, Edianto D, Rusda M, Adenin I, Lumbanraja S N, Ardiansyah E
Objective: To describe the characteristics of patients with malignant and benign ovarian tumors, histopatological types, as well as VEGF expression differences and association between malignant ovarian tumors and benign ovarian tumors cases.
Methods: Through simple random sampling 25 patients who met study criteria were obtained for each group of malignant and benign ovarian tumors. Research was done by collecting data from medical records and assessing VEGF expression of tumor cells derived from paraffin blocks on immunohistochemical examination
Results : Based on ages, patients with benign or malignant ovarian tumors are most ≥40 years old, but the t test results showed significant differences on mean age between the groups (P = 0.0033). Most other characteristics are menarche age ≥10 years old, menopause and have parity ≥1. T test results showed no difference between the two groups based on menarche age, menopausal status, and parity. The most histological type was Adenocarcinoma serosum (32%). Most malignant ovarian tumors showed strong expression of VEGF (score 3-6) with mean score of 3.44±SD2,103 whereas most benign ovarian tumors showed significant differences between the two groups based on the expression of VEGF (P=0.000;95%Cl,-3.498 - -1.542). Significant association was found between strong expression of VEGF with the incidence of malignant ovarian tumors (P=0.000), which 60% of malignant ovarian tumors showed strong expression of VEGF.
Abstrak
PERBEDAAN DAN HUBUNGAN EKSPRESI VEGF ANTARA TUMOR OVARIUM GANAS DAN JINAK
Novina A, Edianto D, Rusda M, Adenin I, Lumbanraja S N, Ardiansyah E
Tujuan : Untuk mengetahui gambaran karakteristik pasien dengan tumor ovarium ganas dan jinak, jenis histopatologi, serta perbedaan dan hubungan ekspresi VEGF antara kasus-kasus tumor ovarium ganas dan jinak
Metode : Melalui pemilihan secara acak sederhana diperoleh 25 pasien yang memenuhi kriteria penelitian pada masing-masing kelompok tumor ovarium ganas dan jinak. Penelitian dilakukan dengan melihat catatan rekam medis dan menilai ekspresi VEGF sel tumor dari blok parafin pada pemeriksaan imunohistokimia.
Hasil : Berdasarkan usia, penderita tumor ovarium jinak maupun ganas terbanyak adalah kelompok usia ≥ 40 tahun, namun uji t menunjukkan terdapat perbedaan rerata usia yang bermakna antara kedua kelompok (P=0.033; 95% Cl, -14.161 - -0.639). Karakteristik lain yang terbanyak adalah usia menarche ≥10 tahun, sudah menopause dan memiliki paritas ≥1. Tidak terdapat perbedaan antara kedua kelompok berdasarkan usia menarche, status menopause dan paritas. Jenis histopatologi terbanyak adalah Adenocarcinoma serosum (32%). Tumor ovarium ganas paling banyak menunjukkan ekspresi kuat VEGF (skor 3-6); rata-rata skor 3,44±SD2,103 sedangkan tumor ovarium jinak kebanyakan menunjukkan ekspresi lemah (skor 0-2); rata-rata skor 0,92±SD1,222. Terdapat perbedaan bermakna antara kedua kelompok berdasarkan ekspresi VEGF (P=0.000;95%Cl,-3.498 - -1.542). Dijumpai hubungan bermakna antara ekspresi kuat VEGF dengan kejadian tumor ovarium ganas (P=0.000), dimana 60% tumor ovarium ganas menunjukkan ekspresi kuat VEGF, sedangkan hanya 8% kasus tumor ovarium jinak yang menunjukkan ekspresi kuat VEGF.
Kata kunci : tumor ovarium ganas, tumor ovarium jinak, ekspresi VEGF, imunohistokimia.
Abstract
DIFFERENCES AND ASSOCIATION OF VEGF EXPRESSION BETWEEN MALIGNANT AND BENIGN OVARIAN TUMORS
Novina A, Edianto D, Rusda M, Adenin I, Lumbanraja S N, Ardiansyah E
Objective: To describe the characteristics of patients with malignant and benign ovarian tumors, histopatological types, as well as VEGF expression differences and association between malignant ovarian tumors and benign ovarian tumors cases.
Methods: Through simple random sampling 25 patients who met study criteria were obtained for each group of malignant and benign ovarian tumors. Research was done by collecting data from medical records and assessing VEGF expression of tumor cells derived from paraffin blocks on immunohistochemical examination
Results : Based on ages, patients with benign or malignant ovarian tumors are most ≥40 years old, but the t test results showed significant differences on mean age between the groups (P = 0.0033). Most other characteristics are menarche age ≥10 years old, menopause and have parity ≥1. T test results showed no difference between the two groups based on menarche age, menopausal status, and parity. The most histological type was Adenocarcinoma serosum (32%). Most malignant ovarian tumors showed strong expression of VEGF (score 3-6) with mean score of 3.44±SD2,103 whereas most benign ovarian tumors showed significant differences between the two groups based on the expression of VEGF (P=0.000;95%Cl,-3.498 - -1.542). Significant association was found between strong expression of VEGF with the incidence of malignant ovarian tumors (P=0.000), which 60% of malignant ovarian tumors showed strong expression of VEGF.
Keywords: malignant ovarian tumors, benign ovarian tumors, VEGF expression, immunohistochemical
BAB I PENDAHULUAN
1.1. Latar Belakang
Kanker ovarium merupakan keganasan ginekologi yang paling banyak
menyebabkan kematian. Jalur umum perkembangan tumor pada kanker ovarium
adalah penyebaran peritoneal, dan akumulasi progresif asites sering terjadi
dengan atau tanpa sel tumor ganas dalam cairan peritoneal. Penyebaran dalam
kavum peritoneal berhubungan dengan gejala klinis non spesifik yang sering
disalah diagnosa dengan gangguan gastrointestinal atau kelainan genitalia
interna lainnya. Beberapa gejala yang umum adalah rasa tidak nyaman dan
penuh di perut. Masalah lainnya adalah sulit untuk mempalpasi massa di
ovarium yang masih berada di rongga pelvis. Oleh karena alasan-alasan
tersebut, sekitar 70% pasien baru terdiagnosa ketika kanker ovarium telah
mencapai stadium III atau IV.
Sekitar 90 sampai 95 persen dari semua kasus kanker ovarium terdiri dari
karsinoma ovarium epitel. Penanganan kanker ovarium epitel didasarkan pada
kombinasi pembedahan dan kemoterapi. Debulking massa tumor diikuti
kemoterapi berbasis platinum telah menjadi standar penanganan kanker ovarium
epitel stadium lanjut. Meskipun penanganan primer yang agresif memberikan
tingkat respon yang baik, kebanyakan penderita kanker ovarium stadium lanjut
menunjukkan kebutuhan dikembangkannya strategi baru dan agen terapi yang
lebih baik.
Ketergantungan pertumbuhan tumor dan metastasis terhadap aliran
pembuluh darah menjadikan angiogenesis sebagai target terapi yang rasional.
Angiogenesis sendiri adalah tolak ukur dari kesembuhan luka, siklus menstruasi,
kanker, dan berbagai iskemia serta penyakit inflamasi. Ketika mencapai ukuran
diameter sekitar 2.0 mm, tumor menjadi hipoksia dan memulai angiogenesis.
Berbagai molekul pro dan antiangiogenik telah ditemukan. Vascular Endothelial
Growth Factor (VEGF) merupakan pencetus angiogenesis dan
limphangiogenesis yang cukup menarik dan banyak dipelajari. Transduksi sinyal
mencakup ikatan dengan reseptor tyrosine kinase dan menghasilkan proliferasi
sel endotelial, migrasi dan juga pembentukan pembuluh darah baru. 1,3
VEGF yang juga dikenal sebagai vascular permeability factor (VPF), adalah
sitokin multifungsi yang meningkatkan permeabilitas mikrovaskuler dan secara
langsung merangsang pertumbuhan sel endotel dan angiogenesis, dimana
reseptor spesifik untuk VEGF diekspresikan dalam sel endotel vaskular. VEGF
disintesis dan disekresi oleh berbagai sel tumor hasil kultur dan tumor solid pada
manusia, seperti tumor otak, kanker paru-paru, kanker payudara,
adenocarcinoma saluran pencernaan, ginjal dan kandung kemih serta kanker
ovarium. Peningkatan ekspresi VEGF dianggap terlibat dalam tumorigenesis,
metastasis dan produksi efusi melalui peningkatan permeabilitas pembuluh
darah atau angiogenesis, sehingga banyak dilakukan penelitian untuk
mendukung penggunaan anti VEGF.
2,5
Apakah tingkat ekspresi VEGF berbeda bermakna antara tumor ovarium
jinak dan kanker ovarium sehingga dapat mendukung penggunaan anti VEGF
pada kasus kanker ovarium, masih belum jelas. Oleh karena itu muncul
pertanyaan penelitian adakah perbedaan ekspresi VEGF pada kasus kanker
ovarium dan tumor ovarium jinak melalui pemeriksaan imunohistokimia pada
jaringan ovarium yang telah diparafinisasi.
1.2. Rumusan masalah
- Apakah terdapat perbedaan ekspresi VEGF pada kasus tumor ovarium
ganas dibandingkan pada tumor ovarium jinak?
- Apakah terdapat hubungan antara ekspresi kuat VEGF dengan kejadian
tumor ovarium ganas?
1.3. Tujuan
1.3.1. Tujuan Umum
Mengetahui perbedaan dan hubungan ekspresi VEGF antara kasus – kasus tumor ovarium ganas dan tumor ovarium jinak
1.3.2. Tujuan Khusus
1. Mengetahui distribusi frekuensi pasien dengan tumor ovarium ganas dan tumor ovarium jinak berdasarkan usia
2. Mengetahui distribusi frekuensi pasien dengan tumor ovarium ganas dan tumor ovarium jinak berdasarkan status menopause
3. Mengetahui distribusi frekuensi pasien dengan tumor ovarium ganas dan tumor ovarium jinak berdasarkan usia menarche
5. Mengetahui distribusi frekuensi pasien dengan tumor ovarium ganas dan tumor ovarium jinak berdasarkan jenis histopatologi tumor ovarium
6. Mengetahui perbedaan ekspresi VEGF pada kasus tumor ovarium ganas dan tumor ovarium jinak
7. Mengetahui hubungan antara ekspresi kuat VEGF dengan kejadian tumor ovarium ganas
1.4. Manfaat
1. Memberikan informasi mengenai ekspresi VEGF yang ditemukan pada kasus – kasus tumor ovarium
2. Menjadi pedoman / pertimbangan pemberian antiangiogenesis pada penatalaksanaan tumor ovarium ganas
BAB II
TINJAUAN PUSTAKA 2.1 Kanker Ovarium
Tumor ovarium adalah temuan yang sering dijumpai dalam praktik
ginekologi. Kebanyakan dari tumor ovarium adalah neoplasma dan umumnya
bersifat jinak. Namun, kanker ovarium merupakan penyebab kematian akibat
kanker organ reproduksi yang paling sering dijumpai. Di seluruh dunia setiap
tahunnya, sebanyak 204.000 wanita didiagnosa dengan kanker ovarium, dan
sebanyak 125.000 wanita meninggal akibat penyakit ini. Pada tahun 2009,
American Cancer Society melaporkan kanker ovarium sebagai keganasan
ginekologi dengan kasus kematian tertinggi dimana dari 21.550 kasus kanker
ovarium epitel dijumpai 14.600 kematian terkait penyakit tersebut. Angka
kematian yang tinggi ini terutama disebabkan tidak timbulnya gejala pada
stadium dini dan mayoritas dari pasien (75%) datang pada stadium lanjut,
dengan penyakit metastasis luas dalam rongga peritoneal.
Tumor ovarium terbagi atas tiga kelompok berdasarkan struktur anatomi
dari mana tumor itu berasal yaitu tumor epitel ovarium, tumor sel germinal, dan
tumor sex cord stromal. Kanker ovarium yang berasal dari epitel merupakan
kasus yang terbanyak yaitu meliputi 90-95%, sisanya sekitar 5-10% berasal dari
sel germinal dan sex cord stromal.
1,8
1,8
Seperti kanker payudara, insidensi kanker ovarium meningkat seiring usia
dengan mayoritas pada usia 40-60 tahun. Pada penelitian Fa¨rkkila et al. (2011),
dari 106 subyek penelitian, rerata usia saat diagnosis kanker ovarium adalah
sedangkan 46 pasien (43%) belum menopause saat didiagnosa.Dari penelitian
Duncan et al. (2005) pada 339 pasien dengan kanker ovarium primer, rerata usia
saat diagnosis adalah 61 tahun (rentang 24 – 90 tahun). Sedangkan pada
penelitian Alvarez et al. (1999) yang melibatkan 88 pasien kanker ovarium,
dijumpai rerata usia pasien 58 tahun (rentang 26-81).
Selain usia, banyak faktor resiko kanker ovarium terkait dengan teori
“incessant ovulation”, meliputi infertilitas, nuliparitas, peningkatan jumlah siklus
ovulasi, menarche dini dan menopause lanjut. Stimulasi ovarium yang
berkepanjangan oleh gonadotropin dan trauma serta penyembuhan berulang
karena ovulasi atau inflamasi diduga berperan sebagai etiologi kanker
ovarium.
8,9,10,11,12,13
Faktor resiko lain terkait kanker ovarium adalah riwayat keluarga dengan
kanker payudara atau ovarium. Diperkirakan 5-10% kanker ovarium epitel
disebabkan pewarisan mutasi germline pada gen predisposisi kanker, 6,10,14
dimana
gen BRCA 1 dan BRCA2 dikaitkan dengan kanker payudara dan ovarium.
BRCA1 maupun BRCA2 merupakan gen supresor tumor. Gen BRCA1 terletak
pada kromosom 17q21, pasien dengan mutasi gen ini terbukti memiliki
peningkatan resiko terjadi kanker payudara (60-85 %) dan kanker ovarium (20–
40%). BRCA2 terletak di kromosom 13q12, mutasi gen ini juga mengarah pada
peningkatan resiko kanker payudara (60-85%) dan kanker ovarium (10-20%).
Hal ini menyebabkan peningkatan permintaan untuk konseling dan pemeriksaan
genetis.
2.2 Angiogenesis pada Kanker Ovarium
Pertumbuhan tumor ganas dan kemampuan metastasis, keduanya telah terbukti sangat tergantung pada angiogenesis, atau pembentukan pembuluh
darah baru. Neovaskularisasi diperlukan oleh tumor untuk menyediakan nutrisi
dan oksigen yang tidak dapat dipenuhi melalui difusi sederhana agar
memungkinkan pertumbuhan tumor >2 mm. Baik tumor dan jaringan penjamu
menghasilkan berbagai faktor angiogenik yang mempromosikan migrasi sel
endotel, biasanya dari venule pasca kapiler ke tumor, sehingga terjadi
perkembangan pembuluh darah dari kapiler.
Neovaskularisasi atau pembentukan pembuluh darah baru dibedakan
menjadi vaskulogenesis dan angiogenesis. Vaskulogenesis secara klasik
merupakan proses pembentukan pembuluh darah baru yang berasal dari
hemangioblas yang berdiferensiasi menjadi sel darah dan sel endotel matur.
Pada embrio dan yolk sac, pembuluh darah dini berkembang dari agregasi
angioblas menjadi sambungan jaringan pembuluh endotel yang sederhana.
Kemudian terjadi remodelling pembuluh darah primitif ini menjadi sistem sirkulasi
yang fungsional. Pembuluh darah ini juga mengalami proliferasi dan regresi lokal
serta pertumbuhan cabang dan migrasi.
6,16,17,18
16,17
Angiogenesis adalah proses pembentukan pembuluh darah baru yang
berasal dari jaringan pembuluh darah yang telah ada sebelumnya dengan cara
pembentukan capillary sprouting. Selama proses ini, sel endotel yang matur
membelah dan menempel pada kapiler baru. Sinyal VEGF diperlukan pada
vaskulogenesis dan angiogenesis.
Angiogenesis dimulai dari stimulasi endothelium, menghasilkan
stroma di bawahnya. Langkah selanjutnya adalah migrasi dan proliferasi sel
endotel, dan pembentukan pembuluh darah baru dan kapiler. Dua faktor penting
dalam angiogenesis adalah fibroblast growth factor (b-FGF) dan vascular
endothelial growth factor (VEGF). VEGF ditemukan sebagai faktor yang
menimbulkan hiperpermeabilitas dan awalnya bernama vascular permeability
factor (VPF). Kebanyakan tumor mengekspresikan VEGF, termasuk kanker
ovarium, lambung dan usus. Peningkatan permeabilitas kapiler akibat produksi
zat aktif lokal seperti VEGF, juga dapat menjadi faktor penting dalam
patofisiologi asites pada keganasan.6,17,20,21
Angiogenesis klasik terdiri dari fase penonjolan pembuluh darah
(sprouting vessel) dan fase resolusi. Fase sprouting terdiri dari enam komponen:
(i) meningkatkan permeabilitas pembuluh darah dan deposisi fibrin
ekstravaskuler, (ii) pembongkaran dinding pembuluh, (iii) degradasi basement
membran, (iv) migrasi sel dan invasi matriks ekstraseluler, (v) proliferasi sel
endotel, dan (vi) pembentukan lumen kapiler. Fase resolusi terdiri dari lima
komponen: (i) penghambatan proliferasi sel endotel, (ii) penghentian migrasi sel,
(iii) pemulihan basement membran, (iv) junctional pematangan kompleks, dan (v)
perakitan dinding pembuluh termasuk perekrutan dan diferensiasi sel otot polos
dan pericytes. Selain angiogenesis klasik, berbagai bentuk angiogenesis
nonsprouting turut berperan dalam perkembangan tumor, termasuk
pertumbuhan pembuluh darah intussusepsi, kooptasi, pembentukan pembuluh
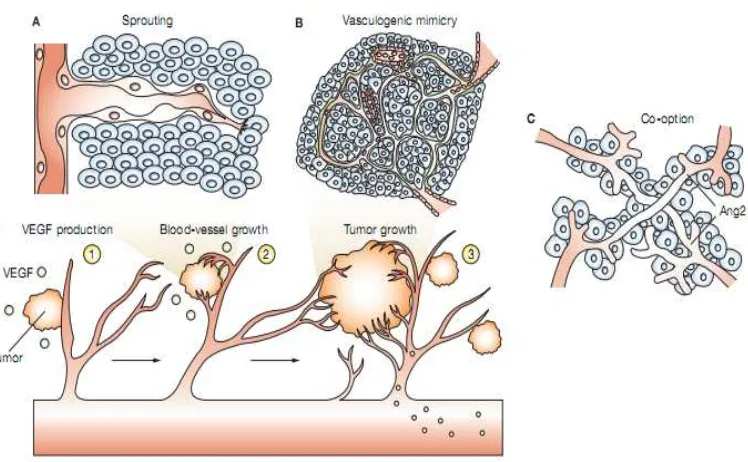
mosaik, dan mimikri vaskulogenik (gambar 2.1).
Pembuluh darah baru sering memiliki membran basal yang cacat dan
besar sel-sel kanker dapat memasuki sistem peredaran darah dan
bermetastasis. Oleh karena itu proses angiogenik tidak hanya meningkatkan
pertumbuhan tumor secara lokal tetapi memfasilitasi penyebaran sel tumor ke
situs lain.3,17
Gambar 2.1. Mekanisme neovaskularisasi tumor. (A) Endothelial sprouting merupakan proses
yang dominan pada pertumbuhan pembuluh darah. Lumen sel endotel bermigrasi disepanjang
membran dasar pembuluh darah ke dalam matrix ekstrasel, berkembang menjadi pertumbuhan
bentuk yang memanjang. (B) Mimikri vaskulogenik merupakan perkembangan saluran
mikrovaskular oleh sel tumor. (C) Kooptasi pembuluh darah melibatkan penggunaan pembuluh
darah yang telah ada pada host. (D) Proses neovaskularisasi tumor melibatkan pelepasan faktor
proangiogenik seperti VEGF oleh sel tumor menyebabkan aktifasi endotel, pertumbuhan
2.3 Aktivator dan penghambat angiogenesis
Pada manusia dewasa, sel-sel endotel sangat sedikit membelah, hanya 1
dari setiap 10.000 sel endotel pada satu siklus pembelahan sel. Namun, terdapat
peningkatan mitosis sel endotel dan angiogenesis selama penyembuhan luka
dan perbaikan jaringan, selama pembentukan korpus luteum ovarium, dan
selama perkembangan plasenta pada kehamilan. Penghambatan angiogenesis
merupakan terapi potensial untuk gangguan angiogenesis non-fisiologis
termasuk degenerasi makula mata terkait usia, retinopati diabetes,
endometriosis, psoriasis, arthritis, pertumbuhan tumor dan metastasis.
Angiogenesis merupakan sistem yang dikendalikan oleh faktor
proangiogenik dan faktor antiangiogenik. Keseimbangan angiogenik adalah
keseimbangan fisiologis antara sinyal stimulasi dan inhibisi pertumbuhan
pembuluh darah. Terdapat sekitar 30 faktor endogen pro-angiogenik, beberapa
tercantum dalam Tabel 2.1. Tiga famili regulator memegang peran penting dalam
vaskulogenesis dan angiogenesis. Famili VEGF/VEGFR adalah famili regulator
yang paling banyak dipelajari. Sistem angiopoietin mengendalikan maturasi
pembuluh darah sementara sistem eph/Ephrin mengendalikan asimetri
arterio-vena.
19,20
Tabel 2.1 Faktor pro-angiogenik endogen
Faktor MW (kDa)
20
Acidic Fibroblast Growth Factor (aFGF,FGF1)b Angiogenin
Basic fibroblast growth factor (bFGF, FGF2)b
Ephrin-A1 23,8
17,3
Ephrin-B1 38,0
Ephrin B2 36,9
Epidemial Growth Factor (EGF)b
Granulocyte colony-stimulating factor (GCSF) 16,3
134
Macrophage-granulocyte colony-stimulating factor (GM –CSF) 16,3
Hepatic growth factor (HGF,Scatter factor)b Interleukin-8 (II-8, CXCL8)
83,1
b
Leptin 18,6
11,1
Placental Growth Factor (PIGF)b
Platelet-derived endothelial growth factor (PD-EGF)
24,8
b
Platelet-derived growth factor-A (PDGF-A)
50,0
b
Platelet-dreived growth factor-B (PDGF –B)
24,0
b
Transforming growth factor-α ( TGF-α)
27,3
b
Transforming Growth Factor- ᵝ (TGF-ᵝ)
17,0
b
Tumor Necrosis Factor (TNF-α)
44,3
b
Vascular Endothelial Growth Factor (VEGF-A)
25,6
Molecular weight (MW) corresponding to the unprocessed human precursor
Pada tabel 2.2 tercantum beberapa faktor anti-angiogenik dari sekitar 30
faktor endogen anti-angiogenik. Sebagai regulator negatif, anti-angiogenik yang
paling banyak dipelajari meliputi angiostatin, endostatin, dan thrombospondin.
Dalam kondisi yang fisiologis pada manusia dewasa, aksi regulator negatif
mendominasi dan angiogenesis cenderung tidak terjadi. Dalam kondisi patologis
tertentu, misalnya, selama perkembangan tumor, pembuluh darah mengalami
apa yang disebut “angiogenic switch”, aksi regulator positif dominan dan
angiogenesis menjadi aktif. Kaskade angiogenesis ini akan menimbulkan
perubahan fenotip pada sel endotel pembuluh darah tumor sehingga
memungkinkan tumor tumbuh cepat, menginvasi jaringan sekitarnya serta
Tabel 2.2 Faktor anti-angiogenik
Inhibitor MW (kDa)
20
(A) Derived from the extracellular matrix
Anestelin 263
Fibulin Fragments ≈ 77
Thrombospondin-1 and -2 129
Tumstatin 162
(B) Non- Matrix derived factors
Angiostatin 90,6
Antithrombin III ( Cleaved) 52,6
Hemopexin-like domain (PEX) 73,9
Interferon-α, -ᵝ,-ᵞ ≈22
Interleukin-1, -4, -12,-18 ≈17
2-Methoxyestradiol
Pigment epithelium-derived factor (PEDF) 46,3
Plasminogen krimgle-5 90,6
Platelet factor-4 10,8
Prolactin Fragments 25,9
Prothrombin kringle-2 70,0
Semaphorin – 3F 88,4
Soluble VEGFR1 151
TIMP-2 24,4
Troponin-1 21,2
TrpRS 53,2
Vasostatin 48,1
2.4 Famili VEGF
VEGF merupakan sitokin multifungsi yang merangsang angiogenesis dan
meningkatkan permeabilitas mikrovaskular melalui ikatan reseptor spesifik yang
diekspresikan pada sel endotel vaskular. Yang termasuk ke dalam kelompok
VEGF adalah VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF E dan Placental
Growth Factor (PIGF). Setiap protein ini mengandung urutan sinyal yang
membelah selama proses biosintesis.1,5,16,20,21,22,23,25
VEGF telah terbukti memiliki peran penting dalam pembentukan
neovaskular pada tumor, menyediakan makanan bagi sel-sel tumor yang tinggi
metabolismenya serta menyediakan akses ke pembuluh darah host. Penelitian
telah menunjukkan peran dari VEGF dalam berbagai tahapan karsinogenesis
ovarium, dengan efek pada pertumbuhan tumor dan neovaskularisasi terlihat
pada model hewan dan pada manusia. Pada kanker ovarium stadium lanjut,
VEGF menginduksi hiperpermeabilitas pembuluh darah peritoneum, selanjutnya
terjadi hiperosmolaritas intraperitoneal yang disebabkan bocornya plasma
protein. Hal ini akan menimbulkan asites.
Pada kanker ovarium stadium dini, peningkatan ekspresi VEGF
berhubungan dengan massa bebas penyakit yang lebih singkat serta klinis yang
lebih buruk. Kadar serum VEGF yang tinggi dianggap merupakan faktor resiko
dan parameter prognostik terhadap metastasis, peningkatan stadium dan
penurunan angka ketahanan hidup pada penderita kanker ovarium. 6,22,25,26
6,26,27
VEGF-A pada umumnya hanya disebut sebagai VEGF saja. Ditemukan
pada akhir 1970-an, VEGF merupakan glikoprotein dimerik terikat disulfida
dengan berat 34 hingga 42-kDa, dan mengandung lokasi N-linkage
glycosylation, yang terdiri dari 9 isoform hasil dari splicing alternatif pre transkrip
mRNA dari gen tunggal yang mengandung 8 akson. Beberapa isoform VEGF-A
yang berperan dalam proses angiogenesis adalah VEGF 121, 145, 165, 183,
189 dan 206. 5,16,18,20,21,25
Ekspresi gen VEGF paling banyak diregulasi oleh keadaan hipoksia,
hormon seks steroid dan beberapa sitokin. VEGF A mRNA pada keadaan
normal dijumpai pada jaringan paru-paru, ginjal, jantung dan kelenjar adrenal.
Kadar VEGF A dengan kadar yang rendah dapat terdeteksi di limpa, hati dan
mukosa lambung. VEGF A mRNA diekspresikan secara luas pada keganasan
payudara, kanker ovarium, kanker kolorektal, kanker paru-paru non small cell
dan kanker prostat. Di antara seluruh anggota famili VEGF, VEGF A dianggap
regulator yang paling penting dalam angiogenesis.
2.4.2 VEGF B
5,16,17,20,25
VEGF B ditemukan pada tahun 1995. VEGF B diekspresikan pada
myocardium, otot skeletal dan pankreas. Gen VEGF B disusun oleh 7 exon.
Splicing alternatif dari exon 6 menghasilkan 2 isoform VEGF B yaitu VEGF-B167
(21 kDa) dan VEGF-B186 (32 kDa). VEGF B167 strukturnya mirip dengan
beberapa isoform VEGF A.
VEGF B berikatan dengan permukaan sel atau pericellular heparan
sulfate proteoglycans dimana VEGF B186 disekresikan secara bebas. VEGF-B
thymoma, karsinoma payudara, fibrosarkoma, lymphoma non-Hodgkins, dan
melanoma. Oleh karena ekspresinya pada tumor dan kemampuannya
mengaktifkan VEGFR1 dan neurophilin 1, VEGF B menjadi target yang potensial
pada pengobatan kanker.17,20
2.4.3. VEGF C
Gen untuk VEGF-C menghabiskan rentang lebih dari 40 kB DNA dan
terdiri dari tujuh exon. VEGF C disintesa sebagai prepro protein yang mengalami
proteolitik untuk menghasilkan growth factor dalam bentuk yang matur. Dua
prekursor VEGF C akan membentuk homodimer yang dihubungkan oleh ikatan
disulfida dari setiap satu terminal C pada terminal propeptida N. Sebelum
disekresi, dimer ini akan mengalami proteolisis. VEGF C dimerik yang matur
mengandung 8 residu cysteine homolog.5,20,27
Pada manusia dewasa, VEGF-C lebih dominan pada jantung, plasenta,
ovarium, usus kecil dan kelenjar tyroid. Bentuk VEGF C matur akan mengikat
VEGFR2 dan VEGFR3 dan menjadi faktor penting pada lymphogenesis. Pada
perkembangan pembuluh limfatik, adanya lymphedema disebabkan adanya
defek pada VEGF C. Sinyal VEGF C diperlukan untuk migrasi dan bertahannya
sel endotel pembuluh limfatik dan pembentukan kantung lymph. VEGF-C ikut
berperan dalam limfangiogenesis selama embriogenesis dan dalam
pemeliharaan diferensiasi endotel limfatik pada usia dewasa. Selain itu, VEGF-C
diekspresikan dengan fraksi yang signifikan pada beberapa tumor termasuk
kanker payudara, leher rahim, usus besar, paru-paru, prostat, lambung. Dengan
demikian, VEGF-C merupakan target anti-kanker yang potensial.
2.4.4. VEGF-D
Seperti VEGF-C, VEGF-D disintesis sebagai prepro-protein yang
mengalami proses proteolitik yang rumit untuk menghasilkan bentuk faktor
pertumbuhan yang matur. VEGF-D yang matur merupakan homodimer
non-kovalen. Meskipun dalam bentuk yang belum diolah, VEGF-D akan mengikat
VEGFR3, hal ini penting dalam limfangiogenesis. Gen VEGF-D berisi tujuh
ekson dan ditemukan pada kromosom X.
Jaringan usus, jantung, paru-paru, otot rangka, dan usus kecil
menunjukkan transkrip VEGF-D yang tinggi sementara ovarium, pankreas,
prostat, limpa, dan testis menunjukkan transkrip VEGF-D yang rendah. Regulasi
VEGF-D meningkat pada karsinoma payudara, kolorektal, lambung, tiroid,
neoplasia intraepitel serviks, glioblastoma, dan melanoma. Ekspresinya
berkorelasi dengan metastasis kelenjar getah beningpada kanker kolorektal,
paru-paru, dan ovarium. Sinyal VEGF-D memiliki potensi menjadi target
anti-kanker dan antimetastasis.
5,20,26
20,23
2.4.5 VEGF E
VEGF-E adalah VEGF yang dikode oleh parapoxvirus Orf. VEGF-E
berikatan dengan afinitas tinggi pada VEGFR2 tapi tidak dengan VEGFR1.
Faktor ini terlibat dalam angiogenesis patologis pada lesi akibat infeksi
parapoxvirus.5,20
Placenta Growth Factor merupakan glikoprotein homodimeric yang
memiliki kemiripan urutan asam amino sebesar 42% dengan VEGF dan dapat
meningkatkan sinyal VEGF. PlGF memiliki inti seperti kelompok VEGF yaitu
terdiri dari delapan residu cystein yang turut dalam pembentukan ikatan disulfida
antar-dan intra-subunit. Gen PlGF berisi tujuh ekson dan mengekspresikan
empat isoform yaitu PlGF- 131, -152, -203, dan -224 berdasarkan splicing
alternatif pra-mRNA. Transkrip isoform PlGF muncul terutama di plasenta.
Ekspresi isoform PlGF yang berbeda-beda juga dapat dijumpai pada payudara,
lambung, prostat, kanker paru-paru non small cell, jantung yang normal, otot
skeletal, retina, dan kulit, namun PlGF hanya berikatan dengan VEGFR1.16,20,25
2.5 Reseptor VEGF
Tiga famili reseptor protein-tyrosine kinase memegang peran penting dalam
vaskulogenesis dan angiogenesis. Tiga reseptor tirosin kinase VEGF afinitas
tinggi telah diidentifikasi: VEGFR-1 (flt-1), VEGFR-2 (flk-1/KDR) dan VEGFR-3
(flt-4). Pengikatan reseptor VEGF ini memulai kaskade jalur sinyal yang
memediasi migrasi, proliferasi, kelangsungan hidup dan permeabilitas sel
endotel.5,19,20,22,23
VEGF-A berinteraksi dengan baik VEGFR-1 dan VEGFR-2 untuk
memediasi angiogenesis, sedangkan VEGF-B dan PlGF memiliki afinitas tinggi
hanya dengan VEGFR-1. VEGF-C dan VEGF-D mengikat baik VEGFR-2 dan
VEGFR-3 untuk mengatur angiogenesis dan juga terlibat dalam
limfangiogenesis. VEGFR-2 adalah reseptor utama yang mempromosikan efek
meskipun studi tambahan telah menggarisbawahi pentingnya signaling melalui
VEGFR-1.
Tambahan ko-reseptor termasuk neuropilin (neuropilin-1 dan -2),
meningkatkan ikatan VEGF ke reseptornya. Namun, data terakhir menunjukkan
bahwa neuropilin-1 dapat mempengaruhi fungsi sel endotel independen dari
VEGFR-2, dan bahwa VEGF121 dapat langsung berinteraksi dengan
neuropilin-1 tanpa membentuk kompleks NRP-neuropilin-1-VEGFR-2. 5,20,25,26
5,20,23
2.5.1. VEGFR1
VEGFR1 (Flt-1, fms-like tyrosyl kinase-1) berikatan dengan VEGF, PlGF
dan VEGF B. VEGFR1 memiliki berat molekul sebesar 210 kDa. Gen VEGFR1
manusia, yang terdiri dari 30 ekson, berlokasi di kromosom 13q12. Alternatif
splicing dari pre-mRNA VEGFR1 menghasilkan isoform reseptor yang larut
(sVEGFR1) yang dapat mengikat dan menghambat kerja dari VEGF. VEGFR1
memiliki beberapa fungsi yang bergantung pada perkembangan stadium dan
lokasi sel endotel yang memproduksi reseptor.
VEGF A memiliki afinitas yang lebih tinggi dengan VEGFR1 dari pada
VEGFR2. VEGFR1 memiliki afinitas fosforilasi tirosine kinase yang lemah
setelah perangsangan oleh VEGF.
20,22
Aktivasi VEGFR1 tidak memiliki efek
langsung terhadap proliferasi, namun aktivasinya berdampak pada ekspresi
plasminogen activator pada sel endotel, dimana molekul ini berperan pada
degradasi matriks ekstraselular dan migrasi sel.20,25
PlGF ditemukan mengikat sampel sel endotel vena umbilicus manusia
kecil isoform VEGF-165 yang terikat. Hasil ini sesuai dengan anggapan bahwa
PlGF hanya berikatan dengan VEGFR1. Potensiasi PlGF ini dianggap
berkontribusi terhadap angiogenesis selama perkembangan tumor.20,25
2.5.2 VEGFR2 (Flk-1/KDR)
VEGFR2 (Flk-1/KDR, Fetal liver kinase-1/Kinase Domain-containing
Receptor) berikatan dengan VEGF dengan berat jenis molekul lebih rendah
(110-165 residu asam amino), VEGF-E, dan VEGF-C serta VEGF-D bentuk
matur. VEGFR2, yang memiliki berat molekul berkisar 210 kDa, merupakan
mediator dominan migrasi sel endotel, proliferasi, kelangsungan hidup, dan
peningkatan permeabilitas pembuluh darah yang distimulasi VEGF. Meskipun
VEGFR2 memiliki afinitas yang lebih rendah untuk VEGF dari pada VEGFR1,
VEGFR2 menunjukkan aktivitas protein tyrosine-kinase terhadap ligandnya.
VEGF merangsang terjadinya dimerisasi VEGFR2 yang menyebabkan
autofosforilasi dan aktivasi reseptor.
2.5.3 VEGFR3 (Flt-4)
5,20
VEGFR 3 memiliki berat molekul 170kDa, memegang peranan penting
dalam terjadinya remodelling primer pleksus kapiler pada embrio serta berperan
pada angiogenesis dan limfangiogenesis pada manusia dewasa. Reseptor ini
terdapat di dalam sel endotel pembuluh darah embrio dan produksinya menurun
dan akhirnya terbatas pada pembuluh limfatik. Mutasi pada loop katalitik domain
kinase VEGFR3 menyebabkan limfedema yang disebut sebagai Milroy’s disease
yang ditandai dengan adanya pembengkakan pada ekstremitas disebabkan oleh
domain imunoglobulin ke 6 dengan 2 komponen rantai awal tetap berikatan
dengan ikatan disulfida. Pada kultur stem cell embrio, hipoksia meningkatkan
ekspresi VEGFR3.5,20
2.5.4 Neurophilin-1 dan -2
Neurophilin merupakan ko-reseptor transmembran non-protein-tyrosine
kinase untuk kelompok semaphorin dan famili VEGF. Neurophilin juga berfungsi
sebagai reseptor isoform VEGF secara terpisah dari VEGFR1, VEGFR2 atau
VEGFR3. VEGF 165, PlGF 152 dan isoform VEGF B berikatan dengan
Neurophilin 1. Sementara VEGF-145, VEGF-165, PlGF-152 dan VEGF-C
berikatan dengan neurophilin 2. VEGF 121 bukan merupakan ligand baik pada
neurophilin 1 dan 2.10,20
Neurophilin merupakan glikoprotein dengan komponen ekstra seluler
yang besar, segmen transmembran, dan bagian intrasel yang pendek (≈40
residu asam amino). Walaupun bagian intra selnya terlalu kecil untuk berfungsi
sebagai katalis, tetapi bagian intraselnya mungkin berfungsi sebagai tempat
berkumpul sinyal molekul atau sebagai hubungan dengan ko-reseptor.
Neurophilin 1 terdapat pada neuron sensoris dan neuron simpatis,
sedangkan neurophilin 2 terdapat pada neuron simpatis saja. Neurophilin 1 juga
terdapat pada bermacam-macam tipe sel non neuronal dan non vaskular pada
kondisi fisiologis termasuk pada fibroblas sumsum tulang, adiposa, sel imun
dendritik, osteoblas, mesangial ginjal dan sel epitel golmerular ginjal. 5,20
5,20
VEGF bekerja pada sel endotel dengan memicu tiga aktivitas utama sel
endotel dalam angiogenesis yaitu sekresi protease, migrasi dan proliferasi.
Degradasi membran dasar dibutuhkan untuk migrasi dan invasi sel endotel. Hal
ini merupakan langkah awal yang penting dalam memulai angiogenesis. VEGF
menginduksi berbagai macam enzim dan protein yang penting untuk proses
degradasi, termasuk matrix degrading meallpotroteinase, metalloproteinase
interstitial collagenase, dan serin proteinase seperti urokinase-type plasminogen
activator (uPA) dan tissue-type plasminogen activator (TTPA). Aktivasi
enzim-enzim tersebut mengarah ke lingkungan yang prodegradasi yang memfasilitasi
migrasi dan pertunasan sel endotel.
Mekanisme intraseluler dimana VEGF menyebabkan peningkatan migrasi
sel endotel belum sepenuhnya dimengerti, tetapi tampaknya melibatkan sinyal
yang berhubungan dengan Focal Adhesion Kinase (FAK) yang menyebabkan
pergantian adhesi fokal dan organisasi filamen actin serta reorganisasi actin
yang diinduksi MAPK (mitogen-activated protein kinase) p38. Sebagai tambahan
telah diusulkan bahwa oksida nitrat juga berperan penting dalam migrasi sel
endotel yang diindukasi VEGF. Oksida nitrat telah diimplikasikan dalam proses
podokinesis sel endotel dan aktivasi sintase oksida nitrat endotel tergantung
pada Akt yang dibutuhkan pada proses migrasi sel yang diinduksi VEGF. 20,22,25
VEGF mengaktivasi sel endotel dengan efek perubahan morfologi sel
endotel, perubahan sitoskeleton, dan menstimulasi migrasi dan pertumbuhan sel
endotel. VEGF bersifat mitogen terhadap sel endotel yang menyebabkan
proliferasi sel. VEGF juga mempengaruhi faktor survival sel endotel dengan
apoptosis dengan mengaktivasi jalur PI3K-Akt yang juga meningkatkan regulasi
protein antiapoptotik seperti bcl-2 dan A1. Hal ini akan menghambat aktivasi
caspase dan meningkatkan regulasi anggota famili penghambat apoptosis
termasuk survivin dan XIAP. Dengan mengaktivasi FAK, VEGF juga
mempertahankan sinyal survival sel-sel endotel. 9,20,25
2.7 Regulasi VEGF
Sinyal terhadap faktor proangiogenik terutama muncul sebagai respon
terhadap hipoksia. Selain hipoksia, berbagai growth factor, hormon, onco-genes,
dan tumor suppressor genes juga meregulasi ekspresi VEGF.5,16,18,24,25,28
2.7.1 Hipoksia
Dalam kondisi fisiogi yang normal, setiap 1014 sel pada tubuh
manusia dewasa mendapat suplai oksigen yang cukup untuk memenuhi
kebutuhan metabolik melalui fungsi sistem pulmonal, hematopoietik dan juga
sistem kardiovaskular. Oksigen diangkut oleh eritrosit yang bersirkulasi,
dikontrol oleh hormon glycoprotein erythropoietin (EPO). Sel yang
menghasilan EPO dalam liver dan ginjal dapat mendeteksi konsentrasi
oksigen untuk merespon hipoksia sistemik dengan meningkatkan transkripsi
gen EPO.5
Hipoksia juga dapat terjadi terbatas pada tingkat sel di dalam organ
spesifik, khususnya akibat perfusi yang tidak cukup. VEGF-A memainkan
peran sentral dalam angiogenesis dan neovaskularisasi, meningkatan
hantaran oksigen dan substrat energi. Ekspresi VEGF-A dapat dirangsang
tergantung pada elemen yang responsif terhadap hipoksia pada regio 5 dan
3 gen VEGF-A.
Hypoxia inducible factor-1 (HIF-1) merupakan mediator utama
terhadap respon hipoksia tersebut. Kompleks protein HIF-1 yang diinduksi
hipoksia berikatan dengan sekuensi enhancer dari gen VEGF-A. HIF-1
adalah heterodimer yang terdiri dari subunit HIF-1α dan HIF-1β. HIF-1α
terdegradasi pada kondisi cukup oksigen melalui ubiquitinasi yang
ditingkatkan oleh ikatan pada protein von Hippel Lindau dan p53. Kondisi
hipoksia menghambat ubiquitinasi dan menstabilkan protein HIF-1α. HIF-1α
akan mengalami dimerisasi dengan HIF-1β agar dapat stabil di dalam
kompartemen nuklear. Kompleks ini kemudian akan berikatan serta
mengaktivasi promoter VEGF-A dan menyebabkan peningkatan transkripsi
VEGF.
5,25,28
2.7.2 Growth factors dan sitokin inflamasi
Tumor necrosis factor-alpha (TNF-α) adalah sitokin inflamasi
dengan spektrum aktivitas biologi yang luas, termasuk dalam angiogenesis.
TNF-α mempengaruhi pembentukan pembuluh darah baru secara tidak
langsung. Pelepasan molekul angiogenik (seperti PAF, A dan
VEGF-C) dan juga pengaturan sistem proteolitik (seperti uPA) merupakan kejadian
biologis yang dipicu oleh TNF-α. Lebih lanjut, telah terbukti bahwa TNF-α
juga meningkatkan transkripsi gen VEGFR-2 dalam sel endotelial vaskular.
Hal ini tentu akan menjelaskan peningkatan dalam ekspresi VEGFR-2.5,18
Beberapa faktor pertumbuhan seperti tissue growth factor-β (TGF-β),
epidermal growth factor (EGF) dan platelet-derived growth factor (PDGF)
menginduksi ekspresi mRNA VEGF-A. Sitokin seperti IL-1α pada fibroblast
synovial manusia, IL-1β pada sel otot polos aorta dan IL-6 pada lini sel tumor
telah memperlihatkan stimulasi ekspresi VEGF-A.
5,16
Salah satu kelainan ginekologi yang dihubungkan dengan keadaan
inflamasi adalah endometriosis. Endometriosis adalah kelainan ginekologi yang
paling sering ditemukan pada wanita usia reproduksi, dimana sekitar 10% wanita
usia reproduksi didapati menderita endometriosis. Pada endometriosis, sejumlah
besar leukosit direkrut dari sirkulasi darah ke dalam lesi endometriosis sehingga
terjadi perubahan jumlah dan fungsi dari leukosit dalam cairan peritoneum dan
juga dalam lesi endometriosis. Terdapat perubahan pada populasi sel T, sel B,
sel mast, sel dendritik dan makrofag dalam lesi endometriosis ektopik yang
mungkin diakibatkan oleh perubahan potensial pada sel T regulator yang
mempengaruhi terjadinya endometriosis dan progresifitasnya.
Endometriosis juga ditandai dengan peningkatan volume cairan
peritoneum, peningkatan konsentrasi sel darah putih cairan peritoneum
(terutama makrofag) dan peningkatan sitokin inflamasi, faktor pertumbuhan, dan
substansi penyokong angiogenesis. Makrofag dapat menyokong pertumbuhan
sel-sel endometrium dengan cara mensekresi growth factor dan angiogenetic
factor seperti Vascular Endothelial Growth Factor (VEGF), epidermal growth
factor (EGF), macrophage-derived growth factor (MDGF), fibronektin, dan
adhesion molecule seperti integrin. Setelah perlekatan sel-sel endometrium ke
peritoneum, terjadi invasi dan pertumbuhan lebih lanjut yang tampaknya
diregulasi oleh matrix metalloproteinase (MMP) dan inhibitor jaringannya.
Pada penelitian Bourlev et al. (2006) yang membandingkan antara wanita
yang menderita endometriosis dengan wanita non-endometriosis, diketahui
bahwa ekspresi VEGF-A lebih tinggi pada endometrium wanita dengan
endometriosis. Ekspresi VEGFR-1 dan VEGFR-2 lebih rendah pada sel stroma
dari wanita yang mengalami endometriosis dibandingkan wanita
non-endometriosis. Ditemukan juga ekspresi VEGFR-2 pada pembuluh darah lebih
tinggi pada wanita dengan endometriosis pada fase sekresi. Hal ini sejalan
dengan penelitian Gagne et al. (2003) yang menjumpai ekspresi VEGF yang
kuat pada lesi endometriosis terutama pada lesi merah (aktif) dibandingkan lesi
hitam.
33,34
35,36
2.7.3 Hormon
Estrogen merangsang transkripsi gen VEGF-A dan menstabilkan
pengaturan VEGF-A masih belum ditemukan mengandung elemen yang
langsung merespon estrogen, namun mengandung beberapa lokasi AP-1
dan Sp1, yang dapat memediasi kerja estrogen. Progestin juga
meningkatkan ekspresi VEGF-A pada uterus manusia dan pada sel kanker
payudara manusia (T47-D), terkait dengan aktivasi transkripsional gen
VEGF.5,16,20
Pengaruh dari testosterone terhadap ekspresi VETGF-A juga telah
diteliti pada lini sel kanker payudara pada tikus S115 yang tergantung
androgen dan pada jaringan prostat manusia. Aktivasi transkripsional
menyebabkan peningkatan dalam ekspresi VEGF-A termasuk stabilisasi dari
mRNA. Bagian pengaturan dari gen VEGF ini tidak mengandung elemen
yang berespon terhadap androgen atau gonadotropin. Namun demikian,
reseptor androgen terikat ligand telah ditemukan dapat memodulasi
transkripsi secara tidak langsung melalui faktor transkripsi lain, seperti
kompleks AP-1.
5,20
2.7.4 Onco-genes dan tumor suppressor genes
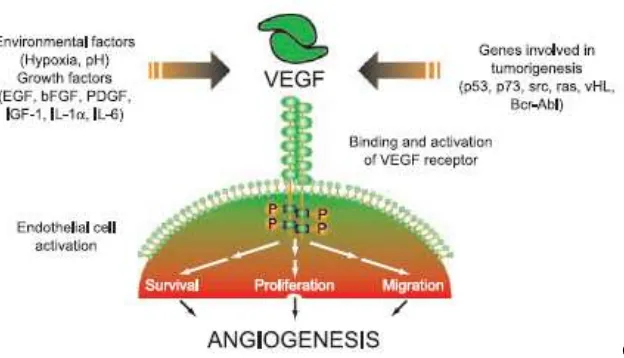
Beberapa onkogen berperan dalam regulasi VEGF seperti c-src dan
PI3/ras (gambar 2.2). Protoonkogen c-src mengkode protein tyrosine kinase,
yang terlibat dalam regulasi ekspresi VEGF dan dalam meningkatkan
neovaskularisasi tumor yang sedang tumbuh. Ekspresi onkogen ras mutan
merupakan salah satu perubahan genetik yang dideteksi menginduksi ekspresi
VEGF. Aktivasi ras juga menjadi bagian dari rangkaian sinyal yang diawali
Gambar 2.2.
VEGF sebagai mediator angiogenesis dan faktor-faktor yang mempengaruhi ekspresi VEGF
Gen supressor tumor p53 merupakan salah satu gen supresor tumor yang
paling intensif dipelajari dalam patogenesis tumor solid. Keterlibatan mutasi gen
p53 dijumpai pada ekspresi fenotip tumor yang agresif dan invasif. Gen ini
berperan penting dalam regulasi VEGF. Perubahan genetik yang terjadi pada
p53 akan meningkatkan ekspresi VEGF dengan menginduksi aktivitas
HIF-1.
16
2.8 Ekspresi Kuat VEGF 16,20,28,29
Ekspresi kuat VEGF telah dihubungkan dengan progresivitas tumor dan
prognosis buruk dalam berbagai macam tumor, termasuk karsinoma kolorektal,
karsinoma lambung, karsinoma pankreas, kanker payudara, kanker paru dan
melanoma, myeloid leukemia, karsinoma hepar dan kanker ovarium. Penelitian
oleh Matei et al. (2007) menjumpai 13 dari 21 kasus karsinoma ovarium (61%)
yang diperiksa secara imunohistokimia menunjukkan pulasan sitoplasma positif
Yamamoto dkk memanfaatkan pewarnaan immunohistokimia dan kadar
serum, untuk meneliti hubungan antara ekspresi VEGF dalam neoplasma
ovarian dengan faktor klinikopatologi. Pewarnaan positif diamati pada 97%
kasus (68 dari 70 kasus) karsinoma ovarium dan 33% kasus (5 dari 15 kasus)
cystadenoma jinak. Diantara pasien dengan karsinoma ovarium, pewarnaan
immunohistokimia untuk faktor VEGF terkait dengan kelangsungan hidup yang
kurang baik.
Fa”rkkila et al. (2011) melakukan pemeriksaan imunohistokimia pada
jaringan tumor sel granulosa ovarium dari pasien yang didiagnosa sejak tahun
1965-2009 di Helsinki University Central Hospital. Dari 91 tumor sel granulosa,
65 (74%) menunjukkan pulasan kuat untuk VEGF, 23 (26%) pulasan lemah dan
hanya 6 (7%) yang negatif terhadap antibodi VEGF. Hasil pewarnaan tersebut
tersebar merata pada sel tumor dan lapisan endotel pembuluh darah tumor.
Kesimpulan dari penelitian ini menunjukkan pentingnya peran VEGF dalam
patologi tumor sel granulosa dan mendukung kemungkinan penerapan terapi
berbasis target pada pasien dengan tumor sel granulosa. 2
Sebaliknya dari penelitian oleh Duncan et al. pada 339 kasus kanker
ovarium primer, ekspresi kuat VEGF hanya dijumpai pada 7% dari seluruh kasus
(22 kasus). Penelitian ini bertujuan menilai pola ekspresi VEGF dan perannya
dalam menentukan prognosis pasien dengan kanker ovarium yang diperkirakan
sesuai untuk mendapat terapi antiangiogenik. Penelitian ini akhirnya
menyimpulkan tidak ada hubungan antara ekspresi VEGF dan varibel klinis
sehingga peran antiangiogenik dinilai terbatas.
11
2.9 Terapi antiangiogenik
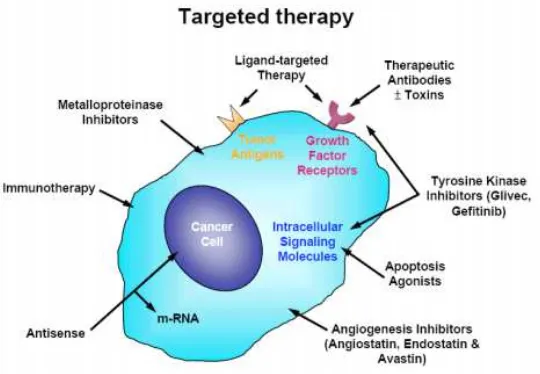
Terapi antiangiogenik termasuk kepada terapi berbasis target (targeted
therapy). Targeted therapy bekerja dengan berbagai pendekatan yang berbeda,
antara lain dengan pendekatan langsung yang mentargetkan antigen tumor
untuk mengubah sinyalnya baik dengan antibodi monoklonal atau dengan
obat-obat bermolekul kecil yang mampu menganggu protein target (gambar 2.3).38,39
Gambar 2.3. Berbagai pendekatan targeted therapy
Terapi antiangiogenik menghambat pertumbuhan pembuluh darah baru,
menginduksi apoptosis sel endotel, menghambat koorporasi sel progenitor
endotelial dan hematopoietik ke dalam pembuluh darah dan normalisasi
pembuluh darah. Oleh karena peran pentingnya dalam angiogenesis tumor, jalur
VEGF/VEGFR telah menjadi fokus utama dalam pengembangan berbagai
antikanker baru. Anti-VEGF bevazicumab (Avastin) telah banyak dievaluasi
penggunannya sebagai agen tunggal atau dikombinasikan dengan kemoterapi
pada kasus kanker. Agen anti-VEGF lainnya adalah aflibercept dan inhibitor
reseptor tyrosine kinase.
20
2.9.1 Bevazicumab
Bevacizumab (Avastin, Genentech) adalah antibodi monoklonal
rekombinan anti VEGF manusia. Bevacizumab merupakan immunoglobulin
G(IgG) yang terdiri dari 2 rantai ringan yang identik, tersusun oleh 214 residu
asam amino dan 2,453 residu rantai berat yang mengandung oligosakarida dan
memiliki berat molekul sebesar 149-kDa.
Bevacizumab secara selektif berikatan dengan afinitas yang tinggi dengan
segala bentuk isoform dari VEGF manusia dan menetralisir aktivitas biologis
VEGF melalui penghambatan sterik ikatan VEGF pada reseptornya yakni Flt-1
(VEGFR-1) dan KDR (VEGFR-2) ada permukaan sel endotel. Aktivasi reseptor
secara normal merangsang fosforilasi tyrosine dan beberapa rangkaian
tranduksi sinyal yang meningkatkan mitogenik dan sinyal aktivitas pro survival
untuk sel endotel pembuluh darah. Ekspresi reseptor VEGF sangat rendah pada
jaringan normal tetapi pada jaringan pembuluh darah tumor terjadi up regulasi
VEGF. Penetralan VEGF oleh bevacizumab memberikan penghambatan yang
relatif spesifik terhadap pembentukan pembuluh darah baru pada tumor
sehingga terjadi penghambatan terhadap pertumbuhan tumor dan proses
terjadinya metastasis.
21,41
Penggunaan bevazicumab telah disetujui oleh Food and Drug
Administration (FDA) pada tahun 2004 sebagai lini pertama pengobatan kanker
kolorektal yang telah bermetastase. Tromboembolisme merupakan efek samping
yang paling signifikan. Efek samping lainnya berupa perforasi gastrointestinal,
hipertensi dan epistaksis. 21,38,41,42
Bevacizumab telah dievaluasi sebagai agen tunggal maupun
dikombinasikan dengan kemoterapi pada pasien dengan kanker ovarium pada
sejumlah uji klinis. Pada model kanker ovarium, penggunaan tunggal antibodi ini
memberikan efek minimal pada massa tumor namun sangat mengurangi asites,
sedangkan pada penggunaanya dikominasikan dengan paclitaxel, massa tumor
serta asites berkurang signifikan.39,42
2.9.2 VEGF Trap (Aflibercept)
Salah satu cara efektif untuk menghambat jalur sinyal VEGF adalah
dengan mencegah VEGF berikatan dengan reseptor normalnya dengan
memberikan perangkap reseptor VEGF. Aflibercept (VEGF Trap) adalah
perangkap reseptor terlarut yang merupakan gabungan protein yang
mengandung domain pengikatan VEGF baik VEGFR-1 dan 2 yang dihubungkan
melalui regio Fc dari IgG1 manusia. Aflibercept mengikat VEGF A dan
menetralkan seluruh isoform VEGF A dan placental growth factor.27,30,38
Dalam suatu penelitian samar ganda tahap II pada pasien dengan kanker
ovarium resisten platinum, 162 pasien diberikan dua tingkat dosis 2 mg/kg atau 4
mg/kg setiap 2 minggu.
Tingkat respons yang dinilai adalah 11%. Hipertensi
adalah efek samping yang paling umum, namun mengingat tingkat respons yang
rendah, aflibercept mungkin tidak akan digunakan sebagai agen tunggal dalam
pengobatan kanker ovarium.
21.41
Molekul reseptor tyrosine kinases (TKIs) phosphorylate yang teraktivasi
akan memicu penurunan jalur transduksi sinyal yang akan mempengaruhi
proliferasi dan survival sel tumor. Mekanisme yang bergantung pada fosforilasi
ini penting untuk memulai aktivitas growth factors seperti VEGF dan PDGF.
Menghambat fosforilasi dengan menargetkan komponen intraseluler dari
tyrosine kinase sehingga menghambat aktivitas biologis VEGF, menjadikan hal
ini salah satu strategi antitumor yang efektif.21,39,41
Hasil yang menjanjikan datang dari beberapa uji f
ase II yang meneliti agen tunggal molekul TKI, yang mentargetkan VEGFR pada
kanker ovarium rekuren. Namun hasil penelitian dengan imatinib, suatu inhibitor
PDGFR dan c-Kit, mengecewakan dengan aktivitas minimal sebagai agen
tunggal. Kebanyakan toksisitas berkaitan dengan dosis berupa diare, kelelahan,
dan lethargi. Oleh karena pemberiannya yang nyaman yaitu per oral, obat ini
akan memainkan peranan penting dalam terapi pemeliharaan kanker ovarium
lanjut.
2.10 Kerangka Teori
VEGF
Pembuluh Darah
Angiogenesis
Ketidakseimbangan anti dan proangiogenik
Progresivitas Metastase Prognosis
Permeabilitas Degradasi
Migrasi Anti apoptosis
Hipoksia Growth factors onco-genes dan
tumor suppressor genes
Hormon
Tumor ovarium
BAB III
KERANGKA KONSEP DAN HIPOTESIS
3.1 Kerangka Konsep
Karakteristik pasien
Variabel bebas
Variabel tergantung
Variabel-variabel penelitian meliputi :
− variabel bebas yaitu ekspresi VEGF (skala nominal)
− variabel tergantung yaitu tumor ovarium jinak (skala nominal), tumor
ovarium ganas (skala nominal)
3.2 Hipotesis
tumor ovarium
ekspresi VEGF
Tumor ovarium ganas Tumor ovariumjinak
usia
status menopause paritas
− Ho : Tidak terdapat perbedaan ekspresi VEGF antara tumor ovarium
ganas dan tumor ovarium jinak.
Ha : Terdapat perbedaan ekspresi VEGF antara tumor ovarium ganas dan
tumor ovarium jinak.
− Ho : Tidak terdapat hubungan antara ekspresi kuat VEGF dengan
kejadian tumor ovarium ganas
Ha : Terdapat hubungan antara ekspresi kuat VEGF dengan kejadian
BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian
Penelitian ini merupakan penelitian analitik dengan pendekatan case
control.
4.2 Tempat dan waktu Penelitian
Penelitian dilakukan di departemen Obstetri dan Ginekologi. Pemeriksaan
jaringan tumor ovarium dilakukan di departemen Patologi Anatomi RSUP
H. Adam Malik Medan. Penelitian dilakukan pada bulan Juli 2013.
4.3 Populasi Penelitian 4.3.1 Populasi Target
Subyek penelitian adalah pasien dengan tumor ovarium di RSUP H. Adam
Malik Medan.
4.3.2 Populasi Terjangkau
Pasien yang telah dioperasi dan jaringannya dilakukan pemeriksaan