PERBANDINGAN EKSPRESI B CELL LYMPHOMA-2
(Bcl-2) PADA TUMOR OVARIUM EPITELIAL TIPE
JINAK, BORDERLINE DAN GANAS
Dr. dr. I Wayan Megadhana, Sp.OG(K)
BAGIAN/SMF OBSTETRI DAN GINEKOLOGI
FK UNUD/RSUP SANGLAH DENPASAR
i ABSTRAK
PERBANDINGAN EKSPRESI B CELL LYMPHOMA-2 (Bcl-2) PADA TUMOR OVARIUM EPITELIAL TIPE JINAK, BORDERLINE DAN
GANAS
Tumor ovarium merupakan masalah ginekologi onkologi di seluruh dunia dan keganasannya merupakan penyebab kematian terbanyak pada semua keganasan ginekologi. Pembagian tumor ovarium epitelial tipe jinak, borderline dan ganas menyebabkan keragaman karakteristik tumor sehingga menimbulkan kesulitan dalam penatalaksanaannya. Berbagai penelitian telah dilakukan untuk menemukan suatu marker yang dapat digunakan untuk deteksi dini, prognosis dan pedoman dalam penatalaksanaannya sehingga diharapkan dapat menurunkan angka morbiditas dan mortalitas penderita. Beberapa peneliti melakukan pendekatan secara genetika untuk mengungkap etiopatogenesis terjadinya suatu tumor. Salah satu gen yang berperan dalam terjadinya suatu tumor adalah Bcl-2 yang merupakan protein yang mengekspresikan gen BCL2. Dengan demikian maka dalam penelitian ini dilakukan perbandingan ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak, borderline dan ganas.
Penelitian ini merupakan studi cross-sectionaldi Bagian Kebidanan dan Penyakit Kandungan, Patologi Anatomi dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah, Denpasar yang dilakukan mulai Maret 2012 sampai Desember 2013 dengan sampelpenelitian sebanyak 49 buah blok parafin. Sampel blok parafin ini dikelompokkan berdasarkan atas tipe tumor ovarium epitelial yaitu tipe jinak, borderline dan ganas. Masing-masing kelompok tipe tumor dilakukan pemeriksaan ekspresi Bcl-2 dengan teknik imunohistokimia,yang kemudian dilakukan perbandingan ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak, borderline dan ganas dengan menggunakan uji Chi-Square.
Penelitian ini memperoleh rerata umur, Indek Massa Tubuh (IMT) dan paritas pada ketiga kelompok tipe tumor ovarium epitelial adalah homogen. Ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak, borderline dan ganas berturut-turut adalah 0%, 7,69% dan 35%. Berdasarkan uji Chi-Squarediperoleh perbedaan ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak dengan ganas (p=0,009), tidak terdapat perbedaan ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak dengan borderline(p=0,448) dan tidak terdapat perbedaan ekspresi Bcl-2 pada tumor ovarium epitelial tipe borderline dengan ganas (p=0,082).
Kata kunci: ekspresi Bcl-2, tumor ovarium epitelial tipe jinak, borderline dan ganas.
ii ABSTRACT
THE COMPARATION OF B CELL LYMPHOMA-2 (Bcl-2) EXPRESSION IN BENIGN, BORDERLINE AND MALIGNANT TYPE OF OVARIAN
EPITHELIAL TUMOR
Ovarian tumor become one of the challenge in gynecology oncology and itsmalignancy accounts for more death than all other gynecologic malignancies combined. Classified as benign, borderline and malignant type of ovarian epithelial tumor cause a diversity of tumor characteristics itself and appears to create difficulty in treatment eventually. Numerous effort has done to find the tumor marker, early prognostic tools and guideline in treatment modalities that could decrease morbidity and mortality. Some of it through genetical approach in order to have a better understanding on tumor etiopathogenesis. One of the gene that plays role in tumor growth is Bcl-2, it is a protein that expressing BCL2 gene. This study aim to compare the Bcl-2 expression in benign, borderline and malignant type of ovarian epithelial tumor.
This was a crosssectional study at Obsteteric and Gynecology Department, Pathology Anatomy Department and Medical Record of Sanglah Hospital, held from March 2012 until December 2013 with 49 paraffin blocks as sample. The paraffin blocks sampel was classified based on histologic type of the ovarian epithelial tumor, as benign, borderline and malignant. Bcl-2 expression by immunohystochemistry technique examined in each of the tumor type. Comparation of Bcl-2 expression in the ovarian epithelial tumor type done with Chi-Square test.
The mean age, body mass index (BMI) and parity in these group was homogen. Bcl-2 expression in benign, borderline and malignant type of ovarian epithelial tumor was 0%, 7,69% and 35% respectivelly. There was a significant difference of Bcl-2 expression in benign and malignant type (p=0,009), there was no difference of Bcl-2 expression in benign and borderline type (p=0,448) nor in borderline and malignant type (p=0,082).
Key word : Bcl-2 expression, benign, borderline and malignant type of ovarian epithelial tumor.
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Neoplasma ovarium merupakan kelainan terbanyak dalam bidang ginekologi, sebagian besar merupakan lesi yang bersifat kistik, dengan gambaran patologi yang sangat beragam tergantung pada struktur sel asalnya. Kanker atau tumor
ganas ovarium termasuk dalam lima besar keganasan pada wanita,selain kanker
payudara, paru-paru, serviks, dan kolorektal. Kanker ovarium memiliki angka
kematian tertinggi diantara semua keganasan ginekologi.
Angka harapan hidup lima tahun untuk penderita kanker ovarium secara
keseluruhan masih sebesar 45% (Ayadidkk.,2010). Setiap tahunnya, di seluruh
dunia terdiagnosis 204.000 kasus baru, dan 125.000 wanita meninggal akibat
kanker ovarium (Schorgedkk., 2008). Kejadian kanker ovarium di Rumah Sakit
Umum Pusat (RSUP) Sanglah pada tahun 2005 sebesar 35% dari seluruh kanker
ginekologi, dengan angka harapan hidup selama lima tahunnya hanya 15%
(Karyana, 2004).Badan Registrasi Kanker menyatakan angka kejadian kanker
ovarium pada populasi adalah 5,99% (Badan Registrasi Kanker, 2006).
Kematian akibat kanker ovarium di Amerika Serikat terhitung terjadi pada
satu wanita dalam setiap 44 menit(Copeland, 2007). Prognosis yang rendah ini
sebagian diakibatkan oleh minimnya gejala kanker ovarium pada stadium awal
sehingga sebagian besar kanker ovarium baru terdiagnosis pada tahap lanjut.
melakukan deteksi dini kanker ovarium, akibat kurangnya pemahaman tentang
etiologi kanker ovarium. Angka kekambuhan yang tinggi juga dikaitkan dengan
resistensi terhadap terapi sitostatika. Pemahaman biologi tumor dalam
etiopatogenesis kanker ovarium yang masih belum dimengerti dengan jelas juga
berperan menjadi faktor penyebab.
Kanker ovariummerupakan tumor ganas yang secara histologis sangat
bervariasi dengan karakteristik klinis maupun
histopatologisnyamasing-masing.Tumor ovarium dapat berasal dari ketiga dermoblast yakni ektodermal,
mesodermal, dan endodermal. Berdasarkan struktur asalnya, tumor ovarium
dibagi menjadi 3 tipe, yaitu tipe epitelial yang merupakan 90-95% dari tumor
ganas ovarium,kemudian tumor ovarium tipe germinal(germ cell) serta tipe
mesenkim (sex cord-stromal) (Havrilesky, 2001; Schorgedkk.,2008). Berdasarkan
tipe histologisnya, neoplasma ovarium epitelial terdiri dari tipe serus, musinus,
endometrioid, clear cell, Brenner, dan tipe karsinoma undifferentiated (Berek,
2007; Stricker,2007). Berdasarkan luas proliferasi serta pola diferensiasi lapisan
epitelnya, tumor dibagi menjadi tumor jinak, tumor borderline atau Low
Malignant Potential (LMP), dan tumor ganas (Schorgedkk., 2008; Kumardkk., 2010).
Tumor ganas epitelial (karsinoma)tipe serus memiliki progresivitas tinggi
dengan metastase luas pada abdomen sehingga mempunyai angka survival yang
rendah. Sementara tumor musinusjarang melibatkan permukaan tumor dan jarang
terjadi bilateral namun cenderung memiliki massa tumor yang lebih besar.
dibandingkan tipe histologis lainnya, seperti pada tipe musinus, endometrioid dan
clear cell. Pada tipe non epitelial, tumor ganas germinal lebih sering ditemukan pada usia yang lebih muda dan terdiagnosis pada stadium yang lebih dini.
Prognosis yang lebih baik pada stadium lanjut juga membedakan tipe ini dari tipe
epitelial, yang disebabkan oleh sifat kemosensitifnya (Greene, 2002; Copeland,
2007).
Karsinogenesis merupakan proses bertahap pada tingkat genetik dan fenotip
sebagai hasil dari akumulasi mutasi yang terjadi berulangkali. Beberapa
perubahan diantaranya adalah: kemampuan self sufficiencyterhadap sinyal
pertumbuhan, insensitivitas terhadap sinyal inhibitor pertumbuhan, kemampuan
untuk menghindari mekanisme apoptosis, defek pada gen perbaikan
Deoxyribonucleic Acid(DNA), kemampuan yang tidak terbatas untuk bereplikasi, kemampuan angiogenesis yang berlangsung terus menerus,kemampuan invasi dan
metastasis, serta kemampuan untuk melepaskan diri dari sistem imunitas
(Hanahan, 2000; Kumardkk., 2010).
Progresivitas tumor ganas dikaitkan dengan kegagalan mekanisme normal
kematian sel yang difasilitasi oleh ekspresi protein-protein regulator apoptosis.
Keluarga protein Bcl-2 dikenal sebagai protein spesifik dalam regulasi apoptosis.
Peranan keluarga protein ini dalam proliferasi neoplasma adalah sebagai inhibitor
(Bcl-2,Bcl-xL,Bcl-w,mcl-1,Bcl-G)maupun pendukung apoptosis (Bax,Bcl-xS,Bak,
Bad, Bid,Bik,Bim) (Marx, 1998; Andersondkk.,2009).
Ekspresi Bcl-2 telah ditemukan pada beragam jaringan neoplastik, termasuk pada
Bcl-2 pada jaringan normal ditemukan secara signifikan lebih tinggi dibandingkan
dengan jaringan neoplasma, dengan nilai median dan range ekspresi Ribonucleic
Acid(RNA) yang berbeda-beda pada berbagai tipe. Kecenderungan pola ekspresi yang sama ditemukan pada kanker lambung, namun pola ekspresi yang berbeda
ditemukan pada kanker mama dan prostat. Perbedaan pola ekspresi Bcl-2 pada
berbagaijenis kanker ini menandakan kemungkinan peranan yang berbeda dalam
proses apoptosis, serta mengindikasikan mekanisme ekspresi yang spesifik untuk
masing-masing jaringan (Maronedkk.,1998; Wheeler, 2001).
Pada epitel normal dan tumor jinakdari ovarium, ekspresi Bcl-2 ditemukan
lebih tinggi dibandingkan dengan spesimen kanker ovarium (Torredkk., 2007;
Andersondkk.,2009). Hasil temuan yang kontradiktif didapatkan pada penelitian
lainnya. Tingkat ekspresi Bcl-2pada kanker ovarium secara signifikan lebih tinggi
dibandingkan dengan pada tumor jinak dan kontrol normal (Gang dkk.,2007;
Hogdaldkk, 2010).Penilaian terhadap sel yang mengalami overekspresi Bcl-2
menunjukkan bukti adanya ketidakstabilan genom, yang konsisten dengan
terganggunya proses apoptosis pada sel yang mengalami kerusakan. Ekspresi
Bcl-2 sebagai protein anti apoptosis mungkin berperan dalam progresivitas tumor
dengan mengurangi sitotoksisitas yang terjadi dalam sel, dan menghambat
kematian sel yang mengalami kerusakan oksidatif, dengan hasil akhir sel
mengalami kerusakan tetapi tidak mengalami kematian (Cox dan Hampton, 2007).
Ekspresi protein Bcl-2 memiliki peranan penting sebagai regulator dalam
proses kematian sel dalam konteks fisiologis maupun patologis.Protein Bcl-2
jaringan. Identifikasi perbedaan ekspresi protein Bcl-2sebagai anti apoptosis pada
berbagai tipe tumor ovarium menjadi tujuan penelitianini untuk pendekatan yang
lebih optimal dalam diagnosis serta penanganan kanker ovarium.
1.2. Rumusan Masalah
1. Apakah ada ekspresi Bcl-2 pada tumor ovariumepitelialtipe jinak?
2. Apakah ada ekspresi Bcl-2 pada tumor ovarium epitelial tipe borderline ?
3. Apakah ada ekspresiBcl-2 pada tumor ovarium epitelial tipe ganas ?
4. Apakah ada perbedaan ekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak,
borderline dan ganas ? 1.3 Tujuan Penelitian
1.3.1 Tujuan umum
Untuk mengetahui ekspresidan peran Bcl-2 dalampatogenesis tumorovarium.
1.3.2 Tujuan khusus
1. Untuk mengetahuiekspresi Bcl-2 pada tumor ovarium epitelial tipe jinak.
2. Untuk mengetahui ekspresi Bcl-2 pada tumor ovarium epitelial tipe
borderline.
3. Untuk mengetahui ekspresi Bcl-2 pada tumor ovarium epitelial tipe ganas.
4. Untuk mengetahui perbedaan ekspresi Bcl-2 pada tumor ovariumepitelial
tipe jinak, borderline dan ganas.
1.4.1 Manfaat bagi Ilmu Pengetahuan
Untuk meningkatkan pemahaman tentang peranekspresi Bcl-2dalam
perkembangan tumor ovarium epitelial tipe jinak, borderline, dan ganas.
1.4.2 Manfaat bagi Pelayanan
Hasil penelitian ini diharapkan dapat dipergunakan untuk mengembangkan upaya
pemahaman tentang etiopatogenesis, pendekatan diagnosis, targetterapi, serta
7 BAB II
KAJIAN PUSTAKA
2.1Tumor Ovarium
2.1.1 Epidemiologi
Neoplasma ovarium merupakan kelainan terbanyak dalam bidang ginekologi, sebagian besar merupakan lesi yang bersifat kistik, dengan insidennya pada populasi berkisar antara 5-15%. Kasus neoplasma jinak merupakan kasus yang terbanyak, mencapai sepertiga kasus ginekologi setiap tahunnya. Tumor ovarium biasanya berkembang tanpa gejala dan baru ditemukan saat pemeriksaan ginekologi rutin atau dari pemeriksaan ultrasonografi oleh karena indikasi lain
(Schorge dkk., 2008). Berdasarkan struktur asalnya, tumor ovarium dibagi
menjadi 3 tipe, yaitu tipe epitelial yang merupakan 90-95% dari tumor ganas
ovarium,kemudian tumor ovarium tipe germinal(germ cell) serta tipe mesenkim
(sex cord-stromal). Berdasarkan luas proliferasi serta pola diferensiasi lapisan
epitelnya, tumor dibagi menjadi tumor jinak, tumor borderline atau Low
Malignant Potential (LMP), dan tumor ganas (Havrilesky, 2001;
Schorgedkk.,2008).
Tumor ganas atau kanker ovarium merupakan keganasan terbanyakkelima dari semua keganasan pada wanita, selain keganasan pada paru-paru, pankreas, payudara, dan kolorektal. Setiap tahunnya, di seluruh dunia terdiagnosis 204.000
kasus baru dan 125.000 wanita meninggal akibat kanker ovarium (Schorge dkk.,
keganasan pada wanita, dan yang tertinggi dari semua kaganasan ginekologi(Coleman, 2007; Nagell, 2008). Kematian akibat kanker ovarium di
Amerika Serikat terhitung terjadi pada satu wanita dalam setiap 44 menit, dengan
probabilitaspenderita kanker ovarium satu diantara 68 wanita. Minimnya
pemahaman tentangetiologi kanker ovarium berperan dalam menyebabkan angka
kematian yang tidak berkurang secara signifikan dalam beberapa dekade terakhir
(Copeland, 2007). Angka harapan hidup untuk lima tahun secara keseluruhan
masih sebesar 45% (Landen dkk.,2008; Ayadi dkk.,2010).
Insiden tumor ganas ovarium yang tertinggi adalah di Swedia dan Amerika
Serikat dengan insiden masing-masing 19,6/100.000 dan 15,4/100.000. Insiden
terendah adalah di Jepang dengan angka insiden 10,1/100.000 (Nagell, 2008;
Coleman, 2007). Kejadian kanker ovarium di Rumah Sakit Umum Pusat (RSUP)
Sanglah pada tahun 2005 sebesar 35% dari seluruh kanker ginekologi, dengan
angka harapan hidup selama lima tahunnya sebesar 15% (Karyana, 2005). Badan
Registrasi Kanker menyatakan angka kejadian kanker ovarium pada populasi
adalah 5,99% (Badan Registrasi Kanker, 2006). Insiden kanker ovarium di
Amerika Serikat tertinggi pada wanita ras Kaukasia, diikuti Afrika Amerika, dan
terendah pada ras asli Amerika. Faktor-faktor yang dihubungkan dengan
peningkatan risiko kanker ovarium adalah usia, nulipara, dan adanya riwayat
kanker dalam keluarga (Coleman,2007; Nagell, 2008).
Kanker ovarium jarang terjadi sebelum usia 40 tahun, insidennya meningkat lebih
dari dua kali lipat setelah usia 60 tahun, dengan puncaknya pada usia 65 sampai
faktor terpenting dalam menentukan potensi keganasan (Disaia,2007). Wanita
dengan usia diatas 65 tahun cenderung terdiagnosis pada stadium yang lebih
lanjut, dengan angka harapan hidup yang jauh lebih rendah. Distribusi tipe
histologis kanker ovarium berdasarkan usia juga didapatkan sangat berbeda.
Kanker ovarium tipe germinal lebih sering ditemukan pada usia dibawah 20
tahun, sedangkan tipe epitelial sebagian besar ditemukan pada usia diatas 50
tahun(Copeland,2007).
Tabel 2.1 Distribusi Tumor Ovarium Primer berdasarkan Umur (tahun)
Tipe < 20 20-50 >50
Coelomic epithelium 29% 71% 81%
Germ cell 59% 14% 6%
Specialized gonadal stroma 8% 5% 4%
Non-spesific mesenchyme 4% 10% 9%
(Copeland,2007)
Paritas adalah faktor non genetik yang juga dianggap sebagai faktor risiko kanker
ovarium. Risiko kanker ovarium menurun secara progresif seiring peningkatan
jumlah kehamilan (Coleman,2007; Nagell, 2008).Wanita nulipara mempunyai
risiko dua kali lipat lebih besar untuk terjadinya kanker ovarium dibandingkan
wanita dengan paritas tiga atau lebih (Larma dkk.,2007; Granstrom, 2008). Dua
puluh lima sampai 30% karsinoma serus terjadi pada nulipara (Wheeler, 2001).
Besarnya risiko seorang wanita menderita kanker ovarium sepanjang
hidupnya, dengan riwayat first relative (ibu,saudari,atau anak perempuan)
menderita kanker ovarium adalah 1,5-5%. Kejadian kanker ovarium
ovarium berkembang secara sporadis. Kanker ovarium familial menurunkan
mutasi genetik yang menjadi predisposisi untuk perkembangan kanker ovarium
(Coleman,2007; Nagell, 2008). Kanker ovarium familial dikategorikan menjadi
kanker ovarium yang site-specific, sindrom breast-ovarian cancer, dan sindrom
Lynch tipe II, dengan anggota keluarga yang memiliki riwayat kanker kolorektal,
endometrium dan ovarium (Copeland,2007).
Beberapa penelitian membuktikan bahwa peningkatan IMT dapat
meningkatkan risiko terjadinya kanker ovarium (Reeves, 2007). Penelitian ini
memperoleh hasil bahwa risiko relatif terjadinya kanker ovarium memiliki
kecenderungan meningkat sesuai dengan peningkatan IMT. Pada IMT kurang dari
18,5 kg/m2 memiliki risiko sebesar 1,09, IMT antara 18,5 sampai 24,9 kg/m2
memiliki risiko sebesar 1,00, IMT antara 25,0 sampai 29,9 kg/m2 memilki risiko
sebesar 1,43, dan IMT lebih dari 30,0 kg/m2 memiliki risiko sebesar 1,56 untuk
menderita kanker ovarium. Penelitian yang dilakukan oleh European Prospective
Investigation into Cancer and Nutrition (2006) mendapatkan wanita dengan IMT di atas 30 atau obesitas memiliki risiko relatif sebesar 1,59 untuk terjadinya
kanker ovarium dibandingan dengan wanita dengan IMT normal. Penelitian yang
berbeda memperoleh hasil bahwa peningkatan IMT pada wanita premenopause
meningkatkan risiko terjadinya kanker ovarium dengan risiko relatif sebesar 1,72
(Schouten, 2008). Leitzmann (2009) juga memperoleh hasil bahwa risiko
terjadinya kanker ovarium pada wanita obesitas dengan IMT lebih dari 30 kg/m2
adalah sebesar 1,26. Faizal (2011) di Rumah Sakit Wahidin Sudirohusodo,
risiko 2,036 kali lebih besar dibandingkan dengan wanita yang memiliki IMT
yang kurang dari 30 kg/m2.
2.1.2 Histopatologi
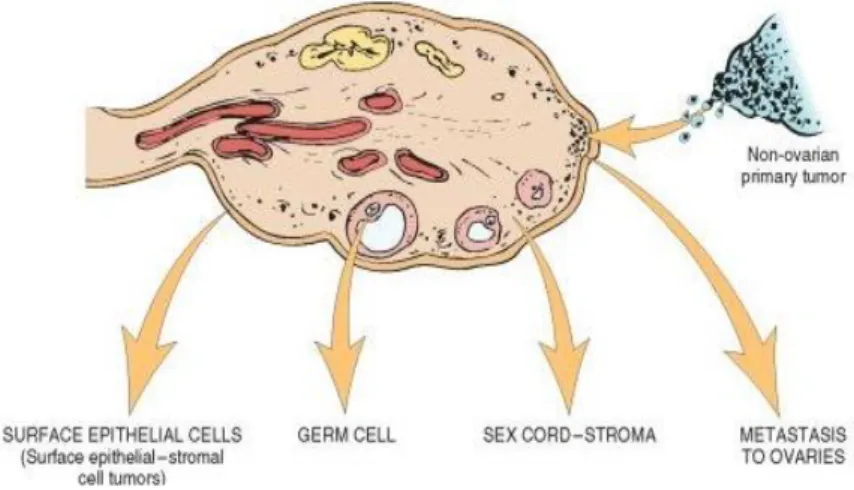
Tumor ovarium merupakan tumor dengan patologi yang sangat beragam. Hal ini didasari oleh tiga jenis tipe sel yang membentuk struktur ovarium normal. Epitel coelomicatau mesotelium yang bersifat multipotensial yang membentuk lapisan epitel ovarium, sel-sel germinal yang bersifat pluripotensial, serta sel-sel stroma ovarium, termasuk didalamnya sex cord yang juga bersifat multipotensial (Kumar dkk., 2010).
Gambar 2.1 Pembagian tumor ovarium berdasarkan sel asalnya(Kumar
dkk.,2010)
Perkembangan awal ovarium dapat dibagi menjadi empat tahap utama. Pada tahap pertama, sel-sel germinal yang belum terdiferensiasi (primordial germ cells) terpisah dan bermigrasi dari tempat asalnya menuju genital ridges, suatu lokasi dimana terjadi penebalan secara bilateral lapisan epitel coelomic. Tahap yang kedua dimulai setelah sel-sel germinal sampai di genital ridges, dimana terjadi proliferasi dari epitel coelomic serta struktur mesenkim dibawahnya. Tahap
ketiga, ovarium terbagi menjadi korteks di bagian perifer dan medula di bagian tengah. Tahap keempat ditandai dengan perkembangan dari korteks dan involusi medula. Klasifikasi histologis neoplasma ovarium dibagi berdasarkan perkembangan dari sel-sel epitel coelomic, sel-sel germinal,serta mesenkim (Copeland, 2007).
Neoplasma ovarium yang berasal dari jaringan epitel atau mesothelium coelomic
merupakan 65-70% dari semua tumor ovarium, dan 90-95 % dari semua tumor
ganas ovarium (Havrilesky, 2001; Schorge dkk.,2008; Kumar dkk., 2010). Tumor
ovarium lebih sering terjadi pada wanita dengan usia diatas 40 tahun, dengan
bentuk ganas lebih sering ditemukan pada usia yang lebih lanjut. Berdasarkan tipe
histologisnya, neoplasma ganas epitelial (karsinoma) ovarium terdiri dari 75%
tipe serus, 20% tipe musinus, 2% endometrioid, dan kurang dari 1% merupakan
tipe clear cell, Brenner, dan jenis karsinoma undifferentiated (Kaku dkk., 2003;
Berek, 2007; Stricker,2007). Sriwidyani (2008) menemukan proporsi karsinoma
ovarium berdasarkan tipe histologisnya adalah tipe serus (40,6%), tipe clear cell
(31,3%), musinus (21,9%), dan endometrioid (6,3%).
Setiap tipe tumor menunjukkan pola histologis tersendiri yang merepresentasikan
gambaran mukosa alat reproduksi wanita. Tumor ovarium tipe serus memiliki
kemiripan histologis dengan epitel kelenjar dan tuba falopi. Tumor tipe musinus
mengandung sel yang sama dengan sel-sel kelenjar endoserviks, dan tumor tipe
endometrioid yang memiliki kemiripan dengan endometrium (Berek,2007).
Tabel 2.2 Klasifikasi Histologis Tumor Ovarium Epitelial-Stromal (WHO)
Klasifikasi Histologis Tumor Ovarium Epitelial-Stromal 1. Serous tumors
Benign (cystadenoma)
Borderline tumors (serous borderline tumor) Malignant (serous adenocarcinoma)
2. Mucinous tumors, endocervival-like and intestinal type Benign (cystadenoma)
Borderline tumors (mucinous borderline tumor) Malignant (mucinous adenocarcinoma)
3. Endometrioid tumors
Benign (cystadenoma)
Borderline tumor (endometrioid borderline tumor) Malignant (endometrioid adenocarcinoma)
4. Clear-cell tumors Benign
Borderline tumors
Malignant (clear cell adenocarcinoma) 5. Transitional cell tumors
Brenner tumor
Brenner tumor of borderline malignancy Malignant Brenner tumor
Transitional cell carcinoma (non-Brenner type) 6. Epithelial-stromal Adenosarcoma Malignant mixed müllerian tumor
(Kumar dkk.,2010)
Klasifikasi tumor ovarium epitelial dibuat berdasarkan pola diferensiasi dan
luas proliferasi lapisan epitel. Luas proliferasi epitel berhubungan dengan
perangai biologis tumor. Berdasarkan proliferasinya, tumor dibagi menjadi: (1)
Tumor jinak dengan proliferasi epitel minimal, (2) Tumor borderline atau Low
Malignant Potential (LMP) dengan proliferasi sedang, dan (3) Tumor ganas atau karsinoma dengan proliferasi nyata dan terjadinya invasi stroma (Kaku dkk.,
2003; Schorge dkk., 2008; Kumar dkk., 2010). Kelompok tumor
karakteristik biologi dan histopatologi yang berada diantara tumor jinak dan tumor
ganas (Copeland, 2007).
Tumor jinak memiliki proporsi 80%, dan muncul sebagian besar pada wanita
muda dengan rentang usia 20 sampai 45 tahun. Tumor borderline muncul pada
usia yang lebih tua, namun 15 tahun lebih muda dibandingkan dengan karsinoma
ovarium invasif. Tumor ganas lebih sering terjadi pada wanita berusia diantara 45
sampai 65 tahun (Schorge dkk., 2008; Kumar dkk., 2010).
Secara histologis, tumor borderline dapat dibedakan dari tumor jinak dengan
ditemukannya beberapa gambaran berikut, yakni: atipia inti, hiperplasi epitel
dalam bentuk psudostratifikasi epitel, terbentuknya gambaran micropapillary,
pleomorfisme seluler, dan peningkatan aktivitas mitosis. Tumor borderline
dibedakan dari karsinoma invasif dengan tidak ditemukannya gambaran invasi
stroma yang destruktif (Berek, 2007; Schorge dkk., 2008). Janovski dan
Paramananthon menyatakan minimal ditemukannya dua dari beberapa gambaran
diatas untuk klasifikasi tumor borderline (Copeland, 2007).
Proporsi tumor borderline dalam tumor ovarium epitelial adalah sekitar
10-15%. Prognosis pasien dengan tumor borderline sangat baik, dengan angka
kelangsungan hidup 5 tahun pada stadium IV sebesar 77%. Terdapat risiko
rekurensi sebesar 15% dalam 20 tahun setelah terapi akibat sifat dasar tumor
borderline yang memiliki kecepatan pertumbuhan lebih lambat (Berek, 2007; Schorge dkk., 2008). Penelitian ini akan meneliti tumor ovarium yang termasuk
dalam kelompok tumor epitelial tipe jinak, borderline dan ganas.
Merupakan neoplasma kistik yang dilapisi sel-sel epitel kolumnar tinggi, bersilia
maupun tanpa silia, dengan cairan serus jernih di dalamnya. Tumor serus
merupakan 30% dari tumor ovarium, dan lebih dari 50% dari semua tumor
epitelial. Karsinoma serus merupakan tumor ganas tipe epitelial yang terbanyak,
40% dari semua kanker ovarium (Berek, 2007; Kumar dkk., 2010).
Karakteristik tumor serus merupakan lesi kistik dengan papil yang terkandung
dalam dinding fibrus kista bagian dalam atau pada permukaan ovarium. Tumor
jinak ditandai dengan kista berdinding tipis,licin dan mengkilat, tanpa penebalan
epitel atau dengan penonjolan papil-papil kecil. Kista ini memiliki potensi
pertumbuhan papiler ke dalam rongga kista sebesar 50% dan pada permukaan luar
kista sebesar 5%. Penonjolan papil ini akan meningkat jumlahnya pada tumor
borderline. Tumor umumnya bilateral, terjadi pada 20% serous cystadenoma, pada 30% tumor serous borderline, dan pada 60% karsinoma serus (Sutoto,
2007;Berek, 2007; Kumar dkk., 2010).Tumor serus adenofibroma sebagian besar
merupakan tumor solid yang terdiri dari jaringan ikat fibrus (Kaku dkk., 2003).
Secara histologis, tumor serus jinak berupa struktur kista dengan lapisan epitel
kolumnar dengan banyak silia, dan dapat ditemukannya papil mikroskopis.
Tumor serus borderline menunjukkan peningkatan kompleksitas proliferasi dari
stroma papil, stratifikasi epitel, dengan atipia inti ringan, tanpa adanya infiltrasi
destruktif pada stroma. Kecurigaan keganasan ditandai dengan massa tumor solid
dengan papil-papil dalam jumlah banyak, ireguler, serta fiksasi dan nodul pada
kapsul. Karakteristik tumor ganas ditandai dengan pola pertumbuhan yang lebih
atipik, dan multinukleasi. Struktur kalsifikasi konsentris (psammoma bodies) yang
juga disebut fokus material asing, berupa pengendapan kalsium dalam stroma
jaringan papiler, merupakan ciri khas tumor serus dan ditemukan pada 80%
karsinoma serus, namun tidak spesifik untuk neoplasia (Berek, 2007; Kumar dkk.,
2010).
Perangai biologis tergantung dari derajat diferensiasi, distribusi, dan
karakteristik pertumbuhannya pada peritoneum. Tumor serus borderline dapat
membentuk implantasi invasif dan non invasif.Implantasi non invasif muncul dari
atau meluas ke peritoneum dalam bentuk proliferasi papil dari sel-sel atipik yang
membentuk invaginasi, terlokalisir, tanpa gejala, penyebaran yang lambat, dan
setelah beberapa tahun dapat menyebabkan obstruksi intestinal atau komplikasi
lainnya. Jenis implantasi invasif tumor serus borderlinememiliki ciri-ciri sel
atipik yang membentuk kelenjar yang ireguler dengan batas yang tegas, dianggap
sebagai lesi prekursor karsinoma serus derajat rendah, yang secara klinis memiliki
ciri progresivitas yang lambat dengansurvival yang lebih lama. Berbeda dengan
jenis karsinoma serus derajat tinggi yang memiliki progresivitas tinggi dengan
metastase luas pada abdomen pada saat terdiagnosis. Angka kelangsungan hidup
lima tahun pada tumor borderline dan ganas dengan massa terbatas pada ovarium
masing-masing adalah 100% dan 70%, dan angka ini berkurang menjadi 90% dan
25% jika ditemukanimplantasi pada peritoneum. Tumor borderline dapat rekuren
setelah beberapa tahun karena sifat pertumbuhannya yang lambat dan berlangsung
Faktor risiko yang hingga kini masih terus didalami pada karsinoma adalah
faktor genetik. Mutasi gen BRCA1 dan BRCA2 dikatakan meningkatkan risiko
kanker ovarium. Mutasi BRCA1 ditemukan pada 5% pasien kanker ovarium yang
berusia dibawah 70 tahun. Perkiraan risiko wanita dengan mutasi gen BRCA1 dan
BRCA2 pada usia 70 tahun adalah 20 sampai 60% (Kumar dkk., 2010).
2.1.2.2 Tumor musinus
Merupakan 30% dari semua tumor ovarium, muncul pada wanita usia
pertengahan, jarang terjadi sebelum pubertas dan setelah menopause. Tumor jinak
dan borderline merupakan 80% kasus, dan 15% kasus adalah tumor ganas.
Karsinoma musinus primer relatif jarang ditemukan, kurang dari 5% dari semua
kanker ovarium.
Karakteristik morfologi dan biologi tumor musinus berbeda dengan tipe
serus, dimana tumor musinus jarang melibatkan permukaan tumor dan jarang
terjadi bilateral. Tumor dengan lesi intraovarium terjadi pada 95-98% kasus.
Tumor bilateral hanya terjadi pada 8-10% kasus. Tumor musinus lebih cenderung
memiliki massa tumor yang lebih besar dibandingkan tumor serus. Tampak
sebagai tumor multilokuler yang dilapisi oleh epitel dengan kandungan musin
intrasitoplasma, yang memiliki kemiripan dengan epitel endoserviks, atau
intestinal.Karsinoma musinus, begitu pula karsinoma endometrioid dan clear cell,
lebih cenderung ditemukan pada stadium yang lebih awal (Berek, 2007;
Copeland, 2007; Kumar dkk., 2010).
Secara histologis, tumor musinus jinak ditandai dengan lapisan sel epitel
Cystadenocarcinoma musinus mengandung mayoritas pertumbuhan tumor yang solid, area nekrosis dan hilangnya struktur kelenjar (Kaku dkk., 2003; Kumar
dkk.,2010).
Peudomyxoma peritonei didefinisikan sebagai temuan klinis berupa ascites musinus yang luas, implantasi epitel kista pada permukaan peritoneum, dan
disertai perlekatan, sehingga dapat menyebabkan obstruksi usus dan kematian.
Hal ini akibat potensi sel epitel untuk tumbuh membentuk struktur kelenjar,
kelenjar membentuk kista-kista baru, yang akan membentuk kista multilokuler.
Dikaitkan dengan tumor musinus primer ekstraovarium, umumnya karsinoma
appendiceal, dengan pertumbuhan sekunder pada ovarium dengan penyebaran pada peritoneum. Angka kelangsungan hidup 10 tahun pada karsinoma stadium I
non invasif dan invasif masing-masing adalah lebih dari 95% dan 90% (Wheeler,
2001; Sutoto, 2007; Kumar dkk., 2010).
Analisa perubahan genetik belum memberikan data yang memadai untuk
menjelaskan patogenesis tumor musinus seperti halnya pada tumor serus. Salah
satu temuan yang konsisten adalah mutasi protoonkogen KRAS. Mutasinya terjadi
pada 58% cystadenoma, 75-86% tumor borderline, dan 85% pada karsinoma
musinus primer (Kumar dkk., 2010).
2.1.2.3 Tumor endometrioid
Tumor endometrioid memiliki karakteristik adanya elemen epitel, elemen
stroma, atau kombinasi keduanya serupa dengan yang ada pada endometrium
(Kaku dkk., 2003). Karsinoma endometrioid merupakan 20% dari semua kanker
ini terjadi bilateral pada 40% kasus, dan berhubungan dengan ekstensi neoplasma
di luar saluran genital. Pada stadium I angka kelangsungan hidup untuk 5
tahunnya adalah 75% (Berek, 2007; Kumar dkk., 2010).
Tumor jenis ini dibedakan dari tumor serus dan musinus melalui adanya struktur
kelenjar tubuler yang memiliki kemiripan dengan endometrium. Tumor
endometrioid borderline dikaitkan dengan endometriosis, dan 15-30% karsinoma
endometrioid disertai dengan karsinoma endometrium. Kasus karsinoma
endometrioid yang berhubungan dengan endometriosis ditemukan terjadi pada
usia yang lebih muda 10 tahun dibandingkan dengan kasus yang tidak
berhubungan dengan endometriosis.
Tumor endometrioid borderline memiliki spektrum morfologi yang luas.
Tumor dapat memiliki kemiripan dengan polip endometrium atau kompleks
hiperplasia endometrial dengan kelenjar, atau memiliki komponen fibroma yang
jelas. Karsinoma endometrioid muncul dalam kombinasi tumor kistik dan solid,
berisi cairan berwarna coklat gelap, dengan karakteristik pola adenomatous serta
dalam bentuk berbagai potensi variasi epitel pada uterus (Kaku dkk.,2003; Berek,
2007; Kumar dkk., 2010). Tumor endometrioid berdiferensiasi buruk sulit
dibedakan dengan tumor serus, dan seringkali tumor jenis ini dikategorikan ke
dalam tumor serus. Hal ini menyebabkan tumor endometrioid secara keseluruhan
memiliki prognosis yang baik (Schorge dkk., 2008).
Meskipun kejadiannya lebih jarang dibandingkan dengan tumor serus dan
musinus, namun perubahan molekuler yang teridentifikasi dalam
sering ditemukan adalah mutasi pada tumor supressor gene PTEN dan onkogen
KRAS dan β-catenin, serta adanya microsatellite instability (Wheeler,
2001;Kumar dkk., 2010).
2.1.2.4 Tumor clear-cell
Karakteristik tumor ini adalah lapisan sel epitel dengan ukuran besar, dengan
sitoplasma jernih yang luas, yang memiliki kemiripan dengan endometrium
gestational yang mengalami hipersekresi. Diduga berasal dari perkembangan
duktus mülleri serta variasi dari karsinoma endometrioid. Dapat bersifat solid atau
kistik (Kumar dkk, 2010).
Secara histologis, dapat ditemukan beberapa pola pada adenokarsinoma clear
cell, dapat berupa tubulokistik, papil, recticular, dan solid. Tumor terdiri dari clear cell dan sel-sel hobnail dengan inti sel bulbous yang menonjol pada tepi sitoplasma. Sel berukuran tinggi dengan vakuola sitoplasma yang jernih akibat
disolusi glikogen, inti hiperkromatik yang ireguler, serta nukleoli dalam berbagai
ukuran (Berek, 2007; Schorge dkk., 2008).
Angka kelangsungan hidup 5 tahun untuk tumor ini adalah 65% jika tumor
masih dalam struktur ovarium, namun tumor ini cenderung bersifat agresif dengan
perluasan di luar ovarium (Kumar dkk., 2010). Rekurensinya terjadi melalui
penyebaran pada permukaan peritoneum, dengan metastase pada kelenjar limfe,
hepar, paru dan tulang yang lebih sering terjadi dibandingkan dengan karsinoma
tipe serus (Wheeler, 2001).
Perubahan molekuler yang mendasari patogenesisnya masih sedikit yang
diploid maupun aneuploid, dimana pola variasi seperti ini sangat jarang
ditemukan pada karsinoma ovarium lainnya (Kumar dkk., 2010).
2.1.2.5 Tumor brenner/sel transisional
Tumorbrenner diklasifikasikan sebagai adenofibroma, terdiri dari matriks
fibromatus hiperplastik yang mengandung sarang-sarang sel epiteloid menyerupai
sel transisional pada saluran kemih. Sebagian besar (99%) tumor brenner
ditemukan dalam bentuk jinak dan unilateral (90%), dengan ukuran yang
bervariasi (Kumar dkk., 2010). Tumor brenner ganas merupakan area residu
proliferasi tumor jinak disertai komponen karsinoma epitelial infiltratif yang
ganas dengan gambaran histologis berupa sel transisional, sel skuamus, atau
undifferentiated (Berek, 2007).
Karsinoma sel transisional secara histologis ditandai dengan tidak
ditemukannya komponen tumor brenner, memiliki kemiripan dengan karsinoma
primer kandung kemih, namun dengan pola imunoreaktivitas yang konsisten
dengan ovarium. Karsinoma sel transisional memiliki perangai biologis yang
berbeda dengan tumor Brenner ganas. Karsinoma sel transisional lebih sering
terdiagnosis pada stadium yang lebih lanjut sehingga memiliki prognosis yang
lebih buruk. Karsinoma ovarium yang lebih dari 50% bagiannya merupakan
karsinoma sel transisional, ternyata menunjukkan sensitivitas yang lebih baik
terhadap kemoterapi sehingga memiliki prognosis yang baik jika dibandingkan
dengan jenis karsinoma ovarium poorly differentiated lainnya pada stadium yang
2.1.3 Patogenesis
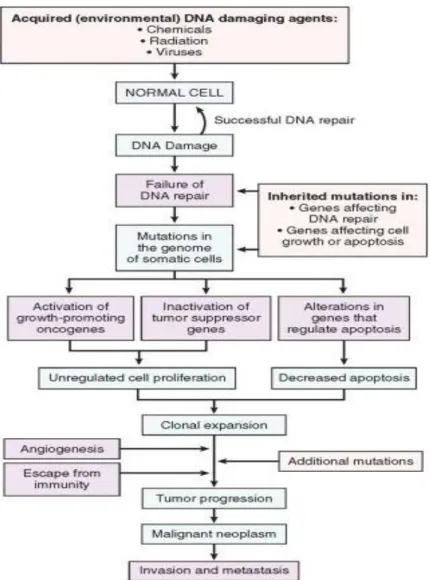
Karsinogenesis merupakan proses bertahap pada tingkat genetik dan fenotip
sebagai hasil dari akumulasi mutasi yang terjadi berulangkali. Kerusakan genetik
merupakan mekanisme dasar dari proses karsinogenesis. Kerusakan ini dapat
diakibatkan oleh faktor lingkungan, seperti bahan kimiawi, radiasi, virus, atau
hasil pewarisan pada sifat germ line. Namun tidak semua mutasi diakibatkan oleh
faktor lingkungan karena beberapa dapat terjadi secara spontan. Target utama dari
kerusakan genetik ini adalah empat kelompok gen utama, yaitu protoonkogen
yang berfungsi meningkatkan pertumbuhan dan proliferasi sel normal, yang
kemudian hasil mutasinya disebut onkogen (HER2Neu,RAS,MYC,CDK1)
kemudian gen lainnya adalah tumor supressor gene yang berfungsi menghambat
proliferasi sel, gen yang mengatur mekanisme apoptosis, serta gen yang terlibat
dalam perbaikan DNA (Stricker, 2007).
Perubahan fundamental yang terjadi dalam karsinogenesis antara lain adalah
kemampuan self sufficiencyterhadap sinyal pertumbuhan yaitu kemampuan sel
tumor untuk berproliferasi tanpa membutuhkan sinyal pertumbuhan ataupun
rangsangan dari luar, hal ini merupakan akibat dari aktivasi onkogen. Perubahan
sifat lainnya adalah insensitivitas terhadap sinyal inhibitor pertumbuhan,
kemampuan untuk menghindari mekanisme apoptosis sebagai akibat inaktivasi
p53 maupun aktivasi gen antiapoptosis. Sel tumor juga memiliki kemampuan
yang tidak terbatas untuk bereplikasi, kemampuan angiogenesis yang berlangsung
terus menerus untuk memenuhi kebutuhan nutrisi dan oksigen, kemampuan invasi
yang juga memiliki peran penting dalam perkembangan tumor adalah
kemampuan untuk melepaskan diri dari mekanisme sistem kekebalan tubuh atau
imunitas (Hanahan, 2000; Tripathy, 2003; Stricker, 2007).
Gambar 2.2 Dasar Molekuler Karsinogenesis(Kumar dkk.,2010)
Keseimbangan antara mekanisme proliferasi sel dengan apoptosis atau
Programmed Cell Death (PCD) akan menjaga keberlangsungan jaringan normal. Mekanisme apoptosis merupakan proses aktif yang melibatkan energi yang
diawali oleh ekspresi gen-gen spesifik. Pertumbuhan tumor secara progresif
patogenesisnya sel kanker tidak hanya gagal bereaksi terhadap sinyal untuk
menghentikan proliferasinya, namun juga gagal dalam menerima sinyal fisiologis
untuk memulai mekanisme apoptosis. Apoptosis dipicu oleh banyak faktor antara
lain sinyal intraseluler dan rangsangan eksogen seperti paparan radiasi,
kemoterapi serta hormonal. Proses ini ditandai dengan perubahan-perubahan
secara histologis, biokimiawi dan biologi molekuler (Lowe, 2000;Berek,2007).
Karsinogenesis pada kanker ovarium, terutama kanker ovarium epitelial atau
karsinoma ovarium masih belum dapat diungkap secara jelas. Suatu model yang
diajukan Schorge dkk. (2008) membagi tumorigenesis kanker ovarium epitelial
menjadi tiga jalur utama. Jalur yang pertama merupakan hasil dari akumulasi
penyimpangan genetik yang menyebabkan perubahan keganasan dari kista jinak
menjadi tumor borderline atau Low Malignant Potential (LMP) dan kemudian
menjadi karsinoma ovarium yang invasif. Jenis tumor invasif yang termasuk
dalam jalur ini memiliki sifat pertumbuhan yang lambat dengan derajat
diferensiasi yang baik.
Jalur yang kedua merupakan hasil dari sifat-sifat yang diturunkan, dengan
frekuensi 5-10% dari kanker tipe epitelial. Kanker familial dengan mutasi gen
BRCA muncul pada usia 15 tahun lebih awal dari jenis kanker yang bersifat
sporadis. Mutasi gen BRCA menyebabkan terhentinya fungsi normal dari tumor
supressor gene BRCA. Penghentian fungsi normal ini berlangsung dalam mekanisme yang lebih cepat. Kanker ovarium dan peritoneum dengan mutasi
BRCA memiliki patogenesis molekuler yang khas, dimana dalam
supressor gene yang telah dipetakan pada kromosom 17. Produk proteinnya mencegah sel memasuki fase pembelahan selanjutnya dari siklus sel, sehingga
mencegah replikasi sel tumor yang tidak terkontrol. Mutasi dari gen p53 ini
dikaitkan dengan berbagai jenis kanker. Hilangnya fungsi normal gen BRCA dan
p53 ditemukan pada tahap dini sebelum terjadinya invasi, sehingga hal ini
menunjukkan peran penting gen ini dalam proses awal keganasan.
Jalur yang ketiga, merupakan mekanisme yang terjadi pada sebagian besar
karsinoma, berawal dari perubahan sel epitel permukaan ovarium pada kista
inklusi yang masuk ke dalam struktur stroma ovarium. Siklus perubahan
permukaan ovarium selama proses ovulasi dalam periode yang panjang dan
berulang-ulang menyebabkan terjadinya proliferasi sel yang berlebihan. Mutasi
p53 secara spontan yang muncul selama sintesis DNA yang menyertai proliferasi
berperan penting dalam jalur ini. Terdapat pula kemungkinan terjadinya inaktivasi
dini beberapa jenis gen lainnya.
Shih dan Kurman (2007) membagi model tumorigenesis karsinoma ovarium
berdasarkan profil morfologis dan genetiknya menjadi dua tipe tumorigenesis.
Tipe I merupakan perkembangan tumor yang berasal dari tumor borderline
dengan lesi perkursor yang telah diketahui. Tumorigenesis tipe I terjadi pada
karsinoma serus berdiferensiasi baik, karsinoma musinus, kersinoma
endometrioid, tumor brenner ganas, dan karsinoma clear cell. Tipe ini
berhubungan dengan mutasi BRAF dan KRAS pada tipe serus, mutasi KRAS
pada tipe musinus, mutasi b-catenin dan PTEN serta microsatellite instability
berdiferensiasi buruk, karsinosarkoma, dan karsinoma undifferentiated.
Cenderung terjadi pada tumor berdiferensiasi buruk, dengan lesi prekursor yang
belum teridentifikasi, sehingga dikenal dengan perkembangan de novo. Profil
genetiknya masih terbatas, namun diketahui memiliki kaitan dengan mutasi p53.
Seperti halnya pada tumor serus, patogenesis tumor musinus juga belum
diketahui dengan jelas. Analisa faktor risiko belum dapat menjelaskan perbedaan
tipe histologis yang ada. Beberapa penelitian menghubungkan tumor musinus
dengan faktor risiko yang berbeda dengan tumor serus seperti contohnya risiko
merokok. Analisa perubahan genetik tidak menunjukkan data yang memadai.
Salah satu temuan yang konsisten adalah mutasi protoonkogen KRAS. Mutasinya
terjadi pada 58% cystadenoma, 75-86% tumor borderline, dan 85% pada
karsinoma musinus primer (Kumar dkk., 2010;Pothuri,2010).
Etiologi dari perubahan seluler yang berperan dalam perkembangan tumor
ovarium epitelial didasari oleh perubahan yang terjadi pada tingkat molekuler
serta terjadinya defek yang spesifik. Hal ini menandakan bahwa perbedaan
gambaran dan pola histologis yang terjadi pada kanker ovarium berhubungan
dengan terjadinya defek yang berbeda-beda pada gen-gen yang mendasari setiap
tipe fenotip histologisnya (Wheeler, 2001;Karst,2010).
2.1.4 Apoptosis
Sel memiliki kemampuan mengaktifkan jalur mekanisme bunuh diri atau
Programmed Cell Death (PCD), yang dikenal dengan apoptosis. Apoptosis adalah proses yang meliputi pemecahan DNA oleh endonuklease serta pemecahan
terjadinya kondensasi kromatin serta penyusutan sel dengan pembentukan
cytoplasmic blebs, dan apoptotic bodies diikuti dengan proses fagositosis. Hal ini berbeda dengan proses nekrosis yang ditandai dengan hilangnya osmolaritas sel
serta pecahnya sel (Havrilesky, 2001).
Apoptosis,dalam fungsinya mengendalikan jumlah sel, juga berperan mencegah
perubahan keganasan dengan mengeliminasi sel-sel yang mengalami mutasi.
Sel-sel yang mengalami mutasi akibat rangsangan mutagen, termasuk radiasi dan zat
karsinogen, akan mengalami penghentian siklus sel untuk memperbaiki kerusakan
DNA yang terjadi. Jika perbaikan DNA gagal, maka sel akan mengalami
apoptosis. Mekanisme ini merupakan mekanisme perlindungan yang mencegah
sel-sel yang bermutasi mengalami perubahan keganasan lebih lanjut. Tumor
supressor gene p53 merupakan pemeran utama mekanisme penghentian siklus sel serta proses apoptosis dalam merespon kerusakan DNA. Apoptosis juga dapat
diaktifkan melalui jalur lainnya dalam kondisi yang berbeda (Havrilesky, 2001).
Proses apoptosis diaktivasi melalui dua jalur utama, yakni jalur intrinsik yang
diawali oleh kerusakan DNA, dan jalur ekstrinsik melalui aktivasi reseptor
Fas/CD95 (Stricker,2007).
Pada jalur ekstrinsik akan terbentuk kompleks protein reseptor dengan procaspase
8, yang kemudian akan mengaktifkan produk caspase 3, yang merupakan caspase
Gambar 2.3 Jalur apoptosis (Kumar dkk.,2010)
Jalur intrinsik diaktifkan oleh beberapa stimulus, antara lain stres dan cedera sel
akibat radiasi maupun rangsangan kimiawi. Aktivasi jalur intrinsik bekerja dengan
mempengaruhi permiabilitas membran mitokondria, memicu pelepasan
molekul-molekul, seperti sitokrom c yang akan mengawali apoptosis. Integritas membran
luar mitokondria dikendalikan oleh kelompok protein Bcl-2 yang bersifat pro
apoptosis dan anti apoptosis. Protein pro apoptosis, yakni Bax,Bad, Bcl-xS dan
Bak, secara langsung meningkatkan permiabilitas membran mitokondria.
Aktivitas ini dihambat oleh kelompok anti apoptosis seperti 2, mcl-1 dan
Bcl-xL. Kelompok proteinBH3-only, antara lain BAD,BID,dan PUMA, berfungsi
mengatur interaksi antara kelompok Bcl-2 yang pro dan anti apoptosis. Protein
BH3-only bekerja menetralisir kerja protein anti apoptosis seperti 2 dan Bcl-xL. Dalam ekspresinya, BH3-only akan mengaktifkan Bax dan Bak serta
dalam sitosol, berikatan dengan APAF-1, yang akan mengaktifkan caspase 9.
Seperti peran caspase 8 pada jalur ekstrinsik, caspase 9 bekerja memecah DNA
dan mengaktifkan caspase eksekutor atau caspase 3(Kumar dkk., 2010).
Jalur ini menggambarkan bagaimana sel kanker mengalami perubahan-perubahan
karsinogenesis dalam konteks proses apoptosis. Pada permukaan sel,
berkurangnya reseptor CD95 menyebabkan sel tumor kurang peka terhadap sinyal
apoptosis oleh Fas ligand (FasL). Inaktivasi kompleks sinyal yang menginduksi
kematian oleh protein FLICE (caspase 8;apoptosis-related cystein peptidase)
yang akan mencegah aktivasi caspase 8. Pada tingkat mitokondria, berkurangnya
sitokrom c dapat diakibatkan oleh peningkatan aktivitas Bcl-2, dan berkurangnya
Bax yang bersifat pro apoptosis akibat hilangnya fungsi normal p53. Hilangnya
apoptotic peptidase activating factor 1 (APAF-1) yang berperan mengaktifkan caspase 9 dengan berikatan dengan sitokrom c. Peningkatan Fas-Associated via
Death Domain (FADD) yang merupakan inhibitor apoptosis, bekerja dengan menghambat caspase 9 (Kumar dkk, 2010).
Mekanisme Bcl-2 serta protein mitokondria lainnya dalam menimbulkan
apoptosis masih belum jelas. Namun telah diketahui bahwa semua hal yang
menyebabkan peningkatan permiabilitas membran mitokondria akan merangsang
apoptosis, dan semua yang menurunkan permiabilitas membran akan mencegah
apoptosis. Aktivasi caspase, enzim proteolitik sitosol, ditemukan dalam proses
apoptosis, menyebabkan degradasi protein sel (Havrilesky, 2001).
Pemahaman tentang mekanisme seluler yang mendasari proses inhibisi
kanker, dan proses apoptosis diyakini mempunyai peranan dalam menghambat
terjadinya pertumbuhan tumor (Feldser, 2007). Peranan Bcl-2 dianggap sebagai
faktor penting dalam melindungi sel tumor dari proses apoptosis (Kumar
dkk.,2010).
2.2 Protein Bcl-2
Protein Bcl-2 merupakan suatu polipeptida yang diekspresikan atau dikode oleh
gen BCL2 yang berperan menekan proses apoptosis pada berbagai sistem seluler.
BCL2 adalah akronim dari B-cell lymphoma/leukemia-2. Sesuai dengan namanya,
gen ini pertamakali teridentifikasi pada limfomafolikuler sebagai hasil aktivasi
dari translokasi kromosom t(14;18) pada sebagian besar folikel pada non-Hodgkin
B-cell lymphoma. Pada translokasi ini, gen BCL2 berpindah dari lokasi normalnya pada kromosom 18q21 menuju lokasi yang sejajar dengan elemen
enhancer yang kuat dalam lokus Immunoglobulin Heavy-chain (IgH) pada kromosom 14q32. Hasil dari translokasi ini menciptakan gen BCL2 yang
mengalami deregulasi serta produksi berlebihan mRNA BCL2 dan protein-protein
yang dikode oleh gen ini.
Sebagai suatu onkogen, pada awalnya gen BCL2 ditemukan memiliki kemampuan
minimal untuk meningkatkan progresi siklus sel maupun proliferasi sel. Namun
terjadinya overekspresi dari BCL2secara spesifik mencegah sel untuk mengalami
apoptosis dalam responnya terhadap sejumlah rangsangan sehingga
memeperpanjang kelangsungan hidup sel. Overekspresi Bcl-2 pada sel limfoma
merupakan proses onkogenik primer yang bertanggungjawab menyebabkan sel
kemudian ditemukan pada sel-sel limfoid yang normal dan juga pada kelainan
limfoproliferatif tanpa adanya translokasi kromosom 14 dan 18 (Naim, 2006;
Muris, 2006; Walensky, 2008) .
Gen BCL2berlokasi di kromosom 18q21, dengan rentang lebih dari 230 kb DNA
dan terdiri dari 3 exon, dengan exon 2 serta sebagian kecil exon 3 merupakan
pengkode protein. BCL2 mengkode 2 mRNA, yaitu BCL2α dan BCL2β, dimana
hanya BCL2α yang memiliki relevansi biologis. Protein Bcl-2 merupakan protein membran dengan berat molekul 26-kDa, mempunyai rantai asam amino
hidrofobik, yang diperlukan untuk insersi pada membran sel, inti dan mitokondria.
Meskipun translokasi gen merupakan mekanisme utama untuk aktivasi gen BCL2,
namun telah dilaporkan pula terjadinya proses mutasi dan amplifikasi (Bronchud,
2004).
Secara ultrastruktural, protein Bcl-2 pertama kali ditemukan pada membran dalam
mitokondria. Pemeriksaan mikroskop elektron kemudian membuktikan bahwa
imunoreaktivitas Bcl-2 berlokasi pada membran luar mitokondria, membran
nukleus, juga pada membran sel dalam jumlah yang lebih minimal. Lokasinya
pada mitokondria mengindikasikan fungsi fisiologis Bcl-2 yang dimediasi oleh
fungsi metabolik dari organel sel ini (Rautureau dkk., 2010).
Protein ini meregulasi kematian sel dengan mempengaruhi permiabilitas membran
mitokondria, melalui keterlibatannya dalam mekanisme umpan balik caspase.
Protein Bcl-2 menghambat kerja caspase dengan mencegah pelepasan sitokrom c
dari mitokondria dan/atau melalui ikatannya dengan faktor aktivasi apoptosis
Gen BCL2 termasuk ke dalam kelompok gen regulator apoptosis yang
memproduksi protein agonis maupun antagonis apoptosis.Telah teridentifikasi
lebih dari 20 protein anggota keluarga Bcl-2, termasuk di dalamnya protein yang
antiapoptosis (Bcl-2,Bcl-xL,Bcl-w,mcl-1,Bcl-G) dan proapoptosis
(Bax,Bcl-xS,Bak,Bad, Bid,Bik,Bim). Keluarga protein ini telah dibuktikan peranannya
dalam mengatur proses apoptosis sebagai respon terhadap kemoterapi baik secara
in vitro maupun in vivo. Meskipun beberapa studi menyatakan bahwa Bcl-2 tidak selalu berfungsi sebagai penghambat apoptosis, namun overekspresi gen ini
menunjukkan kemampuannya dalam menghentikan atau menunda apoptosis dan
meningkatkan tingkat survivalsel tumor setelah pemberian berbagai stimulus,
termasuk dalam hal ini pemberian kemoterapi. Penemuan ini memunculkan suatu
konsep bahwa peningkatan ambang batas apoptosis memiliki peran penting dalam
tumorigenesis (Biroccio, 2000; Andersondkk., 2009; Pagedkk., 2010).
Saat ini telah dapat diidentifikasi protein homolog dari Bcl-2, dimana secara
struktural ditandai dengan adanya empat domainBCL2 homology
(BH1,BH2,BH3,BH4) yang sama-sama memiliki segmen α-helical. Kelompok
protein anti apoptosis (Bcl-2,Bcl-xL) memiliki rangkaian keempat domain yang
ada, sementara kelompok protein pro apoptosis dibagi menjadi kelompok
multi-BH domain (Bax,Bak) yang memiliki domain multi-BH1,multi-BH2, dan multi-BH3, serta kelompok BH3-only (Bim,Bad) yang hanya memiliki domain BH3. Protein
BH3-only merupakan struktur yang berperan penting memasangkan dan mengatur interaksi protein-protein ini (Walensky,2008).
Lokasi mutagenesis dari protein Bcl-2, yaitu domain BH1 dan BH2, menunjukkan
bahwa kedua lokasi ini penting untuk pengikatan Bcl-2 dengan Bax. Hal ini
memberikan kesan bahwa fungsi intrinsik dari Bcl-2 sebagai regulator apoptosis
yang menghambat maupun mengaktifkan apoptosis terjadi melalui interaksi
protein-protein yang saling mempengaruhi satu sama lain (Bronchud,
2004;Pagedkk.,2010). Kematian sel ditentukan oleh rasio antara protein-protein
yang pro dan anti apoptosis, dan ditemukan bahwa efek anti apoptosis dari Bcl-2
dihambat melalui hubungan timbal balik dengan ekspresi protein Bak
(Parkdkk.,2006).
Studi terkini membuktikan bahwa Bcl-2 ditemukan pula pada beberapa jaringan
non limfoid.Introduksi gen yang menghambat fungsi genBCL2dapat menginduksi
apoptosis pada sejumlah tipe tumor. Hal ini memunculkan suatu hipotesis bahwa
sel tumor secara kontinyu diatur oleh fungsi produk gen BCL2atau gen lain yang
berhubungan untuk mencegah kematian sel. Sesuai dengan hipotesis ini, ekspresi
BCL2dihubungkan dengan prognosis yang buruk pada kanker prostat, kanker
kolon, dan neuroblastoma (Naim, 2006;Muris, 2006). Hasil yang bertolak
belakang didapatkan pada kanker paru dan mamae, dimana dengan ekspresi BCL2
yang positif pasien memiliki prognosis yang lebih baik (Lukyanovadkk., 2000).
Pada kanker ovarium, overekspresi protein Bcl-2 berhubungan dengan
resistensi terhadap kemoterapi serta tingkat kelangsungan hidup pasienyang lebih
buruk (Gangdkk.,2007). Namun beberapa penelitian lainnya menghubungkan
ekspresi Bcl-2 dengan tingkat kelangsungan hidup pasien yang lebih lama
dengan ekspresi positif Bcl-2 pada ≥ 75% sel lebih rendah 30% dibandingkan
dengan pasien dengan ekspresi < 75% sel. Peran ini terutama ditemukan pada sel
tumor yang memiliki tingkat pertumbuhan yang lambat sehingga mengurangi
risiko perubahan genetik lebih lanjut yang menyebabkan tumor kurang agresif
(Ayadi dkk., 2010). Hubungan Bcl-2 dengan prognosis yang lebih baik dapat
dijelaskan dengan kemampuan yang dimiliki oleh Bcl-2 dalam menunda sel
memasuki S phase, sehingga sel memiliki indeks proliferasi yang lebih rendah.
Ekspresi Bcl-2 pada jaringan normal ditemukan secara signifikan lebih tinggi
dibandingkan dengan jaringan neoplasma, dengan nilai median dan range ekspresi
mRNAyang berbeda-beda pada berbagai tipe. Kecenderungan pola penurunan
ekspresi yang sama ditemukan pada kanker lambung, namun pola ekspresi yang
berlawanan ditemukan pada kanker payudara dan prostat.
Ekspresi Bcl-2 pada epitel ovarium normal dan tumor jinak ditemukan lebih
tinggi dibandingkan dengan spesimen kanker ovarium (Anderson,2009).
Berdasarkan tipe histologisnya, Torredkk. (2007) menemukan ekspresi Bcl-2 yang
tinggi (> 75% sel tumor) pada tumor ovarium tipe epitelial, dimana terdapat
perbedaan yang signifikan antara tumor jinak/ cystadenoma dan borderline
dibandingkan dengan jenis tumor ganas ovarium. Pewarnaan Bcl-2 yang positif
ditemukan pada jaringan ovarium normal, yakni pada sel teka interna dari korpus
luteum, sel granulosa dari folikel, dan pada stroma ovarium. Tingginya ekspresi
protein ini pada ovarium normal kemungkinan berkaitan dengan fungsi fisiologis
Bcl-2 dalam mencegah apoptosis dan peranannya dalam memacu pertumbuhan
dengan perkembangan dan progresivitas tumor merupakan akibat dari deregulasi
Bcl-2 dalam menjaga fungsi fisiologis dan integritas epitel perrmukaan ovarium
(Andersondkk., 2009).
Hasil temuan yang berbeda didapatkan pada penelitian lainnya. Gang dkk. (2007)
menemukan bahwa ekspresi positif Bcl-2 pada 54,2% kasus melalui pemeriksaan
imunohistokimia 72 kasus kanker ovarium epitelial. Tingkat ekspresinya pada
kanker ovarium secara signifikan lebih tinggi dibandingkan dengan pada tumor
jinak dan kontrol normal. Dengan menggunakan nilai cut off 30% sebagai batas
untuk menilai overekspresi protein Bcl-2, ditemukan ekspresi yang positif pada
kanker ovarium lebih tinggi dibandingkan dengan tumor borderline (Hogdaldkk.,
2010). Hasil ini didukung oleh penelitian sebelumnya dimana ekspresinya pada
karsinoma ovarium lebih tinggi dari tumor borderline (Rauf, 2004).Bcl-2
berperan meningkatkan tumorigenesis dengan mencegah eliminasi sel yang rusak
yang salah satunya melalui mekanisme stres oksidatif sel (Cox, 2007).
Tipe histologis adalah salah satu faktor prognostik signifikan dan independen
pada kanker ovarium yang berhubungan dengan tingkat kelangsungan hidup
secara umum (Greene, 2002). Beberapa penelitian menemukan hubungan yang
bermakna antara ekspresi positif Bcl-2 dengan tipe histologis kanker ovarium
(Sagarradkk., 2002; Kupryjanczykdkk.,2003), namun penelitian lainnya tidak
menemukan hubungan ini (Rauf, 2004; Hogdal dkk., 2010). Pola ekspresi yang
berbeda ditemukan berdasarkan subtipe histologisnya, dimana ekspresi Bcl-2
yang lebih tinggi ditemukan pada tipe endometrioid dan clear cell carcinomajika
Perbedaan ekspresi Bcl-2 pada berbagaijenisneoplasia ini menandakan
kemungkinan peranan yang berbeda-beda dalam proses apoptosis serta
mengindikasikan mekanisme ekspresi yang spesifik untuk masing-masing
jaringan (Wheeler, 2001). Page dkk. (2010) mempertimbangkan perlunya
pendekatan studi tentang protein penanda biologis yang berbeda-beda untuk
subtipe-subtipe tumor ovarium epitelial sebagai kasus yang berbeda dan berdiri
37 BAB III
KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN
3.1 Kerangka Berpikir
Tumor ganas atau kanker ovarium merupakan keganasan terbanyakkelima dari semua keganasan pada wanita dengan angka kematian yang tertinggi. Prognosis yang buruk pada stadium lanjut berhubungan dengan kesulitan diagnosis pada stadium awal, serta deteksi dini efektifyang hingga kini belum dapat dilakukan.
Tumor ovarium secara histologis sangat bervariasi, dengan karakteristik klinis
maupun histopatologisnya masing-masing. Berdasarkan struktur asalnya,
neoplasia ovarium dibagi menjadi 3 tipe, yaitu:tipe epitelial, tipe germinal serta
mesenkim/sex cord-stromal. Berdasarkan luas proliferasi dan pola diferensiasi
lapisan epitelnya, tumor ovarium dibagi menjadi: tumor jinak, borderline dan
ganas.
Karsinogenesis merupakan proses bertahap pada tingkat genetik dan fenotip
sebagai hasil dari akumulasi mutasi yang terjadi berulangkali, dan kerusakan
genetik merupakan mekanisme dasar dari proses karsinogenesis. Target utama
kerusakan genetik ini adalah empat kelompok gen utama, yaitu protoonkogen
yang meningkatkan pertumbuhan dan proliferasi sel, yang kemudian hasil
mutasinya disebut onkogen, mutasi pada tumor supressor gene yang berfungsi
menghambat pertumbuhan sel, gen yang mengatur mekanisme apoptosis, serta
disebabkan oleh ketidakseimbangan antara proliferasi dan kematian sel. Sel
kanker tidak hanya gagal bereaksi terhadap sinyal untuk menghentikan
proliferasinya, namun juga gagal dalam menerima sinyal fisiologis untuk memulai
mekanisme apoptosis.
Protein Bcl-2 merupakan suatu polipeptida yang diekspresikan atau dikode oleh
gen BCL2 yang berperan menekan proses apoptosis pada berbagai sistem seluler.
Protein ini meregulasi kematian sel dengan mempengaruhi permiabilitas membran
mitokondria, melalui keterlibatannya dalam mekanisme umpan balik caspase.
Ekspresi Bcl-2 pada epitel ovarium normal dan tumor jinak ditemukan lebih
tinggi dibandingkan dengan spesimen kanker ovarium. Hasil penelitian
lainmenyatakan tingkat ekspresinya pada kanker ovarium secara signifikan lebih
tinggi dibandingkan dengan pada tumor jinak dan kontrol normalPenilaian
terhadap sel yang mengalami overekspresi Bcl-2 menunjukkan bukti adanya
ketidakstabilan genom, yang konsisten dengan terganggunya proses apoptosis
pada sel yang mengalami kerusakan.
Perbedaan ekspresi Bcl-2 pada berbagaijenisneoplasia ini menandakan
kemungkinan peranan yang berbeda dalam proses apoptosis serta
mengindikasikan mekanisme ekspresi yang spesifik untuk masing-masing
jaringan.
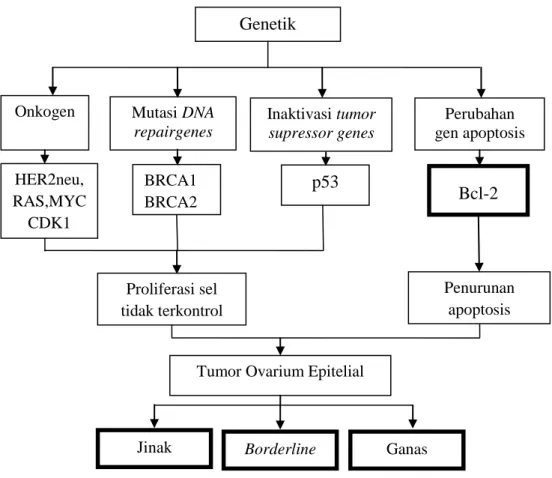
Konsep penelitian ini digambarkan sebagai berikut:
Gambar 3.1 Konsep Penelitian
3.3 Hipotesis Penelitian
1. Ada ekspresi Bcl-2 pada tumor ovariumepitelialtipe jinak
2. Ada ekspresi Bcl-2 pada tumor ovarium epitelial tipe borderline
3. Ada ekspresiBcl-2 pada tumor ovarium epitelial tipe ganas
4. Ada perbedaan ekspresi Bcl-2 pada tumor ovarium epitelial tipe
jinak,borderline dan ganas
Jinak Perubahan gen apoptosis Bcl-2 Proliferasi sel tidak terkontrol
Tumor Ovarium Epitelial
Penurunan apoptosis
Genetik
Onkogen Mutasi DNA
repairgenes Inaktivasi tumor supressor genes HER2neu, RAS,MYC CDK1 BRCA1 BRCA2 BRCA2 p53 Borderline Ganas
40 BAB IV
METODE PENELITIAN
4.1 Rancangan Penelitian
Rancangan pada penelitian ini adalah observasional analitik (cross-sectional).
Secara sistematik rencangan penelitian dapat digambarkan sebagai berikut.
Gambar 4.1 Rancangan Penelitian
4.2. Tempat dan Waktu Penelitian
Penelitian ini melibatkan Bagian Kebidanan dan Penyakit Kandungan, Patologi
Anatomi, dan Rekam Medis Rumah Sakit Umum Pusat (RSUP) Sanglah,
Denpasar. Waktu Penelitian dilaksanakan mulai bulan Maret 2012 sampai
Desember 2013.
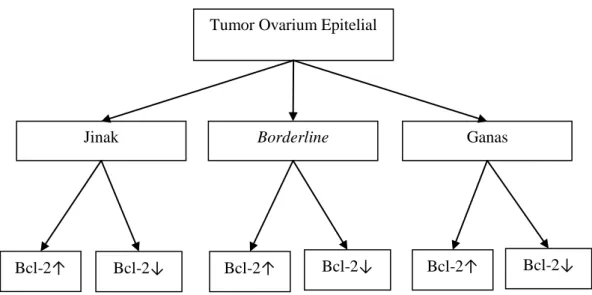
Tumor Ovarium Epitelial
Bcl-2↑
Jinak Borderline Ganas
4.3 Populasi Penelitian
Populasi target penelitian adalah semua pasien dengan tumor ovarium. Populasi
tarjangkau penelitian adalah semua pasien tumor ovarium epitelial yang telah
menjalani pembedahan di RSUP Sanglah dari tahun 2010 sampai 2012, dan
jaringan hasil pembedahan tumor ovarium epitelial telah dibuat blok parafin di
Bagian Patologi Anatomi RSUP Sanglah.
4.4 Sampel Penelitian
Sampel penelitian ini adalah blok parafin tumor ovarium di Bagian Patologi
Anatomi RSUP Sanglah yang dibuat dalam periode waktu 2010 sampai 2012 serta
memenuhi kriteria inklusi dan eksklusi.
4.4.1 Kriteria inklusi
Kriteria inklusi penelitian adalah sebagai berikut.
a. Blok parafin dari tumor ovarium tipe jinak, borderline maupun ganas.
b. Data rekam medis yang lengkap, meliputi: identitas, umur, paritas, IMT,
tipe histologis, serta riwayat keluarga kanker ovarium, mamae dan kolon.
4.4.2 Kriteria eksklusi
Kriteria ekslusi penelitian adalah sebagai berikut.
a. Blok parafin dari pasien yang pernah menjalani kemoterapi atau radiasi
(neoadjuvant) sebelum pembedahan.
4.4.3 Perhitungan besar sampel
Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai
berikut (Arraoye, 2003) : Zα2(pq) n = …..………...(1) d2 Keterangan : 𝑛 : besar sampel Zα : 1,96 (α = 0,05)
p : 15% (prevalensi tumor ovarium di populasi)
q : 85% ( 1 – p )
d : 10% (penyimpangan absolut penelitian)
Berdasarkan perhitungan rumus di atas, didapatkan besar sampel penelitian adalah
48,98 sampel. Penelitian ini akan menggunakan sampel sebanyak 49 sampel.
4.4.4 Cara pengambilan sampel
Cara pengambilan sampel adalah blok parafin tumor ovarium di Bagian Patologi
Anatomi RSUP Sanglah yang telah memenuhi kriteria inklusi dan eksklusi,
kemudian dipilih dengan cara random sampling sebanyak 49 sampel.
4.5 Variabel Penelitian 4.5.1 Identifikasi variabel
Identifikasi variabel adalah sebagai berikut.
4.5.1.1 Variabel bebas : ekspresi Bcl-2
4.5.1.2 Variabel tergantung : tumor ovarium tipe jinak,