MIKROPROPOGASI TUNAS
KANTONG SEMAR (Nepenthes gracillis Korth.)
DENGAN PEMBERIAN NAA DAN BAP SECARA IN VITRO
SKRIPSI
Oleh :
ARIANI SYAHFITRI HRP 060307031
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
MIKROPROPOGASI TUNAS
KANTONG SEMAR (Nepenthes gracillis Korth.)
DENGAN PEMBERIAN NAA DAN BAP SECARA IN VITRO
SKRIPSI Oleh :
ARIANI SYAHFITRI HRP 060307031/PEMULIAAN TANAMAN
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Skripsi : Mikropropogasi Tunas kantong semar (Nepenthes gracillis Korth.) dengan pemberian NAA dan BAP secara in vitro
Nama : Ariani Syahfitri Hrp Nim : 060307031
Departemen : Budidaya Pertanian Program Studi : Pemuliaan Tanaman
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. Rosmayati, MS
Ketua Anggota Ir. Syafruddin Ilyas
Mengetahui:
i
ABSTRAK
ARIANI SYAHFITRI HRP : Mikropropogasi Tunas Kantong Semar (Nepenthes gracillis Korth.) Dengan Pemberian NAA dan BAP Secara In Vitro,
dibimbing oleh Prof. Dr. Ir. Rosmayati, MS dan Ir. Syafruddin Ilyas.
Pengaruh kombinasi NAA dan BAP terhadap mikropropogasi tunas kantong semar belum banyak diteliti saat ini. Untuk itu suatu penelitian telah dilakukan di Laboratorium Kultur Jaringan Fakultas Pertanian USU pada Maret-Juni 2010 menggunakan rancangan acak lengkap faktorial 2 faktor yaitu pemberian NAA (0, 0.5, 1 dan 1.5 mg/l) dan BAP (0, 1, 2, dan 3 mg/l). Parameter yang diamati adalah persentase eksplan yang hidup, persentase eksplan membentuk tunas, jumlah tunas, panjang tunas dan jumlah buku.
Hasil penelitian menunjukkan bahwa pemberian NAA tidak berpengaruh nyata terhadap semua parameter pengamatan. Pemberian BAP berpengaruh nyata terhadap parameter jumlah tunas kecuali persentase eksplan yang hidup, persentase eksplan membentuk tunas, panjang tunas dan jumlah buku. Interaksi perlakuan tidak berpengaruh nyata terhadap semua parameter pengamatan. Hasil yang terbaik diperoleh pada kombinasi 1 mg/l NAA dengan 3 mg/l BAP.
ii
ABSTRACT
ARIANI SYAHFITRI HRP : Shoot Micropropogation of Kantong Semar
(Nepenthes gracillis Korth.) with giving NAA and BAP by In Vitro, supervised by Prof. Dr. Ir. Rosmayati, MS and Ir. Syafruddin Ilyas.
The combination effects of NAA and BAP about shoot micropropogation of kantung semar have not been researched enough today. Therefore, a research had been conducted at of College of Agriculture USU in March-June 2010 using factorial completely rendomized design with two factor that is giving NAA (0, 0.5, 1 dan 1.5 mg/l) and BAP (0, 1, 2, dan 3 mg/l). Parameters measured were percentage of eksplan live, percentage of eksplan shoot form, shoot amount, shoot height, and nood amount.
The result showed that giving NAA those not affected significantly on all parameters observed. Giving BAP affected significantly about shoot amount parameters except percentage of eksplan live, percentage of eksplan shoot form, shoot height, and nood amount. Interaction of the two factors those not affected significantly on all parameters observed. The best result was found in the combination of 1 mg/l NAA with 3 mg/l BAP.
iii
RIWAYAT HIDUP
Penulis dilahirkan di Sosopan pada tanggal 28 Juni 1987 dari ayah Mester
Harahap dan ibu Ratna Sari Daulay. Penulis merupakan putri pertama dari empat
bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 18 Medan dan pada tahun
2006 masuk ke Fakultas Pertanian USU melalui jalur ujian tertulis Seleksi
Penerimaan Mahasiswa Baru. Penulis memilih program studi Pemuliaan
Tanaman, Departemen Budidaya Pertanian.
Selama mengikuti perkuliahan, penulis aktif sebagai pengurus Badan
Kenaziran Musholla (BKM) Al Mukhlisin, Himadita Nursery, Kelompok Aspirasi
Mahasiswa (KAM) Rabbani, Tim Mentoring Agama Islam, sebagai asisten
praktikum di Laboratorium Dasar Pemuliaan Tanaman. Selain itu, penulis juga
aktif dalam organisasi ekstrauniversitas Kesatuan Aksi Mahasiswa Muslim
(KAMMI).
Penulis melaksanakan praktek kerja lapangan (PKL) di Balai Penelitian
Sungei Putih Pusat Penelitian Karet dari tanggal 12 Juli sampai 8 Agustus 2009.
iv
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
”Mikropropogasi Tunas Kantong Semar (Nepenthes gracillis Korth.) Dengan
Pemberian NAA Dan BAP Secara In Vitro”.
Pada kesempatan ini penulis ingin mengucapkan terima kasih
sebesar-besarnya kepada kedua orang tua penulis yang telah membesarkan,
memelihara dan mendidik penulis selama ini. Penulis menyampaikan ucapan
terima kasih kepada Prof. Dr. Ir. Rosmayati, MS dan Ir. Syafruddin Ilyas selaku
ketua dan anggota komisi pembimbing yang telah membimbing dan memberikan
berbagai masukan berharga kepada penulis dari mulai menetapkan judul,
melakukan penelitian, sampai pada ujian akhir.
Disamping itu, penulis juga mengucapkan terima kasih kepada semua staf
pengajar dan pegawai di Departemen Budidaya Pertanian, serta semua rekan
mahasiswa yang tak dapat disebutkan satu persatu di sini yang telah membantu
penulis dalam menyelesaikan skripsi ini. Semoga skripsi ini bermanfaat.
Medan, Juli 2010
v
DAFTAR ISI
Hal
ABSTRAK... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
Penutup Kantong ... 6
Kantong Atas ... 6
Pembungaan ... 6
Habitat ... 7
Kultur Jaringan ... 7
Eksplan ... 8
Media Kultur ... 9
Lingkungan In Vitro ... 10
Zat Pengatur Tumbuh ... 12
Naftalen Asam Asetat (NAA) ... 13
Benzil Aminopurin (BAP) ... 14
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 16
Bahan dan Alat Penelitian ... 16
vi PELAKSANAAN PENELITIAN
Sterilisasi Alat ... 19
Pembuatan Larutan Stok ... 19
Pembuatan Media ... 19
Pemotongan Eksplan ... 20
Penanaman Eksplan ... 21
Pemeliharaan... 21
Parameter Pengamatan ... 21
Persentase Eksplan Yang Hidup (%) ... 21
Persentase Eksplan Membentuk Tunas (%) ... 21
Jumlah Tunas (buah)... 22
Panjang Tunas (cm) ... 22
Jumlah Buku (buah) ... 22
HASIL DAN PEMBAHASAN Hasil Persentase Eksplan Yang Hidup (%) ... 23
Persentase Eksplan Membentuk Tunas (%) ... 24
Jumlah Tunas (buah)... 24
Panjang Tunas (cm) ... 26
Jumlah Buku (buah) ... 26
Pembahasan Pengaruh NAA Terhadap Mikropropogasi Kantung Semar ... 28
Pengaruh BAP Terhadap Mikropropogasi Kantung Semar ... 28
vii
DAFTAR TABEL
No. Hal
1. Pengaruh konsentrasi NAA dan BAP terhadap persentase
eksplan yang hidup ... 23
2. Pengaruh konsentrasi NAA dan BAP terhadap persentase eksplan membentuk tunas ... 24
3. Pengaruh konsentrasi NAA dan BAP terhadap jumlah tunas... 25
4. Pengaruh konsentrasi NAA dan BAP terhadap panjang tunas ... 27
viii
DAFTAR GAMBAR
No. Hal
DAFTAR LAMPIRAN
No. Hal
1. Bagan penelitian ... 34
2. Tabel kegiatan penelitian ... 35
3. Komposisi media murashige dan skoog (MS) ... 36
4. Persentase eksplan yang hidup (%) ... 37
5. Persentase eksplan membentuk tunas (%) ... 38
6. Jumlah tunas (buah)... 39
7. Sidik ragam jumlah tunas (buah) ... 39
8. Panjang tunas (cm) ... 40
9. Sidik ragam panjang tunas (cm)... 40
10.Jumlah buku (buah) ... 41
11.Sidik ragam jumlah buku (buah) ... 41
12.Uji beda rataan mikropropogasi kantong semar dengan pemberian NAA dan BAP secara in vitro ... 42
i
ABSTRAK
ARIANI SYAHFITRI HRP : Mikropropogasi Tunas Kantong Semar (Nepenthes gracillis Korth.) Dengan Pemberian NAA dan BAP Secara In Vitro,
dibimbing oleh Prof. Dr. Ir. Rosmayati, MS dan Ir. Syafruddin Ilyas.
Pengaruh kombinasi NAA dan BAP terhadap mikropropogasi tunas kantong semar belum banyak diteliti saat ini. Untuk itu suatu penelitian telah dilakukan di Laboratorium Kultur Jaringan Fakultas Pertanian USU pada Maret-Juni 2010 menggunakan rancangan acak lengkap faktorial 2 faktor yaitu pemberian NAA (0, 0.5, 1 dan 1.5 mg/l) dan BAP (0, 1, 2, dan 3 mg/l). Parameter yang diamati adalah persentase eksplan yang hidup, persentase eksplan membentuk tunas, jumlah tunas, panjang tunas dan jumlah buku.
Hasil penelitian menunjukkan bahwa pemberian NAA tidak berpengaruh nyata terhadap semua parameter pengamatan. Pemberian BAP berpengaruh nyata terhadap parameter jumlah tunas kecuali persentase eksplan yang hidup, persentase eksplan membentuk tunas, panjang tunas dan jumlah buku. Interaksi perlakuan tidak berpengaruh nyata terhadap semua parameter pengamatan. Hasil yang terbaik diperoleh pada kombinasi 1 mg/l NAA dengan 3 mg/l BAP.
ii
ABSTRACT
ARIANI SYAHFITRI HRP : Shoot Micropropogation of Kantong Semar
(Nepenthes gracillis Korth.) with giving NAA and BAP by In Vitro, supervised by Prof. Dr. Ir. Rosmayati, MS and Ir. Syafruddin Ilyas.
The combination effects of NAA and BAP about shoot micropropogation of kantung semar have not been researched enough today. Therefore, a research had been conducted at of College of Agriculture USU in March-June 2010 using factorial completely rendomized design with two factor that is giving NAA (0, 0.5, 1 dan 1.5 mg/l) and BAP (0, 1, 2, dan 3 mg/l). Parameters measured were percentage of eksplan live, percentage of eksplan shoot form, shoot amount, shoot height, and nood amount.
The result showed that giving NAA those not affected significantly on all parameters observed. Giving BAP affected significantly about shoot amount parameters except percentage of eksplan live, percentage of eksplan shoot form, shoot height, and nood amount. Interaction of the two factors those not affected significantly on all parameters observed. The best result was found in the combination of 1 mg/l NAA with 3 mg/l BAP.
PENDAHULUAN
Latar Belakang
Dalam bahasa Latin, kantong semar disebut “Nepenthes”. Nama tersebut
pertama kali dikenalkan oleh J.P. Breyne ketika dia sedang membuat deskripsi
jenis tumbuhan yang berasal dari Srilangka (1689). Nama Nepenthes diambil dari
sebuah nama gelas anggur. Keunikan dari tumbuhan ini adalah bentuk, ukuran,
dan corak warna kantongnya. Sebenarnya, kantong tersebut adalah ujung daun
yang berubah bentuk dan fungsinya menjadi perangkap serangga atau binatang
kecil lainnya. Dengan kemampuan itulah maka tumbuhan tersebut digolongkan
sebagai carnivorous plant (Mansur, 2006).
Nepenthes memang belum sepopuler tanaman hias lainnya, seperti
anggrek dan aglonema. Walaupun begitu, nama Nepenthes sudah terkenal di
mancanegara, tidak sedikit orang Thailand yang mengoleksinya. Bahkan,
budidaya tanaman dari famili Nepentheceae ini sudah berkembang menjadi skala
industri dan menyumbang devisa negara, seperti Belanda mampu menghasilkan
100.000-500.000 tanaman pertahun dengan nilai Euro 1.5-1.7 juta, Malaysia
produksi tanaman 3000 tanaman per bulan. Ironisnya, tanaman yang dijuluki
sebagai Carnivorous plant ini kebanyakan berasal dari Indonesia. Dari 103
spesies yang terdata di seluruh dunia, 64 spesies berasal dari Indonesia (65.92%).
Dan dari 65.92% ini jumlah Nepenthes yang ada di Indonesia, semua dalam
keadaan kritis, terkikis dan rawan dalam kepunahan (Penebar Swadaya, 2006).
Nepenthes merupakan tanaman langka. Sebagian bahkan sudah hampir
11
11
Endangered Species (CITES). Semua tanaman yang masuk dalam CITES dilarang
untuk diperdagangkan. Untuk menjaganya dari kepunahan, upaya
membudidayakan secara ex-situ (diluar habitat aslinya) saat ini banyak dilakukan.
Salah satunya adalah dengan kultur jaringan (Purwanto, 2007).
Kultur jaringan tanaman merupakan teknik menumbuh kembangkan
bagian tanaman, baik berupa sel, jaringan, atau organ dalam kondisi aseptik secara
in vitro. Teknik ini dicirikan oleh kondisi kultur yang aseptik, penggunaan media
kultur buatan dengan kandungan nutrisi lengkap dan zat pengatur tumbuh (ZPT) ,
serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol
(Yusnita, 2004).
Salah satu aspek yang terpenting dalam kultur jaringan adalah
kemampuan untuk beregenerasi dan memperbanyak tanaman (mikropropagasi).
Mikropropogasi adalah perbanyakan vegetatif tanaman dengan menggunakan
teknik in vitro. Dengan berkembangnya teknik mikropropagasi tanaman akhir
akhir ini, kendala dalam memperbanyak beberapa jenis tanaman dapat diatasi
(Wattimena dkk., 1992).
Perbanyakan tanaman dengan teknik mikropropogasi memiliki kelebihan,
yaitu tanaman dapat diperbanyak setiap saat tanpa tergantung musim karena
dilakukan di ruang tertutup, daya multiplikasinya tinggi dari bahan tanaman yang
kecil, tanaman dihasilkan seragam, dan bebas penyakit terutama bakteri dan
jamur. Jenis tanaman yang diperbanyak dengan teknik mikropropagasi ditujukan
12
12
tanaman hibrida yang tetua jantannya steril, tanaman langka, dan tanaman yang
selalu diperbanyak dengan cara vegetatif (Ekawati, 2010).
Media yang digunakan adalah media Murashige & Skoog (MS). Media
MS digunakan untuk hampir semua macam tanaman, terutama tanaman
herbaceus. Media ini mempunyai konsentrasi garam-garam mineral yang tinggi
dan senyawa N dalam bentuk NO3- dan NH4- (Hendaryono dan Wijayani, 1994).
Selain media, faktor lain yang menentukan keberhasilan kultur jaringan
adalah zat pengatur tumbuh (ZPT). ZPT yang banyak digunakan adalah Naftalen
Asam Asetat (NAA) dan Benzil Aminopurin (BAP). NAA merupakan golongan
auksin yang berfungsi dalam menginduksi pemanjangan sel, mempengaruhi
dominansi apikal, penghambatan pucuk aksilar dan adventif serta inisiasi
pengakaran, sedangkan BAP berfungsi merangsang pembelahan sel dalam
jaringan yang dibuat eksplan dan merangsang pertumbuhan tunas
(Wattimena dkk., 1992).
Penelitian tentang budidaya kantong semar hingga saat ini masih sangat
kurang, mengingat keterbatasan informasi tentang budidayanya secara in vitro pun
masih sangat terbatas. Berdasarkan uraian di atas, maka dipandang perlu untuk
melakukan penelitian mengenai pengaruh pemberian NAA dan BAP terhadap
13
13 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh NAA dan BAP serta
interaksi keduanya terhadap jumlah tunas dan jumlah buku pada mikropropogasi
tunas kantong semar secara in vitro.
Hipotesis Penelitian
1. Ada pengaruh tingkat konsentrasi NAA terhadap jumlah tunas dan jumlah
buku pada mikropropogasi tunas kantong semar
2. Ada pengaruh tingkat konsentrasi BAP terhadap jumlah tunas dan jumlah
buku pada mikropropogasi tunas kantong semar
3. Ada pengaruh interaksi antara tingkat konsentrasi NAA dan BAP terhadap
jumlah tunas dan jumlah buku pada mikropropogasi tunas kantong semar
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan data penyusunan skripsi sebagai
salah satu syarat untuk mendapatkan gelar sarjana pertanian di Fakultas Pertanian,
Universitas Sumatera Utara, Medan dan diharapkan dapat pula berguna untuk
pihak-pihak yang berkepentingan dalam memperbanyak kantong semar.
TINJAUAN PUSTAKA
Botani Tanaman
Mansur (2006) menyebutkan bahwa Nepenthes ini berbeda dengan
tumbuhan carnivorous plant lainnya (Doaea muscipula, Drosera sp, Pinguicula sp
dan Utriculara sp), karena Nepenthes tidak memiliki bagian tubuh yang bergerak
aktif. Adapun klasifikasi tumbuhan ini sebagai berikut:
Kingdom : Plantae
Filum : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Dilleniidae
Ordo : Nepenthales
Famili : Nepentheceae
Genus : Nepenthes
Spesies : Nepenthes grasillis Korth.
Menurut Cheek dan Jebb (2001), morfologi Nepenthes grasillis ini, adalah
sebagai berikut:
Batang
Nepenthes grasillis tumbuh memanjat dengan tinggi 2-5 m, dengan bentuk
batang segitiga, diameter 2-4 mm, dengan sudut daun berbentuk bulat, dengan 2
15
15 Daun
Daun seperti kertas tidak bertangkai, posisi duduk, panjang 12-19 cm,
lebar 1.5-3.7 cm, berbentuk lanset, panjang sulur ≤ 15 cm, ujung daun runcing,
sayap batang agak ramping pada pangkal daun.
Kantong bawah
Kantong bawah berbentuk oval, bagian atas silindris, lebar pada bagian
tengah atas dengan ukuran 1.4-2.4 cm, lebar pada bagian tengah bawah dengan
ukuran 1.7-3.7 cm, terdapat 2 sayap tepi dengan lebar 3-5 mm, panjang struktur
tepi 1-2.5 mm, bagian tengah 0.5-2 mm, mulut kantong berbentuk oval, dengan
bibir berbentuk silindris, lebar 0.5 mm, tanpa cincin, tepi sebelah luar rata, tepi
sebelah dalam agak sepi.
Penutup kantong
Tanaman ini memiliki penutup yang berbentuk bulat oval, dengan
permukaan bawah tanpa anggota tubuh pada kelenjar nektar jarang, jumlah bintik
sedikit 20-30. Tepi besar dari padat, berbentuk kubah, dengan diameter 0.4 mm.
Lubang sentral menyerupai celah dengan diameter 0.1, panjang taji 5 mm.
Kantong atas
Kantong atas sama dengan kantong bawah tetapi setengah silindris dan
mengecil pada bagian pinggang, dengan panjang 7-14.5 cm dan lebar 1.8-4 cm,
lebarnya pada bagian basal hampir sampai 1.5-2.9 cm pada bagian pinggang, pada
16
16 Pembungaan
Bunga jantan dengan panjang 15-30 cm, panjang ibu tangkai bunga 1.2-5
cm, diameter 1.5 mm pada bagian bawah, 1 bunga pada setiap ibu tangkai,
panjang tangkai bunga 5-14 mm, panjang kelamin jantan 0.7-1 mm, panjang
kepala sari 0.7-1.5 mm, panjang bawah 14-30 mm, berbulu sederhana ± 0.1-0.3
mm, warna kantong hijau, merah, hijau bercampur merah, warna bunga ada yang
putih hijau, merah terang, atau coklat.
Habitat
Tanaman ini tumbuh pada kawasan hutan dataran rendah, hutan rawa
gambut, hutan kerangas, vegetasi pinggir sungai, pada ketinggian 0-1100 m dpl.
Sumatra, Kalimantan, Sulawesi, Singapura, Malaysia dan Thailand merupakan
daerah penyebarannya. Saat ini status terlindungi (PP No. 7 Tahun 1999).
Kultur Jaringan
Kultur jaringan itu sendiri dapat diartikan suatu metode untuk mengisolasi
bagian tanaman serta menumbuhkannya dalam kondisi yang aseptik. Sehingga
bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman
lengkap (Hartman, et al, 2002).
Berbeda dengan teknik perbanyakan vegetatif konvensional, kultur
jaringan melibatkan pemisahan komponen-komponen biologis dan tingkat
pengendalian yang tinggi dalam memacu proses regenerasi dan perkembangan
jaringan. Setiap urutan proses dapat dimanipulasi melalui seleksi bahan tanaman,
17
17
seperti jamur dan bakteri. Semua itu dimaksudkan untuk memaksimalkan produk
akhir dalam bentuk kuantitas dan kualitas propagula berdasarkan prinsip
totipotensi sel (Zulkarnain, 2009).
Dibanding dengan perbanyakan tanaman secara konvensional,
perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan
sebagai berikut:
1. Untuk memperbanyak tanaman tertentu yang sulit atau sangat lambat
diperbanyak secara konvensional. Perbanyakan tanaman secara kultur
jaringan menawarkan peluang besar untuk menghasilkan jumlah bibit
tanaman yang banyak dalam waktu relatif singkat sehingga lebih ekonomis.
2. Perbanyakan tanaman secara kultur jaringan tidak memerlukan tempat yang
luas.
3. Teknik perbanyakan tanaman secara kultur jaringan dapat dilakukan
sepanjang tahun tanpa bergantung pada musim.
4. Bibit yang dihasilkan lebih sehat.
5. Memungkinkan dilakukannya manipulasi genetik.
(Yusnita, 2003).
Kultur jaringan akan lebih besar persentase keberhasilannya bila
menggunakan jaringan meristem. Jaringan meristem adalah jaringan muda, yaitu
jaringa n yang terdiri dari sel-el yang selalu membelah, dindingnya tipis, belum
mempunyai penebalan dari zat pektin, plasmanya penuh, dan vakuolanya
kecil-kecil. Kebanyakan orang menggunakan jaringan ini untuk tissue culture.
18
18
diperkirakan mempunyai zat hormone yang mengatur pembelahan
(Hendaryono dan Wijayani, 1994).
Eksplan
Eksplan artinya jaringan tanaman yang digunakan sebagai bahan tanam di
dalam botol. Eksplan dipilih dari jaringan yang masih muda karena jaringan
tersebut tersusun atas sel-sel yang masih muda dan selalu membelah. Dengan
demikian diharapkan nantinya bisa menghasilkan tanaman yang sempurna.
Sebagai eksplan Nepenthes, gunakan bagian daun, tunas pucuk, batang muda dan
bisa juga bagian jaringan lainnya (Purwanto, 2007).
Kondisi fisiologis eksplan memiliki peranan penting bagi keberhasilan
teknik kultur jaringan. Pierik (1997) menyatakan bahwa pada umumnya
bagian-bagian vegetatif lebih siap beregenerasi daripada bagian-bagian-bagian-bagian generatif. Eksplan
mata tunas yang diperoleh dari tanaman yang sedang istirahat, lebih sulit
berpoliferasi daripada mata tunas yang diperoleh dari tanaman yang sedang aktif
tumbuh. Hal itu sama halnya dengan kasus dormansi pada eksplan biji. Kondisi
fisiologis dari suatu tanaman bervariasi secara alami, sejalan dengan pertumbuhan
tanaman yang melewati fase-fase yang berbeda dan perubahan kondisi lingkungan
(Zulkarnain, 2009).
Dalam pemilihan bagian tanaman, perlu juga dipertimbangkan tujuan dari
kulturnya. Bagian-bagian tertentu akan memberikan variasi dalam jumlah
kromosom maupun variasi dalam beberapa gen. Endosperma hanya digunakan
19
19
varietaas yang digunakan juga ikut menentukan keberhasilan regenerasi
(Gunawan, 1995).
Media Kultur
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur
telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan
tanaman yang dikulturkan (Yusnita, 2003).
Sebelum membuat medium, maka terlebih dahulu kita harus menentukan
medium apa yang akan kita buat. Jenis medium dengan komposisi unsur kimia
yang berbeda dapat digunakan untuk media tumbuh dari jaringan tanaman yang
berbeda pula (Hendaryono dan Wijayani, 1994).
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa
medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang
selanjutnya diinduksi membentuk tanaman yang lengkap (disebut sebagai planlet),
sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang
digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber
karbon, vitamin, zat pengatur tumbuh dan suplemen organik (Yuwono, 2008).
Media yang digunakan secara luas adalah media MS yang dikembangkan
pada tahun 1962. Dari berbagai komposisi dasar ini kadang-kadang dibuat
modifikasi, misalnya hanya menggunakan ½ dari konsentrasi dari garam-garam
makro yang digunakan (1/2 MS) atau menggunakan komposisi garam makro
20
20
pengatur tumbuh yang akan digunakan disesuaikan dengan tujuan inisiasi kultur
(Gunawan, 1995).
Lingkungan In Vitro
Lingkungan kultur merupakan hasil interaksi antara bahan tanaman,
wadah kultur, dan lingkungan eksternal ruang kultur, memiliki pengaruh yang
sangat besar terhadap suatu sistem kultur jaringan. Secara teoritis, semua variabel
di dalam setiap wadah kultur pada ruang kultur yang sama adalah seragam.
Sebagai konsekuensinya, hal yang sama terjadi pula di wadah-wadah kultur pada
ruang kultur yang lain. Agar pertumbuhan kultur seragam maka keseragaman
faktor lingkungan harus diupayakan, tidak hanya di dalam ruang kultur, tetapi
juga di dalam semua wadah kultur dengan cara menggunakan wadah yang
seragam (Zulkarnain, 2009).
Lingkungan tumbuh yang dapat mempengaruhi regenerasi tanaman
meliputi:
• Temperatur
• Penyinaran: panjang penyinaran, intensitas penyinaran, dan kualitas sinar,
serta
• Ukuran wadah kultur
(Gunawan, 1995).
Dalam teknik kultur jaringan tanaman, cahaya dinyatakan dengan dimensi
lama penyinaran, intensitas dan kualitasnya. Prof. Murashige menyarankan untuk
21
21
merupakan pencerminan dari kebutuhan periodisitas tanaman yang bersangkutan
di lapangan. Kualitas cahaya mempengaruhi arah diferensiasi jaringan
(Yusnita, 2003).
Pengaruh intensitas cahaya terhadap pembentukan akar bergantung pada
cara pemberian cahaya tersebut. Protokorm Cymbidium yang berwarna hijau akan
membentuk akar dan tunas bila diberi intensitas cahaya 2200 sampai 2500 lux.
Namun, bila disimpan dalam gelap hanya membentuk tunas. Pembentukan akar
disini diduga ada kaitannya dengan metabolism nitrogen yang terjadi dengan
adanya cahaya. Untuk keperluan kultur jaringan cahaya putih dari lampu
flourscent dengan intensitas 1000 lux untuk fase inisiasi dan subkultur, sedangkan
untuk fase pengakaran dan persiapan planlet sebelum dilakukan aklimatisasi
menggunakan intensitas 3000 sampai 10000 lux. Intensitas yang lebih rendah
akan menghasilkan planlet yang mengalami etiolasi dengan daun yang berwarna
pucuk. Lama penyinaran yang dianjurkan adalah 16 jam per hari
(Wattimena, dkk, 1992).
Zat Pengatur Tumbuh
Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan
perkembangan kultur. Faktor yang perlu mendapat perhatian dalam penggunaan
zat pengatur tumbuh antara lain jenis zat pengatur tumbuh yang akan digunakan,
konsentrasi, urutan penggunaan, dan periode masa induksi dalam kultur tertentu
22
22
Terdapat kisaran interaksi yang luas antara kelompok auksin dengan
kelompok sitokinin. Kedua kelompok zat pengatur tumbuh tersebut berinteraksi
pula dengan senyawa-senyawa kimia lainnya dan dipengaruhi oleh faktor-faktor
lingkungan seperti cahaya dan suhu. Pada kondisi tertentu, auksin dapat bereaksi
menyerupai sitokinin atau sebaliknya. Meskipun demikian, baik auksin maupun
sitokinin, keduanya seringkali diberikan secara bersamaan pada medium kultur
untuk menginduksi pola morfogenesis tertentu, walaupun rasio yang dibutuhkan
untuk induksi perakaran maupun pucuk tidak selalu sama. Terdapat keragaman
yang tinggi antargenus, antarspesies, bahkan antar kultivar dalam hal jenis serta
takaran auksin dan sitokinin yang dibutuhkan untuk menginduksi terjadinya
morfogenesis (Kyte, 1983) dan Torres, 1989).
Pierik (1997) mengemukakan bahwa fitohormon adalah senyawa-senyawa
yang dihasilkan oleh tanaman tingkat tinggi secara endogen. Senyawa tersebut
berperan merangsang dan meningkatkan pertumbuhan serta perkembangan sel,
jaringan dan organ tanaman menuju arah diferensiasi tertentu. Senyawa-senyawa
lain yang memiliki karakteristik yang sama dengan hormone, tetapi diproduksi
secara eksogen, dikenal sebagai zat pengatur tumbuh.
Naftalen asam asetat (NAA)
Auksin adalah sekelompok senyawa yang fungsinya merangsang
pemanjangan sel-sel pucuk yang spektrum aktivitasnya menyerupai IAA
(indole-3-acetic-acid). Pierik (1997) menyatakan bahwa pada umumnya auksin
23
23
Auksin berpengaruh pula untuk menghambat pembentukan tunas adventif dan
tunas aksilar, namun kehadirannya dalam medium kultur dibutuhkan untuk
meningkatkan embriogenesis somatik pada kultur suspensi sel. Konsentrasi auksin
yang rendah akan meningkatkan pembentukan akar adventif, sedangkan auksin
konsentrasi tinggi akan merangsang pembentukan kalus dan menekan
morfogenesis (Zulkarnain, 2009).
Pertumbuhan dari kultur jaringan atau organ dan In Vitro morfogenesis
lebih dipengaruhi oleh genotipe sumber jaringan atau organ yang digunakan
dibandingkan dengan faktor lainnya. Media dan kondisi fisik lingkungan tumbuh
kultur sering kali berbeda satu genus dengan genus yang lain, atau spesies
tanaman tertentu dengan spesies lain. Tidak jarang antar varietas yang memiliki
sifat dekat namun kebutuhannya akan lingkungan dan media berbeda
(Wattimena, dkk, 1992).
NAA juga mempunyai sifat-sifat yang tidak baik juga, karena mempunyai
kisaran kepekatannya yang sempit. Batas kepekatan yang meracun dari zat ini
sangat mendekati kepekatan optimum untuk perakaran. Dengan demikian,
kita perlu waspada agar kepekatan optimum ini tidak terlampaui
(Hendaryono dan Wijayani, 1994).
Hillman menekankan tentang sulitnya menganalisa kandungan hormone
pada tunas untuk mempelajari kemungkinan korelasi antara konsentrasinya
24
24
menganalisis kandungan hormone pada tunas-tunas yang sangat kecil dan
kandungan hormonnya juga sangat rendah (Lakitan, 1996).
Benzil aminopurin (BAP)
Sifat paling karakteristik yang berkaitan dengan sitokinin adalah
perangsangan mereka terhadap pembelahan sel pada kultur jaringan tanaman. Satu
dari reaksi yang benar-benar dramatis terhadap sitokinin adalah pembentukan
organ-organ yang terjadi di bawah kondisi yang tepat dalam berbagai kultur
jaringan. Heide (1965) menemukan bahwa sitokinin-sitokinin tertentu beberapa
kali lebih efektif daripada kinetin itu sendiri pada penginduksian pembentukan
tunas dan lebih jauh bahwa spesies atau kultivar tertentu Begonia yang biasanya
tidak membentuk tunas-tunas kebetulan di daun atau berbuat demikian hanya
kadang-kadang saja, dengan pemprosesan sitokinin mengeluarkan pembentukan
tunas yang melimpah (Wilkins, 1989).
Sitokinin biasanya tidak digunakan untuk tahap pengakaran pada
mikropropogasi karena aktivitasnya yang dapat menghambat pembentukan akar,
menghalangi pertumbuhan akar, dan menghambat pengaruh auksin terhadap
inisiasi akar pada kultur jaringan sejumlah spesies tertentu. apabila ketersediaan
sitokinin di dalam medium kultur sangat terbatas maka pembelahan sel pada
jaringan yang dikulturkan akan terhambat. Akan tetapi, apabila jaringan tersebut
disubkulturkan pada medium dengan kandungan sitokinin yang memadai maka
25
25
Zat pengatur tumbuh yang diberikan harus dapat diabsorbsi dan
ditranslokasikan ke jaringan target. Hal ini tentu tergantung dari formulasi dan
konsentrasi zat pengatur tumbuh sehingga dapat dikatakan bahwa pada
konsentrasi tersebut belum dapat diabsorbsi dan ditranslokasikan oleh tanaman
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman,
Departemen Budidaya Pertanian, Fakultas Pertanian Universitas Sumatera Utara,
Medan yang dimulai pada bulan Maret sampai dengan Juni 2010.
Bahan dan Alat Penelitian
Bahan tanaman yang digunakan dalam penelitian ini adalah planlet
kantong semar. Bahan untuk media meliputi larutan stok media MS, NAA, BAP,
agar-agar, NaOH 1 N, HCl, pH meter/kertas lakmus, aluminium foil dan aquades.
Bahan sterilisasi yang digunakan dalam penelitian ini adalah alkohol 96% dan
betadine.
Alat-alat yang digunakan adalah autoklaf, Laminar Air Flow (LAF), botol
kultur, erlenmeyer, pipet skala, gelas ukur, petridis, skalpel, gunting, bunsen,
timbangan analitik, hot plate, batang pengaduk, lemari es, kertas milimeter, pinset,
oven, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial
dengan dua perlakuan, yaitu:
Faktor I : Tingkat konsentrasi Pemberian NAA dengan 4 taraf :
N0 = 0 mg/l
N1 = 0.5 mg/l
N2 = 1 mg/l
27
27
Faktor II : Tingkat Konsentrasi Pemberian BAP dengan 4 taraf :
B0 = 0 mg/l
B1 = 1 mg/l
B2 = 2 mg/l
B3 = 3 mg/l
Kombinasi perlakuan ada 16, yaitu:
N0B0 N1B0 N2B0 N3B0
N0B1 N1B1 N2B1 N3B1
N0B2 N1B2 N2B2 N3B2
N0B3 N1B3 N2B3 N3B3
Jumlah ulangan : 4 ulangan
Jumlah Kombinasi : 16 kombinasi
Jumlah Tanaman/botol : 1 tanaman
Jumlah sampel/botol : 1 tanaman
Jumlah seluruh botol : 64 botol kultur
Jumlah seluruh tanaman : 64 tanaman
Data hasil penelitian dianalisi dengan sidik ragam model linier sebagai
berikut:
28
28
Yijk = Hasil pengamatan dari konsentrasi pada taraf ke-i dan konsentrasi pada
taraf ke-j dalam ulangan ke-k
µ = Efek dari nilai tengah
αi = Efek dari konsentrasi NAA pada taraf ke-i
βj = Efek konsentrasi BAP pada taraf ke-j
(αβ)ij = Interaksi antara konsentrasi NAA dan BAP pada taraf ke-i dengan
konsentrasi BAP pada taraf ke-j
εijk = Galat dan konsentrasi NAA pada taraf ke-i dengan konsentrasi BAP
pada taraf ke-j dalam ulangan ke-k
Jika perlakuan (konsentrasi NAA, konsentrasi BAP dan interaksi) nyata
maka dilanjutkan dengan DMRT (Du n can Multiple Rang e Test) p ad a α = 5 %
PELAKSANAAN PENELITIAN
Sterilisasi Alat
Sterilisasi bermanfaat untuk membersihkan seluruh alat-alat yang
digunakan dalam kultur jaringan sehingga terbebas dari hal-hal yang dapat
menimbulkan kontaminasi. Alat-alat tersebut dicuci dengan deterjen, kemudian
dibilas dengan air, setelah itu dikeringkan. Kemudian alat seperti skalpel, pipa
skala, pinset dan cawan petri dibungkus dengan kertas, sedang untuk erlenmeyer
dan gelas ukur permukaannya ditutup dengan aluminium foil. Setelah itu, semua
botol kultur dan alat-alat dimasukkan ke dalam autoklaf pada tekanan 17,5 psi,
dengan suhu 1210C selama 60 menit. Kemudian alat-alat tersebut dimasukkan ke
dalam oven kecuali botol kultur.
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan untuk memudahkan pekerjaan dalam
membuat media. Larutan stok dibuat sesuai dengan komposisi media MS
(Lampiran. 3) yang diaduk dalam erlenmeyer dengan konsentrasi yang lebih
pekat. Setelah membuat larutan stok garam-garam, perlu dibuat stok zat pengatur
tumbuh biasanya dalam 100 ml. Stok harus disimpan di dalam lemari es.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS dengan
menggunakan dua zat pengatur tumbuh NAA dan BAP. Untuk pembuatan media
1 liter dilakukan dengan mengisi beker gelas dengan aquades steril sebanyak 300
30
30
Piridoksin-HCl, dan Tiamin-HCl sebanyak 10 ml. Kemudian ditambahkan
Myo-inositol dan sukrosa. Setelah itu, ditambahkan aquades sampai mendekati
1000 ml. Lalu, pH-nya diukur dengan menggunakan pH meter dan dilihat
angkanya. Bila pH masih dibawah 5,7 maka perlu ditambah NaOH 1 N, tetapi bila
pH sampai mencapai 6,0 (melebihi 5,8) maka ditambah HCl 1 N. Kemudian,
ditambahkan aquades hingga volume mencapai 1000 ml. Lalu ditambahkan
agar-agar. Diaduk dengan menggunakan stirer sampai mendidih dan agar-agarnya larut
semua. Larutan dituangkan ke dalam 9 botol, masing-masing botol berisi 100 ml
dan sisanya disimpan dalam lemari pendingin. Setiap botol ditambahkan zat
pengatur tumbuh NAA dan BAP sesuai dengan kombinasi perlakuan. Kemudian
setiap media perlakuan dituangkan ke dalam botol kultur sesuai dengan
kombinasinya sehingga setiap botol kultur berisi 15 ml yang telah berlabel dan
ditutup dengan aluminium foil. Media ini selanjutnya disterilkan dengan autoklaf
pada suhu 1210C, tekanan 17,5 psi, selama 30 menit. Setelah itu media diletakkan
di dalam media kultur.
Pemotongan Eksplan
Eksplan yang digunakan adalah nodus ganda yang diambil dari planlet
dengan media MS. Planlet dikeluarkan dari botol kultur dengan menggunakan
pinset setelah itu planlet dipotong-potong dengan menggunakan skalpel.
Kemudian daun yang terdapat pada nodus ganda dipotong sepertiga. Pemotongan
31
31 Penanaman Eksplan
Penanaman eksplan dilakukan di LAF yang telah disterilkan dengan
alkohol 96%. Eksplan yang telah dipotong kemudian di celupkan ke dalam larutan
betadine dan dibilas dengan aquades steril hingga bersih sebanyak tiga kali.
Eksplan yang sudah steril diletakkan di petridis. Diambil botol media lalu di
dekatkan dengan api bunsen kemudian eksplan ditanam ke dalam botol media
sesuai dengan perlakuan, setiap botol media terdapat 2 eksplan. Setelah itu botol
media dikembalikan ke dalam ruang kultur.
Pemeliharaan
Botol-botol yang telah ditanami eksplan diletakkan pada rak-rak kultur di
dalam ruang kultur. Setiap hari disemprot dengan alkohol 96% agar bebas dari
organisme yang menyebabkan terjadi kontaminasi.
Parameter Pengamatan
Persentase eksplan yang hidup (%)
Pengamatan dilakukan pada akhir penelitian dengan menghitung jumlah
eksplan yang hidup.
Persentase eksplan yang hidup = Jumlah eksplan yang hidup x 100%
Jumlah eksplan seluruhnya
Persentase eksplan membentuk tunas (%)
Pengamatan dilakukan pada akhir penelitian dengan menghitung jumlah
32
32
Persentase eksplan membentuk tunas = Jumlah eksplan yang membentuk tunas x
Jumlah eksplan seluruhnya
Jumlah tunas (buah)
Dihitung pada akhir penelitian dengan menghitung jumlah tunas yang
muncul.
Panjang tunas (cm)
Diukur pada akhir penelitian dengan menggunakan kertas milimeter mulai
dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi.
Jumlah buku (buah)
Dihitung pada akhir penelitian dengan menghitung jumlah buku yang
muncul.
HASIL DAN PEMBAHASAN
Hasil
Dari analisa data yang dilakukan, diperoleh bahwa pemberian NAA tidak
berpengaruh nyata terhadap semua parameter pengamatan, sedangkan pemberian
BAP berpengaruh nyata terhadap jumlah tunas dan tidak berpengaruh nyata
terhadap parameter pengamatan yang lain. Adapun interaksi antara NAA dan
BAP tidak berpengaruh nyata terhadap semua parameter.
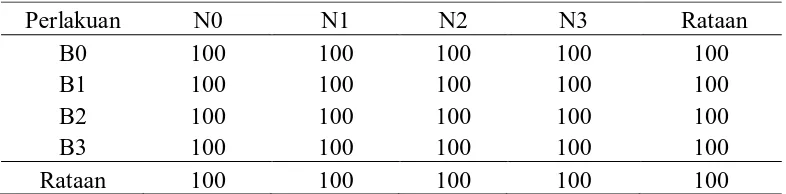
Persentase eksplan yang hidup (%)
Dari data pengamatan persentase eksplan yang hidup pada Lampiran 4,
dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua
perlakuan tidak berpengaruh nyata pada parameter persentase eksplan yang hidup.
Rataan persentase eksplan yang hidup dari perlakuan konsentrasi NAA
dan BAP dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh konsentrasi NAA dan BAP terhadap persentase ekplan yang hidup
Dari Tabel 1 dapat dilihat bahwa semua perlakuan konsentrasi NAA, BAP
dan interaksi antara kedua perlakuan tidak berpengaruh nyata terhadap persentase
34
34 Persentase eksplan membentuk tunas (%)
Dari data pengamatan persentase eksplan membentuk tunas pada
Lampiran 5, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi
antara kedua perlakuan tidak berpengaruh nyata pada parameter persentase
eksplan membentuk tunas.
Rataan persentase eksplan membentuk tunas dari perlakuan konsentrasi
NAA dan BAP dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh konsentrasi NAA dan BAP terhadap persentase eksplan
Dari Tabel 2 dapat dilihat bahwa semua perlakuan konsentrasi NAA, BAP
dan interaksi antara kedua perlakuan tidak berpengaruh nyata terhadap persentase
ekplan membentuk tunas yaitu sebesar 100%.
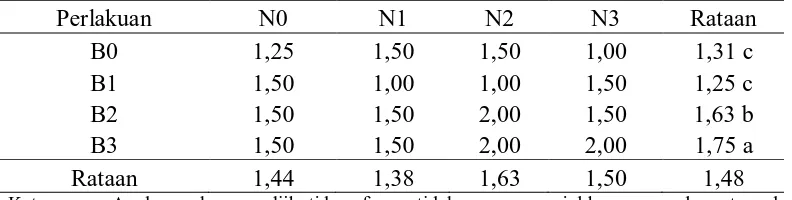
Jumlah tunas (buah)
Dari data pengamatan jumlah tunas pada Lampiran 6 dan sidik ragam pada
Lampiran 7, dapat dilihat bahwa perlakuan konsentrasi BAP berpengaruh nyata
terhadap jumlah tunas sedangkan konsentrasi NAA dan interaksi antara kedua
perlakuan tidak berpengaruh nyata pada parameter jumlah tunas.
Rataan jumlah tunas dari perlakuan konsentrasi NAA dan BAP dapat
35
35
Tabel 3. Pengaruh konsentrasi NAA dan BAP terhadap jumlah tunas
Perlakuan N0 N1 N2 N3 Rataan
B0 1,25 1,50 1,50 1,00 1,31 c
B1 1,50 1,00 1,00 1,50 1,25 c
B2 1,50 1,50 2,00 1,50 1,63 b
B3 1,50 1,50 2,00 2,00 1,75 a
Rataan 1,44 1,38 1,63 1,50 1,48
Keterangan: Angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji jarak Duncan pada taraf kepercayaan 0,05
Dari Tabel 3 dapat dilihat bahwa jumlah tunas tertinggi pada perlakuan
NAA terdapat pada N2 yaitu sebesar 1,63 buah yang tidak berpengaruh nyata
terhadap semua perlakuan dan terendah pada N1 yaitu yaitu sebesar 1,38 buah.
Pada perlakuan BAP jumlah tunas tertinggi terdapat pada B3 yaitu sebesar
1,75 buah yang berpengaruh nyata terhadap semua perlakuan dan terendah pada
B1 yaitu yaitu sebesar 1,25 buah.
Pengaruh konsentrasi BAP pada jumlah tunas dapat dilihat pada
Gambar 1.
36
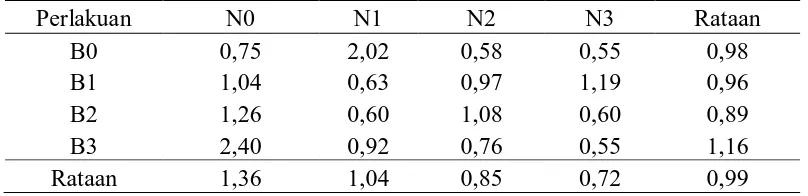
36 Panjang tunas (cm)
Dari data pengamatan panjang tunas pada Lampiran 8 dan sidik ragam
pada Lampiran 9, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan
interaksi antara kedua perlakuan tidak berpengaruh nyata pada parameter panjang
tunas.
Rataan panjang tunas dari perlakuan konsentrasi NAA dan BAP dapat
dilihat pada Tabel 4.
Tabel 4. Pengaruh konsentrasi NAA dan BAP terhadap panjang tunas
Perlakuan N0 N1 N2 N3 Rataan
Dari Tabel 4 dapat dilihat bahwa panjang tunas terpanjang pada perlakuan
NAA terdapat pada N0 yaitu sebesar 1,36 cm yang tidak berpengaruh nyata
terhadap semua perlakuan dan terendah pada N3 yaitu sebesar 0,72 cm.
Pada perlakuan BAP panjang tunas terpanjang pada perlakuan B3 yaitu
sebesar 1,16 cm yang tidak berpengaruh nyata terhadap semua perlakuan dan
terendah pada B2 yaitu sebesar 0,89.
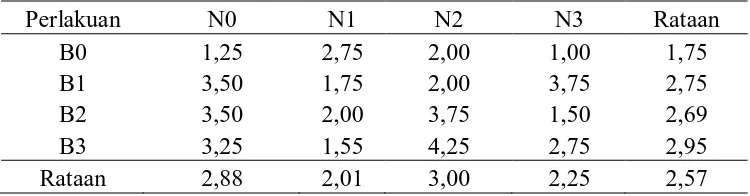
Jumlah buku (buah)
Dari data pengamatan jumlah buku pada Lampiran 10 dan sidik ragam
37
37
interaksi antara kedua perlakuan tidak berpengaruh nyata pada parameter jumlah
buku.
Rataan jumlah buku dari perlakuan konsentrasi NAA dan BAP dapat
dilihat pada Tabel 5.
Tabel 5. Pengaruh konsentrasi NAA dan BAP terhadap jumlah buku
Perlakuan N0 N1 N2 N3 Rataan
Dari Tabel 5 dapat dilihat bahwa jumlah buku tertinggi pada perlakuan
NAA terdapat pada N2 yaitu sebesar 3,00 buah yang tidak berpengaruh nyata
terhadap semua perlakuan dan terendah pada N1 yaitu sebesar 2,01 buah.
Pada perlakuan BAP jumlah buku tertinggi pada perlakuan B3 yaitu
sebesar 2,95 buah yang tidak berpengaruh nyata terhadap semua perlakuan dan
terendah pada B0 yaitu sebesar 1,75 buah.
Pembahasan
Pengaruh NAA terhadap mikropropogasi kantung semar
Dari hasil analisis data diketahui bahwa pemberian NAA tidak
berpengaruh nyata terhadap semua peubah amatan seperti persentase eksplan yang
hidup, persentase eksplan membentuk tunas, jumlah tunas, jumlah buku, dan
panjang tunas. Hal ini diduga karena NAA bekerja pada kisaran konsentrasi yang
38
38
diberikan kepada eksplan melebihi batas kepekatan maka NAA akan menjadi
racun bagi tanaman karena mendekati kepekatan optimum perakaran sehingga
pertumbuhan dari tunas akan terhambat. Hendaryono dan Wijayani (1994) NAA
juga mempunyai sifat-sifat yang tidak baik juga, karena mempunyai kisaran
kepekatannya yang sempit. Batas kepekatan yang meracun dari zat ini sangat
mendekati kepekatan optimum untuk perakaran. Dengan demikian, kita perlu
waspada agar kepekatan optimum ini tidak terlampaui. Selain itu, diduga karena
konsentrasi NAA yang diberikan belum tepat sehingga belum memberikan
pengaruh yang nyata terhadap eksplan yang dikulturkan. Gunawan (1992)
menyatakan faktor yang perlu mendapat perhatian dalam penggunaan zat pengatur
tumbuh antara lain jenis zat pengatur tumbuh yang digunakan, konsentrasi, urutan
penggunaan dan periode masa inkubasi dalam kultur tertentu. .
Pengaruh BAP terhadap mikropropogasi kantung semar
Dari hasil analisis data diketahui bahwa pemberian BAP berpengaruh
nyata terhadap jumlah tunas dan tidak berpengaruh nyata terhadap peubah amatan
yang lain seperti persentase eksplan yang hidup, persentase eksplan membentuk
tunas, jumlah buku, dan panjang tunas. BAP berpengaruh nyata terhadap jumlah
tunas, dikarenakan BAP yang diberikan kepada eksplan masih bisa diabsorbsi dan
ditranslokasikan ke jaringan sehingga proses pembentukan tunas berjalan dengan
baik. Namun, disisi lain pemberian BAP tidak menampakkan pengaruhnya
terhadap peubah amatan yang lain, hal ini diduga karena eksplan belum dapat
39
39
pertumbuhan dan perkembangan tanaman ada yang terhambat. Wattimena, dkk
(1992) menyatakan zat pengatur tumbuh yang diberikan harus dapat diabsorbsi
dan ditranslokasikan ke jaringan target. Hal ini tentu tergantung dari formulasi
dan konsentrasi zat pengatur tumbuh sehingga dapat dikatakan bahwa pada
konsentrasi tersebut belum dapat diabsorbsi dan ditranslokasikan oleh tanaman
untuk pertumbuhan dan perkembangan.
Pengaruh interaksi konsentrasi NAA dan BAP terhadap mikropropogasi kantung semar
Dari hasil analisis data diketahui bahwa interaksi NAA dan BAP tidak
berpengaruh nyata terhadap seluruh parameter pengamatan seperti persentase
eksplan yang hidup, persentase eksplan membentuk tunas, jumlah tunas, jumlah
buku, dan panjang tunas. Hal ini diduga karena interaksi konsentrasi NAA dan
BAP yang diberikan belum mampu mencapai taraf keseimbangan untuk
pertumbuhan dan morfogenesis tanaman. Wattimena (1992) menyatakan bahwa di
dalam kultur jaringan morfogenesis dari eksplan selalu tergantung dari interaksi
antara auksin dan sitokinin. Perlu diperhatikan bahwa apa yang digambarkan
tentang pengaruh interaksi auksin dan sitokinin merupakan gambaran kasar.
Interaksi yang ditemukan dalam praktek pada umumnya lebih kompleks.
Konsentrasi yang diperlukan dari masing-masing ZPT tersebut
(auksin dan sitokinin) tergantung dari jenis eksplan, genotipa, kondisi kultur serta
jenis sitokinin dan auksin yang dipergunakan. Selain itu, pada keadaan tertentu
40
40
pertumbuhan dan perkembangan eksplan menjadi terhambat. Didukung juga oleh
George dan Sherrington (1984) sitokinin biasanya tidak digunakan untuk tahap
pengakaran pada mikropropogasi karena aktivitasnya yang dapat menghambat
pembentukan akar, menghalangi pertumbuhan akar, dan menghambat pengaruh
KESIMPULAN DAN SARAN
Kesimpulan
1. Perlakuan konsentrasi NAA tidak berpengaruh nyata terhadap jumlah
tunas dan jumlah buku pada mikropropogasi tunas kantong semar.
2. Perlakuan konsentrasi BAP berpengaruh nyata terhadap jumlah tunas
sedangkan terhadap jumlah buku tidak berpengaruh nyata pada
mikropropogasi tunas kantong semar.
3. Interaksi antara konsentrasi NAA dan BAP tidak berpengaruh nyata
terhadap jumlah tunas dan jumlah buku pada mikropropogasi tunas
kantong semar.
Saran
Perlu dilakukan penelitian lanjutan dengan menggunakan konsentrasi dan
zat pengatur tumbuh yang berbeda untuk melihat pengaruh yang paling baik
DAFTAR PUSTAKA
Cheek, M. Dan M. Jebb. 2001. Flora Malesiana Series I. Seed Plants. Volume 15. National Herbarium Netherland, Universitas Leiden Branch. Netherland.
Dwidjoseputro, D. 1981. Pengantar Fisiologi Tumbuhan. Penerbit PT Gramedia: Jakarta.
Ekawati, E. 2010. Modul Pjj Teknik Mikropropagasi Tanaman Perkebunan Bidang Peminatan Kultur Jaringan Tanaman. http://www.panpandiz.co.cc/2009/05/modul-pjj-teknik-mikropropagasi
tanaman.html. Diakses tanggal 19 Januari 2010.
Gardner, F. B., R.B. Pearce dan R. Mitchell, 1991. Fisiologi Tanaman Budidaya. Terjemahan H. Susilo dan Subiyanto. UI Press: Jakarta.
George, E.F and P.D. Sherrington. 1984. Plant Propagation by Tissue Culture, Handbook and Directory of Comercial Laboratoryes. Easter Press, England.
Gunawan, L.W. 1995. Teknik Kultur Jaringan In Vitro dalam Hortikultura. Penebar Swadaya: Jakarta.
Hartmann, H.T., D.E. Kester, F.T. Davies and R.L. Geneve. 2002. Plant Propagation Principles and Practiese, 6th Ed. New Delhi: Prentice Hall of Insia Private Limited.
Hendaryono, D.P.S. dan A. Wijayani. 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan secara vegetatip. Jogjakarta: Kanisius.
Hernawati dan Akhriadi. 2006. A File Guide to The Nepenthes of Sumatera. Jawa Barat. Indonesia. Sumatera Nature Study. pp.
Lakitan, B. 1995. Fisiologi Pertumbuhan dan Perkembangan Tanaman. RajaGrafindo Persada: Jakarta.
Mansur, M. 2006. Nepenthes Kantong Semar Yang Unik. Penebar Swadaya: Jakarta.
Penebar Swadaya. 2006. Trubus Info Kit, Nepenthes. Volume 05, Depok. Trubus. Penebar Swadaya: Jakarta.
32
32
Salisbury, F.B. dan Ross, W.C., 1995. Fisiologi Tumbuhan Jilit Tiga. Penerjemah. Lukman, D. R. Dan Sumaryono. Penerbit ITB: Bandung.
Soeryowinoto, M. 1996. Pemuliaan Tanaman Secara In Vitro. Kanisius: Jogjakarta.
Steel, R.G.D dan J.H. Torrie. 1995. Prinsip dan Prosedur Statistik. Gramedia, Pustaka Utama, Jakarta.
Sulaiman, A.H. 1996. Dasar-Dasar Biokimia untuk Pertanian, USU-Press, Medan.
Wattimena, dkk. 1992. Bioteknologi Tanaman. Laboratorium Kultur Jaringan Tanaman, Pusat Antar Spesies, IPB, Bogor.
Wilkins, M.B., 1992. Fisiologi Tanaman. Penerjemah Sutedjo M.M dan Kartasapoetra A.G. penerbit Bumi Aksara: Jakarta.
Yusnita, 2003. Kultur Jaringan. Cara Memperbanyak Tanaman Secara Efisien. Agromedia Pustaka: Jakarta.
Yuwono, T. 2008. Bioteknologi Pertanian. Gadjah Mada University Press: Yogyakarta.