EKSPRESI GEN
HEAT SHOCK PROTEIN
70 DAN
GLUTATHIONE
PEROXIDASE
DENGAN SUPLEMENTASI SELENIUM DAN
PENGARUHNYA TERHADAP PRODUKTIVITAS
BROILER DI DAERAH TROPIS
ROBI AMIZAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGO
RPERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Ekspresi Gen Heat Shock Protein 70 dan Glutathione Peroxidase dengan Suplementasi Selenium dan Pengaruhnya terhadap Produktivitas Broiler di Daerah Tropis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ROBI AMIZAR. Ekspresi Gen Heat Shock Protein 70 dan Glutathione Peroxidase dengan Suplementasi Selenium dan Pengaruhnya terhadap Produktivitas Broiler di Daerah Tropis. Dibimbing oleh RITA MUTIA, SRI SUHARTI dan JAKARIA.
Indonesia merupakan negara tropis dengan rata-rata suhu 23 oC - 33 oC dan kelembaban 45-97% (BMKG 2012). Kondisi tersebut merupakan kondisi yang dapat memicu cekaman panas (heat stress) dan kurang ideal bagi pertumbuhan ayam broiler. Perkembangan strain broiler baru-baru ini merupakan hasil seleksi intensif yang memiliki pertumbuhan yang cepat dan harus dipelihara pada suhu nyaman. Salah satu cara untuk meningkatkan kinerja produksi broiler adalah melalui penerapan pendekatan nutrigenomik yaitu dengan mengoptimalkan penggunaan nutrien pakan pada broiler yang mempengaruhi ekspresi gen untuk mengoptimalkan produktivitas broiler. Selenium merupakan nutrien trace mineral yang memiliki efek antioksidan. Selenium yang ditambahkan bisa dalam bentuk inorganik dan organik. Selenium organik dapat diserap dengan efisien oleh tubuh, karena merupakan komponen fungsional selenoprotein tubuh serta asam amino dan penyerapannya lebih tinggi di bandingkan selenium inorganik (Payne dan Southern 2005). Suplementasi selenium dalam ransum broiler dengan kemampuan antioksidannya mampu mengurangi efek stres panas. Tujuan dari penelitian ini adalah untuk menganalisis ekspresi gen Heat Shock Protein 70 (HSP70) dan Glutathione Peroxidase (GPX) pada broiler yang disuplementasi selenium dan pengaruhnya terhadap aktivitas enzim glutation peroksidase (GSH-Px), kadar malondialdehid (MDA) dan performa broiler yang dipelihara di daerah tropis.
Penelitian menggunakan day old chick (DOC) broiler sebanyak 120 ekor strain Cobb (CP 707), dipelihara pada kandang sistem litter beralaskan sekam padi selama 5 minggu. Percobaan dilakukan dengan menggunakan rancangan acak lengkap dengan tiga perlakuan dan empat ulangan. Perlakuan yang diberikan yaitu suplementasi 0.30 ppm selenium dalam ransum dengan rincian 1) ransum basal tidak disuplementasi selenium dan broiler dipelihara di kandang suhu nyaman (25.0 oC-27.9 oC) menggunakan AC (AC), 2) ransum basal tidak disuplementasi selenium dan broiler dipelihara pada kandang suhu tropis (24.6
o
C-32.9 oC) (NS), 3) ransum basal disuplementasi 0.30 ppm selenium dan broiler dipelihara pada kandang suhu tropis (24.6 oC-32.9 oC) (PS). Selenium yang digunakan merupakan selenium organik (Optimin®SeY, Nutreco). Parameter yang diukur adalah ekspresi gen HSP70, ekspresi gen GPX, aktivitas enzim GSH-Px, kadar MDA dan performa broiler. Data dianalisis dengan analisis ragam dan perbedaan antar perlakuan ditentukan dengan uji Duncan.
aktifitas enzim GSH-Px, kadar MDA serta memperbaiki performa broiler mendekati broiler yang dipelihara di suhu nyaman yang ditunjukkan dengan perbaikan konsumsi ransum, bobot badan, pertambahan bobot badan dan konversi ransum.
SUMMARY
ROBI AMIZAR. The Expression of Heat Shock Protein 70 and Glutathione Peroxidase Gene with Selenium Supplementation and Its Effect on Productivity of Broiler in Tropical Environment. Supervised by RITA MUTIA, SRI SUHARTI and JAKARIA.
Indonesia is a tropical country with an average temperature of 23 °C - 33 °C and humidity of 45-97% (BMKG 2012). The temperature and humidity have an impact on performance of broiler chickens. Heat stress is triggered by changes in ambient temperature. Heat stress can affect the productivity of broiler chickens. The newest strains of broiler chickens are the result of intensive selection with rapid growth ability which must be maintained at comfortable temperature. New possibilites for improving the performance of broiler production through the application of nutrigenomics approach to optimize the use of broiler chickens nutrients. Generally, nutrigenomic covers the nutrient development with affects expression of genes thus nutrigenomics of broiler should focusing on optimizing feed for broiler productivity. Selenium is an trace mineral which has antioxidant effect. Supplementation of organic selenium in broiler ration related with its antioxidant activity could reduce the effect of heat stress. The purpose of this experiment was to study the supplementation of selenium on expression of heat shock protein 70 (HSP70) and glutathione peroxidase (GPX) gene, glutathione peroxidase (GSH-Px) enzyme activity, malondialdehyde (MDA) and productivity (feed intake, body weight, body weight gain, feed conversion ratio and mortality) of broiler in tropical environment.
The experiment was conducted using completely randomized designs with three treatments and four replications. The treatments in this experiment were: comfortable environment pens (25.0 oC-27.9 oC) using air conditioner without supplementation of selenium (AC), tropical environment pens (24.6 oC-32.9 oC) without supplementation of selenium (NS), and tropical environment pens (24.6 oC-32.9 oC) with supplementation of 0.30 ppm selenium (organic selenium (Optimin®SeY, Nutreco)) (PS). Each of treatment consisted of 40 day old chicks (DOC) strain Cobb (unsex). Parameters observed were HSP70 and GPX gene expression, GSH-Px enzyme activity, MDA and the productivities.
The results showed that supplementation of organic selenium significantly increased (P<0.05) feed intake, body weight, body weight gain, and feed conversion ratio. By contrast, the expression of HSP70 and GPX gene, GSH-Px enzyme activity and MDA of broiler significantly decreased (P<0.05) in the tropical pens with organic selenium supplementation compared to the treatment without organic selenium supplementation. It is concluded that supplementation of 0.30 ppm organic selenium in broiler ration in tropical environment improved modulating the expression of HSP70 and GPX gene, and showed similar performance to broiler which kept in the comfortable environment without organic selenium supplementation by reduces oxidative stress in broiler which kept in tropical environment.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
EKSPRESI GEN
HEAT SHOCK PROTEIN
70 DAN
GLUTATHIONE
PEROXIDASE
DENGAN SUPLEMENTASI SELENIUM DAN
PENGARUHNYA TERHADAP PRODUKTIVITAS
BROILER DI DAERAH TROPIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
HALAMAN PENGESAHAN
Judul Tesis : Ekspresi Gen Heat Shock Protein 70 dan Glutathione Peroxidase dengan Suplementasi Selenium dan Pengaruhnya terhadap Produktivitas Broiler di Daerah Tropis
Nama : Robi Amizar NIM : D251120141
Disetujui oleh Komisi Pembimbing
Dr Ir Rita Mutia, MAgr Ketua
Dr Sri Suharti, SPt MSi Anggota
Dr Jakaria, SPt MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi dan Pakan
Dr Ir Dwierra Evvyernie A, MS MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2013 sampai dengan bulan November 2013 ini ialah ketahanan pangan, dengan judul Ekspresi Gen Heat Shock Protein 70 dan Glutathione Peroxidase dengan Suplementasi Selenium dan Pengaruhnya terhadap Produktivitas Broiler di Daerah Tropis.
Terima kasih penulis ucapkan kepada Dr Ir Rita Mutia MAgr, Dr Sri Suharti SPt MSi dan Dr Jakaria SPt MSi selaku pembimbing yang telah banyak memberi bimbingan, saran, waktu dan tenaga sehingga tesis ini dapat diselesaikan. Penulis mengucapkan terima kasih kepada Dr Ir Dwierra Evvyernie A Ms MSc sebagai ketua program studi Ilmu Nutrisi dan Pakan Pascasarjana IPB dan Dr Ir Sumiati MSc sebagai wakil program studi Ilmu Nutrisi dan Pakan Pascasarjana IPB sekaligus sebagai penguji luar komisi, Ibu Lanjarsih di Laboratorium Ilmu Nutrisi Ternak Unggas, Eryk Andreas SPt MSi di Laboratorium Genetika Molekuler Ternak. Penulis juga mengucapkan terima kasih kepada seluruh staf, dosen, teknisi, rekan sepenelitian (Raymundus Genty Laras), kepada teman-teman mahasiswa pascasarjana INP angkatan 2012, dan kepada seluruh teman yang telah berkontribusi dalam proses penyelesain tesis ini. Ungkapan terima kasih juga disampaikan kepada papa, mama, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat untuk kita semua dan bagi perkembangan ilmu pengetahuan selanjutnya.
DAFTAR ISI
DAFTAR TABEL xviii
DAFTAR GAMBAR xviii
DAFTAR LAMPIRAN xix
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Manfaat 3
METODOLOGI PENELITIAN 4
Waktu dan Lokasi 4
Materi 4
Metode 6
HASIL DAN PEMBAHASAN 10
Suhu dan Kelembaban 10
Kuantifikasi Ekspresi Gen Heat Shock Protein 70 (HSP70) 12 Kuantifikasi Ekspresi Gen Glutathione Peroxidase (GPX) 14 Aktifitas Enzim Glutation Peroksidase (GSH-Px) 15
Kandungan Malondialdehid (MDA) 17
Performa Broiler 18
SIMPULAN 20
UCAPAN TERIMA KASIH 20
DAFTAR PUSTAKA 20
LAMPIRAN 25
DAFTAR TABEL
1 Susunan dan kandungan nutrien ransum basal periode starter dan
finisher 5
2 Hasil analisis pakan ransum basal (as fed) 5
3 Rataan suhu dan kelembaban (RH) harian di kandang percobaan selama
penelitian 10
4 Pengaruh penambahan selenium organik terhadap aktifitas enzim
GSH-Px dan kandungan MDA ayam broiler percobaan 15
5 Performa broiler pada percobaan pemberian selenium pada ayam umur
35 hari (5 minggu) 19
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi HSP70
otak 25
2 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi HSP70 otak 25 3 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi HSP70
dada 25
4 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi HSP70 dada 25 5 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi GPX
otak 25
6 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi GPX otak 26 7 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi GPX
dada 26
8 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi GPX dada 26 9 Hasil analisis sidik ragam pengaruh perlakuan terhadap aktifitas enzim
GSH-Px 26
10 Uji lanjut Duncan pengaruh perlakuan terhadap aktifitas enzim GSH-Px 26 11 Hasil analisis sidik ragam pengaruh perlakuan terhadap kandungan
MDA 27
12 Uji lanjut Duncan pengaruh perlakuan terhadap kandungan MDA 27 13 Hasil analisis sidik ragam pengaruh perlakuan terhadap konsumsi
ransum 27
1
PENDAHULUAN
Latar Belakang
Peningkatkan produktivitas ayam broiler atau dikenal dengan ayam ras tipe pedaging, merupakan proses yang berkesinambungan yang melibatkan penerapan penemuan lama maupun baru dalam ilmu perunggasan. Perkembangan ilmu pengetahuan baru-baru ini terutama dalam bidang genetika molekuler telah membuka kemungkinan baru untuk meningkatkan kinerja produksi broiler melalui penerapan pendekatan genomik dalam seleksi broiler untuk melakukan perbaikan genetik secara permanen melalui pendekatan pemuliaan dan aplikasi penelitian nutrigenomik untuk mengoptimalkan penggunaan pakan atau nutrisi pada broiler.
Nutrigenomik (nutritional genomics) didefinisikan sebagai studi tentang hubungan antara nutrien dan ekspresi gen pada tingkat molekular (Rimbach et al. 2005). Nutrigenomik secara luas adalah mencakup pengembangan pakan yang mempengaruhi ekspresi gen sehingga nutrigenomik pada broiler harus berkonsentrasi pada pakan untuk mengoptimalkan produktivitas broiler khususnya yang meliputi pertumbuhan, efisiensi dan karakteristik produksi lainnya. Hal ini sangat penting karena terkait erat dengan penerapan manajemen baru dalam pemberian pakan pada broiler yang didasarkan pada penelitian nutrigenomik.
Pemanasan global (global warming) yang terjadi saat ini, lambat laun akan berdampak terhadap kinerja broiler di Indonesia, karena broiler yang telah dibentuk (galur/strain) saat ini dengan pertumbuhan cepat membutuhkan suhu lingkungan pemeliharaan yang ideal. Pertumbuhan cepat pada broiler memberikan dampak terhadap laju metabolisme yang tinggi, sehingga diperlukan treatment antioksidan dan pengkondisian suhu untuk mengurangi cekaman panas pada kondisi lingkungan tropis seperti Indonesia. Pendekatan secara fisik untuk pengkondisian suhu telah diupayakan untuk menanggulangi terhadap cekaman panas yaitu dengan pemeliharaan menggunakan kandang tertutup (closed house). Sementara sebagian besar peternakan broiler di Indonesia sebagian besar berbasis pada kandang terbuka yang merugikan peternak karena pertumbuhan ayam tidak optimal dan hanya sebagian kecil menggunakan closed house dengan biaya tinggi, sehingga memerlukan investasi yang sangat mahal.
2
fisiologis dan sistem kekebalan/imun pada broiler. Menurut Mujahid et al. (2009) paparan suhu lingkungan yang tinggi merupakan perhatian utama bagi industri perunggasan, khususnya pada daerah tropis. Berbagai strategi yang telah dilakukan dari sisi nutrisi, seperti tingkat kecernaan tinggi dan kepadatan nutrien dari pakan yang dikonsumsi ternak, menambahkan lemak sebagai sumber energi, penambahan asam amino yang seimbang, vitamin-vitamin dan mineral-mineral anti stres juga glukosa yang dikombinasikan berdasarkan tipe unggas, umur unggas, level produksi, panjang dan intensitas paparan panas, dan status kesehatan unggas tersebut, namun hasilnya masih belum optimal.
Hasil penelitian Al-fataftah dan Abu-Dieyeh (2007) menunjukkan bahwa broiler yang dipelihara dalam kondisi nyaman menunjukkan nilai konversi pakan yang lebih baik dibandingkan dengan broiler yang dipelihara dikandang suhu tidak ideal (panas) dengan rataan bobot badan yang dihasilkan yaitu 200 g lebih tinggi dari kondisi panas. Hal ini menunjukkan bahwa lingkungan yang tidak ideal (panas) berdampak terhadap penurunan produktifitas dan efisiensi pakan. Selain itu, upaya menanggulangi cekaman panas pada broiler secara intensif juga telah dilakukan dengan treatment antioksidan yaitu pemberian selenium di dalam ransum yang diduga kuat sangat berpengaruh untuk menghindari cekaman suhu panas.
Selenium merupakan mineral antioksidan yang ditambahkan dalam ransum yang dapat memperbaiki performa broiler. Selenium yang ditambahkan bisa dalam bentuk inorganik dan organik. Selenium inorganik yaitu sodium selenite, sodium hydrogen selenit dan sodium selenate, sedangkan selenium organik yaitu Se-enriched yeast (Se-yeast) dan seleno-amino acid, L-selenomethionine (SeMet). Selenium organik dapat diserap dengan efisien oleh tubuh, karena merupakan komponen fungsional selenoprotein tubuh serta asam amino dan penyerapan selenium organik lebih tinggi di bandingkan selenium inorganik (Payne dan Southern 2005).
Suplementasi minimum selenium yang direkomnedasikan oleh NRC untuk broiler adalah 0.15 ppm (NRC 1994). Menurut Leeson dan Summers (2001) suppementasi selenium yang disarankan untuk broiler adalah 0.15-0.20 ppm. Namun kebutuhan selenium untuk broiler di daerah tropis membutuhkan level yang lebih tinggi. Deniz et al. (2005) menyatakan penambahan selenium organik sebanyak 0.30 ppm pada broiler mampu memperbaiki performa dengan meningkatkan bobot badan, kualitas daging dan memperbaiki konversi ransum. Dengan penambahan 0.30 ppm selenium organik dapat memperbaiki performa broiler yang dipelihara dalam kondisi stres panas (Lagana et al. 2007; Khajali et al. 2010). Selenium bekerja sebagai antioksidan karena memiliki peran penting dalam sistem pertahanan antioksidan seluler dalam jaringan dan merupakan bagian dari enzim glutation peroksidase (GSH-Px) yang mendetoksifikasi H2O2
3
bebas. Menurut Leeson et al. (2008) pemberian selenium organik 0.30 mg/kg mampu menurunkan kadar MDA jaringan pada ayam.
Dari segi genetik, gen-gen dapat diaktifkan dan dinonaktifkan sesuai dengan sinyal metabolik yang diterima dari faktor internal seperti hormon dan faktor eksternal seperti nutrisi yang sangat berpengaruh. Banyak komponen pakan sebagai faktor eksternal dapat merubah proses genetik yang tentunya akan mempengaruhi kondisi performa dan kesehatan ternak. Komponen-komponen esensial dan nonesensial bioaktif makanan berpengaruh terhadap sejumlah proses seluler yang terkait dengan kesehatan dan pencegahan penyakit, termasuk metabolisme karsinogen, keseimbangan hormon, sinyal sel, kontrol siklus sel, apoptosis, dan angiogenesis. Komponen bioaktif makanan tersebut sering memodifikasi beberapa proses secara bersamaan (Daghir 1995).
Perlakuan terhadap penambahan antioksidan berupa selenium pada pakan broiler sebagai upaya untuk mengurangi cekaman terhadap suhu tinggi menjadi penting dilakukan jika dikaitkan dengan mekanisme aktivitas metabolisme di dalam tubuh terutama terkait dengan gen-gen yang secara langsung berpengaruh terhadap respon tersebut seperti gen heat shock protein 70 (HSP70) dan gen glutathione peroxidase (GPX). Gen HSP70 memiliki peran penting dalam biologi sel dan biokimia dan sebagai chaperone, yang dikodekan oleh anggota keluarga multigene, yang berperan dalam merespon terhadap cekaman suhu panas (Bukau dan Horwich 1998), sedangkan gen glutathione peroxidase (GPX) merupakan gen yang berperan penting dalam pertahanan antioksidan dan berkaitan dengan status selenium pada ternak atau sel (Sunde et al. 1997), yang digunakan sebagai indikator biokimia terhadap kebutuhan selenium oleh tubuh (Thomson 2004). Penelitian molekuler tentang pengaruh nutrisi terhadap respon gen/DNA tertentu (nutrigenomik) pada broiler di Indonesia terutama kaitannya dengan penambahan selenium belum pernah ada laporan.
Tujuan
Penelitian ini bertujuan untuk menganalisis ekspresi gen HSP70 dan GPX pada broiler yang disuplementasi selenium dan pengaruhnya terhadap aktivitas enzim glutation peroksidase (GSH-Px), malondialdehid (MDA) dan produktivitas pada broiler yang dipelihara di lingkungan tropis.
Manfaat
4
METODOLOGI PENELITIAN
Waktu dan Lokasi
Penelitian ini dilakukan pada bulan Juni 2013 hingga November 2013. Pemeliharaan broiler dilakukan di Laboratorium Lapang (Kandang C) Fakultas Peternakan Institut Pertanian Bogor (IPB), analisa nutrisi dilakukan di Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB, analisa genetik dilakukan di Laboratorium Genetika Molekuler Ternak Fakultas Peternakan IPB, analisa enzim GSH-Px dan MDA dilakukan di Laboratorium Fisiologi Departemen Anatomi Fisiologi Farmakologi Fakultas Kedokteran Hewan IPB, dan analisa kandungan selenium dilakukan di Balai Besar Industri Agro (BBIA) Bogor.
Materi Ternak
Penelitian ini menggunakan day old chick (DOC) ayam broiler sebanyak 120 ekor strain Cobb dengan merk dagang CP 707 (unsex) produksi PT Charoen Pokphand Jaya Farm. Rata-rata bobot badan DOC yaitu ± 37 g.
Kandang dan Peralatan
Kandang yang digunakan yaitu kandang sistem litter beralaskan sekam padi. Ada 2 jenis desain kandang yang digunakan yaitu kandang kontrol (kandang A) yang merupakan kandang suhu nyaman menggunakan air conditioner (AC) dan kandang tropis (kandang B dan C) yang merupakan kandang diatas zona nyaman (± 30 oC). Kandang A merupakan kandang yang tertutup yang memiliki ukuran kandang 1.5 x 1.5 m sebanyak 4 petak, menggunakan exhaust fan dan AC. Suhu kandang A diatur menggunakan AC pada setingan 22 oC pada saat ayam umur 3 minggu (Effendi 2010). Kandang B dan C menggunakan tirai yang tidak tertutup sepenuhnya sehingga memungkinkan terjadinya pertukaran udara dengan lancar dan ukuran kandang ini 1.5 x 1.5 m sebanyak 8 petak. Kandang A, B dan C pada masing-masing petak dilengkapi dengan tempat makan dan tempat air minum. Peralatan lain yang digunakan adalah brooder (pemanas), timbangan, tirai, sapu, dan thermohigrometer.
Ransum
5
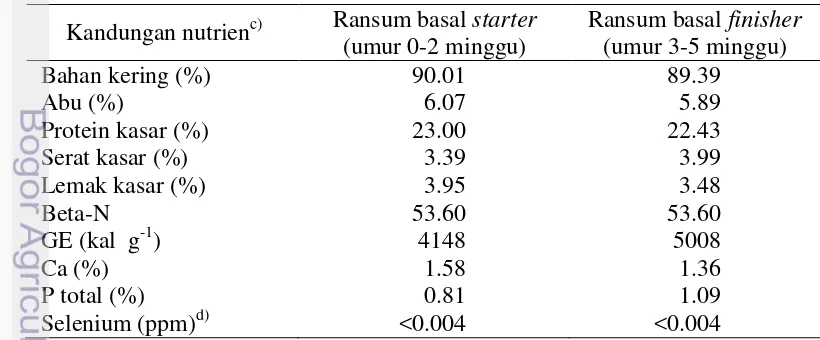
Tabel 1 Susunan dan kandungan nutrien ransum basal periode starter dan finisher Bahan pakan Ransum starter
(umur 0-2 minggu)
Methionin+Cystin (%) 0.96 0.86
Ca (%) 1.17 0.93
P tersedia (%) 0.73 0.45
Na (%) 0.28 0.27
Selenium (ppm) 0.23 0.20
a)
premix (dalam mg/kg premix): vit A 1200000 IU; vit D3 200000 IU; vit E 800; vit K 200; vit B1 200; vit B2 500; vit B6 50; vit B121200µg; vit C 2500; Ca-D pantothenate 600; niacin 4000; choline chloride 1000; methionine 3000; lysine 3000; manganese 12000; iron 2000; iodine 20; zinc 10000; cobalt 20; copper 400; santoquin 1000; zinc bacitracin 2100. b) Hasil hitungan berdasarkan Leeson dan Summers (2005), CGM: corn gluten meal, DCP: dicalcium phosphate, EM: energi metabolis, Ca: calcium, P: phosphor, Na: natrium.
Tabel 2 Hasil analisis pakan ransum basal (as fed) Kandungan nutrienc) Ransum basal starter
(umur 0-2 minggu)
Selenium (ppm)d) <0.004 <0.004
c
6
Metode
Perlakuan Penelitian
Penelitian ini terdiri dari 3 perlakuan dan 4 ulangan. Setiap unit percobaan menggunakan 10 ekor DOC. Perlakuan yang digunakan adalah :
AC : ransum basal (kontrol positif: ransum tidak disuplementasi selenium dan broiler dipelihara di suhu nyaman, pada kandang kontrol yang menggunakan AC).
NS : ransum basal (kontrol negatif: ransum tidak disuplementasi selenium dan broiler dipelihara pada kandang suhu tropis).
PS : ransum basal (ransum disuplementasi selenium 0.30 ppm dan broiler dipelihara pada kandang suhu tropis).
Pemeliharaan Ayam Penelitian
Pemeliharaan broiler selama penelitian dilakukan pada dua temperatur yang berbeda. Broiler sebagai kontrol ditempatkan pada suhu thermonetral zone (suhu nyaman: 19 oC-27 oC), penyetingan AC dimulai ketika broiler berumur 3 minggu. Broiler perlakuan diletakkan pada kandang tropis yang memiliki suhu yang berfluktuasi antara pagi, siang dan sore atau malam (kisaran suhu tropis 23 oC - 33
o
C). Pengukuran suhu dilakukan pada pagi hari pukul 07.00 WIB, siang hari pukul 13.00 WIB dan sore hari pukul 17.00 WIB. Pakan perlakuan mulai diberikan pada broiler umur 3 minggu dan pemberian makan beserta minum broiler selama penelitian dilakukan secara ad libitum.
Peubah yang Diukur
Beberapa peubah yang diamati yaitu : a. Kuantifikasi mRNA HSP70 dan GPX
Pengambilan sampel dilakukan dengan cara menyembelih 2 ekor broiler di akhir penelitian (umur 5 minggu) pada setiap perlakuan dan ulangan, penyembelihan broiler dilakukan di waktu siang hari pukul 12.00-14.00 WIB. Sampel otak dan otot dada diambil kemudian disimpan dalam tabung 1.5 ml yang berisi RNA Later sebanyak 500 µL. Selanjutnya disimpan pada suhu -20 0C yang selanjutnya akan digunakan untuk analisa ekspresi gen. Tahapan untuk analisis kuantifikasi ekspresi gen adalah sebagai berikut:
1. Isolasi dan Estraksi RNA
7
12000 rpm dan bagian supernatan dipindahkan ke dalam tabung baru dan ditambahkan 450 µl etanol dan dicampur dengan pipeting. Selanjutnya larutan dipindahkan ke tabung kolom dan disentrifus 12000 rpm selama 1 menit. Larutannya dibuang, kemudian ditambahkan 700 µl wash buffer 1 (yang berisikan etanol) ke dalam kolom dan disentrifus 12000 rpm selama 1 menit, larutannya dibuang kemudian ditambahkan 600 µl washing buffer 2 (yang berisikan etanol) ke dalam kolom kemudian disentrifus 12000 rpm selama 1 menit. Setelah itu larutannya dibuang, ditambahkan 250 µl washing buffer 2 dan disentrifus 12000 rpm selama 2 menit, kemudian kolom dipindahkan ke tabung 1.5 µl. Setelah ditambahkan 100 µl nuclease free water, sampel disentrifus 12000 rpm selama 1 menit. Pelet RNA (template) yang diperoleh disimpan pada suhu -20 °C sampai siap digunakan.
2. Reverse Transkriptase
RNA di transkripsi ke dalam bentuk complementary DNA (cDNA) menggunakan kit Trancriptor Synthesis First Strand cDNA (Thermo Scientific, Lithuania, EU). Larutan terdiri dari 2 µl template RNA, 1 µl oligo (dT) dan 9 µl air. Larutan diinkubasi pada suhu 65 oC selama 5 menit. Selanjutnya ditambahkan 4 µl 5xRB (buffer), 1 µl riboblock, 2 µl dNTP dan 1 µl reverse transkriptase. Selanjutnya larutan diinkubasi menggunakan PCR (GeneAmp PCR System 9700, AB Applied Biosystem, Singapore) pada suhu 42 oC selama 5 menit dan 78oC selama 5 menit. Kuantifikasi complementary DNA yang didapat dianalisis (absorbansi 260:280 nm yaitu 1.91 s.d 2.03) menggunakan spektrofotometer (Agilent 8453, USA). Selanjutnya berdasarkan kuantifikasi cDNA maka diperoleh konsentrasi standar dengan bantuan program DNA/RNA copy number calculator (http://endmemo.com/bio/dnacopynum.php).
3. Primer gen HSP70 dan gen GPX
Primer yang digunakan untuk mengamplifikasi mRNA HSP70 dan GPX terdiri atas: GADPH (housekeeping): F-5’GTG TTA TCA TCT CAG CTC CCT CAG-3’, R-5’GGT CAT AAG ACC CTC CAC AAT G-3’; HSP70: F-5’GAC AAG AGT ACA GGG AAG GAG AAC-3’, R-5’CTG GTC ACT GAT CTT TCC CTT CAG-3’ (Al-Zhgoul et al. 2013); GPX: F-5'AAG CAA TTC GGG CAC CAG-3', R-5'CCG TTC ACC TCG CAC TTC TC-3' (Yuan et al. 2012). Panjang produk PCR untuk masing-masing gen HSP70 dan GPX yaitu 222 bp dan 122 bp.
4. Kuantifikasi gen HSP 70 dan gen GPX
Complementary DNA digunakan untuk kuantifikasi ekspresi gen HSP70 dengan menggunakan real time PCR (qRT-PCR) (Analytic Jena, AG qTower 4 kanal, Jerman). Reaksi real time PCR menggunakan SYBR Green Select Master Kit (Applied Biosystem, USA) yaitu: 10 µl reaksi campuran yang digunakan mengandung 5 µl master mix; 0.25 µl masing-masing primer forward dan reverse (10 pmol); 1 µl cDNA dari sampel dan 3.5 µl nuklease-bebas air. Kondisi PCR dijalankan sebagai berikut, 95 oC selama 5 menit, 39 siklus pada 95 oC selama 10
8
qRT-PCR menggunakan molekul reporter fluoresens untuk memonitor produksi dari produk amplifikasi pada setiap siklus reaksi PCR. Pada qRT-PCR akan diperoleh nilai cycle threshold (CT), yaitu siklus ketika intensitas emisi zat
warna fluoresens melewati nilai threshold. Semakin tinggi jumlah awal kopi target asam nukleat, semakin cepat peningkatan fluoresens sehingga semakin rendah nilai CT (Bustin 2005). Ekspresi gen HSP70 dan GPX dihitung
berdasarkan pendekatan jumlah relatif kuantitas mRNA gen target (HSP70 dan GPX) dengan gen kontrol (GAPDH) dengan metode perbandingan CT (∆CT).
Ekspresi antara gen target dengan gen kontrol dapat dibandingkan dengan persamaan 2-∆CT, dengan delta CT (∆CT) = CT gen target - CT gen kontrol (house
keeping gene) (Schmittgen dan Livak 2008).
b. Aktivitas enzim glutation peroksidase (GSH – Px) dalam darah
Analisa aktifitas enzim GSH-Px dilakukan setelah 35 hari (5 minggu) pemeliharaan broiler. Sampel darah diambil dari pembuluh darah vena aksilaris di sayap menggunakan spuit dan dimasukkan ke dalam tabung yang berisi anti koagulasi.
Metoda analisa aktifitas enzim GSH-Px yaitu menurut Paglia dan Valentine (1967) yang dimodifikasi oleh Flohe dan Gunzler (1984). Persiapan sampel 100 μl plasma darah ditambah dengan 200 μl buffer phosfat pH 7.0, kemudian dikocok dengan vortex. Larutan disentrifus pada 3000 rpm selama 5 menit dalam kondisi dingin. Supernatan digunakan untuk mengukur aktivitas glutathion peroksidase (GSH-Px). Sebanyak 1 ml PBS-EDTA (PBS 0.1 M pH 7.0 mengandung 0.1 mM EDTA) ditambahkan dengan 200 μl sampel. Selanjutnya ditambahkan 200 μl glutathion tereduksi (GSH) 10 mM dan 200 μl enzim glutathion reduktase 2.4 U ml-1 kemudian diinkubasi selama 10 menit pada suhu 37 ºC menggunakan water bath. Kemudian ditambahkan 200 μl NADPH 1.5 mM ke dalam larutan dan diinkubasi lagi pada suhu yang sama selama 3 menit. Selanjutnya ditambahkan 200 μl H2O2 1.5 mM kemudian absorbansinya dibaca dengan spektrofotometer
(UV-Vis Hitachi U-2001) pada panjang gelombang 340 nm. Perhitungan :
mUnit GSH Px absorban x Vt
6.22 x Vs x 2 x 1000
6.22 = koefisien ekstrensik dari NADPH
2 = 2 mol GSH yang setara dengan untuk mengoksidasi 1 mol NADPH 1000 = perubahan menjadi miliunit
Vs = volume sampel dalam ml
c. Malondialdehid (MDA) daging broiler
9
al. (1991) yang dimodifikasi. Prosedur analisis yaitu: sebanyak 1 g daging broiler yang sudah dicincang dimasukkan kedalam tabung, selanjutnya ditambahkan 2 ml PBS (pH 7.4) - KCl (11.4 g l-1). Larutan tersebut disentrifus 10000 rpm selama 20 menit pada suhu 4oC. Supernatan yang terbentuk diambil sebanyak 0.5 ml kemudian dimasukan ke tabung lain, kemudian ditambahkan 2 ml larutan campuran (2.23 ml HCl pekat, 15 g TCA, 0.38 TBA). Campuran tersebut disimpan dalam oven 80oC selama 1 jam, selanjutnya didinginkan dengan air mengalir dan disentrifus 3000 rpm selama 5 menit. Supernatan hasil sentrifus tersebut kemudian diukur absorbansinya pada panjang gelombang 532 nm dengan alat spektrofotometer (UV-Vis Hitachi U-2001).
d. Performa Broiler.
Broiler percobaan dipelihara selama 35 hari (5 minggu), jumlah konsumsi pakan dan bobot badan ditimbang setiap minggu.
1. Konsumsi ransum (g ekor-1)
Rataan konsumsi ransum dihitung dari selisih antara ransum yang diberikan dengan sisa ransum dibagi dengan jumlah ayam yang ada dalam satu petak. Pengukuran sisa pakan dilakukan seminggu sekali pada pagi hari.
Rataan konsumsi ransum ransum yang diberikan ransum sisajumlah ayam
2. Bobot badan akhir (g ekor-1)
Bobot badan akhir diperoleh dengan menimbang seluruh ayam tiap perlakuan di akhir pemeliharaan kemudian dirata-ratakan.
3. Pertambahan bobot badan (g ekor-1)
Pertambahan bobot badan (PBB) diperoleh dari hasil perhitungan antara bobot badan akhir dikurangi bobot badan awal. Bobot badan diukur seminggu sekali.
P jumlah bobot badan akhir bobot badan awaljumlah ayam yang ditimbang
4. Konversi ransum
Konversi Ransum dihitung dari perbandingan antara rataan konsumsi ransum dengan rataan pertambahan bobot badan.
Konversi ransum pertambahan bobot badanrataan konsumsi ransum
5. Mortalitas (%)
Mortalitas jumlah ayam yang dipelihara selama penelitianjumlah ayam yang mati selama penelitian
Rancangan Percobaan dan Analisis Data
10
Yij= µ + τi+ εij Keterangan :
Yij = nilai pengamatan pada perlakuan ke-j dan ulangan ke-i
µ = nilai rataan umum
τi = pengaruh perlakuan ke-i (i= 1, 2, 3)
εij = pengaruh lingkungan yang tidak terkontrol
Data yang diperoleh dianalisis dengan analisis varian menggunakan program SAS (versi 9.3, 2011), jika berbeda nyata antara perlakuan maka dilakukan uji lanjut Duncan.
HASIL DAN PEMBAHASAN
Suhu dan Kelembaban
Rataan suhu lingkungan kandang tropis lebih rendah dari suhu optimum untuk pertumbuhan broiler secara optimal pada broiler umur 3 minggu dan lebih tinggi pada broiler umur 4-5 minggu. Rata-rata suhu dan kelembaban kandang selama penelitian disajikan pada Tabel 3.
Kandang kontrol (AC) menunjukkan rataan suhu sebesar 26.4 oC dengan kelembaban 78.4% sedangkan pada kandang tropis rataan suhu sebesar 27.6 oC dengan kelembaban 81.0%. Suhu rataan pada kandang kontrol sudah memenuhi kebutuhan suhu ideal untuk pertumbuhan broiler akan tetapi dengan kelembaban yang relatif lebih tinggi dari petunjuk pemeliharaan yang dikeluarkan oleh Charoen Pokphand. Menurut Kuczynski (2002), suhu nyaman untuk broiler periode grower (3-5 minggu) agar dapat bereproduksi optimal yaitu 19 oC-27 oC. Charoen Pokphand (2005) menyatakan bahwa suhu optimum untuk pertumbuhan broiler berturut-turut berdasarkan umur pemeliharaan yaitu umur 1-3 hari: 32 oC; umur 4-6 hari: 31 oC; umur 7-14 hari: 30 oC; umur 15-21 hari: 28 oC, dan umur 22-35 hari: 26 oC dengan kelembaban yaitu 60%.
Tabel 3 Rataan suhu dan kelembaban (RH) harian di kandang percobaan selama penelitian
Minggu ke-
Kandang kontrol (AC) Kandang tropis Suhu (oC) RH (%) Suhu (oC) RH (%) Pagi Siang Sore Pagi Siang Sore Pagi Siang Sore Pagi Siang Sore 1 26.6 27.6 29.1 77.6 78.9 69.7 24.0 32.8 27.7 96.7 60.0 81.9 2 26.4 27.6 28.0 78.0 75.0 73.6 25.0 33.1 28.0 93.7 61.4 83.9 3 25.2 28.1 27.2 83.6 73.7 73.6 24.9 32.8 28.9 91.3 66.0 78.0 4 23.4 27.4 27.7 84.7 78.0 78.3 24.9 32.9 29.2 88.6 63.6 80.0 5 23.3 27.4 27.4 84.0 71.9 79.3 24.1 32.7 27.8 82.4 61.6 78.0 Rataan 25.0 27.6 27.9 81.6 75.5 74.9 24.6 32.9 28.3 90.5 62.5 80.3 Total
11
Pengkondisian kandang broiler pada suhu nyaman dilakukan pada saat broiler berumur 3 minggu yaitu 19 oC - 27 oC. Hal ini dilakukan karena pada umur 3 minggu, broiler membutuhkan suhu nyaman untuk menyeimbangkan suhu tubuh sehingga bisa berproduksi dan berkembang dengan baik. Menurut Efendi (2010) broiler yang berumur 3 minggu ke atas rentan terkena stres panas. Terlihat pada Tabel 3, suhu kandang kontrol pada umur pemeliharaan 3-5 minggu suhu di pagi hari konstan pada 23 oC - 25 oC akan tetapi mengalami kenaikan di siang dan sore hari, dengan kelembaban yang relatif konstan. Pada kandang kontrol, nilai suhu masih tergolong ideal untuk pertumbuhan broiler akan tetapi kelembaban yang relatif lebih tinggi memberikan efek negatif pada broiler. Terdapatnya variasi suhu selama pemeliharaan disebabkan karena adanya cuaca mendung dan hujan yang mengakibatkan turunnya suhu dan meningkatkan kelembaban. Hal ini disebabkan disain kandang kontrol masih belum maksimal mencegah pengaruh lingkungan dari luar yang berpengaruh terhadap suhu dan kelembaban di dalam kandang. Tingginya kelembaban di kandang kontrol disebabkan karena kurangnya exhaust fan dalam kandang sehingga kurangnya aliran uap air yang berada dari dalam ke luar kandang.
Cekaman panas pada ayam terjadi di waktu siang hari, karena suhu rataan pada siang hari pada kandang tropis yaitu 32.9 oC yang melebihi suhu nyaman dan kelembaban yang lebih tinggi (81%) memberikan efek negatif pada broiler (Tabel 3). Cekaman panas pada broiler ditandai dengan aktivitas panting dan mengembangkan sayapnya untuk membantu mengeluarkan panas tubuh. Broiler tidak memiliki kelenjar keringat sehingga rentan terhadap stres sehingga broiler sulit untuk membuang panas tubuh ke lingkungannya (Hilman et al. 2000; Etches et al. 2008). Tingginya kelembaban di kandang tropis disebabkan karena terjadinya hujan di pagi hari, sore dan malam hari atau dini hari serta beberapa kali terjadi mendung di siang hari.
Tabel 3 memperlihatkan fluktuatif suhu kandang tropis dengan rendah di pagi hari dan tinggi di siang hari kemudian mulai turun lagi di sore hari. Fluktuatif suhu ini sangat mempengaruhi homeostasis tubuh broiler dalam menyeimbangkan suhu tubuh terhadap respon suhu lingkungan. Suhu lingkungan yang rendah dibutuhkan oleh broiler untuk melepaskan panas dalam tubuh akibat metabolisme yang terjadi pada tubuh broiler. Laju metabolisme akan semakin meningkat dengan semakin bertambahnya umur broiler, sehingga meningkatkan panas yang dihasilkan oleh tubuh. Proses pelepasan panas tubuh ini adalah upaya untuk menyeimbangkan suhu tubuh dan lingkungan melalui evaporasi salah satunya dengan cara panting (mengeluarkan panas melalui mulut) sehingga performa broiler tidak terganggu karena adanya stres panas.
12
panas. Apabila pernafasan kurang cepat untuk mengeluarkan uap air dari paru-paru ke lingkungan maka akan menyebabkan kematian (Suprijatna et al. 2005).
Kuantifikasi Ekspresi Gen Heat Shock Protein 70 (HSP70)
Broiler yang dipelihara di kandang tropis yang disuplementasi selenium dengan broiler yang dipelihara di kandang kontrol (AC) tidak berbeda nyata (P>0.05) dari segi ekspresi gen HSP70. Pemberian selenium dalam pakan broiler yang dipelihara di daerah tropis dapat menurunkan ekspresi gen HSP70 dan sebaliknya ekspresi gen HSP70 tinggi pada pada broiler yang dipelihara di daerah tropis tanpa penambahan selenium (Gambar 1). Hal ini disebabkan karena broiler yang dipelihara di suhu tropis terkena stres panas yang memicu terekspresinya gen HSP70. Tubuh akan berusaha mengembalikan ke kondisi homeostasis sebelum terkena stres apabila zona homeostasis ternak ini terganggu. Tubuh tidak bisa lagi mengatasi efek stres melalui jalur metabolisme dan akan menggunakan jalur genetis dengan mengaktifkan gen HSP70 yang berfungsi apabila ternak mengalami stres yang terus meningkat. Beberapa hasil penelitian menunjukkan bahwa broiler yang terkena stres panas akan mengalami peningkatan kadar ekspresi gen HSP70 (Gabriel et al. 1996; Mahmoud et al. 2004; Zhen et al. 2006; Yu dan Endong 2008; Tamzil et al. 2013).
Gambar 1 Ekspresi gen HSP70 pada organ otak dan dada broiler. ( ) AC: broiler dipelihara di kandang kontrol ber AC tanpa suplementasi selenium, ( ) NS: broiler dipelihara di kandang tropis tanpa suplementasi selenium, ( ) PS: broiler dipelihara di kandang tropis dengan suplementasi 0.30 ppm selenium. Garis vertikal di atas tiap balok data menunjukkan galat baku dan huruf-huruf di atas balok data menunjukkan perbandingan nilai tengah eskpresi gen pada tiap kelompok perlakuan berdasarkan uji beda nyata terkecil pada taraf nyata 0.05.
13 2013). Produksi HSP70 di dalam tubuh menggunakan segala nutrien yang masih ada di dalam tubuh dan bertindak sebagai last defender dengan berperan menjadi protektor bagi protein yang sensitif terhadap suhu tinggi dan melindunginya dari after effect seperti proses degradasi maupun denaturasi sehingga mencegah protein rusak baik sementara maupun permanen yang selanjutnya mempengaruhi kelangsungan hidup ternak tersebut (Surai 2003; Etches et al. 2008; Noor dan Seminar 2009).
Saat cekaman panas muncul, mRNA akan mengirim pesan untuk memproduksi gen yang berperan apabila ternak tercekam panas seperti gen HSP70 dan GPX, sedangkan tRNA akan membawa pesan untuk pembentukan protein. Pada saat ternak mengalami stres, gen-gen ini akan diproduksi secara besar-besaran sedangkan produksi protein lain akan terhenti, akan tetapi jika keadaan sudah dalam keadaan normal, maka akan kembali seperti biasa. Selenium mempengaruhi ekspresi gen HSP70 dan GPX dapat dilihat dari dua pendekatan. Pertama, selenium secara langsung bekerja mengurangi radikal bebas dan bersama-sama dengan enzim GSH-Px dengan aktifitas antioksidannya sehingga gen HSP70 dan GPX tidak perlu diproduksi dan terkespresi untuk bekerja melindungi sel dari kerusakan radikal bebas dalam tubuh. Kedua, ada kemungkinan selenium berikatan dengan aktivator transkripsi pada proses penyalinan kode genetika yang terdapat pada urutan DNA menjadi molekul RNA pada proses ekspresi gen. Ikatan ini akan menginduksi perubahan konformasi yang memungkinkan faktor menstimulasi ekpresi dari gen HSP70 dan begitu juga dengan gen GPX.
obat-14
pengondisian lingkungan agar ternak berada pada suhu nyaman untuk hidup pokok, tumbuh-kembang, produksi, dan reproduksi ternak tersebut (Surai 2003).
Kuantifikasi Ekspresi Gen Glutathione Peroxidase (GPX)
Hasil kuantifikasi dari ekspresi gen glutathione peroxidase (GPX) dapat dilihat pada Gambar 2. Broiler yang dipelihara di kandang tropis yang disuplementasi selenium dengan broiler yang dipelihara di kandang kontrol (AC) tidak berbeda nyata (P>0.05) dari segi ekspresi gen GPX. Pemberian selenium dalam pakan broiler yang dipelihara di daerah tropis dapat menurunkan ekspresi gen GPX dan sebaliknya ekspresi gen GPX tinggi pada pada broiler yang dipelihara di daerah tropis tanpa penambahan selenium. Hal ini disebabkan karena broiler yang dipelihara di suhu tropis terkena stres panas yang memicu terekspresinya gen GPX.
Gambar 2 Ekspresi gen GPX pada organ otak dan dada broiler. ( ) AC: broiler dipelihara di kandang ber AC tanpa suplementasi selenium, ( ) NS: broiler dipelihara di kandang tropis tanpa suplementasi selenium, ( ) PS: broiler dipelihara di kandang tropis dengan suplementasi 0.30 ppm selenium. Garis vertikal di atas tiap balok data menunjukkan galat baku dan huruf-huruf di atas balok data menunjukkan perbandingan nilai tengah eskpresi gen pada tiap kelompok perlakuan berdasarkan uji beda nyata terkecil pada taraf nyata 0.05.
15
transportasi asam amino, selanjutnya selenium akan berikatan dengan protein membentuk selenoprotein seperti selenocystein atau selenomethionin yang akan digunakan dalam regulasi ekpresi gen GPX dalam tubuh ternak.
Glutathione Peroxidase (GPX) merupakan nama lain untuk famili multiple isozyme. Ada empat macam GPX yaitu yang mengandung selenocystein pada sel aktif (GPX seluler = GPX-1), GPX saluran pencernaan (GPX-2), GPX plasma (GPX-3) dan GPX fosfolipid (GPX-4). GPX bersamaan dengan superokside dismustase dan katalase merupakan sistem antioksidan enzimatis dalam mereduksi produk radikal bebas. GPX seluler (GPX1) memiliki peran penting dalam pertahanan antioksidan selular untuk mereduksi produk radikal bebas seperti H2O2 atau hidroperoksida lain menjadi air atau menjadi ikatan alkohol
(Surai 2003). GPX1 pada level molekuler memiliki peran penting dalam mendeteksi sistem pertahanan antioksidan dalam memproteksi sel dari kerusakan oksidatif dan mRNA GPX1 dapat terekspresi disemua jaringan yang memiliki tingkat ekspresifitas yang berbeda di tiap jaringan.
Aktifitas Enzim Glutation Peroksidase (GSH-Px)
Aktifitas enzim GSH-Px yang lebih tinggi (P<0.05) ditunjukkan pada kandang tropis tanpa penambahan selenium (Tabel 4). Aktivitas enzim GSH-Px pada broiler akan meningkat akibat cekaman panas (Pamok et al. 2009). GSH-Px merupakan enzim antioksidan yang dapat mengurangi pengaruh negatif dari radikal bebas di dalam sel, karena mendetoksifikasi hidrogen peroksida dan hiperperoksida lipid menjadi komponen yang tidak beracun. Selenium merupakan bagian dari sistem enzim antioksidan (glutathione; H2O2 oxidoreductase) yang
mendetoksifikasi H2O2 dan hidroperoksida organik (Surai 2003). Oleh karena itu,
selenium dapat meningkatkan aktifitas enzim antioksidan dalam tubuh dalam menangkal radikal bebas. Selenium tidak hanya digunakan oleh enzim GSH-Px tetapi juga oleh selenoenzim lain maka dengan penambahan selenium organik relatif mengurangi aktivitas dari enzim GSH-Px karena sama-sama bekerja dengan selenoenzim lain yang juga bekerja menangkal radikal bebas. Selain itu selenium yang digunakan merupakan selenium organik yang penyerapannya lebih baik di dalam tubuh.
Tabel 4 Pengaruh penambahan selenium organik terhadap aktifitas enzim GSH-Px dan kandungan MDA ayam broiler percobaan
Perlakuan Enzim GSH-Px (mU mg-1 protein-1) MDA (mg 100-1 g-1)
AC 148.27±23.4b 0.3698±0.0722b
NS 277.33±81.6a 1.1906±0.3610a
PS 155.26±30.4b 0.5631±0.2004b
AC: Ayam dipelihara di kandang ber AC tanpa suplementasi selenium, NS: ayam dipelihara di kandang tropis tanpa suplementasi selenium, PS: ayam dipelihara di kandang tropis dengan suplementasi 0.30 ppm selenium. Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Duncan).
16
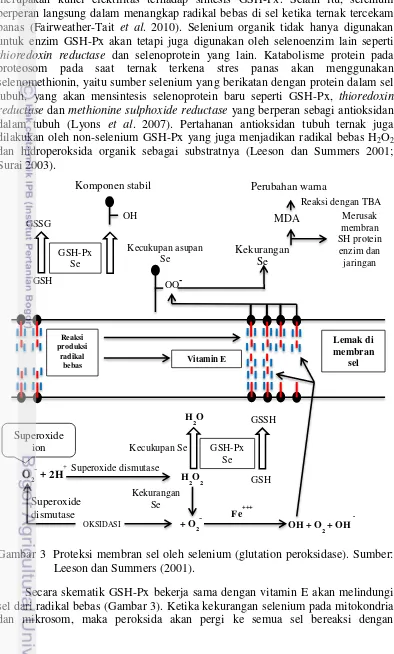
merupakan mineral yang sangat penting dalam pertahanan antioksidan dan merupakan bagian penting dari enzim GSH-Px, serta ketersediaan mineral ini merupakan kunci efektifitas terhadap sintesis GSH-Px. Selain itu, selenium berperan langsung dalam menangkap radikal bebas di sel ketika ternak tercekam panas (Fairweather-Tait et al. 2010). Selenium organik tidak hanya digunakan untuk enzim GSH-Px akan tetapi juga digunakan oleh selenoenzim lain seperti thioredoxin reductase dan selenoprotein yang lain. Katabolisme protein pada proteosom pada saat ternak terkena stres panas akan menggunakan selenomethionin, yaitu sumber selenium yang berikatan dengan protein dalam sel tubuh, yang akan mensintesis selenoprotein baru seperti GSH-Px, thioredoxin reductase dan methionine sulphoxide reductase yang berperan sebagi antioksidan dalam tubuh (Lyons et al. 2007). Pertahanan antioksidan tubuh ternak juga dilakukan oleh non-selenium GSH-Px yang juga menjadikan radikal bebas H2O2
dan hidroperoksida organik sebagai substratnya (Leeson dan Summers 2001; Surai 2003).
Gambar 3 Proteksi membran sel oleh selenium (glutation peroksidase). Sumber: Leeson dan Summers (2001).
17
membran sehingga akan menyebabkan kerusakan sel. Ketika mitokondria dan mikrosom memproduksi antibodi dan mekanisme pertahanan yang lain, maka ketersediaan selenium tidak hanya penting untuk pencegahan, tetapi juga sangat penting untuk pemeliharaan sel yang merespon untuk membentuk mekanisme pertahanan dari penyakit dan pengaruh stres yang lain. Enzim GSH-Px memiliki fungsi utama yaitu mendetoksifikasi hidrogen peroksida dan mengubah hidroperoksida lipid menjadi komponen yang tidak beracun, sehingga dapat melindungi sel dari kerusakan karena adanya radikal bebas (Leeson dan Summers 2001; Surai 2003). Enzim GSH-Px merupakan protein yang berbentuk tentramer dengan bobot molekul 85000D. GSH-Px memiliki 4 atom selenium yang terikat sebagai selenocysteine.
Kandungan Malondialdehid (MDA)
Kadar MDA pada broiler yang dipelihara di daerah tropis yang disuplementasi selenium tidak berbeda nyata (P>0.05) dengan kadar MDA pada broiler yang dipelihara di kandang kontrol (AC) dan lebih rendah (P<0.05) dibandingkan dengan kadar MDA pada broiler yang dipelihara di kandang tropis tanpa penambahan selenium (Tabel 4). Suplementasi selenium nyata dapat menurunkan kadar MDA pada broiler yang di pelihara di daerah tropis. MDA merupakan produk radikal bebas yang dibentuk dari hasil peroksida lipid (Clarkson dan Thomson 2000). Hasil penelitian sependapat dengan Rao et al. (2013) bahwa pemberian selenium organik dapat menurunkan kadar MDA pada ayam yang dipelihara di lingkungan tropis. MDA dapat mengindikasikan tingkat kerusakan sel atau jaringan tubuh akibat radikal bebas. Mineral selenium, yang berperan sebagai antioksidan, dapat mencegah terjadinya stres panas yang memicu dihasilkannya radikal bebas dalam metabolisme tubuh. Selenium mengubah radikal bebas menjadi produk yang lebih stabil, sehingga peroksidasi lipid terhenti. Selain itu, selenium juga dapat mengurangi peroksida yang sudah terbentuk (Fellenberg dan Speisky 2006).
Malondialdehida terpicu awalnya karena cekaman panas memunculkan radikal bebas dalam tubuh yang menimbulkan stres oksidatif dan menurunkan status kesehatan ternak, sehingga nutrien yang masuk ke tubuh kurang dan digunakan sebagian untuk mempertahankan tubuh dari stres, sehingga kebutuhan fisiologis lainnya jadi berkurang. Peroksida lipid merupakan reaksi berantai yang berasal dari senyawa radikal hidroksil (-OH) dengan menyerang asam lemak tidak jenuh ganda atau poly unsaturated fatty acid (PUFA) pada membran sel. PUFA yang banyak dalam membran sel menjadi target utama oksidan karena sangat rentan terhadap terjadinya autokatalisis peroksidasi. Senyawa radikal hidroksil mengekstraksi satu Hidrogen dari lemak poliunsaturated (LH), sehingga terbentuk radikal lemak (L-) yang memicu terbetuknya MDA pada jaringan (Mujahid et al. 2007).
18
akan berperan secara langsung dalam menangkap radikal bebas dalam jalur metabolisme pada tubuh (Fairweather-Tait et al. 2010), selain itu suplementasi selenium sebagai antioksidan dalam pakan dapat menurunkan peroksidasi lemak pada jaringan dalam daging (MDA) dan meningkatkan stabilitas oksidasi pada otot sehingga dapat lebih tahan selama penyimpanan, meningkatkan kualitas dan meningkatkan nilai ekonomis daging. Menurut Fassah (2012) penambahan antioksidan dapat menurunkan MDA dan total SFA (asam lemak jenuh) serta meningkatkan PUFA daging sehingga meningkatkan stabilitas oksidasi daging yang meningkatkan kualitas daging.
Performa Broiler
Suplementasi selenium organik pada broiler yang dipelihara di kandang tropis nyata meningkatkan (P<0.05) konsumsi ransum, bobot badan, pertambahan bobot badan dan konversi ransum dibandingkan dengan broiler yang dipelihara pada kandang tropis dan tidak disuplementasi selenium (Tabel 5). Suplementasi selenium organik menghasilkan performa yang sama dengan broiler yang dipelihara pada kandang kontrol. Hal ini menunjukkan bahwa suplementasi selenium cukup efektif mengatasi cekaman panas pada broiler yang dipelihara pada kandang tropis yang mempunyai suhu dan kelembaban bervariasi.
Pada lingkungan tropis, broiler mengalami fluktuasi variatif suhu yang berdampak pada stres sebagai akibat respon fisiologis karena pengaruh lingkungan, sehingga akan berdampak terhadap penurunan performa, seperti rendahnya produktifitas dan tingginya mortalitas. Pada suhu lingkungan yang tinggi, konsumsi ransum akan menurun. Demikian pula berlaku sebaliknya, pada kondisi dibawah thermoneutral zone, akan menyebabkan konsumsi pakan meningkat. Untuk setiap kenaikan 1 oC pada suhu lingkungan di atas 24.5 oC, terjadi penurunan konsumsi sebesar 1.58% (NRC 1994). Penurunan dari konsumsi broiler yang dipelihara pada kandang tropis terjadi karena ayam tersebut terkena stres panas yang membuat asupan pakan pada ayam lebih rendah yang berakibat pada rendahnya bobot badan dan pertumbuhan bobot badan. Cekaman panas pada broiler berakibat menurunkan konsumsi ransum, pertumbuhan bobot badan dan konversi ransum (Kusnadi 2006).
19
Tanda-tanda klinis terhadap ayam yang mati tidak mencirikan ayam terkena penyakit. Menurut Tarmudji (2005) tanda-tanda klinis setelah ayam mati terkena penyakit adalah hidung berair, berlendir, pembengkakan sinus kepala, pembengkakan kelopak mata dan gangguan pernafasan.
Tabel 5 Performa broiler pada percobaan pemberian selenium pada ayam umur 35 hari (5 minggu)
Peubah Perlakuan
AC NS PS
Konsumsi (g ekor-1) 2215±34a 1929±182b 2153±136a Bobot badan (g ekor-1) 1351±51a 1078±42b 1308±53a
PBB (g ekor-1) 1310±51a 1035±42b 1266±54a
Konversi ransum 1.69 ±0.04b 1.86 ±0.11a 1.70 ±0.12b
Mortalitas*) (%) 5 7.5 2.5
AC: Ayam dipelihara di kandang ber AC tanpa suplementasi selenium, NS: ayam dipelihara di kandang tropis tanpa suplementasi selenium, PS: ayam dipelihara di kandang tropis dengan suplementasi 0.30 ppm selenium, PBB: pertumbuhan bobot badan. *) Tanpa diuji statistik. Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji Duncan).
Rekayasa genetik menyebabkan strain broiler sekarang lebih cepat menghasilkan pertambahan bobot badan disertai dengan produksi panas yang tinggi. Umur yang semakin bertambah dan bobot badan semakin meningkat selama pertumbuhan disebabkan karena kebutuhan akan nutrien untuk hidup pokok, pertumbuhan, produksi dan reproduksi berbanding lurus dengan tingkat konsumsi ransum. Selain besar tubuh ayam, umur ayam, daya aktifitas, kuantitas ransum, status kesehatan, bentuk makanan, imbangan nutrien, kecepatan pertumbuhan serta kebakaan (genetik); suhu dan kelembaban lingkungan turut mempengaruhi tingkat asupan pakan ternak (NRC 1994; Mujahid et al. 2009).
20
bahwa broiler yang dipelihara dalam kondisi nyaman menunjukkan nilai konversi pakan yang lebih baik dibandingkan dengan ayam yang dipelihara dikandang suhu tidak ideal (panas) dengan rataan bobot badan yang dihasilkan yaitu 200 g lebih tinggi dari kondisi panas.
SIMPULAN
Penambahan selenium pada level 0.30 ppm dalam pakan broiler yang dipelihara di daerah tropis dapat menurunkan ekspresi gen HSP70, ekspresi gen GPX, aktifitas enzim GSH-Px, dan kadar MDA. Dengan demikian, pemberian selenium dapat memperbaiki produktivitas broiler mendekati yang dipelihara di suhu nyaman terutama ditunjukkan dengan perbaikan konsumsi ransum, bobot badan, pertambahan bobot badan dan konversi ransum.
UCAPAN TERIMA KASIH
Bantuan dana penelitian dari Hibah Penelitian Unggulan Perguruan Tinggi IPB (BOPTN) tahun 2013 SPK: No. 238/IT3.41.2/L2/SPK//2013. Program Beasiswa Unggulan Direktorat Jenderal Pendidikan Tinggi (BU-DIKTI) Kementerian Pendidikan dan Kebudayaan Republik Indonesia.
DAFTAR PUSTAKA
Akil S, Piliang WG, Wijaya CH, Utomo DB, Wiryawan IKG. 2009. Pengkayaan selenium organik, inorganik dan vitamin E dalam pakan puyuh terhadap performa serta potensi telur puyuh sebagai sumber antioksidan. J Ilm Ternk Vet. 14(1): 1-10.
Al-Fataftah ARA, Abu-Dieyeh ZHM. 2007. Effect of chronic heat stress on broiler performance in Jordan. Intern J Poult Sci. 6(1): 64-70.
Al-Zhgoul M , Dalab AES, Ababneh MM, Jawasreh KI, usadah KAA, Ismail Z . 2013. Thermal manipulation during chicken embryyogenesis results in enhanced HSP70 gene expression and the acquisition of the termotolerance.
Res Vet Sci. 95: 502-507.
Arya R, Mallik M, Lakhotia SC. 2007. Heat shock genes – integrating cell survival and death. J Biosci. 32: 595–610.
[BMKG] Badan Meteorologi Klimatologi dan Geofisika. 2012. Buku Informasi Perubahan Iklim dan Kualitas Udara di Indonesia. Jakarta (ID): BMKG. Bodega G, Hernandes C, Suarez I, Martin M, Fernandez B. 2002. HSP70
constitutive expression in rat central nervous system from posnatal development to maturity. J Histochem Cytochem. 50(9): 1161-1168.
21
Bustin SA. 2005. Real-time PCR. Di dalam: Fuchs J, Podda M, editor. Encyclopedia of Diagnostic Genomics and Proteomics. New York (US): Marcel Dekker, hlm 1117-1125.
Charoen Pokphand. 2005. Manual manajemen broiler CP 707. Jakarta (ID): PT Charoen Pokphand Indonesia.
Clarkson PM, Thomson HS. 2000. Antioxidants: What role do they play in physical activity and health. Am J Clin Nutr. 729: 637-346.
Daghir NJ. 1995. Present Status and Future of the Poultry Industry in Hot Regions. Di dalam: N.J. Daghir. Poultry Production in Hot Climates. New York (US): CABI, hlm 1-10.
Deniz G, Gezen SS, Turkmen II. 2005. Effects of two supplemental dietary selenium sources (mineral and organic) on broiler performance and drip-loss. Revue Méd Vét. 156(8-9): 423-426.
Efendi D. 2010. Performa dan respon fisiologi ayam broiler yang diberi ransum mengandung 1,5% ampas buah merah (Pandanus conoideus) pada waktu pemberian dan suhu kandang berbeda [tesis]. Bogor (ID): Institut Pertanian Bogor.
Etches RJ, John TM, Verrinder GAM. 2008. Behavioural, Physiological, Neuroendocrine and Molecular Response to Heat Stress. Di dalam: N.J. Daghir. Poultry production in Hot Climates. New York (US): CABI, hlm 49-69.
Fassah DM, Supadmo, Rusman. 2012. Efek pemberian ekstrak limbah teh hitam sebagai sumber antioksidan dan level energi-protein pakan yang berbeda terhadap stabilitas oksidatif dan kualitas daging ayam broiler. Buletin Peternakan. 36(2): 75-86.
Fairweather-Tait SJ, Collings R, Hurst R. 2010. Selenium bioavailability: current knowledge and future research requirements. Am J Clin Nutr. 91: 1484s-91s. Fellenberg MA, Speisky H. 2006. Antioxidants: their effects on broiler oxida- tive
stress and its meat oxidative stability. J World’s Poultry Sci. 62: 53 – 67. Flohe L, Gunzler WW. 1984. Assays of glutathione peroxidase. Methods Enzymol.
105: 114 -121.
Gabriel JE, Ferro JA, Stefani RMP, Ferro MIT, Gomes SL, Macari M. 1996. Effect of acute heat stressor the heat shock protein 70 messenger RNA on the heat shock protein expression in the liver of broilers. Br Poult Sci. 37:443-9. Guerreiro EN, Giachetto PF, Givisiez PEN, Ferro JA, Ferro MIT, Gabriel JE,
Furlan RL, Macari M. 2004. Brain and hepatic hsp70 protein levels in heat- acclimated broiler chickens during heat stress. Br Poult Sci. 6(4): 201 – 206. Hilman PE, Scott NR, Van Tienhoven A. 2000. Physiological, responses and
adaption to hot and cold environment. Dalam: Yousef MK (Ed.) Stress fisiology in livestock. Vol.3, Poultry. Florida (US): CRC press, Pp 1-7.
Ibrahim MT, Eljack BH, Fadlalla IMT. 2011. Selenium suplementation to broiler diets. J Anim Sci. 2(1): 12-17.
Khajali F, Raei A, Aghaei A, Qujeq D. 2010. Evaluation of a dietary organic selenium supplement at different dietary protein concentrations on growth performance, body composition and antioxidative status of broilers reared under heat stress. Asian-Aust J Anim Sci. 23(4) : 501 - 507
22
Kuczynski I. 2002. The application of poultry behavior responses on heat stress to improve heating and ventilation system efficiency. Electr J Poult Agric Univ. 5: 1-11.
Kusnadi E. 2006. Suplementasi vitamin C sebagai penangkal cekaman panas pada ayam broiler. J Ilm Ternk Vet. 11(4): 249-253.
Laganá C, Ribeiro AML, Kessler AM, Kratz LR, Pinheiro CC. 2007. Effect of the supplementation of vitamins and organic minerals on the performance of broilers under heat stress. Br Poult Sci. 9(1): 39 – 43. nutrition: leesons from nature : Review. Asian-Aust J Anim Sci. 20(7) : 1135 – 1155.
Mahmoud KZ, Eden FW, Eisen EJ, Haveinstein GB. 2004. The effect of dietary phosporus on heat shock protein mRNAs during acut heat stress in male broiler chickens (Gallus gallus). Comp Biochem Physiol C. 137: 11-18
McDowell LR. 1992. Mineral in Animal and Human Nutrition. San Diego, California (US): Academic pr.
Mujahid A, Ichiro H, Kazuaki T, Atsuro M. 2009. Nutritional strategies to enhance efficiency and production of chickens under high temperature. Bogor (ID). Proceeding the 2nd International Seminar on Animal Industry.
Mujahid A, Neil RP, Walter B, Kiyotaka N, Teruo M, Yukio A, Masaaki T. 2007. Mitocondrial oxidative damage in chicken skeletal muscle induce by acute heat stress. J Poult Sci. 44: 439-445
Noor RR, Seminar KB. 2009. Rahasia dan Hikmah Pewarisan Sifat (Ilmu Genetika dalam Alqur’an). Bogor (ID): IPB pr, P 109.
[NRC] National Research Council. 1983b. Selenium in Nutrition. Rev. ed. Washington DC (US). National Academy of Sciences.
[NRC] National Research Council. 1994. Nutrient Requirement of Poultry. 9thEd. Washington DC (US): National Academy Press.
Paglia DE, Valentine WN. 1967. Studies on the quantitative characterization of erythrocyte glutathione peroxidase. J Lab Clin Med. 70: 158-169.
Pamok S, Aengwanich W, Komunitrin T. 2009. Adaption to oxidtive stress and impact of cronic oxidative stress on immunity in heat stresses broiler. J Therm Bio. 34: 353-357.
Payne RL, Southern LL. 2005. Comparison of inorganic and organic selenium sources for broilers. Poult Sci. 84: 898-902.
23
Rice-Evans CA, Diplock AT, Simons MCR. 1991. Techniques In Free Radical Research. Amsterdam (NL): Elsevier Science. Volume 22, Pages iii-vii, 1-291.
Rimbach G, Fuchs J, Packer L. 2005. Nutrigenomics. Florida (US): CRC Pr. SAS Institut Inc. 2011. SAS/OR® 9.3 User’s Gruide: Mathematical Programming.
Cary, NC (US): SAS Inst, Inc.
Schmittgen TD, Livak KJ. 2008. Analyzing real-time PCR data by the comparative CT method. Nat Protoc. 3(6): 1101-1108.doi:10.1038/nprot. 2008.73.
Steel RGD, Torrie JH. 1993. Prinsip dan prosedur statistika. Ed ke 2. Terjemahan: B. Sumantri. Jakarta (ID): Gramedia Pustaka Utama.
Suprijatna E, Atmomarsono, Kartasudjana U. 2005. Ilmu Dasar Ternak Unggas. Jakarta (ID): Penebar Swadaya.
Sunde RA, Thompson BM, Palm MD, Weiss SL, Thompson KM, Evenson JK. 1997. Selenium regulation of selenium dependent glutathione peroxidases in animals and transfected CHO cells. Biomed Environ Sci. 10: 346-355.
Surai PF, Karadas F, Pappas AC, Sparks NHC. 2006. Effect of organic selenium in quail diet on its accumulation in tissues and transfer to the progeny. Br Poult Sci. 47: 65-72.
Surai PF. 1999. Tissue-specific changes in the activities of antioxidant enzymes during the development of the chicken embryo. Br Poult Sci. 40: 397-405. Surai PF. 2003. Natural antioxidants in Avian Nutrition and Reproduction.
England (GB): Nottingham Univ Pr.
Tamzil MH, Noor RR, Hardjosworo PS, Manalu W, Sumantri C. 2013. Acute heat stress responses of three lines of chickens with different heat shock protein (hsp)-70 genotypes. Int J Poult Sci. 12(5): 264-272.
Tamzil MH. 2013. Identifikasi keragaman gen penyandi tahan panas (Heat Shock Protein 70) ayam lokal serta respon fisiologisnya terhadap cekaman panas akut [tesis]. Bogor (ID): Institut Pertanian Bogor.
Tanguay RM, Wu Y, Khandjian EW. 1993. Tissue-specific expression of heat shock proteins of mousein the absence of stress. Dev Genet. 14: 112-118. Tarmudji. 2005. Penyakit pernafasan pada ayam, ditinjau dari aspek klinik dan
patologik serta kejadiannya di indonesia. Wartazoa. 15:2.
Thomson CD. 2004. Assessment of requirements for selenium and adequacy of seenium status: A review. Eur J Clin Nutr. 58: 391-402.
Valdez LB, Arnaiz SL, Bustamante J, Alvarez S, Costa LE, Boveris A. 2000. Free radical chemistry in biological systems. Biol Res. 33: 2.
Van Der Hel W, Verstegen MWA, Henken AM, Brandsma HA. 1991. The upper critical ambient temperature in neonatal chicks. Poult Sci. 70: 1882–1887. Wang S, Diller KR, Aggarwal SJ. 2003. Kinetics study of endogenous heat shock
protein 70 expression. J Biochem Enginer. 125: 794-797.
Wilaison S, Makoto M. 2009. Effect of selenium on hatchability and cellular glutathione peroxidase mRNA expression during embryogenesis in japanis quail (Coturnix japonica). J Poult Sci. 46: 340-344.
24
Yu J, Endong B. 2008. Effect of acute stress on heat shock protein 70 and its corresponding mRNA Expression in the heart, liver and kidney of broiler. Asian-Aust J Anim Sci. 21(8): 1116-1126.
Yuan D, Zhan XA, Wang YX. 2012. Effect of selenium sources on the expression of cellular glutathione peroxidase and cytoplasmic thioredoxin reductase in the liver and kidney of broiler breeders and their offspring. Poult Sci. 91: 936-942.
25 Perlakuan 2 0.25584233 0.12792117 35.43 <.0001
Galat 21 0.07582762 0.00361084
Total 23 0.33166996
Lampiran 2 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi HSP70 otak Perlakuan Jumlah Rataan Standar Perlakuan 2 0.03156825 0.01578413 7.56 0.0034
Galat 21 0.04386137 0.00208864
Total 23 0.07542962
Lampiran 4 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi HSP70 dada Perlakuan Jumlah Rataan Standar
Lampiran 5 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi GPX otak Perlakuan 2 0.00569508 0.00284754 18.45 <.0001
Galat 21 0.00324075 0.00015432
26
Lampiran 6 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi GPX otak Perlakuan Jumlah Rataan Standar
Lampiran 7 Hasil analisis sidik ragam pengaruh perlakuan terhadap ekspresi GPX dada Perlakuan 2 0.14164675 0.07082338 6.28 0.0073 Galat 21 0.23679175 0.01127580
Total 23 0.37843850
Lampiran 8 Uji lanjut Duncan pengaruh perlakuan terhadap ekspresi GPX dada Perlakuan Jumlah Rataan Standar
Lampiran 9 Hasil analisis sidik ragam pengaruh perlakuan terhadap aktifitas enzim GSH-Px Perlakuan 2 84283.4328 42141.7164 15.53 <.0001
Galat 21 56971.6625 2712.9363
Total 23 141255.0953
Lampiran 10 Uji lanjut Duncan pengaruh perlakuan terhadap aktifitas enzim GSH-Px
27
Lampiran 11 Hasil analisis sidik ragam pengaruh perlakuan terhadap kandungan MDA Perlakuan 2 2.94662908 1.47331454 25.20 <.0001
Galat 21 1.22796825 0.05847468
Total 23 4.17459733
Lampiran 12 Uji lanjut Duncan pengaruh perlakuan terhadap kandungan MDA Perlakuan Jumlah Rataan Standar
deviasi
Lampiran 13 Hasil analisis sidik ragam pengaruh perlakuan terhadap konsumsi ransum Perlakuan 2 180801.2336 90400.6168 5.12 0.0327
Galat 9 158865.4928 17651.7214
Total 11 339666.7265
Lampiran 14 Uji lanjut Duncan pengaruh perlakuan terhadap konsumsi ransum Perlakuan Jumlah Rataan Standar
Lampiran 15 Hasil analisis sidik ragam pengaruh perlakuan terhadap bobot badan Sumber Derajat
bebas
Jumlah kuadrat Kuadrat tengah
F hitung Pr > F Perlakuan 2 172333.4999 86166.7500 35.48 <.0001
Galat 9 21856.6004 2428.5112
28
Lampiran 16 Uji lanjut Duncan pengaruh perlakuan terhadap bobot badan Perlakuan Jumlah Rataan Standar
Lampiran 17 Hasil analisis sidik ragam pengaruh perlakuan terhadap PBB Sumber Derajat
bebas
Jumlah kuadrat Kuadrat tengah
F hitung Pr > F Perlakuan 2 174100.7769 87050.3885 35.66 <.0001
Galat 9 21972.8594 2441.4288
Total 11 196073.6364
Lampiran 18 Uji lanjut Duncan pengaruh perlakuan terhadap PBB Perlakuan Jumlah Rataan Standar
Lampiran 19 Hasil analisis sidik ragam pengaruh perlakuan terhadap FCR Sumber Derajat
bebas
Jumlah kuadrat Kuadrat tengah
F hitung Pr > F Perlakuan 2 0.07160517 0.03580258 3.68 0.0679
Galat 9 0.08754975 0.00972775
Total 11 0.15915492
Lampiran 20 Uji lanjut Duncan pengaruh perlakuan terhadap FCR Perlakuan Jumlah Rataan Standar
29
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 04 Juli 1987 di Solok, Sumatera Barat. Penulis merupakan anak kelima dari enam bersaudara, orang tua bernama Amizar Basir dan Alismar. Penulis mengawali pendidikan di Taman Kanak-Kanak (TK) Al-Munawwarah Talang, selanjutnya di Sekolah Menengah Pertama Negeri 1 Gunung Talang dan Sekolah Menengah Atas Negeri 1 Kubung, Provinsi Sumatera Barat. Pendidikan sarjana di tempuh di Program Studi Nutrisi dan Makanan Ternak, Fakultas Peternakan Universitas Andalas (UNAND) Padang pada tahun 2005 hingga memperoleh gelar Sarjana Peternakan (SPt) pada tahun 2009. Pada tahun yang sama, penulis melanjutkan studi Pascasarjana di Program Studi Kimia, Pemusatan Bioteknologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, UNAND hingga memperoleh gelar Magister Sains pada tahun 2011.