PENCERNAAN AYAM BROILER TERHADAP
Escherichia coli
dan
Salmonella
spp. PADA BERBAGAI MEDIA, AERASI, pH
dan SUHU
GUSMINARNI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul
Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler
Terhadap Escherichia colidan Salmonellaspp. Pada Bebagai Media, Aerasi,
pH dan Suhu. adalah hasil karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Gusminarni
GUSMINARNI Inhibitory Activity of Bacteria Isolated from Digestive Track of Chicken Broiler Against Escherichia coli and Salmonella spp. at Several Growth Media, Aeration, pH, and Temperature. Under Direction of YULIN LESTARI and MIN RAHMINIWATI
This research aim to study the Inhibition activity of bacteria isolated from digestive track chicken broiler against Echerichia coli and Salmonella sp. at several growth media, aeration, pH and temperature. Isolation of digestive track broiler bacteria was conducted by usingNutrient Agar (NA) media at pH 7.0 and pH 4.5. The isolates were assayed against Echerichia coli and Salmonella sp. The isolates which showed inhibition capability were selected, microscopically identified, Gram stained and used for further assay The inhibitory activity of selected isolates was examined using De Man Ragosa (MRS ) and Tripton Glucosa Yeast Extract (TGY) media, with and without agitation. The selected media was then modified with molasses and soybean meal as source of carbon and nitrogen, respectively. The stability of inhibitory activity was examined at five levels of temperature (250C, 300C, 370C, 400C, 500C), and seven pH levels (3.0, 4.0, 5.0, 6.0, 7.0, 8.0, and 9.0). The selected isolates were also enzimatically assayed for amylase, protease, lipase, and cellulose activity. The results showed that 7n isolate produced the highest inhibition activity against E. coli and
Salmonella enteric. For E coli strong inhibition showed by 7n isolate at MRS modified media, pH 6.0-8.0, and temperature at 370C, and similar condition applied also for EPEC K1-1, except the highest inhibition occured at 500C. For
Salmonella enteric growth inhibition by 7n isolate was obtained using MRS modified media, pH 5, and temperature at 300C. For other Salmonella subsp.2 small inhibition by 34n occurred at both MRS and TGY modified at pH 4.0-5.0 and temperature at 370C. Both 7n and 34 isolates showed amylase, protease, lipase and cellulose activity. The results indicate that both isolates have their potency to be developed as probiotics, served as feed additive. The isolates are expected can function as growth promoter through their antibacterial and degrading enzymes activities.
RINGKASAN
GUSMINARNI. Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler Terhadap Escherichia coli dan Salmonella spp. Pada Berbagai Media, Aerasi, pH dan Suhu. Dibimbing oleh YULIN LESTARI dan MIN RAHMINIWATI.
Indonesia merupakan negara berkembang dengan tingkat pertumbuhan penduduk yang cukup tinggi. Peningkatan jumlah penduduk serta meningkatnya kesadaran masyarakat akan kebutuhan gizi yang baik untuk keluarga, mendorong meningkatnya permintaan akan bahan pangan hewani sebagai sumber protein. Salah satu bahan pangan hewani yang bermutu tinggi adalah produk asal ayam. Akan tetapi pemenuhan akan bahan pangan ini sering mendapat kendala. Masalah utama dalam peningkatan produksi ternak termasuk ayam adalah penyediaan pakan, terutama sebagai sumber protein dan energi yang masih diimpor dan sebagai konsekuensinya harga pakan meningkat. Untuk efisiensi pakan biasanya dengan pemberian feed additive sebagai zat pemacu tumbuh (growth promotant). Zat pemacu tumbuh yang umum dipakai berasal dari kelompok antibiotik.
Penggunaan antibiotik mempunyai sifat positif seperti meghambat infeksi bakteri patogen dan memacu pertumbuhan. Akan tetapi antibiotik mempunyai efek samping yaitu ikut hadirnya residu antibiotik dalam produk yang dihasilkan sehingga mengakibatkan efek teratogenik, karsinogenik, mutagenik, resistensi bakteri patogen serta. membunuh bakteri pencernaan yang menguntungkan.
Untuk memicu produksi dan reproduksi ternak yang lebih aman maka dicari zat pengganti antibiotik seperti probiotik, dan enzim. Probiotik adalah makanan tambahan (feed additive) berupa mikroba hidup, baik bakteri maupun kapang atau
yeast yang dapat menguntungkan bagi inagnya dengan jalan meningkatkan keseimbangan mikroflora dalam saluran pencernaan ternak. Enzim adalah senyawa protein yang berfungsi sebagai katalisator untuk mempercepat reaksi pemecahan senyawa komplek menjadi sederhana yang tersusun dari serangkaian asam amino dalam susunan yang teratur dan tetap. Sebagai protein, enzim diproduksi dan digunakan oleh sel hidup untuk mengkatalisis reaksi, antara lain konversi energi dan metabolisme pertahanan sel.
Penelitian ini bertujuan mengkaji aktivitas antibakteri, dari metabolit bakteri asal saluran pencernaan ayam broiler terhadap Escherichia coli dan
Salmonella sp. Kajian juga dilakukan terhadap aktivitas proteolitik, amilolitik, lipolitik, selulolitik dari metabolit yang dihasilkan bakteri asal saluran pencernaan ayam pada beberapa media, aerasi, pH, dan suhu.
Isolasi bakteri asal saluran pencernaan ayam broiler (tanpa antibiotik) dengan menggunakan media NA pH 7.0 dan pH 4.5. Bakteri yang didapat di uji antagonis terhadap EPEC K1-1, E. coli, Salmonela subsp.2, Salmonella enteric
5.0, 6.0, 7.0, 8.0, 9.0).
Hasil isolasi diperoleh 72 isolat terdiri dari 38 isolat pada media NA dengan pH 7.0 dan 34 isolat pada media NA dengan pH 4.5. Bagian saluran yang digunakan untuk isolasi bakteri antara lain duodenum, ileum dan intestinum crasum. Pada duodenum diperoleh 11 isolat, ileum 14 isolat dan intestinum crasum47 isolat. Hasil uji antagonis menunjukkan 19 isolat mampu menghambat EPEC K1-1 yang terdiri dari 13 isolat dari pH 7.0 dan 6 isolat dari pH 4.5. Penghambatan terhadap E. coli diperoleh 30 isolat, terdiri dari 18 isolat dari pH 7.0 dan 12 isolat dari pH 4.5. Penghambatan terhadap Salmonella enteric
didapatkan 21 isolat terdiri dari 7 isolat dari pH 7.0 dan 14 isolat dari pH 4.5. Waktu inkubasi yang paling baik adalah 48 jam. Setelah diseleksi dan diidentifikasi diperoleh empat isolat terpilih yaitu isolat 7n, 25n, 27n, dan 34n. Keempat isolat merupakan kelompok Bacillus yang mempunyai aktifitas penghambatan terhadap EPEC K1-1, E. coli, Salmonella enteric dan Salmonella
subsp.2.
Isolat terpilih dioptimasi aktivitas penghambatannya terhadap media, pH dan suhu. Dari hasil optimasi terhadap media MRS modifikasi dan TGY modifikasi diperoleh isolat 7n, 25n, dan 27n aktivitas penghambatannya terbaik ditumbuhkan pada media MRS modifikasi tanpa agitasi dan untuk isolat 34n media terbaiknya adalah media TGY modifikasi tanpa agitasi. Hasil optimasi terhadap suhu dan pH diperoleh aktifitas penghambatan tertinggi terhadap EPEC K1-1 oleh isolat 7n sebesar 19mm pada media MRS modifikasi suhu 500C dan pH 7.0. Penghambatan tertinggi terhadap E.coli asal ayam oleh isolat 25n sebesar 29 mm pada media MRS modifikasi suhu 400C dan pH 8.0. Aktifitas penghambatan terhadap Salmonella enteric oleh isolat 7n pada media MRS modifikasi dengan suhu 300C dan pH 5.0. Penghambatan terhadap Salmonella
subsp.2. oleh isolat 34n sebesar 19mm pada media MRS modifikasi suhu 370C dan pH 9.0. Keempat isolat menunjukkan aktifitas penghambatan pada kisaran suhu 300C hingga 500C dan kisaran pH 5.0 hingga pH 9.0.
Hasil uji enzim menunjukkan bahwa isolat 7n, 25n, 27n, 34n mempunyai kemampuan menghasilkan enzim amilase, protease, lipase dan selulase ekstraseluler. Dimana isolat 7n mempunyai nilai indeks paling tinggi dengan indeks amilase 0.67, indeks protease 1.5, indeks lipase 1, dan indeks selulase 2. Isolat 27n menghasilkan enzim amilase, protease dan selulase tapi tidak menghasilkan enzim lipase.
Dengan demikian isolat 7n, 25n, 27, dan 34n efektif menghambat pertumbuhan EPEC K1-1, E. coli, Salmonella enteric, Salmonella subsp.2 asal ayam sehingga berpotensi sebagai biokontrol pada ternak ayam pedaging (broiler). Aktivitas penghambatan yang lebih kecil pada media modifikasi dibanding media umum diduga disebabkan oleh kandungan molase dan tepung kedelai masih kompleks. Keempat isolat diharap dapat digunakan sebagai probiotik dan makanan tambahan (feed additive) pengganti antibiotik.
©Hak cipta milik IPB tahun 2009 Hak cipta dilindungi Undag Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENCERNAAN AYAM BROILER TERHADAP
Escherichia coli
dan
Salmonella
spp. PADA BERBAGAI MEDIA, AERASI, pH
dan SUHU
GUSMINARNI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Terhadap Escherichia coli dan Salmonella spp. Pada Berbagai Media, Aerasi, pH dan Suhu
Nama : Gusminarni NRP : G351070071
Disetujui Komisi Pembimbing
Dr. Ir. Yulin Lestari drh. Min Rahminiwati, M.S.PhD
Ketua Anggota
Diketahui
Ketua Mayor Mikrobiologi Dekan Sekolah Pascasarjana
Dr. Ir. Gayuh Rahayu Prof. Dr. Ir. Khairil A. Notodipuro, M.S
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah (tesis) ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2008 sampai April 2009 adalah Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler Terhadap Escherichia coli dan Salmonella spp. Pada Bebagai Media, Aerasi, pH dan Suhu. Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar besarnya terutama kepada pembimbing, yaitu Dr. Ir. Yulin Lestari dan drh. Min Rahminiwati, M.S. PhD yang telah banyak memberikan bimbingan dan saran selama penelitian dan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Iman Rusmana selaku Penguji Luar Komisi yang telah banyak memberikan koreksi dan arahan untuk perbaikan tesis Ungkapan terima kasih juga penulis sampaikan kepada Bapak dan Ibu pengelola Laboratorium Mikrobiologi FMIPA IPB atas segala bantuan dan fasilitas yang diberikan selama penelitian dilakukan.
Terima kasih yang sebesar-besarnya penulis sampaikan pula kepada Departemen Agama Republik Indonesia yang telah memberikan beasiswa untuk melanjutkan studi S2 di Sekolah Pascasarjana IPB melalui Program Peningkatan Mutu Guru Madarasah. Penulis juga mengucapkan banyak terima kasih kepada Kepala MAN 2 Batusangkar, Bapak Drs. Anasril yang telah memberi izin penulis untuk tugas belajar di IPB, serta teman-teman guru MAN 2 Batusangkar atas dukungannya. Akhirnya ungkapan terima kasih juga penulis sampaikan kepada suami dan anak-anak tercinta atas doa, motivasi dan keihkhlasan mereka untuk ditinggalkan selama penulis menempuh pendidikan di IPB serta Bapak dan Ibu mertua, kakak, adik, kakak ipar, adik ipar yang membantu dalam merawat anak anak penulis selama penulis studi. Tidak lupa kepada rekan-rekan yang tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terima kasih atas bantuan dan kebersamaannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah inii bermanfaat bagi pembaca.
Bogor, Agustus 2009
PENCERNAAN AYAM BROILER TERHADAP
Escherichia coli
dan
Salmonella
spp. PADA BERBAGAI MEDIA, AERASI, pH
dan SUHU
GUSMINARNI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul
Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler
Terhadap Escherichia colidan Salmonellaspp. Pada Bebagai Media, Aerasi,
pH dan Suhu. adalah hasil karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Gusminarni
GUSMINARNI Inhibitory Activity of Bacteria Isolated from Digestive Track of Chicken Broiler Against Escherichia coli and Salmonella spp. at Several Growth Media, Aeration, pH, and Temperature. Under Direction of YULIN LESTARI and MIN RAHMINIWATI
This research aim to study the Inhibition activity of bacteria isolated from digestive track chicken broiler against Echerichia coli and Salmonella sp. at several growth media, aeration, pH and temperature. Isolation of digestive track broiler bacteria was conducted by usingNutrient Agar (NA) media at pH 7.0 and pH 4.5. The isolates were assayed against Echerichia coli and Salmonella sp. The isolates which showed inhibition capability were selected, microscopically identified, Gram stained and used for further assay The inhibitory activity of selected isolates was examined using De Man Ragosa (MRS ) and Tripton Glucosa Yeast Extract (TGY) media, with and without agitation. The selected media was then modified with molasses and soybean meal as source of carbon and nitrogen, respectively. The stability of inhibitory activity was examined at five levels of temperature (250C, 300C, 370C, 400C, 500C), and seven pH levels (3.0, 4.0, 5.0, 6.0, 7.0, 8.0, and 9.0). The selected isolates were also enzimatically assayed for amylase, protease, lipase, and cellulose activity. The results showed that 7n isolate produced the highest inhibition activity against E. coli and
Salmonella enteric. For E coli strong inhibition showed by 7n isolate at MRS modified media, pH 6.0-8.0, and temperature at 370C, and similar condition applied also for EPEC K1-1, except the highest inhibition occured at 500C. For
Salmonella enteric growth inhibition by 7n isolate was obtained using MRS modified media, pH 5, and temperature at 300C. For other Salmonella subsp.2 small inhibition by 34n occurred at both MRS and TGY modified at pH 4.0-5.0 and temperature at 370C. Both 7n and 34 isolates showed amylase, protease, lipase and cellulose activity. The results indicate that both isolates have their potency to be developed as probiotics, served as feed additive. The isolates are expected can function as growth promoter through their antibacterial and degrading enzymes activities.
RINGKASAN
GUSMINARNI. Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler Terhadap Escherichia coli dan Salmonella spp. Pada Berbagai Media, Aerasi, pH dan Suhu. Dibimbing oleh YULIN LESTARI dan MIN RAHMINIWATI.
Indonesia merupakan negara berkembang dengan tingkat pertumbuhan penduduk yang cukup tinggi. Peningkatan jumlah penduduk serta meningkatnya kesadaran masyarakat akan kebutuhan gizi yang baik untuk keluarga, mendorong meningkatnya permintaan akan bahan pangan hewani sebagai sumber protein. Salah satu bahan pangan hewani yang bermutu tinggi adalah produk asal ayam. Akan tetapi pemenuhan akan bahan pangan ini sering mendapat kendala. Masalah utama dalam peningkatan produksi ternak termasuk ayam adalah penyediaan pakan, terutama sebagai sumber protein dan energi yang masih diimpor dan sebagai konsekuensinya harga pakan meningkat. Untuk efisiensi pakan biasanya dengan pemberian feed additive sebagai zat pemacu tumbuh (growth promotant). Zat pemacu tumbuh yang umum dipakai berasal dari kelompok antibiotik.
Penggunaan antibiotik mempunyai sifat positif seperti meghambat infeksi bakteri patogen dan memacu pertumbuhan. Akan tetapi antibiotik mempunyai efek samping yaitu ikut hadirnya residu antibiotik dalam produk yang dihasilkan sehingga mengakibatkan efek teratogenik, karsinogenik, mutagenik, resistensi bakteri patogen serta. membunuh bakteri pencernaan yang menguntungkan.
Untuk memicu produksi dan reproduksi ternak yang lebih aman maka dicari zat pengganti antibiotik seperti probiotik, dan enzim. Probiotik adalah makanan tambahan (feed additive) berupa mikroba hidup, baik bakteri maupun kapang atau
yeast yang dapat menguntungkan bagi inagnya dengan jalan meningkatkan keseimbangan mikroflora dalam saluran pencernaan ternak. Enzim adalah senyawa protein yang berfungsi sebagai katalisator untuk mempercepat reaksi pemecahan senyawa komplek menjadi sederhana yang tersusun dari serangkaian asam amino dalam susunan yang teratur dan tetap. Sebagai protein, enzim diproduksi dan digunakan oleh sel hidup untuk mengkatalisis reaksi, antara lain konversi energi dan metabolisme pertahanan sel.
Penelitian ini bertujuan mengkaji aktivitas antibakteri, dari metabolit bakteri asal saluran pencernaan ayam broiler terhadap Escherichia coli dan
Salmonella sp. Kajian juga dilakukan terhadap aktivitas proteolitik, amilolitik, lipolitik, selulolitik dari metabolit yang dihasilkan bakteri asal saluran pencernaan ayam pada beberapa media, aerasi, pH, dan suhu.
Isolasi bakteri asal saluran pencernaan ayam broiler (tanpa antibiotik) dengan menggunakan media NA pH 7.0 dan pH 4.5. Bakteri yang didapat di uji antagonis terhadap EPEC K1-1, E. coli, Salmonela subsp.2, Salmonella enteric
5.0, 6.0, 7.0, 8.0, 9.0).
Hasil isolasi diperoleh 72 isolat terdiri dari 38 isolat pada media NA dengan pH 7.0 dan 34 isolat pada media NA dengan pH 4.5. Bagian saluran yang digunakan untuk isolasi bakteri antara lain duodenum, ileum dan intestinum crasum. Pada duodenum diperoleh 11 isolat, ileum 14 isolat dan intestinum crasum47 isolat. Hasil uji antagonis menunjukkan 19 isolat mampu menghambat EPEC K1-1 yang terdiri dari 13 isolat dari pH 7.0 dan 6 isolat dari pH 4.5. Penghambatan terhadap E. coli diperoleh 30 isolat, terdiri dari 18 isolat dari pH 7.0 dan 12 isolat dari pH 4.5. Penghambatan terhadap Salmonella enteric
didapatkan 21 isolat terdiri dari 7 isolat dari pH 7.0 dan 14 isolat dari pH 4.5. Waktu inkubasi yang paling baik adalah 48 jam. Setelah diseleksi dan diidentifikasi diperoleh empat isolat terpilih yaitu isolat 7n, 25n, 27n, dan 34n. Keempat isolat merupakan kelompok Bacillus yang mempunyai aktifitas penghambatan terhadap EPEC K1-1, E. coli, Salmonella enteric dan Salmonella
subsp.2.
Isolat terpilih dioptimasi aktivitas penghambatannya terhadap media, pH dan suhu. Dari hasil optimasi terhadap media MRS modifikasi dan TGY modifikasi diperoleh isolat 7n, 25n, dan 27n aktivitas penghambatannya terbaik ditumbuhkan pada media MRS modifikasi tanpa agitasi dan untuk isolat 34n media terbaiknya adalah media TGY modifikasi tanpa agitasi. Hasil optimasi terhadap suhu dan pH diperoleh aktifitas penghambatan tertinggi terhadap EPEC K1-1 oleh isolat 7n sebesar 19mm pada media MRS modifikasi suhu 500C dan pH 7.0. Penghambatan tertinggi terhadap E.coli asal ayam oleh isolat 25n sebesar 29 mm pada media MRS modifikasi suhu 400C dan pH 8.0. Aktifitas penghambatan terhadap Salmonella enteric oleh isolat 7n pada media MRS modifikasi dengan suhu 300C dan pH 5.0. Penghambatan terhadap Salmonella
subsp.2. oleh isolat 34n sebesar 19mm pada media MRS modifikasi suhu 370C dan pH 9.0. Keempat isolat menunjukkan aktifitas penghambatan pada kisaran suhu 300C hingga 500C dan kisaran pH 5.0 hingga pH 9.0.
Hasil uji enzim menunjukkan bahwa isolat 7n, 25n, 27n, 34n mempunyai kemampuan menghasilkan enzim amilase, protease, lipase dan selulase ekstraseluler. Dimana isolat 7n mempunyai nilai indeks paling tinggi dengan indeks amilase 0.67, indeks protease 1.5, indeks lipase 1, dan indeks selulase 2. Isolat 27n menghasilkan enzim amilase, protease dan selulase tapi tidak menghasilkan enzim lipase.
Dengan demikian isolat 7n, 25n, 27, dan 34n efektif menghambat pertumbuhan EPEC K1-1, E. coli, Salmonella enteric, Salmonella subsp.2 asal ayam sehingga berpotensi sebagai biokontrol pada ternak ayam pedaging (broiler). Aktivitas penghambatan yang lebih kecil pada media modifikasi dibanding media umum diduga disebabkan oleh kandungan molase dan tepung kedelai masih kompleks. Keempat isolat diharap dapat digunakan sebagai probiotik dan makanan tambahan (feed additive) pengganti antibiotik.
©Hak cipta milik IPB tahun 2009 Hak cipta dilindungi Undag Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENCERNAAN AYAM BROILER TERHADAP
Escherichia coli
dan
Salmonella
spp. PADA BERBAGAI MEDIA, AERASI, pH
dan SUHU
GUSMINARNI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Terhadap Escherichia coli dan Salmonella spp. Pada Berbagai Media, Aerasi, pH dan Suhu
Nama : Gusminarni NRP : G351070071
Disetujui Komisi Pembimbing
Dr. Ir. Yulin Lestari drh. Min Rahminiwati, M.S.PhD
Ketua Anggota
Diketahui
Ketua Mayor Mikrobiologi Dekan Sekolah Pascasarjana
Dr. Ir. Gayuh Rahayu Prof. Dr. Ir. Khairil A. Notodipuro, M.S
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah (tesis) ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2008 sampai April 2009 adalah Aktivitas Penghambatan Bakteri Asal Saluran Pencernaan Ayam Broiler Terhadap Escherichia coli dan Salmonella spp. Pada Bebagai Media, Aerasi, pH dan Suhu. Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar besarnya terutama kepada pembimbing, yaitu Dr. Ir. Yulin Lestari dan drh. Min Rahminiwati, M.S. PhD yang telah banyak memberikan bimbingan dan saran selama penelitian dan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Iman Rusmana selaku Penguji Luar Komisi yang telah banyak memberikan koreksi dan arahan untuk perbaikan tesis Ungkapan terima kasih juga penulis sampaikan kepada Bapak dan Ibu pengelola Laboratorium Mikrobiologi FMIPA IPB atas segala bantuan dan fasilitas yang diberikan selama penelitian dilakukan.
Terima kasih yang sebesar-besarnya penulis sampaikan pula kepada Departemen Agama Republik Indonesia yang telah memberikan beasiswa untuk melanjutkan studi S2 di Sekolah Pascasarjana IPB melalui Program Peningkatan Mutu Guru Madarasah. Penulis juga mengucapkan banyak terima kasih kepada Kepala MAN 2 Batusangkar, Bapak Drs. Anasril yang telah memberi izin penulis untuk tugas belajar di IPB, serta teman-teman guru MAN 2 Batusangkar atas dukungannya. Akhirnya ungkapan terima kasih juga penulis sampaikan kepada suami dan anak-anak tercinta atas doa, motivasi dan keihkhlasan mereka untuk ditinggalkan selama penulis menempuh pendidikan di IPB serta Bapak dan Ibu mertua, kakak, adik, kakak ipar, adik ipar yang membantu dalam merawat anak anak penulis selama penulis studi. Tidak lupa kepada rekan-rekan yang tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terima kasih atas bantuan dan kebersamaannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah inii bermanfaat bagi pembaca.
Bogor, Agustus 2009
Penulis dilahirkan di Bukitinggi pada tanggal 26 Agustus 1968 dari bapak Mislam (Alm) dan ibu Nurma (Almh). Penulis merupakan putri kelima dari enam bersaudara.
Pendidikan Dasar sampai Menengah Atas diselesaikan di Bukittinggi, Sumatera Barat. Tahun 1987 penulis lulus SMA Negeri 2 Bukittinggi dan pada tahun yang sama penulis lulus masuk perguruan tinggi Institut Keguruan Ilmu Pendidikan (IKIP) Padang melalui jalur Penelusuran Minat Dan Kemampuan (PMDK) pada jurusan Pendidikan Biologi FPMIPA, dan lulus pada tahun 1991.
Penulis bekerja sebagai guru honorer di SMA YPP Lubuk Alung Sumatera Barat dari tahun 1991 hingga 1992. Dari tahun 1993 hingga 1996 penulis mengajar di Madrasah Sumatra Tawalib Parabek Bukittinggi. Pada tahun 1994 penulis diangkat menjadi guru Biologi pada MAN 2 Batusangkar, Kabupaten Tanah Datar, Provinsi Sumatera Barat. Tahun 2007 penulis mendapatkan beasiswa dari Departemen Agama Republik Indonesia melalui program Peningkatan Mutu Guru Madarasah untuk melanjutkan studi pada mayor Mikrobiologi, Sekolah Pascasarjana IPB.
Penulis menikah dengan Sumintarto Nurwahyudi. Spd pada tahun 1996 dan dikaruniai 4 orang anak, Syafiq Wahyu Hidayat (12 tahun), Fadhel Ghalib Wahyudi (10 tahun), A.Nouval Dzakwan Wahyudi (5 tahun) dan Ghina Nasywa Fauzana (2 tahun).
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi DAFTAR GAMBAR ... vii DFTAR LAMPIRAN ... viii PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 2 Manfaat ... 2 TINJAUAN PUSTAKA ... 4 Mikroflora Usus ... 4 Probiotik ... 6 Prebiotik ... 8
Bacillus sp... 8
Escherichia coli... 10
Salmonellasp ... 12 Antibiotik ... 14 Enzim ... 15 Protease ... 16 Amilase ... 17 Lipase ... 19 Selulase ... 19 Molase ... 20 Tepung kedelai ... 21 BAHAN DAN METODE ... 22 Waktu dan Tempat ... 22 Bahan dan Alat ... 22 Metode ... 23 Isolasi Bakteri Saluran Pencernaan Ayam ... 23 Pemurnian Bakteri Hasil Isolasi ... 23 Peremajaan Bakteri Target ... 24 Uji Antagonis Langsung Bakteri Asal Saluran Pencernaan Ayam
terhadap EPEC K1-1,Salmonella enteric dan E. coli
Asal Ayam sertaSalmonellasubsp.2 Asal Ayam ... 24 Identifikasi / Karakterisasi Isolat Bakteri... 24 Esei Antagonis Isolat Terpilih Terhadap PertumbuhanE. coli,
Salmonellasubsp.2, EPEC K1-1,Salmonella enteric
dengan Metode Kirby-Bauer... 25 Optimasi Produksi Senyawa Bioaktif ... 25 Uji Kualitatif Aktivitas Amilase, Protease, Lipase, Selulase ... 26 HASIL DAN PEMBAHASAN ... 27
Isolasi dan Pemurnian Bakteri Asal Saluran Pencernaan
Kemampuan Penghambatan Bakteri Asal Saluran Pencernaan Ayam Terhadap EPEC K1-1,Salmonella entericdanE. Coli
Asal Ayam SertaSalmonellasubsp.2 Asal Ayam ... 31 Identifikasi Bakteri Asal Saluran Pencernaan Ayam Broiler ... 32 Esei Antagonis Isolat Terpilih Terhadap Pertumbuhan
E. coli, Salmonellasubsp.2, EPEC K1-1,Salmonella enteric
DAFTAR TABEL
Halaman
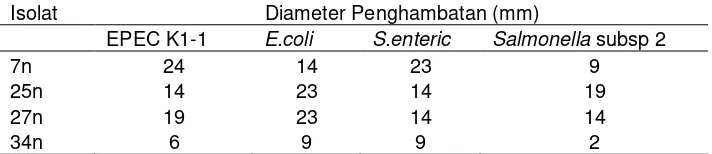
1 Mikroorganisme dalam saluran pencernaan ternak... 5 2 Tabel 2 Hasil Isolasi Bakteri Asal Saluran Pencernaan Ayam Broiler... 28 3 Tabel 3 Aktivitas penghambatan bakteri asal saluran pencernaan ayam
broiler erhadapE.coli, EPEC K1-1,Salmonella enteric... 31 4 Tabel 4 Hasil uji katalase isolat 7n, 25n, 27n, 34n ... 35 5 Tabel 5 Hasil uji penghambatan ekstrak kasar isolat 7n, 25n, 27n, 34n
terhadap EPEC K1-1,E. coli, Salmonella enteric,dan
Salmonellasubsp.2 ... 37 6 Tabel 6 Indeks amilolitik, proteolitik, lipolitik, selulolitik isolat
Halaman
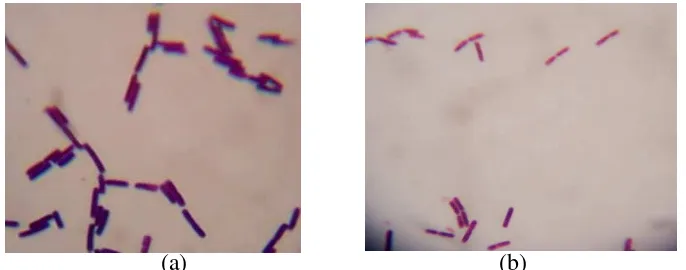
1 Struktur amilosa dengan ikatanα-1.4 D-glukosidik ... 17 2 Struktur amilopektin dengan ikatanα-1.4 danα-1.6- D glikosidik ... 18 3 Strutur selulosa dengan ikatanβ- (1,4) ... 20 4 Hasil pewarnaan Gram a (isolat 7n) diisolasi darijejenum,(isolat 25n)
dariintestinum crasumayam broiler berbentuk batang
(perbesaran 40 x 100) ... 33 5 Hasil pewarnaan Gram a (isolat 27n) b (isolat 34n) diisolasi dari
intestinum crasumayam broiler berbentuk batang Gram positif
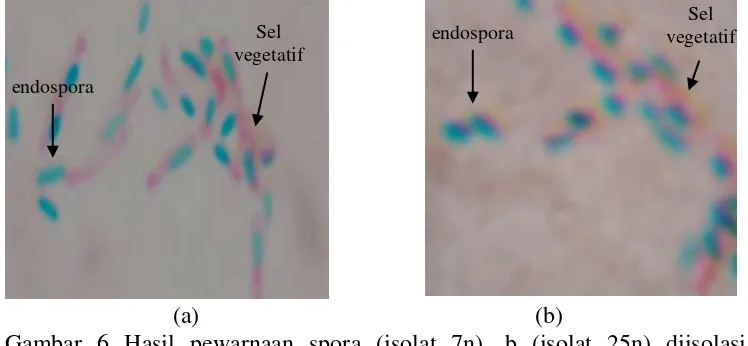
(perbesaran 40 x 100) ... 33 6 Hasil pewarnaan spora (isolat 7n), b (isolat 25n) diisolasi dari
intestinum crasumayam broiler (perbesaran 40 x 100) ... 34 7 Hasil pewarnaan spora (a) isolat 27n, (b) isolat 34n diisolasi
dariintestinum crasumayam broiler (perbesaran 40 x 100) ... 34 8 Aktifitas penghambatan isolat terpilih terhadap bakteri target
(a)EPEC K1-1, (b)E.coli Ф cakram kertas8mm ... 38 9 Aktifitas penghambatan isolat terpilih terhadap bakteri target
(a)Salmonella enteric(b)Salmonellasp. asal ayam,
Ф cakram kertas 8mm ... 38 10 Perbandingan aktivitas penghambatan antara sel dan filtrat kultur
dari isolat 7n, 25n, 27n, 34n terhadapE.coli... 39 11 Aktifitas penghambatan isolat terpilih terhadap (a) EPEC K1-1
(b)E. coliasal ayam ... 41 12 Aktifitas penghambatan isolat terpilih terhadap (a)Salmonella enteric
(b)Salmonellasubsp.2 asal ayam ... 42 13 Hubungan lama inkubasi dengan aktivitas penghambatan terhadapE.coli
(b) Salmonellasubsp.2 asal ayam ... 48 17 Aktifitas penghambatan isolat terhadap (a) EPEC K1-1 (b)E. coli ... 49 18 Aktifitas penghambatan isolat terhadap (a)Salmonella enteric
(b)Salmonellasubsp.2 asal ayam ... 50 19 Zona bening yang dihasilkan isolat 7n, 25n, 27n, 34n pada uji enzim
(a) amilase (b) protease ... 52 20 Zona bening yang dihasilkan isolat 7n, 25n, 27n, 34n pada uji enzim
(a) lipase (b) selulase ... 54
1 Komposisi kimia molase ... 68 2 Komposisi kimia tepung kedelai ... 68 3 Komposisi media peremajaan, produksi, serta uji daya hambat isolat .
asal saluran pencernaan ayam broiler terhadap EPEC K1-1,
E. coliasal ayam,Salmonella enteric,Salmonellasubsp.2 asal ayam ... 69 4 Komposisi Pereaksi Pewarnaan ... 71 5 Hasil isolasi dan identifikasi bakteri asal saluran pencernaan
ayambroilerpada media NA pH 7.0 ... 72 6 Hasil isolasi dan identifikasi bakteri asal saluran pencernaan
ayambroilerpada media NA pH 7.0 ... 73 7 Kurva Standar Isolat 7n ... 74 8 Kurva Standar Isolat 25n ... 75 9 Kurva Standar Isolat 27n ... 76 10 Kurva Standar Isolat 34n ... 77 11 Diameter (Ф) zona bening Isolat 7n, 25n, 27n, 34n yang diantagonis
dengan EPEC K1-1 diinkubasi pada berbagai tingkatan suhu ... 78 11 Diameter (Ф) zona bening Isolat 7n, 25n, 27n, 34n yang diantagonis
denganE. colidiinkubasi pada berbagai tingkatan suhu ... 78 11 Diameter (Ф) zona bening Isolat 7n, 25n, 27n, 34n yang diantagonis
denganSalmonella entericdiinkubasi pada berbagai tingkatan suhu ... 78 11 Diameter (Ф) zona bening Isolat 7n, 25n, 27n, 34n yang diantagonis
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara berkembang dengan tingkat pertumbuhan penduduk cukup tinggi. Peningkatan jumlah penduduk serta meningkatnya kesadaran masyarakat akan kebutuhan gizi yang baik untuk keluarga, menyebabkan meningkatnya permintaan akan bahan pangan hewani sebagai sumber protein. Salah satu bahan pangan hewani yang bermutu tinggi adalah produk asal ayam. Akan tetapi pemenuhan akan bahan pangan ini sering mendapat kendala. Masalah utama dalam peningkatan produksi ternak termasuk ayam pedaging (broiler) adalah penyediaan pakan. Pakan merupakan 70% biaya pemeliharaan. Pakan yang diberikan harus memberikan nutrisi yang dibutuhkan ayam, yaitu karbohidrat, protein, lemak, vitamin dan mineral, sehingga pertambahan berat badan perhari Average Daily Gain (ADGnya) akan tinggi..Pada saat ini pakan terutama sebagai sumber protein dan energi dipenuhi dari impor dan sebagai konsekuensinya harga pakan menjadi mahal.
Untuk meningkatkan efisiensi pakan biasanya dilakukan dengan cara memberi bahan tambahan (feed additive) sebagai zat pemacu tumbuh (growth promotant). Zat pemacu tumbuh yang umum dipakai berasal dari kelompok antibiotik seperti zinkbasitrasin, monensin, tetrasiklin dan penicilin. Selain untuk pemacu tumbuh antibiotik juga digunakan untuk megendalikan penyakit yang disebabkan oleh mikroba. Akan tetapi penggunaan antibiotik yang berlebihan mengandung resiko yaitu ikut hadirnya residu antibiotik dalam produk yang dihasilkan (telur dan daging) yang bersifat teratogenik, karsinogenik dan mutagenik. Resiko lainnya yaitu terjadinya resistensi mikroorganisme patogen seperti Salmonella sp. resisten streptomisin, E. coli resisten Enrofloxasin, dan membunuh bakteri yang menguntungkan.
jalan meningkatkan keseimbangan mikroflora dalam saluran pencernaan ternak (Fuller 1992).
Probiotik menggantikan penggunaan antibiotik sebagai pemacu tumbuh telah terbukti dapat meningkatkan produktivitas ternak. Mikroba yang sudah dinyatakan aman sebagai bahan pakan untuk ayam yaitu golongan bakteri seperti
Lactobacillus sp., Bacillus subtilis, serta dari golongan kapang seperti
Saccharomycessp. (Martin 1995; Haddadinet al. 1996; Jinet al.1996).
Untuk produksi mikroba sebagai probiotik dari segi industri harus memperhatikan efisiensi sehingga diperlukan optimasi produksi metabolit dari mikroba. Pertumbuhan mikroba sangat dipengaruhi oleh faktor lingkungan seperti suhu, pH, oksigen, tekanan osmosis dan faktor nutrisi terdiri dari sumber karbon, nitrogen, mineral (unsur makro dan mikro), vitamin (Stainer et al. 1976; Fardiaz 1989). Kebutuhan akan karbon untuk pertumbuhan mikroba yang paling baik diperoleh dari sumber karbohidrat yang dapat larut seperti glukosa, dan sumber nitrogen yang mudah larut seperti kasein. Namun penggunaan glukosa dan kasein memerlukan biaya yang tinggi, oleh karena itu untuk produksi sel mikroba dengan biaya yang lebih murah dan mudah didapat pada umumnya digunakan sumber karbon lain seperti molase dan sumber nitrogen dari tepung kedelai. Optimasi aktivitas senyawa bioaktif dari bakteri terpilih dilakukan terhadap media produksi yang menggunakan molase dan tepung kedelai, agitasi dan tanpa perlakuan agitasi, pH, dan suhu.
Tujuan
Penelitian ini bertujuan mengkaji aktivitas antibakteri dan aktivitas enzimatik dari metabolit bakteri asal saluran pencernaan ayam broiler. Aktivitas antibakteri dilakukan terhadap Escherichia coli dan Salmonella sp., sedangkan aktivitas enzimatik meliputi proteolitik, amilolitik, lipolitik, selulolitik. Optimasi produksi metabolit yang dihasilkan bakteri dilakukan pada berbagai media, aerasi, pH, dan suhu.
Manfaat
3
Mikroflora Usus
Mahluk hidup sebelum lahir atau menetas berada dalam keadaan steril, Ketika sudah berhubungan dengan dunia luar berbagai tipe mikroba masuk ke dalam tubuh baik dalam proses kelahiran atau menetas, maupun lewat makanan dan kontak dengan lingkungan. Mikroorganisme tersebut tinggal pada saluran pencernaan sampai makhluk hidup itu mati. Bagian dari saluran pencernaan yang paling banyak dihuni oleh bakteri adalah saluran usus. Mikroorganisme yang menempel pada saluran usus tersebut dinamakan mikroflora usus (Nakazawa 1992).
Mikroflora usus merupakan ekosistem yang kompleks terdiri dari sejumlah besar bakteri. Zat yang terdapat dalam ekosistem usus dapat berasal dari bahan luar yang berupa pakan dan dapat berasal dari dalam tubuh (endogeneus) seperti produk metabolisme yang harus dibuang. Mikroflora detrimental umumnya sangat aktif merombak zat yang terdapat dalam usus besar baik berasal dari bahan makanan beracun, obat obatan, steroid, maupun metabolit yang berasal dari bahan makanan (Hasono 2002). Hasil akhirnya adalah metabolit yang bersifat toksik (beracun), karsinogenik (menyebabkan kanker) atau metagenik (membentuk gas metan). Metabolit ini sering menyebabkan kerusakan mukosa usus bahkan membentuk tumor atau beberapa penyakit lain. Dalam kaitan ini proporsi bakteri “baik” akan mendesak atau mengencerkan mikroflora aktif diatas, sehingga zat toksik yang akan dibentuk tidak jadi karena, bahan pembentuknya sudah dibuang terlebih dahulu.
5
populasi tetapnya. Bakteri bakteri ini dapat diselidiki keberadaannya dengan menguji feses dari hostnya.
Pada saluran pencernaan ayam terdapat sekitar 100-400 mikroba yang menguntungkan dan merugikan. Mikroba menguntungkan seperti E. Coli, Lactobacillus, Streptococcus, Bacteroides, Enterococcus, Clostridia, dan yang merugikan seperti Salmonella sp. Bakteri bakteri itu hidup dalam keseimbangan. Kestabilan flora usus bisa terganggu antara lain oleh antibiotik, infeksi bakteri dan virus, kemoterapi, radiasi, pola makan, stres dan iklim (Gsianturi 2002).
[image:32.595.116.511.334.712.2]Menurut Utomo (2002 ) mikroorganisme pada saluran pencernaan ternak terdiri dari mikroorganisme seperti tercantum pada (Tabel 1).
Tabel 1 Mikroorganisme dalam saluran pencernaan ternak
Seikum Feses Lambung
Hewan Bakteri Ileum
(CFU) (CFU) (CFU) (CFU)
Ayam E.coli - - 106 106
Lactobacillus 109 109 106 109
Streptococcus 104 - -
-Bacteroides - - 109 107
Enterococcus - 104 107 107
Clostridia - - -
-Babi E.coli 105 106 107 105
Lactobacillus - 109 109 109
Streptococcus 106 - - 106
Bacteroides - - -
-Enterococcus - 107 107
-Clostridia - 107 108
-Kucing E.coli 104 - - 105
Lactobacillus 107 108 109
-Streptococcus - - - 107
Bacteroides - 109 109
-Enterococcus 106 108 108
Dari tabel terlihat pada saluran pencernaaan ayam Lactobacillus ditemui hampir diseluruh saluran pencernaan, bakteri ini kelompok bakteri baik. Sementara E.coli dan Bacteroides banyak ditemui pada pada lambung dan pada
ileum dan seikum tidak ditemui dan pada feses kembali ditemui dengan jumlah yang sama dengan di lambung. Enterococcus ditemui pada lambung dan pada seikum jumlahnya menurun kemudian pada feses jumlahnya meningkat kembali.
Streptococcushanya ditemui pada saluran pencernaan bagianileum
Mikroflora usus ayam pada umumnya bersumber dari permukaan telur yang tidak steril sebagai hasil kontak induk dengan sangkarnya. Sedangkan pada peternakan komersial, kolonisasi pada saluran usus ada hubungannya dengan kebersihan di hatchery dan kontak dengan lingkungan bebas. Jika saluran usus terkolonisasi dengan mikroba yang merugikan, maka akan berdampak patogen bagi tubuh. Untuk mengantisipasi serangan patogen, bakteri menguntungkan (probiotik) akan membangun pertahanan tanpa memberi ruang bagi bakteri patogen untuk menyerang tubuh (Gsianturi 2002).
Probiotik
Probiotik berasal dari bahasa Yunani yang artinya for life (untuk hidup) memiliki pemahaman yang berbeda-beda. Istilah probiotik pertama kali digunakan oleh Lilley dan Stiwell pada tahun (1965) menyatakan bahwa substansi yang dihasilkan mikroba untuk menstimulir pertumbuhan mikroba lainnya dalam saluran pencernaan. Lebih lanjut Fuller (1989) mendefinisikan probiotik sebagai bahan pangan yang mengandung mikroorganisme dalam keadaan hidup yang mempunyai pengaruh menguntungkan bagi inangnya dengan meningkatkan keseimbangan mikroflora usus.
7
kemudian diperbaharui oleh Salminen et al. (1999) probiotik yaitu sediaan sel mikroba atau komponen dari sel mikroba yang mempunyai pengaruh menguntungkan pada kesehatan dan kehidupan inangnya.
Menurut Fuller (1991) bakteri probiotik harus memiliki persyaratan yaitu memberikan efek yang menguntungkan pada host, tidak patogenik dan tidak toksik, mengandung sejumlah besar sel hidup, mampu bertahan dalam kondisi yang tidak menguntungkan dan melakukan kegiatan metabolisme dalam usus, tetap hidup selama dalam penyimpanan sampai waktu digunakan, mempunyai sifat sensori yang baik, diisolasi darihost.
Beberapa penelitian mengungkapkan pengaruh positif dari probiotik terhadap kesehatan adalah:
1. Memperbaiki keluhan malabsorbsi laktosa (Legowo 2003)
2. Meningkatkan ketahana alami terhadap infeksi di usus (Siswono 2002) 3. Mencegah diare yang diakibatkan oleh antibiotik (Gsianturi 2002)
4. Menurunkan resiko terjadinya penyakit tumor dan kanker kolon (Prangdimurti 2001)
5. Mengurangi kadar kolesterol darah (Tannock 1999) 6. Memperbaiki pencernaan (Fuller 1997)
7. Stimulasi imunitas gastrointestinal (Mc Cracken dan Gaskin 1999; Mc Farlane dan Cummings 1999).
Probiotik dapat digolongakan menjadi dua yakni golongan bakteri dan golongan cendawan. Menurut Mujiasih (2001) mikroorganisme yang sering digunakan sebagai probiotik dari kedua kelompok ini adalah Aspergilus niger, A. oryzae, Bacillus coagulans, B. lentis, B.pumilus, B. brevis, B. alvei,
B. circulans, Bifidobacterium adolescentis, B. animalis, B. bifidum, B. infantis,
B. longum, B. thermopilus, Bacteroides amylophilus, B. ruminicola, Lactobacillus
acidophilus, L. brevis, Streptococcus oremoris, S. faecium, S. lactis,
S. thermophilus, Leiconostoc mesenteroides, Pediococcus acidolacticii,
Propionibacterium shemani dan Saccharomyces cerevisiae.
enzim yang dapat menetralisir senyawa beracun yang tertelan atau dihasilkan oleh saluran pencernaan, (3) merangsang produksi enzim (enzim protease dan alfa-amilase) yang digunakan untuk mencerna pakan, (4) memproduksi vitamin dan zat zat yang tidak terpenuhi oleh tubuh (Seifert dan Gessler 1997). Menurut Sartikaet al. (1994) penggunaan probiotik dapat memperbaiki performance ayam broiler meliputi rataan bobot hidup, konversi pakan dan menurunkan mortalitas.
Prebiotik
Prebiotik pada umumnya adalah karbohidrat yang tidak tercerna dan tidak tidak diserap biasanya dalam bentuk oligosakarida (oligofruktosa) dan inulin (dietary fiber) (Reddy 1998; Grizard dan Barthomeuf 1999; Reddy 1999). Zat ini akan mengalami proses peragian di dalam usus besar, untuk menghasilkan makanan bagi bakteri yang menguntungkan (Karyadi 2003). Makanan tersebut sangat berguna bagi perkembangbiakan bakteri baik menjadi lebih banyak sehingga dapat mendominasi populasi bakteri dalam usus. Prebiotik dikenal juga sebagai nutrisi yang sesuai bagi bakteri baik akan tetapi tidak cocok bagi bakteri jahat.
Bacillussp.
Bacillus sp. merupakan bakteri Gram positif, berbentuk batang, dapat tumbuh pada kondisi aerob dan anaerob. Sporanya tahan terhadap panas (suhu tinggi), mampu mendegradasi Xylan dan karbohidrat (Cowan dan Stell’s 1973).
Bacillusspp mempunyai sifat : (1) mampu tumbuh pada suhu lebih dari 500C dan suhu kurang dari 50C, (2) mampu bertahan terhadap pasteurisasi, (3) mampu tumbuh pada konsentrasi garam tinggi (>10%), (4) mampu menghasilkan spora dan (5) mempunyai daya proteolitik yang tinggi dibandingkan mikroba lainnya.
Bacillus adalah salah satu genus bakteri yang berbentuk batang dan merupakan anggota dari divisi Firmicutes. Menurut Turnbull (1996) Bacillus merupakan bakteri aerob obligat atau fakultatif, dan positif terhadap uji enzim katalase.
Bacillus secara alami terdapat di mana-mana, dan termasuk spesies yang hidup bebas atau bersifat patogen. Beberapa spesiesBacillusmenghasilkan enzim ekstraseluler seperti protease, lipase, amilase, dan selulase yang bisa membantu pencernaan dalam tubuh hewan (Wongsa dan Werukhamkul 2007). JenisBacillus
9
probiotik komersil terdiri dari spora bakteri yang telah dikarakterisasi dan berpotensi untuk kolonisasi, immunostimulasi, dan aktivitas anti mikrobanya (Ducet al.2004).
Beberapa penelitian telah berhasil mengisolasi dan memurnikan bakteriosin
Bacillus sp.Gram positif diantaranya yaitu subtilin yang dihasilkan olehBacillus subtilis (Klein et al. 1993), megacin yang dihasilkan oleh B. megaterium
(Tagg et al. 1976), coagulin dihasilkan oleh B. coagulans I4 (Hyronimus 1998),
cerein dihasilkan oleh B. cereus (Oscariz dan Pisabarro 2000), dan tochicin yang dihasilkan olehB. thuringiensis(Paiket al.1997).
Senyawa antimikrob lain yang dihasilkan olehBacillus sp adalah basitrasin, pumulin, laterosporin, gramisidin, dan tirocidin yang efektif melawan bakteri Gram positif serta kolistin dan polimiksin bersifat efektif melawan bakteri Gram negatif. Sedangkan difficidin memiliki spektrum lebar, mikobacilin dan zwittermicin bersifat anti jamur (Todar 2005).
Bakteriosin yang dihasilkan oleh bakteri Gram positif biasanya merupakan polipeptida bermuatan positif yang dapat menembus membran sel dan tersusun kurang dari 60 residu asam amino. Berdasarkan struktur asam aminonya bakteriosin dapat diklasifikasikan ke dalam dua kelompok, yaitu:
1. Lantibiotik, yaitu kelompok bakteriosin yang dikarakterisasi oleh adanya jembatan sulfur intra rantai dan mengandung asam amino yang tidak lazim yaitu dehidrolanin, lantionin, dan β-metil lantionin, misalnya pada nissin yang dihasilkan oleh bakteri Lactococcus lactis (Hurst 1981) dan variacin
(Pridmoreet al.1996).
2. Non-lantibiotik, yaitu kelompok bakteriosin yang dapat dibagi dua berdasarkan bobot molekulnya, yaitu:
a. Bakteriosin dengan berat molekul relatif kecil yaitu sekitar 2 – 6 kDa (Lozano et al. 1992), misalnya pediocin Ach yang dihasilkan oleh
Pediococcus acidilactici .
b. Bakteriosin dengan berat molekul relatif besar biasanya di atas 30 kDa (Benoit et al. 1994), contohnya helveticin J yang dihasilkan oleh
Bakteriosin merupakan zat antimikroba berupa polipeptida, protein, atau senyawa yang mirip protein. Bakteriosin disintesis di ribosom oleh bakteri selama masa pertumbuhannya dan umumnya hanya menghambat pertumbuhan galur-galur bakteri yang berkerabat dekat dengan bakteri penghasil bakteriosin (Kone & Fung 1992; Jack et al. 1995). Menurut Tagget al. (1976), kriteria yang merupakan ciri-ciri bakteriosin adalah sebagai berikut: (1) memiliki spektra aktivitas yang lebih sempit, (2) senyawa aktif merupakan polipeptida atau protein, (3) bersifat bakterisida, (4) mempunyai reseptor spesifik pada sel sasaran, (5) gen determinan terdapat pada plasmid.
Escherichia coli
E. colitergolong bakteri Gram negatif,anaerob fakultatif, berbentuk batang, tidak membentuk spora, tidak tahan asam dan ukuran 2−3 x 0.6 μm (Gordon dan Jordan 1982). Bakteri ini hidup dalam saluran pencernaan hewan. Uji fisiologis menunjukkan bereaksi positif terhadap indol dan merah metil, negatif terhadap
Vogues-Proskauer, serta tidak menggunakan sitrat sebagai sumber karbon satu-satunya (Krieg dan Holt 1984).
Penyakit yang ditimbulkan oleh E. coli dapat digolongkan menjadi dua kelompok. PertamaE. coli yang bersifatoportunistik, artinya dapat menyebabkan penyakit dalam keadaan tertentu, misalnya kekurangan makanan atau mengikuti penyakit lain. Kedua bersifat enteropatogenic/enterotoksigenic, E. coli yang mempunyai antigen perlekatan dan memproduksi enterotoksin sehingga dapat menimbulkan penyakit. (Lay dan Hastowo 1992).
Faktor virulensi E. coli dipengaruhi oleh ketahanannya terhadap
pagositosis, kemampuan perlekatan terhadap epitel sel pernafasan dan ketahanannya terhadap daya bunuh oleh serum. E.coli yang patogen mempunyai struktur dinding sel yang disebut“pili”,yang tidak ditemukan pada serotipe yang tidak patogen (Tabbu 2000), dan “pili” inilah yang berperan dalam kolonisasi (Lay dan Hastowo 1992).
Ada tiga macam struktur antigen yang penting dalam klasifikasi E. coli
11
pengelompokannya diberi nomor 1,2,3 dan seterusnya. Antigen K merupakan polisakarida atau protein, bersifat tidak tahan panas dan berinterferensi dengan aglutinasi O, Antigen H mengandung protein, terdapat pada flagella yang bersifat termolabil.
Pada saat ini telah diketahui ada 173 grup serotipe antigen O74 jenis antigen K dan 53 jenis antigen H (Barnes dan Gross 1997). Serotipe yang banyak menyebabkan penyakit pada unggas adalah O1, O2, O35 dan O78 (Tabbu 2000), dan dikenal patogenitasnya cukup tinggi (Charltonet al.2000).
Kolibasilosis adalah penyakit pada unggas yang disebabkan oleh bakteri
E. coli yang patogen, sebagai agen primer ataupun sekunder. Infeksi E. coli atau koliseptikemia ini dapat terjadi pada ayam pedaging dan petelur dari semua kelompok umur, serta unggas lain seperti kalkun dan itik (Charlton et al. 2000). Tanda klinis kolibasilosis tidak spesifik dan dipengaruhi oleh umur ayam, lama infeksi, organ yang terserang dan adanya penyakit lain bersamanya. Pada ayam pedaging umur 4−8 minggu dan ayam petelur umur ±20 minggu dapat terjadi septikemia akut dan menimbulkan kematian, yang didahului dengan hilangnya nafsu makan, malas bergerak/inaktif dan mengantuk (Lee dan Lawrence 1998).
Penularan kolibasilosis biasanya terjadi secara oral melalui pakan, air minum atau debu/kotoran yang tercemar oleh E. coli.Debu dalam kandang ayam dapat mengandung 105–106 E. coli/gram dan bakteri ini dapat tahan lama, terutama dalam keadaan kering. Apabila debu tersebut terhirup oleh ayam, maka dapat menginfeksi saluran pernafasannya (Tabbu 2000).
Penyakit kolibasilosis dapat dimanifestasikan dalam bentuk kelainan organ, seperti: septikemia, enteritis, granuloma, omfalitis, sinusitis, airsacculitis, rithritis/synovitis, peritonitis, pericarditis, selulitis dan Swollen Head
Sekitar 10−15% dari seluruh E. coli yang ditemukan di dalam usus ayam yang sehat tergolong serotipe patogen. Bagian usus yang paling banyak mengandung kuman tersebut adalah jejunum, ileumdansekum. JenisE. coli yang terdapat di dalam usus tidak selalu sama dengan jenis yang ditemukan pada jaringan lain. Sebagai agen penyakit sekunder, E. coli sering mengikuti penyakit lain, misalnya pada berbagai penyakit pernafasan dan pencernaan yang menyerang ayam. Kenyataan di lapangan, timbulnya kasus kolibasilosis, terutama akibat pengaruh imunosupresif dari Gumboro (ayam pedaging lebih dominan dibanding petelur) dan sebagai penyakit ikutan padaChronic Respiratory Disease
(CRD), Infectious Coryza (Snot), Swollen Head Syndrome (SHS), Infectious Laryngo Tracheitis(ILT)dan koksidiosis(Tabbu 2000).
Galur E. coli yang menyebabkan diare dibedakan dalam enam kategori, yaitu enterotoxigenic Escherichia coli (ETEC), enterohaemorrhagic Escherichia coli (EHEC), enteroaggregative Escherichia. coli (EAEC), enteropathogenic Escherichia coli (EPEC), enteroinvasive Escherichia. coli (EIEC), dan cell-detaching Escherichia. coli(CDEC) (Nataro & Kaper 1998).
EPEC merupakan penyebab utama diare pada anak-anak di negara berkembang. Studi yang dilakukan di Brazil, Meksiko, dan Afrika Selatan memperlihatkan bahwa 30-40% diare pada anak-anak disebabkan oleh EPEC. Terapi yang dilakukan terhadap diare bertujuan untuk menjaga keseimbangan cairan tubuh, diantaranya melalui pemberian cairan (rehidrasi) secara oral dan konsumsi beberapa antibiotik (Nataro & Kaper 1998). Budiarti et al.(1998) mengisolasi EPEC dari feses anak-anak penderita diare. Salah satu isolat yaitu EPEC K1-1 diketahui memiliki resistensi terhadap ampisilin dengan menghasilkan enzimβ-laktamase secara ekstraseluler (Wahyuni 2006).
Salmonellasp.
Salmonella sp. adalah bakteri berbentuk batang Gram negatif, bersifat anaerob fakultatif tidak membentuk spora dan dapat bergerak. Uji fisiologis
Salmonellasp. menunjukkan H2S, merah metil, reduksi nitrat, sitrat, dulcitol, lisin,
13
termasuk ke dalam famili Enterobactericeae tribus escherichea (Fardiaz 1985). Bakteri ini dapat tumbuh pada suhu 50- 470C dengan suhu optimum 350- 370C, dan kisaran pH 4.1-9.0 dengan pH optimum 6.5-7.5. Pada pH dibawah 4.0 dan diatas 8.0 selSalmonellasp akan mati secara perlahan.
Tempat hidup primer dariSalmonellasp. adalah saluran pencernaan burung, reptil dan mamalia. Salmonellasp. dapat ditemukan dalam berbagai makanan asal ternak. Karena hidup dalam saluran pencernaan, maka adanya Salmonella sp. pada manusia dan hewan dapat terjadi tanpa disertai tanda tanda infeksi. Manusia dan hewan dapat dikatakan pembawa (carier). Pembawa sering menjadi masalah dalam kesehatan masyarakat karena dapat menularkan penyakit tetapi sulit untuk mendeteksinya. Pada unggas dapat ditemukan pembawa sebesar tiga-lima persen (Anonim 2008).
Menurut Jay (1986) Salmonella sp. diklasifikasikan berdasarkan pada analisis antigen, dan ini pertama kali dilakukan oleh Kauffmann dan White, sehingga klasifikasi ini disebut skema Kauffmann-White. Klasifikasi ini menggunakan dua macam antigen yaitu antigen somatik yang disebut antigen O dan antigen flagella yang disebut antigen H. Dengan klasifikasi ini maka spesies dan varietas ditempatkan pada kelompok A,B,C, dan seterusnya sesuai dengan persamaan dalam kandungan satu atau lebih antigen O. Hasilnya adalah
Salmonella schottmuellerri winlow dan Salmonella typhimurium loeffler
ditempatkan pada kelompok B, karena menunjukkan antigen O4 dan 12.
Salmonella typhi, Salmonella enteridis dan Salmonella gallinarum ditempatkan pada kelompok D dengan antigen O.9 dan 12. Antigen H dipisahkan menjadi fase spesifik atau fase satu dan fase kelompok atau fase dua. Fase spesifik hanya dimiliki oleh beberapa spesies atau varietas, sedang fase kelompok dimiliki oleh hampir semua spesies.
Penyakit yang disebabkan oleh Salmonella sp. yaitu salmonelosis dengan gejala gastroenteritis yaitu Salmonella yang menyerang saluran gastrointestin
dengan gejala muntah dan diare, sebagian kecil penderita mengalami pendarahan (septikemia). Pada orang-orang yang memiliki daya tahan tubuh yang sangat rendah, bakteri Salmonella dapat menginvasi aliran darah dan menyebabkan infeksi yang akan mengancam jiwa (Anonim 2008).
Antibiotik
Antibiotik berasal dari kata antibiosis yang berarti substansi yang dihasilkan oleh suatu mikroorganisme atau zat yang sama, sebagian atau seluruhnya dibuat secara sintetis kimia, yang dalam jumlah kecil dapat menghambat pertumbuhan atau mematikan mikroorganisme lain dengan cara menghentikan suatu proses biokimia sehingga terputusnya satu mata rantai metabolisme di dalam tubuh mikroorganisme. Penemuan antibiotik diawali oleh Alexander Fleming pada tahun 1928 yang mengamati adanya penghambatan pertumbuhan bakteri Staphylococcus aureus pada cawan petri oleh kontaminan yang akhirnya dikenal dengan Penicillium notatum. Zat aktif yang kemudian diisolasi dariP. notatumini diberi namapenicillin(Crueger dan Crueger 1984).
Sifat kerja antibiotik secara umum menurut Brander et al. (1991) dibagi dua yaitu bakteriostatik dimana sifat kerja antibiotik meghambat pertumbuhan bakteri lain, yang termasuk kedalam kelompok ini adalahsulfadinamid, tetrasiklin, kloramfenikol dan eritromisin. Bakterisidal adalah antibiotik menghambat pertumbuhan bakteri patogen sekaligus membunuh bakteri tersebut, sehingga banyak dipakai untuk terapi, yang termasuk kedalam kelompok ini adalah
penisilindan derifatnya,streptomisin, flavomisin, kolostin, vankomisin,, basitrasin, dansefalosporin.
Dalam dunia peternakan kegunaan antibiotik ada dua yaitu antibiotik untuk pemacu pertumbuhan dab antibiotik untuk terapi. Antibiotik untuk pemacu tumbuh dapat menekan pertumbuhan bakteri patogen yang berakibat meningkatnya populasi bakteri menguntungkan dalam saluran pencernaan. Penggunaan antibiotik untuk pemacu tumbuh terbukti dapat meningkatkan produksi ternak (Wiryosuharto 1990).
15
lingkungan. Antibiotik untuk terapi ada beberapa macam, diantaranya antibiotik berspektrum sempit yang bertujuan untuk membunuh bakteri negatif atau gram positif saja, antibiotik berspektrum luas yang mampu mengatasi kedua jenis bakteri tersebut (Branderet al.1991).
Antibiotika yang ditambahkan ke dalam pakan atau air minum mempunyai potensi tinggi menimbulkan residu antibiotika dalam produk hewan (daging, telur) untuk manusia (FAO/WHO 1992). Seperti yang dilaporkan oleh Rusiana (2008) dengan meneliti 80 ekor ayam broiler di Jabotabek menemukan 85% daging ayam broiler dan 37% hati ayam tercemar residu antibiotik tylosin, penicilin, oxytetracycline dan kanamycin. Antibiotika yang sering dicampur kedalam pakan adalah :Bacitracin, kuramisin, higromisin, kolistin, kiamisin, spiramisin, tiamulin, tilosin, virginiamisin, avilamisin, enramisin, flavomisin(bambermisin),tetrasiklin
(Dirjen Peternakan 1990).
Penggunaan antibiotik yang terus menerus pada peternakan berakibat buruk bagi ternak, munculnya mikroba target yang resisten antibiotik tetapi juga mikroba lain yang memiliki habitat yang sama dengan mikroba target. Hal ini dimungkinkan karena adanya transfer materi genetik (plasmid resisten) di antara genus bakteri yang berbeda yang masih memiliki hubungan dekat, meliputi bakteri E. coli, Klebsiella, dan Salmonela. Resistensi kolonisasi (colonization resistance) adalah istilah yang menggambarkan imunitas alami yang diperoleh manusia /hewan melalui keberadaan flora normal dalam saluran pencernaan sehingga manusia/hewan akan terlindungi dari kolonisasi/infeksi mikroorganisme dari luar tubuh (Naim 2007).
Enzim
Enzim saat ini banyak dikembangkan sebagai bahan aditif mendampingi probiotik seperti proteinase, amilase, selulase, xylanase, pectinase, lipase dan lain sebagainya yang diberikan kepada ternak. Dalam tubuh makhluk hidup enzim dapat diproduksi sendiri sesuai dengan kebutuhan, akan tetapi penambahan enzim pada pakan kadang masih dibutuhkan. Hal ini disebabkan beberapa hal seperti antinutrisi faktor pada bahan pakan (lekctins dan trypsin inhibitor), rendahnya efesiensi kecernaan bahan pakan, dan ketidak tersediaan enzim tertentu dalam tubuh ternak seperti xylanase dan ß-glucanase yang merupakan enzim untuk meningkatkan daya cerna pada ternakmonogastrik( Sjofjan 2009)
Protease
Enzim protease merupakan biokatalisator untuk reaksi pemecahan protein menjadi molekul yang sederhana seperti asam asam amino. Enzim ini akan mengkatalisis reaksi hidrolisis, yaitu reaksi yang melibatkan unsur air pada ikatan spesifik substrat. Karena itu, enzim ini termasuk dalam kelas utama enzim golongan hidrolase (Winarno 1983). Menurut Ward (1983) protease ialah enzim yang sangat kompleks, mempunyai sifat fisiko kimia dan sifat katalitik yang sangat bervariasi.
Protease dapat dihasilkan secara ekstraseluler dan intraseluler dan mempunyai peranan penting dalam metabolisme sel dan keteraturan proses dalam sel. Berdasarkan letak pemecahan peptida protease dapat dibedakan atas dua bagian, yaitu eksopeptidase dan endopeptidase. Eksopeptidase memotong ikatan peptida pada terminal amino atau karboksil dari substrat, sedangkan endopeptidase memotong bagian tengah dari ikatan peptida (Ward 1983).
Bakteri proteolitik adalah bakteri yang mempoduksi enzim protease ekstraseluler, yaitu enzim yang memecah protein yang diproduksi di dalam sel kemudian di lepaskan keluar dari sel. Semua bakteri memiliki enzim protease di dalam sel, tetapi tidak semua bakteri memiliki enzim protease ekstraseluler. Bakteri proteolitik dapat digolongkan menjadi beberapa kelompok: (1).Bakteri aerobik atau anaerobik fakultatif, tidak membentuk spora, misalnyaPseudomonas
17
misalnya Bacillus, (3). Bakteri anaerobik pembentuk spora, misalnya sebagian spesiesClostridium( Wikepedia 2006).
Amilase
Ezim yang menghidrolisis amilum menjadi molekul yang larut dalam air serta mempunyai berat molekul yang rendah seperti glukosa. Anderson (1958) dan Winarno (1983) mengelompokkan amilase ke dalam tiga golongan besar, yaitu
α-amilase, ß-amilase dan glukoamilase (amiloglukosidase). Enzim α–amylase
menghidrolisis ikatan -1.4 secara acak di bagian dalam (endoamilase) dan enzimß-amilasebekerja menghidrolisis ikatan-1.4 bagian ujung (eksoamilase). Enzim glukoamilase (EC.3.2.1.3) atau sering disebut amiloglukoksidase atau
α-1,4-glukano glukohidrolase merupakan enzim ekstraseluler yang mampu menghidrolisis ikatan α-1.4 pada rantai amilosa, amilopektin, glikogen, dan pullulan. Enzim glukoamilase juga dapat menyerang ikatan -1.6 pada titik percabangan, walaupun dengan laju yang lebih rendah. Hal ini berarti bahwa pati dapat diuraikan secara sempurna menjadi glukosa (Soebiyanto 1986; DeMan 1997).
Amilum terbagi menjadi dua fraksi yaitu amilosa dan amilopektin yang keduanya memiliki sifat yang berbeda secara fisik. Amilosa larut dalam air dan mudah terhidrolisa dibandingkan dengan amilopektin. Amilosa merupakan hasil kondensasi molekul-molekul glukosa yang terdiri dari 300 atau lebih molekul
-D glukosa, tersusun dalam bentuk rantai panjang yang lurus (Anderson 1958). Molekul-molekul ini berhubungan satu dengan yang lainnya melalui ikatan
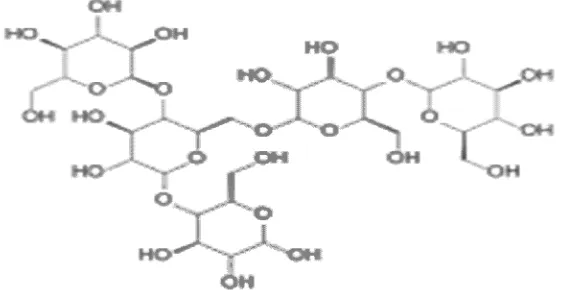
[image:44.595.143.440.575.700.2]-1,4 D-glukosidik seperti pada gambar 1 .
Amilopektin (Gambar 2) merupakan polimer dari glukosa, yang mengandung banyak rantai cabang yang terdiri dari 2000-3000 molekul glukosa pada rantai lurusnya dan 24-30 unit glukosa pada rantai cabang utama (Anderson 1958). Molekul molekul dari glukosa dihubungkan satu dengan yang lainnya dengan ikatan -1.4 dan -1.6- D glikosidik (Meyer 1978; Bergman 1981)
Gambar 2 Struktur amilopektin dengan ikatan-1.4 dan-1.6- D glikosidik (http://id.wikipedia.org/wiki/Amilopektin)
Enzim -amilase termasuk kedalam enzim endoamilase yang kerjanya menghidrolisis pati dari tengah-tengah rantai yang mengandung ikatan -1.4, dengan menghasilkan dua molekul dextrin. Dextrin adalah suatu homopolimer dari glukosa yang merupakan produk antara pada hidrolisa pati menjadi maltosa. Enzim ß-amilase bekerja dari ujung rantai polimer (eksoamilase) menghasilkan maltosa dan ß-limit dekstrin. Sama halnya dengan enzim -amilase, enzim ß-amilase juga tidak dapat memutus rantai ikatan-1.6, pada molekul amilopektin, sehingga degradasi amilopektin oleh enzim ini tidak sempurna, dekstrin yang dihasilkan berupa ß-limit dekstrin yang memiliki berat molekul yang tinggi.
19
molekul-molekul glukosa. Itulah sebabnya oleh Alagaratnam (1977) tahap pemecahan ini disebut juga tahap sakarifikasi.
Amilase merupakan enzim yang paling penting dan keberadaanya paling besar, pada bidang bioteknologi, enzim ini diperjual belikan sebanyak 25% dari total enzim yang lainya. Amilase didapatkan dari berbagai macam sumber, seperti tanaman, hewan dan mikroorganisme. Amilase yang berasal dari mikroorganisme banyak digunakan dalam industri, hal ini dikarenakan mikroorganisme periode pertumbuhanya pendek. Amilase pertama kali yang diproduksi adalah amilase yang berasal dari fungi pada tahun 1894 (Oliveira 2004).
Lipase
Enzim lipase merupakan kelompok enzim yang secara umum berfungsi dalam hidrolisis lemak, mono-, di-, dan trigliserida untuk menghasilkan asam lemak bebas dan gliserol (Suzuki et al. 1988; Kosugi et al. 1990). Asam lemak amat dibutuhkan dalam metabolisme mikroorganisme yang bersangkutan. Enzim lipase bersifat konstitutif artinya terus-menerus diekspresi tanpa membutuhkah induser. Ekspresi enzim lipase meningkat saat mikroorganisme memasuki fase kematian karena jumlah produk lemak dari sel-sel yang mati meningkat (Madiganet al. 2003).
Lipase memiliki potensi untuk memproduksi asam lemak, yang merupakan prekursor berbagai industri kimia. Produksi asam lemak secara industri menggunakan katalis kimia menghasilkan efek samping bagi lingkungan. Selain itu enzim lipase telah banyak dikenal memiliki cakupan aplikasi yang amat luas dalam bidang bioteknologi, seperti biomedikal, pestisida, pengolahan limbah, industri makanan, biosensor, detergen, untuk industri kulit dan industri oleokimia (memproduksi asam lemak dan turunannya) (Macrae 1983).
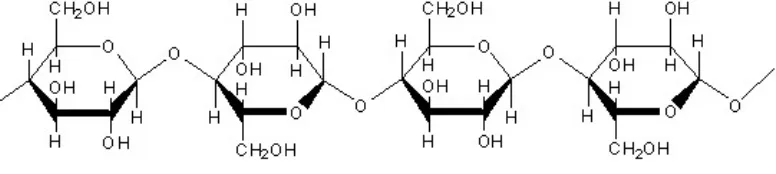
Selulase
(Saxena dan Brown 2005). Ikatan ini hanya dapat dipecah oleh enzim selulase yang hanya dapat disekresikan oleh mikroba selulolitik (Mc Donaldet al. 2002).
Gambar 3 Struktur selulosa dengan ikatanβ- (1,4)
Mikroba selulolitik pada umumnya akan mensekresikan tiga jenis enzim selulase, yaitu endoglukanase atau carboxymethylcellulase (CMC-ase),
eksoglukanase, dan β-glukosidase (Cai et al. 1999; Beauchemin et al. 2003). Proses degradasi selulosa pada prinsipnya melibatkan ketiga jenis enzim diatas yang bekerja secara sinergis, yaitu endo- dan exo- 1.4-β-glucanase serta β -glucosidase. (1) Endoglukanase, 1,4-β-D-glucan glucanohydrolase, CMC-ase,
secara acak menghidrolisis bagian dalam1.4-D-glycosidicdari glukosa. Hasil dari reaksi ini adalah memendeknya polimer glukosa secara cepat yang diikuti dengan meningkatnya gula reduksi secara perlahan-lahan; (2) Eksoglukanase, 1.4-β-D glucan cellobiohydrolase, Avicelase, menghidrolisis rantai ujung selulosa yang tidak tereduksi dengan selobiosa sebagai struktur primer; (3) β-glucosidase, cellobiase, menghidrolisis selobiosa menjadi glukosa (Robson dan Chambliss, 1989). Enzim CMC-ase merupakan enzim pertama dalam sistem enzim selulase sehingga tingkat aktivitasnya sangat menentukan dalam proses degradasi selulosa (Hobson 1988; Ding et al.2001; dan Chenet al.2004).
Molase
Lebih dikenal dengan tetes tebu merupakan hasil samping dari proses pembuatan gula tebu yang masih mengandung kadar gula sekitar 48-58 % (Novita 2001). Meningkatnya produksi gula tebu Indonesia sekitar sepuluh tahun terakhir ini akan meningkatkan produksi molase. Industri yang banyak memanfaatkan molase seperti industri alkohol, bir, asam amino, sodium glutamat.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA). Institut Pertanian Bogor (IPB) dari bulan Agustus 2008 – April 2009.
Bahan dan Alat
Kultur
Isolat bakteri yang diisolasi dari saluran pencernaan (duodenum, ileumdan
intestinum crasum) ayam broiler strain hybro tanpa diberi antibiotik. Bakteri patogen yang digunakan untuk uji antagonis adalah Escheria coli asal ayam, Salmonelasubsp.2 asal ayam yang diperoleh dari Laboratorium Bakteriologi FKH, dan EPHEC K1-1 koleksi Dr. dr. Sri Budiarti , Salmonela enteric koleksi dari Laboratorium Mikrobiologi Departemen Biologi, IPB Bogor.
Bahan Kimia
Bahan kimia yang digunakan adalah bahan untuk menumbuhkan mikroorganisme meliputi nutrient broth(NB) dengan komposisi 8 g/l,trypticase soy broth (TSB) dengan komposisi 30 g/l, De Man Ragosa sharpe (MRS) dan
tripton glucosa yeast ekstract (TGY). Media padat yaitunutrient agar(NA) dan
trypticase soy agar (TSA) dengan menambahkan 15g/l bacto agar, dan untuk media NA dan TSA semi solid ditambahkan 10 g/l bacto agar. Media MRS dan TGY modifikasi yang mengandung molase, dan tepung kedelai (Lampiran 3). Reagen untuk pewarnaan Gram yang meliputi kristal violet, garam yodium, alkohol asseton, dan safranin gram, reagen pewarnaan spora terdiri dari malakit hijau, safranin spora, aquades steril dan NaCl 0.85% (Lampiran 4).
Alat
Metode
Penelitian ini meliputi isolasi kultur bakteri asal saluran pencernaan ayam, pengujian aktivitas antagonis, identifikasi terhadap bakteri yang terpilih serta optimasi aktivitas senyawa bioaktif dari bakteri terpilih terhadap pertumbuhan bakteri patogen pada kondisi media, aerasi, pH dan suhu tertentu, serta uji kualitatif amilolitik, proteolitik, lipolitik dan selulolitik.
Isolasi Bakteri Saluran Pencernaan Ayam
Isolasi bakteri asal saluran pencernaan ayam broiler strainhybrotanpa diberi antibiotik dilakukan menurut metode F.Tomota (Lumyong et al. 2001 dalam (Simarmata 2007). Saluran pencernaan ayam dicuci bersih, kemudian dilakukan sterilisasi permukaan dengan cara merendam dalam etanol 70% selama 1 menit, natrium hipoklorit 5,3% selama 5 menit, kembali dengan etanol 70% selama 30 detik, kemudian saluran pencernaan dibilas dengan air steril beberap kali. Isolasi dilakukan dengan mengambil saluran pencernaan pada bagian duodenum, ileum, danintestinum crassumseberat 1 gr dan dilarutkan dalam larutan pepton 1 % yang mengandung 0.1% agar agar sebanyak 9ml. Larutan di vortex supaya homogen. Kemudian dilakukan pengenceran berseri dari 10-1- 10-6 dengan aquades 9 ml yang mengandung NaCl 0.85%.. Pada pengenceran 10-3hingga10-6diambil 100µ1 larutan dan disebar kecawan petri yang berisi media NA dengan pH 7.0 dan media NA dengan pH 4.5, dengan menambahkan asam klorida 10%, dilakukan secara duplo. Diinkubasi pada suhu ruang selama 24 jam. Pertumbuhan koloni diamati secara periodik.
Pemurnian Bakteri Hasil Isolasi
24
Peremajaan Bakteri Target
EPEC K1-1 diremajakan pada media NA + 100μg/ml ampisilin diinkubasi selama 24 jam pada suhu 370C. Satu koloni tunggal EPEC K1-1 dari media NA+ampisilin diinokulasikan ke dalam media NB+100 μg/ml ampisilin. Biakan ditumbuhkan pada suhu 370C dengan agitasi 100 rpm selama kurang lebih 2 jam.
E. coli diremajakan pada media NA dan ditumbuhkan selama 24 jam pada suhu 370C. Satu koloni tunggal E. coli diinokulasikan ke dalam media NB, diinkubasi pada suhu 370C dengan agitasi 100 rpm selama 24 jam. Salmonella enteric dan
Salmonella subsp.2 asal ayam diremajakan pada media TSA selama 24 jam pada suhu 370C. Satu koloni tunggal Salmonella enteric dan Salmonella subsp.2 asal ayam pada media TSA diinokulasikan ke dalam media TSB. Sel ditumbuhkan pada suhu 370C dengan agitasi 100 rpm selama 24 jam. Bakteri bakteri target ini untuk uji antagonis.
Uji antagonis langsung bakteri asal saluran pencernaan ayam terhadap
EPEC K1-1, Salmonella enteric dan E. coli asal ayam serta Salmonella
subsp.2 asal ayam.
Isolat diuji aktivitas penghambatannya terhadap EPEC K1-1, E. coli, Salmonelasubsp.2, Salmonella entericdengan menggunakan metode agar double layer (Lisboa et al. 2006). Bakteri target yang sudah diremajakan diinokulasikan sebanyak 100μl ke dalam 10ml media NA/TSA 50% dengan konsentrasi minimal 106 sel/ ml. Media tersebut dituangkan pada NA/TSA 100% padat (cawan
overlay). Setelah media memadat, isolat terpilih diinokulasikan dan diinkubasi selama 24 jam pada suhu 370C. Pengamatan dilakukan terhadap koloni bakteri yang mampu membentuk zona bening. Isolat isolat yang mampu membentuk zona bening akan diidentifikasi.
Identifikasi / Karakterisasi Isolat Bakteri
Dan untuk identifikasinya mengacu pada Bergeys Manual of Determinative Bacteriology (Krig dan Holt.1984).
Esei Antagonis Isolat Terpilih Terhadap Pertumbuhan E. coli, Salmonella
subsp.2, EPEC K1-1,Salmonella enteric dengan Metode Kirby-Bauer
Uji antagonis isolat terpilih dilakukan terhadap bakteri EPEC K1-1, E. coli, Salmonela subsp.2, Salmonell