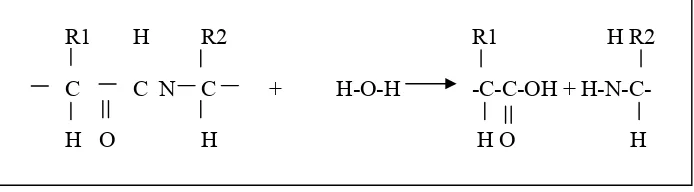DEPROTEINASI KULIT UDANG SECARA FERMENTASI
MENGGUNAKAN ISOLAT Bacillus licheniformis F11 PADA
EKSTRAKSI KITIN
Oleh
SITI RAHMI FATIHIYAH F34101092
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Siti Rahmi Fatihiyah. F3410192. Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus licheniformis F11 Pada Ekstraksi Kitin. Di bawah bimbingan Liesbetini Hartoto dan Niknik Nurhayati
RINGKASAN
Udang merupakan komoditas handal perikanan utama Indonesia (Sudibyo, 1991). Komoditas udang pada saat ini mengalami peningkatan produksi, baik diperoleh dari usaha penangkapan di alam maupun dari hasil budidaya dengan menggunakan tambak udang.
Ekspor udang pada tahun 2004 dari bulan Januari sampai dengan November sebesar 130.000 ton atau senilai 810.905.190 US$ (BPS, diolah oleh Departemen Kelautan dan Perikanan Republik Indonesia, 2003). Menurut Sudibyo (1991), sekitar 80 hingga 90 peresen udang diekspor dalam bentuk udang beku tanpa kepala dan kulit. Bobot kulit dan kepala ini dapat mencapai 25 hingga 30 persen dari bobot udang utuh, sehingga dapat diperkirakan bahwa kulit dan kepala yang dihasilkan pada tahun 2004 sampai dengan November cukup besar yaitu sebanyak 40.000 ton.
Limbah udang mudah sekali rusak akibat degradasi mikroba, sehingga berpotensi besar mencemarkan lingkungan. Semakin pesatnya perkembangan produksi udang, maka dibutuhkan penanganan terhadap limbah udang secara khusus. Pemanfaatan limbah udang selama ini adalah untuk pencampur ransum pakan ternak, bahan pencampur pembuatan terasi, petis dan kerupuk udang. Untuk meningkatkan nilai tambahnya, limbah udang tersebut dapat digunakan sebagai bahan baku pembuatan kitin dan kitosan. Kitin dan kitosan bernilai ekonomi tinggi dan telah dimanfaatkan untuk kosmetik, biomedis, farmasi, pertanian, pengolahan air limbah dan bidang bioteknologi (Suhartono, 1989). Kandungan kitin pada limbah cukup besar, yaitu sebesar 23,5 % (No et al. 1989). Kitin adalah polimer alami yang mempunyai banyak kelebihan, seperti mempunyai sifat biokompatibilitas, biodegradabilitas dan tidak beracun. Sifat khas kitin dapat didayagunakan untuk menangani cemaran logam beracun dan zat pewarna tekstil yang terakumulasi dalam perairan dan dapat menyerap bahan berprotein yang terdapat dalam air limbah industri pengolahan pangan. Kitin juga berpotensi sebagai bahan antibiotika dan benang operasi yang aman (Austin et al. 1981). Kegunaan kitin dalam bidang kesehatan antara lain adalah dalam perawatan luka bakar karena sesuai dengan jaringan otot dan dapat menyerap kolesterol dalam tubuh.
Pada ekstraksi kitin, perlu dilakukan penghilangan protein (deproteinasi) dan mineral (demineralisasi), karena selain kitin, dalam limbah kulit udang juga terdapat protein sebesar 16,9% dan mineral (abu) 63,6%, sehingga dalam pemurnian kitin, komponen tersebut perlu dihilangkan.
pada substrat yang relatif murah, mudah ditingkatkan hasilnya melalui pengaturan kondisi pertumbuhan serta mampu menghasilkan enzim dengan pH optimum yang lebih tinggi (Crueger dan Crueger, 1984).
Tujuan penelitian ini adalah mendapatkan kondisi proses terbaik untuk penghilangan protein (deproteinasi) limbah kulit udang pada ekstraksi kitin secara fermentasi dengan menggunakan islolat Bacillus licheniformis F11.
Penelitian dilakukan dengan memfermentasikan kulit udang dengan perlakuan variasi cara penambahan substrat kulit udang secara steril dan nonsteril. Penambahan kulit udang sebanyak 30 % (b/v) dilakukan secara langsung dan bertahap. Penelitian selanjutnya adalah dengan variasi persentase inokulum pada inokulum 10 persen, 20 persen dan 30 persen. Kemudian dilanjutkan dengan variasi ukuran serpihan kulit udang pada ukuran 2,1 mesh, 2,5 mesh dan 3,5 mesh. Pengamatan yang dilakukan terhadap media kultur setiap 6 jam sekali selama 48 jam adalah jumlah sel, kadar protein media kultur dan pH, sedangkan pengamatan yang dilakukan terhadap kulit udang setiap 12 jam sekali selama 48 jam adalah kadar protein limbah kulit udang. Pengamatan yang dilakukan pada penelitian selanjutnya adalah terhadap kulit udang sertiap 12 jam sekali selama 48 jam untuk mengukur kadar protein limbah kulit udang.
Hasil penelitian menunjukkan bahwa penurunan terbesar kadar protein kulit udang adalah pada penambahan substrat kulit udang secara bertahap dan kondisi steril, yaitu sebesar 47,34%. Penurunan kadar protein kulit udang pada penambahan substrat kulit udang secara bertahap dan kondisi nonsteril adalah sebesar 45,45%, sedangkan pada penambahan substrat kulit udang secara langsung kondisi steril dan nonsteril berturut-turut sebesar 36,08% dan 40,67%.
Siti Rahmi Fatihiyah. F3410192. Deproteinization of Shrimp Shell By Fermentation Using Bacillus licheniformis F11 In Chitin Extraction. Supervised by Liesbetini Hartoto and Niknik Nurhayati
SUMMARY
Shrimp is a potential commodity of main fisheries in Indonesia (Sudibyo, 1991). Production of shrimp commodity, from cacther enterprise in nature as well as from production in shrimp pond shows considerable increases.
Amount of shrimp exported since January until November 2004 was 13.000 ton or US$ 810,905.190 (BPS, processed by Oceanic and Fisheries Departement of Indonesia, 2003). Based on Sudibyo (1991), about 80 to 90 percent shrimp is exported in frozen shrimp form without the heads and the shells. The weight of those heads and shells are about 25 to 30 percent from total shrimp weight. From that amount, it could be measured that head and shell production from January to November 2004 was around 40.000 ton.
Shrimp waste is perishable material, helped by microbes degradation, but it is also potential to pollute the environment. It needs special treatment to overcome shrimp wastes problem because of the rapid increase in shrimp production. Nowadays, shrimp waste is used for feed, making of “terasi” and “petis” and shrimp chips. As an effort to increase its added value, shrimp waste can be used as material for making chitin and chitosan. Chitin and chitosan have high economic value and are used for cosmetics, biomedical, pharmacy, agriculture, waste water treatment and biotechnology (Suhartono, 1989). The content of chitin in shrimp wastes is high enough, that is 23,5% (No et al. 1989). Chitin is a natural polymer with a lot of advantages, e.g having biocompatibility, biodegradability and non toxic characteristic. Special characteristic of chitin is the ability to be used to treat toxic and textile colourant accumulated in fisheries and absorb materials rich of protein which are found in industrial waste of food processing. Chitin is also potential as antibiotic material and safe operation yard (Austin et al. 1981). Chitin is also used to recover burnt skin because it is compatible with human muscle and also can absorb cholesterol inside the body.
Deproteinization is needed in chitin extraction because shrimp shell waste also contains 16,9 % of protein and of 63,6% mineral, so that in chitin purification, that components are needed to be removed. Deproteinization could be done by fermentation using microbes which produces protease, such as Bacillus licheniformis F11. Fermentation can reduce pollution and energy inefficiency, because its specific reaction, nontoxic nature and low energy needs. Microbe as enzyme source gives more benefit because it can grow fast and use cheap substrate. Its yield is easy to be increased by optimization of growth condition and microbe also are capable to produce enzyme with higher optimum pH (Crueger and Crueger, 1984).
nonsterile condition. Additional of 30% shrimp shell is done in one step and in two steps. The next research was done with 10%, 20% and 30% inoculum percentage variation. The research was continued with shrimp shell size variation in 2,1 mesh, 2,5 mesh and 3,5 mesh. Observation of culture media once in every 6 hours was done to measure cells amount, protein content of culture media and pH. Observation of shrimp shell once in every 12 hours for 48 hours was done to evaluate the protein content of shrimp shell waste. Observation of shrimp shell in the next research was done once in every 12 hours for 48 hours to evaluate the protein content of shrimp shell waste.
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
DEPROTEINASI KULIT UDANG SECARA FERMENTASI MENGGUNAKAN ISOLAT Bacillus licheniformis F11
PADA EKSTRAKSI KITIN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh
SITI RAHMI FATIHIYAH F34101092
Dilahirkan pada tanggal 20 Mei 1983 Di Bogor, Jawa Barat
Tanggal lulus :
Menyetujui, Bogor, Februari 2006
BIODATA PENULIS
Penulis dilahirkan di Bogor pada tanggal 20 Mei 1983 dari seorang ibu yang bernama Titin Rochmah dan ayah bernama Oma Soemantri. Penulis merupakan anak kesembilan dari sepu- luh bersaudara. Penulis mendapatkan pendidikan dasar di SDN RIMBA PUTRA tahun 1989 sampai tahun 1995, SLTP di SLTP N 2 Bogor tahun 1995 sampai tahun 1998, dan SMU di SMUN 1
Bogor tahun 1998 sampai 2001. Penulis masuk ke Institut Pertanian Bogor (IPB) pada tahun 2001 melalui jalur USMI (Undangan Seleksi Masuk IPB) pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
KATA PENGANTAR
Dengan mengucap syukur ke hadirat Allah SWT, akhirnya penulis dapat menyelesaikan skripsi yang berjudul “Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus licheniformis F11 Pada Ekstraksi Kitin”. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan studi pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Skripsi ini merupakan hasil penelitian yang dilakukan selama lima bulan, terhitung dari bulan Februari hingga bulan Juli 2005, dan disusun berdasarkan acuan tinjauan pustaka. Selama penelitian hingga penyusunan skripsi ini, penulis banyak sekali mendapat bantuan dan dukungan dari berbagai pihak baik secara moril maupun materil, oleh karena itu, pada kesempatan ini ijinkan penulis untuk mengucapkan terima kasih sebesar-besarnya kepada:
1. Kedua orang tua tercinta Ayahanda Oma Soemantri dan Ibunda Titin Rochmah, sebagai orang yang telah membesarkan penulis dengan penuh cinta kasih dan pendorong semangat terhebat, serta kakak-kakak tercinta dan adik tercinta yang telah banyak berkorban selama penyusunan skripsi ini 2. Dr. Ir. Liesbetini Hartoto, MS selaku dosen pembimbing pertama atas segala
arahan dan bimbingan yang diberikan selama penulis melakukan penelitian hingga penyusunan skripsi.
3. Dr. Niknik Nurhayati selaku dosen pembimbing kedua atas segala arahan dan bimbingan yang diberikan selama penulis melakukan penelitian hingga penyusunan skripsi.
4. Dr. Ir Ono Suparno, MT selaku dosen penguji yang telah memberikan banyak masukan atas perbaikan dan penyempurnaan skripsi.
5. Seluruh staf dan karyawan di Laboratorium Teknologi Bioindustri, BPPT, Serpong, yang banyak membantu penulis selama melakukan penelitian. 6. Teman-teman seperjuangan di LTB (Laboratorium Teknologi Bioindustri):
7. Kawan-kawan TIN 38, dan semua pihak yang tidak dapat saya sebutkan satu persatu, terima kasih yang sebesar-besarnya.
Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang membutuhkan.
Bogor, Februari 2006
SURAT PERNYATAAN
Saya yang bertandatangan dibawah ini:
Nama : SITI RAHMI FATIHIYAH
NRP : F34101092
Judul Skripsi : Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus Licheniformis F11 Pada Ekstraksi Kitin
menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul diatas adalah hasil karya saya sendiri dengan arahan dosen pembimbing akademik, kecuali yang jelas ditunjukkan rujukannya.
Bogor, Februari 2006
DEPROTEINASI KULIT UDANG SECARA FERMENTASI
MENGGUNAKAN ISOLAT Bacillus licheniformis F11 PADA
EKSTRAKSI KITIN
Oleh
SITI RAHMI FATIHIYAH F34101092
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Siti Rahmi Fatihiyah. F3410192. Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus licheniformis F11 Pada Ekstraksi Kitin. Di bawah bimbingan Liesbetini Hartoto dan Niknik Nurhayati
RINGKASAN
Udang merupakan komoditas handal perikanan utama Indonesia (Sudibyo, 1991). Komoditas udang pada saat ini mengalami peningkatan produksi, baik diperoleh dari usaha penangkapan di alam maupun dari hasil budidaya dengan menggunakan tambak udang.
Ekspor udang pada tahun 2004 dari bulan Januari sampai dengan November sebesar 130.000 ton atau senilai 810.905.190 US$ (BPS, diolah oleh Departemen Kelautan dan Perikanan Republik Indonesia, 2003). Menurut Sudibyo (1991), sekitar 80 hingga 90 peresen udang diekspor dalam bentuk udang beku tanpa kepala dan kulit. Bobot kulit dan kepala ini dapat mencapai 25 hingga 30 persen dari bobot udang utuh, sehingga dapat diperkirakan bahwa kulit dan kepala yang dihasilkan pada tahun 2004 sampai dengan November cukup besar yaitu sebanyak 40.000 ton.
Limbah udang mudah sekali rusak akibat degradasi mikroba, sehingga berpotensi besar mencemarkan lingkungan. Semakin pesatnya perkembangan produksi udang, maka dibutuhkan penanganan terhadap limbah udang secara khusus. Pemanfaatan limbah udang selama ini adalah untuk pencampur ransum pakan ternak, bahan pencampur pembuatan terasi, petis dan kerupuk udang. Untuk meningkatkan nilai tambahnya, limbah udang tersebut dapat digunakan sebagai bahan baku pembuatan kitin dan kitosan. Kitin dan kitosan bernilai ekonomi tinggi dan telah dimanfaatkan untuk kosmetik, biomedis, farmasi, pertanian, pengolahan air limbah dan bidang bioteknologi (Suhartono, 1989). Kandungan kitin pada limbah cukup besar, yaitu sebesar 23,5 % (No et al. 1989). Kitin adalah polimer alami yang mempunyai banyak kelebihan, seperti mempunyai sifat biokompatibilitas, biodegradabilitas dan tidak beracun. Sifat khas kitin dapat didayagunakan untuk menangani cemaran logam beracun dan zat pewarna tekstil yang terakumulasi dalam perairan dan dapat menyerap bahan berprotein yang terdapat dalam air limbah industri pengolahan pangan. Kitin juga berpotensi sebagai bahan antibiotika dan benang operasi yang aman (Austin et al. 1981). Kegunaan kitin dalam bidang kesehatan antara lain adalah dalam perawatan luka bakar karena sesuai dengan jaringan otot dan dapat menyerap kolesterol dalam tubuh.
Pada ekstraksi kitin, perlu dilakukan penghilangan protein (deproteinasi) dan mineral (demineralisasi), karena selain kitin, dalam limbah kulit udang juga terdapat protein sebesar 16,9% dan mineral (abu) 63,6%, sehingga dalam pemurnian kitin, komponen tersebut perlu dihilangkan.
pada substrat yang relatif murah, mudah ditingkatkan hasilnya melalui pengaturan kondisi pertumbuhan serta mampu menghasilkan enzim dengan pH optimum yang lebih tinggi (Crueger dan Crueger, 1984).
Tujuan penelitian ini adalah mendapatkan kondisi proses terbaik untuk penghilangan protein (deproteinasi) limbah kulit udang pada ekstraksi kitin secara fermentasi dengan menggunakan islolat Bacillus licheniformis F11.
Penelitian dilakukan dengan memfermentasikan kulit udang dengan perlakuan variasi cara penambahan substrat kulit udang secara steril dan nonsteril. Penambahan kulit udang sebanyak 30 % (b/v) dilakukan secara langsung dan bertahap. Penelitian selanjutnya adalah dengan variasi persentase inokulum pada inokulum 10 persen, 20 persen dan 30 persen. Kemudian dilanjutkan dengan variasi ukuran serpihan kulit udang pada ukuran 2,1 mesh, 2,5 mesh dan 3,5 mesh. Pengamatan yang dilakukan terhadap media kultur setiap 6 jam sekali selama 48 jam adalah jumlah sel, kadar protein media kultur dan pH, sedangkan pengamatan yang dilakukan terhadap kulit udang setiap 12 jam sekali selama 48 jam adalah kadar protein limbah kulit udang. Pengamatan yang dilakukan pada penelitian selanjutnya adalah terhadap kulit udang sertiap 12 jam sekali selama 48 jam untuk mengukur kadar protein limbah kulit udang.
Hasil penelitian menunjukkan bahwa penurunan terbesar kadar protein kulit udang adalah pada penambahan substrat kulit udang secara bertahap dan kondisi steril, yaitu sebesar 47,34%. Penurunan kadar protein kulit udang pada penambahan substrat kulit udang secara bertahap dan kondisi nonsteril adalah sebesar 45,45%, sedangkan pada penambahan substrat kulit udang secara langsung kondisi steril dan nonsteril berturut-turut sebesar 36,08% dan 40,67%.
Siti Rahmi Fatihiyah. F3410192. Deproteinization of Shrimp Shell By Fermentation Using Bacillus licheniformis F11 In Chitin Extraction. Supervised by Liesbetini Hartoto and Niknik Nurhayati
SUMMARY
Shrimp is a potential commodity of main fisheries in Indonesia (Sudibyo, 1991). Production of shrimp commodity, from cacther enterprise in nature as well as from production in shrimp pond shows considerable increases.
Amount of shrimp exported since January until November 2004 was 13.000 ton or US$ 810,905.190 (BPS, processed by Oceanic and Fisheries Departement of Indonesia, 2003). Based on Sudibyo (1991), about 80 to 90 percent shrimp is exported in frozen shrimp form without the heads and the shells. The weight of those heads and shells are about 25 to 30 percent from total shrimp weight. From that amount, it could be measured that head and shell production from January to November 2004 was around 40.000 ton.
Shrimp waste is perishable material, helped by microbes degradation, but it is also potential to pollute the environment. It needs special treatment to overcome shrimp wastes problem because of the rapid increase in shrimp production. Nowadays, shrimp waste is used for feed, making of “terasi” and “petis” and shrimp chips. As an effort to increase its added value, shrimp waste can be used as material for making chitin and chitosan. Chitin and chitosan have high economic value and are used for cosmetics, biomedical, pharmacy, agriculture, waste water treatment and biotechnology (Suhartono, 1989). The content of chitin in shrimp wastes is high enough, that is 23,5% (No et al. 1989). Chitin is a natural polymer with a lot of advantages, e.g having biocompatibility, biodegradability and non toxic characteristic. Special characteristic of chitin is the ability to be used to treat toxic and textile colourant accumulated in fisheries and absorb materials rich of protein which are found in industrial waste of food processing. Chitin is also potential as antibiotic material and safe operation yard (Austin et al. 1981). Chitin is also used to recover burnt skin because it is compatible with human muscle and also can absorb cholesterol inside the body.
Deproteinization is needed in chitin extraction because shrimp shell waste also contains 16,9 % of protein and of 63,6% mineral, so that in chitin purification, that components are needed to be removed. Deproteinization could be done by fermentation using microbes which produces protease, such as Bacillus licheniformis F11. Fermentation can reduce pollution and energy inefficiency, because its specific reaction, nontoxic nature and low energy needs. Microbe as enzyme source gives more benefit because it can grow fast and use cheap substrate. Its yield is easy to be increased by optimization of growth condition and microbe also are capable to produce enzyme with higher optimum pH (Crueger and Crueger, 1984).
nonsterile condition. Additional of 30% shrimp shell is done in one step and in two steps. The next research was done with 10%, 20% and 30% inoculum percentage variation. The research was continued with shrimp shell size variation in 2,1 mesh, 2,5 mesh and 3,5 mesh. Observation of culture media once in every 6 hours was done to measure cells amount, protein content of culture media and pH. Observation of shrimp shell once in every 12 hours for 48 hours was done to evaluate the protein content of shrimp shell waste. Observation of shrimp shell in the next research was done once in every 12 hours for 48 hours to evaluate the protein content of shrimp shell waste.
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
DEPROTEINASI KULIT UDANG SECARA FERMENTASI MENGGUNAKAN ISOLAT Bacillus licheniformis F11
PADA EKSTRAKSI KITIN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh
SITI RAHMI FATIHIYAH F34101092
Dilahirkan pada tanggal 20 Mei 1983 Di Bogor, Jawa Barat
Tanggal lulus :
Menyetujui, Bogor, Februari 2006
BIODATA PENULIS
Penulis dilahirkan di Bogor pada tanggal 20 Mei 1983 dari seorang ibu yang bernama Titin Rochmah dan ayah bernama Oma Soemantri. Penulis merupakan anak kesembilan dari sepu- luh bersaudara. Penulis mendapatkan pendidikan dasar di SDN RIMBA PUTRA tahun 1989 sampai tahun 1995, SLTP di SLTP N 2 Bogor tahun 1995 sampai tahun 1998, dan SMU di SMUN 1
Bogor tahun 1998 sampai 2001. Penulis masuk ke Institut Pertanian Bogor (IPB) pada tahun 2001 melalui jalur USMI (Undangan Seleksi Masuk IPB) pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
KATA PENGANTAR
Dengan mengucap syukur ke hadirat Allah SWT, akhirnya penulis dapat menyelesaikan skripsi yang berjudul “Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus licheniformis F11 Pada Ekstraksi Kitin”. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan studi pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Skripsi ini merupakan hasil penelitian yang dilakukan selama lima bulan, terhitung dari bulan Februari hingga bulan Juli 2005, dan disusun berdasarkan acuan tinjauan pustaka. Selama penelitian hingga penyusunan skripsi ini, penulis banyak sekali mendapat bantuan dan dukungan dari berbagai pihak baik secara moril maupun materil, oleh karena itu, pada kesempatan ini ijinkan penulis untuk mengucapkan terima kasih sebesar-besarnya kepada:
1. Kedua orang tua tercinta Ayahanda Oma Soemantri dan Ibunda Titin Rochmah, sebagai orang yang telah membesarkan penulis dengan penuh cinta kasih dan pendorong semangat terhebat, serta kakak-kakak tercinta dan adik tercinta yang telah banyak berkorban selama penyusunan skripsi ini 2. Dr. Ir. Liesbetini Hartoto, MS selaku dosen pembimbing pertama atas segala
arahan dan bimbingan yang diberikan selama penulis melakukan penelitian hingga penyusunan skripsi.
3. Dr. Niknik Nurhayati selaku dosen pembimbing kedua atas segala arahan dan bimbingan yang diberikan selama penulis melakukan penelitian hingga penyusunan skripsi.
4. Dr. Ir Ono Suparno, MT selaku dosen penguji yang telah memberikan banyak masukan atas perbaikan dan penyempurnaan skripsi.
5. Seluruh staf dan karyawan di Laboratorium Teknologi Bioindustri, BPPT, Serpong, yang banyak membantu penulis selama melakukan penelitian. 6. Teman-teman seperjuangan di LTB (Laboratorium Teknologi Bioindustri):
7. Kawan-kawan TIN 38, dan semua pihak yang tidak dapat saya sebutkan satu persatu, terima kasih yang sebesar-besarnya.
Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang membutuhkan.
Bogor, Februari 2006
SURAT PERNYATAAN
Saya yang bertandatangan dibawah ini:
Nama : SITI RAHMI FATIHIYAH
NRP : F34101092
Judul Skripsi : Deproteinasi Kulit Udang Secara Fermentasi Menggunakan Isolat Bacillus Licheniformis F11 Pada Ekstraksi Kitin
menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul diatas adalah hasil karya saya sendiri dengan arahan dosen pembimbing akademik, kecuali yang jelas ditunjukkan rujukannya.
Bogor, Februari 2006
UCAPAN TERI MAKASI H
Selama empat tahun enam bulan penulis berhasil menyelesaikan
belajar di jurusan Teknologi I ndustri Pertanian, Fakultas Teknologi
Pertanian I nstitut Pertanian Bogor dengan penuh bimbingan, arahan,
saran dan kritik dari semua pihak. Oleh karena itu penulis mengucapkan
terima kasih yang sebesar-besarnya kepada:
1. I bu Liebetini Hartoto yang telah membimbing penulis hingga dapat
meraih yag dicita-citakan
2. I bu Niknik Nurhayati yang selalu membimbing dan mengarahkan
penulis selama melakukan penelitian hingga menyelesaikan skripsi ini
3. Seluruh staf pengajar TI N yang telah memberikan banyak ilmu kepada
penulis
4. Nugraheni Dyahwarni, Rizkiyana Utami, Anne Nurul Kusumawardani,
Wini Pratiwi, Wina Eka Wahyu Lestari, Astrid I ndrajati, Rizka Hezmela,
Dian Panca, Debbi Purnawati, A. Agung Purnama, M.Toni Darmawan,
M.Affan Badar, atas kebersamaan selama 4 tahun
5. Teman-teman ROHI S 38, Nurmalia Muliyati, Asti Lestari, Retno
Widyowati, Hanni Daylistiyo, Amalia Ulfah, Siti Muzdalifah, Berta
Satyarini, Oriza Sativa, Deni Kurniawan, Anas Bunyamin, Bambang
Kurniawan yang selalu saling membantu dan mengingatkan
6. Teman-teman satu bimbingan Azmidi Nazaruddin, M.Doni Darmawan,
Nugraheni Dyahwarni atas perjuangan dan kerjasamanya
7. Mia Rahmawati, Vien Syafrina, I ka Kartika, Mila Hikmatunnisa, Nilla
Amalia, Prima Luna, Laily Dwi atas indahnya keluarga kedua dan atas
inspirasi hidup
8. Teman-teman BEM F 2003/ 2004, HI MALOGI N 2002/ 2003 yang telah
memberikan pelajaran dan pengalaman hidup
9. Semua pihak yang telah membantu penulis yang tidak dapat
DAFTAR ISI
A. PENELITIAN TAHAP I
1. Variasi Penambahan Substrat Pada Kondisi
Steril Dan Nonsteril ... 24 a. Penambahan Substrat Langsung pada Kondisi Steril
iv
b. Penambahan Substrat Bertahap pada Kondisi Steril
dan Nonsteril ... 29
DAFTAR TABEL
Halaman Tabel 1. Komposisi kulit dan limbah udang windu ... 5 Tabel 2. Komposisi (% bobot kering) kulit udang berdasarkan
vi Gambar 4. Diagram alir persiapan inokulum ... 17 Gambar 5. Persiapan bahan baku kulit udang ... 17 Gambar 6. Skema Penelitian Tahap I dengan variasi cara penambahan
substrat kulit udang pada kondisi steril dan nonsteril ... 22 Gambar 7. Skema Penelitian Tahap II dengan variasi
persentase inokulum ... 22 Gambar 8. Skema Penelitian Tahap II dengan variasi ukuran
serpihan kulit udang ... 23 Gambar 9. Kurva pertumbuhan dan kadar protein dalam media pada
penambahan substrat langsung ... 26 Gambar 10. Kurva pertumbuhan dan kadar protein kulit udang pada
penambahan substrat langsung ... 27 Gambar 11. pH media dan kadar protein kulit udang pada
penambahan substrat langsung ... 29 Gambar 12 Kurva pertumbuhan dan kadar protein dalam media pada
penambahan substrat bertahap ... 31 Gambar 13. Kurva pertumbuhan dan kadar protein kulit udang pada
penambahan substrat bertahap ... 32 Gambar 14. pH media dan kadar protein kulit udang pada
penambahan substrat bertahap ... 33 Gambar 15. Kadar protein kulit udang pada variasi persentase inokulum 35 Gambar 16. Kadar protein kulit udang pada
DAFTAR LAMPIRAN
Halaman Lampiran 1. Pembuatan larutan Bradford dan Prosedur
pengujian protein (metode standar) ... 43 Lampiran 2. Kurva Standar Protein ... 44 Lampiran 3. Komposisi Medium Agar LB (Luria Bertani) ... 45 Lampiran 4. Jumlah Sel (sel/ml) 107 Pada Penambahan
Substrat Langsung ... 46 Lampiran 5. Kadar Protein dalam Media (mg/ml) Kultur
Pada Penambahan Substrat Secara Langsung ... 47 Lampiran 6. Kadar Protein Kulit Udang (%) Pada
Penambahan Substrat Secara Langsung ... 48 Lampiran 7. Nilai pH Media Fermentasi Pada Penambahan
Substrat Secara Langsung ... 49 Lampiran 8. Jumlah Sel (sel/ml) 107 Pada Penambahan
Substrat Bertahap ………. 50 Lampiran 9. Kadar Protein Dalam Media (mg/ml)
Kultur Pada Penambahan Substrat Secara Bertahap ... 51 Lampiran 10. Kadar Protein Kulit Udang (%) Pada
Penambahan Substrat Secara Bertahap ... 52 Lampiran 11. Nilai pH Media Fermentasi Pada
Penambahan Substrat Secara Bertahap ... 53 Lampiran 12. Kadar Protein Kulit Udang (%) Variasi
Persentase Inokulum ... 54 Lampiran 13. Kadar Protein Kulit Udang (%) Variasi
1
I. PENDAHULUAN
A. LATAR BELAKANG
Udang merupakan komoditas handal perikanan utama Indonesia
(Sudibyo, 1991). Komoditas udang pada saat ini mengalami peningkatan
produksi, baik diperoleh dari usaha penangkapan di alam maupun dari
hasil budidaya dengan menggunakan tambak udang. Departemen Kelautan
dan Perikanan (2003) melaporkan, luas tambak udang keseluruhan adalah
250 ha, yang terdiri dari 100 ha tambak eks inti dan 150 ha tambak eks
plasma.
Ekspor udang pada tahun 2002 yaitu sebesar 130.000 ton atau
senilai 836.563.280 US$, tahun 2003 yaitu sebesar 140.000 ton atau
senilai 850.222203 US$ dan tahun 2004 sampai dengan November sebesar
130.000 ton atau senilai 810.905.190 US$ (BPS, diolah oleh Departemen
Kelautan dan Perikanan Republik Indonesia, 2003). Menurut Sudibyo
(1991), sekitar 80 hingga 90 persen udang di ekspor dalam bentuk udang
udang beku tanpa kepala dan kulit. Bobot kulit dan kepala ini dapat
mencapai 25 hingga 30 persen dari bobot udang utuh, sehingga dapat
diperkirakan bahwa kulit dan kepala yang dihasilkan pada tahun 2004
sampai dengan November cukup besar yaitu sebanyak 40.000 ton.
Limbah udang mudah sekali rusak akibat degradasi mikroba,
sehingga berpotensi besar mencemarkan lingkungan. Semakin pesatnya
perkembangan produksi udang, maka dibutuhkan penanganan terhadap
limbah udang secara khusus. Pemanfaatan limbah udang selama ini adalah
untuk pencampur ransum pakan ternak, bahan pencampur pembuatan
terasi, petis dan kerupuk udang. Sementara di negara maju seperti Jepang
dan Jerman, limbah udang banyak digunakan sebagai bahan baku
pembuatan kitin dan kitosan (Bastaman, 1989). Kitin mempunyai prospek
yang cukup besar sebagai bahan baku dengan berbagai kegunaannya di
berbagai bidang. Kitin dan kitosan diketahui bernilai ekonomi tinggi dan
telah dimanfaatkan untuk kosmetik, biomedis, farmasi, pertanian,
2
Limbah udang merupakan sisa bagian tubuh yang biasanya berupa
bagian kepala, kulit dan ekor (Moelyanto, 1979). Komposisi utama limbah
udang adalah protein, kitin, lemak dan mineral (Chen dan Chen, 1991).
Bagian kulit mengandung kitin yang lebih banyak dan protein yang lebih
sedikit, sedangkan bagian kepala mengandung kitin yang lebih sedikit dan
protein yang lebih banyak (No et al. 1989).
Kitin adalah polimer alami yang mempunyai banyak kelebihan,
seperti mempunyai sifat biokompatibilitas, biodegradabilitas dan tidak
beracun. Ornum (1992), menyatakan bahwa kitin mudah mengalami
degradasi secara biologis, tidak beracun, tidak larut dalam air, asam
organik encer dan asam-asam organik, tetapi larut dalam larutan dimetil
asetamida dan lithium klorida. Sifat daya serap kitin yang baik dapat
didayagunakan untuk menangani cemaran logam beracun dan zat pewarna
tekstil yang terakumulasi dalam perairan dan dapat menyerap bahan
berprotein yang terdapat dalam air limbah industri pengolahan pangan.
Kitin juga berpotensi sebagai komoditas di bidang industri, misalnya
sebagai aditif pada industri kertas, tekstil dan industri makanan. Kitin juga
berpotensi sebagai bahan antibiotika dan benang operasi yang aman
(Austin et al. 1981).
Terdapat beberapa faktor yang dapat mempengaruhi keberhasilan
isolasi kitin, antara lain adalah jenis bahan baku dan proses ekstraksi kitin,
yang meliputi deproteinasi dan demineralisasi. Untuk mendapat kitin
dengan kualitas tinggi, proses deproteinasi dan demineralisasi merupakan
proses yang paling penting (Knorr, 1991).
Deproteinasi umumnya dilakukan dengan menambahkan NaOH
encer yang disertai dengan pemanasan secara kontinyu (Hackman, 1954).
Proses ini diduga berpengaruh terhadap perubahan sifat kimiawi kitin
(Foster dan Hackman, 1957). Hasil penelitian terdahulu menunjukkan
bahwa penurunan kadar protein dan mineral pada kitin secara kimiawi
menunjukkan hasil yang kurang baik. Hasil deproteinasi dengan
mempergunakan asam kuat atau basa kuat seperti NaOH pada suhu tinggi
3
menjadi peptida dan asam amino, sehingga dapat berpengaruh terhadap
perubahan sifat fisik kimiawi kitin.
Proses deproteinasi dapat juga dilakukan secara fermentasi dengan
menggunakan mikroba penghasil protease, (Citoreksoko dan Nasution,
1999) contohnya menggunakan bakteri Bacillus licheniformis F11. Fermentasi diharapkan dapat mengurangi dampak pencemaran dan
pemborosan energi, karena reaksinya bersifat spesifik, tidak beracun serta
tidak membutuhkan energi yang tinggi. Mikroba sebagai sumber enzim
lebih menguntungkan karena pertumbuhannya cepat dan dapat tumbuh
pada substrat yang relatif murah, mudah ditingkatkan hasilnya melalui
pengaturan kondisi pertumbuhan serta mampu menghasilkan enzim
dengan pH optimum yang lebih tinggi (Crueger dan Crueger, 1984).
B. TUJUAN
Tujuan penelitian ini adalah mendapatkan kondisi proses terbaik
untuk penghilangan protein (deproteinasi) limbah kulit udang pada
4
II. TINJAUAN PUSTAKA
A. KLASIFIKASI DAN KOMPOSISI UDANG
Udang termasuk ke dalam filum Artopoda, kelas Crustacea, ordo
Decapoda dan Sub ordo Natania. Sub ordo ini terdiri dari tiga famili yaitu
Segestiade, Palaemodae dan Penaidae (Sarwono, 1993). Tubuh udang
terdiri atas tiga bagian besar, yaitu kepala dan dada (cephalathorax), badan
atau bagian perut (abdomen) dan ekor. Seluruh tubuhnya terdiri atas
ruas-ruas yang terbungkus oleh kerangka luar (eksoskeleton) yang terbuat dari
semacam zat tanduk (kitin) yang diperkeras oleh bahan kapur CaCO3.
Jumlah ruas pada badan udang terdiri atas 13 ruas yaitu lima ruas kepala
dan delapan ruas dada. Skema susunan tubuh udang windu dapat dilihat
pada Gambar 1.
Keterangan :
1. Cepalothorax 5. Pleopoda
2. Rostum 6. Telson
3. Antena 7. Uropoda
4. Periopoda
a, b, c, d, e : ruas abdomen ke-1, ke-2, ke-3, ke-4, ke-5
5
Kulit udang mengandung komposisi kitin yang lebih baik
dibandingkan dengan limbah udang secara keseluruhan. Perbandingan ini
dapat dilihat pada Tabel 1.
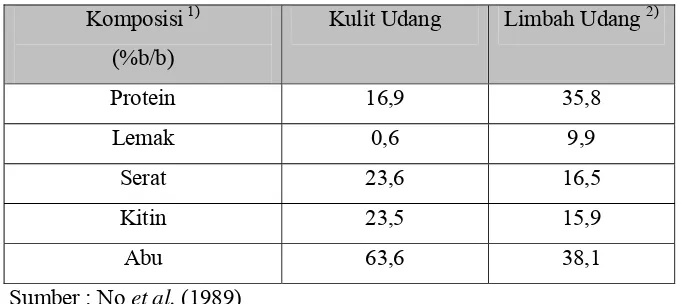
Tabel 1. Komposisi kulit dan limbah udang windu
Komposisi1)
(%b/b)
Kulit Udang Limbah Udang 2)
Protein 16,9 35,8
penentuan berdasarkan bobot kering 2)
limbah udang terdiri dari kepala, kulit dan ekor
Pada limbah kulit udang, kandungan kitin cukup besar yaitu
23,5%. Hal ini menyebabkan limbah kuit udang berpotensi sebagai bahan
baku dalam memproduksi kitin. Selain itu, dalam limbah kulit udang juga
terdapat protein sebesar 16,9% dan mineral (abu) sebesar 63,6%, sehingga
dalam pemurnian kitin komponen tersebut perlu dihilangkan.
Komponen-komponen tersebut perlu dihilangkan untuk menghasilkan produk kitin
yang bermutu tinggi sehingga molekul-molekulnya menjadi lebih halus
dan kelarutannya lebih rendah. Proses penghilangan protein (deproteinasi)
diduga dapat menyebabkan pengurangan lemak dan logam dalam kulit
udang, karena lemak dapat berasal dari lemak yang terikat dengan protein
(lipoprotein), sehingga setelah protein terdegradasi maka lemak dapat
terlepas dari kulit udang (Rohani, 2000).
B. KITIN
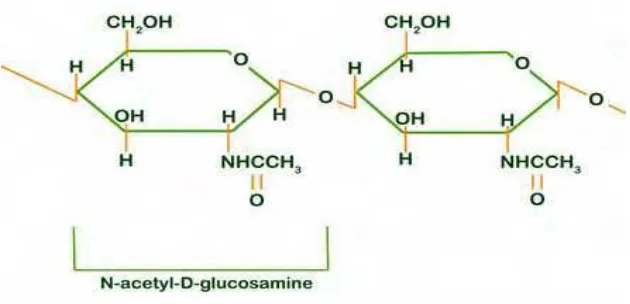
Kitin merupakan senyawa biopolimer berantai panjang dan tidak
6
monomer yang terpaut melalui ikatan β-1,4 glikosida. Unit monomer kitin
mempunyai rumus molekul C18H12O5 dengan kadar C, H, N, O
berturut-turut 47%, 6%, 7% dan 40% (Bastaman, 1989).
Struktur kitin sama dengan selulosa, yaitu ikatan yang terjadi antara monomernya terangkai dengan glukosida pada posisi β-1,4.
Perbedaannya dengan selulosa adalah gugus hidroksil yang terikat pada
atom karbon nomor dua, pada kitin digantikan dengan gugus asetamina
(-NHCOCH3), sehingga kitin dapat menjadi polimer berunit N-Asetil
glukosamin. Struktur kimia kitin dapat dilihat pada Gambar 2.
Gambar 2. Struktur berulang kitin (Bough, 1975)
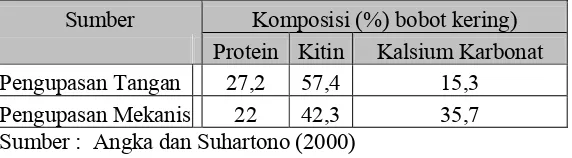
Menurut Angka dan Suhartono (2000), kitin yang diperoleh dari
berbagai sumber memiliki struktur yang sama, kecuali ikatannya dengan
protein dan kalsium karbonat yang merupakan dua komponen lain pada
kulit udang. Setelah protein kalsium dan kalsium karbonat dari kulit udang
dihilangkan dengan pemberian garam dan basa, maka tinggallah kitin yang
berbentuk materi kaku dan berpori yang relatif tahan terhadap perlakuan
kimia dan infeksi mikroba. Komposisi kulit udang berdasarkan proses
7
Tabel 2. Komposisi (% bobot kering) kulit udang berdasarkan proses pengupasan
Sumber Komposisi (%) bobot kering)
Protein Kitin Kalsium Karbonat
Pengupasan Tangan 27,2 57,4 15,3
Pengupasan Mekanis 22 42,3 35,7
Sumber : Angka dan Suhartono (2000)
Kitin adalah penyusun kerangka luar serangga, Moluska dan
Crustacea. Diduga terdapat 37,3 ribu ton kitin per tahun yang diperoleh
dari kulit kerang, kepiting dan udang, sehingga memungkinkan untuk
digunakan sebagai bahan baku industri (Yang et al., 2000).
Menurut Stephen (1995), kitin merupakan padatan amorf berwarna
putih, dapat terurai secara hayati (biodegradable), terutama oleh bakteri
penghasil enzim lisozim dan kitinase. Sifat kitin yang tidak beracun
menyebabkan kitin banyak digunakan untuk keperluan pakan ternak dan
kesehatan misalnya sebagai benang bedah.
Menurut Svitil et al. (1997), kitin dibedakan karena susunan rantai Nasetil-D-glukosamin yaitu α, , dan , derajat deasetilasi serta adanya
ikatan silang seperti dengan protein dan glukan. Kitin dalam tubuh
organisme terdapat dalam tiga bentuk kristal dan dibedakan atas susunan
rantai molekul yang membangun kristalnya yaitu α-kitin (rantai
antiparalel), -kitin (rantai paralel) dan -kitin yang terdiri atas tiga rantai
(Angka dan Suhartono, 2000 ; Rudal, 1969).
Sebagai material pelindung Crustacea, kitin terdapat sebagai
mukopolisakarida yang berasosiasi dengan kalsium karbonat dan berikatan
kovalen dengan protein (Austin, 1984). Masih menurut (Austin, 1984),
tidak semua protein berikatan kovalen dengan kitin. Sebagian besar
protein berikatan secara fisik. Jumlah protein yang terikat secara kovalen
dengan kitin setiap jenis Crustacea tidak sama seperti dapat dilihat pada
Tabel 3. Menurut Muzi (1990), perbedaan jumlah protein yang terikat
secara kovalen akan mempengaruhi mudah tidaknya proses deproteinasi.
8
yang terikat secara kovalen, maka tidak ada proses deproteinasi yang
optimum untuk setiap jenis Crustacea (Muzi, 1990).
Tabel 3. Persentase kadar kitin dan protein pada Crustacea (Austin, 1981)
C. DEPROTEINASI
Deproteinasi adalah proses penghilangan kadar protein pada suatu
bahan. Ikatan peptida yang menghubungkan asam-asam amino pada
molekul protein akan diputus dalam proses ini dengan reaksi hidrolisis.
Menurut Sumaatmadja (1975), pada reaksi hidrolisis ikatan peptida,
protein akan diuraikan menjadi peptida-peptida sederhana dan asam
amino, dan bila asam-asam amino diuraikan lebih jauh membentuk gugus
asam karboksilat dan amina. Reaksi yang akan terjadi dapat dilihat pada
Gambar 3.
R1 H R2 R1 H R2
C C N C + H-O-H -C-C-OH + H-N-C-
H O H H O H
Gambar 3. Reaksi hidrolisis protein (Sumaatmadja, 1975)
Menurut Girindra (1986), hidrolisis protein dapat dilakukan dengan
tiga cara, yaitu sebagai berikut.
Crustacea Kitin (%) Total Protein (%)
9
1. Hidrolisis dengan Asam
Hidrolisis asam dilakukan dengan menggunakan asam anorganik kuat
contohnya HCl dan dipanaskan dengan suhu mendidih serta dapat juga
dilakukan dengan tekanan diatas satu atmosfer. Hidrolisis ini
dilakukan dalam beberapa jam.
2. Hidrolisis dengan Basa
Hidrolisis basa dilakukan dengan menggunakan basa kuat seperti
NaOH dan KOH, juga dilakukan pada suhu tinggi dalam beberapa jam.
3. Hidrolisis dengan Enzim
Hidrolisis enzim dilakukan dengan menggunakan enzim yang
dihasilkan oleh mikroba penghasil protease seperti Bacillus licheniformis.
Hidrolisis protein secara enzimatis tidak seperti hidrolisis dengan
asam atau basa. Hidrolisis menggunakan enzim dapat mencegah terjadinya
kerusakan produk. Selain itu menurut Muchtadi et al. (1992), penggunaan enzim untuk suatu proses lebih menguntungkan karena kerja enzim sangat
spesifik, sehingga tidak didapatkan reaksi samping atau hasil samping
yang tidak dikehendaki. Bila mempergunakan enzim, tidak diperlukan
suhu yang ekstrim seperti pada cara kimiawi, sehingga dapat lebih
menghemat energi, dan yang juga menguntungkan yaitu dalam pemisahan
produk yang dihasilkan aman dari bahan-bahan kimia sintetik yang
umumnya bersifat toksik.
D. FERMENTASI
Fermentasi adalah proses pemecahan senyawa kompleks menjadi
senyawa yang lebih sederhana dengan bantuan mikroba. Proses ini dapat
10
mikroba. Proses fermentasi akan berlangsung secara optimum dengan
mengatur kondisi optimum dari mikroba untuk tumbuh (Rachman,1992).
Fermentasi dapat dilakukan dengan metode kultur terendam (media
cair) dan kultur permukaan (media padat). Dewasa ini proses fermentasi
untuk memproduksi berbagai produk lebih banyak menggunakan teknik
kultur terendam, walau demikian kultur permukaan yang menggunakan
media padat masih banyak digunakan untuk memproduksi berbagai jenis
asam organik dan enzim (Rachman, 1992).
Faktor-faktor yang mempengaruhi proses fermentasi adalah sebagai
berikut.
1. Suhu
Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu.
Bakteri psikrofil tumbuh pada 0-30˚C, mesofil 25-40˚C, dan termofil
pada suhu 50˚C atau lebih. Suhu tersebut mempengaruhi pertumbuhan
atau peningkatan massa sel, reproduksi dan semua aktivitas yang
dilakukan oleh mikroba. Suhu yang rendah dapat memperlambat
aktivitas metabolisme, sedangkan suhu tinggi sampai batas tertentu
akan mempercepat aktivitas sel. Suhu yang tinggi melebihi suhu
maksimum akan menyebabkan kerusakan sel yang menyebabkan
proses metabolisme menurun. Bacillus licheniformis tumbuh pada suhu maksimum 50-55˚C dan suhu minimum 15˚C (Gordon, 1972).
2. pH
Nilai pH optimum pertumbuhan bagi kebanyakan bakteri terletak
antara 6,5-7,5. Namun beberapa spesies bakteri dapat tumbuh dalam
keadaan sangat asam ataupun sangat basa. Bagi kebanyakan bakteri,
nilai pH minimum dan maksimum ialah 4 dan 9. Bakteri yang tumbuh
pada suasana asam disebut asidofilik, pada susana netral disebut
neutrofilik dan pada suasana basa disebut alkalifilik. Kondisi pH lebih
dipengaruhi oleh komposisi media dan senyawa-senyawa asam atau
basa yang dihasilkan dalam pertumbuhannya. Bacillus licheniformis
11
3. Komposisi Media
Secara umum, media fermentasi menyediakan semua nutrien
yang dibutuhkan oleh mikroba untuk memperoleh energi,
pertumbuhan, bahan pembentuk sel dan biosintesis produk-produk
metabolisme. Tergantung pada jenis mikroba dan produk yang akan
diproduksi, setiap fermentasi memerlukan media tertentu karena bila
media tidak sesuai dapat menyebabkan perubahan hasil metabolisme
mikroba.
Senyawa-senyawa sumber karbon dan nitrogen merupakan
komponen terpenting dalam media fermentasi, karena sel-sel mikroba dan
berbagai produk fermentasi sebagian besar terdiri dari unsur karbon dan
nitrogen. Di samping itu media fermentasi juga harus mengandung air,
garam-garam anorganik dan mineral. Mineral seperti magnesium, fosfat,
kalium, sulfur, kalsium dan kromium merupakan komponen penting dalam
media fermentasi. Pemberian unsur tersebut ke dalam media fermentasi
harus diperhatikan agar tidak melebihi kebutuhan. Konsentrasi nutrien
yang terlalu tinggi dapat menghambat metabolisme (Rachman,1992).
Sumber nutrien yang digunakan sebagai media fermentasi harus
memiliki syarat dapat memproduksi produk atau biomassa dengan hasil
maksimum dan laju reaksi yang juga maksimum, mutu harus konsisten,
murah dan tersedia sepanjang tahun, dan juga tidak menimbulkan masalah
terhadap aerasi, agitasi, ekstraksi dan pemurnian serta perlakuan limbah.
Sumber karbon yang biasa digunakan dalam media yaitu glukosa,
sedangkan sumber nitrogennya dapat berasal dari ekstrak daging sapi,
ekstrak khamir, garam triamonium sitrat dan sumber mineral lain seperti
K2HPO4, Na asetat.3H2O, MgSO4.7H2O dan MnSO4 .4H2O (Atlas,1995).
E. PROTEASE
Protease dinamakan juga enzim peptidase, karena enzim protease
bekerja dalam pemecahan molekul protein dengan memutuskan ikatan
12
pemecahan ikatan peptida, protease dibedakan menjadi eksoprotease dan
endoprotease. Eksoprotease menguraikan protein dari ujung rantai,
sehingga dihasilkan satu asam amino dan sisa peptida. Pada tingkat lanjut,
enzim ini akan menghasilkan sejumlah asam amino. Golongan
endoprotease menguraikan ikatan peptida dari bagian dalam rantai protein,
sehingga dihasilkan peptida dan polipeptida. Oleh karena itu kebanyakan
endoprotease hanya akan menghasilkan asam amino dalam jumlah
terbatas.
Berdasarkan aktivitas pH optimumnya, protease digolongkan
menjadi protease asam, netral dan basa (alkalin). Protease asam banyak
dihasilkan oleh kapang dan khamir, tetapi jarang ditemukan pada bakteri.
Enzim ini mempunyai pH optimum 3-4. Protease alkalin mempunyai pH
optimum sekitar 9-11 (Ward, 1983).
Bacillus licheniformis merupakan bakteri yang potensial sebagai penghasil protease. Jenis protease yang dihasilkan oleh bakteri ini adalah
enzim ekstraselular yang tergolong proteinase serin alkali (Aunstrup,
1978). Berdasarkan penelitian sebelumnya yang dilakukan oleh Bisping
(2004), yang hasilnya disampaikan pada Discussion Forum Program Prospect Of Chitin Production And Application In Indonesia, Jakarta. September 14th 2005, Bacillus licheniformis, secara khusus galur F11 sangat potensial untuk digunakan dalam penelitian selanjutnya karena
bersifat termofil yang banyak digunakan untuk produksi enzim industri.
Selain itu proses fermentasi menggunakan Bacillus licheniformis dapat dijalankan tanpa tahap sterilisasi dengan suhu tinggi dan dapat
menggunakan pH optimum Bacillus licheniformis untuk menghasilkan protease.
Protease yang dihasilkan oleh Bacillus licheniformis merupakan golongan endoprotease netral dan basa (alkalin) yang telah dapat
dimurnikan dan dikristalkan. Enzim ini termasuk dalam protease serin
karena mengandung gugus serin pada sisi aktifnya. Enzim ini bekerja
diisopropil-13
fluorofosfat (DFP) karena adanya reaksi DFP dengan gugus hidroksi dari
residu serin pada sisi aktif (Aunstrup,1978).
Bacillus licheniformis menghasilkan dua jenis protease, yang aktif pada pH netral sedangkan yang lainnya pada pH alkali. Protease yang
dihasilkan oleh Bacillus licheniformis dikenal dengan nama Subtilisin Carlberg, yang diisolasi pertama kali oleh Guntelberg Lang dan Ottensen
pada tahun 1953 (Ward,1983). Subtilisin Carlberg mempunyai pH
optimum untuk aktivitasnya pada pH 8,0 sampai 11,0 dan stabil pada pH
5,0 hingga 10,0 pada suhu 25˚C. Enzim ini tahan sampai suhu 50˚C
selama satu jam pada pH 8,5 serta dapat diinaktifkan dengan cepat pada
14
III. METODE PENELITIAN
A. WAKTU DAN TEMPAT
Penelitian ini dilakukan di Laboratorium Teknologi Bioindustri (LTB),
Badan Pengkajian dan Penerapan Teknologi (BPPT), PUSPIPTEK, Serpong
Tangerang dari bulan Februasi sampai Juli 2005.
B. BAHAN DAN ALAT 1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain kulit
udang basah yang telah dipisahkan dari kotoran dan daging ikutan. Kulit
udang ini diperoleh dari industri pembekuan udang yaitu PT. Wirontono
Baru yang terletak di kawasan industri Tanjung Priok, Jakarta Utara. Isolat
bakteri yang digunakan adalah isolat Bacillus licheiformis F11 yang berasal dari koleksi Laboratorium Teknologi Bioindustri (LTB), Badan
Pengkajian dan Penerapan Teknologi (BPPT), PUSPIPTEK, Serpong
Tangerang. Bahan-bahan yang digunakan adalah media LB (Luria
Bertani), ekstrak khamir, NaCl, tripton, bacto agar, NaOH 2 N dan Bovine Serum Albumin (BSA).
2. Alat
Alat-alat yang digunakan antara lain neraca analitik, waterbath, oven, mikroskop cahaya, blender Philips, autoklaf, gelas piala, pembakar Bunsen, cawan petri, cool centrifuge Nimac CR, labu erlenmeyer, gelas ukur, hemasitometer, inkubator, laminar air flow, stirer magnetic, pipet mikro, mikroskop elektron, pH-meter Knick, pinset, pipet volumetrik,
rotary shaker Kuhner, spatula, spektrofotometer Pharmacia ”LKB”, tabung Eppendorf, mikropipet, vortex mixer serta alat-alat lain yang terdapat pada Laboratorium Teknologi Bioindustri (LTB), Badan
Pengkajian dan Penerapan Teknologi (BPPT), PUSPIPTEK, Serpong
15
di Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian
Cimanggu Bogor untuk mengukur ukuran serpihan kulit udang.
C. METODOLOGI
Penelitian yang dilakukan adalah dengan memfermentasikan limbah
kulit udang menggunakan B. licheniformis F11 dengan melakukan variasi cara penambahan substrat kulit udang pada kondisi steril dan nonsteril, variasi
persentase inokulum dan variasi ukuran serpihan kulit udang, sehingga dapat
menurunkan kadar protein pada kulit udang sampai serendah mungkin.
Pada fermentasi, suhu diatur pada 55oC dan agitasi 125 rpm. Hal ini
berdasarkan penelitian sebelumnya yang dilakukan oleh Bisping (2004), yang
hasilnya disampaikan pada Discussion Forum Program Prospect Of Chitin Production And Application In Indonesia, Jakarta. September 14th 2005, pertumbuhan B. licheniformis F11 pada suhu 55oC dapat mendegradasi kadar protein dalam limbah kulit udang secara maksimal yaitu selama 48 jam
dengan agitasi 125 rpm.
Media starter diinkubasi pada suhu 55oC selama 6-7 jam sampai
mencapai jumlah bakteri 107-108. Fermentasi dilakukan selama 48 jam dan
setiap 6 jam dilakukan pengambilan sampel terhadap media dan dilakukan
perhitungan jumlah sel, pengukuran pH dan kadar protein media. Sampel kulit
udang diambil setiap 12 jam selama fermentasi dan dilakukan analisis kadar
protein pada kulit udang (Yang et al. 2000)
1. Penyiapan Isolat Bakteri
Tahapan persiapan isolat B. licheniformis F11 adalah sebagai berikut. a. Persiapan Media Regenerasi
Media yang digunakan adalah media LB (Luria Bertani), yaitu
NaCl sebanyak 0,5 gram, ekstrak khamir 0,5 gram, tripton 1 gram dan
bactoagar 2 gram dilarutkan dalam 100 ml air suling, dihomogenkan
dengan pengaduk magnet, kemudian pH diatur dengan penambahan
asam atau basa menjadi pH netral dan disterilkan dalam autoklaf pada
16
cawan petri sehingga menjadi stok media agar steril yang siap
digunakan.
b. Persiapan Media Pertumbuhan (Inokulum)
Media yang digunakan adalah media LB (Luria Bertani) namun
tanpa penambahan agar. NaCl sebanyak 0,5 gram, ekstrak khamir 0,5
gram, tripton 1 gram dilarutkan dalam 100 ml air suling,
dihomogenkan dengan pengaduk magnet, kemudian pH diatur dengan
penambahan asam atau basa menjadi pH netral dan disterilkan dalam
autoklaf pada suhu 112oC selama 15 menit.
c. Penyegaran Isolat Bakteri
Isolat bakteri disebar pada media LB (Luria Bertani)
menggunakan metode penggoresan kuadran (Hadiutomo, 1993).
Kemudian diinkubasi pada suhu 37oC selama 24 jam.
d. Penyiapan Kultur Isolat Bakteri
Satu lup bakteri diinokulasi dalam 100 ml media starter dalam
labu erlenmeyer 250 ml yang sebelumnya telah disterilisasi pada suhu
121oC selama 15 menit. Kultur ini diinkubasi pada rotary shaker
Kuhner dengan suhu 55oC dan agitasi 150 rpm selama 7 jam. Kultur
ini selanjutnya disebut inokulum. Tahapan persiapan inokulum B. licheniformis F11 dapat dilihat pada Gambar 4.
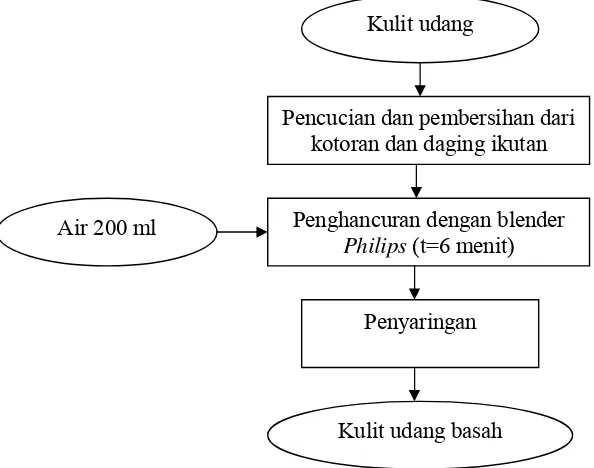
2. Penyiapan Kulit Udang
Mula-mula bahan baku kulit udang dihancurkan menjadi
partikel-partikel kecil menggunakan blender Philips dengan waktu penghancuran selama 6 menit dan dengan penambahan air sebanyak 200 ml. Tahapan
17
Gambar 4. Diagram alir persiapan inokulum
Gambar 5. Persiapan bahan baku kulit udang Kulit udang
Penghancuran dengan blender
Philips (t=6 menit)
Kulit udang basah Air 200 ml
Pencucian dan pembersihan dari kotoran dan daging ikutan
Penyaringan
Isolat B. licheniformis F11
Satu lup biakan agar miring B. licheniformis
Inokulum
Inokulasi dalam 100 ml media cair steril LB
18
3. Penyiapan Media Fermentasi
Komposisi media fermentasi terdiri dari NaCl 0,5% dan ekstrak
khamir 0,1%, selanjutnya dilakukan penambahan kulit udang sebanyak
30% (b/v). Persentase diambil dari volume kerja fermentasi. Fermentasi
dilakukan dalam labu erlenmeyer 500 ml (volume kerja 100 ml).
4. Fermentasi Limbah Kulit Udang
Tujuan fermentasi limbah kulit udang ini adalah untuk melakukan
penghilangan protein (deproteinasi) limbah kulit udang dengan beberapa
perlakuan. Fermentasi limbah kulit udang dilakukan dalam dua tahapan
penelitian. Pada penelitian Tahap I, fermentasi limbah kulit udang
dilakukan pada variasi cara penambahan substrat kulit udang dengan
kondisi steril dan nonsteril. Penambahan substrat kulit udang dilakukan
secara langsung dan bertahap. Penambahan substrat kulit udang secara
langsung dilakukan dengan menambahkan secara langsung substrat kulit
udang ke dalam media fermentasi sebanyak 30% (b/v) dari volume
fermentasi. Sedangkan penambahan substrat secara bertahap dilakukan
dengan menambahkan substrat kulit udang sebanyak 10% di awal
fermentasi, kemudian pada jam ke-12 dilakukan penambahan kembali
substrat kulit udang sebanyak 20%. Penambahan substrat secara bertahap
dilakukan untuk membiasakan mikroba pada media substrat kulit udang.
Pada penambahan kulit udang 10%, diharapkan mikroba dapat beradaptasi
dengan kondisi fermentasi dan kemudian mengalami pertumbuhan sel
mencapai pertumbuhan eksponensial sehingga proses penghilangan
protein pada kulit udang semakin maksimal. Kondisi steril yang dilakukan
pada media fermentasi dengan penambahan substrat kulit udang adalah
dengan perlakuan sterilisasi menggunakan autoklaf121oC selama 15 menit
dan kondisi nonsteril adalah tanpa sterilisasi. Tujuan perlakuan tanpa
sterilisasi adalah untuk efisiensi energi dan waktu pada proses
deproteinasi kulit udang. Selanjutnya, pada penelitian Tahap II, fermentasi
19
dan variasi ukuran serpihan kulit udang yaitu 2,1 mesh, 2,5 mesh dan 3,5
mesh.
Fermentasi dilakukan dalam labu erlenmeyer 500 ml (volume kerja
100 ml) yang diinkubasikan pada incubator shaker suhu 55oC dengan kecepatan agitasi 125 rpm dengan dua kali ulangan.
Pengambilan sampel media kultur dilakukan setiap 6 jam sekali
selama 48 jam dan analisis yang dilakukan adalah jumlah sel (kurva
pertumbuhan) dengan metode hemasitometer, pengukuran pH dan
pengukuran kadar protein media kultur dengan metode Bradford (1976).
Pengambilan sampel kulit udang diambil setiap 12 jam selama fermentasi
yaitu 48 jam dan dilakukan analisis kadar protein kulit udang (Yang et al.
2000).
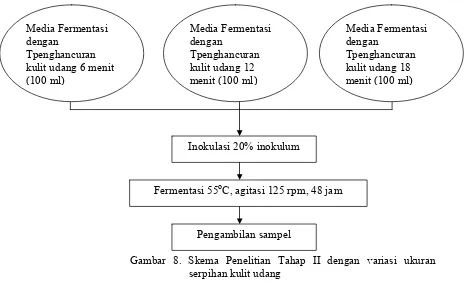
Pada penelitian Tahap II, fermentasi kulit udang dilakukan dengan
variasi persentase inokulum pada 10%, 20% dan 30% (v/v) dan variasi
ukuran serpihan kulit udang yaitu 2,1 mesh, 2,5 mesh dan 3,5 mesh.
Variasi ukuran serpihan kulit udang didapat dengan melakukan variasi
waktu penghancuran pada kulit udang dengan menggunakan blender
Philips yaitu pada 6 menit (T6’), 12 menit (T12’) dan 18 menit (T18’). Penghancuran limbah kulit udang pada waktu 6 menit, 12 menit dan 18
menit menghasilkan ukuran serpihan kulit udang berturut-turut adalah 2,1
mesh, 2,5 mesh dan 3,5 mesh. Pengukuran ini dilakukan dengan
menyaring sampel kulit udang yang telah dihancurkan kemudian
dikeringkan pada oven 80oC, 24 jam dan selanjutnya dilakukan
pengukuran serpihannya. Ukuran serpihan didapat dengan melakukan
penyaringan menggunakan penyaring getar Ristok yang berada di Balai Penelitian dan Pengembangan Pascapanen Pertanian Cimanggu Bogor.
Fermentasi dilakukan dalam labu erlenmeyer 500 ml (volume kerja
100 ml) yang diinkubasikan pada incubator shaker suhu 55oC dengan kecepatan agitasi 125 rpm dengan dua kali ulangan.
Pengambilan sampel kulit udang pada variasi persentase inokulum
20
adalah kadar protein pada kulit udang. Sampling kulit udang sebanyak @
3 gram pada t= 0, 12, 36, 48 jam.
Pengambilan sampel kulit udang pada variasi ukuran serpihan kulit
udang 2,1 mesh, 2,5 mesh dan 3,5 mesh dilakukan setiap 24 jam selama 48
jam. Analisis yang dilakukan adalah kadar protein kulit udang. Sampling
kulit udang sebanyak @ 3 gram dilakukan pada t= 0, 24, 48 jam.
Skema Penelitian Tahap I dan II dapat dilihat pada Gambar 6, 7, 8.
5. Analisis Sampel
1. Analisa Jumlah Sel Metode Hemasitomer (Hadiutomo, 1993)
Langkah pertama adalah menyiapkan alat-alat yang digunakan
seperti hemasitomer, pipet makro, tabung Eppendorf, dan mikroskop. Sampel media biakan B. licheniformis F11 disiapkan.
Permukaan hemasitomer dibersihkan dengan alkohol, demikian
pula dengan kaca tutup hemasitomer. Suspensi mikroba diambil sebanyak 100 μL, dengan menggunakan pipet mikro kedalam tabung
Eppendorf. Kemudian diencerkan dengan garam fisiologis 89% sebanyak 900 μL dan divortex. Suspensi B. licheniformis F11 diambil
sebanyak ± 10-20 μL menggunakan pipet mikro, lalu ujung pipet
diletakkan pada tepi kaca hemasitomer. Hemasitomer diletakkan pada
mikroskop dan dilakukan perhitungan dengan membagi area
hemasitomer menggunakan metode hitungan mikroskopis dan dicatat.
2. Pengukuran pH
Pengukuran pH sampel cairan fermentasi dilakukan dengan
menggunakan pH meter Knick yang telah dikalibrasi dengan larutan
standar. Sampel cairan fermentasi langsung di ukur pH tanpa
pengenceran dan perlakuan lain sebelumnya.
3. Penentuan Kadar Protein Media Kultur (Bradford, 1976)
Sampel media diambil sebanyak 1-2 ml ke dalam tabung
21
selama 20 menit (4oC, 10000 rpm). Sebanyak 40μL supernatan
ditambah dengan 2 ml pereaksi Bradford, kemudian divortex lalu
diinkubasi selama 15 menit pada suhu ruang (± 28oC) dan kemudian
diukur absorbansinya pada panjang gelombang 595 nm.
Standar yang digunakan adalah standar protein Bovine Serum Albumin (BSA) pada konsentrasi beragam, terdiri dari 0; 0,2 ;0,4 ;0,6 ;0,8 ;1 (Lampiran 1). Sedangkan blanko yang digunakan adalah air
suling. Protein yang diperoleh dinyatakan dalam satuan mg/ml.
4. Pengukuran Kadar Protein Kulit Udang (Yang et al. 2000)
Analisis kadar protein kulit udang setelah deproteinasi
dilakukan dengan mengekstraksi kulit udang dengan menggunakan 2 N NaOH pada rasio 3:8 (w/v) dengan pemanasan pada suhu 100°C
selama 30 menit, kemudian supernatan diukur kadar proteinnya
dengan metode Bradford (1976). NaOH digunakan untuk melarutkan
protein, dimana protein akan terekstrak dalam bentuk Na-proteinat.
Protein yang terekstrak bersifat larut dalam air dan akan hilang
terbawa air pada saat pencucian.
Sebanyak 3 gram sampel kulit udang di ambil pada labu
erlenmeyer 100 ml dan di tambahkan dengan 8 ml NaOH 2 N. Setelah
itu dipanaskan pada waterbath 100oC selama 30 menit. Sentrifugasi pada tabung sentrifuse 14 ml dilakukan menggunaka cool centrifuge
selama 20 menit (4oC, 10000 rpm). Sebanyak 40μL supernatan
ditambah dengan 2 ml pereaksi Bradford, kemudian divortex lalu
diinkubasi selama 15 menit pada suhu ruang (± 28oC) dan kemudian
22
Gambar 6. Skema Penelitian Tahap I dengan variasi cara penambahan substrat kulit udang pada kondisi steril dan nonsteril
Gambar 7. Skema Penelitian Tahap II dengan variasi persentase inokulum 30% kulit udang
Pengambilan sampel
Fermentasi 55oC, agitasi 125 rpm, 48 jam Sterilisasi dan nonsterilisasi
Inokulum B. licheniformis
Media fermentasi (100 ml)
Fermentasi 55oC, agitasi 125 rpm, 48 jam Inokulasi
10% Inokulum (50 ml)
Inokulasi 20% Inokulum (100 ml)
Inokulasi 30% Inokulum (150 ml)
23
Gambar 8. Skema Penelitian Tahap II dengan variasi ukuran serpihan kulit udang
Fermentasi 55oC, agitasi 125 rpm, 48 jam Inokulasi 20% inokulum
Pengambilan sampel Media Fermentasi dengan
Tpenghancuran kulit udang 12 menit (100 ml)
Media Fermentasi dengan
Tpenghancuran kulit udang 18 menit (100 ml) Media Fermentasi
dengan
24
IV. HASIL DAN PEMBAHASAN
A. PENELITIAN TAHAP I
1. Variasi Cara Penambahan Substrat Pada Kondisi Steril Dan Nonsteril
a. Penambahan Substrat Langsung pada Kondisi Steril dan Nonsteril
Penambahan substrat secara langsung pada kondisi steril
dan nonsteril dilakukan untuk mempelajari pengaruh penambahan
substrat kulit udang secara langsung kondisi steril dan nonsteril
pada proses deproteinasi. Proses ini dilakukan untuk mengetahui
pengaruh jumlah sel terhadap kadar protein pada media kultur,
jumlah sel terhadap penurunan kadar protein pada kulit udang dan
pH media terhadap penurunan kadar protein pada kulit udang.
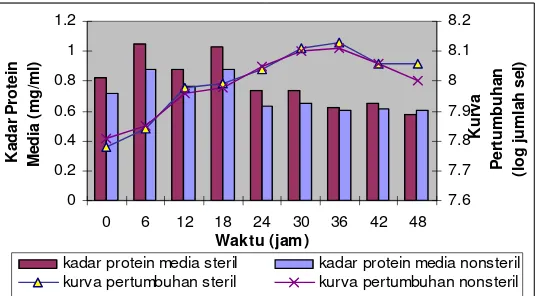
Kurva pertumbuhan
Berdasarkan data yang diperoleh pada Lampiran 4, jumlah
sel pada penambahan substrat langsung kondisi steril pada jam
ke-0 adalah 6,ke-03x1ke-07 sel/ml. Kurva pertumbuhan sel mencapai fase
lag mulai jam ke-0 hingga jam ke-6. Fase logaritmik terjadi antara
jam ke-6 hingga jam ke-30, fase stasioner pada jam ke-30 hingga
jam ke-36 dan fase kematian setelah jam ke-36. Kenaikan jumlah
sel tertinggi terjadi pada jam ke-36 (10,45x107 sel/ml). Jumlah sel
pada kondisi nonsteril pada jam ke-0 adalah 6,36x107 sel/ml. Sama
halnya dengan kondisi steril, fase lag mulai ke-0 hingga jam ke-6.
Fase logaritmik dicapai pada jam ke-6 hingga jam ke-30 dan fase
stasioner antara jam ke-30 dan jam ke-36. Fase kematian setelah
jam ke-36. Jumlah sel tertinggi terjadi pada jam ke-36 (12,95x107
sel/ml). Ilyas (1983), mengatakan bahwa pada fase lag, sel sedang
25
selama metabolisme. Pertumbuhan berlangsung cepat pada fase
logaritmik, sebab sel telah beradaptasi dengan lingkungan.
Kadar Protein Pada Media Kultur
Kadar protein pada media kultur baik pada kondisi steril
maupun nonsteril nilainya berfluktuatif dari jam ke-0 hingga jam
ke-18, selanjutnya terus menurun hingga akhir fermentasi. Nilai
kadar protein media ini memiliki kecenderungan dan berpola untuk
kondisi steril maupun non steril. Kadar protein dalam media untuk
kondisi steril pada awal fermentasi hingga jam ke-18 nilainya
berfluktuatif dan jumlah sel berada pada fase logaritmik.
Kemudian kadar protein menurun dan jumlah sel berada pada fase
stasioner kemudian mengalami kematian. Untuk kondisi nonsteril
pada awal fermentasi hingga jam ke-18 nilainya berfluktuatif dan
jumlah sel meningkat dan berada pada fase logaritmik. Kadar
protein menurun dan jumlah sel berada pada fase logaritmik hingga
jam ke-30 kemudian stasioner dan mengalami kematian.
Kadar protein media meningkat setelah ditambahkan isolat
B. licheniformis F11. Hal ini disebabkan karena protein media dapat berasal dari protease yang diproduksi oleh B. licheniformis.
Selain itu dapat pula berasal dari protein terlarut dari kulit udang.
Fluktuasi kadar protein media terjadi karena adanya pengurangan
protein akibat aktivitas hidrolisis protein oleh protease dan atau
penambahan protein berupa protein yang diproduksi oleh B. licheniformis. Memasuki fase stasioner atau kematian, bakteri tidak lagi memproduksi protein sehingga dalam kultur media hanya
terjadi hidrolisis protein oleh protease sehingga pada fase ini kadar
26
kadar protein media steril kadar protein media nonsteril kurva pertumbuhan steril kurva pertumbuhan nonsteril
Gambar 9. Kurva pertumbuhan dan kadar protein dalam media pada penambahan substrat langsung
Kadar Protein Kulit Udang
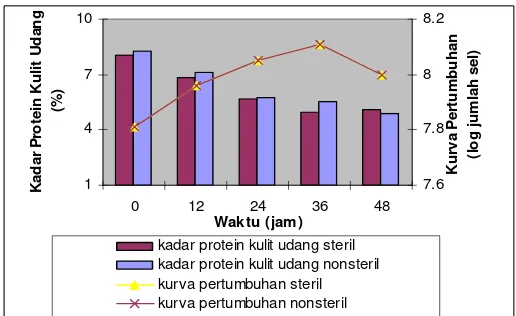
Kadar protein kulit udang kondisi steril seperti dapat dilihat
pada Lampiran 6, mengalami penurunan yaitu pada awal
fermentasi (jam ke-0) adalah sebesar 8,04% menjadi 4,99% pada
jam ke-36 dan pada akhir fermentasi (jam ke-48) yaitu 5,14%
(Gambar 9). Kadar protein kulit udang cenderung terus menurun
selama fermentasi. Persentase penurunan kadar protein kulit udang
mencapai 36,08% di akhir fermentasi (jam ke-48).
Kadar protein kulit udang kondisi nonsteril mengalami
penurunan dari awal fermentasi (jam ke-0) adalah sebesar 8,25%
menjadi 4,89% pada akhir fermentasi (jam ke-48). Kadar protein
kulit udang terus menurun seiring dengan pertumbuhan sel bakteri.
Persentase penurunan kadar protein kulit udang mencapai 40,64%
pada jam ke-48.
Penurunan kadar protein kulit udang selama fermentasi
terjadi karena sel bakteri yang ditambahkan telah beradaptasi
sehingga bakteri dapat segera mensintesis protease. Enzim ini
mempunyai aktivitas memecah molekul protein dengan
memutuskan ikatan peptida, sehingga terbentuk asam amino dan
27
kadar protein kulit udang steril kadar protein kulit udang nonsteril kurva pertumbuhan steril kurva pertumbuhan nonsteril
Gambar 10. Kurva pertumbuhan dan kadar protein kulit udang pada penambahan substrat langsung
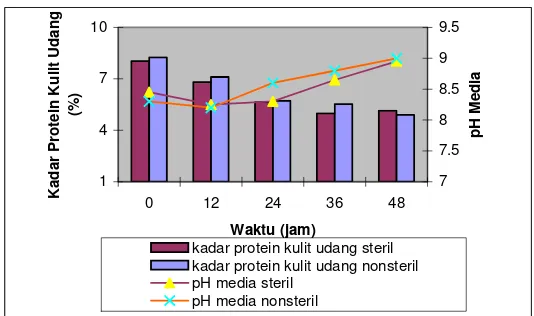
Nilai pH
Nilai pH fermentasi cenderung meningkat seiring dengan
penurunan kadar protein kulit udang selama fermentasi. Nilai pH
kondisi steril pada jam ke-0 yaitu 8,5, kemudian naik mencapai 8,7
pada jam ke-30 dan di akhir fermentasi (jam ke-48) nilai pH adalah
9. Pada kondisi nonsteril, nilai pH pada jam ke-0 yaitu 8,3 dan
tidak mengalami penurunan ataupun peningkatan yang berarti
sampai jam ke-36 yaitu dengan nilai 8,8, kemudian semakin naik
pada jam ke-42 hingga jam ke-48 yaitu dengan nilai pH 9. Proses
penghilangan protein (deproteinasi) kulit udang melalui proses
hidrolisis secara enzimatis, menyebabkan peningkatan nilai pH
media fermentasi. Secara umum, nilai pH pada penambahan
substrat langsung pada kondisi steril dan nonsteril yang
diperlihatkan pada Lampiran 7.
Hidrolisis protein menghasilkan asam amino bebas sebagai
unit pembangunnya yang tersusun melalui ikatan peptida
(Lehninger, 1993). Setiap jenis protein menghasilkan jenis-jenis
asam amino yang khas setelah proses hidrolisis, dan bila
asam-asam amino diuraikan lebih jauh membentuk gugus asam-asam
28
amino tersebut adalah asam aspartat (4,3 mg/g), treonin (2,1 mg/g),
serin (2,4 mg/g), prolin (3,8 mg/g), asam glutamat (5,2 mg/g),
glisin (4,1 mg/g), alanin (2,6 mg/g), valin (2,1 mg/g), sistein (0,2
mg/g), metionin (0,3 mg/g), isoleusin (1,4 mg/g), leusin (2,5 mg/g),
tirosin (28,4 mg/g), penilalanin (2,3 mg/g), lisin (2,2 mg/g),
histidin (0,7 mg/g), arginin (2,6 mg/g). Selama fermentasi, nilai pH
media cenderung meningkat pada kondisi steril maupun nonsteril,
hal ini diduga terjadi karena proses hidrolisis protein oleh protease
menghasilkan asam amino dan kemudian terurai lebih jauh
membentuk gugus karboksilat dan amina. Meningkatnya produksi
gugus amina sebagai hasil penguraian asama amino menyebabkan
nilai pH meningkat pada media fermentasi. Asam amino
digolongkan atas dasar polaritas gugus R. Golongan non-polar
mencakup alanin, leusin, isoleusin, valin, fenilalanin, triptofan dan
metionin. Golongan polar-netral termasuk glisin, serin, treonin,
sistein, tirosin, asparagin dan glutamin. Golongan bermuatan
negatif (asam) mengandung asam aspartat dan asam glutamat dan
golongan bermuatan positif (basa) mengandung arginin, lisin dan
histidin (Lehninger, 1993).
Pada Gambar 11, ditunjukkan kecenderungan
meningkatnya nilai pH seiring dengan bertambahnya waktu
fermentasi. Persentase penurunan kadar protein kulit udang yang
semakin tinggi yang ditandai dengan kadar protein kulit udang
yang semakin rendah, meningkatkan nilai pH deproteinasi.
Fennema (1985), menyatakan bahwa kelarutan protein pada