DIISOLASI DARI PLAK GIGI
Oleh:
Ai Andriani
G34103010
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AI ANDRIANI. Penapisan Streptomyces spp. Penghasil Senyawa Penghambat Pertumbuhan Streptococcus mutansyang Diisolasi dari Plak Gigi. Dibimbimg oleh YULIN LESTARI dan SRI BUDIARTI.
Pembentukan dan perkembangan plak gigi yang disebabkan oleh bakteri mulut sepertiS. mutans, perlu dikurangi untuk mencegah kerusakan gigi dengan menggunakan senyawa antibakteri. Dalam penelitian ini, dilakukan penapisan 6 Streptomyces spp. isolat lokal yaitu IVNF1-1, PS1-4, PS4-16, PD2-9, SLW8-1, dan B56-2 penghasil senyawa antibakteri yang memberikan daya hambat terhadapS. mutansyang diisolasi dari plak gigi manusia. Daya hambat tersebut dibandingkan dengan daya hambat yang dihasilkan oleh minyak atsiri daun sirih dan natrium fluorida (NaF).
Tiga dari lima isolatStreptococcusspp. mempunyai karakteristikS. mutans. Satu dari tiga isolat tersebut, yaituS. mutans4 digunakan sebagai bakteri target dalam uji antagonis. Dari 6 isolat Streptomycesspp. yang diuji, isolat IVNF1-1 mampu menghambat pertumbuhanS. mutans4. Zona hambat filtrat kultur IVNF1-1 pada konsentrasi 0.50% (b/v) yaitu 2.12±0.18 mm. Zona hambat tersebut lebih besar dari zona hambat minyak atsiri daun sirih dan NaF pada konsentrasi yang sama, secara berurutan yaitu 1.75±0.35 mm dan 1.00±0.71 mm. Pada konsentrasi 1.00% (b/v), filtrat kultur isolat IVNF1-1, minyak atsiri daun sirih, dan NaF menghasilkan zona hambat secara berturut-turut yaitu 3.50±0.71 mm, 3.88±0.18 mm, dan 3.00±0.35 mm. Hasil penelitian ini menunjukkan bahwa senyawa bioaktif yang dihasilkan olehStreptomycessp. IVNF1-1 berpotensi sebagai agen kontrol pertumbuhanS. mutans4.
ABSTRACT
AI ANDRIANI. Screening ofStreptomycesspp. which Produces Growth Inhibitory Compounds of Streptococcus mutanswas Isolated from Dental Plaque. Supervised by YULIN LESTARI and SRI BUDIARTI.
The formation and development of dental plaque caused by mouth bacteria such as Streptococcus mutans, need to be controled to prevent tooth decay by using antibacterial compounds. In this study, 6Streptomycesspp. namely IVNF1-1, PS4-16, PS1-4, PD2-9, SLW8-1, and B56-2 were screened for their ability to produce antibacterial compounds which indicated by an inhibition zone against S. mutans isolated from human dental plaque. The capability of Streptomycesspp. in inhibitingS. mutanswas compared with inhibition zone of essential oilPiper betleand natrium fluoride (NaF).
PENAPISAN
Streptomyces
spp.
PENGHASIL SENYAWA
PENGHAMBAT PERTUMBUHAN
Streptococcus mutans
YANG
DIISOLASI DARI PLAK GIGI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut pertanian Bogor
Oleh:
Ai Andriani
G34103010
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : PenapisanStreptomycesspp. Penghasil Senyawa Penghambat PertumbuhanStreptococcus mutansyang Diisolasi dari Plak Gigi Nama : Ai Andriani
NIM : G34103010
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Ir. Yulin Lestari Dr. dr. Sri Budiarti
NIP 131 779 515 NIP 132 047 666
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA NIP 131 578 806
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang berjudul Penapisan Streptomyces spp. Penghambat Pertumbuhan Streptococcus mutans yang Diisolasi dari Sampel Plak Gigi ini dilaksanakan sejak bulan Februari 2007 hingga September 2007 di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) dan Laboratorium Biologi Mulut, Fakultas Kedokteran Gigi (FKG), Universitas Indonesia (UI).
Ucapan terima kasih penulis haturkan kepada Dr. Ir. Yulin Lestari dan Dr. dr. Sri Budiarti atas dukungan moril dan materil yang diberikan kepada penulis selama pelaksanaan penelitian ini. Penulis juga menghaturkan terima kasih kepada Dr. Ir. Utut Widyastuti, MSi selaku dosen penguji atas koreksi dan sumbang sarannya. Terima kasih penulis ucapkan pula kepada teman-teman Biologi 40 dan teman-teman seperjuangan di Laboratorium Mikrobiologi: Ima, Ika supar, Novan, Andri, Irni, Tri, Besti, Nokter, Bibah, Rio atas pengertian dan semangatnya, serta seluruh staf Departemen Biologi khususnya staf Laboratorium Mikrobiologi atas bantuannya. Penghargaan dan terima kasih tertinggi penulis persembahkan untuk Ayah, Ibu, Mas Ilham Novihanto, dan seluruh keluarga atas dukungan do’a, dan kasih sayangnya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2007
RIWAYAT HIDUP
Penulis dilahirkan di Subang pada 10 Oktober 1985. Penulis merupakan anak kedua dari pasangan Bapak Tarim dan Ibu Eti. Penulis menamatkan Sekolah Umum Negeri 2 Subang pada tahun 2003 dan masuk ke Institut Pertanian Bogor pada tahun yang sama melalui jalur Seleksi penerimaan Mahasiswa Baru (SPMB).
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR... viii
DAFTAR LAMPIRAN... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
Waktu dan Tempat... 2
BAHAN DAN METODE Bahan ... 2
Metode ... 2
Isolasi dan IdentifikasiS. mutansdari Sampel Plak Gigi ... 2
Destilasi Minyak Atsiri Daun Sirih ... 2
Peremajaan IsolatStreptomycesspp. ... 3
Produksi Filtrat Kultur yang Mangandung Senyawa Antibakteri dari IsolatStreptomycesspp. ... 3
Penentuan Jumlah SelS. mutans... 3
Uji Antagonis Filtrat KulturStreptomycesspp., Minyak Atsiri Daun Sirih, dan NaF terhadapS. mutans... 3
HASIL DAN PEMBAHASAN Hasil ... 3
Isolasi dan IdentifikasiS. mutansdari Sampel Plak Gigi ... 3
Destilasi Minyak Atsiri Daun Sirih ... 4
Peremajaan IsolatStreptomycesspp. ... 4
Aktivitas Penghambatan Filtrat KulturStreptomycesspp. terhadapS. mutans ... 5
Aktivitas Penghambatan Minyak Atsiri Daun Sirih dan NaF terhadapS. mutans. ... 5
Pembahasan ... 6
Isolasi dan IdentifikasiS. mutansdari Sampel Plak Gigi ... 6
Aktivitas Penghambatan Minyak Atsiri Daun Sirih dan NaF terhadapS. mutans. ... 6
Aktivitas Penghambatan Filtrat KulturStreptomycesspp. terhadapS. mutans. ... 7
SIMPULAN DAN SARAN Simpulan ... 9
Saran ... 9
DAFTAR PUSTAKA... 9
DAFTAR TABEL
Halaman
1 Uji fisiologis isolatStreptococcusspp. danS. mutansserotipe e ... 4 2 Rata-rata diameter zona hambat filtrat kulturStreptomycesspp. terhadapS. mutans4 ... 5 3 Rata-rata diameter zona hambat minyak atsiri daun sirih dan NaF terhadapS. mutans4 .. 6
DAFTAR GAMBAR
Halaman
1 Morfologi koloniStreptococcusspp. di bawah mikroskop pada perbesaran 1000 kali ... 3 2 Respon fisiologisS. mutansserotipe e (a) danS. mutans4 (b) dalam fermentasi
sorbitol (1), manitol (2), inulin (3), dan laktosa (4), serta hidrolisis arginin (5) ... 4
3 Morfologi koloniS. mutansserotipe e (a) danS. mutans4 (b) pada medium TSY20B
dibawah mikroskop dengan perbesaran 100 kali ... 4
4 PertumbuhanStreptomycesIVNF1-1 (a), PS4-16 (b), PS1-4 (c), PD2-9 (d), SLW 8-1 (e), dan B56-2 (f) umur 7 hari pada media YMA ... 5
5 Kemampuan penghambatan filtrat kultur IVNF1-1 pada konsentrasi (b/v) 0.50% (a),
1.00% (b), dan 2.50% (c) terhadap pertumbuhanS. mutans4... 5 6 Kemampuan penghambatan ampisilin pada konsentrasi 10 µg terhadap pertumbuhan
S. mutans4 ... 5
DAFTAR LAMPIRAN
Halaman
1 Komposisi media peremajaan, uji, dan produksi ... 13
2 Standar McFarland ... 15
3 Respon fisiologis isolatStreptococcusspp. danS. mutansserotipe e terhadap sorbitol,
manitol, inulin, laktosa, dan arginin ... 16
4 Aktivitas penghambatan filtrat kulturStreptomycesspp. tanpa pemekatan terhadap
PENDAHULUAN
Latar Belakang
Mikroorganisme penghuni mulut dapat menimbulkan masalah plak gigi. Plak gigi merupakan biofilm mikroorganisme pada permukaan gigi yang terbenam dalam polimer matriks dari saliva dan bakteri itu sendiri (Mars 1992). Bakteri yang umum ditemukan pada plak gigi antara lain:Streptococcusspp., Lactobacillus spp., Actinomyces spp., Neisseria spp., Haemophilus spp., Prevotella gingivalis, P. intermedia, Actinobacillus actinomycetemcomitans, Eikenella corrodens, Fusobacterium nucleatum, dan Treponema spp. (Marsh 1992; Mars & Nyvad 2003). Hamada & Slade (1980) melaporkan bahwa bakteri yang berperan penting dalam pembentukan plak gigi adalah bakteri yang mampu menghasilkan polisakarida ekstraseluler, terutama genus Streptococcus. Salah satu genus Streptococcus yang ditemukan dalam jumlah besar pada plak gigi adalahS. mutans.
Streptococcus mutans merupakan bakteri Gram positif, koloninya berpasangan atau berantai, tidak bergerak dan tidak berspora (Newbrun 1989). Streptococcus mutans dapat digolongkan menjadi delapan serotipe berdasarkan variasi serologis, genetik, dan biokimia. Delapan serotipe S. mutans antara lain: serotipe a (S. cricetus), b (S. rattus), c, e, f (S. mutans), d, g (S. sobrinus), dan h (S. downei). Serotipe lain yang hanya terdapat pada hewan yaitu S. ferus dan S. maccacae (serotipe c) sertaS. downei(Hamada & Slade 1980; Hardie & Whiley 1991).
Streptococcus mutans mempunyai dua sistem enzim yang dapat membentuk dua macam polisakarida ekstraseluler dari sukrosa, yaitu fruktan dan glukan. Fruktan yang disintesis oleh fruktosiltransferase (FTF) merupakan polimer fruktosa yang digunakan sebagai sumber energi, sedangkan glukan disintesis oleh glukosiltransferase (GTFs). Streptococcus mutansmempunyai tiga macam GTFs, yaitu: GTF-I dan GTF-SI mensintesis sebagian besar glukan tidak larut air, serta GTF-S mensintesis sebagian besar glukan larut air (Wexler et.al 1993). Newbrun (1989) melaporkan bahwa koloni S. mutans dapat melekat pada permukaan gigi karena adanya glukan tidak larut air.
Streptococcus mutans dilaporkan sebagai bakteri homofermentatif asam laktat. Namun, lintasan metabolisme glukosa pada S. mutans bervariasi tergantung pada faktor lingkungan. Produk fermentasi utama S. mutans adalah
asam laktat, khususnya ketika bakteri tersebut ditumbuhkan dalam medium yang kaya glukosa. Pada keadaan medium yang miskin glukosa,S. mutansjuga melakukan fermentasi heterolaktik dengan memproduksi asam lain seperti format, asetat, dan etanol (Hamada & Slade 1980). Asam dapat mempercepat pemasakan plak dan menurunkan pH permukaan gigi. Pengasaman gigi secara normal diikuti oleh fase alkalinisasi oleh bakteri mulut seperti S. sanguis dan Actinomyces naeslundii yang menghidrolisis urea menjadi amonia (Clancyet.al2000).
Pembentukan dan perkembangan plak gigi perlu dikurangi untuk mencegah kerusakan gigi. Hal ini dapat dilakukan dengan cara menghambat kolonisasi mikrob, menghambat pertumbuhan dan metabolisme mikrob, menghambat pematangan plak, dan modifikasi ekologi dan biokimia plak (Scheie 2003). Senyawa yang dilaporkan dapat mengurangi bakteri pembentuk plak gigi antara lain klorheksidin, cetylpyridinium chloride, delmopinol, heksetidin, ion logam (Cu2+, Sn2+, Zn2+), sodium dodesil sulfat, triklosan, enzim (glukanase, amiloglukosidase), silitol, fluor, ekstrak tanaman, minyak esensial tanaman (minyak atsiri daun sirih), dan antibiotik (ampisilin, tetrasiklin, eritromisin) (Hendarto et.al 1989; Mars 1992; Yunilawati 2002; Scheie 2003; Elwood & Fejerskov 2003).
Fluor merupakan unsur halogen yang banyak digunakan dalam pasta gigi. Jenis senyawa fluor yang terkandung dalam pasta gigi yang umum beredar dipasar yaitu natrium fluorida (NaF) dan Natrium monofluorofospat (MFP). Akan tetapi, pemakaian pasta gigi dengan konsentrasi fluor tinggi dapat menimbulkan efek samping berupa fluorosis email (Ellwood & Fejerskov 2003).
Salah satu contoh senyawa antibakteri yang termasuk minyak esensial tanaman yaitu minyak atsiri daun sirih (Yunilawati 2002; Lukistyowati 2002). Yunilawati (2002) melaporkan bahwa minyak atsiri daun sirih dalam pasta gigi dengan konsentrasi 0.1% (b/v) efektif menghambat S. mutans. Namun aplikasinya belum dapat dilakukan karena pasta gigi berubah warna jika disimpan, walaupun telah ditambah antioksidan.
antibiotik terbesar. Streptomyces termasuk bakteri aerob, berfilamen dengan diameter 0.5-1.0µm, kandungan G+C tinggi (69-73%), dan bereproduksi dengan spora dari miselium aerial (Holtet.al1994; Madiganet.al2006).
Streptomyces spp. isolat lokal memiliki keanekaragaman morfologi yang tinggi (Lestari 2006). Penelitian terhadap Streptomyces spp. isolat lokal membuktikan bahwa bakteri tersebut mampu menghasilkan senyawa antimikrob. Beberapa Streptomyces spp. isolat lokal mampu menghambat pertumbuhan Staphylococcus aureus dan bakteri penyebab diare Escherichia coli enteropatogenik (EPEC) (Yuliani 1999; Desriani et.al 2004; Fadhilah 2007; Prasetyaningrum 2007). Ifdal (2003) dan Andri (2004) juga melaporkan bahwa Streptomycessp. mampu menghambat bakteri patogen pada tanaman kedelai yaitu Bacillus subtilisdanXanthomonas axonopodis.
Berdasarkan kemampuan Streptomyces spp. dalam menghasilkan senyawa antimikrob, mendorong dilakukannya kajian lebih lanjut mengenai potensi senyawa antimikrob tersebut terhadapS. mutans. Oleh karena itu, penapisan Streptomyces spp. isolat lokal yang mampu menghambatS. mutansperlu dilakukan. Tujuan
Penelitian ini bertujuan menapis Streptomyces spp. isolat lokal penghasil senyawa antibakteri yang memberikan daya hambat terhadapS. mutansyang diisolasi dari plak gigi manusia. Daya hambat tersebut dibandingkan dengan daya hambat yang dihasilkan oleh minyak atsiri daun sirih dan natrium fluorida (NaF).
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) dan Laboratorium Biologi Mulut, Fakultas Kedokteran Gigi (FKG), Universitas Indonesia (UI) dari bulan Februari 2007 hingga September 2007.
BAHAN DAN METODE
BahanBahan yang digunakan ialah Streptomyces spp. isolat lokal yaitu IVNF1-1 yang diisolasi dari Kalimantan Timur, PS4-16 dan PS1-4 dari Pasir Sarongge Cipanas, PD2-9 dari Padang, SLW8-1 dari Sukabumi, dan B56-2 dari pulau Bokor kep. Seribu koleksi Dr. Yulin Lestari,
daun sirih (Piper betle), NaF, isolatS. mutans serotipe e koleksi Laboratorium Biologi Mulut FKG UI, dan sampel plak gigi manusia.
Metode
Isolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Lima sampel plak gigi (1 sampel/orang) diambil menggunakan swab steril, kemudian dimasukkan ke dalam ependorf berisi 1 ml NaCl 0.85% (b/v). Suspensi bakteri divorteks selama 30 detik. Sebanyak 0.1 ml suspensi bakteri dari masing-masing sampel diinokulasikan ke dalam 9.9 ml NaCl 0.85%, kemudian dilakukan pengenceran serial 10-1 sampai 10-6. Dari pengenceran 10-5 dan 10-6disebar 0.1 ml di atas media TSY20B (Trypticase Yeast-Extract Sucrose Bacitracin) (Lampiran 1). Isolat standarS. mutansserotipe e sebagai kontrol positif diremajakan pada medium TSY20B. Inkubasi dilakukan secara anaerob dalamanaerobic jarpada suhu 37OC selama 48 jam. Lima koloni isolat bakteri hasil isolasi dimurnikan dalam medium TSY20B.
Pada ke-5 isolat bakteri dan S. mutans serotipe e dilakukan pengamatan morfologi koloni dan pengamatan mikroskopis dengan perbesaran 1000 kali, serta uji fisiologis. Pengamatan morfologi koloni meliputi warna, bentuk, tepian, elevasi, dan permukaan koloni, sedangkan pengamatan secara mikroskopis pada perbesaran 1000 kali meliputi pewarnaan Gram, bentuk sel, dan penataan sel. Uji fisiologis yang digunakan antara lain fermentasi sorbitol, manitol, inulin, dan laktosa, serta hidrolisis arginin (Holt et.al 1994). Medium untuk uji fermentasi gula dan hidrolisis arginin dibuat dengan pH 7,2 (Lampiran 1). Berdasarkan hasil uji fisiologis, dipilih satu isolat S. mutans untuk digunakan sebagai bakteri target dalam uji antagonis.
Destilasi Minyak Atsiri Daun Sirih. Sebanyak 2 kg daun sirih dikeringanginkan selama ± 2 hari. Selanjutnya daun sirih didestilasi dengan cara destilasi uap air selama 6-8 jam. Destilat yang masuk ketabung pemisah didiamkan selama 24 jam untuk memisahkan fraksi minyak dengan air. Minyak yang sudah dikeluarkan dari tabung pemisah diberi Na2SO4 anhidrat 2-5% dari volume
Peremajaan Isolat Streptomyces spp. Enam isolatStreptomycesspp. yaitu IVNF1-1, PS4-16, PS1-4, PD2-9, SLW8-1, dan B56-2 diremajakan pada media YMB (Yeast Malt Broth) (Lampiran 1) yang telah diberi asam nalidiksat (antibakteri) dan griseovulvin (antifungi), selanjutnya diinkubasi pada suhu ruang dan diaerasi dengan kecepatan pengocokan 100 rpm. Setelah 7-10 hari, isolat digores pada media YMA (Yeast Malt Agar) dan Oatmeal (Lampiran 1) dengan inkubasi selama 7-10 hari pada suhu ruang.
Produksi Filtrat Kultur yang Mengandung Senyawa Antibakteri dari Isolat Streptomyces spp. Isolat Streptomyces spp. yang berusia 7 hari dipindahkan dengan menggunakan sedotan plastik steril (θ1.1 cm) dari media Oatmeal ke dalam 75 ml media ISP4 (International Streptomyces Project 4) (Lampiran 1) dengan pH 7. Inkubasi dilakukan pada inkubator bergoyang dengan kecepatan 100 rpm, suhu ruang selama 5 hari. Biakan disentrifugasi pada 12 000 g (J2-21, Beckman, USA), 4OC, selama 10 menit untuk mendapatkan supernatan. Tiga perempat bagian supernatan dipekatkan pada suhu -30OC sampai volumenya setengah volume awal. Sedangkan satu perempat bagian supernatan tidak dipekatkan.
Penentuan Jumlah Sel S. mutans. Sebanyak 100 µl biakan S. mutans diinokulasikan pada medium Muller Hinton Broth, selanjutnya diinkubasi secara anaerob dalam anaerobic jar pada suhu 37OC selama 24 jam. Kekeruhan suspensi sel diukur berdasarkan standar McFarland (Lampiran 2). Jumlah sel yang digunakan untuk uji antagonis yaitu standar McFarland No. 1 dengan jumlah sel sekitar 3 X 108sel/ml.
Uji Antagonis Filtrat Kultur
Streptomyces spp., Minyak Atsiri Daun Sirih, dan NaF terhadapS. mutans. Minyak atsiri daun sirih dilarutkan dalam etanol, sedangkan NaF dilarutkan dalam air destilata. Konsentrasi etanol yang digunakan sebagai pelarut yaitu berdasarkan hasil uji kelarutan minyak atsiri dalam berbagai konsentrasi etanol. Konsentrasi etanol terendah yang mulai melarutkan minyak atsiri digunakan sebagai pelarut, sehingga diperoleh larutan minyak atsiri dan NaF dengan konsentrasi % (b/v) 0.10; 0.25; 0.50; 0.75; dan 1.00 (Yunilawati 2002). Sebagai kontrol yaitu etanol (konsentrasi berdasarkan hasil uji kelarutan) untuk uji antagonis minyak atsiri daun sirih
serta akuades steril untuk uji antagonis NaF. Kontrol negatif uji antagonis filtrat kultur Streptomyces spp. menggunakan akuades steril, sedangkan kontrol positif yaitu cakram kertas berdiameter 6 mm yang mengandung ampisilin dengan konsentrasi 10µg.
Uji antagonis filtrat kultur Streptomyces spp., minyak atsiri daun sirih, dan NaF dilakukan dengan teknik cawan cakram kertas (paper disk plate). Sebanyak 0.1 ml biakan bakteri target yang telah mencapai jumlah sekitar 3 X 108sel/ml (standar McFarland No. 1) disebar pada permukaan media Muller Hinton Agar(Lampiran 1) dengan konsentrasi agar 10% (b/v) dan dibiarkan mengering selama 5-10 menit. Selanjutnya ditempatkan cakram kertas berdiameter 8 mm di atasnya. Pada setiap cakram kertas diteteskan 15 µl larutan uji. Setiap uji dilakukan secara duplo. Cawan petri diinkubasi secara anaerob dalam anaerobic jarpada suhu 37OC selama 48 jam.
IsolatStreptomycessp. yang menghasilkan zona hambat terbesar terhadap S. mutans, dikeringbekukan pada suhu -30OC untuk mendapatkan filtrat kultur kering. Selanjutnya filtrat kultur kering tersebut ditimbang untuk menentukan bobot keringnya. Filtrat kultur dengan kepekatan lima kali filtrat awal diuji antagonis terhadapS. mutans.
HASIL DAN PEMBAHASAN
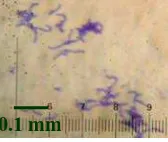
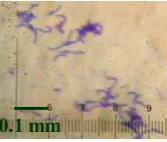
HasilIsolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Pengamatan mikroskopis terhadap lima isolat bakteri hasil isolasi pada perbesaran 1000 kali menunjukkan bahwa bentuk sel bakteri tersebut bulat, penataan sel berantai atau berpasangan, dan Gram positif, sesuai dengan kontrol S. mutans serotipe e. Karakteristik tersebut merupakan ciri umum Streptococcus spp., untuk menentukan bahwa lima isolat tersebut adalah S. mutans maka dilakukan uji fisiologis. Salah satu isolat Streptococcus spp. yang diamati dengan mikroskop pada perbesaran 1000 kali, dapat dilihat pada gambar 1.
Gambar 1 Morfologi koloniStreptococcus spp. di bawah mikroskop pada perbesaran 1000 kali
Tabel 1 Uji fisiologis isolatStreptococcusspp. danS. mutansserotipe e Kode isolat
Karakteristik 1 2 3 4 5 S. mutans
serotipe e
S. mutans (Holtet.al 1994) Produksi Asam dari:
Sorbitol + + + + + + +
Manitol + + + + + + +
Inulin + + - + + + +
Laktosa - + - + + + +
Hidrolisis Arginin - - -
-Ket: + : 90% atau lebih galur positif - : 90% atau lebih galur negatif
Berdasarkan tabel 1, terlihat bahwa isolat Streptococcus spp. 2, 4, dan 5 mempunyai karakteristik fisiologis S. mutans berdasarkan kemampuan dalam memfermentasi sorbitol, manitol, inulin, dan laktosa, serta tidak menghidrolisis arginin. Kemampuan tersebut juga dimiliki oleh S. mutansserotipe e. Isolat Streptococcus sp. 1 dan Streptococcus sp. 3 tidak mempunyai karakteristik fisiologis S. mutans karena tidak mampu memfermentasi laktosa pada Streptococcus sp. 1 dan tidak mampu memfermentasi inulin dan laktosa pada Streptococcus sp. 3. Reaksi positif fermentasi gula ditandai dengan berubahnya warna medium dari ungu menjadi kuning, sedangkan reaksi negatif ditandai dengan tidak berubahnya warna medium.
Berdasarkan hasil uji fisiologis, S. mutans serotipe e (Gambar 2) dan S. mutans 5 (Lampiran 3) tidak dapat memfermentasi gula inulin dan laktosa secara keseluruhan. Hal ini dapat terlihat pada warna medium inulin dan laktosa yang mengandung unsur warna ungu dan kuning. Warna ungu pada medium tersebut menunjukkan gula yang belum difermentasi, sedangkan warna kuning menunjukkan gula yang telah difermentasi. Semua isolat uji tidak menghidrolisis arginin, hal ini ditandai dengan tidak berubahnya warna medium (warna medium tetap ungu).
(a) (b)
Gambar 2 Respon fisiologisS. mutansserotipe e (a) dan S. mutans 4 (b) dalam fermentasi sorbitol (1), manitol (2), inulin (3), dan laktosa (4), serta hidrolisis arginin (5)
Satu dari tiga isolat S. mutans, yaitu S. mutans 4 (Gambar 2) digunakan sebagai bakteri target dalam uji antagonis. Ciri morfologi koloni S. mutans 4 dan S. mutans serotipe e pada medium TSY20B yaitu warna koloni kuning bening, bentuk koloni bulat dengan tepian licin, elevasi seperti tetesan, dan permukaan halus (Gambar 3).
(a) (b)
Gambar 3 Morfologi koloni S. mutans serotipe e (a) dan S. mutans 4 (b) pada medium TSY20B di bawah mikroskop dengan perbesaran 100 kali
Destilasi Minyak Atsiri Daun Sirih. Dua kilogram sirih basah setelah dikeringanginkan selama ±2 hari mengalami penurunan bobot menjadi 900 gram. Destilasi daun sirih menghasilkan minyak dengan volume ±7 ml. Pada awalnya, minyak yang dihasilkan berwarna kuning keruh dan masih mengandung air. Setelah ditambahkan natrium sulfat anhidrat yang berfungsi sebagai penyerap air, minyak yang dihasilkan menjadi berwarna kuning jernih dengan bau khas sirih. Minyak atsiri mulai larut dalam etanol 50% (v/v), ditandai dengan warna keruh dan bersatunya fraksi minyak dengan etanol. Kelarutan minyak atsiri semakin meningkat seiring dengan meningkatnya konsentrasi etanol yang digunakan.
Peremajaan Isolat Streptomyces spp. Enam isolat Streptomyces spp. yang ditumbuhkan pada media YMA dan Oatmeal
0.1 mm 0.1 mm
1 2 3 4
membutuhkan waktu 7-14 hari untuk mencapai koloni dewasa. Pada mulanya ke-6 isolat membentuk miselia aerial berwarna putih, ketika isolat berusia 7 hari miselia aerial sudah berwarna merah muda pada isolat IVNF1-1, PS4-16, PS1-4, dan PD2-9, abu-abu pada SLW8-1, dan putih kehitaman pada B56-2 (Gambar 4).
(a) (b)
(c) (d)
(e) (f)
Gambar 4 PertumbuhanStreptomyces IVNF1-1 (a), PS4-IVNF1-16 (b), PSIVNF1-1-4 (c), PD2-9 (d), SLW8-1 (e), dan B56-2 (f) umur 7 hari pada media YMA
Aktivitas Penghambatan Filtrat Kultur
Streptomyces spp. terhadap S. mutans. Berdasarkan tabel 2, dari 6 isolatStreptomyces spp. yang diuji, isolat IVNF1-1 mampu menghambat S. mutans 4. Lima isolat Streptomyces spp. yaitu PS4-16, PS1-4, PD2-9, SLW8-1, dan B56-2 tidak mampu menghambatS. mutans4 (Lampiran 4). Filtrat kultur IVNF1-1 umur lima hari menghasilkan bobot kering sebesar 5 µg/µl. Berdasarkan bobot keringnya, konsentrasi (b/v) filtrat kultur IVNF1-1 yang tidak dipekatkan yaitu 0.50%, dipekatkan dua kalinya menjadi 1.00%, dan dipekatkan 5 kalinya menjadi 2.50%. Zona hambat yang dihasilkan pada konsentrasi (b/v) 0.50%, 1.00%, dan 2.50% secara berturut-turut 2.12±0.18 mm, 3.50±0.71 mm, dan 7.38±0.53 mm (Gambar 5). Zona hambat yang dihasilkan merupakan diameter seluruh zona dikurangi diameter cakram kertas sebesar 8 mm.
Tabel 2 Rata-rata diameter zona hambat filtrat kultur Streptomyces spp. terhadap S. mutans4
Diameter Zona Hambat (mm)* Kode
Isolat
Filtrat Tidak Dipekatkan
Filtrat Dipekatkan 2 Kali Filtrat
Awal IVNF1-1 2.12±0.18 3.50±0.71
PS4-16 -
-PS1-4 -
-PD2-9 -
-SLW8-1 -
-B56-2 -
-*Diameter zona hambat rata-rata dari dua ulangan
(a) (b)
(c)
Gambar 5 Kemampuan penghambatan filtrat kultur IVNF1-1 pada konsentrasi (b/v) 0.50% (a), 1.00% (b), dan 2.50% (c) terhadap pertumbuhan S. mutans4
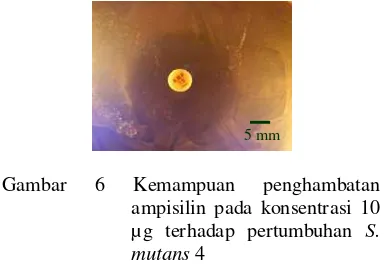
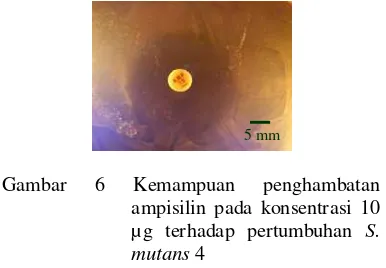
Uji antagonis ampisilin pada konsentrasi 10 µg terhadap S. mutans 4 dengan dua ulangan, menghasilkan zona hambat sebesar 22.62±0.53 mm (Gambar 6).
Gambar 6 Kemampuan penghambatan ampisilin pada konsentrasi 10 µg terhadap pertumbuhan S. mutans4
Aktivitas Penghambatan Minyak Atsiri Daun Sirih dan NaF terhadap S. mutans. Hasil pengukuran zona hambat minyak atsiri daun sirih dan NaF terhadap S. mutans 4
5 mm 5 mm
5 mm
10 mm 10 mm
10 mm 10 mm
10 mm 10 mm
menunjukkan besar yang berbeda pada setiap konsentrasi (Tabel 3). Kemampuan minyak atsiri dan NaF dalam menghambat S. mutans ditunjukkan dengan terbentuknya daerah bening disekitar cakram kertas.
Tabel 3 Rata-rata diameter zona hambat minyak atsiri daun sirih dan NaF terhadapS. mutans4
Diameter Zona Hambat (mm)*
Konsentrasi
% (b/v) Minyak Atsiri
NaF
Kontrol -a -b
0.10 0.75
-0.25 1.12±0.18 0.50 0.50 1.75±0.35 1.00±0.71 0.75 3.25±0.35 2.25±0.35 1.00 3.88±0.18 3.00±0.35 *Diameter zona hambat rata-rata dari dua ulangan a
etanol 50% (v/v) b
akuades
Berdasarkan tabel 3, terlihat bahwa minyak atsiri daun sirih telah menghambat S. mutans 4 pada konsentrasi 0.10% (b/v), sedangkan NaF baru menghambat pada konsentrasi 0.25% (b/v). Semakin tinggi konsentrasi minyak atsiri dan NaF yang diuji, maka semakin besar zona hambatnya terhadap S. mutans. Etanol 50% sebagai pelarut minyak atsiri daun sirih, terbukti tidak bersifat antagonis terhadap S. mutans 4 karena tidak menghasilkan zona hambatan.
.
Pembahasan
Isolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Dalam isolasi S. mutans dari sampel plak gigi dibutuhkan medium yang selektif untuk memudahkan terisolasinya bakteri tersebut. Medium TSY20B merupakan medium yang selektif untuk mengisolasi S. mutans karena mengandung sukrosa dengan konsentrasi 20% dan antibiotik basitrasin 200 unit/liter. Tingginya konsentrasi sukrosa dan adanya antibiotik basitrasin akan menghambat pertumbuhan bakteri mulut lain yang sensitif basitrasin dan kadar gula tinggi seperti S. salivarius(Schaekenet.al1986).
Streptococcus mutans merupakan bakteri anaerobik fakultatif yang tumbuh lebih baik pada kondisi anaerob dibandingkan dengan kondisi aerob dan kondisi lingkungan yang mengandung 5% CO2 (Holt et.al 1994).
Pertumbuhan S. mutans dalam medium padat pada kondisi anaerob menunjukkan morfologi koloni lebih rapat dan subur daripada kondisi aerob. Streptococcus mutans yang tumbuh
pada kondisi aerob akan mengalami gangguan pertumbuhan, karena keberadaan oksigen mempengaruhi metabolisme gula, produksi asam, toleransi tegangan, ketahanan dalam plak gigi, dan kapasitas pembentukan biofilm (Takahashi et.al 1987; Iwami et.al 2000; Takahashi-Abbe et.al 2001; Ahn & Burne 2007). Ahn & Burne (2007) melaporkan bahwa penurunan kapasitas pembentukan biofilm pada kondisi aerob disebabkan oleh adanya genatlAyang ekspresinya dipengaruhi oleh oksigen. GenatlAmenyandikan autolisin yang diperlukan untuk biogenesis permukaan sel dan pematangan biofilm.
Pengamatan mikroskopis pada perbesaran 1000 kali terhadap lima isolat bakteri hasil isolasi dari plak gigi manusia menunjukkan karakteristik Gram positif, bentuk sel bulat berpasangan atau berantai. Hasil pengamatan sesuai dengan kontrol positif S. mutans serotipe e, tetapi karakteristik tersebut merupakan ciri umum yang dimiliki genus Streptococcus. Oleh karena itu, Uji fisiologis perlu dilakukan untuk mengidentifikasi dan membedakan S. mutans dari genus Streptococcus lain yang ada di dalam mulut. Hasil uji fisiologisS. mutansserotipe e dan 3 isolatStreptococcusspp. menunjukkan bahwa bakteri tersebut memfermentasi gula sorbitol, manitol, inulin, dan laktosa, serta tidak menghidrolisis arginin. Holt et.al (1994) melaporkan bahwa ciri-ciri fisiologis tersebut dimiliki olehS. mutans.
Pada reaksi positif fermentasi gula terjadi perubahan warna medium dari ungu menjadi kuning, hal ini disebabkan oleh dihasilkannya asam laktat dari metabolisme gula yang menyebabkan pH medium turun. Jika arginin dapat dihidrolisis maka pH akan naik, karena pemecahan arginin menghasilkan amonia yang cenderung menaikan pH medium (Hamada & Slade 1980). Reaksi perubahan warna pada uji fermentasi gula dan hidrolisis arginin disebabkan oleh adanya reagen Bromcresol Purple sebagai indikator pH yang berwarna ungu pada suasana netral, ungu tua atau gelap pada suasana basa, dan kuning pada suasana asam (Rollins & Joseph 2000).
sedikit keruh, keruh, dan suram. Etanol digunakan sebagai pelarut minyak atsiri karena minyak atsiri larut dalam pelarut organik, selain itu etanol 50% (v/v) tidak bersifat antibakteri terhadapS. mutans. Hal ini ditandai oleh tidak terbentuknya zona hambatan disekitar cakram yang mengandung 15 µl etanol 50% (v/v).
Minyak atsiri daun sirih mulai menunjukkan aktivitas penghambatan terhadap S. mutans 4 pada konsentrasi 0.10% (b/v). Semakin tinggi konsentrasi minyak atsiri yang duji, semakin besar zona hambat yang dihasilkan. Daya hambat minyak atsiri daun sirih lebih besar dibandingkan NaF pada setiap konsentrasi.
Aktivitas penghambatan minyak atsiri daun sirih disebabkan oleh adanya senyawa fenol dan turunannya, salah satunya adalah kavikol (Yunilawati 2002). Senyawa fenol dan turunannya merupakan bahan aktif antibakteri yang bekerja dengan cara mendenaturasi protein sehingga sel bakteri mengalami kerusakan (Pelczar & Chan 1988). Nakahara et.al (1993) dan Hamilton-Miller (2001) melaporkan bahwa beberapa senyawa polifenol pada ekstrak teh terbukti dapat melakukan mekanisme penghambatan terhadap S. mutans, diantaranya bersifat bakteriostatik dan bakterisidal tehadap S. mutans dan S. sobrinus, menghambat perlekatan S. mutans, menghambat aktivitas amilase dari bakteri dan saliva, dan menghambat enzim glukosiltransferase yang mensintesis glukan tidak larut air.
Senyawa NaF mulai menunjukkan aktivitas penghambatan terhadap S. mutans 4 pada konsentrasi 0.25% (b/v), zona hambat meningkat seiring meningkatnya konsentrasi NaF yang diuji. Fluor merupakan kelompok halogen yang dapat menginaktifkan enzim yang membutuhkan kalsium atau magnesium dengan cara mengikat logam-logam tersebut (Pelczar & Chan 1988).
Streptococcus mutans melakukan metabolisme karbohidrat melalui proses glikolisis menggunakan beberapa enzim, salah satunya adalah enolase. Bila terdapat ion fluor, kerja enolase akan dihambat karena ion fluor akan berikatan dengan Mg2+yang merupakan kofaktor enolase, sehingga enolase menjadi tidak aktif. Hal ini mengakibatkan fosfoenolpiruvat tidak dapat disintesis sehingga proses glikolisis yang merupakan mekanisme pembentukan energi tidak berjalan. Dengan demikian, pertumbuhan S. mutansmenjadi terhambat karena kekurangan
energi untuk pertumbuhannya (Bunick & Kashket 1981).
Dalam bidang kesehatan gigi dan mulut, fluor banyak digunakan dalam tablet, obat kumur, dan pasta gigi (Ellwood & Fejerskov 2003). Konsentrasi fluor yang umum digunakan dalam pasta gigi yang beredar yaitu 880-1500 ppm (part per million) atau sama dengan NaF pada konsentrasi 0.19-0.33% (b/v) (Nugrohoet.al2002). Pada penelitian ini, S. mutans mulai terhambat oleh NaF pada konsentrasi 0.25% (b/v) yang mengandung fluor 1131 ppm. Aktivitas penghambatan minimum S. mutans pada konsentrasi 0.25% (b/v) berada pada kisaran konsentrasi fluor yang umum digunakan dalam pasta gigi yang beredar.
Aktivitas Penghambatan Filtrat Kultur
Streptomyces spp. terhadap S. mutans. Aktivitas antibakteri filtrat kultur IVNF1-1 terhadap S. mutans 4, meningkat seiring dengan meningkatnya konsentrasi senyawa antibakteri dalam filtrat kultur tersebut. Hal ini dapat dilihat dari besarnya zona hambatan yang dihasilkan pada setiap konsentrasi uji. Zona hambat tersebut meningkat setelah dilakukan pemekatan dari konsentrasi (b/v) 0.5% menjadi 1.00% dan 2.5%. Yuliani (1999) dan Ifdal (2003) melaporkan bahwa semakin tinggi tingkat kepekatan filtrat kultur yang mengandung senyawa antibakteri, maka semakin luas pula zona hambatan yang dihasilkan. Adanya peningkatan aktivitas antibakteri filtrat kultur setelah dipekatkan, disebabkan oleh meningkatnya konsentrasi senyawa antibakteri pada filtrat kultur tersebut. Madigan et.al (2006) melaporkan bahwa senyawa antibakteri yang dihasilkan Streptomyces diduga merupakan mekanisme adaptasi dan pertahanan terhadap bakteri lain pada lingkungan kompleks seperti pada tanah yang merupakan habitat asli bagi sebagian besarStreptomyces.
yaitu 3.00±0.35 mm, tetapi lebih kecil dari zona hambat minyak atsiri daun sirih yaitu 3.88±0.18 mm.
Pada penelitian ini, kondisi produksi senyawa antibakteri 6 isolatStreptomycesspp. disesuaikan dengan kondisi optimasi produksi senyawa antibakteri pada isolat IVNF1-1, yaitu menggunakan media ISP4, pH 7, dan aerasi 100 rpm (Fadhilah 2007). Media ISP4 merupakan media yang miskin nutrisi dan mengandung banyak mineral dengan sumber karbon pati. Media yang miskin nutrisi akan menekan pertumbuhan, sehingga memicu diekskresikannya metabolit sekunder. Kondisi produksi dibuat dengan aerasi 100 rpm karena Streptomyces merupakan bakteri tanah aerob obligat (Madiganet.al 2006). Fadhilah (2007) melaporkan bahwa Streptomycessp. IVNF1-1 yang ditumbuhkan pada kondisi teraerasi memproduksi metabolit sekunder yang lebih cepat daripada kondisi tanpa aerasi. Metabolit sekunder dihasilkan selama fase stasioner pertumbuhan, pada fase ini nutrisi lingkungan mulai berkurang, pertumbuhan sel menjadi lambat sehingga akan menstimulasi sel untuk memproduksi metabolit sekunder. Media produksi dibuat dengan pH 7 karena Streptomycestumbuh baik pada suasana netral sampai basa (Madiganet.al2006).
Pada kondisi produksi tersebut, filtrat kultur 5 isolatStreptomycesspp. yaitu PS4-16, PS1-4, PD2-9, SLW8-1, dan B56-2 tidak mampu menghambat S. mutans 4, baik pada filtrat yang tidak dipekatkan maupun setelah dipekatkan dua kali filtrat awal (Tabel 2) (Lampiran 4). Hasil uji antagonis tersebut mengindikasikan bahwa metabolit sekunder yang dihasilkan 5 isolatStreptomycesspp. dan logam yang terkandung dalam media ISP4 seperti Fe, Mn, dan Zn tidak bersifat antibakteri terhadap S. mutans 4. Sebaliknya senyawa metabolit sekunder Streptomyces sp. IVNF1-1 mampu menghambat pertumbuhanS. mutans4, baik pada konsentrasi (b/v) 0.50%, 1.00%, dan 2.50% dengan zona hambat secara berturut-turut 2.12±0.18 mm, 3.50±0.71 mm, dan 7.38±0.53 mm.
Perbedaan aktivitas penghambatan pertumbuhan S. mutans 4 oleh Streptomyces spp. yang diuji, kemungkinan disebabkan oleh metabolit sekunder yang dihasilkan Streptomyces spp. memiliki kemampuan antibakteri yang beragam. Senyawa antibakteri yang dihasilkan isolat PS4-16, PS1-4, PD2-9, dan B56-2 tidak mampu menghambat pertumbuhan S. mutans 4, tetapi mampu menghambat pertumbuhan bakteri lain. Hal ini dibuktikan oleh Ifdal (2003), Andri (2004),
dan Lestari (2006) yang melaporkan bahwa isolat PS1-4 dan B56-2 menghasilkan senyawa antibakteri yang menghambat B. subtilis dan X. axonopodis. Desriani et.al (2004) dan Prasetyaningrum (2007) juga melaporkan bahwa isolat PD2-9, PS1-4, dan PS4-16 menghasilkan senyawa antibakteri yang menghambat EPEC. Pelczar & Chan (1988) menyatakan bahwa senyawa antibakteri yang dihasilkan oleh Streptomyces tidak selalu efektif terhadap semua jenis bakteri, hal ini disebabkan tiap spesies atau galur mikroorganisme memiliki kerentanan yang berbeda-beda terhadap berbagai senyawa antimikrob.
Uji antagonis ampisilin terhadap S. mutans 4 dilakukan untuk melihat daya hambat antibiotik yang telah dikomersilkan. Berdasarkan standar diameter zona hambat Kirby-Bauer, bakteri gram positif tergolong resisten ampisilin pada konsentrasi 10 µg jika diameter zona hambat yang dihasilkan 28 mm, serta tergolong sensitif jika diameter zona hambat yang dihasilkan 29 mm (Madigan et.al 2006). Zona hambat ampisilin pada konsentrasi 10 µg terhadapS. mutans4 yaitu 22.62±0.53 mm, hasil tersebut mengindikasikan bahwa S. mutans 4 bersifat resisten terhadap ampisilin yang diujikan. Jumlah sel bakteri yang digunakan pada metode Kirby-Bauer yaitu 1.5 X 108 sel/ml (McFarland 0.5) (Deshpande 2007), sedangkan pada penelitian ini jumlah selS. mutans4 yang digunakan yaitu 3 X 108sel/ml (McFarland 1). ResistensiS. mutans4 terhadap ampisilin pada penelitian ini, kemungkinan disebabkan oleh jumlah sel yang lebih besar dari metode Kirby-Bauer.
Pada konsentrasi 0.5% (b/v) filtrat kultur IVNF1-1 yang mengandung 75 µg filtrat kultur kering, menghasilkan zona hambat sebesar 2.12±0.18 mm. Zona hambat tersebut jauh lebih rendah jika dibandingkan dengan zona hambat yang dihasilkan ampisilin pada konsentrasi 10 µg. Rendahnya zona hambat yang dihasilkan isolat IVNF1-1 disebabkan oleh kondisi filtrat yang masih mengandung senyawa-senyawa pengotor, sedangkan ampisilin kemurnian senyawa antimikrobnya tinggi. Oleh karena itu, perlu dilakukan pemurnian senyawa antimikrob filtrat kultur IVNF1-1, sehingga terbebas dari senyawa-senyawa pengotornya.
bakteri Gram positif (S. mutans) dan Gram negatif (EPEC) (Yuliani 1999; Desriani et.al 2004; Fadhilah 2007; Prasetyaningrum 2007).
SIMPULAN DAN SARAN
SimpulanTiga dari lima isolat Streptococcus spp. hasil isolasi dari plak gigi manusia mempunyai karakteristik fisiologis S. mutans, yaitu memfermentasi sorbitol, manitol, inulin, dan laktosa, serta tidak menghidrolisis arginin. Satu dari tiga isolatS. mutans, yaituS. mutans 4 digunakan sebagai bakteri target dalam uji antagonis.
Dari 6 isolatStreptomycesspp. yang diuji, isolat IVNF1-1 mampu menghambat pertumbuhanS. mutans 4. Zona hambat filtrat kultur IVNF1-1 pada konsentrasi 0.50% (b/v) yaitu 2.12±0.18 mm. Zona hambat tersebut lebih besar dari zona hambat minyak atsiri daun sirih dan NaF pada konsentrasi yang sama, secara berurutan yaitu 1.75±0.35 mm dan 1.00±0.71 mm. Zona hambat filtrat kultur IVNF1-1 pada konsentrasi 1.00% (b/v) yaitu 3.50±0.71 mm. Pada konsentrasi yang sama, zona hambat tersebut lebih besar dari zona hambat NaF yaitu 3.00±0.35 mm, namun lebih kecil dari zona hambat minyak atsiri daun sirih yaitu 3.88±0.18 mm.
Saran
Perlu dilakukan pemurnian senyawa antimikrob yang dihasilkan olehStreptomyces sp. IVNF1-1, sehingga dapat diuji antagonis terhadapS. mutanspada berbagai konsentrasi.
DAFTAR PUSTAKA
Ahn SJ, Burne RA. 2007. Effects of oxygen on biofilm formation and the atlA autolysin of Streptococcus mutans. J Bacteriol 189(17): 6293-6302.
Andri C. 2004. Kajian potensi Streptomyces sp. PS1-4 sebagai penghasil senyawa bioaktif pengendali bakteri patogen tanaman kedelai. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bunick FJ, Kashket S. 1981. Enolases from fluoride-sensitive and fluoride-resistant Streptococci.Infect Immun34(3):856-863. Clancy KA, Pearson S, Bowen WH, Burne RA. 2000. Characterization of
recombinant, ureolytic Streptococcus mutans demonstrates an inverse relationship between dental plaque ureolytic capacity and cariogenicity.Infect immun68(5): 2621-2629.
Deshpande P. 04 Apr 2007. Antimicrobial susceptibility testing by disc diffusion method.Protocol online.
Desriani, Lestari Y, Meryandini A. 2004. Penapisan isolat Streptomyces spp. penghasil protein penghambat â-laktamase.Hayati11(3):88-92.
Ellwood R, Fejerskov O. 2003.Clinical Use of Fluoride. Di dalam: Fejerskov O, Kidd EAM, editor. Dental Caries the Desease and it’s Clinical management. USA: Black Well Munksgaard.
Fadhilah AM. 2007. Optimasi produksi senyawa anti â-laktamase dari Streptomyces sp. IVNF1-1 penghambat pertumbuhan bakteri penyebab diare EPEC KI-I. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Guenther E. 1990. The Essential Oils. New York: Robert Krieger.
Hamada S, Slade HD. 1980. Biology, immunology, and cariogenicity of Streptococcus mutans. Microbiol Rev 44(2): 331-384.
Hamilton-Miller JMT. 2001. Anti-cariogenic properties of tea (Camellia sinensis). J Med Microbiol50:299-302.
Hardie JM, Whiley RA. 1991. The Genus Streptococcus Oral.Di dalam: Balows A, Truper HG, Dworkin M, Harder V, Schleifer KH, editor.The Prokaryotes. Ed ke-2. Volume ke-2. New York: Springer-Verlag.
Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriologi. Ed ke-9. Baltimore: Williams & Wilkins.
Ifdal. 2003. Interaksi antara Streptomyces sp. dengan Bacillus subtilis, Xanthomonas campestris pv glicine, Rhizobia, dan Pseudomonassp. MK I. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Iwami Y, Takahashi-Abbe S, Takahashi N, Abbe K, Yamada T. 2000. Rate-limiting steps of glucose and sorbitol metabolism inStreptococcus mutans cells exposed to air. Oral Microbiol Immunol 15(5):325-328.
Lestari Y. 2006. Identification of indigenous Streptomycesspp. Producing antibacterial compounds [short communication]. J Mikrobiol Indones11(2):99-101.
Lukistyowati E. 2002. The antibacterial potention of piper betle infusion against Streptococcus salivarius. [skripsi]. Jakarta: Fakultas Kedokteran Gigi, Universitas Indonesia.
Madigan MT, Martinko JM, Parker. 2006. Biology of Microorganism. New Jersey: Prentice Hall.
Mars PD. 1992. Microbiological aspects of the chemical control of plaque and gingivitis. J Dent Res71(7):1431-1438.
Marsh PD, Nyvad B. 2003. The Oral Microflora and Biofilms on Teeth. Di dalam: Fejerskov O, Kidd EAM, editor. Dental Caries the Desease and its Clinical management. USA: Black Well Munksgaard.
Nakahara et.al. 1993. Inhibitory Effect of oolong tea polyphenols on glucosyltransferases of Mutans Streptococci. App Environ Microbiol 59(4):968-973.
Newburn. 1989. Cariology. Chicago: Quintessence Books.
Nugroho A, Firmansyah I, Nurhasan. 2002. Kandungan Fluoride dalam Pasta Gigi
Anak. Jakarta: Lembaga Konsumen Jakarta.
Pelczar MJJr, Chan ECS. 1988.Dasar-Dasar Mikrobiologi. Volume ke-2. Hadioetomo RS. Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI pr. Terjemahan dari:Elements of Microbiology.
.
Prasetyaningrum V. 2007. Bioautografi senyawa antibakteri dariStreptomycessp. IVNF1-1 penghambat pertumbuhan Enteropathogenic Escherichia coli K1-1 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rollins DM, Joseph SW. 2000. pH Indicators. http://www.life.umd.edu/classroom/bsci42 4/LabMaterialMethods/pHIndicators. html [4 Okt 2007].
Schaeken MJM, Hoeven VD, Franken HCM. 1986. Comparative recovery of Streptococcus mutans of five isolation medium, including a new simple selective medium.J Dent Res65(6): 906-908. Scheie AA. 2003.The Role of Antimicrobials.
Di dalam: Fejerskov O, Kidd EAM, editor.Dental Caries the Desease and its Clinical management. USA: Black Well Munksgaard.
Takahashi N, Abbe K, Takahashi-Abbe S, Yamada T. 1987. Oxygen sensitivity of sugar metabolism and interconfersion of pyruvate formatelyase in intact cells of Streptococcus mutans and Streptococcus sanguis.Infect immun55(3):652-656. Takahashi-Abbe S, Abbe K, Takahashi N,
Tamazawa Y, Yamada T. 2001. Inhibitory effect of sorbitol on sugar metabolism of Streptococcus mutansin vitro and on acid production in dental plaque in vivo. Oral Microbiol Immunol16(2):94-99.
Wexler DL, Hudson MC, Burne RA. 1993. Streptococcus mutansfructosyltransferase (ftf) and glucosyltransferase (gtfBC) operon fusion strains in continuous culture.Infect Immun61(4):1259-1267. Yuliani E. 1999. Biodiversitas dan
Fakultas matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lampiran 1 Komposisi media peremajaan, uji, dan produksi
a. Media
Trypticase Sucrose Yeast-Extract Bacitracin
(TSY20B)
No
Jenis Bahan
Jumlah (gram/liter) Media
1
Trypticase Soy Agar
(TSA)
40
2
Bakto agar
5
3
Ekstrak ragi
10
4
Sukrosa
200
5
Basitrasin
200 unit/liter
b. Media
Muller Hinton Broth
Digunakan media siap pakai merek Oxoid
c. Media
Muller Hinton Agar
Digunakan media
Muller Hinton Broth
siap pakai merek Oxoid ditambah bakto
agar 10 g/l
d. Media
Yeast Malt Broth
(YMB)
No
Jenis Bahan
Jumlah (gram/liter) media
1
Glukosa
4
2
Ekstrak ragi
4
3
Ekstrak malt
10
e. Media
Yeast Malt Agar
(YMA)
Media YMB ditambah 15% (b/v) agar
f.
Media International Streptomyces Project
(ISP) 4
No
Jenis Bahan
Jumlah (gram/liter) Media
1
Soluble starch
10
2
CaCO
32
3
(NH
4)
2SO
42
4
K
2HPO
41
5
MgSO
4.7H
2O
1
6
NaCl
1
7
FeSO
4.7H
2O
0.001
8
MnCl
2.7H
2O
0.001
9
ZnSO
4.7H
2O
0.001
g. Media uji fermentasi karbohidrat
No
Jenis Bahan
Jumlah (g/l)
1
Karbohidrat (sorbitol, manitol, inulin,
dan laktosa)
10
2
Pepton
10
3
NaCl
5
Lampiran 1 Lanjutan
h. Media uji hidrolisis arginin
No
Jenis Bahan
Jumlah (g/l)
1
Arginin
10
2
Pepton
10
3
NaCl
5
Lampiran 2 Standar McFarland
No
1% (b/v) BaCl
2(ml)
1% (v/v) H
2SO
4(ml)
Rata-rata jumlah sel
(10
6/ml)
1
0.1
9.9
300
2
0.2
9.8
600
3
0.3
9.7
900
4
0.4
9.6
1200
5
0.5
9.5
1500
6
0.6
9.4
1800
7
0.7
9.3
2100
8
0.8
9.2
2400
9
0.9
9.1
2700
Lampiran 3 Respon fisiologis isolat
Streptococcus
spp. dan
S. mutans
serotipe e
terhadap sorbitol, manitol, inulin, laktosa, dan arginin
(a)
(b)
(c)
(d)
(e)
(f)
Ket:
a
S. mutans
serotipe e
1 Sorbitol
b
Streptococcus
sp. 1
2 Manitol
c
S. mutans
2
3 Inulin
d
Streptococcus
sp. 3
4 Laktosa
e
S. mutans
4
5 Arginin
f
S. mutans
5
1
1
1
1
1
1
2
2
2
2
2
2
3
3
3
3
3
3
4
4
4
4
4
4
5
5
5
5
5
Lampiran 4 Aktivitas penghambatan filtrat kultur
Streptomyces
spp. tanpa
pemekatan terhadap pertumbuhan
S. mutans
4
Ket:
1
Streptomyces
sp. PS1-4
2
Streptomyces
sp. IVNF1-1
3
Streptomyces
sp. PS4-16
4
Streptomyces
sp. PD2-9
5
Streptomyces
sp. SLW8-1
6
Streptomyces
sp. B56-2
1
2
3
4
5
DIISOLASI DARI PLAK GIGI
Oleh:
Ai Andriani
G34103010
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AI ANDRIANI. Penapisan Streptomyces spp. Penghasil Senyawa Penghambat Pertumbuhan Streptococcus mutansyang Diisolasi dari Plak Gigi. Dibimbimg oleh YULIN LESTARI dan SRI BUDIARTI.
Pembentukan dan perkembangan plak gigi yang disebabkan oleh bakteri mulut sepertiS. mutans, perlu dikurangi untuk mencegah kerusakan gigi dengan menggunakan senyawa antibakteri. Dalam penelitian ini, dilakukan penapisan 6 Streptomyces spp. isolat lokal yaitu IVNF1-1, PS1-4, PS4-16, PD2-9, SLW8-1, dan B56-2 penghasil senyawa antibakteri yang memberikan daya hambat terhadapS. mutansyang diisolasi dari plak gigi manusia. Daya hambat tersebut dibandingkan dengan daya hambat yang dihasilkan oleh minyak atsiri daun sirih dan natrium fluorida (NaF).
Tiga dari lima isolatStreptococcusspp. mempunyai karakteristikS. mutans. Satu dari tiga isolat tersebut, yaituS. mutans4 digunakan sebagai bakteri target dalam uji antagonis. Dari 6 isolat Streptomycesspp. yang diuji, isolat IVNF1-1 mampu menghambat pertumbuhanS. mutans4. Zona hambat filtrat kultur IVNF1-1 pada konsentrasi 0.50% (b/v) yaitu 2.12±0.18 mm. Zona hambat tersebut lebih besar dari zona hambat minyak atsiri daun sirih dan NaF pada konsentrasi yang sama, secara berurutan yaitu 1.75±0.35 mm dan 1.00±0.71 mm. Pada konsentrasi 1.00% (b/v), filtrat kultur isolat IVNF1-1, minyak atsiri daun sirih, dan NaF menghasilkan zona hambat secara berturut-turut yaitu 3.50±0.71 mm, 3.88±0.18 mm, dan 3.00±0.35 mm. Hasil penelitian ini menunjukkan bahwa senyawa bioaktif yang dihasilkan olehStreptomycessp. IVNF1-1 berpotensi sebagai agen kontrol pertumbuhanS. mutans4.
ABSTRACT
AI ANDRIANI. Screening ofStreptomycesspp. which Produces Growth Inhibitory Compounds of Streptococcus mutanswas Isolated from Dental Plaque. Supervised by YULIN LESTARI and SRI BUDIARTI.
The formation and development of dental plaque caused by mouth bacteria such as Streptococcus mutans, need to be controled to prevent tooth decay by using antibacterial compounds. In this study, 6Streptomycesspp. namely IVNF1-1, PS4-16, PS1-4, PD2-9, SLW8-1, and B56-2 were screened for their ability to produce antibacterial compounds which indicated by an inhibition zone against S. mutans isolated from human dental plaque. The capability of Streptomycesspp. in inhibitingS. mutanswas compared with inhibition zone of essential oilPiper betleand natrium fluoride (NaF).
PENDAHULUAN
Latar Belakang
Mikroorganisme penghuni mulut dapat menimbulkan masalah plak gigi. Plak gigi merupakan biofilm mikroorganisme pada permukaan gigi yang terbenam dalam polimer matriks dari saliva dan bakteri itu sendiri (Mars 1992). Bakteri yang umum ditemukan pada plak gigi antara lain:Streptococcusspp., Lactobacillus spp., Actinomyces spp., Neisseria spp., Haemophilus spp., Prevotella gingivalis, P. intermedia, Actinobacillus actinomycetemcomitans, Eikenella corrodens, Fusobacterium nucleatum, dan Treponema spp. (Marsh 1992; Mars & Nyvad 2003). Hamada & Slade (1980) melaporkan bahwa bakteri yang berperan penting dalam pembentukan plak gigi adalah bakteri yang mampu menghasilkan polisakarida ekstraseluler, terutama genus Streptococcus. Salah satu genus Streptococcus yang ditemukan dalam jumlah besar pada plak gigi adalahS. mutans.
Streptococcus mutans merupakan bakteri Gram positif, koloninya berpasangan atau berantai, tidak bergerak dan tidak berspora (Newbrun 1989). Streptococcus mutans dapat digolongkan menjadi delapan serotipe berdasarkan variasi serologis, genetik, dan biokimia. Delapan serotipe S. mutans antara lain: serotipe a (S. cricetus), b (S. rattus), c, e, f (S. mutans), d, g (S. sobrinus), dan h (S. downei). Serotipe lain yang hanya terdapat pada hewan yaitu S. ferus dan S. maccacae (serotipe c) sertaS. downei(Hamada & Slade 1980; Hardie & Whiley 1991).
Streptococcus mutans mempunyai dua sistem enzim yang dapat membentuk dua macam polisakarida ekstraseluler dari sukrosa, yaitu fruktan dan glukan. Fruktan yang disintesis oleh fruktosiltransferase (FTF) merupakan polimer fruktosa yang digunakan sebagai sumber energi, sedangkan glukan disintesis oleh glukosiltransferase (GTFs). Streptococcus mutansmempunyai tiga macam GTFs, yaitu: GTF-I dan GTF-SI mensintesis sebagian besar glukan tidak larut air, serta GTF-S mensintesis sebagian besar glukan larut air (Wexler et.al 1993). Newbrun (1989) melaporkan bahwa koloni S. mutans dapat melekat pada permukaan gigi karena adanya glukan tidak larut air.
Streptococcus mutans dilaporkan sebagai bakteri homofermentatif asam laktat. Namun, lintasan metabolisme glukosa pada S. mutans bervariasi tergantung pada faktor lingkungan. Produk fermentasi utama S. mutans adalah
asam laktat, khususnya ketika bakteri tersebut ditumbuhkan dalam medium yang kaya glukosa. Pada keadaan medium yang miskin glukosa,S. mutansjuga melakukan fermentasi heterolaktik dengan memproduksi asam lain seperti format, asetat, dan etanol (Hamada & Slade 1980). Asam dapat mempercepat pemasakan plak dan menurunkan pH permukaan gigi. Pengasaman gigi secara normal diikuti oleh fase alkalinisasi oleh bakteri mulut seperti S. sanguis dan Actinomyces naeslundii yang menghidrolisis urea menjadi amonia (Clancyet.al2000).
Pembentukan dan perkembangan plak gigi perlu dikurangi untuk mencegah kerusakan gigi. Hal ini dapat dilakukan dengan cara menghambat kolonisasi mikrob, menghambat pertumbuhan dan metabolisme mikrob, menghambat pematangan plak, dan modifikasi ekologi dan biokimia plak (Scheie 2003). Senyawa yang dilaporkan dapat mengurangi bakteri pembentuk plak gigi antara lain klorheksidin, cetylpyridinium chloride, delmopinol, heksetidin, ion logam (Cu2+, Sn2+, Zn2+), sodium dodesil sulfat, triklosan, enzim (glukanase, amiloglukosidase), silitol, fluor, ekstrak tanaman, minyak esensial tanaman (minyak atsiri daun sirih), dan antibiotik (ampisilin, tetrasiklin, eritromisin) (Hendarto et.al 1989; Mars 1992; Yunilawati 2002; Scheie 2003; Elwood & Fejerskov 2003).
Fluor merupakan unsur halogen yang banyak digunakan dalam pasta gigi. Jenis senyawa fluor yang terkandung dalam pasta gigi yang umum beredar dipasar yaitu natrium fluorida (NaF) dan Natrium monofluorofospat (MFP). Akan tetapi, pemakaian pasta gigi dengan konsentrasi fluor tinggi dapat menimbulkan efek samping berupa fluorosis email (Ellwood & Fejerskov 2003).
Salah satu contoh senyawa antibakteri yang termasuk minyak esensial tanaman yaitu minyak atsiri daun sirih (Yunilawati 2002; Lukistyowati 2002). Yunilawati (2002) melaporkan bahwa minyak atsiri daun sirih dalam pasta gigi dengan konsentrasi 0.1% (b/v) efektif menghambat S. mutans. Namun aplikasinya belum dapat dilakukan karena pasta gigi berubah warna jika disimpan, walaupun telah ditambah antioksidan.
antibiotik terbesar. Streptomyces termasuk bakteri aerob, berfilamen dengan diameter 0.5-1.0µm, kandungan G+C tinggi (69-73%), dan bereproduksi dengan spora dari miselium aerial (Holtet.al1994; Madiganet.al2006).
Streptomyces spp. isolat lokal memiliki keanekaragaman morfologi yang tinggi (Lestari 2006). Penelitian terhadap Streptomyces spp. isolat lokal membuktikan bahwa bakteri tersebut mampu menghasilkan senyawa antimikrob. Beberapa Streptomyces spp. isolat lokal mampu menghambat pertumbuhan Staphylococcus aureus dan bakteri penyebab diare Escherichia coli enteropatogenik (EPEC) (Yuliani 1999; Desriani et.al 2004; Fadhilah 2007; Prasetyaningrum 2007). Ifdal (2003) dan Andri (2004) juga melaporkan bahwa Streptomycessp. mampu menghambat bakteri patogen pada tanaman kedelai yaitu Bacillus subtilisdanXanthomonas axonopodis.
Berdasarkan kemampuan Streptomyces spp. dalam menghasilkan senyawa antimikrob, mendorong dilakukannya kajian lebih lanjut mengenai potensi senyawa antimikrob tersebut terhadapS. mutans. Oleh karena itu, penapisan Streptomyces spp. isolat lokal yang mampu menghambatS. mutansperlu dilakukan. Tujuan
Penelitian ini bertujuan menapis Streptomyces spp. isolat lokal penghasil senyawa antibakteri yang memberikan daya hambat terhadapS. mutansyang diisolasi dari plak gigi manusia. Daya hambat tersebut dibandingkan dengan daya hambat yang dihasilkan oleh minyak atsiri daun sirih dan natrium fluorida (NaF).
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) dan Laboratorium Biologi Mulut, Fakultas Kedokteran Gigi (FKG), Universitas Indonesia (UI) dari bulan Februari 2007 hingga September 2007.
BAHAN DAN METODE
BahanBahan yang digunakan ialah Streptomyces spp. isolat lokal yaitu IVNF1-1 yang diisolasi dari Kalimantan Timur, PS4-16 dan PS1-4 dari Pasir Sarongge Cipanas, PD2-9 dari Padang, SLW8-1 dari Sukabumi, dan B56-2 dari pulau Bokor kep. Seribu koleksi Dr. Yulin Lestari,
daun sirih (Piper betle), NaF, isolatS. mutans serotipe e koleksi Laboratorium Biologi Mulut FKG UI, dan sampel plak gigi manusia.
Metode
Isolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Lima sampel plak gigi (1 sampel/orang) diambil menggunakan swab steril, kemudian dimasukkan ke dalam ependorf berisi 1 ml NaCl 0.85% (b/v). Suspensi bakteri divorteks selama 30 detik. Sebanyak 0.1 ml suspensi bakteri dari masing-masing sampel diinokulasikan ke dalam 9.9 ml NaCl 0.85%, kemudian dilakukan pengenceran serial 10-1 sampai 10-6. Dari pengenceran 10-5 dan 10-6disebar 0.1 ml di atas media TSY20B (Trypticase Yeast-Extract Sucrose Bacitracin) (Lampiran 1). Isolat standarS. mutansserotipe e sebagai kontrol positif diremajakan pada medium TSY20B. Inkubasi dilakukan secara anaerob dalamanaerobic jarpada suhu 37OC selama 48 jam. Lima koloni isolat bakteri hasil isolasi dimurnikan dalam medium TSY20B.
Pada ke-5 isolat bakteri dan S. mutans serotipe e dilakukan pengamatan morfologi koloni dan pengamatan mikroskopis dengan perbesaran 1000 kali, serta uji fisiologis. Pengamatan morfologi koloni meliputi warna, bentuk, tepian, elevasi, dan permukaan koloni, sedangkan pengamatan secara mikroskopis pada perbesaran 1000 kali meliputi pewarnaan Gram, bentuk sel, dan penataan sel. Uji fisiologis yang digunakan antara lain fermentasi sorbitol, manitol, inulin, dan laktosa, serta hidrolisis arginin (Holt et.al 1994). Medium untuk uji fermentasi gula dan hidrolisis arginin dibuat dengan pH 7,2 (Lampiran 1). Berdasarkan hasil uji fisiologis, dipilih satu isolat S. mutans untuk digunakan sebagai bakteri target dalam uji antagonis.
Destilasi Minyak Atsiri Daun Sirih. Sebanyak 2 kg daun sirih dikeringanginkan selama ± 2 hari. Selanjutnya daun sirih didestilasi dengan cara destilasi uap air selama 6-8 jam. Destilat yang masuk ketabung pemisah didiamkan selama 24 jam untuk memisahkan fraksi minyak dengan air. Minyak yang sudah dikeluarkan dari tabung pemisah diberi Na2SO4 anhidrat 2-5% dari volume
antibiotik terbesar. Streptomyces termasuk bakteri aerob, berfilamen dengan diameter 0.5-1.0µm, kandungan G+C tinggi (69-73%), dan bereproduksi dengan spora dari miselium aerial (Holtet.al1994; Madiganet.al2006).
Streptomyces spp. isolat lokal memiliki keanekaragaman morfologi yang tinggi (Lestari 2006). Penelitian terhadap Streptomyces spp. isolat lokal membuktikan bahwa bakteri tersebut mampu menghasilkan senyawa antimikrob. Beberapa Streptomyces spp. isolat lokal mampu menghambat pertumbuhan Staphylococcus aureus dan bakteri penyebab diare Escherichia coli enteropatogenik (EPEC) (Yuliani 1999; Desriani et.al 2004; Fadhilah 2007; Prasetyaningrum 2007). Ifdal (2003) dan Andri (2004) juga melaporkan bahwa Streptomycessp. mampu menghambat bakteri patogen pada tanaman kedelai yaitu Bacillus subtilisdanXanthomonas axonopodis.
Berdasarkan kemampuan Streptomyces spp. dalam menghasilkan senyawa antimikrob, mendorong dilakukannya kajian lebih lanjut mengenai potensi senyawa antimikrob tersebut terhadapS. mutans. Oleh karena itu, penapisan Streptomyces spp. isolat lokal yang mampu menghambatS. mutansperlu dilakukan. Tujuan
Penelitian ini bertujuan menapis Streptomyces spp. isolat lokal penghasil senyawa antibakteri yang memberikan daya hambat terhadapS. mutansyang diisolasi dari plak gigi manusia. Daya hambat tersebut dibandingkan dengan daya hambat yang dihasilkan oleh minyak atsiri daun sirih dan natrium fluorida (NaF).
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) dan Laboratorium Biologi Mulut, Fakultas Kedokteran Gigi (FKG), Universitas Indonesia (UI) dari bulan Februari 2007 hingga September 2007.
BAHAN DAN METODE
BahanBahan yang digunakan ialah Streptomyces spp. isolat lokal yaitu IVNF1-1 yang diisolasi dari Kalimantan Timur, PS4-16 dan PS1-4 dari Pasir Sarongge Cipanas, PD2-9 dari Padang, SLW8-1 dari Sukabumi, dan B56-2 dari pulau Bokor kep. Seribu koleksi Dr. Yulin Lestari,
daun sirih (Piper betle), NaF, isolatS. mutans serotipe e koleksi Laboratorium Biologi Mulut FKG UI, dan sampel plak gigi manusia.
Metode
Isolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Lima sampel plak gigi (1 sampel/orang) diambil menggunakan swab steril, kemudian dimasukkan ke dalam ependorf berisi 1 ml NaCl 0.85% (b/v). Suspensi bakteri divorteks selama 30 detik. Sebanyak 0.1 ml suspensi bakteri dari masing-masing sampel diinokulasikan ke dalam 9.9 ml NaCl 0.85%, kemudian dilakukan pengenceran serial 10-1 sampai 10-6. Dari pengenceran 10-5 dan 10-6disebar 0.1 ml di atas media TSY20B (Trypticase Yeast-Extract Sucrose Bacitracin) (Lampiran 1). Isolat standarS. mutansserotipe e sebagai kontrol positif diremajakan pada medium TSY20B. Inkubasi dilakukan secara anaerob dalamanaerobic jarpada suhu 37OC selama 48 jam. Lima koloni isolat bakteri hasil isolasi dimurnikan dalam medium TSY20B.
Pada ke-5 isolat bakteri dan S. mutans serotipe e dilakukan pengamatan morfologi koloni dan pengamatan mikroskopis dengan perbesaran 1000 kali, serta uji fisiologis. Pengamatan morfologi koloni meliputi warna, bentuk, tepian, elevasi, dan permukaan koloni, sedangkan pengamatan secara mikroskopis pada perbesaran 1000 kali meliputi pewarnaan Gram, bentuk sel, dan penataan sel. Uji fisiologis yang digunakan antara lain fermentasi sorbitol, manitol, inulin, dan laktosa, serta hidrolisis arginin (Holt et.al 1994). Medium untuk uji fermentasi gula dan hidrolisis arginin dibuat dengan pH 7,2 (Lampiran 1). Berdasarkan hasil uji fisiologis, dipilih satu isolat S. mutans untuk digunakan sebagai bakteri target dalam uji antagonis.
Destilasi Minyak Atsiri Daun Sirih. Sebanyak 2 kg daun sirih dikeringanginkan selama ± 2 hari. Selanjutnya daun sirih didestilasi dengan cara destilasi uap air selama 6-8 jam. Destilat yang masuk ketabung pemisah didiamkan selama 24 jam untuk memisahkan fraksi minyak dengan air. Minyak yang sudah dikeluarkan dari tabung pemisah diberi Na2SO4 anhidrat 2-5% dari volume
Peremajaan Isolat Streptomyces spp. Enam isolatStreptomycesspp. yaitu IVNF1-1, PS4-16, PS1-4, PD2-9, SLW8-1, dan B56-2 diremajakan pada media YMB (Yeast Malt Broth) (Lampiran 1) yang telah diberi asam nalidiksat (antibakteri) dan griseovulvin (antifungi), selanjutnya diinkubasi pada suhu ruang dan diaerasi dengan kecepatan pengocokan 100 rpm. Setelah 7-10 hari, isolat digores pada media YMA (Yeast Malt Agar) dan Oatmeal (Lampiran 1) dengan inkubasi selama 7-10 hari pada suhu ruang.
Produksi Filtrat Kultur yang Mengandung Senyawa Antibakteri dari Isolat Streptomyces spp. Isolat Streptomyces spp. yang berusia 7 hari dipindahkan dengan menggunakan sedotan plastik steril (θ1.1 cm) dari media Oatmeal ke dalam 75 ml media ISP4 (International Streptomyces Project 4) (Lampiran 1) dengan pH 7. Inkubasi dilakukan pada inkubator bergoyang dengan kecepatan 100 rpm, suhu ruang selama 5 hari. Biakan disentrifugasi pada 12 000 g (J2-21, Beckman, USA), 4OC, selama 10 menit untuk mendapatkan supernatan. Tiga perempat bagian supernatan dipekatkan pada suhu -30OC sampai volumenya setengah volume awal. Sedangkan satu perempat bagian supernatan tidak dipekatkan.
Penentuan Jumlah Sel S. mutans. Sebanyak 100 µl biakan S. mutans diinokulasikan pada medium Muller Hinton Broth, selanjutnya diinkubasi secara anaerob dalam anaerobic jar pada suhu 37OC selama 24 jam. Kekeruhan suspensi sel diukur berdasarkan standar McFarland (Lampiran 2). Jumlah sel yang digunakan untuk uji antagonis yaitu standar McFarland No. 1 dengan jumlah sel sekitar 3 X 108sel/ml.
Uji Antagonis Filtrat Kultur
Streptomyces spp., Minyak Atsiri Daun Sirih, dan NaF terhadapS. mutans. Minyak atsiri daun sirih dilarutkan dalam etanol, sedangkan NaF dilarutkan dalam air destilata. Konsentrasi etanol yang digunakan sebagai pelarut yaitu berdasarkan hasil uji kelarutan minyak atsiri dalam berbagai konsentrasi etanol. Konsentrasi etanol terendah yang mulai melarutkan minyak atsiri digunakan sebagai pelarut, sehingga diperoleh larutan minyak atsiri dan NaF dengan konsentrasi % (b/v) 0.10; 0.25; 0.50; 0.75; dan 1.00 (Yunilawati 2002). Sebagai kontrol yaitu etanol (konsentrasi berdasarkan hasil uji kelarutan) untuk uji antagonis minyak atsiri daun sirih
serta akuades steril untuk uji antagonis NaF. Kontrol negatif uji antagonis filtrat kultur Streptomyces spp. menggunakan akuades steril, sedangkan kontrol positif yaitu cakram kertas berdiameter 6 mm yang mengandung ampisilin dengan konsentrasi 10µg.
Uji antagonis filtrat kultur Streptomyces spp., minyak atsiri daun sirih, dan NaF dilakukan dengan teknik cawan cakram kertas (paper disk plate). Sebanyak 0.1 ml biakan bakteri target yang telah mencapai jumlah sekitar 3 X 108sel/ml (standar McFarland No. 1) disebar pada permukaan media Muller Hinton Agar(Lampiran 1) dengan konsentrasi agar 10% (b/v) dan dibiarkan mengering selama 5-10 menit. Selanjutnya ditempatkan cakram kertas berdiameter 8 mm di atasnya. Pada setiap cakram kertas diteteskan 15 µl larutan uji. Setiap uji dilakukan secara duplo. Cawan petri diinkubasi secara anaerob dalam anaerobic jarpada suhu 37OC selama 48 jam.
IsolatStreptomycessp. yang menghasilkan zona hambat terbesar terhadap S. mutans, dikeringbekukan pada suhu -30OC untuk mendapatkan filtrat kultur kering. Selanjutnya filtrat kultur kering tersebut ditimbang untuk menentukan bobot keringnya. Filtrat kultur dengan kepekatan lima kali filtrat awal diuji antagonis terhadapS. mutans.
HASIL DAN PEMBAHASAN
Hasil [image:31.595.368.452.643.714.2]Isolasi dan Identifikasi S. mutans dari Sampel Plak Gigi. Pengamatan mikroskopis terhadap lima isolat bakteri hasil isolasi pada perbesaran 1000 kali menunjukkan bahwa bentuk sel bakteri tersebut bulat, penataan sel berantai atau berpasangan, dan Gram positif, sesuai dengan kontrol S. mutans serotipe e. Karakteristik tersebut merupakan ciri umum Streptococcus spp., untuk menentukan bahwa lima isolat tersebut adalah S. mutans maka dilakukan uji fisiologis. Salah satu isolat Streptococcus spp. yang diamati dengan mikroskop pada perbesaran 1000 kali, dapat dilihat pada gambar 1.
Gambar 1 Morfologi koloniStreptococcus spp. di bawah mikroskop pada perbesaran 1000 kali
Peremajaan Isolat Streptomyces spp. Enam isolatStreptomycesspp. yaitu IVNF1-1, PS4-16, PS1-4, PD2-9, SLW8-1, dan B56-2 diremajakan pada media YMB (Yeast Malt Broth) (Lampiran 1) yang telah diberi asam nalidiksat (antibakteri) dan griseovulvin (antifungi), selanjutnya diinkubasi pada suhu ruang dan diaerasi dengan kecepatan pengocokan 100 rpm. Setelah 7-10 hari, isolat digores pada media YMA (Yeast Malt Agar) dan Oatmeal (Lampiran 1) dengan inkubasi selama 7-10 hari pada suhu ruang.
Produksi Filtrat Kultur yang Mengandung Senyawa Antibakteri dari Isolat Streptomyces spp. Isolat Streptomyces spp. yang berusia 7 hari dipindahkan dengan menggunakan sedotan plastik steril (θ1.1 cm) dari media Oatmeal ke dalam 75 ml media ISP4 (International Streptomyces Project 4) (Lampiran 1) dengan pH 7. Inkubasi dilakukan pada inkubator bergoyang dengan kecepatan 100 rpm, suhu ruang selama 5 hari. Biakan disentrifugasi pada 12 000 g (J2-21, Beckman, USA), 4OC, selama 10 menit untuk mendapatkan supernatan. Tiga perempat bagian supernatan dipekatkan pada suhu -30OC sampai volumenya setengah volume awal. Sedangkan satu perempat bagian supernatan tidak dipekatkan.
Penentuan Jumlah Sel S. mutans. Sebanyak 100 µl biakan S. mutans diinokulasikan pada medium Muller Hinton Broth, selanjutnya diinkubasi secara anaerob dalam anaerobic jar pada