UJI IMUNOMODULATOR POLISAKARIDA HASIL
EKSTRAKSI DARI JINTEN HITAM (
Nigella sativa
L.)
TERHADAP TOTAL LEUKOSIT, JUMLAH LIMFOSIT
DAN MONOSIT, SERTA INTERLEUKIN-1β
PADA
MENCIT BALB/C
Skripsi
Diajukan untuk memenuhi syarat gelar sarjana farmasi (S.Far)
TEGUH PRIYANTO
NIM : 108102000074
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
i
UIN
SYARIF HIDAYATULLAH JAKARTA
UJI IMUNOMODULATOR POLISAKARIDA HASIL
EKSTRAKSI DARI JINTEN HITAM (
Nigella sativa
L.)
TERHADAP TOTAL LEUKOSIT, JUMLAH LIMFOSIT
DAN MONOSIT, SERTA INTERLEUKIN-1β
PADA
MENCIT BALB/C
Skripsi
Diajukan untuk memenuhi syarat gelar sarjana farmasi (S.Far)
TEGUH PRIYANTO
NIM : 108102000074
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
v
ABSTRAK
Judul :
Uji imunomodulator polisakarida hasil ekstraksi dari jinten hitam (nigella sativaL.) terhadap total leukosit, jumlah limfosit dan monosit , serta interleukin-1β pada mencitBALB/CNigella sativaL merupakan tanaman yang banyak mengandung zat-zat yang sangat ampuh dalam mengobati penyakit. Bahkan tanaman ini direkomendasikan oleh Rasulullah SAW penggunaanya terutama dalam hal medisinal. Penelitian ini bertujuan untuk menguji efek imunomodulator polisakarida hasil ekstraksiNigella sativa L. melalui pengukuran total leukosit, jumlah limfosit dan monosit, serta kadar Interlekuin1β pada mencit Balb/c. Sebanyak 20 mencit yang diuji dibagi menjadi 4 kelompok: kontrol, dosis rendah (1,25 mg/BB mencit ), dosis sedang (2,5 mg/BB mencit), dan dosis tinggi ( 5 mg/BB mencit). Polisakarida diberikan secara oral selama 14 hari dan sampel darah diambil pada hari ke-7, ke-14 dan ke-21. Hasil rata-rata analisis statistik ANOVA menunjukan bahwa pemberian ekstrak polisakarida pada ketiga dosis mampu meningkatkan total leukosit dan jumlah limfosit secara signifikan dibandingkan kontrol, namun tidak mampu mempengaruhi jumlah monosit. Dosis tinggi 5 mg / BB mencit memiliki aktifitas imunomodulator terbaik. Sedangkan pada uji interlekuin 1β, mencit diberikan
polisakarida hasil ekstraksi Nigella sativa L. secara oral selama 5 hari. Pada hari kelima, dua jam setelah pemberian hasil ekstraksi Nigella sativa L. disuntikan secara i.p LPS 20 ug / BB mencit lalu diambil sampel darahnya setelah 6 jam. Hasil uji statistik kruskal Wallis menunjukan bahwa pemberian polisakarida Nigella sativaL. tidak mempengaruhi kadar interleukin -1βsecara signifikan (p >0.05)
lymphocytes and monocytes, and interleukin1βon mice BalB/C
Nigella sativaL.is a plant that contains many substances that very effective to treat the disease. Moreover this plant was recommended by Rasulullah SAW to use especially in medicinal treatment. This research is aim to test the effect of immunomodulator polysaccharide, the result extraction of black seed (Nigella sativa L.) through measuring the total number of leukocytes, lymphocytes and monocytes, and the level of interleukin 1β onmice BALB/C. as many as 20 mice that have to test were divided into 4 groups : control, low doses (1,25 mg/BW mice), medium doses (2,5 mg/BW mice), and high doses (5 mg/BW mice). Polysaccharide extract was given orally during 14 days and the blood sample was taken in day 7th, 14th, and 21th. The average result of statistical analysis ANOVA indicate that the giving of polysaccharide extract on high doses can increase the total number of leukocytes and lymphocytes significantly (P>0,05) if compared with control group, however it can not give effect to total number of monocytes. The high doses (5 mg/BW mice) have the best immunomodulator activity. While for The test of interleukin-1β, mice was given polysaccharide the result extractionNigella sativa L. orally during 5 days. In day 5th, two hours after giving the result extraction
Nigella sativa L.that have been injection by i.p LPS 20 µg/BW mice then the blood sample was taken after 6 hours. The result of statistical Kruskal Wallis showed that the treatment of polysaccharidesNigella sativa L. not affect levels of interleukin
1βsignificantly. (P>0,05).
vii
KATA PENGANTAR
Puji syukur kepada Allah Subhanahu wa ta’ala, yang telah memberikan
pertolongan dan kasih sayang-Nya sehingga kami penulis dapat menyelesaikan penulisan skripsi ini. Makalah skripsi yang berjudul “Uji Imunomodulator Polisakarida hasil ekstraksi Jinten Hitam (Nigella sativa L.) Terhadap Total Leukosit, Jumlah Limfosit, Jumlah Monosit, Dan Jumlah Interleukin-1β Pada
Mencit Balb/C”dibuat untuk memenuhi tugas mata kuliah Skripsi, salah satu syarat untuk mencapai gelar Sarjana Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
Pada penulisan ini, penulis juga ingin mengucapkan penghargaan dan terima kasih yang sebesar-besarnya kepada:
(1) Farida Sulistiawati M.Si,Apt selaku dosen pembimbing pertama yang telah menyediakan waktu, tenaga, dan pikiran dalam menuntun penulis dalam
penyusunan skripsi ini.
(2) Drs. Umar Mansur M.Sc selaku dosen pembimbing kedua sekaligus Kepala Program Studi Farmasi UIN Syarif hidayatullah Jakarta
(3) Zilhadia M.Si, Apt selaku dosen pembimbing akademik selama pendidikan. (4) Para dosen Farmasi UIN yang telah memberikan ilmu, pengalaman dan
wawasannya.
(5) Kementrian Agama dan pemerintah kabupaten Musi banyuasin yang telah memberikan dukungan moril dan materil selama pendidikan. Ucapan beribu terimakasih, semoga ilmu yang saya terima dapat bermanfaat.
(6) Orangtua, kakak, adik dan keluarga besar yang selalu memberi dukungan, semangat dan doa, Love you all.
(7) Rekan penelitian Zikriah, Sinti ayesa, Nia yuliani dewi, dan Azhari zikro yang telah bersama dalam suka dan duka. Sahabat-sahabat Sukron, Farhan, Lukman dll, yang telah memberikan dukungan dan keceriaan sehingga saya bersemangat dan bisa menyelesaikan tugas akhir ini.
Saya menyadari bahwa dalam makalah skripsi ini masih terdapat banyak kekurangan. Oleh karena itu, saya mengharapkan kritik dan saran yang membangun sehingga dapat menyempurnakan skripsi ini dan melaksanakan perbaikan di masa yang akan datang. Semoga tulisan ini dapat bermanfaat bagi para pembaca dan bagi dunia pendidikan dan ilmu pengetahuan.
Ciputat, 3 April 2015
ix
BAB I PENDAHULUAN...1
1.1 Latar Belakang ...1
1.2 Perumusan Masalah ...3
1.3 Tujuan Penelitian ...3
1.4 Manfaat Penelitian ...3
BAB II TINJAUAN PUSTAKA...4
2.1 DESKRIPSI TANAMAN JINTAN HITAM (Nigella sativaL.)...4
2.1.1 Klasifikasi Tanaman ...4
2.1.2 Nama Daerah ...4
2.1.3 Ciri-ciri tanaman ...4
2.1.4 Kandungan tanaman ...5
2.1.5 Khasiat dan Kegunaan ...7
2.2 EKSTRAK ...7
2.3 METODE EKSTRAKSI ...8
2.3.1 Ekstraksi Dengan Menggunakan Pelarut...8
2.3.2 Metode Ekstraksi Lainnya ...9
2.4 IMUNOMODULATOR...10
2.8 HEWAN UJI (MENCIT/ Mus Muskulus) ...17
BAB III METODOLOGI PENELITIAN ...19
3.1 TEMPAT DAN WAKTU PENELITIAN...19
3.2 BAHAN DAN ALAT ...19
3.2.1 Bahan ...19
a. bahan uji ...19
3.3.1 Optimasi Ekstraksi PolisakaridaNigella sativaL...20
a. Metode Ekstraksi Pertama (Hailat,et al.1998 ) ...20
b. Metode Ekstraksi Kedua (Toneli,et al. 2008 ) 3.3.2 Preparasi sampel ...20
1. Pembuatan Larutan Na-CMC 5 % ...20
2. Penentuan Dosis (hussein el-taher,et al. 2006) ...20
3.3.3 Perlakuan Hewan Uji ...21
a. Perlakuan Untuk Uji Total Leukosit, persentase Limfosit Dan Persentase Monosit ...21
b. Perlakuan Untuk UjiInterlekuin1 β...22
c. Pengambilan Darah (permatasari, 2012) ...23
3.3.4 Metode Uji ...23
a. Uji Total Leukosit, persentase limfosit, dan persentase Monosit ...23
b. uji kadar UjiInterlekuin1 β...25
3.4 ANALISA DATA ...25
BAB IV HASIL DAN PEMBAHASAN ...26
4.1 HASIL OPTIMASI EKSTRAKSI ...26
4.2 TOTAL LEUKOSIT ...29
4.3 JUMLAH LIMFOSIT ...33
4.4 JUMLAH MONOSIT ...37
4.5 KADAR INTERLEUKIN 1β...40
BAB V KESIMPULAN DAN SARAN ...42
5.1 KESIMPULAN ...42
5.2 SARAN ...42
DAFTAR PUSTAKA ...43
xi
DAFTAR GAMBAR
Halaman
Gambar 2. 1 Bentuk batang dan bungaNigella sativaL...5
Gambar 2.2 Komponen terbesarNigella sativa L. (Paarrakh M, 2010) ... 7
Gambar 2.3 Beberapa jenis penampakan mikroskop dari leukosit (Anonim, 2013)...11
Gambar 2.4 Bagan Pembentukan Sel Darah Dari Stema Sel (Theml,et al, 2004). ... 12
Gambar 2.5 Limfosit (Theml, Het all, 2004) ... 13
Gambar 2.6 Monosit (Theml, Het all, 2004) ... 14
Gambar 2.7 Monosit (Theml, Het all, 2004) ... 15
Gambar 2.8 Skema Ilustrasi Uji ELISA (Sino biological.inc, 2015)... 16
Gambar 2.9 Mencit Balb/C (Sino biological.inc, 2015) ... 17
Gambar 3.1 Kamar hitung neubauer (Eki Putra, 2008) ... 24
Gambar 3.2 Alur pengamatan microskop pada gelas objek ... 24
Gambar 4.1 Hasil Ekstraksi PolisakaridaNigella sativaL metode pertama ... ... 24
Gambar 4.2 Hasil uji Barfoed polisakarida hasil ekstraksiNigella sativaL .. ... 27
Gambar 4.3 Hasil uji benedict polisakarida hasil ekstraksiNigella sativa L (terbentuk warna merah bata pada tabung tengah)... 27
Gambar 4.4 Hasil ekstraksi polisakarida metode kedua ... 28
Gambar 4.5 Grafik peningkatan total leukosit hari ke-7... 30
Gambar 4.6 Grafik peningkatan total leukosit hari ke-14... 31
Gambar 4.7 Grafik peningkatan total leukosit hari ke-21 ... 32
Gambar 4.8 Grafik peningkatan jumlah hari ke-7 ... 34
Gambar 4.9 Grafik peningkatan jumlah limfosit hari ke-14 ... 34
Gambar 4.10 Grafik peningkatan jumlah limfosit hari ke-21 ... 35
Gambar 4.11 Grafik peningkatan jumlah monosit hari ke-7... 38
Gambar 4.12 Grafik peningkatan jumlah monosit hari ke-14... 38
Gambar 4.13 Grafik Peningkatan Monosit hari ke-21 ... 39
Tabel 2.1 Konstituen UmumNigella sativaL. (Hussein El- taher,et al2006)
... 6
Tabel 2.2 Konstituen Minyak Nigella sativa(Hussein El- taher,et al2006) ... 6
Tabel 3.1. Perlakuan kelompok uji total leukosit, limfosit, dan monosit ... 21
Tabel 3.2 Perlakuan Kelompok Uji Interlekuin 1β...22
Tabel 4.1 Hasil perhitungan total leukosit ... 29
Tabel 4.2 Rataan Jumlah Limfosit. ... 33
Tabel 4.3 Rataan Jumlah Monosit... 37
xiii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kerangka Konsep Penelitian ...47
Lampiran 2. Bagan ekstraksi pertama ... 48
Lampiran 3. Bagan ekstraksi kedua ...49
Lampiran 4. Surat keterangan mencit ...50
Lampiran 5. Hasil Uji Kadar Abu Dan Kadar Air. ...51
Lampiran 6. Kegiatan Pengukuran Kadar Abu Dan Kadar Air ...52
Lampiran 7. Hasil Uji Karbohidran Total ekstraksi pertama ...53
Lampiran 8: Hasil Uji Karbohidran Total ekstraksi kedua ...54
Lampiran 9. Penentuan Besar Dosis ...55
Lampiran 10. Pembuatan Larutan Induk...56
Lampiran 11. Kegitan penelitian : Pengambilan Darah ...57
Lampiran 12. Kegitan penelitian : Pembuatan sediaan apus...60
Lampiran 13. Kegitan penelitian : Penghitungan Leukosit...62
Lampiran 14.Metode Uji ELISA...63
Lampiran 15.Hasil Pengamatan Mikroskop... 65
Lampiran 16. Hasil Penghitungan total leukosit, Jumlah Presentase Monosit Dan Limfosit hari ke -7... 68
Lampiran 17. Hasil Penghitungan total leukosit, Jumlah Presentase Monosit Dan Limfosit hari ke-14 ...69
Lampiran 18. Hasil Penghitungan total leukosit, Jumlah Presentase Monosit Dan Limfosit hari ke-21 ...70
Lampiran 19. Hasil uji interleukin 1-beta ...71
Lampiran 20. Hasil Uji homogenitas data Total Leukosit hari ke-7...72
Lampiran 21. Hasil Uji ANOVA Total Leukosit hari ke-7 ...73
Lampiran 22. Hasil Uji Turkey HSD (Honest Significant Different) total leukosit hari ke-7...74
Lampiran 23. Hasil Uji homogenitas data Total Leukosit hari ke-14...75
Lampiran 24. Hasil Uji ANOVA Total Leukosit hari ke-14 ...76
Lampiran 25. Hasil Uji Turkey HSD (Honest Significant Different) total leukosit hari ke-14...77
Lampiran 26. Hasil Uji homogenitas data Total Leukosit pada hari ke-21. ...78
Lampiran 27. Hasil Uji non parametrik kruskal wallis Total Leukosit Hari ke-21 ...79
Lampiran 28. Uji homogenitas perbandingan uji total leukosit perminggu...80
Lampiran 29. Uji ANOVA total leukosit per minggu...81
Lampiran 30. Uji Turkey HSD total leukosit perbandingan antar kelompok perminggu ...82
Lampiran 31. Hasil uji homogenitas data jumlah limfosit hari ke-7...83
Lampiran 32. Hasil Uji ANOVA jumlah limfosit hari ke-7 ...84
Lampiran 33. Hasil uji turkey HSD jumlah limfosit hari ke-7 ...85
Lampiran 34. Hasil uji homogenitas data limfosit hari ke-14...86
Lampiran 35. Hasil uji Anova jumlah limfosit hari ke-14 ...87
Lampiran 36. Hasil Uji Turkey HSD (Honest Significant Different) jumlah limfosit hari ke-14 ...88
Lampiran 41. Uji Turkey HSD rata-rata perminggu limfosit. ...93
Lampiran 42. Uji homogenitas data monosit hari ke-7...94
Lampiran 43. Uji ANOVA Monosit hari ke-7 ...95
Lampiran 44. Uji kruskal walis monosit hari ke-7 ...96
Lampiran 45. Uji Homogenitas Hari Ke-14 ...97
Lampiran 46. Uji ANOVA monosit hari ke-14 ...98
Lampiran 47. Uji kruskal walis monosit ke-14...99
Lampiran 48. Uji homogenitas data monosit hari ke-21...100
Lampiran 49. Uji ANOVA monosit hari ke-21 ...101
Lampiran 50. Uji kruskal walis monosit hari ke-21...102
Lampiran 51. Uji homogenitas interleukin1β...103
1
UIN Syarif hidayatullah Jakarta
BAB 1 PENDAHULUAN
1.1 LATAR BELAKANG
Tubuh manusia memiliki suatu sistem keamanan yang melindungi tubuh dari bahaya lingkungan luar tubuh. Lingkuangan di sekitar manusia banyak mengandung berbagai jenis patogen, seperti : jamur, bakteri, virus, protozoa, dan, parasit yang dapat menyebabkan infeksi pada manusia. Infeksi yang terjadi pada manusia pada umumnya terjadi dalam waktu yang singkat dan jarang menimbulkan kerusakan permanen. Hal ini disebabkan karena adanya sistem imun yang melindungi tubuh dari unsur-unsur patogen tersebut.
Imunomodulator adalah obat yang dapat mengembalikan dan memperbaiki sistem imun yang fungsinya terganggu atau untuk menekan yang fungsinya berlebihan (Handayani, 2010). Penggunaan imunomodulator sering digunakan saat tubuh terserang suatu infeksi. Senyawa ini diharapkan dapat membantu sistem imun tubuh dalam mengatasi patogen yang masuk kedalam tubuh manusia.
Nigella sativa L. yang telah dikenal dengan nama jinten hitam termasuk dalam family Ranunculaceae, telah banyak digunakan di berbagai negara sebagai imunomodulator, termasuk negara-negara barat maupun negara-negara timur (Haq A. et al, 1995). Berdasarkan sejarah, penelitian
mendalam mengenai jinten hitam (Nigella sativa L.) pertama kali dikemukakan oleh Grenish melalui publikasi jurnalnya pada tahun 1880. Dalam Nigella sativa L. terkandung 37 % minyak dan 4,1 % abu (garam kalsium) (Hussein,et al., 2006).
.
Hendaklah kalian mengkonsumsi jinten hitam, karena
sesungguhnya terkandung obat penyembuh dari segala macam penyakit,
kecuali kematian (HR. Ibnu Majah dan Nasa i) (Ibn Qayyim Al-Jauziyah.
2003).
Jinten hitam (Nigella sativa L.) dapat meningkatkan jumlah, mutu, kualitas dan aktivitas sel yang berfungsi sebagai imun tubuh. Sebagai contoh pada pengujian tiga macam frase jinten hitam (Nigella sativa L.) (ekstrak etanol, polisakarida, dan,volatil oil) terhadap respon antibodi tikus yang telah divaksinasi dengan vaksin Brucella menunjukkan hasil yang signifikan sebagai bahan tambahan vaksin Brucella Melitensis. Dari percobaan tersebut ketiga fraksi memiliki peran yang signifikan meningkakan titer antibodi, meskipun sebagai bahan tambahan dalam vaksin. Hasil dari penelitian tiga frase diperoleh polisakarida sebagai fraksi hasil ekstraksi yang paling paling efektif (Hailat,et al1998).
Penelitian Nabil Hailat pada tahun 1998 menunjukkan bahwa polisakarida jinten hitam (Nigella sativa L.) sebagai adjuvan memiliki kemampuan yang lebih signifikan dibanding ekstrak lain. Sejauh ini
penelitian imunomodulator frase polisakarida tunggal belum pernah dilakukan.
3
UIN Syarif hidayatullah Jakarta
merupakan salah satu turunan sitokin yang berfungsi sebagai mediator inflamasi.
Pada penelitian ini kami akan mencoba mengetahui efektifitas imunomodulator polisakarida hasil ekstraksi jinten hitam (Nigella sativa
L.) terhadap mencit Balb/C melalui penghitungan total leukosit, jumlah limfosit dan monosit serta pengukuran kadar IL-1 .
1.2 PERUMUSAN MASALAH
1. Apakah polisakarida hasil ekstraksi jinten hitam (Nigella sativa L.) mempengaruhi total leukosit, jumlah limfosit, jumlah monosit dan IL-1 ?
2. Dosis polisakarida hasil ekstraksi jinten hitam (Nigella sativa L.) manakah yang akan memberikan efek imunomodulator yang lebih baik?
1.3 TUJUAN PENELITIAN
Tujuan dari penelitian ini adalah :
1. Mengetahui kemampuan polisakarida hasil ekstraksi jinten hitam (Nigella sativaL.) sebagai imunomodulator.
2. Mengetahui dosis polisakarida hasil ekstraksi jinten hitam (Nigella sativaL.) yang memiliki efek imunomodulator terbaik.
1.4 MANFAAT PENELITIAN
Mengetahui gambaran umum tentang manfaat jinten hitam (Nigella sativa
2.1. DESKRIPSI TANAMAN JINTEN HITAM (Nigella sativaL.) 2.1.1. Klasifikasi Tanaman
Berdasarkan ilmu taksonomi, klasifikasi tanaman jinten hitam adalah sebagai berikut (Junaidi,et al2011):
Kingdom : Plantae
Sub Kingdom : Traceabionta
Divisi : Spermatophyta
Kelas : Magnoliopsida dicotyledon
Subkelas : Magnolidae
Ordo : Ranunculales
Famili : Ranunculaceae
Genus :NigellaL.
Spesies :Nigella sativaL.
2.1.2. Nama Daerah
Jinten hitam dikenal dengan banyak nama, beberapa negara mengenalnya dengan sebutanBlack cumminatauBlack caraway seed.Nabi Muhammad SAW menyebutnya dengan sebutan Habbat Al-Baroka,
sedangkan di Rusia dan Rumania dikenal dengan sebutan Charmuska. Di India dan Pakistan jinten hitam dikenal dengan nama Kalonji (Goreja, 2003). Bahasa yang akan digunakan agar tidak membingungkan dalam bahasan ini adalahNigella sativaL.
2.1.3. Ciri-Ciri Tanaman
5
yrytu rt
pembalut bunga kecil. Kelopak bunga 5, bundar telur ujungnya agak melancip sampai agak tumpul pangkal mengecil membentuk sudut yang pendek dan besar. Mahkota bunga pada umumnya berjumlah 8, agak memanjang lebih kecil dari kelopak bunga, berbulu jarang dan pendek; berbibir dua, bibir bagian atas pendek, lanset, ujung memanjang berbentuk benang. Ujung bibir bunga bagian bawah tumpul, benang sari banyak, gundul; kepala sari jorong dan sedikit tajam, berwarna kuning. Buah bulat telur atau agak bulat. Biji hitam, jorong bersudut tiga tak beraturan dan sedikit berbentuk kerucut, panjang 3 mm berkelenjar (Junaidi,et al2011).
Gambar 2. 1 Bentuk batang dan bungaNigella sativaL.
2.1.4. Kandungan Tanaman
Nigella sativa L. mengandung banyak sekali zat-zat aktif
Tabel 2.1 Konstituen UmumNigella sativaL. (Hussein El- taher,et al
2006).
Konstituen % Range (w/w)
Oil 31–35,5
Protein 16 - 19,5
Karbohidrat 33–34
Fibrate 4,5–6,5
Ash 3,7–7
Saponin 0,013
Moisture 5–7
Sedangkan komposisi minyak dari Nigella sativa L. termasuk senyawa volatilnya adalah sebagai berikut :
Tabel 2.2 Konstituen Minyak Nigella sativaL. (Hussein El- taher,et al
2006).
Konstituen % range (w/w)
Linoleic acid 44,7–56
Oleic acid 20,7–24,6
Linolenic acid 0,6–1,8
Arachidic acid 2–3
Palmitoleic acid 3
Eicosadic Acid 2–2,5
Palmitic acid 12–14,3
Stearic acid 2,7–3
Myristic acid 0,16
7
$% &'y(r)*+),(y(tu--( +.( /(rt(
Nigella sativa L. juga dilaporkan mengandung nigellone, Struktur dari konstituen terbesar yang terisolasi seperti yang terlihat pada gambar struktur di bawah ini :
Gambar 2.2 Komponen terbesarNigella sativaL. (Paarrakh M, 2010).
2.1.5 Khasiat dan Kegunaan
Penelitian tentang manfaat Nigella sativaL. telah banyak dilakukan dan banyak juga yang telah dipublikasikan. Dari sekian jurnal yang telah dipublikasikan membuktikan efek positif yang menunjukkan betapa besarnya potensi kegunaan dariNigella sativaL.
Biji dariNigella sativa L. yang telah dibuat bubuk yang diberikan ke beberapa volunter pada dosis 1 g dua kali sehari selama 4 minggu memberikan efek peningkatan rasio dari sel T helper ke sel T supressor hingga 72 % dan meningkatkan fungsi dan jumlah dari Sel T Killer (Hussein El- taher,et al2006).
2.2. EKSTRAK
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
yang tidak dapat larut dengan pelarut cair (Depkes RI, 2010). Senyawa aktif yang terdapat dalam simplisia dapat di golongkan dalam golongan minyak asiri, alkaloid, flavanoid, dan lain-lain.
2.3. METODE EKSTRAKSI
Ekstraksi memiliki banyak metode tergantung pada sifat-sifat ekstrak yang akan diambil.
2.3.1 Ekstraksi Dengan Menggunakan Pelarut 1. Maserasi
Maserasi adalah metode ekstraksi simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhause extraction) yang umumnya dilakukan pada temperatur ruangan. Proses biasanya terdiri dari tahapan pengembangan bahan tahap maserasi antara tahap perkolasi sebenarnya, terus menerus hingga diperoleh ekstrak yang jumlahnya 1-5 kali bahan.
3. Refluks
Refluks adalah ekstraksi dengan pelarut dengan titik didihnya,
selama waktu tertentu dan jumlah pelarut yang terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3 -5 kali sehingga dapat termasuk proses ekstraksi sempurna.
4. Sokhlet
9
UIN Syarif hidayatullah Jakarta
5. Digesti
Digesti adalah maserasi kinetik pada temperatur yang lebih tinggi dari temperatur ruangan yaitu biasanya dilakukan pada temperatur 40– 500C.
6. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur pemanas air (bejana infus tercelup dalam bejana mendidih, temperatur terukur 96-98oC) selama waktu tertentu. Selama waktu tertentu (15-20 menit). 7. Dekok
Dekok adalah infus pada waktu yang lebih lama (> 30 menit) dan temperatur sampai pada titik didih air.
2.3.2 Metode Ekstraksi Lainnya
Beberapa cara ekstraksi dengan menggunakan cara-cara yang telah dibahas di atas, ada juga ekstraksi yang lain sebagai cara penarik zat aktif dari simplisianya, cara-cara yang digunakan diantaranya adalah: destilasi uap, ekstraksi energi listrik, ekstraksi ultrasonik,dan superkritikal karbondioksida.
Destilasi uap adalah ekstraksi senyawa kandungan menguap (minyak asiri) dari bahan (segar atau simplisianya) dengan uap air berdasarkan peristiwa tekanan parsial senyawa kandungan menguap dengan fase uap air
dari ketel secara kontinu sampai sempurna dan diakhiri dengan kondensasi fase uap campuran (senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama kandungan senyawa yang memisah sempurna atau memisah sebagian. Simplisia benar benar tidak larut dalam air namun benar-benar dilalui uap air sehingga senyawa kandungan ikut terdestilasi (Depkes RI, 2000).
2.4 IMUNOMODULATOR
Sistem imun dibagi atas dua jenis, yaitu sistem imun kongenital atau non spesifik dan sistem imun didapat atau adaptif atau spesifik. Mekanisme pertahanan tubuh oleh sistem imun kongenital bersifat spontan, tidak spesifik, dan tidak berubah baik secara kualitas maupun kuantitas bahkan setelah paparan berulang dengan patogen yang sama. Sedangkan sistem imun didapat muncul setelah proses mengenal oleh limfosit (clonal selection), yang tergantung pada paparan terhadap patogen sebelumnya. Adanya sistem imun kongenital memungkinkan respons imun dini untuk melindungi tubuh selama 4-5 hari, yang merupakan waktu yang diperlukan untuk mengaktifkan limfosit (Bratawidjaja, 2002).
Imunomodulator adalah obat yang dapat mengembalikan dan memperbaiki sistem imun yang fungsinya terganggu atau untuk menekan yang fungsinya berlebihan. Obat golongan imunomodulator bekerja menurut 3 cara, yaitu melalui:
• Imunorestorasi
Imunorestorasi adalah suatu cara mengembalikan fungsi sistim
imun yangterganggu dengan memberikan berbagai komponen sistim imun,
seperti : imunoglobulin dalam bentuk immune serum globulin (ISG),
hyperimmune serum globulin(HSG), plasma, transplantasi sumsum tulang, jaringan hati, timus, plasmaferesis, dan leukoferesis (Djajakusumah, 2010). • Imunostimulasi
Imunostimulasi adalah cara memperbaiki fungsi sistim imun dengan menggunakan bahan yang merangsang sistim tersebut. Bahan yang termasuk imunostimulator itu dapat dibagi sebagai berikut :
1. Biologik, seperti hormon timus, limfokin, interferon, antibodi monoklonal, transfer factor/ekstrak leukosit, sel LAK, bahan biologik asal bakteri dan asal jamur.
11
UIN Syarif hidayatullah Jakarta
percobaan klinik antara lain azimekson, siamekson, bestati, tuftsin, maleic anhydride,divynil ether copolymer, dan 6-phenyl-pyrimidinole (Djajakusumah, 2010).
• Imunosupresi
Merupakan suatu tindakan untuk menekan respons imun. Kegunaannyadi klinik terutama pada transplantasi untuk mencegah reaksi penolakan dan pada berbagai penyakit inflamasi yang menimbulkan kerusakan atau gejala sistemik, seperti autoimun atau auto-inflamasi (Bratawidjaja, 2002).
Imunorestorasi dan imunostimulasi disebut imunopotensiasi atauup regulation, sedangkan imunosupresi disebutdown regulation(Bratawidjaja, 2002).
2.5 LEUKOSIT.
Leukosit adalah sel darah yang mengandung inti, disebut juga sel darah putih. Di dalam darah manusia, normal didapati jumlah leukosit rata-rata 5000-9000 sel/mm3 (Efendi,Z 2003). Jika dilihat dalam mikroskop cahaya maka akan terlihat inti dalam sitoplasmanya yang mempunyai bentuk inti bermacam-macam, Ada kalanya tidak mempunyai granula, sitoplasmanya homogen dengan inti bentuk bulat atau bentuk ginjal.
Menurut dr Zurkesti Efendi, leukosit terbagi menjadi 2 jenis yaitu granular (memiliki granula) dan agranular (tidak memiliki granula). Leukosit granular terbagi menjadi 3 macam turunan leukosit (diferensial leukosit) yaitu: neutrofil, basofil dan eusinofil. Sedangkan leukosit agranular Terdapat dua: limfosit sel kecil, sitoplasma sedikit; monosit sel agak besar mengandung sitoplasma lebih banyak.
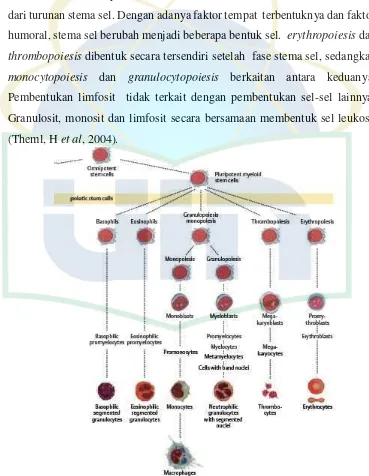
Pada dasarnya seluruh sistem darah dalam tubuh manusia berasal dari turunan stema sel. Dengan adanya faktor tempat terbentuknya dan faktor humoral, stema sel berubah menjadi beberapa bentuk sel. erythropoiesisdan
thrombopoiesisdibentuk secara tersendiri setelah fase stema sel, sedangkan
monocytopoiesis dan granulocytopoiesis berkaitan antara keduanya. Pembentukan limfosit tidak terkait dengan pembentukan sel-sel lainnya. Granulosit, monosit dan limfosit secara bersamaan membentuk sel leukosit (Theml, Het al, 2004).
13
UIN Syarif hidayatullah Jakarta
2.5.1 Limfosit
Limfosit merupakan sel yang sferis, garis tengah 6-8 um, 20-30% leukosit darah. Normal, inti relatif besar, bulat sedikit cekungan pada satu sisi, kromatin inti padat, anak inti baru terlihat dengan elektron mikroskop. Limfosit dalam sirkulasi darah normal dapat berukuran 10-12 um ukuran yang lebih besar disebabkan sitoplasmanya yang lebih banyak (Efendi,Z 2003).
Gambar 2.5 Limfosit (Theml, Het al, 2004)
Leukosit mempunyai peran dalam pertahanan seluler dan humoral organisme terhadap zat-zat asing. Leukosit dapat melakukan gerakan amuboid dan melalui proses diapedisis leukosit dapat meninggalkan kapiler dengan menerobos antara sel-sel endotel dan menembus jaringan penyambung. Jumlah leukosit pada manusia permikroliter adalah 4000-11000, waktu lahir 15000-25000, dan menjelang hari keempat turun sampai 12000. Pada usia 4 tahun jumlah leukosit akan sesuai kadar normal (Efendi,Z 2003).
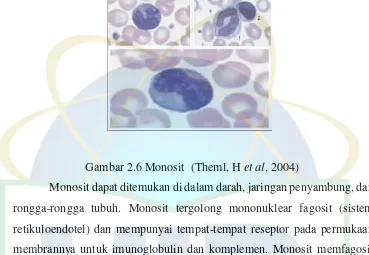
2.5.2 Monosit
sedikit. Juga ribosom, pliribosom sedikit, banyak mitokondria. Aparatus Golgi berkembang dengan baik, ditemukan mikrofilamen dan mikrotubulus pada daerah identasi inti (Efendi,Z 2003).
Gambar 2.6 Monosit (Theml, Het al, 2004)
Monosit dapat ditemukan di dalam darah, jaringan penyambung, dan rongga-rongga tubuh. Monosit tergolong mononuklear fagosit (sistem retikuloendotel) dan mempunyai tempat-tempat reseptor pada permukaan membrannya untuk imunoglobulin dan komplemen. Monosit memfagosit mikroorganisme, sel mati, partikel asing (contohnya debu yang masuk ke dalam paru-paru). Monosit beredar melalui aliran darah, menembus dinding kapiler kemudian masuk ke dalam jaringan penyambung.
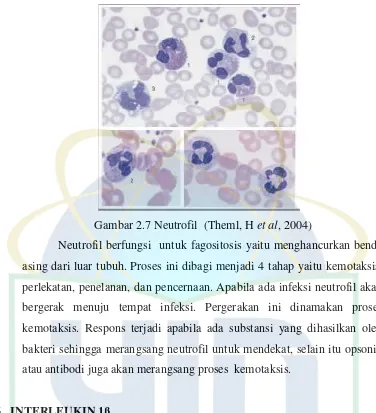
Monosit dalam sistem imun berfungsi sebagai makrophage, yaitu menelan dan menghancurkan sel, mikroorganisme dan benda asing yang bersifat patogen dengan cara menelan dan menghancurkannya. Monosit akan merespon adanya tanda-tanda inflamasi dengan cara bergerak cepat (kira-kira 8-12 jam) ke tempat yang terinfeksi, mengirimkan makrofag untuk merangsang respons imun, dan mengeluarkan substansi yang mempengaruhi terjadinya proses peradangan kronik (Lestari,et al,1993). 2.5.3 Neutrofil
15
UIN Syarif hidayatullah Jakarta
Gambar 2.7 Neutrofil (Theml, Het al, 2004)
Neutrofil berfungsi untuk fagositosis yaitu menghancurkan benda asing dari luar tubuh. Proses ini dibagi menjadi 4 tahap yaitu kemotaksis, perlekatan, penelanan, dan pencernaan. Apabila ada infeksi neutrofil akan bergerak menuju tempat infeksi. Pergerakan ini dinamakan proses kemotaksis. Respons terjadi apabila ada substansi yang dihasilkan oleh bakteri sehingga merangsang neutrofil untuk mendekat, selain itu opsonin atau antibodi juga akan merangsang proses kemotaksis.
2.6 INTERLEUKIN 1β
Interleukin-1 secara umum pada mulanya dikenal sebagai polipeptida yang merupakan derivat dari fagosit mononuklear yang meningkatkan respons dari timosit terhadap aktivator poliklonal khususnya sebagai ko-stimulasi dari aktifasi sel T (Syamhudi, et la 2005). IL-1 diproduksi terutama antara lain oleh : makrofag, sel endotel, limfosit granuler, sel B, fibroblas, sel epitel, astrosit, dan osteoblas. IL-1 juga dapat disintesis oleh hampir semua sel berinti. IL-1 bekerja terutama sebagai mediator pada imunitas non-spesifik bersama interferon dan tumor necrosis factor. IL-1 termasuk dalam golongan Sitokinin.
growth factor, menimbulkan panas, pelepasan ACTH, neutrofil dan respons akut sistemik lainnya, merangsang sintesis limfokin kolagen dan kolagenase, mengaktifkan sel endotel dan makrofag, perantara dalam inflamasi, proses katabolik dan resistensi non spesifik terhadap bakteri.
2.7 ELISA
ELISA (Enzym-Linked Immunosorbent Assay) merupakan metode analisis yang diguanakan untuk menganalisa sitokin dan sejenisnya secara spesifik dan mempunyai sensitifitas yang tinggi. Metode ini pertam kali diterapkan pada tahun 1971 dan semenjak tahun tersebut metode ini banyak digunkan secara luas.
Uji ini menyertakan monoclonal antibody yang digunakan sebagai pelapis microtiter plate. Setelah penambahan sampel, antibodi yang spesifik yang ada di plate akan menangkap protein yang yang sesuai. (misal : sitokin) lalu monoclonal antibody yang digunakan sebagai pendeteksi akan mengikat epitop yang lain pada protein tersebut. Deteksi antibodi diberi label dengan biotin, yang memungkinkan ikatan subsquen enzim streptavidin-terkonjugasi. reagen yang tidak berikatan akan terbuang saat proses “washing”. Setelah
penambahan substrat, reaksi warna yang terbentuk berbanding lurus dengan jumlah protein terikat. Konsentrasi protein dalam sampel ditentukan denagn cara dibandingkan dengan kurva standar konsentrasi protein yang telah dibuat
berdasarkan standar (Sino biological.inc, 2015).
17
UIN Syarif hidayatullah Jakarta
1. DirectELISA
Teknik ELISA ini merupakan teknik ELISA yang paling sederhana. Teknik ini seringkali digunakan untuk mendeteksi dan mengukur konsentrasi antigen pada sampel ELISA direct menggunakan suatu antibodi spesifik (monoklonal) untuk mendetaksi keberadaan antigen yang diinginkan pada sampel yang diuji.
2. IndirectELISA
ELISA indirect menggunakan suatu antigen spesifik (monoklonal) serta antibodi sekunder spesifik tertaut enzim signal untuk mendeteksi keberadaan antibodi yang diinginkan pada sampel yang diuji.
3. CompetitiveELISA
Prinsip dasar dari teknik ini adalah dengan menambahkan suatucompetitor
ke dalam lubang mikrotiter. Teknik ELISA kompetitif ini dapat diaplikasikan untuk mendeteksi keberadaan antigen atau antibodi.
4. Sandwich ELISA
Teknik ELISA yang menggunakan dua antibodi (primer dan sekunder). Pada teknik ELISA ini, antibodi kedua (sekunder) akan dikonjugasikan dengan enzim yang berfungsi sebagai signal.
2.8 HEWAN UJI ( Mencit / Mus Muskulus )
Penggunaan hewan uji dalam penelitian terus digunakan hingga massa
sekarang, penggunaannya bertujuan sebagai model dari subjek yang sebenarnya. Dalam penelitian ini hewan yang akan digunakan sebagai objek percobaan adalah mencit.
Mencit adalah hewan pengerat, yang termasuk golongan mamalia. Hal tersebut akan lebih jelas pada taksonomi mencit berikut :
Kingdom : Animalia
Phylum : Cordata
Sub phylum : Vertebrta
Class : Mamalia
Ordo : Rodentin
Sub ordo : Myomorpha
Family : Muridae
Sub family : Murinae
Genus : Mus
Spesies : Musculus
Morfologi mencit yang kecil memiliki panjang tubuh 75 – 100 milimeter dan luas permukaan tubuh 36 cm2 pada berat badan 20 gram sehingga dalam ruangan yang relatif kecil dapat dipelihara atau digunakan
01
23 456 789 :;9 <767=>??7;@7A78 =7
BAB III
METODOLOGI PENELITIAN
3.1 WAKTU DAN TEMPAT PELAKSANAAN
Penelitian ini dilaksanakan di laboratorium Animal House FKIK UIN Jakarta, laboratoriumBioavaibility & Bioequivalensi (PBB) UIN Jakarta dan laboratorium Drugs Research & Development (PDR) UIN Jakarta pada Bulan Oktober sampai Bulan Desember 2013.
3.2 BAHAN DAN ALAT 3.2.1 Bahan
a. Bahan Uji
Bahan-bahan yang digunakan dalam penelitian ini adalah biji
Nigella sativa L yang diperoleh dari PT. Lantabura Internasional, Depok, berasal dari negara Etiopia.
b. Bahan Kimia
n-heksan, etanol p.a 96 %, eter, larutan NaCl, pewarna giemsa, minyak emersi, metanol, pewarna gentian violet, asam asetat glasial, aquadest, Na-CMC, LPS (lipopolysacharide) dari bakteri E coli (Sigma aldrich).
c. Hewan Uji
Sebanyak 20 Hewan uji yang digunakan dalam penelitian ini adalah
mencit galur balb/c berumur 6–8 minggu dengan berat badan 25–30 gram yang diperoleh dari laboratorium terpadu UGM dan diberikan makan berupa berupa butiran (pelet) dan minumanad libitum.
3.2.2 Alat
Alat yang digunakan adalah perangkat gelas yang biasa digunakan dalam laboratorium, Elysa kit (Foster biological Technology.,LTD), timbangan analitik (wiggen hauser), mikroskop (nikon), kamar hitung (hematocyte) (mariendfeld germany), pipet Micro, timbangan hewan, kandang hewan uji, pipa kapiler (hematokrit), Rotary evaporator (eyela), sentrifugator (ependorf centrifuge5417 R), blender, tabung EDTA, tabung
3.3 PROSEDUR PENELITIAN
3.3.1 Optimasi Ekstraksi PolisakaridaNigella sativaL a. Metode Ekstraksi pertama (Hailat,et al. 1998 ).
Sebanyak 500 mg biji jinten hitam (Nigella sativaL.) yang telah dikeringkan diblender (dihaluskan) kemudian diekstraksi dengan menggunakansodium bicarbonat5% (perbandingan pelarut dan serbuk jinten hitam adalah 3 : 1) pada suhu ruangan selama 24 jam. Larutan hasil ekstraksi 24 jam disaring dan hasil saringanya di endapkan dengan etanol 96 % sebanyak 3 liter (perbandingan larutan dan etanol adalah 1 : 1)
b. Metode Eksraksi kedua (Toneli,et al2008)
Polisakarida diperoleh dengan cara 30 gram serbuk Nigella sativa L. (telah dihilangkan lemaknya dengan n-heksan) dipanaskan dengan 2,1 L aquadest (1 :70) dalamwaterbathsuhu 800C selama 1 jam dan biarkan semalam. Larutan disentrifus pada 5000 rpm selam 20 menit dan disaring. Supernatan ditambahkan etanol 90 % (1 : 1) dan dibiarkan semalam hingga terbentuk endapan. Endapan kemudian diuapkan dengan evaporator.
3.3.2 Preparasi sampel
1. Pembuatan Larutan Na CMC 5 %
Sebanyak 500 mg Na CMC ditimbang dan dilarutkan dengan aquadest hangat. Kemuadian larutan terus diaduk dan ditambahkan aquadest hingga diperoleh volume 100 ml.
2. Penentuan Dosis (Hussein El- taher,et al2006)
Penentuan besar dosis polisakarida Nigella sativa L. Diperoleh dari penelitian terhadap rasio sel limposit T helper. SerbukNigella sativa
UV WXY Z[\ ]^\ _ZY Z` abb Z^c Zd Z[` Z
dosis mencit lalu disesuaikan dengan hasil rendemen polisakarida hasil ekstraksi (Lampiran 10).
3.3.3 Perlakuan Hewan Uji Dan Metode Uji
Sebelum digunakan sebagai hewan percobaan, mencit balb/c diaklimatisasi terlebih dahulu selama 30 hari agar dapat beradaptasi dengan lingkungan laboratorium hewan dan dapat dikontrol kondisi kesehatannya. a. Perlakuan Untuk Uji Total Leukosit, Limfosit, Dan Monosit
Jumlah sampel setiap kelompok berdasarkan Research Guidelines For Evaluation The Safety And Efficiacy Of Herbal Medicines dari WHO tiap kelompok adalah 5 ekor, sehingga mencit balb/c yang digunakan untuk penelitian uji leukosit, limfosit dan monosit adalah 5 ekor perkelompok.
Mencit yang telah diaklimatisasi ditimbang berat badanya dan dicatat untuk ditentukan besar dosis ekstrak yang diberikan. Setelah data berat badan mencit diperoleh, mencit diberi polisakarida hasil ekstraksi
Nigella sativaL berdasarkan kelompok dosis dan berat badannya selama 14 hari percobaan. Setelah itu dilakukan pengambilan darah pada hari 7, ke-14, dan ke-21.
Tabel 3.1. Perlakuan kelompok uji total leukosit, limfosit, dan monosit
No Kelompok Perlakuan
1 Kontrol negatif Hanya diberi Na Cmc
2 Dosis rendah Diberikan oral polisakarida Nigella sativa L dengan dosis 1,25 mg / g BB mencit selama 14 hari. Kemudian diambil darahnya hari ke-7, ke-14, dan ke-21
3 Dosis sedang Diberikan oral polisakarida Nigella sativa L dengan dosis 2,5 mg / g BB mencit selama 14 hari. Kemudian diambil darahnya pada hari ke-7, ke-14, dan ke-21
hari. Kemudian diambil darahnya pada hari ke-7, ke-14, dan ke-21
b. Perlakuan untuk ujiinterlekuin 1β
Untuk uji interlekuin 1β jumlah mencit untuk tiap kelompok jumlah sampel 5. Setelah diaklitimasi selama 1 minggu, mencit diberikan ekstrak polisakarida secara oral selama 5 hari. Pada hari ke-5 mencit disuntik dengan LPS 20 μ g/mencit setelah 2 jam pemberian ekstrak, kemudian 6 jam sesudahnya diambil darahnya untuk diambil plasmanya. Tabung yang digunakan untuk menampung darahnya adalah tabung EDTA. Kemudian ditentukan nilai Il-1β menggunakan ELISA kit.
Tabel 3.2. Perlakuan Kelompok Uji Interlekuin 1β.
No Kelompok Perlakuan
1 Normal Hanya diberi Na Cmc secara oral, pada hari ke-5 diambil darahnya.
2 Kontrol negatif Diberi Na Cmc secara oral disuntikan secara i.p LPS. setelah 6 jam diambil darahnya.
2 Dosis rendah Diberikan oral polisakarida Nigella sativa L dengan dosis 1,25 mg / g BB mencit selama 5 hari. Pa da hari ke-5 disuntikkan i.p LPS lalu setelah 6 jam diambil darahnya.
3 Dosis sedang Diberikan oral polisakarida Nigella sativa L dengan dosis 2,5 mg / g BB mencit selama 5 hari. Pa da hari ke-5 disuntikkan i.p LPS lalu setelah 6 jam diambil darahnya.
v3
wx yz{ |}~ ~ |{ | | | |} |
c. Pengambilan Darah (Permatasari, 2012 )
1. Sebelum pengambilan darah persiapkan terlebih dahulu eter, handscon, kapas dan tisu.
2. Mencit yang akan diambil darahnya dianestesi menggunakan eter. 3. Posisikan mencit dengan nyaman dengan memegang tengkuk dan
kepala agar tidak banyak bergerak, kemudian Mikrohematokrit digoreskan pada medial canthus mata di bawah bola mata ke arah
foramen opticus.
4. Mikrohematokrit diputar sampai melukai plexus, jika diputar 5 kali maka harus dikembalikan 5 kali.
5. Tampung darah yang keluar melalui kapiler di tabung EDTA hingga mencapai 500ul. Setelah mikrohematokrit dilepas mata mencit dilap dengan tisu agar darah yang masih keluar segera berhenti.
3.3.3 Metode Uji
a. Uji Total Leukosit, Persentase Limfosit, dan Presentase Monosit Darah dihisap dengan pipet leukosit sampai pada tanda 0,5 pada pipet dan disusul dengan larutan turk sampai pada tanda 11, kemudian salah satu ujung pipet ditutup dengan menggunakan satu ibu jari dan yang lain dengan telunjuk selama 1- 3 menit, satu sampai dua tetes pertama dibuang kemudian pipet ujung mikro ditempelkan pada salah satu sisi bilik hitung yang telah diberi gelas penutup dan kertas tisu pada sisi lawannya. Darah yang ada pada 4 bilik W (white) diamati di bawah microskop dengan perbesaran 400. Perhitungan terhadap leukosit yang terdapat dalam persegi 1, 2, 3, 4 atau kamar hitung hemacytometer. Jumlah leukosit tersebut dihitung per mm3dengan ketentuan rumus yang telah ditentukan rumus untuk menghitung jumlah leukosit per mm3darah dengan ketentuan :
Luas persegi panjang : 4 mm2 tinggi kamar hitung : 0,1 mm
pengenceran : 20 kali
jumlah leukosit per mm3 adalah
, x 20 x N = 50 N (Suharti,
et al 2010)
Gambar 3.1 Kamar hitung neubauer (Eki putra, 2008)
Untuk uji limfosit dan monosit Sampel darah segar diteteskan pada gelas obyek dan dibuat preparat hapus dengan menggunakan tangan kanan diletakkan gelas obyek lain di depan tetesan darah tersebut dengan sudut 30 - 400 C. Gelas obyek kedua didorong ke depan hingga membentuk hapus tipis. Setelah kering preparat hapus tersebut difiksasi dengan metanol selama 3-5 menit, dibiarkan mengering di udara. Preparat kemudian
diwarnai dengan larutan Giemza dengan pengenceran 1 : 9 selama 30 menit (pH bufer fosfat 6,8 - 7,2). Selanjutnya preparat dicuci dengan aquades dan dibiarkan mengering di atas rak. Setelah kering preparat diperiksa di bawah mikroskop dengan perbesaran 100x dihitung setiap jenis leukosit menggunakanblood counter tabulator. Sel yang dihitung paling sedikit 100 sel dan dilakukan perhitungan jumlah monosit dan limfosit (Suharti, et al
2010).
5
¡¢ £ ¤ ¥¦¦ ¢§ ¨ ¤
b. Uji Kadar Il-1β
Untuk menentukan kadar Interlekuin-1β dalam penelitian ini digunakan ELISA Kit (Mouse IL-1β ELISA Kit, Foster biological Technology.,LTD). Prosedur ELISA pada tahap ini mengikutiProtokol For ELISA Kityang disertakan pada paket ELISA Kit.
3.4 ANALISA DATA
Untuk mengetahui efektivitas imunomodulator polisakaridaNigella sativaL melalui pengukuran jumlahInterleukin 1β, jumlah total leukosit, limfosit, dan monosit mencit balb/c digunakan uji analisa varian (ANOVA) satu arah. Sebelum diuji menggunakan ANOVA data terlebih dahulu diuji tingkat kenormalan homogenitas data dan varian datanya terlebih dahulu. Kemudian dilihat tingkat signifikan datanya menggunakan uji turkey HSD (Pratisto, 2010).
Hipotesis :
Ho : Tidak ada perbedaan yang signifikan antar tiap kelompok Hi : Terdapat perbedaan yang signifikan antar tiap kelompok Kriteria Pengujian :
4.1 HASIL OPTIMASI EKSTRAKSI
BahanNigella sativaL. yang digunakan untuk penelitian ini telah diuji pada penelitian sebelumnya dan telah dideterminasi di Herbarium Bogoriense, pusat penelitian biologi LIPI, Bogor Jawa barat. Hasil determinasi menunjukan bahwa sampel yang digunakan adalah jinten hitam (Nigella sativa L.) famili
Ranunculae(Alawiyah, 2012 ).
Metode ekstraksi pertama dilakukan dengan menggunakan metode penelitian Nabil Hailat tahun 1998. Dari 500 gram Nigella sativa L yang digunakan untuk proses ekstraksi didapat rendemen sebanyak 200 gram polisakarida. Hasil ekstraksi polisakarida hitam pekat dengan bau khasNigella sativaL.
27
UIN Syarif Hidayatullah Jakarta
Gambar 4.2 Hasil uji Barfoed polisakarida hasil ekstraksiNigella sativaL. Warna merah bata terbentuk karena adanya gugus aldehid atau keton (gula pereduksi) bebas dalam molekul karbohidrat. Umumnya yang teridentifikasi dengan uji ini adalah golongan monosakarida dan disakarida.
Selain uji Barfoed dilakukan juga uji Benedict. Uji ini tidak berbeda jauh hasilnya dengan uji barfoed. Hasil uji ini juga menunjukan hasil warna merah bata pada hasil ekstraksi polisakarida yang diperoleh.
Gambar 4.3 Hasil uji Benedict polisakarida hasil ekstraksiNigella sativaL. (terbentuk warna merah bata pada tabung tengah)
sedangkan kadar inulin sebesar : 0,08 % yang diperoleh dengan metode pengukuran dengan alat HPLC.
Metode ekstraksi polisakarida yang kedua menggunakan metode penelitian Toneli pada tahun 2008. Ekstraksi polisakarida Nigella sativa L. dilakukan sebanyak 3 kali (90 gram) ekstraksi, hasil dari ekstraksi sebanyak 14,5 gram polisakarida (rendemen hasil ekstraksi sebesar16,5 %). Polisakarida hasil ekstraksi yang dihasilkan berwarna putih keabu-abuan memiliki bau khasNigella sativaL.
Gambar 4.4 Hasil Ekstraksi PolisakaridaNigella sativaL.
Pengukuran kadar air yang diperoleh dari hasil percobaan ini adalah 18,12 %. Pengujian kadar air dilakukan untuk menetapkan residu air setelah proses pengentalan atau pengeringan. Kadar air merupakan standar acuan sebagai indikasi mutu ekstrak. Hasil ekstraksi polisakaridaNigella sativaL ini merupakan ekstrak kental sesuai dengan kriteria dari VOIG yaitu 5–30 %.
Kadar abu polisakarida yang diperoleh dari hasil ekstraksi ini adalah sebesar 6,8 %. Kadar abu dilakukan bertujuan untuk memberi gambaran
kandungan mineral internal dan eksternal yang berasal dari Kadar abu yang diperoleh dari proses awal sampai akhir terbentuknya ekstrak. Pada proses ini ekstrak dipanaskan pada suhu senyawa organik terdekstruksi hingga tersisa
29
UIN Syarif Hidayatullah Jakarta
Dari hasil uji analisa di laboratorium PT. Saraswanti Indo Genetech bogor diperoleh hasil kadar karbohidrat dari metode ekstraksi kedua ini adalah sebesar 3,98 %, sedangkan inulin sebesar 3,19 %. Hasil ini lebih besar dibandingkan dengan metode ekstraksi pertama, sehingga dalam penelitian ini metode yang kedua digunakan sebagai metode baku yang dipakai untuk ekstraksi polisakarida karena diduga inulin merupakan zat aktif yang berkhasiat sebagai imunomodulator.
4.2 TOTAL LEUKOSIT
Setelah dilakukan penelitian selama 21 hari maka diperoleh data sebagai berikut:
Tabel 4.1 Hasil perhitungan total leukosit
Setelah dilakukan penghitungan, jumlah total leukosit berkisar antara 3,8 + 0,4 hingga 8,6 + 3,0 x 103 per mm3. Jumlah terkecil terlihat pada kelompok kontrol pada hari ke-7, sedangkan nilai tertinggi terlihat pada kelompok dosis tinggi hari ke-21. Peningkatan tersebut sesuai dengan
peningkatan dosis yang diberikan dan lamanya pemberian ekstrak. Berdasarkan penelitian Arrington tahun 1972, kisaran normal jumlah total
leukosit pada mencit Balb/C adalah 4–12 x 103per mm3.
Hasil penghitungan jumlah total leukosit hari ke-7 dianalisa dengan menggunakan program SPSS 16. Hasil uji homogenitas data menunjukkan bahwa homogenitas data hari ke-7 memenuhi syarat untuk dilakukan uji ANOVA (p>0,05). Hasil uji ANOVA menunjukkan bahwa terdapat perbedaan yang bermakna antara kelompok kontrol dengan kelompok uji p=0,000 (p<0,05). Kemudian uji dilanjutkan dengan Uji Turkey HSD. Hasil uji ini
Dosis Rata-rata jumlah total leukosit (x 10
3per mm3) Hari ke-7 Hari ke-14 Hari ke-21
Kontrol 3,8 + 0,4 4,1 + 1,3 4,1 + 0,6
Dosis rendah 5,4 + 0,6 6,2 + 0,7 6,7 + 2,6
Dosis sedang 5,7 + 1,5 6,9 + 1,2 6,9 + 4,4
menunjukkan bahwa terdapat perbedaan yang bermakna antara kelompok kontrol dengan dosis rendah (p=0,049), kelompok kontrol dengan dosis sedang (p=0,016), dan kelompok kontrol dengan kelompok dosis tinggi (p=0,000).
Gambar 4.5 Grafik peningkatan total leukosit hari ke-7
Jumlah total leukosit pada hari ke-14 pemberian polisakarida hasil ekstraksi Nigella sativa L. pada dosis rendah, dosis sedang, dan dosis tinggi yang dibandingkan dengan kelompok kontrol berada dalam kisaran jumlah normal total leukosit. Kenaikan jumlah total leukosit sejalan dengan peningkatan dosis polisakarida hasil ekstraksiNigella sativaL. yang diberikan ke mencit. Pada kelompok dosis tinggi menghasilkan jumlah total leukosit tertinggi dibanding kelompok dosis lainya.
Hasil uji homogenitas data untuk analisa hari ke-14 menunjukkan nilai probabilitas lebih besar dari 0,05 (p=0,602). Hasil ini menunjukkan bahwa semua kelompok uji memiliki varian yang sama sehingga memenuhi syarat untuk uji ANOVA. Hasil uji ANOVA menunjukkan nilai probabilitasnya lebih kecil dari 0,05 (p=0,000). Hasil uji ini menunjukkan bahwa terdapat perbedaan yang bermakna antara kontrol dengan kelompok uji. Kemudian untuk mengetahui tingkat kemaknaan antar kelompok dilakukan uji turkey HSD. Hasil uji ini menunjukkan terdapat perbedaan yang bermakna antar kelompok
3830
31
UIN Syarif Hidayatullah Jakarta
kontrol dengan dosis rendah (p=0,015), kelompok kontrol dengan dosis sedang (p=0,001), dan kelompok kontrol dengan dosis tinggi (p=0,000).
Gambar 4.6 Grafik peningkatan total leukosit hari ke-14
Pemberian ekstrak diberikan selama 14 hari, setelah itu pemberian ekstrak dihentikan. Namun pengambilan darah dilakukan hingga hari ke 21. Jumlah total leukosit pada hari ke 21 memiliki kisaran yang masih normal. Jika diperhatikan jumlah total leukosit meningkat berdasarkan besar dosis dan lama hari pemberian. Kelompok dosis tinggi memiliki jumlah total leukosit paling tinggi dibanding kelompok lainya.
Hasil uji total leukosit hari ke-21 dianalisa menggunakan uji homogenitas data. Hasil uji menunjukkan nilai homogenitas hari ke-21 memiliki nilai lebih kecil dari 0,05 (p=0,022). Nilai probabilitas uji homogenitas data hari ke-21 tidak memenuhi syarat untuk uji ANOVA. Uji analisa dilakukan dengan metode kruskal wallis agar diketahui kemaknaan nilai total leukosit kontrol dengan dosis uji. Hasil Uji Kruskal Wallis menunjukkan nilai dibawah 0,05 (p=0,037). Hasil uji ini menunjukkan bahwa pemberian kelompok dosis pada hari ke-21 memiliki efek yang bermakna terhadap kelompok kontrol mencit Balb/C.
4120
Gambar 4.7 Grafik peningkatan total leukosit hari ke-21
Perbandingan rata-rata kelompok total leukosit pada hari 7 hari ke-14 dan hari ke-21 yang di analisa dengan uji ANOVA memiliki nilai bermakna tiap minggunya (p=0,001). Setelah dilakukan analisa tingkat kemaknaan rata-rata antar kelompok menggunakan turkey HSD diketahui bahwa terdapat perbedaan yang bermakna antara kelompok kontrol dengan dosis rendah (p=0,025), kelompok dosis rendah dengan kelompok dosis tinggi (p=0,045), dan kelompok kontrol dengan dosis tinggi (p=0,001).
Dari pemaparan data diatas menunjukkan bahwa pemberian polisakarida hasil ekstraksi Nigella sativa L pada mencit Balb/C mampu meningkatkan jumlah total leukosit, dan semakin tinggi dosis pemberian ekstrak jumlah total leukosit semakin meningkat. Peningkatan jumlah sel ini tidak melebihi rentang jumlah sel leukosit normal untuk mencit Balb/C. Leukosit merupakan mekanisme pertahanan imun non spesifik tubuh. Umumnya sel ini berperan dalam mempertahankan tubuh dari penyusupan benda asing (Sadikin, 2002). Jumlah total leukosit yang berada pada batas tertinggi normal menunjukkan sistem imun memproduksi jumlah total leukosit yang cukup dalam sirkulasi darah untuk melawan infeksi. Peningkatan jumlah
total leukosit menunjukkan kemampuan sistem imun untuk melawan infeksi atau benda asing (Viera, 2011 ).
4170
perbandingan perlakuan kelompok dosis
33
UIN Syarif Hidayatullah Jakarta
4.3 JUMLAH LIMFOSIT
Setelah penghitungan total leukosit penelitian dilanjutkan dengan menghitung kembali jumlah limfosit. Dari pengamatan didapatkan hasil dalam bentuk persentase lalu dikalikan dengan jumlah total leukosit. Sehingga didapatkan data jumlah limfosit dalam bentuk rata-rata perkelompok sebagai berikut:
Tabel 4.2 Rata-rata Jumlah Limfosit.
Hasil uji menunjukkan bahwa nilai limfosit mencit Balb/C pada tabel diatas berada pada kisaran normal jumlah limfosit pada mencit Balb/C. yaitu 3.300 - 14.250 per mm3(research animal resources university of minnesota).
Jumlah limfosit hari ke-7 dianalisa menggunakan SPSS 16. Analisa dimulai dengan uji homogenitas. Uji ini untuk mengetahui uji yang sesuai dipakai untuk melihat kemaknaan antara kontrol dengan kelompok pemberian dosis.
Hasil uji homogenitas data hari ke-7 menunjukkan nilai probabilitasnya lebih besar dari 0,05 (p=0,449). Hal ini menunjukkan dari setiap kelompok uji memiliki varian yang sama, sehingga bisa dilakukan uji ANOVA. Hasil uji ANOVA menunjukkan bahwa nilai probabilitas data yang
diperoleh lebih kecil dari 0,05 (p=0,000). Hal ini menunjukkan bahwa terdapat perbedaan yang bermakna antara kelompok uji dengan kelompok kontrol. Kemudian untuk mengetahui kemaknaaan antar kelompok masing masing hasil penelitian dianalisa menggunakan uji Turkey HSD. Hasil uji ini menunjukkan bahwa terdapat perbedaan yang bermakna antara kelompok kontrol dengan kelompok dosis renda (p=0,043), kontrol dengan dosis sedang (p=0,039), dan kontrol dengan dosis tinggi (p=0,000).
Dosis
Rata-rata jumlah total limfosit (x 103per mm3)
Hari ke-7 Hari ke-14 Hari ke-21
Kontrol 3,4 + 0,5 3,8 + 0,5 4,4 + 0,6
Dosis rendah 4,8 + 0,7 5,5 + 1,4 6,6 + 0,8
Dosis sedang 4,8 + 1,2 5,5 + 1,08 6,8 + 2,5
Gambar 4.8 Grafik peningkatan jumlah hari ke-7
Pada uji homogenitas data hari ke-14 diperolah nilai probabilitas data sebesar 0,935, sehingga bisa dilakukan Uji ANOVA. Setelah dilakukan uji ANOVA didapatkan hasil nilai probabilitas datanya lebih kecil dari 0,05 (p=0,003). Hasil ini menunujukan bahwa terdapat perbedaan yang bermakna antara kelompok kontrol dengan kelompok dosis. Kemudian uji dilanjutkan dengan uji Turkey HSD untuk mengetahui tingkat kemaknaan antar kelompoknya. Hasil analisis Turkey HSD yang diperoleh menunjukkan bahwa kelompok kontrol berbeda secara bermakna dengan kelompok dosis tinggi (p=0,001).
Gambar 4.9 Grafik peningkatan jumlah limfosit hari ke-14
3416,4
perbandingan antar kelompok dosis limfosit
kontrol dosis rendah dosis sedang dosis tinggi
3807
perbandingan antar kelompok dosis limfosit
35
UIN Syarif Hidayatullah Jakarta
Hasil uji homogenitas data hari ke-21 menunjukkan bahwa nilai homogenitas datanya dibawah 0,05 (p=0,039), hal ini menunjukkan bahwa hasil pengamatan hari ke-21 tidak dapat diuji menggunakan Uji ANOVA, alternatif uji yang digunakan untuk mengetahui kemaknaan suatu analis setelah Uji ANOVA adalah uji Krusskal Wallis. Hasil uji kruskal wallis menunjukkan bahwa nilai probabilitasnya lebih besar dari 0,05 (p=0,063). Data hasil uji ANOVA dan Kruskal Wallis tidak menunjukkan hasil yang signifikan untuk pengamatan hari ke-21, namun jika diamati hasil grafiknya hasil uji hari ke-21 memiliki grafik yang meningkat.
Gambar 4.10 Grafik peningkatan jumlah limfosit hari ke-21
Perbandingan rata-rata peningkatan limfosit tiap kelompok hari
ke-7, hari ke-14 dan hari ke-21 diuji menggunakan ANOVA menunujukan hasil yang signifikan (p=0,011). Dari beberapa dosis yang diberikan ke mencit Balb/C, dosis tinggi (5mg/g BB mencit) memberikan efek yang paling signifikan (p=0,007). Peningkatan efek imunostimulan tersebut berbanding lurus dengan besar dosis yang diberikan.
Limfosit adalah sel yang menghasilkan antibodi terhadap berbagai benda atau senyawa asing (Sadikin, 2002). Sel-sel limfosit ini mempunyai peran yang sangat penting dalam mekanisme pertahanan atau imunitas spesifik.
4119,96
perbandingan antar kelompok dosis limfosit
Sel limfosit tubuh terdiri dari tiga macam sel yaitu: natural killer cell, limfosit T, dan limfosit B (lichman, et al. 2007). Sel-sel ini dihasilkan di sumsum tulang, namun tempat pematangan selnya berbeda. Limfosit T dimatangakan di timus setelah keluar dari sumsum tulang. Sel ini akan bekerja secara selular dan akan menyerang antigen yang ada di sel. Berdasarkan fungsinya limfosit T dibedakan menjadi 3 macam : sel Thelper,sel Tkiller, dansupresorsel T. Sel B yang dimatangkan di susmsum tulang mempunyai fungsi imunitas secara humoral. Sel ini menghasilkan antibodi serta dapat menyimpan memori untuk mengenali antigen yang pernah masuk dalam tubuh. Sedangkan sel natural killermemiliki sifat yang tidak spesifik, sel ini kan mendestruksi sel sel yang terinfeksi.
Pada penelitian ini polisakarida hasil ekstraksi Nigella sativa L. dapat meningkatkan jumlah dari sel limfosit secara signifikan. Dari pemaparan sebelumnya peningkatan sel limfosit terlihat mulai dari pengamatan hari ke-7. Hal ini menunjukan bahwa polisakarida hasil ekstraksiNigella sativaL. sangat efektif dalam peningkatan imun spesifik. Pada pengamatan hari ke-14 jumlah limfosit terus meningkat berbanding lurus dengan jumlah dosis yang diberikan. Sedangakan pada hari ke-21 jumlah limfosit terus meningkat namun secara statistik nlainya tidak bermakna. Hal ini disebabkan karena jumlah limfosit pada beberapa individu mencit mulai mencapai jumlah maksimal nilai normal limfosit, sedangkan limfosit memiliki rentang umur yang panjang yaitu
37
UIN Syarif Hidayatullah Jakarta
4.4 JUMLAH MONOSIT
Penghitungan jumlah monosit yang dilakukan dengan metode yang sama pada penghitungan limfosit didapatkan hasil sebagai berikut:
Tabel 4.3 Rata-rata Jumlah Monosit.
Hasil perhitungan jumlah monosit dari pengamatan hari 7, hari ke-14, dan hari ke-21 menunjukkan bahwa Jumlah monosit terkecil terlihat pada kelompok dosis tinggi hari ke-21, sedangkan nilai tertinggi terlihat pada kelompok dosis tinggi hari ke-14. Rata-rata jumlah monosit mencit normal berada pada kisaran antara 0,060 – 0,600 x103 per mm3 (Research animal resources, University Of Minnesota). Untuk mengetahui pengaruh aktifitas polisakarida hasil ekstraksi Nigella sativaL. terhadap jumlah monosit mencit Balb/C maka dilakukan analisa uji statistik. Uji ini diawali dengan uji homogenitas data kemudian jika memenuhi syarat dilakukan uji ANOVA, dan jika nilai homogenitas data tidak memenuhi syarat uji ANOVA, maka dilakukan uji kruskal wallis (Sopiyudin, 2001).
Hasil uji honogenitas data hari ke-7 menunjukkan nilai probabilitas uji homogenitas data hasil pengamatan lebih besar dari 0,05 (p=0,166), nilai ini memenuhi untuk uji ANOVA. Hasil uji ANOVA menunjukkan nilai probabilitasnya lebih besar dari 0,05 (p=380). Karena nilai probabilitas data lebih besar dai 0,05 uji dilanjutkan ke uji non parametrik kruskal wallis. Hasil
uji kruskal wallis menunjukkan nilai probabilitasnya lebih besar dari 0,05 (p=0,555). Hal ini menunjukkan tingkat dosis hari ke-7 tidak mempengaruhi jumlah monosit.
Dosis
Rata-rata jumlah jumlah monosit (x 103per mm3)
Hari ke-7 Hari ke-14 Hari ke-21
Kontrol 0,25 + 0,08 0,26 + 0,23 0,05 + 0,08
Dosis rendah 0,51 + 0,28 0,50 + 0,283 0,053 + 0,156
Dosis sedang 0,45 + 0,27 0,52 + 1,174 0,055 + 0,08
Gambar 4.11 Grafik peningkatan jumlah monosit hari ke-7
Uji homogenitas data hari ke-14 menunjukkan nilai probabilitas datanya lebih besar dari 0,05 (p=0,075). Kemudian dilanjutkan uji ANOVA. Hasil uji ANOVA menunjukkan nilai probabilitas datanya lebih besar dari 0,05 (p=0368). Karena nilai uji anova tidak memenuhi syarat, maka uji dilanjutakn ke uji non parametrikKruskal wallis. Hasil uji kruskal wallis menunjukkan nilai probabilitas datanya lebih besar dari 0,05 (p=0,128). Hasil uji ini menunjukkan bahwa Variasi dosis yang diberikan ke mencit Balb/C tidak mempengaruhi kadar jumlah monosit.
Gambar 4.12 Grafik peningkatan jumlah monosit hari ke-14
252,78
perbandingan antar kelompok dosis monosit
kontrol dosis rendah dosis sedang dosis tinggi
263,68
perbandingan antar kelompok dosis monosit
39
UIN Syarif Hidayatullah Jakarta
Uji homogenitas data hari ke-21 menunjukkan bahwa nilai probabilitas datanya lebih besar dari 0,243. Hasil uji ini memenuhi syarat uji ANOVA. Hasil uji ANOVA menunjukkan nilai probabilitas datanya lebih besar dari 0,05 (p=0,910). Karena hasil uji ANOVA nilai probabilitasnya terlalu besar, maka uji dilanjutkan ke uji non parametrik kruskal wallis. Hasil uji kruskall wallis menunjukkan nilai probabilitasnya lebih besar dari 0,05 (p=0,128). Hai ini menunjukan bahwa pengujian polisakarida hasil ekstraksi
Nigella sativa L. pada hari ke-21 tidak memiliki pengaruh yang signifikan terhadap jumlah monosit mencit Balb/C.
Gambar 4.13 Grafik Peningkatan Monosit hari ke-21
Monosit berfungsi sebagai fagosistik mononuklear. Sel ini dimatangkan di sum-sum tulang selama 1 sampai 3 hari, kemudian bersirkulasi di darah sangat singkat (kurang lebih 1,5 hari) dan akhirnya berpindah ke jaringan untuk mengambil peranya sebagai makrofag (Nicholis, et al 1971). Sel makrofag memiliki peran melakukan fagositosis dan menghancurkan partikel asing dan jaringan mati serta mengolah bahan asing tersebut untuk dapat merangsang sistem tanggap kebal di tubuh sehingga terbentuk komplek antigen antibodi (Eki Putra, 2008). Hal inilah yang diindikasikan mengapa jumlah leukosit pada hari ke-21 mengalami penurunan. Sel-sel monosit yang
ada di darah telah berpindah ke jaringan karena siklus hidup monosit memang sangat pendek ada di darah. Selain itu, lamanya penelitian (selama 21 hari)
50,04 53,56
perbandingan antar kelompok dosis monosit
memicu mencit menjadi lemah sehingga mempercepat proses perpindahan monosit ke jaringan.
4.5 KADAR INTERLEUKIN 1β
AnalisaInterlekuin 1 βtidak dilakukan pengulangan seperti pada uji total leukosit. Pengujian hanya dilakukan pada hari ke 5 saja.
Tabel 4.4 Rata-rata Jumlah Nilai Il-1β
Hasil uji ELISA menunjukan bahwa polisakarida hasil ekstraksiNigella sativa L. terlihat meningkatkan kadar interleukin 1β dalam darah mencit.
Peningkatan ini berbanding lurus dengan bertambah besarnya dosis yang diberikan. Kelompok kontrol negatif yang telah diinduksi dengan LPS menunjukan peningkatan jumlah interleukin-1β sebesar 71,3 % (27,2 ρg/ml) dari jumlah total interleukin kelompok kontrol (7,8 ρg/ml). Peningkatan ini
karena pemberian lipopolisakarida dari dinding sel yang memicu terjadinya inflamasi dalam tubuh mencit. Pada reaksi inflamasi dalam sistem imun terjadi pelepasan sitokin pro inflamasi (TNF dan IL 1). Pelepasan sel-sel ini dalam tubuh dimaksudkan untuk memacu vasodilatasi, melonggarkan hubungn sel-sel endotel, meningkatkan adhesi neutrofil dan migrasi sel-sel-sel-sel ke jaringan
sekitar untuk memakan mikroba (bratawijaya, 2010). Meskipun perkembangan respon inflamasi efektif berperan penting pada pertahanan tubuh namun respon tersebut menimbulkan kerusakan. Alergi, penyakit auto imun, infeksi mikroba, transplantasi dan luka bakar dapat mengawali respon inflamasi kronis (Bratawijaya, 2010). Dalam penelitian ini diharapkan pemberian ekstrak
Dosis Rata-rata jumlah total Interleukin 1β
(ρg/ml)
Normal 7,8 (+ 0,0)
Kontrol negatif 27,2 ( + 25,9)
Dosis rendah 33,8 ( + 22,0)
Dosis sedang 158,4 ( + 136,2)
41
UIN Syarif Hidayatullah Jakarta
polisakarida hasil ekstraksi Nigella sativa L. diharapkan dapat menekan produksi interleukin 1 β pada mencit balb/c yang telah diinduksi dengan LPS.
Pada pemberian polisakarida hasil ekstraksiNigella sativaL. kelompok dosis rendah menunjukkan bahwa ekstrak ini tidak dapat menurunkan jumlah kadar interleukin-1β. Hasil pengamatan pada dosis rendah ini justru menunjukan hasil sebaliknya. Hasil pengamatan menunjukan peningkatan kadar sebesar 33,8(ρg/ml). Peningkatankadar interleukin-1βjuga terjadi pada kelompok dosis sedang dan pada dosis tinggi sebesar 158,4(ρg/ml)dan 262,5 (ρg/ml).
Gambar 4.14Grafik hasil uji interleukin 1β.
Jika dianalisa berdasarkan hasil uji statistika, nilai homogenitas data uji kadar interleukin 1β memiliki nilai lebih kecil dari alfa (p=0,000). Hal ini
mengindikasikan bahwa data tidak dapat dilakukan uji ANOVA. Uji statistik untuk data yang homogenitasnya tidak normal adalah menggunakan krusial Wallis. Namun setelah dilakukan uji statistik krusial-Wallis nilai probabilitasnya lebih besar dari alfa (P=0,319), sehingga dapat diambil kesimpulan bahwa polisakarida hasil ekstraksiNigella sativaL. tidak memiliki pengaruh yang bermakna terhadapjumlah kadar interleukin 1β.
7,8
5.1 KESIMPULAN
1. polisakarida hasil ekstraksiNigella sativaL. dosis 1,25 mg/BB mencit, 2,5 mg /BB mencit dan 5 mg /BB mencit mampu mempengaruhi jumlah total leukosit dan jumlah limfosit dan tidak mempengaruhi jumlah monosit.
2. Dosis polisakarida hasil ekstraksiNigella sativa L. yang memiliki efek imunomodulator paling baik adalah dosis tinggi (5 mg/BB mencit). 3. Pada uji interleukin 1β belum bisa disimpulkan datanya, karena
berdasarkan analisa statistika datanya tidak sigifikan.
5.2 SARAN