commit to user
i
EFEKTIVITAS PEMBELAJARAN KIMIA MENGGUNAKAN METODE GI YANG DILENGKAPI DENGAN PENERAPAN
MEDIA VBL PADA MATERI POKOK KESETIMBANGAN KIMIA
DI SMAN 1 CEPER TAHUN AJARAN
2009/2010
Disusun Oleh: DESY DWI ARTANTI
K3305027
SKRIPSI
Ditulis dan Diajukan Sebagai Syarat Untuk Mendapatkan Gelar Sarjana Program Pendidikan Kimia Jurusan P.MIPA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS SEBELAS MARET
commit to user
ii
PERSETUJUAN
Telah disetujui untuk dipertahankan di hadapan Tim Penguji Skripsi
Program Studi Kimia Fakultas Keguruan dan Ilmu Pendidikan Universitas
Sebelas Maret Surakarta
Persetujuan Pembimbing
Pembimbing I Pembimbing II
commit to user
iii
PENGESAHAN
Telah disetujui dan disahkan untuk memenuhi syarat mendapat gelar
Sarjana Pendidikan Program Studi Kimia Jurusan P.MIPA Fakultas Keguruan dan
Ilmu Pendidikan Universitas Sebelas Maret Surakarta.
Pada Hari :………..
Tanggal :………..
Ketua : Dra. Bakti Mulyani, M.Si ………..
Sekretaris : Drs. Haryono, M.Pd ………
Anggota I : Drs. J. S. Sukardjo, M.Si ………..
Anggota II : Dr.rer.nat. Sri Mulyani, M.Si ………...
Disahkan Oleh:
Fakultas Keguruan dan Ilmu Pendidikan
Universitas Sebelas Maret
Dekan
Prof. Dr. H. M. Furqon Hidayatullah, M.Pd
commit to user
iv
ABSTRAK
Desy Dwi Artanti. EFEKTIVITAS PEMBELAJARAN KIMIA
MENGGUNAKAN METODE GI YANG DILENGKAPI DENGAN PENERAPAN MEDIA VBL PADA MATERI POKOK KESETIMBANGAN KIMIA DI SMAN 1 CEPER TAHUN AJARAN
2009/2010. Skipsi. Surakarta: Fakultas Keguruan dan Ilmu Pendidikan
Universitas Sebelas Maret Surakarta. Juli 2010
Penelitian ini bertujuan untuk mengetahui :“Efektivitas penggunaan Metode pembelajaran GI yang dimodifikasi dengan penerapan media VBL dalam pembelajaran Kimia pada pokok bahasan Kesetimbangan Kimia”
Penelitian ini menggunakan metode eksperimental dengan rancangan Randomized Control Group Pretest-Postest Design. Populasi dalam penelitian ini adalah siswa kelas XI IPA SMA N 1 Ceper tahun pelajaran 2009/2010. Sampel terdiri dari dua kelas. Kelas XI IPA 1 sebagai kelas eksperimen dan XI IPA 2 sebagai kelas kontrol yang dipilih secara random sampling. Kelas eksperimen menggunakan metode GI yang dimodifikasi dengan penerapan media VBL. Data utama dalam penelitian ini berupa prestasi belajar siswa yang diperoleh melalui tes dalam bentuk objektif untuk aspek kognitif dan metode angket untuk aspek afektif. Analisis data dilakukan dengan uji t-pihak kanan dengan uji persyaratan analisisnya yaitu uji normalitas dengan uji Liliefors dan uji homogenitas dengan uji Bartlet
Berdasarkan hasil penelitian dapat disimpulkan bahwa: penerapan metode pembelajaran GI yang dimodifikasi dengan penerapan media VBL dalam pembelajaran Kimia pada pokok bahasan Kesetimbangan Kimia efektif untuk meningkatkan prestasi belajar siswa baik dari aspek kognitif maupun afektif siswa kelas XI SMAN 1 Ceper, hal ini dapat dilihat dari harga thitung yang diperoleh,
untuk prestasi belajar kognitif thitung = 2,083 > ttabel = 1,66, sedangkan prestasi
belajar afektif thitung = 1,878 > ttabel = 1,66, masing-masing pada taraf signifikansi
commit to user
v
ABSTRACT
Desy Dwi Artanti. THE EFFECTIVENESS OF TEACHING CHEMISTRY USING THE MODIFIED GI METHOD BY THE APPLICATION OF VBL MEDIA ON MAIN SUBJECT OF THE EQUILIBRIUM CHEMISTRY IN
SMAN 1 CEPER. Minithesis. Surakarta: Theacher Training and Education
Faculty of Sebelas Maret University. July 2010.
The aim of this research is to know the effectiveness of teaching chemistry using GI method learning modified by the application of VBL media on main subject of the equilibrium chemistry.
The research is experimental method using Randomized Control Group Pretest-Postest Design. The population of this research was first semester of the XI IPA class SMAN 1 Ceper in academic year 2009/2010. The samples consist of two class, the XI IPA 1 class is as experimental class and the XI IPA 2 is as control class, that were decided by a random sampling. Experiment class were thought by GI method learning modified by the application of VBL media. The data were collected using multiple choice test to measure variable of achievement learning and questionnaires to measure affective aspect. The data were then analysed using t-test (right-tailed test).
The result of this research showed that: the GI method learning modified by the application of VBL media on main subject of the equilibrium chemistry is more effective than conventional method. It could be showed from the value obtained, for the ability cognitive the t-ob = 2,083 > ttable = 1,66, while the ability
of affective t-ob = 1,878 > ttable = 1,66, with difference of the experimental class
commit to user
vi
MOTTO
• Maka Nikmat Tuhan kamu yang manakah yang kamu dustakan? (Ar-Rahman: 13)
• Ketahuilah bahwa bersabar atas apa yang tidak kamu sukai itu mengandung kebaikan yang banyak, dan sesungguhnya kemenangan ada
bersama kesabaran, kelapangan ada bersama kesusahan, dan bersama
kesulitan ada kemudahan (HR. Ahmad & At- Tirmidzi)
• Orang yang hidupnya untuk dirinya sendiri maka dia akan hidup kerdil dan mati sebagai orang yang kerdil, orang yang hidup untuk umat maka
dia akan hidup besar dan namanya tidak akan pernah mati (Sayyid
Quthub)
commit to user
vii
PERSEMBAHAN
• Bapak dan Ibu yang sudah sangat luar biasa memberikan segalanya,
• Mas Eko, Mb Yulis dan Adik Puput yang selalu menjadi motivasi ku,
• Keluarga Besar di Sukoharjo yang telah memberi tempat berteduh selama ini,
• Teman-teman lingkaran kecil yang selalu memberikan energi tersendiri, The Ligh Team (Nanda, Apri, Dewi, Rina, Endah, Wiji, Tri, Andi, Panji) yang telah memberi ukhuwah yang begitu indah, Laskar BIAS FKIP yang telah berjuang bersama-sama, Keluarga besar HMP Kimia Kovalen periode 2007, Terima kasih buat semuanya,
• Semua teman-teman Kimia khususnya 2005 yang telah membersamai dari awal,
commit to user
viii
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan kenikmatan
yang sangat luar biasa, sehingga penulis dapat menyelesaikan karya Skipsi ini,
guna memenuhi persyaratan mendapatkan gelar Sarjana Pendidikan, Program
Kimia Jurusan P.MIPA FKIP UNS. Sholawat dan salam semoga tercurah kepada
Rasulullah SAW.
Penulis menyadari bahwa dalam penelitian dan penyusunan makalah ini
banyak mendapat bimbingan dan bantuan dari berbagai pihak. Oleh karena itu
dengan segala kerendahan hati, perkenankan penulis mengucapkan terima kasih
kepada:
1. Bpk. Prof. Dr. H. M. Furqon Hidayatullah, M. Pd, selaku Dekan Fakultas
Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret, yang telah
memberikan izin penyusunan skripsi,
2. Ibu Dra. Hj. Kus Sri Martini, M.Si, selaku Ketua Jurusan P.MIPA FKIP
UNS, yang telah menyetujui atas permohonan penulisan skripsi,
3. Ibu Dra. Hj. Tri Redjeki, M.S, selaku Ketua Program Studi Kimia P.MIPA
FKIP UNS, yang telah memberikan pengarahan dan izin penulisan skripsi
ini,
4. Bpk. Drs. J.S. Sukardjo, M.Si , selaku pembimbing I yang telah
memberikan bimbingan dan pengarahan selama penelitian hingga
diselesaikan skipsi ini,
5. Ibu Dr.rer.nat.Sri Mulyani, M.Si, Selaku pembimbing II sekaligus
Pembimbing Akademik yang telah banyak memberikan masukan terhadap
skripsi ini,
6. Bpk Drs. Haryono, M.Pd Selaku penguji skripsi yang telah memberi
commit to user
ix
7. Bpk Drs. Sri Harjana, M.M, Kepala Sekolah SMA N I Ceper, yang telah
memberikan izin untuk mengadakan penelitian,
8. Ibu Happy dan Bpk. Sinder, selaku guru Kimia SMA N I Ceper , yang
telah memberikan pengarahan dan bimbingan selama penulis melakukan
penelitian,
9. Siswa-siswa kelas XI IPA 1 dan XI IPA 2 SMA N I Ceper, terimakasih
atas bantuan dan kerjasamanya,
10.Semua pihak yang telah membantu hingga terselesaikannya skripsi ini.
Penulis menyadari bahwa karya ini masih banyak kekurangan. Oleh
karena itu penulis sangat mengharapkan saran dan kritik dari pembaca. Semoga
karya ini dapat memberikan manfaat.
Surakarta, Desember 2010
commit to user
x
DAFTAR ISI
Halaman
JUDUL………... …… i
PERSETUJUAN……… ……... ii
PENGESAHAN………. ……... …... iii
ABSTRAK……… ……… iv
ABSTRACT………... v
MOTTO………. …... vi
PERSEMBAHAN………. vii
KATA PENGANTAR……….. viii
DAFTAR ISI……… ….. x
DAFTAR TABEL………. xii
DAFTAR GAMBAR………. xiv
DAFTAR LAMPIRAN……… xv
BAB I PENDAHULUAN……… 1
A. Latar Belakang Masalah……… 1
B. Identifikasi Masalah……… 4
C. Pembatasan Masalah……… 5
D. Perumusan Masalah……… 5
E. Tujuan Penelitian……… 5
F. Manfaat Penelitian……… 6
BAB II LANDASAN TEORI……… 7
A. Tinjauan Pustaka……… 7
1. Efektifitas……….……… 7
2. Pembelajaran Kimia……… 8
3. Metode Pembelajaran Kooperatif GI……… 9
4. Media Pembelajaran……… 11
5. Media VBL……… 13
6. Kesetimbangan Kimia……… 14
B. Kerangka Pemikiran……… 25
commit to user
xi
BAB III METODOLOGI PENELITIAN……… 27
A. Tempat dan Waktu Penelitian………. 27
B. Metode Penelitian……… 27
C. Populasi dan Sampel……… 29
1. Populasi Penelitian………. 29
2. Teknik Pengambilan Sampel……….. 29
D. Variabel Penelitian………. 29
E. Teknik Pengumpulan Data………. 29
1. Sumber Data………... 29
2. Instrumen Penelitian……….. 29
a. Instrumen Kognitif……… 29
b. Instrumen Afektif……….. 32
F. Teknik Analisis Data………. 34
1. Uji Normalitas……… 34
2. Uji Homogenitas……… 35
3. Uji Hipotesis……….. 36
BAB IV HASIL PENELITIAN………. 38
A. Deskripsi Data……… 38
B. Pembahasan……… 49
C. Keterbatasan Penelitian……….. 53
BAB V SIMPULAN, IMPLIKASI, SARAN……… 54
A. Simpulan ……… 54
B. Implikasi………. 54
C. Saran……….. 54
DAFTAR PUSTAKA……….. 55
commit to user
xii
DAFTAR TABEL
Halaman
Tabel 1. Rincian Kegiatan Penelitian………
Tabel 2. Rancangan Penelitian ………...
Tabel 3. Skor Penilaian Afektif………
Tabel 4. Rangkuman Data Rerata Nilai Prestasi Belajar Kognitif dan
Prestasi Belajar Afektif ………
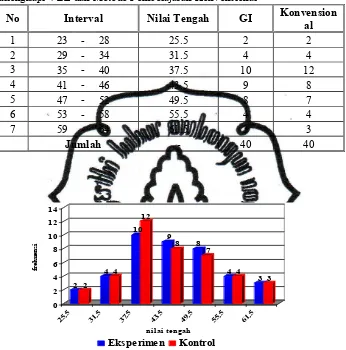
Tabel 5. Perbandingan Distribusi Frekuensi Nilai Pretest Prestasi
Belajar Kognitif Siswa dengan Model Pembelajaran Kooperatif
GI yang dilengkapi VBL dan Model Pembelajaran
Konvensional………...
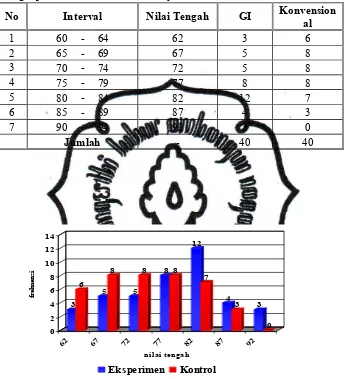
Tabel 6. Perbandingan Distribusi Frekuensi Nilai Postest Prestasi
Belajar Kognitif Siswa dengan Model Pembelajaran Kooperatif GI
yang dilengkapi VBL dan Model Pembelajaran
Konvensional……….
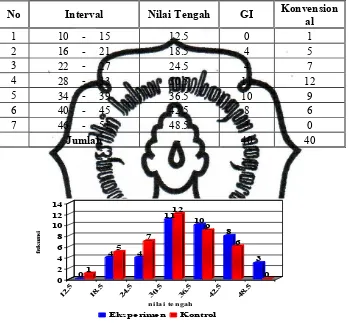
Tabel 7.Perbandingan Distribusi Frekuensi Selisih Nilai Prestasi Belajar
Kognitif Siswa dengan Model Pembelajaran Kooperatif GI
yang dilengkapi VBL dan Model Pembelajaran
Konvensional………..
Tabel 8. Perbandingan Distribusi Frekuensi Nilai Pretest Prestasi Belajar
Afektif Siswa dengan Model Pembelajaran Kooperatif GI yang
dilengkapi VBL dan Model Pembelajaran
Konvensional………..
Tabel 9. Perbandingan Distribusi Frekuensi Nilai Postest Prestasi Belajar
Afektif Siswa dengan Model Pembelajaran Kooperatif GI yang
dimodifikasi VBL dan Model Pembelajaran
Konvensional………..
Tabel 10. Perbandingan Distribusi Frekuensi Selisih Nilai Prestasi
Belajar Afektif Siswa dengan Model Pembelajaran Kooperatif
commit to user
xiii
GI yang dimodifikasi VBL dan Model Pembelajaran
Konvensional………..
Tabel 11. Rangkuman Uji Normalitas Nilai Pretest, Nilai Postest dan
Selisih Nilai Postest-Pretest Prestasi Belajar Kognitif
Siswa………..
Tabel 12. Rangkuman Uji Normalitas Nilai Pretest, Nilai Postest dan
Selisih Nilai Postest-Pretest Prestasi Belajar Afektif
Siswa………..
Tabel 13 Rangkuman Hasil Uji Homogenitas Nilai Pretest, Postest dan
Selisih Postest-Pretest Prestasi Belajar Siswa………...
Tabel 14. Uji t-Pihak Kanan Prestasi Belajar Kognitif………
Tabel 15. Uji t-Pihak Kanan Prestasi Belajar Afektif………...
38
45
46
47
48
commit to user
xiv
DAFTAR GAMBAR
Gambar 1. Bagan Kerangka Pemikiran Penelitian………
Gambar 2. Hisogram Nilai Pretest Prestasi Belajar Kognitif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
Gambar 3. Hisogram Nilai Postest Prestasi Belajar Kognitif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
Gambar 4. Hisogram Selisih Nilai Prestasi Belajar Kognitif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
Gambar 5. Hisogram Nilai Pretest Prestasi Belajar Afektif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
Gambar 6. Hisogram Nilai Postest Prestasi Belajar Afektif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
Gambar 7. Hisogram Selisih Nilai Prestasi Belajar Afektif Siswa dengan
Model Pembelajaran Kooperatif GI yang dimodifikasi VBL
dan Model Pembelajaran Konvensional………
26
39
40
41
42
43
commit to user
xv
DAFTAR LAMPIRAN
Lampiran 1. Silabus dan Sistem Penilaian ………. 57
Lampiran 2. Skenario Pembelajaran ……… 61
Lampiran 3. Soal Try Out ……… 70
Lampiran 4. Lembar Jawab Soal Tes Try Out Kognitif ……….. .79
Lampiran 5. Soal Try Out Aspek Afektif ……… 74
Lampiran 6. Soal Pretest dan Postest ………... 84
Lampiran 7. Lembar Jawab Soal Tes Pretest dan Postest……… 89
Lampiran 8. Soal Pretest dan Postest Aspek Penilaian Afektif …………. 90
Lampiran 9. Uji Validitas, Reliabilitas, Taraf Kesukaran dan Daya Pembeda Soal Kognitif ……… 93
Lampiran 10. Uji Validitas dan Reliabilitas Instrumen Penilaian Aspek Afektif ……… 98
Lampiran 11. Normalitas Pretest Prestasi Belajar Kognitif Kelas Eksperimen ……… 103
Lampiran 12. Normalitas Pretest Belajar Kognitif Kelas Kontrol ……….. 104
Lampiran 13. Normalitas Postest Prestasi Belajar Kognitif Kelas Eksperimen ……… 105
Lampiran 14. Normalitas Postest Prestasi Belajar Kognitif Kelas Kontrol .106 Lampiran 15. Normalitas Pretest Afektif Kelas Eksperimen ……….. 107
Lampiran 16. Normalitas Pretest Prestasi Belajar Afektif Kelas Kontrol .. 108
Lampiran 17. Normalitas Postest Prestasi Belajar Afektif Kelas Eksperimen ……… 109
Lampiran 18. Normalitas Postest Prestasi Belajar Afektif Kelas Kontrol.. 110
Lampiran 19. Normalitas Selisih Nilai Pretest Postest Prestasi Belajar Kognitif Kelas Eksperimen ……….. 111
Lampiran 20. Normalitas Selisih Nilai Pretest Postest Prestasi Belajar Kognitif Kelas Kontrol ……… 112
commit to user
xvi
Lampiran 22. Normalitas Selisih Nilai Pretest Postest Prestasi Belajar
Afektif Kelas Kontrol ……….. 114
Lampiran 23. Uji t-matching Nilai Ulangan Akhir Semester Ganjil Mata Pelajaran Kimia Siswa Kelas XI IPA1 dan XI IPA2 Tahun Pelajaran 2009/ 2010 ……… .115
Lampiran 24. Uji t-pihak kanan Prestasi Belajar Afektif……….116
Lampiran 25. Uji t-pihak kanan Prestasi Belajar Kognitif………117
Lampiran 26. Normalitas Nilai UAS Kelas XI IPA 2………...118
commit to user BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Pesatnya perkembangan ilmu pengetahuan dan teknologi menuntut adanya
perbaikan pada sistem Pendidikan Nasional yang termasuk pada penyempurnaan
kurikulum. Salah satu kebijakan Departemen Pendidikan Nasional yang
mengalami perubahan dari kurikulum 1994 yang disempurnakan diganti dengan
Kurikulum Berbasis Kompetensi (KBK) tahun 2004 dan saat ini sedang
diterapkan dan dikembangkan Kurikulum Tingkat Satuan Pendidikan (KTSP).
KTSP yang merupakan pengembangan dari kurikulum 2004 mempunyai prinsip
bahwa kurikulum berpusat pada potensi, perkembangan, kebutuhan dan
kepentingan peserta didik serta lingkungannya. Hasil belajar yang dinilai
mencakup aspek kognitif, afektif maupun psikomotor diharapkan dapat tercapai
sebagai hasil pembelajaran.
Secara umum pengajaran kimia bertujuan untuk mengembangkan sumber
daya manusia yang memiliki ketrampilan intelektual dan psikomotor dalam
bidang kimia yang dilandasi sikap ilmiah sehingga mampu mengikuti
perkembangan ilmu pengetahuan dan teknologi. Salah satu materi pembelajaran
kimia di SM A adalah Kesetimbangan Kimia. Dalam materi tersebut terdapat
konsep-konsep yang abstrak yang memerlukan pengamatan siswa. salah satu sub
materi Kesetimbangan Kimia adalah Pergeseran Kesetimbangan Kimia yang
didalamnya terdapat pengaruh konsentrasi terhadap kesetimbangan , hal ini dapat
ditunjukkan salah satunya dengan adanya perubahan warna yang terjadi sehingga
arah pergeseran kesetimbangan dapat diketahui bergeser ke kanan atau ke kiri.
Konsep yang bersifat abstrak ini dapat lebih nyata dengan melakukan praktikum
di laboratorium, sehingga diharapkan siswa dapat mengamati secara langsung
agar pembelajaran lebih jelas.
M asalah yang timbul adalah tidak semua sekolah mempunyai gedung
laboratorium dengan peralatan praktik kimia yang lengkap. Kondisi ini terutama
commit to user
laboratorium kimia yang memadai, dan hanya memiliki peralatan praktikum
sederhana. Hal ini tentu tidak mendukung upaya pembelajaran kimia melalui
pengalaman langsung oleh siswa terhadap konsep dan fakta kimia. Sehubungan
dengan itu, peneliti mencoba memberikan satu terobosan pembelajaran kimia
dengan melaksanakan praktikum tanpa gedung laboratorium dan peralatan kimia
yang mahal yaitu VBL (Video Based Laboratory). VBL sebagai alat bantu
potensial dalam pengembangan kemampuan interpretasi bagi siswa. VBL akan
digunakan untuk menampilkan percobaan kimia tentang pergeseran
kesetimbangan dengan baik tanpa melalui praktik langsung. VBL diharapkan
berkemampuan baik untuk digunakan sebagai media pengajaran Kesetimbangan
Kimia yang mencakup aspek teoritis maupun eksperimental. Dalam sebuah
penelitian sebelumnya dengan judul ”Work In Progress- Video-Based Lab
Tutorials in an Undergraduate Electrical Circuit Course”, dalam jurnal Rose-Human Institute of Technology, Terre Haute, IN 47803, menunjukkan hasil
bahwa media yang digunakan yaitu VBL memberikan hasil yang lebih baik
daripada pembelajaran pembelajaran yang berbasis pada teks. Selain itu media
VBL tidak membuat bingung dan frustasi siswa ketika siswa masih belum
familierdengan peralatan yang mau dioperasikan
M ateri pokok bahasan Kesetimbangan Kimia yang diberikan pada kelas XI
SM A semester I di SM AN 1 Ceper Klaten tahun pelajaran 2007/2008
menunjukkan bahwa nilai hasil pembelajaran rata-rata rendah. Hal ini karena
adanya kesulitan belajar yang dialami oleh siswa untuk pelajaran kimia khususnya
materi Kesetimbangan Kimia. Selain itu juga menunjukkan bahwa pengajaran
yang diberikan kepada peserta didik khususnya materi Kesetimbangan Kimia
belum maksimal sehingga hasil yang didapat belum memuaskan. Rendahnya
prestasi belajar siswa khususnya pada materi Kesetimbangan Kimia ini,
dimungkinkan karena rendahnya motivasi belajar siswa dan proses belajar
mengajar yang hanya berpusat pada guru, sehingga siswa tidak ikut terlibat secara
aktif dalam proses belajar tersebut. Berkaitan dengan hal diatas maka harus dicari
model pembelajaran yang sesuai dengan situasi dan kondisi sekolah. Karena
commit to user
guru hanya mentransfer ilmunya secara utuh ke pikiran siswa tanpa
memperhatikan kemampuan siswa berbeda-beda. Sedangakan siswa hanya
sebagai obyek dan dibatasi kebebasannya dalam kegiatan belajar mengajar,
sehingga membuat siswa menjadi malas dan kurang bersemangat dalam mengikuti
proses belajar mengajar.
Pada pembelajaran kooperatif penggunaan ketrampilan-ketrampilan sangat
penting untuk mengembangkan sikap saling bekerjasama, mempunyaai rasa
tanggung jawab dan mampu berkompetisi secara sehat. Sifat dan sikap demikian
akan membawa pribadi yang diharapakan berhasil dalam menghadapi tantangan
pendidikan yang lebih tinggi yang berorientasi pada kelompok. Dalam
pembelajaran kooperatif peserta didik akan lebih mudah untuk menemukan dan
memahami konsep-konsep yang sulit apabila mereka dapat saling mendiskusikan
masalah-masalah tersebut dengan temannya. Anggota kelompok yang mempunyai
prestasi lebih baik harus membantu teman sekelomponya dengan melakukan apa
saja yang dapat membantu kelompok itu berhasil (Slavin, 1985 : 5). M aka perlu
adanya pembelajaran yang berpusat pada siswa sehingga siswa aktif dalam
kegiatan belajar mengajar. Hal ini dapat dilakukan dengan beberapa cara antara
lain: diskusi, presentasi, debat pendapat dan sebagainya. Sehingga kegiatan
belajar mengajar berlangsung aktif dan siswa tidak cepat merasa bosan.
Untuk mendapatkan hasil belajar yang baik dalam proses belajar mengajar
dipengaruhi banyak faktor. Salah satu faktor yang harus diperhatikan adalah
faktor motivasi belajar siswa terhadap materi yang akan dipelajari. M otivasi dapat
diartikan sebagai daya pengerak atau dorongan dari dalam diri seseorang untuk
melakukan suatu tindakan. M otivasi lain tumbuh dalam diri seseorang dapat juga
dirangsang dari luar. Sehubungan dengan hal tersebut, penggunaan media VBL
bukan hanya diharapkan untuk meningkatkan pemahaman siswa dalam hal
menginterpretasikan konsep-konsep abstrak dalam kimia namun juga dapat
dijadikan sebagai sarana untuk menumbuhkan motivasi belajar.
Selain faktor motivasi belajar siswa, pemilihan metode mengajar yang
tepat untuk materi pokok bahasan tertentu juga mempengaruhi pencapaian tujuan
commit to user
yang menuntut keaktifan siswa seperti GI (Group Investigation) diharapkan
mampu meningkatkan prestasi belajar siswa. M etode GI yaitu sistem
pembelajaran yang membuat siswa mempunyai minat dan antusias untuk berperan
aktif baik secara individu ataupun dalam kelompok mencari informasi sendiri,
serta sharing pemahaman dengan teman/ kelompok lain. Dengan GI ini
diharapkan siswa mempunyai kompetensi yang lebih baik. Siswa diharapkan
mempunyai pemahaman secara penuh konsep-konsep dalam Kesetimbangan
Kimia dan diharapakan siswa dapat berlatih diskusi (mengeluarkan pendapat dan
mendengarkan pendapat orang lain), bekerjasama dalam kelompok (team work),
memimpin diskusi, serta berpresentasi.
Berdasarkan uraian diatas, maka akan dilakukan penelitian tentang
penerapan metode kooperatif GI yang dilengkapi dengan penggunaan VBL untuk
meningkatkan aktivitas belajar siswa dan pemahaman konsep. Dengan modifikasi
keduanya tersebut, maka siswa diberi kebebasan untuk membangun sendiri
pengetahuannya. Keduanya merupakan faktor yang sangat membantu dalam
membentuk dan mengembangkan pengetahuan siswa. Dengan demikian,
modifikasi antara GI dengan penggunaan VBL akan dapat meningkatkan prestasi
belajar siswa terhadap materi Kesetimbangan Kimia
B. Identifikasi Masalah
Berdasarkan latar belakang masalah di atas maka dapat diidentifikasikan beberapa
masalah sebagai berikut:
1. Adanya prestasi belajar yang rendah dalam pelajaran Kimia khususnya materi
Kesetimbangan Kimia karena model pembelajaran dan media pembelajaran
yang digunakan selama ini kurang variatif.
2. M etode pembelajaran kooperatif GI belum banyak digunakan di SM A N 1
Ceper
3. Konsep Kesetimbangan Kimia yang bersifat abstrak tidak bisa dijelaskan
dengan praktikum karena keterbatasan sarana laboratorium yang ada di SM A
commit to user
4. Banyak siswa yang kurang aktif dalam proses pembelajaran karena kurangnya
motivasi belajar dan model pembelajaran yang digunakan masih bersifat
teacher centered.
C. Pembatasan masalah
Agar penelitian ini mempunyai arah yang jelas dan pasti, maka perlu adanya
pembatasan masalah. Permasalahan pada penelitian ini dibatasi pada:
1. M ateri yang diajarkan khusus pada materi Kesetimbangan Kimia
2. Pembelajaran dilakukan dengan metode kooperatif GI yang dilengkapi dengan
media VBL
3. M edia VBL hanya menampilkan praktikum tentang reaksi reversible dan
pengaruh perubahan konsentrasi terhadap pergeseran kesetimbangan
4. Prestasi belajar siswa ditinjau dari aspek kognitif dan aspek afektif
5. Subyek penelitian yaitu siswa kelas XI IPA semester ganjil SM AN 1 Ceper
tahun pelajaran 2009/2010
D. Perumusan Masalah
Berdasarkan pembatasan masalah di atas, maka dalam penelitian ini
dirumuskan masalah sebagai berikut : “Apakah metode pembelajaran GI yang
dilengkapi dengan penerapan media VBL efektif dalam pembelajaran Kimia pada
pokok bahasan Kesetimbangan Kimia?”
E. Tujuan Penelitian
Berdasarkan perumusan masalah tersebut di atas maka tujuan penelitian ini
adalah untuk mengetahui :“Efektivitas penggunaan M etode pembelajaran GI yang
dilengkapi dengan penerapan media VBL dalam pembelajaran Kimia pada pokok
commit to user F. Manfaat Penelitian
1. M anfaat Secara Teoritis
Informasi mengenai penggunaan metode GI yang dilengkapi dengan media VBL
2. M anfaat Secara Praktis
a. M emberikan alternatif media pembelajaran yang lain bagi sekolah-sekolah
yang tidak memiliki laboratorium atau tidak memiliki peralatan kimia lengkap
dalam pembelajaran Kimia
b. M emberikan alternatif metode yang lain bagi guru kimia dalam
menyampaikan materi yang memiliki konsep abstrak agar lebih mudah
dipahami siswa
c. M emberikan alternatif metode pembelajaran yang lain bagi guru kimia untuk
meningkatkan aktivitas dan hasil belajar kimia
d. Hasil penelitian ini diharapkan dapat dijadikan acuan bagi peneliti-peneliti
selanjutnya yang melakukan penelitian tentang pengajaran kimia, khususnya
commit to user BAB II
LANDAS AN TEORI
A. Tinjauan Pustaka
1. Efektivitas
Berdasarkan Kamus Besar Bahasa Indonesia (2002: 284), efektif berarti
dapat membawa hasil; berhasil guna (tentang usaha, tindakan). M enurut M argono
(1995: 3) “efektif berarti semua potensi dapat dimanfaatkan dan semua tujuan
dapat dicapai. Sedangkan menurut Roestiyah N.K (2001:1), efektif menunjuk
pada sesuatu yang mampu memberikan dorongan atau bantuan dalam mencapai
suatu tujuan. Dari beberapa definisi diatas dapat ditarik kesimpulan bahwa efektif
adalah sesuatu yang dapat dimanfaatkan untuk mencapai tujuan, sehingga
efektifitas pembelajaran dapat didefinisikan sebagai kesanggupan yang
menimbulkan perubahan-perubahan yang diinginkan pada diri siswa.
M enurut Roestiyah N. K (1989: 37-41) ada beberapa syarat yang
diperlukan untuk mewujudkan pembelajaran yang efektif, antara lain:
a. Belajar secara aktif, baik mental maupun fisik. Di dalam belajar siswa harus
mengalami aktivitas mental, misalnya siswa dapat mengembangkan
kemampuan intelektualnya, kemampuan berfikir kritis juga mengalami
aktivitas jasmani seperti mengerjakan sesuatu.
b. Guru harus menggunakan banyak metode waktu mengajar. Variasi metode
mengakibatkan penyajian bahan pelajaran lebih menarik perhatian siswa,
mudah diterima siswa dan kelas menjadi hidup.
c. Guru harus memberikan motivasi karena hal ini sangat berperan pada
kemajuan perkembangan siswa selanjutnya melaui proses belajar.
d. Guru perlu mempertimbangkan pada perbedaan individu. Guru tidak cukup
hanya merencanakan perencanaan klasikal, karena masing-masing siswa
mempunyai perbedaan dalam beberapa segi misalnya intelegensi, bakat,
tingkah laku dan lain-lain.
e. Guru akan mengajar efektif bila selalu membuat perencanaan sebelum
commit to user
kelas. Perencanaan yang masak dapat menumbuhkan banyak inisiatif dan daya
kreatif guru waktu mengajar, dapat meningkatkan interaksi dan meningkatkan
interaksi dalam proses belajar mengajar antara guru dan siswa.
Efektivitas menunjukkan keberhasilan dari segi tercapai tidaknya suatu
tujuan yang telah ditentukan. Hasil yang semakin mendekati tujuan yang telah
ditentukan menunjukkan semakin tinggi tingkat efektivitasnya. Pembelajaran
yang efektif adalah pembelajaran yang dapat memanfaatkan segala potensi
sebagai pengukur terhadap keberhasilan siswa atau prestasi belajar siswa setelah
mempelajari suatu materi pelajaran.
2. Pembelajaran Kimia
Istilah “pembelajaran” sama dengan “pengajaran”. Pembelajaran
mempunyai arti cara (perbuatan) mengajar atau mengajarkan menurut
Poerwadarminta (1984 : 22). M enurut M argono (1989 : 1) : “M engajar adalah
kegiatan agar siswa dapat belajar, artinya agar terjadi perubahan tingkah laku pada
diri siswa”. M engajar adalah mengatur dan mengorganisasi lingkungan sekitar
siswa sehingga dapat mendorong dan menumbuhkan siswa melakukan kegiatan
belajar (Nana Sudjana, 1989 : 7). Dalam mengajar ada 3 faktor yang harus
diperhatikan : 1. Pengajar – yang mengajar, yang memberikan bahan, yang
memotivasi; 2. pelajar – yang menerima, yang belajar, yang menyerap dan
menggunakannya; 3. Bahan pelajarannya (Roestiyah, 1998 : 1)
Dengan demikian pembelajaran diartikan sebagai perbuatan belajar (oleh
siswa) dan mengajar (oleh guru) dimana terjadi pengorganisasian lingkungan yang
ada disekitar siswa sehingga proses belajar mengajar yang berupa penyampaian
pengetahuan dapat berjalan baik.
M empelajari ilmu kimia tidak hanya bertujuan menemukan zat-zat kimia
yang langsung bermanfaat bagi kesejahteraan umat manusia belaka, akan tetapi
ilmu kimia dapat pula memenuhi keinginan seseorang untuk memahami berbagai
peristiwa alam yang ditemukan dalam kehidupan sehari-hari, mengetahui hakikat
materi dan perubahnnya, menemukan metode ilmiah, mengembangkan
kemampuan dalam mengajukan gagasan-gagasan, dan memupuk ketekunan serta
commit to user
dapat dibuat fakta konkritnya dan sebagian aspek yang lain bersifat abstrak atau
“tidak kasat mata” (invisible), artinya tidak dapat dibuat fakta konkritnya
(Depdiknas, 2003 : 2)
M enurut Elizabeth Kean dan Catheine M iddlecamp (1985 :5) menyatakan
bahwa sebagian besar ilmu kimia bersifat abstrak, materi kimia sifatnya berurutan
dan berkembang dengan pesat, diajarkan dalam bentuk yang lebih sederhana
daripada kenyataannya, melibatkan lebih daripada sekedar pemecahan soal-soal,
dan menuntut banyak belajar.
Sebagaimana telah kita ketahui bahwa dalam proses pembelajaran
khususnya pelajaran kimia guru dituntut untuk memiliki kemampuan yang
memadai dalam melaksanakan kegiatan pembelajarannya dan harus mampu
mewujudkan lingkungan belajar yang efektif dan lebih mampu mengelola
kelasnya sehingga prestasi belajar siswa tinggi.
3. M etode Pembelajaran Kooperatif GI
M etode GI adalah perpaduan bidang sosial dan kemahiran berkomunikasi
dengan intelektual pembelajaran dalam mensintesis dan menganalisis. GI tidak
dapat diimplementasikan dalam lingkungan pendidikan yang tidak ada dukungan
dialog dari setiap anggota atau mengabaikan dimensi afektif-sosial dalam
pembelajaran kelas (Arends,1997 : 120-121)
Dalam menggunakn metode GI umumnya kelas dibagi menjadi beberapa
kelompok dengan anggota 5 atau 6 orang siswa dengan karakteristik yang
heterogen. Adapun metode GI memiliki enam tahapan kegiatan yaitu sebagai
berikut:
a. M engidentifikasi Topik dan Pembentukan Kelompok
Tingkatan ini menekankan pada permasalahan dimana siswa meneliti,
mengajukan topik dan saran. Peranan ini dimulai dengan setiap siswa
diberikan modul yang mana berisikan kisi-kisi, dari langkah ini diharapkan
siswa mampu menebak topik apa yang akan disampaikan pada siswa.
Kemudian siswa yang memiliki topik yang sama dikelompokkan menjadi satu
commit to user
membatasi jumlah kelompok serta membantu mengumpulkan informasi dan
memudahkan pengaturan.
b. M erencanakan Tugas Belajar
Pada tahap ini anggota kelompok menentukan subtopik yang akan
diinvestigasi dengan cara mengisi lembar kerja yang telah tersedia serta
mengumpulkan sumber untuk penyelesaian masalah yang telah diinvestigasi
kelompok kecil. Kemudian setiap kelompok memberikan kontribusi kepada
penelitian untuk seluruh kelas.
c. M enjalankan Investigasi
Siswa secara individual atau berpasangan mengumpulkan informasi,
menganalisa dan mengevaluasi serta menarik kesimpulan. Setiap anggota
kelompok memberikan kontribusi satu dari bagian penting yang lain untuk
kelompoknya. Sedangkan anggota kelompok yang lain dapat menolong dan
mendiskusikan pekerjaannya dengan mengadakan saling tukar informasi dan
mengumpulakan ide-ide tersebut untuk menjadi suatu kumpulan.
d. M enyiapkan Laporan Akhir
Pada tahap ini merupakan tingkat pengorganisasian dengan mengintegrasikan
semua bagian menjadi keseluruhan dan merencanakan sebuah presentasi di
depan kelas. Setiap kelompok telah menunjuk salah satu anggota untuk
mempresentasikan tentang laporan hasil penyelidikannya yang kemudian
setiap anggota mendengarkan. Peran guru disini sebagai penasihat membantu
memastikan setiap anggota kelompok ikut andil di dalamnya.
e. M empresentasikan Hasil Akhir
Setiap kelompok telah siap memberikan hasil akhir di depan kelas dengan
berbagai bentuk presentasi. Diharapkan dari penyajian presentasi yang
beraneka ragam tersebut, kelompok lain dapat aktif mengevaluasi kejelasan
dari laporan setiap kelompok dengan melakukan tanya jawab.
f. M engevaluasi
Pada tahap ini siswa memberikan tanggapan dari masing-masing topik
commit to user
mengevaluasi proses belajar sehingga semua siswa diharapkan menguasai
semua subtopik yang disajikan (Slavin, 1985 : 73)
4. M edia pembelajaran
Kata media berasal dari bahasa latin yang merupakan bentuk jamak dari
kata medium yang secara harfiah berarti perantara atau pengantar, sehingga media
adalah perantara atau pengantar pesan kepada penerima pesan (Arief S. Sadiman,
1996 : 6). Kemudian menurut AECT (Association of Education and
Communication Technology) dalam Arif S. sadiman (1996 : 19), media atau
bahan adalah perangkat lunak (software) berisi pesan atau informasi pendidikan
yang biasanya disajikan dengan peralatan, sedangkan hardware atau perangkat
keras merupakan sarana untuk menampilkan pesan yang terkandung dalam pesan
tersebut.
M edia merupakan alat komunikasi yang digunakan untuk membawa
suatu informasi. Apabila dikaitkan dengan kegiatan pembelajaran maka media
dapat diartikan sebagai alat komunikasi yang digunakan untuk membawa
informasi yang ditujukan untuk pembelajaran. selain digunakan sebagai alat
penyampaian pembelajaran yang utuh, media juga dapat dimanfaatkan untuk
menyampaikan bagian tertentu dari kegiatan pembelajaran, misalnya memperikan
penguatan atau motivasi.
Proses pembelajaran hakikatnya adalah proses komunikasi yaitu proses
penyampaian pesan dari sumber pesan melalui saluran atau media tertentu ke
pengirim pesan (Arief S. sadiman, 1996 : 11), sedangkan Howard dalam Roestyah
N. K (1989 : 15), “Pembelajaran adalah suatu aktivitas untuk mencoba menolong,
membimbing seseorang untuk mendapatkan, mengembangkan ketrampilan, skap,
cita-cita, penghargaan dan pengetahuan”.
Dari pengertian di atas, media pembelajaran dapat diartikan sebagai
perangkat keras dan atau perangkat lunak yang dapat digunakan untuk
menciptakan proses belajar, sehingga pebelajar dapat memperoleh pengetahuan
commit to user
M edia pembelajaran dalam dunia pendidikan secara umum mempunyai
kegunaan sebagai berikut :
1. M emperjelas penyajian agar tidak terlalu bersifat verbalistik (dalam bentuk
kata-kata tertulis atau lisan belaka)
2. M engatasi keterbatasan ruang, waktu dan daya indera,misalnya :
a. obyek yang terlalu besar, bisa digantikan dengan gambar, film bingkai
b. obyek yang kecil bisa dibantu dengan proyektor mikro, film bingkai atau
gambar
c. gerak yang terlalu lambat atau terlalu cepat dapat dibantu dengan time
elapseatau high-speed photography
d. kejadian atau peristiwa yang terjadi dimasa lalu bisa ditampilakan lagi
lewat rekaman film, video, film bingkai, foto maupun secara verbal
e. obyek yang terlalu kompleks (misalnya mesin-mesin) dapat disajikan
dengan model, diagaram dan lain-lain
f. konsep yang terlalu luas (gunung berapi, gempa bumi, iklim dan lain-lain)
dapat divisualisasikan dalam bentuk film, film bingkai, gambar, dan
lain-lain
3. Penggunaan media pembelajaran secara tepat dan bervariasi dapat mengatasi
sifat pasif siswa
Dalam hal ini media pembelajaran berguna untuk:
a. menimbulkan kegairahan belajar,
b. memungkinkan interaksi yang lebih langsung antara siswa dengan
lingkungan dan kenyataan
c. memungkinkan siswa belajar sendiri-sendiri menurut kemampuan dan
sifatnya
4. Dengan sifatnya yang unik pada setiap siswa ditambah lagi dengan lingkungan
dan pengalaman yang berbeda, sedangkan kurikulum dan materi pendidikan
ditentukan sama untuk semua siswa, maka guru akan banyak mengalami
kesulitan bila semua itu diatasi sendiri. Apabila latar belakang lingkungan
guru dan juga siswa berbeda. M asalah ini dapat diatasi dengan media
commit to user
a. memberikan perangsang yang sama,
b. mempersamakan pengalaman,
c. menimbulkan persepsi yang sama (Arief S. sadiman, 1996 : 16-17)
5. M edia VBL
Salah satu usaha untuk memberikan variasi dalam pembelajaran kimia
adalah dengan menggunakan media pendidikan kimia yang cenderung disebut
sebagai alat peraga kimia. M edia pendidikan kimia yang cenderung disebut
sebagai alat peraga kimia juga didefinisikan sebagai suatu alat peraga yang
penggunaannya diintegrasikan dengan tujuan dan isi pembelajaran yang telah
dituangkan dalam Garis Besar Program Pembelajaran (GBPP) mata pelajaran
kimia dan bertujuan untuk mempertinggi mutu kegiatan belajar mengajar
(Darhim, 1993 : 5). Video Based Laboratory (VBL), merupakan salah satu media
pembelajaran sebagai alat bantu potensial dalam pengembangan kemampuan
interpretasi konsep-konsep abstrak melalui video yang menampilkan percobaan
laboratorium untuk memudahkan pemahaman bagi siswa.
VBL sebagai media pembelajaran memiliki beberapa nilai praktis
diantaranya: (1). Dapat mengatasi perbedaan pengalaman siswa, (2). Dapat
membangkitkan semangat belajar yang baru dan membangkitkan motivasi serta
merangsang kegiatan siswa dalam belajar, (3). Dapat mempengaruhi abstraksi,
(4). Dapat memperkenalkan, memperbaiki, meningkatkan dan memperjelas
pengertian konsep dan fakta, (5). Dapat membantu mengatasi keterbatasan indera
manusia, (6). Dapat mengatasi kendala ruang dan waktu, (7). Dapat menyajikan
obyek pelajaran tanpa benda atau peristiwa langka dan berbahaya ke dalam kelas
commit to user
6. Kesetimbangan Kimia
I. Konsep Kesetimbangan Kimia
1. Reaksi Reversibel dan Irreversibel
Perhatikan kertas yang terbakar. Apakah abu hasil pembakaran kertas
dapat diubah menjadi kertas seperti semula? Pengalaman menunjukkan bahwa
proses itu tidak dapat dilakukan, bukan? Reaksi seperti itu kita golongkan sebagai
reaksi yang berlangsung searah atau reaksi yang tidak dapat balik (irreversibel).
Apakah ada reaksi yang dapat balik? Dalam kehidupan sehari-hari sulit
menemukan reaksi yang dapat balik. Proses-proses alami umumnya berlangsung
searah, tidak dapat balik. Namun, di laboratorium maupun dalam proses industri,
banyak rekasi yang dapat balik. Reaksi yang dapat balik kita sebut reaksi
reversible. Dua diantaranya kita sebutkan dalam contoh di bawah ini.
Contoh1:
Jika campuran gas nitrogen dan hidrogen dipanaskan akan menghasilkan amonia
N2 (g) + 3H2 (g) 2NH3 (g)
Sebaliknya jika ammonia (NH3) dipanaskan akan terurai membentuk nitrogen dan
hidrogen:
2NH3 (g) N2 (g)+ 3H2 (g)
Apabila diperhatikan ternyata reaksi kedua merupakan kebalikan dari reaksi
pertama. Kedua reaksi itu dapat digabuhng sebagai berikut:
N2 (g) + 3H2 (g) ⇔ 2NH3 (g)
Tanda ⇔ dimaksudkan untuk menyatakan reaksi dapat balik. Reaksi kekanan
disebut reaksi maju, reaksi ke kiri disebut reaksi balik
Contoh 2:
Reaksi antara timbel(II) sulfat dengan natrium iodida. Jika serbuk timbel(II) sulfat
direaksikan dengan natrium iodida, terbentuk endapan kuning dari timbel(II)
iodida sebagai berikut:
PbSO4(s)+ 2NaI(aq) PbI2(s)+ Na2SO4 (aq)
Putih Kuning
Sebaliknya, jika endapan timbel(II) iodide direaksikan dengan larutan natrium
commit to user
PbI2(s)+ Na2SO4(aq) PbSO4(s)+ 2NaI(aq)
Kuning Putih
Reaksi pertama dan reaksi kedua diatas dapat digabungkan sebagai berikut:
PbSO4(s)+ 2NaI(aq) ⇔ PbI2(s)+ 2Na2SO4(aq)
2. Reaksi Setimbang
Bayangkan suatu ruangan tertutup dimana 1 mol gas nitrogen dipanskan
bersama 3 mol gas hidrogen.pada awalnya, hanya terjadi satu reaksi yaitu
pembentukan amonia
N2(g) + 3H2(g) 2NH3(g)
Seperti telah disebutkan di atas,amonia dapat terurai membentuk nitrogen
dan hidrogen. Oleh karena itu, segera setelah terbentuk, sebagian amonia akan
terurai kembali membentuk gas nitrogen dan gas hidrogen.
2NH3(g) N2(g)+ 3H2 (g)
Selanjutnya kedua reaksi tersebut akan berlangsung secara bersamaan (simultan)
menurut reaki dapat balik berikut:
N2(g) + 3H2(g) ⇔ 2NH3(g)
M isalnya laju reaksi maju v1 dan laju reaksi balik v2. sebagaimana telah
dipelajari dalam bab 3 (Laju Reaksi), nilai v1bergantung pada konsentrasi N2dan
H2, sedangkan nilai v2 bergantubng pada konsentrasi NH3. pada awal reaksi,v1
mempunyai nilai maksimum, sedangkan v2 = 0 (karena NH3 belum terbentuk).
Selanjutnya, seiring dengan berkurangnya konsentarasi N2 dan H2 nilai v1 makin
lama makin kecil. Sebaliknya, dengan bertambahnya konsentrasi NH3, nilai v2
makin lama makin besar. Pada suatu saat, laju reaksi maju (v1) akan menjadi sama
dengan laju reaksi balik (v2).hal itu berarti bahwa laju menghilangnya suatu
komponen sama dengan laju pembentukan komponen itu. Berariti sejak v1 = v2,
jumlah masing-masing komponen tidak berubah terhadap waktu. Oleh karena itu,
tidak ada perubahan yang dapat diamati atau diukur (sifat makroskopis tidak
berubah), reaksi seolah-olah telah berhenti. Keadaan seperti itu disebut keadaan
setimbang (kesetimbangan). Akan tetapi, percobaan menunjukkan bahwa dalam
commit to user
mikroskopis) oleh karena itu, keseimbangan kimia disebut kesetimbangan
dinamis.
3. Waktu Untuk M encapai Kesetimbangan
Waktu untuk mencapai kesetimbangan berbeda dari satu reaksi kereaksi
yang lain. Ada reaksi yang mencaai kesetimbangan begitu zat-zat pereaksi
dicampurkan, misalnya:
Fe3+(aq)+ SCN
-(aq) ⇔ FeSCN 2+
(aq)
2CrO42-(aq)+ 2H
+ ⇔
Cr2O7(aq)+ H2O(l)
Akan tetapi banyak reaksi yang memerlukan waktu lebih lama untuk
mencapai kesetimbanagn. M isalnya, reaksi gas nitrogen dengan gas hidrogen
membentuk amonia,
N2(g) + 3H2(g) ⇔ 2NH3(g)
M emerlukan waktu berhari-hari untuk mencapai kesetimbangan meskipun
dilakukan pada suhu 500oC
Cepat lambatnya suatu reaksi mencapai kesetimbangan bergantung pada laju
reaksinya. Semakin besar laju reaksi, semakin cepat kesetimbangan tercapai.
a. Sifat-Sifat Kesetimbangan Kimia
Kesetimbangan kimia hanya dapat berlangsung dalam sistem tertutup.
Sementara itu, pada umumnya proses alami berlangsung dalam sistem terbuka.
Sebagaimana kita saksikan, berbagai proses alami, seperti perkaratan logam,
pembusukan, dan pembakaran, merupakan reaksi yang berlangsung searah. Akan
tetapi jika sistemnya kita perbesar, misalnya mencakup atmosfer secara
keseluruhan, kita dapat melihat berbagai kesetimbangan. M isalnya kesetimbangan
yang mengatur komposisi atmosfer yang relatif konstan dari waktu ke waktu.
Proses kesetimbangan juga terjadi dalam tubuh makhluk hidup. Darah manusia
sebagai contoh, mempunyai sistem yang mengatur pH tetap sekitar 7,4. hal itu
sangat penting, karena perubahan kecil saja pada pH darah akan mengganggu
commit to user
b. Kesetimbangan Homogen dan Heterogen
kesetimbangan yang sama komponennya satu fase kita sebut
kesetimbangan homogen, sedangkan kesetimbangan yang terdiri dari dua fase
atau lebih kita sebut kesetimbangan heterogen. Kesetimbangan homogen dapat
beruap sistem gas atau laruatan. Kesetimbangan heterogen umumnya melibatkan
komponen padat-gas atau cair-gas.
Contoh kesetimbangan homogen:
1. Azas Le Chatelier
Pada tahun 1884, Henri Louis Le Chatelier (1850 – 1936) berhasil
menyimpulkan pengaruh faktor luar terhadap kesetimbangan dalam suatu azas
yang dikenal dengan azas Le Chatelier sebagai berikut: bila terhadap suatu
kesetimbangan dilakukan suatu tindakan (aksi), maka sistem itu akan mengadakan
reaksi yang cenderung mengurangi pengaruh aksi tersebut. Secara singkat, azas
Le Chatelier dapat disimpulakan sebagai berikut:
Reaksi = -Aksi
Cara sistem bereaksi adalah dengan melakuakn pergeseran ke kiri atau ke
kanan. M arilah kita bahas penerapan azas Le Chatelier terhadap pergeseran
kesetimbanagn
a. Pengaruh Konsentrasi
Sesuai dengan azas Le Chatelier (Reaksi = -Aksi), jika konsentrasi salah
satu komponen diperbesar maka reaksi sistem adalah mengurangi komponen
commit to user
reaksi sistem adalah menambahkan komponen itu. Oleh karena itu, pengaruh
konsentrasi terhadap kesetimbangan berlansung
b. Pengaruh Tekanan
Penambahan tekanan dengan cara memperkecil volum akan memperbesar
konsentrasi semua komponen. Sesuai dengan azas Le Chatelier, maka sistem akan
bereaksi dengan mengurangi tekanan. Sebagaimana anda ketahui, tekanan gas
bergantung pada jumlah molekul dan tidak bergantung pada jenis gas. Oleh
karena itu, untuk mengurangi tekanan maka reaksi kesetimbangan akan bergeser
ke arah yang jumlah koefisiennya lebih kecil. Sebaliknya, jika tekanan dikurangi
dengan cara memperbesar volum, maka sistem akan bereaksi dengan menambah
tekanan dengan cara menambah jumlah molekul. Reaksi akan bergeser ke arah
yang jumlah koefisiennya lebih besar.
c. Pengaruh Komponen Padat dan Cair
Penambahan atau pengurangan komponen yang berupa padatan atau cairan
murni tidak mempegaruhi keetimbangan. Hal ini dapat dipahami sebagai berikut.
Penambahan komponen yang berupa larutan atau gas akan berpengaruh pada
kerapatan antarpartikel dalam campuran.jika suatu komponen gas atau terlarut
ditambahkan, maka konsentrasi meningkat, sehingga sistem bereaksi untuk
mengurangi konsentrasi. Jika yang ditambahkan berupa padatan atau cairan
murni, hal itu tidak merubah konsentrasi karena jarak antarpartikel dalam padatan
dan cairan adalah tetap.
Demikian juga halnya pada perubahan tekanan atau volum. Perubahan
tekanan atau volum tidak mempengaruhi konsentrasi padatan atau cairan murni.
Jadi, ketika mempertimbangkan pengaruh tekanan dan volum, koefisien
komponen padat tidak diperhitungkan. Tekanan hanya berpengaruh pada system
kesetimbangan gas
d. Pengaruh Suhu
Sesuai denagn azas Le Chatelier, jika suhu system kesetimbangan
dinaikkan, maka reaksi sistem menurunkan suhu, kesetimbangan akan bergeser ke
commit to user
suhu diturunkan, maka kesetimbangan akan bergeser ke pihak reaksi eksoterm.
Perhatikan contoh soal berikut:
Ditentukan reaksi kesetimbnagan:
(1) N2(g)+ 3H2(g) ⇔ 2NH3(g) H = -92,2 kJ
(2) H2O(g) ⇔ ½ H2(g)+ O2(g) H = +242 kJ
Ke arah mana kesetimbangan bergeser jika suhu dinaikkan?
Jawab:
Pada kenaikan suhu, kesetimbangan bergeser ke pihak reaksi endoterm;
Pada kesetimbangan (1), reaksi bergeser ke kiri
Pada kesetimbangan (2), reaksi bergeser ke kanan
e. Pengaruh Katalisator
Dalam bab 3 telah dijelaskan bahwa katalisator memperbesar laju reaksi
karena menurunkan energi pengaktifan. Penurunan energi pengaktifan tersebut
berlaku untuk kedua arah. Jadi, katalisator akan mempercepat laju reaksi maju
sekaligus laju reaksi balik. Oleh karena itu, penggunaan katalisator akan
mempercepat tercapainya keadaan setimbang.suatu reaksi yang memerlukan
waktu berhari-hari atau berminggu-minggu untuk mencapai kesetimbangan, dapat
dicapai dalam beberapa menit dengan adanya katalisator. Suatu katalisator juga
penting dalam reaksi yang memerlukan suhu tinggi, karena dengan sutu
katalisator reaksi seperti itu dapat berlangsung pada suhu yang lebih rendah. Hal
itu akan jadi sangat penting jika reaksi pada suhu tinggi mengurangi rendemen
hasil reaksi.
M eskipun katalisator dapat mempercepat pencapaian keadaan setimbang,
namun katalisator tidak mengubah komponen kesetimbangan.
III. Kesetimbangan Dalam Industri
Banyak proses pembuatan zat kimia yang didasarkan pada reaksi
kesetimbangan.agar efesien, kondisi reaksi haruslah diusahakan sedemikian
sehingga menggeser kesetimbangan ke arah produk dan memiinimalkan reaksi
balik. Pada bagian berikut kita akan membahas bagaimana prinsip kesetimbangan
commit to user
1. Pembuatan Amonia M enurut Proses Haber-Bosch
Nitrogen terdapat melimpah di udara, yaitu sekitar 78% volum. Walaupun
demikian, senyawa nitrogen tidak terdapat banyak di alam.satu-satunya sumber
alam yang penting adalah NaNO3 yang disebut senyawa Chili. Sementara itu,
kebutuhan senyawa nitrogen semakin banyak, misalnya, untuk industri pupuk,
mesiu, dan bahan peledak. Oleh karena itu, proses sintesis senyawa nitrogen
disebut fiksasi nitrogen buatan, merupakan proses industri yang sangat pentinng.
M etode yang paling utama adalah dengan mereaksikan nitrogen dengan hidrogen
membentuk amonia. Selanjutnya amonia dapat diubah menjadi senyawa nitrogen
lain seperti asam nitrat dan garam nitrat.
Dasar teori pembuatan amonia dari nitrogen dan hidrogen ditemukan oleh
Fritz Haber (1908), seorang ahli kimia dari Jerman.sedangkan proses industri
pembuatan amonia, untuk produksi secara besar-besaran ditemukan oleh Carl
Bosch, seorang insinyur kimia, juga dari Jerman.
Persamaan termokimia realsi sintesis amonia adalah:
N2(g)+ 3H2(g) ⇔ 2NH3(g) H = -92,4 kJ
Pada 25oC : Kp = 6,2 x 105
Berdasarkan pada prinsip kesetimbangan, kondisi menguntungkan untuk
ketuntasan reaksi ke kanan (pembentukan NH3) adalah suhu rendah tekanan
tinggi. Akan tetapi, reaksi tersebut berjalan sangat lambat pada suhu rendah,
bahkan pada suhu 500oC sekalipun. Di pihak lain, karena reaksi ke kanan
eksoterm, penambahan suhu akan mengurangi rendemen.
Proses Haber-Bosch semula dilangsungkan pada suhu sekitar 500oC dan
tekanan sekitar150 – 350 atm dengan katalisator, yaitu serbuk besi dicampur
dengan Al2O3, M gO, CaO, dan K2O. dewasa ini, seiring dengan kemajuan
teknologi, digunakan tekanan yang jauh lebih besar, bahkan mencapai 700 atm.
Untuk mengurangi reaksi balik, maka amonia yang terbentuk segera dipisahakan.
M ula-mula campuran gas nitrogen dan hidrogen dikompresi (dimampatkan)
hingga mencapai tekanan yang diinginkan. Kemudian campuaran gas dipanaskan
dalam suatu ruangan bersama katalisator sehingga terbentuk amonia. Campuran
commit to user
hidroen yang belum bereaksi (dan juga amonia yang tidak mencair) diresirkulasi,
sehingga pada akhirnya semua diubah menjadi amonia.
2. Pembuatan Asam Sulfat M enurut Proses Kontak
Satu lagi contoh industri yang berdasarkan reaksi kesetimbangan yaitu
pembuatan asam sulfat yang dikenal dengan proses kontak. Reaksi yang terjadi
dapat diringakas sebagai berikut:
1. Belerang dibakar dengan udara membentuk belerang dioksida
S(s)+ O2(g) ⇔ SO2(g)
2. Belerang dioksida dioksidasi lebih lanjut menjadi belerang trioksida
2SO2(g) + O2(g) ⇔ 2SO3(g)
3. Belerang trioksida dilarutakan dalam asam sulfat pekat membentuk asam
pirosulfat
H2SO4(aq)+ SO3(g) ⇔ H2S2O7(l)
4. Asam pirosulfat direasikan dengan air dapat membentuk asam sulfat pekat
H2S2O7(l)+ H2O(l) ⇔ H2SO4(aq)
Tahap penting dalam proses ini adalah reaksi (2). Reaksi ini merupakan reaksi
kesetimbangan dan eksoterm. Sama seperti pada sintesis amonia,reaksi ini hanya
berlangsung baik pada suhu tinggi. Akan tetapi pada suhu tingi kesetimbangan
bergeser ke kiri. Pada proses kontak digunakan suhu sekitar 500oC dengan
katalisator V2O5. sebenarnya tekanan besar akan menguntungkan produksi SO3,
tetapi ternyata penambahan tekanan tidak diimbangi penambahan hasil yang
memadahi. Oleh karena itu, pada proses kontak tidak digunakan tekanan besar
melainkan tekanan normal, 1 atm
IV. Tetapan Kesetimbangan
1. Hukum Kesetimbangan
Kita telah mengetahui bahwa komposisi kesetimbangan dapat berubah
bergantung pada kondisi reaksi. Akan tetapi, pada tahu 1864 Cato maximillian
Gulberg dan PeterWage menemukan adanya suatu hubungan yang tetap antara
konsentrasi komponen dalam kesetimbangan. Hubungan yang tetap ini disebut
commit to user
2. Persamaan Tnetapan Kesetimbangan
Ungkapan hukum kesetimbangan kita sebut persamaan tetapan
kesetimbanagn. Persamaan tetapan kesetimbangan sesuai dengan
stoikiometri reaksi. Secara umum untuk reaksi
mA + nB ⇔ pC + qD
persamaan tetapan kesetimbangan adalah
n
3. Tetapan Kesetimbangan Tekanan (Kp)
Tetapan kesetimbangan untuk kesetimbangan gas juga dapat dinyatakan
berdasarkan tekanan parsial gas, selain tetapan kesetimbnagan berdasarkan
konsentrasi.tetapan kesetimbangan yang bedasarkan tekanan parsial disebut
tetapan kesetimbangan tekanan parsial dan dinyatakan dengan Kp
4. Tetapan Kesetimbangan untuk Kesetimbangan Heterogen
Persamaan tetapan kesetimbangan hanya mengandung komponen yang
konsentrasi atau tekanannya berubah selama reaksi berlangsung. Hal seperti
itu tidak terjadi pada zat padat murni atau zatcair murni. Karena itu, zat padat
murni atau zat cair murni tidak disertakan dalam persamaan tetapan
kesetimbangn.perhatikan contoh di bawah ini:
BiCl2(aq)+ H2O(l) ⇔ BiOCl(s)+ 2HCl(aq)
BiOCl(s)dan H2O(l)tidak disertakan dalam persamaan Kc
5. Hubungan Nilai Tetapan Kesetimbangan Antara Reaksi-reaksi yang Berkaitan
Reaksi dapat balik yang melibatkan SO2(g), O2(g)dan SO3(g) dapat dinyatakan
dengan tiga cara berikut:
(1) 2SO2(g)+ O2(g) ⇔ 2SO3(g) Kc = K1
commit to user
(3) SO2(g)+ ½ O2(g) ⇔ SO3(g) Kc = K3
Bagaimanakah hubungan antara nilai tetapan kesetimbangan reaksi-reaksi itu?
Persamaan Kc untuk ketiga reaksi tersebut adalah sebagai berikut:
]
Reaksi (2) adalah kebalikan dari reaksi (1) dan persamaan Kc untuk reaksi (2)
adalah kebalikan dari reaksi (1)
Jadi,
Reaksi (3) sama dengan reaksi (1) tetapi koefisiennya dibagi dua.
Ternyata, K3= K1 1/2
Dari uraian di atas dapat disimpulakan bahwa:
(1). Jika persamaan reaksi kesetimbangan dibalik, maka harga Kc juga dibalik
(2). Jika koefisien reaksi kesetimbangan dibagi dengan faktor n maka harga
ketetapan kesetimbangan yang baru adalah akar pangkat n dari harga
ketetapan kesetimbangan yang lama.
(3). Jika koefisien reaksi kesetimbangan dikalikan dengan faktor n maka harga
tetapan kesetimbangan yang baru adalah harga tetapan kesetimbangan
yang lama dipangkatkan dengan n.
6. Penggabungan Persamaan Tetapan Kesetimbangan
Jika diketahui harga tetapan kesetimbangan pada 298K untuk dua reaksi
berikut,
Reaksi (1): N2(g) + O2(g) ⇔ 2NO(g) Kc = 4,1 x 10 -31
Reaksi (2): N2(g) + ½ O2(g) ⇔ N2O(g) Kc =2,4 x 10 -18
M aka kita dapat menentukanh arga tetapan kesetimbangan untuk reaksi
berikut
commit to user
Reaksi (3) adalah penjumlahan dari reaksi (1) dengan kebalikan dari reaksi (2)
Reaksi (1): N2(g) + O2(g) ⇔ 2NO(g)
Jika persamaan Kc reaksi (1) dikalikan dengan kebalikan persamaan Kc reaksi
(2) diperoleh persamaan Kc reaksi (3). Dengan demikian, harga Kc reaksi (3)
dapat ditentukan:
Dari uraian diatas dapat disimpulkan bahwa:
Tetapan kesetimbangan untuk suatu reaksi total adalah hasil kali tetapan
kesetimbangan dari reaksi yang digabungkan.
7. M enentukan Nilai Tetapan Kesetimbangan
Harga tetapan kesetimbangan dapat ditentukan melalui percobaan. Salah satu
cara adalah dengan membekukan kesetimbangan, yaitu menurunkan suhu
secara tiba-tiba sehingga reaksi berhenti, sehingga kesetimbangan tidak
sempat bergeser. Dengan demikian, komposisi kesetimbangan dapat
commit to user V. Kesetimbangan Disosasi
Disosiasi adalah peruraian suatu zat menjadi zat lain yang lebih sederhana.
Disosiasi yang terjadi akibat pemanasan disebut disosiasi termal. Disosiasi yang
berlangsung dalam ruang tertutup akan berakhir dengan suatu kesetimbangan
yang disebut dengan kesetimbangan disosiasi.
Beberapa contoh kesetimbangan disosiasi gas:
2SO3(g) ⇔ 2SO2(g) + O2(g)
2NH3(g) ⇔ N2(g)+ 3H2(g)
N2O4(g) ⇔ 2NO2(g)
I2(g) ⇔ 2I(g)
Besarnya reaksi zat yang terdisosiasi dinyatakan oleh derajat disosiasi (á), yaitu
perbandinagn antara zat yang terdisosiasi dengan jumlah zat mula-mula.
mula
Jika jumlah mol zat mula-mula dinyatakan dengan á, maka:
a
Jadi, jumlah mol zat yang terdisosiasi = aá mol
B. Kerangka Pemikiran
Pembelajaran kimia dengan menggunkan media VBL diharapkan akan
bisa meningkatkan pemahaman siswa terhadap materi pokok kesetimbangan
kimia. Karena media VBL menampilkan terkait praktikum materi kesetimbangan
kimia sehingga membantu siswa dalam memahami konsep-konsep abstrak pada
materi kesetimbangan kimia, sehingga siswa lebih mudah memahami
konsep-konsep tersebut, dan diharapkan prestasinya akan lebih meningkat. Dengan
kemampuan visualisasinya, maka penggunaan VBL diharapkan akan lebih
membuat siswa menjadi tertarik dan tidak merasa bosan, sehingga siswa akan
commit to user
Aktivitas belajar siswa sangat penting dalam proses pembelajaran, karena
tanpa aktivitas maka proses pembelajaran tidak akan berjalan dengan baik dan
tujuan pembelajaran akan sulit tercapai. Pada penelitian ini akan diterapkan
metode pembelajaran kooperatif GI yang akan dapat merangsang siswa untuk bisa
terlibat aktif di dalam aktivitas belajar.
Sehingga dengan adanya metode pembelajaran kooperatif GI yang
dilengkapi dengan media VBL ini diharapkan aktivitas belajar siswa dan juga
prestasi belajar siswa akan bisa meningkat.
Penelitian ini merupakan penelitian eksperimental dengan kerangka
pemikiran sebagai berikut:
Bagan 1. Kerangka Pemikiran Penelitian
C. Hipotesis
Hipotesis Penelitian ini adalah: “Metode pembelajaran GI yang dilengkapi dengan penerapan media VBL lebih efektif dalam pembelajaran Kimia pada pokok
bahasan Kesetimbangan Kimiadaripada model pembelajaran konvensional”
Keadaan Awal
Kelompok Eksperimen
Kelompok Kontrol
M etode GI yang
dimodifikasi dengan media VBL
M etode diskusi dilanjutkan ceramah
Prestasi
belajar kimia
commit to user 27 BAB III
METODOLOGI PENELITIAN
A. Tempat dan Waktu Penelitian
1. Tempat Penelitian
Penelitian ini dilaksanakan di SMA Negeri 1 Ceper, Klaten
2. Waktu Penelitian
Penelitian dilaksanakan pada semester ganjil tahun pelajaran 2009/2010 yaitu
pada bulan Oktober- November. Perincian dapat dilihat pada Tabel 1.
Tabel 1. Rincian Kegiatan Penelitian
No Kegiatan I II III IV V VI VII
1 Pengajuan Judul
2 Penyusunan Proposal
3 Try Out
4 PelaksanaanPenelitian
5 Analisis Data
6 Penyusunan Laporan
B. Metode Penelitian
Dalam penelitian ini menggunakan metode eksperimental dengan
Randomized Control Group Pretest-Postest Design.
Tabel 2. Rancangan Penelitian
Kelompok Pretest Treatmen Post test
Eksperimen T1 X T2
commit to user 28 Keterangan :
X : Metode GI yang dimodifikasi dengan media VBL
Y : Metode konvensional, yakni: kegiatan diskusi yang dilanjutkan ceramah
T1 : Pretest Kesetimbangan Kimia
T2 : Post test Kesetimbangan Kimia
(Sumadi Suryabrata, 2000 : 45)
Prosedur dalam rancangan ini adalah:
1. Memilih sejumlah subyek dari suatu populasi.
2. Mengelompokkan subyek tersebut menjadi dua kelompok, yaitu kelompok
eksperimen yang dikenai variabel perlakuan X, dan kelompok kontrol yang
dikenai perlakuan Y.
3. Memberikan pretest T1 pada kelompok eksperimen dan kelompok kontrol
untuk mengukur rata-rata hasil belajar sebelum subyek diberi perlakuan.
4. Memberikan perlakuan X pada kelompok eksperimen. Sedangkan pada
kelompok kontrol diterapkan perlakuan Y.
5. Memberikan Post test T2 pada kelompok eksperimen untuk mengukur
rata-rata hasil belajar yang dicapai setelah adanya perlakuan X.
6. Memberikan post test pada kelompok kontrol.
7. Menentukan selisih nilai antara T1 dan T2 pada kelompok eksperimen untuk
mengukur rata-rata selisih nilai Pretest-Post test (Z1)
8. Menentukan selisih nilai antara T1 dan T2 pada kelompok kontrol untuk
mengukur rata-rata selisih nilai Pretest-Post test (Z2)
9. Membandingkan Z1 dan Z2 untuk menentukan perbedaan yang timbul jika
sekiranya ada.
10.Menerapkan tes statistik yang sesuai untuk menentukan apakah perbedaan
commit to user 29
C. Populasi dan Sampel
1. Populasi Penelitian
Populasi yang digunakan dalam penelitian ini adalah siswa kelas XI IPA semester
ganjil SMAN 1 Ceper Klaten tahun pelajaran 2009/ 2010
2. Teknik Pengambilan Sampel
Pengambilan sampel dalam penelitian menggunakan teknik random sampling
dengan menggunakan dua kelas dari tiga kelas yang ada. Penetapan kelas sampel
dan kelas kontrol didasarkan pada nilai hasil ujian materi sebelumnya yang telah
dilakukan uji t-maching, sehingga kedua kelas mempunyai standar yang sama.
D. Variabel Penelitian
Variabel yang diguanakan dalam penelitian ini adalah sebagai berikut:
a. Variabel bebas
Sebagai variabel bebas dalam penelitian ini adalah penggunaan metode
pembelajaran kooperatif GI yang dimodifikasi dengan media VBL.
b. Variabel terikat
Variabel terikat dalam penelitian ini adalah aktivitas belajar siswa dan prestasi
belajar siswa pada materi pokok bahasan Kesetimbangan Kimia
E. Teknik Pengumpulan data
1. Sumber Data
Metode pengumpulan data yang digunakan adalah metode tes dengan jenis tes
obyektif. Semua data dikumpulkan dengan cara memberikan pretest pada kedua
kelompok sampel dan pemberian post test setelah pemberian materi
Kesetimbangan Kimia, juga pada kedua kelompok sampel.
2. Instrumen Penelitian a. Instrumen Kognitif
Instrumen dalam penelitian ini menggunakan soal-soal tes obyektif dengan lima
alternatif pilihan. Untuk mengetahui kelayakan instrument yang digunakan dalam
commit to user 30 a. Tingkat Kesukaran Soal
Tingkat kesukaran soal dapat ditunjukkan dengan indeks kesukaran yaitu
menunjukkan sukar mudahnya suatu soal, yang harganya dapat dicari dengan
rumus sebagai berikut:
IK =
Skor maksimal = besarnya skor yang dituntut oleh suatu jawaban benar dari
suatu item
N x skor maksimal = jumlah jawaban benar yang seharusnya diperoleh siswa
dari suatu item
Indeks kesukaran soal diklasifikasikan sebagai berikut:
0,81 – 1,00 = mudah sekali (MS)
0,61 - 0,80 = mudah (M)
0,41 – 0,60 = sedang/ cukup (Sd-C)
0,21 – 0,40 = sukar (S)
0,00 – 0,20 = sangat sukar (SS) (Ignatius Masidjo, 1995 : 189 – 192)
b. Daya Pembeda Soal
Rumus untuk menentukan daya pembeda soal adalah sebagai berikut:
ID =
KA = jumlah jawaban benar yang diperoleh siswa yang tergolong
commit to user 31
KB = Jumlah jawaban benar yang diperoleh siswa yang tergolong
kelompok bawah
NKA atau NKB = Jumlah siswa yang tergolong kelompok atas atau
kelompok bawah
NKA atau NKB x skor maksimal = Perbedaan jawaban dari siswa yang
tergolong kelompok atas dan bawah
yang seharusnya diperoleh
Klasifikasi daya pembeda soal adalah sebagai berikut:
0,80 – 1,00 = sangat membedakan (SM)
0,60 – 0,79 = lebih membedakan (LM)
0,40 – 0,59 = cukup membedakan (CM)
0,20 – 0,39 = kurang membedakan (KM)
Negatif – 0,19 = sangat kurang membedakan (SKM)
(Ignatius Masidjo, 1995 : 198 – 201)
C. Validitas
Validitas soal diuji dengan rumus korelasi produk moment, sebagai berikut
:
Rxy = koefisien korelasi suatu butir soal
X = skor item
Y = skor total
N = jumlah subyek
Kriteria pengujian
Jika rxy > rtotal maka item dinyatakan valid
Jika rxy < rtotal maka item dinyatakan tidak valid
Klasifikasi validitas soal adalah sebagai berikut:
commit to user 32 0,71 – 0,90 = tinggi
0,41 – 0,70 = cukup
Negatif – 0,20 = sangat rendah
(Ignatius Masidjo, 1995 : 243)
c. Reliabilitas
Untuk mengetahui reliabilitas soal digunakan rumus KR-20 sebagai
berikut:
R = kooefisien reliabilitas
n = jumlah item
S = deviasi standar
P = indeks kesukaran
Q = 1-p
Klasifikasi reliabilitas adalah sebagai berikut:
0,91 – 1,00 = sangat tinggi
0,71 – 0,90 = tinggi
0,41 – 0,70 = cukup
0,21 – 0,40 = rendah
Negatf – 0,20 = sangat rendah (Ignatius Masidjo, 1995 : 233)
b. Instrumen afektif
Instrumen penilaian afektif yang digunakan dalam penelitian ini berupa
angket. Jenis angket yang digunakan adalah angket langsung dan sekaligus
menyediakan alternatif jawaban. Siswa memberikan jawaban yaitu dengan
memilih salah satu jawaban yang telah disediakan. Penyusunan item-item
angket berdasarkan indikator yang telah ditetapkan sebelumnya. Dalam
menjawab pertanyaan, siswa hanya dibenarkan dengan memilih salah satu
commit to user 33 Digunakan menggunakan acuan sebagai berikut:
Tabel 3. Skor Penilaian Afektif
Pernyataan
Tidak Pernah (TP)
5
Sebelum digunakan untuk mengambil data penelitian, instrumen tersebut
diuji terlebih dahulu dengan uji validitas dan realibilitas untuk mengetahui
kualitas item angket.
1) Uji Validitas
Untuk menghitung validitas butir soal angket dicari dengan menghitung
indeks korelasi antara X dan Y yaitu dengan menggunakan rumus korelasi
product moment dengan angka kasar sebagai berikut:
( )( )
rxy : koefisien korelasi suatu butir soal (koefisien validitas)
X : skor butir item nomor tertentu Y : skor total
N : jumlah subyek Kriteria pengujian :
Kriteria item dinyatakan valid jika rxy > rtabel
Kriteria item dinyatakan tidak valid jika rxy ≤ rtabel