EKSTRAKSI DAN MANFAAT EKSTRAK MANGROVE
(Soniteratin nlba
dan
Sonneratia caseolaris)
SEBAGAI
BAHAN ALAMI ANTIBAKTERJAL: PADA PATOGEN
UDANG WINDU,
Vibrio Itnrveyi
OLEH
PARSIHOLAN EFFENDY NAIBORHU
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
PARSIHOLAN EFFENDY NAIBORHU. Ekstraksi dan Manfaat Ekstrak Mangrove
(So~u~eralia alba dan Sonneratia caseolaris) Sebagai Bahan Alami Antibakterial:
Pada Patogen Udang Windu, Vibrio harveyi. Dibimbing oleh Dr. Ir. DARNAS DmA, M.Sc dan Dr. Ir. SUKENDA, M.Sc.
Ulltuk mengetahui peranan ekstrak mangrove Sonneralia alba dan
S. ca.reolnris (daun, kelopak, buah dan biji) sebagai bahan alarni antibakterial
terhadap I/. haweyi, telah dilakukan percobaan uji daya hambat dengan difusi agar metode Kirby-Barier; metode hitu17gatl cmua17, metode n7ikrokoson7 dan analisis kualitatif senyawa aktif ekstrak mangrove. Dari hasil metode KirIy-barter denzan konsentrasi perlakuan 0.0 ; 0.3; 0.5; 1 . 0 0 10.0; 15.0; dan 20.0 (gll) diperoleh bahwa daya hambat ekstrak buah dan ekstrak kelopak kedua jenis So1717emlia terhadap pertumbuhan bakteri K harijeyi yang ditulijukkan dengan diameter zona hambat bakteri, lebih besar dibanding ekstrak biji dar! ekstrak daun. Konsentrasi terendah ekstrak yang dapat menghsmbat pertumbu'nzn bakteri V. harl~eyi pada metode ini adalah 1.0 g/l. Selanjutnya hasil ini dipertegas pada metode hitlingan
cawa17 dengan konsentrasi perlakuan yang dicobakan 0.5; 1.0; dan 3.0 (g ekstrak/l
SWC), dimana pada konsentrasi 1.0 g/l perlakuan ekstrak buah dan kelopak
S.
caseolaris tidak ditumbuhi koloniK
harveyi sementara pada ekstrak buah dankelopak S. alba, masing-masing terdapat 2 koloni sedangkan pada kontrol tanpa perlakuan ekstrak, terdapat 82 koloni K harveyi pada masa inkubasi 24-96 jam. Ekstrak buah dan kelopak S. caseolaris ini selanjutnya dicobakan pada metode
n~ikrokoson~ dengan konsentrasi perlakuan 0.5; 1.0; dan 3.0 (g/l). Hasil yang
SURAT PERNIrATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul:
EKSTRAKSI DAN MANFAAT EKSTRAK MANGROVE
( S o t ~ n c r ~ ~ t i n nlbn dan Sonnerntin cnseolnris) SEBAGAI BAHAN ALAMI
ANTIBAKTERIAL: PADA PATOGEN UDANG WINDU, Vibrio hnr~leyi
Adalah benar merupakan hasil k a ~ y a saya sendiri dan belum pernal~ dipublikasikan oleh orang lain. Semua sumber data dan inforn~asi yang digr~nakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
PARSIHOLAN E ~ E N D Y NAIBORHU
EKSTRAKSI DAN MANFAAT EKSTRAK MANGROVE
(Sonneratia alba
dan
Sonneratia caseolaris)
SEBAGAI
BAHAN ALAIMI ANTIBAKTERIAL: PADA PATOGEN
UDANG WINDU,
Vibrio Iznrveyi
PARSIHOLAN EFFENDY NAIBORHU
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Umu Perairan
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ekstraksi dan Manfaat Ekstrak Mangrove (Sontlelzrtin nlbn dan Sotmeratin cnseolcwis) Sebagai Bahan Alami Antibakterial: Pada Patogen Udang Windu, Vibrio hm~jeyyi
N a ~ n a : Parsiholan Effendy Naiborhu
NRP
: P19500022Program Studi . Ilmu Perairan
Menyetujui,
1. Komisi Pembimbing
Mengetahui,
2. Ketua Program Studi Ilmu Perairan r Program Pascasarjana
RIWAYAT HIDUP
PARSIHOLAN EFFENDY NAmORHU dilahirkan pada tanggal
9 November 1975 di Penlatang Siantar, Sumatera Utara. Mempakan anak ketujuh dari delapan bersaudara dari pasangan yang berbahagia Alm. Bapak S. Naiborhu dan Ibu R. br Sianipar.
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas berkat dan karunia-Nya sehingga tesis ini dapat diselesaikan. Adapun judul penelitian yang dilakukan sejak bulan Mei - Oktober 2002 ini ialah Ekstraksi dan Manfaat Ekstrak Mangrove (Sot~treratia alba dan Sonnerntia caseolwis) Sebagai Bahan Alami Antibakterial: Pada Patogen Udang Windu, Vibrio hnrileyi.
Pada kesempatan ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada orang tua, abang, kakak-kakakku dan adek Maria Manurung serta keluarga lainnya atas dukungan, perhatian dan doa yang tulus yang telah diberikan. Kepada Bapak Dr. Ir. Darnas Dana, M.Sc selaku Ketua Komisi pembimbing dan Bapak Dr. Ir. Sukenda, M.Sc selaku Anggota Komisi Pembin~bi~g, yang telah banyak membel-ikan himbingan, pexgarahan dan. motivasi yang tulus selan~a penelitian berlangsung hingga selesainya penulisan tesis ini.
Ucapan terimakasih juga peaulis sampaikan kepada pimpinan, staf, karyawan pada Program Pascasarjana. IPB serta seluruh jajaran dosen pada Fakultas Perikanan dan Ilmu Kelautan IPB, khususnya pada Program Studi Ilmu Perairan. Tidak lupa saya juga mengucapkan terimakasih kepada kepala dan teknisi Laboratorium Kesehatan Ikan, Jurusan Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan IPB, Laboratorium Balai Penelitian Bioteknologi Tanaman Pangan Bogor, Laboratorium Kimia Analitik, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, yang telah banyak memberikan bantuan dan dukungan selama penelitian dilaksanakan.
Ungkapan rasa terimakasih juga disampaikan kepada seluruh rekan-rekan ALR 2000, Bang Daniel Manurung, Lae Herbert, Ria, Shanty, KO Tigran-Lenny, Bapak Frankie, Bapak Gurgur, Bapak galung, Bapak Asda, Bapak sahala, Bapak Harold, Bapak Limbong, dan rekan-rekan laimya yang tidak dapat saya sebutkan satu persatu, yang telah banyak memberikan dukungan selama studi, penelitian dan penyususan tesis ini. Tidak lupa ucapan terimakasih kepada beasiswa BPPS yang memberikan keringanan biaya selama penulis menempuh program S2 di IPB.
Semoga karya ilmiah ini dapat bermanfaat. Akhir kata penulis mengucapkan banyak terimakasih
DAFTAR
IS1
Halaman
...
DAFTAR TABEL vi
DAFTAR GAMEL4R ... vii
...
DAFTAR LAMPIRAN ...
.
.
VIIIPENDAHULUAN 1
Latar Belakan 1
Perurnusan Masalah ... 2 Tujuan dan Manfaat ... 3 Hipotesis ... 4 TMJAUAN PUSTAKA ... 5
METODOLOGI ...
Waktu dan Tempat ...
Bahan dan Metode
...
Penyediaan Sampel
...
Ekstraksi...
Uji Daya Hambat Dengan D i s i Agar Metode Kirby-Bauer...
Uji Daya Hambat Dengan Metode Hitungan Cawan...
...
Uji Daya Mematikan Dengan Metode Mikrokosom
...
Analisis Kualitatif kandungan Bahan Aktif Ekstrak Mangrove
Analisis Data
...
HASIL DAN PEMBAHASAN
...
30Penyediaan Sampel 30
Ekstraksi ... 31 Uji Daya Hambat Dengan Dihsi Agar Metode Kirby-Bauer ... 33 Uji Daya Hambat Dengan Metode Hitungan Cawan ... 37 Uji Daya Mematikan Dengan Metode Mikrokosom
...
45Kandungan Bahan Aktif Ekstrak 48
...
DAFTAR
TABEL
Halaman
1. Perbandingan Berat Sampel Segar dengan Sampel Hasil Pengeringan
...
30 2. Berat Sampel Sebelum dan Sesudah Ekstraksi Menggunakan Soxhlet ... 32 3. Rata-rata diameter zona hambat pertumbuhan bakteri V. harveyi yangdiberi perlakuan ekstrak mangrove setelah inkubasi 24 jam pada suhu 25°C 33 4. Jumlah Koloni Bakteri V. harveyi yang tumbuh pada Uji Antibakterial
dengan Pemberian Ekstrak Keiopak dan Ekstrak Buah dengan Konsentrasi
...
0.5 g/I (ekstraW SWC padat) 38
5. Jumlah Koloni Bakteri V. harveyi yang tumbuh pada Uji Antibakterial dengan Pemberian Ekstrak Kelopak dan Ekstrak Buah dengan Konsentrasi
1.0 g/l (ekstraW SWC padat) ... 41 6. Jumlah Koloni Bakteri V. harveyi yang tumbuh pada Uji Antibakterial
dengan Pemberian Ekstrak Kelopak dan Ekstrak Buah dengan Konsentrasi
3.0 g/I (ekstraM SWC padat)
...
43 7. Pengaruh Pemberian Ekstrak Kelopak dan EkstrakBuahS.
caseolaristerhadap Pertumbuhan bakteri V. harveyi pada Media Air Laut ... 45 8. Kandungan Senyawa Bahan Alami Ekstrak Kelopak dan Ekstrak Buah
...
DAFTAR GAMBAR
1. Komunitas Hutan Mangrove Muara .4ngke ...
2. Mangrove So1n1erafia alba ... . . , , . . . . , . . . , . . . 3. Mangrove So1717erafin caseolaris ...
. .
..
. .. .
. . . ..
. . ..
. . . ..
. . ..
. . .4. Perakaran Jenis mangrove So17r7eratia (Pidada) ... ... . . . ... . .... .. . .... . ... .... .. .. . . 5. Sampel S. caseolaris
.. . .. .. . . . .. ... . . .. . .. . .
6. Sampel S. alba
7. Soxhlet
8. Penguap Putar Rotavapor (rotavapor) ...
9. Inkubator Water Bath
...
...10. Diagaram Perbandingan Diameter Zona Hambat Ekstrak
S.
alba ...1 1. Diagaram Perbandingar. Diameter Zona Hambat Ekstrak S. caseolaris ...
12. Diagram Jumlah Koloni V. harbeyi yang Tumbuh Pada Media Agar Dengan Konsentrasi Ekstrak 0.5 gA ...
13. Diagram Jumlah Koloni
V:
harbeyi yang Tumbuh Pada Media Agar Dengan Konsentrasi Ekstrak 1.0 g1114. Diagram Jumlah Koloni V. harbeyi yang Tumbuh Pada Media Agar Dengan Konsentrasi Ekstrak 3.0 g/i ...
15. Grafik Fluktuasi Pertumbuhan Bakteri pada Perlakuan Ekstrak Buah
. .
S.
caseolaris pada Med~a Atr Laut....
... . ... .... ... .... ... ... ... ...16. Grafik Fluktuasi Pertumbuhan Bakteri pada Perlakuan Ekstrak Kelopak
S. caseo1nr.i~ pada Media Air Laut
.
.
. . .. . . .
.17. Hasil Ekstraksi
18. Zona Hambat (Clear Zone ) Disekitar Kertas Cakaram ... 19. Media Mikrokosom (air laut) yang Telah Diberi J? har~jeyi ... 20. Uji Ekstrak Mangrove pada Metode Mikrokosom ... 21. Tidak Ditemukannya Koloni V. hanreyi pada Perlakuan Ekstrak Kelopak
-1
S. caseolmis pada Pengenceran 10 ... ... .... ... ... ... ....
...
.
22. Tidak Ditemukannya Koloni V. hanleyi pada Perlakuan Ekstrak Buah-1
DAFTAR LAMPIRAN
Halaman
I . Prosedur Pembuatan Media SWC (Sea Water Complete) Padat 100 %
Untuk 1000 ml ... 61 2. Prosedur Pembuatan Media Mikrokosom ... 62
PENDAHULUAN
L a t a r Belakang
Penyakit vibriosis pada udang baik itu di pembenihan maupun di tambak, merupakan salah satu jenis penyakit yang sering menyebabkan kerugian besar akibat kematian yang ditimbulkannya. Penyakit ini disebabkan oleh bakteri Vibr-io sp. dan serangannya dapat menyebar dalam waktu yang cepat. Beberapa spesies i~ibr-io yang ditemukan dan sering menimbulkan penyakit pada udang di tambak adalah Vibr-ic hnrileyi, V. par-ahaenrolyticrrs, K algi?lolylicrrs, K a~~griillnr-rim, % i~rih~inicris, dan
j7iii~inlis (Lightner, 1988 ; Boer dan Zafran, 1992).
Pencegahan penyebaran penyakit perlu dilakukan secara dini. Hal ini memerlukan diagnosis dan penanganan yang tepat. Upaya pencegahan dapat dilakukan dengan menggunakan antibiotik dan bahan kimia lainnya, namun dalam jangka waktu yang lama dapat menimbulkan efek negatif terhadap lingkungan
perairan dan menimbulkan resistensi patogen.
Salah satu bahan alami yang diketahui mengandung senyawa antibakterial adalah tumbuhan mangrove. Effendi dan Suhardi (1998) telah melakukan penelitian terhadap beberapa jenis mangrove (Xhizophora apinnrlata, Ai.ice17nia alba, Brrrgrriera aynlnorrhiza, dan Nypa fnrticans), dan tumbuhan ini mampu membunuh
serta menghambat pertumbuhan bakterl V. han~eyi dan V. parahaen7olyticrrs. Selain jenis mangrove tersebut, Sotn~eratia ovata juga inerupakan jenis tumbuhan mangrove
yang dapat membunuh serta menghambat pertumbuhan bakteri Aerontonns hydrophila (Naiborhu ef al., 1999).
Tumbuhan mangove selain dapat meningkatkan kesuburan perairan melalui serasah yang dihasilkannya, juga menghasilkan senyawa aktif seperti: saponin, flavonoid, oktakosil alkohol yang aktif sebagai senyawa antimikroba (Nursal el al., 1998)
Perurnusan Masalah
Kematian udang di tambak, sebagai akibat serangan penyakit yang disebabkan oleh infeksi bakteri, merupakan salah satu permasalahan yang timbul dalam usaha budidaya udang windu. Salah satu j e ~ i s bakteri yang sering menyebabkan kematian pada udang, khususnya pada tingkat larva, pascalarva dan juvenil, adalah
Vibrio hnrileyi.
tersebut Penggunaan bahan kimia dapat menimbulkan resistensi patogen, dampak lingkungan dan bahaya residu bagi konsumen
Untuk menghindari serangan infeksi bakteri tersebut, salah satu altematif yang dapat dilakukan adalah penggunaan bahan antibakterial lain yang bersifat alami dan efektif untuk membunuh dan menghambat pertumbuhan bakteri, ramah lingkungan dan mudah terurai di perairan.
Dari beberapa penelitian terhadap tumbuhan mangrove, diketahui bahwa tumbuhan ini merupakan bahan alami yang mengandung senyawa bioaktif seperti: saponin, tanin, flavonoid, diterpenoid, oktakosil alkohol yang aktif sebagai bahan antimikroba (Nursal el al., 1998)
Sor7neratia alba dan S. caseolaris adalah beberapa jenis tumbuhan mangrove
yang dapat ditemui di daerah pesisir sekitar tambak, namun keberadaan tumbuhan ini sebagai bahan antibakterial belum banyak diketahui. Untuk mengetahui potensi bahan aktif tumbuhan ini, sangat perlu dilakukan penelitian untuk mengendalikan infeksi bakteri V. han~eyi, patogen pada udang windu (Penaeus monodon).
Tujuan d a n Manfaat
Penelitian ini bertujuan untuk:
1. Menghasilkan ekstrak mangrove (So1717eratia alba dan S. caseolaris) serta mengetahui potensinya sebagai bahan alami antibakteri terhadap V. harveyi.
2. Mendapatkan bagian tumbuhan mangrove yang dicobakan yang memiliki kemampuan terbaik untuk membunuh dan menghambat pertumbuhan bakteri
5. Mengetahui senyawa bahan aktif yang terdapat pada tumbuhan mangrove terbaik yang telah dicobakan.
4.
Mendapatkan konsentrasi terendah yang nyata dapat menghambat dan tnembunuhbakteri
I.:
hnrljeyi.Hasil penelitian ini diharapkan dapat memberikan informasi penting tentang kemampuan bahan alami antibakteri yang terdapat pada tumbuhan Sot~neratia sp. dalam mengatasi masalah penyakit, khususnya akibat serangan bakteri V. har~~eyi.
Hipotesis
TINJAUAN PUSTAKA
Pengendalian Penyakit Bakterial
Pengendalian penyakit merupakan faktor yang sangat penting dalarn usaha budidaya perairan. Jika tidak ditangani secara dini dapat rnenirnbulkan kerugian yang besar (Sunaryanto dan Mintardjo, 1980). Usaha pengendalian harna dan penyakit ikan sebaiknya lebih ditekankan pada sistem pengendalian harna dan penyakit secara terpadu, tanpa rnensganggu ekosistern dan masyzrakat yang mengkonsumsinya. Dengan kata lain, jika masih ada cara yang dilakukar. untuk rnengztasinya dan ternyata rnasih rnemberikan hasil yang baik, tidak perlu digunakan obat-obatan kimia yang memiliki daya racun yang sulit terurai sehingga dapat mengganggu konsumen, baik cepat atau pun lambat (Taslihan, 1988).
Dalam kegiatan usaha budidaya ikan dan udang, penyakit dapat rnenyebabkan kerugian ekonomi akibat kematian yang ditimbulkannya. Tingkat kematian ikan dan udang selama di pembenihan maupun selama perneliharaan masih relatif tinggi yakni 30%
-
70% (Atmomarsono et al., 1993). Kematian ini terutama disebabkan adanya serangan parasit, virus maupun bakteri (Lightner, 1988)Banyak cara yang dilakukan oleh panti-panti pembenihan rnaupun pembesaran di Indonesia untuk mengatasi infeksi bakteri. Beberapa diantaranya
Penggunaan bahan-bahan kimia seperti pestisida juga banyak digunakan dalam pengendalian infeksi bakteri di tambak. Namun cara ini akan berbahaya jika tidak dilakukan secara terkontrol. Untuk meghindari akibat buruk yang disebabkan oleh pestisida keras, dapat digunakan pestisida organik atau pestisida alami. Pestisida alami mempunyai banyak keuntungan di antaranya mudah terdegragasi di perairan, sehingga dapat mengurangi pencemaran dan tidak membahayakan bagi lingkungan perairan (Suyanto dan Mudjiman, 1994 ; Nursal et a/., 1998). Lingkungan perairan yang tercemar akan mengganggu proses budidaya, oleh karena it9 air yang digllnakan untuk pemeliharaan biota air harus bersih dari segala bahan pencemar baik itu yang berasal dari mahbak hidup maupan dari komponen kimia lainnya (Murachman, 1995).
Bakteri Vibrio harveyi
Bakteri Vibrio tergolong dalam divisi Bakteria, klas Shyzomycetes, ordo Eubacterial, family Vibrionaceae dan genus Vibrio. Bakteri ini merupakan bakteri gram negatif, berbentuk sel tunggal, berbentuk batang pendek yang bengkok (koma) atau lurus, bersifat motil, oksidase positif, ukuran sel 1-4 mikron, fermentatif karbohidrat, berpendar dan mempunyai flagella di salah satu kutubnya (Kreig and Peter, 1984)
Bakteri Vibrio sp. merupakan bakteri patogen yang berbahaya bagi udang
windu. Bakteri patogen dapat dibedakan atas dua tipe yaitu patogen obligate dan
patogen non abligate. Patogen obligate yaitu patogen yang dapat menimbulkan
yaitu patogen yang dapat hidup dan berkembang baik itu di dalam inang maupun bebas diluar inang, seperti Vibrio sp.
Penularan penyakit bakterial dalam lingkungan perairan, dapat tejadi melalui kontak langsung dengan inang yang sakit, alat-alat yang digunakan, bagian sisa tubuh ikan, melalui hewan dan tumbuhan air serta air bekas ikan sakit (Dana dan Angka, 1990). 'Permukaan tubuh seperti kulit dan sirip adalah beberapa tempat media masuknya bakteri ke dalam tubuh inang, dan daerah ini dapat menjadi gerbang utama untuk menyebabkan infeksi. Pada saat kondisi kulit inang (kutikula) atau permukaan tubuh lainnya mengalami luka, maka sangat memungkinkan bakteri patogen untuk
masuk (Sukenda and Wakabayashi, 2001 ; Gilda et al., 1990). Beberapa spesies bakteri Vibrio sp. yang sering menyebabkan kematian pada fase larva, pasca larva adalah: Vibrio han~eyi, V. parahaemolyticus,
l?
alginolyticus,V.
anguillaruni, V.ioili~inicus, dan V. fluvialis (Boer dan Zafran, 1992).
Kendala utama yang dihadapi panti benih dalam memproduksi benih udang windu (Penaezis nzonodon ) adalah terjadinya serangan penyakit pada stadia larva.
Salah satu penyakit yang terkenal adalah penyakit kunang-kunang atau "li~niinescent iibriosi.~" (Lightner et a/., 1990 dalam Roza et al., 1997). Larva yang terinfeksi pada tingkat parah terlihat bercahaya pada kondisi gelap dan penyebabnya telah diidentifikasi sebagai
V.
harveyi. Selain menyebabkan hnang-kunang V. harveyijuga dapat menyebabkan bercak merah pada dasar bak pemeliharaan larva (Lavilla Pitogo et al., 1992; Roza et al., 1997).
Bakteri Vibrio sp. melakukan infeksinya ke dalam cairan tubuh larva dan
kromatofor, erosi eksoskeleton dan bentuk tubuh tidak normal (Sunaryanto ei al.. 1987) Sedangkan menurut Taslihan dan Sunaryanto (1992) kematian pada udang saat stadia larva sampai pasca larva ditandai dengan ciri-ciri: larva kelihatan lemah, tidak aktif berenang, nafsu makan kurang, tubuh dan antena benvarna merah, dan larva udang kelihatan menyala seperti yang disebabkan oleh bakteri V. harveyi.
Zoea adalah stadium yang paling rawan terhadap infeksi V. harveyi, karena pada stadia ini larva sudah mempunyai saluran pencernaan dan mulai aktif makan dengan cara menyaring air. Pada larva yang terinfeksi
!
l
har~~eyi terjadi penyusutan hepatopankreas dan perubahan warna menjadi coklat kehitaman (Roza et a/., 1997). Menurut Zafran dan Roza (1993)V.
harveyi akan bersifat patogen bagi larva udang windu apabila kepadatannya dalam air pemeliharaan mencapai 8.35x
l o 4
cWml. Hal ini senada dengan Prajitno (1995) yang mengatakan bahwa dengan kepadatan bakteri Vrbrio sp.l o 4
seVml, dapat menyebabkan kematian larva udang windu dalamwaktu 24 jam.
Prajitno (1995) mengatakan bahwa pada media agar V. harveyi dapat menghasilkan cahaya. Cahaya yang dihasiikan oleh bakteri ini diatur oleh sistem
Mangrove Sebagai Antimikrobial
Hutan mangrove atau hutan bakau adalah hutan yang terdapat pada areal pesisir dengan tanah lumpur atau pasir yang selalu dipengaruhi keadaan pasang sumt air laut. Ekosistem mangrove merupakan daerah peralihan (ekoton) yang unik, yang menghubungkan biota daratan dan lautan, dan hngsi hutan mangrove sangat khas yang kedudukannya tidak tergantikan oleh ekosistem lainnya (Nugroho el a/., 1991).
Melalui beberapa penelitian yang telah dilakukan, tumbuhan mangrove juga mem~liki manfaat yang besar sebagai bahan antihakterial melalui serasah yang jatuh
ke perairan. Naiborhu el al. (1999) telah menemukan adanya zat antibakterial yang terdapat pada kelopak putik Sonneratia ovala yang dapat menghambat serta membunuh bakteri Aeromonas hydrophila, dengan zona hambat bakteri 4 mm pada kondisi in vilro. Demikian pula halnya Nursal et al. (1998) juga telah menguji adanya kemampuan antibakterial mangrove Acanthus ilicifolius terhadap bakteri Vibrio sp.
Selain secara ekoiogi, mangrove mempunyai peranan untuk meningkatkan kesuburan perairan, melalui serasah yang dihasilkannya, tumbuhan ini dilaporkan banyak menghasilkan senyawa metabolit sekunder yang aktif sebagai senyawa antimikrobial. Ekstrak beberapa jenis tumbuhan mangrove, seperti Rhizophora sfylosa, Sonneratia griffilhi, Kendelia candel, Aegiceras ,floridunr, don Excoecaria
ngnllochn terbukti dapat menghambat pertumbuhan bakteri Stophylococczls aureus
(Leswara et al., 1987). Senyawa metabolit sekunder tersebut diduga tumt berperan
Dari hasil studi fitokimia diketahui beberapa tumbuhan mangrove mengandung senyawa metabolit sekunder yang terdapat pada berbagai organ tumbuhan terutama pada daun, akar dan bijinya. Misalnya pada akarnya dapat mengandung senyawa oktakosil, sligmasterol, bet~zoksnzolit~ - 2- one, stignlasteril g l z ~ k ~ p i l ~ ~ ~ o s i a . saponin danflavonoid (Kokpol and Chittawong, 1987 ; Minocha and Tiwari, 1981). Senyawa metabolit sekunder yang dihasilkan tumbuhan mangrove tersebut dapat dilepaskan ke lingkungan n~elalui penguapan, eksudat akar, pencucian dan pembusukan bagian tumbuhan yang telah mati (Rice, 1984).
Saenger et al. (1983) mencatat 67 macam produk yang dapat dihasilkan oleh ekosistem hutan mangrove dan sebagian besar telah dapat dimanfaatkan oleh
masyarakat, misalnya untuk bahan bakar (kayu api, arang dan alkohol), bahan bangunan, alat penangkapan ikan, makanan dan minuman, obat-obatan (gula, alkohol, minyak sayur dan cuka), peralatan mmah tangga, pupuk pertanian, produk kertas dan sumber daya d a m (ikan, udang, kerang, kepiting, bumng, mamalia dan reptil).
protein serta mencegah proses pencemaan bakteri; flavonoid yaitu senyawa yang mudah larut dalam air b e h n g s i untuk k e j a antimikroba dan antivirus, serta isoprenoid dengan turunan saponin titerpenoid yang merupzkan iritan yang kuat dan berperan sebagai antimikrobial.
Suatu senyawa antimikrobial yang terdapat pada tumbuhan mangrove dapat bersifat bakteristatik dan baskterisidal, bergantung kepada mekanisme dan konsentrasi obat. Obat dapat bersifat bakteristatik pada konsentrasi minimum tertentu dan jika bahan antimikrobial dihilangkan, perkembangbiakan bakteri akan berjalan kembali seperti semula (hanya b e h n g s i menghambat pertumbuhan bakteri). Akan tetapi obat yang bersifat bakterisidal akan mempunyai kemampuan untuk membunuh bakteri (Bailey and Scott, 1982).
Pertumbuhan bakteri dapat terhambat oleh beberapa ha1 di antaranya: perbedaan tekanan osmosis antara cairan di dalam dan di luar sel, tejadinya penggumpalan, terdenaturasinya protein di dalam sel bakteri, rusaknya membran sel karena iritasi, perubahan pH, tejadinya emulsi dan diksi cairan sel bakteri serta
terhambatnya pertumbuhan sel vegetatif dan spora dari bakteri (Salle, 1961 dalam Zulfarina, 1999). Senyawa yang dapat menyebabkan ha1 seperti tersebut di atas yaitu senyawa organik dan anorganik seperti: asam tenolat, glikosida, alkaloid, protein,
safoitin, ,flni~oiioid, terpenoid, steroid dan senya-*a logam yang terikat pada
senyawa organik.
Beberapa bahan aktif yang b e h n g s i sebagai bahan antimikroba yang terdapat dalam tumbuhan mangrove, seperti: $avonoid, saponin, diterpenoid, triterpenoid,
METODOLOGI
Waktu da11 Tenipat
Penelitiari ini dilakukan selama enam bulan, dari bulan Mei sanipai dengan Oktober 2002. Sarnpel mangrove Sotitierntin nlba dan S. cnseolnris diarnbil dari komunitas hutan mangrove Muara Angke, Jakarta Utara. Proses pengekstrakan dilakukan di Laboratorium Balai Penelitian Bioteknologi Tanaman Pangan Bogor. Uji antibakterial dilakukan di Laboratorium Kesehatan Ikan, Jurusan Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, sedangkan analisis kimia golongan ekstrak dilakukan di Laboratorium Kimia Analitik, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam , Institut Pertanian Bogor.
Bahan d a n Metode
Dalam pelaksanaan penelitian ini dilakukan beberapa tahapan kerja yaitu: (1) penyediaan sampel (2) ekstraksi. Sedangkan untuk mengetahui peranan ekstrak
mangrove (Sotnierntin nlbn dan
S.
cnseolaris), sebagai antibakterial terhadap bakteriI.:
hnrveyi dilakukan: (3) uji daya hambat ekstrak mangrove terhadap V. hflr~~eyidengan dihsi agar metode Kirby-Bnter (4) uji daya hambat ekstrak mangrove terhadap bakteri V. ha1 i~eyi dengan metode h ~ t l n ? g m ~ cntvnti (5) uji daya mematikan ekstrak mangrove terhadap bakteri
V.
hni?~eyi pada metode niikrokosoni danSampel diambil dari komunitas hutan mangrove Muara Angke, Jakarta Utara (Gnmbar 1). Jenis mangrove yang diambil adalah S. alba dan S. caseolaris (Gambar 2, 5 dan 4), sedangkan bagian tumbuhan yang diambil adalah: daun, kelopak, buah dan biji (Gambar 5 dan 6). Setelah sampel diambil, selanjutnya dibersihkan dari kotoran dengan menggunakan akuades dan kemudian dimasukkan k e dalam kantong plastik yang telah diberi label untuk seianjutnya dilakukan pengeringan.
Sebelum dilakukan pioses pengeringan, sampel mangrove segar tersebut ditimbang sebagai data perbandingan berat dengan sampel setelah kering nantinya. Proses pengeringan dilakukan dalam udara terbuka (kering udara) tanpa terkena cahaya matahari secara langsung, untuk rnenghindari kerusakan bahan aktif yang terdapat pada sampel (Harborne, 1984). Pengeringan dilakukan sarnpai sampel dapat diblender untuk dijadikan tepung halus, kira-kira selama 1 bulan. Berat sarnpel yang sudah kering tersebut kemudian dicatat dan selanjutnya dijadikan serbuk halus dengan cara diblender dan diayak dengan saringan halus.
2. Ekstraltsi
Pengekstrakan dilakukan dengan memasukkan serbuk halus sebanyak 15 g yang sudah dibungkus dengan kertas saring ke dalam tabung kaca soxhlet yang sudah berisi pelarut aseton. Selanjutnya proses ekstraksi dapat diamati dengan adanya mekanisnie pengikatan bahan aktif dan penguapan pelarut. Bahan aktif yang diikat o!eh pelarut aseton tersebut dialirkan ke dalam labu ekstrak Ekstraksi ini dilakukan sampai bahan aktif yang terdapat pada sampel habis terikat oleh aseton, kira-kira S jam. Hal ini ditandai dengan tidak terdapatnya lagi warna pada pelarut aseton saat pengikatan (bening tidak berwarna).
Setelah proses pengekstrakan, maserat kental yang dihasilkan selanjutnya dievaporasi menggunakan penguap putar (rotavapor) pada temperatur 5O0c untuk menghilangkan pelarut yang masih tersisa (Gambar 8). Selanjutnya untuk mendapatkan berat kering ekstrak tersebut, dilakukan pengeringan dalam oven.
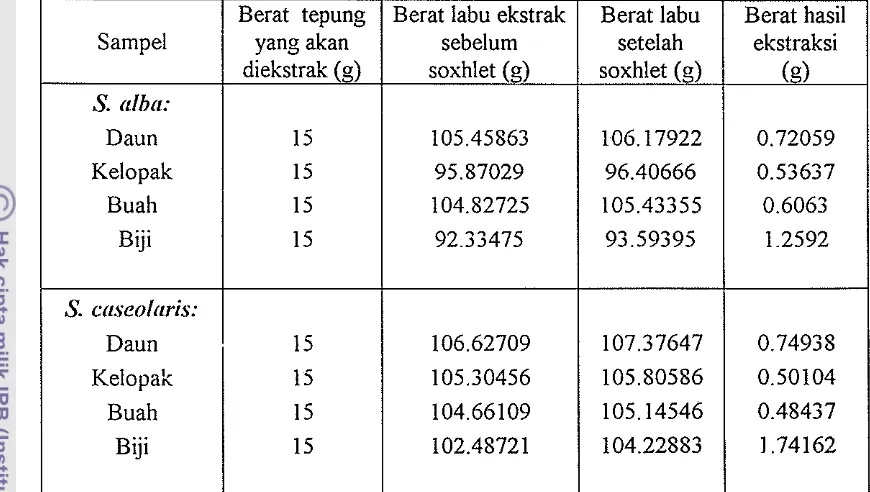
Berat hasil ekstraksi dari 15 gram sampel serbuk halus yang diekstrak diketahui dengan cara menghitung selisih berat labu ekstrak yang berisi hasil ekstrak dengan berat labu ekstrak kosong sebelum dilakukan proses ekstraksi.
Ekstrak kering ini selanjutnya dilamtkan dalam akuades dan diaduk merata sampai homogen hingga diperoleh konsentrasi stok ppm (mg/l) yang diinginkan. Sampel ekstrak mangrove yang tersedia inilah yang kemudian dicobakan pada uji antibakterial pada tahap selanjutnya. Untuk penggunaan dalam waktu yang relatif
3. Uji Daya Hambat Dengan Difusi Agar Metode Kirby-Bnuer
Setelah s e l u ~ h ekstrak sampel selesai, kemudian dilakukan pengujian. Uji antibakterial sampel dilakukan dengan terlebih dahulu mempersiapkan media agar SWC (Sea Water Complete) padat sebanyak 1000 ml sebagai media hidup !l hnrveyi dengan cara menghomogenkan bakto pepton sebanyak 5 g, yeast extract sebayak 1 g, 3 ml gliserol, 15-20 g agar bacto dan 250 ml akuades serta 750 ml air laut saring (Lampiran 1).
Setelah media SWC padat selesai, selanjiltnya bakteri V. hnrl~eyi diambil dari stok kultur murni lalu diinokulasikan pada meciia agar yang diberi label pada setiap cawan petri. Isolat bakteri diambil dengan menggunakan jamm ose yang telah dipanaskan pada api bunsen. Bakteri yang diperoleh diencerkan pada 10 ml larutan garam fisiologis dalam tabung reaksi dar, diaduk merata. Dengan menggunakan metode sebar pemukaan, bakteri dengan kepadatan 10' CFUIml diinokulasikan ke dalam media yang telah disiapkan sebanyak 0.1 ml dan diratakan dengan spreader (batang kaca bengkok) yang steril, kemudian cawan petri ditutup dan didiamkan selama 5 menit. Selanjutnya dilakukan uji antibakterial.
diinokulasikan bakteri, kemudian diinkubasi pada suhu 25°C selama 24 jam. Respon
adanya potensi antibakterial diketahui dengan mengkur diameter zona bebas bakteri di sekeliling kertas cakram yang kelihatan bening dan diukur luas daerah hambatnya (Lay. 1994).
Dari uji yang dilakukan ini, kemudian dipilih 4 contoh bagian mangrove yang memiliki kemampuan antibakterial terbaik. Keempat sampel yang diperoleh, selanjutnya dicobakan kembali dengan menggunakan metode hilrrnfgn~l cmontr.
4. Uji Daya Hambat Dengan Metode Hitutzgan Caivnn
Sampel mangrove yang telah diperoleh pada metode Kirby-Batrer, selanjutnya diuji pada metode hitii~igan cawan menurut Hadioetomo (1989). Setelah formulasi media SWC padat selesai (Lampiran 1) dan sudah disterilisasikan serta didinginkan, pada saat kondisi cair tersebut setiap sampel mangrove dengan konsentrasi yang telah ditentukan berdasarkan hasil pada metode Kirby-Bazter dicampur merata sedemikian rupa pada media SWC sehingga diperoleh konsentrasi perlakuan yang diinginkan. Selanjutnya media ini dituangkan pada cawan petri dan ditutup dibiarkan membeku. Setelah itu bakteri i/. hnnleyi dengan kepadatan 10' CFUIml yang diambil dari stok kultur murni yang telah diencerkan pada 10 ml larutan garam fisiologis diinokulasikan sebanyak 0.1 ml pada media agar yang telah diberi label pada setiap cawan petri, diratakan dengan spreader (batang kaca bengkok) yang steril, setelah itu
Respon adanya potensi antibakteri diketahui dengan menghitung jumlah koloni bakteri yang tumbuh pad2 media dengan membandingkan antara media yang diberi ekstrak mangrove dengan kontrol (tanpa pemberian ekstrak mangrove), serta membandingkan jumlah koloni antar periakuan konsentrasi sampel mangrove. Pada tahap ini percobaan dilakukan dengan ulangan 3 kali.
Dari tahap ini, kemudian diperoleh sampel mangrove yang memiliki kemampuan antibakterial terbaik untuk selanjutnya dicobakan pada media air laut yalig telah diturnbuhi bakteri T/: han~eyi.
5. Uji Daya Mematikan Dengan Ivletode Mikrokosonz
Sebelum percobaan ini dilakukan, terlebih dahulu dipersiapkan media mikrokosom. Media ini dibuat dengan menggunakan air laut steril sebagai media uji pertumbuhan bakteri (Lampiran 2). Setelah media mikrokosom selesai, selanjutnya sampel ekstrak mangrove dengan konsentrasi yang sudah disiapkan yang diperoleh berdasarkan acuan hasil pada metode hiturzgan cawart, dihomogenkan ke dalam mikrokosom tersebut. Selanjutnya bakteri T/: haweyi diambil dari stok yang telah ditumbuhkan pada media SWC cair (Lampiran 3) yang telah disaker selama 18 jam pada inkubator water bath (Gambar 9), dan dimasukkan pada media mikrokosom sehingga kepadatan bakteri pada media mikrokosom adalah 10' CFUIrnl.
mikrokosom (media air laut) dan dapat dibandingkan dengan kontrol tanpa diberi ekstrak mangrove. Dari tahap ini, dapat pula diperoleh konsentrasi ekstrak mangrove terkecil yang dapat membunuh bakteri dalam waktu 24 dan 48 jam.
6. Analisis Kualitatif Kandungan B a h a n Aktif Ekstrak Mailgrove
Analisa kualitatif kandungan bahan aktif golongan ekstrak mangrove yang juga berlaku untuk senyawa bahan alam, dilakukan iuengacu kepada prosedur
Harborne (1 984).
Untuk analisa kualitatif adanya nlknloid, dilakukan dengan menyediakan 1 gram sampel serbuk halus mangrove dan digiling bersama-sama pasir sambil dibasahi dengan 5 ml kloroform yang mengandung beberapa tetes amonia. Tambahkan lagi 5 ml kloroform dan beberapa tetes amonia, kemudian disaring ke dalam tabung reaksi. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes HzS04 2 M, kemudian dipisahkan lapisan asarnnya ke dalam tabung reaksi lain. Spot diteteskan pada spot plate dan ditambahkan 3 pereaksi Dragendrof, Mayer, dan
Wagner yang akan menirnbulkan wama bertumt-tumt endapan merah jingga, endapan putih dan endapan coklat. Sebagai standar digunakan daun tapak dara.
Pada spot plate pertama ditambahkan NaOH 10 %, timbulnya warna merah menandakan positif senyawa fenol hrdrokuinon. Pada spot plate kedua ditambahkan
1 tetes H2S04 pekat, timbulnya warna merah menandakan positif senyawaflnvonoid. Untuk mengetahui adanya senyawa triterpenoid dan steroid, dilakukan dengan menyediakan 1 gram serbuk halus mangrove dan ditambahkan etanol, kemudian dipanaskan dan disaring. Selanjutnya filtrat diuapkan dan ditambahkan eter Lapisan eter yang terbentuk dipipet dan diteteskan pada spot plate lalu ditambah
pereaksi LB (3 tetes asetat anhidrat dan 1 tetes &So4 pekat). Adanya friferperrord ditandai dengan timbulnya warna merah atau ungu. Sedan~kan adanya sterold ditandai dengan timbulnya warna hijau.
Uji flnl~onord, saponin, dan tanin dilakukan dengan menyediakan 1 gram serbuk halus mangrove dan dimasukkan k e dalam gelas piala lalu ditambah 12 ml air panas kemudian dididihkan selama 5 menit. Masukkan masing-masing 3 ml larutan ke dalam 2 tabung reaksi. Pada tabung reaksi 1 dimasukkan serbuk M g dan beberapa tetes HC1 pekat dan amil alkohol. Campuran dikocok dan dibiarkan memisah. Adanya fln~~orroid ditunjukkan dengan timbulnya warna merah coklat pada lapisan amil alkohol. Pada tabung reaksi 2 dilakukan pengocokan secara vertikal selama 10 detik dan dibiarkan selama 10 menit. Adanya busa yang stabil menunjukkan positif saponn7. Sisa campuran tadi dididihkan lagi selama 10 menit kemudian disaring. Pada filtrat ditambahkan beberapa ml larutan FeC13 1%. Timbulnya wama biru tua
Analisis Data
Dari tahapan yang dilakukan dalam percobaan di atas, maka analisis data yang dilakukan adalah:
1. Pada uji antibakterial metode Kirby-Bailer, variabel dan pengukuran yang dilakukan untuk mengevaluasi perlakuan adalah dengan mengukur diameter daerah jernih (zona bebas bakteri) yang tidak ditumbuhi bakteri disekeliling kertas cakram pada cawan petri (Lay, 1994). Data hasil pengainatan disajikan dalam bentuk tabel berdasarkan bagian ekstrak yang dicobakan, selanjutnya dilakukan analisis sidik ragam (ANOVA). Bila uji menunjukkan perbedaan yang nyata dimana F hitung > F tabel, maka kemudian dilakukan uji lanjut untuk menentukan perlahian rnana yang terbaik (Mattjik dan Sumertajaya, 2000)
2. Pada uji antibakterial rnetode hiiurzgan cawan, variabel dan pengukuran yang dilakukan adalah dengan menghitung jumlah koloni bakteri yang tumbuh pada media agar yang telah diinokulasi bakteri dan telah diberi ekstrak mangrove serta membandingkannya dengan kontrol. Perhitungan jumlah sel bakteri menggunakan colony forming units (CFUIml) dengan pengenceran (Lay, 1994)
Jumlah sel bakterilml = Jumlah koloni bakteri x Faktor pengencer
Data yang diperoleh disajikan dalam bentuk tabel berdasarkan bagian ekstrak yang dicobakan, selanjutnya dilakukan analisis sidik ragam (ANOVA). Bila uji menunjukkan perbedaan nyata dimana F hitung > F tabel, maka kemudian dilakukan uji lanjut untuk menentukan perlakuan mana yang terbaik (Mattjik dan Sumertajaya, 2000).
3. Pada metode mikrokosom variabel dan pengukuran yang dilakukan adalah sama dengan prinsip metode hitungan cawan yaitu menghitung jumlah sel bakteri yang hidup pada media air laut (mikrokosom) yang telah diberi ekstrak dan yang tidak diberi ekstrak, dengan menggunakan colony forming units (CFUIml). Data hasil pengamatan disajikan dalam bentuk tabel berdasarkan perlakuan yang dicobakan, selanjutnya digambarkan pada grafik. Respon antibakterial pada tahap ini dilihat dari grafik laju kematian bakteri berdasarkan selang waktu yang telah ditentukan. Data yang diperoleh dianalisis secara deskriptif dengan membandingkan antara perlakuan dan membandingkamya dengan kontrol. Respon antibakterial diperlihatkan dengan adanya penurunan populasi bakteri dalam mikrokosom.
Gambar 5. Sortrter(lti(l ~(~seoloris. Jenis mangrove ini ditandai dertgan gagang atau tangkai daun yang benvama kemerahan dan daunnya yang lebih memanjang yang membedakannya dengan S. alba.
Gambar 6. Sorznerrrtin nlbn. Jenis mangrove ini ditandai dengan tangkai daun benvarna putih kecoklatan dan daunnya agak melebar yang
Gambar 7. Soxhlet, yang digunakan untuk proses ekstraksi.
Gambar 8. Penguap putar (rotavapor), yang digunakan untuk evaporasi
HASIL DAN PEMBAHASAN
Penyediaan Sampel
Sampel mangrove yang diambil adalah Sotitlern/in nlbn dan S. cnseolnris. Bagian tumbuhan yang dicobakan: daun, kelopak, buah dan biji. Sebelum dilakukan proses pengekstrakan, sampel tumbuhan mangrove segar yang ban! diambil dari komunitasnya ditimbang beratnya, selanjutnya dikering udarakan selama 1 bulan tanpa terkena cahaya matahari secara langsung, kemudian ditimbang kembali beratnya setelah pengeringan.
Dari tahap pengeringan sampel mangrove ini, perbandingan berat sampel mangrove segar sebelum dilakukan proses pengeringan dengan sampel yang sudah kering yang akan dijadikan bubuk halus untuk diekstrak, dapat dilihat pada Tabel 1.
Tabel 1. Perbandingan berat sampel segar dengan sampel hasil proses pengeringan
Jenis sampei Sonneratin alba: Daun Kelopak Buah Biji
Berat sampel segar (g)
Berat gram sampel kering (Persentase) Daun Kelopak Buah Biji Sonneratia caseolaris:
I I
Dari Tabel 1 di atas, terlihat bahwa sampel mangrove yang sudah dikering udarakan memiliki persentase kisaran berat antara 30 % sampai 36 % dari berat sampel awal (kondisi segar sebelum proses pengeringan). Batas proses pengeringan sampel mangrove ini dilakukan sampai sampel dapat dihaluskan dengan blender. Sampel yang sudah kering tersebut kemudian dijadikan serbuk halus dengan cara diblender dan diayak dengan saringan halus. Serbuk halus inilah yang kemudian akan diekstrak.
Hafborne (1987) mengatakan bahwa sebelum ekstraksi, tumbuhan dapat dikeringkan. Bila ini dilakukan, maka pengeringan tersebut hams dilakukan dalam keadaan terawasi untuk mencegah tejadinya perubahan kimia yang terlalu banyak. Bahan hams dikeringkan secepat-cepatnya, tanpa menggunakan suhu tinggi, lebih baik dengan aliran udara. Setelah kering, sampel ini dapat disimpan dalam waktu yang lama sebelum dilakukan analisis. Cara ini banyak dilakukan untuk analisis bahan aktif seperti flavonoid, alkaloid, kuinon dan terpenoid.
Tabel 2. Berat sampel sebelum dan sesudah ekstraksi menggunakan soxhlet. Sampel S. ctlba: Daun Kelopak Buah Biji
yang akan sebelum setelah
105.45863 106.17922 95.87029 96.40666 104.82725 105.43355
92.33475 93.59395
Berat hasil ekstraksi
(9)
S. cctseolrtris:
Daun 106.62709 107.37647
Kelopak 15 105.30456 105.80586
Buah 15 104.66109 105.14546
Biji 15 102.48721 104.22883
Tabel 2 menunjukkan bahwa berat hasil ekstraksi berbeda-beda untuk tiap jenis sampel, meskipun waktu yang digunakan dalam proses ekstraksi sama (8 jam)
dan berat awal bubuk sampel sebelum diekstraksi juga sama (15 gram bubuk halus). Dan kedua jenis Sonneratia tersebut, sampel biji memiliki berat hasil
ekstraksi terbanyak dibandingkan dengan jenis sampel lainnya, sedangkan berat hasil ekstraksi terkecil untuk S. alba adalah kelopak, dan untuk S. caseolaris adalah buah. Besarnya berat hasil ekstraksi disebabkan oleh kemampuan pelarut aseton mengikat lebih banyak bahan aktif dari sarrpel.
Ekstrak kering ini selanjutnya dilarutkan dalam akuades dan dihomogenkan
sampai diperoleh konsentrasi stok ppm (mgll) yang diinginkan. Ekstrak yang tersedia
[image:128.595.85.520.111.357.2]Uji Daya H a m b a t Dengan Difusi Agar Metode Kirby-Bauer
Berdasarkan hasil pengujian yang dilakukan terhadap ekstrak yang dicobakan dengan metode Kirby-Rnrrel; diketahui bahwa seluruh sampel ekstrak (daun, kelopak,
buah dan biji) dapat menghambat pertumbuhan bakteri V. hnrveyi kepadatan 10' CFUIml yang disebar pada media SWC padat pada cawan petri, meskipun respon daya hambat berbeda pada setiap konsentrasi. Respon daya hambat terlihat dengan terbentuknya zona hambat (clear zone) disekitar kertas cakram (Gambar 18)
Hasil pengukuran diameter zona hambat bebas baktxi (clear zone) setelah diinkubasi 24 jam pada suhu 25"c dapat dilihat pada Tabel 3
Tabel 3. Rata-rata diameter zona hambat pertumbuhan bakteri K hnn~eyi yang diberi perlakuan ekstrak mangrove setelah inkubasi 24 jam pada suhu 25%
-
Diameter zona hambat (mm) pada masing-masingKeterangan: Konsentrasi ekstrak dalam gfl (ekstraklakuades), Ak (Akuades)
.-
Ekstrak sampel
konsentrasi ekstiak (dl)
20.0
( Ak)
15.0 3.0
1.0
Dari Tabel 3 di atas dapat dilihat bahwa pada kontrol (tanpa perlakuan ekstrak) tidak terdapat zona hambat bakteri, demikian pula halnya untuk perlakuan
0.3 dan 0.5 d l , sedangkan pada perlakuan 1.0 d l untuk ekstrak daun dan biji pada kedua jenis Sonrieralia tidak membentuk zona hambat namun pada ekstrak kelopak dan buah membentuk zona hambat dengan diameter 7 mm.
Pada S. caseolaris, secara keseluruhan dari setiap perlakuan yang dicobakan, diketahui bahwa ekstrak kelopak dan ekstrak buah membentuk zona hambat yang relatif sama kecuali pada perlakuan 10
dl,
dimana ekstrak kelopak membentukdiameter zona hambet 12 mm dan ekstrak buah 13 mm. Sedangkan untuk ekstrak daun dan ekstrak biji memiliki daya hambat berbeda.
Pada S. alba, untuk sampel ekstrak buah dan kelopak, juga membentuk zona hambat yang relatif sama kecuali pada perlakuan 3.0; 15.0; dan 20.0 d l . Sedangkan untuk ekstrak daun dan biji memiliki daya hambat yang berbeda.
Jika dibandingkan antara kedua jenis sorlneratia yang dicobakan dalam setiap
perlakuan, dapat diketahui bahwa ekstrak kelopak dan ekstrak buah pada masing-masing Soiirieratia tersebut, lebih aktif menghambat pertumbuhan bakteri
V.
hm~eyi dibandidgkan dengan ekstrak daun dan ekstrak biji. Terjadinyapenghambatan ini disebabkan oleh senyawa bahan aktif yang terdapat pada ekstrak
sampel mangrove tersebut
Untuk melihat perbandigan daya antibakterial pada masing-masing
Gambar 10. Diagram perbandingan diameterzona hambat
ekstrak Sonncrntin nibn
0.1 0.3 0.5 1 3 5 10 15 20
Konsentrasi ekstrak (gA)
Gmnbar 11. Diagrm perbmdingzu~ dizuneterzona hzunbat
sampel eks trxk Sor~rtcratia cascolaris
.. ...
Buah
...
Berdasarkan perbandingan daerah hambat, pada taraf kepercayaan 95%, perlakuan pemberian ekstrak pada kedua jenis Sonneratia berbeda nyata dengan kontrol. Dari uji lanjut Beda Nyata Terkecil (BNT) menurut Mattjik dan Sumertajaya
(2000). diketahui bahwa ekstrak kelopak dan buah merupakan perlakuan yang memiliki perbedaan nyata terbesar dibandin3 sampel lainnya, sementara antara ekstrak kelopak dan buah tidak tejadi perbedaan.
Terbentuknya zona hambat bebas bakteri melalui pengamatan daerah jernih di sekeliling kertas cakram, membuktikan adanya daya k e j a antimikrobial (Lay, 1994).
Uji antibakterial ini juga dilakukan oleh Effendi dan Suhardi (1998) melalui pengamatan zona bebas bakteri di sekitar kertas cakram, yang mencobakan daya antibakteriai mangrove Rhizophora apiailata, Awicennia alba, Bruguiera gymnorrhiza, d m N y p fruticans terhadap
K
prahaemolytias dan V: harveyi.Melalui pengukuran diameter dan luas daerah hambat bebas bakteri, akan dapat diketahui kemampuan suatu bahan dalam menghambat pertumbuhan bakteri (Naiborhu et al., 1999 ; Nursai et al., 1998). Tejadinya penghambatan dapat dibuktikan dengan terbentuknya daerah hambat di sekitar kertas cakram. Tejadinya penghambatan terhadap pertumbuhan bakteri ini disebabkan oleh pengaruh senyawa bioaktif yang terdapat pada ekstrak. Hal ini terbukti bahwa pada kontrol, bakteri dapat tumbuh dengan baik dan tidak teilihat adanya daerah hambat.
Berdasarkan data yang diperoleh pada Tabel 3, konsentrasi terendah ekstrak kelopak dan ekstrak buah pada kedua jenis Sonneratia, yang dapat menghambat pertumbuhan bakteri K harveyi adalah 1 g/l. Data yang diperoleh ini selanjutnya
menjadi acuan untuk penpjian berikutnya pada metode hitungan cawan.
Perlu diketahui bahwa pengamatan zona hambat bakteri di sekeliling kertas cakram akan sangat kelihatan pada ssat kondisi yang gelap, karena bakteri V. han~eyi adalah jenis bakteri berpendar atau kelihatan bercahaya, sehingga pada saat kondisi
gelap jelas bahwa di sekeliling kertas cakram yang membentuk zona hambat, tidak kelihatan cahaya sementara di luar zona hambat sangat jelas terlihat cahaya berwarna hijau terang
Uji Daya Hambat Dengan Metode Hitungnn Cn~vnn
Pada tahap ini konsentrasi ekstrak yang dicobakan niengacu kepada hasil pengujian metode Krrby-Bazrer dengan nilai konsentrasi terendah yang diperoleh, yang dapat menghambat pertumbuhan bakteri V. hanjeyi. Namun sebagai pembanding, konsentrasi yang dicobakan pada ekstrak kelopak dan ekstrak buah yang masing-masing dihomogenkan pada media SWC padat steril adalah: 0.5; 1.0; dan 3.0 gll (ekstrak sampell SWC padat).
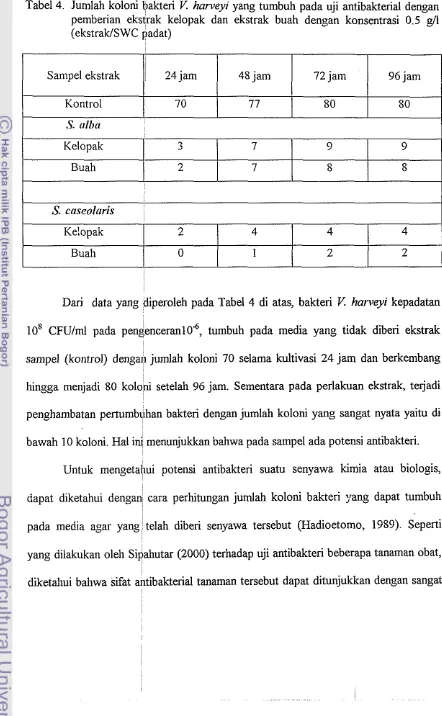
Tabel 4 Jumlah koloni bakteri V. hanjeyi yang tumbuh pada uji antibakterial dengan pemberian ekstrak kelopak dan ekstrak buah dengan konsentrasi 0.5 g/l (ekstraWSWC padat)
Sampel ekstrak Kontrol
Dan data yang diperoleh pada Tabel 4 di atas, bakteri
V.
han~eyi kepadatan 10' CFUIml pada pengenceranlOd, tumbuh pada media yang tidak diberi ekstrak sampel (kontrol) dengan jumlah koloni 70 selama kultivasi 24 jam dan berkembang hingga menjadi 80 koloni setelah 96 jam. Sementara pada perlakuan ekstrak, tejadi penghambatan perturnbuhan bakteri dengan jumlah koloni yang sangat nyata yaitu dibawah 10 koloni. Hal ini menunjukkan bahwa pada sampel ada potensi antibakteri. Untuk mengetahui potensi antibakteri suatu senyawa kimia atau biologis,
aapat diketahui dengan cara perhitungan jumlah koloni bakteri yang dapat tumbuh Kelopak
Buah
pada media agar yang telah diberi senyawa tersebut (Hadioetomo, 1989). Seperti
yang dilakukan oleh Sipahutar (2000) terhadap uji antibakteri beberapa tanaman obat, diketahui bahwa sifat antibakterial tanarnan tersebut dapat ditunjukkan dengan sangat
S crll)n
I
24 jam
1
48 jam [image:134.602.81.523.89.805.2]sedikitnya jumlah koloni bakteri yang tumbuh pada media agar dibandingkan dengan kontrol tanpa perlakuan pemberian ekstrak tanaman obat.
[image:135.602.98.523.220.600.2]Untuk melihat perbandingan daya antibakterial masing-masing perlakuan dapat dilihat pada Gambar 12.
Gambar 12. Diagamjumlah koloni I.'.hnr~~eyyi yang tumbuh pada
media agar dengn konsentrasi ekstrak 0.5 g/l
go -. ... .- ...
I I
Kontrol Kelopak S. alba Buah S. alba Kelopak S. Buah S. caseolaris caseolaris
Periakuan
Untuk S. nlba pada perlakuan ekstrak kelopak, terdapat 3 koloni selama kultivasi 24 jam dan berkembang menjadi 9 koloni setelah 96 jam. Sedangkan untuk eksktrak buah terdapat 2 koloni pada kultivasi 24 jam, dan pada jam ke 96
Pada S. cnseolaris, terdapat 2 koloni selama Axltivasi 24 jam dan berkembang
menjadi 4 koloni setelah 96 jam. Sementara untuk perlakuan ekstrak buah tidak ditemukan koloni bah~eri pada kultivasi 24 jam namun pada jam ke 96 terdapat 2 koloni. Data ini juga sekaligus membuktikan bahwa pada ekstrak terdapat bahan aktif yang dapat me~ighambat dan membunuh bakteri I/. har~leyi.
Dari hasil pengamatan ini terlihat bahwa pemberian ekstrak kelopak dan buah pada kedua jenis sorrrierntin, dapat b e h n g s i sebagai bahan antibakterial, terbukti dari perbandingan jurnlah koloni yang tumbuh pada media yang diberi perlakuan dengan
tanpa perlakuan (kontroi). Pada taraf kepercayaan 95 % jelas diketahui bahwa perlakuan sangat berbeda nyata degan kontrol. Perlakuan ini juga menunjukkan bahwa kemampuan antibakterial ekstrak buah dan ekstrak kelopak S. cnseolnris, lebih baik dibandingkan dengan ekstrak buah dan ekstrak kelopak S. nlba, dimana pada uji lanjut Beda Nyata Terkecil menurut Mattjik dan Surnertajaya (2000), diketahui antara perlakuan ekstrak kelopak dan buah
S.
caseolaris,
tidak terjadi perbedaan nyata.Selanjutnya untuk melihat daya antibakterial ekstrak kelopak dan ekstrak buah kedua jenis Soririerntia tersebut berdasarkan hasil konsentrasi terendah yang dapat menghambat pertumbuhan bakteri V. han~eyi pada metode Kirby-Bauer dan sebagai perbandingan bagi konsentrasi 0.5
gh
yang telah dicobakan di atas, maka dilakukan perlakuan konsentrasi 1.0 g/l.Hasil percobaan yang dilakukan dengan kepadatan bakteri V. han~eyi
Tabel 5. J~lmlah koloni bakteri K hnri1e)li yang tumbuh dengan pemnberian ekstrak kelopak dan ekstrak buah dengan konsentrasi 1.0 gll (ekstraMSWC padat)
I
I
I
I
I
Snmpel ekstrakI
24jam(
48 jamI
72jam/
96jamI
I I I
Untuk melihat perbandingan daya antibakterial pada masing-masing perlakuan dapat dilihat pada Gambar 13.
Icontrol
S. ctlseolriris
G'unbar 13. Diagalam junllah lioloni K 11rari~cj~i yang tumbuh pada media agar dengml konsent~xsi eltstlali 1.0 gll
Icelopak
[image:137.602.90.529.125.308.2]48 jam11
... 96 jam ...
75
Kontrol Kelopak S. alba Buah S, alba Kelopak S. Buah S. caseolaris caseolaris
Pcrlnkunn
.Y.
~ l b oBuah
1
0 0 080
Kelopak
0
82
Buah
1
1I
1I
7I
71
82
0 0
2
Dari data di atas, bakteri V. harveyi kepadatan 10' CFUIml pada pengenceran lo", tumbuh pada media yang tidak diberi ekstrak sampel (kontrol) dengan jumlah koloni 75 selama kultivasi 24 jam dan berkembang menjadi 82 koioni setelah 96 jam. Hal ini membuktikan bahwa pada media kontrol terdapat nutrien yang cukup untuk pertumbuhan bakteri, dan tidak ada senyawa aktif yang bersifat antibakterial terhadap
I.:
hnrileyi.Sama halnya pada perlakuan 0.5
dl,
pada taraf kepercayaan 95 % jelas diketahui bahwa semua perlakuan sangat berbeda nyata degan kontrol. Jika dilihat dari perlakuan ini, menunjukkan bahwa kemampuan antibakterial ekstrak buah dan ekstrak kelopak S. caseolaris pun lebih baik dibandingkan denyan ekstrak buah dan ekstrak kelopak S. albn, dimana pada uji lanjut Beda Nyata Terkecil menurut Mattjik dan Sumertajaya (2000), antara perlakuan ekstrak kelopak dan buah S. caseolaris tersebut tidak terjadi perbedaan nyata.Pada perlakuan
S.
alba pada perlakuan ekstrak kelopak dan ekstrak buah terdapat 1 koloni selama kultivasi 24 jam dan berkembang menjadi 2 koloni setelah 96 jam., sedangkan pada perlakuan ekstrak kelopak dan ekstrak buahS.
cnseolaris, tidak terdapat koloni bakteri V. harveyi selama kultivasi 96 jam.Selanjutnya untuk melihat pengaruhnya pada perlakuan konsentrasi ekstrak yang lebih tinggi, maka diuji kembali pada konsentrasi 3.0 d l . Hasil percobaan yang
Tabel 6. Jun~lah koloni bakteri V: hnnreyi yang tumbuh pada uji antibakterial dengan pemberian ekstrak kelopak dan ekstrak buah dengan konsentrasi 3.0 g/I (ekstrak1SWC padat)
Sarnpel ekstrak I<ontrol S. rrlbn Kelopak
Buah
Untuk melihat perbandinsan daya antibakterial pada masing-masing
S. caseoluris
-1
0 0 0perlakuan dapat dilihat pada Gambar 14 24 jam
90
0 0
[image:139.605.89.530.134.323.2]Buah
Gambar 14. Diag-am jumlah koloni K hmveyi yang tumbuh pada media agar d e n p n konsentrasi ekstrak 3.0
Sfl
Kontrol Kelopak S. alba Buah S. alba Kelopak S. Buah S.
caseolaris caseolaris
Perlakuan 48 jam
92
0
72 jam 92
0
96 jam 92 0 0 0 0 0 0
[image:139.605.86.520.416.806.2]Dari data pada Tabel 6 di atas, bakteri K han~eyi kepadatan 10' CFUIml pada pengenceranl~", tumbuh pada media yang tidak diberi ekstrak sampel (kontrol) dengan jumlah koloni 90 selama kultivasi 24 jam dan berkembang hingga menjadi 92 koloni setelah 96 jam. Sedangkan pada perlakuan ekstrak kelopak dan ekstrak buah pada kedua jenis so~rtleralia tersebut, tidak terdapat koloni bakteri K hnr~jeyi selama kultivasi 96 jam. Sama halnya dengan konsentrasi 1.0
dl,
perlakuan konsentrasi 3.0dl
juga dinyatakan bersifat antibakteri terhadap bakteri K har~~eyi. Hasil ini juga lebih mempertegas pendapat Nursal et al. (1998) bahwa dengan konsentrasi ekstrak yang semakin tinggi maka kemampuan antibakterial juga semakin besar.Ada beberapa mekanisme k e j a senyawa antimikroba yakni: penghambatan sintesis dinding sel, perubahan permeabilitas membran sel atau transpor aktif melalui membran sel, penghambatan sintesis protein yaitu penghambatan penejemahan dan transkripsi material genetik, dan penghambatan sintesis asam nukleat. Membran sel yang tesusun dari protein dan lipid rentan terhadap zat kimia yang dapat menurunkan tegangan permukaan. Kerusakan membran sel menyebabkan tidak berlangsungnya transport senyawa dan ion ke dalam sel bakteri sehingga bakteri mengalami kekurangan nutrisi yang diperlukan bagi pertumbuhannya dan akhirnya mati (Katzung, 1989 dnlanz Sipahutar, 2000 ; Volk and Wheeler, 1998).
Dari percobaan metode hitzrr~gan cmvan di atas, lebih dipertegas bahwa ekstrak kelopak dan ekstrak buah S. caseolaris lebih berpotensi sebagai bahan alami antibakterial dibandingkan dengan S. alba melalui mekanisme penghambatan pertumbuhan, terbukti pada saat perlakuan 1.0
dl
ekstrak kelopak dan buahditemukan koloni. Dari hasil tahap ini selanjutnya ekstrak kelopak dan ekstrak buah
S.
caseolwis di cobakan pada bakteri V. hariwyi yang telah ditumbuhkan pada mediaair laut, atau uji daya mematikan ekstrak mangrove pada metode mikrokosom
Uji Daya Mematikan Dengan Metode Mikrokoson~
Untuk mengetahui ke~narnpuan daya mematikan ekstrak kelopak dan ekstrak
buah S. ca.seoluris pada media air laut (Gambar 19 dan 20), Inaka pada tahap ini akan dilihat laju kematian bakteri setelah wakt~l pemberian ekstrak 0, 1, 3, 6, 12, 24 dan 4S jam (Tabel 7).
Tabel 7. Pengaruh pemberian ekstrak kelopak dan ekstrak buah S. cnseolnris
terhadap pertumbuhan bakteri V. hari)eyi pada niedia air laut
Waktu
12 24 4s
Jumlah sel bakterilml
Kontrol
2 . 0 . 10" 2.2 . 10" 2 . 8 . 10' 4 . 0 . 10" 6.0 . loG 2 . 6 . 10" 4.3 . 10"
Eksi 0.5
3.0. 10" 2 . 6 . lo7 7.4 . lo6 7 . 0 . lo5 6.5 . 10' 2.4 . 10' 3 . 2 . lo4
.ak kelo ak ( d l )
+-pr
Ekstrak buah ( d l )0.5 1 .O 3.0
I
I
Berdasarkan data pada Tabel 7 di atas, dapat diketahui bahwa perlakuan ekstrak kelopak dan buah dapat membunuh dan menghambat pertumbuhan V. hnr~leyi
[image:141.602.82.533.381.579.2]Untuk melihat lebih jelas perbedaan tingkat pengaruh perlakuan ekstrak pada
[image:142.602.76.514.167.806.2] [image:142.602.128.510.198.397.2]masing-masing konsentrasi, dapat dilihat Gambar 15 dan 16
Gambar 15. Glalik fluktuasi peltumbuha~ bakteli pada petiakual e ks t ~ a k buah S. caseok~ris pada media air laut
1 3 6 12 24