AKTIVITAS L-ASPARAGINASE HASIL FERMENTASI KEDELAI MENGGUNAKAN Rhizopus oligosporus
SKRIPSI
Oleh
TIFANI ISTIQOMAH NIM. 101810401001
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
AKTIVITAS L-ASPARAGINASE HASIL FERMENTASI KEDELAI MENGGUNAKAN Rhizopus oligosporus
SKRIPSI
diajukan guna melengkapi tugas akhir dan memenuhi salah satu syarat untuk menyelesaikan Program Studi Biologi (S1)
dan mencapai gelar sarjana Biologi
Oleh Tifani Istiqomah NIM 101810401001
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
ii
PERSEMBAHAN
Skripsi ini saya persembahkan dengan penuh rasa cinta, syukur, dan terima kasih Alhamdulillah yang sebesar-besarnya kepada:
1. Allah SWT. yang memberika segala rahmat dan rezeki-Nya;
2. bapak dan ibu tercinta, Bu Nunuk, beserta keluarga besar atas do’a dan dukungannya;
3. guru-guru dari taman kanak-kanak sampai perguruan tinggi yang telah memberikan ilmu yang bermanfaat;
MOTTO
Tidak ada yang mudah, tetapi tidak ada yang tidak mungkin (Napoleon Bonaparte)1
Tidak ada yang semenakutkan rasa takut, karena ketakutan diciptakan oleh pikiran kita sendiri
(Henry Thordeu)2
1
iv
PERNYATAAN
Saya yang bertanda tangan di bawah ini: Nama : Tifani Istiqomah
NIM : 101810401001
menyatakan dengan sesungguhnya bahwa karya ilmiah yang berjudul “Aktivitas L-Asparaginase Hasil Fermentasi Kedelai Menggunakan Rhizopus oligosporus” adalah benar-benar hasil karya ilmiah sendiri, kecuali jika dalam pengutipan substansi disebutkan sumbernya dan skripsi ini belum pernah diajukan pada institusi manapun serta bukan karya jiplakan. Penelitian ini dibiayai sepenuhnya oleh Esti Utarti, S.P., M.Si. Data yang diperoleh dari penelitian ini tidak dipublikasikan kecuali atas izin Esti Utarti, S.P., M.Si. Saya bertanggung jawab atas keabsahan isinya sesuai dengan sikan ilmiah yang harus dijunjung tinggi.
Demikian pernyataan ini saya buat dengan sebenarnya, tanpa adanya tekanan dan paksaan dari pihak manapun serta bersedia mendapat sanksi akademik jika ternyata kemudian hari pernyataan ini tidak benar.
Jember, 12 Mei 2015 Yang menyatakan,
SKRIPSI
AKTIVITAS L-ASPARAGINASE HASIL FERMENTASI KEDELAI MENGGUNAKAN Rhizopus oligosporus
Oleh Tifani Istiqomah NIM 101810401001
Pembimbing
vi
PENGESAHAN
Skripsi berjudul “Aktivitas L-Asparaginase Hasil Fermentasi Kedelai Menggunakan
Rhizopus oligosporus” telah diuji dan disahkan oleh Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember pada:
hari : tanggal:
tempat : Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember
RINGKASAN
Aktivitas L-Asparaginase Hasil Fermentasi Kedelai Menggunakan Rhizopus oligosporus; Tifani Istiqomah; 101810401001; 2015; 29 halaman; Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember.
L-Asparaginase merupakan enzim yang digunakan sebagai anti-tumor untuk pengobatan acute lymphoblastic leukimia (ALL) dan pengurangan pembentukan akrilamid pada makanan yang dapat menyebabkan kanker. Namun, penggunaan L-Asparaginase sebagai obat terapi ALL membutuhkan biaya yang besar. Oleh karena itu, diperlukan sumber L-Asparaginase yang lebih murah.
Salah satu sumber asparagin adalah kedelai. Asparagin merupakan asam amino non-esensial yang banyak terdapat pada kulit biji dan kotiledon kedelai. Kandungan asam amino yang tinggi menjadikan kedelai banyak dimanfaatkan sebagai substrat untuk produksi enzim karena selain memiliki kandungan protein tinggi, harganya juga murah. Salah satu mikroba yang berperan dalam proses fermentasi kedelai adalah Rhizopus oligosporus. Kemampuan R. oligosporus
menghidrolisis substansi nutrisi dalam substrat juga ditentukan ukuran dan bentuk partikel substrat. Oleh karena itu fermentasi kedelai menggunakan substrat berupa biji kedelai dan tepung kedelai (soybean meal). Kedua jenis substrat tersebut digunakan karena terdapat perbedaan ukuran dan bentuk substrat. Penelitian pendahuluan menunjukkan bahwa R. oligosporus mempunyai kemampuan menghidrolisis asparagin dalam media M9, sehingga diharapkan pada fermentasi kedelai menggunakan R. oligosporusdapat dihasilkan L-Asparaginase.
viii
semikuantitaif R. oligosporus dilakukan dengan menumbuhkan kapang pada media M9 modified (medium minimal M9 dengan penambahan asparagin 0.5% dan indikator phenol red). Enzim L-Asparaginase ekstrak kasar ditentukan aktivitasnya dengan metode Nesslerisasi amonia.
PRAKATA
Puji syukur kehadirat Allah SWT. atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas L-Asparaginase Hasil Fermentasi Kedelai Menggunakan Rhizopus oligosporus”. Skripsi ini disusun untuk memenuhi salah satu syarat menyelesaikan pendidikan strata satu (S1) pada Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember.
Penyusunan skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih kepada:
1. Drs. Rudju Winarsa M.Kes sebagai Dosen Pembimbing Utama, Kahar Muzakhar, S.Si., Ph.D sebagai Dosen Pembimbing Anggota yang telah meluangkan waktu, pikiran, dan perhatian dalam penulisan skripsi ini;
2. Drs. Siswanto M.Si sebagai Dosen Penguji I, Prof. Dr. Ir. Bambang Sugiharto, M.Agr.Sc sebagai Dosen Penguji II sekaligus sebagai Dosen Pembimbing Akademik yang telah memberikan saran dan kritik untuk kesempurnaan skripsi ini;
3. Esti Utarti, S.P., M.Si sebagai Pemberi dana dan Dosen Pembimbing, terima kasih atas arahan dan bimbingannya selama ini;
4. Ir. Endang Susetyaningsih sebagai teknisi Laboratorium Mikrobiologi terima kasih atas bantuan dan masukannya;
5. rekan kerjaku; Lai, Nyi Dini, Hachiko Mu’ammaroh, GusGus, terima kasih atas dukungan dan bantuan kalian selama proses penulisan skripsi ini;
6. Risa dan Tika yang selalu memberikan semangat;
7. seluruh teman angkatan 2010 “BOLU” yang selalu memberikan semangat dan keceriaan selama ini;
x
Penulis juga menerima segala kritik dan saran dari semua pihak demi kesempurnaan skripsi ini. Akhirnya penulis berharap, semoga skripsi ini dapat bermanfaat bagi semua pihak yang membacanya.
xii
3.3 Prosedur Penelitian...11
3.3.1 Peremajaan Isolat R. oligosporus...11
3.3.2 Uji Aktivitas R. oligosporussecara secara Semikuantitaif pada media M9 modified...…….11
3.3.3 Kurva Kepadatan Spora R. oligosporus...11
3.3.4 Pembuatan Inokulum R. oligosporus...12
3.3.5 Fermentasi Padat Kedelai menggunakan R. oligosporus...12
3.3.6 Ekstraksi L-Asparaginase ...13
3.3.7 Uji Kuantitatif L-Asparaginase...14
BAB IV. HASIL DAN PEMBAHASAN...15
4.1 Uji Semikuantitatif R.oligosporuspada media M9 modified...15
4.2 Pola Pertumbuhan berdasarkan Kepadatan Spora R. oligosporus...16
4.3 Fermentasi Padat Kedelai menggunakan R. oligosporus...17
4.4 Uji Aktivitas L-asparaginase...20
BAB V. KESIMPULAN DAN SARAN...24
5.1 Kesimpulan...24
5.2 Saran...24
DAFTAR PUSTAKA...25
DAFTAR TABEL
Tabel 2.1 Perbandingan Kadar Protein Kedelai dan Tempe ...7 Tabel 4.2 Perbandingan fisik kedelai dengan penambahan ragi dan spora ...18 Tabel 4.3 Aktivitas L-asparaginase kedelai, tepung kedelai tanpa inokulum R.
xiv
DAFTAR GAMBAR
Gambar 2.1 Reaksi hidrolisis Asparagin oleh Asparaginase ...4 Gambar 4.1 Uji Semikuantitatif L-Asparaginase R. oligosporuspada media M9
modified ...16 Gambar 4.3 Kurva Kepadatan Spora (Sel/ml) dengan waktu inkubasi 7 hari ...17 Gambar 4.4 Aktivitas L-asparaginase pada tepung kedelai dengan penambahan ragi
dan spora R. oligosporus ...21 Gambar 4.5 Aktivitas L-asparaginase pada kedelai dengan penambahan ragi dan
DAFTAR LAMPIRAN
A. KOMPOSISI BAHAN ...29
A.1 Komposisi Media PDA ...29
A.2 Komposisi Basal Mineral Mendell’s ...29
A.3 Komposisi Buffer Fosfat pH 8. ...29
A.4 Komposisi Media M9 modified...29
A.5 Komposisi Buffer Tris-HCl ...30
A.6 Komposisi TCA...30
A.7 Komposisi Media Produksi ...30
1
BAB I. PENDAHULUAN
1.1 Latar Belakang
L-Asparaginase merupakan enzim yang digunakan sebagai anti-tumor untuk pengobatan acute lymphoblastic leukimia (ALL) dan pengurangan pembentukan akrilamid pada makanan yang dapat menyebabkan kanker (Shukla and Mandal, 2013). Saat ini L-Asparaginase terdapat berbagai macam varian yang sangat penting untuk mengatur pengobatan pada pasien ALL dewasa maupun anak-anak (Rytting, 2012). Namun, penggunaan L-Asparaginase sebagai obat terapi ALL membutuhkan biaya yang besar (Kumar and Sobha, 2012). Oleh karena itu, diperlukan sumber L-Asparaginase yang lebih murah. L-asparaginase bekerja pada substrat spesifik yaitu L-asparagin.
Salah satu sumber L-asparagin yaitu kedelai. Kedelai (Glycine max) merupakan bahan pangan yang komponen utamanya protein dan lemak. Kandungan protein dan lemak kedelai berkisar 31%-35% dan 15.5%-24% (Zanetta et al, 2013). Hernández-Sebastià et al. (2005) menyatakan bahwa asparagin adalah asam amino yang dominan pada biji kedelai yaitu sebesar 38% dari 22 asam amino yang ditemukan pada pelindung biji kedelai.
Salah satu mikroba yang berperan dalam fermentasi kedelai adalah Rhizopus oligosporus.R. oligosporusmempunyai kemampuan menghidrolisis nutrisi kompleks seperti protein, lemak, dan karbohidrat yang terdapat pada kedelai menjadi nutrisi yang lebih sederhana. Komposisi asam amino kedelai hasil fermentasi oleh R. oligosporus mengalami fluktuasi, dengan kandungan tertinggi asam aspartat dan glutamat (Weng and Chen, 2011). Asam aspartat merupakan hasil hidrolisis asparagin oleh enzim L-Asparaginase. Penelitian pendahuluan menunjukkan bahwa R. oligosporus mempunyai kemampuan menghidrolisis asparagin yang terkandung dalam media M9 modified, sehingga diharapkan pada proses fermentasi tempe kedelai dengan menggunakan isolat murni R. oligosporus dapat dihasilkan L-asparaginase ekstraseluler.
Kemampuan R. oligosporus menghidrolisis substrat juga ditentukan ukuran dan bentuk partikel substrat. Hal itu terjadi karena ukuran dan bentuk partikel substrat akan mempengaruhi penetrasi hifa pada substrat untuk memperoleh nutrien sekaligus suplai oksigen (Mitchell et al., 2000). Oleh karena itu dilakukan produksi L-asparaginase menggunakan substrat berupa butiran kedelai dan tepung kedelai (soybean meal) untuk mengetahui pengaruh ukuran substrat pada produksi L-asparaginase oleh R.oligosporus.
1.2 Rumusan Masalah
1.3 Batasan Masalah
Batasan masalah dalam penelitian ini adalah pada uji aktivitas L-Asparaginase yang dihasilkan dari fermentasi kedelai. Pada penelitian ini dibatasi dengan penggunaan substrat berupa biji kedelai dan tepung kedelai yang diinokulasikan dengan isolat murni R. oligosporus dan waktu inkubasi selama produksi L-asparaginase hasil fermentasi kedelai oleh R. oligosporus. Sebagai pembanding digunakan tempe pasar jadi yang diambil secara acak. Selain itu proses fermentasi yang digunakan pada penelitian ini adalah fermentasi padat atau solid state fermentationkarena substrat yang dihasilkan semi-padat.
1.4 Tujuan
Penelitian ini bertujuan untuk mendapatkan L-Asparaginase asal kedelai dan tepung kedelai hasil fermentasiRhizopus oligosporus.
1.5 Manfaat
BAB II. TINJAUAN PUSTAKA
2.1 L-Asparaginase
L-Asparaginase merupakan suatu enzim yang mengkatalisis hidrolisis gugus amida dari L-Asparagin, menghasilkan Aspartat dan NH4+. L-Aparaginase
memanfaatkan nitrogen dari L-Asparagin dalam jaringan penyimpan pada tanaman. Selain itu, L-Asparaginase dapat meningkatkan jumlah asam amino bebas dan mempertahankan osmolaritas dalam sel (Cho et al., 2007).
Gambar 2.1 Reaksi hidrolisis Asparagin oleh Asparaginase
Aktivitas L-Asparaginase banyak ditemukan dalam ekstrak kedelai mulai daun hingga akar (Streeter, 1977). Saat ini, mikroorganisme terutama kapang berpotensi menghasilkan enzim L-Asparaginase. Berdasarkan Sundaramoorthi et al.
sesuai pengamatan dengan waktu inkubasi 96 jam pada suhu 30oC, dengan kelembaban 50%. Berbeda dengan yang dikemukakan oleh Hosamani dan Kaliwal (2011) bahwa hasil maksimum L-Asparaginase dicapai sesuai parameter optimasi fermentasi dengan masa inkubasi 48 jam, kelembaban (70% v/w), volume inokulum (20% v/w), ditambah glukosa (0.5% w/v), amonium sulfat (0.5% w/v), dan yeast ekstrak (0.5% w/v).
L-Asparaginase merupakan agen anti tumor untuk pengobatan Acute Lymphoblastic Leukimia (ALL) (Ahmad et al., 2013) dan membantu mengurangi pembentukan akrilamid penyebab kanker pada makanan (Shukla and Mandal, 2013). Saat ini L-Asparaginase terdapat dalam berbagai macam varian yang sangat penting untuk mengatur pengobatan pada pasien ALL dewasa maupun anak-anak (Rytting, 2012). Pada penderita leukimia, L-Asparaginase berperan sebagai penghalang. Ketika enzim L-Asparaginase disuntikkan, substrat L-Asparagin yang esensial untuk pertumbuhan sel tumor dapat dikurangi dan proliferasi tumor terhalang (Dhanam and Kannan, 2013).
L-asparaginase termasuk enzim yang penting dalam dunia pengobatan, menghidrolisis L-asparagin (asam amino essensial) menjadi asam aspartat dan amonia. Beberapa tipe sel tumor membutuhkan L-asparagin untuk sintesis protein, maka asparagin bersifat esensial pada pertumbuhan sel tumor ketika terdapat L-asparaginase, sehingga, menyebabkan sitotoksisitas terhadap sel leukimia (Jain et al., 2012).
2.2 Fermentasi Padat
dengan cairan (air dengan kandungan mineral tertentu) hingga diperoleh substrat semi-padat (Suhartono, 1989).
Fermentasi padat memiliki potensi yang luar biasa dalam produksi enzim. Faktor utama yang mempengaruhi mikroba mensintesis enzim dalam fermentasi padat yaitu pemilihan substrat dan mikroorganisme yang sesuai, pre-treatment
substrat, ukuran substrat (ruang inter partikel dan area permukaan dari substrat), kandungan air dan aw substrat, tipe dan ukuran inokulum, kontrol temperatur saat
proses fermentasi (Pandey et al., 1999).
Residu agro-industrial secara umum menjadi substrat terbaik untuk proses fermentasi padat dan produksi enzim. Fermentasi padat menghasilkan produk dengan konsentrasi tinggi yang membutuhkan energi relatif rendah (Soniyamby et al., 2011). Fermentasi padat tampil sebagai teknologi potensial untuk produksi produk dari mikrob dengan menggunakan material murah meriah (Hosamani and Kaliwal, 2011). Hosamani and Kaliwal (2011) menyatakan bahwa produksi L-asparaginase dengan fermentasi padat memiliki hasil yang optimal.
2.3 Kedelai dan Produk Olahannya
Kedelai (Glycine max) merupakan kelompok tanaman Legume yang komponen utamanya berupa lipid dan protein. Kedelai yang mempunyai kandungan nutrisi tinggi sering dijadikan berbagai produk olahan makanan. Produk olahan fermentasi seperti tempe, miso, kecap, dan natto. Tempe dibuat dengan metode konvensional 5% (107 CFU/mL) dari R. oligosporus pada suhu ruang selama 48 jam untuk membiarkan kapang dalam kedelai. Miselia menyebar ke seluruh kedelai dan menjadi padat disebut tempe.
Kedelai yang difermentasi diketahui memiliki kandungan nutrisi yaitu protein 25%, 5% lemak, 4% karbohidrat, mineral dan vitamin B12 (Dewi dan Aziz, 2011).
Secara kuantitatif, kandungan nutrisi kedelai yang difermentasi lebih rendah daripada kandungan kedelai yang tidak difermentasi. Namun, secara kualitatif kedelai yang difermentasi memiliki daya cerna yang lebih tinggi karena nutrisi mudah diserap tubuh. Berdasarkan tabel 2.1 menunjukkan bahwa komposisi protein, karbohidrat, dan lemak pada tempe lebih rendah daripada kedelai. Namun, kadar air dan berat tempe lebih besar daripada kedelai. Hal itu karena terdapat pertambahan massa disebabkan pertumbuhan kapang.
Tabel 2.1 Perbandingan Kadar Protein Kedelai dan Tempe
No Jenis Unsur Kedelai Tempe
Rahman et al., (2006) menyebutkan dalam penelitiannya bahwa kelembaban tempe meningkat 50.3% hingga 57.5% selama proses fermentasi. Aktivitas air (Aw) tempe 0.96 pada 0-6 jam dan menurun 0.94 setelah 25 jam. pH tempe meningkat selama proses fermentasi dari 6.87 hingga 7.35. Total protein protein diketahui sekitar 45% hingga 47% dari 0 hingga 48 jam.
difermentasi dan yang terfermentasi. Namun, sebagian besar jumlah asam amino akan dinaikkan ketika kedelai terfermentasi (Popoola and Akueshi, 1986).
Terdapat asam amino yang dominan yaitu 38% Asparagin dari 22 asam amino yang ditemukan pada pelindung biji kedelai. Kedelai sebagai sumber asparagin juga telah dibuktikan oleh Hernandez-Sebastia et al., (2005) bahwa asparagin merupakan asam amino yang banyak terdapat di dalam kotiledon dengan rata-rata 72% (dari sumber asam amino yang ditemukan) dengan jumlah 75 nmol mg-1.
Selain sebagai produk oalahan makanan, kedelai juga dimanfaatkan sebagai media produksi enzim L-asparaginase karena murah dan mudah didapat. Kedelai terbukti sebagai substrat terbaik untuk produksi L-asparaginase (Hosamani and Kaliwal, 2011). Baskar and Renganathan (2011) dalam penelitiannya menyebutkan bahwa substrat tepung kedelai sebagai substrat yang murah untuk produksi L-asparaginase.
2.4Rhizopus oligosporus
Rhizopus oligosporus merupakan kapang yang berperan dalam proses fermentasi kedelai. R. oligosporus dapat menghidrolisis substansi nutrisi kompleks seperti protein, lemak, dan karbohidrat yang terdapat pada kedelai menjadi nutrisi yang lebih sederhana. Kondisi optimal pertumbuhan R. oligosporus pada suhu 42-48oC dan pH 4. Rhizopus oligosporus tumbuh lebih cepat daripada kapang lainnya dan lebih cepat membentuk koloni pada substrat(Kovač and Raspor, 1997).
Secara umum, R. oligosporus memiliki warna konidia abu-abu kecoklatan dengan bentuk oval, globosa; klamidiospora berbentuk globosa, elip atau silindris; sporangiofor tunggal atau berkelompok (Wipradnyadewi et al., 2004). Correia et al.
BAB III. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2014 hingga Januari 2015 di Laboratorium Mikrobiologi Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Jember.
3.2 Bahan dan Alat Penelitian
Bahan yang digunakan pada penelitian ini yaitu isolat Rhizopus oligosporus
(koleksi Laboratorium Mikrobiologi, Jurusan Biologi, FMIPA Universitas Jember), kedelai, ragi tempe, PDA (Potato Dextrose Agar), aquades steril, basal mineral, pepton 0.75%, dan media M9 (Na2HPO4.2H2O 6 gr, KH2PO4 3 gr, NaCl 0.5 gr,
L-Asparagin 5 gr, 1 mol/L MgSO4.7H2O 2 mL, 0.1 mol/L CaCl2.2H2O 1 mL, agar 20
gr, dan pH 7 dalam 1 L aquades dengan Phenol red (2.5%): 0.04-0.36 mL), Buffer fosfat TRIS-HCl 0.50 mmol pH 8.5.
3.3 Prosedur Penelitian
3.3.1 Peremajaan Isolat Rhizopus oligosporus
Koleksi isolat R. oligosporus diinokulasikan pada media PDA miring dan dinkubasi selama 2x24 jam pada suhu 30°C sebagai stok isolat dan untuk uji lanjut.
3.3.2 Uji Aktivitas Rhizopus oligosporus secara Semikuantitaif pada media M9 modified
Isolat R. oligosporus yang telah dibuat stok kulturnya, dilakukan uji semikuantitatif pada media M9 modified untuk mengetahui indeks aktivitas enzim (IAE) L-Asparaginase. Uji semikuantitaif merupakan metode yang cepat dan produksi L-Asparaginase lebih tervisualisasi secara langsung (Gulati et al., 1996). Satu ose isolat diinokulasikan tepat di tengah media M9 modified dengan indikator
phenol red, kemudian diinkubasi pada suhu 30oC selama 2x24 jam. Setelah 48 jam, diamati kemampuan R. oligosporusdalam menghidrolisis asparagin yang terkandung dalam media M9 modified dan diindikasikan dengan terbentuknya zona pink di sekitar koloni. Aktivitas semikuantitatif R. oligosporusdidapatkan dengan mengukur diameter koloni dan diameter zona pink sehingga dperoleh nilai indeks aktivitas enzim dengan persamaan:
Kurva kepadatan spora R. oligosporus dibuat dengan mengkulturkan spora
Haemocytometerdan dihitung dengan menggunakan mikroskop. Spora yang dihitung adalah spora yang ada pada kotak sedang Haemocytometer. Perhitungan dilakukan sebanyak lima kali. Jumlah spora/ml sampel ditentukan dengan persamaan berikut:
S=
Keterangan: S= Jumlah spora/ml; n= Rerata jumlah spora pada bidang hitung; L= Luas bidang hitung (0.2 mm2); t= kedalaman bidang hitung (0.1); d= faktor pengenceran (10-1).
3.3.4 Pembuatan Inokulum Rhizopus oligosporus
Pembuatan inokulum diawali dengan pengukuran pertumbuhan R. oligosporus
yang sudah diremajakan pada media PDA miring, yang diinkubasi pada suhu 30oC selama 7 hari. Pengamatan dilakukan dengan menambahkan 9 ml aquades steril pada tabung kultur. Spora dikerik dengan jarum ose hingga merata. Suspensi spora yang didapat dipindahkan secara aseptis pada tabung steril dan dihomogenkan. 10µl suspensi spora diteteskan pada bidang haemacytometer. Dihitung dengan menggunakan rumus pada prosedur 3.4.3. Hingga didapatkan kepadatan spora 108 sel/ml.
Fermentasi padat menggunakan kepadatan spora berkisar 104 hingga 108 sel/ml. Mitchell et al., (2000) menyatakan bahwa kepadatan spora yang optimum digunakan berkisar 104 hingga 108 sel/ml karena jika kurang dari 104 biomassa spora tidak mencukupi untuk fermentasi, sedangkan jika melebihi 108 akan memicu pertumbuhan kontaminan.
3.3.5 Fermentasi Padat Kedelai menggunakanRhizopus oligosporus
kamar. Pemberian cuka berfungsi agar pH kedelai turun yang sesuai dengan pH tumbuh kapang. Kemudian kedelai yang sudah direndam ditiriskan, dikelupas kulit arinya dan disterilkan dengan autoklaf pada 121oC selama 15 menit. Fermentasi dengan substrat kedelai setelah dingin, sebanyak 10% inokulum R. oligosporus
dengan kepadatan sel 108 sel/ml diinokulasikan pada 500 gram kedelai dalam basal mineral (v/b) sebagai sumber karbon dan sumber energi. Fermentasi dilakukan pada suhu 30oC selama 6 hari (Cheng et al., 2011). Substrat tepung kedelai, setelah disterilisasi proses selanjutnya yaitu pengeringan, kemudian ditumbuk atau diblender untuk mendapatkan bubuk kedelai. Pada fermentasi dengan tepung kedelai, total media produksi yang digunakan 5ml dengan rincian (substrat 2.25 gram, mineral 2.25ml, dan ragi tempe atau spora R. oligosporus)
Ragi tempe digunakan sebagai kontrol baik fermentasi dengan kedelai ataupun tepung kedelai. Kedelai yang diinokulasi dengan spora isolat R. oligosporus
diberi nama kedelai spora R. oligosporus (KSR), sedangkan dengan kedelai yang diinokulasi dengan ragi tempe diberi nama kedelai ragi (KR).
3.3.6 Ekstraksi L-Asparaginase
Setelah masa inkubasi, enzim ekstrak kasar diekstraksi dari substrat menggunakan Buffer Fosfat 0.1M (pH 8) dengan perbandingan 1:2 untuk kedelai, sedangkan tepung kedelai dengan perbandingan 1:4 (Hosamani dan Kaliwal, 2011; Suresh and Raju, 2012) dalam substrat medium. Shaker selama 15 menit kemudian di sentrifuge 8000 rpm selama 20 menit. Supernatan yang dihasilkan diestimasi sebagai
)
Standart ammonium sulfat dibuat dengan mereaksikan 100µL ammonium sulfat dengan konsentrasi 5µM, 10µM, 15µM, 20 µM, 25µM, 30µM, dan 35µM. Setiap konsentrasi ditambahkan dengan reagen Nessler sebanyak 200µL dan 3.7 ml aquades steril. Campuran tersebut direaksikan selama 20 menit. Kemudian diukur OD dengan panjang gelombang 450 nm. Blanko disiapkan dengan penambahan 1 mL aquades (Kushwaha et al., 2012). Berdasarkan nilai absorbansi yang diperoleh dibuat kurva regresi linear yang menunjukkan hubungan antara konsentrasi dengan nilai absorbansi larutan sampel.
b. Uji Aktivitas L-asparaginase
15
BAB IV. HASIL DAN PEMBAHASAN
4.1 Uji Semikuantitatif Rhizopus oligosporuspada media M9 modified
Pada uji semikuantitatif, adanya zona bening di sekitar koloni R. oligosporus
menunjukkan bahwa R. oligosporus mampu mendegradasi asparagin yang terkandung dalam media M9 modified(terdiri atas mineral, asparagin dan Phenol Red sebagai indikator). L-asparagine dibutuhkan sebagai sumber nitrogen untuk sintesis protein dan kelangsungan hidup sel. L-asparaginase mengkatalis hidrolisis gugus amida dari L-asparagin menghasilkan aspartat dan NH4+ (Cho et al., 2007). NH4+
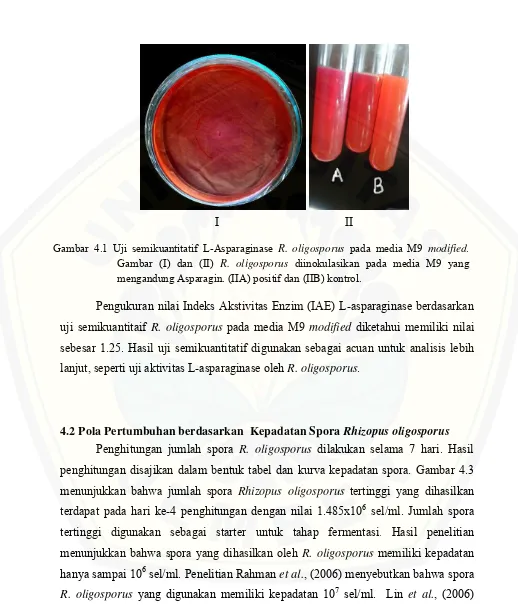
yang dihasilkan dari proses pemecahan tersebut menyebabkan perubahan pH pada medium. Hal ini dibuktikan dengan adanya perubahan warna dari jingga menjadi merah muda di sekitar koloni. Pada media M9 modified yang telah diinokulasi R. oligosporus gambar 4.1 (IIA), muncul perubahan warna menjadi merah muda di sekitar tusukan. Sebagai kontrol, media M9 modified tanpa inokulum tidak mengalami perubahan warna menjadi merah muda.
Perubahan warna dari jingga menjadi merah muda terjadi karena perubahan pH dari asam menjadi basa (IJIRSET, 2013). Struktur Phenol red (phenolsulfonphtalin atau PSP) terdiri atas gugus sulfat yang bermuatan negatif dan gugus keton yang bermuatan positif (H2+ PS-). Ketika pH meningkat, proton dari
Pengukuran nilai Indeks Akstivitas Enzim (IAE) L-asparaginase berdasarkan uji semikuantitaif R. oligosporus pada media M9 modified diketahui memiliki nilai sebesar 1.25. Hasil uji semikuantitatif digunakan sebagai acuan untuk analisis lebih lanjut, seperti uji aktivitas L-asparaginase oleh R. oligosporus.
4.2 Pola Pertumbuhan berdasarkan Kepadatan SporaRhizopus oligosporus
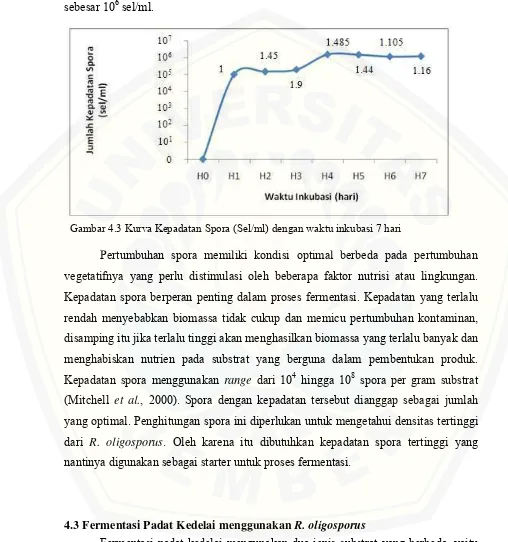
Penghitungan jumlah spora R. oligosporus dilakukan selama 7 hari. Hasil penghitungan disajikan dalam bentuk tabel dan kurva kepadatan spora. Gambar 4.3 menunjukkan bahwa jumlah spora Rhizopus oligosporus tertinggi yang dihasilkan terdapat pada hari ke-4 penghitungan dengan nilai 1.485x106 sel/ml. Jumlah spora tertinggi digunakan sebagai starter untuk tahap fermentasi. Hasil penelitian menunjukkan bahwa spora yang dihasilkan oleh R. oligosporus memiliki kepadatan hanya sampai 106sel/ml. Penelitian Rahman et al., (2006) menyebutkan bahwa spora
R. oligosporus yang digunakan memiliki kepadatan 107 sel/ml. Lin et al., (2006)
Gambar 4.1 Uji semikuantitatif L-Asparaginase R. oligosporus pada media M9 modified. Gambar (I) dan (II) R. oligosporus diinokulasikan pada media M9 yang mengandung Asparagin. (IIA) positif dan (IIB) kontrol.
menyatakan bahwa pada proses fermentasi kedelai kepadatan spora yang digunakan sebesar 106sel/ml.
Pertumbuhan spora memiliki kondisi optimal berbeda pada pertumbuhan vegetatifnya yang perlu distimulasi oleh beberapa faktor nutrisi atau lingkungan. Kepadatan spora berperan penting dalam proses fermentasi. Kepadatan yang terlalu rendah menyebabkan biomassa tidak cukup dan memicu pertumbuhan kontaminan, disamping itu jika terlalu tinggi akan menghasilkan biomassa yang terlalu banyak dan menghabiskan nutrien pada substrat yang berguna dalam pembentukan produk. Kepadatan spora menggunakan range dari 104 hingga 108 spora per gram substrat (Mitchell et al., 2000). Spora dengan kepadatan tersebut dianggap sebagai jumlah yang optimal. Penghitungan spora ini diperlukan untuk mengetahui densitas tertinggi dari R. oligosporus. Oleh karena itu dibutuhkan kepadatan spora tertinggi yang nantinya digunakan sebagai starter untuk proses fermentasi.
4.3 Fermentasi Padat Kedelai menggunakanR. oligosporus
Fermentasi padat kedelai mengunakan dua jenis substrat yang berbeda, yaitu kedelai berupa butiran dan tepung kedelai. Penggunaan dua jenis substrat yang
berbeda berfungsi untuk mengetahui kemampuan R. oligosporus menghasilkan L-asparaginase. Pandey et al., (1999) menyatakan bahwa ukuran partikel substrat dan inokulum berpengaruh dalam proses fermentasi.
Hasil fermentasi menggunakan substrat kedelai disebut dengan tempe, sedangkan hasil ferementasi menggunakan tepung kedelai disebut dengan soybean meal. Kedelai ataupun tepung kedelai diinokulasi dengan dua jenis inokulum, yaitu ragi tempe dan spora isolat R. oligosporus. Secara fisik tidak ada perbedaan, hanya saja saat sudah menjadi tempe memiliki aroma yang berbeda. R. oligosporus yang digunakan memiliki kepadatan spora 106 sel/ml sesuai hasil penghitungan kepadatan spora.
Tabel 4.2 Perbandingan fisik kedelai dengan penambahan ragi dan spora
Nama Warna Penampakan Aroma Keterangan
kapang (isolat R. oligosporus). Secara kualitatif kedelai spora memiliki aroma khas tempe yang lebih keras daripada KR. Hal itu dikarenakan komposisi dan kemurnian dari ragi tidak konsisten sehingga tempe yang dihasilkan memiliki kualitas organoleptik yang beragam (Karsono et al., 2009).
Tempe hasil fermentasi oleh R. oligosporus secara fisik lebih baik daripada ragi tempe. Hal tersebut disebabkan pada ragi tempe isolat yang digunakan lebih dari satu jenis mikroorganisme (kapang, yeast, dan bakteri), kemungkinan produk yang dihasilkan saling menghambat masing-masing spesies. Weng and Chen (2011) menyebutkan dalam penelitiannya bahwa dalam proses fermentasi kedelai, pertumbuhan R. oligosporus terhambat karena adanya aktivitas Bacillus substilis. Oleh karena itu, tempe hasil fermentasi menggunakan R. oligosporus memiliki kualitas fisik lebih baik karena hanya satu jenis kapang (isolat R. oligosporus) yang tumbuh, sehingga pertumbuhannya lebih optimal.
Aroma khas tempe disebabkan karena terdapat senyawa ester yaitu metil asetat pada kedelai (Feng et al., 2007). Jelen et al., (2013) menyebutkan dalam penelitiannya bahwa saat fermentasi kedelai terjadi ditemukan senyawa aromatik seperti asetil-1-pirolin, etil-3,5-dimetilpirazin, dimetil trisulfida, metional, 2-metilpropanal, dan (E,E)-2,4-decadienal.
Hal itu juga berlaku untuk tepung kedelai. Tepung kedelai yang diinokulasikan dengan spora isolat R. oligosporus memiliki aroma khas tempe yang lebih tajam daripada tepung kedelai yang diinokulasikan dengan ragi tempe. Sedangkan untuk penampakannya sama.
Kedelai sebagai sumber nitrogen diperoleh dalam bentuk senyawa asam amino yang memungkinkan ragi tempe ataupun R. oligosporus mensintesis L-asparaginase dengan memanfaatkan asam amino seperti L-asparagin yang jika terhidrolisis akan melepaskan nitrogen dalam bentuk NH3. Nitrogen dalam bentuk
NH3 ini digunakan untuk sintesis protein dan kelangsungan hidup sel. Selama proses
proses tersebut terjadi pelepasan ammonia saat deaminasi asam amino (Aoki et al., 2003).
Hasil fermentasi padat dengan substrat kedelai dan tepung kedelai akan diekstraksi dengan menggunakan Buffer Fosfat pH 8. Penggunaan buffer fosfat pH 8 karena L-asparaginase lebih stabil pada pH alkali (IJIRSET, 2013). Oleh karena itu digunakan buffer fosfat pH 8 untuk menjaga kesetimbangan L-asparaginase.
4.4 Uji Aktivitas Kuantitatif L-asparaginase
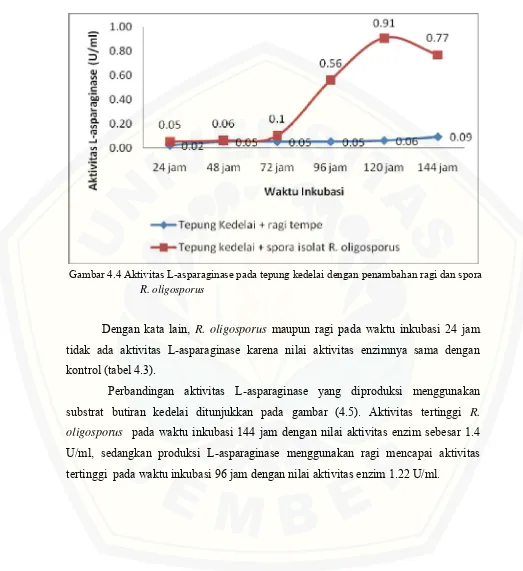
Kemampuan R. oligosporus dan ragi dalam menghasilkan L-asparaginase menggunakan medium tepung menunjukkan hasil yang berbeda dibandingkan pada saat menggunakan kedelai. Pada Gambar 4.4 dapat dilihat bahwa aktivitas enzim tertinggi menggunakan substrat tepung yang dihasilkan oleh R. oligosporus pada waktu inkubasi 120 jam dengan aktivitas enzim 0.91 U/ml. Pada penggunaan ragi, L-asparaginase yang dihasilkan menunjukkan aktivitas enzim tertinggi sebesar 0.09 U/ml selama inkubasi 144 jam.
Dengan kata lain, R. oligosporus maupun ragi pada waktu inkubasi 24 jam tidak ada aktivitas L-asparaginase karena nilai aktivitas enzimnya sama dengan kontrol (tabel 4.3).
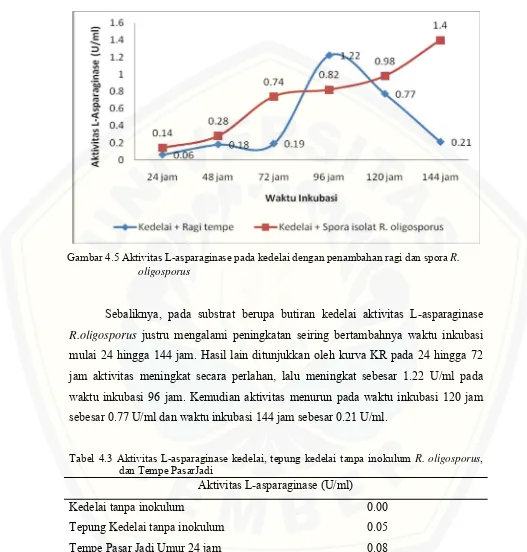
Perbandingan aktivitas L-asparaginase yang diproduksi menggunakan substrat butiran kedelai ditunjukkan pada gambar (4.5). Aktivitas tertinggi R. oligosporus pada waktu inkubasi 144 jam dengan nilai aktivitas enzim sebesar 1.4 U/ml, sedangkan produksi L-asparaginase menggunakan ragi mencapai aktivitas tertinggi pada waktu inkubasi 96 jam dengan nilai aktivitas enzim 1.22 U/ml.
Gambar 4.4 Aktivitas L-asparaginase pada tepung kedelai dengan penambahan ragi dan spora
Sebaliknya, pada substrat berupa butiran kedelai aktivitas L-asparaginase
R.oligosporus justru mengalami peningkatan seiring bertambahnya waktu inkubasi mulai 24 hingga 144 jam. Hasil lain ditunjukkan oleh kurva KR pada 24 hingga 72 jam aktivitas meningkat secara perlahan, lalu meningkat sebesar 1.22 U/ml pada waktu inkubasi 96 jam. Kemudian aktivitas menurun pada waktu inkubasi 120 jam sebesar 0.77 U/ml dan waktu inkubasi 144 jam sebesar 0.21 U/ml.
Tabel 4.3 Aktivitas L-asparaginase kedelai, tepung kedelai tanpa inokulum R. oligosporus, dan Tempe PasarJadi
Aktivitas L-asparaginase (U/ml)
Kedelai tanpa inokulum 0.00 Tepung Kedelai tanpa inokulum 0.05 Tempe Pasar Jadi Umur 24 jam 0.08
Tabel 4.3 menunjukkan bahwa kedelai tanpa inokulum memiliki aktivitas L-asparaginase 0.00 U/ml pada jam ke-0. Jika dibandingkan dengan kontrol (kedelai tanpa inokulum) pada waktu inkubasi 24 jam baik R. oligosporusmaupun ragi sudah menunjukkan aktivitas, walaupun sangat kecil.
Tabel 4.3 menunjukkan bahwa tempe pasar jadi berumur 24 jam (1 hari) memiliki aktivitas L-asparaginase sebesar 0.08 U/ml. Hasil tersebut menunjukkan bahwa nilai aktivitas L-asparaginase tempe pasar jadi lebih kecil daripada kedelai yang diinokulasikan dengan spora isolat R. oligosporus.
Hasil uji aktivitas L-asparaginase dari substrat kedelai yang berupa butiran dan tepung, terlihat bahwa aktivitas tertinggi dihasilkan oleh R. oligosporus yang diinokulasikan pada substrat kedelai butiran daripada tepung. Hal itu disebabkan karena kondisi pertumbuhan dari R. oligosporus. Miselia lebih padat pada substrat butiran daripada tepung, karena kapang umumnya bersifat aerob sehingga ketika pada substrat tepung kedelai ditambahkan basal mineral menyebabkan substrat semakin padat. Hal tersebut menyebabkan miselia sulit untuk penetrasi ke dalam substrat tepung kedelai. Oleh karena sifat kapang yang aerob, maka perlu aerasi yang cukup untuk menunjang pertumbuhan.
Saat uji aktivitas, L-asparaginase dideteksi dengan L-asparagin sebagai substrat spesifik. L-asparaginase mengkatalis hidrolisis gugus amida dari L-asparagin menghasilkan aspartat dan NH4+(Cho et al., 2007). NH4+ yang dilepaskan ini akan
bereaksi dengan reagen Nessler membentuk senyawa berwarna kuning hingga merah bata. Perubahan warna tersebut terjadi ketika reagen Nessler (K2HgI4) bereaksi
dengan amonia yang ada dalam sampel akan menghasilkan kalium iodida (KI). KI diperlukan untuk menjaga stabilitas, tetapi jumlah KI yang terlalu rendah mempengaruhi intensitas warna amonia (Leonard, 1961). Intensitas warna dari kuning hingga merah bata berpengaruh langsung terhadap konsentrasi amonia (Jeong
BAB V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan yang didapat dari penelitian ini adalah kedelai berupa biji ataupun tepung dapat digunakan sebagai substrat untuk produksi enzim L-Asparaginase oleh
Rhizopus oligosporus. Namun, keduanya memiliki perbedaan terhadap jumlah L-asparaginase yang dihasilkan. Aktivitas L-Asparaginase optimum dihasilkan oleh
Rhizopus oligosporus yang diinokulasikan pada substrat kedelai sebesar 1.40 U/ml dengan waktu inkubasi 144 jam, sedangkan pada tepung kedelai sebesar 0.91 U/ml dengan waktu inkubasi 120 jam.
5.2 Saran
DAFTAR PUSTAKA
Ahmad, A., A.M. Patta, and H. Natsir. 2013. Purification and Immobilization of L-Asparaginase Enzyme From The Thermophilic Bacteria Bacillus licheniformis Strain HSA3-1a. Int. J. Pharma. Bio. Sci. 2013 Oct; 4(4): (B) 274-280; ISSN 0975-6299.
Alhussaini, Mohammed S. 2013. Mycobiota of Wheat Flour and Detection of α -Amylase and L-Asparaginase Enzymes. Life Science Journal2013; 10(1).
Aoki, H., I. Uda, K. Tagami, Y. Furuya, Y. Endo, and K. Fujimoto. 2003. The Production of a New Tempeh-like Fermented Soybean Containing a High
Level of γ-Aminobutyric Acid by Anaerobic Incubation with Rhizopus.
Biosci. Biotechnol. Biochem., 67 (5), 1018-1023, 2003.
Baskar, G. and S. Renganathan. 2011. Screening of Supplementary Nitrogen Source for Fungal L-Asparaginase Production from Soya Bean Meal Flour Using Latin Square Design. Inter. Journal of Res. In Biotech and Biochemistry 2011, 1(1) 1-7.
Cheng, K.C., J.T. Lin, and W.H. Liu. 2011. Extracts From Fermented Black Soybean Black Soybean Milk Exhibit Antioxidant and Cytotoxic Activities. Food Technol. Biotechnol.49 (1) 111-117 (2011), ISSN 1330-9862.
Cho, C.W., H.J. Lee, E.S. Chung, K.M. Kim, J.E. Heo, J.I. Kim, J.I. Chung, Y. Ma, K. Fukui, D.W. Lee, D.H. Kim, Y.S. Chung, and J.H. Lee. 2007. Molecular Characterization of The Soybean L-Asparaginase Gene Induced by Low Temperature Stress. Mol. Cells, Vol.23, No.3, pp. 280-286.
Correia, R.T.P., P. Mccue, M.M.A. Magalhães, G.R. Macêdo, and K. Shetty. 2004. Phenolic Antioxidant Enrichment of Soy Flour-Supplemented Guava Waste by Rhizopus oligosporus-Mediated Solid-State Bioprocessing.
Journal of Food Biochemistry28 (2004) 404-418.
Dewi, R.S. and S. Aziz. 2011. Isolasi Rhizopus oligosporus Pada Beberapa Inokulum Tempe di Kabupaten Banyumas. Jurnal Molekul, Vol.6, No.2, Nopember 2011: 93-104.
Feng, X. M., T. O. Larsen, and J. Schnürer. 2007. Production of Volatile Compounds by Rhizopus oligosporus during Soybean and Barley Tempeh Fermentation. International Journal of Food Microbiology, Vol.113(2): 133-141.
Gulati, R., R. K. Saaxena, and R. Gupta. 1996. A Rapid Plate Assay for Screening L-Asparaginase Producing Microorganisms. Letter in Applied Microbiology,24, 23-26. India.
Handoyo, Tri and Naofumi Morita. 2006. Structural and Functional Properties of Fermented Soybean (Tempeh) by Using Rhizopus oligosporus. Inter. J. Food Prop., 9: 347-355, 2006.
Hernández-Sebastià, C., F. Marsolais, C. Saravitz, D. Israel, R. E. Dewey, and S. C. Huber. 2005. Free Amino Acid Profiles Suggest a Possible Role for Asparagine in The Control of Storage-Product Accumulation in Developing Seeds of Low- and High-Protein Soybean Lines. Journal of Experimental Botany, Vol. 56, No.417, pp. 1951-1963.
Hosamani, R. and B.B. Kaliwal. 2011. L-Asparaginase an Anti Tumor Agent Production by Fusarium equiseti Using Solid State Fermentation. Int. J. Drug Discovery, Vol.3, Issue 2, 2011, pp. 88-89, ISSN: 0975-4423 & E-ISSN: 0975-914X.
IJIRSET. 2013. Microbial L-Asparaginase: Present and Future Prospective.
International Journal of Innovative Research in Science, Engineering and Technology. Vol. 2, Issue 11, November 2013. ISSN: 2319-8753.
Jain, R., K. U. Zaidi, Y. Verma, P. Saxena. 2012. L-asparaginase: A Promising Enzyme for Treatment of Acute Lymphoblastic Leukiemia. People’s Journal of Scientific ResearchVol. 5 (1) Jan, 2012.
Jeleń, H., M. Majcher, A. Ginja, and M. Kuligowski. 2013. Determination of
Compounds Responsible for Tempeh Aroma. Journal Food Chemistry
141 (2013) 459-465. Poland.
Jeong, H., J. Park, and H. Kim. 2013. Determination of NH4+ in Environmental Water with Interfering Substances Using the Modified Nessler Method.
Jooyandeh, Hossein. 2011. Soy Products as Healthy and Functional Foods. Middle-East Journal of Scientific Research7 (1): 71-80, 2011, ISSN 1990-9233.
Karsono, Y., Abdi Tunggal C. S., A. Wiratama, P. Adimulyo. 2009. Pengaruh Jenis Kultur Starter terhadap Mutu Organoleptik Tempe Kedelai. Institut Pertanian Bogor (IPB): Bogor.
Kovač, B. and P. Raspor. 1997. The Use of The Mould Rhizopus oligosporus in Food
Production. Food Technol. Biotechnol., 35 (1): 69-73, ISSN: 1330-9862.
Kumar, D.S. and K. Sobha. 2012. L-Asparaginase From Microbes: a Comprehensive Review. Advances in Bioresearch Vo.3[4] Dec 2012: 137-157, ISSN 0976-4585.
Kushwaha, A., F. Ahmed, Jayanand, and P. Singh. 2012. Production and Purification of L-Asparaginase From Bacterial Source. International Journal of Universal Pharmacy and Life Sciences2(2): March-April 2012.
Leonard, R. H. 1961. Quantitative Range of Nessler’s Reaction with Ammonia.
Clinical Chemistry JournalVol.9, No.4.
Lin, Chia-Hung, Wei Yi-Tien, and Chou Cheng-Chun. 2006. Enhanced Antioxidative Activity of Soybean Koji Prepared with Various Filamentous Fungi. Food Microbiology23 (2006) 628-633.
Mitchell, D. A., M. Berovic, and N. Krieger. 2000. Biochemical Engineering Aspect of Solid State Bioprocessing. Advances in Biochemical Engineering/ Biotechnology, Vol. 68. Springer-Verlag: Berlin.
Nout, M.J.R., and J.L. Kiers. 2005. Tempe Fermentation, Innovation and Functionally: Update Into The Third Millenium. Journal of Applied Microbiology2005, 98, 789-805.
Pandey, A., P. Selvakumar, C. R. Soccol, and P. Nigam. 1999. Solid State Fermentation for The Production of Industrial Enzymes. Current Science, Vol. 77, No.1, 10 July 1999.
Popoola, T.O.S and C.O. Akueshi. 1986. Nutritional Evaluation of Daddawa, a Local Spice Made From Soybean (Glycine max). MIRCEN J. Appl. Micro. Biotech. 1986, Vol.2, Issue 3, pp 405-409.
Rytting, M.E. 2012. Role of L-Aparaginase in Acute Lymphoblastic Leukimia: Focus on adult Patient. Review article2012:2 117-124.
Shukla, S. and S.K. Mandal. 2013. Production Optimization of Extracellular L-Asparaginase Through Solid-State Fermentation by Isolated Bacillus substilis. Int. J. App. Bio. and Pharmaceutical Tech., Vol.4, Issue 1, ISSN: 0976-4550.
Soniyamby, A.R., S. Lalitha, B.V. Praveesh, and V. Priyardarshini. 2011. Isolation, Production, and Anti-Tumor Activity of L-Aparaginase of Penicillium sp. 2011. Int. J. Microbiol. Res., 2(1): 38-42, 2011, ISSN 2079-2093.
Streeter, J.G. 1977. Asparaginase and Asparagine Transaminase in Soybean Leaves and Root Nodules. Plant Physiol. (1977) 60,235-239.
Suhartono, Maggy T. 1989. Enzim dan Bioteknologi. Institut Pertanian Bogor: Bogor.
Sundaramoorthi, C., R. Rajakumari, A. Dharamsi, K. Vengadeshprabhu. 2012. Production and Immobilization of L-Asparaginase From Marine Source.
Int. J. Pharm. and Pharmaceutical Sci., Vol. 4, Suppl 4, 2012, ISSN 0975-1491.
Suprapti, M.L. 2003. Pembuatan Tempe. Yogyakarta: Penerbit Kanisius.
Suresh, J.V. and K.J. Raju. 2012. Studies on The Production of L-Asparaginase by Aspergillus terreus MTCC 1782 Using Agro-Residues under Mixed Substrate Solid State Fermentation. J. Chem. Bio. Phy. Sci. Sec. B., 2012-2013, Vol.3, No.1, 314-325, e-ISSN: 2249-1929.
Tamura, Z. and M. Maeda. 1997. Differences between Phthaleins and Sulfonphthaleins. Yakugaku Zasshi, 1997 Nov; 117 (10-11): 764-70.
Weng, T. M. and M. T. Chen. 2011. Effect of Two-Step Fermentation by Rhizopus oligosporus and Bacillus substilis on Protein of Fermented Soybean.
Food Sci. Technol. Res., 17 (5), 393-400, 2011.
Wipradnyadewi, P.A.S., E.S. Rahayu, dan S. Raharjo. 2004. Isolasi dan Identifikasi
Rhizopus oligosporus Pada Beberapa Inokulum Tempe. Proyek Hibah Penelitian Tim Pascasarjana(HPTP).
LAMPIRAN A.
1. Komposisi Media PDA (Potato Dextrose Agar)
Komposisi Jumlah
merupakan komposisi dari TES (Trace Element Solutions)
3. Komposisi Buffer Fosfat pH 8
Komposisi Jumlah
Larutan B (0.2 M Na2HPO4) 947 ml
Larutan A (0.2 M NaH2PO4) 53 ml
Phenol red (pH 6.5-7) 0.09% (v/v)
5. Komposisi Buffer Tris-HCl 0.1 M (pH 8)
Komposisi Jumlah
6. Komposisi TCA (Trichloroacetic acid)
Komposisi Jumlah
Spora isolat R. oligosporus/ Ragi tempe* 50 ml/ 0.5 gram
Basal Medium 450 ml
Catatan:
(*) Spora isolat R. oligosporusdan ragi tempe tidak digunakan secara bersamaan. Jika mengunakan spora isolat R. oligosporusmaka jumlah yang dipakai 50 ml, sedangkan ragi tempe 0.5 gram.
b. Tepung Kedelai
Komposisi Jumlah
Tepung Kedelai 2.25 gram
Spora isolat R. oligosporus/ ragi tempe 0.5 ml/ 0.5 gram
LAMPIRAN B.