DWI SARI AGUSTINA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
DWI SARI AGUSTINA. C34080046. Aktivitas Antioksidan dan Komponen Bioaktif Bintang Laut Culcita sp. Dibimbing oleh KUSTIARIYAH TARMAN dan NURJANAH.
Bintang laut Culcita sp. merupakan salah satu jenis echinodermata yang belum banyak dimanfaatkan dan sebagian besar masyarakat belum mengetahui akan keberadaan dan potensi yang dimiliki bintang laut tersebut. Penelitian tentang senyawa bioaktif dari bintang laut masih terbatas pada penemuan senyawa yang belum diketahui aktivitasnya. Padahal biota laut dikenal sebagai sumber beragam senyawa bioaktif diantaranya sebagai antioksidan. Hal tersebut yang mendasari penelitian ini untuk menentukan potensi antioksidan dan komponen bioaktif yang terdapat dalam bintang laut. Hasil penelitian ini diharapkan dapat memperkaya informasi mengenai kandungan senyawa antioksidan dan komponen bioaktif bintang laut yang dapat bermanfaat untuk bidang pangan, farmasi maupun industri lainnya.
Tujuan penelitian ini untuk menentukan aktivitas antioksidan ekstrak bintang laut, menentukan komponen aktif (alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, serta asam amino) yang terkandung dalam bintang laut melalui uji fitokimia, dan mengetahui fraksi aktif dari ekstrak bintang laut yang memiliki aktivitas antioksidan.
Bintang laut pada penelitian ini berasal dari perairan Lampung Selatan.
Rendemen ekstrak yang paling banyak dihasilkan yaitu ekstraksi dari pelarut metanol bertingkat dan metanol tunggal berturut-turut menghasilkan 8,38% dari 50 g sampel dan 6,55% dari 10 g sampel. Hasil rendemen dari pelarut heksan sebesar 2,06% dan etil asetat sebesar 0,19% dari 50 g sampel.
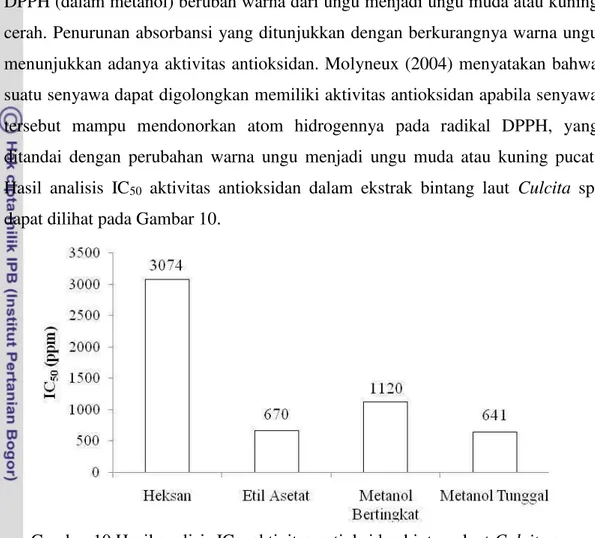
Ekstrak kasar bintang laut memiliki aktivitas antioksidan yang terlihat dari nilai IC50 yang diperoleh. Nilai IC50 dari ekstrak heksan sebesar 3074 ppm, ekstrak
etil asetat sebesar 670 ppm, ekstrak metanol bertingkat sebesar 1120 ppm, dan ekstrak metanol tunggal sebesar 641 ppm. Ekstrak kasar bintang laut ini mengandung 4 dari 6 komponen bioaktif yang diuji dengan metode fitokimia, antara lain alkaloid, steroid, flavonoid, dan asam amino.
DWI SARI AGUSTINA C34080046
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan
Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Aktivitas Antioksidan dan Komponen Bioaktif Ekstrak Bintang LautCulcitasp.
Nama : Dwi Sari Agustina
NRP : C34080046
Program Studi : Teknologi Hasil Perairan
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Kustiariyah Tarman, S.Pi., M.Si. Dr. Ir. Nurjanah, MS.
NIP. 19750818 200501 2 001 NIP. 19591013 198601 2 002
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., M.Phil NIP. 19580511 198503 1 002
Dengan ini saya menyatakan bahwa skripsi ini dengan judul “Aktivitas Antioksidan dan Komponen Bioaktif Bintang Laut Culcita sp.“ adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2012
Penulis bernama lengkap Dwi Sari Agustina
dilahirkan di Palembang pada tanggal 09 Agustus 1990
sebagai anak kedua dari tiga bersaudara pasangan Juana
Abubakar dan Dra. Zuraidah Wahab.
Penulis memulai jenjang pendidikan formal di
SDN 318 Palembang (tahun 1996-2002), selanjutnya
penulis melanjutkan pendidikannya di SLTP Negeri 08
Palembang (tahun 2002-2005) dan SMA Negeri 05
Palembang (tahun 2005-2008). Pada tahun 2008, penulis diterima di Institut
Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) dan pada
tahun 2008 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas
Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis pernah mengikuti kegiatan kepanitiaan
seperti Divisi Publikasi IPB Art Contest 2010, Divisi Kesehatan PORIKAN 2010,
dan Divisi PDD SANITASI 2010.
Penulis telah melaksanakan praktek lapangan dari 11 Juli 2011 sampai
10 Agustus 2011 di PT Lautan Bahari Sejahtera yang beralamat di Kompleks
Perum Perikanan Samudera Jakarta (PPSJ) atau sekarang dikenal dengan
Pelabuhan Nizam Zachman di Jalan Muara Baru Ujung Blok J No. 7 Kecamatan
Penjaringan, Jakarta Utara.
Sebagai salah satu syarat meraih gelar sarjana, penulis melakukan
penelitian yang berjudul “Aktivitas Antioksidan dan Komponen Bioaktif
Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi ini
dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar
Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi
hasil penelitian ini berjudul ”Aktivitas Antioksidan dan Komponen Bioaktif
Ekstrak Bintang LautCulcitasp.”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu penulis dalam menyelesaikan skripsi ini, terutama kepada:
1. Dr. Kustiariyah Tarman, S.Pi., M.Si. dan Dr. Ir. Nurjanah, MS. selaku dosen
pembimbing skripsi, atas segala bimbingan, motivasi, dan arahan yang
diberikan kepada penulis.
2. Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol. selaku Ketua Program Studi
Teknologi Hasil Perairan dan dosen penguji yang telah memberikan
bimbingan, arahan, dan saran kepada penulis.
3. Dr. Ir. Ruddy Suwandi, MS., M.Phil selaku Ketua Departemen Teknologi Hasil
Perairan.
4. Dr. Pipih Suptijah, MBA selaku dosen pembimbing akademik atas segala
bimbingan dan nasehatnya kepada penulis.
5. Pusat Kajian Sumberdaya Pesisir dan Lautan (PKSPL-IPB) yang telah
mendanai penelitian ini.
6. Ayah Juana dan ibu Dra.Zuraidah Wahab, kakakku Indra Bestari, adikku
M. Oktariansyah dan keluarga besarku tercinta yang telah memberikan doa,
semangat moril dan materil, motivasi, dan dukungan selama ini kepada penulis.
7. Trya Adheshi Holqi, S.TP yang selalu menemani, memberi dukungan, dan
suka dukanya selama penelitian dan menyelesaikan skripsi ini.
8. Seluruh staf dosen dan pegawai THP yang telah banyak memberikan bantuan
kepada penulis.
9. Ibu Ema Masruroh, S.Si, Sulastri, A.Md, Dini, dan Saeful Bahri, A.Md yang
11.Teman-teman seperjuangan OMDA Palembang (Rizky, Wirda, Rima, Marla,
Putiha, Sakina, kk Fian, kk Adi, kk Dede, Hera, Ririn, Mei, Desima, Arif,
Fadli, Yudhi, Rian, Edwin, dll) yang telah bersama, menemani, memberikan
motivasi, dan semangatnya selama pendidikan di IPB.
12.Teman-teman seperjuangan selama penelitian (Silvia, Fitri, Euis, Iis, Marisa,
Rivi, Dwi, Ica, Ukon, Steven) yang telah memberikan semangat motivasinya.
13.Teman-teman THP 45 yang telah memberikan suka dan dukanya selama ini.
14.Civitas THP 43, 44, 46, dan 47 yang telah memberikan saran yang membangun
selama penelitian dan pembuatan skripsi.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan
skripsi ini, oleh karena itu penulis harapkan kritik dan saran yang bersifat
membangun. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, November 2012
ix
2.1 Deskripsi dan Klasifikasi Bintang LautCulcitasp. ... 3
2.2 Senyawa Aktif Bintang Laut ... 4
2.3 Ekstraksi ... 5
2.4 Komponen Bioaktif dari Bintang Laut ... 6
2.4.1 Alkaloid ... 6
3.3.1 Tahapan pengambilan dan preparasi bahan baku ... 17
3.3.2 Tahapan pembuatan ekstrak senyawa bioaktif dari bintang laut .... 17
3.3.3 Uji fitokimia ... 19
x
5) Fenol hidrokuinon ... 20
6) Ninhidrin ... 20
3.3.4 Uji aktivitas antioksidan dengan metode DPPH ... 20
3.3.5 Kromatografi lapis tipis (KLT) dan bioautografi ... 23
3.4 Analisis Data ... 24
3.4.1 Rendemen ekstrak ... 24
3.4.2 Persen inhibisi dan IC50 ... 24
4 HASIL DAN PEMBAHASAN ... 25
4.1 Karakteristik Bintang LautCulcitasp... 25
4.2 Rendemen Ekstrak Bintang LautCulcitasp. ... 26
4.3 Komponen Aktif pada Ekstrak Kasar Bintang LautCulcitasp. ... 29
4.4 Aktivitas Antioksidan Ekstrak Kasar Bintang LautCulcitasp. ... 31
4.5 Analisis Kromatografi Lapis Tipis (KLT) ... 38
5 KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
xi
Nomor Halaman
1. Hasil uji fitokimia ekstrak kasar bintang lautCulcitasp. ... 30
xii
Nomor Halaman
1. Bintang lautCulcitasp. dari Perairan Lampung Selatan ... 3
2. Struktur kimia dari steroidal glikosid ... 4
3. StrukturDiphenylpycrilhydrazildanDiphenylpycrilhydrazine ... 14
4. Diagram alir ekstraksi bertingkat bintang lautCulcitasp. ... 18
5. Diagram alir uji aktivitas antioksidan bintang lautCulcitasp. ... 21
6. Diagram alir uji aktivitas antioksidan pembanding ... 22
7. (a) Bintang lautCulcitasp. diambil dari perairan Lampung Selatan (b) Bintang lautCulcitasp. dalam bentuk tepung yang telah difreez drying .. 25
8. Nilai rata-rata rendemen ekstrak bintang lautCulcitasp. ... 27
9. Ekstrak kasar bintang lautCulcitasp. (a) n-heksan, (b) etil asetat, (c) metanol bertingkat, dan (d) metanol tunggal ... 29
10. Hasil analisis IC50aktivitas antioksidan bintang lautCulcitasp. ... 32
11. Hasil analisis IC50aktivitas antioksidan pembanding ... 33
12. Grafik hubungan konsentrasi antioksidan pembanding dengan persen inhibisinya (a) BHT, (b) asam askorbat, (c)α-tokoferol, (d) β-karoten ... 35
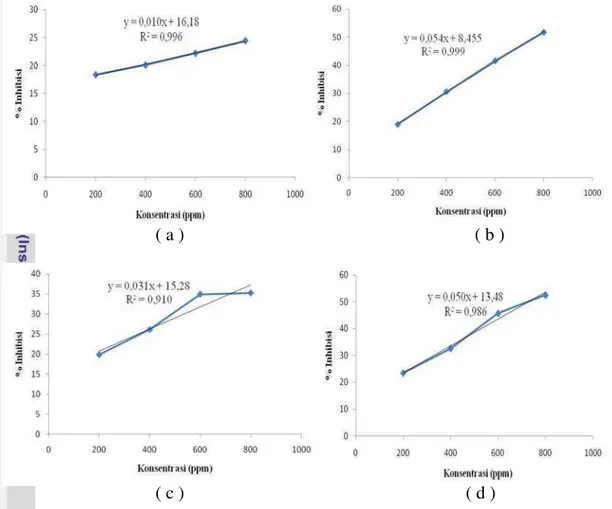
13. Grafik hubungan konsentrasi ekstrak kasar bintang laut dengan persen inhibisinya (a) heksan, (b) etil asetat, (c) metanol bertingkat, (d) metanol tunggal ... 36
14. Hasil fraksinasi ekstrak kasar bintang laut menggunakan KLT (a) di deteksi pada lampu UV 254 nm, (b) nilai Rf masing-masing fraksi ... 38
Nomor Halaman 1. Bentuk bintang lautCulcitasp. yang utuh dan bintang lautCulcitasp.
berupa tepung ... 47
2. Perhitungan rendemen bintang lautCulcitasp. ... 47
3. Data ekstrak kasar bintang lautCulcitasp. ... 47
4. Perhitungan pembuatan larutan stock dan pengencerannya ... 48
5. Perhitungan persen inhibisi dan IC50 ... 50
6. Perubahan warna yang mengindikasikan reaksi peredaman DPPH ... 51
1.1 Latar Belakang
Sumber polusi dapat berasal dari mana saja antara lain asap motor dan
mobil, industri, asap rokok, mesin fotokopi, pendingin ruangan, maupun
kebakaran hutan. Tanpa disadari dalam tubuh kita secara terus-menerus terbentuk
radikal bebas melalui peristiwa metabolisme sel normal, peradangan, kekurangan
gizi dan akibat respon terhadap pengaruh dari luar tubuh. Reaksi oksidasi dari
radikal bebas bisa mencetuskan terbentuknya radikal bebas yang sangat aktif,
yang dapat merusak struktur serta fungsi sel didalam tubuh kita. Reaktivitas
radikal bebas itu dapat dihambat oleh sistem antioksidan yang melengkapi sistem
kekebalan tubuh.
Antioksidan merupakan sebuah substansi yang dapat melindungi sel tubuh
dari radikal bebas dengan cara memperlambat atau mencegah substansi lain yang
teroksidasi oleh radikal bebas. Reaksi oksidasi dapat membentuk radikal bebas
dan merusak sel. Senyawa radikal bebas juga dapat terbentuk dari dalam tubuh
melalui proses oksidasi yang berlangsung pada waktu bernapas, olah raga yang
berlebihan maupun peradangan. Radikal bebas yang terbentuk di dalam tubuh
akan merusak beberapa target antara lain lemak, protein, karbohidrat, dan DNA
(Molyneux 2004).
Pemanfaatan sumberdaya biota laut selain sebagai sumber pangan, juga
berpotensi sebagai sumber senyawa bioaktif yang lebih bernilai ekonomis
(Hafiluddin 2011). Biota laut dapat berpotensi sebagai sumber antioksidan.
Bintang laut Culcita sp. merupakan salah satu jenis echinodermata yang belum
banyak dimanfaatkan dan sebagian besar masyarakat belum mengetahui akan
keberadaan dan potensi yang dimiliki bintang laut tersebut. Tanget al. (2005) dan
Guo et al. (2009) menyatakan bahwa streroidal glikosid atau sulfat steroidal
oliglikosid (asterosaponin) merupakan hasil metabolisme utama dari bintang laut
dan umumnya mengandung racun. Bintang laut memiliki komponen aktif yang
dibagi menjadi tiga kelompok utama berdasarkan strukturnya yaitu asterosaponin,
siklis steroidal glikosid dan glikosid dari steroid polyhydroxylated. Guo et al.
(2009) menyatakan asterosaponin memiliki potensi aktivitas biologis yang
Penelitian tentang senyawa bioaktif dari bintang laut masih terbatas pada
penemuan senyawa yang belum diketahui aktivitasnya. Hal tersebut yang
mendasari penelitian ini untuk menentukan potensi antioksidan dan komponen
bioaktif yang terdapat dalam bintang laut. Hasil penelitian ini diharapkan dapat
memperkaya informasi mengenai kandungan senyawa antioksidan dan komponen
bioaktif bintang laut yang dapat bermanfaat untuk bidang pangan, farmasi,
maupun industri lainnya.
1.2 Tujuan
Penelitian ini bertujuan untuk menentukan komponen bioaktif dan
aktivitas antioksidan dari bintang laut Culcita sp. yang diambil dari Perairan
Lampung Selatan. Tujuan khusus yang ingin dicapai antara lain:
1) Menentukan aktivitas antioksidan ekstrak bintang laut
2) Menentukan komponen aktif (alkaloid, steroid, flavonoid, saponin, fenol
hidrokuinon, serta asam amino) yang terkandung dalam bintang laut melalui
uji fitokimia
3) Menentukan fraksi aktif dari ekstrak bintang laut yang memiliki aktivitas
2.1 Deskripsi dan Klasifikasi Bintang LautCulcitasp.
Bintang laut adalah salah satu spesies dari kelas Asteroidea, dan
merupakan kelompok Echinodermata. Filum Echinodermata terdiri atas lebih
kurang 6.000 spesies, dan semuanya hidup di air laut. Ciri-ciri yang menonjol
adalah kulit yang berduri dan simetris radial (Lariman 2011). Klasifikasi bintang
laut menurut James (1989) adalah sebagai berikut:
Kingdom : Animalia
Filum : Echinodermata
Kelas : Asteroidea
Ordo : Forcipulata
Famili : Oreasteridae
Genus : Culcita
Spesies : Culcitasp.
Culcita sp. merupakan jenis bintang laut yang memiliki lengan, berbentuk
segi lima, tubuhnya tebal seperti roti. Warna tubuh dari bintang laut ini adalah
kuning kecoklatan. Hidupnya di daerah terumbu karang, dasar berpasir, dan
padang lamun. Bintang laut bentuknya mengikuti kontur permukaan bebatuan.
Hewan ini pada umumnya menempati daerah yang digenangi air. Bentuk
morfologi bintang laut dapat dilihat pada Gambar 1.
Gambar 1 Bintang lautCulcitasp. dari Perairan Lampung Selatan
Bintang laut berbentuk simetris radial, permukaan bagian bawahnya
memiliki kaki tabung, yang masing-masing dapat bertindak sebagai cakram
penyedot. Bintang laut mengkoordinasikan kaki tabungnya untuk menempel pada
tersebut memanjang, mencengkeram sekali lagi. Bintang laut juga menggunakan
kaki tabungnya untuk menjerat mangsa, antara lain remis dan tiram (Lariman
2011).
Bintang laut sebagaimana anggota filum echinodermata lainnya
mempunyai susunan tubuh bersimetri lima (pentraradial simetri), tubuh berbentuk
cakram yang di dalamnya terdapat sistem pencernaan, sistem respirasi, dan sistem
saraf. Tubuh dilindungi oleh lempeng kapur berbentuk perisai (ossicles). Mulut
dan anus terletak di sisi yang sama yaitu di sisi oral (Safitri 2010). Kehadiran
bintang laut biru Linckia laevigata dan bintang bantal Culcita novaeguinenae
merupakan pemandangan umum pada ekosistem terumbu karang. Bintang laut
pemakan poli karang (Acanthaster planci) relatif jarang dijumpai di perairan ini.
Penelitian bintang laut di Indonesia masih jarang dilakukan. Informasi kelompok
hewan ini biasanya merupakan hasil studi ekologi dan dipublikasikan sebagai
bagian dari filum Echinodermata (Aziz dan Al-Hakim 2007).
2.2 Senyawa Aktif Bintang Laut
Senyawa aktif dari bintang laut masih terbatas pada penemuan senyawa
yang belum diketahui aktivitasnya. Chludil et al. (2000) menyatakan bahwa
bintang laut memiliki komponen bioaktif berupa saponin. Saponin diperoleh dari
isolasi bintang laut Anasterias minuta yang memiliki kemampuan sebagai
sitotoksik, hemolisis, antifungi, dan antiviral. Isolasi dan purifikasi dari ekstrak
bintang laut ini menghasilkan senyawa steroidal glikosid yang memiliki
kemampuan sebagai antifungi. Struktur kimia dari steroidal glikosid dapat dilihat
pada Gambar 2.
Senyawa aktif saponin secara fisiologi telah dipelajari dari bintang laut
dan timun laut. Senyawa aktif dari bintang laut dan timun laut tidak dapat
digunakan sebagai obat karena dapat membuat sel menjadi lisis. Glycosylated
ceramidesdan saponin merupakan metabolit utama dari echinodermata. Senyawa
imbricatine dari bintang laut Dermasterias imbricata merupakan alkaloid
benzyltetrahydroisoquinolonepertama yang dihasilkan pada sel manusia (Samuel
et al. 2011). Wang et al. (2003) menemukan komponen aktif saponin yang
diisolasi dari bintang laut Certonardoa semiregularis yaitu senyawa
certonardosides. Bintang laut ini diambil dari pantai di Pulau Komun Korea.
Senyawa aktif dari bintang laut Certonardoa semiregularis memiliki aktivitas
sebagai sitotoksik dan antimikroba. Samuel et al. (2011) menyatakan, senyawa
imbricatine, benzyltetrahydroisoquinolone, lysastroside, dan certonardosides
memiliki fungsi sebagai antiviral dan anti-HIV.
Hasil penelitian Maier et al. (2007) menyatakan bahwa asterosaponin
memiliki potensi aktivitas biologis yang berguna sebagai sitotoksik, hemolisis,
dan sitostatis. Aktivitas antifungi diperoleh dari komponen dua sulfated
hexaglycosides dan dua sulfated polyhydroxylated steroidal xylosides yang
diisolasi dari bintang laut PatagoniaAnasterias minuta.
2.3 Ekstraksi
Ekstraksi merupakan salah satu cara pemisahan yang paling banyak
digunakan untuk menarik atau memisahkan komponen bioaktif dari suatu bahan
baku. Ekstraksi dapat diartikan sebagai suatu proses penarikan komponen yang
diinginkan dari suatu bahan menggunakan pelarut yang dipilih sehingga
komponen yang diinginkan dapat larut. Metode dasar penyaringan adalah
maserasi, perkolasi, dan sokhletasi. Pemilihan terhadap ketiga metode tersebut
diatas disesuaikan dengan kepentingan dalam kandungan senyawa yang
diinginkan (Harborne 1987).
Berdasarkan prinsipnya, proses ekstraksi dapat berlangsung bila terdapat
kesamaan dalam sifat kepolaran antara senyawa yang diekstrak dengan senyawa
pelarut. Suatu zat memiliki kemampuan terlarut yang berbeda dalam pelarut yang
berbeda. Hal ini menunjukkan adanya interaksi antara zat terlarut dengan pelarut.
yang digunakan harus memenuhi kriteria murah, mudah didapat, stabil secara
fisika dan kimia, bereaksi netral, tidak mudah menguap, tidak terbakar, dan
selektif artinya menarik zat yang berkhasiat yang dikehendaki. Pelarut yang
digunakan dapat berupa kloroform, heksana (non polar), etil asetat (semi polar),
dan metanol (polar) (Sirait 2007).
2.4 Komponen Bioaktif dari Biota Laut
Komponen bioaktif merupakan kelompok senyawa fungsional yang
terkandung dalam bahan pangan dan dapat memberikan pengaruh biologis.
Sebagian besar komponen bioaktif adalah kelompok alkohol aromatik misalnya
polifenol dan komponen asam (phenolic acid). Komponen bioaktif tidak terbatas
pada hasil metabolisme sekunder saja, tetapi juga termasuk metabolit primer yang
memberikan aktivitas biologis fungsional, misalnya protein dan peptida
Senyawa fitokimia bukanlah zat gizi, namun kehadirannya dalam tubuh dapat
membuat tubuh lebih sehat, lebih kuat, dan lebih bugar (Robinson 1995).
Fitokimia atau kimia tumbuhan berada diantara kimia organik bahan alam
dan biokimia tumbuhan, serta berkaitan erat dengan keduanya. Fitokimia ini
mencakup struktur kimianya, biosintesis, perubahan serta metabolismenya,
penyebaran secara alamiah, dan fungsi biologisnya. Senyawa fitokimia berpotensi
mencegah berbagai penyakit degeneratif dan kardiovaskuler (Harborne 1987).
Beberapa senyawa metabolit sekunder khususnya struktur dan aktivitas
biologisnya telah berhasil diisolasi dari hewan-hewan laut. Senyawa metabolit
sekunder tersebut mempunyai potensi sebagai obat. Senyawa bioaktif yang
menarik diteliti umumnya diisolasi dari spons laut, ubur-ubur, bintang laut, timun
laut, terumbu karang, moluska, echinodermata, dan krustasea. Senyawa bioaktif
yang telah diisolasi dari hewan laut yaitu steroid, terpenoid, isoprenoid,
nonisoprenoid, quinon, dan nitrogen heterosiklik (Sirait 2007). Pengujian
kualitatif terhadap komponen bioaktif ini dapat dilakukan dengan metode uji
fitokimia.
2.4.1 Alkaloid
Alkaloid merupakan senyawa yang bersifat basa yang mengandung satu
atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem
kegiatan fisiologi yang menonjol, jadi digunakan secara luas di bidang
pengobatan. Alkaloid sering bersifat optis aktif, kebanyakan berbentuk kristal
tetapi hanya sedikit yang berupa cairan. Fungsi alkaloid dalam tumbuhan tetap
belum begitu pasti walaupun beberapa senyawa dilaporkan berperan sebagai
pengatur tumbuhan atau penolak dan pemikat serangga (Harborne 1987).
Biota laut yang memiliki kandungan alkaloid yaitu spons, moluska, dan
coelenterata. Sebagian besar alkaloid yang diisolasi dari hewan laut dapat
berfungsi sebagai antiviral, antibakterial, anti-inflamatori, antimalaria,
antioksidan, dan antikanker. Alkaloid pada hewan laut dapat dikelompokkan
menjadi pyridoacridine, indole, pyrrole, pyridine, isoquinoline guanidine dan
streroidal alkaloids(Kumar dan Rawat 2011).
2.4.2 Steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa
alkohol, aldehida, atau asam karboksilat. Senyawa ini tidak berwarna, berbentuk
kristal, seringkali bertitik leleh tinggi, dan aktif optik. Triterpenoid ini dapat
dibagi menjadi empat golongan senyawa yaitu triterpena sebenarnya, steroid,
saponin, dan glikosida jantung. Kedua golongan yang terakhir sebenarnya
triterpena atau steroid yang terutama terdapat sebagai glikosida (Sirait 2007).
Diterpenoid merupakan turunan dari terpenoid. Berdasarkan struktur
kimianya, diterpenoid digolongkan menjadi labdane, pimarane, abietane,
kauranes, marine, dan lain-lain. Diterpenoid memiliki aktivitas sebagai
antibakteri, antifungi, anti-inflamasi, antileishmanial, sitotoksik, dan antitumor.
Diterpenoid yang terdapat pada biota laut yaitu tipelabdanedan tipemarine. Tipe
labdane merupakan metabolit sekunder dari fungi, biota laut, insekta, dan
tumbuhan tinggi yang memiliki aktivitas sebagai antibakteri, sitotoksik, antiviral,
anti-inflamasi, dan antiprotozoa. Selain tipe labdane, tipe marine diterpenoid
merupakan salah satu diterpenoid alami dari biota laut yang memiliki potensial
untuk obat anti-inflamasi. Biota laut yang menghasilkan marine diterpenoid
Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana
perhidrofenantrena. Tiga senyawa yang biasa disebut fitosterol mungkin terdapat
pada setiap tumbuhan tingkat tinggi yaitu sitosterol, stigmasterol, dan
kampesterol. Sterol tertentu hanya terdapat dalam tumbuhan tingkat rendah,
contohnya ergosterol yang terdapat dalam khamir dan sejumlah fungi. Sterol lain
terutama terdapat dalam tumbuhan tingkat rendah tetapi kadang-kadang terdapat
pada tumbuhan tingkat tinggi, misalnya fukosterol, yaitu steroid utama pada alga
coklat dan juga terdeteksi pada kelapa (Robinson 1995). Santalova et al. (2004)
menyatakan bahwa sterol yang diisolasi dari spons Rhizochalina incrustata
memiliki aktivitas sebagai sitotoksik dan hemolisis.
2.4.3 Flavonoid
Flavonoid terdapat dalam tumbuhan sebagai campuran, jarang sekali
dijumpai hanya flavonoid tunggal dalam jaringan tumbuhan. Flavonoid umumnya
terdapat pada tumbuhan sebagai glikosida. Flavonoid diklasifikasikan menjadi
flavon, flavonol, flavanon, flavanonol, isoflavon, calkon, dihidrokalkon, auron,
antosianidin, katekin, dan flavan-3,4-diol (Harborne 1987).
Flavonoid dapat berguna bagi kehidupan manusia. Flavon dalam dosis
kecil bekerja sebagai stimulant pada jantung, hesperidin mempengaruhi pembuluh
darah kapiler. Flavon yang terhidroksilasi bekerja sebagai diurematik dan sebagai
antioksidan pada lemak (Sirait 2007). Gavin dan Durako (2012) menyatakan,
senyawa aktif sitosolik flavonoid yang diisolasi dari lamun Halophila johnsonii
berfungsi sebagai antioksidan.
2.4.4 Saponin
Saponin adalah glikosida dan sterol yang telah terdeteksi pada lebih dari 90
suku tumbuhan. Saponin adalah senyawa aktif permukaan kuat yang
menimbulkan busa jika dikocok dalam air dan pada konsentrasi rendah sering
menyebabkan hemolisis sel darah merah (Robinson 1995). Saponin sebagian
besar bereaksi netral (larut dalam air), beberapa ada yang bereaksi dengan asam
(sukar larut dalam air), sebagian besar ada yang bereaksi dengan basa. Saponin
dapat membentuk senyawa kompleks dengan kolesterol. Saponin dapat bersifat
toksik terhadap ikan dan binatang berdarah dingin lainnya. Saponin yang beracun
misalnya pada epitel hidung, bronkus, ginjal, dan sebagainya. Stimulasi pada
ginjal diperkirakan menimbulkan efek diuretika (Sirait 2007). Chludil et al.
(2000) menyatakan bahwa struktur steroidal glikosid yang diisolasi dari bintang
laut Anasterias minuta memiliki kemampuan sebagai sitotoksik, hemolisis,
antifungi, dan antiviral.
2.4.5 Fenol hidrokarbon
Komponen fenolat merupakan struktur aromatik yang berkaitan dengan
satu gugus atau lebih gugus hidroksil, beberapa mungkin digantikan oleh gugus
metil atau glikosil. Kuinon adalah senyawa berwarna dan mempunyai kromofor
dasar seperti kromofor pada benzokuinon. Kuinon terdiri atas dua gugus karbonil
yang berkonyugasi dengan dua ikatan rangkap karbon-karbon. Kuinon dapat
dibagi menjadi empat kelompok untuk tujuan identifikasi yaitu, benzokuinon,
naftokuinon, antrakuinon, dan kuinon isoprenoid (Sirait 2007). Hasil penelitian
Prajitno (2006) dalam Wiyanto (2010), hasil isolasi dari rumput laut Halimeda
opuntiamempunyai kandungan fenol yang memiliki aktivitas antibakteri.
2.5 Radikal Bebas
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat
reaktif karena mengandung satu atau lebih elektron tidak berpasangan pada orbital
terluarnya. Kestabilan atom atau molekul terjadi apabila radikal bebas bereaksi
dengan molekul disekitarnya untuk memperoleh pasangan elektron. Reaksi ini
akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan akan
menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan dini,
serta penyakit degeneratif lainnya (Winarsi 2007).
Sumber radikal bebas dapat berasal dari dalam tubuh (endogenous) yang
terbentuk sebagai sisa proses metabolisme (proses pembakaran) protein atau
karbohidrat dan lemak yang kita konsumsi. Radikal bebas dapat pula diperoleh
dari luar tubuh (exogenous) yang berasal dari polusi udara, asap kendaraan
bermotor, asap rokok, berbagai bahan kimia, makanan yang terlalu hangus
(carbonated), dan lain sebagainya. Beberapa contoh radikal bebas antara lain:
anion superoksida (2O2•), radikal hidroksil (OH•), nitrit oksida (NO•), hidrogen
akan merusak beberapa target seperti lemak, protein, karbohidrat, dan DNA
(Molyneux 2004).
Radikal bebas memiliki reaktivitas yang sangat tinggi. Hal ini ditunjukkan
oleh sifatnya yang segera menarik atau menyerang elektron di sekelilingnya.
Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan elektron.
Sebagai dampak dari kerja radikal bebas tersebut, akan terbentuk radikal bebas
baru yang berasal dari atom atau molekul yang elektronnya diambil untuk
berpasangan dengan radikal sebelumnya. Bila dua senyawa radikal bertemu,
elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan
bergabung dan membentuk ikatan kovalen yang stabil. Sebaliknya, bila senyawa
radikal bebas bertemu dengan senyawa yang bukan radikal bebas akan terjadi tiga
kemungkinan, yaitu (1) radikal bebas akan memberikan elektron yang tidak
berpasangan (reduktor) kepada senyawa bukan radikal bebas, (2) radikal bebas
menerima elektron (oksidator) dari senyawa bukan radikal bebas, (3) radikal
bebas bergabung dengan senyawa bukan radikal bebas (Winarsi 2007).
2.6 Antioksidan
Secara umum antioksidan didefinisikan sebagai senyawa yang dapat
menunda, memperlambat, dan mencegah proses oksidasi lipid. Antioksidan sangat
bermanfaat bagi kesehatan. Antioksidan merupakan zat yang dapat menetralkan
radikal bebas, atau suatu bahan yang berfungsi mencegah sistem biologi tubuh
dari efek yang merugikan yang timbul dari proses ataupun reaksi yang
menyebabkan oksidasi yang berlebihan (Kumalaningsih 2006).
Antioksidan sangat beragam jenisnya. Berdasarkan sumbernya antioksidan
dibagi dalam dua kelompok, yaitu antioksidan sintetik (antioksidan yang
diperoleh dari hasil sintesis reaksi kimia) dan antioksidan alami (antioksidan hasil
ekstraksi bahan alami).
2.6.1 Antioksidan sintetik
Berdasarkan jenisnya antioksidan sintetik yang diijinkan untuk makanan,
ada lima antioksidan yang penggunaannya meluas dan menyebar diseluruh dunia,
yaitu Butyl Hydroxyanisole (BHA), Butyl Hydroxytoluene (BHT), propil galat,
antioksidan sintetik yang telah diproduksi secara sintetis untuk tujuan komersial
(Buck 1991).
BHA memiliki kemampuan antioksidan (carry through, kemampuan
antioksidan baik dilihat dari ketahanannya terhadap tahap-tahap pengolahan
maupun stabilitasnya pada produk akhir) yang baik pada lemak hewan dalam
sistem makanan panggang, namun relatif tidak efektif pada minyak tanaman.
BHA bersifat larut lemak dan tidak larut air, berbentuk padat putih dan dijual
dalam bentuk tablet atau serpih, bersifat volatil sehingga berguna untuk
penambahan ke materi pengemas (Coppen 1983dalamTrilaksani 2008).
Antioksidan sintetik BHT memiliki sifat serupa BHA, antioksidan ini akan
memberi efek sinergis yang baik jika digunakan bersama antioksidan BHA.
Antioksidan BHT berbentuk kristal padat putih dan digunakan secara luas karena
relatif murah. Antioksidan sintetik lainnya yaitu propil galat. Propil galat
mempunyai karakteristik sensitif terhadap panas, terdekomposisi pada titik
cairnya 148oC, dapat membentuk komplek warna dengan ion metal, sehingga
kemampuan antioksidannya rendah. Propil galat memiliki sifat berbentuk kristal
padat putih, sedikit tidak larut lemak tetapi larut air, serta memberi efek sinergis
dengan BHA dan BHT (Kumalaningsih 2006).
2.6.2 Antioksidan alami
Antioksidan alami di dalam makanan dapat berasal dari senyawa
antioksidan yang sudah ada dari satu atau dua komponen makanan, senyawa
antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan, senyawa
antioksidan yang diisolasi dari sumber alami dan ditambahkan ke makanan
sebagai bahan tambahan pangan. Senyawa antioksidan alami polifenolik ini
adalah multifungsional dan dapat bereaksi sebagai (a) pereduksi, (b) penangkap
radikal bebas, (c) pengkelat logam, dan (d) peredam terbentuknya singlet oksigen
(Pratt 1992).
Antioksidan alami tersebar di beberapa bagian tanaman, seperti pada kayu,
kulit kayu, akar, daun, buah, bunga, biji, dan serbuk sari. Senyawa antioksidan
alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat
berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol, dan
alam terbesar dan terdapat dalam semua tumbuhan hijau. Kebanyakan dari
golongan flavonoid dan senyawa yang berkaitan erat dengannya memiliki
sifat-sifat antioksidan baik didalam lipida cair maupun dalam makanan berlipida
(Hernani dan Rahardjo 2006).
Ada banyak bahan pangan yang dapat menjadi sumber antioksidan alami,
seperti rempah-rempah, dedaunan, teh, kokoa, biji-bijian, serealia, buah-buahan,
sayur-sayuran, dan tumbuhan/alga laut. Bahan pangan ini mengandung jenis
senyawa yang memiliki aktivitas antioksidan, seperti asam-asam amino, asam
askorbat, golongan flavonoid, tokoferol, karotenoid, tannin, peptida, melanoidin,
produk-produk reduksi, dan asam-asam organik lain (Winarsi 2007).
Tokoferol merupakan antioksidan alami yang dapat ditemukan hampir
disetiap minyak tanaman, tetapi saat ini telah dapat diproduksi secara kimia.
Tokoferol memiliki karakteristik berwarna kuning terang, cukup larut dalam lipid
karena rantai C panjang. Pengaruh nutrisi secara lengkap dari tokoferol belum
diketahui, tetapi α-tokoferol dikenal sebagai sumber vitamin E. Aktivitas
antioksidan tokoferol didalam jaringan hidup cenderung α->β->γ->δ-tokoferol,
tetapi dalam makanan aktivitas tokoferol terbalik δ->γ->β->α-tokoferol
(Kumalaningsih 2006).
β-karoten merupakan scavengers (pemulung) oksigen tunggal. Vitamin C
pemulung superoksida dan radikal bebas yang lain, sedangkan vitamin E
merupakan pemutus rantai peroksida lemak pada membran dan Low Density
Lipoprotein(LDL) (Hariyatmi 2003).
Vitamin C mempunyai efek multifungsi, tergantung pada kondisinya.
Vitamin C berfungsi sebagai antioksidan, proantioksidan, pengikat logam,
pereduksi, dan penangkap oksigen. Tubuh sangat memerlukan vitamin C,
kekurangan vitamin C dalam darah menyebabkan beberapa penyakit antara lain
asma, kanker, diabetes, dan penyakit hati. Vitamin ini dapat dikonsumsi dalam
bentuk sintetik atau makanan-makanan yang kaya vitamin C seperti jeruk,
strawbery, brokoli, tomat, kiwi, anggur, dan ubi jalar (Hernani dan Raharjo 2006).
2.7 Mekanisme Antioksidan
Berdasarkan fungsinya, antioksidan dapat dibagi menjadi empat tipe. Tipe
menyumbangkan atom H, misalnya vitamin E. Tipe kedua yaitu pereduksi,
dengan mentransfer atom H atau oksigen, atau bersifat pemulung, misalnya
vitamin C. Tipe ketiga yaitu pengikat logam, mampu mengikat zat peroksidan,
seperti Fe2+ dan Cu2+, misalnya flavonoid. Keempat adalah antioksidan sekunder,
mampu mendekomposisi hidroperoksida menjadi bentuk stabil, pada manusia
dikenal SOD, katalase, dan peroksida (Hariyatmi 2004).
Antioksidan sekunder seperti asam sitrat, asam askorbat, dan esternya,
sering ditambahkan pada lemak dan minyak sebagai kombinasi dengan
antioksidan primer. Kombinasi tersebut dapat member efek sinergis sehingga
menambah keefektifan kerja antioksidan primer. Antioksidan sekunder ini bekerja
dengan satu atau lebih mekanisme berikut (a) memberikan suasana asam pada
medium (sistem makanan), (b) meregenerasi antioksidan utama, (c) mengkelat
atau mendeaktifkan kontaminan logam prooksidan, (d) menangkap oksigen, (e)
mengikat singlet oksigen dan mengubahnya ke bentuk triplet oksigen (Pratt 1992).
Enzim antioksidan dibentuk dalam tubuh, yaitu superoksida dismutase
(SOD), glutation peroksida, katalase, dan glutation reduktase. Sedangkan
antioksidan yang berupa mikronutrien dikenal tiga yang utama, yaitu β-karoten,
vitamin C, dan vitamin E (Shahidi 1997dalamHariyatmi 2004).
Vitamin E yang larut dalam lemak ini merupakan antioksidan yang
melindungi PUFAs dan komponen sel serta membran sel dari oksidasi oleh
radikal bebas. Antioksidan alami mampu melindungi tubuh terhadap kerusakan
yang disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit
degeneratif, serta mampu menghambat peroksida lipid pada makanan (Hariyatmi
2003).
2.8 Uji Aktivitas Antioksidan
Kandungan senyawa antioksidan dalam suatu bahan dapat diketahui
melalui uji aktivitas antioksidan. Pengukuran aktivitas antioksidan dapat
menggunakan beberapa metode. Salah satu metode yang umum digunakan yaitu
dengan menggunakan radikal bebas stabildiphenilpycrylhydrazil (DPPH). Prinsip
metode-metode yang digunakan untuk mengetahui aktivitas antioksidan adalah
antioksidan yang terdapat dalam bahan pangan atau contoh ekstrak bahan alam
(Nurjanah 2009).
Metode radikal bebas stabil DPPH merupakan radikal sintetik yang larut
dalam pelarut polar seperti metanol dan etanol. Pengukuran aktivitas antioksidan
dengan metode DPPH menggunakan prinsip spektrofotometri. Senyawa DPPH
(dalam metanol) berwarna ungu tua terdeteksi pada panjang gelombang sinar
tampak sekitar 517 nm. Suatu senyawa dapat dikatakan memiliki aktivitas
antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya
untuk berikatan dengan DPPH membentuk DPPH tereduksi, ditandai dengan
semakin hilangnya warna ungu (menjadi kuning pucat) (Molyneux 2004). Prinsip
penurunan nilai absorbansi digunakan untuk mengetahui kapasitas antioksidan
suatu senyawa. Berikut merupakan struktur diphenylpycrilhydrazil dan
diphenylpycrilhydrazinepada Gambar 3.
Gamar 3 Strukturdiphenylpycrilhydrazildandiphenylpycrilhydrazine
Molyneux (2004) menyatakan, hasil dari metode DPPH umumnya dibuat
dalam bentuk IC50 (inhibitory concentration 50), yang didefinisikan sebagai
konsentrasi larutan substrat atau sampel yang akan menyebabkan tereduksi
aktivitas DPPH sebesar 50%. Semakin besar aktivitas antioksidan maka nilai IC50
akan semakin kecil. Suatu senyawa antioksidan dinyatakan baik jika nilai
IC50-nya semakin kecil. Semakin kecil nilai IC50 berarti semakin tinggi aktivitas
antioksidan. Secara spesifik suatu senyawa dikatakan sebagai antioksidan sangat
kuat jika nilai IC50 kurang dari 50 μ g/mL, kuat untuk IC50 antara 50-100 μ g/mL,
sedang jika IC50 bernilai 100-150 μ g/mL, dan lemah jika IC50 bernilai
2.9 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan kromatografi serapan dimana fase
diam berupa zat padat yang disebut adsorben (penyerap) dan fase gerak berupa zat
cair yang disebut larutan pengembang. Campuran yang akan dipisah, berupa
larutan, ditotolkan berupa bercak. Setelah plat atau lapisan diletakkan dalam
bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak),
pemisahan terjadi selama perambatan kapiler (pengembangan). Senyawa yang
tidak berwarna harus ditampakkan (dideteksi). Pemisahan senyawa aktif ekstrak
bintang laut dapat menggunakan teknik kromatografi lapis tipis (KLT). Teknik ini
merupakan suatu cara pemisahan komponen senyawa kimia di antara dua fase,
yaitu fase gerak dan fase diam (Kartasubrata 1987dalamHananiet al.2005).
Teknik tersebut hingga saat ini masih digunakan untuk mengidentifikasi
senyawa-senyawa kimia, karena murah, sederhana, serta dapat menganalisis
beberapa komponen secara serempak. Teknik standar dalam melaksanakan
pemisahan dengan KLT diawali dengan pembuatan lapisan tipis adsorben pada
permukaan plat kaca. Tebal lapisan bervariasi, bergantung pada analisis yang akan
dilakukan (kualitatif atau kuantitatif). Pemisahan komponen kimia dari ekstrak
kasar secara KLT bertujuan untuk mengetahui komponen-komponen yang
terdapat dalam ekstrak tersebut (Marliana et al. 2005). Percobaan dibuat dengan
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari 2012 sampai Juli 2012.
Pengambilan sampel dilakukan di Perairan Lampung Selatan, analisis aktivitas
antioksidan dilakukan di Laboratorium Karakteristik Bahan Baku, analisis
fitokimia di Laboratorium Mikrobiologi Hasil Perairan, dan Laboratorium
Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas
Perikanan dan Ilmu Kelautan; Laboratorium Kimia Analitik, Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam; dan Laboratorium
Biologi-Pusat Antar Universitas, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan utama yang digunakan untuk penelitian ini adalah bintang laut
Culcita sp. Bahan-bahan yang diperlukan dalam proses ekstraksi dan evaporasi
sampel meliputi pelarut heksana (p.a), etil asetat (p.a) dan metanol (p.a).
Bahan-bahan yang dibutuhkan untuk uji aktivitas antioksidan, yaitu ekstrak kasar bintang
laut dari 3 jenis pelarut, kristal diphenylpicrylhydrazyl (DPPH), metanol (p.a),
BHT (butil hidroksi toluen) sebagai kontrol positif, α-tokoferol, β-karoten, asam
askorbat sebagai antioksidan pembanding. Bahan-bahan yang dibutuhkan untuk
uji fitokimia meliputi pereaksi Wagner (uji alkaloid), pereaksi Meyer (uji
alkaloid), pereaksi Dragendorff (uji alkaloid), kloroform, anhidra asetat, asam
sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji flavonoid), air
panas, larutan HCl 2 N (uji saponin), etanol 70%, larutan FeCl3 5% (uji fenol
hidrokuinon), dan larutan ninhidrin 0,10% (uji ninhidrin). Bahan-bahan yang
dibutuhkan untuk pengujian kromatografi lapis tipis meliputi pelarut etil asetat
dan kloroform.
Alat-alat yang diperlukan dalam penelitian ini meliputi pisau, sudip,
cawan porselen, timbangan digital, aluminium foil, oven, kompor listrik, kertas
saring Whatman 42, bulb, kapas, pipet volumetrik, pipet mikro, labu Erlenmeyer
250 ml dan 500 ml, gelas ukur,blender,orbital shaker WiseShike SHO-1D,rotary
tabung reaksi, spektrofotometer UV-VIS Hitachi U-2800, pipet tetes, vortex,
sendok plastik, silika GF254Merck, pipa kapiler, gelas, alat semprot, dan pensil.
3.3 Metode Penelitian
Penelitian ini terdiri dari beberapa tahapan, yaitu tahapan pengambilan dan
preparasi bahan baku, tahapan pembuatan ekstrak senyawa aktif dari bintang laut,
pengujian fitokimia (alkaloid, steroid, flavonoid, saponin, fenol hidrokuinon, dan
ninhidrin), pengujian aktivitas antioksidan dengan metode DPPH, dan pengujian
kromatografi lapis tipis (KLT). Analisis aktivitas antioksidan (metode DPPH)
untuk mengetahui aktivitas antioksidan dari ekstrak masing-masing pelarut dan uji
fitokimia untuk menentukan senyawa kimia yang terdapat dalam bintang laut.
3.3.1 Tahapan pengambilan dan preparasi bahan baku
Pada tahap pengambilan sampel, bintang laut Culcita sp. berasal dari
Perairan Lampung Selatan. Bintang laut kemudian dikeringkan dengan suhu
rendah menggunakan freeze dryer dengan suhu kurang dari -40oC. Tujuan dari
proses pengeringan ini adalah untuk mengurangi kadar air dalam bahan yang
dikandungnya. Kadar air yang rendah menunjukkan bahwa air bebas dalam bahan
berada dalam jumlah yang rendah, sehingga proses pembusukan, hidrolisis
komponen aktif dan oksidasi dalam sampel selama dilakukan maserasi dapat
dihindari (Winarno 2008).
Bintang laut yang telah kering kemudian dihaluskan dengan hammer mills,
sehingga didapat tekstur yang halus. Ukuran sampel yang lebih kecil (bubuk atau
tepung) diharapkan dapat memperluas permukaan bahan yang dapat berkontak
langsung dengan pelarut, sehingga proses ekstraksi komponen aktif dapat berjalan
dengan maksimal. Bubuk atau tepung bintang laut akan digunakan dalam proses
ekstraksi.
3.3.2 Tahapan pembuatan ekstrak senyawa bioaktif dari bintang laut
Metode ekstraksi komponen aktif yang digunakan adalah metode ekstraksi
bertingkat dan ekstraksi tunggal. Metode ini menggunakan pelarut heksana (p.a),
etil asetat (p.a), dan metanol (p.a). Masing–masing sampel sebanyak 50 g
dimaserasi selama 3x24 jam dengan pelarut secara bertingkat heksana, etil asetat,
kemudian disaring dengan kertas saring Whatman 42. Filtrat ekstrak pelarut
masing-masing yang diperoleh kemudian dievaporasi sehingga semua pelarut
terpisah dari ekstrak menggunakan rotary vacuum evaporator pada suhu 50ºC,
500 mmHg, kemudian residu yang tersisa dibuang. Proses ini akan menghasilkan
ekstrak heksana, etil asetat, dan metanol yang kental. Proses ekstraksi bertingkat
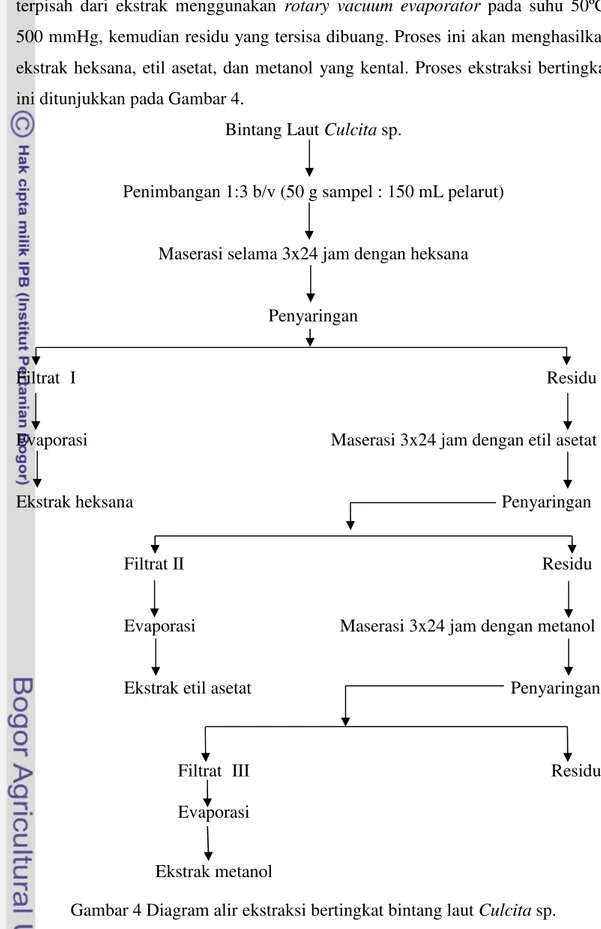
ini ditunjukkan pada Gambar 4.
Bintang LautCulcitasp.
Penimbangan 1:3 b/v (50 g sampel : 150 mL pelarut)
Maserasi selama 3x24 jam dengan heksana
Penyaringan
Filtrat I Residu
Evaporasi Maserasi 3x24 jam dengan etil asetat
Ekstrak heksana Penyaringan
Filtrat II Residu
Evaporasi Maserasi 3x24 jam dengan metanol
Ekstrak etil asetat Penyaringan
Filtrat III Residu
Evaporasi
Ekstrak metanol
3.3.3 Uji fitokimia (Harbone 1987)
Analisis fitokimia dilakukan untuk mengetahui keberadaan komponen
aktif secara kualitatif yang terdapat pada ekstrak kasar bintang laut. Analisis
fitokimia ditujukan untuk mengetahui keberadaan alkaloid, steroid, saponin,
flavonoid, fenol hidrokuinon, dan ninhidrin.
1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N
kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendorff, Meyer,
dan Wagner dengan cara menambahkan 1,36 HgCl2 dengan 0,5 g kalium iodida
lalu dilarutkan dan diencerkan dengan akuades menjadi 100 mL dalam labu takar.
Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat dengan cara 10 mL akuades
dipipet kemudian hasil uji dinyatakan positif bila dengan pereaksi Meyer
terbentuk endapan putih kekuningan, dengan pereaksi Wagner membentuk
endapan coklat dan dengan pereaksi Dragendorff membentuk endapan merah
sampai jingga. Pereaksi Meyer dibuat ditambahkan 2,5 g iodin dan 2 g kalium
iodida, kemudian dilarutkan dan diencerkan dengan akuades menjadi 200 mL
dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi Dragendorff dibuat dengan cara 0,8 g bismut subnitrat
ditambahkan dengan 10 mL asam asetat dan 40 mL air. Larutan ini dicampur
dengan larutan yang dibuat dari 8 g kalium iodida dalam 20 mL air. Sebelum
digunakan, 1 volume campuran ini diencerkan dengan 2,3 volume campuran 20
mL asam asetat glasial dan 100 mL air. Pereaksi ini berwarna jingga.
2) Steroid
Sejumlah sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi.
Anhidrida asetat sebanyak 10 tetes dan asam sulfat pekat sebanyak 3 tetes
ditambahkan ke dalam campuran tersebut. Hasil uji positif sampel mengandung
steroid dan triterpenoid yaitu terbentuknya larutan berwarna merah untuk pertama
kali kemudian berubah menjadi biru dan hijau.
3) Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 mL amil
mL alkohol, kemudian campuran dikocok. Hasil uji positif sampel mengandung
flavonoid, yaitu terbentuknya warna merah, kuning, atau jingga pada lapisan amil
alkohol.
4) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil
selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan
sampel mengandung saponin.
5) Fenol Hidrokuinon
Sampel sebanyak 1 g diekstrak dengan 20 mL etanol 70%. Larutan yang
dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3
5%. Hasil uji positif sampel mengandung senyawa fenol, yaitu terbentukya larutan
berwarna hijau atau hijau biru.
6) Ninhidrin
Larutan sampel sebanyak 2 mL ditambahkan beberapa tetes larutan
ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil
uji positif sampel mengandung asam amino, yaitu terbentuknya larutan berwarna
biru.
3.3.4 Uji aktivitas antioksidan dengan metode DPPH
Ekstrak kasar bintang laut dari hasil ekstraksi bertingkat menggunakan
pelarut heksana, etil asetat, dan metanol, dilarutkan dalam metanol (p.a) dengan
konsentrasi 200, 400, 600 dan 800 ppm. Antioksidan pembanding yang digunakan
yaitu antioksidan sintetik BHT dan antioksidan alami berupa α-tokoferol,
β-karoten, dan asam askorbat dan kontrol positif, dibuat dengan cara dilarutkan
dalam pelarut metanol p.a. dengan konsentrasi 2, 4, 6, dan 8 ppm. Larutan DPPH
yang digunakan, dibuat dengan melarutkan kristal DPPH dalam pelarut metanol
dengan konsentrasi 1 mM. Proses pembuatan larutan DPPH 1 mM dilakukan
dalam kondisi suhu rendah dan terlindung dari cahaya matahari.
Larutan ekstrak dan larutan antioksidan pembanding yang telah dibuat
dengan masing-masing tiga kali ulangan, diambil 4,5 mL dan direaksikan dengan
500 µL (0,5 mL) larutan DPPH 1 mM dalam tabung reaksi yang berbeda dan telah
menit dan diukur absorbansinya menggunakan spektrofotometer UV-VIS pada
panjang gelombang 517 nm. Absorbansi dari larutan blanko juga diukur untuk
melakukan perhitungan persen inhibisi. Larutan blanko dibuat dengan
mereaksikan 4,5 mL pelarut metanol dengan 500 µ L (0,5 mL) larutan DPPH 1
mM dalam tabung reaksi. Larutan blanko ini dibuat hanya satu kali ulangan saja.
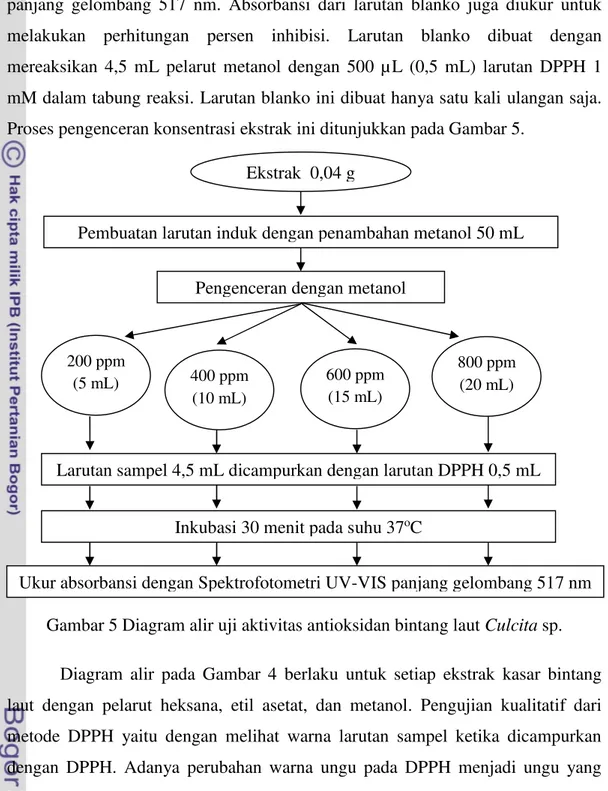
Proses pengenceran konsentrasi ekstrak ini ditunjukkan pada Gambar 5.
Gambar 5 Diagram alir uji aktivitas antioksidan bintang lautCulcitasp.
Diagram alir pada Gambar 4 berlaku untuk setiap ekstrak kasar bintang
laut dengan pelarut heksana, etil asetat, dan metanol. Pengujian kualitatif dari
metode DPPH yaitu dengan melihat warna larutan sampel ketika dicampurkan
dengan DPPH. Adanya perubahan warna ungu pada DPPH menjadi ungu yang
lebih muda atau adanya warna kuning ketika pencampuran dilakukan yang
menandakan terdapatnya aktivitas antioksidan pada larutan sampel bintang laut
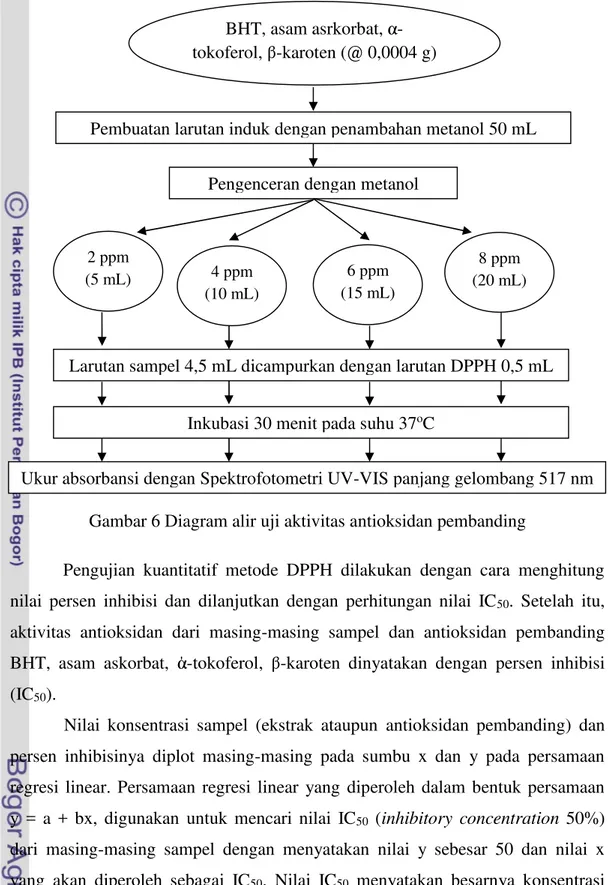
tersebut. Proses pengenceran konsentrasi pembanding ini ditunjukkan pada
Gambar 6.
Ekstrak 0,04 g
Pembuatan larutan induk dengan penambahan metanol 50 mL
Pengenceran dengan metanol
200 ppm
(5 mL) 600 ppm
(15 mL) 400 ppm
(10 mL)
800 ppm (20 mL)
Larutan sampel 4,5 mL dicampurkan dengan larutan DPPH 0,5 mL
Inkubasi 30 menit pada suhu 37oC
Gambar 6 Diagram alir uji aktivitas antioksidan pembanding
Pengujian kuantitatif metode DPPH dilakukan dengan cara menghitung
nilai persen inhibisi dan dilanjutkan dengan perhitungan nilai IC50. Setelah itu,
aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding
BHT, asam askorbat, ά-tokoferol, β-karoten dinyatakan dengan persen inhibisi
(IC50).
Nilai konsentrasi sampel (ekstrak ataupun antioksidan pembanding) dan
persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan
regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan
y = a + bx, digunakan untuk mencari nilai IC50 (inhibitory concentration 50%)
dari masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x
yang akan diperoleh sebagai IC50. Nilai IC50 menyatakan besarnya konsentrasi
larutan sampel (ekstrak ataupun antioksidan pembanding) yang dibutuhkan untuk
mereduksi radikal bebas DPPH sebesar 50%.
Pembuatan larutan induk dengan penambahan metanol 50 mL
Pengenceran dengan metanol
2 ppm
(5 mL) 6 ppm
(15 mL) 4 ppm
(10 mL)
8 ppm (20 mL)
Larutan sampel 4,5 mL dicampurkan dengan larutan DPPH 0,5 mL
Inkubasi 30 menit pada suhu 37oC
Ukur absorbansi dengan Spektrofotometri UV-VIS panjang gelombang 517 nm BHT, asam asrkorbat, α
3.3.5 Kromatografi Lapis Tipis (KLT) dan Bioautografi
Kromatografi lapis tipis adalah suatu metode pemisahan suatu senyawa
berdasarkan perbedaan distribusi dua fasa yaitu fase diam dan fase gerak. Fase
diam berupa plat yang digunakan terbuat dari silika GF254, sedangkan fase gerak
berupa larutan eluen yang digunakan. Plat KLT silika GF254 dioven pada suhu
105oC selama 10 menit untuk menghilangkan air yang terdapat pada plat.
Pemilihan pelarut untuk fraksinasi dilakukan dengan mencoba beberapa
kombinasi untuk mengembangkan spot ekstrak terpilih pada kromatografi lapis
tipis (KLT). Kombinasi yang digunakan adalah eluen campuran dari sampel hasil
ekstrak yang terbaik etil asetat yaitu kloroform:etil asetat: asam format (1:9:0,05).
Ekstrak terpilih sebanyak 0,02 g dilarutkan dalam 0,5 mL pelarutnya. Larutan
ekstrak tersebut kemudian ditotolkan pada plat silika dengan panjang 10 cm lebar
1,5 cm. Kombinasi pelarut yang menghasilkan pengembangan spot terbaik
digunakan sebagai eluen untuk memfraksinasi ekstrak terpilih dengan
kromatografi lapis tipis.
Penotolan dilakukan pada jarak ± 1 cm dari bawah plat KLT menggunakan
pipa kapiler. Apabila noda telah kering, plat dengan panjang 10 cm dielusi dengan
cara meletakkannya secara vertikal di dalam bejana pengembang atau gelas. Gelas
ini berisi campuran eluen yang sesuai untuk senyawa yang akan dipisahkan. Plat
KLT yang telah dimasukkan dalam gelas dibiarkan sampai terjadi pemisahan
dengan atasnya ditutup. Pemisahan ini terjadi karena adanya perbedaan kepolaran
senyawa dengan fase diam plat dan fase gerak yang digunakan. Proses elusi
dihentikan bilamana eluen telah mencapai ¾ plat KLT. Noda-noda hasil
pemisahan ini dapat diamati menggunakan lampuUV λ 254 nm.
Uji bioautografi dilakukan untuk mengetahui nilai Rf senyawa aktif
antioksidan menggunakan kromatografi lapis tipis. Prosedur uji bioautografi
adalah sebagai berikut: fraksi aktif etil asetat yang telah dicampur dengan
pelarutnya sebanyak 0,5 mg ditotolkan pada plat silika, kemudian dikembangkan
dengan fase gerak yang sesuai untuk pemisahan senyawa-senyawa yang terdapat
dalam fraksi, dalam penelitian ini digunakan fase gerak etil asetat:kloroform:asam
format (9:1:0,05). Plat KLT kemudian disemprot dengan larutan DPPH 1 mM,
Komponen aktif yang terdapat pada plat KLT ditunjukkan dengan adanya warna
kuning / putih setelah penyemprotan dengan DPPH.
3.4 Analisis Data
3.4.1 Rendemen ekstrak
Rendemen ekstrak adalah perbandingan antara bobot ekstrak yang
dihasilkan (gram) dengan bobot sampel awal sebelum diekstraksi (gram).
Rendemen ekstrak digunakan untuk menentukan berapa persen kandungan
bioaktif yang terdapat pada suatu bahan. Persentase rendemen ekstrak dihitung
dengan rumus sebagai berikut :
Keterangan:
Pr: Persen rendemen
Be: Bobot ekstrak
Bs: Bobot sampel awal
3.4.2 Persen inhibisi dan IC50
Persen inhibisi adalah perbandingan antara selisih dari absorbansi blanko
dan absorbansi sampel dengan absorbansi blanko. Persen inhibisi digunakan untuk
menentukan persentase hambatan dari suatu bahan yang dilakukan terhadap
senyawa radikal bebas. Persen inhibisi dihitung dengan rumus berikut:
Keterangan:
Pi: Persen inhibisi
Ab: Absorbansi blanko
As: Absorbansi sampel
Nilai persen inhibisi yang telah dihitung dari setiap konsentrasi
(200-800 ppm) selanjutnya digunakan untuk perhitungan IC50. Inhibitory
Concentration 50% (IC50) adalah nilai konsentrasi suatu bahan untuk
menghambat aktivitas DPPH sebesar 50%. Nilai konsentrasi dari larutan yang
telah diencerkan dari ekstrak dan persen inhibisi diplotkan masing-masing pada
sumbu x dan y. Kemudian nilai IC50 dihitung dengan regresi linear y = a(x) + b,
4.1 Karakteristik Bintang LautCulcitasp.
Culcita sp. merupakan jenis bintang laut yang memiliki lengan, berbentuk
segi lima, tubuhnya tebal seperti roti. Warna bintang laut ini menarik, biasanya
ujung duri berwarna kemerahan atau orange sedangkan permukaan lengan
berwarna abu-abu kebiruan. Bentuk seperti bintang, organ organ bercabang
kelima lengan, warna hitam, biru kecoklatan, merah jingga, kuning kecoklatan,
cokelat, dan hijau tua (Hutahuruk 2009). Banyak dijumpai dipantai, di daerah
terumbu karang, berpasir, dan padang lamun. Bintang laut yang digunakan dalam
penelitian ini memiliki warna kuning kecoklatan dan terdapat lengan berbentuk
simetris radial segilima. Morfologi bintang laut yang diambil dari perairan
Lampung Selatan dapat dilihat pada Gambar 7.
(a) (b)
Gambar 7 (a) Bintang lautCulcitasp. diambil dari Perairan Lampung Selatan (b) Bintang lautCulcitasp. dalam bentuk tepung yang telah difreeze
drying
Asteroidea juga sering disebut bintang laut. Bintang laut umumnya
memiliki lima lengan, tetapi kadang-kadang lebih yang memanjang dari suatu
cakram pusat. Permukaan bagian bawah lengan itu memiliki kaki tabung yang
dapat bertindak seperti cakram untuk menyedot. Bintang laut mengkoordinasi
kaki tabung tersebut untuk melekat di batuan dan merangkak secara
perlahan-lahan sementara kaki tabung tersebut memanjang, mencengkeram, berkontraksi,
melemas, memajang, kemudian mencengkeram lagi. Bintang laut menggunakan
kaki tabungnya untuk menjerat mangsanya misalnya remis dan tiram. Lengan
bintang laut mengapit bivalvia yang menutup, kemudian mengeluarkan
kemudian mengekresikan getah pencernaan dan mencerna bivalvia di dalam
cangkangnya (Aziz dan Al-Hakim 2007).
Tubuh bintang laut memiliki duri tumpul dan pendek. Duri tersebut ada
yang termodifikasi menjadi bentuk seperti catut yang disebut pediselaria. Fungsi
pediselaria adalah untuk menangkap makanan serta melindungi permukaan tubuh
dari kotoran. Bagian tubuh dengan mulut disebut bagian oral, sedangkan bagian
tubuh dengan lubang anus disebut aboral. Hewan ini memiliki kaki ambulakral
selain untuk bergerak juga merupakan alat pengisap sehingga dapat melekat kuat
pada suatu dasar. Bintang laut bersifatdioeciusdengan fertilisasi eksternal.
4.2 Rendemen Ekstrak Bintang LautCulcitasp.
Proses ekstraksi bertujuan untuk mendapatkan bagian-bagian tertentu dari
suatu bahan yang mengandung komponen-komponen aktif. Proses ekstraksi pada
penelitian ini meliputi proses pengeringan sampel menggunakan freeze drying,
penghancuran sampel sampai menjadi bubuk menggunakan hammer mills,
maserasi dengan berbagai jenis pelarut (non polar-semi polar-polar), penyaringan,
dan evaporasi menggunakan vacuum rotary evaporator. Sampel yang digunakan
merupakan seluruh bagian dari bintang laut. Proses ekstraksi yang dilakukan
adalahekstraksi bertingkat dan ekstraksi tunggal dengan menggunakan pelarut
heksana (non polar), etil asetat (semi polar), dan metanol (polar).
Kesempurnaan esktraksi bertingkat tergantung pada jenis ekstraksi yang
dilakukan, terutama apabila ekstraksi dilakukan secara berulang dengan jumlah
pelarut sedikit demi sedikit. Ekstraksi dengan pelarut heksana dilakukan pada
awal proses dengan tujuan memisahkan lipid dari bahan sehingga tidak
menghalangi keluarnya senyawa bioaktif pada ekstraksi dengan pelarut-pelarut
berikutnya. Proses ekstraksi selanjutnya digunakan pelarut etil asetat untuk
mengekstrak senyawa semi polar dan terakhir pelarut metanol untuk mengekstrak
senyawa polar.
Proses maserasi dilakukan selama 24 jam dengan cara merendam sampel
dalam pelarut dengan perbandingan 1:3 (b/v). Pengadukan dilakukan sebanyak
beberapa kali untuk meningkatkan tumbukan antara partikel bahan yang
diekstraksi dengan pelarut sehingga komponen aktif yang keluar dari jaringan dan
pemisahan yang terdiri dari penyaringan dan evaporasi. Penyaringan dengan
kertas saring Whatman 42 dilakukan untuk memisahkan ampas bintang laut
dengan filtrat yang mengandung senyawa aktif. Tahap evaporasi dilakukan dalam
penguap putar yang hampa (rotary vacuum evaporator) pada suhu tidak terlalu
tinggi (30-50oC) untuk mencegah terjadi kerusakan pada komponen aktif. Nilai
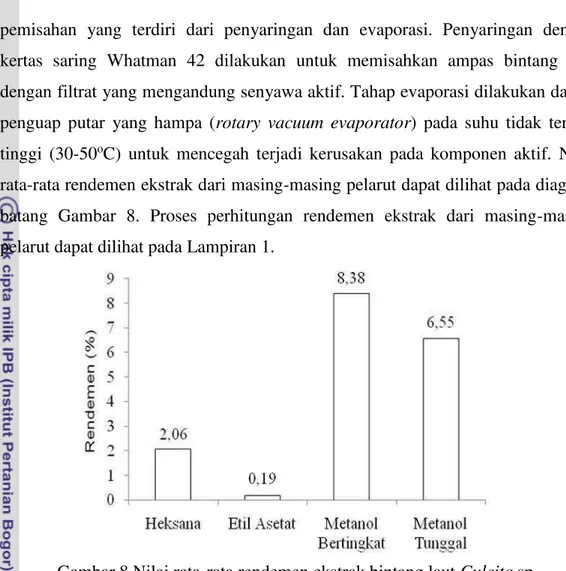
rata-rata rendemen ekstrak dari masing-masing pelarut dapat dilihat pada diagram
batang Gambar 8. Proses perhitungan rendemen ekstrak dari masing-masing
pelarut dapat dilihat pada Lampiran 1.
Gambar 8 Nilai rata-rata rendemen ekstrak bintang lautCulcitasp.
Rendemen merupakan perbandingan berat ekstrak yang diperoleh dengan
bobot awal sampel yang digunakan. Rendemen menggambarkan efektivitas
pelarut tertentu terhadap bahan dalam suatu sistem tetapi tidak menunjukkan
tingkat aktivitas esktrak tersebut. Komponen yang terbawa pada proses ekstraksi
adalah komponen yang memiliki polaritas yang sesuai dengan pelarutnya. Jenis
pelarut yang digunakan mempengaruhi jumlah rendemen yang dihasilkan.
Semakin kecil ukuran partikel maka semakin luas terjadinya kontak dengan
pelarut (Hafiluddin 2011).
Rendemen yang paling banyak dihasilkan yaitu ekstraksi bertingkat dan
ekstraksi tunggal dengan pelarut metanol. Metanol bertingkat menghasilkan
8,38% dari 50 g sampel bintang laut dan metanol tunggal menghasilkan 6,55%
dari 10 g sampel bintang laut. Hasil rendemen yang paling sedikit dihasilkan dari
50 g sampel bintang laut. Hasil ekstrak yang diperoleh akan sangat bergantung
pada beberapa faktor, yaitu kondisi alamiah senyawa tersebut, metode ekstraksi
yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama
waktu ekstraksi, serta perbandingan jumlah pelarut terhadap jumlah sampel
(Harborne 1987; Darusmanet al. 1995).
Kandungan bahan dan senyawa kimia akan mudah larut pada pelarut yang
relatif sama kepolarannya. Pelarut yang bersifat polar, mampu mengekstrak
senyawa alkaloid kuartener, komponen fenolik, karotenoid, tannin, gula, asam
amino, dan glikosida (Harborne 1987). Jenis dan mutu dari pelarut yang
digunakan menentukan proses saat ekstraksi. Pelarut yang digunakan harus dapat
melarutkan zat yang diinginkannya, mempunyai titik didih yang rendah, murah,
tidak toksik, dan mudah terbakar (Ketaren 1986 dalam Andriyanti 2009). Selain
itu juga, proses ekstraksi tergantung pada banyaknya ekstraksi yang dilakukan.
Hasil yang baik diperoleh jika ekstraksi dilakukan secara berulang-ulang dengan
jumlah pelarut yang sedikit-sedikit (Khopkar 2003).
Berdasarkan hasil penelitian Salamah et al. (2008) menunjukkan bahwa
maserasi dengan jenis pelarut yang berbeda akan menghasilkan rendemen ekstrak
yang berbeda pula. Penelitian ini menghasilkan kadar komponen aktif yang
bersifat polar, semipolar, dan nonpolar terdapat dalam jumlah yang berbeda-beda.
Hal ini karena pelarut yang berbeda akan melarutkan senyawa-senyawa yang
berbeda tergantung pada tingkat kepolaran dan tingkat ketersediaannya dalam
bahan yang diekstrak. Proses evaporasi dari filtrat bintang laut dengan ketiga jenis
pelarut menghasilkan ekstrak kasar dengan karakteristik yang berbeda-beda.
Hasil ekstrak kasar bintang laut dengan berbagai jenis pelarut dapat dilihat
pada Gambar 9. Ekstrak heksana berwarna oranye tua dan kering, ekstrak etil
asetat memiliki warna oranye yang lebih muda dan kering, sedangkan ekstrak
metanol bertingkat dan tunggal memiliki warna oranye yang pekat dan sedikit
basah. Ekstrak metanol bertingkat maupun tunggal berbentuk pasta yang kental
dan lebih banyak dibanding dengan ekstrak heksana dan etil asetat. Tingginya
rendemen pada pelarut polar juga dilaporkan oleh Nurjanah (2009), rendemen
Safitri (2010) juga melaporkan rendemen lili laut dengan pelarut etanol sebesar
1,40%.
( a ) ( b ) ( c ) ( d )
Gambar 9 Ekstrak kasar bintang laut (Culcitasp.), (a) heksana, (b) etil asetat, (c) metanol bertingkat, dan (d) metanol tunggal
Gambar 8 menunjukkan bahwa untuk ekstrak kasar bintang laut dengan
pelarut metanol secara bertingkat dan metanol secara tunggal memiliki rendemen
yang lebih besar jika dibandingkan menggunakan pelarut heksana dan etil asetat.
Kandungan komponen aktif yang bersifat polar pada filum Echinodermata
terdapat dalam jumlah yang lebih banyak dibandingkan komponen-komponen
aktif lain yang bersifat nonpolar dan semipolar. Berdasarkan hasil penelitian
Salamahet al. (2008) pada kijing taiwan (Anadonta woodianaLea.) dan Nurjanah
(2009) pada lintah laut (Discodorissp.) dimana ekstrak polar dari masing-masing
komoditas tersebut terdapat dalam jumlah yang paling banyak dibandingkan
dengan ekstrak semipolar dan nonpolar. Nurjanah (2009) menyatakan, pelarut
metanol diketahui dapat menarik semua komponen baik yang bersifat polar,
semipolar, maupun nonpolar. Metanol sebagai pelarut paling akhir pada proses
ekstraksi diduga menarik semua komponen aktif yang tertinggal pada ekstraksi
sebelumnya sehingga rendemen ekstrak metanol cukup besar.
4.3 Komponen Aktif pada Ekstrak Kasar Bintang LautCulcitasp.
Ekstrak kasar hasil ekstraksi bintang laut mengunakan tiga pelarut yang
berbeda, yaitu heksana (non polar), etil asetat (semi polar), dan metanol (polar)