EFEKTIVITAS TANAMAN AIR DALAM PEMBERSIHAN
LOGAM BERAT PADA AIR ASAM TAMBANG
MADANIYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
1Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Tanaman Air dalam Pembersihan Logam Berat pada Air Asam Tambang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015 Madaniyah NIM A154130161
RINGKASAN
MADANIYAH. Efektivitas Tanaman Air dalam Pembersihan Logam Berat pada Air Asam Tambang. Dibimbing oleh ANAS MIFTAH FAUZI dan IRDIKA MANSUR.
Indonesia adalah salah satu negara penghasil batubara di dunia. Sebagian besar kegiatan pertambangan batubara di Indonesia dilakukan dengan metode tambang terbuka (open pit mine). Salah satu perusahaan tambang batubara di Indonesia yang menggunakan metode penambangan terbuka yaitu PT. Bukit Asam (Persero) Tbk. Permasalahan paling berat pada kegiatan penambangan batubara secara terbuka yaitu terjadinya fenomena air asam tambang (AAT). AAT terbentuk karena oksidasi mineral-mineral sulfida yang terekspos ke lingkungan dengan kehadiran air sehingga timbul air tambang yang bersifat asam. Permasalahan AAT ini bukan hanya akan dihadapi pada masa kini, tetapi akan tetap menjadi permasalahan lingkungan yang serius di masa yang akan datang sehingga memerlukan penanganan jangka panjang yang serius dan sistematis. Selama ini, pengendalian AAT yang banyak dilakukan yaitu pengendalian secara aktif dengan pemberian kapur tohor pada aliran AAT. Pengendalian secara aktif ini hanya untuk meningkatkan pH air tetapi tidak memperbaiki kualitas air di kolam bekas tambang. Salah satu metode penanganan AAT adalah pengolahan AAT secara pasif (Passive Treatment). Salah satu bentuk passive treatment dalam pengolahan AAT adalah sistem constructed wetland atau dengan lahan basah. Keberadaan lahan basah dalam pengelolaan AAT dapat meningkatkan pH dan menurunkan kadar logam terlarut. Pemilihan tanaman air untuk lahan basah ini juga perlu dipertimbangkan untuk efektifitas peningkatan pH AAT dan penyerapan logam berat.
Dalam rangka mengembangkan proses remediasi AAT dan mencari tanaman air lokal yang efektif meningkatkan pH dan menyerap logam berat yang terkandung dalam AAT, maka penelitian ini menggunakan tanaman air yaitu kayu apu (Pistia stratiotes), kiambang (Salvinia cucullata) dan enceng gondok (Eichornia crassipes). Tujuan dari penelitian ini adalah: (i) Menganalisis kinerja tanaman kayu apu, kiambang dan enceng gondok dalam meningkatkan pH dan penurunan kadar logam yang terdapat pada AAT serta penyebaran dan komposisi logam berat dari permukaan sampai dasar kolam, (ii) Mengetahui karakteristik hasil pengolahan AAT dengan menggunakan lahan basah dan tanaman air baik sebelum dan sesudah proses melalui parameter nilai pH, kadar besi (Fe) terlarut, kadar mangan (Mn) terlarut dan Total Suspended Solid (TSS).
sebelum digunakan. Sampel AAT diambil dari kolam penampungan Stockpile-1 yang terlebih dahulu dianalisis kandungan Fe, Mn, Sulfat, TSS, dan nilai pH AAT kemudian ditambahkan pada kolam percobaan dengan tinggi muka air ±42 cm. Aplikasi perlakuan adalah sebagai berikut: (i) AAT + Matrik Lahan Basah (MLB) tanpa tanaman uji (Kontrol), (ii) AAT + MLB + kayu apu, (iii) AAT + MLB + kiambang, (iv) AAT + MLB + enceng gondok. Pengambilan sampel air dilakukan setiap 3 hari sampai hari ke 29. Sampel tersebut kemudian dianalisa pH, kadar Fe, Mn dan TSS dilaboratorium. Data yang diperoleh dianalisis menggunakan Analisis Varian (Anova) pada taraf kepercayaan 95% dengan menggunakan software SAS. Jika terdapat pengaruh perlakuan, maka dilakukan uji lanjut dengan uji DMRT (Duncan Multiple Range Test) pada taraf kepercayaan 95%.
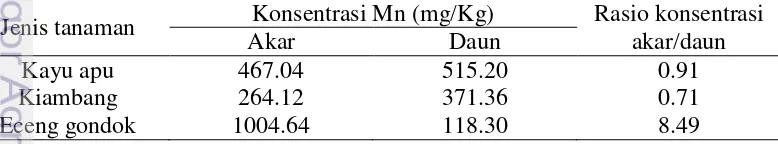
Hasil Penelitian menunjukkan bahwa penggunaan tanaman air dapat memberikan pengaruh terhadap nilai pH, kadar Fe, kadar Mn, dan TSS air asam tambang. Semua perlakuan efektif meningkatkan pH menjadi sesuai baku mutu dalam waktu 3 hari. Perlakuan dengan pemberian tanaman enceng gondok pada kolam lahan basah memberikan pengaruh terhadap penurunan kadar Fe-terlarut dan Mn-terlarut dalam kolam lahan basahdengan persentase efektifitas penurunan 90-99%. Konsentrasi Fe dan Mn tertinggi dalam tanaman ditemukan pada perlakuan dengan tanaman enceng gondok dengan prosentase penyerapan berturut turut 35.5% untuk penyerapan Fe dan 61.59% untuk penyerapan Mn. Secara umum, hasil penelitian menunjukkan bahwa bagian akar memiliki kadar logam lebih besar dibandingkan bagian pucuk pada tanaman enceng gondok yang mengindikasikan bahwa tanaman eceng gondok tidak dapat mengakumulasi logam di bagian pucuk, translokasi dibatasi hanya di bagian akar. Tanaman kayu apu dan kiambang menunjukkan TF>1 pada logam Mn yang dapat diartikan kedua tanaman tersebut tidak hanya mengakumulasi logam Mn di akar tapi juga mampu mentranslokasi logam Mn pada daun.
Penyebaran dan komposisi logam Fe dalam kolam menunjukkan bahwa logam Fe banyak terakumulasi pada bagian dasar kolam atau dengan kata lain logam Fe selain diserap oleh tanaman juga diendapkan. Penyebaran dan komposisi logam Mn dalam kolam menunjukkan bahwa logam Mn baik pada bagian permukaan kolam, tengah kolam dan dasar kolam tidak jauh berbeda. Logam Mn tidak mudah diendapkan. Karakteristik hasil pengolahan air asam tambang secara passive treatment melalui lahan basah dengan menggunakan kayu apu, kiambang dan enceng gondok pada akhir penelitian telah memenuhi baku mutu lingkungan yang dipersyaratkan menurut Keputusan Menteri Negara Lingkungan Hidup Nomor 113 Tahun 2003 dan SK Gubernur Sumatera Selatan Nomor 16 Tahun 2005 tentang Baku Mutu Air Sungai.
SUMMARY
MADANIYAH. Effectivness of Water Plant for Metal Cleaning in Acid Mine Drainage. Supervised by ANAS MIFTAH FAUZI and IRDIKA MANSUR.
Indonesia is one of the coal-producing countries in the world. Most of the coal mining activities in Indonesia carried out by open pit mining. One of the coal mining company in Indonesia that use open pit mining methods, namely PT Bukit Asam (Persero). Tbk. The most severe problem in the open pit mining activites is Acid Mine Drainage (AMD) phenomenon. AMD formed due to the oxidation of sulfide minerals exposed to an environment with the presence of water causing the acidic mining water. The AMD problem is not only would be faced currently, but will remain be a serious environmental problem in the future so that it requires a serious and systematic long-term treatment. During this time, AMD control which is mostly done is actively control with giving limestone on the flow of AMD. This active control is only to increase pH of the water but it does not fix water quality in the ex-mining ponds. One of the interesting technology in the AMD treatment is passive treatment i.e. Constructed Wetland system or wetlands. The existence of wetlands on the AMD management can increase pH and reduce level of dissolved metals. Selection of aquatic plants for wetland also need to be considered for effectivity of an increase of pH and heavy metal absorption.
In order to develop a remediation process of AMD and look for the effective aquatic plants in increasing pH and absorb heavy metals contained in AMD, therefore this study used the aquatic plants such us kayu apu (Pistia stratiotes) and kiambang (Salvinia cucullata) and water hyacinth (Eichornia crassipes). The objectives of this study were: (i) to analyze performance of water hyacinth, kayu apu and kiambang in increasing pH and decreasing level of metals contained in the AMD, distribution and composition of heavy metals from the surface to the bottom of the pool, (ii) To determine the characteristics of the processing results of AMD using wetlands and aquatic plants, both before and after the process through the parameters such us pH, levels of dissolved iron (Fe), levels of dissolved manganese (Mn) and Total Suspended Solid (TSS).
29 days and observations were done every 3 days by taking random samples of aquatic plants. Data were analyzed using analysis of variance (ANOVA) at the level of 95% by SAS software. If there is a treatment effect, then further tests would be done by DMRT (Duncan Multiple Range Test) at the level of 95%.
The results showed that aquatic plants can give effect to pH value, the level of Fe, Mn content and TSS in AMD. Aquatic plants were effective in increasing pH of AMD with retention time of 14 days. The water hyacinth plant showed its effectivity in decreasing the levels of Fe and Mn until 90-99%. The highest concentrations of Fe and Mn in plant found in treatment with water hyacinth with percentage of reduction of Fe 35.5% and 61.59% for Mn. Metals absorption by plants were much accumulated in the roots compare to the leaves. the roots have a higher metal content than leave on the water hyacinth plant which indicates that the water hyacinth plants not accumulate metals in the leave, translocation is restricted only in the roots. Kayu apu and kiambang shows TF> 1 in Mn metal which can be interpreted both these plants not only accumulate Mn metals in roots but is also able to translocate the Mn metal in the leaves.
Deployment and composition of metallic Fe in the pool shows that the metals Fe much accumulated at the bottom of the pond or in other words Metals Fe besides absorbed by plants was also precipitated by the chelating agent and organic materials. Deployment and composition of the Mn metal in the pool shows that the Mn metal both on the surface of the pond, in middle pond and in the bottom of the pool is not much different, although quantitatively Mn metal in the bottom of the pool is more widely. Mn metal is not easily deposited. Characteristics of acid mine water in passive treatment through wetlands with kayu apu, kiambang and water hyacinth at the end of the study have met the environmental standards required by the Decree of the Minister of the Environment No. 113 of 2003 and Decree of the Governor of South Sumatra No. 16 of 2005 on River Water Quality Standard.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi Tanah dan Lingkungan
EFEKTIVITAS TANAMAN AIR DALAM PEMBERSIHAN
LOGAM BERAT PADA AIR ASAM TAMBANG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan salam semoga tercurah kepada Rasulullah SAW. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini adalah tanaman air, dengan judul Efektivitas Tanaman Air dalam Pembersihan Logam Berat pada Air Asam Tambang.
Penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada yang terhormat: Prof Dr Ir Anas Miftah Fauzi, MEng selaku ketua komisi pembimbing, Dr Ir Irdika Mansur, MForSc sebagai anggota komisi pembimbing, atas kerelaannya dalam membekali penulis dengan ilmu pengetahuan, saran, koreksi, dan motivasi sehingga karya tulis dapat diselesaikan dengan baik. Ucapan terimakasih dan penghargaan setinggi-tingginya, juga disampaikan kepada Dr Ir Mohamad Yani, MEng yang telah bersedia menjadi dosen penguji dan banyak memberi masukan mendasar pada keseluruhan isi tesis ini.
Terima kasih kepada Rektor IPB, Dekan SPs IPB, Dekan Fakultas Pertanian IPB yang telah memberikan izin dan kesempatan kepada penulis untuk mengikuti pendidikan program Magister di Sekolah Pascasarjana IPB. Terima kasih kepada Direktur Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah memberikan dukungan dana kuliah pada tahun 2013-2015 pada program beasiswa BPPDN 2013, kepada Ketua Program Studi Bioteknologi Tanah dan Lingkungan SPs IPB beserta staf atas semua bantuan administrasi serta kepada Staf Laboratorium Bioteknologi Tanah.
Penghargaan penulis sampaikan juga kepada Senior Manajer Pengelolaan Lingkungan dan Penunjang Tambang (Bapak Muhammad Bagir) dan Manajer Pengelolaan Lingkungan (Bapak Suhendi Arensta) PT. Bukit Asam (Persero) Tbk. beserta staf yang telah mengizinkan dan membantu pelaksanaan penelitian di PT. Bukit Asam (Persero) Tbk, Teman teman seperjuangan Zahriska Dewani SSi, Firmansyah Adi Prianto ST atas dukungan dan kerjasamanya, rekan-rekan mahasiswa S2 Program Studi Bioteknologi Tanah dan Lingkungan angkatan 2013 Vera Oktavia SP, Maipa Dia Pati SSi dan Deni Pratama SP, serta pihak lain yang tidak dapat disebut nama satu persatu atas kerjasamanya.
Ucapan terima kasih khusus penulis sampaikan kepada keluarga besar penulis. Terimakasih yang sangat dalam kepada ayahanda (Bapak Abd. Samad) dan Ibunda (Ibu Mahkamah) yang telah berjasa membesarkan, mendidik dan membentuk karakter penulis, kepada kakak dan adik serta keluarga besar, penulis ucapkan terimakasih atas dukungannya. Terakhir penulis ucapkan terimakasih kepada Mohammad Ridho atas dukungan semangatnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Air Asam Tambang 3
Teknik Remediasi Air Asam Tambang 8
Pengolahan Limbah Air Asam Tambang dengan Tanaman 9
Tanaman Air 10
3 METODE PENELITIAN 13
Waktu dan Tempat Penelitian 13
Bahan 13
Alat 14
Prosedur Penelitian 14
Pengambilan dan Aklimatisasi Tanaman Air 14
Pembuatan Lahan Basah Buatan 14
Perlakuan Fitoremediasi 15
Isolasi Total Populasi Mikrob 17
Analisis Data 17
4 HASIL DAN PEMBAHASAN 17
Karakteristik Limbah AAT Stockpile 1- IUP Air Laya 17
Pengaruh Tanaman Air Terhadap Nilai pH 18
Pengaruh Tanaman Air Terhadap Kadar Fe dan Mn dalam Wetland 20 Akumulasi Fe dan Mn dalam Jaringan Tanaman 25 Pengaruh Tanaman Air Terhadap Kadar Total Suspended Solid (TSS) 28
5 SIMPULAN DAN SARAN 31
Simpulan 31
Saran 31
DAFTAR PUSTAKA 32
LAMPIRAN 36
DAFTAR TABEL
1 Komposisi material lahan basah aerobik pada pengelolaan AAT secara
pasif 15
2 Metode Pengukuran Parameter 16
3 Karakteristik kimia limbah air asam tambang Stockpile-1 18 4 Total populasi mikrob aerob dan anaerob setelah perlakuan pada
berbagai lahan basah yang ditanami tanaman uji. 24 5 Kadar Fe pada akar dan daun tanaman kayu apu (Pistia stratiotes),
kiambang (Salvinia cucullata) dan enceng gondok (Eichornia
crassipes) 25
6 Konsentrasi Fe dalam jaringan tanaman kayu apu (Pistia stratiotes), kiambang (Salvinia cucullata) dan enceng gondok (Eichornia
crassipes) 26
7 Kadar Mn pada akar dan daun tanaman kayu apu (Pistia stratiotes), kiambang (Salvinia cucullata) dan enceng gondok (Eichornia
crassipes) 27
8 Konsentrasi Mn dalam jaringan tanaman kayu apu (Pistia stratiotes), kiambang (Salvinia cucullata) dan enceng gondok (Eichornia
crassipes) 27
DAFTAR GAMBAR
1 Proses pelarutan mineral pirit oleh bakteri Thiobacillus sp. (Sumber:
Naveke 1986) 6
2 Macam-macam kontaminan yang bisa dihilangkan oleh spesies
tanaman air 10
3 Desain lahan basah buatan 14
4 Perubahan pH pada (A) bagian permukaan lahan basah (B) bagian tengah (20-25 cm dari permukaan) dan (C) bagian bawah (35-40 cm dari permukaan) selama 29 hari masa percobaan. 19 5 Perubahan konsentrasi Fe terlarut pada (A) bagian permukaan lahan
basah (B) bagian tengah (20-25 cm dari permukaan) dan (C) bagian bawah (35-40 cm dari permukaan) selama 29 hari masa percobaan. 21 6 Perubahan konsentrasi Mn terlarut pada (A) bagian permukaan lahan
basah (B) bagian tengah (20-25 cm dari permukaan) dan (C) bagian bawah (35-40 cm dari permukaan) selama 29 hari masa percobaan. 23 7 Profil kadar TSS pada (A) bagian permukaan lahan basah (B) bagian
tengah dan (C) bagian bawah wetland selama 29 hari masa percobaan. 29
DAFTAR LAMPIRAN
1 Proses pembuatan kolam percobaan dan pengambilan sampel air 36 2 Jumlah tanaman kayu apu, kiambang dan eceng gondok selama masa
percobaan. 37
3 Perhitungan konsentrasi logam Fe, Mn dan total biomassa tanaman
kayu apu. 37
4 Perhitungan konsentrasi logam Fe, Mn dan total biomassa tanaman
kiambang. 40
5 Perhitungan konsentrasi logam Fe, Mn dan total biomassa tanaman
1
PENDAHULUAN
Latar Belakang
Indonesia dalam pertambangan batubara memegang peringkat keempat sebagai penghasil batubara di dunia, setelah Cina, Amerika Serikat dan Australia (BP 2014). Posisi ini secara tidak langsung menunjukkan tingginya aktivitas penambangan batubara yang dilakukan di Indonesia. Sebagian besar kegiatan pertambangan batubara di Indonesia dilakukan dengan metode tambang terbuka (open pit mine). Salah satu perusahaan tambang batubara di Indonesia yang menggunakan metode penambangan terbuka yaitu PT Bukit Asam (Persero) Tbk. PT Bukit Asam (Persero) Tbk. merupakan salah satu tambang batubara terbesar di Indonesia yang beroperasi di wilayah Tanjung Enim, Kabupaten Muara Enim, Provinsi Sumatera Selatan. Penambangan terbuka batubara dapat menyebabkan kerusakan lingkungan akibat kegiatan eksploitasinya.
Permasalahan paling berat pada kegiatan penambangan batubara secara terbuka yaitu tereksposnya mineral-mineral yang bersifat reduktif seperti mineral bersulfur ke lingkungan yang dapat menyebabkan timbulnya air tambang yang bersifat asam secara terus menerus yang disebut dengan air asam tambang. Air asam tambang adalah air yang terbentuk akibat oksidasi mineral sulfida yang terpajan atau terdedah (exposed) di udara dengan kehadiran air (Lottermoser 2010) yang dikatalis oleh bakteri pengoksida besi dan sulfur, seperti Thiobacillus ferrooxidans, Leptospirillum ferrooxidans dan Thiobacillus thiooxidans (Schipper 2004; Cohen 2005; Johnson dan Hallberg 2005). Air asam tambang ini dapat mengakibatkan pencemaran badan air sehingga mencemari bukan hanya daerah penambangan akan tetapi juga daerah hilir.
Dengan menurunnya harga batubara dunia sebagai dampak dari menurunnya harga minyak dunia dikhawatirkan akan menyebabkan banyak lahan-lahan tambang batubara yang akan ditinggalkan dan tidak dikelola dengan baik karena tidak ekonomis lagi dilakukan kegiatan penambangan. Hal tersebut akan berdampak pada banyak lahan bekas bukaan tambang yang tidak dilakukan pengelolaan lingkungannya termasuk pengelolaan air asam tambang. Permasalahan air asam tambang ini bukan hanya akan dihadapi pada masa kini, tetapi akan tetap menjadi permasalahan lingkungan yang serius di masa yang akan datang sehingga memerlukan penanganan jangka panjang yang serius dan sistematis. Selama ini, pengendalian air asam tambang yang banyak dilakukan oleh perusahaan pertambangan untuk meningkatkan pH yaitu pengendalian secara aktif dengan pemberian kapur tohor pada aliran air asam tambang. Metode ini mempunyai kelemahan yaitu membutuhkan biaya yang mahal dan harus menambahkan bahan alkali secara terus menerus. Selain itu, pengolahan secara aktif juga dapat menyebabkan terbentuknya beban pencemaran baru yaitu sludge yang berasal dari endapan gipsum (CaSO4) yang harus dikuras secara berkala
(Johnson dan Hallberg 2005). Pengendalian secara aktif ini hanya untuk meningkatkan pH air tetapi tidak memperbaiki kualitas air di kolam bekas tambang.
2
efektif meningkatkan pH dan menurunkan kandungan logam pada air asam tambang. Penggunaan passive treatment dalam pengolahan air asam tambang hanya memerlukan dana pada awal pembangunan serta sedikit perawatan dan tidak memerlukan tenaga manusia yang sering ke lokasi instalasi pengolahan air asam tambang. Hal ini tentu sangat efisien dalam pengelolaan air asam tambang selama pasca penambangan. Salah satu passive treatment dalam pengolahan air asam tambang adalah sistem constructed wetland atau lahan basah.
Secara alamiah, pada sistem lahan basah terjadi proses-proses biologi, kimia dan fisika karena adanya interaksi antara tumbuhan penyusun lahan basah dengan lingkungannya tersebut. Adanya tanaman pada sistem lahan basah ini memberikan kontribusi dalam peningkatan kandungan bahan organik melalui zat-zat hasil sekresi dan dekomposisi sisa tanaman, membantu menstabilkan substrat, membantu menjaga populasi mikroba, dan memberikan kualitas estetika untuk lahan basah (Herniwanti et al. 2013). Keuntungan dari sistem ini adalah biaya operasional yang dibutuhkan relatif kecil dibandingkan dengan sistem penambahan bahan kimia alkalin.
Pemilihan tanaman air untuk lahan basah ini juga perlu dipertimbangkan untuk efektifitas peningkatan pH air asam tambang dan penyerapan logam berat. Beberapa tanaman air yang telah diteliti efektif untuk pengolahan air asam tambang adalah Eichornia sp,, Lepironia sp (Henny et al. 2010), Eleocharis dulcis, Cyperus odoratus, Hydrilla Vercilata, Ipomea aquatic, dan Pistia Stratatiotes (Herniwanti et al. 2013). Pengetahuan bahwa tanaman aquatic (air) dan semiaquatic seperti Eichornia crassipes, Hydrocotyle umbellata, Lemna minor dan Azolla pinnata dapat menyerap logam berat timbal (Pb), tembaga (Cu), kadmium (Cd), besi (Fe) dan merkuri (Hg) dari larutan terkontaminasi telah lama diketahui (Salt et al. 1995). Kemampuan ini sekarang digunakan dalam beberapa kontruksi lahan basah dan mungkin menjadi efektif dalam menghilangkan beberapa logam berat seperti bahan organik dari air.
Berdasarkan pada penjelasan di atas dan dalam rangka mencari tanaman air lokal yang efektif meningkatkan pH dan menyerap logam berat yang terkandung dalam air asam tambang, maka dilakukan penelitian ini yang bertujuan untuk mengetahui peningkatan pH dan penurunan konsentrasi logam berat pada air asam tambang dengan menggunakan tanaman air yaitu kayu apu (Pistia stratiotes), kiambang (Salvinia cucullata) dan enceng gondok (Eichornia crassipes). Tanaman ini adalah jenis tanaman mengapung (floating) yang dapat digunakan untuk pengolahan limbah karena tingkat pertumbuhannya tinggi dan kemampuannya untuk menyerap hara langsung dari kolam air. Akarnya menjadi tempat filtrasi dan adsorpsi padatan tersuspensi serta menjadi tempat pertumbuhan mikrob (Saeni 1989).
Perumusan Masalah
Berdasarkan penjelasan di atas, rumusan masalah penelitian ini yaitu:
3 2. Bagaimana penyebaran dan komposisi logam berat dari permukaan sampai
dasar kolam?
3. Bagaimana karakteristik hasil pengolahan air asam tambang secara passive treatment melalui lahan basah dengan menggunakan kayu apu, kiambang dan enceng gondok?
Tujuan Penelitian
Berdasarkan latar belakang yang telah di uraikan di atas, air asam tambang menjadi permasalahan utama pada proses penambangan. Pemanfaatan tanaman dan penggunaan bioteknologi dalam pengelolaan air asam tambang dapat menurunkan pH dan mengurangi toksisitas logam yang beracun. Dalam rangka mengembangkan proses remediasi air asam tambang dan mencari tanaman air lokal yang efektif meningkatkan pH dan menyerap logam berat yang terkandung dalam air asam tambang, maka penelitian menggunakan tanaman air yaitu kayu apu, kiambang dan enceng gondok sangat diperlukan. Oleh karena itu penelitian ini bertujuan untuk:
1. Mengetahui kinerja tanaman kayu apu, kiambang dan enceng gondok dalam meningkatkan pH air asam tambang dan penurunan kadar logam yang terdapat pada air asam tambang secara passive treatment serta penyebaran dan komposisi logam berat dari permukaan sampai dasar kolam.
2. Mengetahui karakteristik hasil pengolahan air asam tambang dengan menggunakan lahan basah dan tanaman air baik sebelum dan sesudah proses melalui parameter kadar Fe, Mn, TSS, dan nilai pH.
Manfaat Penelitian
Manfaat dalam penelitian ini yaitu diperoleh informasi, data dan pengetahuan baru tentang efektifitas penggunaan kayu apu, kiambang dan enceng gondok dalam meningkatkan pH air asam tambang dan penurunan kadar logam yang terdapat pada air asam tambang secara passive treatment dan mendapatkan karakteristik hasil pengolahan air asam tambang secara passive treatment melalui lahan basah dengan menggunakan ketiga tanaman uji coba.
2
TINJAUAN PUSTAKA
Air Asam Tambang
Kegiatan pertambangan berpotensi menimbulkan dampak penting pada lingkungan hidup. Dalam usaha pertambangan secara garis besar dikenal dua sistem penambangan, yaitu :
1. Sistem penambangan terbuka / di permukaan (open pit mining) 2. Sistem penambangan dalam / bawah tanah (underground mining)
4
lapisan batubara yang akan diambil (Evasari 2013). Kegiatan penambangan batubara yang diterapkan untuk tambang terbuka diawali dengan pembersihan lahan (land clearing), peledakan tanah penutup dan atau pemindahan tanah penutup, penambangan batubara, pembersihan batubara, pemuatan dan pengangkutan batubara menuju penyimpanan (stockpile). Akibat dari kegiatan penggalian dan penimbunan pada penambangan secara terbuka dipastikan akan mengubah kondisi lingkungan, terutama komponen tanah dan batuan yang dapat berdampak pada komponen lingkungan lain baik secara langsung maupun tidak langsung. Secara langsung, penggalian tanah atau batuan akan berdampak pada komponen biota yang berada dipermukaan maupun yang terkandung di dalam tanah atau batuan. Dampak dari kegiatan pertambangan secara tidak langsung yaitu peningkatan erosi tanah, pemiskinan unsur hara akibat erosi dan timbulnya lapisan sub soil yang bereaksi masam dan miskin unsur hara (Rosi 2010).
Kegiatan penggalian dan penimbunan pada pertambangan batubara secara terbuka juga dapat mengakibatkan terdedahnya (exposed) batuan sehingga memungkinkan kontak dengan udara dan air hujan yang akan menghasilkan limbah cair yang bersifat asam yang dikenal dengan air asam tambang (AAT). AAT merupakan air dengan pH yang rendah dan kelarutan logam yang tinggi sebagai akibat dari adanya reaksi oksidasi antara mineral sulfida yang tersingkap karena kegiatan penggalian dengan oksigen dan air (Gunawan et al. 2014) yang dikatalis oleh bakteri pengoksida besi dan sulfur, seperti Thiobacillus ferrooxidans, Leptospirillum ferrooxidans dan Thiobacillus thiooxidans (Schipper 2004; Cohen 2005; Johnson dan Halberg 2005). Pirit merupakan mineral sulfida yang banyak dijumpai pada pertambangan batubara. Reaksi oksidasi mineral sulfida dalam hal ini pirit, dibagi menjadi 3 reaksi utama yakni (i) reaksi spontan yang terjadi saat mineral pirit tersingkap ke permukaan tanah, (ii) reaksi dipercepat dengan adanya ion Fe3+, dan (iii) reaksi biologi yang mengikutsertakan aktivitas oksidasi bakteri pengoksida besi dan sulfur (Lizama dan Suzuki 1989).
AAT ditemukan baik pada tambang-tambang batubara maupun tambang bijih atau kegiatan penggalian lain dimana terdapat mineral-mineral sulfida besi. Bentuk sulfida besi yang umum ditemukan pada daerah batubara adalah pyrite dan marcasite (FeS2), sementara sulfida logam lainnya antara lain chalcopyrite
(CuFeS2) covellite (CuS), dan arsenopyrite (FeAsS) (Baiquni 2007 dalam Evasari
2013). Di pertambangan terbuka, AAT berpotensi untuk terbentuk di area penambangan aktif dan disposal.
5 mg/l), kandungan besi (Fe) dan aluminium (Al) yang tinggi (>100 mg/l) (Lottermoser 2010).
Reaksi pembentukan AAT menurut Gautama (2014) dapat ditulis sebagai berikut :
Reaksi pertama adalah reaksi oksidasi mineral pirit oleh kehadiran air. Pada reaksi ini Fe2+ dihasilkan dari proses oksidasi mineral pirit oleh kehadiran air. Terjadi reaksi pelapukan dari pirit disertai proses oksidasi. Sulfur dioksidasi menjadi sulfat dan besi ferro dilepaskan. Dari reaksi ini dihasilkan dua mol keasaman dari setiap mol pirit yang teroksidasi. Reaksi ini dapat berlangsung baik pada kondisi abiotik maupun biotik.
Reaksi kedua adalah oksidasi lanjutan dari pirit oleh besi ferri. Ini adalah reaksi propagasi yang berlangsung sangat cepat dan akan berhenti jika pirit atau besi ferri habis. Proses reaksi oksidasi pirit setelah reaksi (1) yang terjadi pada kondisi dekat netral, dilanjutkan dengan reaksi (2) jika kondisi semakin asam atau pH lebih kecil dari 4.5. Ion ferri akan mengoksidasi pirit sehingga mempercepat laju oksidasi dua sampai tiga kali dibandingkan dengan oksidasi oleh oksigen. Pada pH rendah (lebih kecil dari 4.5) Fe3+ akan lebih cepat mengoksidasi pirit mengkonsumsi satu mol keasaman. Ion ferri tebentuk sebagai hasil konversi ion ferro yang terbentuk pada reaksi (1) dan mengkonsumsi satu mol keasaman seperti yang ditunjukkan pada reaksi (3). Laju reaksi lambat pada pH < 5 dan kondisi abiotik. Kehadiran Bakteri Acidithiobacillus ferrooxidans akan mempercepat proses oksidasi Fe2+ sampai 5 sampai 6 kali. Dari reaksi (3) tersebut dapat terlihat bahwa untuk mengoksidasi ion ferro menjadi ion ferri diperlukan kehadiran oksigen.
Reaksi keempat adalah hidrolisa dari besi. Hidrolisa adalah reaksi yang memisahkan molekul air (Evasari 2013). Ion ferri dapat mengalami oksidasi dan hidrolisa sehingga membentuk ferri hidroksida. Pembentukan ferri hidroksida yang berwarna coklat kekuningan dan sering disebut yellowboy sangat tergantung pada pH yaitu lebih banyak pada pH diatas 3.5. Reaksi (4) ini merupakan reaksi pelarutan-pengendapan yang reversibel dan berlangsung sampai pH sama dengan 3 dan merupakan sumber atau berkurangnya Fe3+ serta merupakan langkah penting dalam melepaskan asam kelingkungan.
6
asam kondisi sulfat terlarut dapat mencapai 10.000 mg/L atau bahkan lebih pada kondisi yang lebih ekstrim. Jika kondisi semakin basa, konsentrasi sulfat dipengaruhi oleh kelarutan dari gipsum (CaSO4.2H2O). Beberapa mineral sulfida
yang diketahui pembangkit asam dengan ion ferri sebagai pengoksidasi adalah sfalerit (ZnS), galena (PbS), kalkopirit (CuFeS2), kovelit (CuS), cinnabar (HgS),
millerit (NiS), pentlandit ((Fe,Ni)9S8) dan greenockit (CdS). Sedangkan mineral
sulfida yang diketahui pembangkit asam dengan oksigen sebagai pengoksidasi adalah pirit dan markasit (FeS2), pirotit (Fe1-xS), bornit (Cu5FeS4), arsenopirit
(FeAsS), enargit atau famatinit (Cu3AsS4/Cu2SbS4), tennantit atau tetrahidrit
((Cu,Fe,Zn)12As4S13/(Cu,Fe,Zn)12ASb4S13), realgar (AsS), orpiment(As2S3) dan
stibnit (Sb2S3) (Gautama 2014).
Peranan bakteri dalam pembentukan AAT juga sangat penting. Proses oksidasi ion Fe2+ menjadi Fe3+ dipercepat dengan adanya mikrob pengoksida besi, seperti T. ferrooxidans dan L. ferrooxidans. T. Ferrooxidans mampu memanfaatkan Fe3+ untuk mengoksidasi senyawa sulfur, tetapi laju oksidasi sulfur tersebut jauh lebih rendah dibandingkan dengan oksidasi Fe2+ (Lizama dan Suzuki 1989). Adanya aktivitas bakteri pengoksida, laju oksidasi meningkat sampai 106 kali lipat (Hossner dan Doolittle 2003). Percepatan laju pelarutan pirit oleh bakteri mencapai 10-5 μmol Fe per sel per hari pada pH 0,7 dan suhu 42°C (Schrenk et al. 1998).
Adanya peran bakteri dalam proses pelarutan dan oksidasi pirit dapat digambarkan seperti pada Gambar 1 (Naveke 1986). FeS2 akan terurai menjadi
Fe2+ dan S2-. Selanjutnya bakteri T. ferrooxidans akan berperan dalam mengoksidasi Fe2+ menjadi Fe3+. T. ferrooxidans mengoksidasi Fe2+untuk menghasilkan energi yang kemudian dimanfaatkan untuk pertumbuhan dan perkembangan sel bakteri, sedangkan Fe3+ dengan adanya air akan membentuk fenomena yellowboy (Fe(OH)3). Sedangkan S2- atau S0 dioksidasi menjadi SO4
2-oleh T.ferrooxidans dan atau T. Thiooxidans.
Gambar 1 Proses pelarutan mineral pirit oleh bakteri Thiobacillus sp. (Sumber: Naveke 1986)
7 al. 1992). Disamping itu, adanya ion Fe3+ yang merupakan pengoksida kuat mampu melarutkan mineral- mineral logam sulfida, logam-logam berat dalam mineral sulfida tersebut akan teroksidasi menjadi ion logam yang terlarut (Leduc dan Ferroni 1994). Dengan adanya kandungan sulfat dan logam yang terlarut menyebabkan limbah air asam tambang sangat berbahaya bagi kehidupan flora dan fauna, serta ekosistem secara keseluruhan (Downing 2002). Tingkat kemasaman yang tinggi meningkatkan kelarutan logam-logam berbahaya. Meningkatnya kelarutan logam-logam berbahaya tersebut akan sangat membahayakan organisme air, karena akan berakibat pada keracunan dan bahkan dapat menyebabkan kematian hewan air. Dengan demikian, peningkatan kelarutan logam berbahaya tersebut akan mempengaruhi keseimbangan ekosistem.
Fenomena AAT sebenarnya bukan hal yang baru di dunia pertambangan, daerah Iberian Pyrite Belt di Spanyol merupakan contoh yang paling terkenal bagaimana AAT mencemari sungai Tinto dan Odiel sehingga air sungai tersebut memiliki kandungan logam dan tingkat keasaman yang tinggi (Nieto et al. 2013). Penambangan dan pengolahan tembaga di daerah tersebut sudah dilakukan sejak sekitar 3000 tahun sebelum masehi pada awal zaman perunggu. AAT yang mengalir ke kedua sungai tersebut berasal dari lubang-lubang bekas tambang bawah tanah. Sampai dengan saat ini AAT masih terbentuk dan menjadi kewajiban dari pemerintah Spanyol untuk mengendalikan kualitas air sungai yang menerima AAT dari bekas-bekas tambang di wilayah tersebut. Di Amerika Serikat pencemaran limbah AAT di seluruh wilayah pertambangan mencakup area sekitar 25.000 hektar dan mencemari wilayah aliran air permukaan yang cukup luas (Durkin dan Herrmann 1994). Di Indonesia di wilayah industri pertambangan limbah AAT menjadi permasalahan lingkungan yang krusial. Hasil monitoring limbah pertambangan batu bara di Kalimantan, atau pertambangan tembaga di Nusa Tenggara dan Papua, memperlihatkan bahwa limbah air buangan tambang masih melebihi ambang batas mutu air (Gautama 2014). Hal ini yang menyebabkan kondisi lingkungan di sekitar limbah buangan tersebut mengalami kerusakan. Keberadaan AAT di lingkungan terutama air permukaan maupun air tanah berpotensi memberikan dampak terhadap terganggungnya kualitas dan habitat lingkungan. Oleh karena itu, diperlukan sistem pengelolaan AAT yang baik untuk mencegah terbentuknya AAT dan mengolah AAT agar memenuhi baku mutu lingkungan sebelum dialirkan ke badan air penerima.
Teknik Remediasi Air Asam Tambang
8
Teknologi yang saat ini banyak dipakai di Indonesia untuk mengurangi dampak negatif AAT adalah proses pengolahan aktif. Menurut Youger et al. 2003 yang disebut pengolahan aktif adalah penambahan bahan kimia yang dapat menetralisir kemasaman limbah sehingga memperbaiki kualitas air. Penambahan bahan alkalin akan meningkatkan nilai pH, mempercepat laju oksidasi ion fero (Fe2+), serta mengendapkan logam terlarut dalam bentuk hidroksida dan karbonat (Johnson dan Hallberg 2005). Berbagai bahan penetralisir telah banyak digunakan seperti kalsium oksida, kalsium karbonat, sodium hidroksida, magnesium oksida dan magnesium hidroksida. Efektivitas masing-masing bahan tersebut sangat beragam. Penambahan bahan kimia sangat efektif dalam mengolah AAT, akan tetapi membutuhkan biaya operasional sangat tinggi, harus dilakukan secara terus menerus, dan meghasilkan lumpur limbah yang sangat banyak, terutama pada penggunaan senyawa kalsium. Pengendalian secara aktif ini hanya untuk meningkatkan pH air tetapi tidak memperbaiki kualitas air di kolam bekas tambang.
Proses pengolahan AAT secara pasif mulai banyak dikembangkan di Indonesia, kelebihan utama dari sistem pengolahan pasif adalah biaya pemeliharaan relatif murah tetapi sistem ini juga memiliki kelemahan seperti membutuhkan lahan yang cukup luas dan hasil yang terkadang tidak pasti jika dibandingkan dengan sistem pengolahan secara kimiawi (Johnson dan Hallberg 2005). Beberapa teknik yang digunakan dalam sistem pengolahan pasif adalah dengan menggunakan anoxic limestone drains (ALD), Successive alkalinity producing system (SAPS), lahan basah buatan yang meliputi lahan basah aerob dan lahan basah anaerob.
Teknik pengolahan pasif yang banyak digunakan dalam pengolahan AAT adalah lahan basah buatan (constructed wetland) yang meliputi lahan basah aerob dan lahan basah anaerob. Lahan basah aerob adalah sistem lahan basah yang relatif dangkal yang beroperasi dengan aliran permukaan. AAT dialirkan pada permukaan wetland yang biasanya ditumbuhi oleh tanaman sejenis cattail (Typha sp.) yang tumbuh di atas tanah atau substrat organik. Tanaman lahan basah yang ditanam pada sistem aerob ditanam dengan alasan estetika untuk mengatur aliran air dan menyaring serta menstabilkan endapan besi yang terakumulasi. Selain itu, adanya tanaman pada sistem lahan basah aerob memberikan kontribusi meningkatkan kandungan bahan organik melalui zat-zat hasil sekresi dan dekomposisi sisa tanaman. Pada sistem lahan basah aerob, pengurangan konsentrasi logam sebagian terjadi karena proses pengendapan logam dengan adanya reduksi sulfat secara biologi, dan sebagian kecil juga diserap oleh tanaman. Munawar (2007) menjelaskan tumbuhan air pada lahan basah mempunyai beberapa fungsi atau manfaat penting, seperti:
1. Konsolidasi substrat oleh akar tanaman dengan cara memegang substrat bersama-sama dan meningkatkan waktu tinggal air dalam wetland.
2. Stimulasi proses jasad renik melalui penyediaan tapak (site) oleh tanaman untuk menempelnya mikroba, mengeluarkan oksigen dari akarnya, menyediakan sumber bahan organik untuk mikroba heterotrof.
3. Tanaman memasok pakan dan perlindungan bagi satwa liar, sehingga dapat membentuk habitat satwa liar.
9 Keuntungan dari sistem ini adalah biaya yang dibutuhkan relatif kecil dibandingkan dengan sistem aktif. Namun demikian sistem ini juga mempunyai kelemahan, diantaranya adalah membutuhkan lahan yang luas dan hasil kinerja dari sistem ini tidak dapat diprediksi seperti pada pengolahan aktif (Johnson dan Hallberg 2002) .
Berbeda dengan lahan basah aerobik, pada lahan basah anaerobik menggunakan instalasi pengolahan AAT dengan sistem tertutup seluruhnya dibawah permukaan tanah. Sehingga penggunaan tanaman tidak dibutuhkan dalam sistem anaerobik. Pada sistem ini dibutuhkan bahan organik dalam pengoperasiannya. Bahan organik berguna sebagai sumber energi bagi pertumbuhan bakteri pereduksi sulfat. Bakteri tersebut juga menghasilkan kondisi alkalin melalui proses oksidasi bahan organik dan memanfaatkan energi yang dihasilkan untuk reduksi sulfat. Dengan adanya aliran air asam tambang melalui bahan organik menyebabkan kondisi anoksik. Kondisi ini akan mendorong pertumbuhan bakteri pereduksi sulfat dan menghasilkan sulfida. Pada kondisi tidak ada oksigen bebas, oksidasi logam akan berjalan lebih lambat sehingga pembentukan logam oksihidroksida juga lambat dibandingkan dengan kondisi aerob. Hilangnya logam terjadi melalui pengendapan dalam bentuk logam sulfida, dijerap oleh bahan organik dalam bentuk bentuk logam hidroksida dan logam oksihidroksida (Wouls dan Ngwenya 2004). Kelemahan dari sistem ini adalah proses sistem lahan basah sangat lambat dan membutuhkan lahan yang luas.
Pengolahan Limbah Air Asam Tambang dengan Tanaman
Pengembangan teknologi yang murah dan ramah lingkungan untuk remediasi tanah dan air yang tercemar zat beracun menjadi perbincangan yang menarik yang sering dibahas diseluruh dunia. Akhir akhir ini teknik reklamasi yang banyak digunakan untuk menghilangkan polutan dari tanah atau air tercemar yaitu dengan menggunkan tanaman. Penggunaan tumbuhan untuk menghilangkan polutan dari tanah atau perairan yang terkontaminasi disebut dengan fitoremediasi. Teknologi fitoremediasi didefinisikan sebagai pencucian polutan yang dimediasi oleh tumbuhan berfotosintesis, termasuk pohon, rumput-rumputan dan tumbuhan air. Pencucian bisa berarti penghancuran, inaktivasi atau imobilisasi polutan ke bentuk yang tidak berbahaya (Chaney et al. 1995; Squires 2001).
Banyak istilah yang diberikan pada sistem ini sesuai dengan mekanisme yang terjadi pada prosesnya. Phytostabilization: polutan distabilkan di dalam tanah oleh pengaruh tanaman. Phytostimulation: akar tanaman menstimulasi penghancuran polutan dengan bantuan bakteri rhizosfere. Phytodegradation: tanaman mendegradasi polutan dengan atau tanpa menyimpannya di dalam daun, batang, atau akarnya untuk sementara waktu. Phytoextraction: polutan terakumulasi di jaringan tanaman, terutama daun. Phytovolatilization: polutan oleh tanaman diubah menjadi senyawa yang mudah menguap sehingga dapat dilepaskan ke udara. Rhizofiltration: polutan diambil dari air oleh akar tanaman pada sistem hidroponik (Gerloff 1975).
10
diketahui dalam menyerap logam beracun dari air yang tercemar adalah enceng gondok (Eichhornia crassipes, Eichhornia azurea, Eichhornia diversifolia, Eichhornia paniculata), selada air (Pistia stratiotes), Kiambang (Salvinia molesta, Salvinia auriculata ,Salvinia minima) dan Lemna minor (Deng et al. 2004; Axtell et al.2003; Vasely et al. 2011). Sudah banyak hasil penelitian yang membuktikan keberhasilan penggunaan tumbuhan untuk remediasi tanah dan air, tumbuhan tumbuhan tersebut antara lain Thlaspi calaminare untuk seng (Zn), T. caerulescens untuk kadmium (Cd), Aeolanthus biformifolius untuk tembaga (Cu), Phylanthus serpentinus untuk nikel (Ni), Haumaniastrum robertii untuk kobalt (Co) Astragalus racemosus untuk selesium (Se), dan Alyxia rubricaulis untuk mangan (Mn) (Wise et al. 2000).
Semua tumbuhan mampu menyerap logam dalam jumlah yang bervariasi, tetapi beberapa tumbuhan mampu mengakumulasi unsur logam tertentu dalam konsentrasi yang cukup tinggi. Proses remediasi polutan dari dalam tanah atau air terjadi karena jenis tanaman tertentu dapat melepaskan zat carriers, yang biasanya berupa senyawaan kelat, protein, glukosida, yang berfungsi mengikat zat polutan tertentu kemudian dikumpulkan di jaringan tanaman, misalnya pada daun atau akar (Fahrizal 2004). Bioremediasi merupakan salah satu alternatif pengolahan limbah yang telah lama dikenal dalam masyarakat.
Tanaman Air
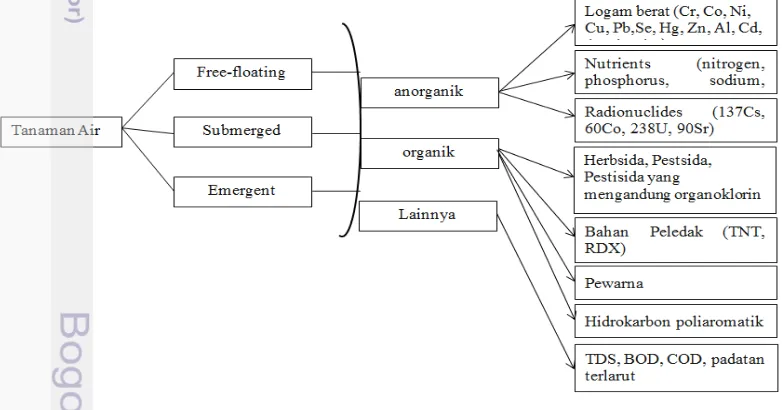
Salah satu faktor penentu fungsi lahan basah dalam fitoremediasi AAT adalah pemilihan jenis tanaman (Kivaisi 2001; Dhir 2013).Pemilihan jenis untuk tujuan remediasi logam dalam AAT pada konstruksi lahan basah yaitu tanaman harus adaptif pada kondisi tergenang, toleran terhadap pH rendah dan toksik logam berat (Tuheteru 2015).
11 Menurut Dhir (2013) ada 3 kategori utama spesies tanaman air yang dapat menghilangkan kontaminan di perairan yaitu spesies free-floating, submerged dan emergent.Tanaman air yang termasuk spesies free-floating adalah tanaman kayu apu, kiambang dan enceng gondok. Tanaman air yang termasuk spesies submerged salah satunya adalah Hydrilla verticillata, sedangkan tanaman air yang termasuk spesies emergent salah satunya adalah Typha latifolia.
Enceng Gondok (Eichornia crassipes)
Jenis : Eichornia crassipes (Mart) Solms
Enceng gondok pertama kali ditemukan secara tidak sengaja oleh seorang ilmuan bernama Carl Friedrich Philipp von Martius, seorang ahli botani berkebangsaan Jerman pada tahun 1824 ketika sedang melakukan ekspedisi di Sungai Amazon Brasil. Enceng gondok lebih banyak dikenal sebagai tanaman tumbuhan pengganggu (gulma) di perairan karena pertumbuhannya yang sangat cepat. Awalnya didatangkan ke Indonesia pada tahun 1894 dari Brazil untuk koleksi Kebun Raya Bogor. Ternyata dengan cepat menyebar ke beberapa perairan di Pulau Jawa. Dalam perkembangannya, tanaman keluarga Pontederiaceae ini justru mendatangkan manfaat lain, yaitu sebagai biofilter cemaran logam berat, sebagai bahan kerajinan, dan campuran pakan ternak. Sebagai biofilter cemaran logam enceng gondok mampu menyerap berbagai zat yang berbahaya yang mencemari perairan seperti logam berat, cemaran organik, buangan industri, buangan pertanian dan buangan rumah tangga (Joedodibroto 1983).
12
Kemampuan tanaman inilah yang banyak digunakan untuk mengolah air buangan, karena dengan aktivitas tanaman ini mampu mengolah air buangan domestik dengan tingkat efisiensi yang tinggi. Eceng gondok mempunyai sifat-sifat yang baik antara lain dapat menyerap logam-logam berat, senyawa sulfida, selain itu mengandung protein lebih dari 11.5% dan mengandung selulosa 64.51% lebih besar dari non selulosanya seperti lignin, abu, lemak, dan zat-zat lain (Joedodibroto 1983). Enceng gondok dapat digunakan untuk menghilangkan polutan, karena fungsinya sebagai sistem filtrasi biologis, menghilangkan nutrien mineral, untuk menghilangkan logam berat seperti cuprum, aurum, cobalt, strontium, timbal, timah. Selain itu, eceng gondok juga punya kemampuan
Famili : Araceae(suku talas-talasan) Genus : Pistia
Spesies : Pistia stratiotes L.
Nama lokal tumbuhan ini adalah kayu apu. Bentuknya mirip dengan sayuran kol atau kubis yang berukuran kecil. Banyak tumbuh di daerah tropis, terapung pada genangan air yang tenang dan mengalir dengan lambat. Kayu apu mempunyai banyak akar tambahan yang penuh dengan bulu-bulu akar yang halus, panjang dan lebat. Bentuk dan ukuran daunnya sangat bervariasi, dapat menyerupai sendok, lidah atau rompong dengan ujung daun yang melebar. Warna daunnya hijau muda makin ke pangkal makin putih. Susunan daun terpusat berbentuk roset. Batangnya sangat pendek, bahkan terkadang tidak tampak sama sekali. Buah buninya bila telah masak pecah sendiri serta berbiji banyak. Selain dengan biji, kayu apu berkembang biak dengan selantar atau stolonnya (Sastrapradja dan Bimantoro 1981).
Tanaman air ini termasuk floating aquatic plant seperti tanaman eceng gondok. Pada mulanya tumbuhan kayu apu hanya dikenal sebagai tumbuhan pengganggu di danau, karena tanaman tersebut biasanya tumbuh dan berkembang biak dengan cepat. Tanaman kayu apu banyak dijumpai pada kolam-kolam air tawar, menempati permukaan dari perairan tersebut, karena tanaman ini tergolong floating aquatic plant. Akar tanaman berupa akar serabut, terjurai pada lapisan atas perairan dan sangat potensial untuk menyerap bahan-bahan yang terlarut pada bagian itu (Yusuf 2001).
butiran-13 butiran lumpur yang halus maka dapat digunakan untuk menjernihkan air bagi industri maupun keperluan sehari-hari.
Kiambang (Salvinia molesta)
Taksonomi Kiambang Kerajaan : Plantae Divisi : Pteridophyta Kelas : Pteridopsida Orde : Salviniales Famili : Salviniaceae Genus : Salvinia
Species : Salvinia molesta D.mitch.
Salvinia molesta adalah jenis tumbuhan yang hidup setahun. Pembiakannya dilakukan dengan spora (Sundaru 1979). Salvinia molesta termasuk tumbuhan air yang hidup mengapung. Daunnya berupa karangan, terdiri dari 3 bagian, yaitu 2 bagian terapung yang berfungsi sebagai daun dan 1 bagian menggantung dalam air berbentuk serabut seperti akar. Pangkal daun berbentuk jantung, panjang dan lebar daun antara 1-2 cm, dengan rambut-rambut pada permukaannya. Fase generatif dari tanaman ini dicirikan oleh adanya daun yang melengkung. Setelah menghasilkan sporangia, pembentukkan sporokarp terjadi dengan cepat pada waktu populasi padat. Sporokarp pertama atau dua yang pertama dari masing-masing kelompok merupakan mikrosporokarp. Dari satu mikrosporokarp, sporangia yang matang adalah 1-5 buah, sedang mikrosporokarp yang matang antara 30-90 buah dari sebuah makrosporokarp (Pancho 1978).
3
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan di Kolam Pengendapan Lumpur (KPL) Cik Ayip - IUP Air Laya PT. Bukit Asam (Persero) Tbk., Kab. Muara Enim, Sumatera Selatan dengan sumber AAT dari Stockpile 1. Analisa sampel penelitian berupa AAT dilakukan di Laboratorium pengujian air PT. Bukit Asam (Persero) Tbk. Analisa logam dalam tanaman dianalisis di Laboratorium Pengujian Balai Penelitian Tanah, Cimanggu, Bogor. Penelitian dilaksanakan pada bulan Maret s/d Mei 2015.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah enceng gondok, kayu apu, kiambang, air asam tambang dari Stockpile 1-IUP Air Laya PT. Bukit Asam (Persero) Tbk., lumpur dan bokashi. Bahan-bahan untuk analisa AAT dan tanaman adalah asam nitrat (HNO3), HClO4, aquadest, larutan standart Fe, larutan
14
Alat
Alat yang digunakan dalam penelitian ini adalah 9 kolam buatan yang masing - masing berukuran 80x80x70 cm3 dengan volume air asam tambang 270 L/bak reaktor fitoremediasi, plastik, labu erlenmeyer, gelas ukur, botol sampel 100 mL, AAS (Atomic Absorbtion Spectrometer), oven, desikator, timbangan analitik, Filter paper no 41 WhatmannTm D125 mm (CAT No 1441-125), Cellulose nitrate filter 0,45µm (Sartorius stedim biotech), pipet ukur, gunting, corong gelas dan labu semprot.
Prosedur Penelitian
Pengambilan dan Aklimatisasi Tanaman Air
Kayu apu, kiambang dan enceng gondok yang akan digunakan dalam penelitian ini diperoleh dari lokasi pertambangan batubara, PT. Bukit Asam (Persero) Tbk. Tanaman air yang diambil sebanyak 2 kg kemudian diaklimatisasi. Sampel kayu apu, kiambang dan enceng gondok diaklimatisasi di kolam aklimatisasi selama 2 minggu sebelum digunakan dalam penelitian.
Pembuatan Lahan Basah Buatan
Lahan basah yang akan digunakan dalam percobaan dibuat seperti lahan basah yang telah digunakan di PT. Bukit Asam (Persero) Tbk. dengan ukuran yang diperkecil menjadi 80x80x70 cm3 (Gambar 2), sehingga kapasitas volume AAT yang tertampung adalah sebesar 270 L/bak, dengan tinggi permukaan air ±42 cm. Jenis kolam lahan basah yang digunakan adalah anaerobic wetland.
Gambar 3 Desain lahan basah buatan
Lumpur yang masih berpotensi membentuk asam (Potensial Acid Forming (PAF)) dimasukkan ke dalam kolam hingga mencapai ketinggian 15 cm. Komponen selanjutnya adalah bokashi yang digunakan oleh PT. Bukit Asam (Persero) Tbk. yang berfungsi sebagai media tumbuh tanaman. Bokashi
AAT
PAF
15 dimasukkan hingga mencapai ketinggian 3 cm. AAT dimasukkan dalam kolam percobaan dengan ketinggian muka air ±42 cm, kemudian dimasukkan tanaman uji berupa kayu apu, kiambang dan enceng gondok (Tabel 1). Sebelum dimasukkan kedalam kolam percobaan sampel AAT yang diambil dari KPL Stockpile-1 IUP Air Laya terlebih dahulu dianalisis Nilai pH, kadar Besi (Fe) terlarut, kadar Mangan (Mn) terlarut dan Total Suspended Solid (TSS).
Tabel 1 Komposisi material lahan basah anaerobik pada pengelolaan AAT secara pasif
Rancangan penelitian yang digunakan adalah Rancangan Acak Kelompok (RAK) Tunggal dengan jenis tanaman air sebagai perlakuan. Perlakuan terdiri dari 3 taraf yaitu kayu apu, kiambang dan enceng gondok. Perlakuan diulang sebanyak 3 kali sehingga terdapat 9 unit kolam percobaan. Aplikasi perlakuan adalah sebagai berikut :
1. AAT + Matrik lahan basah (MLB) tanpa tanaman uji (Kontrol) 2. AAT + MLB + Kayu apu
3. AAT + MLB + Kiambang 4. AAT + MLB + Enceng gondok
Perlakuan Fitoremediasi
Penelitian ini menggunakan metode fitoremediasi statis (air yang di fitoremediasi dalam keadaan diam atau tidak mengalir). Setelah reaktor fitoremediasi siap, selanjutnya dilakukan pemilihan dan penimbangan tanaman kayu apu, kiambang dan enceng gondok yang telah diambil dari media aklimatisasi. Tanaman yang digunakan untuk perlakuan dipilih yang mempunyai ukuran yang relatif sama yaitu dengan panjang daun 2-4 cm dan panjang akar 3-6. Masing-masing tanaman dimasukkan ke dalam kolam percobaan yang telah berisi media AAT + MLB. Setiap percobaan menggunakan 3 ulangan dan dibuat juga kontrol yaitu bak berisi larutan yang sama tetapi tanpa tanaman. Pengambilan sampel air dilakukan setiap 3 hari sampai hari ke 29 (Herniwanti et al. 2013), sedangkan untuk sampel tanaman diambil 5 kali sampel selama 29 hari yaitu pada hari ke-0 setelah perlakuan (HSP), 3 HSP, 7 HSP, 15 HSP, 21 HSP dan 29 HSP.
16
pengabuan basah dengan HNO3-HClO4 (AOAC 2000) kemudian diikuti oleh
pengukuran logam dengan atomic absorption spectrometry (AAS). Nilai kadar logam (Fe dan Mn) selanjutnya digunakan sebagai dasar untuk menghitung nilai Faktor Translokasi (Translocation Factor/TF), dengan persamaan berikut: TF = Caerial/Croot ; dimana Caerial adalah kadar logam pada bagian pucuk (batang & daun) dan Croot adalah kadar logam pada bagian akar (Wang et al. 2005). Pengurangan atau efisiensi reduksi (R) pH, Fe, Mn, dan TSS pada lahan basah dihitung dengan rumus: R (%) = (Konsentrasi awal-Konsentrasi akhir/ Konsentrasi awal ) x 100% (Nyquist dan Greger 2009; Palapa 2009).
Tabel 2 Metode pengukuran parameter
Pengujian Metode Alat yang digunakan
pH SNI: 6989.11-2004 pH meter
Kadar Fe SNI: 6989.4-2009 AAS
Kadar Mn SNI: 6985.5-2009 AAS
TSS SNI: 6989.3-2004 Kertas saring/ Gravimetri Pengukuran pH
SNI: 6989.11-2004. Penetapan pH air asam tambang dilakukan setelah pH meter dikalibrasi terlebih dahulu dengan buffer pH 4 dan pH 7. Stabilisasi pH meter dilakukan selama 15 menit. Setelah itu, elektroda dibilas dengan akuades dan dikeringkan. Elektroda dicelupkan ke dalam larutan sampel air asam tambang dan pengukuran pH dapat diatur. Elektroda dibiarkan tercelup beberapa saat sampai diperoleh pembacaan yang stabil, kemudian pH sampel dapat dicatat. Pengukuran Fe dan Mn
Pengukuran kadar Fe berdasarkanSNI: 6989.4-2009. Pengukuran ion logam Fe terlarut dilakukan dengan metode Spektrofotometri Serapan Atom (SSA) – nyala, pada kisaran kadar Fe 0.3 mg/L hingga 10mg/L dengan panjang gelombang 248.3 nm.
Pengukuran kadar Mn berdasarkan SNI: 6985.5-2009. Pengukuran ion logam Mn terlarut dilakukan dengan metode Spektrofotometri Serapan Atom (SSA) - nyala, pada kisaran kadar Mn 0.1 mg /L hingga 10 mg/L dengan panjang gelombang 279.5 nm.
Pengukuran TSS
Pengukuran Total Padatan Tersuspensi diukur dengan menggunakan metode gravimetri. Sampel yang telah homogen disaring dengan kertas saring yang telah ditimbang. Residu yang tertahan dikeringkan hingga mencapai berat konstan pada suhu 103oC – 105oC. Kenaikan massa pada kertas saring mewakili kadar TSS, maka untuk memperoleh estimasi TSS dapat dihitung melalui rumus:
Keterangan :
A : Massa kertas saring + Residu (mg) B : Massa kertas saring (mg)
17
Isolasi Total Populasi Mikrob
Setelah 29 hari masa percobaan, kemudian dihitung total populasi mikrob
yang terdapat pada kolam lahan basah. Sampel yang akan digunakan untuk
mengetahui total populasi mikrob diambil dari kolam air asam tambang setelah 29 hari masa percobaan. Sampel diambil secara purposif dari kolam air asam tambang yang diberi tanaman kayu apu, kiambang dan enceng gondok dengan ulangan sebanyak 3 kali. AAT dianalisis total populasi mikrobnya menggunakan
metode total plate count (TPC). Sebagai kontrol diambil AAT dari lahan basah
tanpa tanaman dan sebagai pembanding diambil AAT dari kolam lahan basah
yang telah diterapkan di PT. Bukit Asam (Persero) Tbk.
Mikrob diisolasi dari sampel air asam tambang dengan menggunakan medium NA dan medium Postgate B (Atlas 1993). Isolasi sampel dari air asam tambang pada media NA menggunakan metode pengenceran bertingkat spread plate dan pour plate kemudian diinkubasi pada suhu kamar selama 7 hari. Sebanyak 1 ml sampel air asam tambang dimasukkan pada media Posgate B, kemudian di inkubasi suhu 30° C selama 7 hari. Untuk Isolasi total populasi mikrob anaerob, setelah medium dibuat maka diletakkan di anaerob chamber untuk menghilangkan oksigen pada medium. Isolasi total populasi mikrob anaerob dalam pengerjaannya dilakukan secara anaerob. Jenis dan jumlah bakteri yang didapat dari hasil isolasi kemudian dihitung jumlah dan kerapatannya.
Analisis Data
Percobaan berlangsung selama 29 hari dan pengamatan dilakukan setiap 3 hari dengan cara mengambil sampel AAT dan tanaman air secara acak. Analisa data dilakukan secara tabulasi dan statistik. Data yang dibutuhkan dalam penelitian ini berupa data primer dan data sekunder. Data primer yang diperlukan, antara lain data sebelum, pada saat, dan setelah proses pengolahan air asam tambang. Data primer tersebut diambil pada tiap 3 HSP selama 29 hari, sedangkan data sekunder yang dibutuhkan berupa referensi data, baku mutu, dan studi kepustakaan.
Data Primer yang diperoleh yaitu berupa nilai pH, kadar Fe, kadar Mn, dan TSS yang diperoleh dianalisis menggunakan Analisis Varian (Anova) pada taraf kepercayaan 95% untuk mengetahui pengaruh jenis tanaman terhadap penurunan logam berat dan peningkatan pH AAT. Jika terdapat pengaruh perlakuan, maka dilakukan uji lanjut dengan uji DMRT (Duncan Multiple Range Test) pada taraf kepercayaan 95%.
4
HASIL DAN PEMBAHASAN
Karakteristik Limbah AAT Stockpile 1- IUP Air Laya
18
mengambil sampel dari kolam penampungan tersebut. Sampel AAT diambil dengan menggunakan metode grab sampel dimana limbah AAT dimasukkan ke dalam botol sampel dan diambil pada waktu tertentu.
Tabel 3 Karakteristik limbah air asam tambang Stockpile-1
Stockpile-11) Kadar Maksimum2) Kadar Maksimum3)
pH 3.45 6-8 6-9
TSS (mg/L) 28 50 400
Fe (mg/L) 4.49 0.300 7
Mn (mg/L) 8.75 0.100 4
1)
Dewani (2015), Komunikasi pribadi
2)
SK Gubernur Sumatera Selatan Nomor 16 Tahun 2005 tentang Baku Mutu Air Sungai
3)
Kepmen LH Nomor 113 Tahun 2003 tentang baku mutu air limbah bagi usaha dan atau kegiatan pertambangan batu bara
Hasil uji kualitas air asam tambang (AAT) dapat dilihat pada Tabel 3. Nilai pH pada limbah AAT sangat rendah sehingga menyebabkan kemasaman, yaitu berkisar 3.45. Data pH AAT tersebut menunjukkan bahwa AAT pada kolam penampungan Stockpile-1 merupakan air asam tambang tipe “net acid”. Hal ini dapat dilihat dari rendahnya pH AAT yaitu <4.5, dimana pada pH <4.5 alkalinitas dapat mencapai nol (Watzlaf et al. 2004). Tingginya kemasaman AAT juga menyebabkan logam terlarut cukup tinggi, terutama Fe dan Mn, yaitu 4.49 mg/L dan 8.75 mg/L. Kualitas AAT Stockpile-1 untuk parameter TSS dan Fe sudah memenuhi batas ambang Kepmen LH Nomor 113 Tahun 2003 tentang baku mutu air limbah bagi usaha dan atau kegiatan pertambangan batu bara tetapi untuk kadar Fe jauh melebihi batas ambang yang telah ditetapkan dalam SK Gubernur Sumatera Selatan Nomor 16 Tahun 2005 tentang Baku Mutu Air Sungai. Sedangkan untuk parameter pH dan kadar Mn jauh melebihi batas ambang yang telah ditetapkan dalam Kepmen LH Nomor 113 Tahun 2003 dan SK Gubernur Sumatera Selatan Nomor 16 Tahun 2005 tentang Baku Mutu Air Sungai. Oleh karena itu, AAT tersebut perlu diolah sebelum dibuang ke dalam perairan.
Pengaruh Tanaman Air terhadap Nilai pH
19
Gambar 4 Perubahan pH pada (A) bagian permukaan lahan basah, (B) bagian tengah (20-25 cm dari permukaan), dan (C) bagian bawah (35-40 cm dari permukaan) selama 29 hari masa percobaan.
Berdasarkan data yang diperoleh dari hasil pengamatan setiap 3 hari pada bagian permukaan kolam (Gambar 4A) menunjukkan terjadinya peningkatan nilai pH secara bertahap pada semua perlakuan. Pada hari pertama (0 HSP) dimasukkannya AAT pada kolam percobaan, terjadi peningkatan pH AAT dari 3.45 menjadi >5 pada semua perlakuan. Peningkatan pH ini kemungkinan disumbangkan dari kandungan alkalinitas dari kompos yang digunakan sebagai matrik lahan basah. Pada sistem wetland anaerobik, komposisi matrik yang digunakan seperti kompos yang ditambahkan lumpur aktif dari sewage dapat menstimulasi pertumbuhan bakteri pereduksi sulfat untuk menaikkan alkalinitas yang dapat meningkatkan pH AAT (Chang et al. 2000; Gibert et al. 2003). Pada pengamatan 3 HSP dapat dilihat pada Gambar 4A bahwa kolam lahan basah yang
20
ditambahkan tanaman kiambang dan enceng gondok mengalami peningkatan pH dari >5 menjadi 6 yaitu lebih tinggi daripada kontrol dan kolam yang ditambahkan tanaman kayu apu yang nilai pH berada dikisaran 5.73 dan 5.98. Peningkatan pH pada perlakuan dikarenakan proses biologi yang terjadi pada interaksi tanaman dengan lingkungannya tersebut (Henny et al. 2010). Adanya tanaman air yang mengambang pada kolam lahan basah menyebabkan kondisi lingkungan dibawah tanaman tersebut menjadi anaerob. Hal ini akan menyebabkan konsentrasi CO2
pada lingkungan akan meningkat. pH air juga dipengaruhi oleh konsentrasi CO2
bebas yang berada di lingkungan. Tanaman air akan mengambil CO2 dari air
selama proses fotosintesis sehingga mengakibatkan pH air meningkat (Cholik et al. 1991). CO2 dapat mempengaruhi nilai pH dan mempengaruhi kandungan
bikarbonat (Hermawati et al. 2005). Di samping itu, salah satu hasil mineralisasi bahan organik adalah bikarbonat, dimana bikarbonat akan mengikat ion H+ sehingga pH akan meningkat (Bohn 1985).
Nilai pH pada semua kolam lahan basah yang berisi tanaman perlakuan dari 3 HSP sampai 29 HSP terjadi fluktuasi pH yaitu pada 7 HSP dan 11 HSP pH mengalami penurunan, kemudian mengalami peningkatan nilai pH pada 14 HSP dan mengalami penurunan pH kembali pada 17 HSP. Pada 21 HSP dan 24 HSP nilai pH pada semua perlakuan mengalami peningkatan, tetapi mengalami penurunan kembali pada 29 HSP.
Pada grafik nilai pH bagian tengah kolam dan bagian bawah kolam (Gambar 4B dan 4C) yaitu terjadi fluktuasi nilai pH, tetapi secara keseluruhan nilai pH selama 29 perlakuan mengalami peningkatan dari pH >5 menjadi pH >7. Fluktuasi nilai pH baik pada semua perlakuan dan semua bagian memiliki nilai rata rata penurunan pH sebesar 35%. Adanya tanaman air pada kolam lahan basah tidak memberikan pengaruh yang nyata terhadap perubahan kadar pH air asam tambang dibandingkan kontrol tanpa adanya tanaman. Akan tetapi kadar pH akhir percobaan menunjukkan bahwa pH pada kolam lahan basah yang terdapat tanaman air lebih tinggi daripada pH kontrol.
Pengaruh Tanaman Air terhadap Kadar Fe dan Mn dalam Wetland
21
Gambar 5 Perubahan konsentrasi Fe terlarut pada (A) bagian permukaan lahan basah (B) bagian tengah (20-25 cm dari permukaan) dan (C) bagian bawah (35-40 cm dari permukaan) selama 29 hari masa percobaan. Data kualitas AAT pada kolam penampungan Stockpile-1 yang ditunjukkan pada Tabel 3, menjelaskan bahwa konsentrasi Fe dan Mn yang digunakan pada penelitian ini masih memiliki konsentrasi diatas baku mutu yang dipersyaratkan.
22
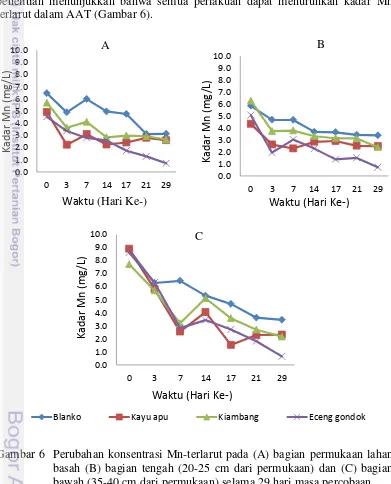
Berdasarkan hasil penelitian dapat dilihat bahwa semua perlakuan dapat menurunkan kadar Fe maupun kadar Mn dalam AAT (Gambar 5 dan Gambar 6).
Gambar 5 menunjukkan perubahan konsentrasi Fe yang terlarut pada AAT di 3 titik pengambilan sampel pada masing masing kolam lahan basah. Hasil analisa konsentrasi Fe terlarut dalam AAT pada bagian permukaan air (Gambar 5A) dapat dilihat bahwa sampel air dari bak yang berisi tanaman kayu apu dan enceng gondok pada akhir perlakuan yaitu 29 HSP menunjukkan konsentrasi Fe yang lebih kecil daripada kontrol dan bak perlakuan kiambang. Meskipun antara perlakuan dan kontrol memberikan penurunan konsentrasi yang tidak berbeda nyata (p>0.05) tetapi semua perlakuan memiliki fluktuasi penurunan konsentrasi Fe yang berbeda dari pada kontrol.
Hal yang menarik disini adalah meningkatnya konsentrasi Fe pada kontrol pada pengamatan 3 HSP pada bagian permukaan (Gambar 5A). Pada kontrol peningkatan konsentrasi Fe kemungkinan disebabkan oleh tidak tertutupnya permukaan kontrol dengan tanaman sehingga menyebabkan teroksidasinya kembali logam sulfida yang telah terbentuk dan dapat meningkatkan konsentrasi logam Fe pada permukaan kontrol. Hal ini juga dapat dikorelasikan dengan peningkatan pH bagian permukaan pada kontrol yang tidak jauh berbeda antara pengamatan 0 HSP dan 3HSP (Gambar 4A). Fenomena meningkatnya kembali konsentrasi Fe dan Mn pada bagian permukaan lahan basah disebabkan oleh proses oksidasi biotik, abiotik, maupun foto-oksidasi logam sulfida yang telah terbentuk pada permukaan lahan basah tersebut.
Pada lahan basah yang berisi tanaman enceng gondok terdapat siklus peningkatan dan penurunan konsentrasi Fe berturut turut pada 3 hari dan 6 hari. Pengamatan lahan basah yang berisi enceng gondok pada 0 HSP memperlihatkan konsentrasi Fe yang rendah sedangkan pada 3 HSP mengalami kenaikan dan pada 6 HSP mengalami penurunan konsentrasi kembali. Hal tersebut terulang sebanyak 3 kali selama 29 hari masa percobaan. Pada akhir percobaan, konsentrasi Fe pada 24 HSP dan menurun kembali pada 29 HSP.
Pada bagian tengah dan bawah lahan basah juga mengalami penurunan kadar Fe (Gambar 5B dan Gambar 5C). Penyisihan logam Fe pada semua titik pengambilan tertinggi dicapai oleh lahan basah yang berisi tanaman enceng gondok yaitu sebesar 90%-99% dalam waktu 29 hari, sedangkan lahan basah yang berisi tanaman kayu apu mengalami penyisihan logam Fe sebesar 77%-98%. Prosentase penyisihan logam Fe oleh perlakuan lebih tinggi daripada kontrol yaitu hanya sebesar 61%.
Terdapat 4 kemungkinan yang menyebabkan terjadinya penurunan konsentrasi logam Fe terlarut pada wetland yaitu:
1. Interaksi antara sulfida (S2- ) yang dihasilkan pada proses reduksi sulfat dengan logam bervalensi 2 (seperti Fe2+ dan Mn2+) membentuk logam sulfida yang mengendap.
23 4. Proses biopsorpsi logam oleh mikroorganisme yang terdapat pada
lingkungan lahan basah.
Penelitian Herniwanti et al. (2013) menggunakan 5 tanaman yang berbeda yaitu Eleocharis dulcis, Cyperus odoratus, Hydrilla vercilata, Ipomea aquatic dan Pistia statatiotes pada skala mini-project di perusahaan batubara PT. Jorong Barutama Greston dengan penurunan rata-rata Fe selama 29 hari sebesar 7%. Rata-rata penurunan logam Fe pada penelitian ini lebih tinggi dari rata-rata penurunan kadar Fe yang dilaporkan oleh Herniwanti et al. (2013) dimana terjadi penurunan kadar Fe pada lahan basah sebanyak 8 kali lebih tinggi yaitu sebesar 54%.
Parameter lainnya yang diukur dalam penelitian yaitu kadar Mn. Hasil penelitian menunjukkan bahwa semua perlakuan dapat menurunkan kadar Mn terlarut dalam AAT (Gambar 6).