PENAPISAN
Bacillus
DAN KARAKTERISASI PROTEASE
DAN AMILASE EKSTRASELULER YANG DIHASILKAN
UNTUK DEGRADASI SISA PAKAN
PADA BUDI DAYA UDANG
IT JAMILAH
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Penapisan Bacillus dan Karakterisasi Protease dan Amilase Ekstraseluler yang Dihasilkan untuk Degradasi Sisa Pakan pada Budi daya Udang adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Maret 2011
Protease and Amylase Produced for Degradation of Shrimp Feed Excess in Shrimp Aquaculture. Under the direction of ANJA MERYANDINI, IMAN RUSMANA, ANTONIUS SUWANTO AND NISA RACHMANIA MUBARIK.
Accumulation of excess feed in shrimp ponds could decrease water quality.
Protein and starch are the primary component of shrimp feed. Bacillus spp.
produce extracelullar enzymes, primarily proteases and amylases. The aim of this study was to screen Bacillus isolated from shrimp ponds and study its proteases and amylases for degradation of protein and carbohydrate of shrimp feed excess in shrimp aquaculture. Bacteria were isolated from soil, water, sediment and shrimp digestive system of sample collected from shrimp ponds of Karawang, West Java. There were 71 proteolytic and amylolytic isolates isolated. Based on proteolytic and amylolytic index (PI and AI), nine isolates were selected for further characterization including morphology characteristic, growth and ability to reduce total suspended solid (TSS) generated from commercial shrimp feed.
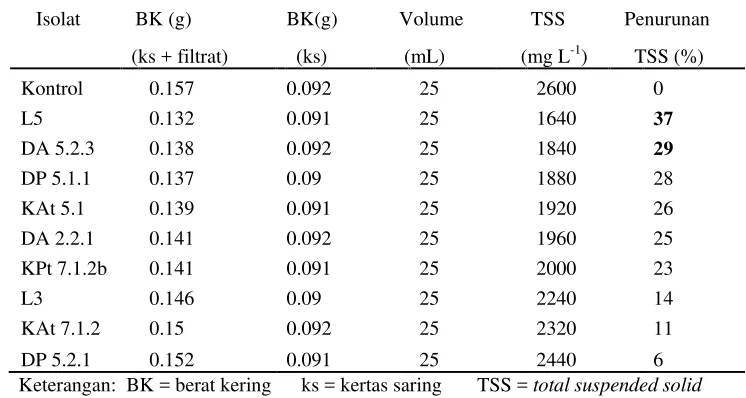
Bacillus sp. DA 5.2.3 and L5had the highest activity in reducing total suspended solid (TSS) of shrimp feed which were 37 and 29% respectively. The protease and
amylase activitiy of Bacillus sp. DA 5.2.3 were higher than that of L5. The
maximum specific activity (40.9 U mg-1)of protease of Bacillus sp. DA 5.2.3 was
reached at 48 hours, while its amylase reached it (47.3 U mg-1
The activity of both enzymes were measured at pH and salinity range mimic to shrimp ponds condition. Further characterization of DA 5.2.3 isolate show
that, protease of Bacillus sp. DA 5.2.3 had the maximum activity at pH 8 while its
amylase showed the maximum activity at pH 6 when produced at commercial shrimp feed medium. These enzymes significantly active at salinity range 1.5-3.5% with activity more than 50%. Stability of both enzymes was measured at optimum condition of enzyme activity and at general condition of shrimp ponds. In general condition of shrimp ponds protease activity was retained above 65% for 3 hours while amylase relatively stable for 6 hours at activity above 80%. SDS-PAGE, Native-PAGE and zymogram analysis of crude extract of both enzymes showed that the size of protease was ±150 kDa, while its amylase had two types of protein with the molecular weight in the range of 123 and 27 kDa.
Bacillus sp. DA 5.2.3 was able to reduce total suspended solid (TSS) of shrimp feed in liquid medium up to 50% in 48 hours and better than commercial probiotic
isolate. Based on 16S rRNA gene sequences Bacillus sp. DA 5.2.3 was 99%
homolog with Bacillus cereus. Based on the characterization of isolate and its
proteases and amylases, this isolate has potential application to reduce proteins, carbohydrates and TSS in water column of shrimp ponds.
) at 24 hours.
Ekstraseluler yang Dihasilkan untuk Degradasi Sisa Pakan pada budi daya Udang.
Dibimbing oleh ANJA MERYANDINI, IMAN RUSMANA, ANTONIUS SUWANTO, dan NISA RACHMANIA MUBARIK.
Seiring dengan berkembangnya budidaya udang di berbagai negara, diikuti pula oleh berbagai kendala seperti perkembangan penyakit dan penurunan kualitas air yang menyebabkan turunnya produksi udang. Penurunan kualitas air pada tambak udang, terutama pada sistem budidaya udang intensif dan semi intensif, dapat disebabkan oleh penumpukan sisa pakan buatan yang seluruhnya disuplai dari luar tambak berupa pakan buatan pabrik. Pakan ini sering tidak dapat dimanfaatkan secara optimal oleh hewan, sehingga tersisa sebagai limbah dalam air dan sedimen. Pakan udang merupakan bahan kaya protein, lemak dan karbohidrat di samping bahan-bahan lainnya. Kandungan sisa pakan yang tinggi di perairan tambak menyebabkan peningkatan kadar senyawa organik dan senyawa toksik dalam air. Di samping itu, hal ini dapat menyebabkan tingginya
padatan tersuspensi (total suspended solid [TSS]), tingginya kebutuhan oksigen
biologis (biological oxygen demand [BOD]), turunnya oksigen terlarut (dissolved
oxygen [DO]), eutrofikasi, dan keracunan terhadap udang. Faktor-faktor tersebut dapat mengganggu pertumbuhan, daya tahan bahkan menyebabkan kematian. Banyak laporan tentang peranan Bacillus spp. sebagai agen biokontrol di tambak udang, tetapi hanya sedikit laporan tentang peranan kelompok bakteri ini dalam degradasi sisa pakan pada perairan tambak udang melalui pendekatan enzim-enzim ekstraseluler. Hal ini dapat mengatasi pencemaran senyawa toksik di perairan seperti amonia, nitrat, nitrit dan penumpukan senyawa organik di perairan tambak. Tujuan penelitian ini ialah: 1) menapis dan mengkarakterisasi
Bacillus proteolitik dan amilolitik yang diisolasi dari tambak udang, 2) mengkarakterisasi enzim protease dan amilase yang dihasilkan isolat terpilih dan 3) mengukur kemampuan isolat terpilih dalam menurunkan total padatan tersuspensi pada kultur cair pakan udang.
Penapisan Bacillus spp. dilakukan dengan pemanasan sampel pada suhu 80
0
C selama 15 menit kemudian disebar pada medium sea water complete (SWC)
50% yang ditambahkan 1% susu skim untuk produksi protease atau 1% pati terlarut untuk produksi amilase. Penapisan isolat berdasarkan kepada indeks hidrolisis, pertumbuhan, penurunan TSS, serta aktivitas protease dan amilase. Sebanyak 71 isolat proteolitik dan amilolitik telah berhasil diisolasi dari sampel tanah, sedimen, air dan saluran pencernaan udang. Berdasarkan penghitungan nilai indeks proteolitik (IP) dan amilolitik (IA) yang dihasilkan pada medium yang mengandung protein dan pati, dipilih 9 isolat yang memiliki IP dan IA tertinggi (≥2.5). Selanjutnya dilakukan uji pertumbuhan isolat-isolat tersebut pada
media pakan udang 1.2% dalam air laut (bv-1) selama 48 jam dengan
penghitungan jumlah sel setiap 24 jam. Kemampuan isolat-isolat tersebut dalam menurunkan TSS diuji dengan metoda penyaringan padatan tersuspensi dari
kultur bakteri pada media pakan udang komersial dan air laut 1.2% (bv-1) (media
Shrimp Feed [SF]). Hasil uji pertumbuhan dan uji TSS menunjukkan bahwa
protease diukur berdasarkan modifikasi metode Walter (1984), amilase berdasarkan metode Bernfeld (1955) dan kadar protein mengacu kepada metode Bradford (1976). Protease dan amilase ekstrak kasar isolat DA 5.2.3 yang diproduksi pada media SF 1.2%, memiliki aktivitas yang lebih tinggi dibandingkan dengan isolat L5. Aktivitas spesifik protease isolat DA 5.2.3 ialah 40.9 U mg-1, sedangkan isolat L5 23 U mg-1. Aktivitas spesifik amilase Bacillus
sp. DA 5.2.3 diperoleh sebesar 47.3 U mg-1, sedangkan isolat L5 hanya sebesar
9.1 U mg-1
Protease ekstrak kasar Bacillus sp. DA 5.2.3 yang diproduksi pada media SF
1.2% mencapai aktivitas maksimum pada awal fase pertumbuhan stasioner setelah 48 jam (20.5 U mg
, oleh sebab itu Bacillus sp. DA 5.2.3 dipilih untuk dikarakterisasi lebih lanjut dalam penelitian ini.
-1
) sedangkan amilasenya mencapai aktivitas maksimum pada
fase pertumbuhan eksponensial setelah 24 jam (23.5 U mg-1
Protease Bacillus sp. DA 5.2.3 memiliki bobot molekul (BM) sekitar 150
kDa, sedangkan amilase terdiri atas 2 tipe enzim dengan BM berkisar 123 kDa dan 27 kDa yang diduga merupakan isoenzim. Uji TSS isolat DA 5.2.3 pada kultur cair media SF 1.2% selama 4 hari menunjukkan bahwa isolat ini mampu menurunkan TSS sebanyak 50% pada hari ke-2. Hal tersebut lebih cepat daripada
Bacillus sp. SP yang diisolasi dari probiotik komersial. Belum ada informasi mengenai hal ini sebelumnya dari Bacillus. Bacillus sp. DA 5.2.3 mempunyai karakteristik : mereduksi nitrat, tidak tumbuh pada suhu 50
). Kedua enzim aktif pada rentangan pH tambak (6-9) dan salinitas (1.5-3.5%). Aktivitas protease maksimum diperoleh pada pH 8 dan amilase pada pH 6. Pada rentangan salinitas 1.5-3.5%, aktivitas protease berkisar di atas 60% dari aktivitas maksimumnya pada kondisi tanpa NaCl (salinitas 0) sedangkan amilase berkisar di atas 50% dari aktivitas maksimumnya pada salinitas 1.5%. Stabilitas protease pada kondisi pH 8, salinitas 2.5% bertahan selama 3 jam dengan aktivitas berkisar di atas 65% sedangkan aktivitas amilase berkisar di atas 80% selama 6 jam inkubasi. Protease dan amilase isolat DA 5.2.3 aktif secara signifikan pada kondisi pH dan salinitas air tambak udang pada media pakan udang dan air laut. Oleh sebab itu isolat ini memungkinkan untuk diaplikasikan di tambak udang.
0
C dan kadar NaCl
7%. Analisis sekuen gen 16S rRNA isolat DA 5.2.3 dengan program Blast
(NCBI) menunjukkan bahwa isolat ini memiliki kesamaan 99% dengan Bacillus
cereus. Berdasarkan karakter yang dimiliki, Bacillus sp. DA 5.2.3 berpotensi untuk diaplikasikan di perairan tambak udang khususnya untuk menurunkan konsentrasi protein dan karbohidrat dari sisa pakan.
©Hak cipta milik IPB, tahun 2011
Hak cipta dilindungi undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
DAN AMILASE EKSTRASELULER YANG DIHASILKAN
UNTUK DEGRADASI SISA PAKAN
PADA BUDI DAYA UDANG
IT JAMILAH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Prof. Dr. Maggy T. Suhartono
Dr. Dinamella Wahyuningrum
Penguji pada Ujian Terbuka : Dr. Tri Widiyanto, M.Si.
Judul Disertasi : Penapisan Bacillus dan Karakterisasi Protease dan Amilase Ekstraseluler yang Dihasilkan untuk Degradasi Sisa Pakan pada Budi daya Udang
Nama : It Jamilah
NIM : G361020051
Disetujui
Komisi Pembimbing
Dr. Anja Meryandini, M.S.
Ketua Anggota
Dr. Ir. Iman Rusmana, M.Si.
Prof. Dr. Ir. Antonius Suwanto, M.Sc.
Anggota Anggota
Dr. Nisa Rachmania Mubarik, M.Si.
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S., DEA. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
penulisan disertasi ini. Puji dan syukur penulis ucapkan kehadirat Allah atas
nikmat ilmu yang telah diberikan. Disertasi yang berjudul Penapisan Bacillus dan
Telaah Enzim Protese dan Amilase yang Dihasilkan untuk Degradasi Sisa Pakan pada Budidaya Udang, disusun berdasarkan hasil penelitian penulis di IPB dari akhir tahun 2005 sampai pertengahan 2009.
Penghargaan yang tinggi dan ucapan terima kasih ditujukan kepada komisi pembimbing, yang terdiri atas Dr. Anja Meryandini M.S. sebagai ketua, Dr. Ir. Iman Rusmana, M.Si., Prof. Dr. Ir. Antonius Suwanto, M.Sc. dan Dr. Nisa Rachmania Mubarik, M.Si. sebagai anggota, yang telah memberikan arahan, kritikan, dan saran untuk kesempurnaan penelitian dan penyusunan tulisan ini. Ucapan terima kasih juga disampaikan kepada semua pihak yang telah memberikan dukungan finansial untuk pendidikkan dan penelitian ini. Dana pendidikan dan penelitian diperoleh dari proyek BPPS (2002-2006) dan Hibah Doktor 2009 dari Direktorat Jendral Pendidikan Tinggi (DIKTI), Departemen Pendidikan Nasional (Depdiknas), bantuan dana pendidikan dan penelitian dari Universitas Sumatera Utara (USU), dan bantuan bahan kimia dari Dr. Ir Iman Rusmana, M.Si. dan para pembimbing lainya.
Penulis sangat berterima kasih kepada Ibu Heni, Ibu Ika, dan Ibu Dewi atas bantuan teknis di laboratorium, dan beberapa staf PT Syahputra atas izin menggunakan produk probiotiknya kepada penulis. Ucapan terima kasih selanjutnya penulis tujukan kepada teman-teman di Laboratorium Mikrobiologi Program Studi Biologi-IPB: Elsi, Isramilda, Rina Puji Astuti, Khairul Syahputra, Huria Marnis, Hasrul Satria, Niken Finansia, Rika Indri Astuti, Roswita, Alberta Rika Pratiwi, Sri Rahayu, dan Aziz atas kerja samanya. Kepada sahabat sejati Magdaliza, terima kasih atas persahabatan dan dukungannya selama studi. Demikian pula kepada Nursahara Pasaribu dan teman-teman lainnya yang tidak dapat disebutkan satu persatu, penulis juga mengucapkan terima kasih atas dukungan, bantuan tenaga dan fikirannya.
tiga dari 4 bersaudara dari pasangan Djama’an dan Rostina. Pendidikan sarjana ditempuh di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Andalas dari tahun 1984 sampai 1990. Berkat rahmat Tuhan Yang Maha Esa, pada tahun 1991 penulis diterima sebagai staf pengajar di Jurusan Biologi, Universitas Sumatera Utara (USU) di Medan.
Pada tahun 1991 sampai 1992, penulis berkesempatan mengikuti pelatihan Bahasa Inggris di Pusat Bahasa Universitas Sriwijaya (UNSRI), Palembang dan di
The British Institute (TBI), Bandung. Pelatihan ini dilanjutkan di Economic Institute, Colorado University di Boulder, USA sampai pertengahan tahun 1993.
Kegiatan ini disponsori oleh Higher Education Developments Support (HEDS)
Project dari pemerintah Indonesia, bekerjasama dengan United State Aid for Development (USAID) dari pemerintah Amerika Serikat. Atas sponsor yang sama pula penulis dapat menempuh pendidikan di jenjang Master pada tahun
1993-1996 di Department of Food Science and Technology, Mississippi State
University, Mississsippi, USA di bidang Mikrobiologi Pangan. Penulis telah menghasilkan 2 publikasi ilmiah di jurnal Food and Dairy Science pada tahun 1998. Setelah lulus S2
Penulis kembali ke bangku pendidikan pada tahun 2002 menempuh program Doktor pada Program Studi Biologi, subprogram Mikrobiologi di IPB atas beasiswa BPPS dari Direktorat Jendral Pendidikan Tinggi (DIKTI), Departemen Pendidikan Nasional (DEPDIKNAS) priode 2002-2006. Setelah itu sampai tahun 2010 biaya penelitian dibantu oleh beberapa pihak seperti yang telah disebutkan sebelumnya dan atas biaya sendiri.
penulis kembali mengabdi di USU dan tahun 1998 penulis meraih penghargaan sebagi Dosen Teladan Tingkat USU. Pada tahun yang sama penulis diberi kesempatan menjabat sebagai Kepala Laboratorium Mikrobiologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam-USU, sampai tahun 2002.
Selama mengikuti program S3 di IPB penulis menjadi anggota Perhimpunan Mikrobiologi Indonesia. Beberapa karya ilmiah yang merupakan bagian dari
disertasi ini telah dipresentasikan 1) pada International Microbiology and
Biotechnology Confrence (IMBC) dalam bentuk poster dengan judul Selection and Characterization of Proteolytic and Amylolytic Bacillus spp. Isolated from Shrimp Ponds, di Universitas Atmajaya, Jakarta pada bulan November, 2008, 2) pada
Seminar Nasional Sains dengan judul Karakterisasi Protease dan Amilase
Bacillus sp. DA 5.2.3 yang Diisolasi dari Tambak Udang, bulan Oktober, 2009 di IPB. Sebuah publikasi ilmiah yang berkaitan dengan penelitian ini telah diterbitkan pula secara bersama-sama dengan komisi pembimbing pada jurnal ilmiah terakreditasi A, Microbiology Indonesia, volume 3 nomor 2 tahun 2009,
dengan judul Activity of Proteloytic and Amylolytic Enzymes of Bacillus spp.
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... ….. xxiii
DAFTAR LAMPIRAN . ... xxiv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA Pencemaran Perairan Tambak Udang ... 7
Pakan Udang ... 10
Total Padatan Tersuspensi (TSS) pada Perairan Budidaya Udang ... 12
Bacillus ... 13
Enzim Protease ... 15
Enzim Amilase ... 17
Identifikasi Mikrobe Berdasarkan Gen Penyandi 16S rRNA ... 19
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 21
Pengambilan Sampel Bakteri ... 21
Isolasi dan Penapisan Bacillus Proteolitik dan Amilolitik ... 21
Media, Kondisi Pertumbuhan dan Seleksi ... 21
Pertumbuhan Isolat ... 22
Uji Total Padatan Tersuspensi ... 23
Produksi Protease dan Amilase Ekstraseluler ... 24
Pengukuran Aktivitas Protease ... 24
Pengukuran Aktivitas Amilase ... 25
Karakterisasi Protease dan Amilase Isolat Terpilih ... 25
Pengaruh pH dan salinitas Terhadap Aktivitas Protease dan Amilase ... 25
Stabilitas Protease dan Amilase ... 26
Penentuan Bobot Molekul (BM)Protease dan Amilase ... 26
Identifikasi Isolat Terpilih ... 27
Ciri-ciri Morfologi dan Fisiologi ... 27
Identifikasi Berdasarkan Sekuen Gen Penyandi 16S rRNA ... 27
HASIL DAN PEMBAHASAN Isolasi dan Penapisan Bacillus Proteolitik dan Amilolitik ... 31
Pertumbuhan Isolat ... 38
DA 5.2.3.... ... 43
Aktivitas Protease Bacillus sp. DA 5.2.3 pada Rentangan pH ... 46
Aktivitas Amilase Bacillus sp. DA 5.2.3 pada Rentangan pH ... 49
Aktivitas Protease Bacillus sp. DA 5.2.3 pada Rentangan Salinitas ... 49
Aktivitas Amilase Bacillus sp. DA 5.2.3 pada Rentangan Salinitas ... 50
Stabilitas Protease Bacillus sp. DA 5.2.3 ... 50
Stabilitas Amilase Bacillus sp. DA 5.2.3 ... 51
SDS-PAGE, Native-PAGE, dan Zimografi ... 54
Total Padatan Tersuspensi Kultur Bacillus sp. DA 5.2.3 ... 59
Ciri-ciri Morfologi dan Fisiologi Bacillus sp. DA 5.2.3 ... 61
Identifikasi Bacillus Terpilih Berdasarkan Sekuen Gen Penyandi 16S-rRNA ... 63
SIMPULAN DAN SARAN ... 67
Simpulan ... 67
Saran .………... 68
DAFTAR PUSTAKA ... 69
1 Kriteria dan katagori kualitas air tambak secara fisik dan kimiawi ... 10
2 Protease ekstraseluler yang dihasilkan beberapa mikrob perairan ... 17
3 Bacillus penghasil protease ekstraseluler ... 18
4 Isolat-isolat yang diisolasi dari tanah sekitar tambak udang (A) Isolat proteolitik yang memiliki aktivitas amilolitik dan (B) isolat amilolitik yang memiliki aktivitas proteolitik ... 32
5 Isolat-isolat yang diisolasi dari sedimen tambak udang (A) I solat
proteolitik yang memiliki aktivitas amilolitik dan (B) isolat amilolitik yang memiliki aktivitas proteolitik ………... 33
6 Isolat- isolat yang diisolasi dari air tambak udang (A) Isolat proteolitik memiliki aktivitas amilolitik dan (B) isolat amilolitik
yang memiliki aktivitas proteolitik …...……….. 34
7 Isolat-isolat proteolitik yang diisolasi dari saluran pencernaan udang P. vannamei. (A) Isolat proteolitik yang memiliki/tidak memiliki aktivitas amilolitik dan (B) isolat amilolitik yang
memiliki/tidak memiliki aktivitas proteolitik ……….... 34
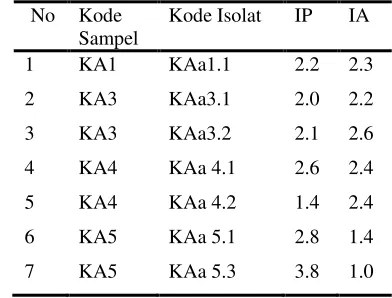
8 Isolat-isolat yang memiliki indeks proteolitik dan amilolitik ≥ 2.5 ... 35 9 Rekapitulasi jumlah isolat dan aktivitas enzim yang dimiliki dari
setiap sampel yang diisolasi dari tambak udang di Karawang,
Jawa Barat ... 36
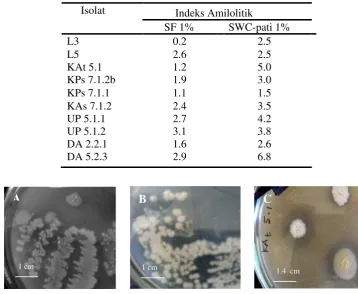
10 Indeks amilolitik sepuluh Bacillus terpilih pada media pakan
udang (SF) dan SWC-pati ... 38
11 TSS dan persentase penurunan TSS isolat Bacillus terseleksi pada kultur cair pakan udang 1.2% yang diinkubasi selama 96 jam pada
pH 7.5, salinitas 2.5%, di suhu ruang dengan penggoyangan 120 rpm ... 41
12 Respon Bacillus sp. DA 5.2.3 terhadap kriteria pengukuran secara
invitro ... 43
13 Karakteristik enzim protease ekstraseluler yang dihasilkan oleh
beberapa Bacillus spp. ... 47
14 Karakteristik enzim amilase ekstraseluler yang dihasilkan oleh
beberapa Bacillus spp. ... 48
15 Ciri-ciri morfologi dan fisiologi Bacillus sp. DA 5.2.3... 62
16 Perbandingan karakteristik fisiologi Bacillus sp. DA 5.2.3 dengan
1 Kerangka pemikiran penelitian ... 5
2 Diagram alir tahapan penelitian ... 30
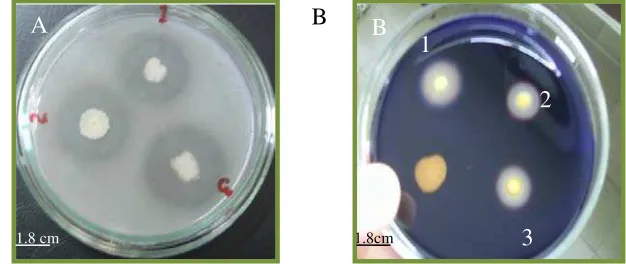
3 A) Zona proteolitik pada media SWC- milk 1%, (1) dan (3) isolat DA 5.2.3, (2) isolat KAs 7.1.2 B) zona amilolitik pada media SWC-starch 1%, (1) isolat DP 5.1.2 (2) dan
(3) isolat DP 2.1.1 ... 32
4 Morfologi koloni kelompok Bacillus yang diisolasi dari tambak dan saluran pencernaan udang A) isolat DP 5.1.2, B)
isolat KAs 7.1.2 C) isolat KAt 5.1 ... 38
5 Pertumbuhan isolat-isolat terseleksi pada media SF 1.2 %, pH 7.5, salinitas 2.5% di suhu ruang (±28 0
120 rpm. ... 39 C) dengan penggoyangan
6 Aktivitas spesifik protease isolat L5 dan DA 5.2.3 pada substrat kasein 1% pH 7.5, salinitas 2.5%. Enzim diproduksi pada suhu ruang
di media SF 1.2% dengan penggoyangan 120 rpm ………. 42
7 Aktivitas spesifik amilase isolat L5 dan DA 5.2.3 pada substrat pati terlarut 1%, pH 7.5, salinitas 2.5%). Enzim diproduksi pada suhu ruang dengan peggoyangan 120 rpm dan media SF 1.2% ... 42
8 Produksi protease dan amilase Bacillus sp. DA 5.2.3 pada interval
waktu pertumbuhan yang berbeda ... 44
9 Aktivitas relatif protease Bacillus sp. DA 5.2.3 pada rentangan
pH 6-9, substrat kasein 1%, salinitas 2.5% di suhu ruang ... 46
10 Aktivitas relatif amilase Bacillus sp. DA 5.2.3 pada rentangan
pH 6- 9, salinitas 2.5% pada pati terlarut 1% di suhu ruang ... 49
11 Aktivitas relatif protease Bacillus sp. DA 5.2.3 pada rentangan
salinitas 0-3.5%, pH 7.5 pada kasein 1%, di suhu ruang ... 49
12 Aktivitas relatif amilase Bacillus sp. DA 5.2.3 pada salinitas 0- 3.5%,
pH 7.5 pada pati terlarut 1% di suhu ruang ……….. 50
13 Aktivitas protease Bacillus sp. DA 5.2.3, pada A) pH 8 salinitas 0%
(kondisi optimum) dan B) pada pH 8 salinitas 2.5%
(kondisi umum tambak udang) ... 51
14 Aktivitas amilase Bacillus sp. DA 5.2.3 A) pada pH 6, salinitas 1.5% (kondisi optimum) dan B) pada pH 8, salinitas 2.5%
(kondisi umum tambak udang) ... 52
15 A) Profil SDS-PAGE protein ekstrak kasar Bacillus sp. DA 5.2.3
17 A) Profil SDS-starch-zimography protein ekstrak kasar amilase Bacillus sp. DA 5.2.3. B) Profil native-starch-zimography amilase
Bacillus sp. DA 5.2.3 ... 57
18 Nilai TSS kultur cair Bacillus sp. DA 5.2.3 pada media
pakan udang 1.2% yang diinkubasi pada suhu ruang ... .... 60
19 Bentuk morfologi Bacillus sp. DA 5.2.3. A) morfologi koloni,
B) morfologi sel dan, C) endospora pada perbesaran 400 X ………... 63
20 Amplikon DNA gen 16S-rRNA Bacillus sp. DA 5.2.3 hasil
PCR sekitar 1.3 kb ... 64
21 Pohon filogenetik berdasarkan sekuen gen 16S rRNA dari Bacillus sp. DA 5.2.3. yang dibandingkan dengan beberapa
1 Prosedur uji aktivitas protease (modifikasi dari Walter 1984) ... 85
2 Prosedur uji aktivitas amilase (Bernfeld 1959) ... 86
3 Pertumbuhan sepuluh Bacillus terseleksi pada media pakan udang (SF) 1.2% ... 89
4 Aktivitas protease Bacillus sp. L5 dan DA 5.2.3 ... 89
5 Aktivitas amilase Bacillus sp L5 dan DA 5.2.3 ... 90
6 Waktu produksi protease, amilase, dan pertumbuhan sel Bacillus sp. DA 5.2.3 ... 90
7 Aktivitas protease Bacillus sp. DA 5.2.3 pada rentangan pH ... 91
8 Aktivitas amilase Bacillus sp.DA 5.2.3 pada rentangan pH ... 91
9 Aktivitas protease Bacillus sp. DA 5.2.3 pada rentangan salinitas ... 91
10 Aktivitas amilase Bacillus sp. DA 5.2.3 pada rentangan salinitas ... 91
11 Stabilitas protease Bacillus sp. DA 5.2.3 pada kondisi optimum reaksi enzim (pH 8, salinitas 0) ... 92
12 Stabilitas protease Bacillus sp. DA 5.2.3 pada kondisi umum tambak udang (pH 8, salinitas 2.5%) ... 92
13 Stabilitas amilase Bacillus sp. DA 5.2.3 pada kondisi optimum reaksi enzim (pH 6, salinitas 1.5%) ... 92
14 Stabilitas amilase Bacillus sp. DA 5.2.3 pada kondisi umum tambak udang (pH 8, salinitas 2.5%) ... 92
15 Komposisi larutan untuk SDS-PAGE ... 93
16 TSS dari kultur Bacillus sp. DA 5.2.3 pada media pakan udang (SF) 1.2% ... 95
17 Sekuen gen penyandi 16S rRNA Bacillus sp. DA 5.2.3 ... 96
18 Hasil analisis Blast gen 16S rRNA Bacillus sp. DA 5.2.3 ... 97
Latar Belakang
Udang merupakan salah satu primadona ekspor perikanan Indonesia, yang
telah memberikan pemasukan devisa yang cukup besar bagi negara. Indonesia
merupakan salah satu negara pengekspor udang terpenting di dunia di samping
Cina, Thailand, India, Vietnam dan beberapa negara di Amerika Latin. Pada tahun
2004 produksi udang Indonesia berada di urutan ke-6 dunia (FAO 2006). Negara
tujuan ekspor terpenting bagi Indonesia adalah Amerika Serikat dan Jepang.
Indonesia merupakan pengekspor produk udang beku nomor dua terbesar bagi
Jepang, sedangkan untuk Amerika Serikat Indonesia berada di tempat ketiga
(Rangkuti 2007).
Jenis udang yang dikembangkan pada awal perkembangan budi daya udang di
Indonesia ialah Penaeus monodon (jumbo tiger prawn) dan P. marquensis (udang
putih). Serangan penyakit dan penurunan kualitas air tambak menyebabkan
produksi udang tersebut terus menurun dari tahun 1990-an sampai 2000-an. Tahun
1992 total produksi nasional sekitar 98.350 ton, produksi menurun menjadi 83.193
ton pada tahu 1994. Pada tahun 1998 produksi ini turun lagi menjadi 74.824 ton
(Departemen Perikanan dan Kelautan 2002).
Tahun 2000 para pengusaha mulai beralih pada jenis udang P. vannamei
karena dianggap lebih tahan penyakit. Sistem budi daya yang dikembangkanpun
lebih kepada sistem semiintensif maupun intensif. Keberhasilan budi daya udang
P. vannamei mengalami puncak pada tahun 2005, dengan peningkatan produksi
tiga kali lipat (Rangkuti 2007). Keberhasilan ini juga tidak berlangsung lama
karena beberapa tahun terakhir produksi udang inipun tidak stabil dan cenderung
menurun meskipun tidak secara drastis. Dari tahun 2008-2009 produksi udang
budi daya turun sebanyak 15% (Kementrian Kelautan & Perikanan 2009).
Masalah utama penurunan produksi udang ialah penurunan kualitas air dan
serangan penyakit. Pada budi daya udang secara intensif, penurunan kualitas air
dapat terjadi dengan cepat disebabkan oleh faktor internal seperti akumulasi sisa
pakan akibat kelebihan pemberian pakan (overfeeding) dan hasil metabolisme
hewan peliharaan (Moriarty 1999). Sisa pakan berupa protein di perairan dapat
nitrat (Intan et al. 2005). Christoper et al. (2003) menyatakan bahwa pada budi
daya udang, sebahagian besar nitrogen (±90%) masuk ke kolam sebagai pakan
buatan, 22% dikonversi menjadi udang yang dipanen, 14% tersisa pada sedimen,
dan sisanya 57% dikeluarkan ke lingkungan.
Protein merupakan sumber nitrogen bagi bakteri. Pada sistem perairan
protein akan diuraikan oleh bakteri heterotrofik maupun fermentatif menjadi
senyawa-senyawa seperti amonia dan nitrit yang bersifat racun bagi hewan air
(Boyd & Fast 1992). Karbohidrat digunakan sebagai sumber energi bagi ikan
selain itu digunakan sebagai bahan pengikat pada proses pembuatan pakan (Craig
2002). Selain diubah menjadi senyawa-senyawa toksik diperairan, akumulasi sisa
pakan yang tinggi di perairan tambak akan menurunkan kualitas air dengan
menurunnya DO (dissolved oxygen) dan meningkatnya BOD (biologycal oxygen
demand). Hal ini dapat mengganggu ketahanan udang, menurunkan laju
pertumbuhan bahkan dapat menyebabkan laju kematian yang tinggi (Moriarty
1999).
Peningkatkan aktivitas degradasi senyawa organik pada sistem akuatik dapat
dilakukan dengan pemanfaatan bakteri melalui produksi enzim ekstraseluler
(Devaraja et al. 2002). Protease ekstraseluler mikrob adalah kunci dalam hidrolisis
senyawa protein menjadi peptida yang lebih sederhana dan asam amino yang
dimanfaatkan oleh mikrob untuk proses metabolismenya. Secara tidak langsung
proses ini dapat mengurangi cemaran amonia, nitrit dan nitrat dalam suatu
ekosistem (Bach et al. 2001).
Penelitian tentang potensi penggunaan bakteri yang menguntungkan
(probiotik) pada budi daya udang sudah banyak dilaporkan diantaranya dapat
memberikan efek positif terhadap ketahanan dan pertumbuhan udang (Veschuere
et al. 2000), menghambat pertumbuhan bakteri patogen udang (Rengpipat et al.
1998, Vaseeharan & Ramasamy 2003, Decamp & Moriarty 2007), merangsang
sistem imun udang (Rengpipat et al 2000, Gullian et al. 2004) dan meningkatkan
kualitas air tambak (Widiyanto et al. 1998, Widiyanto et al. 2005, Widiyanto et al.
2008) yang dapat menurunkan kadar H2S, nitrat, nitrit dan amonia. Ziai-Nejad et
al. (2006) mendapatkan isolat bakteri yang dapat meningkatkan aktivitas enzim
Bacillus spp. telah dilaporkan sebagai agen biokontrol terhadap patogen
udang seperti Vibrio harveyi (Moriarty 1999, Veschuere et al 2000). Lalloo et al.
(2007) dan Zhou et al. (2009) menyatakan bahwa penambahan Bacillus spp. ke air
pemeliharaan udang dapat meningkatkan kualitas air dengan menurunkan kadar
ion amonium, nitrit, nitrat, dan fosfor. Kelompok Bacillus dikenal sebagai
penghasil enzim-enzim ekstraseluler yang potensial sebagai pengurai bahan
organik di alam seperti protease (Mabrouk et al. 1999, Patel et al. 2006,
Essakkiraj et al. 2008) ) dan amilase ( Srivasta 1987, Hagihara et al. 2001, Anto et
al. 2006, dan Ling et al. 2009). Kelompok bakteri probiotik yang telah dilaporkan
untuk budi daya perairan seperti ikan, kerang dan udang ialah bakteri fotosintetik,
Lactobacillus, Bacillus (Zhou et al. 2009), dan Vibrio (Widanarni 2005, Niwane
& Selvin 2009).
Genus Bacillus terdiri atas kelompok bakteri berbentuk batang, Gram
positif, yang dicirikan oleh kemampuannya untuk menghasilkan endospora (Todar
2005). Umumnya spesies Bacillus tidak berbahaya terhadap mamalia, termasuk
manusia dan secara komersial penting sebagai penghasil berbagai macam
metabolit sekunder dalam jumlah yang tinggi seperti antibiotik, bioinsektisida,
dan enzim (Ferrari et al 1993, Olmos-Soto 2003). Isolat DA 5.2.3 yang dipilih
untuk karakterisasi enzim lanjut dalam penelitian ini pada uji awal yang dilakukan
dapat menghambat pertumbuhan V. harveyi secara in vitro (data tidak
dipublikasikan).
Penelitian dilakukan untuk mengatasi pencemaran sisa pakan udang di
perairan yaitu dengan menggunakan Bacillus proteolitik dan amilolitik. Bakteri
diisolasi dari tambak dan saluran pencernaan udang. Penapisan isolat dilakukan
berdasarkan angka indeks proteolitik dan amilolitik, pertumbuhan, nilai TSS, dan
termasuk uji aktivitas enzim. Karakterisasi enzim protease dan amilase yang
dihasilkan dilakukan pada kondisi lingkungan seperti yang umum di perairan
kolam udang seperti pH dan salinitas. Untuk melihat potensi isolat terpilih dalam
degradasi protein dan karbohidrat, digunakan pakan udang komersial dan air laut
sebagai media pertumbuhan dan produksi enzim. Uji TSS dilakukan untuk
mengetahui kemampuan isolat terpilih dalam menurunkan total padatan
tersuspensi dari media cair pakan udang. Konsep pemikiran penelitian ini
Tujuan Penelitian
1) menapis dan mengkarakterisasi Bacillus proteolitik dan amilolitik yang
diisolasi dari tambak dan saluran pencernaan udang,
2) mengkarakterisasi protease dan amilase ekstraseluler yang dihasilkan isolat
terpilih, dan
3) melihat kemampuan isolat terpilih dalam menurunkan total padatan
tersuspensi pada kultur cair pakan udang.
Manfaat Penelitian
Penelitian ini dapat digunakan sebagai bahan informasi tentang suatu pendekatan dalam mengatasi pencemaran air pada suatu sistem budi daya perairan
menggunakan bakteri, dan sebagai salah satu dasar dan acuan dalam pengendalian
senyawa-senyawa toksik pada sistem budi daya udang. Isolat bakteri dari
Indonesia yang diperoleh dari penelitian ini dapat dikembangkan untuk
penanggulangan masalah penurunan kualitas air pada sistem budi daya udang
Gambar 1 Kerangka pemikiran penelitian.
Pakan udang
Sisa pakan di perairan
Seleksi dan karakterisasi
Bacillus proteolitik & amilolitik
Kandungan bahan organik di air tinggi
Udang mengalami gangguan
pertumbuhan
Protein Karbohidrat
Protease Amilase
Kandungan protein dan karbohidrat di air turun
Kualitas air meningkat
Produktivitas udang meningkat
Tambak udang
Isolat potensial
TINJAUAN PUSTAKA
Pencemaran Perairan Tambak Udang
Tingginya permintaan konsumen terhadap produk perikanan terutama
udang dari tahun ketahun memacu perkembangan industri budi daya udang yang
sangat pesat. Selain itu, tingginya nilai produk udang budi daya dan siklus hidup
yang relatif singkat menyebabkan sektor ini menarik minat banyak pengusaha
(New 1999). Pada pengembang budi daya udang skala besar dilakukan sistem
budi daya intensif. Pada sistim ini dilakukan pengaturan yang ketat terhadap
kondisi kolam seperti sistem pengairan, pakan dan perbenihan. Target utama
sistim ini ialah jumlah produksi yang tinggi pada area tambak yang kecil, oleh
sebab itu dilakukan padat tebar benih yang tinggi dan pemberian pakan dalam
jumlah serta kualitas yang tinggi ( Fast 1992).
Berkembangnya budi daya udang sistim intensif, diikuti pula oleh berbagai
permasalahan. Masalah yang umum pada sistem budi daya udang ini ialah
sedikitnya proporsi pakan yang digunakan oleh hewan, akibatnya sebagian besar
pakan tersisa sebagai limbah di air (Antony & Philip 2006) yang diikuti oleh
eutrofikasi dan pengayaan material organik yang tinggi pada dasar kolam.
Penurunan kualitas lingkungan seperti ini menurunkan produktivitas tambak, dan
meningkatkan tekanan pada udang yang menyebabkan udang rentan terhadap
penyakit, sehingga menurunkan produksi di berbagai daerah (Boyd & Musig
1992, Browdy & Hopskin 1995). Umumnya pengusaha tambak bergantung
kepada pergantian air yang relatif tinggi untuk menjaga kualitas air pada sistim
produksi, akibatnya terjadi pengeluaran material limbah pakan dan berbagai
metabolit langsung ke lingkungan terdekat (Browdy & Hopskin 1995).
Selain berdampak negatif terhadap lingkungan, intensifikasi budi daya
udang juga menyebabkan peningkatan resiko penyakit yang potensial terhadap
hewan. Penyakit yang berkembang di tambak udang di Indonesia ialah penyakit
yang disebabkan oleh virus White Spot Syndrome (WSS) dan Yellow Head Virus
(YHV) dan penyakit bakteri berpendar Vibrio harveyi. Selain itu pemakaian
antibiotik menjadi cara yang dianggap efektif untuk menanggulangi bakteri
ditemukannya residu antibiotik yang tinggi pada udang asal Indonesia,
mengakibatkan dikeluarkannya larangan ekspor udang Indonesia ke beberapa
negara tujuan (Rangkuti 2007).
Analisis komunitas mikrob dari tambak udang memainkan peranan yang
penting pada produksi udang, menyediakan sumber makanan, mendaur ulang
nutrien dan mengurai tumpukan bahan organik melalui berbagai proses
metabolisme. Komunitas mikrob sebaliknya juga dapat mempengaruhi kualitas air
dengan meningkatkan kebutuhan oksigen akibat konsumsi karbon organik labil
yang dihasilkan dari sisa pakan, alga, dan pelepasan dari bakteri sedimen akibat
penguraian bahan organik (Hansen & Blackburn 1991).
Berbagai cara dicoba dilakukan untuk mengatasi pencemaran air dan
degradasi kualitas tambak udang di antaranya yang paling populer ialah dengan
pemanfaatan mikrob (Devaraja et al. 2002). Bioremediasi adalah salah satu cara
yang menggunakan mikrob atau enzim di kolam yang digunakan untuk
meningkatkan kualitas air dan menjaga kesehatan dan stabilitas sistem budi daya
air. Bioremediasi melibatkan mineralisasi bahan organik menjadi CO2
Penggunaan bakteri untuk kesejahteraan manusia seperti kesehatan dan
pertanian sangat menarik perhatian lebih dari satu dekade terakhir. Probiotik
sudah digunakan di berbagai produk seperti susu dan makanan tambahan. Di
bidang peternakan probiotik sudah diaplikasikan pada pakan, dan di bidang
pertanian digunakan sebagai pupuk. Probiotik merupakan mikrob hidup baik
dalam bentuk kultur tunggal maupun campuran yang ditambahkan ke dalam
makanan hewan atau manusia yang dapat menguntungkan inang dengan menjaga
keseimbangan mikrob ususnya (Fuller 1992; Salminen & Wright 1998). Defenisi
ini kemudian dikembangkan lagi oleh Verschuere et al. (2000) untuk aplikasi
probiotik pada budi daya perairan. Deskripsi yang diberikan sesuai dengan
modus aksi probiotik tersebut, yaitu mikrob hidup yang menguntungkan bagi ,
merangsang produksi udang, nitrifikasi dan denitrifikasi untuk: 1) menghilangkan
sisa nitrogen dari kolam, dan 2) menjaga keragaman dan menstabilkan komunitas
kolam dengan memusnahkan patogen dari sistim dan mempertahankan spesies
yang diinginkan. Pada bioremediasi digunakan bakteri heterotrofik pendegradasi
bahan organik, bakteri nitrifikasi, denitrifikasi dan bakteri fotosintetik (Antony
inang dengan memodifikasi hubungan komunitas mikrob yang berasosiasi dengan
inang atau lingkungannya, meningkatkan penggunaan makanan atau nilai nutrisi,
memacu respon inang terhadap penyakit, atau dengan meningkatkan kualitas
lingkungan. Berdasarkan definisi di atas probiotik dapat mencakup mikrob yang
mencegah perkembangbiakan patogen pada rongga pencernaan, pada struktur
permukaan, dan pada lingkungan peternakan, menjamin penggunaan pakan secara
optimal dengan membantu sistem pencernaan inang, meningkatkan kualitas air,
dan merangsang sistem ketahanan inang (Verschuere et al. 2000).
Berbagai produk probiotik untuk akuakultur dipromosikan memiliki
berbagai keunggulan yang bervariasi; mereduksi nitrat, nitrit, amonia, H2S,
menghilangkan logam berat, bahan organik, menurunkan BOD, mengatasi
penumpukan lumpur, penghambatan pertumbuhan Vibrio sp. dan bakteri patogen
lainnya. Tetapi banyak dari keuntungan yang diiklankan tidak memiliki
konfirmasi, dan merupakan riset yang tidak dikendalikan secara terpadu (Antony
& Philip 2006).
Penelitian yang dilakukan oleh Fernandes et al. (2010) untuk menguji suatu
sistim aerasi untuk mengatasi pencemaran air di tambak udang, didapatkan
bakteri heterotrofik melampaui jumlah bakteri nitrifikasi, denitrifikasi dan
pereduksi sulfat. Jumlah bakteri heterotrofik berkisar 10-3 sampai 10-4 CFU mL-1
dan selalu tinggi di air yang diaerasi maupun tidak di aerasi. Tingginya
kelimpahan bakteri ini dapat disebabkan tingkat ketersediaan karbon organik di
tambak. Drakare (2002) menjelaskan bahwa di samping memecah senyawa
organik, bakteri heterotrofik juga merupakan kompetitor yang unggul dalam
pemanfaatan fosfat dan dapat menjaga tingkat nutrien yang optimal. Rao dan
Karusanagar (2000) menyatakan udang memiliki kemampuan konversi makanan
yang rendah dimana lebih dari 50% pakan terbuang ke air.
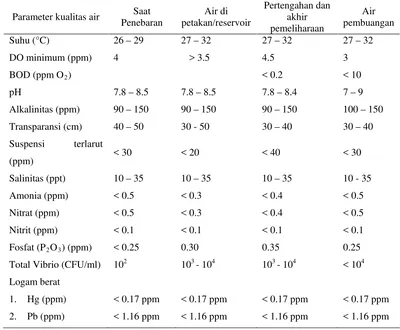
Di Indonesia kriteria kualitas air untuk tambak memiliki kisaran pH 7.8-9.0,
suhu 26-32 0C, kadar nitrat kurang dari 0.3-0.5 ppm, nitrit kurang dari 0.1 ppm
dan suspensi terlarut berkisar dari 20-40 ppm (Tabel 1). Daerah yang paling
cocok untuk pertambakan udang adalah daerah pasang surut dengan fluktuasi
Tabel 1 Kriteria dan katagori kualitas air tambak secara fisik dan kimiawi
buatan merupakan sumber nutrien utama untuk pertumbuhan udang yang dibudi
dayakan. Secara umum nutrisi di dalam pakan diperlukan oleh tubuh untuk
proses pemeliharaan, aktivitas, pertumbuhan dan reproduksi. Ketersediaan pakan
dalam jumlah yang cukup, tepat waktu dan bernilai gizi baik merupakan salah
satu faktor yang sangat penting dalam kegiatan usaha budi daya. Penyediaan
pakan yang tidak sesuai dengan jumlah udang yang dipelihara menyebabkan laju
pertumbuhan udang menjadi lambat, akibatnya produksi yang dihasilkan tidak
sesuai dengan yang diharapkan. Pada dasarnya, sumber pakan berasal dari pakan
alami dan pakan buatan. Oleh karena jumlah pakan alami di kolam pemeliharaan
tidak memadai untuk budi daya intensif dan semi intensif, maka untuk mencapai
Pakan buatan adalah pakan yang dibuat untuk memenuhi kebutuhan nutrisi
dan gizi udang, dibuat dalam skala industri yang diberikan saat ketersediaan
pakan alami yang kurang atau tidak memadai. Berdasarkan komposisi kandungan
nutrisinya pakan buatan mempunyai formulasi yang sudah disesuaikan dengan
kebutuhan pertumbuhan udang. Pakan udang yang dibuat secara komersial
merupakan bahan campuran hasil penggilingan yang mengapung, melayang atau
pelet yang tenggelam di air. Udang termasuk hewan yang menyukai makanan
yang tenggelam, tetapi kebanyakan udang dapat dilatih untuk menerima makanan
yang mengapung (Craig 2002).
Pada budi daya udang nutrisi merupakan masalah yang kritis dan membutuhkan 40-50% dari biaya produksi. Industri pakan udang berkembang
secara dramatis pada beberapa tahun terakhir ini dengan pengembangan formulasi
makanan baru yang seimbang untuk memacu pertumbuhan dan kesehatan yang
optimal (Craig 2002). Pakan udang buatan dapat dalam bentuk lengkap atau
tambahan. Pakan lengkap menyediakan semua bahan (protein, karbohidrat, lemak,
vitamin dan mineral) yang diperlukan untuk pertumbuhan yang optimal dan
kesehatan ikan, biasanya terdiri atas protein (18-50%), lemak (10-25%),
karbohidrat (15-20%), abu (<8.5%), fosfat (<1.5%), air (10%) dan sejumlah kecil
vitamin dan mineral. Kebutuhan protein yang tinggi dalam makanan udang
disebabkan oleh lintasan produksi energinya sebagian besar tergantung kepada
oksidasi dan katabolisme protein (Craig 2002). Khusus untuk udang umumnya
pakan mengandung protein sekitar 28-32%. Komposisi pakan ini dapat bervariasi
berdasarkan umur udang peliharaan.
Pakan mengandung unsur nitrogen yang sebagian besar dikeluarkan
melalui insang dalam bentuk amonia (NH3
Karbohidrat (pati dan gula) adalah sumber energi yang ekonomis dan tidak
mahal dari pakan udang. Karbohidrat termasuk ke dalam makanan budi daya
perairan yang dapat menurunkan biaya pakan dan untuk unsur pengikat pada ) dan hanya 10% hilang dalam bentuk
padat (Craig 2002). Percepatan eutrofikasi akibat pengayaan nutrien pada
permukaan air akibat kelebihan nitrogen pada air buangan budi daya udang
merupakan suatu kekhawatiran petani terhadap penurunan kualitas air.
Pemberian pakan yang efektif dan praktek manajemen limbah penting untuk
proses pembuatan pakan. Karbohidrat disimpan sebagai glikogen oleh ikan yang
dapat diaktifkan untuk memenuhi permintaan energi. Sebanyak 20% karbohidrat
dari pakan dapat digunakan oleh udang (Craig 2002).
Total Padatan Tersuspensi (TSS) pada Perairan Budi daya Udang
Total padatan tersuspensi (total suspended solid [TSS]) terdiri atas sejumlah partikel organik dan anorganik, yang terbawa ke dalam badan air. Pada
kebanyakan sungai, TSS terutama disusun oleh partikel-partikel mineral yang
kecil. Pakan merupakan sumber utama nutrisi dan partikel pada budi daya
perairan. Limbah partikel organik berupa feses, ammonia dan sisa pakan pada
umumnya akan terakumulasi di dasar kolam, sedangkan limbah terlarut akan
terbuang ke lingkungan. Polusi nitrogen dan fosfor dari pakan merupakan
ancaman utama terhadap lingkungan pembuangan air. (Tzachi & Lawrence
1995).
Peranan dari bakterioplankton pada aliran energi dan karbon melalui sitim
akuatik merupakan salah satu bidang penelitian yang dilakukan dengan sangat
serius sejak lebih dari dua dekade terakhir. Penelitian ini memperlihatkan bahwa
bakteri heterotrofik mendominasi sistim metabolism di laut maupun air tawar,
mengubah material organik tersuspensi dan terlarut menjadi biomasa dan karbon
anorganik (Billen et al. 1990). Suatu bioremediator yang baik harus mengandung
mikrob yang mampu secara efektif menghilangkan limbah yang mengandung
karbon di air. Hal ini akan didukung jika mikrob ini berkembang dengan cepat
dan memiliki aktivitas enzim yang tinggi (Antony & Philip 2006).
Pengayaan bahan organik pada ekosistim bentik dapat meningkatkan
konsumsi oksigen pada komunitas sedimen dan pembentukan kondisi anoksik.
Efek nyata dari hal ini ialah turunnya konsentrasi oksigen terlarut pada dasar dan
permukaan air. Penurunan ini disebabkan oleh kebutuhan oksigen biokimia yang
tinggi oleh limbah organik dan respirasi dari hewan air. Aliran air dari tambak
udang intensif memiliki ciri-ciri BOD yang tinggi dengan level partikel organik
dan anorganik serta nitrogen yang tinggi (Tzachi & Lawrence 1995).
Air buangan tambak udang dapat mengandung konsentrasi nutrisi terlarut dan partikel tersuspensi yang lebih tinggi jika dibandingkan dengan air yang
lingkungan yang negatif terhadap perairan pantai yang disebabkan oleh
eutrofikasi dan peningkatan kekeruhan (turbiditas) (Jones & Preston 2008).
Bacillus
Bacillus ditemukan oleh Ferdinan Cohn pada tahun 1872 yang kemudian
dinamakannya B. subtilis. Bakteri ini termasuk ke dalam family Bacillaceae, yang
ditandai dengan produksi endospora, suatu struktur yang terbentuk di dalam sel
bakteri pada bagian subterminal atau terminal. Anggota dari genus Bacillus
termasuk bakteri Gram positif berbentuk batang lurus atau sedikit bengkok,
berukuran 0.3-2.2 µm x 1.2-7.0 µm, aerobik atau fakultatif anaerobik, kebanyakan
spesies motil (Corbin 2005). Bakteri ini tersebar luas di alam, dikenal dengan
daya tahan sporanya yang luar biasa terhadap senyawa kimia dan agen fisik,
perkembangan siklus pembentukan spora, produksi antibiotik, toksisitas spora dan
pembentukan kristal protein terhadap berbagai insekta patogen (Todar 2009).
Bacillus merupakan bakteri Gram positif yang dikenal dengan produksi
endosporanya yang membuat dia dapat bertahan pada berbagai kondisi
lingkungan dalam jangka waktu yang sangat panjang, bahkan sampai ratusan
tahun (Slepecky & Hampell 1992). Bacillus memiliki keragaman fisiologi di
dalam anggota genus. Gambaran kolektifnya mencakup kemampuan degradasi
semua substrat yang diperoleh dari tumbuhan dan hewan, seperti selulosa, pati,
pektin, protein, dan agar-agar hidrokarbon. Selain itu kelompok genus bakteri ini
juga merupakan produser antibiotik, dan berpotensi melakukan proses nitrifikasi,
denitrifikasi, dan fiksasi nitrogen di alam. Karakteristik lainnya mencakup
heterotrof, litotrofi fakultatif, asidofil, alkalofil, psikrofil, termofil dan ada yang
bersifat parasit. Pembentukan spora ditemukan secara universal pada genus,
diperkirakan sebagai suatu strategi untuk bertahan pada lingkungan. spora dorman
melalui udara menyebabkan spesies Bacillus ditemukan hampir di semua habitat
yang diteliti (Todar 2009) .
Daniel dan Morgan (1988) menemukan suatu isolat Bacillus yang diperoleh
dari tanah geotermal di daerah Antartika. Isolat ini mampu tumbuh secara
heterotrof maupun autotrof dengan adanya hidrogen dan karbondioksida. Isolat ini
mirip dengan B. schlegellii yang juga mampu tumbuh secara autotrof
Spesies Bacillus umumnya terdapat di tanah, air, debu dan udara. Bakteri ini juga terlibat dalam pembusukan makanan, masuk ke saluran pencernaan melalui
makanan. Spora Bacillus dapat ditemukan dengan mudah di tanah, oleh sebab itu
bentuk hidup (sel vegetatif) dari bakteri ini diasumsikan juga mendiami tanah,
tetapi asumsi ini belum dapat dibuktikan. Oleh sebab itu lokasi dimana bakteri ini
ditemukan belum tentu merupakan habitat aslinya. Studi literatur lebih jauh
memperlihatkan bahwa Bacillus secara umum ditemukan dalam lambung hewan-
hewan dan serangga. Hal ini dapat terjadi akibat tertelan bakteri yang tercampur
dengan tanah. Teori yang baru muncul menyatakan spesies Bacillus muncul
dalam suatu hubungan endosimbiotik dengan inang, bertahan dan berkembang
biak dalam rongga pencernaan. Kelompok bakteri ini banyak ditemukan pada
sedimen kolam, danau, sungai atau laut oleh sebab itu secara alami tertelan oleh
hewan seperti udang, ikan, dan kerang yang makan di atau dari sedimen. Spesies
Bacillus telah dengan mudah ditemukan pada ikan, krustasea, kerang, udang dan
dapat ditemukan pada insang, kulit dan rongga pencernaan udang (Cutting 2006).
Beberapa Bacillus seperti B. subtilis, B. licheniformis, B. coagulans, dan
termasuk B. cereus adalah contoh bioremediator yang baik karena menghasilkan
enzim-enzim yang potensial dalam degradasi senyawa-senyawa organik. Tetapi
biasanya kelompok bakteri ini tidak memiliki jumlah yang cukup banyak di badan
air, karena habitat alaminya di sedimen (Philip & Antony (2006). Dengan
menjaga bakteri ini dalam level yang tinggi pada kolam produksi, para petani
dapat menurunkan penumpukan karbon organik selama siklus pertumbuhan
ternak, sementara itu hal ini juga akan memacu kestabilan perkembangan
fitoplankton melalui peningkatan produksi CO2
Kelompok Bacillus yang merupakan bakteri heterotrofik dapat merupakan alternatif bakteri nitrifikasi di perairan tambak udang. Bakteri ini lebih toleran
terhadap kondisi lingkungan pada rentangan yang lebih luas (Straub & Dixon
1997). Banyak dari kelompok bakteri ini digunakan dalam bentuk produk paket (Secura 1995).
Suatu keuntungan penggunaan Bacillus di tambak udang adalah karena
bakteri ini tidak mungkin munggunakan gen resistensi antibiotik atau virulensi
dari kelompok vibrio atau bakteri Gram negatif lainnya. Ada penghambat pada
tingkat transkripsi dan translasi untuk mengekspresikan gen dari plasmid, fage
kering karena memiliki spora (Intan et al. 2005). B. subtilis banyak terdapat di
lingkungan seperti air, tanah udara yang mengurai sisa tumbuhan yang
menyumbangkan siklus nutrien karena menghasilkan berbagai enzim (Valbuzzi et
al. 1999). Banyak spesies Bacillus menghasilkan berbagai enzim ekstraseluler dan
digunakan secara luas untuk menghasilkan enzim bagi industri seperti protease
dan amilase (Fleming et al. 1995).
Enzim Protease
Keragaman spesies biota laut dan estuari berkontribusi terhadap berbagai
jenis enzim dengan karakteristik yang unik. Beberapa tahun terakhir, protease dari
usus ikan menarik banyak perhatian (Chi et al. 2007). Hal ini membantu
pengembangan pengayaan aplikasi produk-produk dengan bantuan enzim sebagai
katalis pada protein dari berbagai sumber. Protease memiliki berbagai aplikasi di
bidang industri seperti detergen, pengolahan kulit, penemuan logam, kesehatan,
pemerosesan makanan, pakan ternak, industri kimia, dan pengolahan limbah
(Kumar & Tagaki 1999).
Protease adalah enzim yang menghidrolisis ikatan peptida pada molekul
protein yang menghasilkan peptida atau asam amino. Protein terdiri atas molekul
asam amino yang bervariasi jumlahnya, berkisar antara 10 sampai ribuan yang
berfungsi sebagai unit penyusun polimer protein yang terangkai melalui ikatan
peptida. Protein yang memiliki lebih dari 10 asam amino disebut polipeptida,
sedangkan istilah protein ditujukan bagi polimer asam amino dengan jumlah di
atas 100 (Suhartono 1992).
Persatuan internasional biokimia dan molekuler biologi (The International
Union of Biochemistry and Molecular Biology) tahun 1984 merekomendasikan
kata peptidase (E.C. 3.4) untuk enzim yang menghidrolisis rantai peptida.
Protease sinonim dengan peptidase. Protease secara umum dibagi atas
eksopeptidase (E.C. 3.4.21-99-) atau endopeptidase (E.C. 3.4.19-) tergantung
kepada lokasi tempat aksi enzim terjadi. Jika enzim memecah ikatan peptida di
arah amino atau ujung karboksi dari substrat, maka diklasifikasikan sebagai
eksopeptidase. Jika enzim memecah ikatan peptida jauh dari ujung amino atau
Efektivitas kerja protease terhadap suatu protein ditentukan oleh struktur
protein itu sendiri. Hal ini mempengaruhi kerentanan suatu protein terhadap
hidrolisis oleh suatu protease. Struktur tersebut terdiri atas: 1) struktur primer,
yaitu deret asam amino pada protein, 2) struktur sekunder (derajat pembentukan
struktur sulur alfa dan beta, serta struktur acak, 3) struktur kuartener merupakan
asosiasi antar subunit molekul protein. Protease memecah ikatan peptida dengan
bantuan molekul air (Suhartono 1992).
Ward (1983) menjelaskan bahwa berdasarkan cara kerjanya terhadap ujung
N atau C, eksopeptidase dibedakan menjadi aminopeptidase (E.C 3.4.11) dan
karboksipeptidase (EC 3.4.16 dan E.C 3.4.17). Endopeptidase dapat dibedakan
menjadi empat kelompok berdasarkan gugus asam amino fungsional pada sisi
aktifnya yaitu protease serin, protease sulfuhidril, protease asam dan protease
logam. Protease serin (E.C 3.4.2) merupakan enzim yang memiliki asam amino
serin pada sisi aktifnya. Enzim ini dihambat oleh fenil metil sulfonil flourida
(PMSF) dan diisoprofil flouro fosfat (DFP), tetapi tidak oleh etilen diamina tetra
asam asetat (EDTA). Jenis-jenis protease ini ialah tripsin, kimotripsin, elastase
dan subtilisin. Protease sulfidril atau protease thiol (E.C 3.4.22) merupakan
protease yang memiliki asam amino sistein pada sisi aktifnya. Enzim ini sensitif
terhadap beberapa oksidator basa dan beberapa logam yang dapat mengikat gugus
thiol pada sisi aktifnya. Golongan enzim ini ialah papain, fisin dan bromelin.
Protease asam (E.C 3.4.23) merupakan enzim yang aktif pada pH asam, tidak
sensitif terhadap EDTA maupun inhibitor protease serin. Contoh enzim ini ialah
pepsin, renin, dan beberapa enzim kapang yang aktif pada pH rendah yaitu 2-4.
Protease netral atau protease logam (E.C 3.4.24) adalah enzim yang menunjukkan
aktivitas maksimum pada pH netral, sensitif terhadap EDTA. Contoh enzim ini
ialah karboksipeptidase A, beberapa aminopeptidase, dan beberapa protease
bakteri (Ward 1983). Selain pengelompokan berdasarkan mekanisme di atas,
bagian nomenklatur enzim menempatkan protease yang tidak diketahui
mekanisme katalitiknya dalam suatu grup. Ini menunjukkan masih ada protease
baru yang belum diketahui mekanisme kerjanya (Suhartono 1992).
Enzim proteolitik mikroorganisme dapat ditemukan dalam sel (intraseluler)
pada dinding sel (periplasma), atau disekresikan ke medium (ekstraseluler) (Priest
membran sel. Enzim ini disintesis dalam bentuk prekursor kemudian dibebaskan
dalam bentuk aktif melalui proses proteolisis. Bagian peptida yang dilepaskan
biasanya bersifat hidrofobik (Suhartono 1989). Protease dihasilkan oleh beberapa
kelompok mikrob perairan terutama Bacillus (Intan et al. 2005). Daftar beberapa
protease yang dihasilkan oleh bakteri perairan disajikan pada Tabel 2.
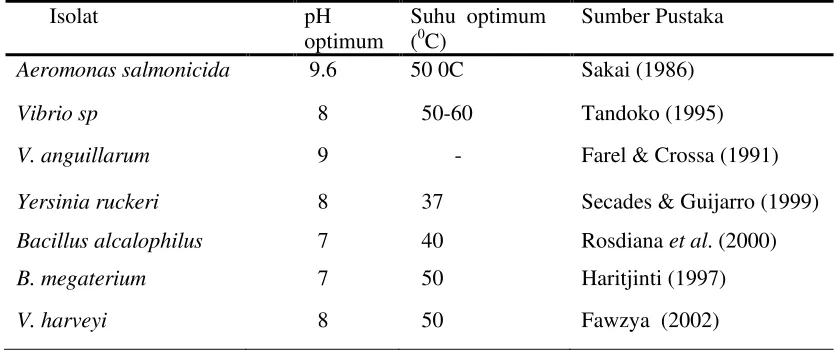
Tabel 2 Protease ekstraseluler yang dihasilkan beberapa mikrob perairan
Isolat pH
optimum
Suhu optimum (0
Sumber Pustaka C)
Aeromonas salmonicida 9.6 50 0C Sakai (1986)
Vibrio sp 8 50-60 Tandoko (1995)
V. anguillarum 9 - Farel & Crossa (1991)
Yersinia ruckeri 8 37 Secades & Guijarro (1999)
Bacillus alcalophilus 7 40 Rosdiana et al. (2000)
B. megaterium 7 50 Haritjinti (1997)
V. harveyi 8 50 Fawzya (2002)
Genus Bacillus menghasilkan beberapa enzim yang penting di antaranya
protease. Jenis protease yang disekresikan oleh Bacillus yang penting dalam
industri antara lain protease logam (netral) dan protease serin atau subtilisin
(alkalin) (Rao et al. 1998). B. licheniformis menghasilkan subtilisin (protease
serin) yang berperan penting dalam bidang industri terutama yang berhubungan
dengan produk-produk yang digunakan dalam pH alkali dan suhu tinggi seperti
detergen, hidrolisat protein untuk makanan maupun pakan (Ward 1983). Enzim
ini mempunyai berat molekul 27.277 kDa dan stabil pada kisaran pH yang luas.
Jenis substilisin yang lain ialah subtilisin BPN (Bacteria Protease Nagatase) yang
ditemukan oleh Harihara pada tahun 1954. Bacillus yang memproduksi enzim ini
ialah B. amyloliquifaciens, B. subtilis dan B. steraotermophilus. B. pumilus
menghasilkan protease logam yang mempunyai pH optimum 7, spesifik terhadap
asam amino hidrofobik dan alifatik. Logam yang dikandung enzim ini berupa Zn.
Mubarik dan Wirahadikusuma (1996) mendapatkan protein ekstraseluler dari
Bacillus subtilis ATTC 6633 yang termasuk protease logam dan protease
pada suhu 40 0C, pH 8 dan untuk protease campuran didapatkan pada suhu 40-45
0
Tabel 3 Bacillus penghasil protease ekstraseluler
C, pH 8-8.5. Beberapa jenis Bacillus menghasilkan enzim ekstraseluler (Tabel 3).
Spesies Jenis protease pH optimum B. cereus netral 7.0
B. licheniformis netral 6.5 -7.5 B. megaterium netral 7.0 B. polymixa netral 6.0 -7.2 B. stearothermophilus netral 6.9 -7.2 B. amyloliquefaciens alkali 10.2-10.7 B. subtilis var amyloliquefaciens netral 7.0
Suhartono (1992)
Enzim Amilase
Amilase adalah kelompok enzim yang mampu mengkatalisis proses hidrolisis pati, suatu polimer glukosa yang banyak terdapat pada polisakarida
tumbuh-tumbuhan seperti beras, jagung, kentang, tapioka dan terigu. Amilase
yang terlibat dalam hidrolisis pati ialah α-amilase (1,4-α-D-glukan
glukanohidrolase, EC 3.2.1.1), β-amilase (1,4-α-D-glukan glukanohidrolase; EC
3.2.1.2), glukoamilase (1,4-D-glukan glukanohidrolase; EC 3.2.1.3), α
-glukosidase (1,4-glukan glukanohidrolase; EC 3.2.1.20) dan enzim pemutus
cabang pullulanase (pullulan 6-glikanohidrolase; EC 3.2.1.41) dan isoamilase
(glikogen 6-glukanohidrolase; EC 3.2.1.68) (Aehle 1997).
Ada beberapa cara kerja amilase dalam memecah substrat: a) menghidrolisis
dari bagian dalam molekul substrat (endo-splitting) atau dari luar (exo-splitting),
b) retensi atau konfigurasi inversi, c) menghidrolisis ikatan glikosidik α-1,4
versus α,1-6 dan d) tipe reaksi hidrolisis atau transfer. α-amilase merupakan
enzim yang memecah dari dalam molekul yang menghidrolisis ikatan glikosidik
α-1,4 secara random dari substrat, menghasilkan sebagian besar maltosa dan
sedikit glukosa. Ikatan α-1,6 glikosidik tidak dipotong oleh α-amilase tetapi
ikatan tersebut tidak menghambat kerja amilase. Hampir semua α-amilase
termasuk metaloenzim kalsium memiliki ion Ca2+ dalam strukturnya yang
berguna untuk stabilitas enzim (Whitaker 1994, Linden et al . 2003). α-amilase
40-60% sintesis protein de novo dan satu-satunya enzim yang dapat secara langsung
menyerang dan menghidrolisis granul pati (Godbole et al. 2003).
β-amilase merupakan enzim yang memecah dari luar dan melepas unit
maltosa secara berurutan dari ujung non reduksi dari ikatan polisakarida. Jika
substrat memiliki ikatan α-1,6 seperti amilopektin, pemecahan pada rantai
tersebut akan berhenti. Glukoamilase merupakan enzim yang memotong molekul
substrat dari dalam dan memecah unit glukosa secara berurutan dari ujung non
reduksi dari rantai substrat. Kerja enzim pada substrat akan menurun bila bertemu
dengan ikatan α-1,6 seperti pada amilopektin dan glikogen, tetapi ikatan tersebut
dihidrolisis. Pululanase adalah enzim yang memecah dari dalam, menghidrolisis
pululan pada ikatan glikosidik α-1,6 (Whitaker 1994).
Pati merupakan substrat bagi amilase. Molekul pati merupakan polimer
glukosa yang dihubungkan oleh ikatan α-1,4 dan α-1,6 glikosidik. Perbedaan
ikatan penghubung ini membedakan struktur molekul pati yang terdiri atas
amilosa bagian yang tidak bercabang; merupakan polimer rantai tunggal terdiri
atas 500 sampai 2000 unit glukosa yang memiliki ikatan α-1,4 glikosidik dengan
penghubung α-1,6 glikosidik yang menghasilkan cabang polimer glukosa disebut
amilopektin. Hidrolisis pati oleh amilase pertama-tama menghasilkan polimer
rantai pendek yang disebut dekstrin, kemudian disakarida maltosa dan terakhir
adalah glukosa (Crueger & Crueger 1984). α dan β-amilase menghidrolisis pati secara menyeluruh menjadi maltosa karena amilosa hanya memiliki ikatan α-1,4 glikosidik tetapi biasanya menyisakan beberapa maltotriosa. Glukoamilase
menghidrolisis amilosa secara menyeluruh menjadi glukosa, beberapa maltosa
tetapi karena hidrolisis yang lambat dari enzim ini maltotriosa dapat tersisa pada
ujung (Whitaker 1994).
α-amilase dihasilkan oleh bakteri di antaranya B. subtilis, B. cereus, B.
amyloliquefaciens, B. coagulan, B. polymixa, B. stearothermophilus, Esherichia
coli, Pseudomonas, dan Proteus. Dari kelompok cendawan penghasil α-amilase di
antaranya ialah genus Aspergillus, Penicillium, Cephalosporium, Mucor dan
Rhizopus. β-amilase dihasilkan oleh sebagian kecil mikrob yaitu B. polymixa, B.
cereus, B. megaterium dan Rhizopus japonicus. Bacillus, B. amyloliquifaciens dan
amilase (Fogarty & Kelly 1980). Sumber karbon merupakan sangat
mempengaruhi produksi amilase, dari karbohidrat yang digunakan, pati
merupakan sumber karbon yang baik untuk sintesis amilase oleh Bacillus (Lin et
al. 1998, Hagihara et al. 2001). Degradasi pati menjadi maltodextrin kemudian
oleh berbagai bakteri dikatalisis oleh α-amilase dan diikuti oleh hidrolisis menjadi
glukosa oleh α- glikosidase ekstraseluler (Vihinem & Mansala 1989).
Di antra sumber karbon yang di uji, pati terlarut, tepung jagung, tepung kentang, maltosa, dan amilosa ditemukan sebagai yang terbaik untuk sintesis
amilase, sedangkan glukosa dan fruktosa memperlihatkan efek penekanan
terhadap produksi enzim. Penekanan katabolit telah dilaporkan pada enzim
pemecah karbohidrat yang dihasilkan oleh genus Bacillus (Lin et al. 1998).
Identifikasi Mikrob Berdasarkan Gen Penyandi 16S rRNA
Untuk menentukan kekerabatan evolusi antar spesies dalam keseluruhan
sistem biologi diperlukan parameter yang memenuhi persyaratan sebagai berikut:
1) terdapat pada semua makhluk hidup, 2) fungsinya identik, 3) dapat
dibandingkan secara objektif, 4) parameter tersebut berubah sesuai dengan jarak
evolusinya sehingga dapat dijadikan sebagai kronometer evolusi yang handal
(Madigan et al. 2000). Identifikasi bakteri berdasarkan gen penyandi 16S rRNA
sudah dilakukan secara luas untuk menentukan pohon filogenetik dari keragaman
bakteri di bumi. Gen penyandi 16S rRNA adalah gen yang menyandikan subunit
16S dari ribosom. yang terdapat pada semua bakteri terdiri atas gen yang sangat
konservatif dan sekuen gen yang sangat cepat berubah (variabel). Sekuen
variabel berevolusi pada laju yang berbeda sehingga memberikan cukup informasi
untuk menentukan kekerabatan hubungan filogenetik suatu organisme (Woese
1987).
Ada tiga cabang utama pohon filogenetik pada makhluk hidup di muka
bumi ini yaitu Bacteria, Archaea dan Eukarya yang disebut domain. Domain
merupakan tingkat taksonomi tertinggi yang berada setingkat di atas Kingdom
(Madigan et al. 2000). Berdasarkan pengelompokan ini mikrob diketahui
mendiami sebagian besar isi bumi. Klasifikasi ini merupakan dasar klasifikasi
terbaru berdasarkan teknik molekuler biologi yang ditemukan oleh Profesor Carl
molekul rRNA, yaitu 5S, 16S dan 23S. Untuk identifikasi sering digunakan 16S
rRNA karena memiliki panjang nukleotida yang ideal (± 1500 kb), 5S memiliki
jumlah nukleotida yang sangat pendek (±120 kb) sehingga tidak cukup informasi
untuk perbandingan sekuen gen. Kebalikan dari hal ini dimiliki oleh 23S rRNA,
gen ini memiliki jumlah rantai nukleotida yang terlalu panjang sehingga tidak
Tempat dan Waktu Penelitian
Penelitian ini dilakukan dari Oktober 2005 sampai dengan Mei 2009 di
Laboratorium Mikrobiologi, Departemen Biologi Fakultas MIPA dan
Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumber daya
Hayati dan Bioteknologi, Institut Pertanian Bogor.
Pengambilan Sampel Bakteri
Sampel air, sedimen, tanah dan udang diambil dari tambak udang perairan
estuari di Karawang, Jawa Barat. Air diambil sebanyak 100 ml sedangkan sedimen
dan tanah diambil kira-kira 100g kemudian dimasukkan ke dalam botol sampel.
Semua sampel disimpan di kotak es sampai dikultur di laboratorium. Bakteri
saluran pencernaan diambil dengan cara menarik usus dari bagian badan di
belakang kepala, kemudian dibilas alkohol 75% selama 3 detik, diusap dengan
kapas sampai kering dan digerus dalam lumpang sampai halus untuk selanjutnya
diencerkan dalam larutan garam fisiologis (NaCl 0.85%). Keseluruhan tahapan
kerja penelitian mulai dari tahap ini dan seterusnya dapat dilihat pada Gambar 3.
Isolasi dan Penapisan IsolatProteolitik dan Amilolitik
Media, Kondisi Pertumbuhan, dan Seleksi. Sampel bakteri diencerkan dengan garam fisiologis pada pengenceran 10-2-10-3 CFU mL-1 kemudian
dipanaskan di dalam penangas air pada suhu 80 0C selama 15 menit. Sebanyak
0.1 mL sampel disebar pada media agar-agar SWC (sea water complete) 50%
yang mengandung 1.5 gL-1 bakto pepton, 0.5 gL-1 ekstrak ragi dan 1.5 mL-1
gliserol dalam campuran air laut dan akuades dengan perbandingan 3:1 (Atlas
1997) kemudian diinkubasi pada suhu ruang (±28 0C). Metode ini memberi
peluang bagi tertapisnya Bacillus mesofilik (Slepecky & Hamphyll 1992, Corbin
2005). Untuk deteksi aktivitas proteolitik media pengkulturan ditambah dengan
1% susu skim (AnleneTM , New Zealand Dairy Board, Selandia Baru). Bakto
pepton dan ekstrak ragi tidak digunakan pada media SWC untuk menjaga agar