ANALISIS GENOTIPE NORMAL DAN ABNORMAL
PADA KLON KELAPA SAWIT
(Elaeis guineensis
Jacq.) DENGAN RAPD
OLEH
:
SARRO INA ITA. BANGUN
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul : " Analisis Genotipe Normal dan Abnormal pada Klon Kelapa Sawit (Elaeis guineensis Jacq) dengan RAPD " adalah benar merupakan hasil karya saya sendiri. Semua
sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat
diperiksa kebenarannya.
Bogor, Oktober 2002
ANALISIS GENOTIPE NORMAL DAN ABNORMAL
PADA KLON KELAPA SAWIT
(Elaeis guineensis
Jacq.)
DENGAN RAPD
SARRO INA ITA. BANGUN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis . : Analisis Genotipe Normal dan Abnornlal pa& Klon
Kelapa sawit (Elaeis guineensis Jacq.) dengan RAPD Nama Mahasiswa : Sarro Ina Ita. Bangun
N ~ P : 99623
Program Studi : Bioteknologi
Menyetujui,
1. Komisi Pembimbing
Prof. Dr. Drh Maria Bintang. MS K e t u a
Dr. Nurita poruan- Mathills MS. APU
Anggota
Mengetahui,
2. Ketua Program. Studi Biotcknologi 3. Direktur Program Pascasarjana
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah Yang Maha Kuasa karena kasih dan karuniaNya penulis dapat melewati masa - masa sulit dalam penelitian maupun penulisan tesis. Salah satu wujud dari karunia Allah adanya kasih dan keikhlasan berbagai pihak untuk memberi dukungan pikiran, tenaga, dana dan doa
sehingga penulis mampu menyelesaikan tesis ini yang merupakan salah satu persyaratan untuk meraih gelar Magister Sains di Program Pascasarjana Institut Pertanian Bogor. Oleh karena itu, melalui kesempatan ini penulis ingin menyampaikan terima kasih dan penghargaan setinggi-tingginya kepada :
1. Prof. Dr. Drh. Maria Bintang, MS selaku ketua komisi pembimbing, atas segala dorongan, bimbingan dan arahan selama penelitian dan penulisan tesis ini. Kesabaran dan dorongan beliau sangat penulis rasakan sehingga menambah motivasi penulis dalam menyelesaikan penelitian dan penulisan tesis ini. Telah banyak sekali bantuan dan kemudahan yang telah diberikan kepada penulis berkaitan dengan kelancaran penulis dalam menyelesaikan studi program pascasarjana secara keseluruhan di Institut pertanian Bogor. Semoga Allah Yang Maha Kuasa memberkati dan melimpahkan karuniaNya. 2. Dr. Nurita Toruan - Mathius, MS. APU, sebagai anggota komisi. Kesediaan
beliau memberi arahan, bimbingan serta dorongan dan motivasi yang sangat besar dan talc henti-hentinya terhadap penulis sejak pelaksanaan teknik penelitian I dan 11, penyusunan proposal, pelaksanaan penelitian yang terus dimonitornya sampai pada penulisan tesis ini sangat penting artinya sehingga berbagai masa sulit dapat terlewati. Sebagai kepala laboratorium biologi molekuler dan imrnunologi pada unit penelitian bioteknologi perkebunan (UPBP) Bogor, beliau memberikan keleluasan penulis dalam memanfaatkan fasilitas yang tersedia disamping itu keleluasan dari segi waktu yang memperbolehkan penulis melakukan aktifitas pada hari-hari libur bahkan malam memungkinkan penulis mempercepat waktu penelitian laboratorium.
3. Kepala Unit Penelitian Bioteknologi Perkebunan (UPBP) Bogor atas izin yang diberikan kepada penulis untuk dapat bergabung dalam proyek penelitianyang ada pada Unit Penelitian Bioteknologi Perkebunan (UPBP) Bogor.
4. Rektor Universitas Nasional Jakarta dan Dekan Fakultas Biologi Universitas atas izin dan kesempatan yang diberikan kepada penulis untuk mengikuti program Magister Sains (S2) di IPB.
5. Rektor IPB, Direktur program pascasarjana IPB dan pengelola proyek BPPS Departemen Pendidikan dan Kebudayaan (Depdiknas saat ini) atas kesempatan dan beasiswa yang diberikan sehingga penulis dapat melanjutkan studi S2 dan dapat menambah ilmu pengetahuan serta ketrampilan penulis. 6 . Tolhas Hutabarat, BSc-Dipl.Kim atas diskusi dan masukkan yang sangat
Ucapan terimakasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada seluruh keluarga, Ayahanda Sanggup Bangun dan Ibunda Radumalem Sinuraya serta adik-adikku yang secara tulus ikhlas memberikan dukungan maupun mendoakan dan mendorong penulis untuk selalu sabar dan tabah dan setiap langkah untuk mencapai kemajuan dan kesuksesan.
Kepada suamiku tercinta Andreas Tetap Malem Sitepu dan anakku tersayang Pieter G.Eisura dengan ketabahan, kesabaran dan segala bentuk pengorbanaannya selama menyelesaikan studi, penulis persembahkan segala apa yang telah diraih selama ini.
Akhirnya penulis berharap semoga tulisan sederhana ini yang tentu saja masih banyak kekurangannya karena keterbatasan penulis dapat bermanfaat terutama bagi penulis dan bagi yang membutuhkannya di kemudian hari.
Bogor, Oktober 2002
DAFTAR
IS1
Halaman
DAFTAR TABEL
...
vi
DAFTAR GAMBAR
...
vi
DAFTAR
LAMPIRAN
...
vii
...
PENDAHULUAN 1
Latar Belakang
.
.
...
1...
Tujuan Penelltian
. .
4...
Kegunaan Penelltian 5
TINJAUAN PUSTAKA
...
6 Botani dan Syarat Turnbuh...
6...
Pemuliaan Tanaman 8
Abnormalitas Klon Kelapa Sawit
...
11...
Markah Molekuler 14
...
Random AmpliJied Polymorphic DNA (RAPD) 17
BAHAN DAN METODE
...
23 Waktu dan Tempat Penelitian...
23 Bahan Tanaman...
23 Isolasi DNA Genom...
24 Percobaan 1.
Seleksi Primer...
25 Percobaan 2.
Analisis RAPD Klon Kelapa sawit Normaldan Abnormal
...
27 HASIL DAN PEMBAHASAN...
31 1.
Seleksi Primer...
31 2.
Analisis RAPD Klon Kelapa sawit yang Normal dan Abnormal....
35 Hubungan Genetik Klon Kelapa sawit...
37 Analisis Pita RAPD sebagai Penanda Abnormalitas...
Klon Kelapa sawit 41
KESIMPULAN DAN SARAN
...
45 Kesimpulan...
45 Saran...
45DAFTAR PUSTAKA
...
46...
DAFTAR
TABEL
Halaman
1. Komposisi campuran utarna untuk reaksi amplifikasi
DNA (master mix)
...
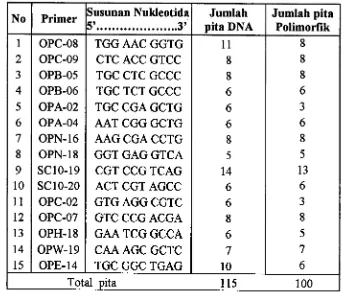
262. Jenis, susunan oligonukleotida, jumlah pita DNA dan jumlah pita
polimorfik DNA yang terseleksi
...
33...
3. Primer dalam reaksi PCR, pasangan Mon normal dan abnormal 36
4. Matrik kemiripan genetik berdasarkan pola pita DNA terhadap
16 genotipe dari 6 klon kelapa sawit
...
38....
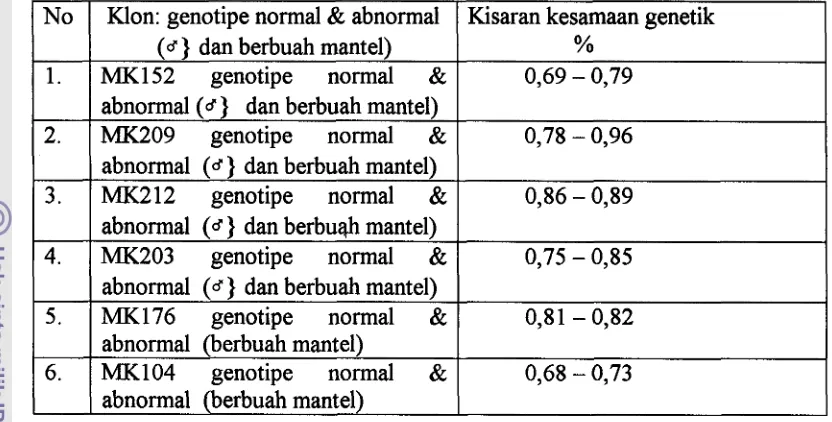
5. Kesamaan genetik antar genotipe tanaman di dalam masing-masing klon 39
DAFTAR GAMBAR
Halaman
1. Buah normal dan tidak normal tanaman kelapa sawit yang
...
berasal dari kultur jaringan 13
...
2. Prinsip amplifikasi fiagrnen DNA pada mesin PCR 2 1
3. Bagan alir analisis data
...
304. Seleksi primer menggunakan klon MK203 (berbuah abnormal dan
normal) dengan primer OPA-02,OPA-04,OPA-07,OPB-05,OPB-06,
...
OPN-16, OPN-18 31
5 . Pita DNA 6 klon kelapa sawit hasil amplifikasi menggunakan primer
- 6. Dendograrn 16 genotipe kelapa sawit hasil analisis klaster berdasarkan
pola pita DNA dengan metode UPGMA menggunakan 1 5 primer acak
. . .
.407. Sebaran genotipe tanaman kelapa sawit terhadap klon MK152, MK209, MK212, MK203, MK176, MK104
...
43DAFTAR
LAMPIRAN
Halaman
1. Komposisi pereaksi dan bufer untuk analisis DNA klon kelapa sawit
...
5 12. Skor pita polimorfik RAPD berdasarkan lima belas primer acak
...
523. Nilai komponen utama dari pita-pita h a i l amplifikasi dengan 15 primer
acak yang berperan membedakan 6 klon kelapa sawit
...
534. Jenis primer, total pita DNA enarn klon kelapa sawit yang diamplifikasi
menggunakan 15 primer acak
...
555. Jenis primer, total pita polimorfik enam klon kelapa sawit yang
diamplifikasi menggunakan 15 primer acak
. .. ..
.
..
..
.. .
..
.
.
.
.
..
...
.
..
...
..
. .. .. .. . .
. .
. .
566. Jenis, susunan oligonukleotida dan kandungan GIC 3 1 primer acak
PENDAHULUAN
Latar Belakang
Kelapa sawit adalah komoditi perkebunan utama sebagai sumber devisa dan
hidup rakyat banyak. Di samping sebagai komoditas ekspor (35%), sekitar 65%
produksi minyak sawit digunakan untuk konsumsi dalam negeri sebagai bahan
mentah untuk industri pangan dan oleokimia, sekitar 2.014.000 ha lahan
pertanaman dengan laju pertumbuhan sekitar 12,6% per tahun (Basiron et
a1.,2002). Dalam 10 tahun terakhir ini perluasan pertanaman di dunia meningkat
dari 1.756.000 ha menjadi 6.563.000 ha, dengan produksi minyak sawit 21,73 juta
ton
-
49,42 juta ton, laju pertumbuhannya sekitar 4,10 % (Basiron, et al., 2002).Kelapa sawit adalah tanaman menyerbuk silang sehingga akan menghasilkan
keturunan yang heterogen. Dengan metode perbanyakan vegetatif secara kultur
jaringan, besar kemunglunan untuk memperoleh material tanaman yang
berkualitas sekaligus homogen (Toruan
-
Mathius, 1998).Keunggulan teknik kultur jaringan di antaranya adalah dapat digunakan untuk
menyediakan bibit kelapa sawit unggul secara massal, seragam, dan waktu
penyedim bibit relatif lebih singkat dibandingkan dengan teknik konvensional.
Menurut Duran et al. (1993) dengan menggunakan bahan tanaman klon diperoleh
peningkatan produksi minyak sawit mentah (MSM) sekitar 12% sampai lebih dari
30% dibandingkan dengan menggunakan bahan tanaman asal benih. Keunggulan
lainnya adalah klon yang dihasilkan secara genetik bersifat true-to type terhadap
ortetnya. Namun, sekitar 10-40% dari bahan tanam klon tersebut memiliki
(>
berproduksi yaitu umur 3-5 tahun. Hal ini menyebabkan kerugian besar bagi
perkebunan karena dibutuhkan biaya untuk pemeliharaan, tenaga
kerja,
dan arealpertanaman.
Menurut Corley et al. (1986) abnormalitas dapat te rjadi pada bunga jantan dan
betina yang berkembang menjadi buah partenokarpi dan buah mantel (bersayap).
Ada beberapa pendapat mengenai terjadinya abnormalitas : bersifat genetik (Rao
& Danough, 1990), gangguan ekspresi gen yang diakibatkan fitohormon (Jones
1991 & Paranjothy et al., 1993), struktur kalus yaitu kalus nodular yang kompak
dan kalus yang remah dengan pertumbuhan yang cepat menghasilkan 5-10% dan
100% tanaman abnormal (Pannetier et al., 1981; Ahee et ~ 1 . ~ 1 9 8 1 & Duran et
al., 1993). Duval et al. (1 993) menemukan perbedaan histologi, kandungan
protein, 2,4 diclorophenoxy acetic acid (2,4-D) dan sitokinin dalam kalus yang
remah. Sedang menurut Paranjothy et al. (1993); Ginting & Fatmawati (1996),
abnormalitas ada hubungannya dengan lamanya subkultur dan umur kalus.
Eeuwens et al. (2002) menyatakan, bunga mantel terjadi dari kondisi kultur
selama multifikasi embrio.
Beberapa metode untuk menelaah sifat genotipe tanaman telah banyak
dikembangkan seperti penanda molekuler. Penanda molekuler masih dibedakan
atas penanda isozim dan penanda DNA. Pada dasarnya ke dua ~enanda molekular
ini mempunyai prinsip dan interpretasi genetika yang sama. Penanda DNA yang
dilihat polimorfisme pita DNA, sedangkan isozim berupa polimorfisme protein.
Penanda molekular dapat memberikan resolusi yang cukup tinggi tentang
perbedaan genetik di antara individu, baik pada tingkat spesies maupun dengan
perbedaan genotipe normal, genotipe abnormal ringan dan berat ramet di primer
B17 dari klon nomor 36 dan 38 pada fiagmen 2,7 kb. Sementara Ng et al. (1993)
menyatakan jenis dan komposisi zat pengatur tumbuh khususnya sitokinin (IPA
dan 2) mempengaruhi terbentuknya mantel berat pada ramet kelapa sawit.
Nurhaimi-Haris & Darussamin (1997) dengan metode Random Amplified
Polymorphic DNA (RAPD) menemukan bahwa beberapa nomor primer acak dari
ABI dan OPB mampu membedakan antar genotipe tanaman kelapa sawit yang
berbuah normal dan abnormal dari klon yang sama, khususnya beberapa nomor
dari klon SOC, MK, LMC dan BC. Toruan-Mathius et al. (1998) dengan analisis
RAPD ditemukan primer yang membedakan genotipe normal, abnormal, dan
tanaman yang mengalami proses penyembuhan dari klon MK33 pada primer
OPC-07, OPC-09 dan OPH-12 ; dari klon MK59 pada primer OPB-04, OPD-07,
OPH-09, Abi 1 17,16 dan Abi 1 17,20. Sedangkan analisis protein (SDS-PAGE)
pada bunga dan buah dari klon MK33 dan MK59 menunjukkan bahwa gen
abnormalitas terekspresi pada bunga dan buah yang abnormal. Ditemukannya
protein spesifik dengan berat molekul 22,2 kD pada buah dan 15
kD
pada daundari tanaman yang berbuah abnormal maupun dari tanarnan yang mengalami
proses penyembuhan. Meskipun penyebab munculnya abnormalitas belum
diketahui, tetapi diduga terjadi akibat perubahan genetik selama proses in vitro.
Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Menetapkan primer RAPD yang mampu menghasilkan pita DNA yang
2. Menetapkan kesamaan genetik antar klon dan antar genotipe normal vs
abnormal maupun antar genotipe abnormal.
3. Menetapkan klon yang stabil di dalam kultur.
4. Menggelompokkan klon dan antar genotipe dalam klon yang sama
maupun antar klon yang diuji dengan analisis Umveight Pair-Group
Methode Arithmetic (UPGMA).
5. Menetapkan pita penciri genotipe abnormal untuk semua klon dengan
analisis komponen utama.
Kegunaan Penelitian
Sebagai informasi yang lebih jauh mengenai pemanfhatan RAPD untuk
menganalisis pita-pita DNA pembeda antar klon-klon kelapa sawit yang berbuah
TINJAUAN PUSTAKA
Botani dan Syarat Tumbuh
Kelapa sawit (Elaeis guineensis) termasuk klas monokotil, famili palrnae genus
elaeis dan species Elaeis guineensis, Elaeis alora dan Elaeis oleifera. Varietas
yang dikembangkan adalah dura, pisifera dan tenera dari spesies Elaeis
guineensis. Tanaman kelapa sawit merupakan tanaman asli Afiika, sesuai dengan
hasil penemuan fosil, sejarahnya dan asal mula bahasa dari nama kelapa sawit
tersebut (Elaeis dari bahasa Greek 'elaion', oil, sementara guineensis
menunjukkan asal yaitu Guinea Coast). Dari Afrika, kelapa sawit menyebar ke
Amerika Selatan dan ke Semenanjung Indo-Malaysia.
Tanaman kelapa sawit berakar serabut yang sebagian besar berada dekat
permukaan tanah yaitu pada kedalaman 15-30 cm (dangkal). Batangnya tegak
tidak bercabang, berdiameter 40-75 cm, tinggi batang dalam pembudidayaan tidak
lebih 15- 18m. Berdaun majemuk dengan pelepah daun tersusun melingkari batang
berbentuk spiral. Panjang pelepah daun mencapai 9 m dengan panjang helai daun
mencapai 1,2 m berjumlah 100
-
160 pasang. Jumlah pelepah yang dipertahankandalam perkebunan kelapa sawit sekitar 30-50 pelepah (Harley, 1971).
Tipe pembungaan kelapa sawit adalah berumah satu ( m o n ~ o u s ) yaitu bunga
betina dan bungan jantan terdapat pada satu tanaman, tetapi pada tandan yang
berbeda. Bunga tumbuh pada setiap ketiak pelepah daun, satu tandan bunga
berupa bunga jantan atau bunga betina, dengan masa siap polinasi yang berbeda
sehingga terjadi penyerbukan silang. Rasio bunga jantan dan betina dapat
bunga jantan mendominasi, sementara pada musim penghujan bunga betina yang
lebih dominan. Pada tanaman muda (umur 2-4 tahun) kadang kala dijumpai bunga
banci (hermaprodit), yaitu bunga jantan dan bunga betina terdapat dalam satu
tandan (Harley, 1971). Namun demikian, bunga banci akan menyusut atau
menghilang dengan sendirinya sejalan dengan bertambahnya umur tanaman.
Buah kelapa sawit tersusun dalam suatu tandan yang merupakan buah batu
yang terdiri dari kulit buah, daging buah, cangkang dan inti. Minyak sawit
sebagian besar (20-27%) terdapat pada bagian perikarp yaitu pada kulit buah dan
daging buah, sementara bagian inti hanya mengandung minyak sekitar 4-6%.
Berdasarkan ketebalan cangkang dan daging buah (mesokarp), tanaman kelapa
sawit dibedakan atas tiga tipe yaitu dura, pisifera dan tenera. Tipe dura
bercangkang tebal (2-8 mm), tanpa lingkaran sabut di bagian luar tempurung,
kandungan mesokarp rendah sarnpai medium (3545% terhadap buah, tetapi
kadang-kadang dijumpai di atas 65%). Pisifera tidak mempunyai cangkang dan
kandungan minyak sangat tinggi. Tipe tenera yang merupakan persilangan dura x
pisifera bercangkang tipis (0,5-4 mm), kandungan mesokarp medium sampai
tinggi (60-96% terhadap buah, tetapi kadang-kadang dijumpai dibawah 55%),
mempunyai lingkaran serabut pada bagian luar (Harley, 1971).
Menurut Harley (1971) kelapa sawit tumbuh baik iklim tropis zone katulistiwa
dengan tipe iklim Af dan Am (menurut klasifikasi Koppen), dengan curah hujan
sekurang
-
kurangnya 9 bulan, 2000-3000 rnmltahun yang menyebar sepanjangtahun. Lahan pertanaman mulai dari dataran rendah sarnpai pada ketinggian tidak
lebih dari 600 m di atas permukaan laut dan sangat sesuai bila tanah tersebut
subur bersolum dalam, berdrainase baik, pH 5,5-7,O yaitu tanah-tanah aluvial
yang bertekstur lempung liat berpasir.
Pemuliaan Tanaman
Program pemuliaan tanaman kelapa sawit di Indonesia dimulai pada tahun
1910an menggunakan material tanaman secara terbatas dari empat tanaman
kelapa sawit induk varietas dura yang ditanam pertarna kali di kebun Botani
Bogor pada tahun 1848. Sejak itu pula material tanaman lainnya diintroduksikan
dari Zaire, Ivory Coast dan Nigeria. Menurut PPKS, PT.Socfindo dan PT.PP
Lonsum (2000) strategi pengembangan bahan tanaman kelapa sawit melalui
penajaman pada pemuliaan tanaman di Indonesia adalah dengan perbaikan
produktivitas tanaman yang mempunyai keunggulan sekunder. Keunggulan
sekunder yang dimaksud antara lain laju pertumbuhan meninggi yang lambat,
kualitas minyak yang tinggi, komponen minor kelapa sawit, ketahanan terhadap
hama dan penyakit, toleransi terhadap cekarnan lingkungan, serta keragaman
morfologi yang kompak. Sementara itu, tidak jauh berbeda dengan Indonesia,
tujuan utama pemuliaan tanaman kelapa sawit di Malaysia adalah untuk
memperbaiki produktivitas tanaman sehingga implikasinya untuk meningkatkan
keuntungan komersial kelapa sawit. Di samping itu pemuliaan kelapa sawit
dewasa ini juga bertujuan untuk menghasilkan rninyak yang berkualitas tinggi
yaitu meningkatkan kandungan asam lemak tidak jenuh, karoten dan
tokoferoVtokotrieno1 (Tajudin & Lee, 2000).
Artas Soewar et al. (2000) menyatakan bahwa kelapa sawit yang diharapkan
sekunder yang berhubungan dengan siklus hidup dan kemudahan pemanenan serta
memperpanjang umur ekonornis tanaman. Di samping itu juga dikombinasikan
dengan upaya mereduksi pertumbuhan lilit batang agar kompetitif antar tanaman
dapat ditekan. Dengan dernikian produksi yang stabil dapat dipertahankan.
Karakter sekunder lainnya adalah ketahanan terhadap penyakit tanaman terutama
penyakit tajuk (crown disease) dan penyakit ganoderma. Penyakit ganoderma
adalah busuk pangkal batang yang disebabkan oleh Ganoderma boninense. Gejala
penyakit busuk pangkal ini dapat dilihat dari mahkota tanaman, di mana jumlah
jamur yang belum membuka lebih banyak dan daun-daun berwarna hijau pucat.
Gejala lebih lanjut daun-daun patah dan menggantung pada batang.
Strategi yang ditempuh dalam upaya perbaikan produktivitas dan performan
kelapa sawit tersebut adalah melalui aktivitas pemuliaan yang sistematis dan
berkelanjutan. Menurut PPKS, PT. Socfindo dan PT. PP Lonsum (2000),
institusinya secara terus menerus telah melakukan aktivitas tersebut sejak 19 16.
Pada awalnya perhatian para pemulia kelapa sawit terfokus pada perbaikan
tanaman yang mempunyai produktivitas CPO tinggi. Namun, sejalan dengan
berkembangnya industri hilir kelapa sawit dan tuntutan konsumen yang beragam,
para pemulia juga mengarahkan penelitiannya ke tanaman kelapa sawit yang
mempunyai keunggulan sekunder.
Seleksi tanaman kelapa sawit di Indonesia dimulai di Marihat Baris pada 1905
dan di Tinjowan pada 1919 dari hasil pertanaman kelapa sawit yang materialnya
berasal dari Kebun Botani Bogor tersebut. Selanjutnya terus dilakukan aktivitas
pemuliaan dengan menyilangkan tipe dura (D) dengan varietas lain yang
Tenera adalah hibrida hasil persilangan tipe dura dengan tipe pisifera dari varietas
lain kelapa sawit. Teramati kemudian bahwa DxP ternyata memberikan hasil 25-
30% lebih tinggi dibandingkan dengan dura. Pada skala komersial dikembangkan
tipe tenera melalui persilangan konvensional yang terkontrol antara dura unggul
(sebagai tetua betina) dan pisifera unggul (sebagai tetua jantan sumber serbuk
sari) (Asmono et al., 2000).
Bahan tanaman komersial selain berupa benih hasil persilangan dan seleksi
dikembangkan melalui perbanyakan secara kultur jaringan untuk memperoleh
turunan yang membawa sifat induknya secara murni, sehingga memunculkan
klon-klon kelapa sawit. Klon-klon tersebut dihltur dari tetua terpilih (ortet)
dengan seleksi ketat didasarkan pada seleksi individu, seleksi famili, seleksi
individu-famili dan indeks seleksi, yang mempunyai potensi produksi rninyak
tinggi, bebas penyakit tajuk dan pertumbuhan 40-60 cmltahun (Ginting &
Fatmawati, 1996). Klon yang dihasilkan oleh Pusat Penelitian Kelapa Sawit di
Marihat diberi nama MK (Marihat Kultur jaringan). Hasil penelitian Ginting &
Fatmawati (1996) menunjukkan bahwa produksi tandan buah segar kelapa sawit
lebih tinggi 10-30% dibandingkan dengan tanaman benih. Dari sejumlah klon
yang dihasilkan, MK60 memproduksi tandan bu& segar 40 tonlhaltahun dengan
rendemen minyak 13,13% dan berpotensi menghasilkan minyak sawit mentah 13
tonlhdtahun.
Kultur jaringan tanaman kelapa sawit dapat dilakukan dengan yaitu kultur
embrio (penyelamatan embrio), kultur organ, kultur pollen (tanaman haploid)
maupun kultur protoplast (hsi protoplas). Dengan kultur jaringan juga diperoleh
dan sewaktu-waktu dapat dimanfaatkan untuk tujuan pemuliaan maupun tujuan
perbanyakan tanaman.
Tahapan perlakuan kultur jaringan kelapa sawit dimulai dari pemilihan pokok
induk (ortet), pengambilan sumber jaringan (eksplan), pembuatan media,
sterillisasi, penanaman eksplan, pembentukan kalus (kalogenesis), pembentukan
embrio (embriogenesis somatik), pembentukan tunas, pembentukan akar,
aklimatisasi dan pengujian di lapang (Lubis et al., 1985).
Abnormalitas Tanaman
Meskipun penampakan tanaman hasil perbanyakan klon di lapangan relatif
seragam, namun perlu diamati lebih teliti apabila terjadi perubahan abnormalitas
pada bagian organ reproduksinya yaitu bunga dan buah. Abnormalitas pada bunga
atau buah tanaman kelapa sawit dilaporkan pada Konferensi Kultur Jaringan
Kelapa Sawit yang diselenggarakan di Kuala Lumpur pada Maret 1986. Corley et
al. (1986) mengemukan ada tiga macam abnormalitas pada tanaman kelapa sawit
yaitu berupa rangkaian bunga jantan andromorphic, buah mantled dan buah
partenokarpi. Abnormalitas berupa terbentuknya rangkaian bunga jantan
andromorphic dan buah mantled terjadi sebagai akibat adanya kesalahan fbngsi
dari organ-organ reproduksi, sedangkan buah partenokarpi dapat terbentuk karena
penyerbukan kurang sempurna. Buah mantled sangat jarang terdapat pada
tanaman asal seedling, tetapi bmyak ditemukan pada bahan tanam yang berasal
dari perbanyakan in vitro melalui teknik kultur jaringan.
Sekitar 10-40% dari bahan tanam klon memiliki pembungaan dan pembuahan
(Toruan - Mathius, 1996). Beberapa ahli berpendapat bahwa terjadinya
abnormalitas bisa bersifat genetik (Rao & Danough, 1990). Selain itu juga dapat
terjadi karena gangguan ekspresi gen yang disebabkan gangguan fitohorrnon
(Jones, 1991). Menurut Paranjothy et a1 (1993) abnormalitas berhubungan dengan
lamanya subkultur dan umur kalus. Struktur kalus yang kompak dan vriabel juga
dapat mengakibatkan adanya tanaman abnormal sebesar 5-10% (Pannetier et
al., 198 1; Duran et al., 1993).
Pada tingkat tanaman yang ada di lapangan yang abnormal ratio bunga jantan
akan lebih tinggi d a i pada tanaman normalnya, sehingga buah yang terbentuk
akan berkurang dan akhirnya menyebabkan hasil minyak mengalami penurunan.
Pada buah yang abnormal akan dijumpai endosperm tipis dan juga bentuk buah
yang abnormal dari biasanya (Haris, 1998).
Penampakan fenotipe (morfologi) merupakan suatu indikator gen-gen yang
spesifik dan berguna sebagai penanda genetik dalam kromosom. Penampakan
fenotipe sebenarnya mudah diamati di lapangan, narnun karena adanya faktor
lingkungan yang mempengaruhi dan berinteraksi h a t dengan faktor genetik,
maka penampakan fenotipe sering berbeda-beda walaupun secara genetik sama.
Selain itu ada perrnasalahan lain yang timbul yaitu pada populasi tunggal sulit
Gambar 1. Buah n o d dan tidak normal lamman kelapa sawit yang berasal dari
kultur jaringan
Keterangrm : (I) buah normal ; (2) mesokarp berdagmg ; (3a) buah
abnormal / bersayap ; (3 b) buah normal ; (4a) buah abnormal / mantel ringan ; (4b) buah abnormal / mantel berat ; (4c) penampang atas buah abnormal ; (44 & (4e) mantel berat 1 mesokarp bersayap keras ; (5a) &
Haris & Darussamin (1997) telah menemukan bahwa beberapa nomor dari
primer acak ABI dan OPB yang digunakan dalam analisis RAPD mampu membedakan antar genotipe tanaman kelapa sawit yang berbuah normal dan
abnormal dari klon yang sama, khususnya beberapa nomor dari klon SOC, LMC,
MK dan BC. Namun, tidak ditemukan pita spesifik yang dapat membedakan
tanaman yang berbuah normal dengan abnormal secara universal. Nurhaimi-Haris
(1998) mendeteksi perbedaan genetik beberapa nomor klon SOC, LMC dan MK
tanaman kelapa sawit yang berbuah normal dan abnormal serta melakukan
analisis pengelompokkan klon-klon tersebut berdasarkan analisis RAPD. Hasil
yang diperoleh menunjukkan bahwa ada kecenderungan genotipe tanaman yang
berbuah normal dan tidak normal dari satu klon yang sama berada dalam satu
kelompok. Diperoleh juga bahwa klon SOC mempunyai variasi genetik lebih
tinggi dibandingkan dengan klon LMC dan MK. Hal ini menunjukkan bahwa klon
SOC cenderung tidak stabil apabila diperbanyak secara in vitro.
Berdasarkan hasil yang sudah diperoleh tersebut dilakukan analisis RAPD
menggunakan klon-klon serta primer yang berbeda, dengan tujuan mendapatkan
informasi yang lebih jauh mengenai pemanfaatan RAPD untuk menganalisis pita-
pita DNA pembeda antar klon-klon kelapa sawit yang berbuah normal dan
abnormal. Tujuan lainnya adalah untuk mengetahui sejauh mana terjadi variasi
genetik antar genotipe normal dan abnormal dalam satu klon dan antar klon.
Markah Molekuler
Karakter morfologi telah lama digunakan untuk mengidentifikasi spesies,
berdasarkan protein atau DNA, dan telah sangat membantu penelitian pada berbagai disiplin seperti taksonomi, filogeni, ekologi, dan pemuliaan tanaman.
Markah molekuler pada tingkat DNA memiliki kelebihan dibandingkan dengan morfologi atau alozim antara lain : (1) karena genotipe suatu organisme diuji
secara langsung, sehingga pengaruh lingkungan dan perkembangan terhadap
fenotipe tidak menjadi masalah; (2) karena bagian yang berbeda dari DNA
berevolusi dengan kecepatan yang berbeda, sehingga bagian yang cocok dapat
digunakan untuk studi tertentu, misalnya bagian yang variabilitasnya tinggi untuk
identifikasi kultivar atau yang variabilitasnya rendah untuk studi filogenetik; (3)
karena jumlah polimorfisme yang ada tidak terbatas dan (4) berbagai macam
teknik telah dikembangkan yang masing-maing dapat menyediakan markah yang
sesuai terhadap suatu tujuan tertentu (Weising et al., 1995). Lebih jauh lagi Berg et
a1.(1997) menambahkan bahwa skoring terhadap kedua markah tersebut
tergantung dari ekspresi gen yang mungkin sensitif terhadap faktor lingkungan,
tahap perkembangan dan tipe jaringan.
Keuntungan utama markah DNA molekuler adalah sifat alarninya. Markah ini mencerminkan perubahan pada tingkat DNA sehingga menunjukkan jarak genetik yang sesungguhnya (aktual) antara individu secara lebih akurat daripada dengan
markah fenotipe. Sering sekali sulit untuk menyetarakan fenotipe dan genotipe
karena fenotipe yang sama bisa dimunculkan oleh genotipe yang berbeda (Serret
et ~1,1997).
Beberapa kegunaan markah molekuler dalam membantu pemuliaan antara lain
adalah (i) untuk analisis pautan dan pemetaan genetik; (ii) untuk identifikasi
antar spesies atau varietas dan juga dapat membantu menjelaskan filogenetiknya
(Weising et aZ.,1996). Lebih jauh lagi Ribaut & Hoisington (1998) menguraikan
bahwa berdasarkan keragaman genetik yang dihasilkan dari data sidik jari, bahan
tanaman bisa dikelompokkan ke dalam genetik pool tertentu. Informasi ini sangat
membantu dalam mengidentifikasi tetua yang paling cocok untuk disilangkan.
Untuk tanaman yang heterosis dimana pemanfaatannya adalah dengan
memproduksi kultivar hibrida, pengukuran jarak genetik berdasarkan markah
DNA dapat sangat membantu. Menurut Powell et al., (1996) ha1 tersebut dapat
dilakukan misalnya melalui analisis menggunakan NTSYS. Analisis klaster
berdasarkan kesamaan genetik menggunakan UPGMA dan hubungan antara
individu divisualisasi dalam bentuk fenogram yang dapat menggambarkan jarak
genetik antara individu yang diuji.
Perkembangan teknologi baru telah dapat menggembangkan analisis yang
dapat mempertinggi tingkat polimorfisme DNA untuk pemetaan genetik, MAS,
genom fingerprinting dan untuk menemukan hubungan genetik. Teknologi
tersebut meliputi antara lain : RFLP, RAPD, AFLP dan mikrosatelit (SSR).
Polimorfisme yang terdeteksi oleh AFLP dan RFLP mengungkapkan variasi
ukuran berdasarkan situs restriksi. Polimorfisme berdasarkan RAPD
mencerminkan variasi sequen DNA pada situs perlekatan (binding site) primer
dan dari perbedaan panjang DNA antara situs perlekatan primer (juga untuk
AFLP). Lokus SSR berbeda pada jurnlah unit ulangan di, tri atau tetranukleotida
yang ada pada DNA dan variasi panjang ini dapat dideteksi dengan PCR dengan
memanfaatkan sepasang primer yang mengapit setiap SSR tersebut (Powell et
berdasarkan apakah analisa tersebut menggunakan PCR atau tidak, dan apakah
primernya arbitrarilsemi-arbitrari ataukah secara spesifik dirancang berdasarkan
sekuen yang telah diketahui terlebih dahulu : (1) tidak berdasarkan PCR (RFLP,
VNTRs); (2) teknik berdasarkan primer arbitrari atau semi arbitrari (multiple
arbitrarily amplicon profiling) (MAAP) misalnya RAPD dan DAF atau AFLP);
(3) Site-targeted PCR (STMS) ; SSR. Banyak terdapat variasi dari berbagai
teknik dasar tersebut, diantaranya adalah sequence characterized amplified
region (SCARS) yang dihasilkan dari markah RAPD tunggal. Fragmen tersebut
diklon dan sekuen nukleotida pada ujungnya disekuensing, kemudian dipakai
sebagai dasar mendisain primer untuk amplifikasi spesifik. Teknik lain misalnya
ISSR, PCR-RFLP (cleaved ampl$ed polymophic sequenceslCAPS) dan AFLP
mikrosatelit.
Random Amplified Polymorphic DNA (RAPD)
Tanaman menyimpan informasi genetiknya dalam genom inti maupun organel
(khloroplas dan mitokondria). Genom didefenisikan sebagai gugus atau
keseluruhan gen dari suatu organisme yang mengendalikan seluruh metabolisme
sehingga organisme tersebut dapat hidup dengan sempurna. Gen dari setiap
organisme dapat mengalami perubahan yang disebut mutasi. Proses mutasi dapat
terjadi pada satu gen yang disebut mutasi gen, atau melibatkan potongan
kromosom, kromosom utuh atau mungkin juga seluruh set kromosom secara
kolektif yang disebut mutasi kromosom. Beberapa mekanisme mutasi seperti
delesi, duplikasi, inversi, dan translokasi yang dapat mengubah fenotipe tanaman.
dan dengan demikian penggunaan penanda DNA lebih mampu menggambarkan
keadaan genom tanaman yang sesungguhnya.
Kemajuan bioteknologi mengungkapkan infonnasi genetik yang terkandung
dalam genom tanaman dapat diamati sampai tingkat DNA. Analisis dapat
dilakukan melalui hibridisasi fiagmen DNA genom tanaman dengan pelacak DNA
(probe) pada teknik Restriction Fragment Length Polymorphism (RFLP), atau
dengan mengamplifikasi DNA genom tanaman dalam mesin Polymerase Chain
Reaction (PCR).
Teknik RAPD merupakan suatu cara untuk menganalisis variabilitas genetik
melalui amplifikasi DNA genom suatu tanaman menggunakan primer acak
tunggal. Variabilitas genetik tanaman dilihat berdasarkan polimorfisme pita DNA
yang berhasil diamplifikasi. Prinsip dasar RAPD adalah komplementasi urutan
basa primer dengan urutan basa DNA cetakan. Apabila terdapat komplementasi
urutan basa antara primer dan DNA cetakan, maka primer akan menempel pada
kedua ujung 3'OH utas DNA cetakan. Jika kedua situs penempelan primer berada dalam jarak yang dapat diamplifikasi, maka produk PCR akan diperoleh berupa
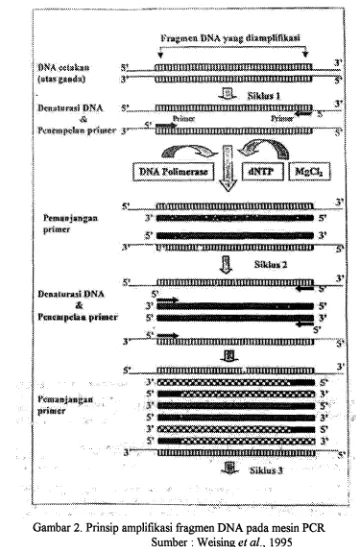
fragmen atau pita DNA (Tingey et al., 1992). Prinsip amplifikasi fragmen DNA
pada mesin PCR dapat dilihat pada Gambar 2.
Pada dasarnya amplifikasi DNA dalam mesin PCR mengikuti pola sintesis
DNA di dalam sel. Di dalam sel, proses sintesis DNA meliputi penguraian utas
ganda DNA menjadi utas tunggal yang disebut denaturasi. Kemudian sintesis
rantai DNA baru dengan menggunakan utasan tunggal sebagai model atau
cetakan. Sintesis DNA dimulai dengan penempelan primer pada utas tunggal
utas ganda kembali. Sintesis DNA mempunyai arah pertumbuhan 5
+
3, yaitudua nukleotida digabungkan satu dengan yang lainnya dengan cara merangkaikan
karbon gula kelima (C5) yang mengandung fosfat dari satu nukleotida kepada
karbon gula ketiga (C3) yang mengandung OH dari nukleotida lain, membentuk
ikatan 5
+
3 fosfodiester.Weising et al., (1995) menyatakan, seperti halnya sintesis DNA di dalam sel,
amplifikasi DNA pada mesin PCR secara in vitro membutuhkan enzim polimerase
DNA, primer, basa nukleotida (dATP, dCTP, dGTP, dTTP), MgC12, dan bufer
yang befingsi sebagai kofaktor enzim, serta H2O. Reaksi PCR melibatkan
pengaturan suhu pada mesin PCR selama pengulangan siklus. Setiap siklus terdiri
dari tiga tahap yaitu denaturasi DNA menjadi utas tunggal (94'~), penempelan
primer pada DNA cetakan ( 2 5 ' ~ - 65'~), dan pemanjangan primer (biasanya
72'~).
Hallden et al., (1996) menegaskan reaksi PCR sangat dipengaruhi oleh
konsentrasi komponen reaksi (MgC12, bufer, enzim, DNA cetakan, primer,
nukleotida, dan HzO), suhu denaturasi, suhu penempelan primer pada DNA
cetakan, suhu pemanjangan primer, jumlah siklus, serta keutuhan dan kemurnian
DNA cetakan.
Enzim polimerase DNA yang pertama kali digunakan dalam reaksi PCR dan
sampai sekarang masih digunakan adalah Tag polimerase DNA yang diisolasi dari
mikroorganisme Thermus aquaticus. Tag polimerase DNA bersifat tahan suhu
panas ( 9 4 ' ~ ) ~ menghasilkan fragmen DNA amplifikasi dengan ujung 3'A
35 - 70 basa per detik (Kidd & Ruano, 1995), dan lebih murah dibandingkan
enzim polimerase lain seperti Pfu dan Tli polimerase DNA.
Analisis genetik yang menggunakan prinsip kerja PCR pertama kali
dikembangkan oleh William dkk. tahun 1990 menggunakan primer tunggal atau
sekuen nukleotida pendek dengan jumlah basa antara 10 - 20 basa (Weising et al.,
1995). Primer adalah suatu f'ragmen DNA pendek dengan berukuran 10 - 20
pasang basa (pb) yang berperan dalam inisiasi sintesis untaian DNA. Peranan
primer pada teknik RAPD seperti peranan RNA-primer pada proses replikasi
DNA di dalam sel. Pada prinsipnya ada dua jenis primer yang dapat digunakan,
yaitu primer spesifik dan primer acak. Primer spesifik merupakan fragmen DNA
yang disintesis dari rangkaian oligonukleotida yang berpasangan dengan rantai
DNA (gen) tertentu yang biasa digunakan pada teknik RFLP, atau bagian dari
rantai DNA yang mengapit untaian DNA dari wilayah bukan penyandi seperti
lokus mini (mikrosatelit) pada teknik Simple Sequence Repeats (S SR). Sedangkan
primer acak merupakan fi-agmen DNA yang disintesis menggunakan "DNA
synthesizer", dan dapat dibeli dalam bentuk kit dari suatu perusahaan seperti
Operon Alamedh Technology (OPA).
Macam primer yang digunakan pada teknik RAPD berkaitan dengan suhu
penempelan primer dalam reaksi amplifikasi. Primer yang biasanya digunakan
mengandung basa G+C antara 60%
-
70%, karena semakin banyak kandunganbasa Guanin dan Cytosin, maka ikatan antara primer dengan DNA cetakan
semakin kuat dan stabil. Basa Guanin dan Cytosin mempunyai tiga ikatan
hidrogen, lebih banyak daripada basa Tirnin dan Adenin yang hanya mempunyai
I
Pca$a?s.jatsgm '
prkc r
i
I
i [image:113.580.123.479.76.623.2]I ... .-Pd....,... ... . , , , , ,-..- , ,#
.
.
.
.
.
.
.
.
,,,Analisis variabilitas genetik melalui teknik RAPD menggunakan primer acak
banyak digunakan karena mudah dilakukan, murah, cepat memberikan hasil,
cocok untuk membuat diagnosis silsilah (filogeni) suatu spesies, tidak
memerlukan latar belakang genom yang dianalisis, mudah mendapatkan primer
acak yang biasa digunakan untuk analisis genom semua organisme, menghasilkan
data seperti ale1 dominan dan polimorfisme yang dihasilkan sangat banyak
(Tingey et al., 1992).
Pada umumnya pemanfaatan markah DNA sudah banyak diterapkan dalam
pemuliaan tanaman misalnya dalam memperkirakan keragaman genetik,
kerabatan inter dan antar spesies atau varietas, identifikasi genotipe serta analisis
pautan dan pemetaan genetik. RAPD sebagai markah molekuler telah banyak
diterapkan dalam studi keragaman genetik, misalnya pada Vigna angularis (Yee et
al., 1999), kedelai (Powell et al., 1996; Doldi et al., 1997, Thompson et al., 1998),
kopi (Orozco-Castillo et al., 1994), pada Sesamun indicum L, (Bhat et al., 1999),
sorghum (Menkir et al., 1997), blueberry (Levi & Rowland, 1997), kelapa
(Ashburner et al., 1997), pada Hordeum vulgare (Selbach & Molina, 2000). Studi
keterpautan markah RAPD dengan sifat tertentu misalnya telah diterapkan antara
lain pada Prunus persica L (Warburton et a1.,1996), keterpautan dengan sifat
tahan terhadap Colletotrichum lindemuthianum pada tanaman buncis (Young &
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan sejak Januari - April 2002. Penelitian dilakukan di
Laboratorium Biomolekuler dan Imunologi, Unit Penelitian Bioteknologi
Perkebunan (UPBP), Bogor.
Bahan Tanaman
Bahan tanarnan yang digunakan berupa daun muda segar dari tanaman kelapa
sawit berumur 5 tahun berasal dari Kebun Percobaan Balai Penerapan Pengkajian
Teknologi (BPPT) Ciamphea, Bogor. Bahan tanaman adalah enam klon yang
terdiri dari empat klon ( MK152, MK209, MK212, MK203) yaitu berbunga
jantan, berbuah abnormal, normal dan dua klon m 1 7 6 , MK104) yaitu berbuah
abnormal dan normal. Masing-masing klon yang diambil dari buah abnormal
adalah bermantel berat, sehingga ada 16 contoh yang digunakan.
Bahan kimia yang digunakan adalah cetyl trimethyl ammonium bromide
(CTAB) lo%, Tris-HC1 1 M (pH=8), NaCl 5 M, larutan etilendiamin tetra asetat
(EDTA) 0,5 M (pH=8), bufer ekstraksi Orozco-Castillo et al. ,(1994) (Lampiran
I), kloroform : isoamilalkohol (24:1), larutan Tris-HC1 : EDTA (TE) (Lampiran
I), polivinil polipirolidon (PVPP), nitrogen cair, etanol 70%, etanol absolut,
isopropanol dingin, merkaptoetanol, air bebas ion, loading buffer (Lampiran I),
agarosa, larutan Tris-HCl : asam asetat : EDTA (TAE) 50X (Lampiran I), etidium
primer, enzim Taq DNA polimerase (Promega), larutan stok dNTPs, larutan ion
M ~ ~ + dan penanda DNA lamda yang dipotong enzim HindIII.
Alat yang digunakan adalah PCR Thermolyne-Arnplitron I, alat elektroforesis,
kamera Polaroid 665, scanner, transiluminator T 2201, sentrifbge high sonic
Sorvall RC-55 Du-pont, sentrifbge high sonic MR 18 12, inkubator, neraca analitik
(4 desimal) Sartorius, oven, pengocok thermolyne tipe 16700, microwave
National, penangas air, pipet mikro eppendorf 0,5 p1, 20 p1, 100 p1, 1000 p1, pipet
mohr 1 ml, 5 ml dan 10 ml, pipet tetes, erlenmeyer, gelas piala, spatula, tabung
eppendorf kecil, tips eppendorf, mortar, dan freezer.
Penelitian ini terdiri atas dua percobaan yang berkaitan yaitu :
(1) seleksi primer, (2) analisis RAPD klon kelapa sawit dari tanaman yang
berbunga jantan, berbuah abnormal dan normal.
Isolasi DNA Genom
Metode ekstraksi dilakukan menurut metode Orozco Castillo et al. (1994),
yang telah dimodifikasi Toruan-Mathius & Hutabarat (1996). Untuk mencegah
tidak terjadinya pencokelatan dilakukan penambahan merkaptoetanol 2%
sebanyak 5 pl ditambahkan bufer ekstrak volume 1 ml ke dalam tabung Ependorf
volume 2 ml. Sebanyak 0,3 g daun muda dimasukkan ke dalam mortar porselein
yang diikuti dengan penambahan PVPP 1% sebanyak 0,02 g dan N2 cair ke
dalamnya kemudian digerus. PVPP untuk menghambat aktivitas enzim polifenol
oksidase yang dapat mendegradasi rantai DNA. Setelah itu, proses penggerusan
dilanjutkan hingga daun menjadi bubuk halus, secepatnya dimasukkan ke dalam
menit. Campuran kemudian di inkubasi pada suhu 6 5 ' ~ selama 30 menit di dalam
waterbath (penangas air) dan setiap 10 menit sekali dikocok.
Pemurnian DNA dilakukan dengan mengekstraksi contoh yang sudah halus
menggunakan campuran larutan kloroform : isoamilalkohol (24: lvlv), disentrifbsi
dengan kecepatan 11.000 rpm selama 10 menit. Ekstraksi dilakukan berulang kali
sampai tidak terbentuk endapan diantara kedua fase cair. Ke dalam ekstraktan
yang sudah dipisahkan ditambahkan isopropanol dingin dan dikocok perlahan-
lahan sampai terbentuk benang-benang halus benvarna putih berupa DNA. Pelet
DNA yang diperoleh dari hasil sentrifbsi dikeringkan dengan membalikkan
tabung selama 15 menit pada suhu kamar kemudian menggunakan alat pengering
DNA yaitu DNA Speed Vac. DNA 1 10 savant selama 5 menit. Pelet yang
dihasilkan dicuci dengan 5 ml alkohol 70% dingin, disentrifbsi sebentar dan
peletnya dilarutkan dalam 2 ml Tris EDTA (TE,pH=8). DNA kemudian
diendapkan kembali dengan 1 ml alkohol absolut, disentrifbsi pada 8.000 rpm
selama 5 menit agar DNAnya kuat mengendap. Setelah itu DNAnya dilarutkan
dalam 300 pl TE di dalam Ependorf dan disimpan pada suhu -20'~.
Percobaan 1. Seleksi Primer
Bahan tanaman yang digunakan klon kelapa sawit MK 203. Ekstraksi DNA
dari daun muda yang belum membuka dilakukan secara mini-prep berdasarkan
metode Orozco - Castillo et al. (1994) yang telah dimodifikasi Toruan - Mathius
dan Hutabarat (1 996).
Arnplifikasi DNA dengan PCR berdasarkan metode William et al. (1990)
utama (master mix) (Tabel 1) sebelum melakukan PCR lalu dimasukkan ke dalam
Ependorf 2 ml. Setelah itu disediakan 20 Ependorf 0,5 ml steril dan masukkan
contoh DNA (hasil isolasi) yang berbunga jantan, berbuah abnormal dan normal
sebanyak 2 p1 pada tiap - tiap Ependorf Kemudian setiap 23 pl dari campuran
utama dipipet dan dimasukkan pada tiap-tiap Ependorf 0,5 ml (20). Disentrifusi
sebentar pada 8.000 rpm selama 5 menit. Lalu ditambahkan 25 pl mineral oil pada
tiap-tiap Ependorf untuk mencegah penguapan selama berlangsungnya proses
amplifikasi. Sesudah itu dimasukkan ke dalam alat Thermal Cycler (Thermolyne
Amplitron I).
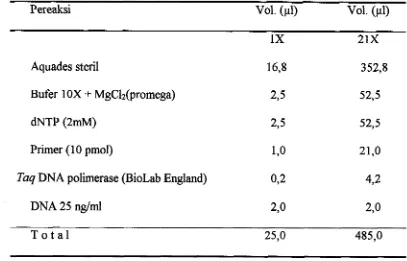
Tabel 1. Komposisi campuran utama untuk reaksi amplifikasi DNA (master mix)
Pereaksi Vol. (pl) Vol. (pl)
1X 21X
Aquades steril 16,8 352,8
Bufer 1 OX
+
MgClz(promega) 2 3 52,5dNTP (2rnM) 2,5 52,5
Primer (10 pmol) 1,o 21,O
Taq DNA polimerase (BioLab England) 0,2 4,2
DNA 25 nglml 2,o 2,o
T o t a l 25,O 485,O
Reaksi amplifikasi dilakukan menggunakan alat Thermal Cycler (Thermolyne,
Amplitron I) dengan siklus termal sebanyak 45 kali dengan tahapan sebagai
[image:118.582.94.501.360.621.2]7 2 ' ~ dan extension time (tahap ramping) 4 menit pada 7 2 ' ~ . Setelah mencapai 45
siklus terdapat tahap ramping selama 4 menit pada suhu tetap 7 2 ' ~ .
Hasil PCR dapat difiaksinasi dengan menggunakan gel agarosa 1,4% (blv)
dalam larutan TAE 1X 30 ml. Cara pembuatan gel ditimbang 0,42 g agarosa
dalam tabung erlenmeyer lalu ditambahkan 30 ml TAE 1X. Kemudian dipanaskan
dalam microvave selama 1 menit 30 detik, lalu diaduk sebentar sampai tercampur.
Dipanaskan kembali 30 detik. Ditambahkan EtBr sebanyak 1,5 yl ke dalam
larutan agarosa, diaduk sampai merata.
Kemudian dituangkan ke dalam cetakan 17 wheel (sumur) selama satu jam.
Setelah tercetak masukkan ke dalam Chamber, dan diisi TAE 1X 500 ml (sampai
gel terendam) ditarnbahkan larutan EtBr sebanyak 2,5 yl untuk pewarnaan DNA.
Setelah itu masing-masing Ependorf 0,5 ml (20) hasil PCR ditambahkan larutan
loading buffer sebanyak 5ml. Sesudah itu, masukkan ke dalam tiap sumur yang
ada. Elektroforesis dijalankan pada 50 volt selama ljam 15 menit. Hasil
elektroforesis divisualisasikan dengan UV transiluminator dan didokumentasikan
dengan menggunakan film Polaroid 665.
Percobaan 2. Analisis RAPD Klon Kelapa Sawit Normal dan Abnormal.
Reaksi PCR (25~1) mengandung 50ng DNA genomik, 1 unit Taq polimerase
dATP, dCTP, dGTP dan dTTP masing-masing dengan konsentrasi 0,l rnM.
Kondisi untuk amplifikasi DNA dengan PCR dilakukan sama seperti pada
percobaan seleksi primer. Dari hasil seleksi ditetapkan 15 primer yaitu : OPA-02,
OPN-18, OPH-18, OPW-19, SC10-19, SC10-20 (Tabel 2). Sehingga ada 240
contoh yang dilakukan.
Analisis Data RAPD
Hasil analisis dengan teknik RAPD diperoleh dalam bentuk pita-pita (hasil
pemotretan). Pembacaan pita dilakukan terhadap pita tegas dan pita tipis secara
konsisten. Pita hasil amplifikasi yang dimiliki secara bersama diberi skor 1 (ada)
atau tidak diberi skor (0) antar individu dari tiap primer yang diuji. Estimasi
kemiripan genetik diperoleh berdasarkan jumlah pita yang dimiliki bersama.
Untuk menentukan tingkat kesamaan pasangan klon yang terdapat pada lajur yang
berbeda ditentukan berdasarkan koefisien Dice atau rumus Nei dan Li, (1979)
yaitu : S = 2 n a b
/
P a + n bKeterangan : S : koefisien kemiripan
a dan b : dua individu yang dibandingkan
nab : jumlah pita DNA yang sama posisinya pada individu
a maupun b
na : jurnlah pita DNA pada individu a
nb : jumlah pita DNA pada individu b
Pengelompokan data matrik dan pembuatan dendogram dilakukan dengan
metode Umveight Pair-Group Methode Arithmetic (UPGMA), hngsi Similarity
Qualitative (SIMQUAL) program NTSY S (Rohlf, 1993). Tingkat kepercayaan
didapat dari dendogram berdasarkan UPGMA yang ditentukan melalui analisis
bootstrap menggunakan program WinBoot dengan pengulangan 2000 kali (Yap &
pita (peubah ke-i) dengan komponen utama ke-j dengan rumus Dillon dan
Goldstein (1984) sebagai berikut :
Keterangan : aij : unsur ke-i dari vektor ciri ke-j
&
: akar ciri ke-js;'
: simpangan baku variabel xiUntuk menggambarkan posisi relatif diantara klon kelapa sawit, data
RAPD dianalisis menggunakan Principal Component analysis (Analisis
Komponen Utama) dengan program NTSYS. Komponen Utama dari peubah data
asal diperoleh dari matriks varian-kovarian peubah asalnya. Skor komponen
utama untuk setiap pengamatan dihitung melalui persamaan :
- -
Y h l = a1 (xh
-
x),...
,
Yhk = ak (xh-
X ) di mana Yhl = adalah skorkomponen ke-1 dari obyek pengamatan ke-h, a1 = vektor pembobot komponen
utama ke-1 dan xh = adalah vektor data pengamatan dari obyek ke-h dan
x
=vektor nilai rata-rata dari variabel asal (Dillon & Goldstein, 1984). Bagan alir
Garnbar 3. Bagan Alir Analisis Data
A B C D E
"
-
~:[i[;iij;~
6Posisi pita DNA pada gel Data biner
0,35 0,48 0,60 0,72 0,84 Analisis
1
pengelompoksn
1
A C*
metode UPGMAE B
D Matriks kemiripan genetik Dendogram
Diagram Pencar Berdasarkan Dua Dan
I
Anailsis komponen utama Tiga Komponen Utama Yll all X +aa +
...
aPl X pj+ Koefieien kemiripan ( Nel & Lie. 1979 )
SM = 2 NAa i (nr + ni)
-
A B C D E
HASIL DAN PEMBAHASAN
1. Seleksi Primer
Elektroforesis DNA genom keenam klon (MK152, MK203, MK209, MK212,
MK104, MK176) kelapa sawit menunjukkan konsentrasi DNA berkisar 150 - 500
pglml. Kemurnian DNA klon kelapa sawit hasil isolasi antara 1,7 - 1,9. Kualitas
DNA cukup baik untuk amplifikasi DNA dengan teknik PCR - RAPD
(Sambrook et al., 1989).
Pada tahap seleksi primer, sebanyak 31 primer (Lamp.6) diperoleh 15 primer,
yaitu OPA-02, OPA-04, OPB-05, OPB-06, OPC-02, OPC-07, OPC-08, OPC-09,
OPE- 14, OPN- 16, OPN- 1 8, OPH- 1 8, OPW- 19, SC 10- 1 9, SC 10-20 yang dapat
mengamplifikasi DNA cetakan. Profil pita DNA hasil amplifikasi difraksinasi
pada gel agarosa 1,4% dan hasilnya, disajikan pada Gambar 4 & Lamp.7. Dasar
pemilihan primer adalah primer yang menghasilkan pita polimorfik dan tegas.
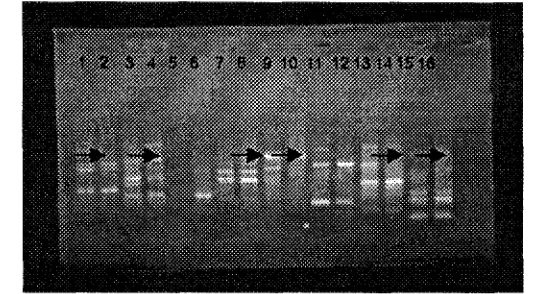
Gambar 4. Seleksi primer menggunakan klon MK203 (berbuah abnormal dan normal) dengan primer OPA-02 (1,2), OPA-04 (3,4), OPA-07 (5,6), OPB-05 (7,8), OPB-06 (9, lo), OPN-10 (1 1,12), OPN-16 (13,14), OPN-18 (15,16).
[image:123.580.174.449.491.638.2]Hasil yang diperoleh menunjukkan bahwa resolusi setiap pita DNA hasil
amplifikasi tidak selalu terlihat jelas (Gbr. 4 & Lamp. 6-7). Jelas tidaknya hasil
resolusi ini ditentukan oleh jumlah fragmen yang teramplifikasi pada genom
tanaman. Makin banyak fragmen DNA yang teramplifikasi, maka resolusi pita
DNA yang dihasilkan akan makin jelas. Menurut Weising et al. (1995), pada
genom tanaman lebih kurang 90% dari DNA genom merupakan urutan yang
berulang. Selain itu adanya kompetisi tempat penempelan primer pada DNA
genom menyebabkan suatu fragmen akan diamplifikasi dalam jumlah yang
banyak dan fragmen lainnya dalam jumlah sedikit. Konsentrasi DNA yang terlalu
kecil juga sering menghasilkan pita yang kabur dan tidak jelas.
Primer-primer yang tidak dapat mengamplifikasi DNA cetakan MK203 adalah
OPA-07, OPN-10, OPC-0 1, OPC-03, OPC-04, OPC-05, OPC-06, OPC- 10, OPW-
15, SC10-48, SC10-56, SC10-57, SC10-71, SC10-76, SC10-83, dan SC10-91.
Tidak terjadinya amplifikasi segmen DNA dengan beberapa primer diatas dapat
disebabkan DNA genom MK203 tidak mempunyai sekuen komplemen dengan
primer-primer tersebut. Menurut Williams et al. (1 990) syarat terjadinya
amplifikasi DNA dengan primer acak tunggal adalah kedua utas DNA mempunyai
sekuen yang komplemen dengan primer yang digunakan.
Jumlah pita DNA klon kelapa sawit yang berhasil diarnplifikasi oleh setiap
primer berkisar 5 (OPN-18) sampai 14 (SC10-19) dengan berat molekul antara
500-2000 pb. Rata-rata per primer terseleksi menghasilkan 8 pita. Jumlah yang
diperoleh ini serupa dengan hasil Chowdhury (1993) berkisar antara 3 sampai 15
Tabel 1. Jenis, susunan oligonukleotida, jumlah pita DNA, dan jumlah pita polimorfik DNA yang terseleksi.
Menurut Grattapaglia et al. (1992) banyaknya pita DNA yang polimorfik
menggambarkan keadaan genom tanaman, sedangkan perbedaan jumlah dan
polimorfisme pita yang dihasilkan setiap primer menggambarkan kompleksnya
genom suatu tanaman. Primer yang paling banyak menghasilkan pita polimorfik
adalah SC10-19. Dari 14 pita yang dihasilkan 13 pita adalah polimorfik (Tabel 2).
Begitu juga dalam masing-masing klon terlihat jumlah pita yang berbeda, klon
MK1 52j, MK1 52,bnY MK152,, jumlah pita 3,3,1 sedangkan jumlah pita polimorfik
2,2,0 (Lamp. 4 & 5). Pola pita yang dihasilkan primer SC10-19 tidak ditemukan
membedakan bunga jantan, buah abnormal dan normal untuk semua klon yang
diuji dan masing-masing klon terdapat pola pita yang berbeda (Gbr. 5).
No 1 2 3 4 5 6 7 8 9 10 1 1 12 13 14 15
Total pita 115 100
Primer OPC-08 OPC-09 OPB-05 OPB-06 OPA-02 OPA-04 OPN-16 OPN-18 SC10-19 SC10-20 OPC-02 OPC-07 OPH-18 OPW-19 OPE-14 Susunan Nukleotida
5'..
...
3'TGGAAC GGTG CTCACCGTCC TGCCTCGCCC TGCTCTGCCC TGC CGAGCTG AAT CGGGCTG AAG CGA CCTG GGT GAG GTCA CGT CCG TCAG ACT CGT AGCC GTG AGG CGTC GTC CCG ACGA GAA TCG GCCA CAAAGC GCTC TGC GGC TGAG
Begitu juga primer OPE-14 (Tabel 2), menghasilkan 10 pita dengan 6 pita
polimorfik, dalam klon terjadi perbedaan jumlah pita dan jumlah pita polimorfik.
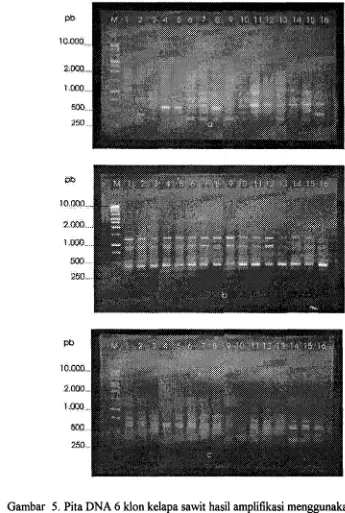
Gambar 5. Pita DNA 6 klon kelapa sawit hasil amplifikasi menggunakan primer (a)SC 10- 19, (b)OPE- 14, (c)OPH- 1 8;
Keterangan : lajur (M) 1 kb DNA Ladder, 1)MKl 52j, 2)MKl 52abn,
[image:126.580.99.444.136.649.2]Seperti pada klon MK104abn, jumlah pitanya 8,4 dan pita polimorfiknya 4,O
(Lamp.4 & 5). Pola pita yang dihasilkan tidak membedakan bunga jantan, buah
abnormal, dan buah normal pada semua klon yang diuji tetapi dalam klon masing-
masing terdapat pola pita yang berbeda (Lamp.8).
Primer OPH-18 (Tabel 2 & Gbr.5) menghasilkan 6 pita dengan 5 pita
polimorfik, terlihat dalam klon TV1X176abn, jumlah pita 5,5 dan pita polimorfiknya
5,4 dalam ha1 ini pita yang dimiliki klon MK176,bn adalah pita polimorfik
(Lamp.4 & 5). Dari pola pita primer OPH-18 tidak ditemukan perbedaan
abnormal dan normal untuk semua klon yang diuji tetapi pada masing-rnasing
klon ada perbedaan pola pita yang abnormal dan normal.
Berdasarkan hasil tersebut, diperoleh 15 primer yang digunakan untuk
melakukan percobaan 2 yaitu analisis RAPD klon-klon yang diuji.
2. Analisis RAPD Klon Kelapa sawit yang Normal dan Abnormal
Amplifikasi DNA pada tiap klon abnormal dan normal ditemukannya satu
primer menghasilkan pola pita DNA yang umum membedakan genotipe abnormal
dan normal dalam semua klon yang diuji.
Hasil yang diperoleh menunjukkan primer OPC-07, OPC-09, SC 10- 19 dan
OPW-19 mampu menunjukkan perbedaan genotipe berbuah normal dan tidak
normal pada masing-masing klon yang diuji yaitu MK152, MK209, MK212,
MK203, MK176, MK104. Sedang OPH- 1 8 hanya mampu membedakan genotipe
berbuah normal dan tidak normal pada klon MK176. Primer lainnya umumnya
juga mampu menunjukkan perbedaan genotipe tanaman normal dan abnormal
DNA klon MK212 dan MK104 pada tanaman berbuah normal dan tidak normal
[image:128.580.77.544.161.477.2]dapat terdeteksi dengan 1 1 primer (Tabel 3).
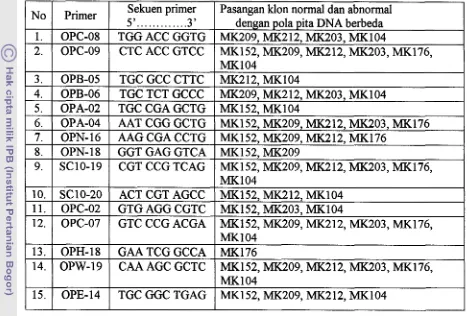
Tabel 3. Primer dalam reaksi PCR, pasangan klon normal dan abnormal.
Dari hasil yang diperoleh, menunjukkan bahwa perbedaari antar genotipe
tanaman yang berbuah normal dan abnormal dalam satu Mon hanya dibedakan
oleh perbedaan pola pita DNA genotipe normal dan tidak normal antar klon yang
diuji. Diduga abnormalitas disebabkan oleh adanya perubahan susunan
oligonukleotida pada untai DNA satu atau beberapa pita DNA saja. Pita DNA
pembeda tersebut tidak sama untuk masing-masing klon. Hal ini menyebabkan
sangat sukar untuk menentukan terjadi secara acak, dan berbeda untuk masing-
masing klon. Darussamin & Nurhaimi (1997) menemukan ha1 yang sama pada
beberapa klon SOC, LMC dan MK (58,60,70 dan 87). No 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 1 1. 12. 13. 14. 15. Primer OPC-08 OPC-09 OPB-05 OPB-06 OPA-02 OPA-04 OPN-16 OPN-18 SC10-19 SC10-20 OPC-02 OPC-07 OPH-18 OPW-19 OPE-14 Sekuen primer 5'
... . . .
. . . ..
. .3' TGG ACC GGTGCTC ACC GTCC
TGC GCC CTTC TGC TCT GCCC TGC CGA GCTG AAT CGG GCTG AAG CGA CCTG GGT GAG GTCA CGT CCG TCAG
ACT CGT AGCC GTG AGG CGTC GTC CCG ACGA
GAA TCG GCCA CAA AGC GCTC
TGC GGC TGAG
Pasangan klon normal dan abnormal dengan pola pita DNA berbeda MK209, MK212, MK203, MK104
MK152, MK209, MK212, MK203, MK176, MK104
MK2 12, MK104
MK209, MK212, MK203, MK104 MK152, MK104
MK152, MK209, MK212, MK203, MK176 MK152, MK209, MK212, MK176
MK152, MK209
MK152, MK209, MK212, MK203, MK176, MK104
MK152, MK212, MK104 MK152, MK203, MK104
MK152, MK209, MK212, MK203, MK176, MK104
MK176
MK152, MK209, MK212, MK203, MK176, MK104
Gambar

Dokumen terkait
Putri.Penelitian ini bertujuan untuk melihat persentase pita polimorfik keragaman genetik pada tanaman kelapa sawit (Elaeis guineensis jacq.) asal klon berdasarkan marka
Putri.Penelitian ini bertujuan untuk melihat persentase pita polimorfik keragaman genetik pada tanaman kelapa sawit (Elaeis guineensis jacq.) asal klon berdasarkan marka
Judul Penelitian : Analisis SSR (Simple Sequence Repeats) Pada Kelapa Sawit (Elaeis guineensis Jacq.) Asal Klon Plasma Nutfah PT.Socfindo.. Nama :
menunjukkan bahwa 30 aksesi klon kelapa sawit asal klon memperoleh gambaran dari kekerabatan diantara individu- individu Setelah diamati profil filogenik dengan
HERMANYANTO LAIA, 2017 : Analisis Keragaman Genetik Klon Kelapa Sawit (Elaeis guinnensis Jacq.) Plasma Nutfah PT.. Socfindo Menggunakan Marka RAPD (Random Amplified
HERMANYANTO LAIA, 2017 : Analisis Keragaman Genetik Klon Kelapa Sawit (Elaeis guinnensis Jacq.) Plasma Nutfah PT.. Socfindo Menggunakan Marka RAPD (Random Amplified
Jumlah fragmen DNA hasil amplifikasi antara 4-12 pita tergantung pada primer dan individu yang dianalisis, dengan rata-rata pita tiap primer 7 pita, dari 52 total fragmen yang
Analisis kemiripan genetik menggunakan program PAUP versi 4b.10, menunjukkan bahwa tanaman klon kelapa sawit Tenera (DxP) dari sumber eksplan ortet 90 memiliki