LAMPIRAN
Lampiran 1. Deskripsi Pembuatan Larutan Stok dan Buffer 1. Pembuatan Larutan Stok
a. CTAB 5 %
Larutan dibuat dengan melarutkan :
- NaCl : 2.0 gr
- CTAB : 5.0 gr
- Aquades : 100 ml
b. Tris HCl 1M pH 8.0 (100 ml)
Bahan yang digunakan adalah :
- Tris : 12.114 gr
- HCl p.a : 4.2 ml
- Aquades : 80 ml
- Larytan dibuat dengan mencampurkan bahan kimia di dalam gelas beker yang diaduk dengan menggunakan batang pengaduk magnetik diatas hotplate
- Volume ditempatkan dengan aquades hingga 100 ml - Larutan disterilisasikan dengan autoclave
c. Tris HCl 1M pH 7.4 (50 ml)
Bahan yang digunakan adalah :
- Tris : 6.057 gr
- Aquades ditambahkan hingga volume larutan mendekati 50 ml
- Pengaturan pH dilakukan dengan menambahkan NaOH 2.5 M hingaa pH 7.4
- Volume ditepatkan hingga 50 ml - Larutan disterilisasi dengan autoclave
d. EDTA 0.5 MpH 8.0 (100ml)
- NaEDTA : 18.612 gr
- NaOH : 2.0 gr
- Aquades : 80 ml
- Larutan dibuat dengan mencampurkan bahan kimia dengan gelas beker dan diaduk dengan batang pengaduk magnetik
- Pengaturan pH dilakukan dengan menambahkan HCl hingga pH 8.0 - Volume ditepatkan dengan aquades hingga 100 ml
- Larutan disterilkan dengan autoclave
e. NaCl 5 M pH (100 ml)
- NaCL : 29.22 gr
- Aquades ditambahkan hingga larutan mencapai 100 ml dan diaduk dengan menggunakan batang pengaduk magnetik hingga larut
- Volume ditepatkan dengan aquades hingga 100 ml - Larutan disterilisasi dengan autoclave
2. Pembuatan Larutan Buffer a. Buffer eKstraksi / CTAB (100ml)
Bahan yang digunakan adalah :
- CTAB 5 % : 40 ml
Bahan yang digunakan adalah :
- Tris : 10 ml
- Asam Asetat Glasial : 5.7 ml - EDTA 0.5 M pH 8.0 : 10 ml
- Aquades ditambahakan hingga volume larutan 100 ml
c. Buffer TAE 1X (500 ml)
Bahan yang digunakan adalah : - Buffer TAE 50 X : 10 ml
- Aquades : 490 ml
d. Buffer TE (50 ml)
Bahan yang digunakan adalah : - Tris HCl 1 M pH 8.0 : 0.5 ml - EDTA 0.5 M pH 8.0 : 0.1 ml
- Aquades : 49.4 ml
- Dimasukkan kedalam gelas beaker dan diaduk hingga merata
e. Klorofom Isoamilalkohol 24 : 1 (50 ml)
Bahan yang digunakan adalah :
- Klorofom : 48 ml
- Isoamilalkohol : 2 ml - Semua bahan dicampur merata
f. Etanol 70% (100 ml)
- Etanol : 70 ml
Lampiran 2. Alur Penelitian
Sampel DNA Kelapa Sawit
Isolasi DNA
Uji Kualitas
Uji Kuantitas
Proses PCR-RAPD
Elektroforesis
Analisis Hasil Amplifikasi PCR
Lampiran 3. Proses Isolasi DNA
Sampel daun Kelapa Sawit ditimbang 0.2 gram dan digerus sambil ditambahkan nitrogen cair dan PVPP
Sampel dimasukkan ke dalam tabung yang berisi 1 ml buffer ekstraksi dan 10 µl β -mercaptoetanol
Tabung di vortex dan diinkubasi dalam waterbath selama 30 menit pada suhu 650C
Supernatan ditambahkan 1 ml KIAA (24:1) dan disentrifuse dengan kecepatan 13.000 rpm selama 10 menit
Supernatan ditambahkan 1 ml KIAA (24:1) dan disentrifus dengan kecepatan 13.000 rpm selama 10 menit
Supernatan ditambahkan 1 ml isopropanol dan diinkubasi pada suhu 40C selama satu malam
Tabung disentrifus pada pada kecepatan 13.000 rpm selama 10 menit dan dikeringkan
Pelet dilarutkan dengan buffer TE 100µl
Campuran ditambahkan dengan etanol absolute dingin dan diinkubasi dalam freezer (-200C) selama 30 menit
Campuran disentrifus dengan kecepatan 13.000 rpm selama 10 menit
Pelet dicuci dengan etanol 70% dan dikeringkan
Pelet dilarutkan dengan 100 µl buffer TE
Lampiran 4. Amplifikasi dan genotyping
Komposisi Master Mix volume 25 µl : Go Taq PCR 12.5 µl
Nuclease free water 9.5 µl Primer 1 µl DNA sampel 2 µl
Running PCR sebanyak 45 siklus : Denaturasi awal 940C 2 menit
Denaturai 940C 1 menit Annealing 360C 1 menit Extension 720C 2 menit Post extension 720C 10 menit Kondisi akhir PCR 40C tak terbatas
Lampiran 5. Proses Elektroforesis hasil PCR- RAPD
Agar rose 2.6 gram ditambahkan dengan 130 ml buffer TAE 1 x
Campuran dipanaskan dengan hot plate
Campuran ditambahkan 1.5 µl EtBr
Larutan gel dituang kedalam cetakan yang telah dipasang sisir
Gel yang telah mengeras dipindahkan ke dalam chamber berisi buffer TAE 1 x
Sampel hasil PCR, marker dan loading dye dimasukkan ke dalam sumur gel dengan perbandingan (8:5:2)
Alat elektroforesis dihubungkan dengan power supply 80 volt
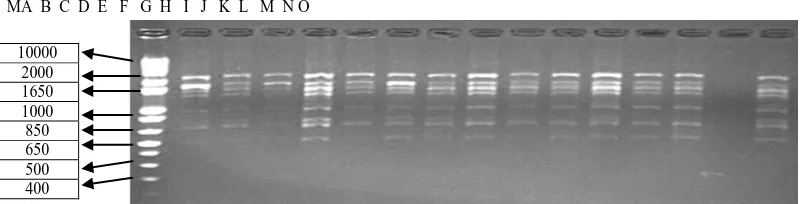
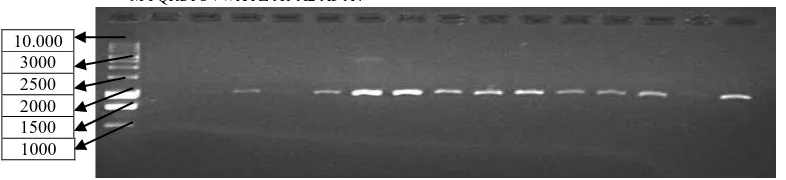
Profil Elektroforesis OPD- 20 MA B C D E F G H I J K L M N O
Gambar 1. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-20, Ket ; M= marker ladder 1kb,kode sampel (A –O).
M PQRSTUVWXYZ A1 A2 A3 A4
Gambar 2. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-20, Ket ; M= marker ladder 1kb,kode sampel (P–A4).
Profil Elektroforesis OPN-03 M A B C D E F G H I J K L M N O
Gambar 5. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPN 03, Ket ; M= markerladder 1kb , kode sampel A –O.
M P Q R S T U V W X Y Z A1 A2 A3 A4
Gambar 6. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPN 03, Ket ; M= markerladder 1kb , kode sampelP-A4.
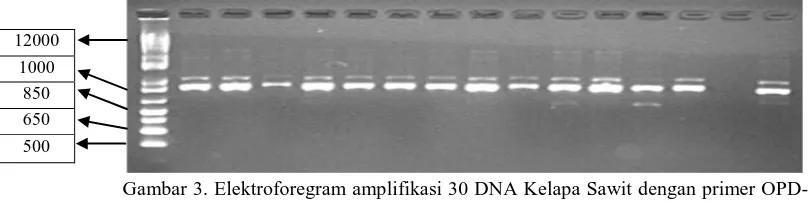
Profil Elektroforesis OPD-13 M A B C D E F G H I J K L M N O
Gambar 3. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-13, Ket ; M=marker ladder 1kb, Kode sampel A –O.
M PQRSTUVWXYZA1A2A3A4
Gambar 4. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-13, Ket ; M=marker ladder 1kb, Kode sampel P–A4
Profil Elektroforesis OPH-13 MA B C D E F G H I J K L M N O
Gambar 7. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPH 13, Ket: M=
marker ladder 1kb + invitro, kode sampel A –O.
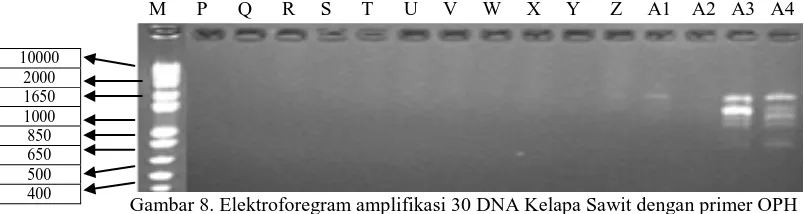
M P Q R S T U V W X Y Z A1 A2 A3 A4
Gambar 8. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPH
Lampiran 7. Hasil Uji Kuantitas dengan UV-Spektrofotometer
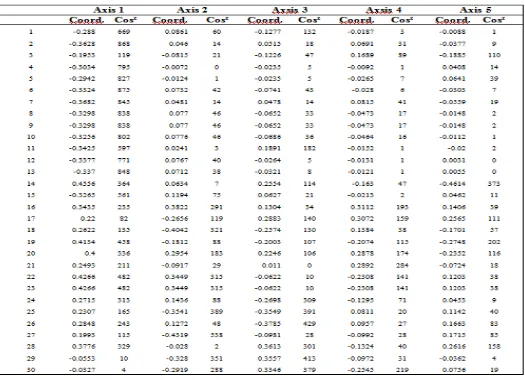
Lampiran 10. Faktorial Koordinat
Tabel 5. Faktorial Analisis (PCoA)
Tabel 6. Nilai Factorial coordinates
ue Inertia%
0.10156 33.53
0.04535 14.97
0.03828 12.64
0.02455 8.11
Y 1 1 0 0 0 0 0 1 0 0 0 1 1 0 0 0 0 0 0 0 0
Z 0 1 0 0 0 0 0 1 0 1 0 0 1 0 0 0 0 0 0 0 0
A1 1 0 0 0 0 0 0 1 0 0 0 1 1 1 0 0 0 1 0 0 0
A2 0 0 1 0 0 0 0 0 1 1 0 1 0 1 0 0 0 0 0 0 0
A3 1 0 1 0 0 0 1 0 0 0 0 1 0 1 0 0 0 1 1 1 1
DAFTAR PUSTAKA
Andras G. 1996. Effect of temperature on separation efficiency in capillary gel electrophoresis. Trends in Analytical Chemistry. Vol 15 no 5
Azizah, A. 2009. Perbandingan Pola Pita Amplifikasi Dna Daun, Bunga Kelapa Sawit Normal dan Abnormal. Institut Pertanian Bogor . Bogor.
Bairu MW, Aremu AO, Staden JV. 2011. Somaclonal variation in plants: causes and detection methods. Plant Growth Regul63:147-173
Bardakci, F. 2001. Peran Markah Molekuler Dalam Pemuliaan Tanaman. Badan Litbang Pertanian. Edisi 16-22 Maret 2011 N0. 3397. Hal. 36.
Corley RHV, Tinker PB. 2003. The Oil Palm. 4th ed. United Kingdom (GB): Blackwell Scientific. 562 p.
Fatchiyah, 2011. Pelatihan analisis fingerprinting DNA tanaman dengan metode RAPD. [Modul]. Laboratorium sentral ilmu hayati Universitas Brawijaya, Malang.
Fauzi, Y, Yustina E.W. Iman S. dan Rudi H. 2008. Budidaya, Pemanfaatan Hasil
dan Limbah,Analisis usaha dan Pemasaran Kelapa Sawit.
PenebarSwadaya. Jakarta.
Ferreira, M.E dan D. Grattapaglia . 1998. Introducao ao uso de marcadores moleculares em analise genetica. Embrapa-Cenargen. Brasilia.
Hutami, S., I. Mariska, dan Y. Supriati. 2005. Peningkatan Keragaman Genetik Tanaman melalui Keragaman Somaklonal. J. Agro. Biogen.2(2):81-88.
Jones,C.J.,KJ. Edwards ,S.Castagiole , M.O. Winfield ,f.Sala,c. Van del Wiel, G. Bredemeijer ,b. Vosman,M. Mattch,A. Dally, R. Brettsshneider , P.Bettini, M, Buiatti, E. Maestri, A. Malcevschi, N. Narmirolli , R.Aert, G. Volkaert , J. Linacero, A. Vasques and A. Karp. 1997. A Reproducibility testing of RAPD, AFLP, SSR markers in plants by a network of Europan laboratories. Molecular Breeding 3(5):385-390
Kiswanto, Jamhari H.P ,Bambang W. 2008. Teknologi Budidaya Kelapa Sawit. Badan Penelitian dan Pengembangan Pertanian. Bogor.
Larkin, P.J. & W.R. Scowcroft (1981). Somaclonal variation- a novel source of variability from cell cultures for plant improvement. Theor. Appl. Genet.,
60, 197-214.
Livy, W. & Gunawan. 1988. Teknik Kultur Jaringan Tanaman. Laboratorium Kultur Jaringan Tanaman, Pusat Antar Universitas. Bogor: Institut Pertanian Bogor.
Lubis, A.U. 1992. Kelapa Sawit (Elaeis guineensis Jacq.) di Indonesia. PusatPenelitian Perkebunan Marihat – Bandar Kuala. Pematang Siantar.
Mangoendidjojo, W. 2003. Polymerase Chain Reaction. Laboratorium Virologi. Fakultas Kedokteran Hewan. Universitas Udayana. Denpasar.
Mangoensoekarjo, S. dan H. Semangun. 2005. Manajemen Agribisnis Kelapa Sawit. Gadjah Mada University Press. Yogyakarta.
Muhardika,I.G.N.K.2003. Polymerase Chain Reaction. Laboratorium Virologi. Fakultas Kedokteran Hewan. Universitas Udayana. Denpasar.
Mulyadiana, A.,2010. Keragaman genetik. Shorea leavis Ridl. Di Kalimantan Berdasarkan penanda mikrosatelit. Skripsi. Institut Pertanian Bogor.
Murray, RK, Graner DK, Mayes PA Rodwell VW . 2000. Biokimia Harper. Andry H, Penerjemah; Anna PB, Tiara MN, editor. Jakarta: Penerbit Buku Kedokteran EGC. Terjemahan dari: Harper’s Biochemistry.
Nehzad, M.N., Solouki M. & Siasar B. 2010. The Comparation of Long and Short Primers Used for RAPD Technique in Grape. Iran: Trakia Journal of Sciences Vol. 8 (1): 38-41.
Orozco-Castillo.,k.j. Chalmers., R. Waugh dan W. Powell. 1994. Detection of genetic diversity and selective gene introgression in coffe using RAPD markers. Theor. Appl. Genet 87: 934-940.
Ogden, R. C., and Adams, D. A. 1987. Electrophoresis in agarose and acrylamide gels. Methods Enzymo. 152. 61-87
Pandi, D.S. 2010. Penanda DNA untuk Pemuliaan Kelapa (Cocos nucifera L.) Perspectife 9 (1):21-35.
Paranjothy, K., R.Othman, C.C.Tan, G.Wang & A.C.Soh (1993). Incidence of abnormalities in relation to in vitro protocols. In Proc. of the 1993 ISOPBInt. Symp. Recent Development in OilPalm Tissue Culture andBiotechnology. Kuala Lumpur, 14-15 September, 1993, p.77-85.
Prana, T.K dan S.N Hartati. 2003. Identifikasi Sidik Jari DNA Talas (Colacasia esculenta L. Schoot) Indonesia dengan Teknik RAPD. Jurnal Natur Indonesia 5(2):107-112.
Poerba, Y.S. dan Yuzammi. 2008. Pendugaan keragaman genetik Amorphophallus titanum Becc. berdasarkan marka Random Amplified DNA. Biodiversitas 9 (2): 103-107.
Putri, L.A.P., Sudarsono, Aswidinnoor, H., dan Asmono, D. 2009. Keragaan Genetik dan Pendugaan Heritabilitas pada Komponen Hasil dan Kandungan
β-Karoten Progeni Kelapa Sawit.Fakultas Pertanian, Institut Pertanian Bogor. J. Agron. Indonesia 37 (2) : 145 – 151
Rao, V. & C.R. Danaough (1990). Preliminary evidence of a genetic cause for the floral abnormalities in some oil palm ramets. Elaeis, 2(2), 199-207.
Risza S. 2009. Kelapa Sawit Upaya Peningkatan Produktivitas. Yogyakarta (ID): Kanisius. 189 hlm.
Rohlf, F.J. 2000. NTSYS-pc. Numerical Taxonomy and Multivariate Analysis System Version 2.1. User Guide . Departement of Ecology and Evolution State University of New York.
Sastrosayono.S. 2003.Budidaya Kelapa Sawit. Agromedia. Jakarta
Setyo, I.E. 2001.Pemetaan dan Keragaman Genetik RAPD Pada Kelapa Sawit sungai pancur (RISPA). Tesis. Program Pascasarjana IPB. Bogor.
Sulandri S & MSA Zein. 2003.Panduan Praktis Laboratorium DNA.Bidang Zoologi LIPI. Bogor
Suryanto, D. 2003. Melihat Keanekaragaman Organisme melalui beberapa teknik genetika molekuler. USU Digital Library [terhubung berkala].
Susantidiana. 2009. Identifikasi beberapa aksesi jarak pagar ( Jatropha curcas L.) melalui analisis RAPD dan morfologi. J. Agron. Indonesia, 37 (2): 167- 173.
Tingey, S.V., J.A. Rafalski, and M.K. Hanafey. 1994. Genetic analysis with RAPD markers. In: Coruzzi, C. and P. Puidormenech (eds.). Plant Molecular Biology. Belin: Springer-Verlag.
Wicaksono BD, Yohana AH, Enos T, Irawan W, Dina Y, Aldrin N,Ferry S. 2009. Antiproliferative effect of the methanol extract of Piper crocatum ruiz &pav leaves on human breast (T47D)cells In-vitro. Trop J Pharm Res 8:345-352.
Yuniastuti. E, R. Setiamihardja, M.H. Karmana, N. Toruan-Mathius. 2005.Analisis AFLP pada Abnormalitas Klon-klon Kelapa Sawit (Elaeis Guineensis Jacq.) Hasil Kultur Jaringan yang Berbuah Normal dan Abnormal.Agrosains 7 (1): 7-12.
Yuwono, T. 2006. Teori Aplikasi Polimerase Chain Reaction. Penerbit Andi. Yogyakarta.
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Fakultas
Pertanian Universitas Sumatera danPusat Seleksi Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok Masihul, Kabupaten Serdang
Bedagai. Penelitian ini dilaksanakan pada bulan Maret 2016 sampai bulan Agustus 2016.
BahandanAlat
Bahantanaman yang digunakan dalam penelitian ini terdiridari klon kelapa sawitsebanyak30sampel dari klon BTC 64, yang dikeluarkan oleh Pusat Seleksi Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok Masihul,
Kabupaten Serdang Bedagai, Sumatera Utara. Bahan kimia yang digunakan
adalahPolyvinylpolypyrolidone (PVPP), nitrogen cair, buffer ekstraksi cetyl trimethylammonium bromide (CTAB), buffer ekstraksi CTAB (2 gr Nacl, 5 gr
CTAB, 100 ml aquades), Buffer TAE, buffer TE, KIAA (24ml klorofom : 1ml
isoamil-alkohol) Hcl p.a, NaOH, Na-EDTA, isopropanol dingin, ethylenediamine tetraacetic (EDTA), β-mercaptoethanol 2%, etanol 70%, etanol absolute, DNA
marker 100bp Ladder, Go taq Green Master Mix, loading dye, aquades, aquabidest, agarose dan primerOPD-20, OPD-13, OPH-13, OPN- 03 kertas tissue, sarung tangan karet, alumunium foil.
Alat yang digunakan dalam penelitan ini adalah mortar, alu, mikropipet ukuran 1-10 µl, 20-100µl, 100-1000µl, tip pipet (warna kristal, kuning dan biru)
1,5ml,chambell well(bak elekroforesis), power supplay, PCR (Therma Cycler)UV Transilluminator, Gel-Doc (UV Cambridge) , pH meter, alat-alat gelas (beaker
gelas, erlenmeyer, dll) power supply, alat tulis, pengaduk , kamera, oven, gunting,
pinset, spatula, timbangan digital.
Pelaksanaan Penelitian Pengambilan Sampel Daun
Semua alat dan bahan disiapkan seperti pisau dan amplop sampel, setelah itu diambil sampel daun muda di lapangan dari masing-masing individu. Daun
dibersihkan dengan air bersih kemudian dibuang tulang daunnya dan daun dipotong. Dimasukkan potongan daun ke alumunium foil lalu simpan ke dalam
refrigerator.
Isolasi dan Pemurnian DNA
DNA disolasi dari bagian daun yang masih muda (bagian pucuk) menurut
metode Orozco-Castilloet al. (1994).Daun kelapa sawit muda yang telah dibuang tulang daunnya dan sudah dicuci bersih, dikeringkan denga tisu dan di timbang
masing-masing 0,1-0,3 g, dipotong halus dengan gunting kecil- kecil , dan digerus menggunakan mortar dan alu. Kemudian ditambahkan nitrogen cair dan ± 0,1 gr Polyvinyl-Polypyrolidone(PVPP), gerus hingga halus. Serbuk halus yang
dihasilkan kemudian dimasukkan ke dalam tube 2 ml yang berisi 1 ml buffer vortexlalu tabungditambahkan1 ml klorofom isoamialkohol (24:1) ,kemudian
tabung diinkubasi pada suhu ruang selama 4-5 menit.
Sampel yang sudah ditambahkan KIAA kemudian di vortex selama 3-5 menit dengan tujuan supaya KIAA tercampur homogen dengan sample yang telah
10 menit. Bila ekstraksi berhasil maka Supernatan akan terpisah berdasarkan berat jenisnya. kemudian dipisahkandari pelet dengan jalan memipetnya ke dalam tabung yang baru, kemudian ditambahkan klorofom:isoamialkohol sebanyak 1
ml. kemudian tabungdi vortexperlahan hingga homogen kemudian disentrifuge selama 15 menit dengan kecepatan 13.000 rpm. Supernatan yang diperoleh
dipindahkan, lalu ditambahkan 1 ml isopropanol dingin kedalam tabung. Supernatan dihomogenkan dengan membolak balik tabung,dikocok perlahan sampai timbul benang-benang putih yang merupakan DNA. Selanjutnya DNA
diendapkan dengan cara diinkubasi selama satu malam dalam lemari es (4ºC). Kemudian tabung di sentrifuse kembali dengan kecepatan 13.000 rpm
pada suhu 4ºC selama 10 menit. Cairan dan pellet DNA dibuang dan dikeringkan dengan cara membalikkan tabung. Kemudian ethanol absolute dingin ditambahkan lalu dibolak-balik hingga homogen. Pellet DNA dilarutkan buffer
TE 100 µl , kemudian tabung dispin manual hingga homogen.
Larutan tersebut disimpan dalam freezeer(-20ºC) selama 2 jam. Kemudian
larutan tersebut disentrifuge selama 10 menit dengan kecepatan 13.000 rpm pada suhu 4ºC, Cairan tersebut kemudian dibuang dan pellet DNA diambil kemudian dicuci dengan ethanol 70% lalu dikeringkan. Pellet DNA yang sudah kering
dilarutkan dalam 100 μl buffer TE, dan disimpan dalam freezer (-20ºC) (Orozco-castillo et al., 1994).
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis metode standar dengan cara memasukkan 5µ DNA stok dan 2µ loading bufferke dalam tabung mikro 2
Agarose ditimbang 1,6 g kemudian dilarutkan ke dalam 80 ml buffer TAE 1x. Larutan tersebut dimasukkan ke dalam erlenmeyer dan diberi tanda, kemudian dipanaskan dan diaduk dengan pengaduk magnetik hingga larutan menjadi bening
dan dibiarkan mendidih selama 30 menit dan di tambahkan etidium bromide 0,5 %. Kemudiandipanaskan kembali.
Setelah larutan agak dingin (± 60ºC) larutan dimasukkan dalam chambel yang telah diberi sepasang well,tuang hingga memenuhi batas dan tunggu hingga cetakan mengeras atau memadat selama ±40 menit. Gel yang telah memadat
diberi larutan TAE 1x ± 670 ML ( hingga terendam ) kemudian tarik sepasang well yang berada pada cetakan. Stok DNA diberi loading buffer (pewarnaan)
sebanyak 2µ dan stok DNA sebanyak 5µ kemudian dicampur menggunakan mikropipet dan setelah rata masing-masing dimasukkan ke dalam sumur gel. Setelah semua lubang sumue gel berisi selanjutnya dielektroforesis. Running
elektroforesis dilakukan pada kondisi 75 volt selama 45 menit. Visualisasi DNA yang telah dielektroforesis dilakukan dengan UV transluminator dan
didokumentsikan.
Kualitas DNA dinyatakan baik apabila hasil elektroforesis menunjukkan pola pita yang terang dan fokus. Artinya DNA yang dihasilkan cukup solid, utuh
dan mempunyai konsentrasi yang tinggi.
Uji Kuantitas DNA
Sebanyak 2 μl stok DNA diukur menggunakan Spektofotometer sinar UV.
Absorbansi (A) diukur pada panjang gelombang 260 nm dan 280 nm. Kemurnian DNA ditentukan dari nilai perbandingan A260/A280.
Tingkat kemurnian DNA ditentukan dengan nilai Perbandingan A260/A280. Menurut Wilson dan Walker (2010), sampel DNA murni akan menghasilkan rasio A260/A280 berkisar 1.8-2.0. nilai kemurnian yang lebih dari
2.0 menunjukkan bahwa sample mengandung kontaminan RNA, sedangkan nilai kemurnian yang kurang dari1.8 menunjukkan bahwa sample mengandung
kontaminan protein (Yuwono, 2006).
Amplifikasi dan Genotyping
Amplifikasi mengikuti prosedur baku analisis RAPD, sesuai prosedur
William et al., (1990). Amplifikasi dilakukan dengan menggunakan 4 primer polimefrik, yaitu OPD- 13, OPH-13, OPD-20, OPN-03.
Sebelum running PCR dilakukan pengenceran DNA dengan mengambil 5 µl stok DNA dan ditambah 5 µl ddH20 sehingga diperoleh 10 µl aliquot DNA. Kemudian dilakukan pengenceran primer yaitu tube primer disentrifius selama 5
menit setelah itu ditambahkan ddH20 sesuai ukuran molar. Dibuat aliquot primer yaitu dengan mengambil 10 – 15 µl stok primer.
Persiapan awal PCR adalah mencairkan komponen untuk running PCR yaitu paket PCR produksi Promega dalam kotak berisi pecahan es. Untuk mempermudah pembuatan larutan master dimisalkan 5 sampel yang akan
digunakan maka larutan master terdiri atas: ddH20 9,5 µl x 5 = 47,5 µl, Go Tag 12,5 µl x 5 = 6,25 µl, aliquot primer 1 µl x 5 = 5 µl. Dari tube diambil 23 µl ke
tube yang lain sehingga diperoleh 20 tube untuk PCR dan ditambahkan masing-masing DNA sebanyak 2 µl. Kemudian tabung dispin manual. Tabung berisi stok DNA dan campuran masker dimasukkan dalam blok sampel di mesin PCR dengan
waktu, suhu dan jumlah siklus termal 45 kali (3 jam 51 menit) yang telah digunakan pada tanaman kelapa sawit, berdasarkan yang digunakan peneliti setiyo (2001). Proses amlifikasi PCR dapat dilihat pada tabel 1.
Tabel1. Siklus,proses, suhu dan waktu dalam amplifikasi DNA daun kelapa sawit
Jumlah
No. Tahapan Suhu Waktu Siklus
1 Denaturasi awal 94o C 4 menit 1
2 Denaturasi 94o C 1 menit 45
3 Annealing 36o C 1 menit 45
4 Ekstention 72o C 1 menit 45
5 Ekstention akhir 72o C 10 menit 1
Setelah reaksi PCR selesai maka DNA hasil amplifikasi disimpan dalam suhu - 20ºC bila sedang tidak digunakan.
Elektroforesis
Gel agarose disiapkan dengan konsentrasi 2% (b/v), kemudian ditimbang
agarose 1,6 g kemudian dilarutkan dengan menambahkan 80 ml buffer TAE 1x . larutan tersebut dimasukkan kedalam erlenmeyer , kemudian di panaskan dan diaduk dengan pengaduk magnetik hingga larutan menjadi bening. Setelah larutan
dipanaskan kemudian didinginkan ditambah larutan etidium bromide 1 µl kemudian dipanaskan kembali lalu didinginkan dengan cara yang sama. Setelah
larutan agak dingin ( suhu ± 60º C) kemudian larutan dicetak kedalam cetakan yang telah dipasang sisir pembuat lubang (well-forming combs ) dan dibiarkan memadat selama ± 45 menit atau sampai gel mengeras. well-formingcombsdilepas
Untuk elektroforesis tray yang berisi gel agarose diletakkan dalam tank elekroforesis dalam larutan buffer TAE 1x dituang ke dalam tank tersebut ± 500 ml (hingga terendam) hingga 1mm diatas permukaan gel atau sampai batas yang
telah ditemukan. Contoh DNA yang telah disiapkan dimasukkan ke dalam sumur pada gel.
Setelah semua sample dimasukkan ke dalam sumur (well), tank elekroforesis ditutup dan dihubungkan dengan arus listrik. Kemudian proses elektroforesis siap dijalankan. Running elekroforesis dilakukan pada kondisi 80
volt selama 65 menit. Setelah running elektroforesis selesai, arus listrik dimatikan dan tray diambil dengan menggunakan sarung tangan. Visualisasi DNA yang
telah dielekroforesis dilakukan dengan UV transluminator dan jika pita/band molekul DNA kelihatan terang maka dilakukan dokumentasi.
Prinsip kerja elekroforesis gel dimulai saat makromolekul yang bermuatan
listrik ditempatkan pada medium yang berisi tenaga listrik. Molekul-molekul tersebut akan bermigrasi menuju kutub positif atau kutub negatif berdasarkan
muatan yang terkandung didalamnya (Magdeldin, 2012). Molekul-molekul yang bermuatan negatif (anion) akan bergerak menuju kutub positif (kation) akan bergerak menuju kutub negatif ( katoda) (Klug and Cummings, 1994).
Analisis Data
Penentuan Skoring Marka RAPD
Pola pita yang muncul pada gel diterjemahkan ke dalam data biner dengan scoring manual. Setiap pita mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya pita. Angka satu “1” untuk pita yang terbentuk dan angka nol “0”
Untuk melihat persentase pita polimorfik menggunakan rumus berikut ini:
% Pita Polimorfik =∑lokus yang polimorfik
∑ ������������� x 100
Setiap pita dalam gel yang merepresentasikanfragmen DNA dari setiap genotipe tanaman diberi nilai satuketika pita muncul dan diberi nilai nol ketika pita tidakmuncul.
Untuk menetukan keragaman genetik, produk PCR – RAPD diskoring berdasarkan muncul tidaknya pita DNA. Pita yang muncul pada gel diasumsikan
sebagai alel RAPD. Keragaman alel RAPD ditentukan dari perbedaan migrasi alel pada gel masing-masing individu sample. Berdasarkan ada atau tidaknya pita, profil pita diterjemahkan kedalam data biner. Pita yang muncul diberi kode 1
(ada) dan 0 (tidak ada) (Ferreira dan Grattapaglia, 1994).
Penetuan Ukuran Pasangan Basa
Ukuran fragmen basa (pasangan basa= bp) produk PCR ditentukan dengan menggunakan software UVITEC Cambrige Fire Reader. Fragmen DNA yang digunakan yaitu 100 bp DNA leader. Dengan menggunakan software UVITEC
Cambrige Fire Reader maka ukuran pita DNA (base pairs) ini akan berpacuan dari leader yang kita gunakan. Program ini akan mengukur pita yang muncul berdasarkan ukuran ladder yang digunakan. Pengukuran pola pita yang terbentuk
ini dengan pendar cahaya DNA yang terbentuk saat proses elektoforesis dengan sinar UV.
Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi pasangan individu dapat dilakukan dengan dua tipe analisis deskriptif dari keragaman : (1) Principal Coordinate Analysis (PCoA), Suatu jenis analisis
Neigbour-Joning Tree (Njtree) berdasarkan Saitou dan Nei (1978) untuk memperoleh gambaran dari kekerabatan diantara individu-individu. Perhitungan
dan analisis deskriptif ini menggunakan software Darwin 5.05
HASIL DAN PEMBAHASAN Isolasi DNA
DNA yang digunakan dalam penelitian ini adalah hasil isolasi DNA dari
klon BTC 64 Tanaman kelapa sawit sebanyak 30 sampel, yang dikeluarkan oleh
Pusat Seleksi Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok
Masihul, Kabupaten Serdang Bedagai, Sumatera Utara.
Dari hasil uji kualitas DNA dapat diketahui bahwa hasil dari isolasi DNA
kelapa sawit dengan metode Orozco-Castillo et al. (1994) yang dimodifikasi dengan penambahan polyvinilpolypirolidone (PVPP) dan β-mercaptoethanol yang dapat digunakan untuk proses PCR.
Uji Kuantitas DNA
Uji kuantitas DNA dilakukan menggunakan spektofotometer dengan
panjang gelombang 260 nm dan 280 nm, sehingga diperoleh nilai kemurnian dan konsentrasi DNA hasil isolasi. Panjang gelombang 260 nm merupakan serapan maksimum untuk asam nukleat, sedangkan pada panjang gelombang 280 nm
merupakan serapan maksimum untuk protein. Hasil pengukuran dapat dilihat pada Lampiran 7.
Prinsip dasar pada spektofotometer adalah sampel yang dihasilkan harus jernih dan larut secara sempurna. Tidak ada partikel koloid dan suspensi. DNA yang mengandung basa-basa purin dan pirimidin dapat menyerap cahaya UV. Pita
ganda DNA dapat menyerap cahaya UV pada 260 nm, sedangkan kontaminan protein atau phenol dapat menyerap cahaya pada 280 nm. Dengan adanya
dengan menghitung nilai absorbansi 260 nm dibagi dengan nilai absorbansi 280 (A260/A280) (Fatchiyah, 2011).
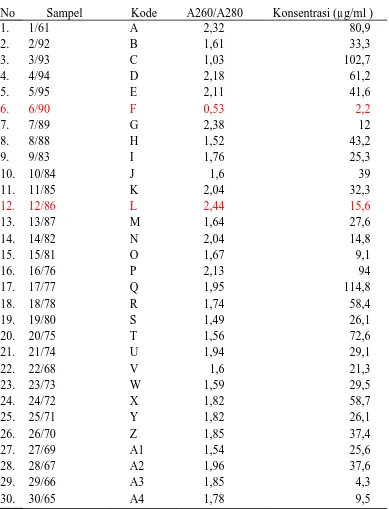
Tabel 2. Hasil uji Kuantitas 30 sampel DNA Kelapa sawit asal klon BTC 64
No Sampel Kode A260/A280 Konsentrasi (µ g/ml )
Kemurnian DNA yang diperoleh pada penelitian ini berkisar 0,53 – 2,44.
berkisar 1,8 – 2,00, yaitu sampel nomor 11, 14, 17, 21, 24, 25, 26, 28, 29, 30. Hal ini menunjukkan bahwa sampel DNA telah murni.
Sampel dengan nilai kemurnian kurang dari 1,8 sebanyak 14 sampel,
yaitu sampel nomor 2,3,6,8,9,10,13,15,18,19,20,22,23,27. Hal ini menunjukkan bahwa stok DNA masih banyak mengandung polysakarida. Sampel dengan
kemurnian lebih dari 2,0 sebanyak 6 sampel, yaitu sampel nomor 1,4,5,7,12,16. Sampel ini masih belum murni dan banyak mengandung protein.
Sulandri dan Zein (2003) menyatakan bahwa kemurnian DNA ditentukan
oleh tingkat kontaminasi protein dalam larutan. Molekul DNA dikatakan murni jika rasio A260 dengan A280 berkisar 1.8 – 2.0. Jika nilai rasio lebih kecil dari
1.8 maka masih ada kontaminasi protein atau fenol di dalam larutan.
Konsentrasi DNA yang diperoleh dari hasil penelitian ini adalah berkisar 2.2 ng/µl – 114.8 ng/µl. Konsentrasi paling rendah terdapat pada sampel nomor
6/90, sedangkan konsentrasi paling tinggi terdapat pada sampel nomor 17/77. Konsentrasi yang digunakan dalam penelitian ini adalah 10 ng/µl – 25 ng/µl
dengan pengenceran yang dihitung dengan memperhatikan faktor pengenceran. Menurut Haris et al. (2003), konsentrasi DNA berdampak pada kualitas fragmen hasil amplifikasi. Konsentrasi DNA yang terlalu rendah akan
menghasilkan fragmen yang sangat tipis pada gel atau bahkan tidak terlihat secara visual, sebaliknya konsentrasi DNA yang terlalu tinggi akan memnyebabkan
fragmen terlihat tebal sehingga sulit dibedakan antara satu fragmen dengan fragmen lainnya.
Kerusakan stok DNA dapat diakibatkan oleh kurang baiknya penyimpanan
sehingga suhu DNA meningkat yang menyebabkan penurunan konsentrasi DNA. Hal ini sesuai dengan pendapat Andras (1996) yang menyatakan bahwa temperatur penyimpanan DNA yang dianjurkan adalah pada -20 C hingga -4C.
DNA (tanpa tambahan) dapat mengalami kerusakan struktur jika berada pada temperature yang tinggi.Hal itu dikarenakan DNA terdiri dari dua jalinan yang
dihubungkan dengan ikatan hidrogen, dan ikatan itu sangat rentan untuk rusak pada suhu tinggi.
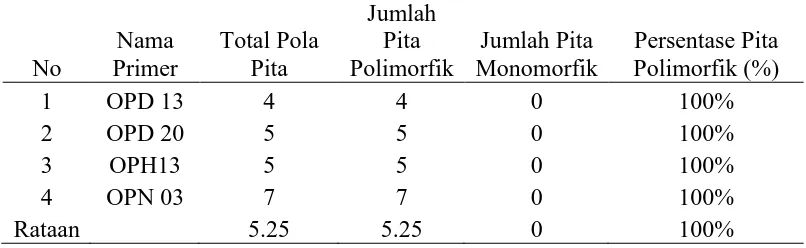
Tabel 3. Persentase pita polimorfis pada empat primer
No
Pita polimorfik adalah pita yang tidak terdapat pada seluruh sampel.
Persentase pita polimorfik yang tinggi menunjukkan tingginya variasi pada setiap aksesi andaliman yang diteliti. Jumlah pita polimorfik hasil amplifikasi
berbeda-beda. Semakin banyak pita polimorfik yang dihasilkan akan semakin mudah untuk mengamati adanya variasi (Azizah, 2009).
Jumlah pola pita tertinggi terdapat pada primer OPN 03 yang berjumlah 7
pita sedangkan total jumlah pola pita terendah terdapat pada primer OPD 13. Jumlah pita polimorfik tertinggi terdapat pada primer OPN 03 yaitu 7 pita
pada primer OPD 20 dan OPN 03 sedangkan OPD 13 dan OPH 13 masing-masing memiliki persentase polimorfik sebesar 100%.
Amplifikasi dan Genotyping
Tabel 4. Urutan basa empat primer dan sampel DNA yang tidak teramplifikasi
Nama Primer Urutan Basa (5'-3') Yang Tidak teramplifikasi Jumlah
OPD 13 ACGCGCATGT N,P,Q,T,V,W 6
OPD 20 ACCCGGTCAC A,B,E,J,N,P,Q,S,A3 9
OPH 13 GACGCCACAC N,P,Q,R,S,T,U,V,W,X,Y,Z,A2 13
OPN 03 GGTACTCCCC C,N,R 3
Jumlah
Sebanyak 30 sampel telah dianalisis menggunakan mesin PCR.Hasil amplifikasi PCR menunjukkan bahwa terdapat 1 sampel tidak teramplifikasi pada setiap primer yang diujikan. 1 sampel dari 30 sampel tersebut yaitu sampel
dengan kode N (14/82) sampel ke 14 dan no pohon 82 . Pada gambar 1-4 menunjukkan bahwa produk amplifikasi primer diseparasi dengan elektroforesis
gel agarose 2% dan divisualisasikan dengan UV Transiluminator.
Pita yang muncul memiliki ukuran basa dan intensitas yag bervariasi. Perbedaan intensitas pita DNA dipengaruhi oleh sebaran situs penempelan primer
pada genom, kemurnian dan konsentrasi genom dalam reaksi.Banyaknya pita yang dihasilkan oleh setiap primer tergantung pada sebaran situs homolog pada genom (Williams et al, 1990).Fragmen yang tidak muncul disebabkan tidak
terjadinya amplifikasi, mungkin terjadi karena primer yang digunakan tidak sesuai dengan DNA cetakan.Beberapa bukti percobaan menunjukkan bahwa perbedaan
Secara umum, hasil penelitian ini menunjukkan bahwa pola pita yang dihasilkan oleh empat primer yang digunakan memperlihatkan pola pita yang berbeda. Ukuran pita-pita yang dihasilkan bervariasi antara 470 – 2609 bp. Total
pola pita dari kelima primer yang tampak sebanyak 21 pita dengan rata-rata 5 pita per primer dengan pita polimorfik sebanyak 21 dan pita monomorfik sebanyak 0
pita. Persentase pita yang polimorfik sebanyak 100% untuk seluruh primer.
Pada tabel .4 menunjukkan bahwa jumlah pola pita tertinggi terdapat pada primer OPN-03 yang berjumlah 7 pola pita sedangkan jumlah pola pita terendah
terdapat pada primer OPD-13 yang berjumlah 4 pola pita. Ukuran pita tertinggi terdapat pada primer OPD-20 sebesar 2609 bp sedangkan ukuran pita terendah
terdapat pada primer OPH- 13 sebesar 470 bp.
Primer OPD-20 menunjukkan pola pita yang berjumlah 5 pita denganukuran pita berkisar 1366 – 2609 bp. Persentase pita polimorfis sebesar
100 % dan persentase pita monomorfis sebesar 0 %. MA B C D E F G H I J K L M N O
Gambar 1. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-20, Ket ; M= marker ladder 1kb,kode sampel (A –O).
M PQRSTUVWXYZ A1 A2 A3 A4
Gambar 2. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-20, Ket ; M= marker ladder 1kb,kode sampel (P–A4).
Primer OPD-13 menunjukkan pola pita yang berjumlah 4 pita dengan ukuran pita berkisar 485 - 1077 bp. Persentase pita polimorfis sebesar 100 % dan persentase pita monomorfis sebesar 0 %.
M A B C D E F G H I J K L M N O
Gambar 3. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-13, Ket ; M=marker ladder 1kb, Kode sampel A –O.
M PQRSTUVWXYZA1A2A3A4
Gambar 4. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPD-13, Ket ; M=marker ladder 1kb, Kode sampel P–A4.
Primer OPN 03 menunjukkan pola pita yang berjumlah 5 pita dengan
ukuran pita berkisar 523 - 1964 bp. Persentase pita polimorfis sebesar 100 % dan persentase pita monomorfis sebesar 0 %.
M A B C D E F G H I J K L M N O
M P Q R S T U V W X Y Z A1 A2 A3 A4
Gambar 6. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPN 03, Ket ; M= markerladder 1kb , kode sampelP-A4.
Primer OPH 13 menunjukkan pola pita yang berjumlah 7 pita dengan
ukuran pita berkisar 470 - 2075 bp. Persentase pita polimorfis sebesar 100 % dan persentase pita monomorfis sebesar 0 %.
MA B C D E F G H I J K L M N O
Gambar 7. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPH 13, Ket: M=
marker ladder 1kb + invitro, kode sampel A –O.
M P Q R S T U V W X Y Z A1 A2 A3 A4
Gambar 8. Elektroforegram amplifikasi 30 DNA Kelapa Sawit dengan primer OPH
13, Ket: M= marker ladder 1kb + invitro, kode sampel P-A4.
Penelitian ini menggunakan klon tanaman kelapa sawit sebagai bahan penelitian karena tanaman klon yang berasal dari perbanyakan in vitro dengan
teknik kultur jaringan memperlihatkan adanya fenomena variasi somaklonal. Menurut Bairu et al.(2011), variasi somaklonal dapat dideteksi dengan beberapa pendekatan yaitu, morfologi, biokimia, dan molekular. Variasi somaklonal
dilakukan dengan mengamati karakter fenotipe setiap bagian tanaman pada fase vegetatif dan generatif. Kelemahan pengamatan karakter morfologi membutuhkan waktu yang lama sampai tanaman berbunga dan berbuah. Sebagai contoh tanaman
kelapa sawit dengan variasi somaklonal buah mantel yang harus menunggu tanaman berbuah, namun pada penelitian molekuler dapat dilakukan sebelum
tanaman berbuah, sehingga dapat digunakan sedini mungkin.
Muncul atau tidaknya pita pada setiap primer berpengaruh terhadap konsentrasi primer yang juga berpengaruh terhadap intensitas produk
PCR-RAPD.Menurut Padmalatha dan Prasad (2006) konsentrasi primer yang terlalu rendah atauterlalu tinggi menyebabkan tidak terjadinya amplifikasi.Rasio yang
rendah antara primer dan DNA cetakan dapat menyebabkan produk RAPD yang dihasilkan tidak konsisten.
Beberapa dari pita DNA tersebut tidak terbentuk secara sempurna. Pada
saat didokumentasikan dengan menggunakan Gel-doc terlihat pita-pita DNA yang blur (tidak jelas). Hal ini disebabkan pita DNA yang tidak terbentuk secara
sempurna. Bedasarkan penelitian Azizah (2009) hasil amplifikasi yang kurang baik dapat disebabkan oleh ketidaksesuaian primer, efisiensi, dan optimasi proses PCR. Primer yang tidak spesifik atau sesuai dapat menyebabkan teramplifikasinya
daerah lain dalam genom yang tidak dijadikan sasaran atau sebaliknya tidak ada daerah genom yang teramplifikasi. Optimasi PCR juga diperlukan untuk
menghasilkan karakter yang diinginkan yang menyangkut suhu denaturasi dan annealing DNA dalam mesin PCR. Suhu denaturasi yang rendah dapat menyebabkan belum terbukanya DNA utas ganda sehingga tidak dimungkinkan
sudah terbuka memerlukan suhu optimum, sebab suhu yang terlalu tinggi dapat menyebabkan amplifikasi tidak terjadi karena primer tidak menempel atau sebaliknya suhu yang terlalu rendah menyebabkan primer menempel pada sisi lain
genom yang bukan sisi homolognya. Hal ini menyebabkan teramplifikasi banyak daerah tidak spesifik dalam genom tersebut. Suhu penempelan (annealing) ini
ditentukan berdasarkan primer.
Beberapa faktor yang sangat mempengaruhi keberhasilan proses elektroforesis dalam analisis ini. Faktor-faktor tersebut diantara nya adalah
ukuran molekul DNA, konsentrasi gel agarosa, konformasi DNA, voltase, keberadaan pewarna DNA, komposisi buffer elektroforesis.
Dalam penelitian ini penulis menggunakan gel agarose dengan konsentrasi 2%. Dengan perbandingan agarose sebesar 1,6 gr dengan 80 ml tris TAE 1 x untuk chamber elektroforesis berukuran sedang. Konsentrasi gel agarose sangat
mempengaruhi laju migrasi DNA pada proses elektroforesis. Berdasarkan penelitian yang dilakukan Fatciyah (2011) konsentrasi agarosa yang digunakan
akan menentukan besarnya pori-pori gel yang akan memisahkan-misahkan DNA. Semakin rendah konsentrasi agarose maka matriks gel akan semakin kecil dan fragmen DNA dapat dipisah semakin jauh berdasarkan ukurannya
Pewarna DNA sangat menentukan tampak atau tidaknya pita DNA saat didokumentasikan dengan geldoc. Pada penelitian ini penulis menggunakan
Etidhium Bromide (EtBr) sebagai pewarna. Hal ini sesuai dengan pendapat
Wicaksono, dkk (2009) yang menyatakan bahwa etidium bromide merupakan sebuah molekul yang dapat mengikat kuat pada DNA. Pewarna DNA igunakan
elektroforesis. Etidium mengikat dengan cara menyisip diantara ikatan basa pada untai ganda DNA.
Gel disinari dengan ultraviolet dari bawah maka akan tampak citra berupa
pita-pita pada gel yang dapat diamati dan dihitung panjang basepair nya dan discoring sehingga bisa ditentukan kekerabatan antar sampel yang diamati.
Yuwono (2006) menyatakan bahwa pita-pita tersebut muncul peranan Etidium bromide dalam membantu visualisasi dengan memendarkan sinar ultraviolet.
Buffer TAE (Tris Acetate EDTA) merupakan larutan penyangga yang
biasa digunakan dalam elektroforesis. Larutan ini berfungsi untuk meneruskan arus listrik sehingga diterima oleh fragmen DNA yang berada pada gel agarosa
yang terendam pada larutan tersebut (Ogden dan Adams, 1987).
Analisis Hubungan Genetik Klon kelapa sawit
Berdasarkan elektroforesis hasil amplifikasi dengan menggunakan 4
primer, diperoleh data biner berupa skoring untuk menentukan kesamaan hubungan genetik antar individu dalam 30 aksesi klon kelapa sawit. Hasil
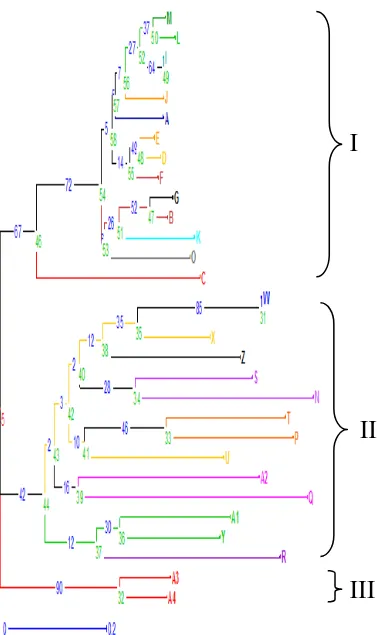
Gambar 9.Pohon filogenetik 30 aksesi klon kelapa sawit yang dianalisis berdasarkan Matrix Dissimilarity Simple Matching.
I
II
Data biner hasil skoring amplifikasi 4 primer yang diolah dengan software DARwin dihasilkan radial filogenetik yang menunjukkan kekerabatan aksesi klon kelapa sawit, dimana 28 aksesi klon kelapa sawit yang dikelompokkan menjadi 3
kelompok. Kelompok I terbagi lagi menjadi 2 subkelompok yaitu : subkelompok IA dan Subkelompok IB. Subkelompok IA terdiri dari (M, L, I, J, A, E, D, F, G,
B, K, O) dan subkelompok IB terdiri dari ( C ) Mengelompok secarab acak. Kelompok II terbagi lagi menjadi 2 subkelompok yaitu subkelompok IIA dan IIB.Subkelompok IIA terdiri atas aksesi (W, X, Z, S, N, T, P, U, A2, Q), dan
subkelompok IIB terdiri dari aksesi (A1, Y, R).
Kelompok III terdiri dari lagi menjadi 2 subkelompok IIIA dan IIIB.
Subkelompok IIIA terdiri atas aksesi (A3) dan subkelompok IIIB terdiri dari aksesi (A4) memiliki kekerabatan yang dekat. Hasil clustering menunjukkan keragaman genetik dari klon tersebut adalah tinggi.
Namun dalam aksesi ke-3 kelompok tersebut memiliki kekerabatan yang jauh apabiladi lihat berdasarkan masing-masing kelompok, dari kelompok I ke
kelompok II atau ke kelompok III memiliki keragaman yang tinggi.Hutami et al., (2006) menyatakan bahwa tanaman yang diperbanyak melalui kultur in-vitro dapat menyebabkan variasi somaklonal pada setiap planletnya. Keragaman
somaklonal berasal dari keragaman genetik eksplan dan keragaman genetik yang terjadi didalam kultur in-vitro.
Keragaman yang tinggi didalam populasi memberikan dasar yang luas
untuk program pengembangan. Dasar untuk seleksi dalam proses ini sama seperti konservasi ex-situtetapi lebih difokuskan pada tingkat tertinggi dari
individu yang lebih banyak dilakukan didalam populasi sehingga variasi genetik yang tinggi dapatdi jaga (Lim et al., 2002).
Hasil skoring pada setiap fragmen pita DNA yang terbentuk setelah amplifikasi dapat diketahui kekerabatan setiap aksesi klon kelapa sawit tersebut.nilai bootstrap pada 1000 replikasi untuk mengetahui tingkat kekerabatan
pengelompokan ditunjukkan pada Gambar 11.
Factorial analysis: Axes 1/2
Gambar 10.Menunjukkan bahwa 30 aksesi klon kelapa sawit asal klon memperoleh gambaran dari kekerabatan diantara individu-individu. Hasil kelompok 1,2 dan 3 aksesi klon kelapa sawit, dapat dilihat bahwa ketiga
kelompok tersebut memiliki kekerabatan yang dekat, namun ketiga aksesi tersebut dalam tiap aksesi mengelompok secara acak. Setelah diamati profil filogenik
dengan menggunakan 4 primer pada masing- masing individu terlihat bahwa pada kelompok I dengan subkelompok IA memiliki kekerabatan yang dekat atau berasal dari induk yang sama, apabila kode sampel diurutkan
(A,B,D,E,F,G,I,J,K,L,M,) akan menghasilkan nomor individu tanaman yang tidak berjauhan (1/61,2/92,4/94,5/95,6/90,7/89,9/83,10/84,11/85,12/86,13/87) hal
ini diduga bahwa kelapa sawit yang berasal dari klon pada PT. SOCFINDO merupakan individu yang memiliki kekerabatan yang dekat. Hal ini sesuai dengan pernyataan Zulhermana (2009) yang menyatakan bahwa Hasil analisis tingkat
kesamaan genetik berdasarkan marka RAPD menunjukkan bahwa empat ramet klon pisifera Nigeria yang dianalisis mempunyai tingkat kesamaan genetik 1,00
(Tabel 2). Hal ini mengindikasikan bahwa ramet 2401, 2402, 2403 dan 2404 yang dievaluasi sebagai bahan tanaman klonal yang berasal dari satu ortet.
Gambar 12.Menunjukkan perbedaan factorial analisis (PCoA) diantara 3
kelompok tercermin dari perbedaan pada hasil aksis 1 dan 2 (Tabel 6) yang mampu menjelaskan total 48.5 % dari keseluruhan keragaman molekuler dari
Faktorial analisis (Principal Coordinates Analysis) aksis 1 (horizontal) adalah 33.53% dan aksis 2 (vertical) adalah 14.97% dengan 4 primer marka RAPD. Dari hasil tersebut dapat diketahui bahwa 28 aksesi klon kelapa sawit
tersebut menyebar pada beberapa daerah pada keempat zona tersebut. Hal ini menunjukkan bahwa aksesi klon kelapa sawit tersebut memiliki keragaman
KESIMPULAN DAN SARAN Kesimpulan
Persentase polimorfik 30 sampel Kelapa sawit pada 4 primer yaitu
OPN-03, OPD- 13, OPD- 20, OPH- 13 menghasilkan polimorfisme yang tinggi sebesar 100% dengan ukuran basa fragmen DNA dari 30 sampel yang diamati adalah 470
– 2609 bp.Untuk 28 aksesi tanaman kelapa sawit asal klon menunjukkan adanya kekerabatan pada subkelompok serta memiliki keragaman pada tiap kelompok, dengan nilai factorial analisis (PCoA) yaitu 48, 5 %.
Dalam penentuan filogenik kelapa sawit asal klon pada analisis Neigbour-jouning Tree (Ntjree)tersebut dapat diketahui bahwa aksesi kelapa sawit asal klon
tersebut membentuk 3 kelompok secara genetik dan diduga memiliki kekerabatan antar subkelompok atau antar individu serta memiliki keragaman antar kelompok.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui keragaman genetik dan kekerabatan antara individu tanaman plasma nutfah pada tanaman
TINJAUAN PUSTAKA Botani Tanaman
Tanaman kelapa sawit menurut klasifikasi tanaman dimasukkan dalam
Kingdom : Plantae, Divisi : Spermatophyta, Subdivisi : Angiospermae, Kelas : Monocotyledonae, Ordo : Palmales, Famili : Palmae, Sub famili : Cocoideae,
Genus : Elaeis, Spesies : Elaeis gueneensis Jacq (Corley, 2003).
Akar tanaman kelapa sawit berfungsi sebagai penyerap unsur hara di dalam tanah dan respirasi tanaman, selain itu juga sebagai penyangga berdirinya
tanaman padaketinggian yang mencapai puluhan meter sampai tanaman berumur 25 tahun. Sistem perakaran kelapa sawit merupakan sistem akar serabut, terdiri
dari akar primer, sekunder, tersier dan kuarter. Akar primer umumnya berdiameter 6–10 mm keluar dari pangkal batang dan menyebar secara horisontal dan menghujam kedalam tanah dengan sudut yang beragam. Akar primer bercabang
membentuk akar sekunder yang diameternya 2-4 mm. Akar sekunder bercabang membentuk akar tersier yang berdiameter 0,7-1,2 mm dan umumnya bercabang
lagi membentuk akar kuarter (Pahan. 2008).
Batang kelapa sawit tumbuh tegak lurus (phototropi) dan pelepah daun (Frond base) menempel membalut batang. Pada tanaman dewasa diameternya
dapat mencapai 40 cm–60 cm, bagian bawah batangnya lebih gemuk disebut bongkol bawah (bowl).Kecepatan tumbuh berkisar35 cm–75 cm/tahun. Sampai
cepat akan tetapi diameter (tebal) batang lebih kecil (Mangoensoekarjodan Semangun. 2005).
Kelapa sawit merupakan tanaman monokotil yaitu tanaman yang
batangnya tidak mempunyai kambium dan umumnya tidak bercabang. Batang tanaman kelapa sawit berfungsi sebagai struktur yang mendukung daun, bunga,
dan buah, sebagai sistem pembuluh yang mengangkut air dan hara mineral dari akar ke atas serta hasil fotosintesis (fotosintat) dari daun ke bawah serta kemungkinan juga berfungsi sebagai organ penimbunzat makanan. Batang
tanaman berbentuk silinder dengan diameter 20 cm–75 cm. Tanamankelapa sawit yang masih muda, batangnya tidak terlihat karena tertutup oleh pelepah daun.
Pertambahan batang tanaman kelapa sawit terlihat jelas setelah tanaman berumur empat tahun (Pahan, 2008).
Daun kelapa sawit mirip kelapa yaitu membentuk susunan daun majemuk,
bersirip genap dan bertulang sejajar. Daun-daun membentuk satu pelepah yang panjangnya mencapai lebih dari 7,5 m -9 m. Jumlah anak daun disetiap pelepah
berkisar antara 250- 400 helai, daun muda yang masih kuncup berwarna kuning pucat. Pada tanah yang subur, daun cepat membuka sehingga makin efektif melakukan fungsinya sebagai tempat berlangsungnya fotosintesis dan sebagai alat
respirasi. Semakin lama proses fotosintesis berlangsung, semakin banyak bahan makanan yang dibentuk sehingga produksi akan meningkat. Jumlah pelepah,
panjang pelepah, dan jumlah anak daun tergantung pada umur tanaman. Tanaman yang berumur tua, jumlah pelepah dan anak daun lebih banyak. Begitu pula pelepahnya akan lebih panjang dibandingkan dengan tanaman yang masih muda
Kelapa sawit merupakan tanaman berumah satu (monoecious), artinya bunga jantan dan bunga betina terdapat dalam satu tanaman dan masing-masing terangkai dalam satu tandan. Rangkaian bunga jantan terpisah dengan bunga
betina. Setiap rangkaian bunga muncul dari pangkal pelepah daun. Sebelum bunga mekar dan masih diselubungi seludang, bunga dapat dibedakan antara bunga
jantan dan bunga betina dengan melihat bentuknya (Lubis. 1992).
Pada tanaman dewasa satu tandan mempunyai ± 200 cabang bunga. Setiap cabang bunga mengandung 700–1200 bunga jantan. Bunga jantan terdiri dari 6
helai benang sari dan 6 perhiasan bunga. Hari pertama kelopak terbuka dan mengeluarkan tepung sari dari ujung tandan bunga, pada hari kedua bagian tengah
dan hari ketiga di bagian bawahtandan yang akan keluar serbuk sari. Serbuk sari berwarna kuning pucat dan berbau spesifik. Satu tandan bunga jantan dapat menghasilkan 25–50 gram tepung sari. Setiap bunga akan dibuahi dengan serbuk
sari yang menghasilkan buah tersusun pada tandan (Sastrosayono. 2003).
Buah kelapa sawit termasuk jenis buah keras (drupe), menempel dan
bergerombol pada tandan buah. Jumlah per tandan dapat mencapai 1.600, berbentuk lonjong sampai membulat. Panjang buah 2-5 cm, beratnya 15-30 gram. Bagian-bagian buah terdiri atas kulit buah (exocarp), sabut dan biji (mesocarp).
Eksokarp dan mesokarp disebut perikarp (pericarp). Biji terdiri atas cangkang (endocarp) dan inti (kernel), sedangkan untuk inti sendiri terdiri atas endosperm
Syarat Tumbuh
Lama penyinaran matahari yang baik untuk kelapa sawit antara 5-7 jam/hari. Tanaman ini memerlukan curah hujan tahunan 1.500-4.000 mm,
temperatur optimal 24-28oC. Ketinggian tempat yang ideal untuk sawit antara 1-500 m dpl (di atas permukaan laut). Kelembaban optimum yang ideal untuk
tanaman sawit sekitar 80-90% dan kecepatan angin 5-6 km/jam untuk membantu proses penyerbukan (Mangoensoekarjo dan Semangun. 2005).
Kelapa sawit dapat tumbuh pada jenis tanah Podzolik, Latosol,
Hidromorfik Kelabu, Alluvial atau Regosol, tanah gambut saprik, dataran pantai dan muara sungai. Tingkat keasaman (pH) yang optimum untuk sawit adalah 5,0-
5,5. Kelapa sawit menghendaki tanah yang gembur, subur, datar, berdrainase (beririgasi) baik dan memiliki lapisan solum cukup dalam (80 cm) tanpa lapisan padas. Kemiringan lahan pertanaman kelapa sawit sebaiknya tidak lebih dari 15º
(Kiswanto, 2008).
Klon Kelapa Sawit
Salah satu yang umum ditemukan pada klon kelapa sawit yang dihasilkan dari kultur jaringan adalah terjadinya perubahan 10- 40% ke arah abnormalitas pada organ reproduktif yaitu bunga dan buah. Dalam proses abnormalitas ini
terjadi konversi satu atau lebih primordial anter menjadi karpel tambahan yang lunak dan berkembang menjadi buah mantel (Corley et al., 1986).
(Hutami et al.,) menyatakan bahwa tanaman yang diperbanyakmelalui kultur in-vitro dapat menyebabkan variasisomaklonal pada setiap planletnya. Keragamansomaklonal berasal dari keragaman genetik eksplan dankeragaman
Ada beberapa pendapat mengenai terjadinya abnormalitas pada tanaman kelapa sawit hasil kultur jaringan, perubahan tersebut dapat bersifat genetik (Rao dan Danough, 1990), gangguan ekspresi gen diakibatkan fitohormon, struktur
kalus, lamanya subkultur dan umur kalus (Paranjothy et al., 1993), tekanan seleksi yang dipakai, jenis eksplan yang digunakan, level ploidi sumber eksplan dan
kecepatan proliferasi kalus. Larkin & Scowcroft (1991) menyatakan bahwa variasi pada tanaman yang diregenerasi dari kultur jaringan disebut sebagai variasi somaklonal.
Keragaman Genetik
Informasi parameter genetik sangat diperlukanuntuk kegiatan seleksi dan
penapisan. Kegiatan seleksimembutuhkan karakter yang tepat agar dapat berjalan efisien. Hasil (produksi minyak) merupakan perhatianyang paling penting dalam program pemuliaan sawit,tetapi hasil merupakan karakter yang diwariskan secara
kompleks dan melibatkan beberapa komponen terkait (Putri, et al., 2009).
Keragaman genetik merupakan landasan bagi pemulia untuk memulai
suatu kegiatan perbaikan tanaman. Besarnya keragaman genetik dapat menjadi dasar untuk menduga keberhasilan perbaikan genetik didalam program pemuliaan. Keragaman genetik yang luas merupakan syarat berlangsungnya proses seleksi
yang efektif karena memberikan keleluasan dalam proses pemilihan suatu genotipe. Selain itu populasi dengan keragaman genetik yang lebih luas akan
memberikan peluang yang lebih besar diperolehnya karakter-karakter yang diinginkan (Mulyadiana, 2010).
Keragaman genetik dalam suatu populasi tanaman sangat penting, agar
Makin tinggi keragaman genetik maka peluang untuk mendapatkan genotipe unggul semakin besar (Greech and Reich, 1971), dan menunjukkan besarnya pengaruh genetik terhadap sifat yanag diekspresikan (Knight, 1979). Jika
keragaman genetik suatu tanaman sangat sempit sehingga sehingga seleksi sulit dilakukan maka, salah satu cara untuk meningkatkan keragaman genetik adalah
melalui mutasi. Mutasi adalah terjadinya perubahan materi genetik pada tingkat genom, kromosom, DNA atau gen sehingga mengakibatkan terjadinya keragaman genetik (Soeranto, 2003). Dalam bidang pemuliaan tanaman, teknik mutasi dapat
meningkatkan keragaman genetik sehingga memungkinkan pemulia melakukan seleksi genotipe tanaman sesuai dengan tujuan pemuliaan yang dikehendaki
(Pandi, 2010).
Keragaman genetik yang tinggi merupakan salah satu faktor penting untuk merakit varietas unggul baru. Peningkatan keragaman genetik dapat dilakukan
dengan memanfaatkan plasma nutfah yang tersedia dialam dan dapat pula dengan melakukan persilangan. Sifat-sifat tertentu sering tidak ditemukan pada sumber
gen yang ada sehingga teknologi lainnya perlu diterapkan (Hutami et al.,2005). Dalam pemuliaan tanaman, keragaman genetik dalam populasi tanaman mempunyai arti yang sangat penting (Mangoendidjojo, 2003) untuk
pengembangan sumber genetik yang diperlukan dalam pemuliaan tanaman (Karsinah et al., 2002). Tingkat keragaman individu dalam populasi
PCR (Polimerase Chain Reaction)
Reaksi berantai polimerase (Polymerase Chain Reaction / PCR) adalah metode amplifikasi suatu sequen DNA tertentu. PCR merupakan cara yang
sensitif, selektif dan sangat cepat untuk memperbanyak sequen DNA yang diinginkan (Murray et al., 2009).
Empat komponen utama pada proses PCR adalah (1) dna cetakan, yaitu fragmen DNA yang akan dilipat gandakan, (2) Oligonukleotida primer, yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan
untuk mengawali sintesis rantai DNA. Primer yang digunakan adalah PCR ada dua yaitu oligonukleotida yang mempunyai sekuen yang identik dengan sequen
pada ujung 3’_OH rantai DNA cetakan yang lain, (3) Deoksiribonukleotida trifosfat (dNTP),yang terdiri atas dATP dCTP dGTP dTTP dan (4) EnzimDNA polimerase yaitu enzim yang berfungsi sebagai katalis dalam reaksi sintesis rantai
DNA. Komponen lainnya yang juga berperan penting adalah senyawa buffer (Yuwono, 2006).
Keunggulan PCR (1) Polimerase-DNA dapat diarahkan untuk sintesis wilayah DNA tertentu. Teknik PCR sebenarnya mengeksploitasi berbgai sifat alami replikasi DNA. Dalam proses tersebut, polimerase –DNA menggunakan
DNA berserat tunggal sebagai cetakan untuk mensintesis serat baru yang komplementer. Cetakan berserat tunggal dapat diperoleh dengan mudah
dilaboratorium melalui pemanasan DNA berserat ganda pendek untuk memulai (prime) proses sintesis. Posisi awal dan akhir sintesis DNA pada PCR dapat ditentukan dengan menyediakan suatu oligonukleotida sebagai primer yang
(2) PCR menghasilkan amlifikasi wilayah DNA tertentu. Serat DNA dapat berfungsi sebagai cetakan untuik mensisntesis bila primer oligonukleotida disediakan untuk masing-masing serat. Sepasang primer dapat dipilih yang
membatasi “flanking” wilayah dari DNA yang ingin diperbanyak sehingga serat DNA yang baru disintesis dimulai dari posisi primer, membentang sampai
melewati primer dari serat lainnya (Murray et al., 2009).
Primer biasanya terdiri dari 20-2- nukleotida dan dirancang berdasarkan daerah konservasif dalam genom tersebut. Makin panjang primer, makin spesifik
daerah yang diamplifikasikan. Jika suatu kelompok organisme memang berkerabat dekat, marka primer dapat digunakan untuk mengamplifikasi daerah
tertentu yang sama dalam genom kelompok tersebut. Beberapa faktor seperti konsentrasi DNA, ukuran panjang primer, konsentrasi ion Mg, dan suhu hibridisasi primer harus dikontrol dengan hati-hati agar dapat diperoleh pita-pita
DNA yang utuh dan baik (Suryanto, 2003).
Random Amplified Polymorphic DNA (RAPD)
Marka RAPD banyak digunakan karena biaya yang murah, serta pengerjaannya yang mudah dan cepat bila dibandingkan marka lainnya (Bardakci, 2001). Teknik ini juga digunakan untuk identifikasi genotip dalam studi
taksonomi tanaman (Nezhad et al., 2010) dan dapat melihat perbedaan genetik masing-masing individu. Teknik RAPD memiliki kelemahan yaitu tingkat
Teknik RAPD membutuhkan amplifikasi daerah genom tertentu dari suatu organisme. Amplifikasi ini membutuhkan primer spesifik (sekuen oligonukelotida khusus) untuk daerah tersebut. Keberhasilan teknik ini lebih didasarkan kepada
kesesuaian primer dan optimasi proses PCR. Primer yang tidak spesifik dapat menyebabkan teramplifikasinya daerah lain dalam genom yang tidak dijadikan
sasaran atau sebaliknyatidak ada daerah genom yang teramplifikasi. Optimasi PCR juga diperlukan untuk menghasilkan karakter yang diinginkan. Optimasi ini menyangkut suhu denaturasi dan annealing DNA dalam mesin PCR
(Suryanto,2003).
Faktor lain yang mempengaruhi pola pita DNA hasil RAPD yaitu
komponen reaksi PCR (konsentrasi DNA template, konsentrasi enzim polymerase, konsentrasi primer, dan jumlah siklus termal), suhu siklus PCR (denaturation, dan annealing). Konsentrasi praimer acak untuk amplifikasi DNA
pada beberapa tanaman bervariasi, bergantung kepada jenis primer dan jenis tanamannya, sehingga diperlukan penelitian tersendiri untuk mendapatkan produk
amplifikasi yang optimum (Prana dan Hartati, 2003).
Pada teknik RAPD tingkat kemurnian DNA tidak perlu terlalu tinggi dengan kata lain teknik ini toleran terhadap tingkat kemurnian DNA (Prana dan
Hartati, 2003). Keuntungan lain penggunaan metode RAPD adalah kuantitas DNA yang dibutuhkan sedikit yakni sekitar 5 -25 ng DNA dalam setiap rantai
PCR (Pandey et al., 1998 di kutip Susantidiana et al., 2009).
Berdasarkan penelitian (Prana dan Hartati 2003) dari 12 primer random (Operon Technologies), dengan dua konsentrasi primer, dan tiga kondisi PCR
kondisi: 940C selama 5 menit (Initial Denaturation); 940C selama 1 menit (Denaturation); 350C selama 3 menit (Annealing) sebanyak 35 siklus; 720C selama 2 menit (Elongation); 720C selama 7 menit (Final Elongation).
Konsentrasi primer yang baik untuk mengamplifikasi DNA talas dalah 3,2 μM. Primer-primer yang dapat menampilkan pola pita diantara sampel yang diuji
PENDAHULUAN
Latar Belakang
Tanaman kelapa sawit (Elais guinensis Jacq.) adalah tanaman berkeping satu yang termasuk dalam famili Palmae. Nama genus Elais berasal dari bahasa yunani Elaoin atau minyak sedangkan nama species guinensis berasal dari kata
Guinea, yaitu tempat di mana seorang ahli bernama Jacquin menemukan tanaman
kelapa sawit pertama kali di pantai Guinea. Salah satu dari beberapa tanaman golongan palm yang dapat menghasilkan minyak adalah kelapa sawit
(Elaisguinensis Jacq). Tanaman Elais guinensis Jacq ini juga dikenal dengan nama, kelapa sawit (Melayu), kelapa sewu (Jawa) (Darnoko et al., 2000).
Kelapa sawit (Elaeis guineensis Jacq) merupakan salah satu dari beberapa tanaman palma penghasil minyak yang memiliki nilai ekonomi tinggi dan termasuk industri padat karya. Pengusahaan tanaman ini untuk produksi minyak
memiliki beberapa keunggulan, antara lain biaya produksi yang relatif murah, hasil per hektar tinggi, umur produktif yang panjang, serta pemanfaatannya
beraneka ragam (Lubis 1992).
Tanaman kelapa sawit merupakan salah satu jenis tanaman perkebunan yang menduduki posisi penting dalam sektor pertanian umumnya, dan sektor
perkebunan khususnya. Hal ini disebabkan karena dari sekian banyak tananam yang menghasilkan minyak atau lemak, kelapa sawit yang menghasilkan nilai
ekonomi terbesar per hektarnya di dunia (Sunarko, 2009).
Analisis produktivitas dengan melihat faktor-faktor yang mempengaruhi pertumbuhan kelapa sawit diperlukan dalam upaya peningkatan produktivitas
kelapa sawit tidak dapat dilakukan secara mudah mengingat banyak faktor yang mempengaruhi. Faktor-faktor yang mempengaruhi produktivitas kelapa sawit yaitu faktor lingkungan, faktor genetik, dan teknik budidaya (Mangunsoekarjo
dan Semangun 2005). Faktor penentu produktivitas kelapa sawit yang akan menjadi bahan kajian penulis yaitu umur tanaman, tenaga kerja panen, curah
hujan, dan hari hujan.
Kultur jaringan (kuljar) merupakan salah satu metode pemuliaan tanaman yang digunakan untuk perbanyakan tanaman kelapa sawit. Perbanyakan melalui
kultur jaringan memungkinkan terjadinya variabilitas genetik pada planlet yang dihasilkan (livy dan Gunawan, 1988). Hutami et al.,(2006) menyatakan bahwa
tanaman yang diperbanyak melalui kultur in-vitro dapat menyebabkan variasi somaklonal pada setiap planletnya. Keragaman somaklonal berasal dari keragaman genetik eksplan dankeragaman genetik yang terjadi di dalam kultur
in-vitro.
Keragaman genetik yang terjadi di dalam kultur jaringan antara lain
disebabkan oleh penggandaan jumlah kromosom (fusiendomitosis), perubahan struktur kromosom (pindah silang), perubahan gen, dan sitoplasma, Untuk mengetahui apakahterdapat keragaman genetik pada tanaman nilam hasilin-vitro
dengan tetuanya dapat dilakukan melalui bantuan marka molekuler (Hutami et al., 2006).
Keanekaragaman genetik dapat terjadi karena adanya perubahan nukleotida penyusun DNA. Perubahan ini mungkin dapat mempengaruhi fenotipe suatu organisme yang dapat dilihat secara langsung atau mempengaruhi reaksi
suatu populasi dapat terjadi karena adanya mutasi, rekombinasi, atau migrasi gen dari satu tempat ke tempat lain (Suryanto, 2003).
Beberapa pendapat menyatakan bahwa mekanisme munculnya
abnormalitas berbeda-beda untuk setiap genotip dan klon tanaman kelapa sawit. Pengamatan genotipik pada tingkat DNA tidak dipengaruhi oleh umur tanaman
atau faktor lingkungan sehingga sama pada setiap fase atau tahap pertumbuhan dan perkembangan tanaman. Analisis pada tingkat DNA dapat digunakan untuk deteksi sedini mungkin pada fase pembibitan atau bahkan saat perbanyakan dalam
kultur jaringan, khususnya tanaman perkebunan seperti tanaman kelapasawit. Dengan demikian program pemuliaan tanaman dalam melakukan seleksi akan
dipercepat, sehingga dapat memberi rekomendasi lebih awal (Yuniastuti et al.,2005).
Informasi keragaman genetik sangat diperlukan untuk mendukung
kegiatan konservasi. Besarnya keragaman genetik mencerminkan sumber genetik yang diperlukanuntuk adaptasi ekologi dalam jangka waktu pendek dan evolusi
dalam jangka panjang. Penanda molekuler banyak digunakan dalam analisis keragaman genetik tanaman, salah satunya adalah Random Amplified Polymorphism DNA (RAPD). RAPD digunakan untuk mengidentifikasi genotipe
tanaman karena memiliki kelebihan dalam pelaksanaan dananalisis. RAPD memerlukan ekstraksi DNA, kondisiamplifikasi optimum, dan analisis data yang
kesemuanya dapat dilakukan dalam waktu yang relatif cepat ( Poerba dan Yuzammi, 2008).
Penanda molekuler banyak digunakan dalam analisis keragaman genetik
Teknik ini digunakan untuk mengidentifikasi genotipe tumbuhan, karena memiliki kelebihan dalam pelaksanaan dan analisisnya. Dibandingkan dengan penanda DNA yang lain, seperti restriction fragment length polymorphisms (RFLP) dan
simple sequence repeats (SSR), teknik RAPD lebih murah, mudah dilakukan, cepat memberikan hasil, menghasilkan polimorfisme pita DNA dalam jumlah
banyak, tidak memerlukan pengetahuan tentang latar belakang genom yang dianalisis dan mudah memperoleh primer acak yang diperlukan untuk menganalisis genom semua jenis organisme (Tingey et al., 1994). Walaupun
metode in kurang sempurna dan memiliki kelemahan dalam konsistensi produk amplifikasi (Jones et al., 1997), tetapi kelemahan ini dapat diatasi dengan
mengoptimalkan ekstraksi, dan kondisi PCR serta pemilihan primer yang tepat. Variabilitas genetik sangat mempengaruhi keberhasilan suatu proses seleksi dalam program pemuliaan. Perbaikan tanaman pada dasarnya tergantung
dari tersedianya suatu populasi, yang terdiri dari individu-individu yang memiliki susunan genetis berbeda dan memiliki adaptasi yang luas serta keefektifan seleksi
terhadap populasi tersebut (Ruchjaniningsih et al., 2002).
Keragaman genetik plasma nutfah merupakan salah satu komponen dasar dalam sistemproduksi pertanian, yang merupakan sumber dari sifat-sifat penting
untuk perbaikan varietas. Untukmengetahui seberapa besar ragam genetik plasma nutfah yang dimiliki tanaman kelapa sawit asal klon maka perlu dipelajari sifat-
dengan menggunakan teknik Random Amplified Polymorphic DNA (RAPD), sebagai langkah awal dari pemuliaan tanaman.
Plasma nutfah kelapa sawit asal klon yang di tanam di Pusat Seleksi
Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok Masihul, Kabupaten Serdang Bedagai, belum pernah diketahui keragaman genetiknya
secara molekuler sehingga basih banyak peluang untuk melakukan penelitian.
Tujuan Penelitian
Penelitian ini bertujuan untuk melihat persentase pita polimorfik
keragaman genetik pada tanaman kelapa sawit (Elaeis guineensis jacq.)asal klon berdasarkan marka RAPD(Random Amplified Polimorpism DNA).
Kegunaan Penulisan
Sebagai salah satu syarat untuk mendapatkan gelar sarjana di Fakultas Pertanian Universitas sumatera Utara, Medan dan sebagai bahan informasi bagi
ABSTRAK
ANA CHRISTIN SIMBOLON, 2016 : Identifikasi Keragaman Genetik Pada Tanaman kelapa Sawit (Elaeis gineensis Jacq.)Asal Klon Berdasarkan Marka RAPD (Random Amplified Polimorphism DNA), dibimbing oleh M.K Bangun dan Lollie Agustina P. Putri.Penelitian ini bertujuan untuk melihat persentase pita polimorfik keragaman genetik pada tanaman kelapa sawit (Elaeis guineensis jacq.) asal klon berdasarkan marka RAPD(Random Amplified Polimorphic DNA).Penelitian ini telah dilakukan di Laboratorium Genetika Molekuler Fakultas Pertanian Universitas Sumatera dan SSPL Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok Masihul, Kabupaten Serdang Bedagai.pada Maret s/d Agustus 2016.Sebanyak 30 sampel daun kelapa sawit asal klon berasal dari PT. SOCFINDO dan telah diisolasi.Total pola pita yang dihasilkan dari primer OPD-20, OPD-13, OPH-13, OPN- 03adalah 21 pita dengan 100% pita polimorfik. Ukuran pita yang dihasilkan berkisar 470 – 2609 bp.Koefisien keragaman genetik dan dendogram filogenetik diperoleh menggunakan software Darwin 5.05 yang hanya dapat memproses 28 aksesiyang diuji dan sebagian aksesi tidak memenuhi persentase yang distandarkan. Analisis tersebut menunjukkan bahwa 28 aksesi klon kelapa sawit terbagi dalam tiga kelompok utama diduga memiliki kekerabatan yang dekat namun pada tiap subkelompoknya memiliki keragaman yang tinggi.
ABSTRACT
ANA CHRISTIN SIMBOLON, 2016: identification of genetic diversity In crops of palm oil (Elaeis gineensis Jacq.) Clones based on Markers RAPD (Random Amplified Polimorphism DNA),supervised byM.K Bangun and Lollie Agustina P. Putri.The aimed of the research was to examine the percentage of polymorphism bands on genetic diversity in palm oil (Elaeis guineensis jacq.) from clones based on markers RAPD (Random Amplified DNA Polimorphism).This research has been conducted in the laboratory of molecular genetics Faculty of Agriculture University of Sumatra and SSPL Bangun Bandar PT. SOCFINDO, Desa Martebing, Kecamatan Dolok Masihul, Kabupaten Serdang Bedagai. From March to August 2016.As many as 30 samples of the original palm leaf clones derived from PT. SOCFINDO and have been isolated. Ribbon pattern resulting from primer OPD, OPD-13, OPH, OPN-03 is 21% 100 ribbons with polymorphic bands. The resulting tape sizes range from 470 – 2609 bp.Coefficients of genetic diversity and phylogenetic dendogram obtained using software Darwin5.05 which can only process the 28 accessions tested and most accessions do not meet a standardised standardised percentages.The analysis showed that 28 accessions palm oil clones are divided into three main groups have allegedly.
Key words: palm oil, clones, genetic diversity, random amplified polymorphism DNA.
IDENTIFIKASI KERAGAMAN GENETIK TANAMAN KELAPA SAWIT
(Elaeis guineensis Jacq.) ASAL KLON BERDASARKAN MARKA RAPD
(Random Amplified Polimorphism DNA)
SKRIPSI
OLEH :
ANA CHRISTIN SIMBOLON 120301193 / PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN