ISOLASI BAKTERI PENGHASIL ANTIMIKROBA DARI
SAMPEL TANAH TAMAN WISATA ALAM SIBOLANGIT DAN
KEMAMPUANNYA MENGHAMBAT PERTUMBUHAN
MIKROBA PATOGEN
TESIS
Oleh :
Siti Khadijah Nasution
087030022
PROGRAM STUDI MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI BAKTERI PENGHASIL ANTIMIKROBA DARI
SAMPEL TANAH TAMAN WISATA ALAM SIBOLANGIT DAN
KEMAMPUANNYA MENGHAMBAT PERTUMBUHAN
MIKROBA PATOGEN
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar
Magister Sains pada Program Studi Magister Biologi pada Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera
Utara
Oleh
SITI KHADIJAH NASUTION
087030022
PROGRAM STUDI MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul Tesis : ISOLASI BAKTERI PENGHASIL ANTIMIKROBA DARI SAMPEL TANAH TAMAN WISATA ALAM
SIBOLANGIT DAN KEMAMPUANNYA
MENGHAMBAT PERTUMBUHAN MIKROBA
PATOGEN
Nama Mahasiswa : Siti Khadijah Nasution Nomor Pokok : 087030022
Program Studi : Biologi Konsentrasi : Mikrobiologi
Menyetujui Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc Prof. Dr. Erman Munir, M.Sc
Ketua Anggota
Ketua Program Studi Dekan
Telah diuji pada
Tanggal : 27 April 2011
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Dwi Suryanto, M.Sc Anggota : Prof. Dr. Erman Munir, M.Sc
PERNYATAAN
ISOLASI BAKTERI PENGHASIL ANTIMIKROBA DARI SAMPEL TANAH TAMAN WISATA ALAM SIBOLANGIT DAN KEMAMPUANNYA
MENGHAMBAT PERTUMBUHAN MIKROBA PATOGEN
TESIS
Dengan ini Saya menyatakan bahwa tesis ini adalah benar hasil karya Saya sendiri dengan bimbingan dosen pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam tesis dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Medan, April 2011 Penulis,
Isolasi Bakteri Penghasil Antimikroba dari Sampel Tanah Taman Wisata Alam Sibolangit dan Kemampuannya Menghambat Pertumbuhan Mikroba Patogen
ABSTRAK
Telah dilakukan penelitian tentang isolasi bakteri tanah yang berpotensi menghasilkan antimikroba dari Taman Wisata Alam Sibolangit, Sumatera Utara. Media nutrient agar digunakan untuk isolasi awal. Dua puluh sembilan isolat yang diperoleh memiliki kemampuan yang berbeda terhadap mikroba uji. Metanol, n-heksana, dan etil asetat digunakan sebagai pelarut untuk memperoleh ekstrak metabolit. Pengujian antagonis ekstrak tiga isolat potensial terpilih dilakukan dengan metode difusi cakram terhadap mikroba uji Escherichia coli, Staphylococcus aureus,
Candida albicans, Fusarium oxysporum, dan Ganoderma boninense. Hasil pengujian secara in vitro menunjukkan bahwa ekstrak metanol dan n-heksana isolat S3T33-3 aktif terhadap E. coli, C. albicans, dan G. boninense, sedangkan terhadap S. aureus
hanya metanol. Ekstrak menggunakan pelarut metanol dan n-heksana isolat S3T32-3 menunjukkan aktivitas yang sama terhadap F. oxysporum. Ekstrak etil asetat isolat S3T33-3 menunjukkan aktifitas yang rendah terhadap G. boninense.
Kata kunci: aktivitas antimikroba, Escherichia coli, Staphylococcus aureus,
Isolation of Antimicrobial Producing Bacteria from Taman Wisata Alam Sibolangit Soil and Their Potentials to Inhibit Pathogenic Microbes
ABSTRACT
A study on isolation and assay of antimicrobial activity of soil bacterial isolates of TWA Sibolangit, North Sumatra has been done. Nutrient agar was used in microbial isolation. Twenty-nine isolates showed different potential in inhibiting pathogens growth. Methanol, n-hexane, and ethyl acetate extraction method was utilised to get antimicrobial metabolites. Antagonistic test of the three selected potential extract was done using disc diffusion methods against Escherichia coli,
Staphylococcus aureus, Candida albicans, Fusarium oxysporum, and Ganoderma boninense. In vitro test of the extract showed that methanol and n-hexane extract of S3T32-3 were active against E. coli, C. albicans, and G. boninense, but methanol to inhibit S. aureus. Methanol and n-hexane extract of S3T32-3 showed the same activity against F. oxysporum. Ethyl acetate S3T33-3 extract showed the lowest activity against G. boninense.
Key words: antimicrobial activity, Escherichia coli, Staphylococcus aureus,
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul, ”Isolasi Bakteri Penghasil Antimikroba dari Sampel Tanah Taman Wisata Alam Sibolangit dan Kemampuannya Menghambat Pertumbuhan Mikroba Patogen”
Dalam kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang setinggi-tingginya khususnya kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc dan Prof. Dr. Erman Munir, M.Sc sebagai dosen pembimbing I dan dosen pembimbing II, Bapak Dr. Edy Batara Mulya Siregar, M.Si dan Ibu Dr. Herla Rusmarilin, M.Si sebagai dosen penguji, terima kasih atas bimbingan, perhatian, motivasi, saran, kritik, dan waktu yang diberikan. Semoga Allah SWT akan memberikan balasan yang lebih atas kebaikan yang telah diberikan, Amin. Kepada Bapak Prof. Dr. Syafruddin Ilyas, M.Biomed, selaku Ketua Program Magister Biologi, terima kasih atas segala bantuan yang telah diberikan. Penulis juga mengucapkan terima kasih kepada seluruh Staf Dosen Program Studi Sekolah Pascasarjana Biologi yang telah mendidik selama masa perkuliahan.
Kepada Ayahanda tercinta (Alm.) Agus Nasution dan Ibunda tercinta (Almh.) Amnah Lubis, serta keluarga besar yang sangat penulis sayangi, terima kasih atas perhatian, kasih sayang, dan cinta yang begitu besar.
Khusus kepada suamiku tercinta, Prof. Dr. Dwi Suryanto, M.Sc. Buah hatiku Aisyah Anindita Prameswari dan Annisa Anindya Vineswari, terima kasih atas cinta kasih dan pengertian yang telah diberikan. Kalianlah sumber inspirasi dan Ibu sayang kalian.
Ami, Affan, Mirza, Nila, Nikmah, Yanti, terima kasih atas kerjasamanya selama ini, sukses juga buat kalian semua.
Akhir kata penulis sangat menyadari akan kekurangan dalam tesis ini, untuk itu penulis sangat mengharapkan kritik dan saran yang dapat membangun demi kesempurnaan tesis ini dan semoga tesis ini dapat bermanfaat bagi semua.
Medan, April 2011
RIWAYAT HIDUP
3.1. Waktu dan Tempat 14
3.2. Alat dan Bahan 15
3.3. Isolasi Bakteri Penghasil Antimikroba 16 3.4. Karakterisasi Isolat Penghasil Antmikroba 16 3.5. Ekstraksi Bahan Antimikroba dengan Pelarut 17 3.6. Uji Daya Hambat Isolat Potensial dan Ekstrak Berbagai
pelarut Terhadap Mikroba Patogen 17 3.7. Rancangan Penelitian dan Analisis data 18
BAB IV HASIL DAN PEMBAHASAN 19
4.1. Isolasi Bakteri Penghasil Antimikroba 19 4.2. Asai Ekstrak dengan Pelarut Metanol, n-heksana, dan
Etil asetat 24
4.3. Abnormalitas Hifa Akibat Antagonisme Ekstrak
Terhadap Jamur Uji 34
BAB V KESIMPULAN DAN SARAN 36
5.1. Kesimpulan 36
5.2. Saran 37
DAFTAR TABEL
No. Judul Halaman
1 Karakterisasi isolat bakteri yang menghasilkan antimikroba 20 2 Hasil uji antagonis isolat terhadap mikroba uji dalam
bentuk zona hambat pertumbuhan 23
3 Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi,
dan isolat pada mikroba uji E. coli 26
4 Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi,
dan isolat pada mikroba uji S. aureus 27
5 Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi,
dan isolat pada mikroba uji C. albicans 28
6 Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi,
dan isolat pada mikroba uji F. oxysporum 29
7 Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi,
DAFTAR GAMBAR
No. Judul Halaman
1 Isolat bakteri yang menunjukkan kemampuan
menghambat bakteri lain 19
2 Asai antagonis antara isolat bakteri terhadap (A) E. coli
dan (B) C. albicans 22
3 Asai ekstrak metanol terhadap S. aureus (A) dan
terhadap G. boninense (B) 25
4 Daya hambat ekstrak isolat potensial terhadap
pertumbuhan mikroba uji E. coli 26
5 Daya hambat ekstrak isolat potensial terhadap
pertumbuhan mikroba uji S. aureus 27
6 Daya hambat ekstrak isolat potensial terhadap
pertumbuhan mikroba uji C. albicans 28
7 Daya hambat ekstrak isolat potensial terhadap
pertumbuhan mikroba uji F. oxysporum 30
8 Daya hambat ekstrak isolat potensial terhadap
pertumbuhan mikroba uji G. boninense 31
9 Hifa normal F. oxysporum (A1), hifa abnormal
F. oxysporum memendek (A2), hifa normal G. boninense
DAFTAR LAMPIRAN
No Judul Halaman
1 Standar zona hambat antibiotik menurut CLSI 41
2 Analisis keragaman pengaruh pelarut, konsentrasi, dan 41 isolat terhadap zona hambat pada mikroba uji E. coli
3 Post Hoc Test pelarut untuk mikroba uji E. coli 42 4 Post Hoc Test konsentrasi untuk mikroba uji E. coli 42 5 Post Hoc Test isolat untuk mikroba uji E. coli 42 6 Analisis keragaman pengaruh pelarut, konsentrasi, dan
isolat terhadap zona hambat pada mikroba uji S. aureus 43 7 Post Hoc Test pelarut untuk mikroba uji S. aureus 43 8 Post Hoc Test konsentrasi untuk mikroba uji S. aureus 44 9 Post Hoc Test isolat untuk mikroba uji S. aureus 44 10 Analisis keragaman pengaruh pelarut, konsentrasi, dan
isolat terhadap zona hambat pada mikroba uji C. albicans 45 11 Post Hoc Test pelarut untuk mikroba uji C. albicans 45 12 Post Hoc Test konsentrasi untuk mikroba uji C. albicans 46 13 Post Hoc Test isolat untuk mikroba uji C. albicans 46 14 Analisis keragaman pengaruh pelarut, konsentrasi, dan
isolat terhadap zona hambat pada mikroba uji F. oxysporum 47 15 Post Hoc Test pelarut untuk mikroba uji F. oxysporum 47 16 Post Hoc Test konsentrasi untuk mikroba uji F. oxysporum 48 17 Post Hoc Test isolat untuk mikroba uji F. oxysporum 48 18 Analisis keragaman pengaruh pelarut, konsentrasi, dan
19 Post Hoc Test pelarut untuk mikroba uji G. boninense 53 20 Post Hoc Test konsentrasi untuk mikroba uji G. boninense 54 21 Post Hoc Test isolate untuk mikroba uji G. boninense 54 22 Hasil uji antagonis ekstrak isolat terhadap mikroba uji
dalam bentuk zona hambat pertumbuhan(mm) 55
23 Alur kerja isolasi bakteri penghasil antimikroba dari
sampel tanah 56
24 Alur kerja ekstraksi isolat bakteri penghasil antimikroba
menggunakan pelarut metanol, n-heksana, dan etil asetat 57 25 Alur kerja pembuatan larutan standar McFarland 108 cfu/ml 58 26 Alur kerja uji daya hambat isolat potensial terhadap
mikroba patogen 59
27 Alur kerja uji daya hambat ekstrak isolat potensial
terhadap bakteri pathogen 60
28 Alur kerja uji daya hambat ekstrak isolat potensial
Isolasi Bakteri Penghasil Antimikroba dari Sampel Tanah Taman Wisata Alam Sibolangit dan Kemampuannya Menghambat Pertumbuhan Mikroba Patogen
ABSTRAK
Telah dilakukan penelitian tentang isolasi bakteri tanah yang berpotensi menghasilkan antimikroba dari Taman Wisata Alam Sibolangit, Sumatera Utara. Media nutrient agar digunakan untuk isolasi awal. Dua puluh sembilan isolat yang diperoleh memiliki kemampuan yang berbeda terhadap mikroba uji. Metanol, n-heksana, dan etil asetat digunakan sebagai pelarut untuk memperoleh ekstrak metabolit. Pengujian antagonis ekstrak tiga isolat potensial terpilih dilakukan dengan metode difusi cakram terhadap mikroba uji Escherichia coli, Staphylococcus aureus,
Candida albicans, Fusarium oxysporum, dan Ganoderma boninense. Hasil pengujian secara in vitro menunjukkan bahwa ekstrak metanol dan n-heksana isolat S3T33-3 aktif terhadap E. coli, C. albicans, dan G. boninense, sedangkan terhadap S. aureus
hanya metanol. Ekstrak menggunakan pelarut metanol dan n-heksana isolat S3T32-3 menunjukkan aktivitas yang sama terhadap F. oxysporum. Ekstrak etil asetat isolat S3T33-3 menunjukkan aktifitas yang rendah terhadap G. boninense.
Kata kunci: aktivitas antimikroba, Escherichia coli, Staphylococcus aureus,
Isolation of Antimicrobial Producing Bacteria from Taman Wisata Alam Sibolangit Soil and Their Potentials to Inhibit Pathogenic Microbes
ABSTRACT
A study on isolation and assay of antimicrobial activity of soil bacterial isolates of TWA Sibolangit, North Sumatra has been done. Nutrient agar was used in microbial isolation. Twenty-nine isolates showed different potential in inhibiting pathogens growth. Methanol, n-hexane, and ethyl acetate extraction method was utilised to get antimicrobial metabolites. Antagonistic test of the three selected potential extract was done using disc diffusion methods against Escherichia coli,
Staphylococcus aureus, Candida albicans, Fusarium oxysporum, and Ganoderma boninense. In vitro test of the extract showed that methanol and n-hexane extract of S3T32-3 were active against E. coli, C. albicans, and G. boninense, but methanol to inhibit S. aureus. Methanol and n-hexane extract of S3T32-3 showed the same activity against F. oxysporum. Ethyl acetate S3T33-3 extract showed the lowest activity against G. boninense.
Key words: antimicrobial activity, Escherichia coli, Staphylococcus aureus,
BAB I PENDAHULUAN
1.1. Latar Belakang
Penyakit infeksi merupakan salah satu masalah kesehatan yang paling utama di negara-negara berkembang termasuk Indonesia. Berdasarkan Survey Kesehatan Rumah Tangga tahun 2007, penyebab utama kematian antara lain: 28,1 % disebabkan oleh penyakit infeksi dan parasit, 18,9 % disebabkan oleh penyakit vaskuler, dan 15,7 % disebabkan oleh penyakit pernafasan (Depkes 1997). Kenyataan ini menunjukkan bahwa masih tingginya penyakit karena infeksi di Indonesia. Untuk mengatasi masalah ini obat anti infeksi yang berpotensi dan dapat diterima oleh kalangan sosial rendah dan menengah harus segera ditemukan. Hal inilah yang mendorong dan mendasari pencarian sumber obat-obatan alami yang murah dan memiliki potensi aktivitas antimikroba (Kumala & Siswanto 2007).
tetrasiklin dan rifamisin. Bahkan ada yang telah dibuat secara kimia penuh misalnya kloramfenikol dan pirolnitrin (Suwandi 1989).
Mikroba penghasil antibiotik meliputi golongan bakteri, aktinomisetes, fungi, dan beberapa mikroba lainnya. Kira-kira 70% antibiotik dihasilkan oleh aktinomisetes, 20% fungi, dan 10% oleh bakteri. Genus Streptomyces merupakan kelompok penghasil antibiotik yang paling besar jumlahnya. Bakteri juga banyak yang menghasilkan antibiotik terutama Bacillus. Namun kebanyakan antibiotik yang dihasilkan bakteri adalah polipeptida yang terbukti kurang stabil, toksik dan sukar dimurnikan. Antibiotik yang dihasilkan fungi pada umumnya juga toksik, kecuali grup penisilin (Suwandi 1989). Dewasa ini pencarian jenis antibiotik yang ampuh terhadap bakteri patogen yang resisten terhadap banyak obat-obatan merupakan penelitian yang sangat menarik di bidang antibiotik, di mana ditemukan produk-produk alami dengan struktur novel yang mempunyai aktivitas biologi yang sangat berguna (Ceylan et al. 2008).
Sumber mikroba penghasil antibiotik antara lain berasal dari tanah, air laut, lumpur, kompos, isi rumen, limbah domestik, bahan makanan busuk dan lain-lain. Tanah merupakan habitat alami bagi mikroba dan produk-produk antimikrobanya (Dancer 2004). Namun kebanyakan mikroba penghasil antibiotik diperoleh dari mikroba tanah terutama Streptomyces dan jamur. Tanah juga merupakan tempat interaksi biologis yang paling dinamis dan mempunyai lima komponen utama yaitu mineral, air, udara, zat organik dan organisme hidup dalam tanah antara lain bakteri, aktinomisetes, fungi, algae, dan protozoa (Setiadi 1989).
mikroba. Untuk memperoleh antibiotik baru, banyak dilakukan pencarian galur penghasil antibiotik terutama Streptomyces dari habitat tanah (Hung et al. 1965). Selain sumber alam juga banyak dilakukan variabilitas genetik intra-strain sebagai sumber penghasil antibiotik baru. Oleh karena itu, isolasi bakteri penghasil antibiotik dari sampel tanah perlu dilakukan karena berguna dalam mengetahui biodiversitas mikroba di alam.
1.2. Permasalahan
a. Apakah bakteri tanah yang berpotensi menghasilkan antimikroba dapat menghambat pertumbuhan mikroba patogen.
b. Apakah jenis pelarut ekstraksi berpengaruh terhadap aktivitas antimikroba. c. Apakah konsentrasi ekstrak berpengaruh terhadap aktivitas antimikroba pada
tiap isolat dan jenis pelarut.
1.3. Tujuan Penelitian
a. Mengetahui kemampuan bakteri tanah yang berpotensi menghasilkan antimikroba dalam menghambat pertumbuhan mikroba patogen.
b. Untuk mengetahui pelarut yang terbaik dalam ekstraksi senyawa antimikroba. c. Untuk mengetahui konsentrasi ekstrak terbaik dalam menghambat
pertumbuhan mikroba patogen dari tiap isolat dan pelarut.
1.4. Hipotesis Penelitian
a. Pada sampel tanah yang berasal dari Taman Wisata Alam Sibolangit terdapat isolat bakteri yang berpotensi menghasilkan senyawa antimikroba yang dapat menghambat pertumbuhan mikroba mikroba patogen.
c. Semakin tinggi konsentrasi yang digunakan semakin tinggi aktivitas antimikroba.
d. Jenis pelarut berpengaruh terhadap aktivitas antimikroba yang dihasilkan. e. Sifat morfologi dan fisiologi mikroba uji yang digunakan berpengaruh terhadap
aktivitas antimikroba yang dihasilkan.
1.5. Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1. Antibiotik
Mikroba merupakan kelompok yang paling tinggi keragamannya di bumi ini. Namun sering kali diabaikan karena pengalaman yang buruk tentang mikroba selama ini. Padahal tanpa disadari mikroba melakukan banyak hal berguna bagi hidup, seperti keterlibatannya dalam siklus biogeokimia, penyedia senyawa tertentu di atmosfer dan tanah. Salah satu nilai penting dari mikroba adalah kemampuannya menghasilkan metabolit sekunder seperti antimikroba. Banyak teknik yang dapat dilakukan untuk mendeteksi anggota mikroba yang memproduksi metabolit yang bernilai ini. Dewasa ini pencarian mikroba dengan kemampuan menghasilkan asam amino, antimikroba (antibiotik), dan metabolit-metabolit lainnya gencar dilakukan (Meyers et al. 1968).
Antibiotik merupakan substansi yang dihasilkan oleh suatu organisme dan dapat menghambat pertumbuhan organisme lain. Antibiotik juga dimanfaatkan untuk bertahan hidup dan menghadapi organisme lain yang mengancam keberadaannya. Antibiotik ini menunjukkan aktivitas toksisitas selektif dan mungkin berbeda pada tiap organisme. Sebagian besar antibiotik yang digunakan dalam beberapa dekade terakhir murni berasal dari mikroba (Pathania & Brown 2008).
bersifat membinasakan mikroba lain. Antibiotik tertentu aktivitasnya dapat ditingkatkan dari bakteriostatik menjadi bakterisida bila konsentrasinya ditingkatkan (Suwandi 1992).
Akhir-akhir ini banyak metode dan peralatan yang tersedia dapat digunakan untuk mencari novel antibakteri. Aspek sumber penghasil gen dan tingkat gen merupakan bagian upaya yang secara terus menerus untuk memperoleh informasi baru terhadap pemahaman tentang patogen. Perangkat gen dapat membantu memilih target dan memahami tentang resistensi bakteri. Di samping itu, ketersediaan produk alami yang mencukupi menyediakan kesempatan yang luas untuk menjadikannya sebagai bahan baru, yaitu sebagai bahan kemoterapi (Michel-Briand 2007). Banyak pendekatan-pendekatan yang telah dilakukan dalam penemuan bahan antibakteri baru, salah satunya berdasarkan pendekatan genetik atau non-genetik. Kedua metode ini memiliki kelebihan dan kekurangan masing-masing. Bagaimanapun caranya kedua metode ini dilakukan yang terpenting adalah keberhasilannya dalam menemukan antibakteri baru yang efektif untuk jangka waktu yang lama (Singh 2009).
2.2. Mekanisme Kerja Antibiotik
Penghambatan pada beberapa reaksi dapat terjadi secara langsung yaitu antibiotik langsung memblokir beberapa reaksi tersebut, namun masing-masing reaksi memerlukan konsentrasi antibiotik yang berbeda. Ketergantungan pada konsentrasi ini menggambarkan perbedaan kepekaan reaksi tersebut terhadap antibiotik. Selain itu, pengaruh antibiotik juga dapat terjadi secara tidak langsung yaitu berupa pengaruh sekunder akibat gangguan pada reaksi lain sebagai pengaruh primer (Suwandi 1992).
Antibiotik tertentu dapat menghambat beberapa reaksi. Reaksi tersebut ada yang penting untuk pertumbuhan dan ada yang kurang penting. Toksisitas selektif rendah kurang dapat diterima, karena dapat mengganggu proses penting sel inang. Banyak proses penting pada bakteri yang dipengaruhi antibiotik mempunyai kemiripan dengan proses penting pada sel manusia seperti sintesis protein, sehingga antibiotik tersebut juga dapat mengganggu proses pada sel manusia (Snow 1977).
Antibiotik yang baik harus memiliki aktivitas antimikroba yang efektif dan selektif serta memiliki aktivitas bakterisida. Sifat toksisitas selektif diperlukan agar aktivitas gangguan pada mikroba penginfeksi lebih besar daripada gangguan pada sel inang. Derajat toksisitas selektif tergantung pada struktur yang dimiliki sel bakteri dan sel manusia, misalnya dinding sel bakteri yang tidak dimiliki oleh sel manusia. Antibiotik dengan mekanisme kegiatan pada dinding sel bakteri mempunyai toksisitas selektif relatif tinggi (Dancer 2004).
pengaruh primer atau sekunder (Suwandi 1992). Dalam beberapa hal mekanisme kegiatan antibiotik sulit diterangkan, karena beberapa alasan, seperti:
1. Kesulitan menetapkan gangguan tersebut sebagai pengaruh sekunder atau primer.
2. Kebanyakan antibiotik merupakan substansi kimia yang rumit dan sering tidak mungkin disintesis secara kimia, sehingga sulit membuat antibiotik bertanda radioaktif.
3. Reaksi esensial yang diblokir, mungkin belum diketahui dengan jelas.
4. Metabolisme organisme berbeda satu sama lain walaupun pada prinsipnya sama, sehingga mekanisme kegiatan pada satu organisme, mungkin bukan cara antibiotik tersebut menghambat pertumbuhan organisme lainnya.
2.3. Sumber Antibiotik
Banyak antibiotik yang sudah ditemukan dan digunakan sebagai terapi utama pengobatan infeksi yang disebabkan mikroba (Pelaez 2006). Penyakit infeksi demikian berbahaya dan dapat menimbulkan kematian. Sebagai contoh penyakit infeksi yang disebabkan oleh Streptococcus pneumoniae dapat membunuh 1,5 juta orang per tahunnya (Fernández-Tornero et al. 2005).
Jenis mikroba gram positif yang ada sekarang ini diisolasi dari penderita infeksi seperti dari jenis-jenis Staphylococcus, Streptococcus pneumoniae, dan
masalah ini dibutuhkan antibiotik baru yang memiliki mekanisme aksi yang unik (Jorgensen et al. 1997) yang tersedia di alam melalui mikroba seperti jamur dan bakteri (Pathania & Brown 2008).
Organisme penghasil antibiotik telah diisolasi dari berbagai sumber misalnya kompos, sayuran busuk, kolam atau mungkin bahan lain. Sumber umum isolasi organisme ini adalah tanah. Banyak bakteri seperti Pseudomonas (Burkholder et al.
1996; Schnider et al. 1995; Thomashow et al. 1990), Nocardia (Greenstein 1981),
Kibdelosporangium aridum (Grappel et al. 1985), Actinoplanes friuliensis (Müller et al. 2007), dan Roseobacter clade-affiliated species (Brinkhoff et al. 2004) dapat menghasilkan antibiotik. Penicillium dan Fusarium merupakan contoh genus jamur yang diketahui dapat menghasilkan antibiotik. Diantara semua mikroba penghasil antibiotik ini, bakteri aktinomisetes Streptomyces merupakan mikroba penting karena menghasilkan banyak sekali jenis antibiotik, salah satunya Streptomyces erythreus
yang menghasilkan antibiotik ABBOTT 29119 (Hung et al. 1965).
Streptomycetes secara morfologi merupakan mikroba gram positif yang banyak ditemukan pada tanah yang alami (Paustian 1999). Streptomyces
dikelompokkan ke dalam kelompok bakteri karena struktur sel yang tidak memiliki membran inti dan mitokondria (Di Salvo 2002), serta struktur dinding selnya yang mengandung peptidoglikan (Paustian 1999).
dari jenis mikroba kelompok Aktinomycetes lain yang berpotensi menghasilkan antibiotik baru yang dapat digunakan sebagai terapi infeksi mikroba patogen (Ridwan et al. 2005).
2.4. Isolasi Bakteri Tanah
Mikroba di lingkungan sangat beragam dan memiliki banyak aktivitas metabolisme dan produk-produk yang dapat diaplikasikan dibidang industri. Namun, >99% mikroba di lingkungan tersebut tidak dapat dikulturkan di bawah kondisi laboratorium, sehingga banyak potensi-potensi yang belum dapat dimanfaatkan (Singh 2009).
Mikroba tanah merupakan bagian terpenting dari kehidupan di dunia, karena merupakan bagian dari sistem biologi dan kimia, serta kehidupan flora, fauna dan mikroba itu sendiri. Secara fungsional bahan organik dan anorganik yang dilepas tanaman ke dalam lingkungan berguna untuk keberlangsungan hidup mikroba tanah (Setiadi 1989). Mikroba di tanah secara rutin dapat menghasilkan antibiotik melalui suatu proses kimia yang disebut metabolisme sekunder. Dipercaya bahwa produksi antibiotik oleh organisme yang ada di tanah memperbesar kemungkinan mereka untuk bersaing dengan mikroba lain di tanah (D’Costa et al. 2006). Persaingan yng terjadi boleh jadi dalam bentuk persaingan terhadap ruang atau makanan (Kotan et al. 2009)
akar dan metabolisme mikroba dalam tanah berperan dalam membentuk tekstur dan kesuburannya (Rao 1994).
Ada beberapa teknik dalam mengisolasi mikroba dari sumbernya. Salah satu teknik yang paling sederhana adalah teknik cawan sebar. Teknik ini digunakan untuk mendapatkan mikroba penghasil antibiotik tanpa melihat jenis antibiotik yang dihasilkan oleh mikroba tersebut. Prinsip dari teknik ini adalah mengencerkan sampel tanah atau sumber mikroba lain kemudian menyebarkan sebagian dari supensi tanah tersebut di atas permukaan agar padat dan diinkubasi selama waktu dan suhu yang telah ditentukan. Koloni yang merupakan penghasil antibiotik akan menunjukkan adanya daerah hambat tanpa perumbuhan mikroba di sekitar koloni mikroba tersebut yang menandakan aktivitas antimikroba yang dihasilkannya (Davis & Blevins 1999). Di samping itu baru-baru ini pendekatan metagenom telah digunakan dalam memperoleh produk novel dari mikroba yang tidak dapat dikulturkan, yang selanjutnya dapat diperbaiki melalui aplikasi nanoteknologi (Singh 2009; Pathania & Brown 2008), juga peningkatan strain-strain yang ada dengan sukses melalui mutagenesis dan modifikasi yang bersifat nutrisional (Demain 2006)
2.5. Mikroba Patogen Uji
Banyak penelitian-penelitian yang bergerak di bidang antimikroba menggunakan mikroba uji seperti E. coli mewakili bakteri Gram-negatif, S. aureus atau S. mutans
mewakili bakteri Gram-positif (Ceylan et al. 2008; El-Mahmood et al. 2010), serta
C. albicans mewakili kamir (Nanjwade et al. 2010), Fusarium sp. dan Ganoderma
sp. mewakili jamur berfilamen atau kapang. Mikroba tersebut bersifat patogen terhadap berbagai macam inang.
bentuk filamen yang panjang, bersifat aerob atau anaerob fakultatif jarang terdapat kapsul, terjadi pengerakan pada sebagian strain E. coli. Bakteri E. coli merupakan kelompok Enterobacteriaceae yang hidup di dalam saluran pencernaan manusia sebagai penghuni usus (enteron) dan bersifat patogen (Ajizah et al. 2007).
Staphyloccos aureus merupakan bakteri patogen utama pada manusia yang menyebabkan berbagai penyakit secara luas yang berhubungan dengan toxic shock syndrome sebagai akibat dari keracunan pangan. Bakteri ini dapat membuat enterotoksin yang dapat menyebabkan keracunan makanan (Ajizah et al. 2007).
Candida albicans merupakan jamur dimorfik karena kemampuannya untuk tumbuh dalam dua bentuk yang berbeda yaitu sebagai sel tunas yang akan berkembang menjadi blastospora dan menghasilkan kecambah yang akan membentuk hifa semu. C. albicans dapat tumbuh pada variasi pH yang luas, tetapi pertumbuhannya akan lebih baik pada pH antara 4,5-6,5. Pada manusia, C. albicans
sering ditemukan di dalam mulut, feses, kulit dan di bawah kuku orang sehat. C. albicans juga dapat membentuk biofilm pada permukaan peralatan medis yang dapat menjadi penyebab infeksi lokal dan sistemik (Harriott & Noverr 2009).
Fusarium merupakan genus cendawan berfilamen yang banyak ditemukan pada tanaman dan tanah. Patogen ini dapat menyebabkan damping-off di persemaian dan tanaman dewasa, terutama saat tanaman memasuki fase generatif. Golongan
spesies Fusarium dapat menyebabkan kontaminasi oleh adanya mikotoksin yang dapat mempengaruhi kesehatan manusia dan hewan (Desjardins et al. 1999).
Ganoderma dikenal sebagai genus jamur dari kelompok Basidiomycetes yang dapat menyebabkan busuk putih. Namun belakangan ini Ganoderma telah banyak digunakan untuk tujuan pengobatan terutama di China, Jepang, dan Korea.
Ganoderma juga merupakan produsen penghasil mikokimia novel dalam jumlah yang besar (Paterson 2006).
2.6. Ekstraksi Isolat Potensial dengan Pelarut yang Berbeda
Ekstrak merupakan hasil penyaringan yang berbentuk kering, kental atau cair yang diperoleh dengan metode tertentu. Ekstraksi merupakan pengikatan senyawa kimia tertentu oleh pelarut tertentu. Ada beberapa macam metode ekstraksi diantaranya maserasi, perkolasi, dan sokletasi. Untuk memperoleh hasil yang kental dapat dilakukan penguapan dengan menggunakan evaporator putar.
2.7. Taman Wisata Alam Sibolangit
BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Mei sampai Desember 2010 di Laboratorium Mikrobiologi dan Laboratorium Penelitian, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: alat-alat sterilisasi, cawan petri, tabung reaksi, rak tabung reaksi, gelas beaker, gelas ukur, gelas erlenmeyer, pipet serologi, karet penghisap, spatula, hockey stick, jarum ose, mikroskop, jangka sorong, rotary evaporator, dan sentrifuse.
Bahan-bahan yang digunakan dalam penelitian ini antara lain: sampel tanah dari Taman Wisata Alam Sibolangit yang diambil dari 41 titik di tiga stasiun pengambilan sampel, media Nutrient Agar (NA), Nutrient Broth (NB), Potato Dextrose Agar (PDA), Mueller Hinton Agar (MHA), Mueller Hinton Broth (MHB), aquadest, alkohol 70%, zat warna pewarnaan Gram, media-media uji biokimia (TSIA, TCA, SIM, glukosa, H2O2 3%, gelatin), aluminium foil, ketokonazol, cakram kertas kosong dan cakram kloramfenikol 30 µg (Oxoid), dimetilsulfoksida (DMSO), standar McFarland 0,5.
Universitas Sumatera Utara, dan Ganoderma boninense yang diperoleh dari Pusat Penelitian Kelapa Sawit (PPKS) Marihat Siantar. Isolat bakteri ditumbuhkan dalam media NA dan diikubasi pada suhu 37 ± 1º C selama 24 jam. Isolat jamur
c. Stasiun III dari 16 titik pada ketinggian 897 m dpl, dengan posisi 03°16'19,2" LU dan 0,98°32'0,42" BT
3.3. Isolasi Bakteri Penghasil Antimikroba
Sebanyak 1 g sampel tanah ditambah aquadest steril hingga 10 ml, kemudian divorteks. Sebanyak 0,1 ml campuran suspensi diambil dan disebarkan di atas permukaan media NA dalam cawan petri. Cawan petri diinkubasi selama 24 sampai 48 jam pada suhu 37°C. Isolat yang memiliki kemampuan menghambat mikroba lain ditunjukkan dengan zona hambat di sekitar koloninya. Isolat ini kemudian ditumbuhkan kembali pada media yang sama sampai diperoleh isolat murni.
3.4. Karakterisasi Isolat Penghasil Antimikroba
motilitas dengan SIM, uji gelatin dengan nutrien gelatin, dan uji katalase dengan larutan H2O2 3%.
3.5. Ekstraksi Bahan Antimikroba dengan Pelarut
Produksi dan ekstraksi metabolit sekunder bakteri yang memiliki aktivitas antimikroba dilakukan berdasarkan metode yang pernah dilakukan oleh Nofiani et al
(2009) yang dimodifikasi. Bakteri yang memiliki aktivitas antimikroba digoreskan pada media padat NA dan diinkubasi selama 5-6 hari. Media padat selanjutnya dipotong kecil-kecil dan direndam dengan metanol dalam erlenmeyer selama 72 jam dan dibungkus dengan kertas alumunium untuk menghindari kerusakan karena cahaya. Maserat diambil dengan cara disaring. Perendaman dilakukan sebanyak 3 kali. Semua maserat yang terkumpul disentrifugasi pada kecepatan 3000 rpm selama 15 menit. Supernatan dipekatkan dengan menggunakan evaporator putar dengan suhu tidak lebih dari 50 ± 2ºC untuk memperoleh ekstrak yang siap untuk digunakan. Metode yang sama dilakukan terhadap pelarut etil asetat dan n-heksana.
3.6. Uji Daya Hambat Isolat Potensial dan Ekstrak Berbagai Pelarut Terhadap Mikroba Patogen
semua suspensi hasil ekstraksi menggunakan pelarut metanol, etil asetat dan n-heksana.
Konsentrasi ekstrak dari masing-masing pelarut yang digunakan yaitu 40, 60, 80, dan 100% dengan DMSO sebagai larutan pengencer sekaligus digunakan sebagai kontrol (-) (Ahameethunisa & Hooper 2010), kontrol (+) untuk bakteri digunakan cakram kertas kloramfenikol 30 µg, sedangkan untuk jamur digunakan larutan ketokonazol 20 µg yang diperoleh dari pengenceran ketokonazol 200 mg dalam 200 ml etanol. Jamur uji sudah ditanam terlebih dulu pada media PDA dan diinkubasi selama 3-4 hari. Masing-masing perlakuan dilakukan dengan 3 kali pengulangan.
3.7. Rancangan Penelitian dan Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi Mikroba Penghasil Antimikroba
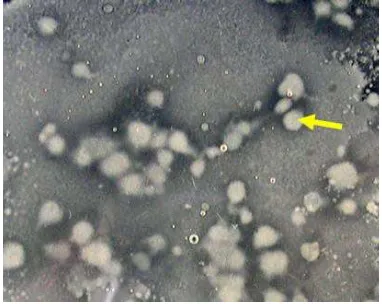
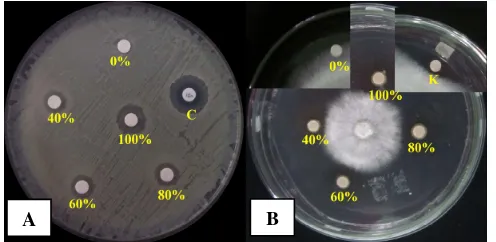
Dari hasil isolasi yang dilakukan terhadap sampel tanah diperoleh 29 isolat bakteri yang memiliki potensi menghambat pertumbuhan mikroba lain. Kemampuan menghambat mikroba lain (antimikroba) ditunjukkan dengan terhambatnya pertumbuhan mikroba lain di sekitar koloni yang merupakan suatu interaksi anatgonis di antara mikroorganisme yang terdapat pada suatu lingkungan, seperti terlihat pada Gambar 1.
Gambar 1. Isolat bakteri (tanda panah) yang menunjukkan kemampuan menghambat bakteri lain
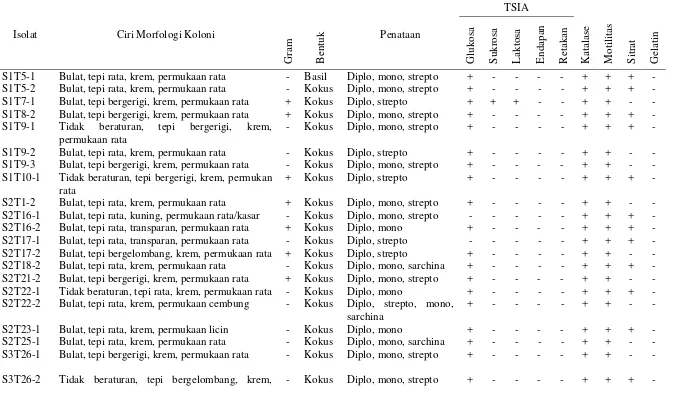
Tabel 1. Karakterisasi isolat bakteri yang menghasilkan antimikroba
S1T9-1 Tidak beraturan, tepi bergerigi, krem, permukaan rata
- Kokus Diplo, mono, strepto + - - - - + + + -
S1T9-2 Bulat, tepi rata, krem, permukaan rata - Kokus Diplo, strepto + - - - - + + - -
S1T9-3 Bulat, tepi bergerigi, krem, permukaan rata - Kokus Diplo, mono, strepto + - - - - + + - -
S1T10-1 Tidak beraturan, tepi bergerigi, krem, permukan rata
permukaan rata
S3T27-1 Oval, tepi rata, krem, permukaan rata - Kokus Strepto, mono + - - - - + + - -
S3T31-2 Bulat, tepi rata, krem, permukaan cembung + Kokus Strepto, mono,
sarchina
+ + + - - + + - -
S3T32-1 Bulat, tepi bergerigi, krem, permukaan rata + Kokus Diplo, mono, sarchina + - - - - + + - -
S3T32-3 Bulat, tepi rata, krem, permukaan rata - Kokus Strepto, sarchina + - - - - + + - -
S3T32-4 Tidak beraturan, tepi bergelombang, krem, permukaan rata
+ Kokus Diplo, strepto, mono, sarchina
+ - - - - + + - -
S3T33-1 Bulat, tepi rata, krem, permukaan rata + Kokus Diplo, sarchina + - - - - + + - -
S3T33-2 Bulat, tepi rata, krem, permukaan rata + Basil Diplo, strepto + - - - - + + - -
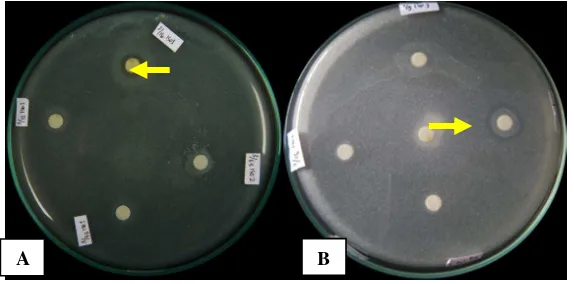
Setelah diperoleh isolat bakteri yang diketahui mampu menghambat mikroba lain pada tahapan isolasi, dilakukan uji antagonis terhadap mikroba uji untuk melihat kemampuan menghambat pertumbuhan mikroba uji (Gambar 2). Pengujian ini dilakukan terhadap 3 jenis mikroba patogen, yaitu 2 jenis bakteri, E. coli dan S. mutans, dan kamir C. albicans. Dasar pemilihan ketiga jenis mikroba uji ini adalah mewakili masing-masing jenis mikroorganisme yaitu mewakili gram negatif, gram positif, dan khamir dari kelompok jamur. Hasil uji menunjukkan bahwa beberapa isolat hanya dapat menghambat satu jenis mikroba, dan beberapa isolat lain dapat menghambat lebih dari satu jenis mikroba uji. Mikroba khususnya bakteri memiliki kemampuan menghambat pertumbuhan mikroba lain disebabkan karena bakteri dapat menghasilkan senyawa metabolit sekunder seperti senyawa antimikroba, antibiotik (Wright et al. 2001), enzim pelisis (Zhang & Yuen 2000; Kim et al. 2008), antivirus, antitumor, antiparasit, obat immunosupresif, atau protein penghambat lain (Bérdy 2005; Borodina et al. 2005; Lestari 2001; Price et al. 1999). Pembentukan senyawa metabolit sekunder ini dikode oleh sejumlah gen yang terdapat pada DNA kromosom atau DNA plasmid (Demain 1998).
Gambar 2. Asai antagonis antara isolat bakteri terhadap (A) E. coli dan (B) C. albicans
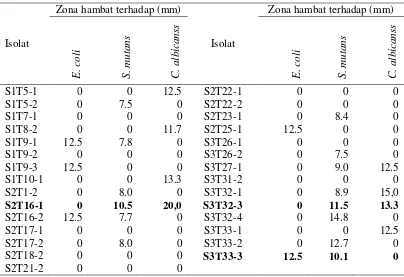
Sifat antagonis yang ditunjukkan oleh masing-masing isolat potensial terhadap mikroba uji menunjukkan hasil yang bervariasi (Tabel 2). Lima isolat menunjukkan kemampuan menghambat E. coli, 14 isolat mampu menghambat pertumbuhan S.
mutans, 8 isolat menghambat C. albicans, sedangkan 9 isolat tidak menunjukkan hambatan terhadap ketiga jenis mikroba uji.
Tabel 2. Hasil uji antagonis isolat terhadap mikroba uji dalam bentuk zona hambat
untuk merespon perubahan lingkungan di sekitarnya. Adanya komunikasi antar sel bakteri sangat penting terutama dalam menghadapi kondisi lingkungan sekitar. Salah satu bentuk respon yang ditunjukkan bakteri adalah membentuk senyawa metabolit sekunder sebagai bentuk pertahanan terhadap serangan mikroba lain (Nofiani et al. 2009).
Beberapa isolat menunjukkan potensi yang cukup besar dalam menghambat pertumbuhan. Isolat S2T16-1 mampu menghambat pertumbuhan C. albicans dengan diameter zona hambat sebesar 20 mm, S3T32-4 mampu menghambat pertumbuhan S. mutans dengan diameter zona hambat sebesar 14,8 mm, dan S3T33-3 mampu menghambat E. coli dan S. mutans dengan diameter zona hambat masing-masing sebesar 12,5 mm dan 10,1 mm. Berdasarkan kemampuan ini diperkirakan bahwa bahan antimikroba yang dihasilkan oleh masing-masing isolat berbeda. Antibiosis dan antimikroba merupakan fenomena yang umum dijumpai pada bakteri Pseudomonas
spp., Bacillus spp., Streptomyces spp., dan jamur Trichoderma spp. (Alabouvette et al. 2006). Antimikroba dihasilkan jika terdapat inisiasi misalnya oleh keterbatasan nutrisi dan pengaruh organisme patogen lain yang mengancam di sekitarnya (Hosoya et al. 1998).
4.2. Asai Ekstrak dengan Pelarut Metanol, n-heksana dan Etil Asetat
tersebut menunjukkan hasil yang bervariasi dalam menghambat pertumbuhan mikroba uji (Gambar 3).
Gambar 3. Asai ekstrak metanol terhadap S. aureus (A) dan terhadap G. boninense
(B). (C: kloramfenikol; K: ketokonazol)
Hasil uji ekstrak metanol, etil asetat, dan n-heksana isolat-isolat potensial terhadap mikroba uji dapat dilihat pada Lampiran 19. Ekstrak metanol isolat S2T16-1 tidak menunjukkan kemampuan dalam menghambat mikroba uji E. coli dan S. aureus. Namun ekstrak dari isolat ini menunjukkan kemampuan dalam menghambat pertumbuhan C. albicans, Fusarium sp dan Ganoderma sp dengan zona hambat terbesar berturut-turut yaitu 10 mm, 1,53 mm dan 9, 40 mm pada konsentrasi 100%.
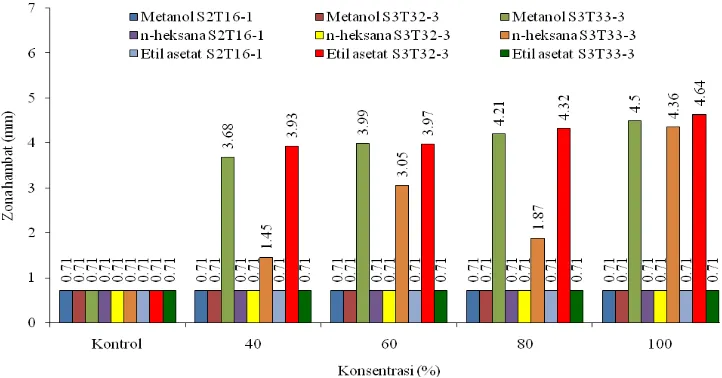
Dari hasil pengujian terhadap perlakuan pelarut, isolat, dan konsentrasi dapat dilihat bahwa dari ketiga jenis ekstrak, ekstrak etil asetat isolat S3T32-3 menunjukkan potensi menghambat paling besar terhadap E. coli pada tiap konsentrasidiikuti dengan ekstrak metanol isolat S3T33-3 dan n-heksana isolat S3T33-3. Zona hambat yang dihasilkan terbesar diperoleh pada ekstrak etil asetat isolat S3T32-3 (4,64 mm) pada konsentrasi 100%, metanol isolat S3T33-3 (4,50 mm) pada konsentrasi 100%, dan n-heksana isolat S3T33-3 (4,36 mm) pada konsentrasi 100% (Tabel 3. dan Gambar 4.).
Tabel 3. Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi, dan isolat pada mikroba uji E. coli
Metanol n-heksana Etil asetat
Konsentrasi
Keterangan: Data merupakan hasil transformasi menggunakan rumus √zona hambat + ½. Angka yang
diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 0.05
Gambar 4. Daya hambat ekstrak isolat potensial terhadap pertumbuhan mikroba uji E. coli
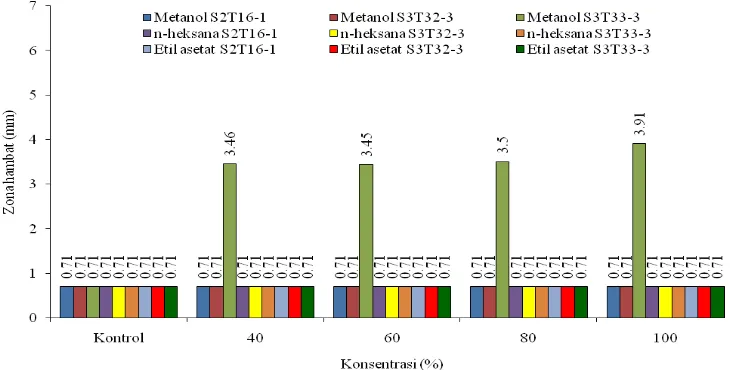
semua isolat tidak menunjukkan hambatan, sedangkan metanol isolat S2T16-1 dan S3T32-3 tidak menunjukkan hambatan (Tabel 4. dan Gambar 5.).
Tabel 4. Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi, dan isolat pada mikroba uji S. aureus
Metanol n-heksana Etil asetat
Konsentrasi
Keterangan: Data merupakan hasil transformasi menggunakan rumus √zona hambat + ½. Angka yang
diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 0.05
Gambar 5. Daya hambat ekstrak isolat potensial terhadap pertumbuhan mikroba uji S. aureus
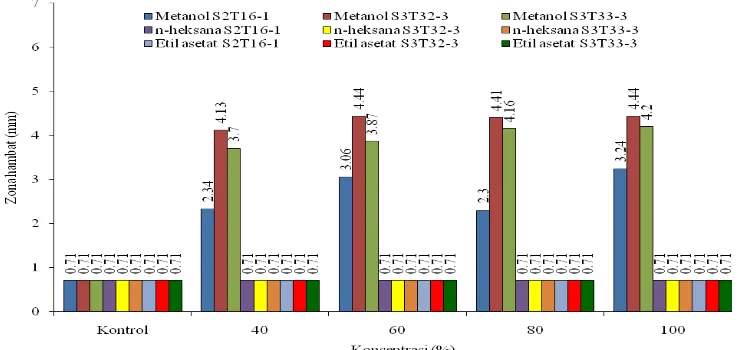
C.albicans (4,44 mm) pada tiap konsentrasi diikuti dengan metanol isolat S3T33-3 (4,20 mm) dan isolat S2T16-1 (3,24 mm) (Tabel 5. dan Gambar 6.).
Tabel 5. Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi, dan isolat pada mikroba uji C. albicans
Metanol n-heksana Etil asetat
Konsentrasi
Keterangan: Data merupakan hasil transformasi menggunakan rumus √zona hambat + ½. Angka yang
diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 0.05
Gambar 6. Daya hambat ekstrak isolat potensial terhadap pertumbuhan mikroba uji C. albicans
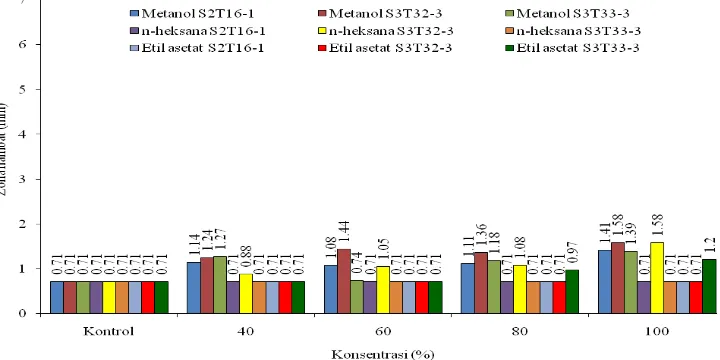
zona hambat terbesar diperoleh pada ekstrak methanol dan n-heksana isolat S3T32-3 (1,58 mm) diikuti oleh ekstrak metanol isolat S2T16-1 (1,41 mm) dan isolat S3T33-3 (1,39 mm). Ekstrak etil asetat menunjukkan aktivitas menghambat hanya pada isolat S3T33-3 konsentrasi 80 dan 100% saja (Tabel 6. dan Gambar 7.).
Tabel 6. Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi, dan isolat pada mikroba uji F. oxysporum
Metanol n-heksana Etil asetat
Konsentrasi
Keterangan: Data merupakan hasil transformasi menggunakan rumus √zona hambat + ½. Angka yang
diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 0.05
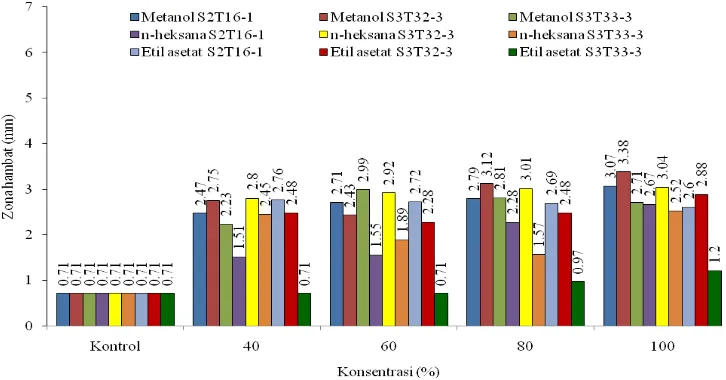
Dari hasil pengujian dapat dilihat bahwa dari ketiga jenis ekstrak, ekstrak metanol isolat S3T32-3 menunjukkan potensi menghambat paling besar terhadap
G.boninense pada tiap konsentrasi diikuti dengan n-heksana dan etil asetat. Zona hambat yang dihasilkan terbesar diperoleh pada pelarut metanol isolat S3T32-3 (3,38 mm) pada konsentrasi 100% (Tabel 7. dan Gambar 8.).
Tabel 7. Nilai rata-rata zona hambat pada perlakuan pelarut, konsentrasi, dan isolat pada mikroba uji G. boninense
Metanol n-heksana Etil asetat
Konsentrasi
Keterangan: Data merupakan hasil transformasi menggunakan rumus √zona hambat + ½. Angka yang
diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 0.05
Diantara semua pengujian menggunakan ekstrak, metanol menunjukkan spektrum yang lebih luas dalam menghambat mikroba uji dibandingakan etil asetat dan n-heksana. Dari semua mikroba uji yang digunakan, G. boninense merupakan mikroba yang paling peka terhadap semua jenis ekstrak. Perbedaan efektifitas ekstrak dalam menghambat mikroba uji kemungkinan disebabkan oleh perbedaan kelarutan senyawa aktif yang terkandung terhadap ketiga jenis pelarut. Adanya perbedaan polaritas antara senyawa aktif yang terkandung dengan pelarut yang digunakan untuk mengekstrak senyawa tersebut menyebabkan perbedaan efektisitas ekstrak yang dihasilkan. Berdasarkan penelitian lain disebutkan bahwa metanol merupakan pelarut yang baik digunakan dalam metode ekstraksi suatu bahan, metanol juga menghasilkan rendemen yang lebih besar jumlahnya dibandingkan pelarut lain (Ahameethunisa & Hopper 2010; Khyade & Vaikos 2009). Di samping itu, penambahan atau penggunaan metanol pada saat maserasi akan menyebabkan pH ekstra sel menurun dan akan meningkatkan konsentrasi proton di dalam sel (Purwoko 2007). Konsekuensinya terjadi akumulasi proton di dalam sel yang dapat menyebabkan lisisnya sel sehingga senyawa metabolit yang ada berdifusi ke pelarut dan memperbesar kemungkinan ekstrak yang diperoleh lebih banyak.
Jika dibandingkan dengan kontrol zona hambat yang dihasilkan oleh cakram kloramfenikol 30 µg sebagai kontrol positif untuk bakteri yaitu sebesar 20,7 mm pada
E. coli dan 19,14 mm pada S. aureus, sedangkan cakram yang berisi ketokonazol 200 µg/ml (Yulian 2007) sebagai kontrol positif untuk jamur yaitu sebesar 10,5 mm pada C. albicans, 5,12 mm pada F. oxyporum, dan 9,8 mm pada G. boninense. Standar diameter zona hambat antibiotik kloramfenikol terhadap Staphylococcus spp. dan
Besarnya zona hambat melebihi kontrol tersebut menunjukkan adanya potensi dari isolat untuk diteliti dan dikembangkan lebih lanjut untuk diisolasi senyawa metabolit sekunder berupa antimikroba atau mungkin antibiotik yang dihasilkan sehingga diharapkan dapat memberikan solusi untuk masalah resistensi. Adanya variasi besar zona hambat yang diperoleh mungkin disebabkan oleh perbedaan sifat yang dimiliki bakteri uji yang digunakan baik secara morfologi dan fisiologi. Selain itu, juga disebabkan oleh senyawa metabolit sekunder yang dihasilkan oleh masing-masing isolat memiliki struktur kimia, komposisi dan kandungan/konsentrasi yang berbeda dengan antibiotik kontrol (Dharmawan et al. 2009).
Hambatan yang dihasilkan oleh ekstrak terhadap mikroba uji kemungkinan disebabkan karena ekstrak tersebut memiliki aktifitas antimikroba yang bisa saja menyebabkan perusakan sel dengan cara menghambat pembentukan dinding dan membran sel yang dapat mengganggu permeabilitas sel atau mungkin menghambat sintesis protein dan asam nukleat sehingga sel tidak dapat lagi melangsungkan hidupnya karena proses utama dalam hidupnya sudah dirusak oleh ekstrak tersebut (Ruzin et al, 2003; Berdy 2005). Secara umum mekanisme yang dilalui mikroba dalam menghambat jamur patogen di rizosfer antara lain melalui persaingan terhadap nutrisi, oksigen, atau ruang, parasitisme atau perusakan dinding sel jamur oleh enzim hidrolitik yang dihasilkan oleh antagonistik, antibiosis atau penghambatan terhadap suatu mikroba melalui produksi senyawa tertentu oleh mikroba lain dan atau melalui kombinasi sinergis dari mekanisme tersebut (Getha & Vikineswary 2002).
lainnya, sedangkan senyawa metabolit sekunder yang aktif dalam menghambat G. boninense dapat ditarik dengan baik oleh semua jenis pelarut, hal ini mungkin disebabkan karena metabolit sekunder yang terdapat dalam suatu mikroba memiliki sifat kepolaran yang berbeda-beda. Oleh karena penggunaan pelarut yang berbeda, senyawa metabolit yang dapat ditarik pun berbeda jenis dan sifatnya sehingga menunjukkan aktifitas yang berbeda terhadap mikroba uji. Sedangkan terhadap F. oxysporum, menurut penelitian lain yang telah dilakukan menyatakan bahwa Fusarium
spp. juga dapat menghasilkan senyawa metabolit sekunder yang dapat menghambat pertumbuhan mikroba lain, sehingga diduga ada pengaruhnya terhadap keefektifan senyawa antimikroba lain terhadap dirinya (Mekawey 2010).
Ada beberapa dugaan lain mengapa suatu isolat bakteri tidak menunjukkan senyawa antimikroba, pertama, isolat bakteri tersebut memiliki gen untuk mengkode terbentuknya senyawa metabolit namun tidak terekspresi pada keadaan normal sehingga perlu diinduksi oleh senyawa tertentu (Demain 1998), kedua, bakteri tersebut menghasilkan senyawa antimikroba namun tidak bersifat aktif terhadap bakteri uji, dan yang ketiga, bakteri tersebut menghasilkan senyawa antimikroba intraseluler sehingga senyawa tersebut tidak terekskresi dan terakumulasi di dalam sel (Nofiani et al. 2009).
Gambar 9. Hifa normal F. oxysporum (A1), hifa abnormal F. oxysporum memendek (A2), dan hifa normal G. boninense (B1), hifa abnormal G. boninense
menyusut (B2)
Jika dibandingan dengan hifa yang normal, hifa jamur-jamur tersebut mengalami abnormalitas dalam bentuk penghambatan miselia pertumbuhan, hifa menjadi kering, pendek, menyusut, dan lisis. Berdasarkan penelitian sebelumnya yang mengujikan bakteri dan jamur endofit terhadap jamur G. boninense dan F. oxysporum
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Dari isolasi awal diperoleh 29 isolat yang berpotensi menghasilkan senyawa antimikroba yang sebagian besar merupakan bakteri gram negatif.
2. Beberapa isolat dan ekstraknya hanya dapat menghambat satu jenis mikroba, sedang beberapa isolat dan ekstrak lain dapat menghambat lebih dari satu jenis mikroba uji.
3. Pelarut metanol dan n-heksana isolat S3T33-3 menghasilkan ekstrak yang aktif terhadap E. coli dan hanya metanol terhadap S. aureus.
4. Pelarut metanol terbaik dalam mengekstrak semua isolat yang aktif terhadap C. albicans.
5. Pelarut metanol dan n-heksana untuk isolat S3T32-3 menunjukkan kemampuan yang sama terhadap mikroba uji F. oxysporum.
6. Semua pelarut menunjukkan kemampuan yang sama dalam mengekstrak isolat yang aktif terhadap G. boninense kecuali etil asetat isolat S3T33-3.
7. Perbedaan sifat kepolaran pelarut berpengaruh terhadap senyawa antimikroba yang akan diperoleh dan akan berpengaruh juga terhadap aktifitasnya terhadap masing-masing mikroba uji.
5.2. Saran
DAFTAR PUSTAKA
Ahameethunisa AR, Hopper W. 2010. Antibacterial activity of Artemisia nilagirica leaf extracts against clinical and phytopathogenic bacteria. Research Article. BMC Complementary and Alternative Medicine, 10:6
Ajizah A, Thirhana, Mirhanuddin. 2007. Potensi ekstrak kayu ulin (Eusideroxylon zwageri T et B) dalam menghambat pertumbuhan bakteri Staphylococcus aureus secara in vitro. Bioscientiae 4(1): 37-42.
Alabouvette C, Olivain C, Steinberg C. 2006. Biological control of plant diseases: the European situation. European J Plant Pathol 114: 329–341.
Bakri, M. 2009. Isolasi dan uji kemampuan antifungal fungi endofit dari tanaman Andaliman (Zanthoxylum acanthopodium DC.) terhadap fungi perusak makanan. Skripsi. USU. Medan.
Baltz RH. 2005. Antibiotic discovery from actinomycetes: Will a renaissance follow the decline and fall? SIM News 55: 186-196.
Bérdy J. 2005. Bioactive microbial metabolites. Riview Article. J Antibiot 58(1): 1–26. Bivi MR, Farhana MSN, Khairulmazmi A, Idris A. 2010. Control of Ganoderma
boninense: A causal agent of basal stem rot disease in oil palm with endophyte bacteria in vitro. Int. J. Agric. Biol.12(6): 833-839.
Borodina I, Krabben P, Nielsen J. 2005. Genome-scale analysis of Streptomyces coelicolor A3(2) metabolism. Genome Research.15: 820-829.
Brinkhoff T, Bach G, Heidorn T, Liang L, Schlingloff A, Simon M. 2004. Antibiotic production by a Roseobacter clade-affiliated species from the German Wadden Sea and its antagonistic effects on indigenous isolates. Appl Environ Microbiol
70: 2560–2565.
Bull AT, Hardman DJ. 1991. Microbial diversity. Curr Op Biotechnol 2: 421-428. Burkholder PR, Pfister RM, Leitz FH. 1966. Production of a pyrrole antibiotic by a
marine bacterium. Appl Microbiol 14: 649-653.
Dancer SJ. 2004. How antibiotics can make us sick: The less obvious adverse effects of antimicrobial chemotherapy. Lancet Infect Dis 4(10): 611-619.
Davis ND, Blevins WT. 1999. Methods for laboratory fermentation in microbial technology: Fermentation Technology. Second edition, Volume II. London. Academic Press Inc. London. hlm. 80-241.
Demain AL. 1998. Induction of Microbial Secondary Metabolism. Review Article. Int Microbiol 1: 259-264.
_________. 2006. From natural products discovery to commercialization: a success story. Review. J Ind Microbiol Biotechnol 33: 486–495.
Departemen Kesehatan. 1997. Survey kesehatan rumah tangga. Badan penelitian dan pengembangan kesehatan, Depkes. Jakarta.
Desjardins AE, Manandhar HK, Plattner RD, Manandhar GG, Poling SM, Maragos CM. 1999. Fusarium species from Nepalese rice and production of mycotoxins and gibberellic acid by selected species. App Environ Microbiol 1020-1025. Dharmawan IWE, Kawuri R, Parwanayoni MS. 2009. Isolasi Streptomyces spp. pada
kawasan hutan Provinsi Bali serta uji daya hambatnya terhadap lima strain diarrheagenic Escherichia coli. Jurnal Biologi 13: (1): 1-6.
Di Salvo, A. 2002. Actinomycetes. Available at: http://www.mirror. internux. co.id / med. sc. edu. 85/ mycology/micology-2.htm.
Drew WL, Barry AL, O’Tool R, Sherris JC. 1971. Reliability of the Kirby-Bauer disc diffusion method for detecting methicillin-resistant strains of Staphylococcus aureus. Appl Microbiol 24(2): 240-247.
D'Costa, VM, McGrann KM, Hughesm DW, Wright GD. 2006. Sampling the antibiotic resistome. Science 311: 374-377. doi:10.1126/science.1120800. PMID:16424339.
El-Mahmood AM, De N, Alo AB. 2010. Susceptibility of nosocomial Staphylococcus aureus, Escherichia coli and Candida albicans to some antimicrobial drug routinely used in Adamawa State Hospitals, Nigeria. Journal of Clinical Medicine and Research 2(8): 125-134.
wall-Gale EF. 1960. Selective toxicity of antibiotics. Brit Med Bull 16: 11-14.
Getha K, Vikineswary S. 2002. Antagonistic effects of Streptomyces violaceusniger
strain G10 on Fusarium oxysporum f.sp. cubense race 4: indirect evidence for the role of antibiosis in the antagonistic process. J Ind Microbiol Biotechnol 28: 303–310.
Grappel SF, Giovenella AJ, Philips L, Pitkin DH, Nisbet LJ. 1985. Antimicrobial activity of Aridicins, novel glycopeptide antibiotics with high and prolonged levels in blood. Antimicrob Agents Chemother 28: 660-662.
Greenstein M, Speth JL, Maiese WM. 1981. Mechanism of action of Cinodine, a glycocinnamoylspermidine antibiotic. Antimicrob Agents Chemother 20: 425-432.
Harborne JB. (1987). Metode Fitokimia. Edisi ke dua, ITB, Bandung
Harriott MM, Noverr MC. 2009. Candida albicans and Staphylococcus aureus form polymicrobial biofilms: Effects on antimicrobial resistance. Antimicrob Agents Chemother :3914–3922.
Hosoya Y, Okamoto S, Muramatsu H, Ochi K. 1998. Acquisition of certain strptomycin-resistant (str) mutations enhances antibiotic production in bacteria.
Antimicrob Agents Chemother 42(8): 2041–2047.
Hung DP, Marks CL, Tardrew PL. 1965. Isolation and characterization of new antibiotics, ABBOTT 29119 from Streptomyces erythreus. Appl Microbiol 13: 216-217.
Jorgensen JH, McElmeel ML, Trippy CW. 1997 In vitro activities of the oxazolidinone antibiotics U-100592 and U-100766 against Staphylococcus aureus and coagulase-negative Staphylococcus species. Antimicrob Agents Chemother 41: 465–467.
Khyade MS, Vaikos NP. 2009. Phytochemical and antibacterial properties of leaves of
Alstonia sholaris R. Br. Afr. J. Biotechnol 8(22): 6434-6436.
Kim YC, Jung H, KIM KY, Park SK. 2008. An effective biocontrol bioformulation against Phytophthora blight of pepper using growth mixtures of combined chitinolytic bacteria under different field conditions. Eur J Plant Pathol
Kotan R, Dikbas N, Bostan H. 2009. Biological control of post harvest disease caused by Aspergillus flavus on stored lemon fruits. Afr J Biotechnol 8: 209-214. Kumala S, Siswanto EB. 2007. Isolation and screening of endophytic from Morinda
citrifolia and their ability to produce anti-microbial substance. Microbiol Indones 1(3): 145-148.
Lechevalier. 2000. Screening for new antibiotic procedures: The selection of wild strains. In The future of antibiotherapy and antibiotic research. Ed. Academic Press. Sydney. hlm. 88-375.
Lestari, Y. 2001. Ekologi dan keragaman hayati bakteri penghasilnya. Pelatihan Mikrobiologi, Dosen-Dosen Perguruan Tinggi Negeri Se-Jawa dan Bali. Jurusan Biologi FMIPA-IPB. Dirjen Perguruan Tinggi. Departemen Pendidikan Nasional.
Mekawey AAI. 2010. The antibiotic properties of several strains of fungi. Aust. J. Basic & Appl. Sci. 4(8): 3441-3454.
Meyer E, Smith DA, Donovick R. 1968. Bioautographic technique for a rapid survey of microbial populations for the production of antibiotics and other metabolites.
Appl Microbiol 16: 10-12.
Michel-Briand Y. 1978. Mechanism of action of antibiotics:some examples. Bull Acad Natl Med. Jan;191(1):35-50; discussion 50-1. Review. French
Mishra KK, Srivastava S, Garg A, Ayyagari A. 2006. Antibiotic susceptibility of Helicobacter pylori clinical isolates: Comparative evaluation of disk-diffusion and E-test methods. Current Microbiology 53: 329-334.
Müller C, Nolden S, Gebhardt P, Heinzelmann E, Lange C, Puk 0, Welzel K, Wohlleben W, Schwartz D. 2007. Sequencing and analysis of the biosynthetic gene cluster of the lipopeptide antibiotic Friulimicin in Actinoplanes friuliensis.
Antimicrob Agents Chemother 51: 1028–1037.
Nanjwade BK, Chandrashekhara S, Shamarez AM, Goudanavar PS, Manvi FV. 2010. Isolation and Morphological Characterization of Antibiotic Producing Actiomycetes. Trop J Pharm Res 9 (3): 231-236
Oskay M. 2009. Antifungal and antibacterial compounds from Streptomyces strains.
African J Biotechnol 8(13): 3007-3017.
Paterson RRM. 2006. Ganoderma: A therapeutic fungal biofactory. Review.
Phytochemistry 67: 1985-2001.
Pathania R, Brown ED. 2008. Small and lethal: Searching for new antibacterial compound with novel model of action. Minireview. Biochem Cell Biol 86: 111-115.
Paustian T. 1999. Microbiology and bacteriologi. The World of microbes Streptomyces. Available at : http://www.bact.wisc.edu / Microtextbook / index.php.
Pelaez F. 2006. The historical delivery of antibiotic from microbial natural products. J Biochem Phar 71: 981-990.
Price B, Adamidis T, Kong R, Champness W. 1999. Streptomyces coelicolor antibiotic regulatory gene, absB, encodes an RNase III homolog. J Bacteriol 181: 6142– 6151.
Purwoko T. 2007. Fisiologi Mikroba. Edisi 1. Bumi Aksara, Jakarta.
Rao. NSS. 1994. Mikroba tanah & pertumbuhan tanaman. Universitas Indonesia Press, Jakarta.
Ridwan R, Kartina G, Rohmatussolihat, Widyastuti Y, Lisdiyanti P. 2005. Ekstraksi dan karakterisasi senyawa bioaktif dari Aktinomicetes. Laporan Teknis Bidang Mikrobiologi, Pusat Penelitian Biologi. LIPI.
Ruzin A, Singh G, Severin A, Yang Y, Dushin RG, Sutherland AG, Minnick A, Greenstein M, May MK, Shlaes DM, Bradford PA. 2004. Mechanism of action on the mannopeptimycins, a novel class of glycopeptides antibiotics active against vancomycin-resistant gram-positive bacteria. Antimicrob Agents Chemother 48: 728–738.
Setiadi, Y. 1989. Pemanfaatan mikroba dalam kehutanan. Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal Pendidikan Tinggi. Pusat Antara Universitas Bioteknologi IPB, Bogor.
Singh BK. 2009. Exploring Microbial diversity for biotechnology: The way forward.
Trend In Biotechnology 28(3):111-116.
Sit CS, Vanderas JC. 2008. Approaches to the discovery of antibacterial agents based on bacteriocins. Minireview. Biochem Cell Biol 96: 116-123.
Snow GA. 1977. Mechanisms of action of antibiotics. In Pharmaceutical Microbiology.
Ed. Hugo WB, Russell AD. Blackwell Scient. Publ. hlm. 12336. Steel RGD, Torrie JH. 1980. Principle and procedure of statistics: A biometric
approach. McGraw-New York :
Suwandi U. 1989. Mikroba penghasil antibiotik. Cermin Dunia Kedokteran No. 58. _________. 1992. Mekanisme kerja antibiotik. Cermin Dunia Kedokteran No. 76.
Thomashow LS, Weller DM, Bonsall RF, Pierson III LS. 1990. Production of the antibiotic Phenazine-1-carboxylic acid by fluorescent Pseudomonas species in the rhizosphere of wheat. Appl Environ Microbiol 56: 908-912.
Wilkins TD, Lilian V, Holdeman, Abramson IJ, Moore WEC. 1972. Standarized single-disc method for antibiotic susceptibility testing of anaerobic bacteria.
Antimicrobial Agents & Chemotherapy 1(6) : 451-459.
Wright SA, Zumoff CH, Schneider L, Beer SV. 2001. Pantoea agglomerans strain Eh318 produces two antibiotics that inhibit Erwinia amylovora in vitro. Appl Environ Microbiol 67: 284-292.
www.dephut.go.id/INFORMASI/INFPROP/Infsumut.pdf. Data dan informasi kehutanan Propinsi Sumatera Utara. Pusat inventarisasi dan statistik kehutanan. Badan planologi kehutanan. Departemen Kehutanan (2002). diunduh pada tanggal 15 April 2010.
Zhang Z, Yuen GY. 2000. Effects of culture fluids and preinduction of chitinase production on biocontrol of bipolaris leaf spot by Stenotrophomonasmaltophilia
LAMPIRAN 1. Standar zona hambat antibiotik menurut CLSI
Jenis antibiotik
Konsentrasi
cakram antibiotik Diameter zona hambat (mm)
Sensitif intermediate Resisten
Kloramfenikol 30 µg ≥ 18 13 s/d 17 ≤ 12
Sumber: Clinical and Laboratory Standards Institute (CLSI, formerly NCCLS) Providing NCCLS standards and guidelines ISO/TC 212 standards, and ISO/TC 76 standards.
LAMPIRAN 2. Analisis keragaman pengaruh pelarut, konsentrasi, dan isolat terhadap zona hambat pada mikroba uji E. coli Post Hoc Test pelarut untuk mikroba uji E. coli
LAMPIRAN 3. Post Hoc Test pelarut untuk mikroba uji E. coli
LAMPIRAN 4. Post Hoc Test konsentrasi untuk mikroba uji E. coli
Duncan Zona Hambat
LAMPIRAN 5. Post Hoc Test isolat untuk mikroba uji E. coli
LAMPIRAN 6. Analisis keragaman pengaruh pelarut, konsentrasi, dan isolat terhadap zona hambat pada mikroba uji S. aureus
Tests of Between-Subjects Effects
LAMPIRAN 8. Post Hoc Test Konsentrasi untuk mikroba uji S. aureus
Duncan Zona hambat
Konsentrasi N Subset
1 2 3
0 27 .7100
60 27 1.0148
40 27 1.0156
80 27 1.0204
100 27 1.0659
Sig. 1.000 .581 1.000
LAMPIRAN 9. Post Hoc Test Isolat untuk mikroba uji S. aureus
Duncan Zona Hambat
Isolat N Subset
1 2
S2T16-1 45 .7100
S3T32-3 45 .7100
LAMPIRAN 10. Analisis keragaman pengaruh pelarut, konsentrasi, dan isolat terhadap zona hambat pada mikroba uji C. albicans
Tests of Between-Subjects Effects
LAMPIRAN 11. Post Hoc Test Pelarut untuk mikroba uji C. albicans
LAMPIRAN 12. Post Hoc Test Konsentrasi untuk mikroba uji C. albicans
Duncan Zona Hambat
Konsentrasi N Subset
1 2
0 27 .7100
40 27 1.6044
80 27 1.6804 1.6804
60 27 1.7370 1.7370
100 27 1.7926
Sig. 1.000 .140 .213
LAMPIRAN 13. Post Hoc Isolat untuk mikroba uji C. albicans
Duncan Zona Hambat
Konsentrasi N Subset
1 2
S2T16-1 45 1.2504
S3T32-3 45 1.5827
S3T33-3 45 1.6816
LAMPIRAN 14. Analisis keragaman pengaruh pelarut, konsentrasi, dan isolat terhadap zona hambat pada mikroba uji F. oxysporum
Tests of Between-Subjects Effects
LAMPIRAN 15. Post Hoc Test Pelarut untuk mikroba uji F. oxysporum