ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT TAPAK DARA (Catharanthus roseus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
SKRIPSI
FEBRIN SETIANI PANDIANGAN 090805054
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT TAPAK DARA (Catharanthus roseus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
SKRIPSI
FEBRIN SETIANI PANDIANGAN 090805054
Skripsi ini diajukan sebagai salah satu syarat untuk mendapatkan
Gelar Sarjana Sains Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara Medan
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Isolasi dan Uji Ekstrak Metanol Bakteri Endofit Tapak Dara (Catharanthus roseus) dalam Menghambat Pertumbuhan Beberapa Mikroba Patogen
Kategori : Skripsi
Nama : Febrin Setiani Pandiangan Nomor Induk Mahasiswa : 090805054
Program Studi : Sarjana (S1) Biologi Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, April 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. It Jamilah M.Sc Prof. Dr. Dwi Suryanto M.Sc NIP. 196310121991032003 NIP. 196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
ISOLASI BAKTERI ENDOFIT DARI TANAMAN TAPAK
DARA (Catharanthus roseus) DAN UJI KEMAMPUAN
EKSTRAK METANOLNYA DALAM MENGHAMBAT
PERTUMBUHAN BEBERAPA MIKROBA PATOGEN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2014
PENGHARGAAN
Puji dan syukur penulis ucapkan ke hadirat Tuhan Yang Maha Kuasa yang telah
memberikan rahmat dan kasih-Nya sehingga penulis dapat menyelesaikan
penyusunan skripsi ini dengan judul Isolasi dan Uji Ekstrak Metanol Bakteri
Endofit Tanaman Tapak Dara (Catharanthus roseus) dalam Menghambat
Pertumbuhan Mikroba Patogen.
Pada kesempatan ini penulis ingin mengucapkan terimakasih kepada
Bapak Prof. Dr. Dwi Suryanto M.Sc selaku Dosen Pembimbing I dan Ibu Dr. It
Jamilah M.Sc selaku Dosen Pembimbing II yang telah banyak memberikan
nasehat dan bimbingan kepada penulis dalam penyusunan skripsi ini. Terimakasih
kepada Bapak selaku Dosen Penguji I dan Bapak Riyanto Sinaga S.Si selaku
Dosen Penguji II yang telah memberikan kritik dan saran yang membangun dalam
penyusunan skripsi ini. Terimakasih kepada Ibu Dr. Nursahara Pasaribu, M.Sc
selaku Ketua Departemen Biologi FMIPA USU Medan, Bapak Dr. Sutarman,
M.Sc selaku Dekan FMIPA USU, Ibu Dr. Marpongahtun, M.Sc selaku Pembantu
Dekan I, Bapak Drs. Nursal M.Si selaku Pembantu Dekan II dan Bapak Drs.
Krista Sebayang, M.Si selaku Pembantu Dekan III, bapak dan ibu Dosen Biologi
FMIPA USU serta seluruh staf pegawai FMIPA USU.
Terimakasih kepada Ibuku tercinta R. Simarmata yang senantiasa selalu
berkorban untukku juga kepada abang, kakak dan adikku, Bang Ruspan, Kak
Novita dan Dolli yang telah memberikan dukungan penuh dalam menyelesaikan
skripsi ini. Akhirnya tidak terlupakan kepada Agustina, Silvia, Jesica, Bertua,
Yenni, Beatrix, Febry, Sukma, Frans Simatupang, Lamhot, Ledi, Anderson,
Raymond, Adrian, teman-teman seperjuangan angkatan 2009 yang tidak dapat
disebutkan semuanya, abang asuh Jupentus, kakak abang angkatan 2008,
adik-adik angkatan 2010, 2011 dan 2012 serta teman-teman Persekutuan Keluarga
Besar Kristen Biologi (PKBKB) yang selama ini memberikan bantuan dan
dorongan yang diperlukan. Semoga Tuhan Yang Maha Esa senantiasa selalu
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT TAPAK DARA (Catharanthus roseus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
ABSTRAK
Penelitian tentang isolasi bakteri endofit dari tanaman tapak dara (Catharanthus roseus) dan uji kemampuan dari ekstrak metanolnya dalam menghambat pertumbuhan beberapa mikroba patogen yaitu Aspergillus flavus, Streptococcus mutans, Salmonella typhii dan Escherichia coli telah dilakukan. Pembuatan ekstrak dilakukan dengan metode maserasi dan sentrifugasi. Ekstrak metanol bakteri endofit dibuat dengan masing-masing konsentrasi 40, 60, 80, dan 100%. Pengujian aktivitas antimikroba dari isolat bakteri dan ekstrak metanol bakteri endofit dilakukan dengan metode difusi cakram. BF1, BF2, AF2, AF3, AF4, AFN7, AFN8 dan AFN9 delapan dari 12 isolat menunjukkan penghambatan pada semua mikroba patogen. Ekstrak metanol bakteri endofit BF1 dan AFN9 mampu menghambat semua mikroba patogen. Kedua ekstrak metanol BF1 dan AFN9 menunjukkan daya hambat yang paling besar terhadap bakteri patogen E. coli
pada konsentrasi 100% .
ISOLATION AND EXAMINATION METHANOL EXTRACTS
OF ENDOPHYTIC BACTERIA TAPAK DARA (Catharanthus
roseus) IN INHIBIT THE GROWTH OF SEVERAL
PATHOGENIC MICROBE
ABSTRACT
A study of isolation of endophytic bacteria from tapak dara (Catharanthus roseus) and examination of methanol extracts in inhibited the growth of several pathogenic microbes such as Aspergillus flavus, Streptococcus mutans, Salmonella typhii and Escherichia coli has been conducted. Examination of methanol extract of endophytic bacteria was done with concentrations of 40, 60, 80, and 100%. Methanol extract was prepared by maceration method and centrifugated at 5000 rpm. Examination of isolates and antimicrobial activity of methanol extract of endophytic bacteria was carried out by the disc diffusion method. Eight out of twelve endophytic bacteria isolates were able to inhibit all tested pathogenic microbes wich were BF1, BF2, AFN7, AFN8, AFN9, AF2, AF3, and AF4. Based on diameter of inhibition zone BF1 and AFN9 isolates were found as the most potential isolates in control tested pathogenic microbes. Methanol extract of BF1 and AFN9 isolates was able to inhibit all tested pathogenic microbes. Both of this isolates more inhibit E. coli compare to other pathogens at concentration of 100% .
DAFTAR ISI
2.2 Manfaat Mikroba Endofit 6
2.3 Tanaman Tapak Dara 7
2.4 Metabolit Sekunder 9
2.5 Mikroba Patogen 10
2.5.1 Aspergillus flavus 10
2.5.2 Streptococcus mutans 12
2.5.3 Salmonella typhii 13
2.5.4 Escherichia coli 14
BAB 3 BAHAN DAN METODE
3.1 Waktu dan Tempat 16
3.2 Alat dan Bahan 16
3.3 Isolat Beberapa Mikroba Patogen 16
3.4 Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Tapak Dara
17
3.5 Karakterisasi dan Identifikasi Bakteri Endofit 17 3.6 Uji Daya Hambat Bakteri Endofit terhadap Mikroba
Patogen
17
3.7 Uji Daya Hambat Bakteri Endofit terhadap A. flavus 18 3.8 Ekstraksi Bahan Antimikroba dari Bakteri Endofit dengan
Pelarut Metanol
19
3.9 Uji Aktivitas Ekstrak Metanol Bakteri Endofit terhadap Beberapa Mikroba Patogen
3.10 Pengamatan Hifa Abnormal 20
BAB 4 HASIL DAN PEMBAHASAN
4.1 Isolasi dan Karakterisasi Bakteri Endofit dari Akar dan Batang Tanaman Tapak Dara (Chataranthus roseus)
22
4.2 Uji Daya Hambat Isolat Bakteri Endofit Terhadap Mikroba Patogen
24
4.3 Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit
27
4.4 Abnormalitas Hifa Akibat Uji Antagonis Ekstrak Terhadap Mikroba Patogen
33
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 35
5.2 Saran 35
DAFTAR TABEL
Nomor Tabel Judul Halaman
4.1. Karakteristik Morfologi Bakteri Endofit dari Akar dan Batang Tanaman Tapak Dara
23
4.2. Hasil Uji Antagonis Isolat Bakteri Endofit Terhadap Mikroba Uji dalam Bentuk Zona Hambat Pertumbuhan
24
4.3. Hasil Uji Aktivitas Antimikroba Ekstrak Metanol terhadap Mikroba Uji
DAFTAR GAMBAR
Nomor Gambar Judul Halaman
2.1. Tanaman Tapak Dara (Catharanthus roseus) 8 2.2. a. Penampakan Makroskopis Aspergillus flavus,
b. Penampakan Mikroskopis Aspergillus flavus
11
2.3. Streptococcus mutans 13
3.1. Metode pengukuran zona hambat bakteri endofit terhadap koloni jamur
19
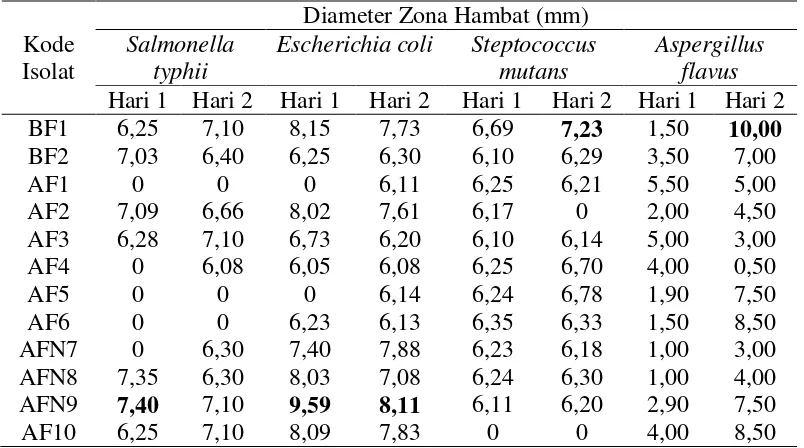
4.1. Uji Antagonis Isolat Bakteri Endofit Terhadap Mikroba Patogen A. flavus (a) Isolat BF2 selama 48 jam (b) Isolat BF1 selama 48 jam (c) Isolat AFN7 selama 24 jam (d) Isolat AF6 selama 48 jam
25
4.2 Hasil Uji Antagonis Ekstrak Bakteri Endofit selama 48 jam (a) Ekstrak BF1 terhadap S. mutans
(b) Ekstrak AFN9 terhadap E. coli (c) Ekstrak AFN9 60% terhadap A. flavus (d) Ekstrak AFN9 80% terhadap A. flavus
30
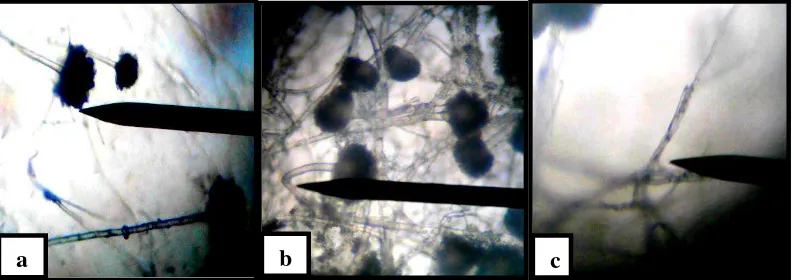
4.3 Hifa jamur Aspergillus flavus pada perbesaran 40x10 (a) Hifa normal (b) Hifa membengkok (c) Hifa menggulung
DAFTAR LAMPIRAN
Nomor Lampiran Judul Halaman
1 Alur Kerja Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Dara metode Radu & Kqueen (2002) yang dimodifikasi
42
2 Alur Kerja Karakterisasi dan Identifikasi Bakteri Endofit
43
3 Alur Kerja Uji Daya Hambat Bakteri Endofit terhadap Mikroba Patogen
44
4 Alur Kerja Uji Daya Hambat Bakteri Endofi terhadap Jamur Patogen
45
5 Alur Kerja Ekstraksi Bahan Antimikroba dari Bakteri Endofit dengan Pelarut Metanol
46
6 Alur Kerja Uji Aktivitas Ekstrak Metanol Bakteri Endofit terhadap Beberapa Mikroba Patogen
47
7 Alur Kerja Uji Aktivitas Ekstrak Metanol Bakteri Endofit terhadap Jamur Patogen
48
8 Alur Kerja Pengamatan Hifa Abnormal 49
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT TAPAK DARA (Catharanthus roseus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
ABSTRAK
Penelitian tentang isolasi bakteri endofit dari tanaman tapak dara (Catharanthus roseus) dan uji kemampuan dari ekstrak metanolnya dalam menghambat pertumbuhan beberapa mikroba patogen yaitu Aspergillus flavus, Streptococcus mutans, Salmonella typhii dan Escherichia coli telah dilakukan. Pembuatan ekstrak dilakukan dengan metode maserasi dan sentrifugasi. Ekstrak metanol bakteri endofit dibuat dengan masing-masing konsentrasi 40, 60, 80, dan 100%. Pengujian aktivitas antimikroba dari isolat bakteri dan ekstrak metanol bakteri endofit dilakukan dengan metode difusi cakram. BF1, BF2, AF2, AF3, AF4, AFN7, AFN8 dan AFN9 delapan dari 12 isolat menunjukkan penghambatan pada semua mikroba patogen. Ekstrak metanol bakteri endofit BF1 dan AFN9 mampu menghambat semua mikroba patogen. Kedua ekstrak metanol BF1 dan AFN9 menunjukkan daya hambat yang paling besar terhadap bakteri patogen E. coli
pada konsentrasi 100% .
ISOLATION AND EXAMINATION METHANOL EXTRACTS
OF ENDOPHYTIC BACTERIA TAPAK DARA (Catharanthus
roseus) IN INHIBIT THE GROWTH OF SEVERAL
PATHOGENIC MICROBE
ABSTRACT
A study of isolation of endophytic bacteria from tapak dara (Catharanthus roseus) and examination of methanol extracts in inhibited the growth of several pathogenic microbes such as Aspergillus flavus, Streptococcus mutans, Salmonella typhii and Escherichia coli has been conducted. Examination of methanol extract of endophytic bacteria was done with concentrations of 40, 60, 80, and 100%. Methanol extract was prepared by maceration method and centrifugated at 5000 rpm. Examination of isolates and antimicrobial activity of methanol extract of endophytic bacteria was carried out by the disc diffusion method. Eight out of twelve endophytic bacteria isolates were able to inhibit all tested pathogenic microbes wich were BF1, BF2, AFN7, AFN8, AFN9, AF2, AF3, and AF4. Based on diameter of inhibition zone BF1 and AFN9 isolates were found as the most potential isolates in control tested pathogenic microbes. Methanol extract of BF1 and AFN9 isolates was able to inhibit all tested pathogenic microbes. Both of this isolates more inhibit E. coli compare to other pathogens at concentration of 100% .
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Mikroba patogen berbahaya bagi kehidupan makhluk hidup, baik hewan, tanaman
dan terutama manusia, yang dapat menyebabkan penyakit infeksi. Mengingat
peningkatan prevalensi patogen manusia dan tanaman resisten antibiotik,
menyebabkan meningkatnya permintaan untuk antimikroba baru dari sumber
alami (Pal’ & Paul, 2013). Indonesia sebagai salah satu negara yang memiliki
biodiversitas sangat besar, menyediakan banyak sumber daya alam hayati yang
tak ternilai harganya, dari bakteri hingga jamur, tumbuhan dan hewan. Salah satu
sumber senyawa bioaktif adalah mikroba endofit. Mikroba endofit dapat
menghasilkan senyawa-senyawa bioaktif yang sangat potensial untuk
dikembangkan menjadi obat. Mikroba endofit memiliki potensi yang besar dalam
pencarian sumber-sumber obat baru. Hal ini karena mikroba merupakan
organisme yang mudah ditumbuhkan, memiliki siklus hidup yang pendek dan
dapat menghasilkan jumlah senyawa bioaktif dalam jumlah besar
(Prihatinginggrum & Wahyuningsi, 2005).
Penelitian tentang bakteri endofit cukup banyak yang sudah dilakukan
sebelumnya, diantaranya Simarmata et al. (2007) dari Pusat Penelitian
Bioteknologi LIPI tentang isolasi mikroba endofit dari tanaman obat sambung
nyawa (Gynura procumbens) dan analisis potensinya sebagai antimikroba dalam
menghambat pertumbuhan beberapa mikroba. Isolat mikroba endofit dari tanaman
sambung nyawa paling banyak menghambat pertumbuhan bakteri Bacillus
substilis dengan luas zona hambat tertinggi pada Candida albicans sebesar 3.01
cm2.
Selain itu, ada juga penelitian tentang aktivitas antibakteri dari endofit
tanaman mangrove (Bruguiera gymnorrhiza) terhadap Staphylococcus aureus dan
Escherichia coli yang dilakukan oleh Utami et al. (2008) yang memperoleh zona
dapat diketahui bahwa mikroba endofit dari suatu tanaman mempunyai
kemampuan yang baik dalam menghambat pertumbuhan mikroba.
Tanaman tapak dara (Catharanthus roseus) merupakan tanaman yang
sering digunakan masyarakat luas sebagai obat tradisional dalam mengobati
berbagai macam penyakit. Menurut Tikhomiroff & Jolicoeur (2002), tanaman ini
memproduksi senyawa metabolit sekunder berupa alkaloid vinblastin dan
vincristin sebagai antikanker dan ajmalicin serta serpentin sebagai senyawa
antihipertensi. Dalam penelitian Widyastuti dan Nursana (2001), ekstrak air tapak
dara dapat menurunkan kadar gula dan meningkatkan jumlah sel beta pankreas
pada kelinci hiperglikemia. Dari hal tersebut dapat diketahui bahwa ekstrak
tanaman tapak dara memiliki manfaat yang cukup banyak, namun potensi mikroba
endofit khususnya bakteri endofit dari tanaman tersebut yang bermanfaat dalam
menghasilkan antimikroba belum diketahui. Sehingga dalam penelitian ini
dilakukan isolasi bakteri endofit dari tanaman tapak dara dan ekstrak metanolnya
dalam menghambat beberapa mikroba patogen. Senyawa aktif yang dihasilkan
mikroba endofit tersebut diharapkan dapat bersifat antimikroba.
Kebutuhan antibiotik baru masih sangat diperlukan, terutama yang efektif
melawan bakteri resisten, protozoa, atau fungi. Untuk mendapatkan antibiotik
baru, para peneliti telah banyak melakukan berbagai cara dengan bantuan mikroba
penghasil antibiotik yang ada di alam (Rahmiati, 2011). Berdasarkan latar
belakang di atas, maka akan dilakukan penelitian tentang isolasi bakteri endofit
dari tanaman obat tapak dara (C. roseus) dan uji kemampuan ekstrak metanolnya
dalam menghambat pertumbuhan beberapa mikroba patogen. Dalam penelitian ini
diharapkan bakteri yang diisolasi dari tanaman tapak dara dan ekstrak metanolnya
yang menghasilkan metabolit sekunder berupa senyawa bioaktif yang dapat
menghambat beberapa mikroba patogen.
1.2 Permasalahan
Mikroba patogen berbahaya bagi hewan, tanaman dan manusia. Mikroba patogen
tersebut dapat menginfeksi manusia dan menyebabkan manusia terserang
bahan kimia sintetik seperti penggunaan antibiotik yang tidak terkontrol dapat
mengakibatkan resistensi pada mikroba patogen tersebut terhadap obat-obatan.
Salah satu alternatif yang aman dalam menghambat mikroba patogen
adalah dengan menggunakan bakteri endofit sebagai antimikroba yang baru dari
sumber alami dalam menghambat pertumbuhan mikroba patogen. Dalam
penelitian ini diharapkan bakteri endofit yang diisolasi dari tanaman tapak dara
(C. roseus) dapat menghasilkan senyawa aktif yang bersifat sebagai antimikroba
atau antibiotik dalam menghambat beberapa pertumbuhan mikroba patogen pada
manusia yaitu Aspergillus flavus, Streptococcus mutans, Salmonella typhii dan
Escherichia coli.
1.3 Tujuan Penelitian
Tujuan penelitian ini ialah:
1. Menguji kemampuan bakteri endofit dari tanaman tapak dara dalam
menghambat pertumbuhan beberapa mikroba patogen yaitu A. flavus, S.
mutans, S. typhii dan E. coli.
2. Untuk mengetahui kemampuan ekstrak metanol bakteri endofit dari tanaman
tapak dara dalam menghambat pertumbuhan beberapa mikroba patogen yaitu
A. flavus, S. mutans, S. typhii dan E. coli.
1.4 Hipotesis
1. Bakteri endofit yang diisolasi dari batang dan akar dari tanaman tapak dara
menghasilkan antimikroba yang menghambat pertumbuhan beberapa mikroba
patogen seperti A. flavus, S. mutans S. typhii dan E. coli.
2. Ekstrak metanol dari bakteri endofit tanaman tapak dara dapat menghambat
pertumbuhan beberapa mikroba patogen seperti A. flavus, S. mutans S. typhii
1.5 Manfaat
1. Memberikan informasi mengenai isolat bakteri endofit dari tanaman tapak dara
dalam menghasilkan antimikroba yang dapat menghambat pertumbuhan
beberapa mikroba patogen A. flavus, S. mutans S. typhii dan E. coli.
2. Dalam penelitian lebih lanjut, ekstrak bakteri endofit yang berpotensi
BAB 2
TINJAUAN PUSTAKA
2.1 Mikroba Endofit
Mikroba endofit dapat ditemukan hampir di semua tumbuhan di muka bumi ini
dan merupakan organisme hidup berukuran mikroskopis yang hidup di dalam
jaringan tanaman selama periode tertentu dari siklus hidupnya (Tarigan &
Kuswandi, 2010), yang dapat dijumpai pada bagian akar, daun serta batang
tumbuhan. Mikroba endofit memiliki keanekaragaman hayati yang kaya, yang
telah ditemukan di berbagai jenis tumbuhan yang telah diperiksa sampai saat ini.
Perlu diketahui bahwa dari hampir 300.000 spesies tumbuhan yang ada di bumi,
masing-masing individu tanaman memiliki satu atau lebih jenis mikroba endofit
(Strobel & Daisy, 2003). Mikroba endofit hidup bersimbiosis dengan tanaman di
dalam jaringan tanaman, apabila mikroba tersebut mampu menghasilkan suatu
agen biologis yang dapat memerangi penyakit tanaman maka secara langsung
tanaman tersebut akan terhindar dari serangan penyakit yang juga disebabkan oleh
mikroba (Melliawati et al., 2006).
Mikroba endofit dapat melindungi tumbuhan inang dari serangan patogen
dengan senyawa yang dikeluarkan oleh mikroba endofit. Senyawa yang
dikeluarkan mikroba endofit berupa senyawa metabolit sekunder yang merupakan
senyawa bioaktif dan dapat berfungsi untuk membunuh patogen. Tumbuhan inang
menyediakan nutrisi yang dibutuhkan oleh mikroba endofit untuk melengkapi
siklus hidupnya (Prihatiningtias & Wahyuningsih, 2006). Oleh sebab itu, tanaman
yang sehat secara langsung dapat bertahan terhadap adanya berbagai serangan
penyakit dengan adanya mikroba endofit.
Mikroba endofit spesifik yang diperoleh dari bagian dalam tanaman
diharapkan mampu menghasilkan sejumlah senyawa bioaktif yang dibutuhkan
tanpa harus mengekstrak dari tanamannya. Mikroba endofit tersebut dapat
diisolasi dari permukaan benih, dalam jaringan akar, batang, daun, biji, dan buah
yang sudah steril permukaannya. Kemampuan mikroba endofit memproduksi
yang sangat besar dan dapat diandalkan untuk memproduksi metabolit dari
mikroba endofit yang diisolasi dari tanaman inangnya tersebut (Utami et al.,
2008). Menurut Diniyah (2010), pemanfaatan bakteri endofit sebagai antibakteri
dan antijamur pada tanaman merupakan pengendalian yang tidak menimbulkan
efek negatif terhadap kehidupan manusia dan lingkungan. Dengan demikian, jika
mikroba endofit dapat menghasilkan senyawa bioaktif yang sama dari tanaman
inangnya, hal ini tidak hanya akan mengurangi kebutuhan untuk memanen
tanaman langka tetapi juga kemungkinan melestarikan dunia dalam
mempertahankan keanekaragaman hayati (Strobel & Daisy, 2003).
2.2 Manfaat Mikroba Endofit
Mikroba endofit memiliki banyak manfaat dalam lingkungan hidup. Seperti dalam
penelitian Melliawati et al. (2006), bakteri endofit pada beberapa tanaman hutan
Indonesia mempunyai prospek dalam menghasilkan senyawa aktif yang berguna
untuk memproteksi serangan mikroba patogen tanaman. Isolat bakteri endofit
yang diperoleh dari penelitian tersebut memiliki kemampuan dalam menghambat
mikroba patogen khususnya kapang patogen dengan menghasilkan senyawa aktif
antikapang patogen.
Selain itu mikroba endofit juga berperan sebagai pengendali hayati.
Pengendalian biologi dengan menggunakan bakteri endofit merupakan salah satu
alternatif pengendalian yang diharapkan dapat mengatasi masalah dalam
pertumbuhan tanaman dan mengendalikan hama tanaman. Keunggulan bakteri
endofit sebagai agens pengendali hayati, selain sebagai agens biokontrol juga
dapat menginduksi ketahanan tanaman yang dikenal sebagai induced systemic
resistance (ISR). Mekanisme bakteri endofit dalam menginduksi ketahanan adalah
dengan mengkolonisasi jaringan dalam tanaman sehingga menstimulasi tanaman
untuk meningkatkan produksi senyawa metabolit yang berupa enzim peroksidase
dalam berperan untuk ketahanan tanaman (Harni & Ibrahim, 2011).
Dalam penelitian Khairani (2009), dapat diketahui salah satu peran
mikroba endofit dari tanaman jagung dapat menghasilkan hormon IAA dalam
membantu proses perkecambahan tanaman tersebut. Selain dapat menghasilkan
pertumbuhan tanaman yang dikenal dengan Plant Growth Promoting
Rhizobacteria (PGPR) (Harni & Ibrahim, 2011) dan menghasilkan senyawa
bioaktif atau metabolit sekunder. Seperti penelitian Munif & Hipi (2011), bakteri
endofit berpotensi dalam meningkatkan panjang tanaman jagung yang dapat
menstimulisasi pertumbuhan tanaman dengan menghasilkan hormon pemacu
pertumbuhan yang dipengaruhi oleh media tanam. Menurut Harni dan Ibrahim
(2011), terjadinya peningkatan pertumbuhan, seperti berat tajuk dan akar,
disebabkan oleh karena bakteri endofit dapat merangsang pembentukan akar
lateral dan jumlah akar sehingga dapat memperluas penyerapan unsur hara.
Menurut Prihatiningtias & Wahyuningsih (2006), mikroba endofit dapat
menghasilkan senyawa-senyawa bioaktif yang dapat berperan sebagai
antimikroba, antimalaria, antikanker, dan juga dapat digunakan dalam dunia
pertanian dan industri. Mikroba endofit memiliki prospek yang baik dalam
penemuan sumber-sumber senyawa bioaktif yang dalam perkembanagan lebih
lanjut dapat dijadikan sebagai sumber penemuan obat untuk berbagai macam
penyakit. Peran mikroba endofit yang dapat memproduksi metabolit sekunder
yang sama kualitasnya dengan tanaman aslinya sangat potensial untuk terus
dikembangkan guna memperoleh metabolit sekunder yang dapat digunakan untuk
mengobati berbagai jenis penyakit (Radji, 2005).
2.3 Tanaman Tapak Dara
Tanaman telah lama kita ketahui merupakan salah satu sumber daya yang sangat
penting dalam upaya pengobatan dan upaya mempertahankan kesehatan
masyarakat. Bahkan sampai saat inipun menurut perkiraan badan kesehatan dunia
(WHO), 80% penduduk dunia masih menggantungkan dirinya pada pengobatan
tradisional termasuk penggunaan obat yang berasal dari tanaman. Sampai saat ini
seperempat dari obat-obat modern yang beredar dunia berasal dari bahan aktif
yang diisolasi dan dikembangkan dari tanaman (Radji, 2005).
Indonesia sebagai negara beriklim tropis, mempunyai tanaman obat yang
sangat beragam, sehingga tradisi penggunaan tanaman obat sudah ada dari nenek
moyang yang dipercaya dapat menyembuhkan berbagai jenis penyakit, baik
tumbuhan dapat dimanfaatkan sebagai bahan baku obat. Tumbuhan tersebut
menghasilkan metabolit sekunder dengan struktur molekul dan aktivitas biologik
yang beraneka ragam, memiliki potensi yang sangat baik untuk dikembangkan
menjadi obat berbagai penyakit (Radji, 2005).
Tapak dara (Catharanthus roseus) (Gambar 2.1) merupakan salah satu
taman obat yang termasuk ke dalam famili Apocynaceae. Tanaman ini juga
dikenal dengan nama lain seperti rutu-rutu, rumput jalang, kembang sari cina,
kembang serdadu, kembang tembaga, tapak lima (Bali) (Agoes, 2010). Tapak dara
merupakan jenis tanaman yang digunakan oleh masyarakat sebagai obat
tradisional. Tanaman tapak dara ini mengandung alkaloid vinblastine, vincristine,
leurosine, catharanthine, dan lochnerine yang berkhasiat sebagai antikanker
(Dinata, 2009).
Gambar 2.1Tanaman Tapak Dara (Cataranthus roseus) (Dinata, 2009)
Tapak dara mengandung komponen antikanker, yaitu senyawa alkaloid
seperti vinca leukoblastine, leurokristine, leurosin, vinkadiolin, leurosidin, dan
katarantin. Selain itu tanaman ini juga mengandung alkaloid yang berkhasiat
hipoglikemik (menurunkan kadar gula darah) seperti katarantin, locherin,
tetrahidroalstonin, vindolin, dan vindolinin, sedangkan akarnya mengandung
alkaloid, saponin, flavonoid, dan tannin. Kandungan alkaloid total di dalam daun
tapak dara berkisar antara 0,70-0,82%. Seluruh bagian tanaman mengandung zat
aktif antara 0,2-1% (Agoes, 2010). Menurut Dewi & Saraswati (2009), rebusan
daun tapak dara yang mengandung alkaloid vincristin sering dipakai sebagai obat
anti kanker sebagai zat antimitosis. Dari hal ini dapat kita ketahui bahwa tanaman
terkendali penyebab kanker. Beberapa senyawa utama bisa dimanfaatkan untuk
pengobatan penyakit lain, misalnya leurisin dan vindolin yang dipakai sebagai
bahan pengganti insulin karena berpengaruh pada kadar gula darah (hipoglikemia)
penderita diabetes (Agoes, 2010).
Menurut Agoes (2010), tapak dara berkhasiat mengobati beberapa jenis
penyakit, bahkan di luar negeri, tapak dara ini sudah diolah menjadi obat suntik.
Tapak dara digunakan untuk mengobati penyakit darah tinggi, kencing manis,
leukemia limfositik akut, luka tersiram air panas, kanker payudara, hipertensi,
diabetes dan batu ginjal.
2.4Metabolit Sekunder
Metabolit sekunder merupakan senyawa kimia yang terbentuk dalam tanaman
maupun mikroba yang bersifat antimikroba. Senyawa antimikroba merupakan
salah satu produk metabolit sekunder yang dihasilkan oleh mikroba yang mampu
membunuh atau menghambat bakteri atau organisme lain (Dalimunthe, 2009).
Pembentukan senyawa metabolit sekunder dikode oleh sejumlah gen yang
terdapat pada DNA plasmid (Demain, 1998). Komponen bioaktif dapat
menggangu pembentukan asam nukleat (RNA dan DNA), menyebabkan
terganggunya transfer informasi genetik yang selanjutnya akan menginaktivasi
atau merusak materi genetik sehingga tergangunya proses pembelahan sel untuk
pembiakan. Oleh karena itu pertumbuhan mikroba menjadi terhambat akibat
senyawa antimikroba (Widiana, 2012).
Ada beberapa kondisi yang mempengaruhi metabolit sekunder yaitu
keterbatasan nutrisi yang tersedia di lingkungan tumbuh suatu bakteri,
penambahan senyawa penginduksi dan penurunan kecepatan pertumbuhan
(Demain, 1998).
Menurut Dalimunthe (2009), antimikroba dapat bersifat bakteriostatik dan
bakterisid. Bakteriostatik yaitu menghambat atau menghentikan laju pertumbuhan
bakteri, seperti kloramfenikol, sedangkan bakterisid yaitu membunuh bakteri,
2.5 Mikroba Patogen
Mikroba patogen merupakan mikroba berbahaya bagi kehidupan, hal ini terlihat
dari kemampuannya menginfeksi manusia, hewan, serta tanaman, yang dapat
menimbulkan penyakit yang berkisar dari infeksi ringan sampai kepada kematian.
Selain itu, mikroba pun dapat mencemari makanan, dengan menimbulkan
perubahan-perubahan bahan kimia di dalamnya, membuat makanan tersebut tidak
dapat dimakan atau bahkan beracun (Pelczar & Chan, 2005).
Penyakit infeksi dapat disebabkan oleh mikroba patogen seperti bakteri,
jamur maupun virus yang menyerang tubuh manusia. Banyak mikroba patogen
tersebut hidup di daerah tropis. Daerah yang beriklim tropis merupakan daerah
yang sangat cocok bagi pertumbuhan dan perkembangbiakan mikroba, baik yang
bersifat patogen maupun yang memberi manfaat bagi manusia (Eddy, 2009).
Beberapa mikroba yang menginfeksi manusia yaitu A. flavus, S. mutans, S. typhii
dan E. coli. Salah satunya dapat menyebabkan diare akut akibat infeksi bakteri
patogen dengan gejala muntah-muntah, demam, nyeri perut atau kejang perut
(Zein et al., 2004).
2.5.1 Aspergilus flavus
A spergillus flavus merupakan jamur patogen yang sering ditemukan sebagai
kontaminan pada komiditi kacang-kacangan dan sereal. Makanan olahan berbahan
baku kacang-kacangan, daging, jagung, ikan, gandum, biji-bijian, buah, dan sereal
juga sangat rentan terhadap kontaminasi jamur ini. Kontaminasi dapat terjadi
mulai dari penyiapan bahan baku, pengolahan, penyimpanan, pemasaran sampai
kepada konsumen (Safika, 2008). Banyak kasus kontaminasi aflatosin pada
produk pangan dan pakan telah dilaporkan terjadi di Indonesia, khususnya produk
berbasis kacang (Aryantha & Lunggani, 2007).
A. flavus merupakan jamur yang mampu memproduksi aflatoksin
(Handajani & Purwoko, 2008) dan merupakan jamur patogen potensial yang dapat
mengakibatkan aspergillosis (Malau, 2012). Aflatoksin yang dihasilkan oleh
beberapa jenis cendawan didefinisikan sebagai senyawa organik beracun yang
berasal dari sumber hayati berupa hasil metabolisme sekunder dari cendawan.
beras) mengakibatkan berbagai kerusakan meliputi kerusakan fisik, kimia, bau,
warna, tekstur, dan nilai nutrisi, serta berakibat pada kesehatan manusia dan
hewan (Talanca & Mas’ud, 2009).
Menurut Talanca & Mas’ud (2009), berbagai hasil penelitian mengenai efek biologik aflatoksin menunjukkan bahwa aflatoksin mempunyai kemampuan
untuk menginduksi kanker pada hati ikan, burung, dan mamalia dibandingkan
dengan bahan-bahan kimia yang dapat menimbulkan kanker hati. Penyakit kanker
hati yang terjadi pada sebagian penduduk Indonesia diduga berhubungan erat
dengan konsumsi pangan mengandung aflatoksin. Di negara tropis seperti
Indonesia, kontaminasi mikotoksin sangat sulit untuk dihindari karena kondisi
iklim dengan tingkat kelembaban, curah hujan dan suhu yang tinggi sangat
mendukung pertumbuhan dan perkembangbiakan kapang penghasil mikotoksin
(Maryam, 2006).
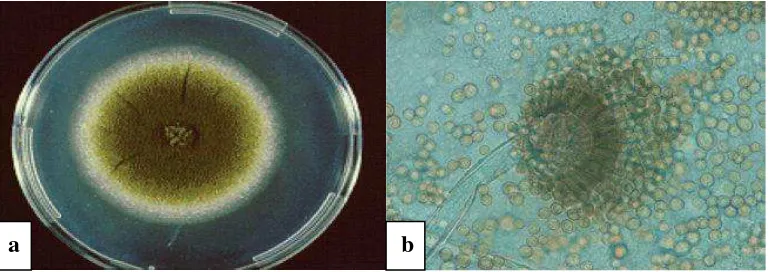
Gambar 2.2 a. Penampakan makroskopis Aspergillus flavus (Hedayati et al., 2007), b. Penampakan konidia mikroskopis Aspergillus flavus
perbesaran 100x (Safika, 2008)
Gambar 2.2 a. secara umum, penampakan makroskopis A. flavus berwarna
kuning kehijauan atau coklat cetakan dengan warna emas menjadi merah-coklat
terbalik (Hedayati et al., 2007), yang tumbuh terlihat warna koloni hijau
kekuningan (Safika, 2008). Pertumbuhan Aspergillus sp. optimal jika aktivitas air
minimal 80%. Jika aktivitas air dibawah 80%, pertumbuhan A. flavus terhambat
(Tandiabang, 2010).
Pada Gambar 2.2 b. konidiofor A. flavus bervariabel panjang, kasar, seperti
berduri, berupa uniseriate atau biseriate yang menutupi seluruh vesikel (Hedayati
et al., 2007). Kepala konidia khas berbentuk bulat, kemudian merekah menjadi
beberapa kolom dan berwarna hijau kekuningan (Gandjar et al, 1999). Konidiofor
hialin, kasar dan dapat mencapai panjang 1,0 mm (ada yang mencapai 2,5 mm).
Vesikula berbentuk bulat hingga semibulat dan berdiameter 25-45 μm. Fialed terbentuk langsung pada vesikula atau pada metula dan berukuran (6-10) x (4-5,5) μm. Konidia berbentuk bulat hingga semibulat, berdiameter 3,6 μm, hijau pucat dan berduri (Gandjar et al, 1999).
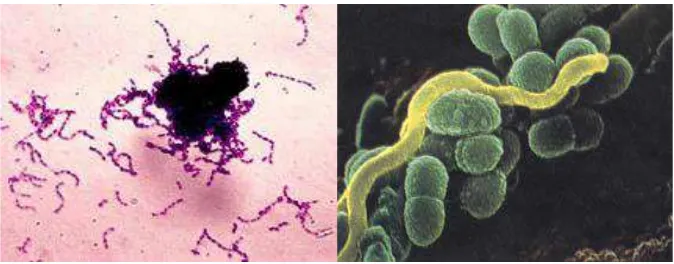
2.5.2 Streptococcus mutans
Streptococcus merupakan bakteri gram positif berbentuk bulat, nonmotil (tidak
bergerak), yang mempunyai karakteristik dapat membentuk pasangan atau rantai
selama pertumbuhannya. Bakteri ini tersebar di alam yang beberapa diantaranya
merupakan anggota flora normal pada manusia. Karies adalah suatu penyakit yang
disebabkan oleh adanya interaksi antara bakteri Streptococcus, plak dan gigi
(Brooks et al., 2001).
Streptococcus mutans merupakan kuman yang mampu membentuk karies
pada gigi karena segera membentuk asam dari karbohidrat yang dapat diragikan.
S. mutans bersifat asidogenik yaitu menghasilkan asam, asidodurik, yang mampu
tinggal pada lingkungan asam, dan menghasilkan suatu polisakarida yang lengket
disebut dextran. Oleh karena kemampuan ini, S. mutans bisa menyebabkan
lengket dan mendukung bakteri lain menuju ke email gigi, lengket mendukung
bakteri- bakteri lain, pertumbuhan bakteri asidodurik yang lainnya, dan asam
melarutkan email gigi (Nugraha, 2008). Kuman tersebut memiliki kemampuan
membuat polisakarida ekstraseluler. Polisakarida ekstraseluler ini terutama terdiri
dari polimer glukosa (Pratiwi, 2005), yang kemudian dipecah kembali oleh
mikroba tersebut. Bila karbohidrat oksigen berkurang sehingga dengan demikian
menghasilkan asam terus menerus yang menyebabkan matriks plak mempunyai
konsistensi seperti gelatin (Enayati, 2009), akibatnya bakteri terbantu untuk
melekat pada gigi serta saling melekat satu sama lain. Plak makin lama makin
tebal, sehingga akan menghambat fungsi saliva untuk melakukan aktivitas
Gambar 2.3 Streptococcus mutans (Hidayaningtias, 2008; Nugraha, 2008)
Di Indonesia penderita gigi berlubang jumlahnya tidak sedikit. Hasil
Survei Kesehatan Nasional 2002 menunjukkan prevalensi gigi berlubang di
Indonesia berkisar 60%, yang berarti dari sepuluh orang enam diantaranya
menderita gigi berlubang. Suatu pencegahan dapat meliputi penyikatan gigi yang
sering dan dengan serat halus seperti sutra. Dilakukan suatu diet yang kaya akan
zat kapur dan fluoride yang di dalam air minum membuat email gigi menjadi lebih
kuat dan mencegah karies gigi. Suatu diet karbohidrat yang lebih kompleks yaitu
diet rendah untuk gula dan tidak terdapat sukrosa dalam makanan merupakan cara
pencegahan yang efektif juga. Kemungkinan dalam penggunaan suatu vaksin
yang melawan terhadap bakteri S. mutans tidak dapat dilakukan karena ditolak
(Nugraha, 2008).
2.5.3 Salmonella typhii
Salmonella adalah bakteri batang bersifat motil, mempunyai karakteristik
memfermentasikan glukosa dan manosa (Brooks et al., 2001). Ciri-ciri Salmonella
ialah batang anaerob fakultatif yang kecil, dianggap sebagai patogen potensial,
bahkan pada orang yang kelihatannya sehat dan tersebarkan dari binatang dan
produk dari binatang ke manusia (Volk & Wheeler, 1989).
Istilah Salmonelosis digunakan untuk infeksi yang disebabkan oleh
anggota Salmonella. Manusia menjadi terinfeksi melalui penelanan makanan dan
minuman yang terkontaminasi, seperti air tercemar karena masuknya kotoran dari
hewan yang mengekskresikan Salmonella. S. typhii menyebabkan demam tifus,
abdomen, lemah, lemah saraf dan demam yang terus menerus (Volk & Wheeler,
1989). Ketika Salmonella mencapai usus kecil, kemudian masuk ke getah bening
dan ke aliran darah, mereka dibawa oleh darah ke beberapa organ, termasuk usus.
Organisme tersebut meningkat di dalam jaringan getah bening intestinal dan
dikeluarkan dalam tinja (Brooks et al., 2001).
Bentuk klasik demam tiphoid selama 4 minggu. Masa inkubasi 7-14 hari.
Minggu pertama terjadi demam tinggi, sakit kepala, nyeri abdomen, dan
perbedaan peningkatan temperatur dengan denyut nadi. 50 % pasien dengan
defekasi normal. Pada minggu kedua terjadi splenomegali dan timbul rash. Pada
minggu ketiga timbul penurunan kesadaran dan peningkatan toksemia,
keterlibatan usus halus terjadi pada minggu ini dengan diare kebiru-biruan dan
berpotensi untuk terjadinya ferforasi. Pada minggu ke empat terjadi perbaikan
klinis (Zein et al., 2004).
2.5.4 Escherichia coli
Escherichia coli merupakan basil pendek tanpa kapsul atau spora tetapi memiliki
flagel sehingga dapat bergerak. bakteri Gram negatif, berbentuk basil anerobik
(Pelczar & Chan, 2006) juga merupakan bakteri fecal dari genus Escherichia,
famili Enterobacteriaceae. E. coli merupakan flora normal yang terdapat dalam
usus pencernaan manusia yang umumnya menyebabkan diare di seluruh dunia
bila jumlahnya melebihi normal atau terlalu banyak di dalam saluran pencernaan
(Brooks et al., 2001). E. coli dalam jumlah yang banyak pada saluran pencernaan
dapat membahayakan kesehatan (Sinaga, 2008). Enterophatogenic E. coli
merupakan penyebab penting diare pada bayi khususnya di negara berkembang,
yang awalnya dihubungkan dengan terjangkitnya diare di ruang perawatan. Akibat
dari infeksi ini adalah diare yang cair, yang biasanya susah diatasi namun tidak
kronis (Brooks et al., 2001).
Pada tahun 1995, di Amerika dilaporkan bahwa dalam tiga tahun terakhir
banyak kejadian diare berdarah yaitu hemolytic uremic syndrome (HUS) pada
masyarakat yang mengkonsumsi daging sapi/burger dan susu yang tidak
dipasteurisasi. Makanan tersebut telah terkontaminasi oleh E. coli O157:H7.
O157:H7 baik secara langsung maupun tidak langsung. Utamanya bersumber dari
hewan sapi melalui teknologi industri yang mengolah makanan serta sumber lain
yang telah tercemar oleh kuman ini, misalnya di Rumah Pemotongan Hewan,
pada waktu proses pengolahan, distribusi dan penyimpanan daging karkas, pada
saat persiapan di dapur dan saat penyajian makanan. Kontaminasi dapat berasal
dari hewan produksi (peternakan) atau juga dari tenaga penjamah itu sendiri.
Sedangkan kontaminasi silang dapat terjadi bila makanan jadi yang diproduksi
berhubungan langsung dengan permukaan meja atau alat pengolah makanan
selama proses persiapan yang sebelumnya telah terkontaminasi kuman patogen
(Sartika et al., 2005).
Penularan diare menyebar melalui jalur fekal-oral, penularannya dapat
dicegah dengan menjaga higienis pribadi yang baik. Ini termasuk sering mencuci
tangan setelah keluar dari toilet dan khususnya selama mengolah makanan.
Kotoran manusia harus diasingkan dari daerah pemukiman, dan hewan ternak
harus terjaga dari kotoran manusia. Makanan dan air merupakan penularan yang
utama, sehingga harus diberikan perhatian khusus (Zein et al., 2004).
Diare yang disebabkan oleh bakteri biasanya diobati dengan memberi
bahan yang mampu dijadikan sebagai antimikroba. Zat antimikroba yang ideal
memiliki toksisitas selektif lebiih bersifat relatif dan bukan absolut, artinya
penggunaan dengan konsentrasi tertentu berbahaya bagi parasit tetapi tidak
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Agustus 2013 di
Laboratorium Mikrobiologi dan Laboratorium Penelitian Fakultas Matematika
dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2Alat dan Bahan
Alat yang digunakan ialah autoklaf, oven, timbangan analitik, cawan petri, labu
Erlenmeyer, inkubator, mikroskop, kaca objek, cover glass, gelas ukur, gelas
beaker, spatula, tabung reaksi, handspray, propipet, bunsen, jarum ose, cork
borer, rak tabung reaksi, pipet serologi, karet penghisap, spektrofotometer, rotary
evaporator, sentrifus, tabung sentrifuse, jangka sorong dan mikropipet.
Bahan yang digunakan dalam penelitian ini ialah isolat bakteri endofit dari
batang dan akar tanaman obat tapak dara (Catharanthus roseus), isolat A. flavus,
S. mutans, E. coli, S. thypii, akuades, alkohol 70%, alkohol 75%, natrium
hipoklorit 5,3%, zat pewarna Gram, media-media uji biokimia triple sugar iron
agar (TSIA), simon sitrat agar (SCA), sulfid indol motility (SIM), starch agar
(SA), gelatin, H2O2 3%, media nutrient agar (NA), media potato dextrose agar
(PDA), agar, cakram kertas kosong, ketokonazol, kloramfenikol, cotton bud,
nystatin, media mueller hinton agar (MHA), metanol, kertas saring, aluminium
foil, dimetilsulfoksida (DMSO), larutan kekeruhan 0,5 standar McFarland.
3.3 Isolat Beberapa Mikroba Patogen
Isolat beberapa mikroba A. flavus, S. mutans, S. thypii dan E. coli
diperoleh dari Laboratorium Mikrobiologi, Departemen Biologi, Universitas
3.4 Isolasi Bakteri Endofit dari Batang dan Akar Tanaman Dara
Bakteri endofit yang diisolasi dari tanaman tapak dara terlebih dahulu
disterilkan permukaan batang dan akarnya dengan menggunakan metode Radu &
Kqueen (2002) yang dimodifikasi (dapat dilihat pada Lampiran A hlm. 39).
Bagian akar dan batang tanaman (3-5 cm) dicuci dengan air mengalir selama 20
menit, kemudian akar dan batang tersebut disterilkan bagian permukaannya
dengan merendamnya secara berturut-turut dalam larutan etanol 75% selama 2
menit, larutan natrium hipoklorit 5,3% selama 5 menit, dan etanol 75% selama 30
detik. Selanjutnya akar dan batang tersebut dibilas dengan akuades steril sebanyak
2 kali, dan dikeringkan dengan kertas saring steril. Setelah kering, bagian ujung
kiri dan kanan dari akar dan batang tanaman dibuang lebih kurang 1 cm, lalu
masing-masing dipotong manjadi 2 bagian dan diletakkan pada permukaan media
NA yang telah dicampurkan dengan antibiotik ketokonazol (0,3 gram/100 ml)
dengan posisi bekas potongan ke arah media yang kemudian diinkubasi pada suhu
ruang (25-30 oC) selama lebih kurang 1-3 hari. Koloni yang muncul dari bagian
akar dan batang tanaman sebelah dalam disubkulturkan ke media NA yang baru
sampai diperoleh biakan murni.
3.5 Karakterisasi dan Identifikasi Bakteri Endofit
Identifikasi isolat murni bakteri endofit dilakukan berdasarkan ciri-ciri dan
karakter morfologis, secara makroskopis maupun mikroskopis (dapat dilihat pada
Lampiran B hlm. 40). Karakterisasi dan identifikasi secara visual berdasarkan
struktur dan warna koloni. Identifikasi secara mikroskopis dilakukan dengan
mengamati morfologinya dengan pewarnaan Gram serta uji biokimia metabolisme
bakteri seperti uji sitrat, uji gelatin, uji mortilitas, uji sulfida, uji katalase dan uji
hidrolisis pati (Lay, 1994).
3.6 Uji Daya Hambat Bakteri Endofit terhadap Bakteri Patogen
Kemampuan bakteri endofit menghambat pertumbuhan bakteri patogen
diuji dengan uji antagonis secara in vitro (dapat dilihat pada Lampiran C hlm. 41).
suspensi bakteri endofit yang telah dibuat dengan kekeruhan yang sama
diinokulasikan pada kertas cakram kosong dengan diameter 0,6 cm di bagian tepi
media dengan menggunakan mikropipet sebanyak 10 µl, dibuat 2 kali
pengulangan dan biakan diinkubasi pada suhu 28-30 oC selama 1-3 hari. Aktivitas
penghambatan ditentukan berdasarkan luas zona hambat yang terbentuk di sekitar
koloni bakteri endofit. Diameter zona hambat tersebut diukur dengan
menggunakan jangka sorong. Pengamatan dimulai dari hari pertama sampai hari
kedua (Suryanto et al., 2006).
3.7 Uji Daya Hambat Bakteri Endofit terhadap A. flavus
Kemampuan bakteri endofit menghambat pertumbuhan jamur A. flavus diuji
dengan uji antagonis secarain vitro (dapat dilihat pada Lampiran D hlm. 42). Pada
jamur patogen, tepi bagian yang aktif tumbuh diambil dengan menggunakan cork
borer, diinokulasikan pada media agar MHA tepat di tengah media dan diinkubasi
selama 2-3 hari. Selanjutnya suspensi bakteri endofit yang telah dibuat dengan
dengan OD600≈ 0,5 setara 108 CFU/ml yang diukur dengan menggunakan spektrofotometer diinokulasikan pada kertas cakram kosong berdiameter 0,6 cm
sebanyak 10 µl di bagian tepi media, dan dibuat sebanyak 2 kali pengulangan.
Biakan diinkubasi pada suhu 28-30 oC selama 1-3 hari. Akitivitas penghambatan
ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni. Diameter
zona hambat dihitung dengan mengukur selisih radial pertumbuhan miselium
jamur yang terhambat oleh isolat bakteri. Pengamatan dimulai dari hari ke-4
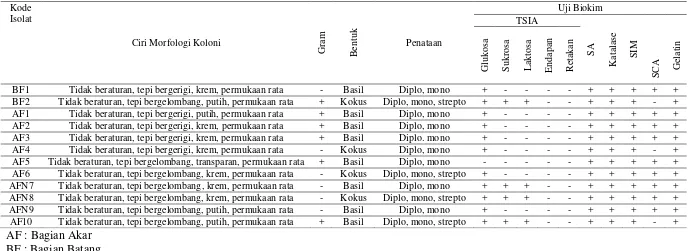
Gambar 3.1 Metode pengukuran zona hambat bakteri endofit terhadap koloni jamur; A. Koloni jamur; B. Zona hambat bakteri endofit terhadap koloni jamur; C. Titik tengah jamur diletakkan; D. Koloni bakteri endofit; X. Diameter koloni jamur yang terhambat pertumbuhannya; Y. Diameter koloni jamur normal. hambat yang terbentuk di sekitar koloni (Suryanto et al., 2006).
Pengukuran jari-jari zona hambat bakteri dilakukan dengan menggunakan
jangka sorong. Jari-jari zona hambat bakteri endofit =
Keterangan: Y= Diameter jamur yang tidak terhambat.
X= Dimeter jamur yang terhambat.
3.8 Ekstraksi Bahan Antimikroba dari Bakteri Endofit dengan Pelarut Metanol
Ekstraksi bahan metabolit sekunder bakteri yang memiliki aktivitas
antimikroba dilakukan berdasarkan metode yang pernah dilakukan oleh Nofiani et
al. (2009) yang dimodifikasi (dapat dilihat pada Lampiran E hlm. 43). Dua bakteri
endofit yang memiliki aktivitas penghambatan yang berpotensi dibuat suspensi
dengan dengan OD600≈ 0,5 setara 108 CFU/ml yang diukur dengan menggunakan spektrofotometer. Suspensi bakteri endofit tersebut disebarkan dengan cotton bud
pada permukaan media padat NA sebanyak 5 petri dan diinkubasi selama 5-6 hari.
Media padat tersebut selanjutnya dipotong kecil-kecil dan direndam dengan
metanol sebanyak 150 ml dalam Erlenmeyer selama 72 jam dan dibungkus
dengan alumunium foil untuk menghindari kerusakan karena cahaya. Maserat
diambil dengan cara disaring dengan kertas saring. Perendaman dilakukan
sebanyak 3 kali. Semua maserat yang terkumpul disentrifugasi pada kecepatan
evaporator putar dengan suhu tidak lebih dari 50 ± 2 ºC untuk memisahkan pelarut
metanol dengan ekstraknya sampai diperoleh ekstrak yang siap untuk digunakan
(Suryanto, 2006).
3.9 Uji Aktivitas Ekstrak Metanol Bakteri Endofit terhadap Beberapa Mikroba Patogen
Pada uji aktivitas ekstrak metanol bakteri endofit terhadap bakteri dan
jamur patogen digunakan media MHA (dapat dilihat pada Lampiran F dan G hlm.
44-45). Pada media ditumbuhkan beberapa mikroba patogen dengan cara hapusan
suspensi yang sudah disesuaikan dengan dengan OD600≈ 0,5 setara 108 CFU/ml yang diukur dengan menggunakan spektrofotometer, khusus untuk jamur patogen
A. flavus terlebih dahulu diinokulasikan pada media selama 2-3 hari dengan suhu
ruang 25–30 ºC dengan menggunakan cork borer. Masing-masing ekstrak metanol bakteri endofit dilarutkan dengan DMSO dengan konsentrasi
masing-masing 40, 60, 80 dan 100%. Larutan DMSO digunakan untuk kontrol (-),
sedangkan kontrol (+) pada bakteri digunakan kertas cakram kloramfenikol 10 μg dan untuk jamur digunakan kertas cakram nystatin. Selanjutnya sebanyak 10 μl ekstrak bakteri endofit yang sudah diencerkan degan DMSO diteteskan pada
kertas cakram kosong dengan menggunakan mikropipet kemudian diletakkan
pada media yang sudah diinokulasikan mikroba patogen. Pengujian kemampuan
ekstrak metanol bakteri endofit dilakukan dengan uji cakram metode
Kirby-Bauer. Cawan uji kemudian diinkubasi pada suhu ruang 25-30 oC selama 1-3 hari.
Aktivitas antibiotik bakteri endofit ditunjukkan dengan adanya zona hambat pada
pertumbuhan mikroba patogen di sekitar koloni, kemudian diamati dan diukur
diamer zona hambat yang terbentuk.
3.10 Pengamatan Hifa Abnormal
Pengamatan dilakukan dengan 2 cara yaitu secara visual dan mikroskopis
(dapat dilihat pada Lampiran H hlm. 46). Pengamatan secara visual dilakukan
dengan cara melihat luas pertumbuhan miselium jamur. Pengamatan hifa
abnormal secara mikroskopis dilakukan dengan cara mengamati ujung miselium
permukaan media agar MHA dipotong berbentuk block square, yang kemudian
diletakkan pada objek gelas, selanjutnya diamati di atas mikroskop adanya
abnormalitas pertumbuhan hifa jamur. Pengamatan abnormalitas miselium jamur
diperoleh dari perubahan struktur hifa seperti hifa menggulung, membengkok dan
BAB 4
HASIL DAN PEMBAHASAN
4.1Isolasi dan Karakterisasi Bakteri Endofit dari Akar dan Batang Tanaman Tapak Dara (Chataranthus roseus)
Dari hasil isolasi yang dilakukan terhadap akar dan batang tanaman tapak dara
(Chataranthus roseus) diperoleh 12 isolat bakteri yang memiliki karakterisasi
yang berbeda. Dari bagian akar tanaman diperoleh 10 isolat sedangkan pada
bagian batang tanaman diperoleh 2 isolat. Karakterisasi yang dilakukan terhadap
isolat bakteri yang diperoleh meliputi bentuk morfologi sel, morfologi koloni,
pewarnaan Gram, penataan dan uji biokimia yang dapat dilihat pada Tabel 4.1.1.
Dari hasil pengamatan dapat diketahui bahwa isolat bakteri yang diperoleh
sebagian besar merupakan Gram-positif dan Gram-negatif yang masing-masing
diperoleh 6 isolat. Hasil Gram positif dan Gram negatif yang diperoleh
disebabkan oleh perbedaan kandungan dinding sel bakteri, pada dinding sel Gram
positif kandungan senyawa peptidoglikan lebih tebal dibandingkan dengan
dinding sel Gram negatif.
Dari hasil uji biokimia tersebut dapat diketahui bahwa kedua belas isolat
tersebut memiliki karakteristik yang berbeda, walaupun terdapat beberapa hasil uji
biokimia yang sama pada beberapa isolat bakteri endofit tersebut, seperti pada
isolat BF1, AF1, AF2, AF3, AF6, dan AFN9 yang mampu menghidrolisis pati dan
gelatin, uji positif pada sitrat yang berarti menggunakan sitrat sebagai sumber
nitrogen. Pada uji hidrogen sulfida dan fermentasi gula hanya mampu
memfermentasikan glukosa saja, tidak ditemukan endapan hitam dan retakan pada
media, serta memiliki pergerakan dan terdapat gelembung udara pada uji katalase.
Isolat BF2 pada uji hidrogen sulfida dan fermentasi gula mampu
memfermentasikan glukosa dan sukrosa, sedangkan pada isolat AF5 tidak mampu
memfermentasikan glukosa, sukrosa maupun laktosa, pada isolat AF7, AF8 dan
Keterangan:
4.2 Daya Hambat Isolat Bakteri Endofit terhadap Mikroba Patogen
Isolat bakteri endofit yang diperoleh selanjutnya dilakukan uji antagonis untuk
melihat kemampuannya dalam menghambat pertumbuhan mikroba patogen.
Mikroba patogen yang digunakan yaitu Salmonella typhii, Escherichia coli,
Steptococcus mutans, dan Aspergillus flavus. Dasar pemilihan mikroba patogen
tersebut adalah mewakili mikroba patogen penyebab penyakit serta
masing-masing organisme mewakili bakteri Gram positif, Gram negatif, dan kapang dari
kelompok jamur. Hasil uji antagonis isolat bakteri endofit dapat dilihat pada Tabel
4.2.1.
Tabel 4.2.1 Uji Antagonis Isolat Bakteri Endofit terhadap Mikroba Uji
Kode
tersebut dapat menghambat mikroba patogen dengan hasil yang bervariasi karena
memiliki karakteristik yang berbeda juga, yang terlihat pada Tabel 4.1.1 sehingga
menghasilkan metabolit yang berbeda juga. Mikroba atau bakteri yang
menghasilkan suatu bahan antibiotik atau antimikroba mampu membunuh atau
menghambat pertumbuhan mikroba lainnya. Menurut Radji (2005), mikroba
endofit memiliki kemampuan menghasilkan senyawa metabolit yang sama seperti
inangnya berupa antimikroba dalam menghambat pertumbuhan mikroba lainnya.
Dalam penelitian ini terdapat 8 isolat mampu menghambat semua mikroba uji
isolat lainnya tidak mampu menghambat beberapa mikroba uji, yaitu isolat
AFN10, AF1, AF5 dan AF6. Pada isolat BF1 memiliki luas zona hambat terbesar
pada A. flavus sebesar 10,00 mm di hari kedua, selain itu juga pada isolat bakteri
AFN9 sebesar 9,59 mm terhadap E. coli pada hari pertama dan mengalami
penurunan pada hari kedua sedangkan pada isolat AFN10 memiliki luas zona
hambat sebesar 8,09 mm pada hari pertama dan pada hari kedua juga mengalami
penurunan zona hambat.
Berdasarkan klasifikasi respon hambat pertumbuhan bakteri menurut
Greenwood (2000) dalam Alfath et all. (2013), diameter zona hambat >20 mm
memiliki respon hambat yang kuat; 16-20 mm memiliki respon hambat yang
sedang; 10-15 mm memiliki respon hambat yang lemah; dan <10 mm tidak
memiliki respon zona hambat. Dari klasifikasi di atas dapat dibandingkan dengan
hasil yang diperoleh bahwa diameter zona hambat isolat bakteri endofit memiliki
respon yang lemah terhadap mikroba uji namun, tetap memiliki kemampuan
dalam menghambat mikroba uji walaupun tidak terlalu besar.
Gambar 4.1 Uji Antagonis Isolat Bakteri Endofit Terhadap Mikroba Patogen A. flavus (a) Isolat BF2 selama 48 jam (b) Isolat BF1 selama 48 jam (c) Isolat AFN7 selama 24 jam (d) Isolat AF6 selama 48 jam
Beberapa isolat bakteri memiliki potensi yang cukup baik dalam
menghambat mikroba patogen uji. Pada isolat BF1 memiliki zona hambat terbesar
a b
pada A. flavus 10,00 mm, AF2 memiliki hambatan terbesar terhadap E. coli
sebesar 8,02 mm pada hari pertama, sedangkan pada isolat AF3 mengalami
peningkatan zona hambat pada hari kedua sebesar 7,10 mm terhadap S. typhii.
Pada isolat AF2 terhadap S. mutans diperoleh data pada hari pertama
memiliki zona hambat 6,17 mm namun, pada hari yang kedua tidak terdapat lagi
zona hambat. Hal ini dapat disebabkan karena beberapa faktor, antara lain yaitu
tidak dihasilkan lagi metabolit sekunder dalam menghambat pertumbuhan
mikroba uji, dan daya hambat metabolit isolat yang kurang baik. Selain itu juga
tergantung dari sifat isolat bakteri, baik bersifat bakteriostatik maupun
bakteriosidal. Menurut Dalimunthe (2009), bakteriostatik yaitu bakteri yang
menghambat atau menghentikan laju pertumbuhan mikroba uji sehingga zona
hambat yang terbentuk tidak terlihat jelas atau hanya akan terlihat zona keruh saja,
sedangkan bakteriosidal bersifat membunuh mikroba uji sehingga zona hambat
yang terbentuk terlihat lebih jelas.
Hasil uji tersebut menunjukkan bahwa isolat bakteri endofit dapat
menghambat mikroba patogen dengan kemampuan yang berbeda-beda dengan
menghasilkan metabolit yang berbeda-beda juga. Salah satu hal yang
menyebabkannya yaitu kandungan media. Menurut Kumala et al. (2006),
kandungan suatu media pada hakekatnya merupakan kondisi dimana mikroba
umumnya akan menghasilkan senyawa metabolit sekunder untuk
mempertahankan hidupnya. Menurut Barry & Wainwright (1997), umumnya
metabolit sekunder tidak terbentuk jika lingkungan tumbuh yang mengandung
cukup nutrien untuk pertumbuhan bakteri karena senyawa tersebut bukan unsur
esensial bagi pertumbuhan dan reproduksi sel.
Ketika isolat bakteri berada pada fase pertumbuhan (fase logaritma),
bakteri melakukan aktivitas pembelahan sel dengan mengkonsumsi nutrien yang
tersedia di media tumbuh. Pada saat nutrien mulai berkurang maka bakteri akan
memasuki fase stasioner dan pada fase ini diduga terjadi pembentukan senyawa
metabolit sekunder yang bersifat antimikroba. Aktivitas antimikroba terbentuk
setelah memasuki fase stasioner mengikuti mekanisme quorum sensing yang
merupakan sistem komunikasi antar sel dalam merespon perubahan lingkungan.
pertahanan melawan mikroba lain (Whitehead et al., 2001; Tinaz, 2003). Salah
satu faktor yang mempengaruhi pembentukan metabolit yaitu nutrien dan laju
pertumbuhan bakteri. Sintesis metabolisme sekunder sering dikodekan oleh gen
pada DNA yang ada di kromosom (Demain, 1998).
Dari uji yang dilakukan terdapat beberapa isolat bakteri yang tidak dapat
menghambat salah satu atau beberapa dari mikroba uji yaitu AFN10, AF1, AF5
dan AF6. Beberapa dugaan yang menyebabkan isolat tersebut tidak mampu
menghambat mikroba uji menurut Nofiani et al. (2009), yaitu isolat bakteri
tersebut menghasilkan senyawa antimikroba namun tidak bersifat aktif terhadap
bakteri uji ataupun bakteri menghasilkan senyawa antimikroba secara intraseluler
sehingga senyawa antimikroba yang dihasilkan oleh bakteri tersebut tidak
terekskresi dan terakumulasi dalam media tumbuh. Selain itu juga terdapat
beberapa isolat yang zona hambatnya terlihat pada hari ke dua seperti pada AF1
dan AF5 terhadap E. coli dan AF4 terhadap S. typhii, hal ini disebabkan metabolit
sekunder dari bakteri endofit tersebut dihasilkan lebih banyak pada hari kedua
sehingga besar zona hambat lebih terlihat jelas pada hari kedua dibandingkan
dengan hari pertama. Dari hal ini dapat diketahui bahwa setiap isolat bakteri yang
diperoleh menghasilkan metabolit yang berbeda-beda dalam menghambat
mikroba uji.
4.3 Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit
Dari 12 isolat bakteri endofit dipilih 2 isolat yang cukup berpotensi dalam
menghambat semua mikroba patogen uji untuk dilakukan ekstraksi bakteri yaitu
isolat BF1 dan AFN9, selain mampu mampu menghambat semua mikroba uji juga
karena memiliki diameter zona hambat terbesar dibanding dengan 10 isolat
lainnya. Mikroba patogen uji yang digunakan sama seperti mikroba patogen uji
pada uji antagonis sel bakteri. Ekstraksi bakteri dilakukan dengan menggunakan
pelarut metanol.
Hasil uji ektstrak bakteri endofit BF1 dan AFN9 memiliki kemampuan
dalam menghambat mikroba patogen dengan hasil yang berbeda-beda dapat diliat
pada Tabel 4.3.1. Dari tabel tersebut terdapat beberapa persen dari ekstrak isolat
media, karena media merupakan salah satu faktor yang mempengaruhi mikroba
atau bakteri dalam menghasilkan metabolit sekunder (Kumala et al., 2006;
Nofiani et al., 2009).
Tabel 4.3.1 Uji Aktivitas Antimikroba Ekstrak Metanol terhadap Mikroba Uji
Patogen
Konsentrasi Ekstrak
(%)
Diameter Zona Hambat terhadap Patogen (mm)
BF1 AFN9
K+ = Kontrol dengan menggunakan kloramfenikol pada bakteri dan nistatin pada jamur
Dari data yang diperoleh dapat dilihat bahwa ekstrak bakteri AFN9
memiliki kemampuan menghambat tertinggi pada konsentrasi 100% dengan
mikroba uji E. coli pada hari pertama sebesar 16,04 mm, sedangkan pada hari
keduanya mengalami penurunan zona hambat. Pada ekstrak bakteri BF1 memiliki
zona hambat terbesar dengan konsentrasi 100% sebesar 13,09 mm di hari pertama,
dan pada hari kedua juga mengalami penurunan zona hambat. Hal ini disebabkan
mudah menguapnya ekstrak bakteri pada konsentrasi 100% dibandingkan dengan
40%, 60% dan 80% karena ditambahkan dengan pelarut DMSO yang merupakan
senyawa yang memiliki toksisitas yang rendah dan mampu melarutkan lebih dari
100 jenis senyawa, baik senyawa yang bersifat polar maupun non-polar.
Kemampuan pelarut DMSO sebagai pelarut universal dan tidak bersifat toksik
yang membuat banyak penelitian menggunakan pelarut ini (Engriyani, 2012).
Pada mikroba uji S. typhii zona hambat terbesar pada ekstrak BF1 sebesar
7,34 mm pada hari pertama dengan konsentrasi 100%, sedangkan pada ekstrak
AFN9 sebesar 9,70 mm. Zona hambat terbesar pada mikroba uji E. coli yaitu
13,09 mm pada ekstrak BF1, dan 16,04 mm pada ekstrak AFN9 dengan
konsentrasi 100% di hari pertama. Ekstrak BF1 pada hari pertama mampu
menghambat S. mutans dengan zona hambat terbesar 8,21 mm dengan konsentrasi
100%, sedangkan pada ekstrak AFN9 memiliki zona hambat 10,85 mm pada hari
pertama dengan konsentrasi 80%. Namun pada mikroba uji A. flavus, ekstrak BF1
dan AFN9 yang memiliki zona hambat terbesar pada konsentrasi 80% di hari
kedua yaitu sebesar 9,50 mm dan 10,85 mm. Hal ini dapat diduga karena pada
hari pertama jamur A. flavus belum sepenuhnya tumbuh, sehingga ekstrak bakteri
belum dapat menghambat dengan maksimal.
Penelitian ini menggunakan pelarut metanol dalam mengekstrak isolat
bakteri endofit, hal ini karena dalam penelitian sebelumnya yang dilakukan oleh
Nasution (2011), mendapatkan hasil ekstrak bakteri dengan menggunakan
metanol merupakan ekstrak bakteri yang paling unggul dan memiliki kemampuan
menghambat yang lebih besar dibandingkan dengan ekstrak bakteri etil asetat dan
n-heksan. Dari hasil penelitian tersebut dapat diketahui bahwa pelarut metanol
memiliki kemampuan yang baik dalam mengekstraksi suatu bahan dan
peningkatan proton dari dalam sel yang menyebabkan lisisnya sel sehingga
senyawa metabolit yang ada berdifusi ke dalam pelarut dan memperoleh hasil
ekstraksi dengan jumlah yang lebih banyak dibanding dengan pelarut lainnya.
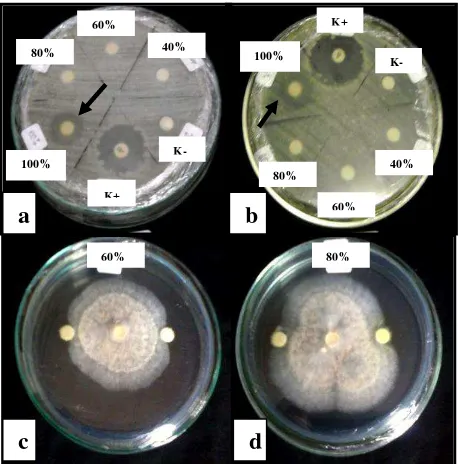
Gambar 4.2 Hasil Uji Antagonis Ekstrak Bakteri Endofit selama 48 jam (a) Ekstrak BF1 terhadap S. mutans (b) Ekstrak AFN9 terhadap E. coli
(c) Ekstrak AFN9 60% terhadap A. flavus (d) Ekstrak AFN9 80% terhadap A. flavus
Kontrol negatif dari penelitian ini menggunakan DMSO yang ditetesi pada
kertas cakram dan kontrol positif menggunakan kloramfenikol sebagai antibakteri
dan nistatin sebagai antijamur komersial. Nilai zona hambat dari kontrol positif
memiliki kemampuan yang lebih besar dalam menghambat mikroba patogen uji.
Kloramfenikol sebagai kontrol positif merupakan antimikroba yang memiliki
sifat bakteriostatik, yaitu menghambat atau menghentikan laju pertumbuhan
bakteri. Nistatin merupakan antifungal dari golongan poliena yang aman terhadap
sel mamalia, yang bekerja mengikat sterol (terutama ergosterol) pada membran sel
fungi (Ridawati et al., 2011).
Dari data yang dihasilkan, banyak diameter zona hambat yang berbeda,
hal ini dikarenakan kemampuan daya hambat ekstrak bakteri endofit
berbeda-beda, bahkan terdapat beberapa konsentrasi ekstrak bakteri yang tidak mampu
menghambat mikroba patogen uji. Seperti pada ekstrak BF1 konsentrasi 40% dan