Lampiran 1. Isolasi Bakteri Endofit dari Akar dan Batang Keji Beling
Dicuci dengan air mengalir selama 20 menit Disterilisasi bagian permukaan dengan cara direndam dalam larutan etanol 75% selama 2 menit
Direndam dalam larutan sodium hipoklorit 5,3% selama 5 menit
Direndam dalam larutan etanol 75% selama 30 detik
Dibilas dengan akuades steril sebanyak 2 kali
Dikeringkan dengan kertas saring steril Dibuang bagian ujung kiri dan kanan ±1 cm Dipotong menjadi 4 bagian
Diletakkan di atas media NA+ketokonazol 0,3 g/100ml dengan posisi bekas potongan ke arah media
Diinkubasi pada suhu 28-30oC selama 24 jam
Disubkultur pada media NA Akar dan batang
tanaman keji beling
Akar dan batang steril
Koloni bakteri endofit
Lampiran 2. Karakterisasi Isolat Bakteri Endofit
Dikarakterisasi
Diamati Uji sitrat
Uji gelatin Uji motilitas Uji sulfida Uji katalase Bakteri endofit
Uji Biokimia
Hasil
Lampiran 3. Uji Daya Hambat Isolat Bakteri Endofit terhadap Jamur Patogen
Diinokulasikan inokulum A. flavus di bagian tengah media
Diinkubasi pada suhu 28-30oC selama
2-3 hari
Dibuat jarak 3,5 cm dari hifa terluar
Diletakkan cakram yang telah ditetesi dengan suspensi bakteri pada jarak yang telah ditentukan
Diinkubasi pada suhu 28-30oC selama 3 hari
Diamati dan dihitung zona hambat yang terbentuk
Diletakkan cakram yang telah ditetesi dengan suspensi bakteri pada jarak yang telah ditentukan
Diletakkan cakram pembanding Nystatin
Diinkubasi pada suhu 28-30oC selama 3 hari
Diamati dan dihitung zona hambat yang terbentuk Media MHA
Hasil
Hasil Hasil
Lampiran 4. Uji Daya Hambat Isolat Bakteri Endofit terhadap Bakteri Patogen
Diinokulasikan mikroba patogen dengan metode usap menggunakan cotton bud dengan absorbansi 0,5 standar Mc-Farland 108 CFU/ml
Diletakkan cakram kertas yang telah ditetesi dengan suspensi bakteri endofit pada jarak yang telah ditentukan
Diletakkan cakram pembanding yaitu khloramphenikol
Diinkubasi pada suhu 28-30oC selama 3
hari
Diamati dan dihitung zona hambat yang terbentuk
Lampiran 5. Ekstraksi Bakteri Endofit
Ditumbuhkan pada media Nutrient Agar (NA) Disaring sebanyak 3 kali ulangan
Lampiran 6. Pengamatan Hifa Abnormal Jamur
Diambil berbentuk block square Diletakkan di atas object glass
Diamati pertumbuhan abnormal hifa (baik pecah, berbelah, bercabang, lisis dan kerdil)
Lampiran 7. Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit terhadap bakteri dan jamur Patogen
Dituang ke dalam cawan petri Dibiarkan memadat
Diinokulasikan inokulum A. flavus pada bagian tengah media Diletakkan cakram yang telah ditetesi dengan ekstrak bakteri endofit (konsentrasi 40, 60, 80, 100%) pada jarak yang telah ditentukan sebanyak 10 µl Dibuat kontrol pembanding dengan menggunakan cakram Nystatin patogen dengan metode usap menggunakan cotton bud
Diletakkan cakram yang telah ditetesi dengan ekstrak bakteri endofit (Konsentrasi 40, 60, 80,
Lampiran 8. Dokumentasi penelitian
a. Isolat bakteri endofit
Keterangan gambar: a. AJ7
b. BJ1 c. BJ2 d. BJ3 e. BJ4 f. BJ5
a b c
b. Hasil uji biokimia
Uji Sitrat Uji TSIA Uji Katalase
c. Cara kerja
Pencacahan kultur bakteri endofit Rotarievaporasi supernatan bakteri endofit
d. Hasil
DAFTAR PUSTAKA
Bata, A and Lasztity, R. 1999. Detoxification of Mycotoxin Contaminated Food and Feed by Microorganism. Trendsin Food Science and Technology 10: 223-228. Bauer AW, Kirby WMM, Sherris JC, Turck M. 1966. Antibiotic Susceptibility Testing
by a Standardized Single Disk Method. Am J Clin Pathol. 36: 493-496
Coallier., and E. S. Idziak. 1985. Interaction between Streptococcus lactis and Aspergillus flavus on Production of Aflatoxin. Microbiol 49:163-167.
Cotty, P.J. and J.E. Melon. 2004. The Use of Atoxigenic Strains of A. flavus to Prevent Aflatoxin Contamination. Food and Feed Safety Unit, SRRC, New Orleans, LA. Djamaan,A., Helmi, A.,dan Hendri. 1993. Penelitian Pendahuluan Penapisan Mikroorganisme Tanah yang Dapat Menghasilkan Senyawa Antibiotika dari Sampel Tanah Kawasan Hutan Raya Bung Hatta Padang. Majalah Farmasi Indonesia. 4(3): 107 – 112.
Drew WL, Barry AL, O’Tool R, Sherris JC. 1971. Reliability of The Kirby-Bauer Disc Diffusion Method for Detecting Methicilin-Resistant Strains of Staphylococcus aureus. Appl Microbiol. 24(2): 240-247.
Gandjar I, Samson RA, Karin VA, Oetari dan Iman S. 1999. Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia. Jakarta.
Hallmann, J., A. uadt-Hallman, W. F. Mahafee and J. W. Kloepper. 1997. Bacterial Endophytes in Agricultural Crops. Can J Microbio. 43: 895-914.
Hawley, L. B. 2003. Intisari Mikrobiologi dan Penyakit Infeksi. Hipokrates. Jakarta Jawetz E, Melnick J, and Adelberg E. 2001. Mikrobiologi Kedokteran. Edisi ke 20.
Penerbit buku kedokteran. Jakarta.
2005. Mikrobiologi untuk Profesi Kesehatan. Diterjemahkan oleh Huriati dan Hartanto. Penerbit buku kedokteran EGC. Jakarta.
Kumala S, Fransisca S dan Priyo W. 2006. Aktivitas Antimikroba Metabolit Bioaktif Mikroba Endofitik Tanaman Trengguli (Cassia fistula L.). Jurnal Farmasi Indonesia. 3(2): 97-102.
Lay, B. W. 1994. Analisis Mikroba di Laboratorium. Grasindo Persada. Jakarta. LIPI. 2009. Tanaman Obat (Kolesterol). UPT-Balai Informasi Teknologi LIPI. Pangan
Lorito MG, Harman E, Hayes CK, Broadway RM, Tronsmo SL, Woo and Di Pietro A. 1992. Chitinolytic Enzimes Produced by Tricoderma harzianum: Antifungal Activity or Purified Endochitinase and Chitobiosidase. Phytopathol. 83: 302-307.
Mangundjaja, S. 2002. Pengaruh Jamu terhadap Streptococcus mutans dan Stomatitis Aftosa Rekuren pada Pengidap HIV (satu kasus). Makalah. Jakarta: Fakultas Kedokteran Gigi Universitas Indonesia.
Massey, T.E., Steward, R.K. Daniels, J.M. and L. Ling. 1995. Biochemical and Moleculer Aspects of Mammalian Susceptibility to Aflatoxin B1 Cacinogenicity.
Mehan, V. K., Mc Donald, D, Haravu, L. J. and Jayanthi, S. 1991. The Groundnut Aflatoxin Problem Review and Literature Database. International Crops Research Institute for the Semi Arid Tropics. India.
Melliawati, R. 2009. Escherichia coli dalam kehidupan manusia. BioTrends. 4(1): 10-14.
Misgyarta dan Suarni. 2005. Kontaminan Aflatoksin Dihasilkan oleh Aspergillus flavus pada Jagung dan Penangannya. Prosiding Seminar Nasional Jagung. Makassar:. Balitsereal.
Mishra KK, Srivastava S, Gorg A, Ayyagari A. 2006. Antibiotic Susceptibility of Helicobacter pylori Clinical Isolates: Comparative Evaluation of Disk-Diffusion and E-test Methods. Current Microbiology. 53: 329-334.
Mycek, M. J. 2001. Farmakologi: Ulasan bergambar. Edisi 2. Widya medika. Jakarta. Nofiani R, Nurbetty S, Sapar A. 2009. Aktivitas Antimikroba Ekstrak Metanol Bakteri
Berasosiasi dengan Spons dari Pulau Lemukutan Kalimantan Barat. Jurnal Ilmu dan Teknologi Kelautan Tropis. 1(2): 33-41.
Nugraha, A. W. 2008. Streptococcus mutans si Plak Dimana-Mana. Universitas Sanata Dharma. Yogyakarta.
Petrini, O, Sieber TN, Toti L, Viret O. 1992. Ecology, Metabolite Production and Substrate Utilization in Endophytic Fungi. Natural toxins 1: 185-196.
Purwoko, T. 2007. Fisiologi Mikroba. Bumi Aksara. Jakarta.
Radji, M. 2005. Peranan Bioteknologi dan Mikroba Endofit dalam Pengembangan Obat Herbal. Majalah Ilmu Kefarmasian 2(3): 113-126.
Rahmiati. 2011. Penapisan Fungi Penghasil Antibiotik dari Tanah Bangka dan Taman Wisata Alam Sibolangit serta Potensinya dalam Menghambat beberapa Fungi Patogen Tanaman. [Skripsi]. Medan. Departemen Biologi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sumatera Utara.
Rio Y, Djamal A dan Asterina. 2012. Perbandingan Efek Antibakteri Madu Asli Sikabu dengan Madu Lubuk Minturun terhadap Escherichis coli dan Staphylococcus aureus secara In Vitro. Jurnal kesehatan Andalas. 1(2): 59-62.
Sabir, A. 2005. Aktivitas Antibakteri Flavonoid Propolis Trigona sp. terhadap Bakteri Streptococcus mutans (in vitro). Majalah Kedokteran Gigi. 38(3): 135-141. Safika, 2008. Korelasi Aspergillus flavus dengan konsentrasi aflatoksin B1 pada Ikan
Kayu. Aceh: Fakultas Kedokteran Hewan. 2(2): 170-175.
Sharma P K., Sarita S., Prell J. 2005. Isolation and Characterization of an Endophytic Bacterium Related to Rhizobium/Agrobacterium from Wheat (Triticum aestivum L) Roots. Current Sci. 89: 608-610.
Simarmata, R., Lekatompessy, S., dan Sukiman, H. 2007. Isolasi Mikroba Endofitik dari Tanaman Obat Sambung Nyawa (Gynura procumbens) dan Analisis Potensinya sebagai antimikroba. Berkala Penelitian Hayati. 13: 85-90.
Song, Y. 1998. Isolation and Cultivation of Endophyte Fungi. Asian Network on Microbial Reseacher. Gadjah Mada University. Yogyakarta. 255-258.
Strobel GA and Daisy B. 2003. Bioprospecting for Microbial Endophytes and Their Natural Products. Microbiology and Molecular Biology Reviews. Microbiol. 67: 419-502.
Sulaksana, J dan Jayusman D. 2005. Keji Beling: Mencegah dan Menggempur Batu Ginjal. Penebar Swadaya. Jakarta.
Suryanto, D., S. Patonah dan E. Munir. 2010. Control of Fusarium Wilt of Chili With Chitinolytic Bacteria. Hayati. 17(1): 5-8.
Tan, R. X dan W.X. Zou. 2001. Endophytes: A Rich Source of Functional Metabolites. Nat. Prod. Rep. 18: 448-459.
Tanaka M, Sukiman H, Takebayashi M, Saito K, Suto M, Prana MS, and Tomita F, 1999. Isolation, Screening and Phylogenetic Identification of Endophytes From Plants in Hokaido Japan and Java Indonesia. Microbes and Environment 14(4): 237-241.
Utami U, Soemarno, Sumarno, dan Risjani Y. 2008. Aktivitas Antibakteri Endofit Tanaman Mangrove terhadap Staphylococcus aureus dan Escherichia coli. Jurnal Penelitian Perikanan. 11(1): 42-48.
Wan, N. F. 2011. Uji Aktivitas Antimikroba dan Analisis Klt-Bioautografi Ekstrak Alga Hijau Enteromorpha Linza terhadap Mikroba Patogen pada Manusia. [Skripsi]. Fakultas Farmasi. Universitas Hasanuddin. Makassar.
Wilkins TD, Lilian V, Holdeman, Abramson IJ, Moore WEC. 1972. Standarized Single-Disc Method for Antibiotic Susceptibility Testing of Anaerobic Bacteria. Antimicrobial Agents & Chemotherapy. 1(6): 451-459.
BAB 3
BAHAN DAN METODA
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2013 sampai dengan Agustus 2013 di Laboratorium Penelitian dan Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Alat dan Bahan
Alat yang digunakan ialah timbangan analitik, cawan petri, labu Erlenmeyer, autoklaf, inkubator jamur, inkubator bakteri, gelas ukur, spatula, oven, propipet, bunsen, jarum ose bengkok, jarum ose lurus, pipet tetes, pinset, pipet serologi, tabung reaksi, rak tabung reaksi, rotarievaporator, spektrofotometer, mikroskop, handspray, cutton bud, object glass, cover glass, vortex, cork borer, sentrifuse.
Bahan yang digunakan ialah bakteri endofit dari akar dan batang keji beling. Bahan pendukung yang digunakan ialah aquadest, alkohol 70%, alkohol 75%, sodium hipoklorit 5,3%, ketokonazol, kertas cakram kosong, cakram khlorampenicol, cakram ketokonazol, media Potato Dextrose Agar (PDA), media Nutrient Agar (NA), media Mueller Hinton Agar (MHA), metanol, dimetilsulfoksida (DMSO), media uji biokimia seperti uji sitrat dengan Simon Citrat Agar (SCA), uji katabolisme gula dengan Triple Sugar Iron Agar (TSIA), uji motilitas dengan Sulfit Indol Motility (SIM), uji gelatin dan uji katalase dan zat warna pewarna Gram seperti kristal violet, aseton alkohol, lugol dan safranin.
3.3. Isolasi Bakteri Endofit dari Akar dan Batang Keji Beling
Isolasi bakteri endofit dari akar dan batang tanaman terlebih dahulu dilakukan sterilisasi permukaan menurut metode Radu and Kqueen (2002). Tahap awal isolasi ialah mengambil akar dan batang tanaman keji beling dari tanah secara aseptis dengan menyemprotkan alkohol, kemudian dibungkus dengan kertas koran dan dimasukkan ke dalam plastik yang telah disemprot alkohol dan dibawa ke laboratorium. Bagian akar dan batang tanaman dicuci dengan air mengalir selama 20 menit. Permukaan akar dan batang disterilisasi dengan merendamnya secara berturut-turut dalam larutan etanol 75% selama dua menit, larutan sodium hipoklorit 5,3% selama lima menit, dan etanol 75% selama 30 detik. Selanjutnya akar dan batang dibilas dengan akuades steril sebanyak dua kali dan dikeringkan dengan kertas saring steril. Setelah kering, bagian ujung kiri dan kanan akar dan batang tanaman dibuang ± 1 cm. Masing-masing akar dan batang dipotong menjadi empat bagian dan diletakkan pada permukaan media NA yang telah dicampurkan dengan antibiotik ketokonazol (0,3 gram/100 ml) dengan posisi bekas potongan ke arah media, kemudian diinkubasi pada suhu ruang (28-30oC) selama 1-3 hari.
Koloni yang muncul dari bagian akar dan batang tanaman sebelah dalam disubkulturkan ke media NA yang baru sampai didapat biakan murni. (Lampiran 1, hal 30).
3.4. Karakterisasi Isolat Bakteri Endofit
Isolat murni yang diperoleh dikarakterisasi morfologinya berdasarkan bentuk, warna, elevasi dan tepi koloni dan berdasarkan pewarnaan gram serta uji biokimia seperti uji pati, uji sitrat, uji gelatin, uji motilitas, uji sulfida, uji katalase (Lay, 1994). (Lampiran 2, hal 31 ).
3.5. Uji Daya Hambat Isolat Bakteri Endofit terhadap Jamur Patogen
masing-masing tabung reaksi secara aseptis. Isolat bakteri endofit diinokulasikan ke dalam tabung reaksi dengan menggunakan jarum ose bengkok, kemudian disamakan kekeruhannya sesuai dengan OD600= 0,5 (setara 108 CFU/ml).
Kemampuan bakteri endofit dalam menghambat pertumbuhan jamur A. flavus diuji dengan uji antagonisme in vitro. Tepi bagian yang aktif tumbuh dari biakan jamur yang telah diinkubasi selama 2-3 hari diambil dengan menggunakan cork borer, diinokulasikan pada agar MHA dengan jarak 3,5 cm dari kertas cakram tempat inokulan bakteri. Selanjutnya suspensi bakteri endofit diinokulasikan pada cakram kertas berdiameter 0,6 cm sebanyak 10 µl di bagian tepi media, dibuat dua kali pengulangan. Biakan diinkubasi pada suhu 28-30oC selama tiga hari. Akitivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni. Diameter zona hambat dihitung dengan mengukur selisih radial pertumbuhan miselium jamur yang terhambat oleh isolat bakteri.
Pengukuran pertumbuhan A. flavus dilakukan dengan cara mengukur batas akhir pertumbuhan dari jamur patogen pada sumbu X dan batas akhir pertumbuhan jamur patogen pada sumbu Y (Gambar 3.1) dilakukan setelah terjadi penghambatan bakteri endofit terhadap jamur patogen dengan rumus [y-x]. (Lampiran 3, hal 32).
2
Gambar 3.1. Metode pengukuran zona hambat bakteri endofit terhadap koloni jamur patogen: A. Koloni jamur; B. Zona hambat bakteri endofit; C. Titik tengah jamur diletakkan; D. Koloni bakteri endofit; X. Diameter koloni jamur yang terhambat pertumbuhannya; Y. Diameter koloni jamur normal (Suryanto et al., 2010).
Pengujian daya hambat isolat bakteri patogen menggunakan metode difusi cakram kertas. Cakram kertas ditetesi dengan suspensi isolat bakteri endofit sebanyak 10 μl dan diletakkan di atas sebaran mikroba uji dengan OD600=0,5 pada
cawan petri, kemudian diinkubasi selama 24 jam pada suhu 28-30°C sesuai dengan metode Kirby-Bauer (Drew et al., 1971; Wilkins et al., 1972; Mishra et al., 2006). Pengamatan dilakukan terhadap pengukuran zona hambat yang terbentuk di sekitar cakram kertas yang menunjukkan adanya aktivitas antimikroba. (Lampiran 4, hal 33).
3.7. Ekstraksi Bakteri Endofit
Ekstraksi bakteri endofit yang telah diuji secara in vitro diekstraksi dengan metode yang dilakukan Nofiani et al., (2009) yang dimodifikasi dari segi media dan kecepatan sentrifugasi. Bakteri yang memiliki aktivitas antimikroba ditumbuhkan pada media NA dengan metode oles, dan diinkubasi selama 5-6 hari. Media selanjutnya dicacah (Lampiran 8, hal 35) dan direndam ke dalam erlenmeyer yang berisi metanol selama 72 jam dan dibungkus dengan aluminium untuk menghindari kerusakan karena cahaya. Maserat disaring sebanyak tiga kali ulangan. Maserat disentrifuse pada kecepatan 5000 rpm selama 15 menit. Supernatan dipekatkan dengan rotarievaporator pada suhu tidak lebih dari 50±2oC untuk mendapatkan ekstrak yang siap digunakan. (Lampiran 5, hal 33).
3.8. Pengamatan Hifa Abnormal Jamur Patogen
Pengamatan secara mikroskopis dilakukan dengan cara mengamati ujung miselium pada daerah zona hambat jamur patogen. Ujung miselium A. flavus yang tumbuh pada permukaan media dipotong berbentuk block square, kemudian diletakkan pada gelas objektif. Selanjutnya pertumbuhan miselium jamur patogen diamati adanya abnormalitas, berupa pembengkokan ujung miselium, miselium pecah, miselium berbelah, miselium bercabang, miselium lisis dan miselium kerdil (Lorito et al., 1992). (Lampiran 6, hal 34).
Pengujian aktivitas antimikroba ekstrak metanol bakteri endofit terhadap jamur patogen dilakukan dengan cara uji antagonisme yaitu biakan kultur jamur A. flavus yang telah diinkubasi selama 2-3 hari diambil dengan cork borer yang berjarak 3,5 cm dari kertas cakram tempat inokulan bakteri. Selanjutnya ekstrak antimikroba diinokulasikan 10 μl pada kertas cakram diameter 0,6 cm di bagian tepi media MHA, dibuat dua kali pengulangan. Biakan diinkubasi pada suhu 28-30oC selama tiga hari. Akitivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni. Diameter zona hambat dihitung dengan mengukur selisih radial pertumbuhan miselium jamur yang terhambat oleh isolat bakteri serta diamati hifa abnormal yang terbentuk.
Pengujian terhadap bakteri patogen dilakukan dengan menyebarkan suspensi kultur bakteri uji di atas media agar MHA. Cakram kertas ditetesi dengan ekstrak antimikroba sebanyak 10 μl dan diletakkan di atas sebaran bakteri uji dengan OD600=0,5, lalu diinkubasi pada suhu 28-30°C selama tiga hari. Konsentrasi ekstrak
BAB 4
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Keji Beling Dari hasil isolasi yang telah dilakukan terhadap bagian akar dan batang tanaman keji beling (Strobilanthes crispus), diperoleh 12 isolat bakteri endofit yaitu AJ1, AJ2, AJ3, AJ4, AJ5, AJ6, AJ7, BJ1, BJ2, BJ3, BJ4, BJ5 yang memiliki potensi dalam menghambat pertumbuhan beberapa mikroba patogen. Potensi isolat-isolat tersebut ditunjukkan dengan adanya penghambatan mikroba patogen uji di sekitar koloni.
Karakterisasi yang dilakukan pada isolat yaitu karakterisasi morfologi sel dan morfologi koloni serta karakterisasi sifat biokimia yang meliputi uji hidrogen sulfida, uji sitrat, uji motilitas, uji pati, uji gelatin dan uji katalase. Karakteristik morfologi bentuk yaitu bundar dan tidak beraturan, untuk tepi keriting, bulat, berombak, elevasi yaitu rata, warna krem, bentuk sel kokus, penataan sel mono, diplo, strepto dan staphylo, serta pewarnaan Gram (+) maupun Gram (-). Secara umum isolat bakteri endofit menunjukkan uji positif terhadap hidrolisis pati, hidrolisis gelatin, uji sitrat, uji katalase, motilitas berbentuk pedang dan tidak terdapatnya endapan hitam. Uji positif untuk keretakan media ditunjukkan oleh isolat BJ4. Untuk isolat AJ5, AJ6, BJ1, BJ2 dan BJ4 dapat memfermentasi glukosa, sukrosa dan laktosa, isolat AJ1, AJ3, AJ4, AJ7 dan BJ3 hanya memfermentasi glukosa saja, sedangkan isolat AJ2 dan BJ5 tidak dapat memfermentasi gula apapun, baik itu glukosa, sukrosa maupun laktosa.
Tabel 4.1. Karakterisasi isolat bakteri endofit yang diperoleh dari tanaman keji beling
Kode
Isolat Ciri Morfologi koloni
Gr
Tidak beraturan, berombak, rata, krem
4.2. Uji Daya Hambat Isolat Bakteri Endofit Terhadap Pertumbuhan Bakteri dan Jamur Patogen
Berdasarkan hasil uji antagonis 12 isolat bakteri endofit terhadap beberapa bakteri dan jamur patogen uji, diperoleh hasil sebagai berikut (Tabel 4.2).
Tabel 4.2. Hasil uji daya hambat isolat bakteri endofit terhadap pertumbuhan bakteri dan jamur patogen uji
Kode Isolat
Besar Zona Hambat Terhadap Patogen (mm)
Salmonella typhii Streptococcus mutans Escherichia coli Aspergillus flavus
lebih banyak dan lebih bervariasi dibanding dengan bakteri endofit yang berada pada bagian batang. Menurut Sharma et al., (2005), akar merupakan bagian tumbuhan yang paling banyak mengandung mikroba endofit. Hal ini dikarenakan mikroba endofit masuk ke dalam jaringan tanaman melalui akar kemudian menyebar ke dalam ruang interseluler dari berkas pembuluh.
Penghambatan terbesar terhadap pertumbuhan S. typhii ditunjukkan oleh isolat AJ4 pada hari pertama yaitu 9,49 mm. Zona hambat terbesar terhadap S. mutans ditunjukkan oleh isolat AJ7 sebesar 7,54 mm, zona hambat terbesar terhadap E. coli ditunjukkan oleh isolat BJ5, sedangkan zona hambat terbesar terhadap A. flavus oleh isolat AJ1 sebesar 11,5 mm. Besar kecilnya diameter zona hambat dipengaruhi oleh laju pertumbuhan mikroorganisme, kemampuan dan laju difusi bahan aktif pada medium, kepekaan mikroorganisme terhadap zat aktif serta ketebalan dan viskositas medium.
Diameter zona hambat yang terbentuk di sekitar koloni isolat bakteri endofit terhadap pertumbuhan bakteri dan jamur patogen uji menandakan bahwa isolat bakteri endofit memiliki senyawa antimikroba. Senyawa antimikroba dapat merusak dinding sel atau mencegah sintesisnya. Membran sitoplasma juga dapat dirusak oleh agen antimikroba yang mengakibatkan terhambatnya pertumbuhan mikroba patogen (Jawetz et al., 2005). Berdasarkan diameter zona hambat yang terbentuk, penghambatan mikroba patogen oleh isolat bakteri endofit belum terlalu maksimal, yang menurut Wan Nawi (2011) bahwa daya hambat dengan besar zona bening di bawah 10 mm termasuk ke dalam kategori lemah. Menurut Song (1998), mikroba endofit tumbuh dan memproduksi senyawa metabolit sekunder lebih lambat pada medium buatan daripada medium di dalam tanaman inangnya, oleh karena itu sangat penting untuk merancang media isolasi maupun faktor pertumbuhannya yang sesuai.
Gambar 4.1. Uji daya hambat isolat bakteri endofit terhadap mikroba patogen: (a) Salmonella typhii (AJ4= 7,86 mm, AJ5= 7,00 mm, AJ6= 6,35 mm, AJ7= 6,80 mm), (b) Escherichia coli (AJ4= 7,18 mm, AJ5= 6,66 mm, AJ6= 7,13 mm, AJ7= 6,28 mm), (c) Streptococcus mutans (AJ4= -, AJ5= 6,16 mm, AJ6= 6,73 mm, AJ7= 7,13 mm).
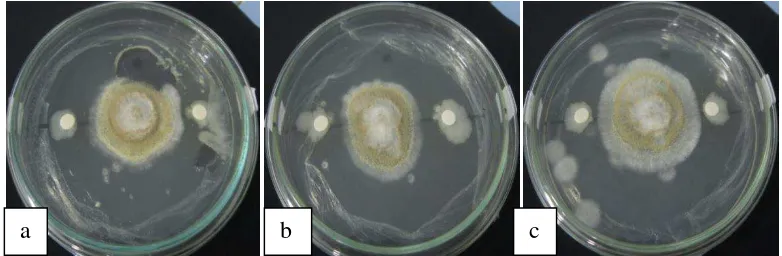
Gambar 4.2. Uji daya hambat isolat bakteri endofit terhadap Aspergillus flavus: (a) Isolat AJ6, (b) Isolat AJ5, (c) Isolat BJ5
4.3. Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit Terhadap Mikroba Patogen
Dari hasil pengukuran besar zona hambat yang diperoleh dari masing-masing isolat bakteri endofit terhadap bakteri dan jamur patogen uji, dua isolat yang memiliki zona hambat paling besar akan diekstrak dengan menggunakan pelarut metanol. Isolat bakteri endofit yang diekstrak yaitu AJ5 dan AJ7, untuk pengujian antimikroba terkadang mikroba patogen uji dilakukan dengan pembuatan konsentrasi ekstrak yang berbeda yaitu 40%, 60%, 80%, dan 100%.
a b c
Hasil pengamatan pada ekstrak AJ5 dan AJ7 ditunjukkan oleh Tabel 4.3. Isolat AJ5 dan AJ7 memiliki potensi antimikroba yang berbeda untuk setiap konsentrasinya. Namun dapat dilihat bahwa semakin tinggi konsentrasi ekstrak, besar zona hambat yang terbentuk semakin kecil.
Tabel 4.3. Hasil uji aktivitas ekstrak metanol beberapa bakteri endofit terhadap bakteri dan jamur patogen uji
Jenis Patogen
Konsentrasi Ekstrak
(%)
Besar Zona Hambat Terhadap Patogen (mm)
AJ5 AJ7
rendah, sekitar 20-30% mempunyai aktivitas spektrum luas dalam menghambat mikroba patogen tertentu dan dimungkinkan karena adanya penghambatan terhadap sintesis dinding sel atau aktivitas tidak bertahan lama. Dinding sel ini mampu mempertahankan sel mikroba dan pelindung sel bakteri yang mempunyai tekanan osmotik internal yang tinggi (Jawetz et al., 2005).
Diameter zona hambat terbesar terhadap S. typhii ditunjukkan oleh ekstrak AJ7 pada konsentrasi 60% yaitu sebesar 14 mm, terhadap S. mutans ditunjukkan oleh ekstrak AJ7 pada konsentrasi 40% sebesar 8,4 mm, terhadap E. coli ditunjukkan oleh ekstrak AJ7 pada konsentrasi 40% sebesar 8,3 mm dan terhadap A. flavus oleh ekstrak AJ7 pada konsentrasi 100% sebesar 6,6 mm. Perbedaan dan variasi besar diameter zona hambat yang terbentuk pada konsentrasi yang berbeda dapat disebabkan karena adanya perbedaan kandungan substansi masing-masing konsentrasi ekstrak dan kemampuan dari masing-masing mikroba patogen. Hal ini juga diduga karena adanya pengaruh dari DMSO sebagai pelarutnya. Berdasarkan data tersebut, ekstrak AJ7 memiliki potensi yang lebih besar dalam menghambat pertumbuhan mikroba patogen dibandingkan dengan ekstrak AJ5.
Penurunan besar zona hambat dapat dipengaruhi oleh produksi dan potensi dari senyawa antimikroba. Suatu antimikroba bersifat bakteriostatik jika senyawa antimikroba tersebut hanya mampu menghambat pertumbuhan bakteri jika pemberian senyawa terus dilakukan dan jika dihentikan atau habis, maka pertumbuhan dan perbanyakan dari bakteri akan kembali meningkat yang ditandai dengan berkurangnya diameter zona hambatan pada masa inkubasi kedua. Sebaliknya bersifat bakteriosida jika diameter zona hambatan meningkat pada masa inkubasi kedua, hal ini disebabkan karena senyawa ini mampu membunuh dan menghentikan aktivitas fisiologi dari bakteri, meskipun pemberian senyawa tersebut dihentikan (Mycek, 2001).
mikroba patogen yang terbentuk berbeda untuk setiap mikroba patogen, dan setiap mikroba patogen uji yang merupakan bakteri Gram (+), bakteri Gram (-) dan fungi memiliki mekanisme dinding sel yang berbeda.
Pemakaian ekstrak bakteri endofit diduga lebih baik daripada pemakaian isolatnya, hal ini dibuktikan dari pengukuran besar diameter zona hambatnya, dimana diameter zona hambat oleh ekstrak isolat bakteri endofit lebih besar dibanding dengan diameter zona hambat oleh isolat bakteri endofitnya. Menurut Purwoko (2007), pemecahan sel dapat dilakukan pada saat maserasi bakteri dengan media tumbuh. Penambahan metanol pada saat maserasi akan menyebabkan pH ekstra sel menjadi asam dan berakibat pada peningkatan konsentrasi proton di dalam sel. Ketika sel tidak cukup memiliki ATP untuk memompa proton keluar sel maka terjadi akumulasi proton di dalam sel dan dapat menyebabkan lisis sel dan senyawa metabolit berdifusi ke pelarut metanol. Ada kemungkinan kandungan senyawa antimikroba memiliki aktivitas antimikroba yang kuat tetapi produksi senyawa antimikroba oleh bakteri sangat kecil
4.4. Pengamatan Hifa Abnormal
Pengamatan hifa abnormal jamur Aspergillus flavus dilakukan pada bagian hifa yang terhambat pertumbuhannya.
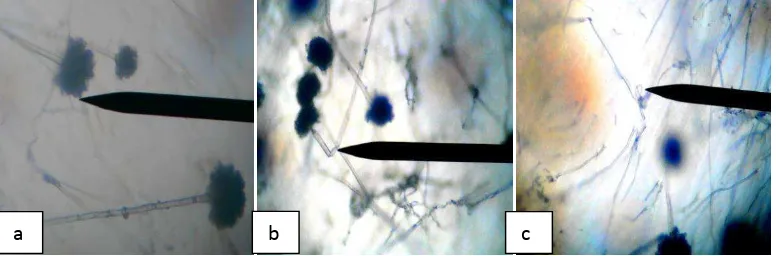
Gambar 4.3. Hifa jamur Aspergillus flavus pada perbesaran 40 x 10 (a) Hifa normal (b) Hifa membengkok (c) Hifa menggulung
Dari pengamatan mikroskopik yang dilakukan, dapat dilihat bahwa hifa A. flavus mengalami abnormalitas akibat pengaruh dari ekstrak bakteri endofit yang ujikan. Berdasarkan Gambar 4.3 dapat dilihat perubahan hifa A. flavus yang terjadi karena interaksi antara ekstrak bakteri endofit terhadap A. flavus yang menyebabkan terjadinya abnormalitas berupa hifa yang mengalami pembengkokan dan hifa menggulung.
Menurut penelitian Rahmiati (2011), terdapat aktivitas antagonisme yang kuat oleh jamur endofit terhadap jamur patogen dengan mekanisme antibiotik alami sehingga efektif dalam menghambat pertumbuhan jamur patogen dengan mendegradasi dinding selnya. Hal tersebut diduga sama dengan aktivitas dari ekstrak bakteri endofit terhadap jamur A. flavus, namun dalam hal ini senyawa antimikroba yang dimiliki oleh ekstrak bakteri endofit tersebut diduga menghambat sintesis dinding sel yang menyebabkan adanya keabnormalan hifa A. flavus seperti hifa membengkok dan hifa menggulung.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Adapun kesimpulan dari penelitian ini yaitu:
1. Bakteri endofit yang diisolasi dari tanaman keji beling yaitu sebanyak 12 isolat. 2. Isolat AJ1 memiliki zona hambat tertinggi sebesar 11,5 mm terhadap Aspergillus
flavus.
3. Isolat AJ5 dan AJ7 mampu menghambat semua pertumbuhan bakteri dan jamur patogen uji.
4. Ekstrak metanol isolat AJ5 memiliki diameter zona hambat tertinggi terhadap Escherichia coli pada konsentrasi 40% dan konsentrasi 60% sebesar 10 mm sedangkan ekstrak metanol isolat AJ7 memiliki diameter zona hambat tertinggi terhadap Salmonella typhii pada konsentrasi 60% sebesar 14 mm, terhadap Streptococcus mutans pada konsentrasi 40% sebesar 8,4 mm dan terhadap Aspergillus flavus pada konsentrasi 100% sebesar 6,6 mm.
5.2. Saran
Adapun saran untuk penelitian ini yaitu:
1. Perlu dilakukan identifikasi untuk mengetahui senyawa aktif metabolit sekunder yang terkandung dalam ekstrak AJ5 dan AJ7.
2. Perlu dilakukan penelitian lanjutan untuk memperoleh media pertumbuhan bakteri endofit dalam menginduksi dan menghasilkan metabolit sekunder yang lebih maksimal.
alternatif pengendalian secara biologi untuk menekan pertumbuhan mikroba patogen dan untuk mendapatkan isolat awal bakteri endofit dari tanaman tersebut.
BAB 2
TINJAUAN PUSTAKA
2.1. Keji Beling (Strobilanthes crispus)
Keji beling (Gambar 2.1) adalah suatu jenis tumbuhan yang berbatang basah dan sepintas menyerupai rumput berbatang tegak. Batang pohonnya berdiameter antara 0,2 - 0,7 cm. Kulit luar berwarna ungu dengan bintik-bintik hijau dan apabila menjadi tua berubah menjadi coklat. Daun berbentuk bulat telur, pada tepinya bergerigi dengan jarak agak jarang, berbulu halus hampir tak kelihatan. Panjang helaian daun (tanpa tangkai) berkisar antara 5 - 8 cm (ukuran normal) dan lebar daun kira-kira 2 - 5 cm (LIPI, 2009). Akar utama keji beling berbentuk tunggang, berwarna putih kekuningan dan berfungsi dalam menyerap air dan memperkuat tanaman. Kulit batangnya berwarna serta memiliki bulu halus.
Gambar 2.1. Keji Beling (LIPI, 2009)
penyebarannya hingga ke Indonesia belum diketahui secara pasti. Kemungkinan besar keji beling dibawa ke Indonesia oleh para pedagang rempah-rempah yang berkeliling dunia berabad-abad yang lalu. Di Indonesia, keji beling bisa tumbuh hampir di seluruh wilayah kepulauan Nusantara.
2.2. Bakteri Endofit
Mikroba endofit adalah organisme hidup yang berukuran mikroskopis (bakteri dan jamur) yang hidup di dalam jaringan tanaman (xylem dan phloem), daun, akar, buah, dan batang. Mikroba ini hidup bersimbiosis saling menguntungkan, dimana dalam hal ini mikroba endofit mendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanaman sedangkan tanaman mendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Tanaka et al., 1999). Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer genetik dari tanaman inang ke dalam mikroba endofit (Tan & Zou, 2001).
Mikroba endofit terdapat dalam beragam jenis tanaman, mengkolonisasi jaringan tanaman, mendapatkan nutrisi dan perlindungan dari tanaman inangnya. Mikroba endofit dapat menghasilkan beragam metabolit sekunder potensial dalam bidang kesehatan, pertanian dan industri (Strobel & Daisy, 2003). Dalam satu jaringan tanaman kemungkinan ditemukan beberapa jenis endofit. Endofit yang hidup dalam tanaman dapat menghasilkan senyawa metabolit sekunder sama dengan yang dihasilkan inangnya akibat adanya pertukaran genetis dan hubungan evolusi yang panjang (Tan & Zou, 2001).
Jaringan internal akar dilaporkan memiliki kerapatan populasi bakteri endofit yang paling tinggi dibandingkan bagian tanaman lain seperti batang dan daun (Hallmann et al., 1997), sehingga dapat menjadi sumber berbagai metabolit sekunder baru yang berpotensi untuk dikembangkan dalam bidang medis, pertanian dan industri. Kemampuan bakteri endofit dalam memproduksi senyawa metabolit sekunder merupakan peluang yang sangat besar di bidang pertanian dalam hal biopestisida yang ramah lingkungan (Radji, 2005).
pengendali hayati yaitu mampu meningkatkan ketersediaan nutrisi, menghasilkan hormon pertumbuhan dan mengendalikan penyakit tanaman melalui mekanisme induksi ketahanan tanaman (Hallmann et al., 1997).
2.3. Mikroba Patogen
Keberadaan mikroba patogen, sangat mempengaruhi kehidupan kita, terutama dalam hal masalah kesehatan. Terdapat berbagai penyebab penyakit, salah satunya ialah mikroba patogen. Penyakit yang ditimbulkan bermacam-macam tergantung dari jenis mikroba penyebab penyakit tersebut, dan menimbulkan infeksi pada organ-organ tertentu. Oleh karena itu, dilakukan pencegahan semaksimal mungkin terhadap mikroba patogen tersebut.
2.3.1. Streptococcus mutans
Streptococcus mutans merupakan kuman yang mampu membentuk karies pada gigi karena segera membentuk asam dari karbohidrat yang dapat diragikan. S. mutans bersifat asidogenik yaitu menghasilkan asam, asidodurik, yang mampu tinggal pada lingkungan asam, dan menghasilkan suatu polisakarida yang lengket disebut dextran (Nugraha, 2008).
Karies gigi merupakan suatu penyakit infeksi yang dapat menular dan terutama mengenai jaringan keras gigi, sehingga terjadi kerusakan jaringan keras setempat. Proses terjadinya kerusakan pada jaringan keras gigi melalui suatu reaksi kimiawi oleh bakteri. Proses kerusakan terjadi pada bagian anorganik, kemudian berlanjut pada bagian organik (Sabir, 2005).
2.3.2. Salmonella typhii
Salmonella typhii merupakan bakteri Gram-negatif yang tidak berspora dan merupakan salah satu penyebab infeksi penyakit utama pada manusia. Keberadaan S. typhii tidak tahan pada kondisi lingkungan yang mengandung konsentrasi garam yang tinggi. Organisme ini masuk melalui jalan oral, biasanya dengan mengkontaminasi makanan atau minuman. Salah satu infeksi penyakit yang disebabkan oleh S. typhii ialah demam enterik Typhoid.
Mekanisme infeksi penyakit demam typhoid S. typhii berada pada bagian dalam tubuh. S. typhii menyerang ileosekum, menginvasi dan mematikan sel-sel makrofag sehingga menyebar dan mencapai aliran darah. Selanjutnya S. typhii berada di jaringan pembuluh empedu, diangkut ke dalam saluran pencernaan, sehingga dapat menyebabkan penyakit (Hawley, 2003). Ketika Salmonella mencapai usus kecil, kemudian masuk ke dalam cairan getah bening dan kemudian ke aliran darah, selanjutnya dibawa oleh darah ke beberapa organ. Bakteri ini meningkat di dalam jaringan getah bening usus dan dikeluarkan melalui tinja (Jawetz etal., 2001).
Waktu masa demam tiphoid yaitu selama empat minggu. Masa inkubasi 7-14 hari. Minggu pertama terjadi demam tinggi, sakit kepala, nyeri abdomen, dan perbedaan peningkatan temperatur dan denyut nadi. Pada minggu kedua terjadi peradangan pada splenomegali dan timbul rash. Pada minggu ketiga timbul penurunan kesadaran dan peningkatan toksemia, keterlibatan usus halus terjadi pada minggu ini dengan diare dan berpotensi untuk terjadinya ferforasi dan pada minggu ke empat terjadi perbaikan klinis (Zein et al., 2004).
2.3.3. Escherichia coli
Escherichia coli merupakan jenis mikroorganisme koliform. E. coli memiliki ciri-ciri berbentuk batang, merupakan bakteri Gram-negatif, tidak berkapsul dan bersifat motil. E. coli juga digunakan sebagai indikator pencemaran makanan dan air oleh tinja. Bakteri ini terdapat banyak pada usus manusia dan hewan.
penyakit dengan mekanisme yang berbeda. Ketika infeksi klinis terjadi, biasanya disebabkan oleh E. coli. Bakteri ini menjadi patogen ketika mereka mencapai jaringan di luar intestinal normal atau tempat flora normal yang kurang umum, dan kebanyakan tempat yang sering mengalami infeksi klinis yaitu pada saluran air kemih, dan beberapa rongga perut (Jawetz et al., 2001), kemudian ketika ketahanan tubuh inang tidak kuat dapat menimbulkan infeksi lokal yang secara klinik dapat mencapai aliran darah lalu menimbulkan sepsis (Rio et al., 2012).
Selama ini, E. coli merupakan mikroorganisme indikator yang dipakai dalam analisis air untuk menguji adanya pencemaran oleh tinja, tetapi penyebarannya tidak selalu melalui air, melainkan juga melalui mulut dan dapat ditemukan tersebar di alam sekitar kita. Penyebaran secara pasif dapat terjadi melalui makanan atau minuman (Melliawati, 2009). E. coli juga merupakan penyebab utama diare pada bayi di negara-negara berkembang. Penyakit ini ditularkan melalui pemakaian feses sebagai pupuk tanaman dan umumnya pada sanitasi yang buruk (Hawley, 2003).
2.3.4. Aspergillus flavus
Aspergillus flavus merupakan kapang saprofit. Koloni yang sudah menghasilkan spora akan berwarna cokelat kehijauan hingga kehitaman. Miselium yang semula berwarna putih tidak tampak lagi ketika spora mulai muncul. Spesies ini umum ditemukan pada kacang-kacangan (khususnya kacang tanah), rempah-rempah, biji yang mengandung minyak, serealia, dan kadang-kadang pada buah-buahan yang dikeringkan (Gandjar et al., 1999). Berbagai bahan baku dan makanan olahan seperti kacang-kacangan, daging dan buah juga rentan mendapat kontaminasi dari jamur ini, yang terjadi melalui penyiapan bahan baku, pengolahan, penyimpanan, pemasaran, hingga sampai pada konsumen.
Vesikula berbentuk bulat hingga semibulat, dan berdiameter 25-45 µm. Fialid terbentuk langsung pada vesikula atau pada metula, dan berukuran (6-10) x (4,0-5,5) µm. Metula berukuran (6,5-10) x (3-5) µm. Konidia berbentuk bulat hingga semibulat, berdiameter 3,6 µm, hijau pucat dan berduri (Gandjar et al., 1999).
Secara makroskopis jamur yang tumbuh terlihat warna koloni hijau kekuningan yang merupakan indikator adanya jamur A. flavus. Secara mikroskopis pada A. flavus tampak vesikel agak lonjong dengan dinding konidia lebih halus dan tidak bergerigi seperti pada Gambar 2.2.
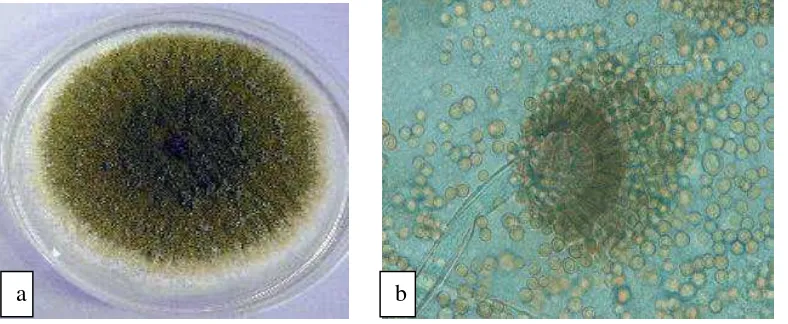
Gambar 2.2. a. Koloni jamur A. flavus, b. Konidia A. flavus pada pembesaran 100x10 (Safika, 2008)
Tahun 1961 telah ditemukan suatu bahan beracun dihasilkan oleh jamur A. flavus bersifat saprofit, dengan alasan ini maka racun tersebut dinamakan aflatoksin. Aflatoksin merupakan hasil metabolit sekunder dari jamur A. flavus yang banyak ditemukan pada hasil pertanian di negara tropik. Lingkungan tropik memberkan kondisi optimum bagi pertumbuhan jamur A. flavus (Massey et al., 1995).
Kondisi optimum jamur ini untuk menghasilkan aflatoksin adalah pada suhu 25-35 0C, kelembaban relatif 85 % dan kadar air 16 %, serta pH 6. Kontaminasi aflatoksin pada bahan pangan terjadi bila strain aflatoxigenic berhasil tumbuh dan membentuk koloni serta selanjutnya memproduksi aflatoksin. Jamur A. flavus akan menghasilkan 50 % strain aflatoxigenic (Cotty & Melon, 2004).
Aflatoksin merupakan suatu metabolit sekunder yang terbentuk setelah fase logaritmik pertumbuhan kapang A. flavus (Mehan et al., 1991), yang terdiri dari empat komponen induk yaitu, aflatoksin B1 (AFB1), aflatoksin B2 (AFB2),
aflatoksin G1 (AFG1) dan aflatoksin G2 (AFG2). Di antara keempat jenis aflatoksin ini, diketahui aflatoksin B1 (AFB1) dan aflatoksin B2 (AFB2) termasuk yang berbahaya, sehingga pengembangan penelitian banyak difokuskan pada aflatoksin jenis ini (Coallier & Idzack, 1985).
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Berbagai macam penyakit yang ditimbulkan oleh mikroba banyak ditemukan di negara-negara beriklim tropis termasuk Indonesia. Salah satunya yaitu penyakit infeksi yang disebabkan oleh bakteri, jamur dan virus. Kondisi seperti ini dikarenakan daerah-daerah yang beriklim tropis sangat cocok bagi pertumbuhan dan perkembangan mikroba, baik yang bersifat patogen maupun yang memberikan manfaat bagi manusia (Djamaan et al., 1993).
Di Indonesia persentase penyakit infeksi pada manusia yang disebabkan oleh mikroba patogen masih menunjukkan angka yang relatif tinggi dan kebutuhan terhadap obat anti infeksipun meningkat pula. Selama ini pencegahan infeksi dilakukan dengan menggunakan antibiotik. Pemakaian antibiotik yang tidak terkontrol sebagai akibat dari tingginya kebutuhan akan obat antiinfeksi ini mengakibatkan meningkatnya pola resistensi kuman atau mikroba patogen terhadap jenis antibiotika (Mangundjaja, 2002).
hayati bagi tanaman atau untuk memacu pertumbuhan tanaman (Tarabily et al., 2003).
Menurut penelitian yang dilakukan oleh Simarmata et al., (2007), telah diisolasi bakteri endofit dari tanaman sambung nyawa (Gynura procumbens), dan diperoleh 38 isolat. Berdasarkan hasil uji, 21% isolat bakteri endofit tersebut mampu menunjukkan aktivitas antimikroba terhadap mikroba patogen seperti E.coli, Pseudomonas sp., B. subtilis dan Candida albicans. Hal ini menunjukkan bahwa bakteri endofit memiliki kemampuan dalam menghasilkan senyawa antimikroba.
Menurut penelitian Utami et al., (2008), terdapat 33 isolat bakteri endofit yang telah diisolasi dari tanaman mangrove (Bruguiera gymnorrhiza). Isolat-isolat bakteri tersebut diuji aktivitas antibakterinya secara in vitro. Dari 33 isolat tersebut, diperoleh tujuh isolat yang memiliki aktivitas antibakteri terhadap Staphylococcus aureus dan enam isolat terhadap Escherichia coli. Pengujian aktivitas metabolit bakteri endofit dari tanaman ini menunjukkan bahwa beberapa metabolit isolat bakteri endofit menimbulkan adanya zona hambatan yang jernih.
Pada tanaman-tanaman obat yang sudah digunakan secara turun-temurun ditemukan mikroba endofit yang mampu menghasilkan senyawa bioaktif atau senyawa antimikroba. Pengendalian biologi dengan menggunakan mikroba endofit yang menghasilkan antibiotik dari tanaman obat merupakan salah satu alternatif pengendalian mikroba patogen yang menginfeksi manusia, hewan dan tumbuhan (Petrini et al., 1992).
Keji beling merupakan tanaman yang biasanya digunakan sebagai tanaman hias, tanaman pagar atau tanaman yang berkhasiat obat. Keji beling biasa digunakan sebagai obat untuk batu ginjal dan kencing manis. Tanaman ini memiliki kandungan polifenol, saponin, alkaloid, kalium dan kalsium. Selama ini, belum pernah dilaporkan adanya mikroba endofit dari tanaman keji beling. Oleh karena itu, pada penelitian ini dilakukan isolasi bakteri endofit penghasil antibiotik dari tanaman keji beling dan uji penghambatannya terhadap beberapa mikroba patogen.
Pengendalian penyakit infeksi yang diakibatkan oleh mikroba patogen, dilakukan dengan menggunakan antibiotik. Pemakaian antibiotik yang tidak terkontrol dapat menyebabkan pola resistensi pada mikroba patogen tersebut. Oleh karena itu, perlu dilakukan pencarian sumber antibiotik baru untuk menekan pertumbuhan dari mikroba patogen, salah satunya ialah bakteri endofit dari tanaman keji beling. Tanaman keji beling diasumsikan memiliki bakteri endofit yang memiliki kemampuan dalam menghambat beberapa mikroba patogen. Oleh karena itu perlu ditinjau sejauh mana kemampuan bakteri endofit yang diisolasi dari tanaman keji beling dalam menghambat pertumbuhan beberapa mikroba patogen dan ekstraknya, yang diuji pada mikroba patogen seperti Streptococcus mutans, Salmonella typhii, Escherichia coli dan Aspergillus flavus.
1.3. Tujuan
1. Mengetahui kemampuan bakteri endofit dari tanaman keji beling dalam menghambat pertumbuhan beberapa mikroba patogen.
2. Mengetahui kemampuan ekstrak metanol bakteri endofit dalam menghambat pertumbuhan beberapa mikroba patogen.
1.4. Hipotesis
1. Bakteri endofit dari tanaman keji beling memiliki kemampuan dalam menghambat pertumbuhan beberapa mikroba patogen.
2. Ekstrak metanol bakteri endofit memiliki kemampuan dalam menghambat pertumbuhan beberapa mikroba patogen.
1.5. Manfaat
alternatif pengendalian secara biologi untuk menekan pertumbuhan mikroba patogen dan untuk mendapatkan isolat awal bakteri endofit dari tanaman tersebut.
BAB 2
TINJAUAN PUSTAKA
2.1. Keji Beling (Strobilanthes crispus)
Keji beling (Gambar 2.1) adalah suatu jenis tumbuhan yang berbatang basah dan sepintas menyerupai rumput berbatang tegak. Batang pohonnya berdiameter antara 0,2 - 0,7 cm. Kulit luar berwarna ungu dengan bintik-bintik hijau dan apabila menjadi tua berubah menjadi coklat. Daun berbentuk bulat telur, pada tepinya bergerigi dengan jarak agak jarang, berbulu halus hampir tak kelihatan. Panjang helaian daun (tanpa tangkai) berkisar antara 5 - 8 cm (ukuran normal) dan lebar daun kira-kira 2 - 5 cm (LIPI, 2009). Akar utama keji beling berbentuk tunggang, berwarna putih kekuningan dan berfungsi dalam menyerap air dan memperkuat tanaman. Kulit batangnya berwarna serta memiliki bulu halus.
Gambar 2.1. Keji Beling (LIPI, 2009)
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT KEJI BELING
(
Strobilanthes crispus
)
DALAM
MENGHAMBAT PERTUMBUHAN
BEBERAPA
MIKROBA
PATOGEN
ABSTRAK
Penelitian mengenai isolasi dan uji ekstrak metanol bakteri endofit keji beling (Strobilanthes crispus) dalam menghambat pertumbuhan mikroba Salmonella typhii, Streptococcus mutans, Escherichia coli dan Aspergillus flavus telah dilakukan. Penelitian ini bertujuan untuk mendapatkan isolat bakteri endofit penghasil senyawa antimikroba. Terdapat 12 isolat bakteri endofit yang diisolasi dari keji beling. Dua isolat yaitu AJ5 dan AJ7 dipilih untuk diekstrak dengan metanol berdasarkan kemampuannya dalam menghambat pertumbuhan mikroba patogen. Kemampuan ekstrak dalam menghambat pertumbuhan mikroba patogen dibuat dalam konsentrasi 40%, 60%, 80% dan 100%. Hasil penelitian menunjukkan bahwa zona hambat tertinggi terhadap Salmonella typhii ditunjukkan oleh ekstrak AJ7 pada konsentrasi 60% dengan besar 14 mm, terhadap Streptococcus mutans ditunjukkan oleh ekstrak AJ7 pada konsentrasi 40% dengan zona hambat 8,4 mm, sedangkan ekstrak AJ5 pada konsentrasi 40% dan 60% menghambat Escherichia coli sebesar 10 mm. Penghambatan terhadap jamur Aspergillus flavus ditunjukkan oleh ekstrak AJ7 pada konsentrasi 100% sebesar 6,6 mm.
ISOLATION AND EXAMINATION METHANOL EXTRACT
OF ENDOPHYTIC BACTERIA FROM KEJI BELING
(Strobilanthes crispus) IN INHIBIT SEVERAL PATHOGENIC
MICROBE GROWTH
ABSTRACT
A study on isolation and examination methanol extract of endophytic bacteria from keji beling (Strobilanthes crispus) in inhibiting Salmonella typhii, Streptococcus mutans, Escherichia coli and Aspergillus flavus microbe growth was conducted. The objective of the study was to isolate endophytic bacteria producing antimicrobial compounds. There were 12 isolates of endophytic bacteria isolated from “keji beling”. Two isolates, AJ5 and AJ7 were chosen to be extracted with methanol based on their ability to inhibit the pathogen growth. The ability of the extract to inhibit the gowth of the pathogens were conducted at concentration of 40%, 60%, 80%, and 100%. The results showed that higher inhibition zone against Salmonella typhii was shown by the extract of AJ7 at concentration of 60% by 14 mm, Streptococcus mutans was shown by extract of AJ7 at concentration of 40% with inhibition zone of 8.4 mm, respectively, while extract of AJ5 with concentration of 40% and 60% inhibited Escherichia coli by 10 mm. Inhibition of fungi Aspergillus flavus was shown by the extract of AJ7 at concentration of 100% by 6.6 mm.
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT KEJI BELING (Strobilanthes crispus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
SKRIPSI
AGUSTINA JATI PANGLIPUR 090805039
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT KEJI BELING (Strobilanthes crispus) DALAM
MENGHAMBAT PERTUMBUHAN BEBERAPA MIKROBA
PATOGEN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
AGUSTINA JATI PANGLIPUR 090805039
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Isolasi dan Uji Ekstrak Metanol Bakteri Endofit Keji Beling (Strobilanthes crispus) dalam
Menghambat Pertumbuhan Beberapa Mikroba Patogen
Kategori : Skripsi
Nama : Agustina Jati Panglipur
Nomor Induk Mahasiswa : 090805039
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, April 2014
Komisi Pembimbing : Pembimbing 2,
Dr. It Jamilah, M. Sc NIP: 196310121991032003
Pembimbing 1,
Prof. Dr. Dwi Suryanto, M.Sc NIP: 196404091994031003
Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI ENDOFIT KEJI BELING (Strobilanthes crispus) DALAM MENGHAMBAT
PERTUMBUHAN BEBERAPA MIKROBA PATOGEN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2014
PENGHARGAAN
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Kuasa yang telah memberikan kasihNya sehingga penulis dapat menyelesaikan skripsi ini dengan judul Isolasi dan Uji Ekstrak Metanol Bakteri Endofit Keji Beling (Strobilanthes crispus) dalam Menghambat Pertumbuhan Beberapa Mikroba Patogen.
Pada kesempatan ini penulis mengucapkan terimakasih kepada Bapak Prof. Dr. Dwi Suryanto, M. Sc selaku Dosen Pembimbing I dan Ibu Dr. It Jamilah, M.Sc selaku Dosen Pembimbing II yang telah memberikan nasehat dan bimbingan kepada penulis dalam penyusunan skripsi ini. Terimakasih kepada Ibu Dr. Nunuk Priyani, M. Sc selaku Dosen Penguji I dan Bapak Riyanto Sinaga, S. Si, M. Si selaku Dosen Penguji II yang telah memberikan kritik dan saran yang membangun dalam penyusunan skripsi ini. Terimakasih kepada Ibu Dr. Nursahara Pasaribu, M. Sc selaku Ketua Departemen Biologi FMIPA USU, Bapak Dr. Sutarman, M. Sc selaku Dekan FMIPA USU, Ibu Dr. Marpongahtun, M. Sc selaku Pembantu Dekan I, Bapak Drs. Nursal, M.Sc selaku Pembantu Dekan II dan Bapak Drs. Kerista Sebayang, M. Si selaku Pembantu Dekan III, Bapak dan Ibu Dosen Biologi FMIPA USU, kepada Bang Erwin dan Ibu Roslina Ginting serta seluruh staf pegawai FMIPA USU, terimakasih saya ucapkan atas semua bantuannya.
Terimakasih tak terhingga kepada orangtuaku tercinta, Bapak Christophorus Bangun Topo (alm) dan Ibu Yuliana Sumariyam yang senantiasa berkorban, mencintai dan berdoa untukku, juga kepada adik-adikku tersayang, Yohana Retno Puspo Giwang dan Cicilia Dewi Melati Sari yang memberikan dukungan penuh. Terimakasih juga kepada masku Andreas Urip Waluyo yang telah memberikan dukungan dan doanya kepadaku. Tak lupa juga kepada Tante Tetty dan Opung serta rekan-rekan di opung camp yang selalu menghibur dan berbagi cerita.
Kepada seluruh sahabatku Febrin, Jesica, Silvia, Grace, Ledi, Febri, Yenni, Bertua, Uba, Itok Raymond, Edag Fivin dan seluruh stambuk 2009. Kepada adikku Doris dan seluruh stambuk 2010, 2011 dan 2012. Kepada Kak Yanti, Kak Netty, Kak Nikmah, Kak Widya, dan Kak Rahmi yang telah membantu selama penelitian. Terimakasih juga kepada rekan-rekan Persekutuan Keluarga Besar Kristen Biologi (PKBKB), Biologi Pecinta Alam dan Studi Lingkungan Hidup (BIOPALAS) dan Keluarga Mahasiswa Katolik (KMK) St. Aloysius Gonzaga serta semua pihak yang telah memberikan ilmu, pengalaman dan membantu penulis yang tidak dapat disebutkan satu persatu.
ISOLASI DAN UJI EKSTRAK METANOL BAKTERI
ENDOFIT KEJI BELING
(
Strobilanthes crispus
)
DALAM
MENGHAMBAT PERTUMBUHAN
BEBERAPA
MIKROBA
PATOGEN
ABSTRAK
Penelitian mengenai isolasi dan uji ekstrak metanol bakteri endofit keji beling (Strobilanthes crispus) dalam menghambat pertumbuhan mikroba Salmonella typhii, Streptococcus mutans, Escherichia coli dan Aspergillus flavus telah dilakukan. Penelitian ini bertujuan untuk mendapatkan isolat bakteri endofit penghasil senyawa antimikroba. Terdapat 12 isolat bakteri endofit yang diisolasi dari keji beling. Dua isolat yaitu AJ5 dan AJ7 dipilih untuk diekstrak dengan metanol berdasarkan kemampuannya dalam menghambat pertumbuhan mikroba patogen. Kemampuan ekstrak dalam menghambat pertumbuhan mikroba patogen dibuat dalam konsentrasi 40%, 60%, 80% dan 100%. Hasil penelitian menunjukkan bahwa zona hambat tertinggi terhadap Salmonella typhii ditunjukkan oleh ekstrak AJ7 pada konsentrasi 60% dengan besar 14 mm, terhadap Streptococcus mutans ditunjukkan oleh ekstrak AJ7 pada konsentrasi 40% dengan zona hambat 8,4 mm, sedangkan ekstrak AJ5 pada konsentrasi 40% dan 60% menghambat Escherichia coli sebesar 10 mm. Penghambatan terhadap jamur Aspergillus flavus ditunjukkan oleh ekstrak AJ7 pada konsentrasi 100% sebesar 6,6 mm.
ISOLATION AND EXAMINATION METHANOL EXTRACT
OF ENDOPHYTIC BACTERIA FROM KEJI BELING
(Strobilanthes crispus) IN INHIBIT SEVERAL PATHOGENIC
MICROBE GROWTH
ABSTRACT
A study on isolation and examination methanol extract of endophytic bacteria from keji beling (Strobilanthes crispus) in inhibiting Salmonella typhii, Streptococcus mutans, Escherichia coli and Aspergillus flavus microbe growth was conducted. The objective of the study was to isolate endophytic bacteria producing antimicrobial compounds. There were 12 isolates of endophytic bacteria isolated from “keji beling”. Two isolates, AJ5 and AJ7 were chosen to be extracted with methanol based on their ability to inhibit the pathogen growth. The ability of the extract to inhibit the gowth of the pathogens were conducted at concentration of 40%, 60%, 80%, and 100%. The results showed that higher inhibition zone against Salmonella typhii was shown by the extract of AJ7 at concentration of 60% by 14 mm, Streptococcus mutans was shown by extract of AJ7 at concentration of 40% with inhibition zone of 8.4 mm, respectively, while extract of AJ5 with concentration of 40% and 60% inhibited Escherichia coli by 10 mm. Inhibition of fungi Aspergillus flavus was shown by the extract of AJ7 at concentration of 100% by 6.6 mm.
DAFTAR ISI
1.3. Tujuan Penelitian 3
1.4. Hipotesis 3
1.5. Manfaat 3
BAB 2. Tinjauan Pustaka
2.1. Keji Beling (Strobilanthes crispus) 4
2.2. Bakteri Endofit 5 BAB 3. Bahan Dan Metoda
3.1. Waktu dan Tempat 11
3.2. Alat dan Bahan
3.3. Isolasi Bakteri Endofit dari Akar dan Batang Keji Beling 3.4. Karakterisasi Isolat Bakteri Endofit
3.5. Uji Daya Hambat Isolat Bakteri Endofit terhadap Jamur Patogen 11 12 12 12 3.6. Uji Daya Hambat Isolat Bakteri Endofit terhadap Bakteri Patogen 3.7. Ekstraksi Bakteri Endofit
3.8. Pengamatan hifa abnormal jamur patogen
3.9. Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit terhadap Mikroba Patogen
BAB 4. Hasil Dan Pembahasan
4.1. Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Keji Beling
16 4.2. Uji Daya Hambat Isolat Bakteri Endofit terhadap Pertumbuhan
Mikroba Patogen
4.3. Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit terhadap Mikroba Patogen
4.4. Pengamatan Hifa Abnormal
18 20 24 BAB 5. Kesimpulan Dan Saran
5.1. Kesimpulan 25
5.2. Saran 25
Daftar Pustaka Lampiran
DAFTAR TABEL
Nomor Tabel Judul Halaman
4.1. Karakterisasi Isolat Bakteri Endofit 17 4.2. Hasil Uji Daya Hambat Isolat Bakteri Endofit
terhadap Pertumbuhan Mikroba Patogen
18 4.3. Hasil Uji Aktivitas Ekstrak Metanol Bakteri
Endofit terhadap Mikroba Patogen
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1. Keji Beling (Strobilanthes crispus) 4
2.2. Koloni jamur A. flavus & Konidia A. flavus
pada pembesaran
100x10
9
3.1. Metode pengukuran zona hambat bakteri endofit terhadap koloni jamur patogen
13 4.1. Uji daya hambat isolat bakteri endofit terhadap
bakteri pathogen
20 4.2. Uji daya hambat isolat bakteri endofit terhadap
jamur patogen
20
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Isolasi Bakteri Endofit dari Akar dan Batang Keji Beling
30
2. Karakterisasi Isolat Bakteri Endofit 31
3. Uji Daya Hambat Isolat Bakteri Endofit terhadap Jamur Patogen
32 4. Uji Daya Hambat Isolat Bakteri Endofit terhadap
Mikroba Patogen
33
5. Ekstraksi Bakteri Endofit 33
6. Pengamatan hifa abnormal jamur patogen 34
7. Uji Aktivitas Antimikroba Ekstrak Metanol Bakteri Endofit terhadap Mikroba Patogen
34