SKRIPSI
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK KULIT
KAYU MESOYI (Cryptocaria massoia) TERHADAP BAKTERI
PATOGEN DAN PEMBUSUK PANGAN
Oleh
ELSADORA REAPINA M
F 24102132
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK KULIT
KAYU MESOYI (Cryptocaria massoia) TERHADAP BAKTERI
PATOGEN DAN PEMBUSUK PANGAN
SKRIPSI
Oleh:ELSADORA REAPINA M
F 24102132
SKRIPSISebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Fakultas Teknologi Pertanian Institut Pertanian Bogor
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Elsadora Reapina Malthaputri. F 24102132. Kajian aktivitas antimikroba ekstrak kulit kayu mesoyi (Cryptocaria massoia) terhadap bakteri patogen dan pembusuk pangan. Di bawah bimbingan Dr. Ir. Sedarnawati Yasni, M.Agr dan Elvira Syamsir, STP., Msi.
RINGKASAN
Di Indonesia terdapat kira-kira 4000 jenis kayu dan dari jumlah tersebut masih banyak yang belum diketahui sifat dan kegunaannya, termasuk didalamnya adalah tanaman mesoyi (Cryptocaria massoia). Penelitian ini bertujuan untuk mengkaji aktivitas antimikroba pada kulit kayu mesoyi sebagai salah satu sumber daya alam khas Indonesia yang belum optimal pemanfaatannya. Dengan diketahui aktivitas antimikrobanya diharapkan penggunaan kulit kayu mesoyi dapat dikembangkan sebagai salah satu sumber antimikroba alami.
Penelitian dibagi atas dua tahapan, yaitu penelitian pendahuluan dan penelitian lanjutan. Pada penelitian pendahuluan dilakukan persiapan kultur bakteri uji, proses ekstraksi, dan pengujian aktivitas antimikroba dengan metode uji difusi sumur. Pada penelitian lanjutan dilakukan penentuan nilai MIC dan uji fitokimia terhadap ekstrak kulit kayu mesoyi terpilih.
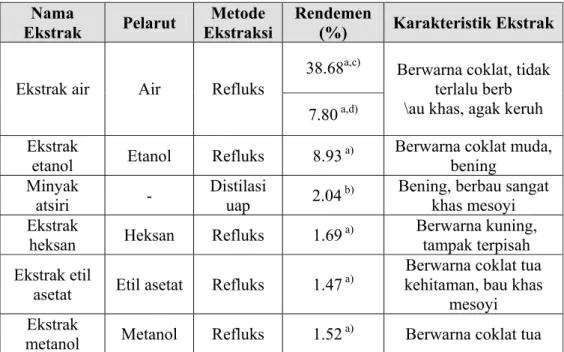
Persiapan kultur bakteri uji dilakukan dengan metode hitungan cawan dan didapatkan bahwa pengenceran yang diperlukan adalah 10-3. Proses ekstraksi dilakukan dengan metode refluks dan destilasi uap. Proses ekstraksi dilakukan secara tunggal dengan pelarut air dan etanol, serta secara bertingkat dengan pelarut heksan, etil asetat, dan metanol. Rendemen ekstrak air, ekstrak etanol, minyak atsiri, ekstrak heksan, ekstrak etil asetat, dan ekstrak metanol kulit kayu mesoyi berturut-turut adalah 7.80% (w/w), 8.93% (w/w), 2.04% (w/v), 1.69% (w/w), 1.47% (w/w), dan 1.52% (w/w).
Uji difusi sumur menunjukkan bahwa hampir semua ekstrak kulit kayu mesoyi memiliki spektrum penghambatan yang luas karena mampu menghambat semua bakteri uji, kecuali ekstrak air dan ekstrak metanol. Perbedaan ekstrak yang diujikan, bakteri uji yang digunakan, dan interaksi yang terjadi diantaranya memiliki pengaruh yang nyata (p<0.05) terhadap nilai diameter penghambatan. Bakteri uji yang paling sensitif terhadap ekstrak kulit kayu mesoyi adalah Salmonella Thypimurium, sedangkan bakteri yang paling tahan adalah E. coli. Ekstrak kulit kayu mesoyi yang memiliki aktivitas antimikroba paling baik adalah ekstrak etil asetat dan minyak atsiri, sedangkan ekstrak kulit kayu mesoyi yang paling tidak efektif adalah ekstrak air.
Ekstrak yang dipilih untuk diuji lanjut adalah ekstrak etanol dan minyak atsiri. Nilai MIC ekstrak etanol terhadap Bacillus cereus adalah 0.557 (% w/w), sedangkan nilai MIC minyak atsiri terhadap bakteri uji Salmonella Typhimurium adalah 0.005 (% w/w). Uji fitokimia terhadap ekstrak etanol dan minyak atsiri kulit kayu mesoyi membuktikan bahwa ekstrak etanol mengandung fenol dan terpenoid, sedangkan minyak atsiri kulit kayu mesoyi mengandung terpenoid.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK KULIT
KAYU MESOYI (Cryptocaria massoia) TERHADAP BAKTERI
PATOGEN DAN PEMBUSUK PANGAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ELSADORA REAPINA M
F 24102132
Dilahirkan Pada Tanggal 24 September 1984 Di Jakarta
Tanggal Lulus : 15 Januari 2007 Menyetujui
Bogor, 24 Januari 2007
Dr. Ir.Sedarnawati Yasni, M.Agr Elvira Syamsir, STP., Msi. Dosen Pembimbing I Dosen Pembimbing II
Mengetahui
Dr. Ir. Dahrul Syah, MSc Ketua Departemen ITP
RIWAYAT HIDUP
Penulis yang bernama lengkap Elsadora Reapina Malthaputri adalah anak kedua dari Bapak Bakri Beck dan Ibu Sri Enery yang dilahirkan di Jakarta pada tanggal 24 September 1984. Penulis menempuh pendidikan di Taman Kanak-kanak Aisyah Palangkaraya (1988-1990), Sekolah Dasar Negeri Langkai 12 Palangkaraya (1990-1992), Sekolah Dasar Negeri Anyelir I Depok (1992-1996), Sekolah Lanjutan Tingkat Pertama Islam Al-Azhar Pejaten (1996-1999), dan Sekolah Menengah Umum Negeri 8 Jakarta (1999-2002).
Pada tahun 2002, penulis diterima sebagai mahasiswa pada Departemen Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Selama mengikuti perkuliahan, penulis aktif menjadi panitia dalam berbagai kegiatan seperti Lepas Landas Sarjana FATETA, BAUR 2004, NSPC (National Students’
Paper Competition) dan LCTIP (Lomba Cepat Tepat Ilmu Pangan). Selain itu,
penulis juga pernah mengikuti seminar National Students’ paper competition on
food issue (2003) dan IDF International Conference of FGW Student Forum for Milk and Milk Product (2005).
Penulis melakukan kegiatan praktek lapang di PT Makro Indonesia dengan topik mempelajari sistem penyimpanan dan pemajangan bahan pangan segar dalam usaha mengurangi tingkat kerusakan di makro cabang pasar rebo (Divisi
fresh food) di PT. Makro Indonesia, Jakarta. Sebagai syarat untuk memperoleh
gelar Sarjana Teknologi Pertanian, penulis menyusun skripsi dengan judul “Kajian aktivitas antimikroba ekstrak kulit kayu mesoyi (Cryptocaria massoia) terhadap bakteri patogen dan pembusuk pangan” di bawah bimbingan Dr. Ir. Sedarnawati Yasni, M. Agr dan Elvira Syamsir, STP., MSi.
KATA PENGANTAR
Puji syukur dipanjatkan kehadirat Allah SWT yang selalu memberikan rahmat dan hidayahnya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Shalawat serta salam juga tidak lupa penulis panjatkan kehadirat Rasulullah SAW. Penyelesaian penulisan skripsi ini tidak terlepas dari bantuan berbagai pihak, untuk itu penulis mengucapkan terima kasih kepada :
1. Dr .Ir. Sedarnawati Yasni, M.Agr dan Elvira Syamsir, STP., Msi. selaku dosen pembimbing akademis yang selalu memberikan bimbingan, selama perkuliahan dan penelitian sampai penulisan skripsi selesai.
2. Ir. Budi Nurtama, M. Agr, atas kesediaannya menjadi dosen penguji.
3. Papa, Mama, kak Ridho dan Rayhan, untuk semua dukungan yang diberikan. 4. Mas Deddy yang sudah menemani dan menyemangati disetiap waktu penulis,
dan Vita Amanda yang mengajarkan arti sahabat sejati.
5. Sahabat-sahabat poobiers-ku, Nungi, Tuxki, Farah, Tish, Tante, Ina, Grid dan Nene, terima kasih untuk kebersamaan dan waktunya berbagi apa saja.
6. Sahabat-sahabatku, Ratih Woro, Aponk, dan Kanyaka, serta teman-teman TPG 39, Vero Anna, Ajeng, Didin, Dadik, Ulik, dan Boyon.
7. Eva H. Direja, untuk kerja sama tak terlupakan, dan teman sebimbingan lainnya, Mba dewi TPG’36, Mba Lily TPG’37, dan Mba Nurma TPG’38. 8. Teman-teman selama di Laboratorium, Inda, Rebek, Manginar, Nanda, Shinta,
Muslimah, Tojay, Ibu Yuspi, Ibu Diana, Ibu Asriani, dan Mba Tri. 9. Laboran-laboran Laboratorium Departemen Ilmu dan Teknologi Pangan. 10. Pihak-pihak yang tidak dapat disebutkan satu per satu.
Penulis menyadari skripsi ini masih banyak kekurangannya dalam penulisan, walaupun demikian penulis tetap berharap skripsi ini dapat bermanfaat bagi yang memerlukannya.
Bogor, Januari 2007
DAFTAR ISI KATA PENGANTAR ... i DAFTAR ISI ... ii DAFTAR TABEL ... iv DAFTAR GAMBAR ... v DAFTAR LAMPIRAN ... vi I. PENDAHULUAN ... 1 A. Latar Belakang ... 1
B. Tujuan dan Sasaran ... 3
II. TINJAUAN PUSTAKA ... 4
A. Kulit kayu mesoyi ... 4
B. Teknik ekstraksi ... 7
C. Senyawa antimikroba ... 11
D. Karakteristik mikroba patogen dan mikroba perusak makanan ... 12
E. Pengujian aktivitas antimikroba ... 18
F. Uji fitokimia ... 23
III. BAHAN DAN METODE ... 29
A. Bahan dan alat ... 29
B. Tempat dan waktu ... 29
C. Metode penelitian ... 30
D. Metode analisis ... 37
IV. HASIL DAN PEMBAHASAN ... 45
A. Persiapan kultur bakteri uji ... 45
B. Aktivitas antimikroba ekstrak kulit kayu mesoyi ... 46
C. Uji lanjut ekstrak kulit kayu mesoyi ... 63
V. KESIMPULAN DAN SARAN ... 70
A. Kesimpulan ... 70
B. Saran ... 71
DAFTAR TABEL
Tabel 1. Hasil analisis proksimat kulit kayu mesoyi ... 6
Tabel 2. Nilai MIC beberapa minyak rempah-rempah ... 23
Tabel 3. Komponen fenolik yang ditemukan dalam tanaman ... 25
Tabel 4. Komponen fenolik tanaman dan aktivitas antimikroba ... 25
Tabel 5. Total mikroba kultur bakteri uji ... 45
Tabel 6. Nilai rendemen dan karakteristik ekstrak kulit kayu mesoyi .. 47
Tabel 7. Hasil uji statistik GLM-Univariate ... 54
Tabel 8. Nilai MIC (Minimum Inhibitory Concentration) ... 64
Tabel 9. Hasil uji fitokimia ... 65
DAFTAR GAMBAR
Gambar 1. (a) pohon mesoyi (b) minyak atsiri ... 6
Gambar 2. Mesoyi lakton atau 5-Pentylpent-2-en-5-olide (C10H16O2) .. 6
Gambar 3. Bakteri-bakteri uji : (a) P. aeruginosa, (b) B. cereus, (c) E. coli, (d) S. aureus, dan (e) Salmonella Thypimurium... 17
Gambar 4. Dimethyl sulfoxide atau DMSO ... 22
Gambar 5. Diagram alir penelitian ... 30
Gambar 6. Diagram alir metode hitungan cawan ... 32
Gambar 7. Skema ekstraksi tunggal dengan pelarut etanol dan air ... 34
Gambar 8. Diagram alir proses ekstraksi bertingkat dari ampas kulit kayu mesoyi... 36
Gambar 9. Diagram alir uji difusi sumur ... 39
Gambar 10. Diagram alir penentuan nilai MIC ... 41
Gambar 11. Jenis ekstrak kulit kayu mesoyi : (a) ekstrak air, (b) ekstrak etanol, (c) minyak atsiri, (d) ekstrak heksan, (e) ekstrak etil asetat, dan (f) ekstrak metanol... 48
Gambar 12. Penghambatan jenis-jenis ekstrak kulit kayu mesoyi terhadap bakteri uji...……… 51
Gambar 13. (a) penghambatan ekstrak etil asetat terhadap P. aeruginosa dan (b) penghambatan minyak atsiri terhadap Salmonella Typhimurium dengan kontrol positifnya... 52
Gambar 14. Profil perkiraan aktivitas antimikroba berbagai jenis ekstrak kulit kayu mesoyi... 53
Gambar 15. Profil perkiraan penghambatan berbagai bakteri uji ... 53
Gambar 16. Penghambatan jenis-jenis ekstrak kulit kayu mesoyi terhadap jenis bakteri Gram positif dan Gram negatif... 58
Gambar 17. Perbandingan diameter penghambatan jenis-jenis ekstrak kulit kayu mesoyi... 61
DAFTAR LAMPIRAN
Lampiran 1. Hasil uji kadar air ekstrak air kulit kayu mesoyi ... 79
Lampiran 2. Perhitungan rendemen ... 80
Lampiran 3. Data uji konfirmasi ... 81
Lampiran 4. Perhitungan diameter penghambatan ... 82
Lampiran 5. Data aktivitas antimikroba ekstrak etanol ... 83
Lampiran 6. Data aktivitas antimikroba minyak atsiri ... 83
Lampiran 7. Data aktivitas antimikroba ekstrak heksan ... 84
Lampiran 8. Data aktivitas antimikroba ekstrak etil asetat ... 84
Lampiran 9. Data aktivitas antimikroba ekstrak metanol ... 85
Lampiran 10. Uji statistik metode GLM dengan uji lanjut LSD ... 86
Lampiran 11. Perkiraan rataan marginal daya hambat jenis-jenis ekstrak kulit kayu mesoyi terhadap bakteri uji... 93
Lampiran 12. Perkiraan rataan marginal daya hambat bakteri uji oleh jenis-jenis ekstrak kulit kayu mesoyi... 93
Lampiran 13. Perkiraan rataan marginal daya hambat pertumbuhan bakteri uji karena interaksi jenis ekstrak kulit kayu mesoyi dengan jenis bakteri uji... 94
Lampiran 14. Struktur dinding sel bakteri (a) Gram positif dan (b) Gram negatif... 95
Lampiran 15. Penentuan nilai MIC minyak atsiri terhadap Salmonella Typhimurium... 96
I. PENDAHULUAN A. LATAR BELAKANG
Salah satu karakteristik bahan pangan adalah mudah sekali mengalami kerusakan yang disebabkan oleh kontaminasi mikroorganisme. Senyawa antimikroba ditambahkan ke dalam bahan pangan untuk menghindari kerusakan ataupun penurunan mutu bahan pangan akibat mikroorganisme.
Senyawa antimikroba terbuat dari bahan yang berasal dari alam ataupun buatan (sintetik). Saat ini senyawa antimikroba yang banyak ditambahkan pada makanan (aditif) sebagai pengawet adalah senyawa antimikroba buatan atau sintetik. Adanya peningkatan taraf hidup, dan perubahan pola hidup, serta peningkatan pengetahuan dan kesadaran pentingnya menjaga kesehatan telah mengubah pola pikir sebagian masyarakat untuk cenderung memilih produk pangan alami daripada produk pangan yang diawetkan dengan menggunakan pengawet sintetik. Perubahan perilaku masyarakat tersebut mendorong banyaknya penelitian yang dilakukan untuk mencari solusi melepaskan ketergantungan terhadap pengawet sintetik dan kembali ke alam (back to nature), termasuk mencari sumber pengawet/senyawa antimikroba alami.
Indonesia adalah salah satu pusat keanekaragaman hayati dunia selain Brazilia dan Tanzania (Agusta, 2000). Indonesia adalah negara penghasil rempah-rempah khas yang telah dikenal sejak dahulu kala. Rempah banyak digunakan sebagai bumbu ataupun digunakan secara tradisional untuk pengobatan suatu penyakit dan pengawetan bahan pangan. Salah satu rempah di Indonesia yang dimanfaatkan sebagai obat terutama di Indonesia bagian timur adalah kulit kayu mesoyi.
Mesoyi merupakan salah satu dari 4000 jenis kayu di Indonesia yang belum diketahui sifat dan kegunaannya (Kartasujana dan Martawijaya, 1973). Tanaman mesoyi (Cryptocaria massoia) termasuk dalam famili Lauraceae. Beberapa rempah dari famili ini yang telah lebih banyak dikenal dibandingkan mesoyi adalah kayu manis (Cinnamomun burmanii) dan
antarasa (Litsea cubeba) (Agusta, 2000). Selain itu, bagian kayu dari rempah yang banyak diteliti adalah kayu secang (Caesalpinia sappan Linn.).
Mesoyi (Cryptocaria massoia) merupakan pohon hutan yang terdapat di Indonesia, terutama di Indonesia Timur. Kulit kayu merupakan bagian yang paling banyak dimanfaatkan dari tanaman mesoyi (Guenther, 1972). Kulit kayu mesoyi lebih banyak digunakan sebagai obat-obatan daripada sebagai bumbu. Kulit kayu mesoyi banyak digunakan untuk mengobati diare, kejang, demam, TBC, sakit otot, sakit kepala, dan konstipasi kronis (Lily, 1980).
Sa’roni dan Adjirni (2001) menyatakan bahwa infus kulit kayu mesoyi dosis 300 mg/100 g bobot badan mempunyai efek antiinflamasi pada tikus putih, tetapi tidak sekuat fenilbutazon (kontrol) dengan dosis 10 mg/100 g bobot badan. Mesoyi juga diketahui sebagai rempah yang memiliki khasiat analgetika. Pada dosis 100 mg/10 g bobot badan, mesoyi memiliki efektivitas analgetik lebih besar daripada asetosal sebagai kontrol pada dosis 0.52 mg/10 g bobot badan mencit (Widowati dan Pudjiastuti, 2001). Diketahuinya manfaat kulit kayu mesoyi sebagai antiinflamasi dan analgetika, serta penggunaan kulit kayu mesoyi secara empiris inilah yang menjadi dasar perlunya dilakukan penelitian lain agar pemanfaatan kulit kayu mesoyi semakin luas. Salah satu caranya adalah dengan mempelajari aktivitas antimikroba dari kulit kayu mesoyi.
Kemampuan mempengaruhi pertumbuhan mikroba dipengaruhi oleh kandungan komponen bioaktif yang bersifat antimikroba di dalam suatu bahan. Telah diketahui bahwa kandungan komponen bioaktif rempah-rempah merupakan komponen yang banyak berperan sebagai senyawa antimikroba. Diduga kulit kayu mesoyi berpotensi sebagai salah satu sumber senyawa antimikroba alami, sehingga dapat digunakan sebagai pengawet pangan dan dikembangkan sebagai bahan pangan fungsional. Dengan demikian nilai ekonomis kulit kayu mesoyi akan meningkat.
B. TUJUAN DAN SASARAN
Penelitian ini bertujuan untuk mengkaji aktivitas antimikroba beberapa jenis ekstrak kulit kayu mesoyi terhadap mikroba patogen dan perusak pangan. Sasaran yang ingin dicapai dari penelitian ini adalah peningkatan pemanfaatan ekstrak kulit kayu mesoyi sebagai pengawet pangan alami dan pengembangannya sebagai pangan fungsional.
II. TINJAUAN PUSTAKA A. KULIT KAYU MESOYI
Kulit kayu mesoyi merupakan bagian kulit kayu dari tanaman mesoyi (Cryptocaria massoia). Mesoyi termasuk famili Lauraceae. Spesies yang paling populer dari famili tumbuhan ini sebagai penghasil minyak atsiri adalah Cinnamomun burmannii (kayu manis) dari genus
Cinnamomun, Litsea cubeba (antarasa) dari genus Litsea, dan Cryptocaria massoia (mesoyi) dari genus Cryptocaria (Agusta, 2000).
Daerah sebaran Cinnamomun dan Cryptocaria di Indonesia terbagi menjadi dua daerah yang menarik untuk dicermati. Daerah Indonesia bagian barat dan tengah seperti Sumatera dan Jawa, umumnya didominasi oleh Cinnamomun, sedangkan Cryptocaria populasinya lebih dominan di daerah Indonesia timur, terutama Irian Jaya (Agusta, 2000).
Beberapa ilmuwan mengemukakan beberapa nama botani tanaman mesoyi, antara lain Massoia aromaticum Becc., dan Cinnamomun
xanthoneuron Blume (Guenther, 1972). Saat ini diketahui bahwa terdapat
beberapa varietas tanaman mesoyi, seperti Cryptocaria massoia, Massoia
aromaticum Baecari., Cinnamomun xanthoneuron Blume, dan Cinnamomun culilawan Blume (Ketaren, 1985). Varietas Cryptocaria massoia terdapat di daerah Bogor (Ketaren 1985), dan karenanya kulit
kayu mesoyi yang digunakan pada penelitian ini termasuk dalam varietas
Cryptocaria massoia.
Mesoyi digambarkan sebagai pohon hutan yang indah, tingginya sedang, tegak, dan dapat tumbuh pada tanah berkapur. Mesoyi terdapat di beberapa daerah di Sumatera, Kalimantan, Jawa, Bali, Seram Selatan dan Laut Bacan, Pulau Aru dan Kai, dan Irian. Mesoyi memiliki beberapa bagian penting yang banyak digunakan, antara lain daun, cabang, kulit dan kayu. Tanaman ini tumbuh pada ketinggian 1000-1500 m diatas permukaan laut (Heyne, 1987). Selain terdapat di beberapa daerah di Indonesia, mesoyi juga banyak terdapat di Cina (Guenther, 1972).
Mesoyi memiliki beberapa bagian penting yang banyak digunakan. Daun mesoyi banyak digunakan di Pulau Seram sebagai bahan pengisi bantal atau sebagai obat dengan mengoleskannya pada kepala saat perjalanan jauh (Guenther, 1972), karena daun mesoyi memberi efek menghangatkan.
Kulit kayu mesoyi berwarna coklat, memiliki bau tajam yang khas, dan rasa yang cenderung kurang disukai (Heyne, 1987). Kulit kayu mesoyi memiliki ukuran rata-rata lebar 5 cm dan panjang mencapai 100 cm. Biasanya kulit tanaman mesoyi dijual dalam bentuk ikatan atau potongan (Guenther, 1972). Bagian kulit ini mengeluarkan cairan yang dapat menyebabkan gatal-gatal bila terkena kulit. Oleh karena itu pada penanganannya cairan ini harus dikeluarkan terlebih dahulu dengan cara diletakkan secara berdiri selama beberapa hari. Setelah kering kulit kayu kayu mesoyi akan terlepas dengan sendirinya. Meskipun demikian kulit kayu mesoyi tetap mengandung lemak walaupun dibiarkan berhari-hari (Iskandar dan Ismanto, 2001).
Kulit kayu mesoyi banyak digunakan sebagai obat-obatan, makanan, dan jamu. Penggunaannya sebagai obat, antara lain sebagai campuran pada obat kejang perut, dan obat keputihan. Di Sumatera, Kalimantan, Jawa dan Bali, kulit kayu mesoyi digunakan pada hari-hari dingin karena dapat membuat badan lebih hangat. Di Jawa dan Bali, kulit kayu mesoyi dibuat menjadi bubur, yang berfungsi selain membuat badan lebih hangat juga dapat mengharumkan badan (Heyne, 1987).
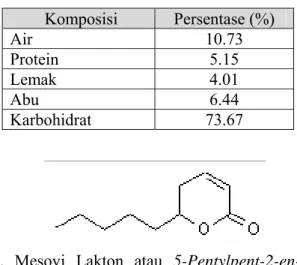
Kulit kayu mesoyi berwarna kelabu muda, kaki batang kasar dan retak, dan bagian dalam berwarna kemerah-merahan. Potongan kulit kayu mesoyi dan minyak hasil penyulingannya dapat dilihat pada Gambar 1. Komposisi kulit kayu mesoyi dapat dilihat pada Tabel 1. Saat ini, kulit kayu mesoyi banyak diambil minyaknya sebagai bahan baku parfum. Minyak kulit kayu mesoyi dihasilkan dari proses penyulingan uap kulit kayu mesoyi. Komponen utama minyak kulit kayu mesoyi adalah persenyawaan mesoyi-lakton (Ketaren, 1985). Struktur persenyawaan mesoyi-lakton dapat dilihat pada Gambar 2.
(a) (b)
Gambar 1. (a) pohon mesoyi (Sudibyo, 1998) dan (b) minyak atsiri kulit kayu mesoyi (Anonima, 2004)
Tabel 1. Hasil analisis proksimat kulit kayu mesoyi Komposisi Persentase (%) Air 10.73 Protein 5.15 Lemak 4.01 Abu 6.44 Karbohidrat 73.67
Gambar 2. Mesoyi Lakton atau 5-Pentylpent-2-en-5-olide (C10H16O2) (Leffingwell, 1999)
Sebagai tanaman khas Indonesia, kulit kayu mesoyi belum banyak dimanfaatkan dan diteliti kegunaannya bila dibandingkan dengan tanaman khas Indonesia lainnya seperti kayu manis, antarasa, dan kayu secang. Kayu manis dengan senyawa sinamaldehid sebagai komponen utamanya, telah diketahui sebagai salah satu rempah penghasil minyak yang memiliki aktivitas antimikroba (Davidson dan Naidu, 2000). Litsea
cubeba (antarasa) diketahui sebagai rempah yang memiliki aktivitas
antimikroba (Mulia, 2000). Kayu secang (Caesalpinia sappan Linn) merupakan rempah di Indonesia yang juga berasal dari kayu dan telah terbukti memiliki aktivitas antimikroba (Sundari et al., 1998).
B. TEKNIK EKSTRAKSI
Ekstraksi adalah suatu cara memisahkan komponen tertentu dari suatu bahan sehingga didapatkan zat yang terpisah secara kimiawi maupun fisik. Ekstraksi biasanya berkaitan dengan pemindahan zat terlarut diantara dua pelarut yang tidak saling bercampur. Proses ekstraksi bertujuan untuk mendapatkan bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif. Teknik ekstraksi yang tepat berbeda untuk masing-masing bahan. Hal ini dipengaruhi oleh tekstur, kandungan bahan, dan jenis senyawa yang ingin didapat (Nielsen, 2003).
Terdapat dua jenis ekstraksi yang dikenal, yaitu dengan menggunakan panas dan tanpa pemanasan. Pada penelitian ini digunakan teknik ekstraksi yang menggunakan pemanasan, atau biasa disebut refluks. Pembagian jenis ekstraksi dapat juga dilakukan menurut pelarut yang digunakan. Untuk pembagian ini, ekstraksi dibagi menjadi ekstraksi tunggal dan ekstraksi bertingkat. Ekstraksi tunggal adalah teknik ekstraksi pada bahan secara langsung menggunakan satu jenis pelarut, sedangkan ekstraksi bertingkat adalah ekstraksi dengan beberapa pelarut organik yang tingkat kepolarannya berbeda-beda.
Proses ekstraksi yang dilakukan pada penelitian ini adalah ekstraksi tunggal dengan pemanasan (refluks), destilasi uap, dan ekstraksi bertingkat dengan pemanasan (refluks). Berikut akan dijelaskan lebih lanjut proses ekstraksi tersebut.
1. Refluks
Refluks adalah teknik ekstraksi dengan menggunakan panas. Kelebihan dari refluks adalah dapat mempercepat proses ekstraksi, dan mendapatkan komponen bahan lebih banyak (rendemen lebih besar). Pengaplikasian panas dapat meningkatkan kelarutan bahan dan membuat komponen-komponen didalamnya lebih mudah terekstrak (Adawiyah, 1998). Selain itu, penggunaan panas juga lebih mendekati pada aplikasi sehari-hari, yaitu rempah sering digunakan sebagai bumbu dan dalam pengolahannya biasanya melalui proses pemasakan (panas). Kekurangannya adalah resiko terjadinya kerusakan komponen yang terekstrak karena terkena panas.
Untuk memperkecil resiko, maka refluks dilakukan dengan waktu yang lebih singkat. Selain itu, pemilihan pelarut yang digunakan juga dapat mengurangi kerusakan oleh panas. Pelarut yang baik digunakan pada cara panas adalah pelarut organik dengan titik didih lebih rendah daripada air, seperti benzena (Pomeranz dan Meloan, 1994).
Pada refluks, baik tunggal ataupun bertingkat, bahan diekstraksi pada suhu tinggi selama 3 jam. Cairan kemudian disaring dan bahan diekstraksi kembali selama dua jam. Hal ini bertujuan untuk meningkatkan rendemen (Adawiyah, 1998). Gambar alat refluks dapat dilihat pada Lampiran 2.
2. Destilasi uap
Destilasi adalah cara ekstraksi yang telah dikenal sejak dahulu kala dan digunakan secara luas selama ribuan tahun. Awalnya alat yang terdiri dari evaporator dan kondensor banyak digunakan untuk mendapatkan konsentrat dari minuman beralkohol. Destilasi dapat diartikan sebagai proses yang memisahkan dua atau lebih campuran
bahan yang memiliki titik didih yang berbeda. Pemisahan terjadi dengan mengeluarkan komponen volatil (Kister, 1992).
Untuk mendapatkan minyak atsiri, dilakukan destilasi uap. Destilasi uap adalah salah satu jenis ekstraksi tanpa menggunakan panas. Pada metode ini, air sebagai sumber uap panas berada pada ketel yang berbeda yang kemudian dialirkan dari bejana uap ke dalam bahan (Ketaren, 1985). Setelah bahan banyak teruapkan, maka bahan akan mendidih kemudian air dan minyak naik melalui tabung dan mengalami kondensasi. Distilat yang diperoleh terdiri dari dua lapisan, yaitu lapisan minyak dan lapisan air. Dengan demikian minyak dapat dipisahkan dari air (Mulia, 2000).
Ekstraksi minyak atsiri dengan metode destilasi uap memiliki beberapa kelemahan, yaitu: (1) tidak baik digunakan terhadap beberapa jenis minyak yang mengalami kerusakan oleh adanya panas dan air, (2) minyak atsiri yang mengandung fraksi ester akan terhidrolisa karena adanya air dan panas, (3) komponen minyak yang larut dalam air tidak dapat diekstraksi, dan (4) bau minyak sedikit berubah dari bau wangi alamiah (Ketaren, 1985).
3. Ekstraksi dengan pelarut organik
Ekstraksi secara bertingkat dilakukan dengan menggunakan beberapa pelarut dengan tingkat kepolaran yang berbeda. Hal ini dikarenakan tingkat kepolaran berbagai komponen non-volatil dalam rempah-rempah berbeda-beda juga. Hal-hal yang perlu diperhatikan mengenai pelarut adalah: (1) pelarut polar akan melarutkan senyawa polar, (2) pelarut organik akan cenderung melarutkan senyawa organik, dan (3) pelarut air cenderung melarutkan senyawa anorganik dan garam dari asam ataupun basa (Achmadi, 1992).
Prinsip ekstraksi menggunakan pelarut organik adalah bahan yang akan diekstrak dikontakkan langsung dengan pelarut selama selang waktu tertentu, sehingga komponen yang akan diekstrak akan
terlarut dalam pelarut. Kelebihan dari ekstraksi menggunakan pelarut organik adalah mendapatkan senyawa yang lebih terkonsentrasi dan memiliki aroma yang hampir benar-benar sama dengan bahan alami awal (Anonimb, 2006). Pengekstraksian minyak tumbuhan dengan kimiawi (pelarut organik) adalah cara paling ekonomis karena membutuhkan sedikit biaya dengan hasil yang banyak. Tetapi bahan-bahan kimia yang digunakan dikhawatirkan dapat mengganggu kesehatan dan mencemari lingkungan (Iskandar, 2003). Kekurangan ini disebabkan terdapatnya residu pelarut organik didalam ekstrak. Oleh karena itu, setelah proses ekstraksi selesai, penting dilakukan penghilangan sisa pelarut organik yang terdapat dalam bahan (Anonimb, 2006).
Pada penelitian ini, ekstraksi dilakukan secara berturut-turut menggunakan heksan, etil asetat, dan metanol. Dengan demikian akan diperoleh ekstrak yang mengandung senyawa non polar, senyawa dengan kepolaran menengah, dan senyawa polar.
Proses ekstraksi dengan pelarut non-polar (heksan) diperlukan untuk menghilangkan lemak (defatting), sehingga pelarut yang lain lebih efektif dalam mengekstraksi ampas mesoyi. Heksan adalah hidrokarbon alkana dengan rumus molekul C6H14. Heksan biasanya merupakan cairan tak berwarna dan bersifat non-polar. Heksan memiliki titik didih 69°C dan dapat larut dalam air (Anonimh, 2006).
Etil asetat adalah komponen organik semi polar dengan rumus molekul C4H8O2. Etil asetat adalah cairan tidak berwarna dan memiliki bau tajam yang kurang enak. Keuntungan menggunakan etil asetat sebagai pelarut disebabkan oleh sifatnya yang volatil, non-toksik, dan tidak higrokopis (Anonimi, 2006).
Metanol adalah alkohol sederhana dengan senyawa kimia dengan rumus molekul CH3OH. Metanol merupakan cairan kimia tak berwarna, volatil, dapat terbakar, beracun, dengan bau yang lebih dalam dan lebih wangi dibandingkan etanol. Metanol banyak
digunakan sebagai pelarut dan bahan bakar. Titik didih pelarut ini adalah 64.7°C. Metanol bersifat polar dan karenanya akan mengekstrak komponen-komponen polar dari bahan (Anonimc, 2006).
C. SENYAWA ANTIMIKROBA
Senyawa antimikroba adalah senyawa biologis atau senyawa kimia yang digunakan dalam dosis kecil dengan tujuan untuk mencegah ataupun menghambat pertumbuhan dan aktivitas mikroba (Ray, 2001). Senyawa ini terdapat didalam bahan pangan dengan berbagai cara. Beberapa diantaranya terdapat secara alamiah, ditambahkan dengan sengaja, ataupun terbentuk selama pengolahan atau oleh mikroorganisme yang tumbuh selama fermentasi (Fardiaz, 1992). Dalam bidang pangan, senyawa antimikroba umumnya digunakan sebagai senyawa aditif untuk mencegah pembusukan makanan karena adanya pertumbuhan mikroba (Branen, 1993).
Senyawa antimikroba yang ditambahkan pada makanan untuk mengawetkan harus mempunyai beberapa kriteria ideal, antara lain memiliki aktivitas antimikroba, aman untuk dikonsumsi manusia, ekonomis, tidak menyebabkan perubahan kualitas makanan, memiliki aktivitas antimikroba yang baik pada kondisi lingkungan makanan, efektif pada dosis kecil, serta bersifat membunuh daripada menghambat pertumbuhan mikroba (Ray, 2001). Pemilihan senyawa antimikroba pangan yang baik didasarkan pada kemampuannya menghambat jenis-jenis mikroba. Biasanya senyawa antimikroba yang dapat menghambat lebih banyak bakteri, baik bakteri pembusuk ataupun patogen (spektrum penghambatan yang luas) lebih diharapkan (Branen, 1993).
Penghambatan terhadap bakteri uji dapat bersifat bakterisidal ataupun bakteristatik. Bakteristatik artinya dapat menghambat pertumbuhan bakteri secara cukup signifikan, dan bila bahan penghambat dihilangkan maka bakteri akan pulih dan dapat tumbuh kembali (Prescott
et al., 2003). Bakterisidal dapat diartikan sebagai bahan yang dapat
membunuh bakteri yang menjadi target. Aktivitas dari senyawa yang bersifat bakterisidal sangat tergantung pada konsentrasi antimikroba yang digunakan (Prescott et al., 2003).
Fakta yang menunjukkan adanya hubungan antara rempah-rempah dengan mikrobiologi diantaranya adalah: (1) beberapa rempah diketahui memiliki aktivitas antimikroba, (2) rempah-rempah dapat menstimulasi metabolisme mikroorganisme, (3) rempah-rempah menjadi berjamur bila disimpan pada tempat dengan kelembaban tinggi, dan (4) terkadang rempah mengandung mikroba secara alami (Farkas, 2000). Rempah-rempah dan ekstrak-ekstrak tanaman telah banyak diketahui memiliki aktivitas antimikroba. Kayu manis, bawang putih, bawang bombay, jahe, dan banyak rempah lainnya telah terbukti memiliki aktivitas antimikroba. Hal ini membuka jalan untuk banyak penelitian yang bertujuan mempelajari kemungkinan penggunaan bahan alami sebagai pengawet (Ray, 2001).
Senyawa antimikroba dapat menyebabkan kerusakan sel bakteri dengan beberapa cara. Secara umum mekanisme kerja antimikroba dalam menghambat mikroba adalah: (1) bereaksi dengan membran sel, (2) inaktivasi enzim esensial, dan (3) mendestruksi atau menginaktivasi fungsi dari materi genetik (Davidson, 1993).
D. KARAKTERISTIK MIKROBA PATOGEN DAN MIKROBA PEMBUSUK MAKANAN
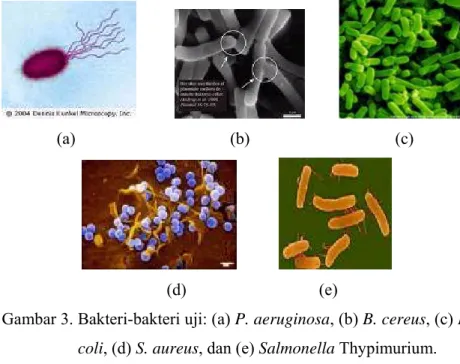
Bakteri yang akan diuji pada penelitian ini mewakili bakteri patogen dan pembusuk pangan. Bakteri yang akan diuji adalah Staphylococcus
aureus, Eschericia coli, Salmonella Typhimurium, Pseudomonas aeruginosa, dan Bacillus cereus. Staphylococcus aureus, Eschericia coli, Salmonella Typhimurium, dan Bacillus cereus mewakili jenis bakteri
patogen, sedangkan Pseudomonas aeruginosa mewakili bakteri pembusuk pangan.
Bakteri dikategorikan patogen bila bakteri tersebut dapat menyebabkan penyakit bagi manusia yang mengkonsumsi makanan yang mengandung bakteri ini dalam jumlah tertentu. Beberapa bakteri patogen juga dapat menghasilkan toksin (racun), sehingga jika toksin tersebut dikonsumsi oleh manusia dapat menyebabkan intoksikasi. Pada intoksikasi, sekalipun makanan atau bahan pangan sudah dipanaskan, toksin yang sudah terbentuk masih tetap aktif dan bisa menyebabkan keracunan meski bakteri tersebut sudah tak ada dalam makanan (Ardiansyah, 2006).
Kualitas pangan akan menurun jika terdapat bakteri pembusuk di dalamnya. Pembusukan (spoilage) adalah istilah yang digunakan untuk menggambarkan penurunan kualitas dari warna, tekstur, aroma, dan rasa makanan hingga titik dimana makanan tersebut tidak dapat diterima oleh manusia (Shiddieqy, 2006).
Bakteri-bakteri uji ini dapat dikelompokkan atas golongan bakteri Gram positif dan bakteri Gram negatif. Bakteri yang termasuk kedalam kelompok bakteri Gram positif adalah Staphylococcus aureus dan Bacillus
cereus, sedangkan yang termasuk pada bakteri Gram negatif adalah Eschericia coli, Pseudomonas aeruginosa, dan Salmonella Typhimurium.
1. Staphylococcus aureus
Stapilokoki merupakan kumpulan sel yang tidak beraturan dan berbentuk seperti buah anggur. Staphylococcus aureus merupakan golongan bakteri Gram positif, famili Micrococcaceae, dan berbentuk bulat dengan diameter 0.5-1.5 µm. Staphylococcus aureus dapat hidup secara aerobik maupun anaerobik fakultatif, bersifat non-motil dan tidak membentuk spora (Parker, 2000). Gambar S.
aureus dapat dilihat pada Gambar 3.
S. aureus dapat tumbuh pada kisaran suhu 7-48°C dengan suhu
optimum pertumbuhannya adalah 35-37oC. S. aureus terbukti mampu bertahan pada suhu beku (freezing), dan pada suhu -18°C dapat bertahan pada daging dan produk unggas dengan tidak atau
hanya mengalami sedikit perubahan dalam jumlah sel (White dan Hall, 1984). Beberapa strain dari S. aureus juga tahan panas. Faktor-faktor yang mempengaruhi ketahanan S. aureus terhadap panas adalah suhu dimana sel tersebut tumbuh dan umur sel (Parker, 2000).
S. aureus yang tumbuh dibawah suhu 30°C lebih sensitif terhadap
panas dibandingkan S. aureus yang tumbuh di atas suhu 30°C, sedangkan S. aureus yang tumbuh di atas suhu 40°C lebih resisten terhadap panas (Smith dan Marmer, 1991). Sel S. aureus pada masa awal fase log lebih tidak tahan panas dibandingkan sel pada masa stasioner. Kondisi penyembuhan dari sel S. aureus yang rusak akibat panas berlangsung optimum pada suhu 32°C dan pH 6.0 (Parker, 2000).
S. aureus adalah salah satu mikroba patogen yang paling tahan
terhadap lingkungan kering. S. aureus dapat tumbuh pada lingkungan dengan nilai aw yang lebih rendah dibandingkan bakteri patogen lain. Batas nilai aw untuk pertumbuhan akan lebih rendah pada kondisi lingkungan aerobik daripada anaerobik, dan bila suhu dan pH turun batas nilai aw yang diharapkan untuk pertumbuhan meningkat. Kisaran pH untuk pertumbuhan S. aureus adalah antara 4.0-10.0 dalam kondisi lingkungan yang cocok, dengan pH optimumnya adalah 6.0-7.0 (Parker, 2000).
Hampir seluruh strain S. aureus bersifat patogen dan dapat memproduksi 6 jenis enterotoksin (A, B, C1, C2, D, dan E) dengan tingkat toksisitas yang berbeda yang tahan panas, dimana ketahanan panasnya melebihi sel vegetatifnya. Sebagian besar kasus keracunan makanan disebabkan oleh enterotoksin tipe A. S. aureus sering menyebabkan orang yang mengkonsumsi susu dari sapi yang menderita mastitis stapilokoki menjadi sakit (Parker, 2000).
2. Escherichia coli
Bakteri koliform dibedakan atas dua kelompok yaitu fekal dan nonfekal. Escherichia coli merupakan jenis bakteri dari kelompok
fekal yang berasal dari saluran pencernaan manusia dan biasanya diisolasi dari kotoran manusia. Escherichia coli merupakan bakteri Gram negatif yang berbentuk batang. E. coli termasuk famili Enterobacteriaceae. Panjang E. coli adalah 2.0-6.0 µm dan lebarnya adalah 1.1-1.5 µm. E. coli bersifat motil atau non motil dengan flagela peritrikat bersifat fakultatif anaerob. Kisaran suhu untuk pertumbuhan E. coli adalah 10-40oC, dengan suhu optimum pertumbuhannya adalah 37oC. Gambar E. coli dapat dilihat pada Gambar 3.
E. coli mengandung enterotoksin dan faktor virus lainnya yang
dapat menyebabkan diare. Bakteri ini adalah penyebab utama infeksi pada saluran kencing dan nosocomial, termasuk septisimia dan meningitis (Holt, et al.., 1994).
3. Bacillus cereus
B. cereus adalah bakteri Gram positif yang memiliki sel
berukuran cukup besar. B. cereus bersifat fakultatif dan dapat menghasilkan spora yang tahan terhadap suhu tinggi dan pengeringan. Spora B. cereus umumnya berbentuk silinder. B. cereus dapat tumbuh secara aerobik dan juga anaerobik (Granum, 2000). Gambar B. cereus dapat dilihat pada Gambar 3.
Suhu optimum pertumbuhan B. cereus adalah 35-40°C, tetapi beberapa strain B. cereus diketahui dapat tumbuh pada suhu 4-6°C atau bersifat psikrotropik (Driessen, 1993). B. cereus yang dapat menyebabkan keracunan makanan adalah jenis B. cereus yang tumbuh pada suhu 30-40°C atau bersifat mesofilik (Granum, 2000).
Bacillus cereus merupakan saprofit umum pada tanah
(Granum, 2000). B. cereus banyak terdapat pada daging, sayuran, nasi goreng, sup, makaroni, keju, produk roti, kacang-kacangan dan salad mentah.
B. cereus dapat menyebabkan penyakit pada manusia lewat
cereus adalah muntah-muntah, diare, dan sakit perut (Granum,
2000). Sindrom diare disebabkan oleh setidaknya dua jenis enterotoksin yang dihasilkan selama pertumbuhan vegetatif B. cereus didalam usus kecil. Untuk mencegah dampak buruk B. cereus, makanan harus dijaga agar jumlah kontaminasinya tidak tinggi. Batas aman konsumsi B. cereus adalah 1x106 (Granum, 1994). Hal ini dapat dilakukan dengan pemasakan yang dapat membunuh sel vegetatif dan mencegah germinasi spora; pemanasan kemudian pendinginan secepatnya sehingga memberikan shok; dan penyimpanan pada suhu refrigerator.
4. Salmonella Typhimurium
Bakteri dari jenis Salmonella merupakan bakteri penyebab infeksi. Jika tertelan dan masuk ke dalam tubuh maka menimbulkan gejala yang disebut salmonelosis. Gejala salmonelosis yang paling sering terjadi adalah gastroenteritis. Selain gastroenteritis, beberapa spesies Salmonella juga dapat menimbulkan gejala penyakit lainnya, misalnya demam enterik seperti demam tifoid dan demam paratifoid serta infeksi lokal (Fardiaz, 1992).
Salmonella merupakan salah satu genus dari
Enterobacteriaceae. Salmonella berbentuk batang, Gram negatif, anaerobik fakultatif, dan aerogenik. Biasanya, Salmonella bersifat motil dan mempunyai flagela peritrikus. Kebanyakan strain
Salmonella bersifat aerogenik, dapat menggunakan sitrat sebagai
sumber karbon, dan tidak membentuk H2S (Fardiaz,1992). Gambar
Salmonella Typhimurium dapat dilihat pada Gambar 3.
Salmonella hidup secara anaerobik fakultatif. Bakteri ini tidak
dapat berkompetisi secara baik dengan mikroba-mikroba yang umum terdapat di dalam makanan seperti bakteri-bakteri pembusuk, bakteri genus lainnya dalam famili Escericieae dan bakteri asam laktat. Oleh karena itu, pertumbuhannya sangat terhambat dengan adanya bakteri-bakteri tersebut (Cox, 2000).
Salmonella Typhimurium dapat tumbuh pada suhu 5-47°C
dengan suhu optimum 35-37°C. Nilai pH optimum untuk pertumbuhannya adalah 6.5-7.5, sedangkan aw optimum adalah 0.945-0.999 (Cox, 2000).
5. Pseudomonas aeruginosa
Pseudomonas aeruginosa termasuk ordo Pseudomonadales,
sub ordo Pseudomonadaceae, dan famili Pseudomonadaceae, merupakan bakteri aerob obligat dan oksidase positif. Beberapa spesies bersifat motil dengan flagela polar, sedangkan spesies lainnya bersifat non-motil (Bennik, 2000). Pseudomonas aeruginosa adalah Gram negatif, berbentuk batang, tidak membentuk spora, dan berukuran kecil (Gambar 3).
Pseudomonas aeruginosa tumbuh dengan baik pada suhu
37oC. Bakteri ini memproduksi senyawa-senyawa yang menimbulkan bau busuk dan pigmen tiosianin yang berwarna biru. Untuk pertumbuhan yang baik, diperlukan aw minimum 0.96-0.98, pH optimum 6.6-7.0, dan suhu pertumbuhan optimum 37°C (Bennik, 2000).
(a) (b) (c)
(d) (e)
Gambar 3. Bakteri-bakteri uji: (a) P. aeruginosa, (b) B. cereus, (c) E.
E. PENGUJIAN AKTIVITAS ANTIMIKROBA
Pengujian aktivitas antimikroba dapat dilakukan dengan metode in
vitro ataupun dengan metode aplikasi (Davidson dan Parish, 1989).
Metode aplikasi adalah metode dimana senyawa antimikroba diaplikasikan secara langsung terhadap produk pangan untuk mengukur pengaruhnya terhadap mikroflora alami produk pangan tersebut. Metode
in vitro adalah uji aktivitas antimikroba dengan senyawa antimikroba
yang tidak diaplikasikan langsung kepada produk. Metode ini hanya bisa memberikan informasi awal tentang potensi kegunaan komponen sebagai antimikroba. (Davidson dan Parish, 1993). Salah satu metode pengujian aktivitas antimikroba secara in vitro adalah uji difusi sumur dan penentuan nilai MIC.
1. Uji difusi sumur
Uji difusi sumur adalah cara menguji aktivitas antimikroba yang paling banyak digunakan (NCCLS, 1991). Branen (1993) menyatakan bahwa uji difusi sumur merupakan cara yang sederhana dan cepat, walaupun cara ini memiliki kelemahan pada data yang dihasilkan karena lebih bersifat kualitatif. Aktivitas antimikroba yang terlihat pada uji difusi sumur dipengaruhi oleh beberapa faktor, antara lain: (1) tipe dan ukuran cawan, (2) tipe agar, pH, dan kandungan garamnya, (3) kemampuan zat untuk berdifusi kedalam agar, (4) karakteristik media, dan (5) jenis bakteri uji yang digunakan.
Ekstrak yang dimasukkan ke dalam sumur atau lubang akan berdifusi masuk kedalam agar selama masa inkubasi. Bila memiliki sifat antimikroba, ekstrak ini akan menimbulkan gradien konsentrasi di dalam agar dan membentuk penghambatan yang akan terlihat sebagai zona bening. Semakin jauh jarak masuk ke dalam agar, maka konsentrasi ekstrak yang dapat menghambat pertumbuhan bakteri uji juga akan semakin berkurang. Berkurangnya konsentrasi berarti
kekuatan ekstrak berkurang dan hanya beberapa bakteri yang dapat terhambat. Hal inilah yang menimbulkan gradien konsentrasi pada tingkat-tingkat konsentrasi tertentu (Davidson dan Parish, 1993).
Batas dari zona bening adalah pada saat kekuatan ekstrak sudah jauh berkurang, sehingga tidak lagi menghambat pertumbuhan bakteri uji. Zona bening yang terbentuk disebut juga diameter penghambatan. Diameter penghambatan yang terbentuk dipengaruhi oleh beberapa faktor, antara lain konsentrasi ekstrak, tingkat kelarutan ekstrak, dan kemampuan ekstrak untuk berdifusi kedalam agar (Prescott et al., 2003).
2. Penggunaan Kontrol
Pada uji difusi sumur digunakan kontrol sebagai pembanding. Kontrol negatif yang digunakan adalah pelarut untuk melarutkan ekstrak, yaitu Dimetilsulfoksida (DMSO), sedangkan kontrol positif yang digunakan adalah antibiotik. Tujuan menggunakan kontrol negatif adalah untuk melihat pengaruh DMSO terhadap aktivitas antimikroba ekstrak. Kontrol positif digunakan sebagai pembanding terhadap aktivitas antimikroba ekstrak, karena antibiotik merupakan senyawa antimikroba yang telah dibuat secara terstandar.
a. Kontrol positif
Kontrol positif yang digunakan adalah antibiotik dengan spektrum antimikroba yang luas, yaitu amoxycillin. Antibiotik adalah produk metabolit yang dihasilkan organisme tertentu, yang dalam jumlah amat kecil bersifat merusak atau menghambat mikroorganisme lainnya. Antibiotik merupakan zat kimia yang dihasilkan oleh suatu mikroba dan bersifat menghambat mikroorganisme yang lain.
Antibiotik merupakan bahan yang sering digunakan dalam penelitian. Beberapa antibiotik yang sering digunakan pada
penelitian adalah penicillin, actinomycins, chloramphenicol,
cycloserine, asam nalidiksik dan novobiosin, rifampin, cycloheximide, daunomisin, mitomisin C, dan polioksin (Prescott
et al., 2003).
Suatu zat antibiotik hendaknya memiliki sifat sebagai berikut: (1) mampu menghambat atau merusak patogen spesifik, (2) tidak mengakibatkan berkembangnya bentuk-bentuk resisten, (3) tidak menimbulkan efek samping yang dikehendaki, (4) tidak mengganggu flora alamiah dari suatu benda atau manusia, (5) harus dapat dimasukkan dari mulut tanpa diinaktifkan, dan (6) sangat mudah larut dalam air.
Amoxycillin adalah senyawa antibiotik semisintesis dari
Penisilin. Penisilin merupakan salah satu antibiotik yang umum dan banyak beredar di masyarakat. Penisilin merupakan antibiotik modern yang pertama, dan merupakan antibiotik yang bermanfaat karena paling luas penggunaannya. Penisilin ditemukan sebagai metabolit sekunder dari kapang jenis tertentu, yaitu Penicillium notatum, dan P. Chrysogenum.
Cara kerja penisilin menghambat pertumbuhan bakteri adalah dengan menghambat pembentukan dinding sel bakteri. Penisilin menghambat kerja enzim yang mengkatalis reaksi pemindahan peptida-peptida dalam proses pembentukan peptidoglikan dinding sel. Kemampuan ini dimiliki penisilin karena kemiripan struktur dengan enzim pengkatalis. Penisilin diketahui efektif karena memiliki kemampuan menghambat sintesis peptidoglikan dinding sel bakteri. Penghambatan tersebut bersifat spesifik dan sedikit sekali mempunyai efek buruk bagi pemakai (Prescott et al., 2003).
Penisilin menghambat bakteri patogen hanya bila bakteri tersebut sedang berada pada fase log (Prescott et al., 2003). Hal ini sesuai dengan kemampuan penisilin menghambat sintesis peptidoglikan dinding sel yang terjadi pada fase log. Penisilin
menghalangi pembentukan ikatan peptidoglikan dengan sempurna dan pada akhirnya dapat mengakibatkan osmotik lisis (Prescott et al., 2003). Bila sel bakteri yang peka terhadap penisilin ditumbuhkan dengan tambahan antibiotik ini, sel bakteri tersebut akan menjadi luar biasa besar ukurannya serta memiliki bentuk yang tidak umum lalu kemudian lisis.
Saat ini telah diketahui beberapa mekanisme penghambatan penisilin yang lain. Pensilin diketahui dapat berikatan dengan protein pengikat dan dapat menghancurkan bakteri dengan mengaktifkan enzim autolisis. Penisilin menstimulasi protein khusus yang disebut hollins untuk membentuk lubang pada membran plasma. Hal ini akan mengakibatkan membran rusak dan menyebabkan kematian. Beberapa antibiotik lain yang memiliki mekanisme serupa dengan penisilin adalah
cephalosporins, vancomycin, dan bakitrasin (Prescott et al.,,
2003).
Penisilin G efektif terhadap beberapa bakteri patogen Gram positif, misalnya Streptococcus dan Staphylococcus. Ampisilin, yang merupakan salah satu turunan penisilin, diketahui efektif untuk dikonsumsi dengan diminum, dan memiliki spektrum penghambatan bakteri yang lebih luas antara lain dapat menghambat bakteri Gram negatif, seperti Haemophilus,
Salmonella, dan Shigella.
b. Kontrol negatif
Kontrol negatif yang digunakan pada uji difusi sumur adalah DMSO (dimetil sulfoksida). DMSO adalah pelarut yang umum digunakan dalam analisis atau percobaan, karena kemampuannya untuk melarutkan senyawa baik polar ataupun non polar. DMSO memiliki sifat seperti emulsifier. Rumus senyawa DMSO adalah (CH3)2SO. Gambar strukturnya dapat dilihat pada Gambar 4.
Gambar 4. Dimethyl sulfoxide atau DMSO (Anonimd, 2006)
DMSO merupakan cairan bening dengan bau seperti bawang putih. DMSO memiliki titik didih 189°C dan dapat larut dalam air. DMSO bersifat stabil dalam kondisi normal dan bersifat higrokopis. DMSO efektif sebagai pelarut dalam proses ekstraksi dan pemisahan komponen aroma (flavor), serta dalam fraksinasi komponen tidak jenuh dari suatu bahan (Anonimd, 2006).
3. Penentuan Nilai MIC
MIC (Minnimum Inhibitory Concentration) adalah konsentrasi terendah dari suatu senyawa antimikroba dimana antimikroba tersebut masih memiliki kemampuan menghambat mikroba dalam periode inkubasi tertentu (Davidson dan Parish, 1993). Nilai MIC penting diketahui untuk mengkonfirmasi resistensi bakteri uji terhadap senyawa antimikroba dan untuk menentukan aktivitas senyawa antimikroba baru (Anonimc, 2006).
Penentuan MIC dapat dilakukan dengan cara padat ataupun cara cair. Perbedaan cara padat dan cara cair terletak pada jenis media agar yang digunakan untuk analisis. Pada cara cair, mikroba uji yang telah ditumbuhkan didalam media cair kemudian ditambahkan senyawa antimikroba dalam selang konsentrasi tertentu (Davidson dan Parish, 1993). Cara ini disebut metode kontak. Nilai MIC ditentukan pada konsentrasi dimana mikroba didalam media cair sudah tidak tumbuh lagi, dengan ciri-ciri media agar cair bening (tidak keruh) (Davidson dan Parish, 1993). Pada cara padat digunakan uji difusi sumur. Data diameter penghambatan kemudian diolah dengan regresi sehingga didapat persamaan sederhana yang dapat digunakan untuk mencari nilai MIC.
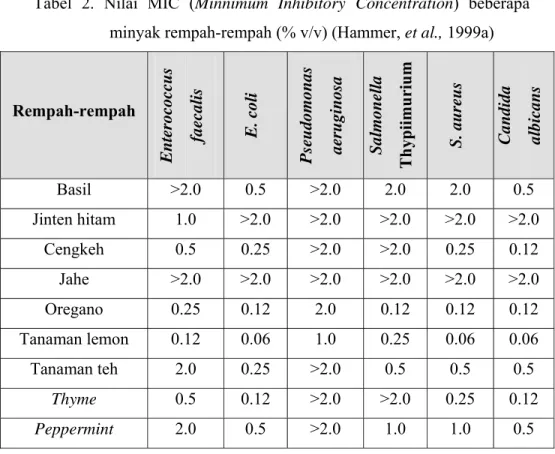
Kelebihan dari metode kontak adalah hasilnya yang lebih akurat. Kelemahannya adalah waktu yang dibutuhkan lebih lama, diperlukan ketelitian dan pengulangan analisis berkali-kali untuk mendapatkan data yang valid. Kelebihan dari metode difusi sumur untuk menentukan nilai MIC adalah cara ini lebih sederhana dan waktu yang diperlukan lebih singkat, sedangkan kelemahannya adalah datanya kurang akurat. Beberapa nilai MIC dari minyak rempah-rempah terhadap beberapa bakteri dapat dilihat pada Tabel 2.
Tabel 2. Nilai MIC (Minnimum Inhibitory Concentration) beberapa minyak rempah-rempah (% v/v) (Hammer, et al., 1999a)
Rempah-rempah Ent eroco cc us faecalis E. col i Pseudomonas aeru gino sa S a lmonel la Th ypiimuri u m
S. aureus Candida albicans
Basil >2.0 0.5 >2.0 2.0 2.0 0.5 Jinten hitam 1.0 >2.0 >2.0 >2.0 >2.0 >2.0 Cengkeh 0.5 0.25 >2.0 >2.0 0.25 0.12 Jahe >2.0 >2.0 >2.0 >2.0 >2.0 >2.0 Oregano 0.25 0.12 2.0 0.12 0.12 0.12 Tanaman lemon 0.12 0.06 1.0 0.25 0.06 0.06 Tanaman teh 2.0 0.25 >2.0 0.5 0.5 0.5 Thyme 0.5 0.12 >2.0 >2.0 0.25 0.12 Peppermint 2.0 0.5 >2.0 1.0 1.0 0.5 F. UJI FITOKIMIA
Fitokimia mempelajari aneka ragam senyawa organik yang dibentuk dan ditimbun oleh tumbuhan, yaitu mencakup struktur kimia, biosintesis, perubahan serta metabolisme, penyebaran secara alamiah, dan fungsi biologis. Kandungan kimia tumbuhan dapat digolongkan
berdasarkan asal biosintesis, sifat kelarutan, dan adanya gugus kunci tertentu (Harborne, 1996).
Uji fitokimia biasanya memiliki kegunaan dalam fisiologi tumbuhan, patologi tumbuhan, ekologi tumbuhan (interaksi antara tumbuhan dengan lingkungan), paleobotani (tumbuhan berperan dalam menguji hipotesis tentang fosil), dan genetika tumbuhan (Harborne, 1996). Pada bidang fisiologi tumbuhan, uji fitokimia dilakukan untuk mengidentifikasi baik secara awal ataupun lanjut senyawa-senyawa yang menyusun tanaman, seperti penentuan struktur, asal-usul biosintesis, dan fungsi kerja senyawa tersebut dalam tanaman.
Uji fitokimia dilakukan untuk mengetahui metabolit sekunder dari tumbuhan. Beberapa jenis metabolit sekunder memiliki aktivitas antimikroba (Naidu, 2000). Metabolit sekunder tanaman yang banyak terdapat pada batang, daun, kayu, bunga, dan buah antara lain adalah saponin, flavonoid, fenol, alkaloid, steroid dan terpenoid, serta tanin.
1. Fenol
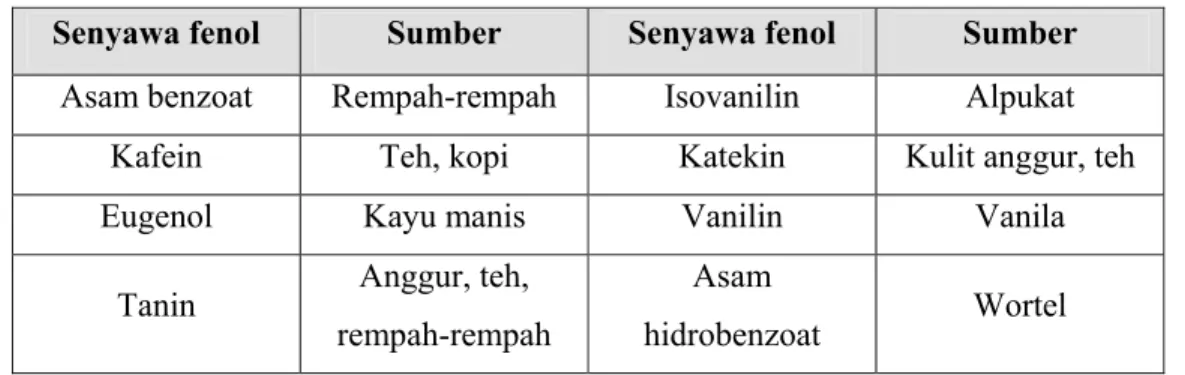
Fenol merupakan senyawa yang memiliki sebuah cincin aromatik dengan satu atau lebih gugus hidroksil. Fenol dan turunannya memiliki sifat cenderung larut dalam air (Suradikusumah, 1989). Fenol merupakan senyawa yang penting karena merupakan kelas besar diantara senyawa-senyawa penyusun tanaman. Senyawa fenolik terdiri atas ribuan struktur. Beberapa senyawa fenol yang banyak ditemukan di tanaman dapat dilihat pada Tabel 3.
Komponen antimikroba yang terkandung dalam fraksi-fraksi minyak esensial rempah-rempah banyak mengandung komponen jenis fenol (Beuchat, 1994). Komponen fenolik dari tanaman yang memiliki aktivitas antimikroba dapat dilihat pada Tabel 4.
Tabel 3. Komponen fenolik yang ditemukan dalam tanaman (Nychas, 1994)
Senyawa fenol Sumber Senyawa fenol Sumber
Asam benzoat Rempah-rempah Isovanilin Alpukat Kafein Teh, kopi Katekin Kulit anggur, teh
Eugenol Kayu manis Vanilin Vanila
Tanin Anggur, teh, rempah-rempah
Asam
hidrobenzoat Wortel
Tabel 4. Komponen fenolik tanaman dan aktivitas antimikrobanya (Davidson dan Naidu, 2000)
Sumber Senyawa fenolik Spektrum antimikroba
Nigella sativa L. Timohidrokuinon Bakteri Gram positif Anethum graveolens L. Minyak atsiri Saccaromyces vini
Ducrosia anethifolia α-pinen / limonen Bakteri Gram positif, khamir Thymus vulgaris Minyak atsiri Enterobakteria patogen
Ocimum sp. Minyak atsiri E. coli, S. aureus Melaleuca alternifolia Linalool / terpinen E. coli, S. aureus
Mekanisme antimikroba senyawa fenolik adalah mengganggu kerja di dalam membran sitoplasma mikroba. Termasuk diantaranya adalah mengganggu transpor aktif dan kekuatan proton (Davidson, 1993). Fenol dapat membentuk ikatan hidrogen dengan protein (Suradikusumah, 1989). Hal ini sesuai dengan Juven et al. (1994) yang menyatakan bahwa thymol dapat bereaksi dengan kandungan protein membran sitoplasma Salmonella Thypimurium. Kompleks ini membuat perubahan permeabilitas membran sel mikroba dan membuat
Salmonella Thypimurium dapat dihambat.
2. Flavonoid
Flavonoid banyak terdapat dalam buah-buahan, sayuran, kacang-kacangan, biji-bijian, akar, dan bunga (Middleton dan Kandaswami,
1994). Flavonoid merupakan bagian dari fenol. Flavonoid umumnya terdapat dalam tumbuhan, dalam bentuk aglikon maupun terikat pada gula sebagai glikosida (Harborne, 1996).
Flavonoid memegang peranan penting dalam biokimia dan fisiologi tanaman, diantaranya berfungsi sebagai antioksidan, penghambat enzim, dan prekursor bagi komponen toksik (Middleton dan Kandaswami, 1994). Flavonoid pada tumbuhan berfungsi untuk mengatur pertumbuhan, mengatur fotosintesis, mengatur kerja antimikroba dan anti-virus, dan mengatur kerja anti-serangga (Robinson, 1995). Selain itu, banyak dari jenis flavonoid merupakan pigmen tanaman, seperti antosianin, flavonol, dan kalkon (Harborne, 1987).
Flavonoid merupakan golongan yang penting karena memiliki spektrum aktivitas antimikroba yang luas dengan mengurangi kekebalan pada organisme sasaran (Naidu, 2000). Flavonoid juga penting dalam teknologi pangan karena turut serta dalam meningkatkan kualitas sensori dan nutrisi dari buah dan produk-produk pangan dari buah-buahan. Flavonoid memiliki kerangka dasar yang terdiri dari 15 atom karbon, dengan dua cincin benzen terikat dan membentuk struktur C6-C3-C6 (Suradikusumah, 1989).
Isoflavon merupakan jenis flavonoid yang banyak terdapat pada tanaman dan memiliki aktivitas antimikroba yang paling tinggi dibandingkan jenis flavonoid lainnya. Sebagai contoh isoflavon dapat menghambat pertumbuhan kapang dan membantu dalam mengontrol wabah penyakit (Naidu, 2000).
3. Saponin
Saponin merupakan senyawa yang secara alami mengandung glikosida, banyak terdapat di tumbuhan (Naidu, 2000). Gruiz (1996) menyatakan bahwa 76% dari jenis tanaman di Asia mengandung saponin. Saponin bersifat seperti sabun. Keberadaan saponin dapat dideteksi dengan mengamati kemampuannya membentuk busa.
Saponin menghambat pertumbuhan atau membunuh mikroba dengan cara berinteraksi dengan membran sterol. Efek utama saponin terhadap bakteri adalah adanya pelepasan protein dan enzim dari dalam sel-sel (Zablotowicz et al.,, 1996).
4. Terpenoid
Terpenoid merupakan senyawa besar yang terkandung dalam tumbuhan. Penggolongan terpenoid didasarkan pada adanya molekul isopren. Secara kimiawi, terpenoid bersifat larut dalam lemak dan terdapat dalam sel tumbuhan (Suradikusunah, 1989). Terpenoid merupakan zat pengatur pertumbuhan tanaman. Salah satu golongan terpenoid yang berpotensi sebagai antimikroba adalah triterpenoid.
Triterpenoid (C30) tersebar luas dalam damar, gabus dan kutin tumbuh-tumbuhan. Triterpenoid termasuk senyawa yang merupakan komponen aktif dalam obat. Senyawa ini banyak digunakan untuk menyembuhkan penyakit gangguan kulit. Triterpenoid memiliki sifat antijamur, insektisida, antibakteri, dan antivirus (Robinson, 1995).
5. Tanin
Tanin adalah polifenol tanaman yang memiliki rasa pahit (Anonime, 2006). Nama tanin diambil dari kegunaannya menyamak kulit binatang. Senyawa yang tergolong tanin adalah senyawa polifenol yang mengandung gugus hidroksil dan gugus lainnya (misalnya karboksil), sehingga mampu membentuk kompleks kuat dengan protein. Senyawa tanin memiliki berat molekul antara 500-20.000 μg.
Tanin mempunyai rasa sepat dan mempunyai kemampuan menyamak kulit. Tanin terdiri dari berbagai asam fenolat. Beberapa tanin dapat mempunyai aktivitas antioksidan, menghambat pertumbuhan tumor, dan menghambat enzim seperti reverse transkripitase dan DNA topoisomerase (Robinson, 1995).
Tanin memiliki beberapa fungsi kesehatan, diantaranya antioksidan dan relaksasi. Selain itu tanin merupakan senyawa yang secara klinis memiliki kemampuan diare, hemostatik, dan anti-hemorhodial (Anonime, 2006).
6. Alkaloid
Alkaloid adalah senyawa alami amina, baik pada tanaman, hewan, ataupun jamur. Senyawa yang tergolong kedalam alkaloid adalah senyawa-senyawa yang mengandung nitrogen. Kebanyakan alkaloid memiliki rasa sepat. (Anonimf, 2006).
Alkaloid banyak ditemukan pada tanaman berbunga. Alkaloid merupakan metabolit sekunder pada tanaman, misalnya kentang dan tomat. Beberapa tanaman yang terbukti mengandung alkaloid adalah
Litsea firma, Phoebe cuneata BL., Litsea diversifolia BL. (Santoni,
2004; Alfinus, 2004; Hakim, 2004).
Alkaloid memiliki efek farmakologi pada hewan dan juga manusia, seperti penggunaannya sebagai analgesik dan anaestetik. Alkaloid yang biasa digunakan sebagai analgesik dan anaestetik adalah morfin dan kodein. Selain berguna sebagai obat-obatan, alkaloid juga dapat bersifat racun, misalnya strisin dan konin (Anonimf, 2006).
III. BAHAN DAN METODE A. BAHAN DAN ALAT
Bahan baku utama pada penelitian ini adalah bubuk kulit kayu mesoyi. Bubuk kulit kayu mesoyi yang digunakan didapat dari pasar Tanah Abang, Jakarta Pusat. Untuk proses ekstraksi digunakan aquades, heksan teknis, etil asetat teknis, metanol teknis, etanol teknis, es batu, dan gas N2. Bahan-bahan yang digunakan untuk persiapan kultur, uji difusi sumur dan penentuan MIC (Minimum Inhibition Concentration) adalah spiritus, antibiotik, alkohol 70%, NaCl, Dimetil Sulfoksida (DMSO), dan Nutrient Broth (NB) serta Nutrient
Agar (NA).
Kultur murni bakteri uji yang digunakan terdiri dari bakteri patogen yaitu Staphylococcus aureus, Eschericia coli, Salmonella Typhimurium, dan
Bacillus cereus, sedangkan kultur bakteri uji yang merupakan bakteri
pembusuk yaitu Pseudomonas aeruginosa.
Peralatan yang digunakan pada proses ekstraksi adalah peralatan refluks, oven vakum, kertas saring Whatman No.1, termometer, sudip, gelas ukur 100 ml, botol berwarna gelap, corong kaca, botol kaca bening, rotavapor, labu refluks, tabung rotavapor, plastik, kain, dan alat saring vakum.
Alat-alat untuk persiapan kultur, uji difusi agar dan penentuan nilai MIC adalah otoklaf, shaker, gelas piala, sudip, timbangan, sudip, peralatan gelas, plastik tahan panas, cawan petri, ose, pipet mikron ukuran 1000 μl dan 200 μl, tip untuk pipet mikro, alat pembuat sumur, botol kaca, tusuk gigi, jar atau botol kaca, gelas piala, cawan petri, jangka sorong, bunsen bakar, baskom, tissue, label, pembungkus aluminium, dan gunting.
B. TEMPAT DAN WAKTU
Penelitian dilakukan di Laboratorium Mikrobiologi Pangan, Pusat Antar Universitas, Institut Pertanian Bogor, dan Laboratorium Kimia Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari Februari 2006 hingga
C. METODE PENELITIAN
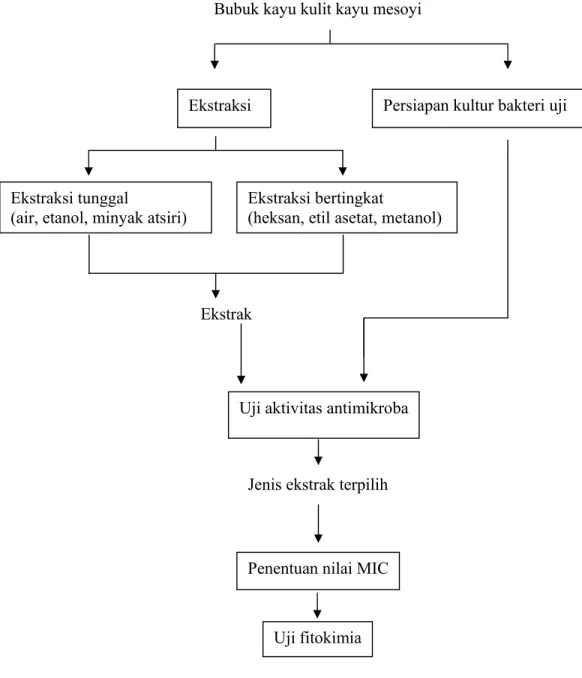
Penelitian dibagi menjadi penelitian pendahuluan dan penelitian lanjutan. Penelitian pendahuluan terdiri dari beberapa tahap, yaitu : (1) persiapan kultur bakteri uji, (2) proses ekstraksi, dan (3) pengujian aktivitas antimikroba dengan uji difusi sumur. Penelitian kemudian dilanjutkan dengan beberapa tahap, yaitu : (1) penentuan MIC dan (2) uji fitokimia (Gambar 5).
Bubuk kayu kulit kayu mesoyi
Jenis ekstrak terpilih
Gambar 5. Diagram alir penelitian Ekstraksi tunggal
(air, etanol, minyak atsiri)
Ekstraksi bertingkat
(heksan, etil asetat, metanol)
Ekstraksi Persiapan kultur bakteri uji
Uji aktivitas antimikroba
Penentuan nilai MIC
Uji fitokimia Ekstrak
1. Penelitian Pendahuluan a. Persiapan kultur bakteri uji
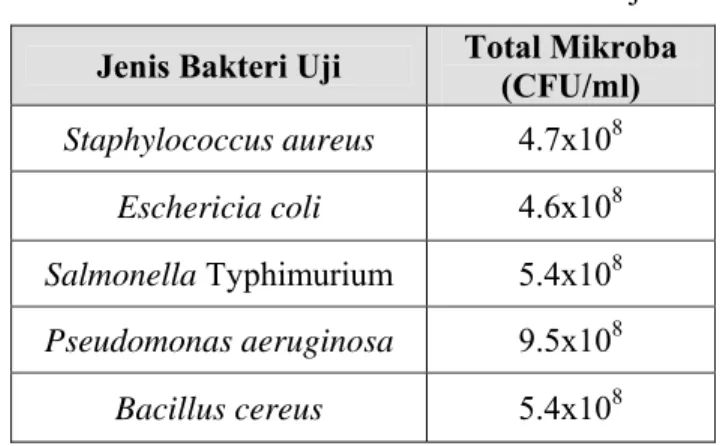
Pada tahap persiapan kultur bakteri uji dilakukan perhitungan total mikroba menggunakan metode hitungan cawan. Persiapan kultur ini perlu dilakukan untuk mengetahui jumlah total mikroba sehingga dapat dihitung pengenceran yang diperlukan agar saat kultur digunakan pada uji difusi sumur total mikroba pada cawan adalah 1x105 hingga 1x106 dan jumlah ini stabil di setiap cawan.
Kultur murni yang berupa padatan diambil satu ose, kemudian dilarutkan secara aseptis dalam media pertumbuhan NB 10 ml. Media NB yang telah berisi mikroba kemudian diinkubasi pada suhu ruang (37°C) selama 24 jam. Setelah itu, dari NB 10 ml diambil 1 ml dan dimasukkan kedalam NB 9 ml, kemudian diinkubasi pada suhu 37°C selama 24 jam. Bila pada NB 9 ml cairannya berwarna keruh maka diambil 1 ml dari NB 9 ml dan diencerkan pada pengencer (larutan fisiologis 0.85%) sampai pengenceran ke-8. Pada pengenceran ke-5 sampai dengan ke-8, diambil 1 ml dan dimasukkan kedalam cawan petri steril. Kemudian diberi media pertumbuhan agar dengan metode tuang (pour plate). Cawan kemudian diinkubasi pada suhu 37°C selama 48 jam.
Bila pada NB 9 ml cairannya berwarna bening maka diambil 1 ml dari NB 9 ml dan diencerkan pada larutan pengencer (larutan fisiologis 0.85%) sampai pengenceran ke-5. Pada pengenceran ke-0 sampai dengan ke-5, diambil 1 ml dan dimasukkan kedalam cawan petri steril. Kemudian diberi media pertumbuhan agar dengan metode tuang (pour
plate). Cawan kemudian diinkubasi pada suhu 37°C selama 48 jam.
Diagram alir persiapan kultur menggunakan metode hitungan cawan dapat dilihat pada Gambar 6.
Setelah dilakukan tahapan persiapan kultur dan telah didapat jumlah total mikroba, maka selanjutnya dihitung pengenceran yang
Kultur Bakteri
Diambil satu ose
Dimasukkan ke dalam 10 ml NB steril Diinkubasi 24 jam pada suhu 37 ºC
Diambil 1 ml
Dimasukkan ke dalam 9 ml NB steril Diinkubasi 24 jam pada suhu 37 ºC
Diamati kekeruhannya
Keruh Agak bening Dipipetl 1 ml Dipipet 1 ml Dimasukkan ke dalam Dimasukkan ke dalam 9 ml pengencer steril 9 ml pengencer steril Dilakukan pengenceran dari 101-108 Dilakukan pengenceran dari 100-105 Dipipet masing-masing 1ml Dipipet masing-masing 1 ml dari pengenceran 105-108 dari pengenceran 100-105 Masing-masing dimasukkan Masing-masing dimasukkan ke dalam cawan petri steril ke dalam cawan petri steril
Kedalam cawan petri dituang agar Didiamkan hingga agar membeku
Diinkubasi 48 jam pada 37 ºC Diamati dan dihitung total mikroba
Ditentukan jumlah µl NB yang akan dimasukkan ke dalam 25 ml NA cair ( A )
b. Proses ekstraksi
Ekstraksi tunggal dilakukan dengan mengekstrak secara langsung bubuk kulit kayu mesoyi. Tujuan dari ekstraksi tunggal adalah mendapatkan ekstrak kulit kayu mesoyi yang dekat dengan aplikasi sehari-hari, dengan menggunakan pelarut yang aman dan mudah didapat (air dan etanol teknis). Selain itu, penyulingan minyak atsiri juga merupakan ekstraksi tunggal. Minyak atsiri diperoleh dengan teknik destilasi uap, sedangkan ekstrak etanol dan air diperoleh dengan teknik ekstraksi refluks.
Pada ekstraksi tunggal bubuk kulit kayu mesoyi dilakukan ekstraksi langsung dengan etanol teknis dan juga aquades sebagai pelarut. Perbandingan antara pelarut dengan bahan adalah 3:1 (v/w). Suhu refluks harus dibawah titik didih pelarut yang digunakan. Karenanya ekstraksi dengan pelarut etanol teknis berlangsung pada suhu 60°C, sedangkan ekstraksi dengan aquades berlangsung pada suhu 100°C.
Proses ekstraksi bahan secara refluks dicoba selama 5 jam secara langsung dan 5 jam dengan pengulangan ekstraksi. Ekstraksi bahan selama 5 jam dengan pengulangan dilakukan dengan mengekstraksi bahan selama 3 jam yang kemudian diekstraksi kembali selama 2 jam. Ekstrak hasil refluks selama 5 jam secara langsung ternyata memiliki karakteristik yang lebih tidak baik dibandingkan dengan ekstrak hasil proses refluks selama 3 jam yang kemudian direfluks kembali selama 2 jam. Karakteristik yang tidak baik tersebut antara lain tidak adanya bau khas mesoyi dan rendemen yang lebih sedikit. Karenanya untuk selanjutnya, baik pada ekstraksi tunggal ataupun ekstraksi bertingkat, ekstraksi refluks dilakukan selama 3 jam dan cairan disaring dengan kertas saring Whatman No.1 kemudian diekstraksi kembali selama 2 jam dengan menambahkan pelarut dengan jumlah yang sama.
Cairan ekstrak yang didapat kemudian disaring dengan kertas saring Whatman No.1 menggunakan penyaring vakum. Proses ekstraksi
tunggal ini menghasilkan ekstrak air dan ekstrak etanol. Diagram alir proses ekstraksi tunggal menggunakan etanol dan air dapat dilihat pada Gambar 7.
Dipekatkan dengan rotavapor
pada suhu 40 oC Dipekatkan dengan rotavapor
pada suhu 50 oC
Dihembuskan gas N2
Gambar 7. Skema ekstraksi tunggal dengan pelarut etanol dan air
Kulit kayu mesoyi didestilasi uap untuk mendapatkan minyak atsiri. Dari minyak atsiri diperoleh komponen volatil kulit kayu mesoyi. Ampas kulit kayu mesoyi hasil penyulingan uap minyak atsiri tentu masih mengandung komponen-komponen yang bersifat non-volatil, karena itulah diekstraksi lanjut secara bertingkat menggunakan pelarut organik dengan rasio antara pelarut dan bahan adalah 3:1 (v/w). Tujuan Direfluks dengan etanol (60 oC, 3 jam)
Direfluks dengan air (100 oC, 3 jam)
Ampas Filtrat
Bubuk Kulit Kayu Mesoyi
Ampas Filtrat Ulangan (60°C, 2 jam) Ekstrak etanol Ekstrak air Ulangan (60°C, 3 jam)
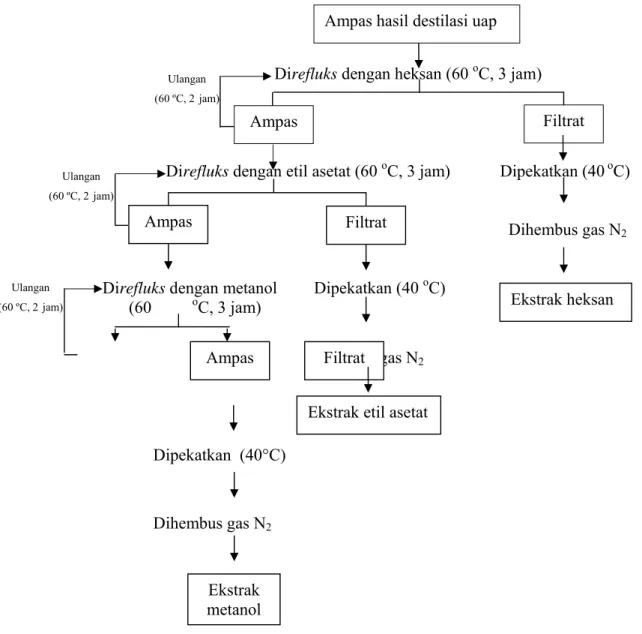
ekstraksi bertingkat adalah fraksinasi dan mengisolasi komponen aktif. Setelah dikeringkan dengan oven vakum selama 24 jam pada suhu kamar (35-40°C), ampas kulit kayu mesoyi kemudian diekstraksi dengan pelarut heksan.
Setelah heksan yang merupakan pelarut non polar kemudian dilanjutkan proses ekstraksi secara bertingkat dengan pelarut yang lebih tinggi kepolarannya, yaitu etil asetat (semi polar) dan metanol (polar). Suhu yang digunakan pada proses ekstraksi bertingkat adalah 60°C.
Pada ekstraksi bertingkat dilakukan proses pengulangan refluks selama 3 jam kemudian diekstraksi kembali dengan pelarut yang sama selama 2 jam. Cairan ekstrak yang didapat disaring dengan kertas saring Whatman No.1 menggunakan penyaring vakum. Setiap penggantian pelarut ampas dikeringkan dengan oven vakum selama 24 jam pada suhu kamar (35-40°C). Diagram alir ekstraksi bertingkat dapat dilihat pada Gambar 8. Pada proses ekstraksi bertingkat ini diperoleh ekstrak heksan, ekstrak etil asetat, dan ekstrak metanol.
Jenis-jenis ekstrak kulit kayu mesoyi yang didapat, kecuali minyak atsiri, kemudian dipekatkan menggunakan rotavapor. Ekstrak air dirotavapor pada suhu 50oC, sedang ekstrak etanol, ekstrak heksan, ekstrak etil asetat, dan ekstrak metanol dirotavapor pada suhu 40°C. Suhu ini dipilih sehingga diharapkan senyawa aktif yang terkandung dalam ekstrak tidak akan rusak.
Ekstrak kemudian dihembus dengan gas N2 sebelum disimpan. Penghembusan ekstrak dengan gas N2 dilakukan terhadap seluruh ekstrak etanol, ekstrak heksan, ekstrak etil asetat, dan ekstrak metanol. Botol ekstrak yang telah seluruhnya diganti kandungan udaranya dari O2 menjadi N2 akan menjadi dingin. Selain itu, ciri-ciri lainnya adalah berat ekstrak yang terus berkurang, yang berarti pelarut telah dihilangkan oleh hembusan N2. Penghembusan gas N2 dihentikan bila botol ekstrak tidak menjadi lebih lebih dingin lagi dan berat ekstrak sudah stabil. Berat ekstrak yang stabil adalah bila berat sudah tidak berubah, atau paling tidak perubahannya tidak lebih dari 0,1 gr.
Ulangan (60 ºC, 2jam) Ulangan (60 ºC, 2jam) Ulangan (60 ºC, 2jam)
Khusus untuk ekstrak air kulit kayu mesoyi dilakukan analisis kadar air ekstrak, karena air tidak dapat dihilangkan secara sempurna oleh rotavapor. Pengukuran kadar air ekstrak air kulit kayu mesoyi dilakukan dengan metode azeotropik.
Direfluks dengan heksan (60 oC, 3 jam)
`
Direfluks dengan etil asetat (60 oC, 3 jam) Dipekatkan (40 oC)
Dihembus gas N2
Direfluks dengan metanol Dipekatkan (40 oC) (60 oC, 3 jam) Dihembus gas N2 Dipekatkan (40°C) Dihembus gas N2
Gambar 8. Diagram alir proses ekstraksi bertingkat dari ampas kulit kayu mesoyi
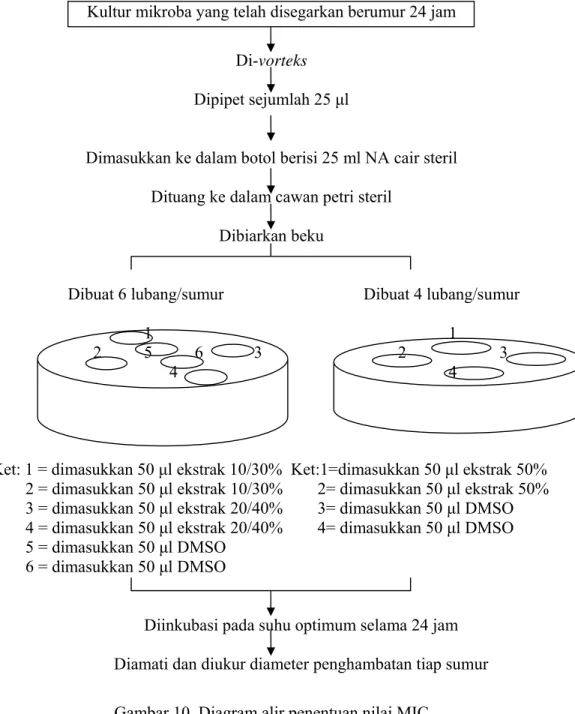
c. Uji Difusi Sumur
Pengujian aktivitas antimikroba awal ekstrak-ekstrak kulit kayu mesoyi dilakukan dengan uji difusi sumur. Uji difusi sumur merupakan
Ampas Filtrat
Ampas Filtrat
Ampas Filtrat
Ekstrak metanol
Ampas hasil destilasi uap
Ekstrak heksan