SKRIPSI
SENYAWA ANTRAKUINON HASIL ISOLASI DARI UMBI BAWANG SABRANG
(Eleutherine palmifolia (L.) Merr)
OLEH:
DAMERIA BR SINGARIMBUN NIM : 081524065
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
SENYAWA ANTRAKUINON HASIL ISOLASI
DARI UMBI BAWANG SABRANG (Eleutherine palmifolia (L.) Merr) OLEH :
DAMERIA BR SINGARIMBUN NIM 081524065
Dipertahankan di Hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: Pebruari 2011
Disetujui Oleh:
Pembimbing I, Panitia Penguji
(Prof.Dr.Siti Morin Sinaga, M.Sc.,Apt.) (Prof.Dr. Jansen Silalahi,M.AppSc.,Apt.) NIP 195008281976032002 NIP 195006071979031001
Pembimbing II, (Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.) NIP 195008281976032002
(Dr. Marline Nainggolan, M.S., Apt.) (Dra. Suwarti Aris. M.Si., Apt.)
NIP 195709091985112001 NIP 195107131982032001
(Drs. Suryadi Achmad, M.Sc., Apt.) NIP 195109081985031002
Dekan,
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan kepada Tuhan Yang Maha
Pengasih atas berkat dan kasih karuniaNya yang melimpah, sehingga penulis
dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul:
SENYAWA ANTRAKUINON HASIL ISOLASI DARI UMBI BAWANG SABRANG (Eleutherine palmifolia (L.) Merr).
Penulis mempersembahkan rasa terima kasih yang tak terhingga kepada
Ayahanda D. Singarimbun, SH dan Ibunda M. Ginting yang selalu memberikan
cinta dan kasih sayang yang tidak dapat tergantikan dengan apapun, doa yang
tulus, serta dukungan baik materi maupun motivasi yang tidak terkira, juga
kepada kakak dan abgku tersayang D. Singarimbun, Amk dan D. Singarimbun,
SSTP, serta segenap keluarga besar atas kasih sayang, doa dan semangat. Semoga
Tuhan Yang Maha Pengasih selalu melimpahkan berkat dan kasih karuniaNya
kepada kita semua.
Penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada
Ibu Prof. Dr. Siti Morin Sinaga, M. Sc., Apt. dan Ibu Dr. Marline Nainggolan,
M.S., Apt., selaku dosen pembimbing yang dengan sabar telah memberikan
waktu, bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan
Dengan segala kerendahan hati penulis tidak lupa menyampaikan terima
kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara.
2. Ibu Dr. Julia Reveny, M.Si., Apt., selaku penasihat akademik serta
seluruh Staf Pengajar Fakultas Farmasi USU yang telah banyak
membimbing dan mendidik penulis selama masa perkuliahan hingga
selesai.
3. Bapak Prof. Dr. Jansen Silalahi, M.AppSc.Apt., Ibu Suwarti Aris,
M.Si., Apt., dan Bapak Drs. Suryadi Achmad, M.Sc., Apt., selaku
dosen penguji yang telah memberikan arahan, kritik dan saran dalam
penyelesaian skripsi ini.
4. Ibu Dr. Marline Nainggolan, M.S., Apt., selaku Kepala Laboratorium
Fitokimia yang telah memberi petunjuk dan membantu selama
melakukan penelitian.
5. Teman-teman seperjuangan, Putri siti, kk vika, kk siska, vika, Gabe,
Rosfi dan semua teman-teman Ekstensi Farmasi 2008, teman-teman di
Laboratorium Fitokimia dan Laboratorium Penelitian Farmasi, Kakak,
Abang dan Adik-adik Farmasi serta semua pihak yang tidak dapat
disebutkan satu persatu yang telah banyak membantu selama masa
perkuliahan, penelitian hingga selesainya penulisan skripsi ini.
Semoga Tuhan Yang Maha Pengasih selalu melindungi dan memberikan
berkat dan kasih karuniaNya yang melimpah kepada semua pihak yang telah
Akhir kata, penulis menyadari bahwa tulisan ini masih belum sempurna.
Untuk itu penulis mengharapkan kritik dan saran yang membangun. Semoga
skripsi ini dapat memberikan sumbangan yang berarti bagi ilmu pengetahuan
khususnya bidang Farmasi.
Medan, Pebruari 2011
Penulis,
(Dameria Br. Singarimbun)
Abstrak
Abstract
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ...iv
ABSTRAK ...vii
ABSTRACT ………viii
DAFTAR ISI ...ix
DAFTAR TABEL ………...xiv
DAFTAR GAMBAR ...xv
DAFTAR LAMPIRAN ...xvi
BAB I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II. TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan ...4
2.1.1 Habitat ...4
2.1.2 Morfologi Tumbuhan ...4
2.1.3 Sistematika Tumbuhan ...5
2.1.4 Nama Daerah ...5
2.1.6 Khasiat ...5
2.2 Antrakuinon ...6
2.3 Ekstraksi ...8
2.4 Kromatografi ...10
2.4.1 Kromatogrfi Lapis Tipis (KLT) ...11
2.4.2 Kromatografi Lapis Tipis Preparatif (KLTP) ...13
2.5 Spektroskopi ...14
2.5.1 Spektrofotometri Ultraviolet/Visibel ...14
2.5.2 Spektrofotometri Inframerah ...15
BAB III. METODOLOGI PENELITIAN 3.1 Alat dan Bahan ... 19
3.1.1 Alat-alat ... 19
3.1.2 Bahan-bahan ... 19
3.2 Pengambilan dan Pengolahan Sampel ... 20
3.2.1 Pengambilan Sampel ... 20
3.2.2 Identifikasi Tumbuhan ... 20
3.2.3 Pengolahan Sampel ... 20
3.3 Pembuatan Larutan Pereaksi ... 20
3.3.1 Pereaksi Asam Klorida 2 N ... 20
3.3.2 Pereaksi Natrium Hidroksida 2 N ... 20
3.3.3 Pereaksi Besi (III) Klorida 1% ... 21
3.3.4 Pereaksi Bouchardat ... 21
3.3.5 Pereaksi Dragendorff ... 21
3.3.7 Pereaksi Molish ... 21
3.3.8 Pereaksi Timbal (II) Asetat 0,4 N ... 22
3.3.9 Pereaksi Liebermann-Burchard ... 22
3.3.10 Pereaksi Kalium Hidroksida 10% ... 22
3.4 Pemeriksaan Makroskopik Umbi Bawang Sabrang ... 22
3.5 Pemeriksaan Karakteristik Simplisia ... 22
3.5.1 Pemeriksaan Makroskopik ... 22
3.5.2 Penetapan Kadar Air ... 22
3.5.3 Penetapan Kadar Sari Larut dalam Air ... 23
3.5.4 Penetapan Kadar Sari Larut dalam Etanol ... 24
3.5.5 Penetapan Kadar Abu Total ... 24
3.5.6 Penetapan Kadar Abu Tidak Larut dalam Asam ... 24
3.6 Skrining Fitokimia ...25
3.6.1 Pemeriksaan Alkaloid ... 25
3.6.2 Pemeriksaan Flavonoid ... 25
3.6.3 Pemeriksaan Glikosida ... 26
3.6.4 Pemeriksaan Saponin ... 27
3.6.5 Pemeriksaan Glikosida Antrakuinon ... 27
3.6.6 Pemeriksaan Glikosida Sianogenik ... 27
3.6.7 Pemeriksaan Tanin ... 27
3.6.8 Pemeriksaan Triterpenoid/Steroid ... 28
3.7 Pembuatan Ekstrak ... 28
3.8 Isolasi Senyawa Antrakuinon dari Ekstrak Etanol ... 28
Tipis (KLT) ...29
3.10 Pembuatan Plat KLT Preparatif ... 30
3.11 Pemisahan Senyawa Antrakuinon dari Fraksi Etilasetat dengan cara KLT Preparatif ... 30
3.12 Pemurnian Kristal Hasil Preparatif ... 31
3.13 Uji Kemurnian Senyawa Antrakuinon Hasil KLT Preparatif ... 31
3.13.1 Pengujian dengan KLT Satu Arah ... 31
3.13.2 Pengujian dengan KLT Dua Arah ... 31
3.14 Karakterisasi Isolat ... 32
3.14.1 Karakterisasi Isolat dengan Spektrofotometri Ultraviolet/Visibel ... 32
3.14.2 Karakterisasi Isolat dengan Spektrofotometri Inframerah .. 32
BAB IV. HASIL DAN PEMBAHASAN ... 34
4.1 Hasil Identifikasi Tumbuhan ...34
4.2 Hasil Pemeriksaan Makroskopik Umbi Bawang sabrang ...34
4.3 Hasil Pemeriksaan Karakteristik Simplisia ...34
4.4 Hasil Ekstraksi dan Isolasi ...37
4.5 Hasil Analisis Fraksi Etilasetat dengan cara KLT ...37
4.6 Hasil Pemisahan Senyawa Antrakuinon dari Fraksi etilasetat dengan cara KLT Preparatif ...38
4.7 Hasil Pengujian dengan KLT Satu Arah dan Dua Arah ...39
BAB V. KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Halaman
Tabel 1. Hasil Karakterisasi Serbuk Simplisia Umbi Bawang Sabrang ...35
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus Struktur Antrakuuinon ...7
Gambar 2. Spektrum Ultraviolet/visibel Isolat A ...43
Gambar 3. Spektrum Inframerah Isolat A ...43
Gambar 4. Spektrum Ultraviolet/visibel Isolat A ...45
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan Bawang Sabrang (Eleutherine
palmifolia (L.) Merr) ...52
Lampiran 2. Gambar Tumbuhan dan Umbi Bawang Sabrang ...53
Lampiran 3. Gambar Simplisia Umbi Bawang Sabrang ...54
Lampiran 4. Perhitungan Kadar Air Serbuk Simplisia Umbi Bawang Sabrang ...55
Lampiran 5. Perhitungan Kadar Sari Larut dalam Air ...56
Lampiran 6. Perhitungan Kadar Sari Larut dalam Etanol ...57
Lampiran 7. Perhitungan Kadar Abu Total ...58
Lampiran 8. Perhitungan Kadar Abu Tidak Larut dalam Asam ...59
Lampiran 9. Kromatogram Hasil KLT Fraksi Etilasetat Umbi Bawang Sabrang Menggunakan Fase gerak Petroleum eter-etilasetat- asam formiat, Petroleum eter-etilasetat-air dan Etilasetat-metanol-air ...60
Lampiran 10. Kromatogram Hasil KLT Fraksi Etilasetat Umbi Bawang Sabrang Menggunakan Fase gerak Benzen-aseton ...62
Lampiran 11. Kromatogram Hasil KLT Fraksi Etilasetat Umbi Bawang Sabrang Menggunakan Fase gerak Kloroform-etilasetat ...64
Lampiran 12. Kromatogram Hasil KLT Fraksi Etilasetat Umbi Bawang Sabrang Menggunakan Fase gerak n.propanol-etilasetat ...66
Abstrak
Abstract
BAB I PENDAHULUAN
1.1 Latar Belakang
Tumbuhan merupakan keragaman hayati yang selalu ada di sekitar kita,
baik itu yang tumbuh secara liar maupun yang sengaja dibudidayakan. Sejak zaman
dahulu, tumbuhan sudah digunakan sebagai tanaman obat, walaupun
penggunaannya disebarkan secara turun-temurun maupun dari mulut ke mulut
(Yuniarti, 2008).
Indonesia kaya akan berbagai keanekaragaman hayati yang berpotensi
untuk dikembangkan sebagai obat atau bahan baku obat (Fajiriah, dkk., 2007).
Ini didukung dengan penelitian ilmiah, tumbuhan secara fungsional tidak lagi
dipandang sebagai bahan konsumsi maupun penghias saja, tetapi juga sebagai
tanaman obat yang multi fungsi. Mengingat biaya pengobatan yang tidak
terjangkau oleh semua orang, pengobatan alamiah dengan tanaman obat
tradisional dipandang sebagai alternatif yang terjangkau dan back to nature.
Bahkan untuk fungsinya sebagai tanaman obat sudah dikomersialkan sebagai
lahan income yang sangat menguntungkan (Yuniarti, 2008).
Kimia bahan alam sangat penting peranannya dalam rangka pemanfaatan
zat-zat kimia yang tersedia di alam, terutama senyawa-senyawa yang aktif secara
farmakologi sangat penting ditinjau dari berbagai segi, misalnya senyawa alam
hayati umumnya memiliki efek samping yang ringan atau hampir tidak ada
Salah satu tumbuhan berkhasiat dan digunakan sebagai obat adalah
umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr) dimana
tumbuhan ini termasuk ke dalam suku Iridaceae. Tumbuhan ini dapat tumbuh
hampir di setiap daerah di Indonesia seperti di Jawa, Sumatera dan Kalimantan.
Bentuk dan warna umbi bawang sabrang mirip dengan bawang merah (Nawawi,
dkk., 2010). Hasil penelitian sebelumnya menunjukkan bahwa tanaman bawang
sabrang memiliki hampir semua kandungan fitokimia yaitu alkaloid, glikosida,
flavonoid, fenolik, steroid dan antrakuinon (Galingging, 2007; Ifesan, et al.,
2009). Senyawa antrakuinon mempunyai beberapa macam fungsi yaitu antiseptik,
antibakteri, antikanker, pencahar (Anonim, 2004; Gunawan, 2004; Samuelsson,
1999).
Berdasarkan hal tersebut diatas, maka peneliti tertarik untuk mengisolasi
senyawa antrakuinon dari umbi bawang sabrang (Eleutherine palmifolia (L.)
Merr). Ekstraksi dilakukan secara maserasi dengan pelarut etanol dan di analisis
dengan kromatografi lapis tipis (KLT), selanjutnya diisolasi dengna KLT
preparatif, isolat yang diperoleh diidentifikasi dengan alat spektrofotometer
1.2Perumusan Masalah
1. Apakah senyawa antrakuinon yang terdapat pada umbi bawang sabrang
(Eleutherine palmifolia (L.) Merr) dapat diisolasi dengan KLT dan KLT
preparatif menggunakan campuran pelarut yang sesuai?
2. Apakah senyawa antrakuinon hasil isolasi dapat diidentifikasi secara
spektrofotometri UV/Vis dan IR?
1.3Hipotesis
1. Senyawa antrakuinon yang terdapat pada umbi bawang sabrang (Eleutherine
palmifolia (L.) Merr) dapat diisolasi dengan KLT dan KLT preparatif
menggunakan campuran pelarut yang sesuai.
2. Senyawa antrakuinon hasil isolasi dapat diidentifikasi secara spektrofotometri
UV/Vis dan IR.
1.4Tujuan Penelitian
1. Memperoleh senyawa antrakuinon dari umbi bawang sabrang (Eleutherine
palmifolia (L.) Merr).
2. Melakukan identifikasi senyawa antrakuinon hasil isolasi dari umbi bawang
sabrang (Eleutherine palmifolia (L.) Merr) secara spektrofotometri UV/Vis
dan IR.
1.5 Manfaat Penelitian
Sebagai informasi tentang senyawa antrakuinon hasil isolasi dari
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan 2.1.1 Habitat
Tanaman berupa terna dan tumbuh pada ketinggian 600 hingga 1500 m di
atas permukaan laut, dan sering di jumpai di pinggir jalan yang berumput, di Jawa
dipelihara sebagai tanaman hias dan tumbuhan ini berasal dari Amerika tropis
(Heyne, 1987).
2.1.2 Morfologi Tumbuhan
Bawang sabrang merupakan terna yang merumpun sangat kuat dengan
tinggi 26 hingga 50 cm. Umbi berada di bawah tanah berbentuk bulat telur
memanjang dan berwarna merah. Bunga berwarna putih, mekar jam lima sore hari
dan jam tujuh menutup kembali. Daun tunggal, letak daun berhadapan, warna
daun hijau muda, bentuk daun sangat panjang dan meruncing (acicular), tepi daun
halus tanpa gerigi (entire), pangkal daun berbentuk runcing (acute) dan ujung
daun meruncing (acuminate) permukaan daun atas dan bawah halus (glabrous),
2.1.3 Sistematika Tumbuhan
Sistematika dari tumbuhan bawang sabrang (Tjitrosoepomo, 2007) adalah
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas
Ordo : Liliales
Famili : Iridaceae
Genus : Eleutherine
Spesies : Eleutherine palmifolia (L.) Merr.
2.1.4 Nama Daerah
Nama daerah dari tumbuhan bawang sabrang adalah bawang dayak,
bawang hantu (Kalimantan Tengah) (Galingging, 2009), bawang kapal
(Sumatera), brambang sabrang, luluwan sapi, teki sabrang, bebawangan beureum,
bawang siem (Jawa) ( Depkes, 1985).
2.1.5 Kandungan Kimia
Bawang sabrang mengandung senyawa-senyawa yang meliputi alkaloid,
glikosida, flavonoid, fenolik, triterpenoid/steroid dan antrakuinon (Galingging,
2009; Ifesan, et al., 2009).
2.1.6 Khasiat
Umbi tumbuhan bawang sabrang dapat digunakan sebagai antiemetik,
sembelit, disuria, radang usus, disentri, penyakit kuning, luka, bisul, penyakit
kolesterol, kanker payudara (Galingging, 2009), antimelanogenesis dan sebagai
antioksidan (Arung, et al., 2009). Daunnya dapat diminumkan kepada wanita
nifas (Heyne, 1987).
2.2 Antrakuinon
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar seperti
kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang
berkonjugasi dengan dua ikatan rangkap karbo-karbon. Untuk tujuan identifikasi
kuinon dapat dibagi atas empat kelompok yaitu : benzokuinon, naftokuinon,
antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama biasanya
terhidroksilasi dan bersifat fenol serta mungkin terdapat dalam bentuk gabungan
dengan gula sebagai glikosida atau dalam bentuk kuinol (Harborne, 1987).
Golongan kuinon alam terbesar terdiri atas antrakuinon dan keluarga
tumbuhan yang kaya akan senyawa jenis ini adalah Rubiaceae, Rhamnaceae,
Polygonaceae (Robinson, 1995; Herbert,19..). Antrakuinon juga disebut
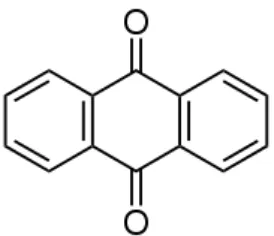
9,10-dioxo-dihydro-anthracen dengan rumus C14H8O2 (Merck, 1983; Samuelsson,
1999; Morrison dan Boyd, 1959). Struktur dasar antrakuinon terlihat sebagai
berikut :
Antrakuinon terhidroksilasi tidak sering terdapat dalam tumbuhan secara
bebas tetapi sebagai glikosida. Semua antrakuinon berupa senyawa kristal bertitik
leleh tinggi, larut dalam pelarut organik basa. Senyawa ini biasa berwarna merah,
tetapi yang lainnya berwarna kuning sampai coklat, larut dalam larutan basa
dengan membentuk warna violet merah.
Bentuk senyawa antrakuinon dalam tumbuhan masih rumit karena prazat
aslinya mudah terurai oleh enzim atau cara ekstraksi yang tidak sesuai, sehingga
laporan mengenai adanya antrakuinon bebas harus dipertimbangkan dengan
hati-hati. Banyak antrakuinon yang terdapat sebagai glikosida dengan bagian gula
terikat dengan salah satu gugus hidroksil fenolik (Robinson, 1995).
Pada saat mengidentifikasi pigmen dari tumbuhan baru, harus diingat
bahwa hanya sedikit saja antrakuinon yang terdapat secara teratur dalam
tumbuhan. Yang paling sering dijumpai ialah emodin, sekurang-kurangnya
terdapat dalam enam suku tumbuhan tinggi dan dalam sejumlah fungus
(Harborne, 1987).
(i). Struktur
Sama halnya dengan sifat glikosida lainnya, glikosida antrakuinon juga
mudah terhidrolisis. Bentuk uraiannya adalah aglikon dihidroksi antrakuinon,
trihidroksi antrakuinon, atau tetrahidroksi antrakuinon. Sementara bagian gulanya
tidak tertentu. Di alam kira-kira telah ditemukan 40 turunan antrakuinon yang
berbeda-beda, 30 macam di antaranya mengelompok dalam famili Rubiaceae.
Pada tanaman monokotil, antrakuinon ditemukan dalam famili Liliaceae dan
dalam bentuk yang tidak lazim, yaitu C-glikosida barbalion.
Turunan antrakuinon yang terdapat dalam bahan-bahan purgativum
berbentuk dihidroksi fenol, trihidroksi fenol seperti emodin, atau tetrahidroksi
fenol seperti asam karminat. Turunan antrakuinon sering kali berwarna merah
oranye.
(Anonim, 2004; Gunawan, 2004; Robinson, 1995; Samuelsson, 1999).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam
golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Diketahuinya senyawa
aktif yang dikandung oleh simplisia akan mempermudah pemilihan pelarut dan
cara ekstraksi yang tepat. Simplisia yang lunak seperti rimpang dan daun mudah
diserap oleh pelarut, karena itu pada proses ekstraksi tidak perlu diserbuk sampai
halus. Simplisia yang keras seperti biji, kulit kayu dan kulit akar susah diserap
oleh pelarut, karena itu perlu diserbuk sampai halus (Ditjen POM, 2000).
Metode ekstraksi menurut Ditjen POM (2000) ada beberapa cara, yaitu:
(i) Maserasi
Maserasi adalah suatu cara penyarian simplisia dengan cara merendam
simplisia tersebut dalam pelarut (Syamsuni, 2006) dengan beberapa kali
pengocokan atau pengadukan pada temperatur kamar, sedangkan remaserasi
adalah pengulangan penambahan pelarut setelah dilakukan penyaringan maserat
pertama dan seterusnya (Ditjen POM, 2000). Keuntungan metode maserasi adalah
(ii) Perkolasi
Perkolasi adalah suatu cara penyarian simplisia menggunakan perkolator
dimana simplisianya terendam dalam pelarut yang selalu baru (Syamsuni, 2006)
dan umumnya dilakukan pada temperatur kamar. Prosesnya terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak) terus-menerus sampai diperoleh ekstrak
(perkolat) (Ditjen POM, 2000).
Keuntungan metode perkolasi adalah proses penarikan zat berkhasiat dari
tumbuhan lebih sempurna, sedangkan kerugiannya adalah membutuhkan waktu
yang lama dan peralatan yang digunakan mahal (Agoes, 2007).
(iii) Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya
dalam jangka waktu tertentu (Ditjen POM, 2000) dimana pelarut akan
terkondensasi menuju pendingin dan kembali ke labu (Mayo, et al., 1955;
Landgrebe, 1982).
(iv) Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet (Ditjen POM,
2000), dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian
jatuh membasahi sampel dan mengisi bagian tengah alat soklet. Tabung sifon juga
terisi dengan larutan ekstraksi dan ketika mencapai bagian atas tabung sifon,
larutan tersebut akan kembali ke dalam labu (Mayo, et al., 1955; Landgrebe,
1982).
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar (Ditjen POM, 2000),
umumnya dilakukan pada suhu 40-60o
(vi) Infundasi
C (Syamsuni, 2006).
Infus adalah ekstraksi dengan pelarut air pada temperatur 90o
(vii) Dekoktasi
C selama
15-20 menit (Ditjen POM, 15-2000; Syamsuni, 15-2006; Anief, 15-2000).
Dekok adalah ekstraksi pada suhu 90oC- 98o
senyawa antrakuinon umumnya di ekstraksi dengan cara refluk
menggunakan pelarut metanol, kemudian dipekatkan dengan evaporator sampai
diperoleh ekstrak pekat metanol (Nawawi, dkk., 2010) cara lain ekstraksi senyawa
antrakuinon dapat dilakukan dengan metode maserasi pada suhu kamar selama 24
jam menggunakan pelarut aseton (Kristanti, dkk., 2006).
C menggunakan pelarut air
selama 30 menit (Ditjen POM, 2000; Agoes, 2007).
2.4Kromatografi
Kromatografi pertama kali dikembangkan oleh ahli botani Rusia pada
tahun 1903 yang bernama Michael Tswett untuk memisahkan pigmen warna
dalam tanaman. Saat ini kromatografi merupakan teknik pemisahan yang paling
umum dan paling sering digunakan dalam bidang kimia analisis dan dapat
dimanfaatkan untuk melakukan analisis, baik analisis kualitatif, analisis kuantif,
atau preparatif dalam bidang farmasi, industry dan lain sebagainya. Kromatografi
merupakan suatu teknik pemisahan yang menggunakan fase diam (stationary
phase) dan fase gerak (mobile phase) (Rohman dan Gandjar, 2007).
Kromatografi lapis tipis (KLT) pada umumnya disebut sebagai
kromatografi planar. Pada kromatografi lapis tipis (KLT), fase diamnya berupa
lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh
lempeng kaca, pelat aluminium, atau plat plastik. Kromatografi lapis tipis dalam
pelaksanaannya lebih mudah dan lebih murah. Demikian juga peralatan yang
digunakan (Rohman, 2007).
Kromatografi lapis tipis merupakan kromatografi serapan dimana fase
diam berupa zat padat yang disebut adsorben (penjerap) dan fase gerak berupa zat
cair yang disebut larutan pengembang (Gritter, et al., 1991). Empat macam
adsorben yang umum dipakai adalah silika gel (asam silikat), alumina (aluminium
oxyde), kieselguhr (diatomeous earth), dan selulosa (Adnan, 1997).
Fase gerak adalah medium angkut, terdiri dari satu atau beberapa pelarut,
yang bergerak di dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya
kapiler (Stahl, 1985). Pemilihan sistem pelarut yang dipakai didasarkan atas
prinsip like dissolves like, artinya untuk memisahkan sampel yang bersifat
nonpolar digunakan sistem pelarut yang bersifat nonpolar juga. Proses
pengembangan akan lebih baik bila ruangan pengembangan tersebut telah jenuh
dengan uap sistem pelarut (Adnan, 1997). Pelarut dalam ruangan pengembang
dihindarkan dari atmosfer luar untuk menghindari penguapan
komponen-komponen (Sastrohamidjojo, 1985) dan campuran pelarut dianjurkan hanya
dipakai untuk sekali pengembangan saja karena susunannya mudah berubah
akibat salah satu komponennya menguap (Gritter, et al., 1991).
Harga dihitung dengan menggunakan perbandingan sebagaimana
Harga maksimum adalah 1, sampel bermigrasi dengan kecepatan sama dengan
fase gerak. Harga minimum adalah 0, dan ini teramati jika sampel tertahan
pada posisi titik awal di permukaan fase diam (Rohman, 2007).
Faktor-faktor yang mempengaruhi harga Rf pada KLT (Sastrohamidjojo,
1985), antara lain:
1. Struktur kimia dari senyawa yang dipisahkan
2. Sifat dari penyerap dan derajat aktivitasnya
3. Tebal dan kerataan lapisan penyerap
4. Derajat kemurnian fase gerak
5. Derajat kejenuhan uap pengembang pada bejana
6. Jumlah cuplikan
7. Suhu.
Pada umumnya senyawa antrakuinon dipantau dengan kromatografi lapis
tipis (KLT), dilanjutkan dengan kromatografi cair vakum kemudian dilanjutkan
dengan kromatografi kolom menggunakan eluen yang sesuai atau dipisahkan
menggunakan berbagai teknik kromatogarafi dengan berbagai perbandingan
campuran eluen (Nawawi, dkk., 2010; Kristanti, dkk., 2006). Dimana fase diam
yang sering digunakan yaitu plat pra lapis silika gel GF254 dan silika gel GF254,
fase gerak yang sering digunakan untuk senyawa antrakuinon adalah petroleum
etilasetat-metanol-air (100:17:13), toluen-etil formiat-asam formiat (50:40:10) dan
sebagai penampak bercak kalium hidroksida (KOH) 10% (Wagner, et al., 1984).
2.4.2 Kromatografi Lapis Tipis Preparatif (KLTP)
Salah satu metode pemisahan yang memerlukan pembiayaan paling murah
dan memakai peralatan paling dasar ialah kromatografi lapis tipis preparatif
(KLTP). Walaupun KLTP dapat memisahkan bahan alam dalam jumlah gram,
sebagian besar pemakaian hanya dalam jumlah milligram. Ukuran pelat biasanya
20 x 20 cm atau 20 x 40 cm. Pelat KLTP dapat dibuat sendiri atau dibeli dengan
sudah terlapisi penjerap (biasanya disebut pelat siap pakai atau pelat pra lapis)
Pada KLTP, cuplikan yang akan dipisahkan ditotolkan berupa pita dengan tidak
merusak lapisan penjerap. Sebelum dikembangkan, zat pelarut yang dipakai
dalam sampel harus diuapkan dahulu. Pengembangan dikerjakan seperti dalam
KLT yang lain.
Kebanyakan penjerap KLTP mengandung indikator fluoresensi yang
membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang
dipisahkan menyerap sinar UV. Untuk senyawa yang tidak menyerap sinar UV,
pita dapat ditampakkan dengan menutup plat dengan sepotong kaca menyemprot
dengan salah satu sisi dengan pereaksi semprot atau dengan cara lain dengan
menambahkan senyawa pembanding. Pita yang kedudukannya telah diketahui
dikerok dari plat kemudian dilarutkan dengan pelarut polar (sekitar 5 ml pelarut
untuk 1 g penjerap) (Hostettmann, dkk., 1995; Adnan, 1997).
Spekstroskopi adalah studi mengenai interaksi cahaya dengan atom dan
molekul. Radiasi cahaya dan elektromagnetik dapat dianggap menyerupai
gelombang (Creswell, et al., 2005).
2.5.1 Spektrofotometri Ultraviolet/Visibel
Radiasi elektromagnetik sinar ultra lembayung dan sinar tampak
merupakan energi yang merambat dalam bentuk gelombang. Radiasi pada rentang
panjang gelombang 200-800 nm dilewatkan pada suatu larutan senyawa, maka
elektron-elektron pada ikatan di dalam molekul tereksitasi sehingga menempati
keadaan yang lebih tinggi dan pada proses tersebut sejumlah energi akan diserap
oleh molekul di dalam larutan tersebut (Rohman dan Gandjar, 2007; Watson,
2009).
Jika lebih banyak ikatan rangkap dalam struktur terkonjugasi, maka
serapan terjadi pada panjang gelombang yang lebih besar dan dengan intensitas
yang lebih besar. Sistem ikatan rangkap yang diperpanjang tersebut dikenal
sebagai kromofor (Watson, 2009).
Beberapa istilah dalam spektrofotometri ultraviolet menurut Noerdin
(1985) dan Silverstein, et al. (1981) antara lain :
1. Khromofor didefinisikan sebagai gugus fungsi yang menyerap radiasi di
daerah ultraviolet dekat dan daerah tampak, contoh : C=C, C≡C, C=O, NO2.
2. Auksokrom didefinisikan sebagai gugus fungsi yang mempunyai elektron
tidak berpasangan, tidak menyerap radiasi pada panjang gelombang lebih
besar dari 200 nm, dan bila terikat dengan gugus khromofor akan mengubah
3. Efek batokromik (pergeseran merah) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih panjang akibat terikat dengan gugus
khromofor atau efek pelarut.
4. Efek hipsokromik (pergeseran biru) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih pendek akibat terikat dengan gugus khromofor
atau efek pelarut.
5. Efek hiperkromik adalah peningkatan intensitas penyerapan.
6. Efek hipokromik adalah penurunan intensitas penyerapan.
Pada umumnya spektrum ultraviolet/visibel senyawa antrakuinon terjadi
pada serapan 224, 246 dan 394 nm atau 206, 282 dan 448 nm (Nawawi, dkk.,
2010; Kristanti, dkk., 2006).
2.5.2 Spektrofotometri Inframerah
Spektrofotometri inframerah merupakan teknik spektrofotometri tercepat
dan termurah yang digunakan dalam kimia organik. Sampel dapat berupa padatan,
cairan atau gas, dan dapat diukur dalam larutan dengan KBr atau minyak mineral.
Kemudian spektrum dapat diperoleh hanya dalam beberapa menit dari material
murni parsial dengan tujuan memberikan indikasi bahwa reaksi yang terjadi
seperti yang diinginkan. (Cooper, 1980).
Identifikasi senyawa yang tidak diketahui gugus fungsinya dapat diuji
struktur inframerahnya, kemudian dideteksi menggunakan data korelasi
(Sastrohamidjojo, 1991). Menurut Pavia, et al., (1988), langkah-langkah umum
untuk memeriksa pita serapan adalah sebagai berikut:
Gugus C=O memberikan puncak pada daerah 1820-1660 cm-1
2. Jika gugus C=O ada, periksa gugus-gugus berikut. Jika tidak ada, langsung ke
nomor 3.
. Puncak ini
biasanya merupakan yang terkuat dengan lebar medium dalam spektrum.
a. Asam : Apakah ada O-H ? Serapan lebar di daerah 3300-2500 cm-1
b. Amida : Apakah ada N-H? Serapan medium di dekat 3500 cm
.
Biasanya tumpang tindih dengan C-H.
-1
c. Ester : Apakah ada C-O? Serapan medium di daerah 1300-1000 cm
,
kadang-kadang dengan puncak rangkap.
-1
d. Anhidrida: Mempunyai dua serapan C=O di daerah 1810 dan 1760 cm .
-1
e. Aldehida : Apakah ada C-H aldehid? Dua serapan lemah di daerah
2850-2750 cm
.
-1
f. Keton : Jika kelima kemungkinan di atas tidak ada. yaitu di sebelah kanan serapan C-H.
3. Bila gugus C=O tidak ada.
a. Alkohol/fenol: Periksa gugus O-H, merupakan serapan lebar di daerah
3600-3300 cm-1 yang diperkuat adanya serapan C-O di daerah 1300-1000
cm-1
b. Amina : Periksa gugus N-H, yaitu serapan medium di daerah 3500 cm .
-1
c. Eter : Periksa gugus C-O (serapan O-H tidak ada), yaitu serapan medium
di daerah 1300-1000 cm
.
-1
4. Ikatan rangkap dua dan/atau cincin aromatik. .
a. C=C mempunyai serapan lemah di daerah 1650 cm-1
b. Serapan medium sampai kuat pada daerah 1650-1450 cm .
-1
sering
c. Buktikan kemungkinan di atas dengan memperhatikan serapan pada
daerah C-H aromatik di sebelah kiri 3000 cm-1
5. Ikatan rangkap tiga.
, sedangkan C-H alifatis
terjadi di sebelah kanan daerah tersebut.
a. C≡N mempunyai serapan medium dan tajam di daerah 2250 cm-1
b. C≡C mempunyai serapan lemah tapi tajam di daerah 2150 cm .
-1
. Periksa
juga CH asetilenik di dekat 3300 cm-1
6. Gugus nitro.
.
Dua serapan kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1
7. Hidrokarbon.
.
a. Apabila keenam kemungkinan di atas tidak ada.
b. Serapan utama di daerah C-H dekat 3000 cm-1
c. Spektrum sangat sederhana, hanya terdapat serapan lain di daerah
1450-1375 cm
.
-1
Spektrum inframerah untuk zat hasil pemurnian menunjukkan adanya
gugus-gugus fungsi yaitu terlihat pada posisi (cm .
-1
) : 3427,51, 2927,94-2858,51,
736,81-1000, yang memiliki gugus fungsi OH, C-H alifatik, gugus aromatic dan
alkena, isolate di duga senyawa kuinon (Nawawi, dkk., 2010) dan spektra pada
spektrofotometer inframerah yang terjadi pada serapan (cm-1) 3445,18
menunjukkan adanya gugus OH; 2924,35 dan 2852,98 menunjukkan adanya
gugus CHsp3 (alkena); 1697,51 menunjukkan adanya gugus C=O; 1628,07
menunjukkan adanya gugus α-OH; 1452,53 menunjukkan adanya gugus C-C;
1265,42 dan 1190,19 menunjukkan adanya gugus C-O; 898,91 dan 748,45
spektrofotometri inframerah terseebut di simpulkan bahwa zat hasil pemurnian
BAB III
METODOLOGI PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah blender (Philips),
neraca listrik (Vibra AJ), neraca kasar, eksikator, oven listrik, penangas air
(Yenaco), rotary evaporator (Haake D1), lampu UV 366 nm (Diamond),
seperangkat alat penetapan kadar air, seperangkat alat kromatografi lapis tipis,
alat-alat gelas laboratorium, spektrofotometer ultraviolet/visibel (Shimadzu) dan
spektrofotometer inframerah (Shimadzu).
3.1.2 Bahan-bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah umbi dari
tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr). Bahan kimia yang
digunakan kecuali dinyatakan lain adalah berkualitas pro analisa, yaitu : alfa
naftol, asam asetat anhidrida, asam klorida pekat, asam nitrat pekat, asam sulfat
pekat, aseton, benzen, besi (III) klorida, bismuth (III) nitrat, etanol, eter minyak
tanah, etilasetat, iodium, isopropanol, kalium hidroksida, kalium iodida,
kloroform, metanol, natrium hidroksida, natrium sulfat anhidrat, n-heksan, raksa
(II) klorida, serbuk magnesium, serbuk zinkum, timbal (II) asetat, toluen. Plat pra
3.2 Pengambilan dan Pengolahan Sampel
3.2.1 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan serupa dari daerah lain. Sampel yang
digunakan umbi tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr)
yang diambil dari jalan Bunga Rampai V, Kelurahan Simalingkar B, Kecamatan
Medan Tuntungan, Kotamadya Medan, Provinsi Sumatera Utara.
3.2.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian dan Pengembangan
Biologi, LIPI, Bogor.
3.2.3 Pengolahan Sampel
Umbi bawang sabrang yang segar dibersihkan dari kotoran dengan cara
mencuci di bawah air mengalir hingga bersih, ditiriskan, kemudian ditimbang,
selanjutnya dirajang tipis dan dikeringkan. Sampel dianggap kering bila sudah
rapuh (diremas menjadi hancur), selanjutnya ditimbang dan diserbuk dengan
menggunakan blender.
3.3 Pembuatan Larutan Pereaksi
3.3.1 Pereaksi Asam Klorida 2 N
Sebanyak 16,67 ml asam klorida pekat diencerkan dalam air suling hingga
3.3.2 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida ditimbang, kemudian dilarutkan
dalam air suling hingga 100 ml (Depkes, 1979).
3.3.3 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
hingga 100 ml (Depkes, 1989).
3.3.4 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, kemudian sebanyak 2 g iodium dilarutkan dalam larutan kalium
iodida, setelah larut dicukupkan volume dengan air suling hingga 100 ml (Depkes,
1995).
3.3.5 Pereaksi Dragendorff
Sebanyak 0,85 g bismut (III) nitrat dilarutkan dalam 100 ml asam asetat
glasial, lalu ditambahkan 40 ml air suling. Pada wadah lain dilarutkan 8 g kalium
iodida dalam air suling, kemudian campurkan kedua larutan sama banyak, lalu
ditambahkan 20 ml asam asetat glasial dan diencerkan dengan air suling hingga
volume 100 ml (Zweig and Sherma, 1987).
3.3.6 Pereaksi Mayer
Sebanyak 1,569 g raksa (II) klorida ditimbang, kemudian dilarutkan dalam
lalu dilarutkan dalam 10 ml air suling. Kemudian keduanya dicampur dan
ditambahkan air suling hingga 100 ml (Depkes, 1989).
3.3.7 Pereaksi Molish
Sebanyak 3 g alfa naftol ditimbang, kemudian dilarutkan dalam asam
nitrat 0,5 N hingga 100 ml (Depkes, 1979).
3.3.8 Pereaksi Timbal (II) Asetat 0,4 N
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbondioksida hingga 100 ml (Depkes, 1989).
3.3.9 Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrid dicampurkan dengan 1 bagian
asam sulfat pekat (Harborne, 1987).
3.3.10 Pereaksi Kalium Hidroksida 10%
Sebanyak 10 g kalium hidroksida ditimbang, kemudian dilarutkan dalam
etanol hingga 100 ml (Wagner, et al., 1984).
3.4 Pemeriksaan Makroskopik Umbi Bawang Sabrang
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar,
warna, bau, rasa, ukuran dari umbi bawang sabrang (Eleutherine palmifolia (L.)
3.5 Pemeriksaan Karakteristik Simplisia
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
simplisia umbi bawang sabrang (Eleutherine palmifolia (L.) Merr).
3.5.2 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi
toluen). Dimasukkan 200 ml toluen dan 2 ml air suling ke dalam labu alas bulat,
lalu didestilasi selama 2 jam. Setelah itu, toluen dibiarkan mendingin selama 30
menit, dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml.
Kemudian ke dalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah
ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluen
mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian
besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap
detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kandungan air yang terdapat dalam bahan yang diperiksa (World Health
Organization, 1992). Kadar air dihitung dalam persen. Rumus perhitungan kadar
air serbuk simplisia sebagai berikut :
% Kadar air = x100%
sampel berat
awal volume akhir
3.5.3 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama
24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai
1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama
diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan
sisa dipanaskan pada suhu 105o
100% x 20 100 x (g) sampel berat (g) sari berat
C sampai bobot tetap. Kadar dalam persen sari
yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes,
1989). Rumus perhitungan kadar sari larut dalam air serbuk simplisia sebagai
berikut : % Kadar sari larut dalam air =
3.5.4 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama
24 jam dalam 100 ml etanol 95% dalam labu bersumbat sambil dikocok sesekali
selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring
cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa
dipanaskan pada suhu 105o
100% x 20 100 x (g) sampel berat (g) sari berat
C sampai bobot tetap. Kadar dalam persen sari yang
larut dalam etanol 95% dihitung terhadap bahan yang telah dikeringkan (Depkes,
1989). Rumus perhitungan kadar sari larut dalam etanol serbuk simplisia sebagai
3.5.5 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk yang telah dihaluskan dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, lalu diratakan. Krus
dipijarkan pada suhu 600ºC sampai arang habis, kemudian didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang
telah dikeringkan (Depkes, 1989). Rumus perhitungan kadar abu total serbuk
simplisia sebagai berikut : % Kadar abu total = x100% (g)
sampel berat
(g) abu berat
3.5.6 Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan
dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam
asam dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci
dengan air panas. Residu dan kertas saring dipijarkan pada suhu 600ºC sampai
bobot tetap, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu
tidak larut dalam asam dihitung terhadap bahan yang dikeringkan (Depkes, 1989).
Rumus perhitungan kadar abu tidak larut dalam asam serbuk simplisia sebagai
berikut : % Kadar abu tidak larut dalam asam = x100% (g)
sampel berat
(g) abu berat
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan Alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang kemudian ditambahkan 10 ml
asam klorida 0,2 N, dipanaskan di atas penangas air selama 10 menit, didinginkan
reaksi, lalu kedalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung
reaksi : (i). Ditambahkan 2 tetes pereaksi Mayer
(ii). Ditambahkan 2 tetes pereaksi Dragendorff
(iii). Ditambahkan 2 tetes pereaksi Bouchardat
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga percobaan
diatas (Depkes, 1989).
3.6.2 Pemeriksaan Flavonoid
Sebanyak 0,5 g serbuk simplisia ditimbang kemudian ditambahkan 10 ml
metanol, direfluks selama 10 menit, disaring panas-panas melalui kertas saring.
Filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambahkan 5 ml eter
minyak tanah, dikocok hati-hati, lalu diamkan sebentar. Lapisan metanol diambil,
diuapkan pada temperatur 40ºC, sisanya dilarutkan dalam 5 ml etilasetat, disaring.
Filtratnya digunakan untuk uji flavonoid dengan cara berikut:
(i). Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, kemudian ditambah 0,5 g serbuk Zn dan 2 ml asam klorida 2 N,
didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida pekat.
Jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya
flavonoid.
(ii). Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, lalu ditambah 0,1 g serbuk Mg dan 10 tetes asam klorida pekat. Jika
terjadi warna merah jingga sampai warna merah ungu menunjukkan adanya
3.6.3 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia ditimbang kemudian disari dengan 30 ml
campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks
selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml
air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3),
dilakukan berulang sebanyak 3 kali. Pada kumpulan sari ditambahkan natrium
sulfat anhidrat dan diuapkan pada temperatur tidak lebih dari 50٥C. Sisanya
dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut :
(i). 0,1 ml larutan percobaan diuapkan, ditambahkan 5 ml asam asetat anhidrid
dan 10 tetes asam sulfat pekat.
(ii). 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi dan diuapkan
diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish.
Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui
dinding tabung. Terbentuknya cincin berwarna ungu pada batas kedua cairan
menunjukkan glikosida.
(iii). Serbuk sampel direbus dalam air, didinginkan, disaring. Pada filtrat
ditambahkan fehling A dan fehling B (1:1), dipanaskan. Terbentuknya endapan
merah bata menunjukkan adanya gula pereduksi (Depkes, 1989).
3.6.4 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia ditimbang dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok
kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida
2 N menunjukkan adanya saponin (Depkes, 1989).
3.6.5 Pemeriksaan Glikosida Antrakuinon
Serbuk ditimbang sebanyak 0,2 g, ditambahkan 5 ml asam sulfat 2 N,
dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Kocok lapisan benzen
dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan
benzen tidak berwarna menunjukkan adanya antrakuinon (Depkes, 1989).
3.6.6 Pemeriksaan Glikosida Sianogenik
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam erlenmeyer,
dilembabkan dengan air suling. Diselipkan kertas saring yang telah dibasahi
natrium pikrat pada mulut erlenmeyer, ditutup, dibiarkan terkena sinar matahari.
Jika kertas saring memberikan warna merah, menunjukkan adanya sianogenik
glikosida (Depkes, 1989).
3.6.7 Pemeriksaan Tanin
Sebanyak 1 g serbuk simplisia ditimbang, dididihkan selama 3 menit
dalam 100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan
1- 2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau
hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.8 Pemeriksaan Triterpenoid/Steroid
Sebanyak 1 g serbuk simplisia ditimbang, dimaserasi dengan 20 ml
n-heksan selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan pada
atau merah yang berubah menjadi merah ungu atau biru hijau menunjukkan
adanya triterpenoid/steroid (Farnsworth, 1966).
3.7 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
etanol 80% (Farnsworth, 1966). Sebanyak 650 g serbuk kering umbi bawang
sabrang dimaserasi dengan pelarut etanol 80% sampai seluruh serbuk terendam,
ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil sesekali diaduk
(Depkes, 1986). Kemudian disaring sehingga didapat maserat. Ampas dimaserasi
kembali dengan etanol 80% menggunakan prosedur yang sama, maserasi
dilakukan sebanyak 3 kali. Seluruh maserat digabung dan dipekatkan dengan
bantuan alat rotary evaporator pada temperatur tidak lebih dari 40°C sampai
diperoleh ekstrak kental.
3.8 Isolasi Senyawa Antrakuinon dari Ekstrak Etanol
Sebanyak 50 g ekstrak etanol kental ditambah pelarut etanol 80% sampai larut
kemudian difraksinasi dengan pelarut etilasetat, hasilnya diperoleh fraksi etilasetat
dan fraksi air. Kemudian fraksi etilasetat dipekatkan di atas penangas air sehingga
diperoleh fraksi etilasetat kental. Bagan ekstraksi dan isolasi senyawa antrakuinon
Serbuk simplisia
Ampas Maserat
Ekstrak etanol kental
difraksinasi dengan etilasetat
Fraksi air
Fraksi etilasetat
dipekatkan diatas penangas air Fraksi etilasetat kental
Ampas
dimasukkan ke dalam wadah
ditambahkan etanol 80% sampai serbuk terendam sempurna
dibiarkan selama 5 hari terlindung dari cahaya, sambil sesekali diaduk
disaring
Maserat
dimaserasi kembali dengan pelarut etanol 80%
disaring
3.9Analisis Fraksi Etilasetat dengan cara Kromatografi Lapis Tipis (KLT) Fraksi etilasetat yang diperoleh dianalisis dengan cara KLT menggunakan
plat pra lapis silika gel GF254 dengan berbagai macam fase gerak yaitu petroleum
eter-etilasetat-asam formiat (75:25:1), petroleum eter-etilasetat-air (75:25:1) dan
etilasetat-metanol-air (100:17:13) (Wagner, et al., 1984). Benzen-aseton (9:1, 8:2,
7:3, 6:4, 5:5), kloroform-etilasetat (9:1, 8:2, 7:3, 6:4, 5:5) dan n.propanol-etilasetat
(8:2, 7:3, 5:5, 3:7). Sebagai penampak bercak adalah pereaksi kalium hidroksida
(KOH) 10% dalam etanol. Fraksi etilasetat ditotolkan pada plat pra lapis silika gel
GF254 kemudian dimasukkan ke dalam chamber yang masing-masing telah
dijenuhkan dengan uap fase gerak dan ditutup rapat. Setelah elusi selesai plat
dikeluarkan dari chamber, dikeringkan kemudian plat disemprot dengan
penampak bercak KOH 10%, warna bercak yang terjadi diamati dan dihitung
harga Rf-nya.
3.10 Pembuatan Plat KLT Preparatif
Sebanyak 7 g silika gel GF254 ditambahkan air suling dengan perbandingan
1 : 2 dan dihomogenkan sampai didapat suspensi yang seragam tanpa terjadi
gelembung udara ataupun gumpalan, kemudian suspensi segera dituangkan ke plat
kaca ukuran 20 x 20 cm yang telah dibebaslemakkan dengan pelarut metanol. Plat
yang sudah dilapisi dibiarkan kering kemudian diaktifkan dalam oven pada suhu
3.11 Pemisahan Senyawa Antrakuinon dari Fraksi Etilasetat dengan cara KLT Preparatif
Terhadap fraksi etilasetat dilakukan pemisahan dengan cara KLT
preparatif menggunakan fase diam silika gel GF254, fase gerak benzen : aseton
(8:2) dan penampak bercak KOH 10%. Fraksi etilasetat ditotolkan berupa pita
pada plat KLT preparatif berukuran 20 x 20 cm yang telah di aktifkan, setelah
kering plat dimasukkan ke dalam chamber yang telah jenuh dengan uap fase
gerak, kemudian fase gerak dibiarkan naik sampai batas pengembangan. Setelah
elusi selesai plat dikeluarkan dari chamber lalu dikeringkan, bagian tepi dari plat
disemprot dengan penampak bercak KOH 10%. Bagian plat silika yang sejajar
dengan bercak yang memberikan hasil positif dengan penampak bercak KOH
10%, dikerok kemudian dilarutkan dalam pelarut metanol.
3.12 Pemurnian Kristal Hasil Preparatif
Kristal hasil KLT preparatif dimurnikan dengan cara dicuci berulang-ulang
dengan metanol dingin hingga diperoleh kristal berbentuk jarum.
3.13 Uji Kemurnian Senyawa Antrakuinon Hasil KLT Preparatif
Terhadap isolat yang diperoleh dilakukan uji kemurnian dengan KLT satu
arah dan dua arah menggunakan fase diam plat pra lapis silika gel GF254, fase
3.13.1 Pengujian dengan KLT Satu Arah
Isolat ditotolkan pada plat pra lapis silika gel GF254, setelah kering
dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak. Setelah
fase gerak mencapai batas pengembangan plat dikeluarkan dari chamber, diamati
bercaknya kemudian disemprot dengan penampak bercak KOH 10%. Amati
warna yang terbentuk dan dihitung harga Rf.
3.13.2 Pengujian dengan KLT Dua Arah
Isolat ditotolkan pada plat pra lapis silika gel GF254, lalu dimasukkan ke
dalam chamber yang telah dijenuhkan dengan uap fase gerak I, setelah elusi
selesai, plat dikeluarkan dari chamber dan dikeringkan. Selanjutnya dielusi
kembali dengan fase gerak II dengan arah yang berbeda, plat dikeluarkan,
dikeringkan dan diamati bercaknya kemudian disemprot dengan penampak bercak
KOH 10%. Diamati warna yang terbentuk dan dihitung harga Rf.
3.14 Identifikasi Isolat
3.14.1 Identifikasi Isolat dengan Spektrofotometri Ultraviolet/Visibel
Karakterisasi isolat dilakukan secara spektrofotometri ultraviolet/visibel
dengan melarutkan isolat dalam metanol, kemudian dimasukkan ke dalam kuvet
yang terlebih dahulu dibilas dengan larutan sampel dan diukur panjang gelombang
3.14.2 Identifikasi Isolat dengan Spektrofotometri Inframerah
Karakterisasi isolat secara spektrofotometri inframerah dilakukan dengan
cara mencampurkan isolat dengan kalium bromida hingga homogen kemudian
dimasukkan ke dalam alat spektrofotometer inframerah, lalu diukur absorbansinya
Bagan Isolasi Senyawa Antrakuinon dari Fraksi Etilasetat sebagai berikut :
Di KLT satu arah dan
Kristal
Isolat murni
dikarakterisasi secara
Spektrum
di KLT, fasegerak yang sesuai dan penampak bercak yang sesuai
Kromatogram
di KLT preparatif, fasegerak yang sesuai dan penampak bercak yang sesuai
Fraksi-fraksi (F)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan
Pengembangan Biologi, LIPI, Bogor adalah tumbuhan bawang sabrang
(Eleutherine palmifolia (L.) Merr) suku Iridaceae. Hasil identifikasi dan gambar
tumbuhan dapat dilihat pada lampiran 1-2 halaman 52-53.
4.2 Hasil Pemeriksaan Makroskopik Umbi Bawang Sabrang
Hasil pemeriksaan makroskopik umbi dari bawang sabrang segar
(Eleutherine palmifolia (L.) Merr) adalah berbentuk bulat telur memanjang,
berwarna merah dan tidak berbau, serta berasa pahit. Umbi lapis terdiri dari 5-6
lapisan dengan pangkal daun di tengahnya dan biasanya memiliki panjang 4-5 cm
dan diameter 1-3 cm, hasil ini sama dengan yang tertera pada Heyne (1987) dan
Depkes (1989).
4.3 Hasil Pemeriksaan Karakteristik Simplisia
Hasil pemeriksaan makroskopik simplisia adalah berwarna merah pucat
dan sangat rapuh. Gambar umbi dan simplisia dari bawang sabrang dapat dilihat
pada lampiran 2-3 halaman 54-55. Hasil pemeriksaan karakterisasi dari serbuk
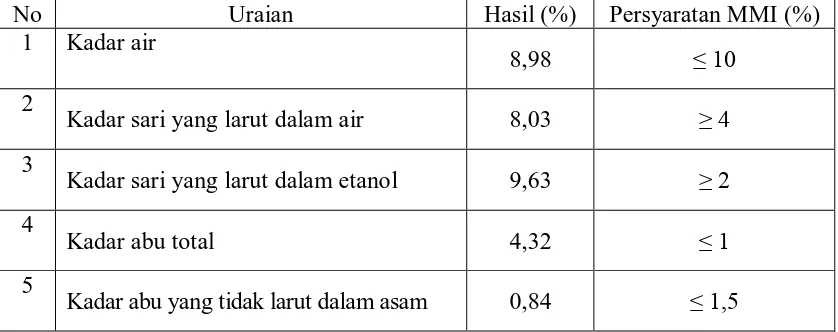
Tabel 1. Hasil Karakterisasi Serbuk Simplisia Umbi Bawang Sabrang
No Uraian Hasil (%) Persyaratan MMI (%)
1 Kadar air
8,98 ≤ 10
2
Kadar sari yang larut dalam air 8,03 ≥ 4
3
Kadar sari yang larut dalam etanol 9,63 ≥ 2
4
Kadar abu total 4,32 ≤ 1
5
Kadar abu yang tidak larut dalam asam 0,84 ≤ 1,5
Penetapan kadar air dilakukan untuk mengetahui apakah simplisia
memenuhi persyaratan, karena air merupakan media yang baik untuk tumbuhnya
jamur, ternyata hasilnya memenuhi syarat yaitu 8,98% lebih kecil dari 10%.
Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa yang
bersifat polar, sedang kadar sari larut dalam etanol dilakukan untuk mengetahui
senyawa yang terlarut dalam etanol, baik polar maupun non polar. Penetapan
kadar abu total dilakukan untuk mengetahui kadar senyawa anorganik dalam
simplisia, misalnya logam K, Ca, Na, Pb, Hg, silika, sedang penetapan kadar abu
tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa yang tidak
larut dalam asam, misalnya silika, logam-logam berat seperti Pb, Hg. Perhitungan
hasil karakterisasi simplisia dapat dilihat pada lampiran 4-8 halaman 29-33.
Hasil pemeriksaan skrining fitokimia dari serbuk simplisia umbi bawang sabrang
Tabel 2. Hasil Skrining Fitokimia Serbuk Simplisia Umbi Bawang Sabrang
No Skrining Pereaksi Hasil (warna/endapan)
1 Alkaloid Dragendorff
Bouchardat Mayer
(+) jingga kecoklatan
(+) kuning kecoklatan
(+) kekeruhan dan endapan putih
2 Flavonoid Zn + asam klorida pekat
Mg + asam klorida pekat (+) merah
3 Glikosida Molish
Fehling
(+) cincin ungu
(+) endapan merah bata
4 Saponin air panas/dikocok (+) busa
5 Antrakuinon glikosida KOH 10% (+) merah
6 Sianogenik glikosida Natrium pikrat (+) merah
7 Tanin FeCl3 1% (+) hijau
8 Triterpenoid/Steroid Liebermann-Burchard (+) ungu
Keterangan : (+) = mengandung golongan senyawa, (-) = tidak mengandung golongan senyawa.
Pada serbuk simplisia umbi bawang sabrang yang ditambah dengan
pereaksi Dragendorff memberikan warna jingga kecoklatan, dengan pereaksi
Bouchardat memberikan warna kuning kecoklatan, sedangkan dengan pereaksi
Mayer terbentuk adanya kekeruhan dan endapan putih, ini menunjukkan adanya
senyawa alkaloid. Penambahan serbuk Mg dan serbuk Zn dengan asam klorida
pekat memberikan warna merah, menunjukkan adanya senyawa flavonoid.
Skrining glikosida ditunjukkan dengan penambahan pereaksi Molish dan asam
sulfat pekat dimana terbentuk cincin ungu, sedangkan dengan penambahan
Fehling A dan Fehling B sama banyak terbentuk endapan berwarna merah bata.
Skrining saponin menghasilkan busa yang stabil dan tidak hilang dengan
pada lapisan air, sedangkan lapisan benzen berwarna kuning menunjukkan adanya
antrakuinon glikosida. Penambahan FeCl3 1% memberikan warna hijau yang
menunjukkan adanya senyawa tanin. Penambahan Liebermann-Burchard
memberikan warna ungu menunjukkan adanya triterpenoid.
4.4 Hasil Ekstraksi dan Isolasi
Hasil maserasi 650 g serbuk simplisia umbi bawang sabrang diperoleh
86,5 g ekstrak etanol. Terhadap 50 g ekstrak etanol umbi bawang sabrang
dilakukan isolasi senyawa antrakuinon dengan cara fraksinasi menggunakan
pelarut etilasetat. Setelah diuapkan diperoleh hasilnya sebanyak 4,37 g fraksi
etilasetat kental.
4.5 Hasil Analisis Fraksi Etilasetat dengan cara Kromatografi Lapis Tipis (KLT)
Terhadap fraksi etilasetat dilakukan analisis KLT menggunakan fase diam
plat pra lapis silika gel GF254, dengan berbagai macam fase gerak yang digunakan
yaitu petroleum eter-etilasetat-asam formiat (75:25:1), petroleum eter-etilasetat-air
(75:25:1), etilasetat-metanol-air (100:17:13), benzen-aseton (9:1, 8:2, 7:3, 6:4,
5:5), kloroform-etilasetat (9:1, 8:2, 7:3, 6:4, 5:5) dan n.propanol-etilasetat (8:2,
7:3, 5:5, 3:7). Ternyata fase gerak yang terbaik adalah benzen-aseton (8:2)
diperoleh sembilan noda, dimana lima diantaranya berwarna merah dengan KOH
10%. Ini menunjukkan adanya senyawa antrakuinon dengan harga Rf 0,29, 0,39,
Keterangan : Fase diam silika gel GF254, penampak bercak = KOH10%, fase gerak = benzen-aseton (8:2), A = visual, B = setelah disemprot, k = kuning, kl = kuning lemah, j = jingga, kj = kuning jingga, kc = kuning coklat, cm = coklat muda, b = biru, m = merah.
Hasil kromatogram dengan berbagai macam fase gerak yang lain dapat dilihat
pada lampiran 9-12 halaman 60-67.
4.6 Hasil Pemisahan Senyawa Antrakuinon dari Fraksi Etilasetat dengan cara KLT Preparatif
Analisis selanjutnya pemisahan dengan KLT preparatif digunakan fase
gerak benzene-aseton (8:2) dan hasil kromatogramnya dapat dilihat pada lampiran
13 halaman 68. Pada pemisahan fraksi etilasetat dengan KLT preparatif bercak
yang diambil adalah pita 1 dan 9 karena memberikan noda yang lebih besar dan
warna yang lebih intensif dibanding dengan pita 2, 4 dan 5 yang nodanya lebih
kecil. Masing-masing hasil KLT preparatif untuk pita 1 dan 9 dikerok dan
filtrat, diuapkan dan dilarutkan kembali, dimasukkan dalam freezer selama 1
malam. Hasilnya diperoleh bentuk kristal, kemudian dilarutkan dalam metanol
dan dilakukan KLT kembali untuk uji kemurnian dengan fase gerak
benzen-aseton (6:4) dan kloroform-etilasetat (8:2) untuk pita 1, sedangkan pita 9
digunakan fase gerak benzen-aseton (8:2) dan diklormetan-etilasetat (6:4).
4.7 Hasil Pengujian dengan KLT Satu Arah dan Dua Arah
Ternyata hasil KLT dari pita 1 telah menunjukkan satu noda disebut isolat
A, hasil kromatogram dapat dilihat sebagai berikut :
Kromatogram hasil KLT satu arah isolat A
Kemudian dilanjutkan dengan KLT dua arah hasil tetap menunjukkan satu noda,
kromatogramnya dapat dilihat sebagai berikut :
Kromatogram hasil KLT dua arah isolat A
Sedangkan pita 9 masih dijumpai dua noda, kromatogramnya dapat dilihat
sebagai berikut :
Kromatogram hasil KLT satu arah isolat B
Keterangan : Fase diam silika gel GF254, penampak bercak KOH 10%, tp = titik penotolan, bp = batas pengembangan, A = visual, B = setelah disemprot, k = kuning, kc = kuning coklat, ck = coklat kuning, m = merah.
sehingga dilakukan KLT preparatif kembali menggunakan fase gerak
diklormetan-etilasetat (6:4) dan penampak noda KOH 10%, untuk bercak yang
berwarna merah (Rf 0,84) dikerok dan dilarutkan dalam metanol, saring kemudian
gerak diklormetan-etilasetat (6:4) dan benzen-aseton (8:2) ternyata hasilnya telah
menunjukkan satu noda disebut isolat B. Hasil kromatogram dapat dilihat sebagai
berikut :
Kromatogram hasil KLT dua arah isolat B
4.8 Hasil Identifikasi Isolat secara Spektrofotometri U/Vis dan IR
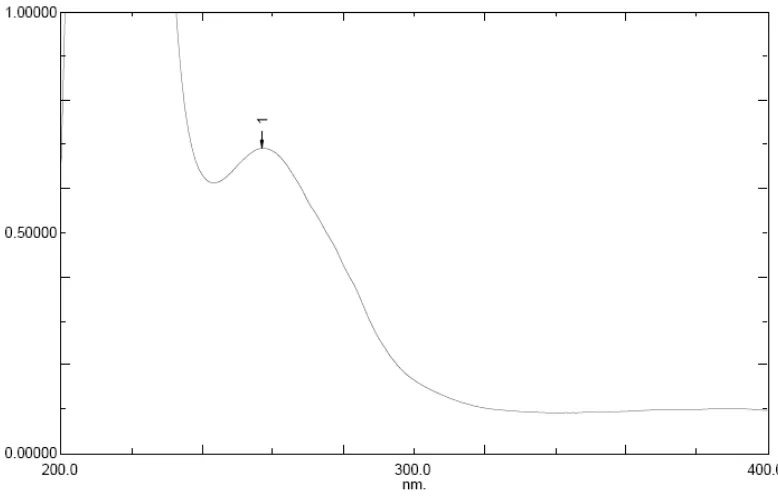
Gambar 2. Spektrum Ultraviolet/Visibel Isolat A.
Hasil pemeriksaan spektrofotometri ultraviolet/visibel dari isolat A
memberikan absorbansi maksimum pada panjang gelombang 417 nm.
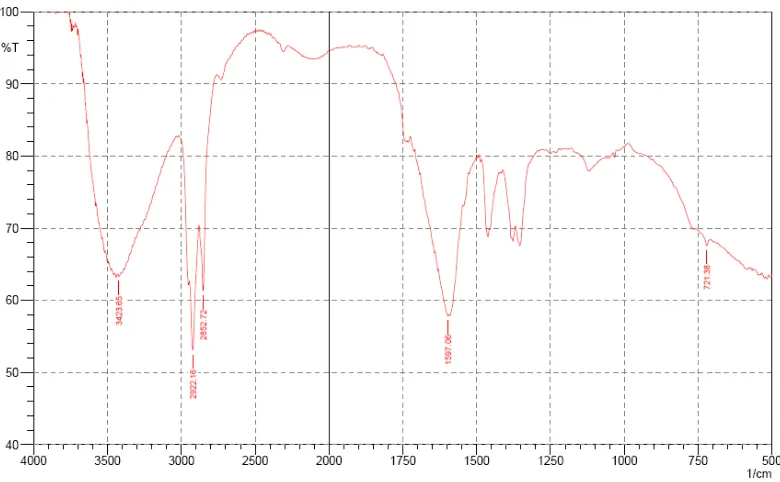
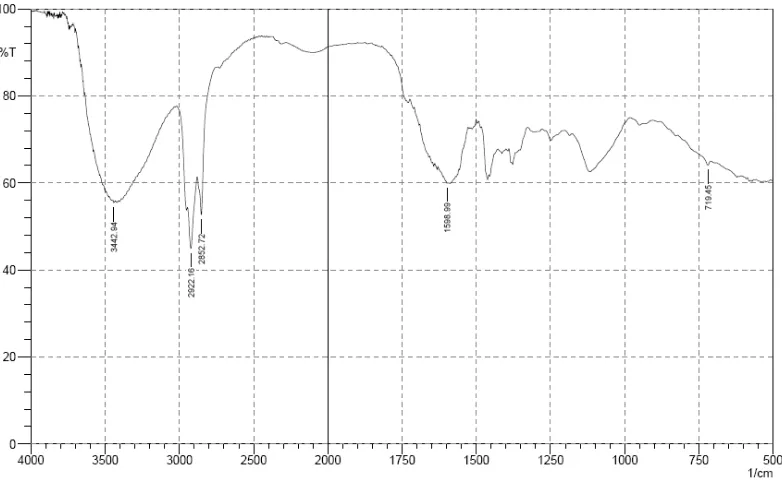
[image:62.595.152.542.466.707.2]Hasil pemeriksaan spektrofotometri inframerah dari ioslat A menunjukkan
adanya ikatan O-H pada bilangan gelombang 3423,65 cm-1 (masih terdapat pada
kisaran 3500 cm-1-3200 cm-1 ; 3650 cm-1-3200 cm-1,Pavia, et al., 1979; Williams
and Fleming , 1973), bilangan gelombang diantara 2922,16 cm-1 dan 2852,72 cm-1
menunjukkan adanya ikatan C-H alifatis (masih terdapat pada kisaran 3000 cm-1
-2800 cm-1, Pavia, et al., 1979 ), bilangan gelombang 1597,06 cm-1 menunjukkan
adanya ikatan C=O keton (masih terdapat pada kisaran 1870cm-1-1540 cm-1,
Silverstein, et al., 1984), bilangan gelombang 1462,04 cm-1 menunjukkan adanya
CH2 (masih terdapat pada kisaran 1465 cm-1-1450 cm-1, Williams and Fleming,
1973) dan bilangan gelombang 1118,71 cm-1 menunjukkan adanya ikatan C-O
[image:63.595.149.538.387.635.2](masih terdapat pada kisaran 1300 cm-1-1100 cm-1, Pavia, et al., 1979).
Gambar 4. Spektrum Ultraviolet/Visibel Isolat B.
Hasil pemeriksaan spektrofotometri ultraviolet/visibel dari isolat B
Gambar 5. Spektrum Inframerah Isolat B.
Hasil pemeriksaan spektrofotometri inframerah dari isolat B menunjukkan
adanya ikatan O-H pada bilangan gelombang 34442,94 cm-1 (masih terdapat pada
kisaran 3500 cm-1-3200 cm-1 ; 3650 cm-1-3200 cm-1,Pavia, et al., 1979; Williams
and Fleming, 1973), bilangan gelombang 2922,16 cm-1 dan 2852,72 cm-1
menunjukkan adanya ikatan C-H alifatis (masih terdapat pada kisaran 3000 cm-1
-2800 cm-1, Pavia, et al., 1979 ), bilangan gelombang 1598,99 cm-1 menunjukkan
adanya ikatan C=O keton (masih terdapat pada kisaran 1870 cm-1-1540 cm-1,
Silverstein, et al., 1984), bilangan gelombang 1462,04 cm-1 menunjukkan adanya
CH2 (masih terdapat pada kisaran 1465 cm-1-1450 cm-1, Williams and Fleming,
1973) dan bilangan gelombang 1116,78 cm-1 menunjukkan adanya ikatan C-O
(masih terdapat pada kisaran 1300 cm-1-1100 cm-1, Pavia, et al., 1979).
Pada hasil inframerah tidak terlihat adanya gugus aromatis (ikatan C=C)
pada kisaran 3150 cm-1-3050 cm-1 (Pavia, et al., 1979), ini dapat terjadi karena
yang terbentuk dengan penambahan KOH 10% cukup besar setelah disemprot
BAB V
KESIMPULAN DAN SARAN
4.1 Kesimpulan
1. Hasil analisis KLT fraksi etilasetat umbi bawang sabrang (Eleutherine
palmifolia (L.) Merr) diperoleh fase gerak terbaik benzen-aseton (8:2). Hasil
kromatografi preparatif diperoleh dua isolat yaitu isolat A Rf 0,72 dengan fase
gerak benzen-aseton (6:4) dan isolat B Rf 0,91 dengan fase gerak
benzen-aseton (8:2) diperoleh kristal berwarna kuning bentuk jarum.
2. Hasil spektrofotometri ultraviolet/visibel untuk isolat A diperoleh panjang
gelombang 417 nm, sedangkan hasil spektrofotometri inframerah diperoleh
O-H, C-H, C=O, CH2, C-O. Hasil spektrofotometri ultraviolet/visibel untuk
isolat B diperoleh panjang gelombang 257 nm, sedangkan hasil
spektrofotometri inframerah diperoleh O-H, C-H, C=O, CH2, C-O.
4.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan elusidasi struktur
terhadap senyawa antrakuinon hasil isolasi yang diperoleh serta melakukan uji
DAFTAR PUSTAKA Anonim. (2004). Tanaman Obat Mengkudu.
Adnan, M. (1997). Teknik Kromatografi Untuk Analisis Bahan Makanan. Yogyakarta : Penerbit Andi. Halaman 10, 15-16.
Agoes, G. (2007). Teknologi Bahan Alam. Bandung: ITB. Hal 8; 38-39.
Anief, M. (2000). Farmasetika. Yogyakarta: UGM Press. Hal 182.
Arung, E. T., Kusuma, I.W., Christy, O.E., Shimizu, K., and Kondo, R. (2009). Evaluation of Medicinal Plants From Central Kalimantan for Antimelanogenesis. J Nat Med 63:473-480.
Cooper, J. W. (1980). Spectroscopic Teqniques For Organic Chemist. United States of America : John Wiley & Sons. Pages 231.
Creswell, C. J., Runqeist, O. A., dan Campbell, M. M. (2005). Analisis Spektrum Senyawa Organik. Diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro. Bandung : Penerbit ITB. Halaman 1.
Depkes. (1979). Farmakope Indonesia. Edisi III. Jakarta. Halaman 744, 748.
Depkes. (1985). Tanaman Obat Indonesia. Jilid II. Jakarta : Departemen Kesehatan RI. Halaman 47.
Depkes. (1986). Sediaan Galenik. Jakarta : Departemen Kesehatan RI. Halaman 10-12.
Depkes. (1989). Materia Medika Indonesia. Jilid V. Jakarta : Departemen Kesehatan RI. Halaman 194-197, 516, 518, 522, 536, 540, 549-553.
Depkes. (1995). Materia Medika Indonesia. Jilid VI. Jakarta : Departemen Kesehatan RI. Halaman 300.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal 1, 10-11.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plant. In Journal of Pharmaceutical Science Volume 55 Number 3. Chicago : Reheis Chemical Company. Pages 245-266.
Galingging, R. Y. (2007). Potensi Plasma Nutfah Tanaman Obat Sebagai Sumber Biofarmaka di Kalimantan Tengah. Jurnal Pengkajian dan Pengembangan Teknologi Pertanian Vol 10, No. 1, Halaman 82.
Galingging, R.Y. (2009). Bawang Dayak (Eleutherine palmifolia) Sebagai Tanaman Obat Multifungsi. Warta Penelitian dan Pengembangan Badan Penelitian dan Pengembangan Pertanian Vol 15, No. 3, Halaman 2-4.
Gunawan, D. (2004). Ilmu Obat Alam (Farmakognosi). Cetakan I. Jakarta : Penerbit Penebar Swadaya. Halaman 77-80.
Gritter, R.J., Bobbit, J.M., Schwarting, A.E. (1991). Pengantar Kromatografi. Bandung: Penerbit ITB. Hal 157-158.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB. Hal 147.
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Jilid I. Cetakan ke-I. Diterjemahkan oleh Badan Litbang Kehutanan. Jakarta : Yayasan Sarana Wana Jaya. Halaman 551-552.
Hostettmann, K., Hostettmann, M., dan Marston, A. (1995). Cara Kromatografi Preparatif. Diterjemahkan oleh Kosasih Padmawinata. Bandung : Penerbit ITB. Halaman 33.
Ifesan, B. O. T., Hamtasi