ISOLASI DAN KARAKTERISASI SENYAWA FLAVONOID UMBI DARI TUMBUHAN
BAWANG SABRANG (Eleutherine palmifolia (L.) Merr) SKRIPSI
OLEH:
ROSFIANITA M. NAPITUPULU 081524050
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
ISOLASI DAN KARAKTERISASI SENYAWA FLAVONOID UMBI DARI TUMBUHAN
BAWANG SABRANG (Eleutherine palmifolia (L.) Merr)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ROSFIANITA M. NAPITUPULU 081524050
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
ISOLASI DAN KARAKTERISASI SENYAWA FLAVONOID UMBI DARI TUMBUHAN
BAWANG SABRANG (Eleutherine palmifolia (L.) Merr) OLEH:
ROSFIANITA M. NAPITUPULU 081524050
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Juli 2011
Pembimbing I, Panitia Penguji,
Prof.Dr.Siti Morin Sinaga,M.Sc.,Apt. Dr. M. Pandapotan Nasution, MPS., Apt. NIP 195008281976032002 NIP 195304031983032001
Pembimbing II,
Prof. Dr. Siti Morin Sinaga,M.Sc.,Apt. NIP 195008281976032002
Dr. Marline Nainggolan, MS., Apt. NIP 195709091985112001
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Dr. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, Juli 2011
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Kuasa yang telah
melimpahkan berkat dan anugerahNya sehingga penulis dapat menyelesaikan
penelitian dan penulisan skripsi yang berjudul “Isolasi dan Karakterisasi Senyawa
Flavonoid Umbi dari Tumbuhan Bawang Sabrang (Eleutherine palmifolia (L)
Merr)” untuk memenuhi syarat guna mencapai gelar sarjana farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini dengan kerendahan hati penulis mengucapkan terima
kasih yang tak terhingga kepada Ayahanda tercinta T. M Napitupulu dan Ibunda
T. Gurning, serta kakanda dan adinda tersayang yang dengan penuh kesabaran dan
kasih sayang selalu memberi dorongan, bimbingan, nasehat serta doa.
Melalui tulisan ini ucapan terima kasih yang tulus dan ikhlas atas
bimbingan, petunjuk, pemberian fasilitas serta saran dan bantuan lainnya, sebelum
dan selama penelitian juga disampaikan kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara yang telah mensyahkan dan
memberikan pengarahan dalam penyusunan skripsi ini.
2. Ibu Dra. Suwarti Aris, M.Si., Apt., selaku dosen wali yang selama ini
telah banyak membina dan membimbing penulis selama masa
pendidikan.
3. Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt., dan Dr. Marline
Nainggolan, M.S., Apt., selaku dosen pembimbing yang telah
membimbing penulis dengan penuh kesabaran selama penelitian
4. Bapak Dr. M. Pandapotan Nasution., MPS., Apt, Bapak Drs. Suryadi
Achmad, M.Sc., Apt., dan Ibu Dra. Aswita Hafni Lubis, M.Si., Apt.,
selaku penguji dan memberikan masukan kepada penulis dalam
penyusunan skripsi ini.
5. Dosen Staf Pengajar dan Asisten Laboratorium Fitokimia yang banyak
memberikan dorongan dan bantuan selama penelitian.
6. Teman-teman penulis khususnya Elwisda, Lastiur, Rogabe, Rosdiana,
Kak Vikha yang telah memberikan dukungan dalam menyelesaikan
penelitian dan penulisan skripsi.
7. Semua mahasiswa/i farmasi khususnya farmasi ekstensi 2008 yang
tidak dapat penulis sebutkan satu persatu, terima kasih untuk semangat
dan doanya.
Semoga skripsi ini dapat menjadi sumbangan yang berarti bagi ilmu
pengetahuan khususnya pada ilmu farmasi. Penulis mengharapkan
kritik dan saran demi kesempurnaan skripsi ini.
Medan, Juli 2011
Penulis
(Rosfianita Napitupulu)
Isolasi dan Karakterisasi Senyawa Flavonoid
dari Umbi Tumbuhan Bawang Sabrang (Eleutherine palmifolia (L.) Merr)
Abstrak
Telah dilakukan isolasi senyawa flavonoid umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr), yang dapat berkhasiat sebagai antiemetik, disuria, radang usus, disentri, penyakit kuning, luka, bisul, diabetes melitus, hipertensi, menurunkan kolesterol, kanker payudara, antimelanogenesis dan sebagai antioksidan. Tujuan penelitian ini adalah untuk memperoleh senyawa flavonoid dari umbi bawang sabrang dan melakukan karakterisasi terhadap senyawa flavonoid dan hasil isolasi dengan spektrofotometri ultraviolet (UV).
Terhadap serbuk umbi bawang sabrang dilakukan pemeriksaan karakteristik simplisia dan skrining fitokimia, kemudian diekstraksi secara maserasi dengan pelarut etanol 80%. Selanjutnya ekstrak etanol dipartisi dengan pelarut n-heksan: air (1:1), kemudian dengan pelarut kloroform : air (1:1), fraksi air direfluks dan difraksinasi dengan etilasetat. Fraksi etilasetat dianalisis secara kromatografi kertas (KKt) dengan menggunakan lima jenis fase gerak yang berbeda yaitu n-Butanol Asam asetat Air, Forestal, asam asetat 50%, asam asetat 15% dan asam klorida 1%, sedangkan sebagai penampak noda uap NH3, AlCl3
5% dan FeCl3 1%. Fraksi etilasetat dipisahkan dengan KKt preparatif
menggunakan fase gerak asam asetat 50% dan isolat yang diperoleh dikarakterisasi dengan spektrofotometri UV menggunakan pereaksi geser (shift reagent).
Hasil pemeriksaan makroskopik umbi bawang sabrang adalah berbentuk bulat telur memanjang, berwarna merah dan tidak berbau, serta berasa pahit. Umbi lapis terdiri dari 5-6 lapisan dengan pangkal daun di tengahnya dan biasanya memiliki panjang 4-5 cm dan diameter 1-3 cm. Hasil penetapan kadar air dari serbuk simplisia diperoleh 8,98%, kadar sari yang larut dalam air 8,03%, kadar sari yang larut dalam etanol 9,63%, kadar abu total 4,32% dan kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia diperoleh adanya alkaloid, flavonoid, glikosida, saponin, antrakinon glikosida, tanin dan triterpenoid/steroid. Hasil isolasi dari fraksi etilasetat diperoleh dua senyawa yaitu F2 dengan harga Rf= 0,53 (berflouresensi jingga) diduga senyawa flavonoid golongan flavon dengan gugus 5-OH pada cincin A dan F3 dengan harga Rf= 0,79 (berflouresensi biru) diduga senyawa flavonoid golongan flavon 4-OH pada cincin B dan 6,7-diOH.
Isolation and Characterization of Flavonoids Compound from Tree Bawang Sabrang Bulb (Eleutherine palmifolia (L.) Merr)
Abstract
The flavonoid compounds have been isolated from tree bawang sabrang bulbs (Eleutherine palmifolia (L.) Merr.), which can be efficacious as an antiemetic, dysuria, colitis, dysentery, jaundice, wounds, ulcers, diabetes mellitus, hypertension, lowering cholesterol, breast cancer, antimelanogenesis and as an antioxidant. The purpose of this study was to isolated flavonoid compounds from bawang sabrang bulbs and characterization of isolated with a ultraviolet spectrophotometry (UV).
The characterization and phytochemical screening of the powder of bawang sabrang bulb was extracted by maceration with 80% ethanol, and partitioned with n-heksan : water (1:1), it was then partitioned with chloroform : water (1:1), aqueous residue was refluxed and fractionated with ethylacetate. Each of the ethylacetate fraction was analysed using paper chromatography five kinds difficult with n-Butanol Acetic acid Water, Forestal, 50% acetic acid, 15% acetic acid and 1% hydrochloric acid, visualisation using NH3 vapors, 5% aluminium
chloride and 1% ferry chloride. The ethylacetate fraction was separated by preparative paper chromatography using 50% acetic acid as mobile phase and the isolate were identified with spectrophotometry UV using shift reagent.
The results of macroscopic of bawang sabrang bulb is elongated oval shaped, red, not odor and taste bitter. Bulb consists of 5-6 layers with a base of the leaf in the center and usually has a length of 4-5 cm and 1-3 cm diameter. The result of the determination of water content of 8.98% from simplex powder, levels of water-soluble extract 8.03%, levels of soluble extract in ethanol 9.63%, 4.32% total ash content and ash content that does not dissolve in acid 0.84%. The phytochemical screening results indicate the existence of alkaloids, flavonoids, glycosides, saponin, anthraquinone glycosides, tannins and triterpenoids/steroids. Isolate from ethylacetate fraction obtained two pure isolate, that were F2 with Rf value = 0,53 (orange fluoresence) that was flavon containing 5-OH groups in ring A, whereas F3 with Rf = 0,79 (blue fluoresence) that was flavon containing 4-OH groups in ring B and 6,7-diOH.
DAFTAR ISI
Halaman
Judul . ... i
Halaman Pengesahan ... iii
Kata Pengantar . ... iv
Abstrak ... vi
Abstract ... vii
Daftar Isi ... viii
Daftar Tabel ... xiii
Daftar Gambar . ... xiv
Daftar Lampiran ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA . ... 4
2.1 Uraian Tumbuhan . ... 4
2.1.1 Habitat . ... 4
2.1.2 Morfologi Tumbuhan . ... 4
2.1.3 Sistematika Tumbuhan . ... 5
2.1.4 Nama daerah. ... 5
2.1.6 Khasiat. ... 5
2.2 Flavonoid. ... 6
2.3 Ekstraksi. ... 10
2.4 Kromatografi kertas. ... 12
2.5 Spektrofotometri ultraviolet. ... 15
BAB III METODOLOGI PENELITIAN ... 18
3.1 Alat dan Bahan ... 18
3.1.1 Alat-alat yang digunakan ... 18
3.1.2 Bahan-bahan ... 18
3.2 Pengambilan dan Pengolahan Sampel ... 19
3.2.1 Pengambilan Sampel ... 19
3.2.2 Identifikasi Tumbuhan ... 19
3.2.3 Pengolahan Sampel ... 19
3.3 Pembuatan Pereaksi ... 20
3.3.1 Pereaksi Asam klorida 2 N ... 20
3.3.2 Pereaksi Natrium Hidroksida 2 N ... 20
3.3.3 Pereaksi besi (III) klorida 1% ... 20
3.3.4 Pereaksi Bouchardat ... 20
3.3.5 Pereaksi Dragendorff ... 20
3.3.6 Pereaksi Mayer ... 21
3.3.7 Pereaksi Molish ... 21
3.3.8 Pereaksi Timbal (II) asetat 0,4 N ... 21
3.3.9 Pereaksi Liebermann-Burchard ... 21
3.3.11 Pereaksi Aluminium Klorida 5% ... 21
3.3.12 Pereaksi Asam Sulfat 2 N... 22
3.3.13 Pereaksi BAA ... 22
3.3.14 Pereaksi Forestal ... 22
3.3.15 Pereaksi Asam Asetat 15% ... 22
3.3.16 Pereaksi Asam Asetat 50% ... 22
3.3.17 Pereaksi Asam Klorida 1% ... 22
3.4 Pemeriksaan Makroskopik Umbi Bawang Sabrang ... 23
3.4.1 Pemeriksaan Makroskopik ... 23
3.5 Pemeriksaan Karakterisasi Simplisia ... 23
3.5.2 Penetapan Kadar Air ... 23
3.5.3 Penetapan Kadar Sari Larut dalam Air ... 24
3.5.4 Penetapan Kadar Sari Larut dalam Etanol ... 24
3.5.5 Penetapan Kadar Abu Total ... 25
3.5.6 Penetapan Kadar Abu Tidak Larut dalam Asam ... 25
3.6 Skrining Fitokimia ... 25
3.6.1 Pemeriksaan alkaloid ... 25
3.6.2 Pemeriksaan flavonoid ... 26
3.6.3 Pemeriksaan glikosida ... 27
3.6.4 Pemeriksaan saponin ... 27
3.6.5 Pemeriksaan glikosida antrakuinon ... 27
3.6.6 Pemeriksaan glikosida sianogenik ... 28
3.6.7 Pemeriksaan tanin ... 28
3.7 Pembuatan Ekstrak ... 29
3.8 Isolasi Senyawa Flavonoid dari Ekstrak Etanol ... 30
3.9 Analisis Fraksi Etilasetat dengan Cara Kromatografi Kertas (KKt) ... 31
3.10 Pemisahan Senyawa Flavonoid dari Fraksi Etilasetat dengan Cara Kromatografi Kertas (KKt) Preparatif ... 32
3.11 Uji Kemurnian terhadap Senyawa Flavonoid Hasil Kromatografi Kertas Preparatif ... 33
3.11.1 Uji kemurnian isolat hasil isolasi dengan KKt satu arah ... 33
3.11.2 Uji kemurnian isolat hasil isolasi dengan KKt dua arah …. 33
3.12 Identifikasi Senyawa Hasil Isolasi ... 34
BAB IV HASIL DAN PEMBAHASAN ... 36
4.1 Hasil Identifikasi tumbuhan ... 36
4.2 Hasil Pemeriksaan Makroskopik Umbi Bawang Sabrang ... 36
4.3 Hasil Pemeriksaan Karakterisasi Simplisia ... 36
4.4 Hasil Ekstraksi dan Isolasi ……… 40
4.5 Hasil Analisis Fraksi Etilasetat dengan cara Kromatografi Kertas (KKt) ……… 40
4.6 Hasil Pemisahan Senyawa Flavonoid dari Fraksi Etilasetat dengan cara KKt Preparatif ……… 41
4.7 Hasil pengujian dengan KKt Satu Arah dan Dua Arah ………. 41
4.8 Hasil Penafsiran Isolat F2 dan F3 secara Spektrofotometri UV…. 42
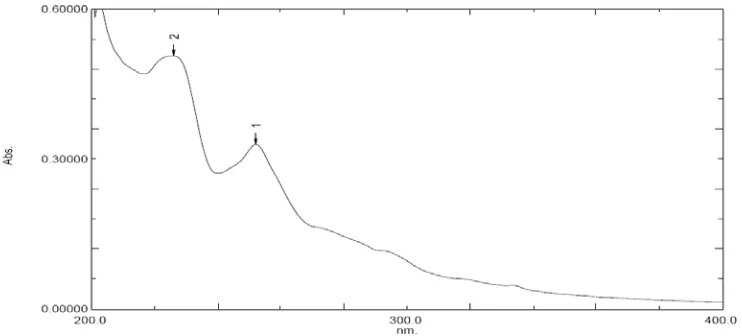
4.8.1 Penafsiran spektrum ultraviolet untuk isolat F2 ………. 42
4.8.2 Penafsiran spektrum ultraviolet untuk isolat F3 …………... 48
BAB V KESIMPULAN DAN SARAN ... 56
5.2 Saran ... 56
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
Halaman
Tabel 4.1. Hasil Karakterisasi Serbuk Simplisia Umbi Bawang Sabrang .. 38
Tabel 4.2. Hasil Skrining Fitokimia Serbuk Simplisia Umbi bawang
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Kerangka dasar flavonoid………..… 6
Gambar 2.2. Struktur flavonoid dasar dengan kerangka penomoran… 6
Gambar 2.3. Struktur flavon dan struktur flavonol.………. 7
Gambar 2.4. Struktur isoflavon……… 8
Gambar 2.5. Struktur flavanon dan Struktur flavanonol ………. 9
Gambar 2.6. Struktur antosianin………. 9
Gambar 2.7. Struktur auron dan Struktur khalkon………. 10
Gambar 4.1. Spektrum ultraviolet dari isolat F2 dalam metanol………. 42
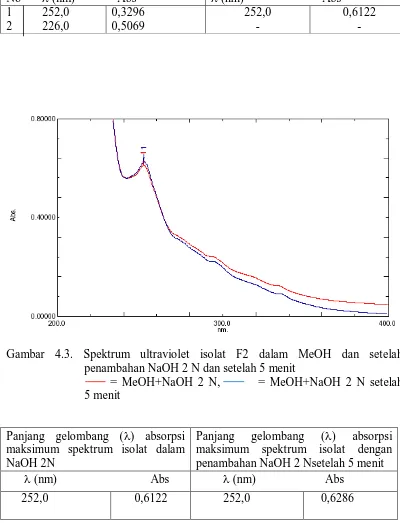
Gambar 4.2. Spektrum ultraviolet isolat F2 dalam metanol dan setelah penambahan NaOH 2 N……… 43
Gambar 4.3. Spektrum ultraviolet isolat F2 dalam metanol dengan penambahan NaOH 2 N dan spektrum yang diukur setelah 5 menit……… 44
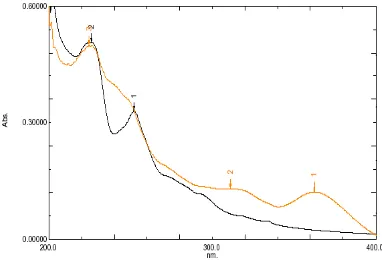
Gambar 4.4. Spektrum ultraviolet isolat F2 dalam metanol dan setelah penambahan AlCl3 5%/HCl 6 N ……… 45
Gambar 4.5. Spektrum ultraviolet isolat F2 dalam metanol dengan penambahan AlCl3 5% dan setelah penambahan AlCl3 5%/HCl 6 N ……… 46
Gambar 4.6. Spektrum ultraviolet isolat F2 dalam metanol dan setelah penambahan NaOAc ……… 47
Gambar 4.7. Spektrum ultraviolet isolat F2 dalam metanol dan setelah penambahan NaOAc/H3BO3 ……… 47
Gambar 4.8. Struktur Flavonoid dengan gugus 5-OH flavon………… 48
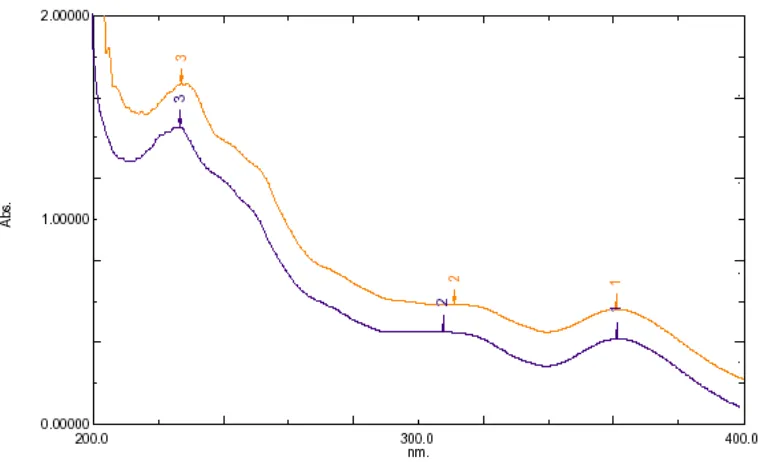
Gambar 4.10. Spektrum ultraviolet isolat F3 dalam metanol dan setelah penambahan NaOH 2 N ………. 50
Gambar 4.11. Spektrum ultraviolet isolat F3 dalam metanol
dengan penambahan NaOH 2N dan spektrum yang diukur
setelah 5 menit ……….. 50
Gambar 4.12. Spektrum ultraviolet isolat F3 dalam metanol dan
setelah penambahan AlCl3 5%/HCl 6N ……… 51
Gambar 4.13. Spektrum ultraviolet isolat F3 dalam metanol
dengan penambahan AlCl3 5% dan setelah penambahan
AlCl3 5%/HCl 6 N ……….. 52
Gambar 4.14. Spektrum ultraviolet isolat F3 dalam metanol dan
setelah penambahan NaOAc ……… 53
Gambar 4.15. Spektrum ultraviolet isolat F3 dalam metanol dan setelah
penambahan NaOAc/H3BO3 ……….. 54
Gambar 4.16. Struktur Flavonoid dengan gugus 4-OH pada cincin B
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan bawang sabrang (Eleutherin palmifolia (L.) Merr) ... 60
Lampiran 2. Gambar Tumbuhan, Umbi, Simplisia bawang sabrang ... 61
Lampiran 3. Perhitungan Kadar Air Serbuk Simplisia Umbi Bawang Sabrang ... 62
Lampiran 4. Perhitungan Kadar Sari Larut dalam Air Serbuk Simplisia Umbi Bawang sabrang ... 63
Lampiran 5. Perhitungan Kadar Sari Larut dalam Etanol Serbuk Simplisia Umbi Bawang Sabrang ... 64
Lampiran 6. Perhitungan Kadar Abu Total Serbuk Simplisia Umbi Bawang Sabrang ... 65
Lampiran 7. Perhitungan Kadar Abu Tidak Larut dalam Asam Serbuk Simplisia Umbi Bawang Sabrang ... 66
Lampiran 8. Kromatogram hasil KKt fraksi etilasetat dengan fase
gerak BAA ... 67
Lampiran 9. Kromatogram hasil KKt fraksi etilasetat dengan fase
gerak Forestal ... 69
Lampiran 10. Kromatogram hasil KKt fraksi etilasetat dengan fase
gerak asam asetat 50% ... 71
Lampiran 11. Kromatogram hasil KKt fraksi etilasetat dengan fase
gerak asam asetat 15% ... 73
Lampiran 12. Kromatogram hasil KKt fraksi etilasetat dengan fase
gerak asam klorida 1% v/v ... 75
Lampiran 13. Pembagian kromatogram hasil KKt preparatif dengan
fase gerak asam asetat 50% ... 77
Lampiran 14. Kromatogram hasil KKt isolat F2 menggunakan fase
diam kertas Whatmann No.1 dan fase gerak BAA ... 78
Lampiran 15. Kromatogram hasil KKt isolat F2 menggunakan fase
Lampiran 16. Kromatogram hasil KKt isolat F2 menggunakan fase
diam kertas Whatmann No.1 dan fase gerak asam asetat 50% ... 80
Lampiran 17. Kromatogram hasil KKt isolat F3 menggunakan fase
diam kertas Whatmann No.1 dan fase gerak BAA ... 81
Lampiran 18. Kromatogram hasil KKt isolat F3 menggunakan fase
diam kertas Whatmann No.1 dan fase gerak Forestal ... 82
Lampiran 19. Kromatogram hasil KKt isolat F3 menggunakan fase
diam kertas Whatmann No.1 dan fase gerak asam asetat 50% ... 83
Lampiran 20. Kromatogram hasil uji kemurnian isolat F2 dengan KKt
2 arah menggunakan fase diam kertas Whatmann No.1, fase gerak I asam asetat 50% dan fase gerak Forestal ... 84
Lampiran 21. Kromatogram hasil uji kemurnian isolat F3 dengan KKt
2 arah menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak asam asetat 50% ... 85
Lampiran 22. Harga Rf Hasil Uji Kemurnian Kromatografi Kertas Satu
Isolasi dan Karakterisasi Senyawa Flavonoid
dari Umbi Tumbuhan Bawang Sabrang (Eleutherine palmifolia (L.) Merr)
Abstrak
Telah dilakukan isolasi senyawa flavonoid umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr), yang dapat berkhasiat sebagai antiemetik, disuria, radang usus, disentri, penyakit kuning, luka, bisul, diabetes melitus, hipertensi, menurunkan kolesterol, kanker payudara, antimelanogenesis dan sebagai antioksidan. Tujuan penelitian ini adalah untuk memperoleh senyawa flavonoid dari umbi bawang sabrang dan melakukan karakterisasi terhadap senyawa flavonoid dan hasil isolasi dengan spektrofotometri ultraviolet (UV).
Terhadap serbuk umbi bawang sabrang dilakukan pemeriksaan karakteristik simplisia dan skrining fitokimia, kemudian diekstraksi secara maserasi dengan pelarut etanol 80%. Selanjutnya ekstrak etanol dipartisi dengan pelarut n-heksan: air (1:1), kemudian dengan pelarut kloroform : air (1:1), fraksi air direfluks dan difraksinasi dengan etilasetat. Fraksi etilasetat dianalisis secara kromatografi kertas (KKt) dengan menggunakan lima jenis fase gerak yang berbeda yaitu n-Butanol Asam asetat Air, Forestal, asam asetat 50%, asam asetat 15% dan asam klorida 1%, sedangkan sebagai penampak noda uap NH3, AlCl3
5% dan FeCl3 1%. Fraksi etilasetat dipisahkan dengan KKt preparatif
menggunakan fase gerak asam asetat 50% dan isolat yang diperoleh dikarakterisasi dengan spektrofotometri UV menggunakan pereaksi geser (shift reagent).
Hasil pemeriksaan makroskopik umbi bawang sabrang adalah berbentuk bulat telur memanjang, berwarna merah dan tidak berbau, serta berasa pahit. Umbi lapis terdiri dari 5-6 lapisan dengan pangkal daun di tengahnya dan biasanya memiliki panjang 4-5 cm dan diameter 1-3 cm. Hasil penetapan kadar air dari serbuk simplisia diperoleh 8,98%, kadar sari yang larut dalam air 8,03%, kadar sari yang larut dalam etanol 9,63%, kadar abu total 4,32% dan kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia diperoleh adanya alkaloid, flavonoid, glikosida, saponin, antrakinon glikosida, tanin dan triterpenoid/steroid. Hasil isolasi dari fraksi etilasetat diperoleh dua senyawa yaitu F2 dengan harga Rf= 0,53 (berflouresensi jingga) diduga senyawa flavonoid golongan flavon dengan gugus 5-OH pada cincin A dan F3 dengan harga Rf= 0,79 (berflouresensi biru) diduga senyawa flavonoid golongan flavon 4-OH pada cincin B dan 6,7-diOH.
Isolation and Characterization of Flavonoids Compound from Tree Bawang Sabrang Bulb (Eleutherine palmifolia (L.) Merr)
Abstract
The flavonoid compounds have been isolated from tree bawang sabrang bulbs (Eleutherine palmifolia (L.) Merr.), which can be efficacious as an antiemetic, dysuria, colitis, dysentery, jaundice, wounds, ulcers, diabetes mellitus, hypertension, lowering cholesterol, breast cancer, antimelanogenesis and as an antioxidant. The purpose of this study was to isolated flavonoid compounds from bawang sabrang bulbs and characterization of isolated with a ultraviolet spectrophotometry (UV).
The characterization and phytochemical screening of the powder of bawang sabrang bulb was extracted by maceration with 80% ethanol, and partitioned with n-heksan : water (1:1), it was then partitioned with chloroform : water (1:1), aqueous residue was refluxed and fractionated with ethylacetate. Each of the ethylacetate fraction was analysed using paper chromatography five kinds difficult with n-Butanol Acetic acid Water, Forestal, 50% acetic acid, 15% acetic acid and 1% hydrochloric acid, visualisation using NH3 vapors, 5% aluminium
chloride and 1% ferry chloride. The ethylacetate fraction was separated by preparative paper chromatography using 50% acetic acid as mobile phase and the isolate were identified with spectrophotometry UV using shift reagent.
The results of macroscopic of bawang sabrang bulb is elongated oval shaped, red, not odor and taste bitter. Bulb consists of 5-6 layers with a base of the leaf in the center and usually has a length of 4-5 cm and 1-3 cm diameter. The result of the determination of water content of 8.98% from simplex powder, levels of water-soluble extract 8.03%, levels of soluble extract in ethanol 9.63%, 4.32% total ash content and ash content that does not dissolve in acid 0.84%. The phytochemical screening results indicate the existence of alkaloids, flavonoids, glycosides, saponin, anthraquinone glycosides, tannins and triterpenoids/steroids. Isolate from ethylacetate fraction obtained two pure isolate, that were F2 with Rf value = 0,53 (orange fluoresence) that was flavon containing 5-OH groups in ring A, whereas F3 with Rf = 0,79 (blue fluoresence) that was flavon containing 4-OH groups in ring B and 6,7-diOH.
BAB I PENDAHULUAN 1.1Latar Belakang
Kekayaan jenis tumbuhan di Indonesia cukup berlimpah, termasuk di
dalamnya tumbuhan yang dapat dimanfaatkan untuk tujuan pengobatan.
Penggunaan dan permintaan terhadap tanaman obat tradisional bertambah
sehingga penelitian kearah obat-obatan tradisional semakin meningkat. Hal ini
disebabkan efek samping obat tradisional yang lebih kecil dibanding obat modern
(Fajiriah, dkk., 2007).
Salah satu tumbuhan berkhasiat yang digunakan sebagai obat adalah umbi
dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr), termasuk suku
Iridaceae. Tumbuhan ini dapat tumbuh hampir di setiap daerah di Indonesia
seperti di Kalimantan, Jawa dan Sumatera. Bentuk dan warna umbi bawang
sabrang mirip dengan bawang merah (Nawawi, dkk., 2007). Umbi tumbuhan ini
banyak digunakan sebagai obat kanker yaitu dengan cara merebus umbinya
dengan air atau dimakan, namun informasi tentang tumbuhan ini masih sedikit
sekali. Hasil uji yang telah dilakukan menunjukkan bahwa tanaman bawang
sabrang memiliki hampir semua kandungan fitokimia, antara lain alkaloid,
glikosida, flavonoid, fenolik dan steroid (Galingging, 2009). Umbinya bermanfaat
sebagai antiemetik, disuria, radang usus, disentri, penyakit kuning, luka, bisul
(Ogata, 1995; Heyne, 1987), diabetes melitus, hipertensi, menurunkan kolesterol
dan kanker payudara (Galingging, 2009), antimelanogenesis dan sebagai
Senyawa flavonoid merupakan salah satu golongan fenol alam yang
tersebar jumlahnya dan digunakan dalam pengobatan tradisional untuk mengobati
gangguan hati, menghambat pendarahan, inhibitor kuat, antihipertensi, antivirus,
antiinflamasi dan sitotoksik. Alasan ini yang menjelaskan kenapa tumbuhan yang
mengandung senyawa flavonoid banyak digunakan sebagai obat tradisional
(Farnsworth, 1966; Robinson, 1995).
Salah satu kandungan senyawa kimia dari umbi tumbuhan bawang sabrang
adalah flavonoid dan dapat digunakan sebagai pengobatan kanker payudara.
(Wardani, 2009). Berdasarkan hal diatas maka penulis tertarik untuk melakukan
penelitian terhadap umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia
(L.) Merr). Pada penelitian ini dilakukan karakterisasi simplisia, skrining
fitokimia, isolasi senyawa flavonoid menggunakan kromatografi kertas (KKt)
serta identifikasi senyawa hasil isolasi dengan spektrofotometri ultraviolet (UV)
menggunakan pereaksi geser (shift reagent).
1.2 Perumusan Masalah
1. Apakah senyawa flavonoid yang terdapat pada umbi dari tumbuhan bawang
sabrang (Eleutherine palmifolia (L.) Merr) dapat diisolasi dengan metode
KKt?
2. Apakah senyawa flavonoid hasil isolasi dapat dikarakterisasi secara
1.3 Hipotesis
1. Senyawa flavonoid yang terdapat pada umbi dari tumbuhan bawang sabrang
(Eleutherine palmifolia (L.) Merr) dapat diisolasi dengan metode KKt.
2. Senyawa flavonoid hasil isolasi dapat dikarakterisasi secara spektrofotometri
UV menggunakan pereaksi geser (shift reagent).
1.4 Tujuan Penelitian
1. Mengisolasi senyawa flavonoid umbi dari tumbuhan bawang sabrang
(Eleutherine palmifolia (L.) Merr).
2. Melakukan karakterisasi senyawa flavonoid hasil isolasi umbi dari tumbuhan
bawang sabrang (Eleutherine palmifolia (L.) Merr) secara spektrofotometri
UV menggunakan pereaksi geser (shift reagent).
1.5 Manfaat Penelitian
Sebagai informasi tentang senyawa flavonoid hasil isolasi umbi dari
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi habitat dan daerah tumbuh, morfologi
tumbuhan, sistematika tumbuhan, nama daerah, kandungan kimia dan khasiat.
2.1.1 Habitat
Terna bawang sabrang berasal dari Amerika tropis, di Jawa dipelihara
sebagai tanaman hias dan di beberapa tempat tumbuh liar antara 600 hingga
1500 m di atas permukaan laut, kadang-kadang didapati dalam jumlah besar di
pinggir-pinggir jalan yang berumput dan di dalam kebun-kebun teh, kina dan
karet (Heyne, 1987; Ogata, 1995).
2.1.2 Morfologi Tumbuhan
Tumbuhan ini merumpun sangat kuat, tinggi 26 hingga 50 cm. Umbi
berbentuk bulat telur memanjang, berwarna merah dan tidak berbau. Bunga
berwarna putih, mekar jam lima sore hari, dan menutup kembali pada jam tujuh.
Daun mirip dengan daun anggrek tanah, hijau bergerigi dengan lebar beberapa jari
(Juhara, 2009). Daun tunggal, letak daun berhadapan, warna daun hijau muda,
bentuk daun sangat panjang dan meruncing (acicular), tepi daun halus tanpa
gerigi (entire), pangkal daun berbentuk runcing (acute) dan ujung daun meruncing
(acuminate) permukaan daun atas dan bawah halus (glabrous), tulang daun
2.1.3 Sistematika Tumbuhan
Sistematika dari tumbuhan bawang sabrang (Tjitrosoepomo, 2007) adalah
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas
Ordo : Liliales
Famili : Iridaceae
Genus : Eleutherine
Spesies : Eleutherine palmifolia (L.) Merr.
2.1.4 Nama Daerah
Nama daerah dari tumbuhan bawang sabrang adalah sebagai berikut:
bawang hantu (Kalimantan); brambang sabrang, luluwan sapi, teki sabrang,
bebawangan beureum, bawang siem (Jawa); bawang kapal (Sumatera).
2.1.5 Kandungan Kimia
Bawang sabrang mengandung senyawa-senyawa yang meliputi alkaloid,
glikosida, flavonoid, fenolik, triterpenoid/steroid dan tanin (Galingging, 2009).
2.1.6 Khasiat
Umbi tumbuhan bawang sabrang digunakan sebagai diuretik, pencahar,
antiemetik. Rebusan umbi sebagai astringen, menyembuhkan disentri, hati dan
penyakit kelamin. Daunnya digunakan sebagai antipiretik dan antiemetik (Ogata,
1995). Menurut Kusuma, dkk., (2010), komponen aktif tumbuhan ini mempunyai
2.2 Flavonoid
Senyawa flavonoid adalah senyawa yang mengandung C15 terdiri atas dua
cincin aromatik yang dihubungkan oleh tiga satuan karbon (Sastrohamidjojo,
1996; Markham, 1988; Manitto, 1992). Golongan flavonoid dapat digambarkan
sebagai deretan senyawa C6-C3-C6. Artinya, kerangka karbonnya terdiri atas dua
gugus C6 disambungkan oleh rantai alifatik tiga-karbon (Robinson, 1995).
Gambar struktur kerangka dasar flavonoid dapat dilihat pada gambar 2.1.
Gambar 2.1. Struktur Kerangka dasar flavonoid
Flavonoid mempunyai cincin piran yang menghubungkan rantai
tiga-karbon dengan cincin benzen (Robinson, 1995). Setiap cincin diberi tanda: A, B
dan C; atom karbon dinomori dengan angka biasa pada cincin A dan C, serta
angka beraksen untuk cincin B (Markham, 1988). Gambar struktur flavonoid
dengan kerangka penomoran dapat dilihat pada gambar 2.2.
Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai
glikosida. Aglikon flavonoid mungkin saja terdapat dalam beberapa bentuk
kombinasi glikosida dalam satu tumbuhan, sehingga dalam menganalisis
flavonoid biasanya lebih baik bila kita memeriksa aglikon yang terdapat dalam
ekstrak tumbuhan yang telah dihidrolisis dari pada mengamati bentuk
glikosidanya yang rumit (Harborne, 1987). Menurut Robinson (1995), senyawa
flavonoid dapat dibedakan menjadi :
1. Flavon dan Flavonol
Flavon dan flavonol merupakan pigmen berwarna kuning yang tersebar
secara luas pada tumbuhan tinggi (Robinson, 1995; Tyler, et al., 1976). Flavon
sering terdapat sebagai glikosida. Aglikon flavonol yang umum, yaitu : kaemferol,
kuersetin dan mirisetin. Flavon juga terdapat sebagai glikosida tetapi jenis
glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Jenis yang
paling umum yaitu: 7-glukosida. Flavon berbeda dengan flavonol karena pada
flavon tidak terdapat gugus 3-OH. Hal ini mempengaruhi serapan UV, gerakan
kromatografi, serta reaksi warnanya, dan karena itu, flavon dapat dibedakan dari
flavonol berdasarkan ketiga sifat tersebut (Harborne, 1987). Gambar struktur
flavonoid dari flavon dan flavonol dapat dilihat pada gambar 2.3.
2. Isoflavon
Isoflavon merupakan golongan flavonoid yang langka dan umumnya
terdapat pada anak suku Leguminosae (Papilionoideae) (Harborne, 1987).
Beberapa isoflavon memberikan warna biru muda cemerlang dengan sinar UV
bila diuapi amonia, tetapi kebanyakan tampak sebagai bercak lembayung pudar
yang dengan amonia berubah menjadi coklat pudar (Harborne, 1987). Gambar
struktur flavonoid dari isoflavon dapat dilihat pada gambar 2.4.
Gambar 2.4. Struktur Isoflavon
3. Flavanon dan Flavanonol
Senyawa ini hanya terdapat dalam jumlah yang sedikit sekali jika
dibandingkan dengan golongan flavonoid lainnya. Kedua senyawa ini tidak
berwarna atau hanya kuning sedikit. Beberapa glikosida flavanon (atau
dihidroflavon) yang dikenal, yaitu: hesperidin dan naringin, sedangkan flavanonol
(atau dihidroflavonol) merupakan flavonoid yang paling kurang dikenal dan tidak
diketahui apakah senyawa ini terdapat sebagai glikosida (Robinson, 1995).
Gambar struktur flavonoid dari flavonon dan flavononol dapat dilihat pada
Gambar
2.5.a. Struktur Flavanon Gambar 2.5.b. Struktur Flavanonol
4. Antosianin
Antosianin merupakan zat warna yang paling penting dan tersebar paling
luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah
penyebab hampir semua warna merah jambu, merah marak, merah, merah
senduduk, ungu dan biru dalam daun, bunga dan buah pada tumbuhan tinggi
(Harborne, 1987; Bohm, 1998). Antosianin selalu terdapat sebagai glikosida dan
bila antosianin dihidrolisis dengan asam akan terbentuk antosianidin yang
merupakan aglikon dari antosianin (Robinson, 1995; Salisbury and Ross, 1995).
Antosianin yang paling umum, yaitu sianidin yang berwarna merah lembayung
(Harborne, 1987). Gambar struktur flavonoid dari antosianin dapat dilihat pada
gambar 2.6.
Gambar 2.6. Antosianidin
5. Auron dan Kalkon
Auron dan kalkon merupakan pigmen kuning yang bila dideteksi dengan
uap amonia akan menghasilkan warna jingga atau merah. Salah satu kalkon yang
umum, yaitu: butein, dan salah satu auron yang umum, yaitu: aureusidin.
Compositae (Harborne, 1987). Gambar struktur flavonoid dari auron dan kalkon
dapat dilihat pada gambar 2.7.
Gambar 2.7.a. Struktur Auron Gambar 2.7.b. Struktur Kalkon
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam
golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Diketahuinya senyawa
aktif yang dikandung oleh simplisia akan mempermudah pemilihan pelarut dan
cara ekstraksi yang tepat. Simplisia yang lunak seperti rimpang dan daun mudah
diserap oleh pelarut, karena itu pada proses ekstraksi tidak perlu diserbuk sampai
halus. Simplisia yang keras seperti biji, kulit kayu dan kulit akar susah diserap
oleh pelarut, karena itu perlu diserbuk sampai halus (Ditjen POM, 2000).
Metode ekstraksi menurut Ditjen POM (2000) ada beberapa cara, yaitu:
maserasi, perkolasi, refluks, sokletasi, digesti, infus dan dekok.
1. Maserasi
Maserasi adalah suatu cara penyarian simplisia dengan cara merendam
simplisia tersebut dalam pelarut dengan beberapa kali pengocokan atau
penambahan pelarut setelah dilakukan penyaringan maserat pertama dan
seterusnya. Keuntungan metode maserasi adalah prosedur dan peralatannya
sederhana (Agoes, 2007; Depkes, 1986; Ditjen POM, 2000; Syamsuni, 2006)).
2. Perkolasi
Perkolasi adalah suatu cara penyarian simplisia menggunakan perkolator
dimana simplisianya terendam dalam pelarut yang selalu baru dan umumnya
dilakukan pada temperatur kamar. Prosesnya terdiri dari tahapan pengembangan
bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak) terus-menerus sampai diperoleh ekstrak
(perkolat) (Ditjen POM, 2000; Syamsuni, 2006)).
Keuntungan metode perkolasi adalah proses penarikan zat berkhasiat dari
tumbuhan lebih sempurna, sedangkan kerugiannya adalah membutuhkan waktu
yang lama dan peralatan yang digunakan mahal (Agoes, 2007).
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya
dalam jangka waktu tertentu dimana pelarut akan terkondensasi menuju pendingin
dan kembali ke labu (Ditjen POM, 2000; Mayo, et al., 1955; Landgrebe, 1982).
4. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet dimana pelarut
akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi
sampel dan mengisi bagian tengah alat soklet. Tabung sifon juga terisi dengan
akan kembali ke dalam labu (Ditjen POM, 2000; Mayo, et al., 1955; Landgrebe,
1982).
5. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, umumnya dilakukan pada
suhu 40-60oC (Ditjen POM, 2000; Syamsuni, 2006).
6. Infundasi
Infus adalah ekstraksi dengan pelarut air pada temperatur 90oC selama
15-20 menit (Ditjen POM, 15-2000; Syamsuni, 15-2006; Anief, 15-2000).
7. Dekoktasi
Dekok adalah ekstraksi pada suhu 90oC- 98oC menggunakan pelarut air
selama 30 menit (Ditjen POM, 2000; Agoes, 2007).
2.4 Kromatografi Kertas
Kromatografi kertas merupakan metode kromatografi cair-cair (KCC)
dengan fase diam cair, biasanya air yang berada pada serabut kertas (Gritter, et al.,
1991). Metode ini merupakan jenis dari sistem partisi dimana fase gerak biasanya
merupakan campuran dari satu atau lebih pelarut-pelarut organik dan air. Kertas
yang digunakan pada percobaan awal adalah kertas Whatmann No.1, sedangkan
kertas Whatmann No.3 biasanya digunakan untuk pemisahan pada jumlah yang
lebih besar karena dapat menampung lebih banyak cuplikan (Sastrohamidjojo,
1985a).
Jenis-jenis fase gerak yang biasa digunakan pada analisis flavonoid antara
lain : BAA (n-butanol : asam asetat : air = 4 : 1 : 5), Forestal (asam asetat : air :
2), Bu/HCl (n-butanol : asam klorida 2 N = 1 : 1), asam klorida 1%, fenol (4 g) :
air (1 ml) (Markham, 1988; Harborne, 1987), TBA (t-butanol : asam asetat : air =
3 : 1 : 1), KAA (kloroform : asam asetat : air = 30 : 15 : 2), BEA (n-butanol :
etanol : air = 4 : 1 : 2,2), benzen : asam asetat : air (125 : 72 : 3), EPAA (etil asetat
: piridin : asam asetat : air = 36 : 36 : 7 : 21), air, asam asetat 5%, asam asetat
15%, asam asetat 50% dan BBPA (n-butanol : benzen : piridin : air = 5 : 1 : 3 : 3)
(Markham, 1988).
Adapun jenis penyemprot yang dapat digunakan pada analisis flavonoid
antara lain: larutan aluminium klorida 5% dalam metanol, larutan kompleks
difenil-asam borat-etanolamin 1% dalam metanol, asam sulfanilat yang
terdiazotasi, vanilin-asam klorida (Markham, 1988), uap amonia dan larutan besi
(III) klorida 1% dalam air (Harborne, 1987).
Hal-hal yang perlu diperhatikan pada saat melakukan pemisahan dengan
kromatografi kertas (Sastrohamidjojo, 1985a) :
1. Metode pemisahan (penaikan, penurunan atau mendatar).
2. Macam dari kertas.
3. Pemilihan dan pembuatan pelarut (fase gerak).
4. Kesetimbangan dalam bejana yang dipilih.
5. Pembuatan cuplikan.
6. Waktu pengembangan.
7. Metode deteksi dan identifikasi
Kromatografi kertas dapat dikembangkan dengan cara menaik, menurun,
dan mendatar.
1. Menaik
Pada kromatografi kertas menaik, ujung bawah kertas dicelupkan ke dalam
digantungkan pada bagian tutup bejana kromatografi dan fase gerak diletakkan di
bagian bawah bejana (Sastrohamidjojo, 1985a; Gritter, et al., 1991).
2. Menurun
Pemisahan zat dengan cara kromatografi kertas menurun dilakukan dengan
membiarkan fase gerak merambat turun pada kertas kromatografi (Depkes,
1979a).
Bejana yang digunakan berukuran lebih besar terbuat dari gelas, platina
atau logam tahan karat yang ditutup bagian atasnya untuk mencegah penguapan
dari pelarut, juga dilengkapi dengan wadah pelarut yang dipasang pada penopang.
Kertas kromatografi dicelupkan ke dalam pelarut dan diberi penahan dari batang
gelas agar tidak terlepas (Gritter, et al., 1991; Sastrohamidjojo, 1985a).
3. Mendatar
Pada metode ini, kertas dibentuk bulat dan di tengahnya diberi lubang
sebagai tempat untuk meletakkan sumbu yang terbuat baik dari gulungan kertas
atau benang. Fase gerak akan naik, membasahi kertas dan merambat melingkar
membawa senyawa yang dipisahkan (Sastrohamidjojo, 1985a).
Keuntungan dari kromatografi kertas adalah peralatan yang digunakan
sederhana dan mudah dalam pelaksanaan pemisahan (Harborne, 1987;
Sastrohamidjojo, 1985a). Selain itu, keterulangan Rf (retordation factor)
merupakan parameter yang berharga dalam memaparkan senyawa tumbuhan baru
(Harborne, 1987).
Harga Rf =
Bilangan Rf diperoleh dengan mengukur jarak antara titik awal dan pusat
bercak yang dihasilkan senyawa dibagi dengan jarak antara titik awal dan garis
batas pengembang. Bilangan ini terletak antara 0,01 dan 0,99 (Harborne, 1987).
2.5 Spektrofotometri Ultraviolet
Spektrum ultraviolet adalah suatu gambaran yang menyatakan hubungan
antara panjang gelombang atau frekuensi serapan terhadap intensitas serapan
(transmitasi atau absorbansi) (Sastrohamidjojo, 1985b). Apabila suatu molekul
menyerap radiasi ultraviolet, di dalam molekul tersebut terjadi perpindahan
tingkat energi elektron-elektron ikatan pada orbital molekul paling luar dari
tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi (Noerdin,
1985).
Spektrum ultraviolet senyawa biasanya diperoleh dengan melewatkan
cahaya berpanjang gelombang tertentu melalui larutan encer senyawa tersebut
dalam pelarut yang tidak menyerap, misalnya air, etanol dan heksana (Creswell, et
al., 1982).
Beberapa istilah dalam spektrofotometri ultraviolet menurut Noerdin
(1985) dan Silverstein, et al. (1981) antara lain :
1. Khromofor didefinisikan sebagai gugus fungsi yang menyerap radiasi di
daerah ultraviolet dekat dan daerah tampak, contoh : C=C, C≡C, C=O, NO2.
2. Auksokrom didefinisikan sebagai gugus fungsi yang mempunyai elektron
tidak berpasangan, tidak menyerap radiasi pada panjang gelombang lebih
besar dari 200 nm, dan bila terikat dengan gugus khromofor akan mengubah
3. Efek batokromik (pergeseran merah) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih panjang akibat terikat dengan gugus khromofor
atau efek pelarut.
4. Efek hipsokromik (pergeseran biru) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih pendek akibat terikat dengan gugus khromofor
atau efek pelarut.
5. Efek hiperkromik adalah peningkatan intensitas penyerapan.
6. Efek hipokromik adalah penurunan intensitas penyerapan.
Spektroskopi ultraviolet merupakan cara yang paling berguna untuk
menganalisis struktur flavonoid. Cara tersebut digunakan untuk membantu
mengidentifikasi jenis flavonoid dan menentukan pola oksigenasi. Selain itu,
kedudukan gugus hidroksil fenol bebas pada inti flavonoid dapat ditentukan
dengan menambahkan pereaksi geser ke dalam larutan cuplikan dan mengamati
pergeseran puncak serapan yang terjadi untuk menentukan kedudukan gula atau
metil yang terikat pada salah satu gugus hidroksil fenol.
Keuntungan utama cara ini adalah jumlah flavonoid yang diperlukan untuk
analisis sangat sedikit (biasanya sekitar 0,1 mg). Spektrum senyawa flavonoid
terdiri atas dua pita absorpsi maksimum, yaitu pita I pada rentang 300-550 nm dan
BAB III
METODOLOGI PENELITIAN 3.1 Alat dan Bahan
3.1.1 Alat-alat yang Digunakan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas, bejana
kromatografi (Dessaga), blender (Philips), eksikator, krus porselin, lampu UV 366
nm (Diamond), mikroskop cahaya, neraca kasar (Home Line), neraca listrik
(Vibra AJ), oven (Memmert), penangas air (Yenaco), rotary evaporator (Haake
D1), seperangkat alat penetapan kadar air, seperangkat alat refluks,
spektrofotometer ultraviolet (Shimadzu) dan tanur.
3.1.2 Bahan-bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah umbi dari
tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr). Bahan kimia yang
digunakan kecuali dinyatakan lain adalah berkualitas proanalisa, yaitu alfa-naftol,
aluminium (III) klorida, ammonium hidroksida, asam asetat, asam asetat
anhidrida, asam borat, asam klorida pekat, asam nitrat pekat, asam sulfat pekat,
benzen, besi (III) klorida, bismut (III) nitrat, butanol, etanol, eter, etilasetat,
n-heksan, iodium, isopropanol, kalium iodida, kloralhidrat, kloroform, metanol,
natrium asetat, natrium hidroksida, raksa (II) klorida, natrium pikrat, serbuk
magnesium, serbuk zinkum, timbal (II) asetat dan toluena, air suling, kertas
3.2 Pengambilan dan Pengolahan Sampel 3.2.1 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan sama dari daerah lain. Sampel yang digunakan
umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr), yang
diambil dari jalan Bunga Rampai V, Kelurahan Simalingkar B, Kecamatan Medan
Tuntungan, Kotamadya Medan, Provinsi Sumatera Utara.
3.2.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan Indonesia
(Indonesian Institute Biologi), Pusat Penelitian Biologi (Research Center for
Biology), Bogor.
3.2.3 Pengolahan Sampel
Umbi dari tumbuhan bawang sabrang yang segar dibersihkan dari kotoran
dengan cara mencucinya dengan air bersih, ditiriskan, kemudian ditimbang,
selanjutnya dirajang tipis dan dikeringkan dengan cara diangin-anginkan di udara
terbuka, terlindung dari sinar matahari langsung. Sampel dianggap kering bila
sudah rapuh (diremas menjadi hancur), selanjutnya ditimbang dan diserbuk
3.3 Pembuatan Larutan Pereaksi 3.3.1 Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dalam air suling hingga
100 ml (Depkes, 1979).
3.3.2 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida ditimbang, kemudian
dilarutkan dalam air suling hingga 100 ml (Depkes, 1979).
3.3.3 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
hingga 100 ml (Depkes, 1989).
3.3.4 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, kemudian sebanyak 2 g iodium dilarutkan dalam larutan kalium
iodida, setelah larut dicukupkan volume dengan air suling hingga 100 ml
(Depkes, 1995).
3.3.5 Pereaksi Dragendorff
Sebanyak 0,85 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam
100 ml asam asetat glasial, lalu ditambahkan 40 ml air suling. Pada wadah lain
dilarutkan 8 g kalium iodida dalam air suling, kemudian campurkan kedua larutan
sama banyak, lalu ditambahkan 20 ml asam asetat glasial dan diencerkan dengan
air suling hingga volume 100 ml (Zweig, 1987).
3.3.6 Pereaksi Mayer
Sebanyak 1,359 g raksa (II) klorida ditimbang, kemudian dilarutkan dalam
lalu dilarutkan dalam 10 ml air suling. Kemudian keduanya dicampur dan
ditambahkan air suling hingga 100 ml (Depkes, 1989).
3.3.7 Pereaksi Molish
Sebanyak 3 g alfa naftol ditimbang, kemudian dilarutkan dalam asam
nitrat 0,5 N hingga 100 ml (Depkes, 1979).
3.3.8 Pereaksi Timbal (II) Asetat 0,4 N
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbondioksida hingga 100 ml (Depkes, 1989).
3.3.9 Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrid dicampurkan dengan 1 bagian
asam sulfat pekat (Harborne, 1987).
3.3.10 Pereaksi Kalium Hidroksida 10%
Sebanyak 10 g kalium hidroksida ditimbang, kemudian dilarutkan dalam
etanol hingga 100 ml (Wagner, 1984).
3.3.11 Pereaksi Aluminium klorida 5%
Sebanyak 5 g aluminium klorida ditimbang, kemudian dilarutkan dalam
metanol hingga 100 ml (Depkes, 1989).
3.3.12. Pereaksi Asam sulfat 2 N
Asam sulfat pekat sebanyak 18 ml diencerkan dengan air suling
secukupnya hingga volume 100 ml (Depkes, 1989).
3.3.13. Fase gerak Butanol-Asam asetat-Air (BAA)
Sebanyak butanol 20 ml, asam asetat 5 ml, air suling 25 ml, diambil lapisan
3.3.14. Fase gerak Forestal
Sebanyak 30 ml asam asetat, air suling 10 ml, dan asam klorida 3 ml.
Perbandingan fase gerak 30: 10: 3 (Markham, 1988).
3.3.15. Pereaksi Asam asetat 50%
Asam asetat sebanyak 50 ml diencerkan dalam air suling hingga 100 ml,
dibiarkan selama 12 jam (Markham, 1988).
3.3.16. Pereaksi Asam asetat 15%
Asam asetat sebanyak 15 ml diencerkan dalam air suling hingga 100 ml,
dibiarkan selama 5 jam (Markham, 1988).
3.3.17. Pereaksi Asam klorida 1%
Asam klorida pekat sebanyak 2,7 ml diencerkan dalam air suling hingga
100 ml, dibiarkan selama 5 jam (Markham, 1988).
3.4 Pemeriksaan Makroskopik Umbi Bawang Sabrang 3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
simplisia umbi dari tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr).
3.5 Pemeriksaan Karakterisasi Simplisia 3.5.1 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi
toluen). Dimasukkan 200 ml toluen dan 2 ml air suling ke dalam labu alas bulat,
dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml. Kemudian ke
dalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang
seksama, dimasukkan kedalam labu dipanaskan hati-hati selama 15 menit. Setelah
toluen mendidih, kecepatan tetesan diatur sebanyak 2 tetes untuk tiap detik sampai
sebagian besar air terdestilasi, selanjutnya diatur 4 tetes tiap detik. Setelah semua
air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada
suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan
air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(World Health Organization, 1992).
% Kadar air = x100%
sampel berat awal volume akhir volume −
3.5.2 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam campuran
100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam
labu bersumbat sambil dikocok sesekali selama 6 jam, kemudian dibiarkan selama
18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering
dalam cawan dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada
suhu 105oC sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap
bahan yang telah dikeringkan diudara (Depkes, 1989).
% Kadar sari larut dalam air = x100%
3.5.3 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 95% dalam labu bersumbat sambil dikocok sesekali selama 6 jam,
kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC
sampai bobot tetap. Kadar sari larut dalam etanol 95% dihitung terhadap bahan
yang telah dikeringkan diudara (Depkes, 1989).
% Kadar sari larut dalam etanol = x100%
20 100 x (g) sampel berat (g) sari berat
3.5.4 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia ditimbang seksama dimasukkan dalam krus
porselin yang telah dipijar dan ditara lebih dahulu, kemudian diratakan. Krus
dipijarkan pada suhu 600ºC selama 3 jam, kemudian didinginkan dan ditimbang
sampai diperoleh bobot tetap. Kadar abu serbuk simplisia dihitung terhadap bahan
yang telah dikeringkan (Depkes, 1989).
% Kadar abu total = x100%
(g) sampel berat (g) abu berat
3.5.5 Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan
dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam
asam dikumpulkan, disaring melalui kertas saring bebas abu, kemudian dicuci
bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam
asam dihitung terhadap bahan yang dikeringkan (Depkes, 1989).
% Kadar abu tidak larut dalam asam = x100% (g)
sampel berat
(g) abu berat
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan Alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
(i). Ditambahkan 2 tetes pereaksi Mayer
(ii). Ditambahkan 2 tetes pereaksi Dragendorff
(iii). Ditambahkan 2 tetes pereaksi Bouchardat
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga
percobaan diatas (Depkes, 1995).
3.6.2 Pemeriksaan Flavonoid
Sebanyak 0,5 g serbuk simplisia ditimbang kemudian ditambahkan 10 ml
metanol, direfluks selama 10 menit, disaring panas-panas melalui kertas saring.
Filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambahkan 5 ml eter
minyak tanah, dikocok hati-hati, lalu diamkan sebentar. Lapisan metanol diambil,
diuapkan pada temperatur 40ºC, sisanya dilarutkan dalam 5 ml etilasetat, disaring.
Filtratnya digunakan untuk uji flavonoid dengan cara berikut:
(i). Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, kemudian ditambah 0,5 g serbuk Zn dan 2 ml asam klorida 2 N,
pekat. Jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan
adanya flavonoid.
(ii). Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, lalu ditambah 0,1 g serbuk Mg dan 10 tetes asam klorida pekat.
Jika terjadi warna merah jingga sampai warna merah ungu menunjukkan
adanya flavonoid (Depkes, 1989).
3.6.3 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia ditimbang kemudian disari dengan 30 ml
campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks
selama 1 jam, didinginkan dan disaring. Diambil 20 ml filrat ditambahkan 25 ml
air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3),
dilakukan berulang-ulang sebanyak 3 kali. Kumpulan sari air diuapkan pada
temperatur tidak lebih dari 50 C. Sisanya dilarutkan dalam 2 ml metanol. Larutan
sisa dimasukkan dalam tabung reaksi, selanjutnya diuapkan diatas penangas air.
Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi molish, kemudian secara
perlahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung. Glikosida
positif jika terbentuk cincin ungu pada batas kedua cairan (Depkes, 1995).
3.6.4 Pemeriksaan Saponin
Sebanyak 0.5 g serbuk simplisia ditimbang dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok
kuat-kuat selama 10 detik. Terbentuk busa setinggi 1-10 cm yang stabil tidak
kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida
3.6.5 Pemeriksaan Glikosida Antrakuinon
Sebanyak 0.2 g serbuk simplisia tambahkan dengan 5 ml asam sulfat 2 N,
dipanaskan, setelah dingin ditambahkan 10 ml benzen, dikocok dan didiamkan.
Lapisan benzen dipisahkan dan disaring. Kocok lapisan benzen dengan 2 ml
NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan benzen tidak
berwarna menunjukkan adanya antrakuinon (Depkes, 1989).
3.6.6 Pemeriksaan Glikosida Sianogenik
Sebanyak 0.5 g serbuk simplisia dimasukkan ke dalam erlenmeyer,
dilembabkan dengan air suling. Diselipkan kertas saring yang telah dibasahi
natrium pikrat pada mulut erlenmeyer, ditutup, dibiarkan terkena sinar matahari.
Jika kertas saring memberikan warna merah, menunjukkan adanya sianogenik
glikosida (Depkes, 1989).
3.6.7 Pemeriksaan Tanin
Sebanyak 0.5 g serbuk simplisia ditimbang, dididihkan selama 3 menit
dalam 10 ml air suling lalu didinginkan dan disaring. Filtrat diencerkan dengan air
suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1- 2 tetes
pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau
kehitaman menunjukkan adanya tanin (Farnsworth, 1966)
3.6.8 Pemeriksaan Terpenoid/Steroid
Sebanyak 1 g serbuk simplisia ditimbang, dimaserasi dengan 20 ml
n-heksan selama 2 jam, disaring, filtrat diuapkan dan dimasukkan kedalam 2
lubang pelat tetes masing-masing 3 tetes, kemudian menambahakan setetes asam
sulfat pekat dan setetes asam asetat anhidrida kedalam masing-masing pelat tetes,
asam asetat anhidrida menandakan adanya steroid, sedangkan bila terbentuk
warna merah atau merah ungu menandakan adanya terpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak
Sebanyak 650 g serbuk simplisia dimasukkan kedalam wadah berwarna
gelap, dimaserasi dengan pelarut etanol 80% sampai serbuk terendam sempurna
(Farnsworth, 1966). Kemudian ditutup dan dibiarkan selama 5 hari terlindung dari
cahaya, sambil sesekali diaduk, disaring dan dipisahkan ampasnya (Depkes,
1986). Kemudian ampas ditambahkan cairan penyari sampai terendam sebanyak
500 ml, kemudian dilakukan perlakuan yang sama sampai diperoleh maserat
jernih. Seluruh maserat digabungkan dan diuapkan menggunakan alat penguap
dengan bantuan alat rotary evaporator pada temperatur tidak lebih dari 40°C
sampai diperoleh ekstrak kental
Bagan Kerja Ekstraksi Serbuk Simplisia Umbi bawang Sabrang
Dimaserasi dengan etanol 80% selama 5 hari
diulangi sampai diperoleh maserat jernih
Dipekatkan dengan rotary evaporator hingga kental Simplisia Umbi bawang sabrang
Maserat Ampas
Ekstrak etanol kental
- Pemeriksaan makroskopik - PK Air
- PK Sari yang Larut dalam Air
- PK Sari yang Larut dalam Etanol
- PK Abu
- PK Abu yang Tidak Larut Skrining
3.8 Isolasi Senyawa Flavonoid dari Ekstrak Etanol
Ekstrak cair-cair senyawa flavonoid dari ekstrak etanol kental dilakukan
berturut-turut dengan menggunakan pelarut n-heksan, kloroform, dan etilasetat.
Ekstrak etanol dimasukkan kedalam corong pisah kemudian difraksinasi dengan
pelarut n-heksan: air (1:1), diperoleh fraksi n-heksan dan air. Fraksi n-heksan
dipisahkan, fraksi air difraksinasi kembali dengan kloroform : air (1:1), diperoleh
fraksi kloroform dan fraksi air. Fraksi kloroform dipisahkan, fraksi air dihidrolisis
dengan asam klorida pekat dan direfluks selama 5 jam. Fraksi air hasil hidrolisis
difraksinasi kembali dengan etilasetat (1:1), diperoleh fraksi etilasetat dan fraksi
air. Kedua hasil fraksi dipekatkan di atas penangas air sehingga diperoleh fraksi
etilasetat dan fraksi air.
Bagan Kerja Fraksinasi dari Ekstrak Etanol Kental
dipartisi dengan n-heksan: air (1:1)
Dipartisi dengan kloroform : air (1: 1)
Dihi
dihidrolisis dengan asam pekat selama 5 jam difraksinasi dengan etilasetat : air (1:1)
dipekatkan di atas penangas air Ekstrak etanol
kental
Fraksi
Fraksi air Fraksi kloroform
Fraksi air Fraksi etilasetat
Fraksi etilasetat
3.9 Analisis Fraksi Etilasetat dengan Cara Kromatografi Kertas (KKt)
Menurut (Markham, 1988), fraksi etilasetat dianalisis dengan KKt
masing-masing menggunakan fase gerak :
1. n-butanol : asam asetat : air (BAA) = 4 : 1 : 5; 2. asam asetat : air : asam klorida
(Forestal) = 30 : 10 : 3; 3. Asam asetat 50%; 4. Asam asetat 15%; 5. Asam
klorida 1%.
Fraksi etilasetat ditotolkan pada kertas Whatmann No. 1, kemudian
dimasukkan ke dalam bejana kromatografi yang telah dijenuhkan dengan uap fase
gerak BAA, Forestal, asam asetat 50%, asam asetat 15% dan asam klorida 1% dan
dielusi dengan jarak rambat 13 cm. Kemudian kertas diangkat dan dikeringkan,
diamati di bawah sinar lampu UV 366 nm, kemudian disemprot dengan penampak
bercak uap NH3, AlCl3 5% dan FeCl3 1%, kemudian diamati di bawah sinar
lampu UV 366 nm.
Bagan Kerja Fraksi Etilasetat dengan Cara Kromatografi Kertas (KKt)
DiKKt dengan fase gerak BAA, Forestal, asam asetat 50%, asam asetat 15%, asam klorida 1% dan fase diam dengan kertas whatmann No 1
Disemprot dengan Penampak bercak Uap NH3, AlCl3 5%, FeCl3 1% lalu
diamati dibawah sinar lampu UV 366 nm
Fraksi Etilasetat
3.10. Pemisahan Senyawa Flavonoid dari Fraksi Etilasetat dengan cara Kromatografi Kertas (KKt) Preparatif
Terhadap fraksi etilasetat dilakukan pemisahan secara KKt preparatif dengan
fase gerak asam asetat 50%, dan fase diam kertas whatmann No. 3. Fraksi
etilasetat yang telah ditotolkan berupa pita lebar kemudian dimasukkan ke dalam
bejana kromatografi yang telah dijenuhkan dengan fase gerak asam asetat 50%,
dielusi sampai garis tanda, selanjutnya kertas diangkat dan dikeringkan,diamati
dibawah sinar lampu UV 366 nm. Bercak diberi tanda dan digunting berupa pita
menjadi potongan-potongan kecil, dimaserasi dengan metanol selama 24 jam
sekali-kali dikocok dan disaring. Proses perendaman/pelarutan diulangi hingga
3 kali sampai semua senyawa flavonoid tersari sempurna, selanjutnya sari
dikumpulkan dan dipekatkan.
Bagan Kerja Isolasi Senyawa Flavonoid dari Fraksi Etilasetat dengan cara Kromatografi Kertas (KKt) Preparatif
Di KKt preparatif
FD kertas whatmann No.3 FG asam asetat 50%
Dimaserasi dengan metanol selama 24 jam kemudian disaring dan perlakuan sebanyak 3 kali
3.11 Uji Kemurnian terhadap Senyawa Flavonoid Hasil Kromatografi Kertas Preparatif
3.11.1 Uji kemurnian isolat hasil isolasi dengan KKt satu arah
Menggunakan berbagai fase gerak (BAA, Forestal, asam asetat 50%, asam
asetat 15% dan asam klorida 1%). Isolat ditotolkan pada kertas Whatmann No.1,
kemudian dimasukkan ke dalam bejana kromatografi yang masing-masing telah
dijenuhkan dengan uap fase gerak, dielusi sampai garis tanda, selanjutnya kertas
diangkat dan dikeringkan dan masing-masing diamati secara visual, di bawah
sinar lampu UV 366 nm, dengan penampak bercak AlCl3 5%/UV 366 nm dihitung
harga Rf-nya.
3.11.2. Uji kemurnian Isolat hasil isolasi dengan KKt dua arah
Menggunakan dua sistem fase gerak yaitu BAA sebagai fase gerak I, asam
asetat 50% sebagai fase gerak II dan asam asetat 50% sebagai fase gerak I,
Forestal sebagai fase gerak II. Isolat ditotolkan pada kertas Whatmann No.1, lalu
dimasukkan ke dalam bejana kromatografi yang telah jenuh dengan uap fase gerak
I, kemudian dielusi dengan jarak rambat 15 cm. Kertas diangkat dan setelah
kering dielusi kembali dengan fase gerak II dengan arah yang berbeda. Kertas
dikeluarkan, kemudian diamati di bawah sinar lampu UV 366 nm, dengan
Bagan kerja Uji Kemurnian senyawa Flavonoid Hasil Kromatografi Kertas Preparatif
Di KKt satu arah fase gerak - BAA
- Forestal
- As. Asetat 50% - As. Asetat 15%
- As. Klorida 1% Di KKt dua arah FG I BAA, As Asetat
50%
FG II Forestal, As. Asetat 50% PN AlCl3 5%
3.12 Identifikasi Senyawa Hasil Isolasi
Identifikasi senyawa isolat dilakukan dengan spektrofotometer ultraviolet
menggunakan pereaksi geser (shift reagent) (Markham, 1988; Mabry, 1970).
Cara kerja:
(i). Isolat dilarutkan dalam MeOH (larutan isolat), dimasukkan kedalam kuvet
dan kemudian diukur spektrumnya. Setelah diukur spektrumnya dalam
MeOH, ditambahkan tiga tetes larutan NaOH 2 N kedalam kuvet dan diukur
spektrumnya, kemudian setelah lima menit diukur kembali spektrumnya.
(ii). Larutan isolat ditambahkan enam tetes pereaksi AlCl3 5% dicampur dan
diukur spektrumnya. Selanjutnya ditambahkan tiga tetes HCl 6 N, dicampur
dan diukur spektrumnya.
Isolat murni Isolat
(iii). Larutan isolat ditambahkan serbuk NaOAc hingga kira-kira 2 mm lapisan
NaOAc pada dasar kuvet, dicampur lalu diukur spektrum. Ke dalam kuvet
ditambahkan H3BO3 kira-kira setengah dari NaOAc, dicampur, kemudian
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan oleh Pusat Penelitian dan
Pengembangan Biologi, LIPI Bogor, hasilnya disebutkan tumbuhan yang
digunakan adalah bawang sabrang (Eleutherine palmifolia (L.) Merr) suku
Iridaceae. Hasilnya identifikasi tumbuhan bawang sabrang dapat dilihat pada
Lampiran 1 halaman 60.
4.2 Hasil Pemeriksaan Makroskopik dari Umbi Bawang Sabrang
Hasil pemeriksaan makroskopik umbi dari tumbuhan bawang sabrang
segar berbentuk bulat telur memanjang, berwarna merah dan tidak berbau, serta
berasa pahit. Umbi lapis terdiri dari 5-6 lapisan dengan pangkal daun di tengahnya
dan biasanya memiliki panjang 4-5 cm dan diameter 1-3 cm, hasil ini sama
dengan tertera pada Heyne (1987) dan Depkes (1989). Gambar tumbuhan, umbi
dan simplisia umbi bawang sabrang dapat dilihat pada Lampiran 2 halaman 61.
4.3 Hasil Pemeriksaan Karakteristik Simplisia
Hasil pemeriksaan makroskopik simplisia adalah berwarna merah pucat
dan sangat rapuh. Pemeriksaan karakterisasi serbuk simplisia umbi dari tumbuhan
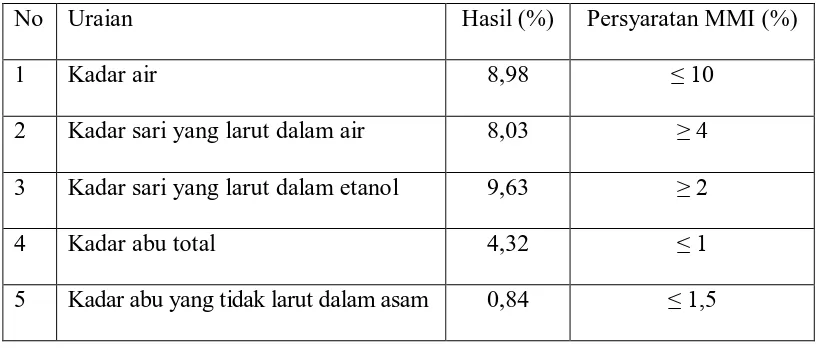
bawang sabrang (Eleutherine palmifolia (L.) Merr) diperoleh kadar air sebesar
8.98% menunjukkan serbuk simplisia memenuhi persyaratan penetapan kadar air
batasan minimal kandungan air simplisia karena air merupakan media yang baik
untuk pertumbuhan jamur dan mikroba. Kadar sari yang larut dalam air sebesar
8.03% menunjukkan serbuk simplisia memenuhi persyaratan yaitu lebih besar dari
4% (Depkes, 1980), tujuannya untuk mengetahui kandungan senyawa kimia yang
bersifat polar.
Kadar sari yang larut dalam etanol sebesar 9.54% menunjukkan serbuk
simplisia memenuhi persyaratan yaitu lebih dari 2% (Depkes, 1980), tujuannya
untuk mengetahui kandungan senyawa kimia terutama untuk senyawa yang larut
dalam air maupun etanol. Kadar abu total sebesar 4.41% tidak memenuhi
persyaratan MMI, yaitu kurang dari 1% (Depkes, 1980), tujuannya untuk
mengetahui mineral dan juga cemaran logam pada simplisia. Kadar abu total tidak
memenuhi persyaratan karena umbi bawang sabrang yang digunakan sebagai
sampel diperoleh dari dalam tanah, dimana tingginya kadar logam didalam tanah
(unsur-unsur hara) sehingga terjadi kontaminasi terhadap umbi. Untuk
mengurangi jumlah kontaminasi dapat dilakukan pengupasan kulit terluar.
Kadar abu larut dalam asam sebesar 0.84 ini menunjukkan serbuk
simplisia memenuhi persyaratan yaitu lebih kecil dari 1.5% (Depkes, 1980),
tujuannya untuk mengetahui bahan-bahan yang tidak larut asam. Perhitungan hasil
karakterisasi simplisia dapat dilihat pada Lampiran 3-7 halaman 62-66. Hasil
pemeriksaan karakterisasi dari serbuk simplisia umbi bawang sabrang terlihat
Tabel 4.1. Hasil Karakterisasi Serbuk Simplisia Umbi Bawang Sabrang
No Uraian Hasil (%) Persyaratan MMI (%)
1 Kadar air 8,98 ≤ 10
2 Kadar sari yang larut dalam air 8,03 ≥ 4
3 Kadar sari yang larut dalam etanol 9,63 ≥ 2
4 Kadar abu total 4,32 ≤ 1
5 Kadar abu yang tidak larut dalam asam 0,84 ≤ 1,5
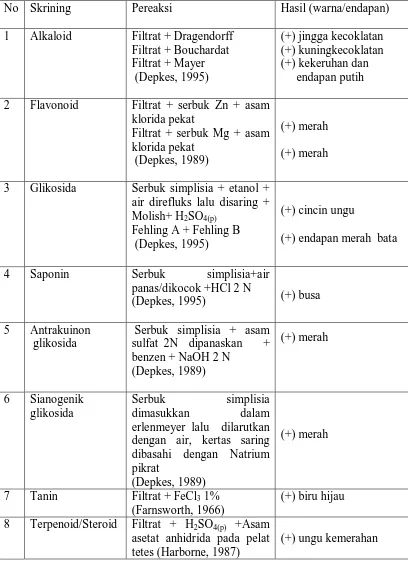
Pada serbuk simplisia umbi bawang sabrang yang ditambah dengan
pereaksi Dragendorff memberikan warna jingga kecoklatan, dengan pereaksi
Bouchardat memberikan warna kuning kecoklatan, sedangkan dengan pereaksi
Mayer terbentuk adanya kekeruhan dan endapan putih, menunjukkan adanya
senyawa alkaloid. Penambahan serbuk Mg ditambahkan dengan asam klorida
pekat memberikan warna merah dan serbuk Zn dengan asam klorida pekat
memberikan warna merah, menunjukkan adanya senyawa flavonoid. Glikosida
ditunjukkan dengan penambahan pereaksi Molish dan asam sulfat pekat dimana
terbentuk cincin ungu, sedangkan dengan penambahan Fehling A dan Fehling B
sama banyak terbentuk endapan berwa