SKRIPSI
FORMULASI SEDIAAN GEL ANTIOKSIDAN EKSTRAK ETANOL BAWANG SABRANG (Eleutherine palmifolia (L.) Merr.)
BERBASIS HPMC
OLEH:
AHMAD GAZALI SOFWAN NIM 071501014
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
FORMULASI SEDIAAN GEL ANTIOKSIDAN EKSTRAK ETANOL BAWANG SABRANG (Eleutherine palmifolia (L.) Merr.)
BERBASIS HPMC
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
AHMAD GAZALI SOFWAN NIM 071501014
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat ALLAH SWT atas segala
limpahan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan
penelitian dan penyusunan skripsi ini.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada
Ayahanda dan Ibunda yang telah memberikan cinta dan kasih sayang,
pengorbanan baik materi maupun motivasi serta doa tulus yang tidak pernah
berhenti, juga kepada abang dan kakak tersayang, serta keluarga besar atas semua
doa, kasih sayang, dan semangat yang telah diberikan.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara.
2. Bapak Drs. Gindo Haro, M.Sc., Ph.D, Apt., selaku penasihat akademik serta
seluruh Staf Pengajar Fakultas Farmasi USU yang telah banyak membimbing
dan mendidik penulis selama masa perkuliahan hingga selesai.
3. Ibu Dr. Julia Reveny, M.Si.,Apt., dan Bapak Drs. Muchlisyam, M.Si., Apt.,
selaku dosen pembimbing yang telah memberikan waktu, bimbingan, nasehat
selama penelitian hingga selsainya skripsi ini.
4. Ibu Dra. Saodah, M.Sc, Apt., Bapak Drs. Suryanto, M.Si, Apt., dan Ibu Dra.
Aswita Hafni Lubis, M.Si, Apt., selaku dosen penguji yang telah memberikan
saran, arahan, kritik dan masukan kepada penulis dalam penyelesainan skripsi
5. Ibu dan Bapak Kepala Laboratorium Farmasetika Dasar dan Laboratorium
Penelitian yang telah memberi petunjuk dan membantu selama penelitian.
6. Sahabat-sahabat terbaikku di Farmasi Klinis dan Komunitas 2007 terima kasih
atas segala perhatian dan kebersamaan selama ini.
7. Teman-teman seperjuangan Farmasi 2007, kakak, abang senior dan adik-adik
junoir Farmasi serta semua pihak yang telah banyak membantu selama masa
perkuliahan hingga selesainya penulisan skripsi ini.
Semoga Allah SWT memberikan karunia dan kesehatan kepada semua
pihak yang telah membantu penyelesaian skripsi ini.
Akhir kata, penulis menyadari bahwa tulisan ini masih belum sempurna.
Untuk itu penulis mengharapkan kritik dan saran yang membangun. Semoga
skripsi ini dapat memberikan sumbangan yang berarti bagi ilmu oengetahuan
khususnya bidang farmasi.
Medan, Februari 2011
Penulis,
ABSTRAK
Telah dilakukan pengujian aktivitas antioksidan terhadap ekstrak etanol dari umbi tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr) menggunakan metode peredaman radikal bebas DPPH (1,1-diphenyl-2-picrylhyrazil) dalam formulasi sediaan gel berbasis HPMC
Serbuk simplisia umbi bawang sabrang dimaserasi menggunakan pelarut etanol 80% selama 5 hari, kemudian dipisahkan dan ampas dimaserasi kembali. Seluruh maserat digabung, diserkai dan dienap tuangkan. Maserat yang diperoleh dipekatkan dengan bantuan rotary evaporator dan di freeze dryer (-400C). Terhadap ekstrak etanol yang diperoleh dilakukan uji aktivitas antioksidan menggunakan DPPH untuk meredam 50% aktivitas radikal bebas DPPH (IC50
Hasil uji aktivitas aktioksidan dari ekstrak umbi bawang sabrang (Eleutherine bulbus) dapat meredam radikal bebas DPPH dengan nilai (IC
) dengan mengukur absorbansi secara spektrofotometri Visibel. Selanjutnya ekstrak etanol umbi bawang sabrang diformulasi menjadi sediaan gel menggunaan HPMC dengan atau tanpa propilen glikol, kemudian dilakukan pengamatan secara visual, organoleptis dan pengukuran pH selama penyimpanan.
50) pada
menit ke 45, 50 dan 55 masing-masing sebesar 137,77, 137,62 dan 138,19 ppm, secara statistik dengan analisis ANAVA tidak terjadi perbedaan penurunan aktivitas yang bermakna. Hasil formulasi sediaan gel antioksidan menggunakan HPMC dengan atau tanpa propilen glikol memberikan warna, bau, dan konsistensi yang secara fisik tidak mengalami perubahan dan pH memenuhi persyaratan (5,0-6,0). Sediaan gel antioksidan dengan propilen glikol lebih stabil dibandingkan dengan gel tanpa propilen glikol namun masih dalam kisaran yang diperbolehkan.
ABSTRACT
The examination of antioxidant activity from ethanolic extract of bawang sabrang bulb (Eleutherine palmifolia (L.) Merr.) by DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenger method in gel formulation with HPMC has been carried out.
The powder of simplex from bawang sabrang bulb was macerated using ethanol 80% for 5 days, then separated and the pulp remaceration. Collecting all of the macerat, separated and wait for moment then pour it. The macerat was evaporated using rotary evaporator and freeze dryer (-40°C). The activity antioxidant of ethanol extract using DPPH for scavengering 50% of free radical activity of DPPH (IC50
The result of antioxidant activity from bawang sabrang bulb (Eleutherine bulb.) can be free radical scavenge of DPPH with value (IC
) with absorbance by visible spectrophotometry. The ethanol extract of bawang sabrang bulb was formulated become gel formulation using HPMC with or without propylen glycol, then visualization observation, organoleptics and pH measurement during storing.
50) at minute 45, 50
and 55 respectively at 137,77; 137,62 and 138,19 ppm, statistically with ANAVA analyses no differences decrease significantly in activity.
Key words: Gel, bawang sabrang, antioxidant, DPPH, , HPMC.
DAFTAR ISI
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 5
1.3 Hipotesis ... 5
1.4 Tujuan ... 5
BAB II. TINJAUAN PUSTAKA ... 6
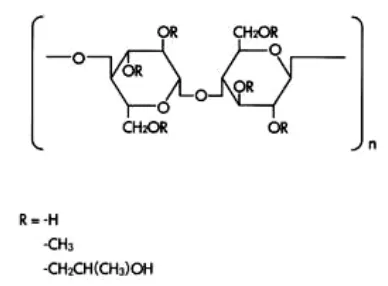
2.1 Gel ... 6
2.1.1 Hidroksi propil metilselulose (HPMC) ... 8
2.1.2 Propilen glikol ... 9
2.1.3 Metil Paraben ... 10
2.2 Kulit ... 11
2.2.2 pH kulit ... 13
2.3 Pemberian Obat Melalui Kulit ... 14
2.4 Proses Penuaan Kulit ... 15
2.5 Radikal Bebas ... 16
2.6 Antioksidan ... 16
2.7 Uraian Tumbuhan ... 18
2.7.1 Habitat ... 18
2.7.2 Sistematika tumbuhan ... 18
2.7.3 Nama daerah ... 19
2.7.4 Kandungan kimia ... 19
2.7.5 Khasiat dan kegunaan ... 19
2.8 Flavonoid ... 19
2.9 Ekstraksi ... 20
2.10 Spektroforometri UV-Visibel ... 22
2.11 Metode DPPH (1,1-diphenyl-2-picrylhydrazyl) ... 22
2.11.1 Pelarut ... 24
2.11.2 Pengukuran absorbansi – panjang gelombang ... 25
2.11.3 Waktu pengukuran ... 25
BAB III. METODOLOGI PENELITIAN ... 26
3.1 Alat ... 26
3.2 Bahan ... 26
3.3 Penyiapan Bahan Tumbuhan ... 26
3.3.2 Identifikasi tumbuhan ... 27
3.3.3 Pengelolahan sampel ... 27
3.4 Pembuatan Pereaksi ... 27
3.4.1 Etanol 80% ... 27
3.4.2 Larutan pereaksi DPPH 0,5 mM ... 28
3.5 Pembuatan Ekstrak ... 28
3.6 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel ... 28
3.6.1 Prinsip metode penangkapan radikal bebas DPPH ... 28
3.6.2 Pembuatan larutan blanko ... 29
3.6.3 Penentuan panjang gelombang Absorbansi maksimum DPPH dalam metanol ... 29
3.6.4 Penentuan operating time larutan DPPH dalam metanol ... 29
3.6.5 Pembuatan larutan induk sampel uji ... 29
3.6.6 Pembuatan larutan Uji ... 30
3.6.7 Penentuan persen peredaman ... 30
3.6.8 Penentuan IC50 3.7 Formula Dasar Gel ... 31
... 30
3.8 Formula Sediaan ... 32
3.9 Penentuan Mutu Fisik Sediaan ... 32
3.9.1 Uji organoleptis ... 32
3.9.2 Uji homogenitas ... 32
BAB IV. HASIL DAN PEMBAHASAN ... 34
4.1 Hasil Identifikasi Tumbuhan ... 34
4.2 Hasil Ekstraksi Serbuk Umbi Bawang Sabrang ... 34
4.2.1 Hasil penentuan panjang gelombang absorbansi maksimum DPHH ... 34
4.2.2 Hasil penentuan operating time larutan DPPH dalam metanol ... 35
4.3 Hasil Analisis Peredaman Radikal bebas DPPH oleh Sampel Uji ... 36
4.4 Analisis Nilai IC50 4.5 Hasil Penetapan Konsentrasi Formula Sediaan ... 42
(Inhibitory Concentration) Sampel Uji ... 39
4.6 Hasil Pengamatan Pembuatan Sediaan Gel Antioksidan ... 42
4.6.1 Hasil pengamatan secara visual ... 42
4.6.2 Hasil pengamatan secara organoleptis ... 43
4.6.3 Hasil pengamatan pH ... 45
BAB V. KESIMPULAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 48
DAFTAR TABEL
Tabel Halaman
1. Penggunaan propilen glikol dalam sediaan farmasi ... 10
2. Rancangan formula dasar gel ... 31
3. Rancangan formula sediaan gel antioksidan ekstrak bawang
sabrang ... 32
4. Hasil analisis peredaman radikal bebas oleh ekstrak etanol bawang sabrang ... 37
5. Hasil persamaan regresi linier yang diperoleh untuk ekstrak etanol bawang sabrang ... 40 6. Nilai IC50 ekstrak etanol umbi bawang sabrang ... 41
7. Hasil pengamatan sediaan gel secara visual... 43
8. Hasil pengamatan perubahan konsistensi, warna, dan bau sediaan gel ... 44
DAFTAR GAMBAR
7. Reaksi antara DPPH dengan atom H netral yang berasal dari antioksidan ... 25
8. Kurva absorbansi maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel ... 35
9. Kurva absorbansi operating time larutan DPPH dalam metanol ... 36
10. Hasil analisis aktivitas antioksidan sampel ekstrak etanol umbi bawang sabrang menit ke- 45 ... 38
11. Hasil analisis aktivitas antioksidan sampel ekstrak etanol umbi bawang sabrang menit ke- 50 ... 38
12. Hasil analisis aktivitas antioksidan sampel ekstrak etanol umbi bawang sabrang menit ke- 55 ... 39
13. Hasil regresi IC50 menit ke- 45 ... 40
ekstrak etanol umbi bawang sabrang 14. Hasil regresi IC50 menit ke- 50 ... 41
ekstrak etanol umbi bawang sabrang 15. Hasil regresi IC50 menit ke- 55 ... 41
ekstrak etanol umbi bawang sabrang 16. Hasil pengamatan pH penyimpanan sediaan gel dengan propilen glikol selama 28 hari ... 46
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi tumbuhan ... 53
2. Gambar tumbuhan dan umbi bawang sabrang ... 54
3. Gambar Spektrofotometer ... 55
4. Bagan ekstraksi simplisia bawang sabrang secara maserasi ... 56
5. Data absorbansi Operating Time DPPH dalam metanol ... 57
6. Hasil uji aktivitas antioksidan ekstrak umbi bawang sabrang ... 58
7. Data analisis Duncan ... 61
7. Perhitungan nilai IC50 8. Perhitungan Penentuan Dosis Pembuatan Gel ... 65
... 62
ABSTRAK
Telah dilakukan pengujian aktivitas antioksidan terhadap ekstrak etanol dari umbi tumbuhan bawang sabrang (Eleutherine palmifolia (L.) Merr) menggunakan metode peredaman radikal bebas DPPH (1,1-diphenyl-2-picrylhyrazil) dalam formulasi sediaan gel berbasis HPMC
Serbuk simplisia umbi bawang sabrang dimaserasi menggunakan pelarut etanol 80% selama 5 hari, kemudian dipisahkan dan ampas dimaserasi kembali. Seluruh maserat digabung, diserkai dan dienap tuangkan. Maserat yang diperoleh dipekatkan dengan bantuan rotary evaporator dan di freeze dryer (-400C). Terhadap ekstrak etanol yang diperoleh dilakukan uji aktivitas antioksidan menggunakan DPPH untuk meredam 50% aktivitas radikal bebas DPPH (IC50
Hasil uji aktivitas aktioksidan dari ekstrak umbi bawang sabrang (Eleutherine bulbus) dapat meredam radikal bebas DPPH dengan nilai (IC
) dengan mengukur absorbansi secara spektrofotometri Visibel. Selanjutnya ekstrak etanol umbi bawang sabrang diformulasi menjadi sediaan gel menggunaan HPMC dengan atau tanpa propilen glikol, kemudian dilakukan pengamatan secara visual, organoleptis dan pengukuran pH selama penyimpanan.
50) pada
menit ke 45, 50 dan 55 masing-masing sebesar 137,77, 137,62 dan 138,19 ppm, secara statistik dengan analisis ANAVA tidak terjadi perbedaan penurunan aktivitas yang bermakna. Hasil formulasi sediaan gel antioksidan menggunakan HPMC dengan atau tanpa propilen glikol memberikan warna, bau, dan konsistensi yang secara fisik tidak mengalami perubahan dan pH memenuhi persyaratan (5,0-6,0). Sediaan gel antioksidan dengan propilen glikol lebih stabil dibandingkan dengan gel tanpa propilen glikol namun masih dalam kisaran yang diperbolehkan.
ABSTRACT
The examination of antioxidant activity from ethanolic extract of bawang sabrang bulb (Eleutherine palmifolia (L.) Merr.) by DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenger method in gel formulation with HPMC has been carried out.
The powder of simplex from bawang sabrang bulb was macerated using ethanol 80% for 5 days, then separated and the pulp remaceration. Collecting all of the macerat, separated and wait for moment then pour it. The macerat was evaporated using rotary evaporator and freeze dryer (-40°C). The activity antioxidant of ethanol extract using DPPH for scavengering 50% of free radical activity of DPPH (IC50
The result of antioxidant activity from bawang sabrang bulb (Eleutherine bulb.) can be free radical scavenge of DPPH with value (IC
) with absorbance by visible spectrophotometry. The ethanol extract of bawang sabrang bulb was formulated become gel formulation using HPMC with or without propylen glycol, then visualization observation, organoleptics and pH measurement during storing.
50) at minute 45, 50
and 55 respectively at 137,77; 137,62 and 138,19 ppm, statistically with ANAVA analyses no differences decrease significantly in activity.
Key words: Gel, bawang sabrang, antioxidant, DPPH, , HPMC.
BAB I PENDAHULUAN 1.1Latar Belakang
Obat-obat sediaan topikal selain mengandung bahan berkhasiat juga
bahan tambahan (pembawa) yang berfungsi sebagai pelunak kulit, pembalut
pelindung, maupun pembalut penyumbat (Lachman, dkk., 1994). Salah satu bahan
pembawa yang biasa digunakan dalam sediaan topikal adalah gel yang dibuat dari
partikel anorganik maupun molekul organik (Ditjen POM, 1995).
Sediaan dalam bentuk gel banyak digunakan karena mudah mengering dan
membentuk lapisan film sehingga mudah dicuci. Bahan pembentuk gel yang biasa
digunakan adalah turunan selulosa seperti metil selulosa (CMC), karbomel dan
hidroksi propil metil selulosa (HPMC). HPMC dapat menghasilkan gel yang
netral, jernih, tidak berwarna dan tidak berasa, stabil pada pH 3 hingga 11,
mempunyai resistensi yang baik terhadap serangan mikroba serta memberikan
kekuatan film yang baik bila mengering pada kulit (Suardi, dkk., 2008)
Gel mempunyai beberapa keuntungan diantaranya tidak lengket,
mempunyai aliran tiksotropik dan pseudoplastik yaitu gel berbentuk padat apabila
disimpan dan akan segera mencair bila dikocok. Konsentrasi bahan untuk
membentuk massa gel yang baik dibutuhkan hanya sedikit, disamping itu
viskositas gel tidak mengalami perubahan yang berarti pada suhu penyimpanan
(Sihombing, dkk., 2009). Sediaan semipadat biasanya digunakan pada kulit dan
umumnya sediaan tersebut digunakan sebagai pelindung dari sinar ultraviolet
atau premature aging. Saat ini berbagai sediaan kosmetika perawatan kulit banyak
mengandung senyawa antioksidan. Disamping itu antioksidan diperlukan untuk
melindungi kulit dari pengaruh negatif akibat adanya radikal bebas (Rusdiana,
dkk., 2007).
Ciri utama dari antioksidan adalah kemampuannya untuk meredam radikal
bebas yang dapat bersifat destruktif, sangat reaktif dan mampu bereaksi dengan
makromolekul sel. Senyawa kimia yang digunakan untuk mencegah atau
memperlambat kerusakan akibat radikal bebas adalah senyawa antioksidan yang
memiliki peran sangat penting dalam kesehatan. Sumber antioksidan alami dapat
diperoleh dari biji-bijian, buah-buahan dan sayuran
Salah satu tumbuhan yang banyak digunakan oleh masyarakat khususnya
masyarakat Kalimantan Tengah sebagai obat adalah bawang sabrang (Eleutherine
palmifolia (L.) Merr), termasuk familia Iridaceae dan bagian yang digunakan
adalah umbinya. Tanaman ini sudah digunakan secara turun temurun oleh
masyarakat Dayak sebagai tanaman obat yang memiliki umbi berwarna merah.
Pada umbi bawang sabrang terkandung senyawa metabolit sekunder yakni
alkaloid, glikosida, flavanoid, steroid dan tanin yang merupakan sumber
biofarmaka yang berpotensial untuk dikembangkan sebagai tanaman obat modern
dalam kehidupan manusia. (Galingging, 2009; Purba, 2010; Banjarnahor, 2010). sedang yang termasuk
antioksidan sintetis antara lain adalah butil hidroksi anisol (BHA), butil hidroksi
Senyawa flavonoid memiliki sifat antioksidan sebagai penangkap radikal
bebas karena mengandung gugus hidroksil yang bersifat sebagai reduktor dan
dapat bertindak sebagai donor hidrogen terhadap radikal bebas. Senyawa ini
banyak terdapat didalam berbagai jenis tumbuhan terutama sayur-sayuran dan
buah-buahan sehingga dapat menurunkan resiko terserang penyakit kanker dan
jantung koroner (Silalahi, 2006).
Pengukuran aktivitas antioksidan dapat dilakukan dengan beberapa
metode di antaranya CUPRAC, DPPH, dan FRAP. Metode DPPH menggunakan
1,1-difenil-2-pikrilhidrazil sebagai sumber radikal bebas. Prinsip adalah reaksi
penangkapan hidrogen oleh DPPH dari zat antioksidan (Widyaastuti, 2010).
HPMC atau nama lainnya adalah hypromellose, methocel, hydroxy propil
methil cellulose, pharmacoat sering digunakan sebagai basis gel. Secara luas
HPMC digunakan sebagai suatu eksipien di dalam formulasi sediaan topikal dan
oral, juga dapat sebagai pengemulsi, agen pensuspensi, agen penstabil di dalam
sediaan salep dan gel (Wardani, 2009; Rowe., dkk, 2005)
Propilen glikol adalah salah satu bahan pembantu dalam formulasi sediaan
semi padat yang berfungsi sebagai pengawet, antimikroba, disinfektan, humektan,
solven, stabilizer untuk vitamin dan untuk kosolven bercampur dengan air.
Propilen glikol yang digunakan sebagai penahan lembab dalam konsentrasi dari
10-20% (Voight, 1994; Rowe., dkk, 2005).
Berdasarkan hal di atas maka peneliti ingin menguji aktifitas dari ekstrak
etanol umbi bawang sabrang ((Eleutherine palmifolia (L.) Merr) sebagai
1.2 Perumusan Masalah
1. Apakah ekstrak dari umbi bawang sabrang dapat bertindak sebagai antioksidan
dengan menentukan kadarnya secara spektrofotometri sinar tampak?
2. Apakah ada pengaruh waktu peredaman terhadap kemampuan ekstrak umbi
bawang sabrang bertindak sebagai antioksidan.
3. Apakah ekstrak dari umbi bawang sabrang dapat diformulasikan dalam bentuk
sediaan gel?
4. Apakah ada perbedaan formulasi sediaan gel menggunakan propilen glikol dan
tanpa propilen glikol?
1.3 Hipotesis
1. Ekstrak umbi bawang sabrang dapat bertindak sebagai antioksidan.
2. Ada pengaruh perbedaan waktu peredaman terhadap kemampuan ekstrak umbi
bawang sabrang sebagai antioksidan.
3. Penggunaan basis gel dan cara formulasi yang tepat, maka ekstrak dari umbi
bawang sabrang diformulasi dalam bentuk sediaan gel.
4. Formulasi sediaan gel menggunakan propilen glikol dan tanpa propilen glikol
1.4 Tujuan
1. Untuk mengetahui ekstrak umbi bawang sabrang dapat bertindak sebagai
antioksidan.
2. Untuk mengetahui pengaruh waktu peredaman terhadap kemampuan ekstrak
umbi bawang sabrang.
3. Untuk membuat formula sediaan gel antioksidan ekstrak umbi bawang
sabrang dengan basis HPMC.
4. Untuk membandingkan sediaan gel ekstrak umbi bawang sabrang dengan atau
BAB II
TINJAUAN PUSTAKA 2.1. Gel
Gel umumnya merupakan suatu sediaan semipadat yang jernih, tembus
cahaya dan mengandung zat aktif, merupakan dispersi koloid mempunyai
kekuatan yang disebabkan oleh jaringan yang saling berikatan pada fase
terdispersi (Ansel, 1989). Zat-zat pembentuk gel digunakan sebagai pengikat
dalam granulasi, koloid pelindung dalam suspensi, pengental untuk sediaan oral
dan sebagai basis supositoria. Secara luas sediaan gel banyak digunakan pada
produk obat-obatan, kosmetik dan makanan juga pada beberapa proses industri.
Pada kosmetik yaitu sebagai sediaan untuk perawatan kulit, sampo, sediaan
pewangi dan pasta gigi (Herdiana, 2007).
Makromolekul pada sediaan gel disebarkan keseluruh cairan sampai tidak
terlihat ada batas diantaranya, disebut dengan gel satu fase. Jika masa gel terdiri
dari kelompok-kelompok partikel kecil yang berbeda, maka gel ini
dikelompokkan dalam sistem dua fase (Ansel, 1989). Polimer-polimer yang biasa
digunakan untuk membuat gel-gel farmasetik meliputi gom alam tragakan, pektin,
karagen, agar, asam alginat, serta bahan-bahan sintetis dan semisintetis seperti
metil selulosa, hidroksietilselulosa, karboksimetilselulosa, dan karbopol yang
merupakan polimer vinil sintetis dengan gugus karboksil yang terionisasi. Gel
dibuat dengan proses peleburan, atau diperlukan suatu prosedur khusus berkenaan
Dasar gel yang umum digunakan adalah gel hidrofobik dan gel hidrofilik.
1. Dasar gel hidrofobik
Dasar gel hidrofobik umumnya terdiri dari partikel-partikel anorganik, bila
ditambahkan ke dalam fase pendispersi, hanya sedikit sekali interaksi antara
kedua fase. Berbeda dengan bahan hidrofilik, bahan hidrofobik tidak secara
spontan menyebar, tetapi harus dirangsang dengan prosedur yang khusus (Ansel,
1989).
2. Dasar gel hidrofilik
Dasar gel hidrofilik umumnya terdiri dari molekul-molekul organik yang
besar dan dapat dilarutkan atau disatukan dengan molekul dari fase pendispersi.
Istilah hidrofilik berarti suka pada pelarut. Umumnya daya tarik menarik pada
pelarut dari bahan-bahan hidrofilik kebalikan dari tidak adanya daya tarik menarik
dari bahan hidrofobik. Sistem koloid hidrofilik biasanya lebih mudah untuk dibuat
dan memiliki stabilitas yang lebih besar (Ansel, 1989). Gel hidrofilik umummnya
mengandung komponen bahan pengembang, air, humektan dan bahan pengawet
(Voigt, 1994).
Keuntungan sediaan gel :
Beberapa keuntungan sediaan gel (Voigt, 1994) adalah sebagai berikut:
- kemampuan penyebarannya baik pada kulit
- efek dingin, yang dijelaskan melalui penguapan lambat dari kulit
- tidak ada penghambatan fungsi rambut secara fisiologis
- kemudahan pencuciannya dengan air yang baik
Tingginya kandungan air dalam sediaan gel dapat menyebabkan terjadinya
kontaminasi mikrobial, yang secara efektif dapat dihindari dengan penambahan
bahan pengawet. Untuk upaya stabilisasi dari segi mikrobial di samping
penggunaan bahan-bahan pengawet seperti dalam balsam, khususnya untuk basis
ini sangat cocok pemakaian metil dan propil paraben yang umumnya disatukan
dalam bentuk larutan pengawet. Upaya lain yang diperlukan adalah perlindungan
terhadap penguapan yaitu untuk menghindari masalah pengeringan. Oleh karena
itu untuk menyimpannya lebih baik menggunakan tube. Pengisian ke dalam botol,
meskipun telah tertutup baik tetap tidak menjamin perlindungan yang memuaskan
(Voigt, 1994).
2.1.1 Hidroksi propil metilselulose (HPMC)
HPMC merupakan turunan dari metilselulosa yang memiliki ciri-ciri
serbuk atau butiran putih, tidak memiliki bau dan rasa. Sangat sukar larut dalam
eter, etanol atau aseton. Dapat mudah larut dalam air panas dan akan segera
menggumpal dan membentuk koloid. Mampu menjaga penguapan air sehingga
secara luas banyak digunakan dalam aplikasi produk kosmetik dan aplikasi
lainnya (Anonim, 2006; Rowe., dkk, 2005).
HPMC digunakan sebagai agen pengemulsi, agen pengsuspensi, dan
sebagai agen penstabil pada sediaan topikal seperti gel dan salep. Sebagai koloid
pelindung yaitu dapat mencegah tetesan air dan partikel dari penggabungan atau
aglomerasi, sehingga menghambat pembentukan sedimen (Rowe., dkk, 2005).
HPMC melarut sangat lambat dan sulit, metode yang disarankan sebagai
berikut (Anonim, 2006):
1) Sediakan air panas
2) Tambahkan air panas lebih dari 80oC sebanyak 1/3 atau 2/3 kali dari jumlah
HPMC, sebab HPMC mudah larut dalam air panas dan HPMC di sebar merata
pada permukaan air panas. Tambahkan sisa air dingin, aduk dan dinginkan
campuran.
2.1.2. Propilen glikol
3) Tambahkan pelarut organik seperti etanol, propilen glikol atau minya sebagai
peningkat kelarutan, lalu tambahkan air dapat menyebabkan HPMC
benar-benar larut.
Propilen glikol banyak digunakan sebagai pelarut dan pembawa dalam
pembuatan sediaan farmasi dan kosmetik, khususnya untuk zat-zat yang yang
tidak stabil atau tidak dapat larut dalam air. Propilen gilkol adalah cairan bening,
tidak berwarna, kental, dan hampir tidak berbau. Memiliki rasa manis sedikit
tajam menyerupai gliserol. Dalam kondisi biasa, propilen glikol stabil dalam
wadah yang tertutup baik dan juga merupakan suatu zat kimia yang stabil bila
sebagai penghambat pertumbuhan jamur. Data klinis telah menunjukkan reaksi
iritasi kulit pada pemakaian propilen glikol dibawah 10% dan dermatitis dibawah
2% (Lodėn, 2009).
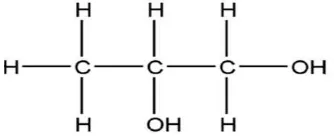
Gambar 2. Rumus Bangun Propilen glikol (Rowe., dkk, 2005).
Propilen glikol telah banyak digunakan sebagai pelarut dan pengawet
dalam berbagai formulasi parenteral dan nonparenteral. Propilen glikol secara
umum merupakan pelarut yang lebih baik dari gliserin dan dapat melarutkan
berbagai bahan, seperti kortikosteroid, fenol, obat-obatan sulfa, barbiturat, vitamin
A dan D, alkaloid, dan banyak
Tabel 1. Penggunaan propilen glikol dalam sediaan farmasi.
anestesi lokal (Tabel 1) (Rowe., dkk, 2005).
Penggunaan Bentuk sediaan Konsentrasi %
Humektan Topikal ≈ 15
Pengawet Larutan, Semisolid 15-30
Pelarut Aerosol 10-30
Larutan oral 10-25
Parenteral 10-60
Topikal 5-80
2.1.3. Metil paraben
Metil paraben memiliki ciri-ciri serbuk hablur halus, berwarna putih,
hampir tidak berbau dan tidak mempunyai rasa kemudian agak membakar diikiuti
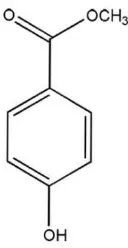
Gambar 3. Rumus Bangun Metil Paraben (Rowe., dkk, 2005).
Metil paraben banyak digunakan sebagai pengawet dan antimikroba dalam
kosmetik, produk makanan, dan formulasi farmasi dan digunakan baik sendiri
atau dalam kombinasi dengan paraben lain atau dengan antimikroba lain. Pada
kosmetik, metil paraben adalah pengawet antimikroba yang paling sering
digunakan. Jenis paraben lainnya efektif pada kisaran pH yang luas dan memiliki
aktivitas antimikroba yang kuat. Metil paraben meningkatkan aktivitas
antimikroba dengan panjangnya rantai alkil, namun dapat menurunkan kelarutan
terhadap air, sehingga paraben sering dicampur dengan bahan tambahan yang
berfungsi meningkatkan kelarutan. Kemampuan pengawet metil paraben
ditingkatkan dengan penambahan propilen glikol (Rowe., dkk, 2005).
2.2. Kulit
Kulit merupakan suatu organ besar yang berlapis-lapis, menutupi permukaan lebih dari 20.000 cm2 yang mempunyai bermacam-macam fungsi dan
kegunaan. Merupakan jaringan pelindung yang lentur dan elastis, melindungi
seluruh permukaan tubuh dan mempunyai berat 5% dari total berat badan. Secara
dibagi dalam tiga lapisan jaringan yaitu: epidermis, dermis dan hipodermis
(Lachman., dkk, 1994).
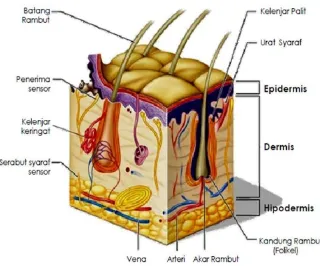
Gambar 4. Penampang Kulit (Tortora, 1986).
Lapisan Eidermis
Epidermis merupakan bagian terluar yang dibentuk oleh epitelium dan
terdiri dari sejumlah lapisan sel yang disusun atas dua lapisan yang jelas tampak,
yaitu selapis lapisan tanduk dan selapis zona germinalis. Pada epidermis tidak
ditemukan pembuluh darah, sehingga nutrisi diperoleh dari transudasi cairan pada
dermis karena banyaknya jaringan kapiler pada papila (Lachman., dkk, 1994;
Lapisan Dermis
Dermis atau korium tersusun atas jaringan fibrus dan jaringan ikat yang elastik.
Pada permukaan dermis tersusun papila-papila kecil yang berisi pembuluh darah
kapiler. Tebal lapisan dermis kira-kira 0,3-1,0 mm. Dermis merupakan jaringan
penyangga berserat yang berperan sebagai pemberi nutrisi pada epidermis
(Lachman., dkk, 1994; Junqueira dan Kelley, 1997).
Hipodermis
Hipodermis yaitu bukan merupakan bagian dari kulit, tetapi batasnya tidak
jelas. Kedalaman dari hipodermis akan mengatur kerutan-kerutan dari kulit
(Lachman., dkk, 1994; Junqueira dan Kelley, 1997).
2.2.1. Fungsi kulit
Kulit menutupi dan melindungi permukaan tubuh dan bersambung dengan
selaput lendir yang melapisi rongga-rongga dan lubang-lubang masuk. Kulit
mempunyai banyak fungsi yaitu di dalamnya terdapat ujung saraf peraba,
embantu mengatur suhu dan mengendalikan hilangnya air dari tubuh, juga
mempunyai sedikit kemampuan ekstori, sekretori dan absorbsi (Pearce, 2004).
2.2.2 pH kulit
Kulit merupakan organ terbesar yang meliputi bagian luar dari seluruh
tubuh dan juga membentuk pelindung tubuh terhadap lingkungan. Bagian luar
yang kuat dan kering menandakan sifat fisik kulit. Morfologi dan ketebalan kulit
berbeda pada setiap bagian tubuh. Kulit mempertahankan karakterisasi
fisikokimia seperti struktur, suhu, pH dan keseimbangan oksigen dan
tahun 1982 dan kemudian disahkan oleh Schade dan Marchionini pada tahun
1928, yang dianggap bahwa keasaman digunakan sebagai pelindung dan
menyebutnya sebagai “pelindung asam“ dan beberapa literatur saat ini
menyatakan bahwa pH permukaan kulit sebagian besar asam antara 5,4 dan 5,9.
Sebuah variasi permukaan pH kulit terjadi pada setiap orang karena tidak
semua permukaan kulit orang terkena kondisi yang sama seperti perbedaan cuaca.
Banyak penelitian menyatakan bahwa pH kulit alami adalah pada rata-rata 4,7 dan
sering dilaporkan bahwa pH kulit antara 5,0 dan 6,8. pH permukaan kulit tidak
hanya bervariasi di lokasi yang berbeda, tetapi juga dapat mempengaruhi profil
pH di stratum korneum (Ansari., dkk, 2009).
2.3 Pemberian Obat Melalui Kulit
Tujuan umum penggunaan obat pada terapi dermatologi adalah untuk
menghasilkan efek terapetik pada tempat-tempat spesifik di jaringan epidrrmis.
Absorbsi perkutan didefinisikan sebagai absorbsi yang dapat menembus lapisan
stratum korneum (lapisan tanduk) dan berlanjut menembus lapisan di bawahnya
dan akhirnya masuk ke sirkulasi darah (Lachman., dkk, 1994).
Absorbsi perkutan suatu obat umumnya disebabkan oleh penetrasi obat
melalui stratum korneum yang terdiri dari kurang lebih 40% protein (pada
umumnya keratin) dan 40% air dengan lemak berupa trigliserida, asam lemak
bebas, kolesterol dan fosfat lemak. Stratum korneum sebagai jaringan keratin akan
berlaku sebagai membran buatan yang semi permiabel, dan molekul obat
mempenetrasi dengan cara difusi pasif, jadi jumlah obat yang pindah menyebrangi
mempunyai sifat larut dalam keduanya, minyak dan air, merupakan bahan yang
baik untuk difusi melalui stratum korneum seperti juga melalui epidermis dan
lapisan-lapisan kulit (Ansel, 1989)
Prinsip absorbsi obat melalui kulit adalah difusi pasif yaitu proses dimana
suatu substansi bergerak dari daerah suatu sistem ke daerah lain dan terjadi
penurunan kadar gradien yang diikuti bergeraknya molekul. Difusi pasif
merupakan bagian terbesar dari proses trans-membran bagi umumnya obat. Daya
dorong untuk difusi pasif ini adalah perbedaan konsentrasi obat pada kedua sisi
membran sel. Difusi obat berbanding lurus dengan konsentrasi obat, koefisien
difusi, viskositas dan ketebalan membran. Disamping itu difusi pasif dipengaruhi
oleh koefisien pasrtisi, yaitu semakin besar koefisien pastisi maka semakin cepat
difusi obat (Martin., dkk, 1993).
2.4 Proses Penuaan Kulit
Sejumlah penelitian telah dilakukan dalam upaya untuk menjelaskan
biokimia dan mekanisme molekuler penuaan. Proses biokimia yang mendasari
proses penuaan pertama sekali diperkenalkan pada tahun 1956 dengan teori
penuaan radikal bebas. Teori ini menyatakan bahwa kerusakan oksidatif pada
DNA dan komponen sel lain adalah faktor utama terjadinya penuaan. Penelitian
terbaru menyatakan bahwa mitokondria adalah sumber utama spesies reaktif
oksigen (ROS) yang menyebabkan kerusakan oksidatif. Gagasan bahwa
mitokondria rusak dengan berjalannya waktu bertanggungjawab atas penuaan
fenotipe melalui terganggunya produksi energi dan produksi ROS yang berlebihan
2.5 Radikal Bebas
Pada proses metabolisme normal, tubuh memproduksi partikel kecil
dengan tenaga besar disebut sebagai radikal bebas. Atom atau molekul dengan
elektron bebas ini dapat digunakan untuk menghasilkan tenaga dan beberapa
fungsi fisiologis seperti kemampuan untuk membunuh virus dan bakteri. Namun
oleh karena mempunyai tenaga yang sangat tinggi, zat ini juga dapat merusak
jaringan normal apabila jumlahnya terlalu banyak. Radikal bebas dapat
mengganggu produksi DNA, lapisan lipid pada dinding sel, mempengaruhi
pembuluh darah, dan produksi prostaglandin. Radikal bebas juga dijumpai pada
lingkungan, beberapa logam (misalnya besi, tembaga), asap rokok, polusi udara,
obat, bahan beracun, makanan dalam kemasan, bahan aditif, dan sinar ultraviolet
dari matahari maupun radiasi (Putra, 2008).
2.6 Antioksidan
Antioksidan adalah zat yang dapat menetralkan radikal bebas sehingga
atom dengan elektron yang tidak berpasangan mendapat pasangan elektron.
Antioksidan berfungsi mengatasi atau menetralkan radikal bebas dan melindungi
tubuh dari beragam penyakit termasuk penyakit degeneratif pada usia lanjut
seperti arteriosklerosis. Senyawa yang bersifat antioksidan banyak terdapat dalam
sayur mayur, buah-buahan segar dan rempah-rempah. Hasil penelitian ilmiah
menunjukan bahwa buah-buahan, sayuran, biji-bijian merupakan sumber
antioksidan yang baik dan dapat mencegah reaksi berantai radikal bebas dan
tubuh. Sayur mayur banyak mengandung antioksidan karena adanya vitamin C,
Di bidang dermatologi, antioksidan adalah bahan yang banyak digunakan
dan inovatif dalam sediaan topikal. Antioksidan yang paling penting adalah
vitamin E, vitamin C, tiol dan flavonoid. Tubuh terus terkena radikal bebas yang
berasal dari sumber endogen sebagai akibat dari jalur metabolisme normal.
Radikal bebas yang berasal dari sumber eksogen timbul dari polusi
lingkingan seperti asap, kabut asap, radiasi UV dan diet. Efek dari antioksidan
sistemik yaitu menghancurkan spesies oksigen reaktif, mencegah kerusakan
makromolekul seperti lipid, DNA dan protein. Biasanya ada keseimbangan ketat
antara radikal bebas dan produksi antioksidan, namun dalam kondisi tertentu
keseimbangan bisa berpihak pada radikal bebas dan dikenal dengan “stres
oksidatif”. Stress oksidatif dapat disebabkan oleh peningkatan jumlah radikal
bebas, misalnya akibat dari merokok, radiasi UV, atau karena kekurangan
antioksidan penting (Weber., dkk, 2009)
Menurut (Anies, 2009), antioksidan tubuh dikelompokkan menjadi 3
yakni:
(1). Antioksidan primer, bekerja untuk mencegah pembentuk senyawa radikal
baru menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas
ini sempat bereaksi. Contohnya: enzim SOD yang berfungsi sebagai pelindung
hancurnya sel-sel dalam tubuh serta mencegah proses peradangan karena radikal
bebas. Enzim SOD sebenarnya sudah ada dalam tubuh kita, namun kerjanya
membutuhkan zat-zat gizi mineral seperti mangan, seng, tembaga dan selenium
penyakit degeneratif, mineral-mineral tersebut hendaknya tersedia cukup dalam
makanan yang dikonsumsi setiap hari.
(2) Antioksidan sekunder, berfungsi menangkap senyawa serta mencegah
terjadinya reaksi berantai. Contoh: vitamin E, vitamin C, betakaroten, asam urat,
bilirubin, dan albumin.
(3) Antioksidan tersier, memperbaiki kerusakan sel-sel dan jaringan yang
disebabkan radikal bebas. Contoh: enzim metionin sulfoksidan reduktase untuk
memperbaiki DNA pada inti sel.
2.7 Uraian Tumbuhan 2.7.1 Habitat
Bawang sabrang (Eleutherine palmifolia (L.) Merr ) merupakan tumbuhan
yang berasal dari pulau Kalimantan Tengah (Galingging, 2009). Bawang ini
banyak terdapat pada lahan yang kaya akan belerang pada ketinggian 600–2000
meter dari permukaan laut (Stewart, 2011).
2.7.2 Sistematika tumbuhan
Sistematika tumbuhan bawang sabrang (Tjitrosoepomo, 2007) adalah
sebagai berikut :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Monocotyledoneae
Bangsa : Liliales
Suku : Iridaceae
Jenis : Eleutherine palmifolia
Sinonim : Eleutherine americana
2.7.3 Nama daerah
Nama daerah dari tumbuhan bawang sabrang adalah sebagai berikut :
bawang dayak, bawang hantu (Kalimantan Tengah) (Galingging, 2009), bawang
kapal (Sumatera), brambang sabrang, luluwan sapi, teki sabrang, bebawangan
beureum, bawang siem (Jawa) (Depkes, 1985).
2.7.4 Kandungan kimia
Bawang sabrang mengandung senyawa-senyawa yang meliputi alkaloid,
glikosida, flavonoid, fenolik, steroid, triterpenoid dan tanin (Galingging, 2009).
2.7.5 Khasiat dan kegunaan
Secara empiris bawang dayak sudah dipergunakan masyarakat lokal
sebagai obat berbagai jenis penyakit seperti kanker payudara, obat penurun darah
tinggi (hipertensi), penyakit kencing manis (diabetes melitus), menurunkan
kolesterol, obat bisul, kanker usus dan mencegah stroke (Galingging, 2009).
2.8 Flavonoid
Flavonoid adalah senyawa kimia yang tersebar luas diseluruh bagian
tumbuhan seperti pada korteks, akar, daun, bunga dan buah-buahan. Selain
berperan sebagai fotoproteksi juga sebagai kontribusi warna tanaman.
Flavonoid telah digunakan dalam pengobatan tradisional selama beberapa
abad dan diakui sebagai polifenol tanaman yang bersifat sebagai antioksidan yang
sangat kuat. Mengingat struktur polifenolnya, kemampuan menyumbangkan
elektron dan hidrogen terhadap radikal bebas adalah fitur utama dari sifat
antioksidan (Weber., dkk, 2009).
Efek flavonoid terhadap macam-macam organisme sangat banyak
macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung
flavonoid dipakai dalam pengobatan tradisional. Aktivitas antioksidan flavonoid
tertentu merupakan komponen aktif tumbuhan yang digunakan secara tradisional
untuk mengatasi gangguan fungsi hati. Flavonoid tertentu dalam makanan
tampaknya menurunkan agregasi platelet dan dengan demikian mengurangi
pembekuan darah, tetapi jika dipakai pada kulit, flavonoid menghambat
pendarahan (Robinson, 1995).
2.9 Ekstraksi
Ekstrasi adalah kegiatan penarikan kandungan senyawa kimia yang dapat
larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair
(Depkes, 2000).
Beberapa metode ekstraksi dengan menggunakan pelarut yaitu: (Depkes, 2000)
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan pengadukan pada temperatur kamar. Maserasi yang
yang dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan
terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian semplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap
perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak)
terus-menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan.
3. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
4. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan
pada temperatur 40-50⁰C.
5. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
selalu baru, dilakuakan menggunakan alat soklet sehingga terjadi ekstraksi
kontinu dengan pelarut relatif konstan dengan adanya pendingin baik.
6. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
7. Dekok
Dekok adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90⁰C selama 30 menit.
2.10 Spektroforometri UV-Visibel
Spektrofotometri merupakan langkah lanjut pemeriksaan visual, yaitu
dengan menggunakan alat untuk mengukur absorbansi energi radiasi
bermacam-macam zat kimia dan memungkinkan dilakukan dengan pengukuran kualitatif dan
kuantitatif dari suatu zat dengan ketelitian yang lebih besar (Day, dkk., 1986).
Spektrofotometer UV-Vis sangat berguna dalam usaha melengkapai data
untuk elusidasi struktur menjadi lebih mudah, namun karena informasi penting
yang diperoleh kebanyakn hanya senyawa kromofornya tinggi seperti sistem
polikromatik dan heterosiklik, maka hanya pada senyawa-senyawa tertentu saja
digunakan spektrofotometer UV-Vis (Silverstein., dkk, 1991)
Spektrofotometer serapan adalah pengukuran serapan radiasi
elektromagnetik panjang gelombang tertentu yang sempit, mendekati
monokromatik, yang diserap zat. Spektrofotometri ultraviolet dengan panjang
gelombang 190-380 nm dan visibel (cahaya tampak) dengan panjang gelombang
380-780 (Depkes, 1979)
2.11 Metode DPPH (1,1-diphenyl-2-picrylhydrazyl)
Pada beberapa tahun belakangan ini, pengujian absorbansi oksigen radikal
telah digunakan untuk mengevaluasi aktivitas antioksidan pada makanan, serum
dan cairan biologis lain. Metode analisa ini mengukur aktivitas dari antioksidan
aktivitas dari antioksidan dalam melawan radikal bebas seperti
1,1-diphenyl-2-picrylhydrazyl (DPPH) radikal, anion superoksida radikal (O2
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering
digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau
ekstrak bahan alam. DPPH menerima elektron atau radikal hidrogen akan
membentuk molekul diamagnetik yang stabil. Interaksi antioksidan dengan DPPH
baik secara transfer elektron atau radikal hidrogen pada DPPH, akan menetralkan
radikal bebas dari DPPH dan membentuk DPPH tereduksi. Jika semua elektron
pada radikal bebas DPPH menjadi berpasangan, maka warna larutan berubah dari
ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang 517 nm
akan hilang. Perubahan ini dapat diukur sesuai dengan jumlah elektron atau atom
hidrogen yang ditangkap oleh molekul DPPH akibat adanya zat antioksidan
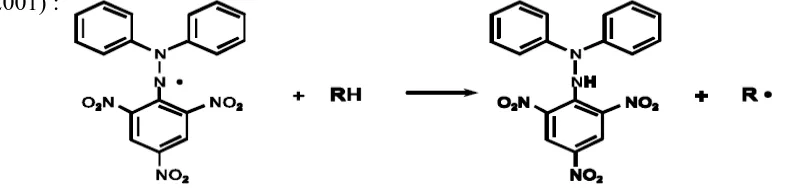
(Prior, dkk., 1998; Prakash, 2001; Gurav, dkk., 2007).
), hidroksi radikal
(ROO). Bermacam-macam metode yang digunakan untuk mengukur aktivitas
antioksidan dari produk makanan dapat memberikan hasil yang beragam
tergantung pada spesifitas dari radukal bebas yang digunakan sebagai reaktan
(Prakash, 2001; Ionita, 2005).
Molyneux (2004) menyatakan bahwa suatu zat mempunyai sifat
antioksidan bila nilai IC50 kurang dari 200 ppm. Bila nilai IC50 yang diperoleh
berkisar antara 200-1000 ppm, maka zat tersebut kurang aktif namun masih
Bentuk radikal DPPH Bentuk nonradikal (DPPH-H)
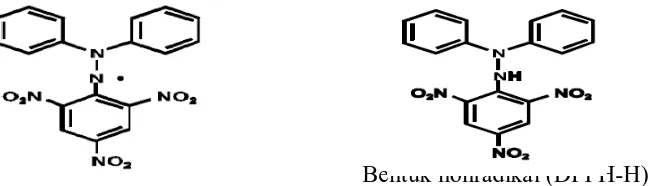
Gambar 6. Rumus Bangun DPPH (Prakash, 2001)
Aktivitas antioksidan merupakan kemampuan suatu senyawa atau ekstrak
untuk menghambat reaksi oksidasi yang dapat dinyatakan dengan persen
penghambatan. Senyawa antioksidan mempunyai sifat yang relatif stabil dalam
bentuk radikalnya (Brand-Williams, dkk., 1995).
Parameter yang dipakai untuk menunujukkan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibitiory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50%. Zat yang mempunyai
aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50
2.11.1 Pelarut
yang rendah
(Brand-Williams, dkk., 1995; Molyneux, 2004; Sihombing, dkk., 2009).
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antar sampel uji
sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004;
Panjang gelombang maksimum (λmaks
2.11.3 Waktu pengukuran
) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm,
520 nm. Bagaimanapun dalam praktiknya hasil pengukuran yang memberikan
peak maksimum itulah panjang gelombangnya yaitu sekitar panjang gelombang
yang disebutkan diatas (Molyneux, 2004).
Lamanya pengukuran menurut beberapa literatur, yang direkomendasikan
adalah selama 30 menit dan ini telah dilakukan dalam beberapa penelitian
khususnya belakangan ini, waktu pengerjaan terpendek yaitu 5 menit atau 10
menit. Waktu pengukuran digunakan sebagai parameter untuk mengevaluasi
aktivitas antioksidan sampel sebagai rujukan untuk digunakan dalam
penelitian-penelitian berikutnya (Schwarz, 2001).
Berikut ini dapat dilihat resonansi DPPH dan reaksi DPPH dengan atom H
netral yang berasal dari senyawa-senyawa yang bersifat antioksidan (Prakash,
2001) :
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan secara eksperimental.
3.1 Alat-alat yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, spektrofotometer visible (Hitachi U-2900), rotary evaporator
(Heidolph VV 2000), freeze dryer (Modulyo/Edwards), neraca analitis (Vibra AJ),
penangas air (Yenako), desikator, lemari pengering, oven (Memmert), pH meter
(001 ATC).
3.2 Bahan
Bahan yang digunakan dalam penelitian adalah umbi bawang sabrang
(Eleutherine bulbus) dan bahan kimia yang digunakan yaitu
1,1-diphenyl-2-picrylhydrazyl (DPPH), metanol (E Merck), metil paraben, propilen glikol,
larutan dapar pH 4 dan pH 7, etanol teknis (hasil destilasi), dan air suling
(Laboratorium Kuantitatif).
3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan,
identifikasi tumbuhan dan pengolahan bahan tumbuhan.
3.3.1 Pengambilan bahan tumbuhan
Pengambilan sampel dilakukan secara purposif, yaitu tanpa
digunakan adalah umbi bawang sabrang (Eleutherine bulbus) segar, diambil dari
jalan Bunga Rampe V kelurahan Simalingkar B kecamatan Medan Tuntungan.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan
Indonesia-Pusat Penelitian Biologi, Bogor. Hasil identifikasi dapat dilihat pada lampiran 1
halaman 53.
3.3.3 Pengolahan sampel
Umbi bawang sabrang (Eleutherine bulbus) segar dibersihkan dari kotoran
dengan cara mencucinya dengan air bersih, ditiriskan, lalu diiris tipis, ditimbang,
kemudian dikeringkan dengan cara diangin-anginkan diudara terbuka yang
terlindung dari sinar matahari langsung. Sampel dianggap kering bila sudah rapuh
(diremas menjadi hancur), lalu sampel kering diserbuk dengan menggunakan
blender dan ditimbang berat serbuk keringnya.
3.4 Pembuatan Pereaksi 3.4.1 Etanol 80%
Diencerkan 842 ml etanol (95%) dengan air suling secukupnya hingga
1000 ml.
3.4.2 Pembuatan larutan DPPH 40 ppm (0,5 mM)
Sebanyak 19,7 mg DPPH ditimbang, kemudian dilarutkan dalam metanol
hingga volume 100 ml (Zuhra, dkk.,2008).
3.5 Pembuatan ekstrak
Pembuatan ekstrak dilakukan secara maserasi dengan pelarut etanol.
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
etanol 80%. Sebanyak 500 g serbuk kering umbi bawang sabrang dimasukkan
dalam wadah kaca berwarna gelap kemudian dimaserasi dengan pelarut etanol
80% sampai seluruh serbuk terendam, ditutup dan disimpan pada suhu kamar
selama 5 hari terlindung dari cahaya sambil sering diaduk, kemudian pisahkan
sehingga didapat maserat. Ampas dimaserasi kembali dengan etanol 80% selama
2 hari menggunakan prosedur yang sama. Seluruh maserat digabung, diserkai dan
dienap tuangkan. Dipekatkan dengan bantuan alat rotary evaporator pada
temperature tidak lebih dari 50o
3.6 Pengujian Kemampuan Antioksidan dengan Spektrofotometri Visibel 3.6.1 Prinsip metode penangkapan radikal bebas DPPH
C sampai diperoleh ekstrak kental, kemudian
dikeringkan dengan freeze dryer -40ºC (Depkes, 1979)
Kemampuan sampel uji dalam meredam oksidasi DPPH
(1-1-diphenyl-2-picryl-hidrazyl) sebagai radikal bebas dalam larutan metanol (sehingga terjadi
peredaman warna ungu DPPH) dengan nilai IC50
3.6.2 Pembuatan larutan blanko
(konsentrasi sampel uji yang
mampu meredam radikal bebas sebesar 50% ) digunakan sebagai parameter untuk
menentukan aktivitas antioksidan sampel uji tersebut (Sihombing, 2009).
Larutan DPPH 0,5 mM dipipet sebanyak 5ml, kemudian dimasukkan ke
dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis
tanda (konsentrasi 40 ppm).
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur
absorbansinya pada panjang gelombang 515 - 520 nm (Marxen, 2007). Gambar
spektofotometer dapat dilihat pada lampiran 3 halaman 55.
3.6.4 Penentuan operation time larutan DPPH dalam metanol
Laturan DPPH 0,5 mM dipipet sebanyak 5 ml, kemudian dimasukkan ke
dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis
tanda (konsentrasi 40 ppm), lalu diukur untuk menentukan operating time larutan
DPPH dalam metanol sampai menit ke-60 (selama 1 jam) pada panjang
gelombang absorbansi maksimumyang telah diperoleh.
3.6.5 Pembuatan larutan induk sampel uji
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu
tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol
sampai garis tanda (konsentrasi 1000 ppm).
3.6.6 Pembuatan larutan uji
Larutan induk dipipet sebanyak 0,4 ml; 0,6 ml; 0,8 ml; 1,0 ml, kemudian
dimasukkan ke dalam labu tentukur 10 ml (untuk mendapatkan konsentrasi 40,
60, 80 dan 100 ppm), ke dalam masing-masing labu tentukur ditambahkan 2 ml
larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volume dicukupkan dengan
metanol sampai garis tanda.
3.6.7 Penentuan persen peredaman
Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan
Nilai absorbansi larutan DPPH sebelum dan sesudah penambahan larutan uji
tersebut dihitung sebagai persen peredaman.
% Peredaman = x 100%
Keterangan : Akontrol
A
= Absorbansi tidak mengandung sampel
sampel
3.6.8 Penentuan nilai IC
= Absorbansi mengandung sampel
Nilai IC
50
50
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat
jika nilai IC
merupakan bilangan yang menunjukkan konsentrasi sampel uji
(µg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/
meredam proses oksidasi sebsar 50%). Nilai 0% berarti tidak mempunyai aktivitas
antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu
dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi
aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan
konsentrasi ekstrak (µg/ml) sebagai absis (sumbu X) dan nilai % peredaman
(antioksidan) sebagai ordinatnya (sumbu Y). Hasil pengujian dapat dilihat pada
lampiran 8 halaman 62.
50 kurang dari 50 µg/ml, kuat untuk IC50 bernilai 50-100 µg/ml,
sedang jika IC50 bernilai 100-150 µg/ml, dan lemah jika IC50
3.7 Formula Dasar Gel
bernilai 151-200
µg/ml (Mardawati, 2008).
Tabel 2. Rancangan formula dasar gel
Formula I (g) Formula II (g)
HPMC 3,5 3,5
Propilen glikol 15 -
Metil Paraben 0,18 0,18
Cara Pembuatan :
Air suling sebanyak 20 kali berat HPMC dipanaskan hingga mendidih,
kemudian diangkat dan HPMC dikembangkan di dalamnya selama 15 menit,
setelah kembang ditambahkan metil paraben. Ditambahkan dengan atau tanpa
propilen glikol sedikit demi sedikit sambil digerus sampai homogen, lalu
dicukupkan dengan air suling hingga 100 g (Suardi, dkk., 2008).
3.8 Formula Sediaan
Tabel 3. Rancangan formula sediaan gel antioksidan ekstrak umbi bawang sabrang
Ekstrak umbi bawang sabrang 30 mg
Ekstrak umbi bawang sabrang 60 mg
Ekstrak umbi bawang sabrang 180 mg
Ekstrak umbi bawang sabrang 0,030%, 0,060% dan 0,180% digerus
sedikit demi sedikit dengan masing-masing dasar gel sampai homogen, lalu
dipindahkan ke dalam beker gelas, terakhir dicukupkan dengan dasar gel hingga
100 g dan diaduk hingga homogen.
3.9 Penentuan Mutu Fisik Sediaan
Penentuan mutu fisik sediaan gel umbi bawang sabrang dilakukan
terhadap uji organoleptis, homogenitas dan penentuan pH sediaan yang dilakukan
3.9.1 Uji organoleptis
Meliputi bentuk, warna dan bau yang diamati secara visual. 3.9.2 Uji homogenitas
Uji homogenitas dilakukan dengan menggunakan objek gelas. Cara :
Sejumlah tertentu sediaan jika dioleskan pada sekeping kaca atau bahan
transparan lain yang cocok, sediaan harus menunjukkan susunan yang homogen
dan tidak terlihat adanya butiran kasar (Depkes, 1979).
3.9.3 Penentuan pH sediaan
Penentuan pH sediaan dilakukan dengan menggunakan pH meter. Cara:
Alat pH meter dikalibrasi menggunakan larutan dapar pH 4 dan pH 7. Satu
gram sediaan yang akan diperiksa diencerkan dengan air suling hingga 10 mL.
Elektroda pH meter dicelupkan ke dalam larutan yang diperiksa, pH meter
dibiarkan bergerak sampai menunjukkan posisi tetap, angka yang ditunjukkan pH
meter dicatat (Suardi, dkk., 2008).
BAB IV
Identifikasi tumbuhan dilakukan di Pusat Penelitian dan Pengembangan
Biologi, LIPI, Bogor, disebutkan bahwa tumbuhan yang digunakan adalah
bawang sabrang (Eleutherine palmifolia (L.) Merr.) suku Iridaceae (Sinaga,
2010). Tumbuhan yang digunakan pada penelitian ini diambil pada tempat yang
sama yaitu kelurahan Simalingkar B kecamatan Medan Tuntungan, sehingga
tidak dilakukan identifikasi kembali. Gambar tumbuhan dan umbi bawang
sabrang dapat dilihat pada lampiran 1 halaman 53.
4.2 Hasil Ekstraksi Serbuk Umbi Bawang Sabrang
Hasil maserasi dari 500 g serbuk umbi bawang sabrang dengan pelarut
etanol diperoleh 66,5 (13,3%) g ekstrak setelah di freeze dryer.
4.2.1. Hasil penentuan panjang gelombang serapan maksimum DPPH
Penentuan panjang gelombang serapan maksimum larutan DPPH
dilakukan pada konsentrasi 40 ppm dalam metanol, karena larutan DPPH telah
stabil menjadi radikal bebas dan sangat lambat berubah dengan menggunakan
spektrofotometer Visibel pada panjang gelombang 515-520 nm (Marxen, dkk.,
2007). Hasil pengukuran larutan DPPH dalam metanol menunjukkan serapan
maksimum pada panjang gelombang 515,5 nm, ini termasuk dalam kisaran
panjang gelombang sinar tampak (400-750 nm). Pengujian selanjutnya untuk
aktivitas antioksidan digunakan pengukuran pada panjang gelombang 515,5 nm,
yang dilakukan dengan peredaman warna radikal bebas DPPH oleh ekstrak untuk
meredam aktivitas radikal bebas DPPH (IC50) menggunakan spektrofotometer
UV-Vis. Hasil pengukuran larutan DPPH dalam metanol dapat dilihat pada
Gambar 8. Kurva absorbansi maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel.
4.2.2 Hasil penentuan operating time larutan dpph dalam metanol
Penentuan operating time bertujuan untuk mengetahui waktu pengukuran
yang stabil dan ditentukan dengan cara mengamati hubungan antara waktu
pengukuran dengan absorbansi larutan. Penentuan operating time larutan DPPH
40 ppm dalam metanol dilakukan dengan waktu preparasi selama 13 menit
(sehingga data nomor 1 merupakan data pada menit ke-14), dan diperoleh waktu
kerja terbaik pada menit ke-26 sampai menit ke-59 setelah penambahan pelarut
metanol. Kurva serapan untuk operating time larutan DPPH dalam metanol dapat
dilihat pada Gambar 9 berikut, dan data selengkapnya pada Lampiran 5 halaman
Gambar 9. Kurva absorbansi operating time larutan DPPH dalam metanol
Berdasarkan gambar di atas maka untuk pengujian aktivitas antioksidan
dari ekstrak etanol umbi bawang sabrang dilakukan pada menit ke-45, 50 dan 55
dalam range kerja terbaik.
4.3 Hasil Analisis Peredaman Radikal bebas DPPH oleh Sampel Uji
Kemampuan antioksidan diukur pada menit ke-45, 50, dan 55 sebagai
penurunan serapan larutan DPPH (peredaman warna ungu DPPH) akibat adanya
penambahan larutan uji. Nilai serapan larutan DPPH sebelum dan sesudah
penambahan larutan uji tersebut dihitung sebagai persen peredaman. Dari analisis
yang telah dilakukan, diperoleh nilai persen peredaman pada setiap kenaikan
konsentrasi sampel uji seperti yang terlihat pada Tabel 4 berikut:
Tabel 4. Hasil analisis peredaman radikal bebas oleh ekstrak etanol bawang sabrang.
Menit
45
Pada tabel di atas menunjukkan bahwa semakin tinggi konsentrasi ekstrak
semakin meningkat aktivitas antioksidan untuk meredam DPPH dengan
bertambahnya waktu.
Penambahan larutan DPPH pada ekstrak etanol konsentrasi 40, 60, 80,
dan 100 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan
larutan uji), menunjukkan hubungan antara absorbansi DPPH dengan
penambahan ekstrak umbi bawang sabrang dalam menganalisis aktivitas
Gambar 10. Hasil analisis aktivitas antioksidan sampel ekstrak etanol umbi bawang sabrang menit ke- 45
Gambar 12. Hasil analisis aktivitas antioksidan sampel ekstrak etanol umbi bawang sabrang menit ke- 55
Gambar di atas menunjukkan hasil analisis aktivitas antioksidan dari
ekstrak etanol umbi bawang sabrang pada menit ke-45, 50 dan 55, terlihat
adanya penurunan nilai absorbansi DPPH yang diberi larutan ekstrak
dibandingkan kontrol pada setiap kenaikan konsentrasi. Penurunan absorbansi
ini menunjukkan telah terjadi peredaman radikal bebas DPPH oleh larutan
ekstrak, ini berarti adanya aktivitas antioksidan dari ekstrak umbi bawang
sabrang. Hasil uji ANAVA yang dilakukan terhadap perbedaan waktu dan
absorbansi dari ekstrak umbi bawang sabrang ternyata tidak terlihat adanya
perbedaan yang bermakna pada waktu 45, 50 dan 55 menit Hasilnya terlihat pada
Lampiran 7 halaman 61.
4.4 Analisis Nilai IC50
Parameter yang digunakan untuk aktivitas antioksidan dengan uji
penangkapan radikal DPPH ini adalah IC
(Inhibitory Concentration) Sampel Uji
50 yaitu konsentrasi bahan uji yang
dibutuhkan untuk menangkap radikal DPPH sebesar 50%, dimana konsentrasi
larutan uji (ppm) sebagai absis dan nilai persen peredaman sebagi ordinat. Hasil
persamaan regresi linier yang diperoleh, dapat dilihat pada Tabel 5 dan hasil
regresi IC50
Tabel 5. Hasil persamaan regresi linier yang diperoleh untuk ekstrak etanol bawang sabrang
pada Gambar 13,14 dan 15. Data perhitungan dapat dilihat pada
lampiran 8 halaman 62.
Larutan Uji Persamaan Regresi
Menit ke- 45 Menit ke- 50 Menit ke- 55 Ekstrak etanol
umbi Bawang Sabrang
Gambar 13. Hasil regresi IC50 ekstrak etanol umbi bawang sabrang menit ke- 45
Gambar 14. Hasil regresi IC50 ekstrak etanol umbi bawang sabrang menit ke- 50
Gambar 15. Hasil regresi IC50
Hasil analisis nilai IC
ekstrak etanol umbi bawang sabrang menit ke- 55
Tabel 6. Nilai IC50
Sampel Uji
ekstrak etanol umbi bawang sabrang
Nilai IC50
Tabel di atas menunjukkan bahwa ekstrak etanol umbi bawang sabrang
memiliki aktifitas antioksidan yang sedang (100-150 µg/ml) (Mardawati, 2008).
Ekstrak umbi bawang sabrang mempunyai aktivitas antioksidan karena
mengandung senyawa flavonoid (Galingging, 2009). Senyawa flavonoid adalah
salah satu kelompok metabolit sekunder pada tumbuhan tingkat tinggi yang
digunakan sebagai obat atau suplemen diet karena flavonoid memiliki sifat
antioksidan yang kuat (Kitamura, 2006)
4.5 Hasil Penetapan Konsentrasi Formula Sediaan
. Aktivitas antioksidan senyawa flavonoid
dikaitkan dengan adanya gugus hidroksil fenolik yang menempel pada struktur
kerangkanya, dan flavonoid terbukti dapat meredam radikal bebas
1,1-.diphenyl-2-picrylhydrazyl (DPPH) (Sihombing, dkk., 2009) Hasil aktivitas antioksidan
yang sedang ini, dapat disebabkan ekstrak etanol masih bercampur dengan
senyawa-senyawa metabolit sekunder yang lain.
Penetapan konsentrasi formula sedian gel antioksidan ekstrak etanol umbi
bawang sabrang dapat ditentukan dengan cara perhitungan dari IC50
4.6 Hasil Pengamatan Sediaan Gel Antioksidan
dengan
membuat variasi konsentrasi untuk formula sediaan gel, yaitu 30, 60 dan 180mg
dalam 100 g sediaan atau 0,030, 0,060 dan 0,18% (Sihombing, dkk., 2009). Data
4.6.1. Hasil pengamatan secara visual
Hasil uji homogenitas yang diamati secara visual memperlihatkan bahwa
semua sediaan homogen. Hasil formula sediaan gel dari ekstrak etanol umbi
bawang sabrang dilakukan terhadap sediaan yang baru dibuat, yang diamati secara
visual, dapat dilihat pada Tabel 7 berikut :
Tabel 7. Hasil pengamatan sediaan gel secara visual
Formula Warna Bau Konsistensi
1 bening khas HPMC Kental
2 kuning muda khas ekstrak bawang sabrang Kental
3 kuning khas ekstrak bawang sabrang Kental
4 kuning kecoklatan khas ekstrak bawang sabrang+ Kental
5 bening khas HPMC Kental
6 kuning muda khas ekstrak bawang sabrang Kental
7 kuning khas ekstrak bawang sabrang Kental
8 kuning kecoklatan khas ekstrak bawang sabrang + Kental
Keterangan : + : bau kuat
1. Formula dengan propilen glikol tanpa ekstrak umbi bawang sabrang
2. Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,030 % 3. Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,060 % 4. Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,180 % 5. Formula tanpa propilen glikol tanpa ekstrak umbi bawang sabrang 6. Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,030% 7. Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,060% 8. Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,180%
Gel tanpa penambahan ekstrak etanol umbi bawang sabrang berwarna
bening sedangkan dengan penambahan ekstrak dihasilkan sediaan gel berwarna
kuning sampai kuning kecoklatan karena ekstrak yang ditambahkan pada gel
berwarna coklat muda. Intensitas warna gel bertambah dengan meningkatnya
konsentrasi ekstrak yang ditambahkan. Bau khas ekstrak bawang sabrang juga
formula yang dibuat menghasilkan sediaan gel yang kental. Gambar hasil sediaan
gel dapat dilihat pada lampiran 10 halaman 66.
4.6.2. Hasil pengamatan secara organoleptis
Hasil pengamatan dari perubahan stabilitas sediaan gel yang dilakukan
secara organoleptis meliputi konsistensi, warna, dan bau dari masing-masing
formula sediaan gel pada penyimpanan selama 28 hari. Hasilnya dapat dilihat
pada Tabel 8 berikut :
Tabel 8. Hasil pengamatan perubahan konsistensi, warna, dan bau sediaan gel Pengamatan Formula Waktu Penyimpanan (Hari)
1 4 7 10 13 16 19 22 25 28
4 : Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,180 % 5 : Formula tanpa propilen glikol tanpa ekstrak umbi bawang sabrang 6 : Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,030 % 7 : Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,060 % 8 : Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,180 %
Berdasarkan hasil pengamatan yang dilakukan terhadap sediaan gel,
diketahui bahwa formula sediaan gel antioksidan dengan ataupun tanpa
menggunakan propilen glikol dan penambahan ekstrak etanol umbi bawang
sabrang dengan konsentrasi 0,030 %, 0,060 % dan 0,180 % tidak mengalami
perubahan konsistensi, warna maupun bau. Artinya bahwa sediaan gel yang dibuat
stabil secara fisik.
4.6.3 Hasil pengukuran pH
Stabilitas gel juga dapat dilihat dari pH sediaan selama penyimpanan.
Hasil pengukuran pH sediaan gel ekstrak etanol bawang sabrang dapat dilihat
pada Tabel 9 dan hasil pengamatan pH sediaan gel selama penyimpanan 28 hari,
pada Gambar 16 dan 17.
Tabel 9. Hasil pengukuran pH sediaan gel selama penyimpanan Formula Waktu Penyimpanan (Hari)
1 4 7 10 13 16 19 22 25 28
7 : Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,060 % 8 : Formula tanpa propilen glikol dengan ekstrak umbi bawang sabrang 0,180 %
Gambar 16. Hasil pengamatan pH penyimpanan sediaan gel dengan propilen glikol selama 28 hari.
Keterangan :
Formula dengan propilen glikol tanpa ekstrak umbi bawang sabrang
Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,030 % Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,060 % Formula dengan propilen glikol dan ekstrak umbi bawang sabrang 0,180 %
Gambar 17. Hasil pengamatan pH penyimpanan sediaan gel tanpa propilen glikol selama 28 hari.
Keterangan :
Formula tanpa propilen glikol tanpa ekstrak umbi bawang sabrang
Formula tanpa propilen glikol dan ekstrak umbi bawang sabrang 0,180 %
Berdasarkan pengukuran pH dari masing-masing formula selama
pengamatan terjadi penurunan pH dan secara keseluruhan terlihat bahwa pH dari
sediaan gel ekstrak etanol umbi bawang sabrang menurun dengan bertambahnya
waktu penyimpanan. Sediaan gel untuk blanko tanpa penambahan ekstrak etanol
umbi bawang sabrang juga mengalami penurunan pH. Hasil uji stabilitas terhadap
pH sediaan gel baik blanko maupun sediaan gel antioksidan dari ekstrak etanol
umbi bawang sabrang menunjukkan pH sediaan tetap stabil pada penyimpanan
karena masih berada dalam range pH normal kulit yaitu 5,0-6,0 (Ansari., dkk,