BAHAN SEMINAR
ISOLASI DAN KARAKTERISASI SENYAWA TRITERPENOID DARI UMBI BAWANG SABRANG (Eleutherinae bulbus)
OLEH:
ELIZABET R. BANJARNAHOR NIM : 060804022
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Isolasi dan Karakterisasi Triterpenoid
dari Umbi Bawang Sabrang (Eleutherinae bulbus) Abstrak
Umbi dari bawang sabrang (Eleutherinae bulbus) dapat berkhasiat menyembuhkan kanker usus, kanker payudara, diabetes mellitus, tekanan darah tinggi, stroke, penyakit weil, radang usus, disentri, sembelit, luka, bisul, menurunkan kolesterol, diuretik dan antimelanogenesis. Salah satu kandungan kimia umbi tumbuhan ini adalah triterpenoid. Tujuan penelitian ini adalah untuk menganalisa dan mengisolasi triterpenoid dari umbi bawang sabrang dan melakukan karakterisasi terhadap isolat dengan spektrofotometer ultraviolet dan inframerah.
Terhadap serbuk simplisia dilakukan pemeriksaan karakteristik simplisia dan skrining fitokimia, selanjutnya serbuk diekstraksi secara maserasi dengan etanol 80%, kemudian difraksinasi dengan pelarut n-heksan-air (2:1) v/v. Fraksi
n-heksan dianalisa secara Kromatografi Lapis Tipis (KLT) menggunakan berbagai
perbandingan fase gerak, yaitu n-heksan : etilasetat (9:1), (8:2), (7:3), (6:4), (5:5) dengan penampak bercak Liebermann-Burchard. Fraksi n-heksan dipisahkan secara kromatografi kolom menggunakan fase gerak n-heksan-etilasetat (7:3), dilanjutkan dengan KLT preparatif menggunakan fase gerak yang sama. Kemudian isolat dikarakterisasi dengan spektrofotometer ultraviolet dan inframerah.
Hasil makroskopik umbi bawang sabrang adalah berbentuk bulat telur memanjang, berwarna merah, tidak berbau, berasa pahit dan simplisia yang kering berwarna merah pucat dan sangat rapuh. Hasil mikroskopik terhadap serbuk simplisia menunjukkan adanya kristal Ca-oksalat, parenkim, xilem dengan penebalan tangga dan butir amilum. Kadar air serbuk simplisia sebesar 8,98%, kadar sari yang larut dalam air 8,03%, kadar sari yang larut dalam etanol 9,54%, kadar abu total 4,41% dan kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia menunjukkan adanya alkaloid, flavonoid, glikosida, saponin, tanin, triterpenoid/steroid dan antrakinon glikosida. Hasil kromatografi kolom diperoleh isolat golongan triterpenoid pada F5 dan F7 yang memberikan harga Rf 0,475 (ungu merah) dan 0,213 (ungu). Hasil spektrofotometri ultraviolet dan inframerah isolat F5 diperoleh panjang gelombang maksimum (λ) 393 nm dan adanya gugus C=O, C=C aromatik, C-H aromatik, C=C alkena, C-O, C-H alifatis, C-H metilen dan C-H metil. Hasil spektrofotometri ultraviolet dan inframerah isolat F7 diperoleh panjang gelombang maksimum (λ) 333 nm adanya gugus C=O, C=C aromatik,C-H aromatik, C-O, C-H alifatis, C-H aldehid, C-H metilen dan C-H metil.
Isolation and Characterization of Triterpenoid from Bawang Sabrang Bulb (Eleutherinae bulbus)
Abstract
The bulb of the bawang sabrang (Eleutherinae bulb) can be efficacious to the cure for colon cancer, breast cancer, diabetes mellitus, high blood pressure, stroke, Weil's disease, colitis, dysentery, constipation, injury, blain, hypoglycemic, diuretic and antimelanogenesis.. One of the chemical constituents of the bulb of this plant is triterpenoid. The purpose of this recearch is to analyze and isolate the triterpenoid from the bawang sabrang bulb and to do the characterization of the isolates using ultraviolet and infrared spectrophotometer.
On the simplex powder was examined for characteristics of simplex and phytochemical screening, after that the powder was extracted by maceration with ethanol 80%, then fractionated with the solvent n-hexane: aquadest (2:1) v/v. The
n-hexane fraction was analyzed by Thin Layer Chromatography (TLC) using
various mobile phase ratio, which were n-hexane-ethylacetate (9:1), (8:2), (7:3), (6:4), (5:5) with the Liebermann-Burchard sprayed reagent. The n-hexane fractions were separated by column chromatography using mobile phase n-hexane-ethylacetate (7:3), continued with preparative TLC using same mobile phase. Then the isolates were characterized by ultraviolet and infrared spectrophotometer.
The result of macroscopic examination of bawang sabrang bulb is elongated oval-shaped, red in color, odorless, bitter taste, and dry simplex, which was a pale red color and very frail. Microscopic results of simplex powder showed the existence of Ca-oxalate crystals, parenchyma, xylem with thickening of the stairs and starch grains. The water content of simplex powder is 8.98%, the water-soluble extract content is 8.03%, the ethanol-soluble extract content is 9.54%, the total ash content is 4.41% and the acid insoluble ash content is 0.84%. The result of the phytochemical screening showed the existence of alkaloids, flavonoids, glycosides, saponins, tannins, triterpenoids/steroids and anthraquinone glycosides. The result of the column chromatography was triterpenoid isolate on F5 and F7 that gives the Rf value 0,475 (reddish purple) and 0.213 (purple). The result of the ultraviolet and infrared spectrophotometry of F5 isolates obtained maximum wavelengths (λ) 393 nm and the existence of clusters C=O, C=C aromatic, aromatic C-H, C=C alkene, C-O, C-H alifatis, C-H methyl and C-H methylene. The result of the ultraviolet and infrared spectrophotometry of F7 isolates obtained maximum wavelength (λ) 333 nm, the existence of clusters C=O, C=C aromatic, aromatic C-H, C-O, C-H alifatis, C-H aldehyde, C-H methyl and C-H methylene.
DAFTAR ISI
Halaman
JUDUL ………... i
LEMBAR PENGESAHAN ………... ii
ABSTRAK ………. iii
ABSTRACT ………... iv
DAFTAR ISI ……….. v
DAFTAR LAMPIRAN ……….. viii
DAFTAR TABEL ……….. x
BAB I. PENDAHULUAN 1.1 Latar Belakang ………... 1
1.2 Perumusan Masalah ……… 2
1.3 Hipotesis ………. 3
1.4 Tujuan Penelitian ……… 3
BAB II. METODE PENELITIAN 2.1 Alat-alat ……….. 4
2.2 Bahan-bahan ………... 4
2.3 Pengumpulan dan Pengolahan Bahan Tumbuhan …...……... 5
2.3.1 Pengumpulan Bahan Tumbuhan ………...……… 5
2.3.2 Identifikasi Tumbuhan ……….. 5
2.3.3 Pembuatan Simplisia ……..………... 5
2.4 Pembuatan Larutan Pereaksi ……….. 6
2.4.1 Pereaksi kloralhidrat ………...…… 6
2.4.3 Pereaksi besi (III) klorida 1% ………..…... 6
2.4.4 Pereaksi Bouchardat …………..………... 6
2.4.5 Pereaksi Dragendorff………..……….. 6
2.4.6 Pereaksi Mayer ………..………... 7
2.4.7 Pereaksi Molish ………..…….. 7
2.4.8 Pereaksi natrium hidroksida 2 N …………...………... 7
2.4.9 Pereaksi Liebermann-Burchard …………...………… 7
2.4.10 Pereaksi timbal (II) klorida 0,4 N ………..………... 7
2.5 Pemeriksaan Karakteristik Simplisia ………..…….. 7
2.5.1 Pemeriksaan Makroskopik ………... 8
2.5.2 Pemeriksaan Mikroskopik ………... 8
2.5.3 Penetapan Kadar Air ……… 8
2.5.4 Penetapan Kadar Sari yang Larut dalam Air ……….. 9
2.5.5 Penetapan Kadar Sari yang Larut dalam Etanol ……. 9
2.5.6 Penetapan Kadar Abu Total ………. 9
2.5.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam 10
2.6 Skrining Fitokimia ……….………... 10
2.6.1 Pemeriksaan Alkaloid ……….. 10
2.6.2 Pemeriksaan Flavonoid ……… 11
2.6.3 Pemeriksaan Glikosida ………. 11
2.6.4 Pemeriksaan Saponin ………... 12
2.6.5 Pemeriksaan Tanin ……….. 12
2.6.6 Pemeriksaan Triterpenoid/Steroid ………... 13
2.6.8 Pemeriksaan Glikosida Sianogenik ……….. 13
2.7 Pembuatan Ekstrak ……… 13
2.8 Analisis Fraksi n-heksan Secara Kromatografi Lapis Tipis (KLT) ……… 14
2.9 Pemisahan Fraksi n-heksan Dengan Kromatografi Kolom .. 15
2.10 Pembuatan Plat KLT ………... 16
2.11 Pemurnian Isolat dengan KLT Preparatif ………. 16
2.12 Pemurnian Kristal Isolat ……….. 17
2.13 Uji Kemurnian Isolat ………. 17
2.14 Karakterisasi Isolat ……… 17
2.14.1 Spektrofotometri Ultraviolet ………. 18
2.14.2 Spektrofotometri Inframerah ……… 18
BAB III. HASIL DAN PEMBAHASAN ………...……….. 19
BAB IV. KESIMPULAN DAN SARAN ……….………... 26
DAFTAR PUSTAKA ………...………. 27
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan Bawang Sabrang
(Eleutherine palmifolia (L.) Merr) ……… 30
Lampiran 2. Gambar Tumbuhan Bawang Sabrang (Eleutherine
palmifolia (L.) Merr) ………. 31 Lampiran 3. Gambar Simplisia Umbi Bawang Sabrang (Eleutherinae
bulbus) ………... 32
Lampiran 4. Gambar Fragmen Pengenal Serbuk Simplisia Umbi Bawang
Sabrang (Eleutherinae bulbus) ………... 33
Lampiran 5. Perhitungan Penetapan Kadar Air Simplisia Umbi Bawang
Sabrang (Eleutherinae bulbus) ……….. 34
Lampiran 6. Perhitungan Penetapan Kadar Sari yang Larut dalam Air
Simplisia Umbi Bawang Sabrang (Eleutherinae bulbus) ….. 35
Lampiran 7. Perhitungan Penetapan Kadar Sari yang Larut dalam Etanol
Simplisia Umbi Bawang Sabrang (Eleutherinae bulbus) ….. 36
Lampiran 8. Perhitungan Penetapan Kadar Abu Total Simplisia Umbi
Bawang Sabrang (Eleutherinae bulbus) ……… 37
Lampiran 9. Perhitungan Penetapan Kadar Abu yang Tidak Larut
dalam Asam Simplisia Umbi Bawang Sabrang (Eleutherinae
bulbus) ……… 38
Lampiran 10. Bagan Ekstraksi Serbuk Simplisia Umbi Bawang Sabrang
(Eleutherinae bulbus) ……… 39
Lampiran 11. Bagan Isolasi Ekstrak n-heksan Umbi Bawang Sabrang
(Eleutherinae bulbus) dengan Kromatografi Kolom ………. 40
Lampiran 12. Kromatogram Analisa KLT dari Fraksi n-heksan Umbi
Bawang Sabrang (Eleutherinae bulbus) ……… 41
Lampiran 13. Kromatogram Analisa KLT Eluat Kromatografi Kolom Fraksi n-heksan Umbi Bawang Sabrang (Eleutherinae
bulbus) ………. 43
Lampiran 14. Kromatogram KLT Preparatif F7 ………..……….. 44
Umbi Bawang Sabrang (Eleutherinae bulbus) ……... 45
Lampiran 16. Kromatogram Uji Kemurnian Isolat F7 Fraksi n-heksan Umbi Bawang Sabrang (Eleutherinae bulbus) ……... 47
Lampiran 17. Spektrum Ultraviolet Isolat F5………..………... 49
Lampiran 18. Spektrum Ultraviolet Isolat F7………..………... 50
Lampiran 19. Spektrum Inframerah Isolat F5………..………... 51
DAFTAR TABEL
Halaman Tabel 1. Hasil Penetapan Karakterisasi Simplisia Umbi Bawang Sabrang
(Eleutherinae bulbus) ………... 20
Tabel 2. Hasil Skrining Fitokimia Serbuk Simplisia Umbi Bawang
Isolasi dan Karakterisasi Triterpenoid
dari Umbi Bawang Sabrang (Eleutherinae bulbus) Abstrak
Umbi dari bawang sabrang (Eleutherinae bulbus) dapat berkhasiat menyembuhkan kanker usus, kanker payudara, diabetes mellitus, tekanan darah tinggi, stroke, penyakit weil, radang usus, disentri, sembelit, luka, bisul, menurunkan kolesterol, diuretik dan antimelanogenesis. Salah satu kandungan kimia umbi tumbuhan ini adalah triterpenoid. Tujuan penelitian ini adalah untuk menganalisa dan mengisolasi triterpenoid dari umbi bawang sabrang dan melakukan karakterisasi terhadap isolat dengan spektrofotometer ultraviolet dan inframerah.
Terhadap serbuk simplisia dilakukan pemeriksaan karakteristik simplisia dan skrining fitokimia, selanjutnya serbuk diekstraksi secara maserasi dengan etanol 80%, kemudian difraksinasi dengan pelarut n-heksan-air (2:1) v/v. Fraksi
n-heksan dianalisa secara Kromatografi Lapis Tipis (KLT) menggunakan berbagai
perbandingan fase gerak, yaitu n-heksan : etilasetat (9:1), (8:2), (7:3), (6:4), (5:5) dengan penampak bercak Liebermann-Burchard. Fraksi n-heksan dipisahkan secara kromatografi kolom menggunakan fase gerak n-heksan-etilasetat (7:3), dilanjutkan dengan KLT preparatif menggunakan fase gerak yang sama. Kemudian isolat dikarakterisasi dengan spektrofotometer ultraviolet dan inframerah.
Hasil makroskopik umbi bawang sabrang adalah berbentuk bulat telur memanjang, berwarna merah, tidak berbau, berasa pahit dan simplisia yang kering berwarna merah pucat dan sangat rapuh. Hasil mikroskopik terhadap serbuk simplisia menunjukkan adanya kristal Ca-oksalat, parenkim, xilem dengan penebalan tangga dan butir amilum. Kadar air serbuk simplisia sebesar 8,98%, kadar sari yang larut dalam air 8,03%, kadar sari yang larut dalam etanol 9,54%, kadar abu total 4,41% dan kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia menunjukkan adanya alkaloid, flavonoid, glikosida, saponin, tanin, triterpenoid/steroid dan antrakinon glikosida. Hasil kromatografi kolom diperoleh isolat golongan triterpenoid pada F5 dan F7 yang memberikan harga Rf 0,475 (ungu merah) dan 0,213 (ungu). Hasil spektrofotometri ultraviolet dan inframerah isolat F5 diperoleh panjang gelombang maksimum (λ) 393 nm dan adanya gugus C=O, C=C aromatik, C-H aromatik, C=C alkena, C-O, C-H alifatis, C-H metilen dan C-H metil. Hasil spektrofotometri ultraviolet dan inframerah isolat F7 diperoleh panjang gelombang maksimum (λ) 333 nm adanya gugus C=O, C=C aromatik,C-H aromatik, C-O, C-H alifatis, C-H aldehid, C-H metilen dan C-H metil.
Isolation and Characterization of Triterpenoid from Bawang Sabrang Bulb (Eleutherinae bulbus)
Abstract
The bulb of the bawang sabrang (Eleutherinae bulb) can be efficacious to the cure for colon cancer, breast cancer, diabetes mellitus, high blood pressure, stroke, Weil's disease, colitis, dysentery, constipation, injury, blain, hypoglycemic, diuretic and antimelanogenesis.. One of the chemical constituents of the bulb of this plant is triterpenoid. The purpose of this recearch is to analyze and isolate the triterpenoid from the bawang sabrang bulb and to do the characterization of the isolates using ultraviolet and infrared spectrophotometer.
On the simplex powder was examined for characteristics of simplex and phytochemical screening, after that the powder was extracted by maceration with ethanol 80%, then fractionated with the solvent n-hexane: aquadest (2:1) v/v. The
n-hexane fraction was analyzed by Thin Layer Chromatography (TLC) using
various mobile phase ratio, which were n-hexane-ethylacetate (9:1), (8:2), (7:3), (6:4), (5:5) with the Liebermann-Burchard sprayed reagent. The n-hexane fractions were separated by column chromatography using mobile phase n-hexane-ethylacetate (7:3), continued with preparative TLC using same mobile phase. Then the isolates were characterized by ultraviolet and infrared spectrophotometer.
The result of macroscopic examination of bawang sabrang bulb is elongated oval-shaped, red in color, odorless, bitter taste, and dry simplex, which was a pale red color and very frail. Microscopic results of simplex powder showed the existence of Ca-oxalate crystals, parenchyma, xylem with thickening of the stairs and starch grains. The water content of simplex powder is 8.98%, the water-soluble extract content is 8.03%, the ethanol-soluble extract content is 9.54%, the total ash content is 4.41% and the acid insoluble ash content is 0.84%. The result of the phytochemical screening showed the existence of alkaloids, flavonoids, glycosides, saponins, tannins, triterpenoids/steroids and anthraquinone glycosides. The result of the column chromatography was triterpenoid isolate on F5 and F7 that gives the Rf value 0,475 (reddish purple) and 0.213 (purple). The result of the ultraviolet and infrared spectrophotometry of F5 isolates obtained maximum wavelengths (λ) 393 nm and the existence of clusters C=O, C=C aromatic, aromatic C-H, C=C alkene, C-O, C-H alifatis, C-H methyl and C-H methylene. The result of the ultraviolet and infrared spectrophotometry of F7 isolates obtained maximum wavelength (λ) 333 nm, the existence of clusters C=O, C=C aromatic, aromatic C-H, C-O, C-H alifatis, C-H aldehyde, C-H methyl and C-H methylene.
BAB I PENDAHULUAN
2.1Latar Belakang
Indonesia yang beriklim tropis menyebabkan tanahnya subur dan banyak
jenis tumbuhan dapat tumbuh dan beberapa diantaranya memiliki khasiat sebagai
obat. Secara umum, kegunaan tumbuhan obat sebenarnya disebabkan oleh
kandungan kimianya. Namun tidak seluruhnya diketahui secara lengkap karena
pemeriksaan bahan kimia dari satu tumbuhan memerlukan biaya yang cukup
mahal (Hariana, 2004).
Salah satu tumbuhan yang dapat digunakan sebagai obat adalah bawang
sabrang (Eleutherine palmifolia (L.) Merr), atau dikenal dengan nama bawang
dayak atau bawang hantu oleh masyarakat Kalimantan Tengah (Krismawati,
2004). Bawang sabrang merupakan tumbuhan umbi dengan tinggi tidak lebih dari
setengah meter. Umbi berwarna merah menyala dengan permukaan licin. Daun
hijau berbentuk pita, bunganya berwarna putih yang mekar pada sore hari dan
setelah beberapa jam menutup kembali. (Galingging, 2009; Ogata, 1995).
Dalam “Bawang Dayak Sebagai Tanaman Obat Multifungsi”, umbi
bawang sabrang (Eleutherinae bulbus) dapat mengatasi beberapa keluhan seperti
kanker usus, kanker payudara, diabetes mellitus, tekanan darah tinggi, stroke,
menurunkan kolesterol (Galingging, 2009), menyembuhkan penyakit weil, radang
usus, disentri, sembelit, luka, bisul dan diuretik (Ogata, 1995) dan
antimelanogenesis (Arung, et al., 2009). Dapat digunakan dalam bentuk segar,
glikosida, flavonoid, fenolik, steroid, triterpenoid, tanin (Galingging, 2009),
eutherol, eleutherine, isoeleutherine, eleuthosides A, B dan C (Shibuya, et al.,
1997).
Senyawa triterpenoid mempunyai banyak kegunaan, antara lain dapat
mengobati diabetes, gangguan menstruasi, patukan ular, gangguan kulit,
kerusakan hati dan malaria (Robinson, 1995), antiradang (Aguirre, et al., 2006),
analgesik (Delporte, et al., 2007) dan sitotoksik (Atenza, dkk, 2009).
Pemeriksaan karakterisasi simplisia perlu dilakukan untuk mengetahui
apakah simplisia yang digunakan memenuhi persyaratan Materia Medika
Indonesia (MMI). Berdasarkan hal di atas penulis tertarik untuk melakukan
karakterisasi simplisia, skrining fitokimia dan mengisolasi senyawa triterpenoid
dari umbi bawang sabrang. Isolasi dilakukan secara kromatografi, meliputi
kromatografi lapis tipis (KLT), kromatografi kolom dan KLT preparatif, serta
karakterisasi isolat secara spektofotometri ultraviolet dan spektofotometri
inframerah.
2.2Perumusan Masalah
1. Apakah senyawa triterpenoid yang terdapat pada ekstrak etanol dapat
difraksinasi dengan n-heksan dari umbi bawang sabrang (Eleutherinae bulbus)
sehingga dapat diisolasi dengan kromatografi kolom menggunakan campuran
pelarut yang sesuai?
2. Apakah senyawa triterpenoid hasil isolasi dapat dikarakterisasi secara
2.3Hipotesis
1. Senyawa triterpenoid yang terdapat pada ekstrak etanol dapat difraksinasi
dengan n-heksan dari umbi bawang sabrang (Eleutherinae bulbus) sehingga
dapat diisolasi dengan kromatografi kolom menggunakan campuran pelarut
yang sesuai.
2. Senyawa triterpenoid hasil isolasi dapat dikarakterisasi secara
spektrofotometri ultraviolet dan spektrofotometri inframerah.
2.4Tujuan
Tujuan penelitian ini dilakukan adalah untuk:
1. Mengisolasi senyawa triterpenoid yang terdapat pada fraksi n-heksan umbi
bawang sabrang (Eleutherinae bulbus) yang difraksinasi dari ekstrak etanol.
2. Karakterisasi senyawa triterpenoid hasil isolasi menggunakan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Habitat
Terna bawang sabrang berasal dari Amerika tropis, di Jawa dipelihara
sebagai tanaman hias dan di beberapa tempat tumbuh jalang antara 600 hingga
1500 m di atas permukaan laut (Ogata, 1995). Di Kalimantan Tengah bawang
sabrang sudah dibudidayakan sebagai salah satu tanaman obat (Galingging, 2009).
2.1.2 Morfologi Tumbuhan
Tumbuhan bawang sabrang merumpun sangat kuat, tinggi 26 hingga 50
cm. Umbi berwarna merah menyala dengan permukaan licin. Bunga berwarna
putih, mekar jam lima sore hari, dan jam tujuh menutup kembali. Daun hijau
berbentuk pita (Galingging, 2009; Ogata, 1995). Daun tunggal, letak daun
berhadapan, warna daun hijau muda, bentuk daun sangat panjang dan meruncing
(acicular), tepi daun halus tanpa gerigi (entire), pangkal daun berbentuk runcing
(acute) dan ujung daun meruncing (acuminate) permukaan daun atas dan bawah
halus (glabrous), tulang daun paralel/sejajar (Krismawati, 2004).
2.1.3 Sistematika Tumbuhan
Sistematika dari tumbuhan bawang sabrang (Tjitrosoepomo, 2007) adalah
sebagai berikut:
Kingdom : Plantae
Sub Divisi : Angiospermae
Kelas
Ordo : Liliales
Famili : Iridaceae
Genus : Eleutherine
Spesies : Eleutherine palmifolia (L.) Merr.
2.1.4 Nama Daerah
Nama daerah dari tumbuhan bawang sabrang adalah sebagai berikut:
bawang kapal (Sumatera), brambang sabrang, luluwan sapi, teki sabrang,
bebawangan beureum, bawang siem (Jawa) ( Depkes, 1985).
2.1.5 Kandungan Kimia
Bawang sabrang mengandung senyawa-senyawa yang meliputi alkaloid,
glikosida, flavonoid, fenolik, triterpenoid/steroid dan tanin (Galingging, 2009).
2.1.6 Khasiat
Dalam pengobatan tradisional, umbi tanaman ini dapat menyembuhkan
beberapa penyakit, antara lain kanker usus, kanker payudara, diabetes mellitus,
tekanan darah tinggi, stroke, menurunkan kolesterol (Galingging, 2009),
menyembuhkan penyakit weil, radang usus, disentri, sembelit, luka, bisul dan
diuretik. Daunnya dapat digunakan untuk menurunkan demam dan antimuntah
(Ogata, 1995). Menurut Arung, dkk (2009), umbi tanaman ini dapat berkhasiat
2.2Uraian Kimia Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena (Harbone, 1987). Kebanyakan senyawa terpenoid terdapat bebas
dalam jaringan tanaman, tetapi banyak diantaranya yang terdapat sebagai
glikosida (Sastrohamidjojo, 1996), alkohol, aldehid (Harbone, 1987) dan ester
asam aromatik (Robinson, 1995).
Isoprena
Sejauh ini triterpenoid monosiklik dan disiklik belum ditemukan,
sedangkan trisiklik langka. Senyawa triterpenoid tetrasiklik menarik perhatian
karena kemungkinan ada kaitan biogenesis dengan steroid, misalnya lanosterol,
senyawa antara biosintesis steroid pada hewan (Robinson, 1995). Steroid adalah
senyawa yang memiliki kerangka siklopentanafenantren. Pada umumnya, gugus
metil berada pada 10 dan 13. Rantai samping alkil dapat juga berada pada
C-17. Sterol adalah steroid yang memiliki gugus hidroksi pada C-3. Atom karbon
tambahan dapat berada pada rantai samping. (IUPAC, 1989).
Triterpenoid pentasiklik paling tersebar luas, umumnya pada tumbuhan
berbiji, baik dalam bentuk bebas maupun sebagai glikosida. Sering ditemukan
bentuk nonglikosida sebagai ekskresi dan dalam kutikula sebagai pelindung
terhadap air. Salah satu contohnya yang banyak terdapat pada tumbuhan adalah β
-amirin (Robinson, 1995).
β-amirin
Triterpenoid memiliki beberapa aktivitas fisiologi, antara lain untuk
penyakit diabetes, gangguan menstruasi, patukan ular, gangguan kulit, kerusakan
hati dan malaria. Beberapa senyawa menunjukkan aktivitas antibakteri atau
antivirus (Robinson, 1995). Senyawa ini merupakan senyawa yang tidak
berwarna, berbentuk kristal, bertitik leleh tinggi dan optik aktif, yang umumnya
sukar dicirikan karena tidak mempunyai kereaktifan kimia. Kebanyakan triterpena
dan sterol memberikan warna hijau-biru dengan pereaksi Liebermann-Burchard
(Harbone, 1987).
2.3Ekstraksi
Ekstraksi adalah kegiatan penarikan zat aktif yang dapat larut sehingga
terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Pemilihan pelarut
dan cara ekstraksi yang tepat dapat dipermudah dengan mengetahui terlebih
kehalusan serbuk dan perbedaan konsentrasi. Jika hanya dengan mencelupkan
serbuk simplisia ke dalam pelarut, maka ekstraksi tidak akan sempurna karena
terjadi kesetimbangan antara larutan zat aktif di luar sel dan larutan zat aktif di
dalam sel (Depkes, 1986).
Menurut Depkes (2000), ekstraksi dapat dilakukan dengan berbagai cara,
salah satunya maserasi. Maserasi adalah proses ekstraksi menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan.
Maserasi dilakukan dengan merendam serbuk simplisia dalam cairan penyari,
dimana cairan akan berdifusi dengan dinding sel yang mengandung zat aktif.
Pengadukan dilakukan untuk menjaga adanya derajat perbedaan konsentrasi
antara larutan di luar sel dan di dalam sel. Larutan yang terpekat didesak keluar
dinding sel sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan
di dalam sel (Depkes, 1986).
Pengulangan penambahan pelarut setelah dilakukan penyaringan hasil
maserasi pertama dikenal dengan remaserasi. Selain maserasi, ekstraksi dapat
dilakukan dengan perkolasi, serta ekstraksi cara panas, antara lain dengan cara
refluks, sokhlet, digesti, infus dan dekok (Depkes, 2000).
2.4Kromatografi
Kromatografi merupakan suatu teknik pemisahan yang menggunakan fase
diam (stationary phase) dan fase gerak (mobile phase). Saat ini, kromatografi
merupakan teknik pemisahan yang paling umum dimanfaatkan untuk melakukan
analisis, baik analisis kualitatif maupun kuantitatif, atau preparatif dalam bidang
2.4.1 Kromatografi Lapis Tipis
Penggunaan umum KLT adalah untuk menentukan banyaknya komponen
dalam campuran, identifikasi senyawa, memantau proses reaksi, menentukan
efektifitas pemurnian, menentukan kondisi yang sesuai untuk kromatografi kolom,
serta untuk memantau kromatografi kolom, melakukan screening sampel untuk
obat (Rohman, 2007).
Fase diam pada KLT sering disebut penyerap, biasanya dapat melewati
ayakan 250 mesh dengan ukuran partikel lebih kecil dari 63µ m. (Gritter, et al.,
1991). Banyak penyerap yang telah digunakan, termasuk silika gel dengan
ketebalan sekitar 0,10 sampai 0,25 mm, didukung oleh plat kaca, aluminium atau
plastik (Wall, 2005).
Permukaan polar dari gugus hidroksi silika gel berfungsi menarik molekul
sampel. Lapisan silika gel harus sesedikit mungkin mungkin mengandung air,
sehingga harus diaktifkan dengan pemanasan pada 1000C selama 1-3 jam. Jika
suhu pengaktifan jauh di atas 1100C terjadi dehidrasi yang tak bolak-balik
menyebabkan pemisahan kurang efektif (Gritter, et al., 1991).
Fase gerak adalah medium angkut, terdiri dari satu atau beberapa pelarut,
yang bergerak di dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya
kapiler (Stahl, 1985). Pemilihan sistem pelarut yang dipakai didasarkan atas
prinsip like dissolves like, artinya untuk memisahkan sampel yang bersifat
nonpolar digunakan sistem pelarut yang bersifat nonpolar juga. Proses
pengembangan akan lebih baik bila ruangan pengembangan tersebut telah jenuh
Nilai dihitung dengan menggunakan perbandingan sebagaimana
persamaan sebagai berikut:
Nilai maksimum adalah 1, solut bermigrasi dengan kecepatan sama dengan
fase gerak. Nilai minimum adalah 0, dan ini teramati jika solut tertahan pada
posisi titik awal di permukaan fase diam (Rohman, 2007).
Faktor-faktor yang mempengaruhi harga Rf pada KLT, antara lain:
struktur kimia dari senyawa yang dipisahkan, sifat dari penyerap dan derajat
aktivitasnya, tebal dan kerataan lapisan penyerap, derajat kemurnian fase gerak,
derajat kejenuhan uap pengembang pada bejana, jumlah cuplikan dan suhu
(Sastrohamidjojo, 1991).
2.4.2 Kromatografi Kolom
Penggunaan kolom besar merupakan metode kromatografi untuk
pemisahan campuran dalam jumlah besar (lebih dari 1 g). Campuran yang akan
dipisahkan berupa pita pada bagian atas kolom penyerap. Fase gerak dialirkan
melalui kolom oleh gaya berat atau oleh tekanan. Pita campuran bergerak melalui
kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi
(Gritter, et al., 1991).
Ukuran partikel penyerap untuk kolom dengan gaya tarik bumi biasanya
lebih besar daripada untuk KLT, yaitu 63-250 µ m, dapat melewati ayakan mesh
70-230; sedangkan untuk kolom dengan tekanan biasanya lebih kecil daripada
untuk KLT (Gritter, et al., 1991; Hostettmann, et al., 1995).
Karena memerlukan waktu yang lama dan bahan yang cukup banyak,
dapat dipecahkan melalui tiga pendekatan, antara lain penelusuran pustaka,
penerapan data KLT dan pemakaian elusi landaian (Gritter, et al., 1991).
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan
KLT) digabungkan, diuapkan dengan tekanan rendah. Jika pelarut dan penyerap
murni, maka fraksi-fraksi pun murni. Namun mungkin masih diperlukan
penghabluran ulang atau penyulingan kasar untuk memperoleh senyawa murni
(Gritter, et al., 1991).
2.5Spektoskopi
Spekstroskopi adalah studi mengenai interaksi cahaya dengan atom dan
molekul. Radiasi cahaya dan elektromagnetik dapat dianggap menyerupai
gelombang. (Creswell, et al., 2005).
2.5.1Spektrofotometri Ultraviolet
Spektrum ultraviolet merupakan gambaran antara panjang gelombang
serapan dan intensitas serapan (absorbansi). Panjang gelombang serapan
merupakan ukuran pemisahan tingkatan energi dari orbital-orbital. Intensitas dari
berkas cahaya sebanding dengan jumlah foton per detik yang melalui satu satuan
luas penampang (Sastrohamidjojo, 1991).
Apabila suatu molekul menyerap radiasi ultraviolet, di dalam molekul
tersebut terjadi perpindahan tingkat energi elektron-elektron ikatan di orbital
molekul terluar dari tingkat energi terendah ke tingkat energi yang tertinggi. Baik
molekul senyawa organik maupun anorganik dapat menyerap radiasi ultraviolet
tingkat tereksitasi, maka semakin besar panjang gelombang dari serapan
(Silverstein, et al., 1986).
Serapan transisi n→л* terjadi pada panjang gelombang yang panjang dan
intensitas yang rendah (Sastrohamidjojo, 1991), membutuhkan energi yang lebih
sedikit daripada transisi л →л* dan σ→σ* (Silverstein, et al., 1986).
2.5.2Spektrofotometri Inframerah
Spektrofotometri inframerah merupakan teknik spektrofotometri tercepat
dan termurah yang digunakan dalam kimia organik. Sampel dapat berupa padatan,
cairan atau gas, dan dapat diukur dalam larutan dengan KBr atau minyak mineral.
Kemudian spektrum dapat diperoleh hanya dalam beberapa menit dari material
murni parsial dengan tujuan memberikan indikasi bahwa reaksi yang terjadi
terjadi seperti yang diinginkan. (Cooper, 1980).
Identifikasi senyawa yang tidak diketahui gugus fungsinya dapat diuji
struktur inframerahnya, kemudian dideteksi menggunakan data korelasi
(Sastrohamidjojo, 1991). Menurut Pavia, et al., (1988), langkah-langkah umum
untuk memeriksa pita serapan adalah sebagai berikut:
1. Apakah terdapat gugus karbonil? Gugus C=O memberikan puncak pada
daerah 1820-1660 cm-1. Puncak ini biasanya merupakan yang terkuat dengan
medium lebar pada spektrum.
2. Jika gugus C=O ada, periksa gugus-gugus berikut. Jika tidak ada, langsung ke
nomor 3.
Asam : Apakah ada O-H? Serapan lebar di daerah 3300-2500 cm-1.
Amida : Apakah ada N-H? Serapan medium di dekat 3500 cm-1,
kadang-kadang dengan puncak rangkap.
Ester : Apakah ada C-O? Serapan medium di daerah 1300-1000 cm-1.
Anhidrida : Mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1.
Aldehida : Apakah ada C-H aldehid? Dua serapan lemah di daerah 2850-
2750 cm-1 yaitu di sebelah kanan serapan C-H.
Keton : Jika kelima kemungkinan di atas tidak ada.
3. Bila gugus C=O tidak ada.
Alkohol/fenol: Periksa gugus O-H, merupakan serapan lebar di daerah
3600-3300 cm-1 yang diperkuat adanya serapan C-O di daerah
1300-1000 cm-1.
Amina : Periksa gugus N-H, yaitu serapan medium di daerah 3500 cm-1.
Eter : Periksa gugus C-O (serapan O-H tidak ada), yaitu serapan
medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua dan/atau cincin aromatik.
- C=C mempunyai serapan lemah di daerah 1650 cm-1.
- Serapan medium sampai kuat pada daerah 1650-1450 cm-1 sering
menunjukkan adanya cincin aromatik.
- Buktikan kemungkinan di atas dengan memperhatikan serapan pada
daerah C-H aromatik di sebelah kiri 3000 cm-1, sedangkan C-H alifatis
terjadi di sebelah kanan daerah tersebut.
5. Ikatan rangkap tiga.
- C≡C mempunyai serapan lemah tapi tajam di daerah 2150 cm-1. Periksa
juga CH asetilenik di dekat 3300 cm-1.
6. Gugus nitro.
Dua serapan kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1.
7. Hidrokarbon.
- Apabila keenam kemungkinan di atas tidak ada.
- Serapan utama di daerah C-H dekat 3000 cm-1.
- Spektrum sangat sederhana, hanya terdapat serapan lain di daerah
BAB III
METODE PENELITIAN
Metode penelitian meliputi pengumpulan dan pengolahan bahan
tumbuhan, pembuatan ekstrak, analisis fraksi n-heksan yang dilanjutkan isolasi
senyawa triterpenoid menggunakan kromatografi kolom dan KLT preparatif.
Isolat yang diperoleh diuji kemurniannya dengan KLT satu arah dan dua arah,
karakterisasi isolat dengan spektrofotometer ultraviolet dan inframerah.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, blender (National), desikator, hairdryer (Fransen), neraca digital
(Vibra AJ), neraca kasar (Home Line), oven listrik (Memmert), penangas air
(Yenaco), penguap vakum putar (Haake D1 Fisons), seperangkat alat KLT dan
alat kromatografi kolom, seperangkat alat penetapan kadar air, spektrofotometer
inframerah (IRPrestige21 Shimadzu), spektrofotometer ultraviolet (UV1800
Shimadzu) dan tanur.
3.2 Bahan-bahan
Bahan tumbuhan yang digunakan pada penelitian ini adalah umbi bawang
sabrang (Eleutherinae bulbus). Bahan kimia yang digunakan kecuali dinyatakan
lain adalah berkualitas proanalisis, yaitu asam asetat anhidrid, asam asetat glasial,
asam klorida, asam nitrat, asam sulfat, benzen, besi (III) klorida, bismut (III)
iodida, kalium natrium tartrat, kloroform, metanol, natrium hidroksida, natrium
sulfat anhidrat, n-heksan, plat pralapis silika gel GF254, raksa (II) klorida, serbuk
magnesium, serbuk seng, silika gel GF254, silika gel 60 mesh 70-230 ASTM,
timbal (II) asetat, tembaga sulfat, toluen, dan α- naftol. Air suling dan n-heksan
hasil destilasi.
3.3 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.3.1 Pengumpulan Bahan Tumbuhan
Sampel yang digunakan dalam penelitian ini adalah umbi bawang sabrang
(Eleutherinae bulbus) yang diambil dari Jalan Bunga Rampe V, Kelurahan
Simalingkar B, Kecamatan Medan Tuntungan, Kotamadya Medan, Sumatera
Utara. Bagian tumbuhan yang digunakan adalah umbi segar yang berwarna merah
dengan umur ± 3 bulan. Pengambilan sampel dilakukan secara purposif, yaitu
tanpa membandingkan dengan tumbuhan dari tempat lain.
3.3.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian dan Pengembangan
Biologi, LIPI, Bogor.
3.3.3 Pembuatan Simplisia
Umbi bawang sabrang (Eleutherinae bulbus) yang baru diambil
dibersihkan dari kotoran, dicuci dengan air yang bersih, ditiriskan di atas kertas
perkamen, lalu ditimbang berat basahnya. Simplisia basah diiris, dikeringkan di
lemari pengering hingga kering dan rapuh, lalu ditimbang berat keringnya.
Selanjutnya simplisia kering diserbuk dengan blender dan disimpan dalam wadah
3.4 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi dilakukan menurut Depkes (1979) (pereaksi
kloralhidrat, asam klorida 2 N, natrium hidoksida 2 N, Bouchardat, Mayer),
Depkes (1995) (pereaksi besi (III) klorida 1%, timbal (II) asetat 0,4 N, Molish),
Zweig (1987) (pereaksi Dragendorff) dan Wagner, et all (1984) (pereaksi
Liebermann-Burchard).
3.4.1 Pereaksi kloralhidrat
Sebanyak 50 g kloralhidrat ditimbang dan dilarutkan dalam 20 ml air
suling.
3.4.2 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga
100 ml.
3.4.3 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml.
3.4.4 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 8 ml air suling, lalu
ditambahkan 2 g iodium dilarutkan sedikit demi sedikit ke dalam kalium iodida,
lalu volumenya dicukupkan dengan air suling sampai 100 ml.
3.4.5 Pereaksi Dragendorff
Sebanyak 0,85 g bismuth (III) nitrat dilarutkan dalam 100 ml asam asetat
glasial, lalu ditambahkan 40 ml air suling. Pada wadah yang lain dilarutkan 8 g
kalium iodida dalam 20 ml air suling, kemudian dicampurkan kedua larutan sama
banyak, lalu ditambahkan 20 ml asam asetat glasial dan diencerkan dengan air
3.4.6 Pereaksi Mayer
Sebanyak 60 ml raksa (II) klorida dicampur dengan 10 ml larutan kalium
iodida 50%, kemudian ditambahkan air suling sampai 100 ml.
3.4.7 Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh
100 ml larutan.
3.4.8 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas
karbon dioksida hingga 100 ml.
3.4.9 Pereaksi Liebermann-Burchard
Sebanyak 5 ml asam asetat anhidrid ditambahkan 5 ml asam sulfat pekat,
ditambahkan ke dalam 50 ml etanol absolut, dibiarkan mendingin. Larutan ini
harus dibuat baru.
3.4.10 Pereaksi timbal (II) asetat 0,4 N
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbon dioksida secukupnya hingga 100 ml.
3.5 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia dilakukan menurut World Health
Organization (1992) (penetapan kadar air) dan Depkes (1995) (pemeriksaan
makroskopik, pemeriksaan mikroskopik, penetapan kadar sari yang larut dalam
air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik terhadap umbi segar dan simplisia dilakukan
dengan mengamati organoleptis, meliputi bentuk, warna, bau dan rasa, serta
ukuran.
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan dengan cara menaburkan serbuk
simplisia di atas kaca objek yang telah ditetesi dengan kloralhidrat, dipanaskan di
atas lampu spiritus, kemudian ditutup dengan kaca penutup, diamati di bawah
mikroskop. Untuk melihat adanya butir amilum, serbuk simplisia ditaburkan di
atas kaca objek yang telah ditetesi dengan air suling, kemudian ditutup dengan
kaca penutup, diamati di bawah mikroskop.
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Cara kerja :
Ke dalam labu alas bulat dimasukkan 200 ml toluen dan 2 ml air suling,
didestilasi selama 2 jam. Setelah itu toluen dibiarkan mendingin selama 30 menit
dan volume air pada tabung penerima dibaca. Kemudian ke dalam labu
dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan
hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2
tetes per detik, sampai sebagian air terdestilasi. Kemudian kecepatan destilasi
dinaikkan hingga 4 tetes per detik. Setelah semua air terdestilasi, bagian dalam
pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian
memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua
volume air dibaca dengan kandungan air yang terdapat dalam bahan yang
diperiksa. Kadar air dihitung dalam persen.
3.5.4 Penetapan Kadar Sari yang Larut dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter)
dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian
dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara, dan sisa dipanaskan
pada suhu 105º C sampai bobot tetap. Kadar sari yang larut dalam air dihitung
terhadap bahan yang telah dikeringkan.
3.5.5 Penetapan Kadar Sari yang Larut dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96% dalam labu bersumbat sambil sesekali dikocok
selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring
cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa
dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar sari yang larut dalam
etanol dihitung terhadap bahan yang telah dikeringkan.
3.5.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk yang telah dihaluskan dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, lalu diratakan. Krus
ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang
telah dikeringkan.
3.5.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan
dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam
asam dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci
dengan air panas. Residu dan kertas saring dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung
terhadap bahan yang dikeringkan.
3.6 Skrining Fitokimia
Skrining fitokimia serbuk simplisia dilakukan menurut Depkes (1995)
(alkaloid, flavonoid, glikosida, glikosida antrakinon dan saponin) dan Farnsworth
(1966) (pemeriksaan tanin, triterpenoid/ steroid dan glikosida sianogenik).
3.6.1 Pemeriksaan Alkaloid
Serbuk ditimbang sebanyak 0,5 g, ditambahkan 1 ml asam klorida 2 N dan
9 ml air suling, dipanaskan di atas penangas air selama 10 menit, didinginkan dan
disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid. Ke dalam 4 tabung
reaksi dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
1. ditambahkan 2 tetes pereaksi Mayer
2. ditambahkan 2 tetes pereaksi Dragendorff
3. ditambahkan 2 tetes pereaksi Bouchardat
Alkaloid positif jika terjadi endapan atau kekeruhan pada minimal dua dari tiga
3.6.2 Pemeriksaan Flavonoid
Serbuk ditimbang sebanyak 0,5 g, lalu ditambahkan 10 ml metanol,
direfluks selama 10 menit, disaring panas-panas melalui kertas saring. Filtrat
diencerkan dengan 10 ml air suling. Setelah dingin ditambahkan 5 ml eter minyak
tanah, dikocok hati-hati, lalu diamkan sebentar. Lapisan metanolnya diambil,
diuapkan pada temperatur 40ºC, sisanya dilarutkan dalam 5 ml etilasetat, disaring.
Filtratnya digunakan untuk uji flavonoid dengan cara berikut:
a. Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, lalu ditambah 0,5 g serbuk seng dan 2 ml asam klorida 2 N,
didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida
pekat. Jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan
adanya flavonoid.
b. Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 95 %, lalu ditambah 0,1 g serbuk magnesium dan 10 tetes asam klorida
pekat. Jika terjadi warna merah jingga sampai warna merah ungu
menunjukkan adanya flavonoid, warna kuning jingga menunjukkan adanya
flavon, kalkon dan auron.
3.6.3 Pemeriksaan Glikosida
Serbuk ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol
95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama 2 jam,
didinginkan dan disaring. Diambil 20 ml filrat ditambahkan 25 ml air suling dan
25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat
disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan
anhidrat dan diuapkan pada temperatur tidak lebih dari 50 C. Sisanya dilarutkan
dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut :
1. 0,1 ml larutan percobaan diuapkan, ditambahkan 5 ml asam asetat anhidrid dan
10 tetes asam sulfat pekat.
2. 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan diatas
penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish.
Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui
dinding tabung. Terbentuknya cincin berwarna ungu pada batas kedua cairan
menunjukkan glikosida.
3. Serbuk sampel direbus dalam air, didinginkan, disaring. Pada filtrat
ditambahkan fehling A dan fehling B (1:1), dipanaskan. Terbentuknya endapan
merah bata menunjukkan adanya gula pereduksi.
3.6.4 Pemeriksaan Saponin
Serbuk ditimbang sebanyak 0,5 g dan dimasukan ke dalam tabung reaksi,
lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama
10 detik. Terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit
dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan
adanya saponin.
3.6.5 Pemeriksaan Tanin
Serbuk daun ditimbang sebanyak 1 g, dididihkan selama 3 menit dalam
100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1- 2 tetes
pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau
kehitaman menunjukkan adanya tanin.
Serbuk ditimbang sebanyak 1 g, dimaserasi dengan 20 ml n-heksan 2 jam,
disaring, filtrat diuapkan dalam cawan penguap, dan pada sisanya ditambahkan
pereaksi Liebermann-Burchard. Terbentuknya warna ungu atau merah yang
berubah menjadi merah ungu atau biru hijau menunjukkan adanya
triterpenoid/steroid.
3.6.7 Pemeriksaan Glikosida Antrakinon
Serbuk ditimbang sebanyak 0,2 g, ditambahkan 5 ml asam sulfat 2 N,
dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Kocok lapisan benzena
dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan
benzen tidak berwarna menunjukkan adanya antrakinon.
3.6.8 Pemeriksaan Glikosida Sianogenik
Sebanyak 0,5 g serbuk dimasukkan ke dalam erlenmeyer, dilembabkan
dengan air. Diselipkan kertas saring yang telah dibasahi natrium pikrat pada mulut
erlenmeyer, ditutup, dibiarkan terkena sinar matahari. Jika kertas saring
memberikan warna merah, menunjukkan adanya sianogenik glikosida.
3.7 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
etanol 80%, kemudian ekstrak etanol dipartisi dengan cara fraksinasi
menggunakan pelarut n-heksan.
Cara kerja:
Sejumlah serbuk simplisia dimasukkan ke dalam wadah bertutup,
dibiarkan selama 120 jam terlindung dari cahaya sambil sering diaduk, disaring.
Diperoleh filtrat hasil maserasi (maserat). Pengerjaan dilakukan berulangkali
hingga maserat tidak memberikan warna. Maserat yang diperoleh digabungkan,
kemudian diuapkan dengan bantuan penguap vakum putar pada suhu ± 400C
sampai diperoleh ekstrak kental. Ekstrak etanol yang diperoleh ditambahkan air
suling, lalu difraksinasi dengan n-heksan. Dilakukan berulang kali sampai fraksi
n-heksan memberikan hasil negatif terhadap pereaksi Liebermann-Burchard.
Fraksi n-heksan diuapkan. Bagan ekstraksi dapat dilihat pada lampiran 10
halaman 39.
3.8Analisa Fraksi n-heksan Secara KLT
Terhadap fraksi n-heksan dilakukan analisa secara KLT dengan fase diam
plat pralapis tipis silika gel GF254, menggunakan fase gerak n-heksan-etilasetat
dengan berbagai perbandingan yaitu (9:1), (8:2), (7:3), (6:4), (5:5). Sebagai
penampak bercak digunakan pereaksi Liebermann-Burchard.
Cara kerja :
Fraksi n-heksan ditotolkan pada plat pralapis tipis silika gel GF254,
kemudian dimasukkan ke dalam bejana yang telah jenuh dengan uap fase gerak.
Setelah elusi selesai, plat dikeluarkan dan dikeringkan, amati bercak yang terjadi
dan hitung harga Rf-nya. Plat kemudian disemprot dengan penampak bercak
Liebermann-Burchard, dipanaskan di oven pada suhu 1100C selama 15-20 menit.
Amati bercak yang terjadi dan hitung harga Rf-nya.
Terhadap fraksi n-heksan dilakukan pemisahan dengan kromatografi
kolom menggunakan fase diam silika gel 60 mesh 70-230 ASTM dengan ukuran
partikel 0,063-0,200 dan fase gerak n-heksan-etilasetat (7:3).
Cara kerja :
Seperangkat alat kromatografi kolom dirangkai dan ke dalam dasar kolom
dimasukkan kapas yang telah dicuci dengan metanol sebagai filter. Silika gel
disuspensikan dengan fase gerak n-heksan-etilasetat (7:3), diaduk sampai
gelembung udara habis, lalu dimasukkan ke dalam kolom yang telah diisi dengan
fase gerak yang sama. Dinding kolom diketuk-ketuk untuk menghilangkan
gelembung udara sambil dialiri dengan fase gerak sampai memadat. Kolom yang
telah dikemas dibiarkan selama 24 jam, kemudian kran kolom dibuka sampai
genangan pelarut setinggi fase diam. Fraksi n-heksan dilarutkan dengan sedikit
fase gerak dan ditambahkan sedikit fase diam dan aduk rata, setelah fase gerak
menguap dimasukkan ke dalam kolom secara perlahan-lahan dengan kran
tertutup. Setelah sampel turun tepat setinggi fase diam, melalui dinding kolom
secara perlahan-lahan dialirkan fase gerak sambil kran kolom dibuka. Tetesan
yang keluar diatur agar sama dengan tetesan pelarut dari reservoir. Hasil elusi
(eluat) ditampung dalam vial masing-masing sebanyak 5 ml kemudian elusi
dihentikan setelah eluat memberikan hasil negatif terhadap pereaksi
Liebermann-Burchard. Selanjutnya terhadap eluat dipantau dengan KLT menggunakan plat
pralapis tipis silika gel GF254 dengan fase gerak n-heksan-etilasetat (7:3). Setelah
dielusi, disemprot dengan pereaksi Liebermann-Burchard, dan untuk pola
3.10 Pembuatan Plat KLT
Sebanyak 10 g silika gel GF254 dimasukkan ke dalam lumpang porselen
kering, ditambahkan 20 ml air suling, diaduk perlahan-lahan dengan alu sampai
diperoleh suspensi homogen tanpa ada gumpalan ataupun gelembung udara
dengan jangka waktu pengadukan tidak lebih dari 90 detik. Suspensi dituang ke
plat kaca berukuran 20 x 20 cm yang telah dicuci dengan metanol terlebih dahulu,
dibiarkan kering, kemudian diaktifkan dalam oven pada suhu 110o selama 30
menit. Plat disimpan di tempat yang tidak lembab dan bebas dari uap
laboratorium.
3.11 Pemisahan Isolat dengan KLT Preparatif
Fraksi yang terbentuk dari Kristal yang diperoleh dipisahkan kembali
dengan KLT preparatif menggunakan fase diam plat pralapis tipis silika gel GF254
dan fase gerak n-heksan-etilasetat (7:3) menggunakan penampak bercak
Liebermann-Burchard.
Cara kerja:
Kristal yang diperoleh ditotolkan berupa pita pada plat KLT berukuran 20
x 20 cm, kemudian dimasukkan ke dalam bejana yang telah jenuh dengan uap fase
gerak. Setelah elusi selesai plat dikeluarkan dan dikeringkan. Salah satu ujung plat
disemprot dengan pereaksi Liebermann-Burchard, lalu dipanaskan dengan
bantuan hairdryer. Bagian plat yang memberikan harga Rf yang sama dengan
noda yang positif terhadap pereaksi Liebermann-Burchard dikerok, dilarutkan
dengan metanol dingin. Kemudian filtrat dipisahkan dengan cara didekantasi dan
3.12 Pemurnian Kristal
Kristal hasil isolasi KLT preparatif dicuci berulang kali dengan metanol
dingin tetes demi tetes sampai larut, masukkan dalam freezer. Kemudian kristal
yang terbentuk dipisahkan, dicuci kembali sampai terbentuk kristal jarum.
3.13 Uji Kemurnian Isolat
Uji kemurnian terhadap isolat yang diperoleh dilakukan dengan KLT satu
arah dengan fase diam plat pralapis tipis silika gel GF254, menggunakan berbagai
fase gerak, yaitu n-heksan-etilasetat (7:3), toluen-etilasetat (7:3) dan
kloroform-toluen (7:3). Sebagai penampak bercak digunakan pereaksi Liebermann-Burchard.
Selanjutnya dilakukan uji kemurnian dengan KLT dua arah dengan fase
diam plat pralapis tipis silika gel GF254 berukuran 20 x 20 cm. Fase gerak I adalah
toluen-etilasetat (7:3) dan fase gerak II adalah kloroform-toluen (7:3), sebagai
penampak bercak digunakan pereaksi Liebermann-Burchard.
3.14 Karakterisasi Isolat
Karakterisasi terhadap isolat yang diperoleh menggunakan
spektrofotometer ultraviolet dan spektrofotometer inframerah.
3.14.1 Spektrofotometri Ultraviolet
Karakterisasi isolat secara spektrofotometri ultraviolet dilakukan dengan
yang terlebih dahulu dibilas dengan larutan sampel dan diukur panjang gelombang
maksimum pada panjang gelombang 200-600 nm.
3.14.2 Spektrofotometri Inframerah
Karakterisasi isolat secara spektrofotometri inframerah dilakukan dengan
cara mencampurkan sedikit kristal isolat dengan KBr, dicetak menjadi pelt,
kemudian diukur menggunakan spektrofotometer inframerah pada frekuensi
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan
Pengembangan Biologi, LIPI, Bogor, menyebutkan bahwa tumbuhan yang
digunakan adalah bawang sabrang/ bawang hantu (Eleutherine palmifolia (L.)
Merr) suku Iridaceae. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1
halaman 41 dan gambar tumbuhan pada lampiran 2 halaman 42.
Pada pengolahan bahan tumbuhan, berat basah bahan setelah sortasi basah
diperoleh 5190 g. Bahan tumbuhan dikeringkan di lemari pengering untuk
menghentikan proses enzimatik sehingga mencegah kerusakan simplisia
(Goeswin, 2007), dan setelah sortasi kering diperoleh berat kering simplisia 2270
g, dengan demikian susut pengeringan yang dialami simplisia adalah sebesar
56,26%.
Hasil pemeriksaan makroskopik menunjukkan umbi segar bawang sabrang
berbentuk bulat telur memanjang, berwarna merah dan tidak berbau, serta berasa
pahit. Umbi lapis terdiri dari 5-6 lapisan dengan pangkal daun di tengahnya dan
biasanya memiliki panjang 4-9 cm dan diameter 4-7 cm, gambar umbi segar pada
lampiran 2 halaman 31. Simplisia yang kering berwarna merah pucat dan sangat
rapuh, gambar simplisia dapat dilihat pada lampiran 3 halaman 43.
Pemeriksaan mikroskopik terhadap serbuk simplisia menunjukkan adanya
beberapa fragmen pengenal yang dapat dilihat pada lampiran 4 halaman 44, yaitu
kristal Ca-oksalat berbentuk jarum dimana letak kristal tidak beraturan; parenkim
dengan penebalan dinding sel berupa tangga (skalarifom); dan butir amilum
dengan satu hilus (monoadelph) dan hilus berada di tengah (kosentris).
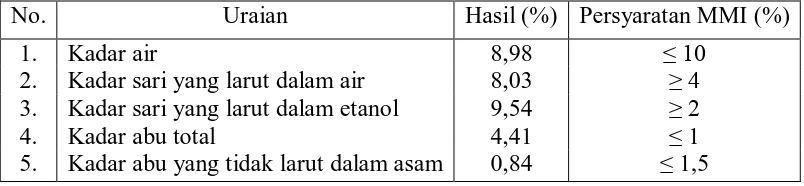
Hasil pemeriksaan karakteristik simplisia dapat dilihat pada tabel 1
berikut. Perhitungan penetapan karakteristik simplisia dapat dilihat pada lampiran
[image:42.595.115.517.264.357.2]5-9 halaman 45-50.
Tabel 1. Hasil Penetapan Karakteristik Simplisia Umbi Bawang Sabrang (Eleutherinae bulbus)
No. Uraian Hasil (%) Persyaratan MMI (%)
1. Kadar air 8,98 ≤ 10
2. Kadar sari yang larut dalam air 8,03 ≥ 4 3. Kadar sari yang larut dalam etanol 9,54 ≥ 2
4. Kadar abu total 4,41 ≤ 1
5. Kadar abu yang tidak larut dalam asam 0,84 ≤ 1,5
Berdasarkan tabel di atas, kadar abu total yang diperoleh sebesar 4,41%
tidak memenuhi persyaratan MMI, yaitu kurang dari 1%. Hal ini disebabkan
karena umbi bawang sabrang yang digunakan sebagai sampel diperoleh dari
dalam tanah, dimana terjadi kontaminasi mikroorganisme maupun debu dari tanah
terhadap umbi. Untuk mengurangi jumlah kontaminasi dapat dilakukan
pengupasan kulit terluar (Goeswin, 2007).
Skrining fitokimia perlu dilakukan untuk mendapatkan gambaran
mengenai golongan senyawa metabolit sekunder yang terdapat pada tumbuhan
bawang sabrang. Hasil skrining fitokimia simplisia dapat dilihat pada tabel 2.
Pemeriksaan alkaloid dengan penambahan pereaksi Mayer terjadi
kekeruhan, larutan iodium terjadi kekeruhan, Dragendorff terbentuk warna jingga
kecoklatan, dan Bouchardat tebentuk warna kuning kecoklatan, menunjukkan
adanya senyawa alkaloid. Pemeriksaan flavonoid dengan serbuk magnesium dan
Pemeriksaan glikosida dengan Molish dan asam sulfat pekat pada dinding tabung
terbentuk cincin ungu yang segera hilang, dan terbentuk endapan merah bata pada
penambahan fehling A dan fehling B menunjukkan adanya glikosida. Uji busa
terbentuk buih ±0,5 cm yang stabil dengan penambahan asam klorida 2 N
menunjukkan adanya saponin. Terbentuknya warna kuning kehijauan pada
penambahan besi (III) klorida 1% menunjukkan adanya tanin. Penambahan
Liebermann-Burchard memberikan warna ungu menujukkan adanya triterpenoid.
Pemeriksaan glikosida antrakinon terbentuk warna merah pada lapisan air,
sedangkan lapisan benzen berwarna kuning menunjukkan adanya glikosida
antrakinon. Tidak berubahnya warna kertas saring yang dibasahi natrium pikrat
[image:43.595.115.465.429.565.2]memberikan hasil negatif glikosida sianogenik.
Tabel 2. Hasil Skrining Fitokimia Serbuk Simplisia Umbi Bawang Sabrang (Eleutherinae bulbus)
Keterangan: (+) = mengandung senyawa (-) = tidak mengandung senyawa
Ekstraksi serbuk simplisia dilakukan dengan cara maserasi menggunakan
pelarut etanol 80%, hasilnya diperoleh 129,796 g ekstrak etanol dari 1300 g
serbuk simplisia. Terhadap ekstrak etanol dilakukan ekstraksi cair-cair dengan
campuran pelarut n-heksan-air suling (2:1) v/v, dimana diharapkan senyawa No. Golongan Senyawa yang Diperiksa Hasil
1. Alkaloid +
2. Flavonoid +
3. Glikosida +
4. Saponin +
5. Tanin +
6. Triterpenoid/Steroid +
7. Glikosida Antrakinon +
triterpenoid tersari sempurna, hasilnya diperoleh 2,362 g fraksi n-heksan dari
57,065 g ekstrak etanol.
Analisa KLT fraksi n-heksan digunakan fase gerak n-heksan-etilasetat
dengan perbandingan (9:1), (8:2), (7:3), (6:4), (5:5). Fase gerak yang terbaik
adalah perbandingan (7:3), memberikan bercak yang paling banyak dengan
penampak bercak Liebermann-Burchard, diperoleh 9 noda yaitu 5 senyawa
triterpenoid, Rf 0,075 (merah muda), 0,213 (ungu), 0,475 (ungu merah), 0,563
(ungu merah), 0,725 (ungu lemah); dan 4 noda lainnya Rf 0,150 (coklat), 0,388
(hijau tua), 0,775 (hijau muda) dan 0,850 (coklat muda). Kromatogram dapat
dilihat pada lampiran 12 halaman 52-53.
Pemisahan lebih lanjut fraksi n-heksan dengan kromatografi kolom
menggunakan fase gerak n-heksan-etil asetat (7:3) dan fase diam silika gel 60
mesh 70-230 ASTM dengan ukuran partikel 0,063-0,200. Hasilnya ditampung
pada vial masing-masing sebanyak 5 ml, diperoleh 59 vial. Terhadap eluat
dilakukan analisis secara KLT dengan fase gerak n-heksan-etilasetat (7:3),
diperoleh 8 fraksi, yaitu F1 (vial 1-2), F2 (vial 3-7), F3 (vial 8-15), F4 (vial
16-19), F5 (vial 20-29), F6 (vial 30-34), F7 (vial 34-50) dan F8 (vial 51-59).
Kromatogram hasil penggabungan fraksi kromatografi kolom dapat dilihat pada
lampiran 13 halaman 54.
Hasil kromatografi kolom menunjukkan bahwa pada isolat F5, F6 dan F7
telah terbentuk kristal. Pada F5 diperoleh 2 noda yang berwarna ungu merah
dengan Rf 0,475 dan 0,563. Selanjutnya dicuci dengan metanol dingin sampai
terbentuk kristal berbentuk jarum. Pada F7 telah dijumpai 1 noda yang berwarna
Uji kemurnian isolat dengan KLT satu arah menggunakan berbagai macam
fase gerak, yaitu toluen-etilasetat (7:3), n-heksan-etilasetat (7:3) dan kloroform-
toluen (7:3). Pada F5 telah dijumpai satu bercak berwarna ungu merah dengan
penampak bercak Liebermann-Burchard, harga Rf berturut-turut 0,5441, 0,459
dan 0,306. Sedangkan pada F7 ternyata diperoleh 2 noda, yaitu Rf 0,213 yang
berwarna ungu dan Rf 0,312 yang terlihat memberikan fluoresensi kuning di
bawah sinar UV 254 nm namun tidak memberikan hasil positif dengan penampak
bercak Liebermann-Burchard dengan, sehingga perlu dilakukan pemisahan lebih
lanjut dengan KLT preparatif.
Terhadap F7 dilakukan KLT preparatif menggunakan fase diam plat
pralapis silika gel GF254, fase gerak n-heksan-etilasetat (7:3), dan bagian yang
memberikan harga Rf yang sama dengan bercak dikerok dan dilarutkan dalam
metanol dingin. Setelah didekantasi dan diuapkan. Selanjutnya dicuci dengan
metanol dingin sampai terbentuk kristal berbentuk jarum. Kromatogram KLT
preparatif dapat dilihat pada lampiran 14 halaman 55.
Uji kemurnian isolat dengan KLT satu arah menggunakan berbagai macam
fase gerak, yaitu toluen-etilasetat (7:3), n-heksan-etilasetat (7:3) dan kloroform-
toluen (7:3) terhadap F7 telah memberikan satu bercak berwarna ungu dengan
penampak bercak Liebermann-Burchard, harga Rf berturut-turut 0,550, 0,250 dan
0,231.
Pada pemeriksaan KLT dua arah dengan fase gerak toluen-etilasetat (7:3)
dan kloroform-toluen (7:3), isolat F5 memberikan satu bercak berwarna ungu
merah dengan penampak bercak Liebermann-Burchard, harga Rf 0,557 dan 0,091
Liebermann-Burchard, harga Rf 0,405 dan 0,209. Kromatogram uji kemurnian
isolat dapat dilihat pada lampiran 15-16 halaman 56-59.
Spektrum ultraviolet isolat F5 dan F7 memberikan panjang gelombang
maksimum (λ) 393 dan 333 nm, yang menunjukkan adanya gugus kromofor yang
mengalami transisi n→л * (Sastrohamidjojo, 1991). Hasil pemeriksaan
spektrofotometri ultraviolet isolat dapat dilihat pada lampiran 17-18 halaman
60-61.
Penafsiran spektrum inframerah isolat F5, antara lain terdapat serapan kuat
pada bilangan gelombang 1691,57 cm-1 menunjukkan adanya gugus C=O, serapan
kuat pada bilangan gelombang 1585,49 cm-1 menunjukkan adanya gugus C=C
aromatik yang diperkuat dengan serapan pada bilangan gelombang 3072,60 cm-1
menunjukkan adanya gugus C-H aromatis, serapan kuat pada bilangan gelombang
1641,42 cm-1 menunjukkan adanya gugus C=C alkena, bilangan gelombang
1255,66 cm-1 dengan intensitas sedang menunjukkan adanya gugus C-O, bilangan
gelombang 2922,16 cm-1 menunjukkan adanya gugus C-H alifatis, bilangan
gelombang 1462,04 cm-1 dengan intensitas sedang menunjukkan adanya gugus
C-H metilen, dan bilangan gelombang 1456,26 dan 1379,10 cm-1 dengan intensitas
sedang menunjukkan adanya gugus C-H metil (Pavia, et al., 1988).
Penafsiran spektrum inframerah isolat F7, antara lain terdapat serapan kuat
pada bilangan gelombang 1680 cm-1 menunjukkan adanya gugus C=O, serapan
kuat pada bilangan gelombang 1585,49 cm-1 menunjukkan adanya gugus C=C
aromatik yang diperkuat dengan serapan pada bilangan gelombang 3151,69 cm-1
menunjukkan adanya gugus C-H aromatis, bilangan gelombang 1132,21 cm-1
2947,23 cm-1 menunjukkan adanya gugus C-H alifatis, dua serapan lemah
bilangan gelombang 2758,21 dan 2727,35 cm-1 menunjukkan adanya gugus C-H
aldehid, bilangan gelombang 1460,11 cm-1 dengan intensitas sedang menunjukkan
adanya gugus C-H metilen, dan bilangan gelombang 1442,75 dan 1352,10 cm-1
dengan intensitas sedang menunjukkan adanya gugus C-H metil (Pavia, et al.,
1988). Hasil pemeriksaan spektrofotometri inframerah isolat dapat dilihat pada
BAB V
KESIMPULAN DAN SARAN
4.1Kesimpulan
1. Hasil analisis KLT pada fraksi n-heksan dari umbi bawang sabrang
(Eleutherinae bulbus) diperoleh n-heksan-etilasetat (7:3) sebagai fase gerak
terbaik dengan pemisahan terbanyak. Hasil kromatografi kolom diperoleh
isolat golongan triterpenoid, yaitu Rf 0,475 (ungu merah) dan dengan Rf 0,213
(ungu) masing-masing untuk isolat F5 dan F7 setelah disemprot dengan
penampak bercak Liebermann-Burchard menggunakan fase gerak yang sama.
2. Hasil spektrofotometri ultraviolet dan inframerah isolat F5 diperoleh panjang
gelombang maksimum (λ) 393 nm dan adanya gugus C=O, C=C aromatik,
C-H aromatik, C=C alkena, C-O, C-C-H alifatis, C-C-H metilen dan C-C-H metil. C-Hasil
spektrofotometri ultraviolet dan inframerah isolat F7 diperoleh panjang
gelombang maksimum (λ) 333 nm adanya gugus C=O, C=C aromatik,C-H
aromatik, C-O, C-H alifatis, C-H aldehid, C-H metilen dan C-H metil.
4.2Saran
Disarankan kepada peneliti selanjutnya untuk melakukan elusidasi struktur
terhadap senyawa triterpenoid hasil isolasi yang diperoleh serta melakukan uji
DAFTAR PUSTAKA
Adnan, M. (1997). Teknik Kromatografi Untuk Analisis Bahan Makanan. Yogyakarta : Penerbit Andi. Halaman 10, 15-16.
Aguirre, M. C., Delporte. C., Backhouse, N., Erazo, S., Letelier, M. E., Cassels, B. K., Silva, X., Alegria, S., Negrete, R. (2006). Topical Anti-Inflamatory
Activity of 2α-Hydroxy Pentacyclic Triterpen Acids from the Leaves of Ugni molinae. In Journal Bioorganic and Medicinal Chemistry Vol. 14.
Pages 5673-5677.
Arung, E. T., Kusuma, I. W., Christy, E. D., Shimizu, K., Kondo, R. (2009).
Evaluation of Medicinal Plants from Central Kalimantan for Antimelanogenesis. In Journal Nat. Med Vol. 63. Pages 473-480.
Atenza, M., Ratnawati, D., Widiyati, E. (2009). Uji Pendahuluan Penentuan
Adanya Kandungan Senyawa Flavonoid dan Triterpenoid Pada Tanaman Sayuran Serta Bioassay Brine Shrimp Menggunakan Artemia Salina Leach. Bengkulu : FMIPA Universitas Bengkulu. Halaman 1.
Cooper, J. W. (1980). Spectroscopic Teqniques For Organic Chemist. United States of America : John Wiley & Sons. Pages 231.
Creswell, C. J., Runqeist, O. A., dan Campbell, M. M. (2005). Analisis Spektrum
Senyawa Organik. Diterjemahkan oleh Kosasih Padmawinata dan Iwang
Soediro. Bandung : Penerbit ITB. Halaman 1.
Delporte, C., Backhouse, N., Inostroza, V., Aguirre, M. C., Peredo, N., Silva, X., Negrete, R., Miranda, H. F. (2007). Analgesic Activity of Ugni molinae
(Murtilla) in Mice Models of Acute Pain. In Journal Bioorganic and
Medicinal Chemistry. Pages 162-165.
Depkes. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 3.
Depkes. (1985). Tanaman Obat Indonesia. Jilid II. Jakarta : Departemen Kesehatan RI. Halaman 47.
Depkes. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan RI. Halaman 10-13.
Depkes. (1989). Materia Medika Indonesia. Jilid V. Jakarta : Departemen Kesehatan RI. Halaman 194-197.
Depkes. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 10-11.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plant. In Journal of Pharmaceutical Science Volume 55 Number 3. Chicago : Reheis Chemical Company. Pages 245-266.
Galingging, R.Y. (2009). Bawang Dayak (Eleutherine palmifolia) Sebagai
Tanaman Obat Multifungsi. Dalam Warta Penelitian dan Pengembangan
Volume 15 Nomor 3. Halaman 2-4.
Goeswin, A. (2007). Teknologi Bahan Alam. Bandung : Penerbit ITB. Halaman 12-27.
Gritter, R.J., Bobbit, J.M. dan Schwarting, A.E. (1991). Pengantar Kromatografi. Terbitan Kedua. Diterjemahkan oleh Kosasih Padmawinata. Bandung : Penerbit ITB. Halaman 108-109, 160-179.
Harbone, J.B. (1987). Metode Fitokimia. Diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro. Bandung : Penerbit ITB. Halaman 4-5, 147.
Hariana, A. (2004). Tumbuhan Obat dan Khasiatnya Seri I. Depok : Penebar Swadaya. Halaman 1.
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Jilid I. Cetakan ke-I. Diterjemahkan oleh Badan Litbang Kehutanan. Jakarta : Yayasan Sarana Wana Jaya. Halaman 551-552.
Hostettmann, K., Hostettmann, M. dan Marston, A. (1995). Cara Kromatografi
Preparatif. Diterjemahkan oleh Kosasih Padmawinata. Bandung :
Penerbit ITB. Halaman 33.
IUPAC. (1989). Nomenclature of Steroid. In Pure & Applied Chemistry Volume 61 Number 10. London : Queen Mary College, Mi