VALIDASI METODE ANALISIS BASA PURIN ADENIN DAN
HIPOSANTIN PADA EMPING MELINJO DENGAN
INSTRUMEN HPLC-UV
MUTIARA PRATIWI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Validasi Metode Analisis Basa Purin Adenin dan Hiposantin pada Emping Melinjo dengan Instrumen HPLC-UV adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Mutiara Pratiwi
ABSTRAK
MUTIARA PRATIWI. Validasi Metode Analisis Basa Purin Adenin dan Hiposantin pada Emping Melinjo dengan Instrumen HPLC-UV. Dibimbing oleh HANIFAH NURYANI LIOE.
Emping melinjo yang umum dikonsumsi oleh orang Indonesia dianggap sebagai salah satu penyebab penyakit asam urat karena senyawa purin yang dikandungnya. Di sisi lain, metode analisis basa purin masih belum banyak dikembangkan oleh laboratorium di Indonesia. Penelitian ini bertujuan untuk melakukan validasi metode analisis basa purin pada emping melinjo dengan menggunakan instrumen HPLC-UV. Jenis basa purin yang dipilih yaitu adenin dan hiposantin karena keduanya diketahui memiliki efek yang lebih besar terhadap akumulasi asam urat dalam tubuh dibandingkan jenis basa purin lainnya yaitu guanin dan santin. Selain itu, guanin dan santin tidak dapat larut dalam fase gerak yang digunakan, sehingga tidak dapat dianalisis secara simultan dengan adenin dan hiposantin. Hasil validasi menunjukkan instrumen memiliki linearitas yang baik pada rentang konsentrasi 7.81–125.00 µg/mL dengan nilai R2 lebih besar dari 0.999 baik untuk analisis adenin maupun hiposantin. Limit deteksi (LOD) dan limit kuantifikasi (LOQ) instrumen pada analisis adenin masing-masing sebesar 0.72 dan 2.39 µg/mL, sedangkan pada analisis hiposantin sebesar 0.69 dan 2.30 µg/mL. Adenin dan hiposantin terdeteksi pada HPLC-UV dengan kolom RP-C18 masing-masing pada menit ke- 5.9-6.8 dan ke- 4.8–5.5 (presisi waktu retensi keduanya <2.0 %). Metode memiliki linearitas yang baik pada rentang konsentrasi 50–800 µg/g sampel dengan nilai R2 lebih besar dari 0.990 baik untuk adenin maupun hiposantin. Limit deteksi metode untuk analisis adenin dan hiposantin berturut-turut sebesar 19.44 dan 14.42 µg/g. Pada analisis adenin, akurasi metode dengan uji rekoveri pada konsentrasi spike 100, 500, dan 1000 µg/g diperoleh hasil rekoveri masing-masing sebesar 79.33%, 89.39%, dan 90.37% dengan presisi metode masing-masing sebesar 5.19%, 4.50%, dan 3.46%. Sementara pada analisis hiposantin diperoleh hasil rekoveri masing-masing sebesar 66.75%, 92.29%, dan 100.15% dengan presisi metode masing-masing sebesar 2.98%, 3.15%, dan 2.22%. Dalam parameter reprodusibilitas intralab, metode belum memenuhi persyaratan dengan nilai reprodusibilitas intralab untuk analisis adenin dan hiposantin masing-masing sebesar 34.52% dan 39.89%. Berdasarkan hasil yang diperoleh, metode analisis basa purin pada sampel emping melinjo telah tervalidasi dan memberi hasil yang akurat pada konsentrasi lebih dari 100 µg/g.
ABSTRACT
MUTIARA PRATIWI. Validation of Analytical Method for Adenine and Hypoxanthine Purine Bases on Melinjo Chips by Using HPLC-UV. Supervised by HANIFAH NURYANI LIOE.
Melinjo chips, which is commonly consumed by Indonesian people, is considered as one of the causes which can trigger gout disease in respect with its purine content. However, method for testing purine is still rarely developed by laboratories in Indonesia. The objective of this research was to conduct validation of purine bases analytical method on melinjo chips by using HPLC-UV. Adenine and hypoxanthine were chosen to be analysed due to their characteristics which cause more effect on uric acid accumulation in the body rather than the other purin bases, which are guanine and xanthin. Besides, guanine and xanthin are insoluble in the mobile phase used in this study, so that they can not be simultaneously analysed with adenine and hypoxanthine. The results showed a good linearity of instrument in the concentration range of 7.81–125.00 µg/mL with coefficient of determination (R2) more than 0.999 for both adenine and hypoxanthine. Detection limit (LOD) and quantification limit (LOQ) of the instrument was found to be 0.72 and 2.39 µg/mL for analysis of adenine, while for analysis of hypoxanthine was 0.69 and 2.30 µg/mL respectively. Adenine and hypoxanthine were detected by HPLC-UV equipped with RP-C18 column at retention time of 5.9–6.8 and 4.8–5.5 min respectively (precision of retention time is less than 2.0 %). Method showed a good linearity at a concentration range of 50–800 µg/g sample with R2 more than 0.990 for both adenine and hypoxanthine analysis. Method detection limit (MDL) of adenine and hypoxanthine analysis was 19.44 and 14.42 µg/g respectively. Accuracy of the method was determined by a recovery test at spike concentrations of100, 500, and 1000 µg/g. In analysis of adenine the recovery results were respectively 79.33%, 89.39%, and 90.37% with precision of method were respectively 5.19%, 4.50%, and 3.46%. While in analysis of hypoxanthine the recovery results were respectively 66.75%, 92.29%, and 100.15% with precision of method were respectively 2.98%, 3.15%, and 2.22%. Method however didn’t show a good result in the parameter of within lab reproducibility (WLR), which exhibited the WLR values 34.52% and 39.89% for analysis of adenine and hypoxanthine respectively. Based on these results, purine bases analytical method on melinjo chips has been validated and was found to be accurate at concentration more than 100 µg/g.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
VALIDASI METODE ANALISIS BASA PURIN ADENIN DAN
HIPOSANTIN PADA EMPING MELINJO DENGAN
INSTRUMEN HPLC-UV
MUTIARA PRATIWI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
vii
Judul Skripsi: Validasi Metode Analisis Basa Purin Adenin dan Hiposantin pada Emping Melinjo dengan Instrumen HPLC-UV
Nama : Mutiara Pratiwi NIM : F24100043
Disetujui oleh
Diketahui oleh
Dr. Ir. Feri Kusnandar, M.Sc Ketua Departemen
Tanggal Lulus:
ix
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala, karena atas ridho dan karunia-Nya skripsi ini berhasil diselesaikan dengan baik. Penelitian yang dilaksanakan sejak Januari 2014 ini berjudul Validasi Metode Analisis Basa Purin Adenin dan Hiposantin pada Emping Melinjo dengan Instrumen HPLC-UV.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Hanifah Nuryani Lioe, M.Si selaku pembimbing yang selalu meluangkan waktunya untuk membimbing penulis dengan penuh kesabaran serta telah memberi banyak masukan yang berharga selama studi, penyelesaian penelitian hingga penyusunan skripsi. Terima kasih kepada Ibu Dr. Ir. Didah Nur Faridah, M.Si dan Ir. Sutrisno Koswara, M.Si atas kesediaannya menjadi penguji dalam ujian akhir penulis. Di samping itu, penghargaan penulis sampaikan kepada Mbak Ririn Anggraeni selaku teknisi Laboratorium Jasa Analisis Departemen Ilmu dan Teknologi Pangan yang memberi banyak bantuan dan saran yang baik selama pelaksanaan penelitian serta Annisa Defriana atas kerja sama dan bantuannya selama penelitian. Ungkapan terima kasih juga penulis sampaikan kepada Ibunda, Ayahanda, dan Adikku tercinta atas segala dukungan, doa, dan kasih sayang yang tak henti. Tak lupa juga ungkapan terima kasih penulis sampaikan kepada Rio Damanik atas doa dan dukungan yang tak henti diberikan, juga teruntuk sahabatku Muhana Nurul dan Meira Mawati atas nasihat dan dukungannya, teman-teman terbaikku Ni KD Willi, Cony Arisya, M. Wildan atas bantuan, dukungan, dan kerja samanya selama studi, serta segenap teman-teman ITP 47 tercinta yang tidak bisa disebutkan satu per satu.
Semoga skripsi ini bermanfaat.
Bogor, Juli 2014
11
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan dan Manfaat Penelitian 2
METODOLOGI PENELITIAN 2
Bahan dan Alat 2
Metode Penelitian 3
HASIL DAN PEMBAHASAN 8
Uji Pendahuluan untuk Penentuan Waktu Retensi dan Resolusi Pemisahan 8
Uji Unjuk Kerja Instrumen 9
Pengembangan Prosedur Analisis Basa Purin Adenin dan Hiposantin pada
Sampel Emping Melinjo 14
Validasi Metode 16
Spesifisitas Metode 16
Linearitas Metode 17
Akurasi dan Presisi Metode dari Uji Rekoveri 21
Limit Deteksi Metode 23
Reprodusibilitas intralab 24
SIMPULAN DAN SARAN 25
Simpulan 25
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 28
RIWAYAT HIDUP 42
12
DAFTAR TABEL
1 Kondisi operasi analisis basa purin adenin dan hiposantin pada sampel
emping melinjo dengan HPLC-UV 6
2 Keberterimaan hasil uji rekoveri menurut AOAC (2002) 7 3 Hasil uji linearitas instrumen HPLC-UV pada analisis adenin 10 4 Hasil uji linearitas instrumen HPLC-UV pada analisis hiposantin 10 5 Hasil uji unjuk kerja instrumen HPLC-UV pada analisis adenin dan
hiposantin 14
6 Hasil orientasi prosedur analisis adenin dalam matriks sampel emping melinjo menggunakan berbagai volume HCl untuk hidrolisis dalam tahap persiapan sampel sebelum analisis dengan HPLC-UV 15 7 Hasil orientasi prosedur analisis hiposantin dalam matriks sampel emping
melinjo menggunakan berbagai volume HCl untuk hidrolisis dalam tahap persiapan sampel sebelum analisis dengan HPLC-UV 16 8 Hasil uji linearitas metode analisis adenin dalam matriks sampel emping
melinjo menggunakan instrumen HPLC-UV 18
9 Hasil uji linearitas metode analisis hiposantin dalam matriks sampel
emping melinjo menggunakan instrumen HPLC-UV 18 10 Hasil uji rekoveri metode analisis adenin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV 21 11 Hasil uji rekoveri metode analisis hiposantin dalam matriks sampel emping
melinjo menggunakan instrumen HPLC-UV 21
12 Presisi metode analisis adenin dalam matriks sampel emping melinjo
menggunakan instrumen HPLC-UV 22
13 Presisi metode analisis hiposantin dalam matriks sampel emping melinjo
menggunakan instrumen HPLC-UV 22
14 Hasil uji reprodusibilitas intralab metode analisis adenin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV 24 15 Hasil uji intralab reprodusibilitas metode analisis hiposantin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV 24
DAFTAR GAMBAR
1 Kromatogram standar adenin (a), standar hiposantin (b), campuran standar adenin dan hiposantin (c) dalam pelarut asam fosfat 0.4% (90%) dan
metanol p.a. (10%) pada konsentrasi 62.50 µg/mL. 9 2 Kurva linearitas instrumen pada analisis adenin dan hiposantin pada
konsentrasi 1.95, 3.91, 7.81, 15.62, 31.25, 62.50, 125.00, dan 250.00 µg/mL dengan HPLC-UV menggunakan kolom C18 dan fase gerak yang terdiri atas asam fosfat 0.4% (90%) dan metanol p.a. (10%) 11 3 Kromatogram standar campuran adenin dan hiposantin dalam pelarut asam
13 yang dianalisis dengan instrumen HPLC-UV pada konsentrasi 7.81 (a), 15.62 (b), 31.25 (c), 62.50 (d), dan 125.00(e) µg/mL 12 4 Kromatogram standar campuran adenin dan hiposantin (a), sampel
unspiked (b), dan sampel spiked dengan konsentrasi spike 400 µg/g sampel 17 5 Kurva linearitas metode analisis adenin dan hiposantin dengan HPLC-UV
menggunakan kolom C18 dan fase gerak yang terdiri atas asam fosfat 0.4%
(90%) dan metanol p.a. (10%) 19
6 Kromatogram senyawa adenin dan hiposantin pada uji linearitas metode analisis menggunakan HPLC-UV pada konsentrasi spike 50 (a), 100 (b),
200 (c), 400 (d), dan 800 (e) µg/g 20
7 Kurva hubungan konsentrasi (µg/g) dan standar deviasi pada penentuan limit deteksi metode analisis adenin dan hiposantin dengan HPLC-UV 23
DAFTAR LAMPIRAN
1 Hasil uji linearitas instrumen pada analisis adenin dan hiposantin dengan
HPLC-UV 28
2 Hasil uji presisi luas area dan waktu retensi pada analisis adenin dan
hiposantin dengan HPLC-UV 29
3 Hasil uji LOD dan LOQ instrumen pada analisis adenin dan hiposantin
dengan HPLC-UV 30
4 Hasil orientasi prosedur analisis adenin dan hiposantin dalam matriks sampel emping melinjo menggunakan berbagai volume HCl 31 5 Hasil uji linearitas metode analisis adenin dan hiposantin dalam matriks
sampel emping melinjo dengan HPLC-UV 32
6 Hasil uji akurasi dan presisi dari uji rekoveri pada analisis adenin dan hiposantin dalam matriks sampel emping melinjo dengan HPLC-UV 33 7 Hasil uji intralab reprodusibilitas pada analisis adenin dan hiposantin dalam matriks sampel emping melinjo dengan HPLC-UV 37 8 Hasil uji one-way ANOVA dan uji lanjut Duncan pada hasil analisis
reprodusibilitas intralab pada analisis adenin dalam matriks sampel emping
melinjo dengan HPLC-UV 38
9 Hasil uji one-way ANOVA dan uji lanjut Duncan pada hasil analisis reprodusibilitas intralab pada analisis hiposantin dalam matriks sampel
1
PENDAHULUAN
Latar Belakang
Purin merupakan basa nitrogen dalam DNA dan RNA yang memiliki struktur cincin heterosiklik (Ellington 2007). Senyawa golongan purin terdiri atas adenin dan guanin. Sementara hiposantin dan santin merupakan senyawa alami turunan purin yang jarang ditemukan sebagai basa dalam DNA dan RNA, tetapi sering bertindak sebagai senyawa antara yang penting dalam proses pembentukan dan pemecahan nukleotida (Garret 2005). Mengingat purin dapat disintesis secara
de novo dan dapat digunakan kembali oleh tubuh, kebutuhan purin dari makanan yang dikonsumsi sangatlah sedikit. Purin dari makanan yang diserap tubuh tetapi tidak dibutuhkan akan dikatabolisme dengan produk akhir asam urat (Angstadt 1997). Purin diketahui terkandung dalam berbagai tanaman seperti kacang polong, kacang tanah, bayam, brokoli, oat, dan jamur (Ellington 2007). Dalam penelitian Kaneko et al. (2008), kandungan purin dalam tanaman seperti brokoli, bayam, lobak putih, tauge, bawang putih, jahe, dan berbagai tanaman lainnya berada pada kisaran 22.5-1717.9 µg/g.
Gout atau yang juga dikenal dengan penyakit asam urat merupakan kondisi penumpukan kristal asam urat pada persendian. Penumpukan tersebut terjadi karena produksi asam urat berlebih atau kurang optimalnya ekskresi asam urat sebagai produk katabolisme purin. Sumber utama purin dalam tubuh berasal dari makanan yang dikonsumsi (Ellington 2007). Menurut penelitian Clifford (1976) dalam Ellington (2007), adenin dan hiposantin menunjukkan dampak yang lebih besar terhadap kadar asam urat, dibandingkan dengan guanin dan santin.
Metode pengujian basa purin dalam makanan belum banyak dikembangkan oleh laboratorium di Indonesia. Mengingat emping melinjo umum dikonsumsi oleh masyarakat Indonesia dan bahkan sudah menjadi komoditas eksport, pengujian kandungan gizi emping melinjo perlu dilakukan, begitu pula kandungan senyawa purin yang dapat menjadi pertimbangan bagi konsumen emping melinjo (Munajad 2009). Dengan demikian, perlu adanya metode analisis yang tervalidasi untuk melakukan pengujian kandungan purin dalam emping melinjo.
Purin diketahui dapat dianalisis dengan instrumen HPLC-UV hingga level konsentrasi ppm (mg/kg) (Biearau 2011). Aromatisitas struktur cincin yang dimiliki purin menyebabkan purin dapat menyerap dengan kuat cahaya pada panjang gelombang ultraviolet (UV). Hal ini dapat dimanfaatkan dalam analisis kuantitatif maupun kualitatif pada purin (Garret 2005). HPLC fase terbalik (reverse phase) telah terbukti sangat efisien untuk pengujian asam nukleat (Titkova et al. 1983), dan telah umum digunakan untuk memisahkan dan mengkuantifikasi basa purin (Ellington 2007).
2
hingga diperoleh pH 4.0, ditera dengan akuades dalam labu ukur 50 mL, disaring, dan akhirnya dianalisis dengan HPLC. Basa purin terpisah secara isokratik dengan HPLC fase terbalik menggunakan kolom C18 dan fase gerak campuran buffer kalium fosfat 0.1 M dan asam fosfat pada pH 4.0.
Pada penelitian Sotelo (2002) mengenai penentuan basa purin dalam gonad bulu babi (Paracentortus lividus), sampel dihidrolisis dengan campuran asam trifluoroasetat/asam format (1/1, v/v) pada suhu 90 oC selama 15 menit, ditera dalam labu 250 mL, dan dikeringkan dengan rotary vacuum evaporator
pada suhu 75 oC. Basa purin dilarutkan dengan 10 mL buffer KH2PO4 0.3 M (pH 4.0) dan disaring dengan menggunakan membran filter sebelum dianalisis dengan HPLC fase terbalik yang dilengkapi detektor UV-VIS pada panjang gelombang 255 nm. Analisis dilakukan secara gradien menggunakan fase gerak larutan buffer KH2PO4 0.3 M dengan pH 4.0.
Pada penelitian ini dilakukan validasi metode analisis basa purin dalam sampel emping melinjo dengan instrumen HPLC-UV. Basa purin yang dipilih ialah adenin dan hiposantin yang diketahui memiliki dampak yang lebih besar terhadap peningkatan asam urat dalam tubuh dibandingkan guanin dan santin. Adenin dan hiposantin dianalisis dengan HPLC fase terbalik dengan kondisi operasi mengacu pada metode analisis adenosin dalam royal jelly pada penelitian Xue et al. (2009). Metode persiapan sampel diadaptasi dari prosedur analisis kualitatif pada basa purin santin (AOAC 2012) dengan beberapa modifikasi. Sampel emping melinjo dihidrolisis dengan HCl 6 N pada suhu 100 oC selama 1 jam, dinetralkan dengan NH4OH 25%, dan ditera dengan aquabidest dalam labu ukur 10 mL. Akhirnya, sampel dilewatkan melalui kolom SPE (Solid Phase Extraction) berisi silika, dan diinjeksikan ke HPLC yang dilengkapi detektor UV. Secara umum penelitian ini terdiri atas empat bagian, yaitu uji pendahuluan untuk penentuan waktu retensi serta resolusi pemisahan, uji unjuk kerja instrumen HPLV-UV, pengembangan prosedur analisis basa purin, dan validasi metode analisis basa purin pada sampel emping melinjo. Validasi metode analisis yang dilakukan meliputi uji spesifisitas metode, linearitas metode, akurasi dan presisi metode dari uji rekoveri, limit deteksi metode, dan reprodusibilitas intralab.
Tujuan dan Manfaat Penelitian
Tujuan umum dari penelitian ini adalah melakukan validasi metode analisis basa purin dengan instrumen High Performance Liquid Chromatography
(HPLC) yang dilengkapi detektor UV. Manfaat penelitian ini adalah dihasilkannya metode analisis yang telah tervalidasi pada penentuan kandungan purin pada emping melinjo dengan menggunakan HPLC-UV.
METODOLOGI PENELITIAN
Bahan dan Alat
3 Sigma, Sigma-Aldrich, USA), asam fosfat 0.4% (Merck, Jerman), metanol (p.a., Merck, Jerman), etanol 80% (p.a., Merck, Jerman), aquabidest, NH4OH 25% (Merck, Jerman), HCl 37% (Merck, Jerman), dan silika 60 (Merck, Jerman).
Alat-alat yang dibutuhkan meliputi neraca analitik, food processor, hot plate, magnetic stirrer, penyaring vakum, gelas ukur, sudip, gelas piala, labu ukur, pipet volumetrik, pipet Mohr, vortex, pipet tetes, membran filter millipore
0.45 µm, kolom SPE (Solid Phase Extraction), botol semprot, pengaduk kaca. Instrumen analisis yang digunakan adalah pH-meter, High Performance Liquid Chromatography (HPLC) model LC 6A (Shimadzu, Shimadzu Corp., Kyoto, Jepang) yang dilengkapi detektor UV model SPD-10AV (Shimadzu, Shimadzu Corp., Kyoto, Jepang), perekam data semi otomatis chromatopac (Shimadzu, Shimadzu Corp., Kyoto, Jepang), dan kolom C18 (Zorbax, Agilent Technologies, USA).
Metode Penelitian
Penelitian ini terdiri atas empat tahapan, yaitu uji pendahuluan untuk penentuan waktu retensi serta resolusi pemisahan, uji unjuk kerja instrumen HPLC-UV untuk analisis basa purin, pengembangan prosedur analisis basa purin pada sampel emping melinjo, dan validasi metode analisis basa purin pada sampel emping melinjo. Basa purin yang dianalisis pada penelitian ini hanya adenin dan hiposantin. Hal tersebut dikarenakan guanin dan santin tidak dapat larut pada fase gerak yang digunakan yang memiliki pH 4. Hasil percobaan yang dilakukan menunjukkan bahwa guanin dan santin baru dapat larut pada pH alkali, yaitu pada pH antara 12-13. Kolom Zorbax C18 yang digunakan untuk pemisahan juga tidak sesuai karena tidak tahan terhadap pH lebih besar dari 8. Dengan demikian, pada penelitian ini, analisis hanya difokuskan pada dua jenis basa purin, yaitu adenin dan hiposantin yang juga diketahui lebih berdampak terhadap akumulasi asam urat dalam tubuh dibandingkan kedua jenis basa purin lainnya.
Uji Pendahuluan untuk Penentuan Waktu Retensi dan Resolusi Pemisahan
4
Uji Unjuk Kerja Instrumen HPLC-UV untuk Analisis Basa Purin Adenin dan Hiposantin
Linearitas Instrumen
Linearitas diuji dengan cara menginjeksikan larutan standar campuran adenin dan hiposantin pada konsentrasi 1.95, 3.91, 7.81, 15.62, 31.25, 62.50, 125.00, dan 250.00 µg/mL, sehingga dapat diketahui luas area pada berbagai konsentrasi. Pengujian pada larutan standar campuran dengan delapan konsentrasi berbeda tersebut dilakukan sebanyak tiga kali ulangan dengan pembuatan tiga seri larutan standar campuran yang berbeda. Hasil pembacaan HPLC selanjutnya digunakan untuk pembuatan kurva standar hubungan antara konsentrasi (µg/mL) dengan luas area peak, lalu dihitung koefisien determinasinya (R2). Linearitas dianggap baik apabila memiliki R2 lebih besar dari 0.990 (AOAC 2012).
Presisi dari Luas Area dan Waktu Retensi
Penentuan presisi dari luas area dan waktu retensi dilakukan dengan cara menginjeksikan larutan standar campuran adenin dan hiposantin pada konsentrasi yang sama sebanyak tujuh kali ulangan, dalam hal ini digunakan konsentrasi 7.81 µg/mL. Konsentrasi tersebut dipilih karena merupakan konsentrasi yang cukup rendah namun masih memberikan hasil rekoveri yang cukup tinggi (lebih besar dari 80%) berdasarkan uji coba yang dilakukan. Hasil pengukuran berupa luas area dan waktu retensi ketujuh ulangan dihitung nilai rata-rata, standar deviasi (SD), dan relative standard deviation (RSD). Keberterimaan RSD dalam uji ini ialah lebih kecil dari 2.0% (JECFA 2006).
Limit Deteksi dan Limit Kuantifikasi Instrumen
Limit deteksi instrumen (LOD instrumen) ditentukan dengan cara menginjeksikan larutan standar campuran pada konsentrasi rendah sebanyak tujuh kali ulangan, dalam hal ini digunakan konsentrasi 7.81 µg/mL. Dasar pemilihan konsentrasi tersebut sama dengan uji presisi dari luas area dan waktu retensi. Konsentrasi masing-masing ulangan dihitung dengan menggunakan kurva linearitas. Standar deviasi dari konsentrasi yang diperoleh pada ketujuh ulangan tersebut dihitung, kemudian LOD ditentukan sebagai tiga kali nilai standar deviasinya. Limit kuantifikasi ditentukan dengan cara yang sama dengan LOD, namun LOQ ditentukan sebagai sepuluh kali nilai standar deviasinya.
Pengembangan Prosedur Analisis Basa Purin Adenin dan Hiposantin pada Sampel Emping Melinjo
Prosedur persiapan sampel untuk analisis basa purin pada sampel emping melinjo menggunakan metode hidrolisis asam yang diadaptasi dari AOAC 2012,
5 proses hidrolisis. Sementara kondisi operasi HPLC-UV untuk analisis basa purin pada sampel emping melinjo mengikuti metode analisis adenosin pada royal jelly
(Xue et al. 2009) dengan beberapa modifikasi. Modifikasi dilakukan dalam hal metode elusi dengan fase gerak dan laju aliran fase gerak. Pada tahap persiapan, sampel emping melinjo yang sudah dihaluskan dengan food processor
dihidrolisis dengan HCl 6 N pada volume HCl yang berbeda-beda, yaitu 0.5, 1.0, dan 2.0 mL pada suhu 100 oC selama 1 jam, dinetralkan dengan NH4OH 25%, dan ditera dengan aquabidest dalam labu ukur 10 mL. Dilakukan masing-masing dua kali ulangan untuk setiap volume HCl yang diujikan. Selanjutnya sampel dilewatkan melalui kolom SPE (Solid Phase Extraction) berisi silika (kurang lebih 1 gram) dan diinjeksikan ke HPLC yang dilengkapi detektor UV. Sampel yang akan dianalisis dengan HPLC-UV terdiri atas sampel unspiked (tanpa penambahan spike) dan sampel spiked (dengan penambahan spike). Spike yang ditambahkan yaitu standar campuran adenin dan hiposantin dengan konsentrasi 400 µg/g. Dengan demikian, dapat diketahui rekoveri yang diperoleh dengan metode analisis menggunakan hidrolisis asam serta dapat ditentukan volume HCl yang dapat memberikan hasil analisis dengan rekoveri yang terbaik.
Prosedur Analisis Basa Purin Adenin dan Hiposantin dengan HPLC-UV
Persiapan Sampel
Pada tahap persiapan sampel, sejumlah 0.5 gram sampel emping melinjo yang sudah dihaluskan dengan food processor ditimbang dengan menggunakan neraca analitik. Kemudian, sampel dihidrolisis dengan HCl 6 N pada suhu 100 oC selama 1 jam. Volume HCl 6 N yang digunakan untuk menghidrolisis yaitu sejumlah 0.5 mL (volume terpilih hasil pengembangan prosedur analisis). Sebelum dihidrolisis, sampel dicampur merata agar HCl membasahi seluruh bagian sampel. Sampel yang telah dihidrolisis kemudian dinetralkan dengan NH4OH 25% dan divortex. Larutan dipindahkan ke dalam labu ukur 10 mL dan ditepatkan hingga tanda tera dengan aquabidest. Larutan analitik tersebut dilewatkan melalui kolom SPE (Solid Phase Extraction) yang berisi silika sejumlah kurang lebih 1 gram sebelum diinjeksikan ke HPLC.
Pembuatan Larutan Standar
Dibuat larutan stok standar adenin dan hiposantin dengan konsentrasi 500 µg/mL dengan cara melarutkan masing-masing standar sejumlah 0.025 g ke dalam 50 mL fase gerak. Fase gerak terdiri atas campuran asam fosfat 0.4% (90%) dan metanol p.a. (10%). Standar adenin dan hiposantin dicampurkan hingga diperoleh konsentrasi standar campuran dengan konsentrasi 250 µg/mL. Penentuan Kandungan Basa Purin Adenin dan Hiposantin dengan HPLC-UV
6
mengacu pada metode analisis adenosin dalam royal jelly pada penelitian Xue et al. (2009) dengan modifikasi pada metode elusi dengan fase gerak serta laju aliran fase gerak.
Tabel 1. Kondisi operasi analisis basa purin adenin dan hiposantin pada sampel emping melinjo dengan HPLC-UV
Kriteria Kondisi
Kolom Zorbax C18 (ODS), ukuran partikel
pendukung 5 µm, panjang 250 mm, diameter dalam 4.6 mm
Suhu running Suhu ruang (30 oC)
Fase gerak Asam fosfat 0.4% (90%) dan
metanol p.a (10%) dengan penyesuaianpH menggunakan NH4OH 1 M hingga pH 4.0 Laju aliran fase gerak 0.5 mL / menit
Deteksi UV 257 nm
Sampel loop 20 µL
Perhitungan
Kadar purin/g sampel =
Keterangan: FP = Faktor Pengenceran
Validasi Metode Analisis Basa Purin Adenin dan Hiposantin
Analisis kandungan basa purin adenin dan hiposantin pada sampel dibandingkan dengan hasil injeksi standar basa purin adenin dan hiposantin. Apabila peak masing-masing basa purin dalam sampel dapat terdeteksi, maka prosedur analisis basa purin yang dikembangkan tersebut dapat digunakan untuk tahap validasi metode.
Validasi metode analisis basa purin adenin dan hiposantin terdiri atas: uji spesifisitas metode, linearitas metode, akurasi dan presisi metode dari uji rekoveri limit deteksi metode, dan reprodusibilitas intralab. Validasi metode dilakukan menurut kriteria di bawah ini dengan mengikuti metode EURACHEM (1998). Uji Spesifisitas Metode
7 tidak akan diperoleh tiga kromatogram yang dapat diamati peak-peaknya. Jika kromatogram menunjukkan peak-peak yang terpisah dengan baik dan peak
tersebut tidak diganggu oleh peak senyawa cemaran dalam sampel, maka spesifisitas metode analisis dinyatakan baik.
Linearitas Metode
Pengujian dilakukan dengan menggunakan sampel yang di-spike dengan standar adenin dan hiposantin pada konsentrasi 50, 100, 200, 400, dan 800 µg/g, kemudian diberikan perlakuan sesuai prosedur analisis untuk sampel, dan diinjeksikan ke dalam HPLC. Pengujian linearitas metode dilakukan sebanyak tiga ulangan dengan pembuatan tiga seri sampel yang di-spike pada konsentrasi yang ditetapkan. Setelah itu, dibuat kurva linearitas metode yang merupakan hubungan konsentrasi purin (µg/g) dengan luas area peak, sehingga diperoleh persamaan linear y = ax + b. Persyaratan linearitas untuk metode analisis adalah mempunyai R2 lebih besar dari 0.990 atau r lebih besar dari 0.995 (AOAC 2012). Akurasi dan Presisi Metode dari Uji Rekoveri
Akurasi
Pengujian dilakukan dengan menggunakan sampel yang di-spike dengan standar pada tiga konsentrasi yang berbeda. Konsentrasi spike yang digunakan adalah konsentrasi rendah, sedang, dan tinggi. Pembuatan sampel untuk uji ini dapat dilihat pada tahap pendahuluan, hanya saja pada sampel sengaja ditambahkan standar pada konsentrasi 100, 500, dan 1000 µg/g. Pemilihan konsentrasi tersebut ditentukan berdasarkan pertimbangan nilai 10 kali LOQ, yaitu sebesar 400 µg/g. Dengan demikian dipilih konsentrasi yang lebih kecil (100 µg/g) dan lebih besar (500 dan 1000 µg/g) dari nilai 10 kali LOQ untuk mengetahui kisaran konsentrasi yang memberikan hasil yang akurat. Pengujian dilakukan sebanyak tujuh kali ulangan pada masing-masing konsentrasi spike. Hasil analisis pada masing-masing konsentrasi spike kemudian dihitung persen rekoverinya. Keberterimaan hasil uji rekoveri disajikan pada Tabel 2. Rekoveri dihitung pada masing-masing ulangan dengan menggunakan rumus:
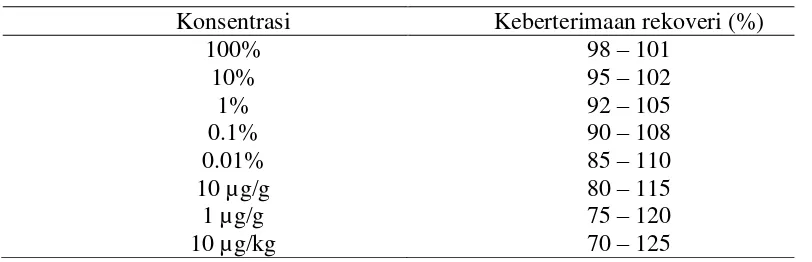
Tabel 2. Keberterimaan hasil uji rekoveri menurut AOAC (2002)
Konsentrasi Keberterimaan rekoveri (%)
100% 98 – 101
10% 95 – 102
1% 92 – 105
0.1% 90 – 108
0.01% 85 – 110
10 µg/g 80 – 115
1 µg/g 75 – 120
8 Presisi
Data yang diperoleh pada uji rekoveri untuk akurasi pada tiga konsentrasi berbeda tersebut dapat digunakan untuk menentukan presisi metode analisis untuk pengujian purin pada konsentrasi rendah, sedang, dan tinggi. Nilai konsentrasi hasil uji rekoveri yang didapat pada masing-masing ulangan dihitung nilai RSD analisisnya. Presisi ditentukan dengan membandingkan nilai RSD analisis (RSDa) dengan RSD Horwitz (RSDh). Presisi yang baik memiliki nilai RSDa yang lebih kecil dari dari RSDh. Nilai RSDh dapat dihitung dengan menggunakan rumus:
RSDh = [2 exp (1-0.5 log C)]
Keterangan: C = Nilai rata-rata konsentrasi analat (dalam bentuk fraksi)
Limit Deteksi Metode/Method Detection Limit (MDL)
Limit deteksi metode ditentukan dari kurva hubungan antara standar deviasi dengan konsentrasi adenin dan hiposantin dari hasil uji rekoveri pada konsentrasi 100, 500, dan 1000 µg/g. Melalui persamaan linear pada kurva, nilai standar deviasi ditentukan ketika konsentrasinya sama dengan nol (SD0). Nilai MDL yaitu tiga kali nilai SD0 yang diperoleh. Penentuan nilai MDL tersebut mengacu pada EURACHEM (1998).
Reprodusibilitas Intralab
Pengujian reprodusibilitas intralab dilakukan dengan menggunakan operator dan laboratorium yang sama, akan tetapi dilakukan pada minggu yang berbeda. Persiapan larutan yang akan diinjeksikan pada uji reprodusibilitas intralab mengikuti prosedur baku yang terdapat pada tahap pendahuluan. Hasil analisis kemudian dihitung nilai rata-rata dan RSD analisisnya. Nilai RSD yang diperoleh kemudian dibandingkan dengan nilai RSD yang dihitung menggunakan persamaan Horwitz. Hasil uji reprodusibilitas intralab yang baik memiliki nilai RSD analisis yang lebih kecil dibanding RSD Horwitz. Selain itu, hasil yang diperoleh diolah dengan one-way ANOVA menggunakan program IBM Statistic SPSS 20 untuk menguji signifikansi perbedaan hasil analisis antarminggu yang berbeda. Data hasil analisis kemudian dilakukan uji lanjut Duncan pada taraf uji 5%.
HASIL DAN PEMBAHASAN
Uji Pendahuluan untuk Penentuan Waktu Retensi dan Resolusi Pemisahan
9 artinya kedua senyawa dapat dianalisis secara simultan. Selanjutnya, adenin dan hiposantin dianalisis secara simultan untuk menentukan resolusi pemisahan kedua senyawa.
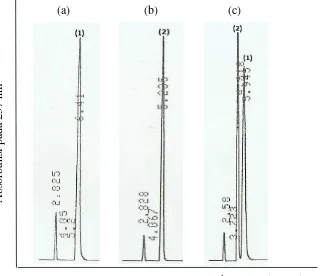
Gambar 1. Kromatogram standar adenin (a), standar hiposantin (b), campuran standar adenin dan hiposantin (c) dalam pelarut asam fosfat 0.4% (90%) dan metanol p.a. (10%) pada konsentrasi 62.50 µg/mL. Peak: (1). adenin, (2). hiposantin
Pada Gambar 1 disajikan contoh kromatogram standar adenin, standar hiposantin, dan standar campuran adenin dan hiposantin pada salah satu konsentrasi yang digunakan, yaitu 62.50 µg/mL. Hasil analisis campuran standar adenin dan hiposantin pada konsentrasi 62.50 µg/mL tersebut mempunyai resolusi sebesar 4.51. Resolusi menunjukkan kemampuan kolom untuk memisahkan kedua
peak dan dinyatakan baik apabila memiliki nilai lebih besar dari 1.50 (Zhang 2007). Dengan demikian, resolusi peak adenin dan hiposantin tersebut dinyatakan baik, sehingga kedua senyawa dapat dianalisis secara simultan.
Uji Unjuk Kerja Instrumen
Linearitas Instrumen
Linearitas instrumen diuji untuk menentukan seberapa linear respon instrumen terhadap konsentrasi analat pada berbagai tingkat konsentrasi. Pengujian linearitas instrumen dilakukan dengan menginjeksikan standar pada delapan tingkat konsentrasi yang telah ditetapkan sebanyak tiga ulangan. Hasil uji
Waktu retensi (menit)
Absor
ba
nsi pada
257 nm
10
linearitas instrumen berupa persamaan regresi linear y = ax + b dari kurva hubungan antara konsentrasi (sumbu x) dan luas area (sumbu y), dengan a adalah
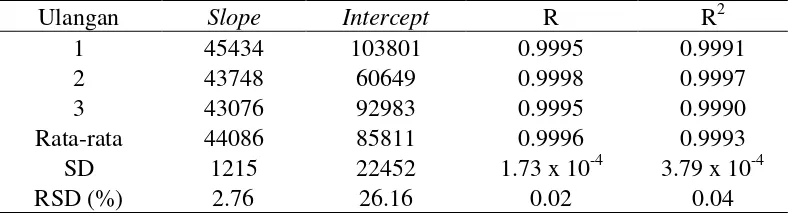
slope dan b adalah intercept. Hasil uji linearitas instrumen pada analisis adenin dan hiposantin masing-masing diperlihatkan pada Tabel 3 dan 4. Hasil uji linearitas instrumen pada analisis adenin maupun hiposantin menunjukkan presisi
slope yang baik, dengan nilai RSD lebih kecil dari 5%. Sementara itu, nilai
intercept yang diperoleh menunjukkan presisi yang kurang baik pada analisis adenin maupun hiposantin dengan nilai RSD lebih besar dari 20%.
Tabel 3. Hasil uji linearitas instrumen HPLC-UV pada analisis adenin
Ulangan Slope Intercept R R2
1 65840 92344 0.9998 0.9997
2 66281 139408 0.9999 0.9998
3 66773 44532 0.9999 0.9999
Rata-rata 66298 92095 0.9999 0.9998
SD 467 47438 5.77 x 10-5 1.00 x 10-4
RSD (%) 0.70 51.51 0.01 0.01
Tabel 4. Hasil uji linearitas instrumen HPLC-UV pada analisis hiposantin
Ulangan Slope Intercept R R2
1 45434 103801 0.9995 0.9991
2 43748 60649 0.9998 0.9997
3 43076 92983 0.9995 0.9990
Rata-rata 44086 85811 0.9996 0.9993
SD 1215 22452 1.73 x 10-4 3.79 x 10-4
RSD (%) 2.76 26.16 0.02 0.04
11
Gambar 2. Kurva linearitas instrumen pada analisis adenin dan hiposantin pada konsentrasi 1.95, 3.91, 7.81, 15.62, 31.25, 62.50, 125.00, dan 250.00 µg/mL dengan HPLC-UV menggunakan kolom C18 dan fase gerak yang terdiri atas asam fosfat 0.4% (90%) dan metanol p.a. (10%). Kurva merupakan rata-rata dari tiga ulangan uji linearitas instrumen
12
Gambar 3. Kromatogram standar campuran adenin dan hiposantin dalam pelarut asam fosfat 0.4% (90%) dan metanol p.a. (10%) pada uji linearitas instrumen yang dianalisis dengan instrumen HPLC-UV pada konsentrasi 7.81 µg/mL (a), 15.62 µg/mL (b), 31.25 µg/mL (c), 62.50 µg/mL (d), dan 125.00 µg/mL (e).
Peak: (1). adenin, (2). hiposantin
Presisi dari Luas Area dan Waktu Retensi
Presisi menunjukkan kedekatan hasil pengukuran atau tingkat penyebaran dari serangkaian pengukuran dalam beberapa ulangan (APVMA 2004). Presisi kromatogram yang ditentukan pada penelitian ini meliputi presisi
(b) )
(e)
Absor
ba
nsi pada
257 nm
Waktu retensi (menit) (d)
(c)
13 luas area dan waktu retensi. Penentuan presisi kromatogram dilakukan dengan menginjeksikan sebanyak tujuh kali larutan standar pada konsentrasi yang sama. Pada standar adenin, diperoleh nilai RSD untuk waktu retensi sebesar 0.67% dan RSD untuk luas area sebesar 3.18%. Sementara pada standar hiposantin, diperoleh nilai RSD untuk waktu retensi sebesar 0.96% dan RSD untuk luas area sebesar 2.97%. Keberterimaan nilai RSD uji ini ialah lebih kecil dari 2.0% (JECFA 2006).
Hasil yang diperoleh pada uji presisi dari waktu retensi tersebut memenuhi persyaratan yang ditetapkan, sehingga presisi dari waktu retensi yang dihasilkan oleh instrumen HPLC-UV yang digunakan dapat dikategorikan baik. HPLC yang digunakan pada penelitian ini menggunakan system controller semi otomatis yang secara teoretis dapat mempengaruhi waktu retensi yang dihasilkan. Akan tetapi, hasil pengujian menunjukkan bahwa pada penelitian ini hal tersebut tidak mempengaruhi presisi waktu retensi yang dihasilkan dan instrumen tetap menunjukkan unjuk kerja yang baik dalam hal presisi waktu retensi. Sementara itu, presisi luas area baik untuk adenin maupun hiposantin belum memenuhi persyaratan yang ditetapkan tersebut. Presisi luas area yang kurang baik diduga disebabkan oleh penggunaan data recorder dan printer semi otomatis. Hal tersebut dapat terjadi karena luas area peak dapat dipengaruhi oleh feed speed,
yaitu kecepatan keluarnya kertas dari printer semi otomatis yang pada akhirnya berpengaruh terhadap kecepatan tercetaknya data yang terekam oleh data recorder pada kertas. Selain hal tersebut, menurut Barwick (1999), presisi luas area sangat dipengaruhi oleh laju aliran fase gerak. Laju aliran fase gerak yang konstan hanya dapat dihasilkan oleh pompa HPLC yang masih dalam keadaan baik, yaitu yang dapat menghasilkan tekanan yang konstan. Dengan demikian, tekanan pompa HPLC yang tidak konstan dapat diduga sebagai penyebab presisi luas area yang kurang baik.
Limit Deteksi dan Limit Kuantifikasi Instrumen
Limit deteksi instrumen diuji untuk menentukan konsentrasi analat yang dapat dideteksi oleh instrumen, sedangkan limit kuantifikasi instrumen diuji untuk menentukan jumlah analat yang dapat ditentukan secara kuantitatif dengan presisi tertentu pada kondisi analisis (APVMA 2004). Pengujian dilakukan dengan menginjeksikan standar pada konsentrasi rendah dengan tujuh kali ulangan. Limit deteksi instrumen ditentukan sebagai tiga kali nilai standar deviasi hasil pengukuran sebanyak tujuh ulangan tersebut, sedangkan nilai limit kuantifikasi instrumen merupakan sepuluh kali nilai standar deviasinya. Nilai LOD dan LOQ yang diperoleh pada analisis adenin dan hiposantin masing-masing sebesar 0.72 dan 2.39 µg/mL. Sementara itu, nilai LOD dan LOQ pada analisis hiposantin masing-masing sebesar 0.69 dan 2.30 µg/mL. Sebagai perbandingan, dalam penelitian Sotelo (2002) mengenai penentuan kadar basa purin dalam gonad bulu babi (Paracentortus lividus) dengan instrumen HPLC, diperoleh limit deteksi adenin dan hiposantin masing-masing sebesar 0.076 dan 0.060 µg/mL, yang nilainya kurang lebih sepuluh kali lebih rendah dibandingkan limit deteksi yang diperoleh pada penelitian ini.
14
Horwitz (RSDh). Hasil analisis adenin menunjukkan nilai RSDa (3.90%) lebih kecil dari 2/3 RSDh (8.12%). Begitu pula pada analisis hiposantin, nilai RSDa (3.97%) lebih kecil dari 2/3 RSDh (8.19). Nilai RSDa yang lebih kecil dari 2/3 RSDh menunjukkan presisi pengukuran yang baik. Hasil analisis unjuk kerja secara ringkas dapat dilihat pada Tabel 5.
Tabel 5. Hasil uji unjuk kerja instrumen HPLC-UV pada analisis adenin dan
coef. of correlation (R)
66298 ± 467
Pengembangan Prosedur Analisis Basa Purin Adenin dan Hiposantin pada Sampel Emping Melinjo
Prosedur analisis basa purin dalam sampel emping melinjo diadaptasi dari AOAC 2012, Chapter 18, AOAC Official Method 960.56 Microchemical Tests for Xanthine Alkaloids, halaman 53, namun dengan beberapa modifikasi. Modifikasi yang dilakukan yaitu dalam hal volume HCl 6 N yang digunakan serta lamanya proses hidrolisis. Pada prosedur uji untuk santin alkaloid tersebut tidak terdapat informasi mengenai volume HCl 6 N yang digunakan serta lamanya proses hidrolisis yang harus dilakukan. Dengan demikian, dilakukan uji coba penggunaan beberapa volume HCl 6 N yang digunakan untuk menghidrolisis sampel, yaitu pada volume 0.5, 1.0, dan 2.0 mL, masing-masing dilakukan sebanyak dua kali ulangan. Proses hidrolisis dilakukan pada suhu 100 o
15 sampel. Sifat silika yang polar menyebabkan sejumlah adenin dan hiposantin yang bersifat polar dapat tertahan oleh silika, sehingga menyebabkan rekoveri yang diperoleh lebih rendah dari yang seharusnya. Akan tetapi, rekoveri yang diperoleh dianggap masih dapat diterima, dengan nilai rekoveri lebih besar dari 65%. Harga kolom SPE silika yang lebih terjangkau dibandingkan kolom SPE C18 menjadi pertimbangan pemilihan silika dibandingkan C18. Penggunaan kolom SPE C18 diduga akan memberikan rekoveri yang lebih baik karena sifat C18 yang non-polar. Setelah disaring dengan kolom SPE, akhirnya sampel siap untuk diinjeksikan ke HPLC.
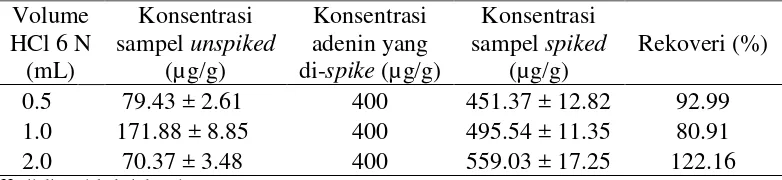
Pada pengembangan prosedur analisis ini, sampel yang telah dipreparasi dengan penambahan HCl 6 N pada berbagai volume tersebut diinjeksikan ke HPLC, dimana sampel terdiri atas sampel unspiked (tanpa penambahan spike) dan sampel spiked (dengan penambahan spike). Spike ditambahkan pada konsentrasi 400 µg/g sampel yang merupakan sepuluh kali nilai LOQ instrumen. Dengan demikian, dapat diketahui rekoveri yang diperoleh dengan adanya pengembangan metode analisis menggunakan hidrolisis asam serta dapat ditentukan volume HCl yang memberikan hasil rekoveri yang terbaik.
Hasil analisis sampel tanpa penambahan spike dengan menggunakan volume HCl 0.5, 1.0, dan 2.0 mL menunjukkan bahwa emping melinjo rata-rata mengandung adenin pada kisaran konsentrasi 70.37-171.88 µg/g sampel serta hiposantin pada kisaran konsentrasi 48.37-155.58 µg/g sampel. Menurut Munajad (2009), kandungan total basa purin dalam emping melinjo ialah antara 500-1500 µg/g bahan. Rekoveri yang diperoleh pada penggunaan volume HCl 0.5, 1.0, dan 2.0 mL disajikan pada Tabel 6 dan 7. Hasil tersebut menunjukkan bahwa volume HCl sebanyak 0.5 mL memberikan hasil analisis terbaik dengan pertimbangan hasil rekoveri yang diperoleh. Penggunaan HCl sebanyak 0.5 mL memberikan hasil rekoveri masing-masing sebesar 92.99% dan 113.84% untuk analisis adenin dan hiposantin. Hasil rekoveri tersebut paling mendekati keberterimaan rekoveri menurut AOAC (2002), yaitu antara 85-110%. Sementara pada pengunaan HCl sebanyak 1.0 dan 2.0 mL, hasil rekoveri berada jauh di luar kisaran rekoveri yang dapat diterima menurut AOAC (2002).
Tabel 6. Hasil orientasi prosedur analisis adenin dalam matriks sampel emping melinjo menggunakan berbagai volume HCl untuk hidrolisis dalam tahap persiapan sampel sebelum analisis dengan HPLC-UV*
Volume
16
Tabel 7. Hasil orientasi prosedur analisis hiposantin dalam matriks sampel emping melinjo menggunakan berbagai volume HCl untuk hidrolisis dalam tahap persiapan sampel sebelum analisis dengan HPLC-UV*
Volume
* Hasil diperoleh dari dua ulangan
Metode yang diadaptasi dari AOAC (2012) tersebut terbukti dapat diaplikasikan untuk analisis basa purin adenin dan hiposantin di dalam sampel emping melinjo. Dengan demikian, prosedur analisis yang telah dikembangkan tersebut dapat digunakan untuk tahap penelitian selanjutnya (validasi metode).
Validasi Metode
Spesifisitas Metode
Spesifisitas metode diuji untuk menentukan kemampuan metode analisis untuk dapat mengukur konsentrasi analat dengan adanya komponen-komponen lain dalam sampel. Spesifisitas metode dapat ditentukan dengan mengamati kromatogram pada standar campuran adenin dan hiposantin, sampel tanpa penambahan standar, serta sampel yang telah ditambahkan standar campuran adenin dan hiposantin. Kromatogram hasil uji spesifisitas metode ditunjukkan oleh Gambar 4.
Kromatogram pada Gambar 4 memperlihatkan bahwa peak adenin dan hiposantin dapat terpisah satu sama lain baik dalam bentuk murni (standar) maupun dalam matriks sampel emping melinjo. Peak adenin maupun hiposantin tidak terganggu oleh peak senyawa lain dalam sampel yang terdeteksi dalam kromatogram. Guanin dan santin yang dapat terekstrak ketika proses persiapan sampel juga tidak teranalisis oleh HPLC dikarenakan keduanya tidak dapat dielusi dengan fase gerak yang digunakan. Hal ini menunjukkan bahwa metode analisis yang divalidasi memiliki spesifisitas yang baik. Adenin dan hiposantin dalam matriks sampel emping melinjo masing-masing terdeteksi pada menit ke- 5.9-6.8 dan ke- 4.8–5.5. Pada penelitian Sotelo (2002) mengenai penentuan basa purin dalam gonad bulu babi dengan HPLC, adenin dan hiposantin masing-masing terdeteksi di sekitar menit ke- 18 dan 11. Perbedaan yang cukup jauh antara waktu retensi yang diperoleh pada penelitian ini dengan penelitian Sotelo (2002) dikarenakan perbedaan fase gerak yang digunakan. Fase gerak yang digunakan pada penelitian Sotelo (2002) yaitu larutan buffer KH2PO4 0.3 M, sedangkan pada penelitian ini digunakan campuran asam fosfat 0.4% (90%) dan metanol p.a. (10%) sebagai fase gerak. Akan tetapi, secara umum hiposantin akan terdeteksi lebih dahulu oleh HPLC dibandingkan adenin.
17
Gambar 4. Kromatogram standar campuran adenin dan hiposantin (a), sampel
unspiked (b), dan sampel spiked dengan konsentrasi spike 400 µg/g sampel (c).
Peak: (1). adenin, (2). hiposantin Linearitas Metode
Linearitas metode diuji untuk menentukan seberapa linear respon terhadap konsentrasi analat di dalam sampel dengan metode analisis yang digunakan. Pengujian linearitas metode dilakukan dengan menggunakan sampel yang ditambahkan spike pada lima tingkat konsentrasi yang ditetapkan dengan tiga kali pengulangan. Seperti halnya pada uji linearitas instrumen, hasil uji linearitas metode berupa persamaan regresi linear dari kurva hubungan hubungan antara konsentrasi (sumbu x) dan luas area (sumbu y), dengan a adalah slope dan b adalah intercept. Hasil uji linearitas metode pada analisis adenin dan hiposantin
Waktu retensi (menit) (b)
(c)
(a)
Absor
ba
nsi pada
18
masing-masing diperlihatkan pada Tabel 8 dan 9. Hasil uji linearitas metode pada analisis adenin maupun hiposantin memiliki presisi slope yang kurang baik dengan nilai RSD lebih besar dari 5%. Begitu pula pada nilai intercept, pada analisis adenin maupun hiposantin diperoleh presisi yang kurang baik dengan nilai RSD lebih besar dari 20%.
Tabel 8. Hasil uji linearitas metode analisis adenin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV
Ulangan Slope Intercept R R2
1 3258.9 263852 0.9981 0.9963
2 3930.2 250410 0.9944 0.9889
3 3723.8 400828 0.9939 0.9879
Rata-rata 3637.7 305030 0.9955 0.9910
SD 343.8 83235 2.29 x 10-3 4.59 x 10-3
RSD (%) 9.45 27.29 0.23 0.46
Tabel 9. Hasil uji linearitas metode analisis hiposantin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV
Ulangan Slope Intercept R R2
1 2217.9 181675 0.9986 0.9972
2 2888.7 82613 0.9902 0.9804
3 2500.6 208661 0.9977 0.9955
Rata-rata 2535.8 157650 0.9955 0.9910
SD 336.8 66370 4.61 x 10-3 9.25 x 10-3
RSD (%) 13.28 42.10 0.46 0.93
19
20
Gambar 6. Kromatogram senyawa adenin dan hiposantin pada uji linearitas metode analisis menggunakan HPLC-UV pada konsentrasi spike 50 µg/g (a), 100 µg/g (b), 200 µg/g (c), 400 µg/g (d), dan 800 µg/g (e). Peak: (1). adenin, (2). hiposantin
Absor
ba
nsi
pa
da
257 nm
(a)
(e) (d)
(c) (b)
21 Akurasi dan Presisi Metode dari Uji Rekoveri
Akurasi metode diuji untuk mengetahui kedekatan hasil analisis yang diperoleh dengan nilai benar (true value) yang diketahui menggunakan metode analisis yang dipilih. Penentuan akurasi pada penelitian ini dilakukan dengan uji rekoveri yaitu dengan menggunakan sampel yang ditambahkan spike pada tiga konsentrasi yang telah ditetapkan, yaitu pada konsentrasi rendah, konsentrasi sedang, dan konsentrasi tinggi. Pengujian pada ketiga konsentrasi masing-masing dilakukan sebanyak tujuh ulangan. Penentuan akurasi metode dilakukan dengan menghitung rekoveri dari hasil analisis. Hasil uji rekoveri pada analisis adenin dan hiposantin pada tiga konsentrasi spike masing-masing diperlihatkan pada Tabel 10 dan 11.
Tabel 10. Hasil uji rekoveri metode analisis adenin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV *Rekoveri diperoleh dari hasil rata-rata tujuh kali ulangan
**Rekoveri diperoleh dari hasil rata-rata lima kali ulangan
Tabel 11. Hasil uji rekoveri metode analisis hiposantin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV
Konsentrasi *Rekoveri diperoleh dari hasil rata-rata enam kali ulangan
**Rekoveri diperoleh dari hasil rata-rata tujuh kali ulangan
Menurut AOAC (2002), keberterimaan persen rekoveri untuk konsentrasi 100 dan 500 µg/g yaitu sebesar 85-110%, sedangkan untuk konsentrasi 1000 µg/g sebesar 90-108%. Hasil uji rekoveri pada analisis adenin hanya pada konsentrasi
spike 500 dan 1000 µg/g yang memenuhi syarat AOAC (2002), yaitu dengan rekoveri masing-masing sebesar 89.39% dan 90.37%. Sementara pada konsentrasi
22
kandungan analat dalam sampel (tanpa penambahan spike) yang secara alami cukup rendah. Dengan demikian, hilangnya sejumlah analat selama preparasi sampel lebih berdampak signifikan terhadap hasil analisis dibandingkan pada sampel dengan penambahan spike pada konsentrasi yang lebih tinggi. Selain itu, karena adenin dan hiposantin merupakan senyawa alami yang terkandung dalam bahan pangan, kandungan keduanya di dalam bahan pangan dapat bervariasi. Hal ini menyebabkan kadar analat yang terukur dalam sampel tanpa penambahan
spike menjadi beragam dan pada akhirnya dapat mempengaruhi rekoveri yang diperoleh.
Ketelitian atau presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata–rata jika prosedur diterapkan secara berulang pada sampel–sampel yang diambil dari campuran yang homogen. Ukuran ketelitian dinyatakan dalam nilai RSD dari hasil uji (Harmita 2004). Presisi metode analisis ditentukan dengan menggunakan data pada uji rekoveri untuk penentuan akurasi pada konsentrasi rendah (100 µg/g), sedang (500 µg/g), dan tinggi (1000 µg/g). Presisi metode analisis adenin dan hiposantin masing-masing dapat dilihat pada Tabel 12 dan 13. Tabel 12. Presisi metode analisis adenin dalam matriks sampel emping melinjo
*RSDa merupakan nilai RSD analisis yang diperoleh dengan rumus (SD/rata-rata) x 100%
**RSDh merupakan nilai RSD yang diperoleh berdasarkan persamaan Horwitz 2(1-0.5 log c) dengan nilai c merupakan
rata-rata fraksi konsentrasi analat yang terukur dalam sampel
Tabel 13. Presisi metode analisis hiposantin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV
*RSDa merupakan nilai RSD analisis yang diperoleh dengan rumus (SD/rata-rata) x 100%
**RSDh merupakan nilai RSD yang diperoleh berdasarkan persamaan Horwitz 2(1-0.5 log c) dengan nilai c merupakan rata-rata fraksi konsentrasi analat yang terukur dalam sampel
23 tetapi hanya pada konsentrasi 1000 µg/g nilai RSDa lebih kecil dari 2/3 RSDh. Hal ini menunjukkan bahwa pada analisis adenin penambahan spike 100 dan 500 µg/g kurang presisi dibandingkan penambahan spike 1000 µg/g. Di sisi lain, pada analisis hiposantin, nilai RSDa lebih kecil dari 2/3 RSDh pada semua konsentrasi
spike yang digunakan. Dengan demikian, analisis hiposantin memiliki presisi yang baik pada semua konsentrasi spike yang digunakan.
Limit Deteksi Metode
Limit deteksi metode diuji pada matriks sampel yang berbeda untuk menguji unjuk kerja operator, unjuk kerja metode, dan efek matriks terhadap analat yang diuji. Penentuan limit deteksi metode berdasarkan hasil uji rekoveri pada penentuan akurasi dan presisi dengan penambahan spike pada tiga konsentrasi yang telah ditetapkan, yaitu pada konsentrasi rendah, sedang, dan tinggi. Limit deteksi metode ditentukan dengan memplot kurva hubungan antara standar deviasi dengan konsentrasi adenin dan hiposantin yang diperoleh pada uji rekoveri. Melalui persamaan linear kurva, ditentukan nilai standar deviasi saat konsentrasi sama dengan nol (SD0). Nilai limit deteksi metode merupakan tiga kali nilai SD0. Kurva hubungan antara standar deviasi dengan konsentrasi adenin dan hiposantin disajikan pada Gambar 7.
Gambar 7. Kurva hubungan konsentrasi (µg/g) dan standar deviasi pada penentuan limit deteksi metode analisis adenin dan hiposantin dengan HPLC-UV
24
terlalu linear, akan tetapi hasil tersebut sudah cukup baik. Umumnya nilai standar deviasi proporsional dengan besarnya konsentrasi analat. Nilai R2 yang lebih kecil dari 0.990 tersebut dapat disebabkan kesalahan acak yang terjadi pada saat preparasi sampel serta ketidakseragaman kandungan analat dalam sampel (tanpa penambahan spike).
Reprodusibilitas intralab
Pengujian reprodusibilitas intralab memiliki tujuan yang sama dengan penentuan presisi dengan uji rekoveri, hanya saja presisi hasil analisis ditentukan pada data hasil analisis sampel unspiked yang dikerjakan pada minggu yang berbeda. Hasil uji intralab reprodusibilitas pada analisis adenin dan hiposantin masing-masing dapat dilihat pada Tabel 14 dan 15.
Tabel 14. Hasil uji reprodusibilitas intralab metode analisis adenin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV*
* Angka-angka pada kolom yang sama dan diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata pada taraf uji 5% (uji lanjut Duncan)
**Kadar adenin merupakan rata-rata hasil analisis dari dua kali pengulangan di setiap minggunya ***RSDa merupakan nilai RSD analisis yang diperoleh dengan rumus (SD/rata-rata) x 100%
****RSDh merupakan nilai RSD yang diperoleh berdasarkan persamaan Horwitz 2(1-0.5 log c) dengan nilai c merupakan rata-rata fraksi konsentrasi analat yang terukur dalam sampel
Tabel 15. Hasil uji intralab reprodusibilitas metode analisis hiposantin dalam matriks sampel emping melinjo menggunakan instrumen HPLC-UV*
Minggu
* Angka-angka pada kolom yang sama dan diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata pada taraf uji 5% (uji lanjut Duncan)
**Kadar hiposantin merupakan rata-rata hasil analisis dari dua kali pengulangan di setiap minggunya ***RSDa merupakan nilai RSD analisis yang diperoleh dengan rumus (SD/rata-rata) x 100%
****RSDh merupakan nilai RSD yang diperoleh berdasarkan persamaan Horwitz 2(1-0.5 log c) dengan nilai c merupakan rata-rata fraksi konsentrasi analat yang terukur dalam sampel
Hasil pengujian pada adenin maupun hiposantin pada minggu yang berbeda menunjukkan nilai reprodusibilitas intralab yang belum memenuhi persyaratan, dengan nilai RSDa jauh lebih besar dibandingkan nilai RSDh. Nilai reprodusibilitas intralab adenin dan hiposantin yang diperoleh masing-masing
25 sebesar 34.53% dan 39.89%. Selain itu, hasil pengujian reprodusibilitas intralab dianalisis secara statistik dengan one-way ANOVA dan uji lanjut Duncan. Hasil uji statistik diperlihatkan pada Lampiran 9. Hasil yang diperoleh menunjukkan bahwa hasil analisis adenin pada minggu ke-1 berbeda nyata dengan hasil analisis pada minggu ke-2 dan ke-3, tetapi hasil analisis pada minggu ke-2 dan ke-3 tidak berbeda nyata satu sama lain pada taraf uji 5%. Sementara itu, hasil analisis hiposantin pada minggu ke-1, ke-2, dan ke-3 berbeda nyata satu sama lain pada taraf uji 5%. Hal ini menunjukkan bahwa metode analisis yang divalidasi memiliki keterulangan yang kurang baik apabila dilakukan pada waktu yang berbeda dengan rentang waktu yang cukup lama, walaupun dikerjakan oleh operator yang sama dan di laboratorium yang sama pula. Hasil yang diperoleh menunjukkan trend
kadar adenin dan hiposantin yang meningkat dari minggu ke minggu. Hal tersebut mengindikasikan adanya kesalahan sistematis yang dapat disebabkan oleh beberapa faktor antara lain sampel yang tidak homogen (pada penelitian belum dilakukan uji homogenitas sampel) serta kadar air sampel yang menurun selama penyimpanan dalam refrigerator yang menyebabkan analat terkonsentrasi dan seakan-akan meningkat kadarnya di dalam sampel. Selain itu, hasil pengujian reprodusibilitas yang kurang baik juga diduga berhubungan dengan presisi luas area yang kurang baik yang teramati pada hasil uji unjuk kerja instrumen.
SIMPULAN DAN SARAN
Simpulan
Prosedur analisis santin alkaloid pada AOAC Official Method 960.56 dapat diterapkan pada analisis basa purin adenin dan hiposantin pada sampel emping melinjo dengan HPLC-UV. Pengembangan prosedur analisis yang dilakukan menunjukkan bahwa metode analisis menggunakan hidrolisis asam tersebut memberikan rekoveri yang terbaik pada penggunaan volume HCl 6 N sejumlah 0.5 mL. Prosedur yang dikembangkan tersebut selanjutnya dapat digunakan pada tahap validasi metode.
26
Hasil reprodusibilitas intralab yang tidak memenuhi syarat diduga disebabkan oleh sampel yang tidak homogen serta kadar air sampel yang menurun selama penyimpanan dalam refrigerator yang menyebabkan analat terkonsentrasi dan seakan-akan meningkat kadarnya di dalam sampel.
Hasil penelitian secara keseluruhan menunjukkan bahwa metode analisis basa purin adenin dan hiposantin pada sampel emping melinjo dengan instrumen HPLC-UV telah tervalidasi dan memberi hasil yang akurat pada konsentrasi lebih dari 100 µg/g.
Saran
Pada penelitian ini, hanya basa purin adenin dan hiposantin yang dapat dianalisis. Hal ini dikarenakan standar guanin dan santin tidak dapat larut pada fase gerak yang digunakan untuk melarutkan adenin dan hiposantin, yaitu campuran asam fosfat 0.4% (90%) dan metanol p.a. (10%). Metode analisis perlu dikembangkan kembali agar dapat menganalisis santin dan guanin secara simultan. Hal ini penting karena guanin dan santin umum ditemukan pada berbagai sumber tanaman. Pada berbagai sumber tanaman, guanin diketahui dapat ditemukan dengan konsentrasi pada kisaran 10-1000 µg/g. Sementara santin umumnya ditemukan dalam kisaran konsentrasi yang lebih rendah yaitu 1-150 µg/g. Dengan demikian, dapat diperoleh informasi mengenai total basa purin yang terkandung dalam sampel emping melinjo.
Pada penelitian ini belum dilakukan uji homogenitas sampel. Sebaiknya uji homogenitas dilakukan untuk memastikan bahwa variasi hasil analisis bukan berasal dari sampel yang tidak homogen. Kadar analat dalam sampel sebaiknya dihitung dalam basis kering untuk memastikan bahwa kadar analat tidak dipengaruhi perubahan kandungan air dalam sampel. Selain dengan cara tersebut, sampel dapat pula disimpan di freezer untuk mencegah perubahan kadar air dalam sampel selama penyimpanan.
Penggunaan kolom SPE silika untuk menghilangkan komponen pengotor dalam sampel sebaiknya diganti dengan penggunaan kolom SPE C18. Hal tersebut dikarenakan sifat basa purin adenin dan hiposantin yang polar menyebabkan keduanya dapat tertahan oleh kolom SPE silika yang juga bersifat polar, dengan demikian rekoveri yang diperoleh menjadi lebih kecil dari yang seharusnya. Penggunaan kolom SPE C18 yang bersifat non-polar diharapkan dapat memberikan rekoveri yang lebih baik.
DAFTAR PUSTAKA
Angstadt CN. 1997. Purine and Pyrimidine Metabolism. http://library.med.utah.edu/NetBiochem/pupyr/pp.htm. (Agustus 2013). [APVMA] Australian Pesticides and Veterinary Medicines Authority. 2004.
Guidelines for the Validation of Analytical Methods for Active Constituent, Agricultural, and Veterinary Chemical Products. http://www.apvma.gov.au. (Maret 2014).
27 [AOAC] Association of Official Analytical Chemists. 2002. Peer Verified Methods Program, Manual on Policies and Procedures. Washington D.C.: The Association Analytical Chemist Inc.
[AOAC] Association of Official Analytical Chemists. 2012. AOAC Official Methods of Analysis, Appendix K: Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanical.
[AOAC] Association of Official Analytical Chemists. 2012. AOAC Official Method 960.56 Microchemical Tests for Xanthine Alkaloids, halaman 53. Barwick VJ. 1999. Sources of uncertainty in gas chromatography and
high-performance liquid chromatography. J. chrom 849: 13-33.
Bierau J. 2011. Erndim Advisory Document of The Quantitative Analysis of
Purines and Pyrimidines.
http://www.erndim.org/store/docs/PurPyrGuidance-UDUREPAT111614-10-4-2011.pdf. (Agustus 2013).
Clifford AJ, Story DL. 1976. Levels of purines in foods and their metabolic effects in rats. J. Nutr 106: 435-42.
EURACHEM Guide. 1998. The Fitness for Purpose of Analytical Methods: a Laboratory Guide to Method Validation and Related Topics. United Kingdom.
Ellington A. 2005. Reduction purine content in commonly consumed meat products through rinsing and cooking. Thesis. University of Georgia.
Garrett R, Grisham C. 2005. Nucleotides and Nucleic Acid. Biochemistry 3rd edition. Thomson Brooks/Cole.USA. (309-340).
Harmita. 2004. Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Di dalam: Majalah Ilmu Kefarmasian, Desember, Vol. 1, No. 3, pp. 117 – 135. Departemen Farmasi FMIPA-UI.
[JECFA] Joint Expert Committee on Food Additives. 2006. Combined Compendium of Food Additive Specification Volume 4. Anlaytical Methods, Test Procedures and Laboratory Solutions Used by and Referenced in the Food Additive Specifications. Rome: Food and Agriculture Organization of the United Nations.
Munajad A. 2009. Nilai Gizi Emping Melinjo.
http://empingmelinjo5s3.com/kandungan-gizi-emping.html. (Agustus 2013)
Sotelo MP, Quiros ARB, Hernandez JL, Lozano JS. 2002. Determination of purine bases in sea urchin (Paracentortus lividus) gonads by high-performance liquid chromatography. Food Chem. 79: 113-117
Titkova NF, Pomazanov VV, Kalinia YT, Sakodysnksii KI. 1983. High performance liquid chromatography of components of nucleic acid. Z Anal Khim 38: 1305-18.
Xue XF, Jin HZ, Li MW, Liang HF, Jing Z. 2009. HPLC determination of adenosine in royal jelly. Food Chem 115: 715 – 719.
28
LAMPIRAN
Lampiran 1. Hasil uji linearitas instrumen pada analisis adenin dan hiposantin dengan HPLC-UV
Adenin
Konsentrasi Adenin (µg/mL)
Area
Rata-rata SD RSD Ulangan 1 Ulangan 2 Ulangan 3
1.95 139131 181551 149538 156740 22108.05 14.10 3.91 309727 337474 274419 307207 31602.96 10.29 7.81 575649 684855 543595 601366 74058.31 12.32 15.62 1103076 1349559 1078749 1177128 149824.19 12.73 31.25 2170334 2134669 2125186 2143396 23805.68 1.11 62.50 4287204 4283828 4266246 4279093 11252.87 0.26 125.00 8500431 8466010 8500145 8488862 19790.93 0.23 250.00 16444188 16687748 16673782 16601906 136766.18 0.82
Hiposantin
Konsentrasi Hiposantin (µg/mL)
Area
Rata-rata SD RSD Ulangan 1 Ulangan 2 Ulangan 3
29
Lampiran 2. Hasil uji presisi luas area dan waktu retensi pada analisis adenin dan hiposantin dengan HPLC-UV
Adenin
Ulangan Area Waktu Retensi (menit)
1 472294 6.69
2 504553 6.718
3 507203 6.702
4 478256 6.712
5 505193 6.617
6 501217 6.617
7 514243 6.71
Rata-rata 497565.57 6.6809
SD 15826.47 0.04
RSD (%) 3.18 0.67
Hiposantin
Ulangan Area Waktu Retensi (menit)
1 324531 5.07
2 346174 5.097
3 348474 5.072
4 328595 5.077
5 346965 4.982
6 347828 4.975
7 346253 5.057
Rata-rata 341260 5.05
SD 10141.22 0.05
30
Lampiran 3. Hasil uji LOD dan LOQ instrumen pada analisis adenin dan hiposantin dengan HPLC-UV
Adenin 7.81 ppm
Ulangan Area Konsentrasi (µg/mL)
1 472294 5.73
2 504553 6.22
3 507203 6.26
4 478256 5.82
5 505193 6.23
6 501217 6.17
7 514243 6.37
Rata-rata 6.12
SD 0.24
RSDa 3.90%
RSDh 12.80%
2/3 RSDh 8.12%
LOD 0.72 µg/mL
LOQ 2.39 µg/mL
Hiposantin 7.81 ppm
Ulangan Area Konsentrasi (µg/mL)
1 324531 5.4149
2 346174 5.9058
3 348474 5.9580
4 328595 5.5071
5 346965 5.9237
6 347828 5.9433
7 346253 5.9076
Rata-rata 5.7943
SD 0.2300
RSDa 3.97%
RSDh 12.28%
2/3 RSDh 8.19%
LOD 0.69 µg/mL
31
Lampiran 4. Hasil orientasi prosedur analisis adenin dan hiposantin dalam matriks sampel emping melinjo menggunakan berbagai volume HCl
32 matriks sampel emping melinjo dengan HPLC-UV
Adenin
Konsentrasi Luas Area Adenin
Rata – rata (µg/g) Ulangan 1 Ulangan 2 Ulangan 3
50 347893 530891 638064 505616
100 596374 716063 735542 682660
200 1005965 978154 1001095 995071
400 1568283 1625396 2077318 1756999
800 2852091 3493379 3324054 3223175
Hiposantin
Konsentrasi Luas Area Hiposantin
Rata – rata (µg/g) Ulangan 1 Ulangan 2 Ulangan 3
50 327344 344580 388751 353558
100 387439 404086 435964 409163
200 576939 598746 637949 604545
400 1104164 1053106 1251758 1136343
33
Lampiran 6. Hasil uji akurasi dan presisi dari uji rekoveri pada analisis adenin dan hiposantin dalam matriks sampel emping melinjo dengan HPLC-UV
36
Hiposantin (1000µg/g)
Unspiked
Ulangan Found (µg/g)
Rata-rata (µg/g)
SD (µg/g)
RSD (%)
RSDh (%)
2/3 RSDh (%) 1 259.61 260.12 11.83 4.55 6.93 4.62 2 248.55
3 272.20
Spiked
Ulangan Added (µg/g)
Found
(µg/g)
Rata-rata (µg/g)
SD (µg/g)
RSDa (%)
RSDh (%)
Rekoveri (%) 1 1000 1248.54 1261.64 28.07 2.22 5.46 100.15 2 1000 1306.05