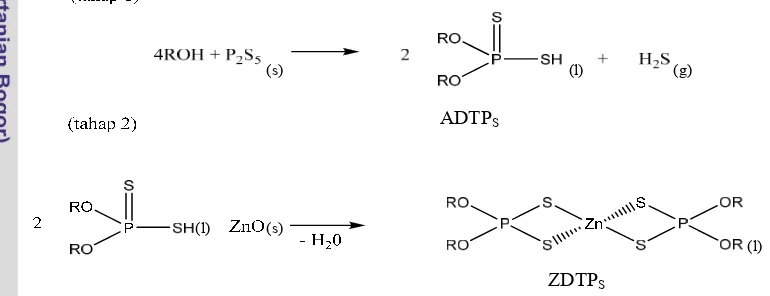
KINETIKA DAN TERMODINAMIKA KOROSI LOGAM Cu DAN
INHIBISINYA OLEH ZINK (DISIKLOHEKSILDITIOFOSFAT)
DENGAN TEKNIK POLARISASI POTENSIODINAMIK
MAULANA SEPTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kinetika dan Termodinamika Korosi Logam Cu dan Inhibisinya oleh Zink (Disikloheksilditiofosfat) dengan Teknik Polarisasi Potensiodinamik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
MAULANA SEPTIANA. Kinetika dan Termodinamika Korosi Logam Cu dan Inhibisinya oleh Zink (Disikloheksilditiofosfat) dengan Teknik Polarisasi Potensiodinamik. Dibimbing oleh KOMAR SUTRIAH dan MOHAMMAD KHOTIB.
Zink dialkilditiofosfat (ZDTP) merupakan aditif pelumas yang memiliki berbagai fungsi di antaranya sebagai antifriksi, antiaus, antioksidan, dan antikorosi. Jenis ZDTP yang dibuat dalam penelitian ini adalah ZDTP dengan gugus alkil sikloheksil (ZDTPS). Rendemen ZDTPS dihasilkan sebesar 83.50%
dan 82.10%. Efektivitas inhibisi zink disikloheksilditiofosfat mencapai 94.30% pada konsentrasi 3% dan meningkat secara signifikan pada konsentrasi 1%. Parameter termodinamika diukur untuk menunjukkan kemudahan terjadinya reaksi korosi. Parameter termodinamika dari blangko menghasilkan ΔH∗ sebesar 26.8583 kJ/mol, ΔS∗ sebesar -150.4102 J/molK, dan ΔG∗ sebesar 72.4295 kJ/mol. Sementara itu, untuk parameter termodinamika dari ZDTPS menghasilkan ΔH∗
sebesar 50.0563 kJ/mol, ΔS∗ sebesar -79.9807 J/molK, dan ΔG∗sebesar 74.2963 kJ/mol. Energi aktivasi proses korosi dengan kehadiran ZDTPS sebesar 52.6509
kJ/mol. Nilai ini lebih besar daripada energi aktivasi blangko yakni 29.4548 kJ/mol.
Kata kunci: efektivitas inhibisi, kinetika, polarisasi, termodinamika, ZDTP
ABSTRACT
MAULANA SEPTIANA. Kinetics and Thermodynamics of corrosion metal Cu and its Inhibition by Zinc (Dicyclohexyldithiophosphate) with Potentiodynamic Polarization Techniques. Supervised by KOMAR SUTRIAH and MOHAMMAD KHOTIB.
Zinc dialkyldithiophosphates (ZDTP) is a lubricant additives which has many functions such as anti-friction, anti-wear, antioxidants, and anti-corrosion. In this research, ZDTP type which was made is ZDTP with alkyl cyclohexyl group (ZDTPS). The yield of ZDTPS were 83.50% and 82.10%. Inhibition
effectivity of zinc dicyclohexyldithiophosphate were 94.30% in concentration 3% and increase significantly in concentration 1%. The parameters of thermodynamics was measured to show the easiness of corrosion reaction occur. Themodynamics parameters of blank revealed ΔH∗ was 26.8583 kJ/mol, ΔS∗ was
-150.4102 J/molK, and ΔG∗ was 72.4295 kJ/mol. Thermodynamics parameters of ZDTPS revealed ΔH∗ was 50.0563 kJ/mol, ΔS∗ was -79.9807 J/molK, and ΔG∗
was 74.2963 kJ/mol. Activation energy from the corrosion process with ZDTPS
presence was 52.6509 kJ/mol. This value is bigger than energy activation of blank with the value was 29.4548 kJ/mol.
© Hak Cipta milik IPB, tahun 2014
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
KINETIKA DAN TERMODINAMIKA KOROSI LOGAM Cu DAN
INHIBISINYA OLEH ZINK (DISIKLOHEKSILDITIOFOSFAT)
DENGAN TEKNIK POLARISASI POTENSIODINAMIK
MAULANA SEPTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kinetika dan Termodinamika Korosi Logam Cu dan Inhibisinya oleh Zink (Disikloheksilditiofosfat) dengan Teknik Polarisasi Potensiodinamik
Nama : Maulana Septiana NIM : G44100035
Disetujui oleh
Dr Drs Komar Sutriah, MS Pembimbing I
Mohammad Khotib, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2014 sampai Juli 2014 di Laboratorium Terpadu IPB ini ialah inhibitor korosi dengan judul Kinetika dan Termodinamika Korosi Logam Cu dan Inhibisinya oleh Zink (Disikloheksilditiofosfat) dengan Teknik Polarisasi Potensiodinamik.
Terima kasih penulis ucapkan kepada Bapak Dr Drs Komar Sutriah, MS dan Bapak Mohammad Khotib, MSi selaku pembimbing atas bimbingan, dorongan semangat, dan ilmu yang diberikan kepada penulis selama penelitian dan penyusunan karya ilmiah ini. Terima kasih tak terhingga penulis ucapkan kepada Ayah, Ibu, Kakak-kakak dan seluruh keluarga atas dorongan semangat, doa, bantuan fisik dan materi, kesabaran, dan kasih sayangnya kepada penulis. Ucapan terima kasih juga penulis ucapkan kepada Denar Zuliandanu SSi, Lestari Ainun SSi, Kak Yono, Kak Saiful, Eva Nurlaela Sari, Yunita Primasanti, Nofianita Khoirunnisa, Faisal RG, Vicky O, Ali Aulia G, Bapak Puy, dan semua teman-teman penelitian di Laboratorium Terpadu yang telah membantu selama penelitian berlangsung. Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Waktu dan Tempat Penelitian 2
METODE 2
Bahan dan Alat 2
Sintesis Zink Disikloheksilditiofosfat 2
Pencirian Gugus Fungsi 3
Analisis Logam 3
Pengukuran dengan Teknik Polarisasi Potensiodinamik 3
Parameter Termodinamika 4
Kinetika Laju Korosi 4
HASIL DAN PEMBAHASAN 5 Hasil Sintesis ZDTPS 5 Pencirian Gugus Fungsi 6
Analisis Logam 7
Pengukuran Efektivitas Inhibisi 7
Pengaruh Suhu terhadap Arus Korosi 8
Parameter Termodinamika dan Kinetika Korosi 9
SIMPULAN DAN SARAN 10 Simpulan 10
Saran 10
DAFTAR PUSTAKA 11
LAMPIRAN 12
DAFTAR TABEL
1 Rendemen sintesis ZDTPS 6
2 Data hasil uji kadar logam 7
3 Parameter korosi dan EI korosi larutan ZDTPS yang diukur pada suhu
ruang dan lama penyelupan 15 detik 8
4 Pengaruh suhu terhadap arus korosi 8
5 Parameter termodinamika dan kinetika korosi 9
DAFTAR GAMBAR
1 Rute sintesis ZDTPS 5
2 Spektrum FTIR produk hasil sintesis 6
3 Kurva hubungan antara ln (icorr/T) terhadap 1000/T 9
4 Kurva hubungan antara ln icorr terhadap 1000/T 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian 12
2 Rangkaian alat sintesis ZDTPS 13
3 Elektrode, reservoir, dan rangkaian alat potensiostat 14
4 Bobot reaktan dan perhitungan sintesis ZDTPS 15
5 Contoh perhitungan data polarisasi potensiodinamik 16
6 Kurva polarisasi ZDTPS 17
PENDAHULUAN
Latar Belakang
Manusia telah banyak memanfaatkan logam di dalam segala bidang kehidupan terutama bidang industri dan transportasi. Salah satu logam yang sering dimanfaatkan adalah logam tembaga. Logam yang berinteraksi dengan lingkungan akan menimbulkan penurunan mutu atau kerusakan yang dapat memperpendek umur pakai (lifetime) dari suatu material. Penurunan mutu atau kerusakan material tersebut disebut korosi. Korosi pada umumnya tidak dapat dihentikan karena merupakan peristiwa alami yang terjadi ketika suatu logam berinteraksi dengan lingkungannya, tetapi korosi dapat diperlambat lajunya. Salah satu cara yang digunakan untuk memperlambat laju korosi yaitu dengan penambahan inhibitor. Umumnya inhibitor korosi berasal dari senyawa organik maupun anorganik yang memiliki pasangan elektron bebas (Haryono et al. 2010). Dengan adanya inhibitor korosi maka umur pakai alat-alat industri dan transportasi dapat lebih lama jika dibandingkan dengan tanpa adanya inhibitor korosi.
Minyak pelumas secara umum diartikan sebagai suatu zat yang ditempatkan di antara dua bidang permukaan pada alat industri atau transportasi yang terbuat dari logam yang bergerak dengan tujuan mengurangi gesekan di antara keduanya. Perkembangan teknologi industri dan transportasi menyebabkan kebutuhan akan pelumas meningkat dengan pesat. Perkembangan selanjutnya memungkinkan mesin-mesin bergerak lebih cepat, lebih berat, dan suhu yang ditimbulkan lebih tinggi, sehingga menimbulkan suatu tuntutan bagi minyak pelumas agar memiliki sifat yang lebih baik. Untuk memenuhi tuntutan tersebut, timbul pemikiran untuk menambahkan suatu zat aditif ke dalam minyak pelumas.
Senyawa zink dialkilditiofosfat (ZDTP) banyak digunakan sebagai aditif minyak lumas (Jaenudin 1998). ZDTP juga dapat bertindak sebagai inhibitor korosi (Loftus 2002). ZDTP melindungi logam dari korosi dengan cara teradsorpsi pada permukaan logam. Selain sebagai inhibitor korosi, ZDTP juga berperan sebagai antifriksi, antiaus, dan antioksidan (Rudnick 2009). Dalam penelitian ini, ZDTP yang akan diuji kinerja antikorosinya memiliki rantai alkil C6
yang memiliki bentuk siklik yaitu sikloheksil (ZDTPS). Senyawa ZDTP di
laboratorium dapat disintesis dari fosfor pentasulfida dengan berbagai macam alkohol, baik primer, sekunder, maupun tersier melalui dua metode sintesis yaitu langsung dan tidak langsung. Metode langsung dilakukan melalui pembentukan senyawa ADTP sebagai senyawa antara, sedangkan metode tidak langsung dilakukan melalui pembentukan garam alkali atau garam amonium sebagai senyawa antara (Jaenudin 1998).
Pengukuran kinerja antikorosi dilakukan dengan menggunakan teknik polarisasi potensiodinamik dengan ekstrapolasi kurva Tafel. Teknik ini merupakan teknik yang umum digunakan untuk mengukur kinerja antikorosi berdasarkan pantauan arus korosi. Pantauan polarisasi seperti arus korosi, potensial korosi, dan kemiringan Tafel dapat digunakan untuk menghitung kinerja antikorosi zink disikloheksilditiofosfat (ZDTPS) yang akan diuji. Parameter
2
kemudahan peristiwa korosi dapat terjadi. Parameter termodinamika ditinjau dari besarnya ΔG, ΔH, dan ΔS, sedangkan parameter kinetika ditinjau dari besarnya
energi aktivasi (Ea).
Tujuan Penelitian
Penelitian ini bertujuan menyintesis senyawa ZDTP dengan alkil sikloheksil sebagai ligan, mengukur kinerja ZDTPS sebagai inhibitor korosi melalui
penetapan parameter kinetika dan termodinamikanya pada logam tembaga (Cu).
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari hingga bulan Juli 2014 di Laboratorium Terpadu IPB Baranangsiang.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah P2S5 (Merck), n-heptana (Merck), ZnO
(teknis), akuades, sikloheksanol, HCl pekat, aseton, HCl 5%, ampelas silikon karbida 100 CW, dan elektrode tembaga. Alat-alat yang digunakan, yaitu Erlenmeyer asah, sudip, labu didih, penguap putar, termometer, pemanas, pengaduk magnetik, neraca analitik, Potentiostat DY2300, FTIR Prestige-21 Shimadzu, dan AAS AA-6300 Shimadzu.
Sintesis Zink Disikloheksilditiofosfat
Alat sintesis dirangkai seperti yang tertera pada Lampiran 1. Zink disikloheksilditiofosfat disintesis dalam dua tahap (Gambar 1). Tahap pertama dilakukan dengan mereaksikan 0.1440 mol sikloheksil alkohol dan 0.0360 mol P2S5 atau dengan perbandingan 4:1 dalam pelarut n-heptana. Campuran diaduk
dengan pengaduk magnetik pada suhu 80 °C selama 12 jam di dalam penangas air. Reaksi ini akan membentuk asam disikloheksilditiofosfat (ADTPS). Tahap kedua
dilakukan dengan menambahkan sebanyak 0.0360 mol ZnO untuk membentuk ZDTPS dengan cara diaduk. Pengadukan dilakukan dengan menggunakan
pengaduk magnetik selama 12 jam untuk mendapatkan zink disikloheksilditiofosfat (Dinoiu et al. 2007). Produk hasil sintesis kemudian diekstraksi dengan 20 ml n-heptana dan pencucian dengan 30 ml air (Rismawati 2013). Ekstraksi dan pencucian dilakukan hingga fase air terlihat jernih. Fase organik yang diperoleh, kemudian dipisahkan dan diuapkan pelarutnya menggunakan penguap putar untuk mengetahui rendemen ZDTPS hasil sintesis
3 Pencirian Gugus Fungsi
ZDTPS hasil sintesis diidentifikasi dengan menggunakan instrumen FTIR
yang bertujuan mengetahui gugus fungsi dan ikatan kimia dari hasil sintesis. Pengukuran dilakukan dengan cara menggerus ZDTPS sebanyak 0.02 gram
dengan bubuk KBr sebanyak 0.1 gram, lalu campuran dimasukkan ke dalam oven selama 24 jam pada suhu 60 °C. Selanjutnya dibuat menjadi pelet dan kemudian diukurpada bilangan gelombang 4000-500 cm-1.
Analisis Logam
Sampel ZDTPS ditimbang sebanyak 0.5 gram dan ditambahkan 10 mL
HNO3 pekat. Campuran kemudian didestruksi hingga larutan menjadi tidak
berwarna, kemudian ditambahkan HCl pekat sebanyak 5 mL dan didestruksi kembali hingga asap hilang. Larutan hasil destruksi kemudian disaring ke dalam labu takar 100 mL lalu ditera dengan akuades. Larutan kemudian diukur konsentrasi Zn-nya pada panjang gelombang 213.9 nm dan lebar celah 0.7 nm dengan AAS Shimadzu sehingga didapatkan kadar Zn dari ZDTPS hasil sintesis.
Pengukuran dengan Teknik Polarisasi Potensiodinamik
Tembaga (Cu) sebagai elektrode kerja dipreparasi dengan cara diampelas permukaannya lalu dibilas dengan akuades dan aseton. Selanjutnya, logam tembaga dimasukkan ke dalam reservoir yang berisi larutan uji NaCl 1%. Elektrode Ag/AgCl sebagai elektrode pembanding dan elektrode Pt sebagai elektode pembantu. Kabel warna hitam pada Potentiostat DY2300 disambungkan pada elektrode kerja, kabel warna putih disambungkan pada elektrode pembanding, dan kabel warna merah dihubungkan pada elektrode pembantu. Larutan uji didiamkan 5 menit untuk mencapai kesetimbangan dengan elektrode, kemudian program Potentiostat DY2300 pada perangkat komputer dinyalakan dan pilih teknik linear sweap polarization pada kotak dialog. Pengukuran blangko dilakukan pada rentang potensial 60 sampai 100 mV untuk anode dan 60 sampai 0 mV untuk katode dengan laju payar0.2 mV/s. Setelah pengukuran blangko selesai, elektrode Cu dibersihkan kembali dengan cara dibilas HCl 5% dan diampelas. Setelah itu dicuci kembali menggunakan akuades dan aseton. Elektrode Cu yang telah dibersihkan kemudian dicelupkan ke dalam larutan ZDTPS dengan
konsentrasi 0.5%, 1%, 2%, dan 3% selama 15 detik dan ditiriskan beberapa saat. Elektrode kerja kemudian dirangkaikan kembali pada reservoir dan dilakukan lagi pengondisian sekitar 2 menit. Setelah pengondisian selesai, sampel diukur pada rentang potensial yang sama baik untuk anode maupun katode. Data yang didapatkan kemudian diproses dengan ekstrapolasi kurva Tafel dan Microsoft Excel sehingga didapatkan kurva polarisasi. Dari kurva tersebut, diperoleh informasi berupa potensial korosi (Ecorr), tetapan Tafel anode (βa) dan katode (βc),
serta arus korosi (icorr)(Perez 2004). Efektivitas inhibitor (%EI) dihitung dengan
4
%EI= !!"## !"#$%&' ! !!"## (!"#!$!%&')
!!"## (!"#$%&') ×100% (1) sedangkan untuk menghitung derajat penutupan permukaan dapat dihitung dengan menggunakan persamaan berikut (Morad dan El-Dean 2006):
ɵ = 1 – !!"## (!"#!$!%&') !!"## (!"#$%&')
(2)
Parameter Termodinamika
Rafiquee et al. (2008) menyatakan bahwa parameter termodinamika proses terjadinya korosi dapat ditentukan dari Persamaan Arrhenius keadaan transisi, yaitu:
tetapan Planck, T adalah suhu (K), ΔS∗ adalah nilai entropi keadaan transisi, dan
ΔH∗ adalah nilai entalpi keadaan transisi. Perubahan energi bebas Gibbs transisi dapat dihitung dengan persamaan:
ΔG∗ = ΔH∗ −TΔS∗ (4)
Dengan ΔG∗ adalah nilai derajat kebebasan pada keadaan transisi. Untuk mencari parameter termodinamika ini dilakukan pengukuran pada suhu 30 °C, 40 °C, dan 50 °C.
Kinetika Laju Korosi
Kinetika laju korosi dapat diketahui dengan meninjau energi aktivasinya. Energi aktivasi adalah energi minimum yang dibutuhkan untuk terjadinya suatu reaksi. Energi aktivasi dapat dihitung dari alur data antara ln icorr dengan1T
berdasarkan persamaan Arrhenius dengan memvariasikan suhu pengaturan pada 30 °C, 40 °C, dan 50 °C.
k= Aexp ! !!
!" (5) Ea adalah energi aktivasi dan k adalah konstanta laju reaksi yang berbanding lurus
dengan arus korosi (icorr) yang peka terhadap perubahan suhu. Sehingga
persamaan Arrhenius dapat ditulis sebagai berikut:
�!"## = Aexp ! !!
!" ln
�!"## = lnA− !!
5 A adalah konstanta Arrhenius yang ditentukan secara empirik, �! adalah energi
aktivasi dari proses korosi, T adalah suhu, dan R adalah konstanta gas ideal (8.314 J mol-1 K-1).
HASIL DAN PEMBAHASAN
Hasil Sintesis ZDTP
Zink disikloheksilditiofosfat disintesis dengan menggunakan cara konvesional yang terbagi menjadi 2 tahap yaitu tahap pertama dengan menyampurkan sikloheksanol atau sikloheksil alkohol dengan bubuk fosforus pentasulfida (P2S5) dalam pelarut n-heptana. Campuran tersebut kemudian
direfluks selama 12 jam pada suhu 80 °C dengan pengadukan. Pada tahap pertama ini dihasilkan senyawa antara yaitu asam disikloheksilditiofosfat (ADTPS). Pada
tahap kedua, ADTPS yang terbentuk direaksikan dengan bubuk zink oksida (ZnO)
untuk membentuk senyawa hasil ZDTPS.
Gambar 1 Rute sintesis ZDTP (R = sikloheksil)
Pada proses sintesis ZDTPS, senyawa P2S5 yang direaksikan harus dalam
jumlah berlebih. Hal tersebut dikarenakan agar sikloheksanol yang digunakan bereaksi seluruhnya pada tahap pertama, sehingga tidak ada sikloheksanol yang tersisa atau tidak bereaksi. Jika sikloheksanol tersisa, maka dikhawatirkan akan terjadi persaingan reaksi adisi pada tahap 2 antara sikloheksanol yang bersisa dan ADTPS terhadap ZnO. Persaingan reaksi tersebut akan mengakibatkan rendemen
ZDTPS berkurang. Senyawa ZnO juga harus ditambahkan dalam jumlah berlebih.
Hal tersebut dikarenakan agar senyawa ADTPS bereaksi seluruhnya menjadi
ZDTPS (Zuliandanu 2013).
Zink disikloheksilditiofosfat yang dihasilkan memiliki wujud cair seperti minyak (oily). Tabel 1 menunjukkan besar persen rendemen ZDTPS hasil sintesis.
Bobot reaktan dan perhitungan rendemen dapat dilihat pada Lampiran 4.
6
Tabel 1 Rendemen sintesis ZDTPS
Ulangan Pelarut Gugus alkil Suhu sintesis (°C) % Rendemen 1
n-heptana Sikloheksil 80 83.50
2 82.10
Rendemen sintesis kurang dari rendemen teoritis dikarenakan suhu sintesis ADTPS pada tahap pertama kurang tinggi atau kurang optimum. Struktur
sikloheksil yang lebih ruah dibandingkan alkil dengan rantai alifatik menyebabkan proses adisi nukleofili ketika pembentukan ADTPS menjadi lambat. Maka
diperlukan pasokan energi yang lebih besar yaitu dengan meningkatkan suhu sintesis (Zuliandanu 2013). Suhu 80 °C diduga belum optimal, sehingga jumlah mol ADTPS yang dihasilkan pada tahap pertama kurang dari jumlah mol ADTPS
teoritis yang berdampak pada rendemen ZDTPS. Namun, jika suhu sintesis terlalu
tinggi maka ADTPS yang terbentuk akan terurai kembali. Selain suhu sintesis
yang kurang optimum, faktor lain yang menyebabkan rendemen sintesis kurang dari rendemen teoritis adalah adanya oksigen dari udara ketika sintesis tahap pertama dan tahap kedua. Hal tersebut mengakibatkan oksidasi pada 2 molekul ADTPS yang akan membentuk ikatan disulfida, yaitu ikatan dimer antara dua
molekul ADTP (Jaenudin 1998).
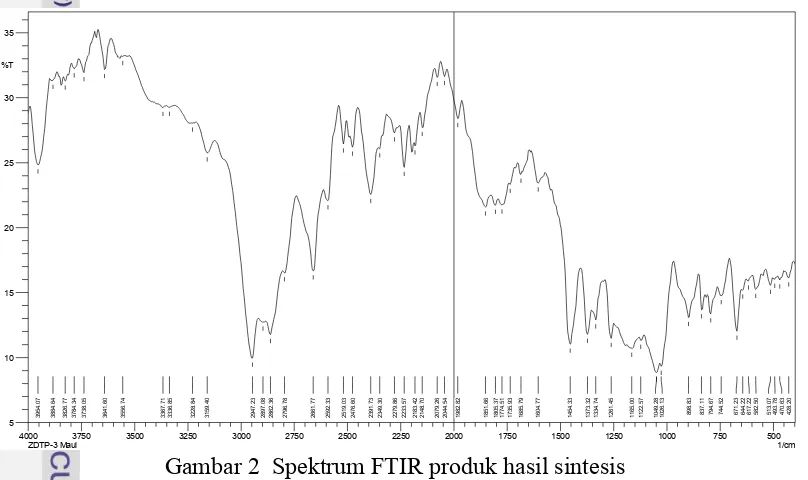
Pencirian Gugus Fungsi
Pencirian gugus fungsi dari ZDTPS hasil sintesis dilakukan dengan
menggunakan FTIR. Prinsip dari FTIR adalah untuk mengidentifikasi ikatan-ikatan kimia yang terbentuk dari produk sintesis.
Gambar 2 Spektrum FTIR produk hasil sintesis
7 senyawa alkana siklik. Serapan pada bilangan gelombang 794.67 cm-1 (845-725 cm-1) menunjukkan adanya regangan P−O dan dan serapan pada bilangan gelombang 1049.28 cm-1 (1300-1000 cm-1) menunjukkan adanya regangan C−O. Serapan pada rentang 582.50 cm-1(650-540 cm-1)menunjukkan adanya regangan P−S. Adanya serapan regangan O−H pada bilangan gelombang 3641.60 cm-1 (3650-3600 cm-1) dan tekuk C−O−H pada bilangan gelombang 1373.32 cm-1 (1440-1220 cm-1) menunjukkan masih adanya alkohol yang bersisa (Pavia et al. 2001). Sementara untuk serapan Zn−S pada daerah inframerah jauh (500-300 cm
-1
) tidak diukur.
Analisis Logam
Analisis logam pada ZDTPS dilakukan dengan menggunakan metode
spektrofotometri serapan atom (SSA). Metode ini sangat tepat untuk menganalisis kadar logam dengan konsentrasi yang sangat kecil. Hasil analisis digunakan untuk memverifikasi komposisi logam Zn yang ada pada ZDTPS.
Tabel 2 Data hasil uji kadar logam Ulangan Kadar Zn Hasil Kadar Zn Sintesis (%) Teoritis (%)
1 6.28
10.04
2 6.94
Dari Tabel 2 dapat dilihat bahwa diperoleh persen kadar Zn sebesar 6.28% dan 6.94%. Hasil kadar zink dari ZDTPS hasil sintesis masih rendah dibandingkan
dengan kadar Zn yang seharusnya yaitu sebesar 10.04%. Hal ini diduga karena adanya pengotor dari ZDTPS hasil sintesis, sehingga kadar zink hasil sintesis lebih
rendah dibandingkan zink teoritis.
Pengukuran Efektivitas Inhibisi
Pengukuran efektivitas inhibisi dari ZDTPS hasil sintesis dilakukan dengan
menggunakan alat potensiostat yaitu dengan teknik polarisasi potensiodinamik. Sifat korosi dapat didekati dengan kurva polarisasi (Lampiran 6). Pengukuran dengan alat potensiostat akan didapatkan kurva Tafel anode dan katode. Arus korosi didapatkan dari perpotongan antara kedua kurva tersebut.
Tabel 3 menunjukkan penurunan arus korosi dan kenaikan efektivitas inhibisi seiring dengan kenaikan konsentrasi ZDTPS. Persamaan yang digunakan
untuk mencari %EI dapat dilihat pada Persamaan 1. Kenaikan konsentrasi inhibitor mengakibatkan efektivitas inhibisi meningkat. Hal tersebut dikarenakan semakin banyaknya molekul-molekul inhibitor yang terkandung di dalamnya sehingga kemungkinan inhibitor korosi teradsorpsi pada permukaan logam menjadi semakin besar (Fahrurrozie et al. 2010). Kenaikan efektivitas inhibisi secara signifikan ditunjukkan pada konsentrasi ZDTPS 1%. Ketika konsentrasi
ZDTPS 2% dan 3% kenaikannya tidak signifikan lagi, sehingga konsentrasi
8
dalam menginhibisi arus korosi. Meningkatnya efektivitas inhibisi diikuti dengan meningkatnya derajat penutupan permukaan logam oleh inhibitor korosi (ɵ). Nilai derajat penutupan yang tinggi menunjukkan penutupan penuh permukaan logam oleh inhibitor korosi (El-Lateef et al. 2012). Persamaan 2 merupakan rumus yang digunakan untuk mencari nilai derajat penutupan permukaan.
Tabel 3 Parameter korosi dan EI korosi larutan ZDTPS yang diukur pada suhu
ruang dan lama penyelupan 15 detik Konsentrasi
Laju korosi dapat didefinisikan sebagai hilangnya massa atau bobot material atau logam dalam satuan waktu yang diakibatkan oleh penyerangan substituen korosif terhadap material. Pada umumnya, satuan laju korosi adalah mm per tahun (Iga dan Ik 2007). Pada Tabel 3, dapat dilihat bahwa kenaikan konsentrasi ZDTPS
dapat menurunkan laju korosi dari logam Cu. Hal tersebut dikarenakan dengan meningkatnya konsentrasi larutan ZDTPS maka akan semakin banyak molekul
ZDTPS yang melapisi logam Cu.
Pengaruh Suhu terhadap Arus Korosi
Dalam suatu reaksi, konsentrasi dan orde reaksi tidak peka terhadap perubahan suhu. Melainkan konstanta laju yang peka terhadap perubahan suhu (Atkins dan Paula 2012), sedangkan dalam kinetika elektrokimia korosi, arus korosi peka terhadap perubahan suhu (Rafiquee et al. 2008). Jadi dapat dikatakan bahwa konstanta laju sebanding dengan arus korosi.
Kenaikan suhu mengakibatkan energi sistem menjadi lebih besar. Energi tersebut menjadikan konstituen korosif menjadi lebih aktif dalam pergerakannya, sehingga arus korosi meningkat dengan tejadinya kenaikan suhu seperti yang terlihat pada Tabel 4.
9 Arus korosi baik blangko maupun sampel tidak mengalami peningkatan yang signifikan dengan tiap kenaikan suhu 10 °C dengan rentang 30-50 °C. Hal ini diduga pergerakan konstituen korosif menjadi semakin acak dan semakin cepat dalam reservoir yang mengakibatkan efektivitas kontak dengan logam menjadi berkurang. Pengolahan data pengaruh suhu terhadap arus korosi disajikan pada Lampiran 7.
Parameter Termodinamika dan Kinetika Korosi
Parameter termodinamika korosi ΔG∗, ΔH∗, dan ΔS∗ didapatkan dari
persamaan regresi kurva hubungan antara ln (icorr/T) terhadap 1000/T (Gambar 3)
sesuai dengan persamaan Arrhenius keadaan transisi (Persamaan 3 dan Persamaan 4).
Gambar 3 Kurva hubungan antara ln (icorr/T) terhadap 1000/T
Tabel 5 memperlihatkan bahwa nilai ΔH∗,ΔS ∗,dan ΔG∗ korosi logam Cu yang dilapisi oleh ZDTPS memiliki nilai yang lebih besar dibandingkan dengan
logam Cu yang tidak dilapisi ZDTPS (blangko). Nilai ΔH∗ ZDTPS yang lebih
besar dibandingkan blangko menunjukkan bahwa dibutuhkan energi yang lebih besar untuk terjadinya peristiwa korosi dengan adanya ZDTPS yang melapisi
logam uji dibandingkan dengan blangko. Nilai ΔS∗ menunjukkan derajat
ketidakteraturan. Adanya ZDTPS meningkatkan derajat ketidakteraturan yang
dimanifestasikan dengan kenaikan ΔS∗ yang terukur (Morad dan El-Dean 2006). Nilai ΔG∗ menunjukkan spontanitas reaksi. Nilai ΔG∗ ZDTPS lebih besar dibandingkan blangko yang menunjukkan menurunnya spontanitas poses korosi pada logam uji atau proses korosi terhambat dengan adanya ZDTPS.
Tabel 5 Parameter termodinamika dan kinetika korosi logam Cu Larutan ΔH∗ (kJ mol-1
) ΔS∗ (J K-1mol-1) ΔG∗ (kJ mol-1) Ea (kJ mol-1)
Blangko 26.8583 -150.4102 72.4295 29.4548
10
Gambar 4 Kurva hubungan antara ln icorr terhadap 1000/T
Parameter kinetika korosi dimanifestasikan melalui energi aktivasi (Ea). Nilai Ea didapatkan dari kurva hubungan antara ln icorr terhadap 1000/T (Gambar
4) sesuai dengan persamaan Arrhenius (Persamaan 5 dan Persamaan 6). Keberadaan ZDTPS meningkatkan nilai dari energi aktivasi (Tabel 5). Semakin
tinggi energi aktivasi, maka semakin besar juga energi yang dibutuhkan untuk terjadinya proses korosi, sehingga proses korosi akan sulit tercapai.
SIMPULAN DAN SARAN
Simpulan
Kinerja inhibitor korosi ZDTPS yang dimanifestasikan oleh parameter
termodinamika dan parameter kinetika telah berhasil ditentukan dengan teknik polarisasi potensiodinamik. Zink disikloheksilditiofosfat memiliki efektivitas inhibisi efektif pada konsentrasi 1% yakni sebesar 74.51%. ZDTPS hasil sintesis
mampu menurunkan spontanitas korosi dari 72.4295 kJ mol-1 menjadi 74.2963 kJ mol-1. Nilai Ea ZDTPS didapati lebih besar daripada blangko yang artinya
dibutuhkan energi minimum yang lebih besar untuk terjadinya proses korosi. Sehingga dengan penambahan ZDTPS proses korosi akan sulit tercapai.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai optimasi suhu sintesis dan pengondisian atmosfer inert ketika menyintesis zink disikloheksilditiofosfat agar mendapatkan ZDTPS dengan rendemen yang lebih besar, serta variasi atom pusat
dan alkil untuk mendapatkan ZDTP dengan kinerja antikorosi yang lebih baik.
y = -3.5428x + 12.415
3.0500 3.1000 3.1500 3.2000 3.2500 3.3000 3.3500
ln
icorr
1000/T
Blanko
11
DAFTAR PUSTAKA
Atkins P, Paula JD. 2012. Physical Chemistry Ed ke-6. New York (US): WH Freeman.
Dinoiu V, Danilian F, Bogatu L. 2007. The influence of synthesis method of zinc dialkyldithiophosphates on the process of addivation. Rev Chim (Bucure°ti). 58(2):183-185.
El-Lateef HM, Aliyeva LI, Abbasov VM, Ismayilov TI. 2012. Corrosion inhibition of low carbon steel in CO2-saturated solution using anionic
surfactant. Adv Appl Sci Res. 3(2):1185-1201.
Fahrurrozie A, Sunarya Y, Mudzakir A. 2010. Efisiensi inhibisi cairan ionic turunan imidazolin sebagai inhibitor korosi baja karbon dalam larutan elektrolit jenuh karbon dioksida. J Sains dan Teknologi Kimia. 1(2):110-111. Haryono G, Sugiarto B, Farid H, Tanoto Y. 2010. Ekstrak bahan alam sebagai
inhibitor korosi. Kejuangan. ISSN 1693-4393.
Hayati IK. 2013. Pengaruh pelarut pada rendemen sintesis zink bis(dibutilditiofosfat) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Iga KS, Ik S. 2007. Prediksi laju korosi dengan perubahan besar derajat deformasi plastis dan media pengorosi pada material baja karbon. J Ilmiah Teknik Mesin Cakram. 1(1):1-8.
Jaenudin. 1998. Pembuatan Zn-Diisobutilditiofosfat dan penggunaanya sebagai aditif minyak lumas otomotif [tesis]. Jakarta (ID): Universitas Indonesia. Loftus S. 2002. Zinc Dialkylditiophosphates Category. New York (US): American
Chemistry Council.
Morad MS, El-Dean AMK. 2006. 2,2'-Dithiobis(3-cyano-4,6-dimethylpyridine): A new class of acid corrosion inhibitors for mild steel. Corr Sci. 48(11):3398- 3412.
Pavia DL, Lapman GM, Kriz GS, Vyvyan JR. 2001. Intoduction to Spectroscopy Ed ke-4. Washington (US): Thomson Learning.
Perez N. 2004. Electrochemistry and Corrosion Science. New York (US): Kluwer Academic Publishers.
Rafiquee MZA, Saxena N, Khan S, Quraishi MA. 2008. Influence of surfactants on the corrosion inhibition behavior of 2-aminophenyl-5-mercapto-1-oxa- 3,4-diazole (AMOD) on mild steel. M Chem and Phys. 107(2-3):528-533. Rismawati. 2013. Pengaruh jenis alkohol pada rendemen sintesis zink
dialkilditiofosfat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rudnick LR. 2009. Lubricant Additives Chemistry and Applications Ed ke-2. Prancis: CRC Pr.
12
LAMPIRAN
Lampiran 1 Diagram alir penelitian
P2S5 n-heptana Sikloheksanol
ADTPS ZnO
ZDTPS
Crude
produk Ekstraksi
13 Lampiran 2 Rangkaian alat sintesis ZDTP
(Hayati 2013)
Keterangan: a = P2S5 + n-heptana + sikloheksanol
b = penangas air
c = rangkaian penjerap H2S
14
Lampiran 3 Elektrode, reservoir, dan rangkaian alat potensiostat
Elektrode Cu Potentiostat DY2300
Reservoir
15 Lampiran 4 Bobot reaktan dan perhitungan sintesis ZDTPS
Ulangan Contoh perhitungan rendemen (Ulangan 1):
Mol sikloheksanol (pereaksi pembatas) = !"!"# !"#$%&'#!()%$
16
Lampiran 5 Contoh perhitungan data polarisasi potensiodinamik
Suhu
Perhitungan ekstrapolasi kurva Tafel (suhu 30 °C):
• Arus korosi blangko
Persamaan garis Tafel anode : y = -10.9214x + 0.0300 Persamaan garis Tafel katode: y = 17.6540x + 0.0876
Arus korosi (x) didapatkan ketika persamaan garis Tafel anode dan Tafel katode berpotongan (yanode = ykatode)
17 Lampiran 6 Kurva polarisasi ZDTPS
Kurva polarisasi tumpuk dari blangko, ZDTPS 0.5%, ZDTPS 1%, ZDTPS 2%, dan
ZDTPS 3%
Kurva polarisasi dari ZDTPS 1% pada suhu 30 °C
18
Lampiran 7 Pengolahan data variasi suhu dan perhitungan CR
Larutan Suhu
303 3.3003 2.0157 0.7010 0.0067 -5.0128
313 3.1949 3.1242 1.1392 0.0100 -4.6070
323 3.0960 4.1519 1.4236 0.0129 -4.3541
ZDTPS 1%
303 3.3003 0.9355 -0.0667 0.0031 -5.7804
313 3.1949 2.1405 0.7610 0.0068 -4.9852
323 3.0960 3.4008 1.2240 0.0105 -4.5536
19
RIWAYAT HIDUP
Penulis lahir di Rangkasbitung, 3 September 1992. Penulis merupakan anak ketiga dari empat bersaudara dari pasangan H. Ajot Al Sartaja dan Hj. Enjun Junaeni. Pada tahun 2010, penulis lulus dari SMA Negeri 1 Rangkasbitung dan melanjutkan studi di Departemen Kimia, FMIPA Institut Pertanian Bogor melalui jalur undangan seleksi masuk IPB (USMI).