AKTIVITAS ANTIKANKER ISOLAT
Sinularia
sp.
PERAIRAN TELUK LAMPUNG
NANDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudulAktivitas Antikanker IsolatSinularia sp. Perairan Teluk Lampungadalah benar karya saya dari arahan
komisi pembimbing dan belum diajukan dalam bentuk apapun di perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, Juli 2016
Nanda
RINGKASAN
NANDA. Aktivitas Antikanker IsolatSinularia sp. Perairan Teluk Lampung.
Dibimbing oleh TUN TEDJA IRAWADI, ZAINAL ALIM MAS’UD dan ETTY RIANI.
Kanker merupakan salah satu penyebab kematian utama di dunia. Tercatat 8.2 juta orang meninggal karena kanker pada tahun 2012, penyebab utamanya kanker paru, hati, perut, kolorektal dan payudara. Hingga saat ini peneliti terus melakukan pengembangan pengobatan kanker, salah satunya pengembangan obat-obatan baru yang bersifat antikanker. Sumber obat-obat-obatan terbaru dapat diperoleh dari hewan atau tumbuhan laut seperti spons, tripang dan karang. Sinularia
merupakan karang lunak yang memiliki beragam aktivitas biologis diantaranya sebagai antiinflamasi, antikanker, antibakteri dan antivirus. Penelitian ini bertujuan untuk mendapatkan isolatyang berpotensi sebagai antikanker payudara dari Sinularia perairan Teluk Lampung.
Sampel dimaserasi dengan pelarut etil asetat, kemudian residu dimaserasi kembali dengan pelarut n-heksana. Ekstrak kasar yang diperoleh di uji tingkat toksisitas menggunakan larva udang A. salina. Ekstrak terbaik difraksionasi
menggunakan Kromatografi cair vakum (KCV). Fraksi terbaik hasil KCV, kemudian difraksionasi dengan kromatogravi kolom gravitasi. Fraksi dan subfraksi terbaik didasarkan pada nilai LC50 terkecil. Selajutnya fraksi dan
subfraksi terbaik diujikan ke sel kanker MCF-7 serta subfraksi terbaik diidentifikasi kandungan senyawa dengan mengunakan GC-MS.
Penapisandengan uji toksisitas menggunakan larva udang menunjukkan ektrak etil asetat dan n-heksana memiliki toksisitas dengan LC50 berurut sebesar
38.2λ µg/mL dan 40.84 µg/mL. Ekstak etil asetat tersebut selanjutnya difraksionasi dengan kromatografi cair vakum dan menghasilkan 13 fraksi. Berdasarkan hasil uji toksisitas setiap fraksi, fraksi 12 memiliki toksisitas paling tinggi, yaitu 5.00 µg/mL. Fraksi 12 difraksionasi dengan kromatografi kolom gravitasi dan diperoleh 17 subfraksi. Hasil uji toksisitas subfraksi tersebut menunjukkan subfraksi λ memiliki toksisitas tertinggi yaitu λ.58 µg/mL.
Hasil uji toksisitas larva udang menunjukkan fraksi 12 dan subfraksi λ memiliki potensi sebagai antitumor dan antikanker. Pengujian fraksi 12 dan subfraksi λ terhadap sel kanker payudara MCF-7 diperolah IC50 secara berurut 20.4λ
µg/mL dan 17.λ4 µg/mL. Hasil analisis GC-MS subfraksi λ memperlihatkan bahwa
subfraksi tersebut memiliki 30 puncak senyawa. Berdasarkan library index
spektroskopi massa teridentifikasi 13 senyawa dan dari tinjauan pustaka 8 dari 13
senyawa tersebut diketahui memiliki bioaktivitas yaitu dodecanoic acid,
tetradecanoic acid, (-)-loliolide, hexadecanoic acid, oleic acid, 2-Piperidinone, N-[4-bromo-n-butyl]-, myristic acid dan Bis(2-ethylhexyl) phthalate.
SUMMARY
NANDA. Anticancer Activities of Sinularia sp. Isolates From Lampung Bay.
Supervised by TUN TEDJA IRAWADI, ZAINAL ALIM MAS’UD and ETTY RIANI.
Cancer is one of the leading causes of death in the world. There were 8.2 million people who died because of cancer in 2012; the main cause of the death was lung, liver, stomach, colorectal and breast cancer. Researchers have kept on developing cancer treatment, one of which is the development of new anticancer medicine.Source of new medicines can be obtained from marine animal or marine plants such as sponges, sea cucumbers and corals.Sinularia, a soft coral, has
diverse biological activities, such as, anti-inflammatory, anticancer,antibacterial and antiviral. The aim of this study was to obtain isolates that are potential to function as anti breast cancer from Simularia Lampung Bay.
Samples were macerated with the solvent ethyl acetate, and then the residue was macerated again with n-hexane. The crude extrat obtained in testing toxicity levels used larvae brine shrimp A. salina. The best extract was fractionated by using vacuum liquid chromatography (VLC). After that the best fraction from the result of VLC was fractionated with the column chromatography gravity. The best sub fraction and fraction were based on the smallest value of LC50. Furthermore, the best fractions and sub-fractions were tested for MCF-7cancer cells, and the compound within the best subfractions was identified by using GC-MS.
The screening using brine shrimp lethality test (BSLT) showed that ethyl acetate extract and n-hexane extract had toxicity of LC50 of38.2λ µg/mL and 40.84
µg/mL, respectively. The ethyl acetate extract was then fractionated by using vacuum liquid chromatography and resulted in 13 fractions. Based on the results of toxicity tests of each fraction, the fraction 12 had the highest toxicity, i.e., 5.00
µg/mL. Fraction 12 was fractionated by column chromatography gravity which was then gained 17 sub-fractions. The toxicity test of the sub-fractions showed that a sub-fraction λ had the highest toxicity, i.e., λ.58 µg/mL.
The brine shrimp lethality test showed that fractions 12 and sub-fractions λ had potential antitumor and anticancer. The test of fraction 12 and sub-fraction λ towards breast cancer cells of MCF-7 gained IC50, 20.4λ µg/mL and 17.λ4 µg/mL
respectively. The results of GC-MS analysis of sub-fractions λ showed that those sub-factions had 30 top compound. Based on the index library of the mass spectroscopy, 13 compounds were identified, and from the literature review, 8 out of 13 compounds had bioactivity, like dodecanoic acid, tetradecanoic acid, (-)-loliolide, hexadecanoic acid, oleic acid, 2-Piperidinone, N-[4-bromo-n-butyl]-, myristic acid and Bis(2-ethylhexyl) phthalate.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
AKTIVITAS ANTI KANKER ISOLAT
Sinularia
sp. PERAIRAN
TELUK LAMPUNG
NANDA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul μ AktivitasAntikanker IsolatSinularia sp. Perairan Teluk Lampung
Nama μ Nanda NIM μ G451130171
Disetujui olehμ
Komisi Pembimbing
Prof Dr Ir Tun Tedja Irawadi, MS Ketua
Diketahui olehμ
Tanggal Ujianμ 23 Mei 2016 Tanggal Lulusμ
Dr Ir Etty Riani, MS Anggota Dr Drs Zainal Alim Mas’ud, DEA
Anggota
Ketua Program Studi Kimia
Prof Dr Dyah Iswantini Pradono, MSc Agr
Dekan Sekolah Pascasarjana
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 ini ialah Aktivitas Antikanker IsolatSinularia sp. Perairan Teluk Lampung.
Terima kasih penulis ucapkan kepada IbuProf Dr Ir Tun Tedja Irawadi, MS, Bapak Dr Drs Zainal Alim Mas’ud, DEA dan Ibu Dr Ir Etty Riani, MSselaku pembimbing, Prof Dr Dyah Iswantini Pradono, MSc Agr selaku Ketua Program Studi Kimia, Bapak Sobur dan rekan laboratorium kimia organik dan rekan-rekan mahasiswa Sekolah Pascasarjana Kimia yang telah banyak memberikan bantuan dalam menyelesaikan peneliatan ini. Ucapan terimakasih juga saya sampaikan kepada keluarga besar di Baso dan keluarga besar di Purworejo atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2016
DAFTAR ISI
Waktu dan Tempat Penelitian 6
Alat dan Bahan 6
Persiapan Sampel 7
Ekstraksi, Fraksionasi, Isolasi dan Identifikasi Senyawa 7
Uji Toksisitas Metode Brine Shrimp Lethality Test(BSLT) 7
Uji Toksisitas dengan Metode MTT 8
4 HASIL DAN PEMBAHASAN 8
Data Ekologi dan Proksimat Analisis 8
Fitokimia dan Toksisitas Ekstrak λ
Fraksionasi dan Toksisitas Fraksi 10
Uji terhadap Sel Kanker Payudara MCF-7 12
Analisis Senyawa Aktif 13
DAFTAR TABEL
1 Data pengukuran parameter perairan Pulau Tegal λ
2 Data prosimat analisis 10
3 Nilai Rf hasil KCV ekstrak etil asetat 11
4 Perbandingan %Rendemen, Rf dan LC50 hasil kolom Fraksi 12 12
DAFTAR GAMBAR
1 Bentuk umum sklerit pada karang lunak Sinularia (Fabricius dan
Aderslade 2001) 3
2 Struktur doksorubisin 6
3 Sinularia sp di laut (kiri) dan Sinularia sp didarat 10
DAFTAR LAMPIRAN
1 Sampel Sinularia sp. 1λ
2 Bagan kerja penelitian 20
3 Hasil analisis kadar air 22
4 Rendemen ekstrak etil asetat 23
5 Metode uji fitokimia 24
6 Uji fitokimia ekstrak etil asetat 25
7 Profil KLT 13 fraksi hasil KCV dibawah sinar UV λ 366 nm (A), 254
nm (B) dan hasil penandaan spot noda (C) 26
8 Data hasil analisa BSLT 27
λ Profil KLT 17 subfraksi hasil KKGdengan eluen etil asetat μ
diklorometana (1μ3) 33
10 Data uji sel kanker payudara MCF-7 34
11 Profil mikroskopik penghambatan pertumbuhan sel kanker payudara
MCF-7 35
1 PENDAHULUAN
Latar Belakang
Kanker merupakan salah satu penyebab kematian utama di dunia. Tercatat 8.2 juta orang meninggal karena kanker pada tahun 2012, penyebab utamanya kanker paru, hati, perut, kolorektal dan payudara. Berdasarkan Data GLOBOCAN, International Agency for Research on Cancer (IARC) tahun 2012, kanker paru merupakan penyebab utama kematian pada laki-laki, sedangkan kanker payudara merupakan penyebab utama kematian pada perempuan. (KEMENKES RI. 2015). Hingga saat ini peneliti terus melakukan pengembangan pengobatan kanker, salah satunya mencari obat-obatan baru bersifat antikanker yang bersumber dari perairan atau laut. Tumbuhan dan hewan laut sangat kaya akan senyawa bioaktif yang berpotensi sebagai antikanker, salah satunya adalah karang lunak.
Karang lunak merupakan hewan invertebrata laut yang saat ini banyak dikaji kandungan bioaktifnya seperti terpenoid, steroid, steroid glikosida, dan beragam senyawa bioaktif lainnya. Coll dan Sammarco (1λ8λ) menjelaskan bahwa senyawa bioaktif yang dihasilkan ini berfungsi sebagai perlindungan diri dari serangan predator dan lingkungan. Hasil tinjauan terhadap 636 jurnal yang dilakukan oleh Putra pada November 2010, senyawa bioaktif karang lunak yang banyak diteliti adalah golongan diterpen (352) dan steroid (141) (Putra 2012). Senyawa bioaktif ini memiliki aktivitas biologis, diantaranya antifungal, sitotoksik, antineoplastik, antimikroba, inhibitor HIV dan antiinflamasi (Radhika 2006).
Sinularia merupakan jenis karang lunak yang banyak diteliti dan memiliki
berbagai aktivitas biologis. Manuputty (1λλ0) melaporkan bahwa Sinularia
mengandung senyawa terpena yang diduga memiliki aktivitas antikanker pada manusia. Shih et al. (2011) berhasil mengisolasi senyawa diterpen yang memiliki
aktivitas antiinflamasi dan bersifat sitotoksik dari Sinularia flexibilisDongsha
Atoll,laut Cina Selatan sedangkan Rajaram et al. (2013) telah melaporkan
golongan karboksamida yaitu asam furano-sesquiterpena karboksilat sebagai antikanker dari Sinularia kavarattiensis. Selain itu, Thao et al. (2013) mengisolasi Nortipenoid sebagai antiinflamasi dari Sinulariamaxima pantai Vietnam dan
Chenget al. (2014) mengisolasi senyawa diterpena sebagai antinflamasi dan
antiviral dari Sinularia gyrosa yang diperoleh di Dongsha Atoll, Taiwan. Menurut
Ahmed et al. (2013) bahwa karang lunak Sinulariacandidula dari laut merah
berpotensi sebagai antivirus H5N1 sedangkan Shaaban et al. (2013) telah
melaporkanbahwa senyawa steroid Sinularia polydactyla dari Perairan Mesir
memiliki aktivitas antimikroba.
Keadaan suatu wilayah sangat memengaruhi komposisi komponen kimia suatu tumbuhan atau hewan. Perbedaan tempat tumbuh dan berkembang karang lunak Sinularia akan berpengaruh pada jenis serta jumlah senyawa metabolit
karang lunak Sinularia yang berasal dari perairan Teluk Lampung belum pernah
dilaporkan.
Rumusan Masalah
Berdasarkan uraian pada latar belakang yang menjadi rumusan masalah adalah kondisi suatu wilayah mempengaruhi komponen kimia suatu hewan atau
tumbuhan.Sinularia merupakan salah satu karang lunak yang memiliki
bioaktivitas yang beraneka ragam dan juga memiliki tingkat toksisitas yang tinggi. Senyawa hasil isolasi dari Sinularia sp. perairan Teluk Lampung diharapkan
memiliki aktivitas antikanker terutama antikanker payudara.
Tujuan penelitian
Mendapatkan isolat dan mengidentifikasi senyawa yang berpotensi sebagai antikankerpayudara dari Sinularia sp. Perairan Teluk Lampung.
Manfaat penelitian
Memberikan informasi tentang potensi isolat dari Sinularia sp. Perairan
Teluk Lampung sebagai antikanker payudara.
2 TINJAUAN PUSTAKA
Sinularia
Karang lunak merupakan kelompok hewan tingkat rendah (invertebrata) yang termasuk ke dalam filum Coelenterata atau disebut juga Cnidaria karena memiliki cnide (bahasa Yunani) yang berarti sengat. Filum ini terbagi menjadi tiga kelas, yaitu Hydrozoa, Anthozoa, dan Scyphozoa. Saat ini kelas dari filum Coelenterata telah berkembang menjadi empat kelas yaitu Hydrozoa, Anthozoa,
Cubozoa, dan Scyphozoa (Suwignyo et al. 2005). Karang lunak termasuk dalam
kelas Anthozoa dengan subkelas Octocorallia (Alcyonaria). Bentuk khas dari karang lunak ini adalah memiliki delapan buah tentakel, ditemukan dari daerah tropis sampai ke daerah kutub, dan di habitat muara sungai berlumpur di daerah pasang surut sampai ke perairan laut dalam (Manuputty 2010).
Karang lunak secara struktural mirip karang batu, tapi karang lunak mempunyai tubuh lebih lentur karena tidak memiliki kerangka kapur luar yang keras. Untuk menyokong tubuhnya, karang lunak ditunjang oleh tangkai-tangkai berupa jaringan berdaging dari partikel-partikel kapur mikroskopis yang disebut sklerit atau spikula(Manuputty 2002).
Karang lunak genus Sinularia merupakan bagian dari suku Alcyonidae
karang lunak lainnya (Manuputty 2010). Bentuk pertumbuhannya bervariasi dari bentuk mengerak (encrusting) dengan lobus berbentuk tonjolan kecil sampai
bentuk seperti semak-semak. Koloni Sinularia berwarna coklat,krem, kuning atau
hijau kecoklatan. Warna-warna ini berasal dari zooxanthellae yang hidup
bersimbiosis di dalam jaringan endodermal karang lunak. Kelompok karang lunak
Sinularia dapat hidup di perairan yang keruh sampai perairan jernih. Karang lunak
ini tersebar secara vertikal dari perairan pesisir dangkal sampai kedalaman 40 m (Fabricius dan Alderslade 2001).
Sinularia memiliki tekstur tubuh lunak dan ditunjang oleh tangkai berupa
jaringan berdaging yang diperkuat oleh matriks dari partikel-partikel kapur mikroskopis disebut sklerit. Anggota dari genus Sinularia sangat banyak,
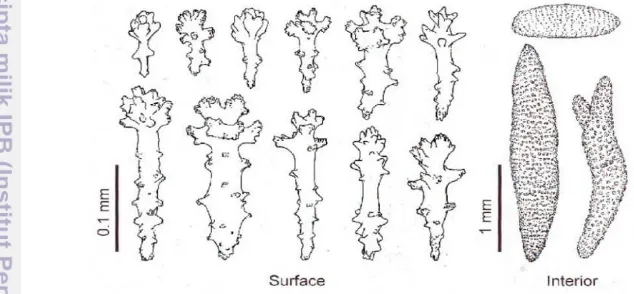
sehingga untuk membedakan jenis satu dengan lainnya tidak cukup dengan morfologi, tapi harus dibedakan dari bentuk sklerit atau spikulanya (Manuputty 1λλ6). Bentuk sklerit dari Sinularia berbeda antara yang terdapat di bagian atas
dan di bagian basal koloni. Begitu pula dengan bagian yang terdapat di bagian permukaan (surface) dan di bagian dalam (interior). Oleh karena itu, bentuk,
ornamen, dan ukuran sklerit sangat berguna untuk identifikasi (Gambar 1).
Gambar 1Bentuk umum sklerit pada karang lunak Sinularia (Fabricius dan
Aderslade 2001)
Kandungan Kimia Sinulria
Proses ekstraksi merupakan suatu metode pemisahan yang didasarkan pada distribusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur. Faktor-faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yangdigunakan. Dalam pemilihan jenis pelarut yang digunakan harus memperhatikan daya larut, titik didih, sifat toksik, mudah tidaknya terbakar, dan sifat korosif terhadap peralatan ekstraksi (Khopkar 2003). Pertimbangan yang perlu diperhatikan dalam memilih suatu pelarut adalah sifat pelarut tersebut dimana pelarut polar akan melarutkan senyawa polar, demikian sebaliknya pelarut non polar akan melarutkan senyawa non polar, pelarut semi polar akan cenderung melarutkan senyawa semi polar (Achmadi 1λλ2).
dengan pelarutnya pada saat proses perendaman. Kemudian bahan ditimbang untuk mengetahui berat awal bahan sehingga dapat menentukan rendemen yang dihasilkan. Bahan yang telah ditimbang kemudian direndam dalam pelarut, seperti heksana (non polar), etil asetat (semi polar) dan metanol (polar). Proses perendaman ini disebut dengan maserasi. Prinsip pelarutan yang dipakai pada metode ini adalah like dissolve like artinya pelarut polar akan melarutkan senyawa polar dan pelarut non polar akan melarutkan senyawa non polar. Tahap selanjutnya, yaitu tahap pemisahan yang terdiri dari penyaringan dan evaporasi. Penyaringan dilakukan untuk memisahkan sampel dengan pelarut yang telah mengandung bahan aktif. Untuk memisahkan pelarut dengan senyawa bioaktif yang terikat dilakukan evaporasi, sehingga pelarutnya akan menguap dan diperoleh senyawa hasil ekstraksi yang dihasilkan (Khopkar 2003). Hasil ekstraksi yang diperoleh tergantung pada beberapa faktor, yaitu kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama waktu ekstraksi, dan perbandingan jumlah pelarut terhadap jumlah sampel (Harborne 1λ87).
Karang lunak merupakan sumber yang kaya akan senyawa bioaktif seperti terpenoid, steroid, dan steroid glikosida. Hasil penelitian terakhir menyebutkan bahwa sekitar 50% ekstrak karang lunak menunjukkan sifat racun pada ikan, selain itu banyak metabolit sekunder yang dihasilkan oleh karang lunak memiliki aktivitas biologi seperti antifungal, sitotoksik, antineoplastik, inhibitor HIV, dan anti-inflamtori (Radhika 2006).
Coll dan sammarco (1λ82) telah mengisolasi senyawa terpen yang bersifat racun dari beberapa karang lunak terutama Sinularia flexibillis dan mengamati pertumbuhan karang batu Pavona cactus yang hidup berdampingan dengan karang lunak tersebut. Terbukti bahwa pada jarak 30 cm pertumbuhan karang batu tersebut terhambat, sedangkan pada jarak lebih dekat yaitu sekitar 15 cm karang batu tersebut mati. Percobaan ini membuktikan bahwa sifat allelopatik tersebut dipakai untuk merebut ruang lingkup dari tetangganya dalam hal ini karang batu.
Karang lunak hidup berdampingang (bersimbiosis) dengan alga uniseluler (zooxanthella). Menurut peneliti senyawa terpena adalah senyawa yang hanya
dihasilkan oleh tumbuhan. Menurut peneliti, ada tiga kemungkinan senyawa terpena dihasilkan oleh karang lunak yaitu pertama dihasilkan oleh polip karang sendiri, kedua oleh zooxanthella sendiri dan ketiga dihasilkan oleh keduanya yaitu
hasil asosiasi polip karang dengan zooxanthella. Dari hasil pengujian
dilaboratorium, disimpulkan bahwa senyawa terpena ini dihasilkan karang lunak itu sendiri dan hasil kerjasama antara karang lunak daengan zooxanthella
(Manuputty 1λλ0).
Dari hasil tinjauan pustaka, ekstraksi senyawa bioaktif dari karang lunak
sinularia banyak dilakukan dengan menggunakan pelarut etil asetat, metanol,
etanol, campuran metanol dan kloroform dan campuran metanol dan diklorometana. Ekstrak yang diperoleh difraksionasi dengan kromatografi kolom
gravitasi dan dimurnikan menggunakan HPLC (High Performance Liquid
Chromatography). Senyawa-senyawa bioaktif yang banyak diisolasi dari
Sinularia adalah senyawa steroid dan terpenoid. Senyawa-senyawa bioaktif ini
-hydroxy-5-episinuleptolide dari Sinularia numerosayang diperoleh dari National Museum of
Marine Biology and Aquarium, Taiwan (Chen et al. 2015), Capillosananesdari Sinularia capillosayang diperoleh dari Pantai Senya Laut Cina Selatan (Chen et al. 2014), Epidioxysteroldari Sinularia gaweliyang diperoleh dari taitung Taiwan
(Yen et al. 2013a), Leptoclalin dari Sinularia leptoclados yang diperoleh dari
Pantai Taiwan (Tsai et al. 2013), Sinulanorcembranolidedari Sinularia
gaweliyang diperoleh dari pantai Taiwan (Yen et al. 2013b), Sicrassrines dari Sinularia crasa yang diperoleh dari Pantai Taitung Taiwan (Lin et al. 2012), Sinugyrosanolidedari Sinularia gyrosa yang berasal dari pantai Taiwan (Cheng et al. 2014), Numerosoldari Sinularia numerosa yang berasal dari Sansiantai Taiwan
(Tseng et al. 2014) dan Polyhidroxylated sterol dari Sinularia sp Pantai Laut Cina
Selatan (Liao et al. 2011). Senyawa bioaktif yang memiliki bioaktivitas sebagai
antiinflamasi adalah CrassarosteroldariSinularia crasayang diperoleh dari
Taitung Taiwan (Chao et al. 2012), Flexibilisquinonedari Sinularia Flexibilis
yang berasal dari National Museum of Marine Biology and Aquarium Taiwan (Lin et al. 2013) dan senyawa yang memiliki bioaktivitas sebagai anti virus adalah Polyhydroxylated steroldari Sinularia candidula yang berasal dariLaut Merah
(Ahmed et al. 2013)
Kanker dan Antikanker
Tumor dibagi dalam dua golongan, yaitu tumor jinak dan tumor ganas. Sel tumor pada tumor jinak bersifat tumbuh lambat, sehingga tumor jinak pada umumnya tidak cepat membesar. Sel kanker mendesak jaringan sehat sekitarnya secara serempak sehingga terbentuk simpai (serabut pembungkus yang memisahkan jaringan tumor dari jaringan sehat). Oleh karena bersimpai, maka pada umumnya tumor jinak mudah dikeluarkan dengan cara operasi. Sel tumor pada tumor ganas (kanker) tumbuh cepat, sehingga tumor ganas pada umumnya cepat menjadi besar (Huspa, 200λ)
Kanker adalah istilah umum untuk semua jenis tumor ganas. Kanker adalah segolongan penyakit yang ditandai dengan pembelahan sel yang tidak terkendali dan kemampuan sel-sel tersebut untuk menyerang jaringan biologis lainnya,baik dengan tempat yang jauh (metatesis). Pertumbuhan yang tidak terkendali tersebut disebabkan kerusakan DNA, adanya kerusakan DNA akan menyebabkan mutasi di gen vital yang mengontrol pembelahan sel (Huspa, 200λ). Pengobatan kanker dapat dapat dilakukan dengan cara pembedahan, radiasi, kemoterapi, endokrinoterapi dan imunoterapi (Siswandono dan Soekardjo, 1λλ5).
gugus gula amino. Antibiotika antikanker tersebut mengikat dobel heliks DNA secara kuat dengan menginterkalasi gugus kromofor planar (pada cincin B dan C) pada dua pasang basa. Turunan antrasiklin bekerja secara tidak khas pada siklus kehidupan sel (Siswandono dan Soekardjo, 1λλ5).
Gambar 2 Struktur Doksorubisin
3 METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan November 2014 – Desember 2015 di Laboratorium Terpadu IPB, Laboratorium Kimia Organik Departemen Kimia Fakultas Matematika dan Imu Pengetahuan Alam, Laboratorium Forensik MABES POLRI dan Departemen Farmakognosi dan Fitokimia Fakultas Farmasi Universitas Airlangga.
Bahan dan Alat
Sampel yang digunakan dalam penelitian adalah karang lunak dari Perairan Teluk Lampung (-5.56o Lintang Selatan, 105.27o Bujur Timur). Bahan kimia yang
digunakan adalah pereaksi uji fitokimia, berbagai jenis pelarut organik teknis dan proanalis yang biasa digunakan seperti μ n-heksan, metanol, kloroform, etil asetat,
aseton, aquades, DMSO (dimethyl sulfoxide),natrium bikarbonat, silika gel, telur A. Salina, sel lestari kanker payudara MCF-7 koleksi PSSP IPB, etanol λ6%,
media Rosewell Park Memorial Institute (RPMI), dan 3-(4,5-dimetiltiazol-2-il)2,5- difeniltetrazolium bromida (MTT).
Alat yang digunakan dalam penelitian ini adalah seperangkat alat destilasi,
chamber, kolom kromatografi gravitasi, neraca analitis, corong pisah, berbagai
alat gelas yang biasa digunakan di laboratorium, kromatografi cair vakum (KCV), kromatografi kolom grafitasi, rotary evaporator (RE) R-114 Buchi dengan sistem
mm; 20 x 20 cm, kromatografi cair vakum (KCV), spektrofotometer ELISA
microplate reader (BIO RAD) dan inkubator CO2dan kromatografi
gas-spektrometer massa (Agilent 68λ0)
Persiapan Sampel
Karang lunak (Sinularia sp.) dari Teluk Lampung (Pantai Sari Ringgung)
dibersihkan dan disimpan dalam lemari pendingin agar kesegarannya tetap terjaga. Sinularia sp. dipotong-potong dan dikeringkan di dalam oven 400C
selama empat hari (λ6 jam) kemudian digiling (Lampiran 1).
Ekstraksi, Fraksionasi, Isolasi dan Identifikasi Senyawa
Bubuk Sinularia sebanyak 1.5 kg dimaserasi dengan etil asetat selama 4x24
jam. Filtrat etil asetat disaring dan residunya dikeringkan kemudian residu etil asetat dimaserasi dengan n-heksana selama 4x24 jam. Ekstrak etil asetat dan
ekstrak n-heksana dipekatkan dengan penguap putar dan diuji toksisitas terhadap A.Salina serta uji fitokimia. Ektrak yang memiliki toksisitas paling tinggi
selanjutnya diisolasi. Ekstrak terpilih difraksinasi menggunakan kromatografi cair vakum (KCV) menggunakan eluen terbaik. Pencarian eluen terbaik dilakukan dengan kromatografi lapis tipis (KLT) menggunakan variasi berbagai macam pelarut yaitu metanol, etilasetat, n-heksana, aseton dan diklorometana. Fraksi–
fraksi yang diperoleh diuji toksisitasnya terhadap A. salina. Fraksi terpilih
difraksionasi dengan kromatografi kolom gravitasi menggunakan eluen terbaik. Subfraksi yang diperoleh diuji tosisitasnya dan subfraksi terbaik diujikan ke sel kanker MCF-7 lalu diidentifikasi kandungan senyawa dengan mengunakan GC-MS. Bagan kerja penelitian tercantum pada Lampiran 2.
Uji Toksisitas Metode Brine Shrimp Lethality Test (BSLT)
Uji toksisitas metode BSLT dilakukan berdasarkan metode Mayer (1λ82). Telur A. salina ditetaskan dalam wadah berisi air laut yang diaerasi dengan
kondisi cukup cahaya selama 48 jam. Penetasan dilakukan selama 48 jam dengan kondisi cukup cahaya. Setelah 48 jam, larva dapat digunakan.
Larutan stok dibuat dalam labu takar dengan melarutkan sampel dengan 0.05% DMSO dari volume total larutan stok, kemudian ditera sampai tanda batas dengan air laut. 10 ekor larva A. salina dimasukkan ke dalam plat sumur
kemudian ditambahkan sampel dengan volume tertentu. Selanjutnya, air laut ditambahkan hingga volumenya 200 µL atau 400 µL dan diinkubasi selama 24 jam. Pengujian ini dilakukan dengan tiga kali ulangan. Jumlah larva yang mati dihitung dan ditentukan reratanya dari tiga kali ulangan. Nilai LC50 dihitung dari
% = − %
Uji Toksisitas dengan Metode MTT
Pengujian tosisitas dilakukan pada sel kanker payudara MCF-7. Sel MCF-7 diinokulasi pada pelat λ6-sumur dalam media RPMI dengan jumlah sel 5000 sel/sumur. Larutan sampel sebanyak 100 L ditambahkan pada inokulan dan
diinkubasi selama 48 jam dalam inkubator CO2 5% pada suhu 37 °C. Selanjutnya
setiap sumur ditambahkan 10 L MTT dan diinkubasi kembali selama empat jam dalam inkubator CO2 5% dan supernatant yang terbentuk dibuang. Sel hidup akan
bereaksi dengan MTT membentuk formazan yang berwarna biru. Formazan yang terbentuk dilarutkan dalam etanol λ6%. Serapan dibaca dengan spektrofotometer ELISA microplate reader pada λ 5λ5 nm. Nilai IC50 diperoleh dari persamaan
regresi grafik hubungan log konsentrasi sampel uji dengan persen inhibisi (Maurya et al. 2010). Persen inhibisi diperoleh melalui persamaan μ
% penghambatan = − × %
4 HASIL DAN PEMBAHASAN
Data Ekologi dan Prosimat analisis
Hasil pengukuran data kualitas perairan Pulau Tegal, Teluk Lampung tanggal 1 September 2014 disajikan pada Tabel 1. Pengujian dilakukan untuk melihat kondisi lingkungan tempat tumbuh Sinularia sp. Parameter pada Tabel 1
merupakan beberapa parameter standar yang biasa digunakan untuk menentukan konsisi suatu lingkungan perairan. Hasil pengujian menunjukkan bahwa perairan di Pulau Tegal masih sesuai standar regulasi dari Kementrian Lingkungan Hidup, namun hanya parameter (pH) yang tidak sesuai standar. Berdasarkan hasil pengujian tersebut, disimpulkan bahwa isolat yang didapatkan dari Sinularia sp.
dalam penelitian ini adalah metabolit sekunder yang dihasilkan saat kondisi lingkungan masih sesuai standar. Namun, hasil tinjauan dilapangan terlihat bahwa tempat lokasi tempat tumbuh Sinularia sp. sedikit kotor akibat aktifitas
masyarakat sekitar dan pelaku usaha dalam pengembangan lokasi objek wisata. Saat pengambilan sampel terlihat berbagai macam warna dan bentuk karang lunak diperairan pulau Tegal, diantaranya ada yang berwarna ungu, orange, merah, putih dan kuning keemasan. Sedangkan, Sinularia sp yang diambil pada penelitian ini
Manuputty (1λλ0) membantu beberapa jenis karang lunak dalam menghasilkan senyawa bioaktif golongan terpena.
Hasil proksimat analisis (basis kering) sampel karang lunak Sinularia sp.
disajikan pada Tabel 2. Pada Tabel 2 terlihat bahwa kadar abu pada sampel
Sinularia sp. sebesar 53.784 % yang berarti Sinularia sp. mengandung 53.784 %
mineral. Dari perbandingan beberapa mineral yaitu kalsium (Ca), Kalium (K), Natrium (Na) dan Fosfor (P), Ca merupakan miniral tertinggi yang terkandung dalam Sinularia sp. Mineral Ca pada karang berupaka CaCO3 (kalsium karbonat)
yang merupakan senyawa hasil sekresi dari karang itu sendiri. Sedangkan kandungan metabolit primer (protein, lemak dan karbohidrat), karbohitrat merupakan metabolit primer yang paling tinggi.
Tabel 1 Data pengukuran parameter perairan Pulau Tegal
Parameter P.Tegal Batasana Unit
Kedalamanb 1-.2 - M
a) Regulasi dari Kemetrian Lingkungan Hidup No.51 Tahun 2004 Lamp III b) Hasil Uji Insitu/ dilapangan
c) Pengujuan dilakukan di Laboratorium Terpadu Institut Pertanian Bogor
Fitokimia dan Toksisitas Ekstrak
Kadar air ditentukan sebagai faktor koreksi untuk masa sampel yang digunakan. Berdasarkan hasil analisis, kadar air dalam sampel kering Sinularia sp.
sebesar 3.2% (Lampiran 3). Uji kadar air ini dilakukan pada sampel bubuk yang telah dikeringkan dalam oven selama λ6 jam. Kemudian sampel yang sudah diketahui kadar airnya dimasehasi menggunakan etil asetat. Hasil maserasi dengan dua kali pengulangan, didapatkan ekstrak pekat 30.8108 gr dan λ.602λ gr dengan persen rendemen hampir sama (Lampiran 4).
Hasil analisis fitokimia kimia menggunakan prosedur Harborne (1λ87), menunjukkan bahwa ekstrak etil asetat Sinularia sp. mengandung senyawa steroid
dan alkaloid (Lampiran 5 dan 6) namun senyawa steroid sebagai senyawa yang paling dominan. Hasil pengujian toksisitas larva udang (BSLT, brine shrimp lethality test) pada ekstrak etil asetat dan n-heksana didapatkan nilai LC50 secara
berurutan 38.2λ µg/mL dan 40.84 µg/mL (Lampiran 8). Ramazaniet al. (2010)
menyebutkan bahwa terdapat tiga kategori toksisitas berdasarkan nilai LC50 yaitu
sangat toksik (LC50 30 µg/mL), toksik (LC50 = 30 - 1000 µg/mL), dan tidak
kategori toksik berdasarkan nilai LC50. Penelitian Carballo et al. (2002)
menunjukkan adanya hubungan yang konsisten antara toksisitas dan kematian larva A.salina pada ekstrak bahan alam dimana semakin tinggi toksisitas maka
jumlah kematian larva A. salina akan meningkat. Mayer (1λ82) menyebutkan
bahwa BSLT hanya dapat digunakan sebagai monitor suatu sampel tetapi tidak bisa dijadikan patokan untuk uji bioasai tertentu.
Table 2. Data proksimat analisis (basis kering)
Parameter Hasil Unit
Gambar 3 Sinularia sp di laut (kiri) dan Sinularia sp di darat (kanan)
Berdasarkan hasil uji BSLT dan berat ekstrak yang diperoleh maka fraksionasi selanjutnya dilakukan pada ekstrak kasar etil asetat karena ekstrak tersebut memiliki jumlah yang banyak untuk dilakukan pemisahan berikutnya.
Fraksionasi dan Toksisitas Fraksi
Ekstrak kasar etil asetat sebanyak 20 g difraksionasi dengan KCV
menggunakan pelarut n-hekasana dalam diklorometana (100% - 0%),
diklorometana dalam etil asetat (100% - 0%), dilanjutkan aseton 100% dan methanol 100%. Sebanyak 127 vial hasil fraksionasi di KLT dengan eluen terbaik diklorometana μ etil asetat μ n-hekasana (5 μ 1 μ 4) dan diperoleh 13 fraksi
(Lampiran 7) dan masing-masing fraksi diuji toksisitasnya.
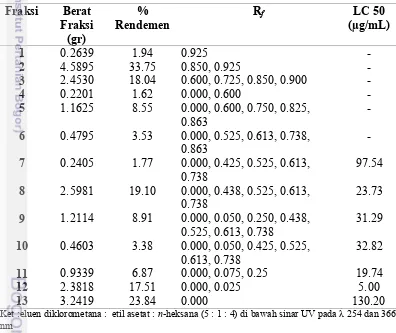
Hasil fraksionasi tersebut menunjukkan fraksi-fraksi etil asetat yang lebih toksik dan berpotensi sebagai antikanker. Hasil uji BLST diketahui beberapa fraksi memiliki toksisitas dengan LC50 lebih rendah dari ekstrak etil asetat (Tabel
kemunukinan merupakan fraksi non polar karena pada saat fraksionasi dengan KCV, pelarut yang digunakan adalah penalrut n-heksana yang bersifat nonpolar.
Penggunaan surfaktan dan penggantian pelarut selain DMSO dan metanol sangat mempengaruhi hasil pengujian BSLT. Pengaruh tersebut diantaranya
kesulitan meningkatkan nilai LC50 suatu sampel dan menghalangi dalam
perhitungan jumlah larva udang yang hidup atau mati (sampel mengalami penggumpalan). Pengunaan surfaktan ini diantara diujikan kefraksi 1 sampai λ. Hasil pengujian tersebut diketahui fraksi 1, 2, 4, 5 dan 6 tidak diperoleh LC50
karena fraksi tersebut terjadi penggumpalan sampel saat penambahan air laut sehingga mempersulit menghitung jumlah larva udang yang hidup atau mati. Pengujian pada fraksi 3, 8 dan λ diperoleh LC50 177.17 µg/mL, 43.λ1 µg/mL dan
82.88 µg/mL. Jika dibandingkan LC50 fraksi 8 dan λ antara penggunaan DMSO
dengan campuran surfaktan dan kloroform diketahui nilai LC50 fraksi tersebut
naik dari 23.73 µg/mL menjadi 43.λ1 µg/mL dan 31.2λ µg/mL menjadi 82.88 µg/mL. Maka dari hasil pengujian fraksi 8 dan λ, penggunaan campuran surfaktan dengan kloroform tidak bisa digunakan. Hasil perbandingan rendemen fraksi, Rf
(retention factor) dan uji toksisitas (Tabel 3; Lampiran 8) dapat diambil
kesimpulan bahwa fraksi 12 merupakan fraksi terbaik untuk dilanjutkan ke tahap pemisahan selanjutnya.
Tabel 3 Nilai Rfhasil KCV ekstrak etil asetat Fraksi Berat
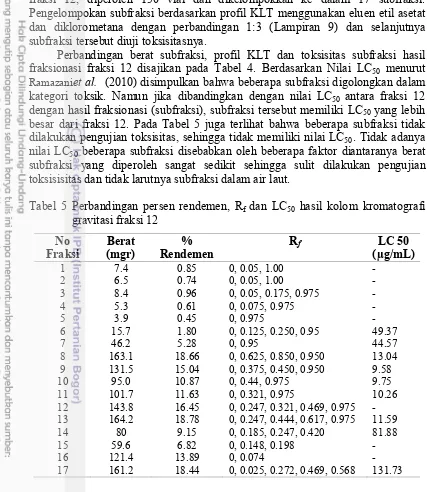
dilanjutkan diklorometana dalam etil asetat (100%-10%). Hasil pemisahan 1.28 g fraksi 12, diperoleh 150 vial dan dikelompokkan ke dalam 17 subfraksi. Pengelompokan subfraksi berdasarkan profil KLT menggunakan eluen etil asetat dan diklorometana dengan perbandingan 1μ3 (Lampiran λ) dan selanjutnya subfraksi tersebut diuji toksisitasnya.
Perbandingan berat subfraksi, profil KLT dan toksisitas subfraksi hasil fraksionasi fraksi 12 disajikan pada Tabel 4. Berdasarkan Nilai LC50 menurut
Ramazaniet al. (2010) disimpulkan bahwa beberapa subfraksi digolongkan dalam
kategori toksik. Namun jika dibandingkan dengan nilai LC50 antara fraksi 12
dengan hasil fraksionasi (subfraksi), subfraksi tersebut memiliki LC50 yang lebih
besar dari fraksi 12. Pada Tabel 5 juga terlihat bahwa beberapa subfraksi tidak dilakukan pengujian toksisitas, sehingga tidak memiliki nilai LC50. Tidak adanya
nilai LC50 beberapa subfraksi disebabkan oleh beberapa faktor diantaranya berat
subfraksi yang diperoleh sangat sedikit sehingga sulit dilakukan pengujian toksisisitas dan tidak larutnya subfraksi dalam air laut.
Tabel 5 Perbandingan persen rendemen, Rf dan LC50 hasil kolom kromatografi
µg/mL berpotensi sebagai antitumor atau antikanker. Berdasarkan nilai LC50
fraksi dan subfraksi, maka fraksi 12 dan subfraksi λ memiliki nilai LC50 terkecil
yang selanjutnya dilakukan pengujian ke sel kanker payudara MCF-7.
Uji terhadap Sel Kanker Payudara MCF-7
BSLT fraksi 12 dan subfraksi λ merupakan fraksi dan subfraksi yang memiliki LC50 terkecil yaitu 5.00 µg/mL dan λ.58 µg/mL. Hasil pengujian fraksi
secara berurut 20.4λ µg/mL dan 17.λ4 µg/mL (Lampiran 10). Pada pengamatan sel di bawah mikroskop (Lampiran 11) terlihat adanya perbedaan morfologi sel MCF-7 antara perlakuan dan tanpa perlakuan (kontrol). Hasil pengamatan 80 kali pembesaran menunjukkan bahwa penambahan sampel dapat menghambat pertumbuhan sel MCF-7. Hasil uji toksisitas menunjukkan persen inhibisi sampel terhadap proliferasi sel MCF-7 tidak memiliki korelasi positif dengan meningkatnya konsentrasi larutan uji (Lampiran 10).
Hasil tinjauan pustaka diketahui bahwa isolat genus Sinulariasudah pernah
diujikan pada sel kanker payudara MCF-7. Menurut Su et al.(2013),senyawa oxygenated cembranoid yang diisolasi dari Sinularia flexibilisyang diambil dari
pantai Taiwan memilki IC50 16-18 µg/mL. Sedangkan Rajaram et al.(2013)
mengisolasi senyawa furano-sesquiterpene carboxylic acids dari Sinularia
kavarattiensis yang diambil dari Tamilnadu India memiliki IC50 20-80 µg/mL.
Namun jika dibandingkan nilai IC50 yang mereka dapatkan dengan IC50 fraksi 12
dan subfraksi λ yang sama-sama diperoleh dari ektrak etil asetat, ternyata tidak nilainya tidak berbeda jauh yaitu sekitar 20µg/mL.Tetapi jika dibandingkan dengan kontrol positif doksorubisin (obat antikanker payudara), nilai LC50 fraksi
12 dan subfraksi λ tidak sebaik doksorubisin yang memiliki LC50 0.4λ µg/mL.
Analisis Senyawa Aktif
Hasil analisis GC-MS menunjukkan subfraksi λ merupakan campuran
senyawa. Berdasarkan library index spektroskopi massa diketahui bahwa
subfraksi λ terdiri dari 30 senyawa dimana 13 senyawa teridentifikasi dan 17 senyawa belum diteridentifikasi. Senyawa-senyawa yang teridentifikasi diantaranya adalah asam laurat, asam miristat, (-)-loliolide, asam palmitat, asam
oleat, N-[4-bromo-n-butyl]-2-piperidinone,asam 2hidroksi
tertradekanoatdanBis(2-ethylhexyl) phthalate. Pada Lampiran 12 terlihat bahwa
ada beberapa puncak hasil GC-MS yang belum teridentifikasi berdasarkan library index Willeyλ N11.L (persen kemiripan diatas 70%).
Hasil tinjauan pustaka diketahui beberapa senyawa hasil GC-MS yang teridentifikasi dan memiliki bioaktivitas diantaranya asam laurat, asam meristat, (-)-loliolide, asam palmitat, N-[4-bromo-n-butyl]-2-piperidinone, dan Bis(2-ethylhexyl) phthalate. Asam palmitat merupakan senyawa dominan dan memiliki
bioaktivitas sebagai antikanker pada sel A5Aλ (kanker kolon) dan anti-inflamasi dimana asam palmitat sebagai inhibitor enzim. Contoh inhibitor enzim diantaranya adalah inhibitor enzim topoisomerase 1 (topo 1), dimana inhibitor enzim ini memiliki kemampuan untuk membunuh semua sel yang mengalami replikasi DNA, menghalangi DNA untuk produksi protein dan menghalangi perbaikan kerusakan DNA. Sel-sel kanker merupakan sel yang membelah lebih cepat, maka dengan menggunakan inhibitor enzim topo 1 akan memhambat atau membunuh sel-sel kanker, meskipun pada batas tertentu. Hasil penelitian Karna et
al. (2012) diketahui bahwa dengan menggunakan asam palmitat sebagai inhibitor
enzim topo 1 dapat membunuh sel A5Aλ (kanker kolon) dengan IC50 150 pM.
Sedangkan penelitian Aparna et al. (2012) menyimpulkan bahwa asam palmitat
membran fosfolipid dan asam lemak yang merupakan langkah awal terjadinya peradangan.
Senyawa (-)-Loliolidemerupakan senyawa lakton monoterpen,
dimanasenyawa ini memiliki aktivitas sebagai antioksidan. Yang et al. (2011)
berhasil megisolasi senyawa (-)-Loliolide darirumput laut coklat (Sargassum ringgoldianum subsp. Coreanum) dan menguji efek antioksidannya terhadap
DPPH (2,2-diphenyl-1-picrylhydrazyl) dan radikal H2O2. Hasil penelitian tersebut
memperlihatkan bahwa senyawa (-)-Loliolide mampu mengurangi kerusakan sel
yang disebabkan oleh DPPH dan radikal H2O2.
Asam meristat memiliki aktivitas sebagai antioksidan, pencegahan kanker, nematicid, hipokolesterolemik (Kumar et al. 2014), antibakteri dan antijamur
(Agoramoorthy G at al. 2007) dan asam laurat memiliki aktivitas
sebagaiantibakteri (Mihailovi et al. 2011).Menurut Thenmozhi dan Rajan (2015)
bahwa senyawa Bis(2-ethylhexyl) phthalate bersifat sitotoksit dan senyawa N-[4-bromo-n-butyl]-2-Piperidinonemenurut Sivagurunathan dan Xavier
(2014)memiliki aktivitas sebagai antimikroba dan antiinflamasi.
5 SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian, fraksi 12 dan subfraksi λ dari ektrak etil asetat
Sinularia sp. perairan Teluk Lampung memiliki potensi sebagai antikanker
payudaya (MCF7) dengan IC50 20.4λ µg/mL dan 17.λ4 µg/mL. Dari hasil analisis
GC-MS diketahui bahwa subfraksi λ mengandung campuran senyawa yang diantaranya adalah asam laurat, asam miristat, (-)-loliolide, asam palmitat, asam
oleat, N-[4-bromo-n-butyl]-2-piperidinone,asam 2hidroksi
tertradekanoatdanBis(2-ethylhexyl) phthalate.
Saran
Perlu dilakukan identifikasi lebih lanjut dan isolasi senyawa yang berperan sebagai antikanker. Penelitian lebih lanjut dapat dilakukan untuk mengetahui senyawa spesifik yang berperan sebagai antikanker.
DAFTAR PUSTAKA
Achmadi S S. 1λλ2. Teknik Kimia Organik. Bogor μ Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Agoramoorthy G, Chandrasekaran M, Venkatesalu V, Hsu M, Antibacterial and antifungal activities of fatty acid methyl esters of the blind-your-eye mangrove from India. Brazil J Microbiol ; 38μ 73λ-742.
Ahmed S, Ibrahim A, Arafa AS. 2013. Anti-H5N1 virus metabolites from the Red Sea soft coral, Sinularia candidula. J. Tetlet. 54μ2377-2381.
Aparna V, Dileep KV, Mandal PK, Karthe P, Sadasivan C, Haridas M. 2012. Anti-Inflammatory Property of n-Hexadecanoic Acidμ Structural Evidence and Kinetic Assessment. Chem Biol Drug. doiμ
10.1111/j.1747-0285.2012.01418.x
Carballo JL, Hernandez ZL, Perez P, Garcia MD. 2002. Comparison between two brine shrimp assays to detect in vitro cytotoxicity in marine natural products. BMC Biotechnology. 2μ1472-6570.
Chao CH, Chou KJ, Huang CY, Wen ZH, Hsu CH, Wu YC, Dai CF, Sheu JH. 2012. Steroids from the Soft Coral Sinularia crassa.Mar. Drugs,
10μ43λ-450; doiμ10.33λ0/md1002043λ.
Chen D, Cheng W, Liu D, Ofwegen LV, Proksch P, Lin W. 2014. Capillosananes S–Z, new sesquiterpenoids from the soft coral Sinularia capillosa. Tetrahedron Letters, 55μ3077–3082.
Chen WF, Yin CT, Cheng CH 1, Lu MC, Fang LS,Wang WH, Wen ZH, Chen JJ, Wu YC,Sung PJ. 2015. Norcembranoidal Diterpenes from the
Cultured-Type Octocoral Sinularia numerosa.Int. J. Mol. Sci. 16, 3298-3306;
doi:10.3390/ijms16023298.
Cheng SY, Shih NL, Chuang CT, Chiou SF, Yang CN, Wang SK, Duh CY. 2014. Sinugyrosanolide A, an unprecedented C-4 norcembranoid, from the Formosan soft coral Sinularia gyrosa. Bioorganic & Medicinal Chemistry Letters. 24μ 1562–1564.
Coll JC, Sammarco PW.1λ8λ. Soft Coral. Chemistry abd ecology. Oceanus. 2λ
(2)μ 33-37.
Fabricius K, Alderslade P. 2001. Soft Coral and Sea Fans. Australian (AU)μ
Australian Institute of Marine Science.
Harborne JB. 1λ87. Metode Fitokimiaμ Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata.
Huspa DHP. 200λ. Senyawa antikanker dan insektisida dari genus Aglaia.
Universitas Padjadjaran Press. Bandung.
Karna S, Lim WB, Kim JS, Kim SW, Zheng H, Bae KH, Cho MS, Oh HK, Kim
OS, Choi HR, Kim OJ. 2012. C16 Saturated Fatty Acid Induced Autophagy
in A54λ Cells through Topoisomerase I Inhibition. Food and Nutrition Sciences. vol 3, 1220-1227
Kemenntrian Kesehatan Republik Indonesia. 2015. Situasi penyakit kanker. Pusat Data dan Informasi KEMENKES RI. semester 1.
Khopkar SM. 2003. Konsep Dasar Kimia Analitik. Jakartaμ UI-Press.
Kumar SS, Samydurai P, Ramakrishnan R, Nagarajan N. 2014. Gas chromatography and mass spectrometry analysis of bioactive constituents of Adiantum Capillus-Veneris L. Int J Pharm Pharm Sci, Vol 6, Issue 4,
Liao XJ, Tang LD, Liang YW, Geng HW, Xu SH. 2011. Isolation and Identification of Two New PolyhydroxylatedSterols from Soft Coral
Sinularia sp. Chem. Res. Chinese Universities 27(2), 217—220.
Lin YF, Kuo CY, Wen ZH, Lin YY, Wang WH, Su JH, Sheu JH, Sung PJ. 2013. Flexibilisquinone, a New Anti-Inflammatory Quinone from the Cultured
Soft Coral Sinularia flexibilis. Molecules,18μ8160-8167;
doiμ10.33λ0/molecules18078160.
Lin YS, Lee NL, Lu MC, Su JH. 2012. Two New Cembrane-Based Diterpenoids from the Marine Soft Coral Sinularia crassa. Molecules,17μ5422-542λ;
doiμ10.33λ0/molecules17055422.
Manuputty AEW. 1λλ0. Senyawa terpena dalam karang lunak (Octocorallia, Alcyonacea). Oseana. 15(2)μ7-84.
Manuputty AEW. 1λλ6. Pengenalan beberapa karang lunak (Octocorallia, Alcyonacea) di lapangan. Oseana. 21(4)μ1-11.
Manuputty AEW. 2002. Karang lunak (Soft Coral) Perairan Indonesia. Jakartaμ
Puslitbang Oseanologi-LIPI.
Manuputty AEW. 2010. Sebaran karang lunak marga Sinularia May 188λ8
(Octocorallia, Alcyonacea) di pulau-pulau Derawan Kalimantan Timur.
Oseanologi dan Limnologi di Indonesia. 36(2)μ211-225.
Maurya DK, kumar N, Devasagayam TPA. 2010. Anticancer property of galic acid in A5Aλ, a human lung adenocarcinoma cell line, and possible mechanisms. J. Clin. Biochem. Nutr. 48 μ85-λ0.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin J.E. 1λ82. A convenient general bioassay for active plant constituents. Planta Med. 45μ 31-34
Mihailovi V, Vukovi N, Niforovi N, Soluji S, Mladenovi M, Maškovi P, Stankovic MS. 2011 Studies on the antimicrobial activity and chemical composition of the essential oils and alcoholic extracts of Gentiana asclepiadea L. J Med Plant Res 5(7)μ 1164-1174.
Putra MY, 2012a. Bioactive Marine Natural Products From the Indonesian Soft Coral Sinularia sp. (order Alcyonacea, family Alcyoniidae). PhD Thesis.
Università Politecnica Delle Marche. Italia.
Radhika P. 2006. Chemical constituens and biological activities of the soft coral
of genus Cladiellaμ A review. Biochemical Systematics and Ecological
34μ781-78λ.
Rajaram S, Ramulu U, Ramesh D, Srikanth D, Bhattacharya P, Prabhakar P, Kalivendi SV, Babu KS, Venkateswarlu Y, Navat S. 2013. Anti-cancer evaluation of carboxamides of furano-sesquiterpene carboxylic acids from the soft coral Sinularia kavarattiensi.J.BMCL, 23μ 6234–6238; doi μ
10.1016/j.bmcl.2013.0λ.0λ3.
Ramazani A, Zakeri S, Sardari S, Khodakarim N, Djadidt ND. (2010). In vitro and in vivo anti-malarial activity of Boerhavia elegans and Solanum surattense. Malaria Journal, λ(124)μ 1-8.
Shaaban M, Shaaban KA, Ghani MA. 2013. Hurgadacinμ A new steroid from
Sinularia polydactyla.Steroids 78 (2013) 866–87.
Shih HJ, Tseng YJ, Huang CY, Wen ZH, Dai CF. 2012. Cytotoxic and
anti-inflamatory diterpenoids from Dongsha Atoll soft coral
Siswandono, Soekardjo B. 1λλ5. Kimia Medisinal. Universitas Airlangga Press. Surabaya.
Sivagurunathan A, Xavier IB. 2014. GC-MS Evaluation of Bioactive Compounds of Marsilea quadrifolia Linn (Aquatic Fern). IJPRS. V-3, I-1.
Suwigno S, Widigdo B, Wardiatno Y, Krisanti M. Avertebrata Air. 2005. Jakarta
(ID)μ Penebar Swada.
Thao NP, Nam NH, Cuong NX, Quang TH, Tung PT, Dat LD, Chae D, Kim S, Koh YS, Kiem PV, et al. 2013. Anti-inflamatory norditerpenoids from soft coral Sinulariamaxima. Bioorganic & Medicinal Chemistry Letters. 23μ
228-231.
Thenmozhi S, Rajan S. 2015. GC-MS analysis of bioactive compounds in Psidium
guajava leaves. Jurnal of Pharmacognosy and Phytochemistry
3(5)μ162-166.
Tsai TC, Wu YJ, Su JH Lin WT Lin YS. 2013. A New Spatane Diterpenoid from the Cultured Soft Coral Sinularia leptoclados.Mar. Drugs,11: 114-123;
doiμ10.33λ0/md11010114.
Tseng YJ, Yang YC, Wang SK, Duh CY. 2014. Numerosol A–D, new cembranoid diterpenes from the soft coral Sinularia numerosa. Mar. Drugs.
12μ 3371–3380.
Yang X, Kang MC, Lee KW, Kang SM, Lee WW, Jeon YJ. 2011. Antioxidant activity and cell protective effect of loliolide isolated from Sargassum ringgoldianum subsp. Coreanum. Algae.doiμ 10.44λ0/algae.2011.26.2.201.
Yen WH, Chen WF, Cheng CH, Dai CF, Lu MC, Su JH, Su YD, Chen YH,
Chang YC, Chen YH et al. 2013a. A New 5α,8α-Epidioxysterol from the
Soft Coral Sinularia gaweli. Molecules.18μ28λ5-2λ03;
doiμ10.33λ0/molecules180328λ5.
Lampiran 1 Sampel Sinularia sp.
A B Ket μ A μdari freezer sebelum dipotong
20
Lampiran 2 Bagan kerja penelitian
Uji BSLT Uji BSLT
Kromatografi Cair Vakum
Sinularia sp.
Maserasi dengan EtOAc
Ekstrak EtOAc
Residu Maserasi dengan n-heksana
Ekstrak n-heksana
Ekstrak EtOAc LC50 = 38.29 µg/mL
F1
Residu
F2 F3 F4 F5 F6
F7 F8 F9 F10 F11 F12 F13
21
Lanjutan Lampiran 2
Uji BSLT Kromatografi Kolom Gravitasi
F12
SF1 SF2 SF3 SF4 SF5
SF6 SF7 SF8 SF9 SF10 SF11
SF12 SF13 SF14 SF15 SF16 SF17
SF9 IC50 antikanker
Analisis GC-MS
Identifikasi Kandungan Senyawa
Lampiran 3 Hasil analisis kadar air
% = Berat Basah − Berat keringBerat Basah %
a. Bobot Cawan (gr)
Ulangan A B C
1 21.01λ1 26.7545 27.5374
2 21.018λ 26.7518 27.5370
3 21.0187 26.7523 27.5372
Rerata 21.018λ 26.7528 27.5372
b. Bobot Cawan + Sampel
Bobot Sampel basah 1.0150 1.0070 1.0113
Bobot sampel kering A B C
Ulangan 1 0.λ881 0.λ75λ 0.λ762
Ulangan 2 0.λ862 0.λ756 0.λ765
Ulangan 3 0.λ817 0.λ712 0.λ725
Rerata 0.λ853 0.λ742 0.λ751
Kadar Air (%) 2.λ % 3.2 % 3.5 %
Contoh perhitungan kadar air (ulangan A);
Kadar air =Bobot basah − Bobot keringBobot sampel basah × %
= . 5 g − . 5 g. 5 g × %
Kadar air = . %
Rerata kadar air =Kadar air ulangan + ulangan + ulangan
= . % + . % + .5%
Lampiran 4 Rendemen ekstrak etil asetat.
Pecobaan Bobot (g) Rendemen
Sampel Ekstrak %
Etil asetat 1 1500.00 30.8108 2.12
Lampiran 5 Metode uji fitokimia
Uji fitokimia dilakukan untuk mengetahui jenis komponen kimia yang terdapat dalam karang lunak Sinularia khususnya senyawa golongan fenolik,
flavonoid, alkaloid, saponin, steroid, dan terpenoid. Pengujian dilakukan mengikuti prosedur Harborne (1λ87).
Uji Flavonoid dan Fenol.
Sebanyak 0.1 g ekstrak dilarutkan dengan kloroform-air (1μ1), kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Lapisan atas dibagi 2 untuk uji flavonoid dan fenol. Uji flavonoid dilakukan dengan menambahkan 0.1 g logam Mg, 1 mL HCl pekat, dan 1 mL n-amil alkohol. Uji positif flavonoid apabila
terbentuk warna kuning atau jingga. Uji fenol dilakukan dengan menambahkan FeCl3 1% dan akan positif fenol apabila terbentuk warna hijau atau biru/ungu.
Uji Alkaloid.
Sebanyak 0.1 g ekstrak ditambahkan 10 mL kloroform-amonia 10% dan disaring. Filtrat ditetesi dengan H2SO4 2 M, dikocok, kemudian didiamkan hingga
terbentuk 2 lapisan. Lapisan asam (lapisan atas yang tidak berwarna) diteteskan ke lempeng tetes dan ditambahkan beberapa tetes pereaksi Mayer, Wagner, dan Dragendorf. Uji positif alkaloid berturut-turut menghasilkan endapan berwarna putih kekuningan, cokelat, dan jingga.
Uji Saponin dan Tanin.
Sebanyak 0.1 g ekstrak dilarutkan dengan kloroform-air (1μ1), kemudian dikocok dan didiamkan hingga terbentuk 2 lapisan. Lapisan bawah disaring, residunya dimasukkan ke dalam gelas piala, kemudian ditambahkan 5 mL akuades. Larutan dipanaskan hingga mendidih selama 5 menit, lalu dimasukkan ke dalam 2 tabung reaksi. Larutan pada tabung pertama dikocok secara vertikal sampai terbentuk buih, kemudian didiamkan selama 10 menit. Larutan ditambahkan HCl 2 N, kemudian didiamkan. Apabila buih tidak berubah maka positif terdapat saponin. Larutan pada tabung ke-2 ditambahkan FeCl3 1%.
Apabila warna menjadi biru atau hitam kehijauan maka positif terdapat tanin.
Uji Triterpenoid dan Steroid.
Lampiran 6 Uji fitokimia ekstrak etil asetat
Uji
Flavonoid (-) Fenol (-) Tanin (-)
Steroid (+++)
Lampiran 7 Profil KLT 13 fraksi hasil KCV dibawah sinar UV λ 366 nm (A), 254 nm (B) dan hasil penandaan spot noda (C)
A B
C
Lanjutan Lampiran 8
BSLT hasil kolom fraksi 12 (sub fraksi 6)
[ ] (mg/mL) 70 56 42 28 14 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 8)
[ ] (mg/mL) 64 48 32 16 8 4 Kontrol LC 50
Persamaan Regresi μ 0.0154x + 0.3455
Lanjutan Lampiran 8
BSLT hasil kolom fraksi 12 (sub fraksi λ)
[ ] (mg/mL) 30 20 10 5 2.5 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 10)
[ ] (mg/mL) 36 27 18 λ 4.5 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 11)
[ ] (mg/mL) 60 30 15 7.5 3.75 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 12)
Lanjutan Lampiran 8
BSLT hasil kolom fraksi 12 (sub fraksi 13)
[ ] (mg/mL) 45 30 15 7.5 3.75 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 14)
[ ] (mg/mL) 205 164 82 41 20.5 Kontrol LC 50
BSLT hasil kolom fraksi 12 (sub fraksi 17)
Lampiran λ Profil KLT 17 Subfraksi hasil KKG dengan eluen Etil asetat μ diklorometana (1μ3)
A
B
C
Lampiran 10 Data uji sel kanker payudara MCF-7
Contoh perhitungan uji sel kanker payudara MCF-7
Lampiran 11 Profil mikroskopik penghambatan pertumbuhan sel kanker payudara MCF-7
A. Kontrol Negatif
10 µg/mL 20 µg/mL
40 µg/mL 80 µg/mL
Lanjutan Lampiran 11
5 µg/mL 10 µg/mL
20 µg/mL 40 µg/mL
Lampiran 12 Hasil analisis GC-MS
PK RT % Area Library/ID
1 5.882 0.6173 -
2 λ.1λ8λ 0.4015 N-(2-phenylethyl)-Formamide
3 λ.54λ4 0.7077 Dodecanoic acid / Asam Laurat
4 λ.652 0.3441 -
5 10.1λλ1 0.λ255 -
6 11.07λ6 3.6386 Tetradecanoic acid / Asam meristat
7 11.1822 0.601λ -
8 11.2677 0.617λ -
λ 11.4814 5.1421 (-)-Loliolide
10 12.1054 1.8λ22 -
11 12.1738 0.6444 Cyclopentaneundecanoic acid, methyl ester
12 12.4λ87 44.6171 Hexadecanoic acid / Asam Palmitat
13 12.7124 3.0524 Hexadecanoic acid / Asam Palmitat
14 12.8321 4.1473 Hexadecanoic acid / Asam Palmitat
15 13.2253 1.37λλ Nonadecyl acetate
16 13.2766 1.7535 -
17 13.4λ03 2.1185 -
18 13.5501 1.2453 Oleic Acid / Asam Oleat
1λ 13.6271 3.1666 -
20 13.7211 2.27λ6 N-[4-bromo-n-butyl]- 2-Piperidinone
21 14.122λ 2.037λ -
22 14.37λ4 3.3653 Asam 2hidroksi tertradekanoat
26 14.λ778 1.66λ6 -
27 15.371 1.30λ -
28 16.755λ 5.3551 Bis(2-ethylhexyl) phthalate
2λ 17.2261 0.5866 -
RIWAYAT HIDUP