KONSTRUKSI VEKTOR EKSPRESI DARI GEN
plnW
DARI
Lactobacillus plantarum
U10 DAN EKSPRESINYA DI
Lactococcus lactis
AKSAR CHAIR LAGES
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Konstruksi Vektor Ekspresi dari Gen plnW dari Lactobacillus plantarum U10 dan Ekspresinya di Lactococcus lactis adalah benar karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
RINGKASAN
AKSAR CHAIR LAGES. Konstruksi Vektor Ekspresi dari Gen plnW dari Lactobacillus plantarum U10 dan Ekspresinya di Lactococcus lactis. Dibimbing oleh SUHARSONO dan APON ZAENAL MUSTOPA.
Lactobacillus plantarum U10 yang diisolasi dari Tempoyak menghasilkan bakteriosin jenis plantarisin (disandikan oleh gen pln) yang memiliki aktivitas penghambatan terhadap beberapa bakteri patogen. Gen-gen plantarisin tersebar ke beberapa operon yang masing-masing memiliki fungsi tersendiri dalam sistem biosintesis plantarisin. Terdapat lima operon yang terdiri dari plnABCD, plnEFI, plnJKLR, plnMNOP dan plnGHSTUVW. Operon plnGHSTUVW menyandikan protein yang berperan sebagai ATP-binding cassette (ABC) transporter dan beberapa protein membran yang belum diketahui fungsinya, termasuk plnW. Hasil-hasil studi terdahulu menunjukkan bahwa beberapa lokus bakteriosin (termasuk plantarisin) menyandikan protein yang tergolong dalam protein Abi (no. aksesi Pfam PF02517) jenis CAAX protease. Beberapa protein Abi dalam lokus ini (PlnI, PlnL, SkkI, PncO dan SagE) diketahui berperan membentuk imunitas terhadap aktivitas bakteriosin. Selain itu, protein-protein tersebut memiliki motif-motif terkonservasi yang mirip dengan plantarisin W (PlnW). Penelitian ini bertujuan untuk mengkarakterisasi gen plnW asal L. plantarum U10 dan mengklonnya ke dalam vektor ekspresi dan mengekspresikannya dalam L. lactis, serta untuk mengetahui aktivitas PlnW dalam menghambat aktivitas bakteriosin.
Penelitian ini dimulai dari amplifikasi gen plnW dari DNA kromosom L. plantarum U10, kemudian mengklonnya ke dalam vektor pengklonan pGEM-T Easy dan vektor ekspresi pNZ8148. Vektor ekspresi yang telah membawa gen plnW diintroduksikan ke inang L. lactis NZ3900 menggunakan teknik elektroporasi. Analisis tingkat ekspresi PlnW dilihat melalui pengaruh dosis nisin dalam menginduksi L. lactis. Sifat resisten bakteriosin dilihat dari kemampuan pertumbuhan L. lactis pembawa gen plnW ketika dipaparkan bakteriosin.
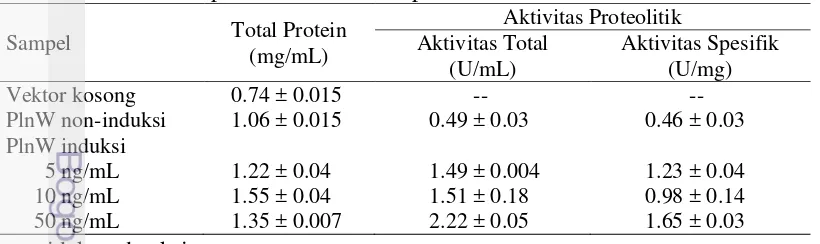
vektor/plasmid sebesar 1 µg. L. lactis yang membawa vektor pNZ8148-WU10 berhasil mengekspresikan plnW. Protein PlnW berukuran 25.3 kDa, terlihat pada bagian sampel rekombinan. Konsentrasi protein meningkat secara cukup signifikan ketika diinduksi nisin. Konsentrasi protein tertinggi (1.55 ± 0.04 mg/mL) dicapai ketika diinduksi 10 ng/mL nisin. Selain itu, PlnW mempunyai aktivitas protease sebesar 2.22 ± 0.05 U/mL dengan aktivitas spesifik sebesar 1.65 ± 0.03 U/mg protein ketika diiduksi dengan 50 ng/mL nisin. PlnW mempunyai aktivitas imunitas terhadap plantarisin dan imunitas silang terhadap jenis bakteriosin lain yaitu pediosin, fermentsin dan acidosin. Hilangnya sensitivitas L. lactis transforman yang mengandung PlnW terhadap bakteriosin mengindikasikan bahwa PlnW merupakan protein imunitas. Berdasarkan analisis lokasi protein, situs aktif dominan terletak pada bagian luar/permukaan sel. Hal ini menjelaskan bahwa mekanisme imunitas bakteriosin diduga terjadi pada daerah tersebut.
SUMMARY
AKSAR CHAIR LAGES. Construction of Expression Vector of plnW gene from Lactobacillus plantarum U10 and Its Expression in Lactococcus lactis. Supervised by SUHARSONO and APON ZAENAL MUSTOPA.
Lactobacillus plantarum U10 isolated from Tempoyak could produce bacteriocin called plantaricin (encoded by pln gene) which has the activity against several pathogenic bacteria. Plantaricin genes are spreaded into several operons which have different functions in biosynthesis system. There are five operons in plantaricin loci called plnABCD, plnEFI, plnJKLR, plnMNOP, and plnGHSTUVW. plnGHSTUVW operon encode the ATP-binding cassette (ABC) transporter and suggesting a putative membrane protein with unknown function, including plnW. Recent studies shown that several bacteriocin loci (include plantaricin) encode proteins that belong to Abi protein family (Pfam accession no. PF02517) CAAX proteases. Some of Abi protein encoded in these loci (PlnI, PlnL, SkkI, PncO and SagE) showed an important role in maintaining immunity against bacteriocin itself based on gene knockout studies. In addition, these proteins contained similar conserved motif with plantaricin W (PlnW). This study aims to characterize plnW gene from L. plantarum U10, clone this gene into an expression vector, then expressed in L. lactis. This study also aims to look forward PlnW activity in order to against bacteriocin activity.
protein significantly increased by nisin induction. the maximum concentration of total protein (1.55 ± 0.04 mg/mL) was achieved at the concentration of inducer was 10 ng/mL. Furthermore, PlnW exhibited protease activity with value of 2.22 ± 0.05 U/mL and specific activity about 1.65 ± 0.03 U/mg protein with 50 ng/mL nisin induction. The PlnW has activity of immunity to plantaricin and cross immunity to other bacteriocins such as pediocin, fermentcin, and acidocin. Loss of sensitivity by L. lactis PlnW containing-transformant to the bacteriocin indicates that PlnW is an immunity protein. Based on location analyze, majority active domains were located at outside of the cell. This explains that the mechanism of bacteriocin immunity is occurring in this region.
© Hak Cipta Milik IPB dan LIPI, Tahun 2015
Hak Cipta
Dilindungi
Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
KONSTRUKSI VEKTOR EKSPRESI DARI GEN
plnW
DARI
Lactobacillus plantarum
U10 DAN EKSPRESINYA DI
Lactococcus lactis
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah “Konstruksi Vektor Ekspresi dari Gen plnW dari Lactobacillus plantarum U10 dan Ekspresinya di Lactococcus lactis”. Sebagian dari hasil penelitian ini dipublikasikan di jurnal Applied Biochemistry and Biotechnology dengan judul “Cloning and Expression of Plantaricin W
Produced by Lactobacillus plantarum U10 Isolate from ‘Tempoyak’ Indonesian
Fermented Food as Immunity Protein in Lactococcus lactis”.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Suharsono, DEA dan Bapak Dr Apon Zaenal Mustopa, MSi selaku komisi pembimbing, serta Bapak Dr Ir Iman Rusmana, MSi selaku penguji luar komisi yang telah memberikan kritik dan saran yang bersifat membangun untuk menyempurnakan tesis ini. Di samping itu, penghargaan penulis sampaikan kepada Bapak Dr Ir Bambang Sunarko selaku Kepala Pusat Penelitian Bioteknologi LIPI yang telah mengizinkan penulis untuk melakukan penelitian di Laboratorium Rekayasa Genetika Terapan dan Disain Protein, Puslit Bioteknologi LIPI.
Terima kasih kepada Lembaga Ilmu Pengetahuan Indonesia atas bantuan Program Riset Kompetitif 2014 yang telah membantu membiayai penelitian ini atas nama Dr Apon Zaenal Mustopa, MSi. Ungkapan terima kasih juga disampaikan kepada keluarga, para rekan se-laboratorium, teman kuliah dan seluruh pihak yang membantu atas segala doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA
Lactobacillus plantarum 3
Bakteriosin 4
Imunitas Bakteriosin 6
Ekspresi Protein Heterolog di Lactococcus lactis 7 3 METODE
Tempat dan Waktu Penelitian 8
Bahan 8
Prosedur Kerja 9
4 HASIL DAN PEMBAHASAN
Pengklonan dan Karakterisasi plnW Asal L. plantarum U10 13
Vektor Ekspresi Rekombinan 16
Transformasi L. lactis NZ3900 18
Ekspresi Plantarisin W di L. lactis NZ3900 19
Imunitas Plantarisin W terhadap Bakteriosin 21
5 SIMPULAN DAN SARAN
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Karakteristik genetik beberapa strain L. plantarum 4
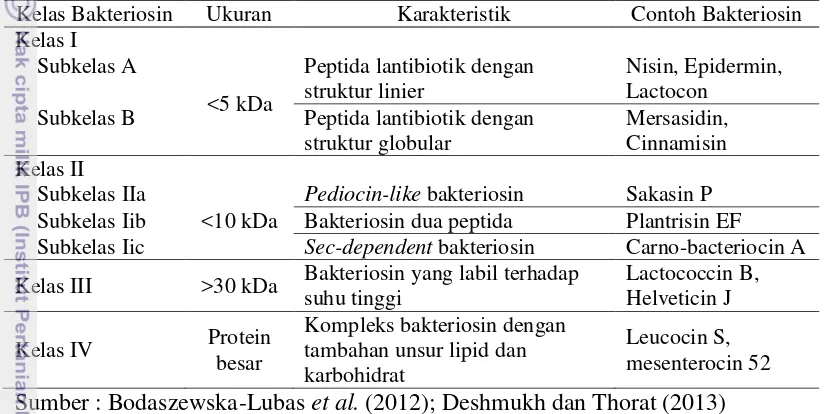
2 Klasifikasi bakteriosin 5
3 Jenis-jenis protein yang telah diekspresikan di L. lactis 7
4 Primer yang digunakan 9
5 Homologi urutan nukleotida plnW 13
6 Optimasi transformasi L. lactis NZ3900 18
7 Konsentrasi protein dan aktivitas proteolitik PlnW 20
DAFTAR GAMBAR
1 Scanning Electron Micrograph dari Lactobacillus plantarum WCFS1 3 2 Lokus-lokus plantarisin pada beberapa strain L. plantarum 5 3 Pensejajaran urutan asam amino yang memiliki motif CAAX
protease 6
4 Peta vektor pengklonan (a) dan vektor ekspresi (b) 8 5 Fragmen DNA pembawa gen plnW (a) dan peta vektor pengklonan
rekombinan (b) 13
6 Urutan nukleotida plnW dari genom L. plantarum U10 14 7 Homologi asam amino PlnW asal L. plantarum U10 dengan PlnW
dari beberapa strain L. plantarum 15
8 Analisis lokasi PlnW pada membran sel 15
9 (a) Amplifikasi gen plnW; (b) konfirmasi pemotongan vektor rekombinan dengan enzim NcoI dan HindIII; (c) peta vektor
rekombinan 16
10 Transformasi E. coli MC1061 (a), beserta konfirmasi transforman menggunakan PCR koloni (b), isolasi vektor rekombinan (c) dan
PCR vektor rekombinan (d) 17
11 Analisis urutan gen plnW pada vektor pNZ8148-WU10 18 12 Koloni transforman L. lactis NZ3900 ketika diintroduksi vektor
sebanyak 0.5 µg (a), 0.7 µg (b) dan 1 µg (c). PCR koloni transforman yang positif membawa vektor ekspresi pNZ8148-WU10 (d) 19 13 Profil SDS-PAGE dan zimogram protease dari plantarisin W 20 14 Imunitas Plantarisin W dalam menghadapi aktivitas bakteriosin 22
DAFTAR LAMPIRAN
1 Komposisi media pertumbuhan de Man, Rogosa, Sharpe (MRS) 30 2 Komposisi media pertumbuhan Luria-Bertani (LB) 30
3 Komposisi media pertumbuhan M17 30
4 Komposisi larutan dalam SDS-PAGE 31
5 Kurva standar BSA 32
6 Kurva standar tirosin 32
7 Skor hydrophaty dari asam amino 33
1
PENDAHULUAN
Latar Belakang
Bakteriosin merupakan protein antimikroba yang dihasilkan oleh bakteri. Sebagian besar bakteriosin yang dihasilkan oleh Bakteri Asam Laktat (BAL) telah diketahui peranannya sebagai bahan pengawet pangan alami dan bahan substitusi antibiotik (Richard et al. 2006). Pangan fermentasi merupakan lingkungan hidup yang sangat cocok bagi BAL dikarenakan melimpahnya nutrisi yang menunjang pertumbuhan BAL tersebut. Pada penelitian sebelumnya, Lactobacillus plantarum U10 berhasil diisolasi dari Tempoyak (pangan fermentasi asal Pulau Sumatera dan Kalimantan) dan diketahui menghasilkan plantarisin yang dapat menghambat pertumbuhan beberapa bakteri patogen (Urnemi et al. 2010).
Bakteriosin umumnya dibagi menjadi tiga atau empat kelas. Kelas satu biasa disebut dengan lanbiotik yang tersusun atas 19 sampai 50 asam amino yang termodifikasi seperti lantionin, metil-lantionin, dehidrobutirin, dan dehidroalanin. Bakteriosin kelas dua merupakan peptida kecil, stabil terhadap panas, dan tidak memiliki peptida termodifikasi (Cleveland et al. 2001; Holo et al. 2001). Kelas tiga merupakan golongan peptida berukuran besar (> 30 kDa), serta tidak stabil terhadap panas. Bakteriosin kelas empat yang merupakan protein kompleks yang mengandung tambahan lipid esensial atau karbohidrat pada protein (Jack et al. 1995). Sistem biosintesis plantarisin terdiri atas lima operon yaitu plnABCD, plnEFI, plnJKLR, plnMNOP, dan plnGHSTUVW. Operon plnABCD diketahui peranannya dalam proses regulasi sistem biosintesis, sedangkan tiga operon lainnya (plnEFI, plnJKLR, dan plnMNOP) memiliki peranan dalam menghasilkan bakteriosin beserta protein imunitasnya. Operon plnGHSTUVW menghasilkan protein-protein yang berperan dalam translokasi bakteriosin, serta beberapa protein membran yang belum diketahui fungsinya, yang salah satunya adalah protein plantarisin W (PlnW) (Diep et al. 1996; Tsapieva et al. 2011).
Lokus-lokus bakteriosin (termasuk plantarisin) memiliki beberapa gen yang menyandikan protein golongan abortive infection (Abi) CAAX protease seperti PlnI, PlnL, SkkI, PncO dan SagE yang memiliki peran imunitas dalam menghambat aktivitas bakteriosin. Protein Abi CAAX protease memiliki tiga motif/domain aktif yang terkonservasi yaitu Glu-Glu-xxx-Arg („x‟ merupakan jenis asam amino lainnya), Phe-xxx-His dan His dimana ketiga motif tersebut juga terdapat pada susunan asam amino penyusun PlnW (Kjos et al. 2010). Bakteri penghasil bakteriosin mengekspresikan gen penyandi bakteriosin berikut dengan gen imunitasnya sebagai upaya dalam memproteksi diri dari bakteriosin yang dihasilkannya (Drider et al. 2006). Hal ini merupakan salah satu upaya dalam meningkatkan produksi bakteriosin yaitu dengan menggabungkannya dengan gen imunitas dan mengekspresikannya secara heterolog pada bakteri inang yang lain dengan teknologi DNA rekombinan.
2
tersebut. Namun, belum ada penelitian yang mempelajari aktivitas dari PlnW dalam membentuk sifat resisten terhadap plantarisin.
Beberapa peptida plantarisin telah berhasil diekspresikan secara heterolog pada Saccharomyces cerevisiae (van Reenen et al. 2002), Lactobacillus sakei (Straume et al. 2006) dan Escherichia coli (Pal dan Sheela 2014; Kusdianawati et al. 2015). Strain BAL dipilih sebagai inang karena merupakan mikroorganisme yang telah diketahui aman secara umum, baik dalam aspek pangan maupun biomedis. Selain itu, menurut Kunji et al. (2003) struktur dinding sel yang dimiliki BAL memungkinkan optimalisasi dari ekspresi protein membran dikarenakan hanya memiliki satu lapisan membran.
Produksi bakteriosin dapat ditingkatkan dengan menggunakan teknik rekayasa genetik, dimana bakteriosin rekombinan diekspresikan pada bakteri inang secara inducible. Namun, ekspresi bakteriosin rekombinan tersebut berpotensi menghambat pertumbuhan bakteri inang dikarenakan sensitivitasnya terhadap aktivitas bakteriosin. Ko-ekspresi bakteriosin rekombinan dengan protein imunitas merupakan salah satu cara meningkatkan produksi bakteriosin tanpa menghambat pertumbuhan bakteri inang. Skema ini telah digunakan pada penelitian Martin et al. (2007) dengan mengekspresikan enterocin A (entA) bersamaan dengan protein imunitasnya (entiA), namun masih belum menghasilkan tingkat produksi yang optimum dikarenakan ketidakcocokan dengan inang yang digunakan. Oleh sebab itu studi pendahuluan terkait kompatibilitas gen penyandi protein imunitas yang akan diekspresikan pada kandidat bakteri inang perlu dilakukan. Pada penelitian ini, gen plnW asal L. plantarum U10 diekspresikan pada inang BAL jenis Lactococcus lactis, serta dievaluasi aktivitasnya dalam membentuk sifat resisten terhadap bakteriosin.
Hasil penelitian ini diharapkan dapat dijadikan acuan dalam pengembangan sistem ko-ekspresi ataupun hibridisasi protein antara bakteriosin rekombinan dengan Plantarisin W sebagai protein imunitasnya, sehingga dapat mengoptimalkan produksi bakteriosin rekombinan tersebut. Selain itu, penelitian ini menghasilkan produk berupa strain bakteri inang yang dapat mengekspresikan plantarisin W.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkarakterisasi gen plnW asal L. plantarum U10 yang diisolasi dari pangan fermentasi tempoyak, dan mengklon gen tersebut ke dalam vektor ekspresi serta mengekspresikannya dalam strain BAL jenis L. lactis NZ3900. Penelitian ini juga bertujuan untuk mengetahui aktivitas imunitas plantarisin dari PlnW, serta potensinya dalam menghambat aktivitas bakteriosin jenis lain.
2
TINJAUAN PUSTAKA
Lactobacillus plantarum
Bakteri asam laktat (BAL) merupakan bakteri gram positif yang tumbuh secara anaerobik, tidak bersporula, serta dapat memproduksi asam laktat sebagai produk dari proses fermentasi. BAL telah banyak dimanfaatkan sejak ribuan tahun dalam proses produksi pangan fermentasi dimana BAL berkontribusi terhadap cita rasa, kualitas, tekstur dan keamanan produk tersebut. Lactobacillus plantarum (Gambar 1) merupakan bakteri gram positif yang tidak menghasikan spora dan katalase, resisten terhadap kondisi lingkungan yang asam, tumbuh optimum secara anaerobik aerotoleran pada suhu 30 °C (mesofilik) atau 42 °C (termofilik) dengan kisaran pH optimum 4.0-4.5. L. plantarum bersifat heterofermentatif fakultatif, dimana proses fermentasi karbohidrat pada umumnya melalui jalur sintesa fosfoketolase. Fermentasi pentosa (xylosa dan ribosa) akan menghasilkan piruvat dan asetil fosfat yang nantinya akan dikonversi menjadi laktat dan asetat. Selain itu, heksosa (glukosa, fruktosa dan mannosa) juga akan dikonversi menjadi laktat, CO2 dan etanol (Mayo et al. 2010; Todorov dan Franco 2010; Hammes dan Vogel
1995).
Gambar 1 Scanning Electron Micrograph dari Lactobacillus plantarum WCFS1 [Gambar direproduksi dari Bron et al. (2004) dengan seizin penerbit American Society for Microbiology].
4
Konsorsium bakteri ini dapat meningkatkan nilai organoleptik pangan fermentasi dengan cara mensekresikan enzim-enzim glikolitik, lipolitik dan proteolitik yang akan mempengaruhi struktur, aroma dan cita rasa produk tersebut (Todorov et al. 2012).
Tabel 1 Karakteristik genetik beberapa strain L. plantarum
Strain Sumber isolat Ukuran
genom (mb) Sumber : Siezen dan van Hylckama Vlieg (2011)
Kemampuan BAL, termasuk L. plantarum dalam menghasilkan substansi antimikrobial seringkali dimanfaatkan pada bidang industri pangan dalam mengurangi kontaminasi bakteri pembusuk maupun patogen (Martinez et al. 2013). L. plantarum U10 berhasil diisolasi dari „tempoyak‟, pangan fermentasi asal Sumatera Selatan (Urnemi et al. 2010). Pangan fermentasi merupakan lingkungan hidup yang cocok bagi BAL karena menyediakan kompleks nutrisi yang mendukung pertumbuhan BAL. Kelimpahan jenis mikroorganisme BAL pada pangan tempoyak diantaranya adalah L. plantarum, L. sakei dan L. corynebacterium (Yuliana dan Garcia 2009).
Bakteriosin
Beberapa strain BAL diketahui dapat memproduksi peptida antimikroba dalam bentuk protein berukuran kecil yang disebut bakteriosin. Bakteriosin disintesis oleh ribosom dengan sifat antagonis terhadap beberapa bakteri gram positif maupun negatif. Penerapan bakteriosin dalam preservasi pangan memberikan beberapa maanfaat diantaranya yaitu menurunkan resiko toksik dan kontaminasi silang terhadap pangan, meningkatkan umur simpan produk pangan, menekan kerugian ekonomi akibat kemunduran mutu pangan, serta dapat mengurangi tingkat penggunaan bahan kimia sintetik pada pangan. (Calo-Mata et al. 2005; Cotter et al. 2005). Pengelompokan bakteriosin disajikan pada Tabel 2.
Bakteriosin kelas I umumnya dikenal sebagai lantibiotik, terdiri atas peptida linier (tipe A) dan globular (tipe B) dengan bobot molekul yang rendah (<5 kDa, dengan rata-rata 19 hingga 38 asam amino). Protein ini mengalami modifikasi pasca-translasi yang akan membentuk struktur cincin lanthionine. Salah satu contoh dari protein lantibiotik adalah Nisin, bakteriosin yang dihasilkan oleh L. lactis (Todorov 2009; Ghrairi et al. 2012).
5 lactococcin G), serta kelas IIc (bakteriosin yang memiliki struktur siklik akibat ikatan kovalen antara ujung C dan N) (Drider et al. 2006; Balciunas et al. 2013).
Bakteriosin kelas III merepresentasikan protein berukuran besar (>30 kDa) yang sifatnya tidak stabil terhadap perlakuan suhu tinggi. Jenis bakteriosin yang termasuk dalam kelas ini diantaranya adalah helveticin J, acidophilucin A, lactacin A dan B. Bakteriosin kelas IV merupakan kompleks bakteriosin yang tersusun atas gabungan karbohidrat, lipid dengan protein (Heng et al. 2007). Tabel 2 Klasifikasi bakteriosin
Kelas Bakteriosin Ukuran Karakteristik Contoh Bakteriosin Kelas I
Subkelas B Peptida lantibiotik dengan struktur globular
Pediocin-like bakteriosin Sakasin P Subkelas Iib Bakteriosin dua peptida Plantrisin EF Subkelas Iic Sec-dependent bakteriosin Carno-bacteriocin A
Kelas III >30 kDa Bakteriosin yang labil terhadap suhu tinggi
Sumber : Bodaszewska-Lubas et al. (2012); Deshmukh dan Thorat (2013)
Bakteri L. plantarum menghasilkan bakteriosin yang dikenal dengan nama plantarisin. Sebanyak 25 gen yang terorganisir ke dalam 5 hingga 6 operon terdapat dalam lokus-lokus plantarisin pada tiap strain (Gambar 2). Sistem biosintesis plantarisin teridiri atas lima operon yaitu plnABCD, plnEFI, plnJKLR, plnMNOP, dan plnGHSTUVWXY. Operon plnABCD diketahui peranannya dalam proses regulasi sistem biosintesis, sedangkan tiga operon lainnya (plnEFI, plnJKLR, dan plnMNOP) memiliki peranan dalam menghasilkan bakteriosin beserta protein imunitasnya. Operon plnGHSTUVWXY menghasilkan protein-protein yang berperan dalam translokasi bakteriosin, serta beberapa protein-protein membran yang belum diketahui fungsinya, salah satunya adalah protein plantarisin W (PlnW) (Diep et al. 1996; Tsapieva et al. 2011).
6
Mekanisme regulasi biosintesis plantarisin berdasarkan pada sistem komunikasi antar sel (quorum sensing) yang diperankan oleh tiga komponen regulator yaitu peptida penginduksi, histidin kinase pada membran dan protein respon regulator. Gen plnA menyandikan peptida penginduksi, ditranslasikan oleh ribosom dan dipindahkan keluar sel menggunakan bantuan ATP-binding cassette (ABC) transporter. Ketika konsentrasi berada pada titik optimum, peptida penginduksi di luar sel akan berikatan secara spesifik dengan histidin kinase (disandikan oleh plnB) yang akan memicu reaksi berantai melalui fosforilasi, sehingga mengaktifkan protein respon regulator (disandikan oleh plnC dan plnD) di dalam sel. Protein respon regulator yang telah terfosforilasi akan berikatan pada daerah promoter dan mengaktifkan transkripsi gen target (Diep et al. 2009a). Bakteriosin jenis plantarisin (Plantarisin EF dan JK) memiliki urutan leader berupa double glisin pada bagian N-terminal peptida. Urutan asam amino ini memiliki kosensus motif Leu-Ser-xx-Glu-Leu-xxx-Gly-Gly („x‟ merupakan jenis asam amino lainnya) dimana double glisin bersifat sangat terkonservasi. Urutan leader akan menekan aktivitas peptida selama masih berada di dalam sel, sekaligus mengenali motif pada ABC transporter dan mentranslokasikan peptida tersebut keluar sel (Havarstein et al. 1995; Nes et al. 1996).
Imunitas Bakteriosin
Operon bakteriosin mengekspresikan bakteriosin bersamaan dengan protein imunitasnya. Protein imunitas berperan melindungi bakteri dari aktivitas bakteriosin yang dihasilkannya. Salah satu contohnya adalah ekspresi bakteriosin plantarisin EF maupun JK akan selalu diikuti dengan ekspresi dari gen plnI atau plnL yang menyandikan protein imunitas (Diep et al. 2009a). Protein PlnI dan PlnL telah diketahui menunjukkan aktivitas resisten terhadap bakteriosin melalui mutasi pada titik-titik yang menjadi motif dari protein tersebut. Motif aktif yang terdapat pada PlnI dan PlnL dikenal dengan nama motif CAAX protease. Selain pada dua protein imunitas tersebut, motif CAAX protease juga diketahui terdapat pada beberapa protein membran di lokus plantarisin yang hingga saat ini belum diketahui aktivitasnya yaitu PlnT, PlnU, PlnV dan PlnW (Kjos et al. 2010, 2011) (Gambar 3).
7 Protease dengan motif CAAX banyak terdapat pada bakteri, namun peranannya hingga saat ini masih belum banyak diketahui dan belum stabil. Protein CAAX protease memiliki tiga motif/domain aktif yang terkonservasi yaitu Glu-Glu-xxx-Arg, Phe-xxx-His dan His (Diep et al. 2009a; Kjos et al. 2010). Sedikit berbeda dengan protein-protein imunitas bakteriosin pada umumnya yang menggunakan bantuan protein terasosiasi membran, motif CAAX protease diprediksi menjalankan fungsi imunitasnya dengan cara mengenali secara langsung reseptor protein pada bakteriosin dan mencegah terbentuknya pori pada membran sel yang akan memicu kematian bakteri tersebut (Diep et al. 2009a).
Ekspresi Protein Heterolog di Lactococcus lactis
Lactococcus lactis banyak digunakan dalam proses pembuatan susu fermentasi maupun keju (Braat et al. 2006). Beberapa strain telah diketahui mampu menghasilkan nisin, suatu lantibiotik yang telah banyak digunakan sebagai bahan pengawet pangan sejak lebih dari 50 tahun yang lalu (Lv et al. 2004). Puluhan genom strain L. lactis yang diisolasi dari berbagai sumber telah berhasil diurutkan sehingga dapat diketahui bahwa salah satu karakteristik genetik dari L. lactis yaitu memiliki kandungan basa nitrogen guanin (G) dan sitosin (C) yang relatif rendah yaitu sekitar 35% (Cavanagh et al. 2015). Hal ini membuat L. lactis telah banyak dimanfaatkan dalam beberapa bidang bioteknologi (Tabel 3) seperti dalam ekspresi antigen bakteri dan virus sebagai pengembangan vaksin oral yang aman, produksi hormon sitokinin dan agen terapeutik lainnya, serta pilot production pengembangan produk farmasetika (Mierau 2005).
Tabel 3 Jenis-jenis protein yang telah diekspresikan di L. lactis
3
METODE
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Rekayasa Genetika Terapan dan Disain Protein, Pusat Penelitian Bioteknologi LIPI, Cibinong pada bulan Maret 2014 hingga April 2015.
Bahan
Escherichia coli DH5α (Novagen) dan E. coli MC1061 (NIZO) digunakan sebagai bakteri inang untuk pengklonan, L. plantarum U10 (stok laboratorium) sebagai sumber bakteriosin sekaligus gen plnW, L. fermentum U11 (stok laboratorium), L. acidophilus C99 (stok laboratorium) dan Pediococcus acidilactici S23 (stok laboratorium) sebagai sumber bakteriosin jenis lain dari plantarisin, serta L. lactis NZ3900 (NIZO) sebagai bakteri inang ekspresi. Vektor atau plasmid yang digunakan adalah pGEM-T Easy (Promega) sebagai vektor pengklonan dan pNZ8148 (NIZO) sebagai vektor ekspresi yang dapat dilihat pada Gambar 4. Adapun beberapa pasang oligonukleotida primer yang digunakan dalam mengkonstruksi vektor rekombinan dapat dilihat pada Tabel 4.
9 Tabel 4 Primer yang digunakan
Primer Urutan Nukleotida (5‟‟γ) Situs
Situs restriksi pada urutan nukleotida bergaris bawah.
Prosedur Kerja
Isolasi DNA Genomik L. plantarum U10
Genom L. plantarum U10 diisolasi menggunakan metode Mustopa dan Fatimah (2014). Sebanyak 5 mL kultur stasioner L. plantarum U10 dalam media de Man, Rogosa, Sharpe (MRS) (Lampiran 1) dipanen dengan sentrifugasi pada kecepatan 11000 x g selama 10 menit. Pelet sel diresuspensi dalam 540 µ L bufer Tris-EDTA yang mengandung 5 mg/mL lisozim, kemudian diinkubasi selama 1 jam pada suhu 37 °C. Proses lisis sel dilanjutkan dengan menambahkan 200 µ L 10% sodium dedocyl sulfate, 100 µ L 5M NaCl, dan 80 µ L 10% CTAB untuk kemudian diinkubasi selama 30 menit pada suhu 68 °C. Campuran tersebut ditambahkan kloroform dengan rasio 1:1, lalu disentrifugasi selama 10 menit pada kecepatan 23000 x g. Sentrifugasi menghasilkan tiga fase larutan dimana fase paling atas merupakan cairan bening yang mengandung nukleotida untuk kemudian dipresipitasi dengan isopropanol. DNA yang terendapkan disentrifugasi dan dikering-anginkan untuk menghilangkan sisa senyawa alkohol. DNA dilarutkan dengan nuclease-free water yang telah mengandung 0.1 mg/mL RNAse untuk menghilangkan kontaminan RNA. DNA disimpan pada suhu -20 °C.
Pengklonan dan Karakterisasi plnW asal L. plantarum U10
10
Analisis lokasi protein plantarisin W diprediksi dengan melihat simulasi dari profil hidrofobik protein menggunakan Protter (http://wlab.ethz.ch/protter/start/).
Konstruksi Vektor Rekombinan
Vektor pGplnWU10 dijadikan cetakan PCR untuk mengamplifikasi spesifik gen plnW yang sudah dipasangi situs restriksi NcoI dan HindIII menggunakan primer plnW-NcoI_F dan plnW-HindIII_R (Tabel 4). Proses PCR dilakukan sebanyak 35 siklus dengan kondisi 94 °C selama 3 menit untuk denaturasi awal, 94 °C selama 1 menit untuk denaturasi, 55 °C selama 1 menit untuk penempelan primer, 72 °C selama 30 detik untuk pemanjangan/elongasi, serta 72 °C selama 6 menit untuk elongasi akhir. Hasil PCR dimurnikan dan dipotong menggunakan enzim restriksi NcoI dan HindIII. Pada saat yang bersamaan, vektor pNZ8148 juga dipotong menggunakan enzim restriksi NcoI dan HindIII. Gen plnW diligasikan ke vektor pNZ8148. Hasil ligasi merupakan vektor pNZ8148-WU10. Hasil ligasi diintroduksikan ke E. coli MC1061 menggunakan metode Sambrook et al. (1989). Koloni tunggal dari transforman yang tumbuh dideteksi menggunakan PCR koloni dengan primer nisA_F dan T8148_R. Proses PCR dilakukan sebanyak 35 siklus dengan kondisi 94 °C selama 3 menit untuk denaturasi awal, 94 °C selama 1 menit untuk denaturasi, 55 °C selama 1 menit untuk penempelan primer, 72 °C selama 40 detik untuk pemanjangan/elongasi, serta 72 °C selama 6 menit untuk elongasi akhir. Transforman yang positif membawa gen target, diisolasi vektor rekombinannya. Vektor rekombinan pNZ8148-WU10 dikonfirmasi menggunakan pengurutan DNA. Vektor pNZ8148-WU10 akan diintroduksikan ke L. lactis NZ3900.
Transformasi Bakteri
Transformasi E. coli dilakukan dengan metode „Heat shock’ (Sambrook et al. 1989). Preparasi sel kompeten E. coli strain DH5α dan MC1061 dimulai dengan prekultur di dalam 5 mL media LB. Kultur bakteri diinkubasi dengan agitasi selama semalam pada suhu 37 °C. Sebanyak 1 mL kultur stasioner tersebut diinokulasi ke dalam 100 mL media LB. Kultur bakteri diinkubasi dengan agitasi pada suhu 37 °C hingga mencapai OD600 ~ 0.4. Kultur bakteri disentrifugasi
2700 x g selama 10 menit pada suhu 4 °C. Pelet diresusupensi dengan 30 mL larutan CaCl2-MgCl2 (80 mM MgCl2, 20 mM CaCl2). Campuran tersebut
disentrifugasi 3500 g pada suhu 4 °C selama 10 menit. Pelet diresuspensi dengan 1 ml larutan 0.1 M CaCl2. Sebanyak 100 µ L sel kompeten dicampurkan dengan
hasil ligasi. Proses „heat shock‟ dilakukan dengan pemanasan campuran tersebut di dalam water bath pada suhu 42 °C selama 90 detik, kemudian secara cepat diinkubasi di dalam es selama 2 menit. Campuran tersebut ditambahkan 400 µL media LB, kemudian diinkubasi pada suhu 37 °C selama 2 jam. Transforman diseleksi pada media tumbuh LB agar yang mengandung antibiotik (ampicilin ataupun kloramfenikol), kemudian diinkubasi selama semalam pada suhu 37 °C.
11 menit pada suhu 4 °C. Pelet diresuspensi dengan buffer pencuci (0.5 M sukrosa dan 10% (vol/vol) gliserol), kemudian disentrifugasi kembali selama 10 menit pada kondisi yang sama. Pelet diresuspensi dengan buffer inkubasi (0.5 M sukrosa, 10% (vol/vol) gliserol dan 0.05 M EDTA), diamkan di dalam es selama 15 menit, kemudian sentrifugasi kembali pada kondisi yang sama. Pelet dicuci dengan buffer pencuci, kemudian diresuspensi sebanyak 1 mL dengan buffer yang sama. Vektor rekombinan dengan jumlah tertentu (0.5, 0.7 dan 1 µg) dicampurkan ke dalam 100 µ L sel elektrokompeten, kemudian dimasukkan ke dalam kuvet elektroda. Elektroporasi dilakukan dengan kondisi tegangan 2 kV, kapasitas 25 µ F dan hambatan 200 Ω. Sel bakteri yang telah terelektroporasi ditambahkan 400 µ L media M17 yang mengandung 20 mM MgCl2 dan 2 mM CaCl2, kemudian
diinkubasi tanpa agitasi selama 3 jam pada suhu 30 °C. Transforman diseleksi pada media tumbuh M17 agar yang mengandung 10 µg/mL antibiotik kloramfenikol, kemudian diinkubasi selama semalam pada suhu 30 °C. Efisiensi proses transformasi diketahui menggunakan rumus (Janjua et al. 2014) :
Efisiensi Transformasi cfu µg =Jumlah transforman
µg DNA × faktor pengenceran ×
Vol. kultur transformasi Vol. kultur yang disebar
Ekspresi Plantarisin W di L. lactis
Ekspresi plantarisin W di L. lactis dilakukan menggunakan metode Wu et al. (2013) dengan beberapa modifikasi. Transforman L. lactis yang membawa vektor pNZ8148-WU10 ditumbuhkan pada 10 mL media M17 yang telah disuplementasi dengan 0.5% glukosa dan 10 µg/mL kloramfenikol tanpa agitasi pada suhu 30 °C. Tingkat ekspresi dilihat dari optimasi induksi nisin (NIZO) dengan konsentrasi 5, 10 dan 50 ng/mL pada OD600 ~ 0.5, kemudian ditumbuhkan
hingga OD600 ~ 1.0. Kultur dipanen menggunakan sentrifus dan diresuspensi
dengan 50 mM bufer Tris-HCl pH 7.4. Sel dilisis secara mekanik menggunakan ultrasonikator (Branson) selama 5 menit di suhu dingin dengan cycle 0.5 dan amplitudo 40. Hasil pemecahan sel disentrifugasi selama 15 menit pada 23000 x g. Supernatan/fraksi terlarut yang didapat merupakan ekstrak bebas sel yang diduga telah mengandung plantarisin W.
Elektroforesis Gel Poliakrilamida-Sodium Dedosil Sulfat (SDS-PAGE)
Protein hasil ekspresi dielektroforesis SDS-PAGE (Lampiran 4) menggunakan gel pemisah 10% dan gel penahan 4% untuk melihat bobot molekul plantarisin W dengan cara membandingkannya dengan pita protein standar. Campuran fraksi protein dan buffer loading dye (50 mM Tris HCl pH 6.8, 2% SDS, 10% gliserol, 1% -merkaptoetanol, 12.5 M EDTA, 0.02% Bromophenol biru, H2O)dipanaskan pada suhu 95 °C selama 15 menit, kemudian dimigrasikan
di dalam gel elektroforesis SDS-PAGE. Proses elektroforesis berlangsung pada kondisi tegangan 100 V dan arus listrik 20 mA. Gel diwarnai dengan menggunakan Coomassie blue G-250. Pewarnaan dengan Coomassie blue G-250 dilakukan selama semalam. Kemudian proses destaining dilakukan selama 30 menit dengan pengulangan 3 kali atau hingga pita protein terlihat jelas.
Penentuan Konsentrasi Total Protein
12
standar bovine serume albumine (BSA) (Lampiran 5). Konsentrasi standar BSA yang digunakan adalah 25, 125, 250, 500, 750, 1000, 1500 dan 2000 g/mL. Working reaction dibuat dengan mencampurkan reagen A dan B dengan perbandingan 50 : 1. Sampel dan working reaction ditambahkan dalam microplate 96-well dengan perbandingan sampel : working reaction (1:20). Microplate diinkubasi pada suhu 37 °C selama 30 menit, kemudian hasil reaksi dibaca pada panjang gelombang 540 nm dengan menggunakan spektrofotometer.
Zymogram Protease
Zymogram protease dilakukan menggunakan metode Kleiner et al. (1994) untuk mendeteksi pita protein yang menunjukkan aktivitas proteolitik. Sebanyak 0.2% gelatin ditambahkan dalam campuran gel pemisah, kemudian sampel yang tidak didenaturasi dielektroforesis hingga pemisahan protein selesai. Gel dicuci dengan air steril selama 2 x 5 menit, kemudian direndam dalam 2.5% Triton-X 100 selama 1 jam untuk proses recovery protein. Gel dicuci kembali dengan air steril, kemudian direndam dalam bufer reaksi dan diinkubasi selama 24 jam pada suhu 37 °C. Zona bening yang mengindikasikan aktivitas proteolitik akan tampak setelah gel diwarnai dengan Commasie blue G-250.
Uji Kuantitatif Aktivitas Proteolitik
Aktivitas proteolitik dianalisis secara kuantitatif menggunakan 0.5% kasein sebagai substrat. Uji aktifitas protease dilakukan dengan menggunakan modifikasi metode Enyard (2009). Uji ini dilakukan dengan menggunakan microplate 96 well. Sebanyak 18 µ L campuran reaksi yang terdiri dari 6 µ L sampel, 6 µL bufer Tris dan 6 µ L substrat diinkubasi selama 30 menit pada suhu 37 °C. Reaksi enzimatik dihentikan dengan menambahkan 12 µL larutan asam trikloroasetat. Larutan tirosin digunakan sebagai standar mulai dari 0, 25, 50, 100, 125, 250, 500 dan 1000 µM. Sebanyak 143 µ L working reagent (Na2CO3 dan
CuSO4.5H2O dengan rasio 5:1) dan 30 µL reagen Folin Ciocalteau ditambahkan
ke dalam campuran reaksi, kemudian disentrifugasi selama 5 menit pada kecepatan 23000 x g. Tirosin bebas pada supernatan diukur absorbansinya pada 620 nm dan konsentrasinya dibandingkan menggunakan kurva standar tirosin (Lampiran 6). Satu unit aktivitas proteolitik didefinisikan sebagai besarnya sampel yang melepas 1 µmol tirosin per menit pada kondisi eksprerimen.
Uji Imunitas terhadap Bakteriosin
4
HASIL DAN PEMBAHASAN
Pengklonan dan Karakterisasi plnW Asal L. plantarum U10
Fragmen DNA berukuran 1033 pb yang mengandung gen plnW telah berhasil teramplifikasi dari DNA kromosom L. plantarum U10 asal tempoyak (Gambar 5a). Fragmen DNA tersebut juga telah berhasil disisipkan ke vektor pengklonan pGEM-T Easy sehingga menghasilkan vektor pGplnWU10 yang berukuran 4205 pb (Gambar 5b). Hasil pengurutan DNA menunjukkan bahwa fragmen DNA yang diperoleh memiliki tiga daerah pembacaan/open reading frame (ORF) (Gambar 6). Ketiga ORF tersebut meliputi sebagian kecil dari plnV dan plnX, serta keseluruhan gen dari plnW. Amplifikasi DNA dari daerah ujung plnV hingga daerah awal plnX bertujuan untuk mengetahui secara pasti ukuran maupun urutan nukleotida plnW, sehingga dapat dideteksi jika terjadi mutasi pada tingkat gen. Mutasi gen merupakan perubahan material genetik yang bersifat permanen (Burrus dan Waldor 2005). Hasil BLAST menunjukkan urutan nukleotida plnW dari L. plantarum U10 memiliki tingkat homolog yang tinggi (99%) dengan plnW dari L. plantarum C11 dan L. plantarum ST-III yang diisolasi dari pangan fermentasi mentimun dan makanan tradisional Korea (Tabel 5). Hal ini menunjukkan pula bahwa sifat genetik dari plnW relatif stabil dengan tingkat mutasi yang cukup rendah di berbagai strain L. plantarum.
Gambar 5 Fragmen DNA pembawa gen plnW (a) dan peta vektor pengklonan rekombinan (b)
Tabel 5 Homologi urutan nukleotida plnW
Strain Bakteri Sumber Aksesi Tingkat Homolog
14
menyebabkan perbedaan signifikan antara PlnW asal L. plantarum U10 dengan PlnW dari berbagai strain L. plantarum, yaitu pada posisi ke-77 (arginin triptofan) dan posisi ke-160 (asam aspartat glisin) (Gambar 7). Lingkungan hidup BAL dapat mempengaruhi stabilitas genetik strain tersebut dalam prosesnya beradaptasi terhadap cekaman lingkungan (Machielsen et al. 2010).
Gambar 6 Urutan nukleotida plnW dari genom L. plantarum U10. Tanda (*) merupakan kodon stop.
15
Gambar 7 Homologi asam amino PlnW asal L. plantarum U10 dengan PlnW dari beberapa strain L.plantarum. L. plantarum ATCC14917 asal fermentasi kubis (no. aksesi EFK30766), L. plantarum AY01 asal fermentasi susu domba (no. aksesi ERL43668), L. plantarum C11 asal fermentasi mentimun (no. aksesi CAX65636), L. plantarum IPLA88 asal pangan Italia (sourdough) (no. aksesi EPD24000), L. plantarum NC8 asal silase rumput (no. aksesi EHS83019), L. plantarum ST-III asal pangan Korea (kimchi) (no. aksesi ADN97580), L. plantarum UCMA3037 asal keju (no. aksesi EMP42931), L. plantarum WCFS1 asal saliva manusia (no. aksesi YP_004888449), L. plantarum WJL asal serangga Drosophila (no. aksesi ERO41324), L. plantarum ZJ316 asal feses bayi manusia
(no. aksesi AGE38135) .Tanda titik (·) menunjukkan asam amino yang identik, sedangkan kotak bergaris putus-putus menunjukkan perbedaan dominan dari asam amino PlnW asal L. plantarum U10.
16
Situs aktif dari PlnW diketahui berada pada bagian luar sel. Hal ini sejalan dengan hasil-hasil penelitian sebelumnya yang menyebutkan bahwa beberapa protein imunitas meskipun memiliki segmen hidrofobik yang membuat daerah tersebut berada di dalam membran, namun situs/domain aktif yang dimilikinya cenderung berada di luar sel ataupun berada pada daerah sitosol/intra sel (Quadri et al. 1995; Abel-Dayem et al. 1996; Eijsink et al. 1998).
Vektor Ekspresi Rekombinan
Gen plnW berukuran 687 pb yang telah teramplifikasi menggunakan primer spesifik berhasil disisipkan ke daerah multiple cloning site (MCS) pada vektor ekspresi pNZ8148, sehingga membentuk vektor rekombinan yang berukuran 3815 pb (Gambar 9). Ukuran DNA vektor yang tidak terlalu besar dapat mempermudah proses introduksi ke bakteri inang. Seleksi transforman menggunakan antibiotik klorampenikol dikarenakan vektor ekspresi dilengkapi dengan gen penyandi resisten kloramfenikol sebagai marka seleksi.
Gambar 9 (a) Amplifikasi gen plnW; (b) konfirmasi pemotongan vektor rekombinan dengan enzim NcoI dan HindIII; (c) peta vektor rekombinan
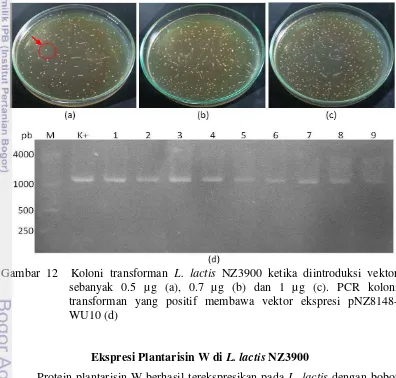
17 ini diimbangi dengan adanya dua titik awal replikasi (repA dan repC) yang mudah dikenali inang baik E. coli maupun L. lactis (de Ruyter et al. 1996). Koloni transforman yang tumbuh dijadikan cetakan PCR koloni. Hasil PCR koloni menunjukkan bahwa dari empat koloni tranforman yang tumbuh, hanya satu koloni yang positif membawa sisipan gen plnW. Vektor rekombinan pNZ8148-WU10 diisolasi dari koloni transforman pembawa gen plnW untuk kemudian konfirmasi kembali dengan PCR menggunakan vektor tersebut sebagai cetakan. Hasil transformasi E. coli MC1061 beserta validasinya dapat dilihat pada Gambar 10.
Gambar 10 Transformasi E. coli MC1061 (a), beserta konfirmasi transforman menggunakan PCR koloni (b), isolasi vektor rekombinan (c) dan PCR vektor rekombinan (d).
18
menyebabkan adanya penambahan dua asam amino (6 nukleotida) ketika proses translasi. Pengklonan pada situs NcoI memungkinkan adanya adaptasi urutan DNA dikarenakan titik awal translasi tidak dimulai dari gen, melainkan dari situs NcoI (CCATGG) sehingga urutan gen harus menyesuaikan dengan residu guanin (G) pada situs restriksi (Mierau dan Kleerebezem 2005).
Gambar 11 Analisis pengurutan gen plnW pada vektor pNZ8148-WU10, RBS : daerah pengikatan ribosom, * : kodon stop, 1 : titik awal transkripsi, Terminator : titik akhir transkripsi
Transformasi L. lactis NZ3900
Vektor rekombinan pNZ8148-WU10 diintroduksikan ke dalam bakteri inang L. lactis NZ3900 menggunakan teknik elektroporasi. Teknik ini digunakan dalam menyisipkan DNA asing ke dalam inang bakteri gram positif yang memiliki karakteristik struktur membran sel yang cukup tebal. Teknik elektroporasi ini mengaplikasikan tegangan listrik tinggi yang dilewatkan dalam waktu yang singkat, sehingga membentuk pori pada dinding/membran sel yang dapat tersisipi DNA asing (Rattanachaikunsopon dan Phumkachorn 2009).
Tabel 6 Optimasi transformasi L. lactis NZ3900 Jumlah Vektor
(µg)
Efisiensi Transformasi (CFU/µg DNA) 0.5
0.7 1.0
(1.3 x 103) ± 50 (4.3 x 103) ± 70 (7.2 x 103) ± 100
19 jumlah vektor yang lebih rendah akan berakibat pada menurunnya efisiensi transformasi. Sejalan dengan penelitian ini, hasil penelitian Zhang et al. (2012) juga menyebutkan bahwa konsentrasi DNA sebanyak 1 µg menghasilkan efisiensi transformasi yang optimum bagi BAL jenis L. acidophilus NCK105.
Penambahan sukrosa dan glisin dapat membantu proses transformasi menjadi lebih efisien. Selain sukrosa sebagai penstabil kondisi osmotik, glisin yang ditambahkan pada media pertumbuhan BAL diketahui dapat melemahkan membran sel bakteri inang dengan cara menghambat pembentukan ikatan silang yang akan memperkuat membran sel tersebut (Heravi et al. 2012). Dalam penelitian ini, digunakan sebanyak 2.5% glisin untuk melemahkan membran sel bakteri inang. Penggunaan glisin yang terlalu tinggi (lebih dari 8%) akan berdampak pada menurunnya efisiensi transformasi, dikarenakan memicu terjadinya autolisis bakteri (Kim et al. 2005).
Gambar 12 Koloni transforman L. lactis NZ3900 ketika diintroduksi vektor sebanyak 0.5 µg (a), 0.7 µg (b) dan 1 µg (c). PCR koloni transforman yang positif membawa vektor ekspresi pNZ8148-WU10 (d)
Ekspresi Plantarisin W di L. lactis NZ3900
20
Gambar 13 Profil SDS-PAGE dan zimogram protease dari plantarisin W Pada umumnya, tingkat ekspresi protein spesifik secara kualitatif dideteksi menggunakan teknik western blot. Western Blot atau immunoblot protein mendeteksi protein spesifik pada sampel berdasarkan kemampuan protein tersebut berikatan dengan antibodi (Mahmood dan Yang 2012). Dalam penelitian ini belum terdapat antibodi poliklonal maupun antibodi monoklonal yang secara spesifik dapat mengikat protein PlnW, sehingga proses deteksi protein dilakukan menggunakan zimogram protease. Zimografi merupakan suatu teknik elektroforesis protein (SDS-PAGE) yang dalam campuran gel pemisahnya ditambahkan substrat (misal: gelatin, casein, albumin, hemoglobin, dsb), sehingga aktivitas endo- ataupun eksopeptidase dari suatu protein dapat terlihat dalam bentuk zona hambat (d‟Avila-Levy et al. 2012). Berbeda dengan teknik SDS-PAGE pada umumnya, dalam analisis zimografi tidak dilakukan proses denaturasi protein sehingga aktivitas dari protein tersebut tidak hilang.
Tingkat ekspresi dari PlnW diukur secara kuantitatif melalui analisis konsentrasi protein yang menunjukkan ekspresi paling tinggi pada induksi 10 ng/mL nisin menghasilkan 1.55 ± 0.04 mg/mL protein. Aktifitas protease secara kuantitatif menunjukkan tingkat aktifitas yang cukup signifikan pada induksi 50 ng/mL, yaitu sebesar 2.22 ± 0.05 U/mL dengan aktivitas spesifik 1.65 ± 0.03 U/mg protein (Tabel 7).
Table 7 Konsentrasi protein dan aktivitas proteolitik PlnW
Sampel Total Protein
Vektor kosong merupakan pNZ8148 tanpa gen plnW
21 dari respon ini akan membentuk faktor transkripsi yang akan mengaktifkan promoter nisA sehingga proses transkripsi oleh RNA polimerase dapat berjalan (Sorvig et al. 2003). Bakteri L. lactis NZ3900 merupakan turunan dari L. lactis MG1363 yang diketahui tidak memiliki gen penghasil nisin (Kunji et al. 2003). Adapun terdapatnya pita protein target pada sampel non-induksi, diduga karena adanya aktivitas basal yang menyebabkan gen plnW terekspresi meskipun tanpa adanya induksi nisin. Hal ini telah dibuktikan pada penelitian Sorvig et al. (2003) bahwa sistem ekspresi NICE seringkali menunjukkan aktivitas ekspresi basal (tanpa adanya induksi) ketika diekspresikan pada Lactobacillus.
Selain mengatur dosis nisin yang diberikan, beberapa cara lain dapat digunakan untuk meningkatkan level ekspresi suatu gen, diantaranya dengan mengganti promoter yang bersifat inducible dengan konstitutif, selain itu dapat pula dilakukan optimasi penggunaan kodon. Salah satu promoter konstitutif yang umum digunakan dalam ekspresi pada inang BAL adalah promoter surface layer protein (PslpA) dari Lactobacillus brevis, dimana telah diketahui dapat
meningkatkan level ekspresi sebesar 28% terhadap protein aminopeptidase N (Diep et al. 2009b). Salah satu karakteristik L. lactis yang berperan dalam sistem ekspresi heterolog adalah pemanfaatan kodon. DNA kromosom L. lactis memiliki kandungan basa guanin (G) dan sitosin (C) yang relatif kecil, yaitu antara 35-37%, sehingga gen dari organisme pendonor yang memiliki kekerabatan dekat dengan inang ekspresi heterolog akan lebih mudah terekspresi dikarenakan karakteristik kandungan basa GC yang relatif sama (Kunji et al. 2003).
Imunitas Plantarisin W terhadap Bakteriosin
22
5
SIMPULAN DAN SARAN
Simpulan
Gen penyandi Plantarisin W (plnW) dari L. plantarum U10 asal pangan tempoyak memiliki tingkat homolog sebesar 99% dengan gen plnW asal L. plantarum C11 dan L. plantarum ST-III. Gen plnW berhasil diklon kedalam pNZ8148 dan diekspresikan pada L.lactis sebagai protein dengan bobot molekul 25.3 kDa. Ekspresi maksimum diperoleh dengan induksi nisin konsentrasi 10 ng/mL. Protein PlnW mempunyai aktivitas proteolitik tertinggi secara kualitatif dan kuantitatif ketika diinduksi nisin konsentrasi 50 ng/mL. PlnW juga memiliki aktivitas proteolitik dan imunitas. Aktivitas imunitas PlnW bekerja pada plantarisin dan bakteriosin lain seperti pediosin, fermentsin, dan acidosin sebagai sistem resistensi silang.
Saran
DAFTAR PUSTAKA
Abel-Dayem M, Fleury Y, Devilliers G, Chaboisseau E, Girrard R, Nicolas P, Delfour A. 1996. The putative immunity protein of the gram-positive bacteria Leuconostoc mesenteroides in preferentially located in the cytoplasm compartment. FEMS Microbiol. Lett. 138: 251-259
Balciunas EM, Martinez FAC, Todorov SD, Franco BDGM, Converti A, Oliveira RPS. 2013. Novel biotechnological applications of bacteriocins: a review. Food Control 32(1): 134-142
Bodaszewska-Lubas M, Brzychczy-Wloch M, Goslewski T, Heczko PB. 2012. Antibacterial activity of selected standard strains of lactic acid bacteria producing bacteriocins – pilot study. Postepy. Hig. Med. Dosw. 66: 787-794
Braat H, Rottiers P, Hommes DW, Huyghebaert N, Remaut E, Remon JP, van Deventer SJ, Neirynck S, Peppelenbosch MP, Steidler L. 2006. A phase I trial with transgenic bacteria expressing interleukin-10 in Crohn‟s disease. Clin. Gastroenterol. Hepatol. 4: 754-759
Bron PA, Marco M, Hoffer SM, van Mullekom E, de Vos WM, Kleerebezem M. 2004. Genetic characterization of the bile salt response in Lactobacillus plantarum and analysis of responsive in vitro and in situ in the gastrointestinal tract. J. Bacteriol. 186(23): 7829-7835
Burrus V, Waldor MK. 2005. Shaping bacterial genomes with integrative and conjugative elements. Res. Microbiol. 155: 376-386
Butcher BG, Helmann JD. 2006. Identification of Bacillus subtilis σW-dependent genes that provide intrinsic resistance to antimicrobial compounds produced by Bacili.Mol. Microbiol. 60: 765-782
Calo-Mata P, Arlindo S, Boehme K, Miguel T, Pascoal A, Barros-Velazquez J. 2008. Current applications and future trends of lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food product. Food Bioprocess Tech. 1: 43-63
Cavanagh D, Fitzgerald GF, McAuliffe O. 2015. From field to fermentation: the origins of Lactococcus lactis and its domestication to dairy environment. Food Microbiol. 47: 45-61
Choudhuri S. 2014. Bioinformatics for Beginners: genes, genomes, molecular evolution, database and analytical tools. UK: Elsevier
Cotter PD, Hill C, Ross RP. 2005. Bacteriocins: developing innate immunity for food. Nat. Rev. Microbiol. 3: 777-788
d‟Avila-Levy C, Santos ALS, Cuervo P, de Jesus JB, Braquinha MH. 2012. Application of Zymography (Substrate-SDS-PAGE) for Peptidase Screening in a Post-Genomic Era. Di dalam: Magdeldin S, editor. Gel Electrophoresis-Advanced Techniques. Rijeka (HR): InTech Europe. Hlm 265-288
25 Diep DB, Havarstein LS, Nes IF. 1996. Characterization of the locus responsible for the bacteriocin production in Lactobacillus plantarum C11. J. Bacteriol. 178: 4472-4483
Diep DB, Straume D, Kjos M, Torres C, Nes IF. 2009a. An overview of the mosaic bacteriocin pln loci from Lactobacillus plantarum. Peptides 30: 1562-1574
Diep DB, Mathiesen G, Eijsink VGH, Nes IF. 2009b. Use of Lactobacilli and their pheromone-based regulatory mechanism in gene expression and drug delivery. Curr. Pharm. Biotechnol. 10: 62-73
Drider D, Fimland G, Heehard Y, McMullen LM, Prevost H. 2006. The continuing story of class IIa bacteriocins. Microbiol. Mol. Biol. Rev. 70: 564-582
Duan K, Dunn NW, Kim WS. 1999. Rapid plasmid DNA isolation from Lactococcus lactis using overnight cultures. Biotechnol. Techniques. 13: 519-521
Eijsink VGH, Skeie M, Middlehoven PH, Brurberg MB, Nes IF. 1998. Comparative studies of class IIa bacteriocins of lactic acid bacteria. Appl. Environ. Microbiol. 63: 4321-4330
Enyard CC. 2009. Sigma's non-specific protease activity assay - casein as a substrate. J. Vis. Exp. 17: 899
Ghrairi T, Chaftar N, Hani K. 2012. Bacteriocins: recent advances and opportunities. Prog. Food Preserv. 1: 485-511
Hammes WP, Vogel RF. 1995. The genus Lactobacillus. Di dalam: Wood BJN, editor. The Genera of Lactic Acid Bacteria. New York (US): Chapman & Hall. Hlm 19-54.
Havarstein LS, Diep DB, Nes IF. 1995. A family of bacteriocin ABC transporter carry out proteolytic processing of their substrates concomitant with export. Mol. Microbiol. 16: 229-240
Heng NCK, Wescombe PA, Burton JP, Jack RW, Tagg JR. 2007. The diversity of bacteriocins in gram-positive bacteria. Di dalam: Riley MA, Chavan MA, editor. Bacterions: Ecology and Evolution. New York (US): Springer. hlm 45-83.
Heravi RM, Nasiraii R, Sankian M, Kermanshahi H, Varasteh AR. 2012. Optimization and Comparison of two electrotransformation methods for lactobacilli. Biotechnol. 11: 50-54
Holo H, Nes IF. 1995. Transformation of Lactococcus by electroporation. Methods Mol. Biol. 47: 195-199
Kjos M, Borrero J, Opsata M, Birri DJ, Holo H, Cintas LM, Snipen L, Hernandez PE, Nes IF, Diep DB. 2011. Target recognition, resistance, immunity and genome mining of class II bacteriocins from gram-positive bacteria. Microbiol. 157: 3256-3267
Kjos M, Snipen L, Salchian Z, Nes I F, Diep DB. 2010. The abi proteins and their involvement in bacteriocin self-immunity. J. Bacteriol. 8: 2068-2076 Kim YH, Han KS, Oh S, You S, Kim SH. 2005. Optimization of technical
conditions for the transformation of Lactobacillus acidophilus strains by electroporation. J. Appl. Microbiol. 99: 167-174
26
Kunji ERS, Slotboom D, Poolman B. 2003. Lactococcus lactis as host for overproduction of functional membrane proteins. Biochim. Biophys. Acta 1610: 97-108
Kusdianawati, Mustopa AZ, Suharsono, Budiarto BR, Fatimah, Danuri H. 2015. Construction, expression and purification of recombinant pre-mature peptide of plantaricin f from Lactobacillus plantarum S34 in Escherichia coli. IJAS 16(1): 31-38
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-685
Lv WH, Cong W, Cai ZL. 2004. Nisin production by Lactococcus lactis subsp lactis under nutritional limitation in fed-batch culture. Biotechnol. Lett. 26: 235-238
Machielsen R, van Alen-Boerrigter IJ, Koole LA, Bongers RS, Kleerebezem M, van Hylckama-Vlieg JE. 2010. Indigenous and environmental modulation of frequencies of mutation in Lactobacillus plantarum. Appl. Environ. Microbiol. 76: 1587-1595
Mahmood T, Yang P. 2012. Wstern blot: technique, theory, and trouble shooting. North Am. J. Med. Sci. 4: 429-434
Martin M, Gutierrez J, Criado R, Herranz C, Cintas LM, Hernandez PE. 2007. Cloning, production and expression of the bacteriocin enterocin A produced by Enterococcus faecium PLBC21 in Lactococcus lactis. Appl. Microbiol. Biotechnol. 76: 667-675
Martinez FAC, Balciunas EM, Salgado JM, Dominguez Gonzales JM, Converti A, Oliveira RPS. 2013. Lactic acid properties, applications and production: a review. Trends Food Sci. Tech. 30: 70-83
Mayo B, Aleksandrzak-Piekarczyk T, Fernandez M, Kowalczyk M, Alvares-Martin P, Bardowski J. 2010. Updates in metabolism of lactic acid bacteria. Di dalam: Mozzi F, Raya RR, editor. Biotechnology of Lactic Acid Bacteria: Novel applications. Iowa (US): Wiley-Blackwell. hlm 3-33. Mierau I, Kleerebezem M. 2005. 10 years of the nisin-controlled gene expression
system (NICE) in Lactococcus lactis. Appl. Microbiol. Biotechnol. 68: 705-717
Mironczuk AM, Krasowka A, Murzyn A, Plachetka M, Lukaszewicz M. 2012. Production of the Bacillus licheniformis SubC protease using Lactococcus lactis NICE expression system. SpringerPlus, 1, 54
Mustopa AZ, Fatimah. 2014. Diversity of lactic acid bacteria isolated from Indonesian traditional fermented foods. Microbiol. Indones. 8: 48-57 Nes IF, Diep DB, Havarstein LS, Brurberg MB, Eijsink V, Holo H. 1996.
Biosynthesis of bacteriocins in lactic acid bacteria. Antonie van Leeuwenhoek 70: 113-128
Pal G, Sheela S. 2013. Cloning and heterologous expression of plnE, -F, -J and – K genes derived from soil metagenome and purification of active plantaricin peptides. Appl. Microbiol. Biotechnol. 98:1441–1447
27 Pei J, Mitchell DA, Dixon JE, Grishin NV. 2011. Expansion of type II CAAX protease reveals evolutionary origin of -secretase subunit APH-1. J. Mol. Bio. 410: 18-26
Prins WA, Botha M, Botes M, Kwaadsteniet M, Endo A, Dicks LMT. 2010. Lactobacillus plantarum 24, isolated from the marula fruit (Sclerocarya birrea), has probiotic properties and harbors genes encoding the production of three bacteriocins. Curr. Microbiol. 61: 584-589
Quadri LE, Sailer M, Terebiznik MR, Roy KL, Vederas JC, Stiles ME. 1995. Characterization of the protein conferring immunity to the antimicrobial peptide carnobacteriocin B2 and expression of carnobacteriocin B2 and BM1. J. Bacteriol. 177: 1144-1151
Ra R, Beerthuyzen MM, de Vos WM, Saris PE, Kuipers OP. 1999. Effects of gene disruptions in the nisin gene cluster of Lactococcus lactis on nisin production and producer immunity. Microbiol. 145: 1227-1233
Rattanachaikunsopon P, Phumkhachorn P. 2009. Glass bead transformation method for gram-positive bacteria. Braz. J. Microbiol. 40: 923-926
Richard C, Canon R, Naghmouchi K, Bertrand D, Prevost H, Drider D. 2006. Evidence on correlation between number of disulfide bridge and toxicity of class IIa bacteriocins. Food Microbiol., 23: 175-183
Sambrook J, Fritsch FF, Maniatis T. 1989. Molecular Cloning: a laboratory manual, 2nd ed. New York (US): Cold Spring Harbor Laboratory Press Sedgley CM, Clewell DB, Flannagan SE. 2009. Plasmid pAMS1-encoded,
bacteriocin-related “Siblicide” in Enterococcus faecalis. J. Bacteriol. 191: 3183–3188
Siezen RJ, van Hylckama Vlieg JET. 2011. Genomic diversity and versatility of Lactobacillus plantarum, a natural metabolic engineer. Microb. Cell Fact. 10(1): 1-13 lactis nisin immunity genes nisI and nis FEG after coordinated expression in the surrogate host Bacillus subtilis. J. Biol. Chem. 278: 89-94
Straume D, Axelsson L, Nes IF, Diep DB. 2006. Improved expression and purification of the correctly folded response regulator PlnC from lactobacilli. J. Microbiol. Methods. 67: 193-201
Todorov SD, Franco BGM. 2010. Lactobacillus plantarum: characterization of species and application in food production. Food Rev. Int. 26: 205-229 Todorov SD, LeBlanc JG, Franco BDGM. 2012. Evaluation of the probiotic
potencial and effect of encapsulation on survival for Lactobacillus plantarum ST16Pa isolated from papaya. World J. Microb. Biot. 28: 973-984
Todorov SD. 2009. Bacteriocins from Lactobacillus plantarum: production, genetic organization and mode of action. Braz. J. Microbiol. 40: 209-221 Tsapieva A, Duplik N, Suvorov A. 2011. Structure of plantaricin locus of
28
Urnemi, A. Zaenal M., M. Ridwan. 2010. Potensi bakteri asam laktat dari lempok durian dalam menghasilkan bakteriosin sebagai biopreservatif pangan. Di dalam: Hernaman I, Tanuwiria UH, Hendronoto A, Yurmiati LH, Sulistyati M, Hidayati YA, Herlina L, Indrijani H, Sujana E, Putranto WS, Islami RZ, Widiawati Y, Sofjan O, Syamsul JA, editor. Sistem Produksi Berbasis Ekosistem Lokal. Seminar Nasional Peternakan Berkelanjutan; 2010 November 4; Bandung, Indonesia. Bandung (ID):Universitas Padjajaran. hlm 679-685.
Van Reenen CA, van Zyl WH, Dicks MT. 2006. Expression of the immunity protein of plantaricin 423, produced by Lactobacillus plantarum 423, and analysis of the plasmid encoding the bacteriocin. Appl. Environ. Microbiol.72(12): 7644-7651
Venema K, Haverkort RE, Abee T, Haandrikman AJ, Leenhouts KJ, de Leij L, Venema G, Kok J. 1994. Mode of action of LciA, the lactococcin A immunity protein Mol. Microbiol. 14: 521-532
Wu C, Zhang J, Du G, Chen J. 2013. Heterologous expression of Lactobacillus casei RecO improved the multiple-stress tolerance and lactic acid production in Lactococcus lactis NZ9000 during salt stress. Bioresour. Technol. 143: 238-241
Yuliana N, Garcia VV. 2009. Influence of Pediococcus acidilactici as a starter on the flavor of tempoyak (fermented durian). Indian J. Biotechnol. 8: 304-310
30
Lampiran 1 Komposisi media pertumbuhan de Man, Rogosa, Sharpe (MRS)
Pepton 10 g/L
Bubuk „Lab-Lemco‟ 8 g/L Ekstrak khamir 4 g/L Sorbitan mono-oleat 1 mL Di-potassium hidrogen fosfat 2 g/L Sodium asetat 5 g/L Tri-ammonium sitrat 2 g/L Magnesium sulfat 0.2 g/L Mangan sulfat 0.05 g/L
Lampiran 2 Komposisi media pertumbuhan Luria-Bertani (LB)
Tripton 10 g/L
Ekstrak khamir 5 g/L Sodium klorida 10 g/L
Lampiran 3 Komposisi media pertumbuhan M17
Tripton 5 g/L
Pepton soya 5 g/L
Meat digest 5 g/L
Ekstrak khamir 2.5 g/L
Asam askorbat 5 g/L
31 Lampiran 4 Komposisi larutan dalam SDS-PAGE
Medium dan larutan-larutan Bahan-bahan
Larutan gel separating 10% H2O 6.25 ml 1,5 M Tris-Cl pH 8,8
containing 0.4% SDS 3.75 ml
30% Akrilamid 5 ml
10% Amonium Persulfat 0.05 ml
TEMED 0.01 ml
Larutan gel stacking 3.9% H2O 3.05 ml 0,5 M Tris-Cl pH 6,8
containing 0.4% SDS 1.25 ml
30% Akrilamid 0.65 ml
10% Amonium Persulfat 0.025 ml
TEMED 0.005 ml
Buffer sampel SDS 2X (Loading Dye)
4x Tris Cl/SDS pH 6,8 25 ml
Gliserol 20 ml
SDS 4 g
- mercaptoethanol 2 ml
Bromphenol blue 1 mg
H2O 53 ml
Commasie Blue G-250 Staining Solution (500 ml)
45% H2O 225 ml 45% Metanol 225 ml
10% Asam asetat glacial 50 ml
0,05%Commasie brilliant
blue 250 mg Commasie Blue G-250
Destaining Solution (1000 ml)
50% H2O 500 ml 10% Asam asetat glacial 100 ml
32
Lampiran 5 Kurva standar BSA
33 Lampiran 7 Skor hydrophaty dari asam amino
34
36
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, 27 April 1989 sebagai anak pertama dari dua bersaudara. Penulis melanjutkan kuliah S1 tahun 2008 pada Program Studi Teknologi Hasil Perairan di Institut Pertanian Bogor (IPB). Selama masa kuliah S1 penulis aktif dalam berorganisasi, diantaranya sebagai staf salah satu komisi di Dewan Perwakilan Mahasiswa. Penulis beberapa kali mengikuti program kreatifitas mahasiswa (PKM) yang diselenggarakan oleh Direktorat Jendral Pendidikan Tinggi, dan pada tahun 2011 lolos hingga tingkat nasional sebagai finalis Pekan Ilmiah Mahasiswa (Pimnas) di Universitas Hasanudin Makassar.