KARAKTERISTIK MIKROKAPSUL Lactobacillus plantarum
DAN STABILITAS DALAM SELAI SALAK SELAMA
PENYIMPANAN
NURWULAN PURNASARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Karakteristik Mikrokapsul Lactobacillus plantarum dan Stabilitas dalam Selai Salak Selama Penyimpanan adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
RINGKASAN
NURWULAN PURNASARI. Karakteristik Mikrokapsul Lactobacillus plantarum dan Stabilitas dalam Selai Salak Selama Penyimpanan. Dibimbing oleh Sri Laksmi Suryaatmadja dan Lilis Nuraida
Salah satu pangan fungsional yang mengalami peningkatan di pasar global adalah probiotik. Pemanfaatan probiotik pada pangan berbasis non susu dengan memanfaatkan sumber daya lokal belum banyak berkembang. Sumberdaya lokal seperti buah tropis salah satunya adalah salak yang dapat dikembangkan sebagai pangan fungsional probiotik berbasis buah. Beberapa strain probiotik unggul yang sudah diperoleh antara lain adalah Lactobacillus plantarum BSL, Lactobacillus plantarum 2C12 yang merupakan hasil isolasi dari sumber daya lokal (fermentasi kubis dan daging sapi). Masalah yang dihadapi dalam pengembangan pangan probiotik adalah bahwa proses pengolahan produk pangan dan kondisi penyimpanan akan menurunkan ketahanan probiotik. Teknik mikroenkapsulasi diketahui mampu menyediakan perlindungan fisik bagi probiotik terhadap kondisi lingkungan. Salah satu teknik yang dapat diterapkan adalah teknik emulsi.
Penelitian ini bertujuan : (1) mengetahui pengaruh mikroenkapsulasi probiotik dengan teknik emulsi terhadap sintasan dan karakteristik probiotik, (2) mengetahui suhu optimum penambahan probiotik pada selai salak, (3) mengetahui pengaruh enkapsulasi terhadap viabilitas Lb. plantarum selama penyimpanan selai salak.
Tahap pertama penelitian ini adalah aplikasi teknik mikroenkapsulasi pada isolat probiotik. Strain probiotik yang digunakan adalah Lb. plantarum BSL dan Lb. plantarum 2C12. Teknik mikroenkapsulasi yang diterapkan adalah teknik emulsi dengan menggunakan alginat 3%. Evaluasi meliputi uji sintasan, uji ketahanan panas, uji ketahanan terhadap garam empedu dan pH rendah serta uji aktivitas antimikroba terhadap E. coli ATCC 25922, Salmonella typhii ATCC 14028, S. aureus ATCC 25923, S. cereviseae ATCC 9763, serta Aspergillus niger. Tahap kedua adalah aplikasi probiotik pada selai salak pada beberapa suhu yaitu 50, 60, 70 0C. Jenis salak yang digunakan adalah salak pondoh (Salacca edulis) yang diperoleh dari pasar sekitar Dramaga. Pada saat akhir proses pembuatan, mikrokapsul probiotik ditambahkan pada produk. Evaluasi meliputi uji sintasan serta sifat fisik (aw, pH) dari selai yang dihasilkan. Tahap ketiga
meliputi pengaruh penyimpanan suhu ruang selama 4 minggu terhadap sintasan probiotik. Evaluasi meliputi uji viabilitas probiotik dan kapang serta khamir serta aw dan pH produk.
probiotik pada selai salak dilakukan pada suhu pemaparan terendah yaitu 500C. Teknik mikroenkapsulasi juga meningkatkan secara nyata (P<0.05) ketahanan probiotik terhadap garam empedu 0.5% serta pH rendah (pH 2) dibandingkan dengan probiotik bebas. Kedua strain Lb. plantarum terenkapsulasi terbukti mampu menghambat pertumbuhan bakteri E. coli, Salmonella typhii dan S. aureus, namun tidak mampu menghambat pertumbuhan S. cereviseae dan Aspergillus niger.
Bakteri probiotik terenkapsulasi pada selai salak memperlihatkan viabilitas yang lebih baik dibanding sel bebas selama penyimpanan suhu kamar 4 minggu, dimana keseluruhan sel bebas sudah tidak terdeteksi pada penyimpanan 2 minggu. Pada akhir penyimpanan 4 minggu total kapang khamir yang terdeteksi pada semua selai dengan berbagai perlakuan masih dibawah 2 log cfu g-1. Perubahan aw
dan pH selai salak kontrol tanpa penambahan probiotik hampir sama dengan selai salak dengan penambahan kedua strain Lb. plantarum bebas maupun terenkapsulasi. Hasil penelitian menunjukkan bahwa mikroenkapsulasi probiotik dengan metode emulsi dapat diaplikasikan sebagai teknik perlindungan bagi sel probiotik dari kondisi lingkungan dan kondisi penyimpanan di dalam produk pangan berbasis buah selama 4 minggu.
SUMMARY
NURWULAN PURNASARI. Microcapsule Characteristics of
Lactobacillus plantarum and Its Stability in Snake Fruit Jam During Storage. Under direction of Sri Laksmi Suryaatmadja and Lilis Nuraida
Modern consumers expect their food to be healthy and to prevent illness. Therefore the demand of functional food including probiotic products growing significantly. Functional foods containing probiotic bacteria generally are dominated by milk-based foods. Recently, the incorporation of probiotic bacteria in various food products especially fruit-based products have been studied. Probiotic strains in this research had been isolated from saurkraut (Lb. plantarum BSL) and beef (Lb.plantarum 2C12). Many reports indicated that there were poor survival of probiotic bacteria in food products containing free probiotic cells. Providing probiotic living cells with a physical barrier such as microencapsulation to resist adversed effect of environmental conditions is therefore an approach currently receiving considerable interest.
The objectives of the study were 1) to evaluate the effect of Lb. plantarum microencapsulation by emulsion technique toward the resistancy to heat, injured cell, low pH (2.0) and bile salt (0.5%) and its antimicrobial activity. 2) to determine the most suitable temperature for incorporation probiotic into snake fruit jam. 3) to study the viability of free and encapsulated Lb. plantarum in snake fruit jam, total yeast mold, pH changes and water activity during room storage.
The first stage of this study was microencapsulation of probiotics by emulsion method with sodium alginate as encapsulanting material. Characterization of the encapsulated probiotic were conducted including resistance to heat, injured cell, low pH and bile salt resistance, antimicrobial activity againts E. coli ATCC 25922, Salmonella typhii ATCC 14038, S. aureus ATCC 25923, S. cereviseae ATCC 9763 and Aspergillus niger. The second stage was incorporating the encapsulated probiotic into snake fruit jam. The most suitable temperature for incorporate based on the result of heat resistance.The last stage was evaluation of the probiotic viability in snake fruit jam during storage in room temperature for 4 weeks.
The results showed that high survival number (11 log cfu g-1) of both Lb. plantarum strains were achieved after encapsulation. Heat resistance of the encapsulated strains at 50oC was better than their free cells, but the higher the temperature applied the lower the number of survivors would be. Heating at 70oC was more detrimental to all encapsulated probiotics with a decrease of more than 5 log cell numbers. Heating at 50o-70oC caused injury to all probiotics cells. Encapsulation probiotics also showed significantly higher survival (P<0.05) in bile salt (0.5%) and low pH (pH 2) treatments compared to their free cells. All encapsulated Lactobacillus strains could inhibit the growth of E. coli, Salmonella typhii and S. aureus as well as their free cells, but none of them could inhibit S. cereviseae and Aspergillus niger.
that microencapsulated probiotic prepared by emulsion method is suitable to be incorporated in snake fruit jam and provided good stability during 4 weeks of storage at room temperature.
©Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
KARAKTERISTIK MIKROKAPSUL Lactobacillus plantarum
DAN STABILITAS DALAM SELAI SALAK SELAMA
PENYIMPANAN
NURWULAN PURNASARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Departemen Ilmu dan Teknologi Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Penelitian : Karakteristik Mikrokapsul Lactobacillus plantarum dan : Stabilitas dalam Selai Salak Selama Penyimpanan
Nama : Nurwulan Purnasari
NIM : F251120171
Disetujui oleh Komisi Pembimbing
Prof. Dr.Ir Sri Laksmi Suryaatmadja, MS Prof. Dr. Lilis Nuraida M.Sc
Ketua Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr.Ir. Ratih Dewanti-Hariyadi, M.Sc Dr.Ir. Dahrul Syah, M. Sc. Agr
PRAKATA
Puji syukur kehadirat Allah SWT atas karuniaNya sehingga penulis bisa menyelesaikan karya ini. Tema yang diambil dalam penelitian ini adalah Karakteristik Mikrokapsul Lactobacillus plantarum dan Stabilitas Dalam Produk Selai Salak Selama Penyimpanan.
Pada kesempatan kali ini penulis ingin menyampaikan terimakasih kepada: 1. Prof. Dr. Ir. Sri Laksmi Suryaatmadja, MS dan Prof. Dr. Lilis Nuraida, M.Sc selaku pembimbing atas arahan, ilmu dan motivasi selama awal hingga akhir proses penelitian ini.
2. DIKTI yang telah membiayai penelitian ini melalui program Hibah Kompetensi dengan judul ‘Pengembangan Pangan Probiotik Berbasis
Buah Tropis Menggunakan Bakteri Asam Laktat Lokal Terenkapsulasi’ yang
diterima oleh Prof. Dr. Ir. Sri Laksmi Suryaatmadja MS, Prof. Dr. Lilis Nuraida M.Sc, Dr. Dra Suliantari, MS serta membiayai studi penulis melalui program Beasiswa Unggulan.
3. Dr. Nur Wulandari, S.TP, M.Si atas kesediaannya menguji penulis dan memberikan masukan demi sempurnanya tesis ini.
4. Suami Iman Sabarisman dan putra Muhammad Rayhan atas dukungan dan perhatian selama penulis menjalani studi dan penelitian.
5. Orangtua dan mertua karena atas doa dan ridha mereka penulis mampu menyelesaikan studi dan penelitian ini.
6. Patner penelitian, Anis Usfah dan Rina Ningtyas yang setia menjadi teman dalam suka duka selama penelitian.
Selain itu tak lupa penulis sampaikan terimakasih kepada para sahabat, Laboran, teman-teman IPN 2012 serta pihak pihak yang tidak bisa penulis sebutkan satu persatu atas dukungannya selama ini. Akhir kata semoga penelitian ini bermanfaat demi perkembangan ilmu pengetahuan.
Bogor, Juni 2015
DAFTAR ISI
RINGKASAN ... ii
PRAKATA ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 2
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Salak ... 4
Selai ... 5
Probiotik ... 6
Mikroenkapsulasi ... 9
METODE PENELITIAN ... 12
Tahapan Penelitian ... 12
Waktu dan Tempat Penelitian ... 13
Bahan dan Alat ... 13
Preparasi Kultur Mikroorganisme (Harmayani et al. 2001) ... 13
Mikroenkapsulasi (Mandal et al. 2005) ... 13
Aplikasi Probiotik pada Pengolahan Buah Salak menjadi Selai Salak ... 14
Penyimpanan Produk Selai Salak ... 15
Prosedur Analisis ... 15
Uji sintasan probiotik bebas dan terenkapsulasi (Gebara et al. 2013) ... 15
Sel Cedera (Injured cell) Setelah Pemanasan (Golowczyc et al. 2010) ... 15
Ketahanan Terhadap Panas (Mandal et al. 2005) ... 15
Uji Sifat Antimikroba dari Probiotik Bebas dan Probiotik Terenkapsulasi
(Sahputra 2012) ... 16
Uji Ukuran dan Bentuk Mikrokapsul ... 17
Uji kapang dan khamir (Fardiaz 1992) ... 17
Metode Analisis ... 17
Analisis Rendemen Enkapsulasi ... 17
Perhitungan Koloni (BAM 2001) ... 17
Pengukuran aw dan pH selai salak probiotik (BSN 1992) ... 18
Analisis Data ... 19
HASIL DAN PEMBAHASAN ... 20
Karakteristik Fisik Mikrokapsul ... 20
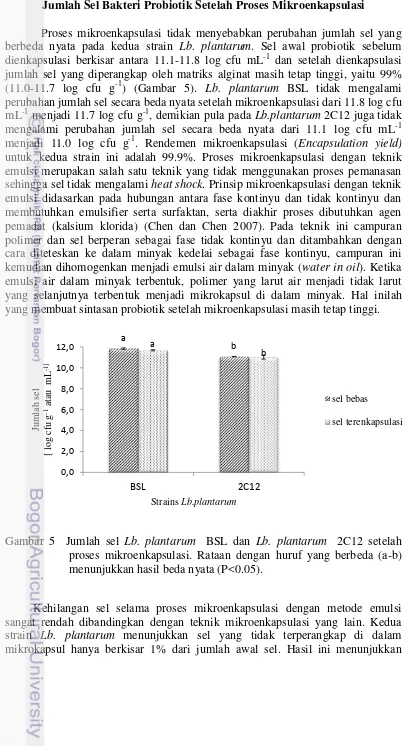
Jumlah Sel Bakteri Probiotik Setelah Proses Mikroenkapsulasi ... 22
Pengaruh Mikroenkapsulasi Terhadap Sifat Probiotik ... 23
Ketahanan Lb. plantarum Terhadap Panas ... 23
Sel Cedera (Injured cell) Setelah Pemanasan ... 25
Ketahanan Strain Lb. plantarum Terhadap Garam Empedu (0.5%) ... 27
Ketahanan Strain Lb. plantarum Terhadap pH Rendah (pH 2)... 28
Stabilitas Bakteri Probiotik Dalam Produk Selai Salak Selama Penyimpanan Suhu Kamar ... 32
Survival bakteri probiotik dalam selai salak ... 32
Total Kapang Khamir Selai Salak Selama Penyimpanan ... 33
Perubahan pH dan aw Selai Salak Selama Penyimpanan ... 35
SIMPULAN DAN SARAN... 38
RIWAYAT HIDUP ... 52
DAFTAR TABEL
Tabel 1. Kandungan Nilai Gizi dalam 100g Buah Salak ... 4Tabel 2. Batas Maksimum Cemaran Mikroba dan Kimia dalam Makanan ... 6
Tabel 3. Ketahanan Lb. plantarum Terhadap Pemanasan ... 24
Tabel 4. Jumlah dan Penghambatan E. coli ATCC 25922 pada Uji Kompetisi dengan Strain Lb. plantarum ... 31
Tabel 5. Perubahan pH Selai Salak Selama Penyimpanan Suhu Kamar ... 35
DAFTAR GAMBAR
Gambar 1. Skema Kegiatan Penelitian ... 12
Gambar 2. Skema Pembuatan Selai Salak ... 14
Gambar 3. Bentuk Mikroskopis Mikrokapsul strain Lb. plantarum (perbesaran 20x) ... 20
Gambar 4. Sebaran Ukuran Mikrokapsul strain Lb.plantarum ... 21
Gambar 5. Jumlah sel Lb. plantarum BSL dan Lb. plantarum 2C12 Setelah Proses Mikroenkapsulasi ... 22
Gambar 6. Efek mikroenkapsulasi terhadap penurunan jumlah sel Lb. plantarum BSL dan Lb. plantarum 2C12.. ... 23
Gambar 7. Pengaruh Suhu pemanasan dan Mikroenkapsulasi Terhadap Jumlah Sel Cedera Lb. plantarum ... 26
Gambar 8. Penurunan Jumlah Sel Strain Lb. plantarum Bebas dan Terenkapsulasi Terhadap Garam Empedu (0.5%) ... 28
Gambar 9. Penurunan Jumlah Sel Strain Lb. plantarum Bebas dan Terenkapsulasi Terhadap pH Rendah (pH 2) ... 29
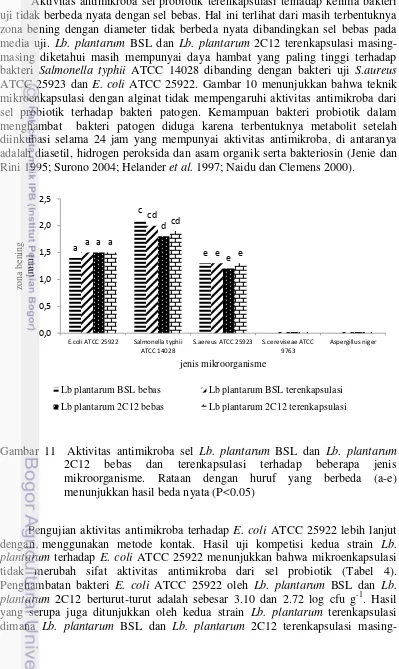
Gambar 10. Aktivitas Antimikroba Sel Lb. plantarum BSL Dan Lb. plantarum 2C12 Bebas dan Terenkapsulasi Terhadap Beberapa Jenis Mikroorganisme ... 30
Gambar 11. Pengaruh Enkapsulasi Terhadap Jumlah Sel Lb. Plantarum Pada Selai Salak Selama Penyimpanan Suhu Kamar ... 32
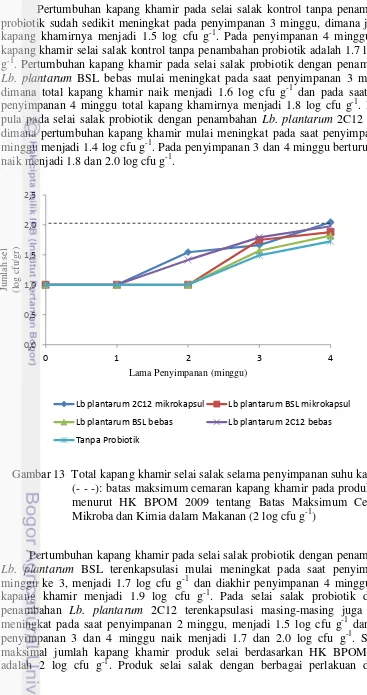
Gambar 12. Total Kapang Khamir Selai Salak Selama Penyimpanan Suhu Kamar ... 34
DAFTAR LAMPIRAN
Lampiran 1 Bentuk mikrokapsul dengan teknik emulsi ... 45Lampiran 2 Bentuk mikrokapsul dibawah mikroskop cahaya (a) dan mikroskop okuler (b) ... 45
Lampiran 3 Hasil pengukuran kadar air ... 45
Lampiran 4 Hasil pengukuran kadar gula ... 46
Lampiran 5 Rendemen enkapsulasi (RE) dengan teknik emulsi... 46
Lampiran 6 Ketahanan probiotik terhadap pemanasan suhu 50 oC ... 46
Lampiran 7 Ketahanan probiotik terhadap pemanasan suhu 60 oC ... 47
Lampiran 8 Ketahanan probiotik terhadap pemanasan suhu 70 oC ... 47
Lampiran 9 Sel cedera setelah pemanasan ... 47
Lampiran 10 Hasil analisis statistik pengujian ketahanan probiotik terhadap pH rendah 47 Lampiran 11 Hasil analisis statistik pengujian ketahanan probiotik terhadap garam empedu ... 48
Lampiran 12 Hasil analisis statistik aktivitas antimikroba terhadap beberapa jenis mikroba ... 48
Lampiran 13 Hasil analisis statistik perubahan pH dan aw selai salak selama penyimpanan ... 49
PENDAHULUAN
Latar Belakang
Konsumsi produk pangan fungsional di masyarakat meningkat seiring kesadaran masyarakat akan pentingnya kesehatan. Salah satu komponen pangan fungsional yang mengalami peningkatan adalah produk pangan probiotik. Pasar global untuk probiotik secara keseluruhan mencapai US $ 14.9 milyar pada tahun 2007 dan mencapai US $ 16 milyar pada tahun 2008, dan dengan pertumbuhan sebesar 4.3%, diperkirakan target penjualan pada tahun 2013 mencapai US $ 19.6 milyar (Rahayu 2011). Namun hingga saat ini, produk probiotik masih didominasi oleh produk berbasis susu seperti yakult, yoghurt, susu formula, es krim dan keju.
Probiotik didefinisikan sebagai mikroba hidup yang dikonsumsi oleh manusia atau hewan dalam jumlah yang cukup, mampu hidup dan melewati kondisi lambung dan saluran pencernaan serta bermanfaat bagi sel inangnya dengan cara meningkatkan kesehatan bagi inangnya (FAO/WHO 2002). Mikroba probiotik umumnya berasal dari bakteri asam laktat (BAL). Probiotik memiliki berbagai fungsi kesehatan antara lain sebagai pencegah diare, mengurangi kejadian lactose intolerance, serta meningkatkan sistem imun tubuh. Persyaratan dasar yang perlu dimiliki oleh probiotik adalah tahan terhadap kondisi asam lambung dan garam empedu, dapat bertahan hidup saat melalui saluran pencernaan, memiliki kemampuan menempel pada permukaan usus, serta memiliki aktivitas antimikroba untuk melawan bakteri patogen (Ouwehand et al. (2001). Bakteri probiotik harus termasuk kelompok GRAS (Generally Recognized as Safe).
Di masa mendatang, pasar pangan probiotik berbasis non-susu diperkirakan akan berkembang. Perkembangan ini semakin terbuka lebar karena beberapa alasan, salah satunya adalah lactose intolerance. Hal ini tentunya mendorong para peneliti maupun industri untuk melakukan terobosan guna menemukan wahana (vehicle) probiotik baru berbasis non-susu, seperti buah-buahan maupun sayuran. Wilayah Asia Tenggara menduduki peringkat tertinggi jumlah penderita lactose intolerance yang mencapai 98%, sangat jauh berbeda dengan daerah Eropa Utara yang hanya sebesar 5% (Rahayu 2011). Hal ini menunjukkan bahwa produk probiotik non susu dibutuhkan dan cocok untuk dikembangkan pada pasar dengan tingkat prevalensi lactose intolerance tinggi seperti di Indonesia.
Produk IMF (intermediate moisture food) atau pangan semi basah diperkirakan berpotensi untuk dikembangkan sebagai pangan probiotik baru berbasis buah lokal. Penelitian Nualkaekul et al. (2013) menunjukkan jus buah terbukti dapat menjadi pembawa (carrier) probiotik terenkapsulasi. Ding dan Shah (2008) juga menyebutkan bahwa serbuk buah mampu menjadi pembawa probiotik terenkapsulasi selama penyimpanan dingin 6 minggu. Selai merupakan salah satu produk pangan tradisional yang termasuk produk IMF. Keunggulan dari produk IMF adalah memiliki aw yang rendah (0.7-0.8), sehingga mampu
memperpanjang masa simpan produk pada suhu kamar (Labuza et al. 2007) Viabilitas probiotik umumnya mengalami penurunan selama berada dalam sistem pangan dan kondisi penyimpanan pangan serta saat dikonsumsi melalui alat pencernaan (Sultana et al. 2000). Salah satu upaya untuk mempertahankan viabilitas probiotik adalah dengan mengaplikasikan teknik mikroenkapsulasi. Probiotik terenkapsulasi dalam gel alginat lebih tahan panas (60oC), asam (pH 1.5) dan garam empedu 2% dibandingkan probiotik tanpa enkapsulasi (Mandal et al. 2006), serta memiliki sintasan lebih baik selama penyimpanan dingin (Jayalalitha et al. 2011).
Pengembangan pangan probiotik non-susu, prosesnya diawali dengan produksi biomassa probiotik yang kemudian diintroduksi pada makanan. Penambahan probiotik dilakukan selama pembuatan produk perlu dipelajari terlebih dahulu, agar tidak terjadi penurunan jumlah probiotik yang signifikan selama proses. Untuk dapat memberikan manfaat terhadap kesehatan viabilitas probiotik dalam produk umumnya sekitar 108 cfu g-1 (Hatting dan Viljoen 2001), sedangkan US FDA merekomendasikan jumlah minimum probiotik saat konsumsi sebesar 106 cfu mL-1.
Rumusan Masalah
Tujuan Penelitian
1) Mengetahui karakteristik probiotik terenkapsulasi meliputi sintasan setelah enkapsulasi, ketahanan panas, sel cedera, ketahanan terhadap garam empedu dan pH rendah, serta aktivitas antimikroba.
2) Mengetahui suhu optimum proses penambahan probiotik pada selai salak 3) Mengetahui pengaruh penyimpanan terhadap viabilitas Lb. plantarum serta
aw, pH serta cemaran kapang khamir pada selai salak.
Manfaat Penelitian
Hasil penelitian ini akan memberikan kontribusi terhadap perkembangan ilmu pengetahuan dalam bidang pangan fungsional khususnya pangan probiotik berbasis non-susu. Penelitian akan menghasilkan teknologi proses pembuatan probiotik terenkapsulasi dan aplikasinya pada selai salak.
Hipotesis
1) Mikroenkapsulasi Lb. plantarum dengan teknik emulsi akan meningkatkan sintasan, ketahanan terhadap panas, garam empedu dan pH rendah serta tidak mempengaruhi aktivitas antimikroba terhadap bakteri patogen.
2) Jumlah sel probiotik terenkapsulasi lebih tinggi daripada sel bebas pada suhu aplikasi selai salak.
TINJAUAN PUSTAKA
Salak
Salak merupakan tanaman yang banyak dibudidayakan di Indonesia dengan berbagai varietas. Masing-masing varietas mempunyai keunggulan tersendiri. Salah satu varietas yang dikenal adalah salak pondoh, salak varietas ini banyak dibudidayakan di daerah Yogyakarta terutama kabupaten Sleman. Buah salak pondoh adalah jenis salak yang paling unggul dibanding jenis lainnya. Keunggulan utama salak pondoh adalah memiliki rasa yang manis dan gurih tanpa rasa sepat walaupun salak masih muda (Nusmawarhaeni et al. 1989). Sleman merupakan sentra penghasil, penelitian buah dan bibit salak pondoh dengan produksi 500300 Kw/tahun. Adanya keunggulan salak pondoh tersebut menyebabkan nilai ekonomis salak pondoh lebih tinggi dibanding jenis salak lainnya (Djuwanto 1989).
Salak pondoh (Salacca edulis Reinw.) termasuk famili Palmaceae. ordo Spadiceflorae dan genus Salacca. Salak pondoh memiliki ukuran yang relatif lebih kecil bila dibandingkan dengan salak jenis lainnya, memiliki tekstur yang keras, kulit yang lebih hitam dan daging buah yang relatif lebih putih (Hastuti dan Ari 1988). Bobot salak pondoh antara 30-100 gram dan memiliki biji yang kecil (Sabari 1983). Ketebalan daging salak pondoh umumnya adalah antara 0.8 sampai 1.5 cm (Rukmana 1999).
Tanaman salak pondoh berbeda dengan jenis buah tropis lainnya yang rata-rata mengalami masa panen sekali dalam setahun dengan waktu yang bersamaan. Musim salak pondoh dapat dipilah menjadi 4 periode, yaitu : 1) panen raya : November – Januari, 2) panen kecil : Februari-April, 3) panen sedang : Mei-Juli dan 4) panen susulan: Agustus-Oktober (Harsoyo 1999).
Buah salak dapat dimakan segar, maupun sebagai produk olahan atau awetan. Buah salak produk awetan selain manisan bisa juga dibuat wajik dan selai. Hal ini dilakukan untuk menghindari pembusukan buah. Dengan total produksi yang besar di sepanjang tahun memungkinkan untuk menjadikan salak pondoh sebagai salah satu basis pengembangan produk lanjut berupa pangan probiotik guna memberikan nilai tambah pada buah ini.
Salak pondoh mempunyai kelebihan tersendiri dibanding salak yang lain (Widiharta, 1988) yaitu:
1) Kualitas rasa daging buahnya lebih manis, tanpa ada rasa sepat meskipun masih muda, sedangkan jenis buah salak lainnya umumnya terasa sepat sewaktu muda.
2) Sifat buah relatif lebih lama dibanding dengan jenis salak lainnya. Salak pondoh akan tetap segar walaupun disimpan lebih dari 20 hari. 3) Apabila banyak makan salak pondoh tidak akan menimbulkan sakit
perut.
Selai
Selai merupakan salah satu jenis produk IMF (Intermediate Moisture Food). IMF merupakan produk pangan yang berbasis pengawetan, dimana produk pangan tersebut dibuat sedemikian rupa sehingga memiliki nilai aktivitas air (aw)
yang lebih rendah. Hal tersebut bertujuan agar hampir seluruh mikroba khususnya mikroba perusak makanan tidak dapat tumbuh di dalamnya (Sych 2003). Vermeulen et al. (2012) menambahkan, IMF atau pangan semi basah seperti selai, produ-produk bakery dan cokelat pasta, umumnya mengandung antara kadar air 20-50% (w/w). IMF merupakan produk pangan yang memiliki nilai aw berkisar
antara 0.65-0.90 dengan RH 15-40%. IMF secara tradisional dibuat dengan prinsip penarikan air baik secara adsorpsi maupun desorpsi dan atau dengan penambahan humektan seperti gliserol dan sorbitol yang berfungsi untuk mengatur aw. Selain itu, kombinasi dari beberapa humektan dengan konsentrasi
yang rendah dapat menurunkan masalah off-flavor pada produk IMF (Sych 2003). Food and Drug Administration/ FDA (2002)mendefinisikan selai sebagai produk olahan buah-buahan, baik buah segar, buah beku, buah kaleng maupun campuran ketiganya. Selai merupakan produk awetan yang dibuat dengan memasak hancuran buah yang dicampur gula atau campuran gula dengan dekstrosa atau glukosa, dengan atau tanpa penambahan air dan memiliki tekstur yang lunak dan plastis (Suryani et al. 2004). Menurut Suryani et al. (2004), selai yang bermutu baik mempunyai tanda spesifik yaitu: konsistensi kokoh; distribusi buah merata; warna cemerlang; flavor buah alami; tekstur lembut; tidak mengalami sineresis dan kristalisasi selama penyimpanan.
Pembuatan selai meliputi tahap pemilihan bahan, pencucian, pengupasan, penghancuran buah, pemasakan, pengemasan dalam wadah botol, pasteurisasi dan pendinginan. Pemilihan tingkat kematangan buah yang digunakan akan mempengaruhi hasil akhir selai yang dihasilkan. Buah yang digunakan haruslah berkualitas baik terutama jika memanfaatkan buah segar, kemudian dilakukan pengupasan pada buah yang berkulit serta penghilangan biji pada buah-buahan yang berbiji (Suryani et al. 2004). Buah yang akan dijadikan selai dipilih yang bermutu baik dengan campuran buah setengah matang dan buah matang penuh buah setengah matang akan menyediakan pektin dan asam yang cukup, sedangkan buah matang sepenuhnya akan memberikan aroma yang baik (Facruddin 2008)
Nilai aw pada selai berkisar antara 0.7-0.8 (Labuza et al. 2007). Selai
menambahkan pengawet kimia guna memperpanjang masa simpan. Torok dan King (1991) dan Shearer et al. (2002) menyebutkan bahwa lebih dari 239 khamir telah diidentifikasi sebagai perusak pada produk olahan buah-buahan seperti konsentrat dan sayuran di USA di antaranya termasuk Candida dan Saccaromyces. Jumlah mikroba pada selai dipengaruhi oleh beberapa faktor (Buckle et al. 1987) yaitu kandungan gula tinggi 65-73%, keasaman tinggi dengan pH 3,1-3,5, dan nilai aw sekitar 0.73-0.83. Menurut Teti dan Ahmadi (2009),
penambahan gula dengan kadar yang tinggi (minimum 40%) menyebabkan air dalam bahan pangan menjadi terikat sehingga menurunkan nilai aktivitas air (aw)
dan dapat memperpanjang masa simpan karena air terikat tidak dapat digunakan oleh mikroba. Gula pasir selain menjadi pemberi cita rasa juga berpengaruh terhadap kekentalan gel, karena gula dapat menyerap air. Akibatnya pengembangan pati menjadi lebih lambat sehingga suhu gelatinisasi lebih tinggi. Penambahan gula lebih dari 75% akan memberikan daya oles yang kurang baik (Hambali 2004).
Kapang dapat menyebabkan kerusakan pada selai karena biasanya tumbuh di permukaan selai. Kapang-kapang tersebut berasal dari bahan baku yaitu buah pada waktu proses, dimana menurut Ray (2000) kapang-kapang yang terdapat pada buah-buahan yang menyebabkan kebusukan adalah Rhizopus, Aspergillus dan Penicillium.
Tabel 2 Batas maksimum cemaran mikroba dan kimia dalam makanan
Cemaran Jumlah maksimum
ALT (30oC, 72 jam) 1x104 koloni/g
APM Koliform <3/g
Staphylococcus aureus 1 x 102 koloni/g
Clostridium sp <1x101 koloni/g
Kapang dan khamir 1x102 koloni/g
Sumber : Peraturan BPOM Nomor HK.00.06.1.52.4011
Probiotik
Probiotik didefinisikan sebagai mikroba hidup yang dikonsumsi oleh manusia atau hewan dalam jumlah yang cukup, mampu hidup dan melewati kondisi lambung dan saluran pencernaan serta bermanfaat bagi sel inangnya dengan jalan meningkatkan kesehatan bagi inangnya (FAO/WHO 2002). Mikroba probiotik umumnya berasal dari bakteri asam laktat (BAL). Probiotik mempunyai berbagai fungsi kesehatan antara lain sebagai pencegah diare, mengurangi kejadian lactose intolerance, meningkatkan sistem imun tubuh. Probiotik sangat penting bagi tubuh karena menunjukkan peranan yang penting dalam menjaga keseimbangan mikroflora saluran pencernaan. Keseimbangan ini ditunjukkan dengan adanya interaksi yang kompleks yang bekerja secara sinergis dan antagonistis tergantung dari strain yang terlibat, jumlah serta aktivitas metaboliknya.
et al. 2001). Probiotik juga berfungsi untuk menyempurnakan proses pencernaan manusia dengan cara melindungi saluran pencernaan dari serangan bakteri patogen (Arief et al. 2011). Bakteri probiotik juga harus termasuk kelompok aman atau GRAS (Generally Recognized as Safe).
Di samping itu, beberapa peneliti lain telah mengemukakan jaminan kriteria untuk bakteri probiotik. Beberapa di antaranya adalah sebagai berikut :
a. Probiotik harus mampu bertahan melewati lambung dan usus halus, sehingga probiotik harus toleran terhadap suasana asam dan adanya asam empedu (Sunny- Roberts dan Knoor 2008).
b. Probiotik harus mempunyai kemampuan untuk melakukan penempelan ke usus (Nitisinprasert et al. 2006), karena sangat berkaitan dengan beberapa efek kesehatan antara lain efek imunologik dan eksklusi kompetitif dengan mikroba patogen (Bourlioux et al. 2003).
c. Probiotik harus mampu bertahan selama proses pengolahan dan penyimpanan (FAO/WHO 2002; Sunny-Roberts dan Knoor 2008), sehingga saat dikonsumsi masih mempunyai viabilitas yang cukup untuk mengatasi berbagai masalah di saluran pencernaan antara lain dengan meningkatkan pencernaan laktosa, mengontrol infeksi di usus, serta menjaga keseimbangan barier mukosa usus (Agostoni et al. 2004).
Bakteri probiotik dapat menghambat pertumbuhan mikroba yang tidak dikehendaki dan bakteri penghasil racun pada makanan. Efek dari probiotik adalah dengan memproduksi asam, bakteriosin, berkompetisi dengan patogen, dan meningkatkan sistem imun. Bakteri probiotik memproduksi β-galaktosidase yang bermanfaat bagi penderita lactose intolerance. Probiotik juga dapat berfungsi sebagai antikarsinogenik dan antimutagenik (Aysun 2002).
Selain itu, probiotik memiliki sifat fungsional seperti aktivitas hipokolesterol dengan menurunkan kadar kolesterol dalam darah (Kusumawati, 2003). Karakteristik probiotik dan sifat fungsionalnya tersebut dipengaruhi oleh strain BAL dan semua strain probiotik tersebut unik dan berbeda sehingga perlu dilakukan pemilihan strain yang memiliki karakteristik sebagai probiotik.
Banyak strain dan spesies yang berbeda dari Lactobacilli yang digunakan sebagai probiotik. Salah satu strain yang secara komersial digunakan adalah Lactobacillus acidophilus NCFM dan Lactobacillus casei strain Shirota. Bakteri probiotik harus melakukan metabolisme dengan stabil dan aktif di dalam produk, dapat bertahan di lingkungan pencernaan dalam jumlah yang banyak, dan dapat memberikan keuntungan bagi usus sebagai tempat hidupnya. Penelitian menunjukkan bahwa bakteri probiotik pada yogurt dan pada susu fermentasi tidak dapat bertahan pada fermented frozen dairy desserts sehingga jumlahnya mengalami penurunan sebanyak 5-6 siklus log yang disimpan pada suhu 18oC selama 8-12 minggu.
Menurut Salminen dan Lee (2009) ada beberapa faktor yang mempengaruhi viabilitas probiotik pada produk pangan, di antaranya;
1) Suhu
dalam produk pangan tersebut. Selama proses pengolahan, suhu di atas 45o C-50oC akan mengganggu viabilitas probiotik. Semakin tinggi suhu, semakin pendek jangka waktu paparan untuk dapat mengurangi bakteri yang hidup. Lamanya paparan berkisar antara hitungan menit sampai jam untuk suhu 45-55 -o
C, dan hitungan detik untuk suhu yang lebih tinggi. Hal ini jelas membuktikan bahwa probiotik seharusnya ditambahkan pada saat penurunan suhu di akhir proses pemasakan produk pangan.
2) aw
Probiotik dapat bertahan hidup pada produk kering lebih dari 12 bulan pada suhu ruang, dengan syarat aw produk dipertahankan pada kisaran 0.2-0.3. Secara
umum, semakin rendah aw maka ketahanan bakteri probiotik selama penyimpanan
semakin baik. Mempertahankan viabilitas probiotik pada produk IMF selama penyimpanan merupakan tantangan utama dan salah satu solusinya adalah dengan melakukan mikroenkapsulasi.
3) pH
BAL memproduksi asam organik sebagai produk akhir dari metabolisme karbohidrat, oleh sebab itu bakteri ini toleran terhadap pH rendah dibanding bakteri lain. Cotter dan Hill (2003) memaparkan mekanisme homeostatik instrinsik yang menyebabkan BAL mampu bertahan pada kondisi pH rendah atau keasaman yang tinggi. Mekanisme yang terjadi pada BAL antara lain sistem Glutamatdekarboksilase (GAD), sistem arginin deiminasi (ADI) dan pompa proton H+-ATP-ase. Sistem glutamat dekarboksilase merupakan suatu mekanisme pertahanan sel sebagian BAL terhadap kondisi pH yang rendah. Beberapa spesies Lactobacillus sp dilaporkan memiliki mekanisme sistem GAD. Keberadaan glutamat sebagai zat yang dapat mempertahankan kondisi homeostatis pH internal sel BAL menjadi faktor yang penting untuk perlindungan BAL terhadap kondisi pH rendah. Glutamat dapat diperoleh dari berbagai sumber terutama dari makanan pembawa BAL misalnya makanan kaya protein (susu dan daging), beberapa buah-buahan, ataupun bahan kriogenik yang sengaja ditambahkan untuk pengawetan BAL selama pengolahan.
Lactobacillus plantarum termasuk bakteri dalam filum Firmicutes, kelas Bacilli, ordo Lactobacillales, famili Lactobacillaceae dan genus Lactobacillus. Lactobacillus plantarum merupakan salah satu jenis BAL homofermentatif dengan pertumbuhan yang optimal pada suhu 30-37 oC serta pada pH 5-7 (Emanuel et al. 2005). Lactobacillus plantarum mempunyai kemampuan untuk menghambat mikroba patogen pada bahan pangan dengan daerah penghambatan terbesar dibandingkan dengan bakteri asam laktat lainnya (Jenie dan Rini 1995). Lactobacillus plantarum termasuk spesies bakteri yang tergolong dalam probiotik (Salminen dan Wright 2004).
BAL di mukosa dan isi sekum, serta menurunkan total E. coli pada mukosa dan isi sekum (Arief et al. 2010).
Bakteri asam laktat dianggap sebagai bakteri yang membutuhkan berbagai asam amino esensial dan vitamin untuk tumbuh, namun beberapa strain probiotik diketahui mampu tumbuh pada matriks pangan yang berasal dari buah-buahan (Ding dan Shah 2008, Nualkaekul et al. 2013). Penelitian menunjukkan bahwa viabilitas sel tergantung pada strain yang digunakan, karakteristik substrat, kandungan oksigen dan keasaman dari produk pangan (Shah 2001). Spesies yang berbeda akan memberikan sensitivitas yang berbeda terhadap pH substrat dan keasaman akhir pada produk fermentasi, suhu maupun kondisi pencernaan. Probiotik tumbuh optimum pada suhu 35-40o C dan pH 4.5-6.4 dan terhenti ketika pH mencapai 4.0-3.6 (Shah 2007). Hal ini dapat disiasati dengan memberikan pelindung fisik terhadap kondisi yang tidak menguntungkan, seperti penyalutan dengan alginat, chitosan, gel kalsium pektat maupun poliakrilamida.
Mikroenkapsulasi
Enkapsulasi merupakan teknologi pengemasan zat padat, cair atau gas dalam kapsul berukuran kecil yang dapat melepaskan isinya dalam lingkungan tertentu. Mikrokapsul ini dapat berukuran dari submikron hingga beberapa milimeter dan memiliki berbagai bentuk tergantung pada bahan dan teknik yang digunakan untuk membuatnya. Secara umum, mikrokapsul memiliki kemampuan untuk memodifikasi dan meningkatkan bentuk dan sifat substansi. Bahkan lebih spesifik, mikrokapsul memiliki kemampuan untuk mengawetkan substansi dan melepaskannya ketika diperlukan (Mosilhey 2003).
Enkapsulasi dapat dilakukan pada bakteri, yang bertujuan untuk mengawetkan kultur serta memberikan kondisi yang mampu mempertahankannya dari kondisi yang tidak menguntungkan seperti panas dan bahan kimia. Keuntungan dari proses enkapsulasi antara lain menurunkan reaktivitas bahan inti dengan lingkungan luar (misalnya: cahaya, oksigen, dan air), menurunkan laju evaporasi atau transfer bahan inti ke lingkungan luar, mempermudah penanganan bahan inti, mengendalikan pelepasan bahan inti untuk mencapai penundaan yang tepat, menyembunyikan rasa bahan inti, dan melarutkan bahan inti jika digunakan dalam jumlah yang sangat kecil, namun tetap mencapai penyebaran yang merata dalam bahan pembawanya. Teknik mikroenkapsulasi merupakan teknik yang menjanjikan untuk menghasilkan bakteri probiotik hidup dalam produk karena matrik penyalut dapat menjadi barier bagi kondisi lingkungan yang tidak mendukung seperti pembekuan maupun kondisi saluran pencernaan (Boh 2007; Capela et al. 2006; Champagne dan Kailasapathy 2008; Kailasapathy 2002; Shah 2000). Beberapa penelitian menyebutkan bahwa enkapsulasi meningkatkan viabilitas probiotik ketika melewati saluran pencernaan (dengan adanya garam empedu dan ph rendah). Lee dan Heo (2000) melaporkan bahwa ketahanan B. longum yang dienkapsulasi dengan kalsium alginat pada pH rendah (1.5) cenderung meningkat. Penyalutan kalsium klorida pada gel sodium alginat yang mengandung Lb. acidophilus lebih tahan terhadap pH rendah (pH 2) dan garam empedu 1 % (Chandramouli et al. 2004)
Picot dan Lacroix, 2004; Chandramouli et al. 2004; Saarela et al. 2006). Mikroenkapsulasi dapat menyediakan lingkungan anaerobik yang menguntungkan bagi bakteri probiotik, dengan berperan sebagi pelindung fisik dari kondisi asam pada jus buah. Burgain et al. (2011) menyatakan bahwa emulsifikasi merupakan teknik kimia yang digunakan untuk mengenkapsulasi sel probiotik hidup dengan menggunakan hidrokoloid seperti alginat, karagenan dan pektin sebagai enkapsulan. Teknik emulsifikasi dilakukan dengan membuat larutan yang berisi matriks polimer dan sel probiotik dalam volume kecil kemudian larutan tersebut ditambahkan ke dalam minyak sayur dengan volume besar. Campuran tersebut kemudian dihomogenisasi menjadi bentuk emulsi air dalam minyak. Ketika emulsi air dalam minyak telah terbentuk, polimer larut air harus dibuat tidak larut untuk membentuk partikel-partikel gel kecil dalam fase minyak. Gel yang terbentuk dipisahkan dengan penyaringan maupun dengan menggunakan sentrifus
Enkapsulasi dengan teknik emulsi diperlukan suatu emulsifier dan juga surfaktan serta bahan pengeras yaitu kalsium klorida (CaCl2). Teknik emulsi ini
sangat mudah dilakukan dan dapat memberikan rata-rata sel mikroba hidup dalam jumlah tinggi. Kekurangan dari teknik ini adalah ukuran dan bentuk mikrokapsul yang dihasilkan cenderung lebih bervariasi dari mikrokapsul yang dihasilkan dengan teknik lainnya. Hal ini disebabkan karena variasi dari ukuran yang dihasilkan tersebut dapat dipengaruhi oleh kecepatan agitasi dan perbandingan air dan minyak yang digunakan (Kailasapathy 2009). Diameter dari mikrokapsul yang dihasilkan berpengaruh penting terhadap viabilitas sel probiotik, kecepatan metabolismenya serta karakteristik sensori dari produk yang dihasilkan. Selain itu, ukuran dari diameter mikrokapsul juga dapat mempengaruhi distribusi serta kualitas dispersi dari mikrokapsul di dalam produk (Picot dan Lacroix 2003). Jenis enkapsulan, diameter enkapsulan merupakan faktor yang menentukan untuk meningkatkan viabilitas probiotik.
Pada beberapa penelitian, emulsifier juga dipergunakan untuk membentuk emulsi yang lebih baik, karena emulsifier mampu menurunkan tegangan permukaan dan menghasilkan gel yang lebih kecil. Emulsifier yang sering digunakan adalah Tween 80 0.2% (Sheu dan Marshall 1993). Teknik emulsi ini bisa diterapkan untuk enkapsulasi bakteri probiotik pada fermentasi batch maupun fermentasi continuous (Lacroix dan Paquin 1992).
Perlindungan probiotik dengan teknik mikroenkapsulasi dapat dilakukan dengan berbagai jenis enkapsulan, salah satunya adalah dengan alginat. Alginat merupakan bahan yang paling baik digunakan untuk mikroenkapsulasi karena dapat memperbaiki viabilitas probiotik di dalam produk pangan fungsional. Alginat merupakan polysakarida yang diekstrak dari berbagai jenis alga. Kalsium alginat umumnya digunakan untuk enkapsulasi bakteri asam laktat maupun bakteri probiotik dengan konsentrasi berkisar antara 0.5-4% (Sultana et al. 2000; Krasaekoopt et al. 2004). Sultana et al. (2000) peningkatan konsentrasi alginat (>2%, bahkan lebih dari 4%) tidak memberikan efek lebih baik dalam melindungi probiotik terhadap kondisi lingkungan.
dengan alginat juga dapat mencegah tekanan yang mengakibatkan kerusakan pada sel bakteri, dan dapat diaplikasikan dalam jumlah atau volume yang cukup besar (Ding dan Shah 2008). Mikrokapsul alginat diketahui mampu meningkatkan viabilitas probiotik 80-95% (Krasaekoopt et al. 2003; Sheu et al. 1993). Enkapsulasi Lactobacillus rhamnosus menggunakan alginat diketahui mampu meningkatkan kemampuan bertahan pada pH 2,0 hingga 48 jam, dimana pada kondisi tersebut sel bebas seluruhnya mati (Goderska et al. 2003). Enkapsulasi Lactobacillus spp. dengan menggunakan kalsium-alginat diketahui juga meningkatkan kemampuan bertahan terhadap panas (Selmer-Olsen et al. 1999). Ketahanan Lactobacillus diketahui meningkat setelah dienkapsulasi dengan menggunakan alginat pada suhu 55, 60 dan 65oC serta semakin meningkat seiring bertambahnya konsentrasi alginat sebagai penyalut (Mandal et al. 2005).
Mikrokapsul yang terbentuk dari alginat juga mempunyai beberapa kelemahan. Salah satunya adalah rentan terhadap lingkungan asam, adanya kerusakan dan hilangnya keseimbangan mekanis pada lingkungan yang mengandung asam laktat telah dipelajari. Selain itu, mikrokapsul alginat terbentuk dari adanya ion kalsium, yang akan dipengaruhi oleh keberadaan ion monovalen maupun chelating agent yang mampu menyerap ion kalsium seperti fosfat, laktat dan sitrat (Ellenton 1998).
METODE PENELITIAN
Tahapan Penelitian
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Mikrobiologi Pangan Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian Institut Pertanian Bogor (IPB); Pilot Plant SEAFAST (Southeast Asian Food and Agriculture Science and Technology) Center, IPB. Penelitian ini dilaksanakan dari bulan Februari hingga Oktober 2014.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain Na-alginat (Sigma-Aldrich,UK), minyak kedelai, sodium sitrat (Merck, Jerman), kalsium klorida (Merck, Jerman), Tween 80 (Merck, Jerman). Medium yang digunakan adalah MRSA (Oxoid, Inggris), MRSB (Oxoid, Inggris), PDA (Oxoid, Inggris), garam empedu (Merck, Jerman), HCl (Merck, Jerman) dan NaCl (Oxoid, Inggris). Varietas salak yang digunakan adalah salak pondoh yang diperoleh dari pasar di daerah Dramaga. Salak yang dipilih adalah buah yang segar yang sudah matang dan dikupas atau dibuang bagian yang tidak dapat dimakan.
Alat-alat yang digunakan adalah sentrifus suhu rendah (refrigerated), refrigerator, autoklaf, waterbath, laminar air flow, inkubator, neraca digital, pH-meter, pengaduk magnetik, vortex, mikropipet, alat gelas, ose, bunsen, wajan, kompor dan blender.
Preparasi Kultur Mikroorganisme (Harmayani et al. 2001)
Kultur bakteri asam laktat yaitu Lactobacillus plantarum BSL diperoleh dari Laboratorium Mikrobiologi Departemen Ilmu dan Teknologi Pangan FATETA IPB sedangkan Lactobacillus plantarum 2C12 diperoleh dari Departemen Ilmu Produksi dan Teknologi Peternakan IPB. Pembuatan biomassa bakteri asam laktat mengacu pada Harmayani et al. (2001), kultur bakteri ditumbuhkan pada agar miring MRSA (De Man, Rogosa, Sharpe agar), kemudian diambil sebanyak satu ose untuk ditumbuhkan pada media MRSB, dan diinkubasi selama 24 jam (37oC). Selanjutnya diambil sebanyak 1 mL dan ditumbuhkan kembali pada MRSB 1000 mL. Biomassa yang dihasilkan kemudian dipanen dengan cara mensentrifugasi pada 5000g selama 10 menit dan dicuci dua kali dengan PBS (Phospat Buffer Saline) 0.1 M.
Mikroenkapsulasi (Mandal et al. 2005)
cara sentrifugasi (350 rpm, 10 menit) pada suhu 4oC kemudian dicuci dua kali dengan menggunakan akuades steril. Mikrokapsul dipisahkan dengan menggunakan kertas Whatman filter (no. 1), kemudian dipindahkan ke dalam cawan steril dan disimpan dalam lemari pendingin (7±1oC). Ukuran mikrokapsul diukur dengan menggunakan mikrometer. Analisis dilakukan terhadap jumlah sel, ketahanan panas, kerusakan sel setelah pemanasan serta ketahanan terhadap garam empedu dan pH dan dibandingkan antara sel bebas dengan sel terenkapsulasi. Ketahanan sel dilihat dari penurunan jumlah sel yang diperoleh dari jumlah sel awal sebelum perlakuan dikurangi jumlah sel akhir setelah perlakuan (log cfu mL-1).
Aplikasi Probiotik pada Pengolahan Buah Salak menjadi Selai Salak
Pembuatan Produk Selai Salak (Noerhartati et al. 2001)
Pembuatan selai salak dilakukan dengan menggunakan metode Noerhartati (2001) dengan perbandingan gula dan buah salak adalah 3:4. Kultur probiotik yang sudah dimikroenkapsulasi ditambahkan pada saat pemasakan dengan suhu untuk penambahan probiotik adalah 50o C (berdasarkan uji ketahanan panas). Skema pembuatan selai salak dijelaskan pada Gambar 2.
Penambahan kultur probiotik dilakukan pada saat selai salak sudah sempurna matang, ditandai dengan warna yang kecoklatan dan tekstur yang kental. Jumlah bakteri probiotik yang ada di dalam produk minimal 7 log cfu g-1, sehingga penambahan kultur didasarkan pada berat selai salak. Pada penelitian ini masing-masing 10 mL bakteri probiotik bebas dan 10 g bakteri probiotik terenkapsulasi (11 log cfu mL-1) ditambahkan ke dalam 100 g selai salak (10 log cfu g selai salak-1). Proses pengadukan harus dilakukan secara sempurna agar probiotik bisa menyebar rata di semua bagian selai.
Selai Salak
Gambar 2. Skema Pembuatan Selai Salak Buah Salak
Sortasi, Pengupasan dan Pemisahan
Daging Buah
Pemasakan awal selama 25 menit
Penghancuran
Pemasakan akhir selama 25 menit
Biji, Kulit
Gula
Kultur probiotik
Pengemasan Pencucian dan sterilisasi kering (170-180oC)
Proses pembuatan selai salak diawali dengan sortasi dan pengupasan serta pemisahan daging buah salak dari biji serta kulit. Proses pemasakan awal dilakukan selama 25 menit dimana suhu pemasakan berkisar pada suhu 85oC. Proses penghancuran dilakukan dengan menggunakan blender dan pada proses ini dilakukan penambahan gula dengan perbandingan gula dan buah salak 3:4. Pemasakan selai dilakukan selama 25 menit, parameter berakhirnya proses ditandai dengan nilai aw berkisar antara 0.7-0.8.
Penyimpanan Produk Selai Salak
Selai salak yang sudah ditambah probiotik terenkapsulasi disimpan pada suhu ruang selama 30 hari. Pengemasan selai salak menggunakan botol selai yang sudah disterilkan terlebih dahulu dengan sterilisasi kering. Selai salak yang disimpan adalah selai salak dengan mutu terbaik dilihat dari sintasan probiotiknya. Hal ini didasarkan pada suhu penambahan probiotik pada saat pembuatan selai salak. Selain itu disimpan juga selai salak kontrol tanpa pernambahan probiotik, serta salak dengan penambahan probiotik bebas sebagai pembanding.
Prosedur Analisis
Uji sintasan probiotik bebas dan terenkapsulasi (Gebara et al. 2013)
Sintasan probiotik ditentukan dengan menghitung sel yang hidup di dalam media tumbuh dan juga di dalam mikrokapsul. Mikrokapsul probiotik didisintegrasikan yakni dengan menambahkan sebanyak 1g ke dalam 9 mL (b/v) larutan sodium sitrat 2 % steril (pH 7.0) kemudian dihomogenisasi selama 5 menit (Krasaekoopt et al. 2004). Setelah didisintegrasi, mikroba dalam hal ini adalah probiotik, akan keluar dari enkapsulan lalu dihitung. Perhitungan dilakukan dengan membuat serial larutan dari natrium chloride (0.85 % b/v) kemudian dilakukan pour plate pada MRSA menggunakan cawan petri lalu diinkubasi pada suhu 37 oC selama 72 jam.
Sel Cedera (Injured cell) Setelah Pemanasan (Golowczyc et al. 2010)
Lb. plantarum yang telah mengalami pemanasan (50-70oC) selama 20 menit diambil 1 mL dan ditumbuhkan pada media MRSA yang ditambah NaCl (5% b/v, Merck) dan MRSA sebagai kontrol. Inkubasi dilakukan selama 48 jam dengan suhu inkubasi 37oC. Sel sehat dihitung berdasarkan jumlah koloni yang tumbuh pada media MRSA yang ditambah NaCl 5% (log cfu mL-1) sedangkan sel cedera tidak mampu tumbuh. Jumlah sel cedera dihitung berdasarkan selisih antara koloni pada cawan MRSA kontrol (log cfu mL-1) dengan koloni pada cawan MRSA yang ditambahkan dengan NaCl 5% (log cfu mL-1).
Ketahanan Terhadap Panas (Mandal et al. 2005)
Ketahanan Terhadap Garam Empedu (0.5%) dan pH rendah (pH 2)
(Nuraida et al. 2012)
Pengujian ketahanan terhadap garam empedu dilakukan dengan mengambil kultur bakteri probiotik sebanyak 1 mL berumur 24 jam dan 1 g mikrokapsul dimasukkan masing-masing ke dalam 10 mL MRSB kontrol dan MRSB dengan penambahan 0.5% garam empedu. Campuran selanjutnya dihomogenisasi dengan vortex dan diinkubasipada suhu 37oC selama 5 jam. Ketahanan bakteri dinyatakan dari perbedaan koloni (log cfu mL-1) antara media kontrol dengan media yang mengandung garam empedu.
Pengujian ketahanan terhadap pH rendah dilakukan dengan memasukkan 1 mL kultur bakteri probiotik berumur 24 jam dan 1 g mikrokapsul masing-masing ke dalam 10 mL MRSB kontrol dan MRSB dengan penambahan HCl hingga pH 2. Campuran kemudian dihomogenisasi dengan menggunakan vortex dan kemudian diinkubasi selama 5 jam (37oC). Perhitungan dilakukan dengan menggunakan media MRSA dan metode tuang. Probiotik yang toleran terhadap asam dihitung dengan melihat perbedaan koloni (log cfu mL-1) antara media kontrol dengan media asam.
Uji Sifat Antimikroba dari Probiotik Bebas dan Probiotik Terenkapsulasi (Sahputra 2012)
Isolat probiotik yang telah ditumbuhkan pada MRS B 10 mL selama 18 jam pada suhu 37o C kemudian disentrifus dengan kecepatan 10000 rpm selama 10 menit sehingga diperoleh sel basah. Kemudian diencerkan dengan pengencer NaCl 0.85% sehingga diperoleh jumlah probiotik sekitar 1010 cfu/mL. Mikrokapsul probiotik didisintegrasikan yakni dengan menambahkan sebanyak 1 g ke dalam 9 mL (b/v) larutan sodium sitrat 2 % steril dengan pH 7.0 kemudian dihomogenisasi selama 5 menit (Krasaekoopt et al. 2004). Jumlah sel probiotik setelah disintegrasi ini sekitar 1010 cfu mL-1. Selanjutnya terhadap bakteri probiotik dilakukan kembali pengenceran dengan media pengencer NaCl sehingga diperoleh jumlah bakteri sekitar 109 log cfu mL. Hal yang sama dilakukan pada E. coli, bakteri ini ditumbuhkan pada media TSB 10 mL, selanjutnya diinkubasi sampai akhir fase log yaitu selama 18 jam pada suhu 37o C. Pengenceran dengan media pengencer NaCl 0.85% 9 mL dilakukan sehingga diperoleh hasil perhitungan E. coli setelah 18 jam inkubasi. Selanjutnya terhadap bakteri E. coli dilakukan kembali pengenceran dengan media pengencer NaCl sehingga diperoleh jumlah bakteri sekitar 105 cfu mL-1 (agar jumlah E. coli pada susu sebesar 103 cfu mL-1).
Sebanyak 2 mL suspensi probiotik dan 2 mL suspensi E. coli diinokulasikan ke dalam 20 mL susu (2.88 gram sampel susu skim). Jumlah masing-masing bakteri pada susu skim diperkirakan 108 cfu mL-1 BAL dan 103 cfu mL-1 untuk E. coli. Selanjutnya susu diinkubasi pada suhu 37 oC selama 24 jam. Kemudian dilakukan perhitungan pertumbuhan relatif yang dinyatakan sebagai Nt/N0 dimana
Nt adalah log dari jumlah koloni setelah kontak 24 jam dan N0 adalah log dari
jumlah koloni pada waktu kontak 0 jam. Setelah itu dilakukan perhitungan jumlah koloni sesuai dengan perhitungan SPC (Standard Plate Count).
100 mL. 20 mL NA yang sudah ditambah patogen kemudian dituang ke dalam cawan petri steril dan didiamkan hingga mengeras. Lubang sumur dibuat dengan diameter 6mm. 30µL kultur bakteri probiotik berumur 24 jam dituang ke dalam sumur dan diinkubasi pada suhu 37oC selama 2 hari. Zona penghambatan ditunjukkan dengan adanya area bening di sekeliling sumur.
Uji Ukuran dan Bentuk Mikrokapsul
Bentuk dan ukuran mikrokapsul dihitung dengan menggunakan mikrometer okuler. Preparat berisi mikrokapsul tunggal diamati dibawah mikrometer okuler dengan perbesaran 20x. Skala 100 unit = 1 cm maka tiap unit setara dengan 0.01 cm atau 100 μm. Jumlah sampel yang diukur adalah 30 mikrokapsul dengan 3x pengamatan untuk masing-masing sampel.
Uji kapang dan khamir (Fardiaz 1992)
Analisis kontaminasi kapang khamir dilakukan pada media PDA dengan penambahan asam tartarat 14%. Sebanyak 10 g selai salak dimasukkan ke dalam 90 mL NaCl 0.85% steril dan divortek, selanjutnya dibuat pengenceran berseri. Jumlah kontaminan dihitung dengan metode hitungan cawan dengan beberapa seri pengeceran setelah diinkubasi (37oC, 48 jam). Kemudian dihitung total kapang dan khamir berdasarkan standard plate count.
Metode Analisis
Analisis Rendemen Enkapsulasi
Rendemen enkapsulasi (encapsulation yield/EY) dapat dihitung berdasarkan Annan et al. (2008). Rendemen enkapsulasi merupakan pengukuran terhadap efektivitas proses enkapsulasi dan sintasan sel selama proses mikroenkapsulasi, yang dihitung dengan rumus berikut:
EY = (N/N0) x 100 %
Keterangan :
EY : encapsulation yield atau rendemen enkapsulasi
N : jumlah sel yang terperangkap dalam mikropartikel atau mikrokapsul (log cfu g-1)
N0 : jumlah sel bebas atau jumlah sel probiotik yang ditambahkan ke dalam
emulsi selama proses mikroenkapsulasi
Perhitungan Koloni (BAM 2001)
Koloni bakteri dapat dihitung dengan rumus Standar Plate Count (SPC). Jumlah koloni bakteri probiotik dan bakteri uji dihitung setelah diinkubasi pada suhu 37oC selama 48 jam. Adapun rumus SPC adalah sebagai berikut
N= ΣC{[(1*n1)+(0.1*n2)+...]*(d)}
Keterangan
n2 : jumlah cawan pada pengenceran kedua d : pengenceran pada cawan pertama
Deteksi koloni metode SPC berkisar antara 25-250. Apabila di dalam cawan terdapat koloni kurang dari 25 maka dalam pelaporannya dinyatakan bahwa jumlahnya < 2.5x101cfu mL-1, dan apabila tidak ditemukan koloni di dalam cawan hingga pengenceran terendah maka pelaporannya sebanyak 1.0x101 cfu mL-1. Koloni yang jumlahnya melebihi 250 maka dianggap TBUD (Terlalu Banyak Untuk Dihitung).
Pengukuran aw dan pH selai salak probiotik (BSN 1992)
Pengukuran aw dilakukan dengan menggunakan aw meter. Sebelum
digunakan, alat aw-meter harus dikalibrasi terlebih dahulu dengan menggunakan
larutan NaCl jenuh pada kertas saring dan diletakkan pada cawan, kemudian nilai aw diset sampai dengan 0,750. Sampel ditimbang seberat 5 g dan diletakkan dalam
cawan pengukur. Setelah ditutup dan dikunci nilai aw dapat dibaca jika aw-meter
sudah menunjukkan tanda completed.
Untuk pengukuran pH selai salak dilakukan dengan menggunakan alat pH-meter. Sebelum digunakan, alat pH meter dikalibrasi terlebih dahulu menggunakan larutan buffer pH 4 dan pH 7. Sekitar 5 g sampel selai salak dimasukkan ke dalam gelas piala kecil. Elektroda pH-meter ditancapkan ke dalam sampel, kemudian dilakukan pembacaan pH sampel hingga mencapai nilai yang tetap.
Analisis Kadar Gula dengan metode Anthrone (Apriyantono, 1988)
Pembuatan kurva standar
Larutan gula standar (104.1 µg/mL) dimasukan ke dalam tabung reaksi sebanyak 0.0 (blanko); 0.2; 0.4; 0.6; 0.8 dan 1 mL. Aquades ditambahkan pada masing-masing tabung hingga volume masing-masing tabung reaksi 1 mL. Pereaksi athrone sebanyak 5 mL ditambahkan secara cepat ke dalam masing-masing tabung reaksi, kemudian divortex hingga homogen. Selanjutnya tabung reaksi berisi larutan dipanaskan dalam waterbath 100oC selama 12 menit. Pendinginan dilakukan dengan cepat dengan menggunakan air mengalir. Larutan kemudian dipindahkan ke dalam kuvet dan ditera dengan absorbansi pada 630 nm dan selanjutnya dibuat kurva hubungan antara nilai absorbansi dengan konsentrasi gula.
Penetapan sampel
Sampel sebanyak 1 mL (dari persiapan sampel) ke dalam tabung reaksi, selanjutnya dimasukan secara cepat peraksi anthrone sebanyak 5 mL. Tahapan selanjutnya mengikuti tahap pembuatan kurva standar.
Analisis Kadar Air (AOAC 1995)
Analisis kadar air dilakukan dengan menggunakan metode oven, adapun prinsipnya adalah menguapkan molekul air (H2O) bebas yang ada di dalam
dahulu pada suhu 100-105oC selama 30 menit, kemudian didinginkan dalam desikator untuk menghilangkan uap air kemudian ditimbang. Sampel ditimbang sebanyak 2 g dalam cawan yang sudah dikeringkan kemudian di oven pada suhu 100-105oC selama 6 jam untuk selanjutnya didinginkan dalam desikator selama 30 menit dan ditimbang. Tahap ini diulangi hingga dicapai bobot yang konstan. Kadar air dihitung dengan rumus:
% kadar air (bb) = x 100%
Keterangan :
A : berat sampel awal dinyatakan dalam gram
B : berat cawan + sampel kering dinyatakan dalam gram C : berat cawan kosong dinyatakan dalam gram
Analisis Data
HASIL DAN PEMBAHASAN
Karakteristik Fisik Mikrokapsul
Mikrokapsul yang dihasilkan melalui metode emulsi berbentuk bulat (Gambar 3). Hal serupa juga dilaporkan oleh Fahimdanesh et al. (2012) yang melaporkan bahwa ciri fisik mikrokapsul adalah bulat. Sultana et al (2000) juga melaporkan bahwa mikroenkapsulasi dengan metode emulsi dengan enkapsulan alginat menghasilkan mikrokapsul dengan bentuk bulat sempurna dan bulat lonjong. Bentuk mikrokapsul yang homogen berbentuk bulat diperoleh karena adanya ion Na+ seperti yang dilaporkan oleh Thu et al. (1996) bahwa keberadaan ion Na+ dan Ca2+ akan menyebabkan terbentuknya gel yang homogen, selain itu konsentrasi alginat yang digunakan juga berpengaruh. Chandramouli et al. (2004) melaporkan bahwa konsentrasi alginat lebih dari 2% akan menyebabkan meningkatnya viskositas larutan alginat dan menurunkan penyebaran sel di dalam alginat sehingga tidak didapatkan mikrokapsul dengan bentuk bulat dan seragam.
Ukuran mikrokapsul kedua strain Lb. plantarum BSL dan Lb. plantarum 2C12 dengan menggunakan metode emulsi memiliki variasi berkisar antara 0.1-0.5mm (Gambar 4). Variasi ukuran yang dihasilkan dipengaruhi oleh kecepatan agitasi yang digunakan pada saat pembentukan mikrokapsul. Semakin besarnya diameter menurut Truelstrup-Hansen et al. (2002) tidak memberikan efek beda nyata terhadap sintasan probiotik. Selain itu dilaporkan pula bahwa mikrokapsul dengan ukuran >1 mm akan memberikan tekstur yang kasar pada produk. Menurut Talwakar dan Kailasapathy (2003), ukuran diameter manik-manik yang kecil akan menghasilkan distribusi sel di dalam bead yang lebih merata. Hasil serupa juga dilaporkan oleh Burgain et al. (2010) enkapsulasi dengan menggunakan teknik emulsi akan menghasilkan ukuran mikrokapsul yang bervariasi, antara 0.1-5000 µm.
tidak diinginkan. Mikrokapsul alginat dengan diameter 0.5-1.0 mm terbukti mampu meningkatkan sintasan bifidobakteri pada yogurt dengan pH normal selama penyimpanan dingin, namun tidak mampu melindungi pada kondisi pH rendah (pH lambung) (Sultana et al. 2000). Ukuran mikrokapsul selain menjadi salah satu faktor yang mempengaruhi sintasan probiotik, juga mempengaruhi kecepatan metabolisme dan penerimaan sensori pada produk akhir dan juga mempengaruhi distribusi dan kualitas dispersi mikrokapsul pada produk (Picot dan Lancroix 2003). Krasaekoopkt et al. (2003) juga melaporkan bahwa mikrokapsul dengan ukuran 0.5-1.0 mm akan menghasilkan pelepasan sel dan tingkat produksi asam dengan kecepatan yang lebih tinggi.
Gambar 4 Sebaran ukuran mikrokapsul strain Lb. plantarum a) Lb. plantarum BSL b) Lb. plantarum 2C12
0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50
ju
0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50
Jumlah Sel Bakteri Probiotik Setelah Proses Mikroenkapsulasi
Proses mikroenkapsulasi tidak menyebabkan perubahan jumlah sel yang berbeda nyata pada kedua strain Lb. plantarum. Sel awal probiotik sebelum dienkapsulasi berkisar antara 11.1-11.8 log cfu mL-1 dan setelah dienkapsulasi jumlah sel yang diperangkap oleh matriks alginat masih tetap tinggi, yaitu 99% (11.0-11.7 log cfu g-1) (Gambar 5). Lb. plantarum BSL tidak mengalami perubahan jumlah sel secara beda nyata setelah mikroenkapsulasi dari 11.8 log cfu mL-1 menjadi 11.7 log cfu g-1, demikian pula pada Lb.plantarum 2C12 juga tidak mengalami perubahan jumlah sel secara beda nyata dari 11.1 log cfu mL-1 menjadi 11.0 log cfu g-1. Rendemen mikroenkapsulasi (Encapsulation yield) untuk kedua strain ini adalah 99.9%. Proses mikroenkapsulasi dengan teknik emulsi merupakan salah satu teknik yang tidak menggunakan proses pemanasan sehingga sel tidak mengalami heat shock. Prinsip mikroenkapsulasi dengan teknik emulsi didasarkan pada hubungan antara fase kontinyu dan tidak kontinyu dan membutuhkan emulsifier serta surfaktan, serta diakhir proses dibutuhkan agen pemadat (kalsium klorida) (Chen dan Chen 2007). Pada teknik ini campuran polimer dan sel berperan sebagai fase tidak kontinyu dan ditambahkan dengan cara diteteskan ke dalam minyak kedelai sebagai fase kontinyu, campuran ini kemudian dihomogenkan menjadi emulsi air dalam minyak (water in oil). Ketika emulsi air dalam minyak terbentuk, polimer yang larut air menjadi tidak larut yang selanjutnya terbentuk menjadi mikrokapsul di dalam minyak. Hal inilah yang membuat sintasan probiotik setelah mikroenkapsulasi masih tetap tinggi.
Gambar 5 Jumlah sel Lb. plantarum BSL dan Lb. plantarum 2C12 setelah proses mikroenkapsulasi. Rataan dengan huruf yang berbeda (a-b) menunjukkan hasil beda nyata (P<0.05).
bahwa enkapsulasi dengan menggunakan teknik emulsi tidak mengurangi jumlah sel secara beda nyata (p<0.05) dilihat dari jumlah sel setelah enkapsulasi setara dengan sel bebas. Hal serupa juga dilaporkan oleh Mokarram et al. (2009) yang menyatakan bahwa mikroenkapsulasi dengan alginat menggunakan teknik emulsi mampu menghasilkan mikrokapsul Lb. acidophilus PTCC1643 dengan sintasan tinggi (99.8%) dari jumlah sel awal berkisar antara 9.04-10.2 log cfu mL-1 dan setelah dienkapsulasi jumlah sel menjadi 9.02-10.1 log cfu mL-1 .
Pengaruh Mikroenkapsulasi Terhadap Sifat Probiotik
Ketahanan Lb. plantarum Terhadap Panas
Jumlah sel kedua strain Lb. plantarum yang tidak dienkapsulasi setelah pemanasan mengalami penurunan yang berbeda nyata dan lebih banyak dibandingkan sel terenkapsulasi. Semakin tinggi suhu pemanasan semakin banyak penurunan jumlah sel, namun sel probiotik yang terenkapsulasi terbukti mampu memperkecil penurunan jumlah sel secara beda nyata dibandingkan dengan sel bebas (Gambar 2).
Gambar 6. Efek mikroenkapsulasi terhadap penurunan jumlah sel Lb. plantarum BSL dan Lb. plantarum 2C12 setelah pemanasan pada suhu yang
Penurunan jumlah sel Lb. plantarum BSL bebas lebih banyak dibandingkan dengan Lb. plantarum 2C12. Lb. plantarum BSL terenkapsulasi mengalami
BSL bebas BSL mikrokapsul 2C12 bebas 2C12 mikrokapsul
50oC. Sedangkan pada pemanasan suhu 60 dan 70oC Lb. plantarum BSL mengalami penurunan masing-masing sebesar 4.7 dan 6.0 log cfu g-1 dari jumlah awal 10.67 log cfu g-1. Hasil serupa juga ditunjukkan oleh Lb. plantarum 2C12 terenkapsulasi yang mengalami penurunan jumlah sel lebih kecil dibanding sel bebas setelah pemanasan. Lb. plantarum 2C12 terenkapsulasi mengalami penurunan jumlah sel masing-masing sebesar 1.0; 3.2; 5.2 log cfu g-1 setelah dipanaskan pada suhu 50; 60 dan 70oC dari jumlah awal 10.02 log cfu g-1.
Ketahanan panas Lb. plantarum BSL dan Lb. plantarum 2C12 terbukti meningkat setelah dienkapsulasi dibandingkan dengan sel yang tidak dienkapsulasi (Tabel 3). Ketahanan panas kedua strain semakin menurun seiring kenaikan suhu, hal ini terlihat dari semakin turunnya sintasan Lb. plantarum pada suhu pemanasan yang lebih tinggi. Suhu pemanasan yang dapat ditoleransi dengan cukup baik oleh probiotik baik Lb. plantarum BSL maupun Lb. plantarum 2C12 adalah pada suhu 50oC.
Tabel 3 Ketahanan Lb. plantarum bebas dan terenkapsulasiterhadap pemanasan
Suhu
Jumlah sel setelah pemanasan (log cfu g-1 atau mL-1) Lb. plantarum BSL Lb. plantarum 2C12 Bebas Terenkapsulasi Bebas Terenkapsulasi
50o C 8.13aq 9.56bq 8.26cq 9.86dq
60o C 4.46ar 5.98br 4.79cr 6.80dr
70o C 1.54as 4.63bs 1.74cs 4.81ds
Ket.: Rataan dengan huruf yang berbeda (a-d) pada baris yang sama menunjukkan hasil beda nyata (P<0.05). Rataan dengan huruf yang berbeda (q-s) pada kolom yang sama menunjukkan hasil beda nyata (P<0.05).
a
Sel Cedera (Injured cell) Setelah Pemanasan
Proses pemanasan merupakan salah satu kondisi yang dapat membuat sel kehilangan aktivitasnya bahkan menyebabkan kematian sel. Sensitivitas sel terhadap NaCl 5% dapat digunakan sebagai salah satu indikator terjadinya kerusakan membran akibat pemanasan. Gambar 7 memperlihatkan bahwa sel bebas baik Lb. plantarum BSL maupun Lb. plantarum 2C12 mengalami cedera pada semua suhu pemanasan (50-70oC). Suhu pemanasan yang semakin tinggi menyebabkan sel yang cedera justru menurun, hal ini dikarenakan semakin tinggi suhu pemanasan sel cedera akan mengalami kematian sehingga hanya sel sehat yang mampu bertahan. Sel cedera pada Lb. plantarum BSL bebas dengan pemanasan 50oC 2 kali lebih banyak dibanding dengan sel cedera pada Lb. plantarum BSL terenkapsulasi (Gambar 7a). Demikian pula pada strain Lb. plantarum 2C12, dimana sel cedera pada probiotik yang tidak terenkapsulasi juga lebih banyak dibandingkan sel probiotik terenkapsulasi.
Gambar 7a Pengaruh suhu pemanasan dan mikroenkapsulasi terhadap jumlah sel cedera Lb. plantarum pada suhu 500C. Rataan dengan huruf yang berbeda (a-d) pada suhu yang sama dengan strain yang berbeda menunjukkan jumlah sel cedera yang beda nyata (P<0.05).
Ket.: BSL B: Lb. plantarum BSL Bebas; BSL M: Lb. plantarum BSL Mikrokapsul 2C12 B: Lb. plantarum 2C12 Bebas; 2C12 M: Lb. plantarum 2C12 Mikrokapsul
Pada suhu 60o dan 70o C sel cedera Lb. plantarum BSL masing-masing sebesar 1.9; 0.5 log cfu mL-1. Hal ini berbeda nyata dengan Lb. plantarum BSL terenkapsulasi dimana sel cedera setelah proses pemanasan adalah 0.8; 0.7 log cfu g-1 (Gambar 7b). Berdasarkan penurunan jumlah sel terlihat bahwa mikroenkapsulasi mampu melindungi probiotik dari cedera akibat pemanasan. Suhu pemanasan yang masih bisa ditoleransi oleh kedua strain Lb. plantarum ditandai dengan paling sedikitnya sel luka di antara suhu yang lain adalah suhu 50oC.