KAJIAN PENGARUH SUHU DAN JENIS PAKAN TERHADAP
PERKEMBANGAN STADIA DAN REPRODUKSI
KOPEPODA SIKLOPOIDA Apocyclops sp.
YANG DIKULTUR SECARA INDIVIDU
DI DALAM LABORATORIUM
MULYADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
iii ABSTRACT
Mulyadi: Study of the Temperature and Food Source Effect on Development and Reproduction Model of the Cyclopoid Copepod Apocyclops sp. That Individual Cultured in the Laboratory at Different Temperature and Food Source. Under the direction of D. DJOKOSETIYANTO dan RIDWAN AFFANDI.
Research on copepods Apocyclops sp. have been conducted since 1996 by the UNSRAT’s Faculty of Fisheries and Marine Science. The research focused more on the bioecology and reproduction characteristics. Former researchs reports a high quantity of eggs produced by the copepods Apocyclops sp. Its lifespan can reach a total number of 70 to 448 with three to four times of copulations. The research is aimed at finding out the difference effect of temperature and feed source on structure and some reproduction charactheristic of Apocyclops sp.. The copepod is individually cultured in the laboratory. Observation is focussed on the biological reproduction aspect. Variables measured include : total fecundity, intercluth, hatching ratio, copulation rate, reproduction intervals, sex ratio. The research uses experimental design to measure the effect of temperature, and food conditioned and the obtained data are analized by the ANOVA and continued by Duncan’s Multiple Range Test. The result showed that the interaction of temperature and microalgal food give no significantly different to fecundity, hatching, and growth stadia; and significantly different to intercluth, copulation, generation time, sex ratio, and age, the temperature give high significantly different effect to total fecundity, hatching, hatching ratio, intercluth, generation time, copulation, sex ratio, age, and growth stadia. Giving of microalgal Chlorella sp., Tetraselmis sp., and Nannochloropsis oculata give high significantly different effect to whole of variables measured.
iv
© Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin dari Institut Pertanian
Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak,
v
KAJIAN PENGARUH SUHU DAN JENIS PAKAN TERHADAP
PERKEMBANGAN STADIA DAN REPRODUKSI KOPEPODA
SIKLOPOIDA
Apocyclops
sp. YANG DIKULTUR
SECARA INDIVIDU DI DALAM LABORATORIUM
MULYADI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
KAJIAN PENGARUH SUHU DAN JENIS PAKAN TERHADAP
PERKEMBANGAN STADIA DAN REPRODUKSI KOPEPODA
SIKLOPOIDA
Apocyclops
sp. YANG DIKULTUR SECARA
INDIVIDU DI DALAM LABORATORIUM
Adalah bena r hasil karya sendiri dan belum dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Juli 2006 Yang menyatakan
vii
PRAKATA
Alhamdulillahirobbil’aalamiin penulis ucapkan kehadirat Allah SWT, karena hanya berkat perkenanNya thesis yang mengambil judul : Respon Struktur Perkembangan Stadia dan Pola Reproduksi Kopepoda Siklopoida Apocyclops Sp. yang Dikultur Individu dalam Laboratorium pada Suhu dan Sumber Pakan Berbeda dapat diselesaikan.
Pemilihan topik ini didasarkan pada serangkaian penelitian terhadap biologi kopepoda Apocyclops sp. yang telah dilakukan sebelumnya oleh beberapa peneliti di Fakultas Perikanan dan Ilmu Kelautan Universitas Sam Ratulangi Manado. Berpangkal tolak dari situlah kemudian penulis tertarik untuk mencoba menelitinya, khususnya struktur perkembangan stadia dan pola reproduksi dikaitkan dengan berbagai tingkatan suhu dan sumber pakan yang berbeda. Hal ini mengingat, bahwa pada beberapa penelitian sebelumnya difokuskan hanya pada satu model suhu dan satu model pemberian pakan.
Penulis merancang penelitian ini menjadi dua tahap, yaitu : 1). Pra-penelitian berupa studi tentang struktur perkembangan dan biologi reproduksi dari kopepoda Apocyclops sp. dan identifikasi serta aklimatisasi kopepoda terhadap perlakuan (suhu dan sumber pakan) yang diberikan , dan 2). Tahap penelitian berupa uji coba kultur individu kopepoda Apocyclops sp. di dalam laboratorium dengan mengamati dan mengkur parameter atau variabel struktur perkembangan dan pola reproduksinya.
Pada kesempatan ini kami menyampaikan rasa terima kasih yang tak terhingga kepada semua pihak yang telah banyak membantu kami hingga selesainya pekerjaan ini, khususnya pada para Komisi Pembimbing : 1). Bapak Dr. Ir. H. D Djokosetiyanto, DEA dan 2). Bapak Dr. Ir. H. Ridwan Affandi,DEA yang telah membimbing kami selama ini. Ibu Dr. Inneke F.M. Rumengan, MSc, yang telah banyak memberikan masukkan berupa kritik dan saran terhadap penelitian kami selama di FPIK UNSRAT Manado.
Akhirnya, kepada Allah SWT jualah kami bertawakal, semoga thesis ini dapat bermanfaat bagi perkembangan ilmu khususnya budidaya laut (marikultur).
Bogor, Juli 2006
viii
UCAPAN TERIMA KASIH
Sesungguhnya Allah SWT berfirman: “Sesunggunya Kami telah banyak memberi nikmat,… barangsiapa yang bersyukur atas nikmatKu maka akan aku tambahkan padanya, dan jika mereka kafir (ingkar) atas nikmat yang kuberi, …ketahuilah azabKu amatlah pedih” (QS Ibrahim : 7).
Patutlah kami haturkan rasa syukur dalam wujud terima kasih kepada : 1. Allah SubhanaHuwata’ala
2. Rasul Muhammad saw. Kerabat dan para shohabat r.a.
3. Ayahanda dan Ibunda (almarhumah) yang selalu mendo’akan 4. Adik-adikku yang sabar
5. Bapak Dr. Ir. D Djoko Setijanto,MSc. Selaku “Bapak”, ketua komisi pembimbing dan Pimpinan di FMIPA-UT.
6. Bapak Dr. Ir. H. Ridwan Affandi,DEA, selaku “Bapak”, anggota komisi pembimbing dan nasehat dari Bapak tidak akan pernah saya lupakan, karena nasehat itu saya dapat kembali tegar.
7. Ibu Dr. Ir. Inneke FM. Rumengan, MSc, selaku “Ibu”, “Kakak”, Teman dan “Guru” yang banyak mengajari kami tentang arti perjuangan di mata Tuhan YME dan arti sebuah kejujuran dan ketabahan.
8. Teman-teman AIR 2000, dan adik-adik di Lab. Biotek FPIK UNSRAT Manado; Marvella Barends, Alkianus, Jon, Eko A dan Eko B, dan BITEX mania semua.
viii
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 8 Januari 1969 dari ayah H. Slamet Durdjani, BA dan ibu Fornon Akulina Masael. Penulis merupakan anak pertama dari tiga bersaudara. Dan, telah menikah dengan Vilma Delvi pada tahun 2005.
ix
DAFTAR I SI
Halaman
DAFTAR TABEL ……… xi
DAFTAR GAMBAR ……… xii
DAFTAR LAMPIRAN .……… xiv
PENDAHULUAN ……… 1
Latar Belakang …..……….. 1
Batasan Masalah ………. 2
Perumusan Masalah ………..……… 2
Tujuan Penelitian ... Manfaat Penelitian ... 4 4 TINJAUAN PUSTAKA …... 5
Potensi Kopepoda Sebagai Pakan Alami ...…..……… 5
Biologi Kopepoda Apocyclops sp. ... 10
1. Sistematika kopepoda Apocyclops sp. ... 2. Kebiasaan Makanan Kopepoda Siklopoida ... 3. Habitat ... 4. Ekologi kopepoda Apocyclops sp. ... 10 14 15 15 Mikroalga Tetraselmis sp., Chlorella sp., dan Nannochloropsis oculata ... 16
1. Tetraselmis sp. ... 19
2. Chlorella sp. ... 3. Nannochloropsis oculata ... 20 21 BAHAN DAN METODE ... ... 23
Tempat dan Waktu Penelitian ... 23
Bahan dan Alat ... 23
Desain Rancangan Penelitian ... 23
1. Tahap I ... 23
a. Tujuan ... 23
b. Prosedur ... 24
2. Tahap II ... 24
a. Tujuan ... 24
b. Prosedur ... 24
Metode Penelitian ... 26
1. Penyediaan bahan dan peralatan ...……… 26
2. Kultur pakan alami sebagai sumber pakan kopepoda ... 26
3. Persiapan hewan uji (Kultur Apocyclops sp.) ... 27
4. Pelaksanaan penelitian ……….. 27
5. Variabel dan pengukuran ... 28
6. Teknik pengumpulan data ... 30
7. Pengendalian dan pengelolaan ... 30
x
HASIL DAN PEMBAHASAN ... 32
Tahap I ... 32
Galur murni (F2) kopepoda ... 32
Aklimatisasi stok hewan uji ... 32
Tahap II Fekunditas dan kemampuan penetasan telur ... 32
Kemampuan pelepasan telur ... 42
Frekwensi kopulasi dan kisaran waktu aktivitas reproduksi ... 47
Rasio Seks ... 55
Umur (’lifespan’) kopepoda ……….. 59
Waktu Perkembangan Stadia Kopepoda ...……… 62
SIMPULAN DAN SARAN ... 72
DAFTAR PUSTAKA ... 74
xi
DAFTAR TABEL
Halaman
1 Perbandingan DHA/ EPA pada kopepoda dengan naupli Artemia
yang diperkaya (Dhert 1999) ... 6 2 Komposisi asam lemak (%) beberapa pakan alami yang diberikan
pada stadium awal larva ikan Epinephelus coioides (Toledo et al.
1999 dalam Marte 2000)... 9 3 Mikroalga yang umum dikultur secara masal sebagai pakan alami di
panti-panti pembenihan ikan (Coutteau dalam Lavens dan Sorgeloos
1996; modifikasi dari De Pauw dan Persoone 1988)... 17 4 Kelebihan dan kelemahan beberapa metode kultur mikroalga
(Coutteau dalam Lavens dan Sorgeloos 1996) ... 18 5 Fekunditas total , kemampuan penetasan telur dan rasio telur yang
menetas (”Hatching Ratio/ HR”) perinduk kopepoda Apocyclops sp.
pada suhu dan sumber pakan berbeda ……… 33
6 Kopulasi dan kisaran waktu aktivitas reproduksi induk kopepoda
Apocyclops sp. pada suhu dan sunber pakan berbeda ... 48 7 Persentase rata-rata jumlah betina dari total individu kopepoda
Apocyclops sp. yang dikultur pada suhu dan pakan yang berbeda... 54 8 Rata-rata umur induk kopepoda Apocyclops sp. pada suhu dan
xii
DAFTAR GAMBAR
Halaman
1 Diagram alir permasalahan pada kultur kopepoda Apocyclops sp... 2
2 Tahap perkembangan nauplius (N1 – N6) Apocyclops sp ……….. 11
3 Tahap perkembangan kopepodit (C1 – C6) Apocyclops sp………… 12
4 Anatomi Kopepoda Siklopoida ... 13
5 Kantung telur kopepoda siklopoida betina... 13
6 Nauplii kopepoda siklopoida……….. 14
7 Organ kopepoda filter feeder……… 14
8 Habitat kopepoda siklopoida ... 15
9 Metode Batch Untuk Kultur Mikroalga (dimodifikasi dari Lee dan Tamaru (1983) dalam Lavens dan Sorgeloos 1986)... 19
10 Mikroalga Tetraselmis spp……… 20
11 Mikroalga Chlorella sp………. 21
12 Mikroalga Nannochloropsis oculata………. 22
13 Identifikasi dan penyediaan stok hewan uji... 25
14 Ruang kultur mikroalga... 27
15 Grafik nilai rata-rata fekunditas total, kemampuan penetasan telur dan ”Hatching Rate” kopepoda Apocyclops sp. pada suhu dan sumber pakan berbeda ...………. 34
16 Respon fekunditas pada suhu dan sumber pakan berbeda ... 35
17 Respon kemampuan penetasan telur (”hatching rate”) pada suhu dan sumber pakan berbeda ... 36
18 Hubungan kopulasi dengan fekunditas, ‘hatching’ dan ‘hatcing rate’ induk kopepoda Apocyclops sp. pada T1 (24±1 oC) ... 37
19 Hubungan kopulasi dengan fekunditas, ‘hatching’ dan ‘hatcing rate’ induk kopepoda Apocyclops sp. pada T2 (28±1 oC) ... 37
20 Hubungan kopulasi dengan fekunditas, ‘hatching’ dan ‘hatcing rate’ induk kopepoda Apocyclops sp. pada T3 (32±1 oC) ... 37
21 Variasi rata-rata fekunditas total induk kopepoda ... 39
22 Variasi rata-rata kemampuan penetasan telur induk kopepoda ... 39
23 Rata-rata frekwensi kemampuan pelepasan telur (‘intercluth’) induk kopepoda pada suhu berbeda... 40
xiii
pelepasan telur induk kopepoda ... 26 Interaksi pengaruh faktor pemberian pakan mikroalga pada suhu
yang berbeda terhadap pola pelepasan telur induk kopepoda
Apocyclops sp. ... 45 27 Rentang waktu awal dan akhir masa pelepasan kantung telur
kopepoda ... 46 28 Kopulasi dan Kisaran waktu aktivitas reproduksi kopepoda
Apocyclops sp. ... 49 29 Interaksi suhu pada sumber pakan berbeda terhadap kemampuan
kopulasi kopepoda ... 50 30 Interaksi pakan pada suhu berbeda berbeda terhadap kemampuan
kopulasi kopepoda ... 51 31 Interaksi suhu pada sumber pakan berbeda terhadap kisaran waktu
aktivitas reproduksi ... 52 32 Interaksi pakan pada suhu yang berbeda terhadap kisaran waktu
aktivitas reproduksi …………... 52 33 Rasio seks (perbandingan jumlah betina dari jumlah total individu)
Kopepoda ……… 55
34 Pengaruh suhu (T) pada berbagai pakan (P) ... 56 35 Pengaruh pakan (P) pada berbagai suhu (T) ... 56 36 Umur (’life span’) rata-rata induk kopepoda Apocyclops sp. pada
suhu dan sumber pakan berbeda ...
59
37 Pengaruh suhu (T) pada berbagai pakan (P) ... 60 38 Pengaruh pemberian pakan (P) pada berbagai suhu ... 60 39 Waktu perkembangan kopepoda per stadia ... 63 40 Respon Waktu perkembangan kopepoda per stadia terhadap jenis
pakan dan suhu yang berbeda ...
65
41 Respon Waktu perkembangan kopepoda per stadia terhadap suhu dan jenis pakan yang berbeda ...
xiv
DAFTAR LAMPIRAN
Halaman
1 Sampling kopepoda pada tambak pembesaran ikan banding (Chanos chanos)
di Desa Manembo-nembo Kota Bitung, Sulawesi Utara... 81
2 Kultur mikroalga (Chlorella sp., Tetraselmis sp, dan Nannochloropsis oculata sebagai sumber pakan Apocyclops sp. ... 82
3 Kultur Apocyclops sp. sebagai hewan uji ………... 84
4 Peralatan sampling dan identifikasi kopepoda siklopoida Apocyclops sp... 84
5 Peralatan pengamatan Karakteristik Biologi Reproduksi Apocyclops sp... 85
6 Literatur penelitian yang berkaitan dengan kopepoda Apocyclops sp. ... 86
7 Pengamatan karakteristik pola reproduksi Apocyclops sp. ... 87
8 Analisis Sidik Ragam Fekunditas dan kemampuan penetasan telur induk kopepoda Apocyclops sp. : (Aplikasi Komputer Sistem SAS). ... 88
9 a. Hasil uji Jarak Berganda Duncan untuk fekunditas kopepoda (aplikasi komputer program SAS). ... b. Hasil uji Jarak Berganda Duncan untuk Kemampuan Penetasan Telur kopepoda (aplikasi komputer program SAS)... 89 89 10 a. Analisis Ragam Kemampuan Pelepasan Telur Induk Kopepoda Apocyclops sp. (Aplikasi Komputer program SAS) ... b. Uji Wilayah Berganda Duncan (Aplikasi komputer program SAS). ... 90 90 11 Analisis ragam kemampuan kopulasi dan kisaran aktivitas reproduksi ... 91
12 Uji Wilayah Berganda Duncan Untuk Kopulasi dan kisaran waktu aktivitas reproduksi (Aplikasi computer program SAS) ... 92
PENDAHULUAN
Latar Belakang
Langkah-langkah pengembangan kopepoda sebagai pakan alami telah banyak dilakukan di luar negeri, namun masih terbilang sangat sedikit sekali informasi tentang penelitian dan pengembangannya di Indonesia. Sedemikian jauh penelitian tentang kopepoda masih terfokus pada jenis harpaktikoid dan kalanoid, dan sangat jarang yang meneliti tentang siklopoid. Pada kenyataannya kopepoda siklopoid memiliki beberapa kelebihan sebagai alternatif pakan alami, diantaranya adalah memiliki ukuran yang lebih kecil dan mampu menghasilkan ”resting-eggs” atau telur dorman seperti pada Artemia (Morris & Mischke, 2000; Treece & Davis, 2000).
Apocyclops sp. merupakan salah satu jenis kopepoda dari grup siklopoid, yang banyak dijumpai di perairan tropis dan memiliki kemampuan bereproduksi yang cukup tinggi. Menurut Rumengan et al. (1998), semasa hidupnya (”lifespan”) kopepoda jenis ini mampu memproduksi telur fertil sebanyak 70 sampai 448 butir dengan tiga sampai empat kali masa kopulasi. Oleh karena itu Apocyclops sp. memiliki potensi sebagai pakan alami alternatif untuk larva dan benih ikan/ udang.
Potensi ini didukung oleh penelitian sebelumnya yang melaporkan bahwa species ini mampu berdaptasi dengan lingkungan tempat hidupnya. Kemampuan adaptasinya yang tinggi tersebut telah diuji oleh Asngadi (1996), Sugeha (1996), Wulur (1997) dan Posumah (1998) yang melaporkan bahwa, Apocyclops sp. dapat beradaptasi pada kondisi laboratorium dan telah menjadi obyek penelitian yang berkelanjutan di Laboratorium Bioteknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan, Universitas Sam Ratulangi (FPIK Unsrat) sejak tahun 1996. Serangkaian penelitian yang telah dilakukan di Laboratorium Bioteknologi FPIK Unsrat banyak difokuskan pada identifikasi dan karakteristik reproduksi kopepoda melalui metode kultur individu.
2
Perkembangan stadia dan reproduksi
kopepoda.
Batasan Masalah
Pada penelitian ini, permasalahan yang ada dibatasi untuk mengkaji pengaruh suhu dan pemberian pakan berupa mikroalga terhadap pola reproduksi dan perkembangan stadia kopepoda siklopoid Apocyclops sp. Cf. A. borneoensis.
Perumusan Masalah
Permasalahan yang dapat diidentifikasi pada kultur individu kopepoda secara umum adalah : struktur dan pola reproduksinya tidak menentu. Hal ini dapat dijelaskan bahwa, bila dukungan media kultur tidak layak, kelangsungan hidup (sintasan) larva (naupli) kopepoda menjadi rendah. Sejalan dengan kondisi tersebut, pertumbuhan dan pola reproduksinya terhambat. Hal ini dimungkinkan karena kondisi lingkungan yang tidak sesuai dengan kemampuan fisiologis pada setiap stadia perkembangan larva. Di samping itu, tahapan perkembangan dan pertumbuhan naupli diketahui dari seberapa tepat manajemen pakan alami yang diberikan. Permasalahan di atas dapat diilustrasikan pada diagram alir berikut ini (Gambar 1).
- +
layak
- + - +
suhu sal
- +
- Cukup
- +
INPUT PROSES
Keterangan gambar :
Garis : kembali ke perbaikan perlakuan awal Garis : lanjut ke perlakukan berikutnya
Gambar 1 Diagram alir permasalahan pada kultur kopepoda Apocyclops sp. Kualit as
media kult ur
Kopepoda Siklopoida
Sumber Pakan
Kelangsungan hidup ( Survival
3
Untuk memecahkan permasalahan tersebut, pendekatan yang akan ditempuh adalah mengkaji kaitan antara input, proses (pengaruh perlakuan) terhadap output yang diinginkan (karakteristik biologi reproduksi Apocyclops sp.). Kajian diarahkan pada teori yang ada serta laporan hasil penelitian sebelumnya. Selanjutnya dikembangkan melalui rumusan kerangka pemikiran sebagai berikut :
a. Kopepoda memiliki struktur dan pola perkembangan per stadia, yaitu dimulai dari nauplius (N1 – N6), kopepodit (C1 – C5) hingga dewasa.
b. Ukuran dan lama waktu untuk pertumbuhan dan perkembangannya bergantung kepada kondisi media kultur dalam hal ini suhu dan salinitas serta sumber pakan yang meliputi jenis, jumlah dan kualitasnya (Rippingale & Payne 2001).
c. Pada tahapan awal kultur kopepoda, keberhasilan perkembangan stadia naupli hingga kopepodit dan pertumbuhan mencapai dewasa akan sangat ditentukan oleh kualitas telur (Rippingale & Payne 2001).
Hal ini berarti bahwa struktur dan pola reproduksi Apocyclops sp. sangat dipengaruhi oleh kondisi media kultur, suhu dan ketersediaan pakan yang sesuai cukup. Berdasarkan pola pengaturan suhu media dan penggunaan input (pakan) pada kultur Apocyclops sp., pengamatan akan dilakukan terhadap tiga proses produksi (struktur perkembangan), yaitu :
1). Sistem produksi larva awal (naupli); masa perkembangan stadia I (N1) – VI (N6),
2). Sistem produksi lanjut (kopepodit); masa perkembangan larva lanjut pada stadia I (C1) – stadia XI (C5), dan
4
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh interaksi perlakuan (suhu dan pemberian pakan) dan pengaruh tingkat perbedaan suhu dan pemberian pakan terhadap struktur perkembangan stadia dan pola reproduksi Apocyclops sp.
Manfaat Penelitian
TINJAUAN PUSTAKA
Potensi Kopepoda Sebagai Pakan Alami
Salah satu faktor penunjang dalam teknologi pembenihan adalah penyediaan pakan alami yang berkualitas. Pakan alami berkualitas merupakan syarat utama bagi keberlangsungan dan kualitas hidup larva disamping memiliki harga yang terjangkau, mudah didapat, dan tersedia dalam jumlah yang memadai. Hal ini karena pakan alami merupakan salah satu input penting dalam akuakultur, terutama pada usaha pembenihan yang digunakan sebagai sumber pakan untuk larva dan benih udang/ ikan.
Keberadaan pakan alami sangat menentukan kualitas, kuantitas dan kesinambungan benih yang dihasilkan. Oleh karena itu, pemilihan jasad pakan alami dari berbagai jenis fitoplankton ataupun zooplankton yang cocok untuk larva ikan/udang yang dikembangbiakan tidaklah mudah. Proses untuk mendapatkan jasad pakan tersebut memerlukan penelitian yang cukup panjang dan berkesinambungan.
Menurut Isnansetyo & Kurniastuty (1995) untuk mendapatkan calon organisme sebagai pakan alami yang baik memerlukan beberapa persyaratan tertentu antara lain adalah :
1. Syarat Fisik dan Biologi
Suatu organisme yang digunakan sebagai pakan alami harus tidak membahayakan bagi kehidupan larva/udang yang dipelihara, tidak mengandung bahan racun dan logam berat, serta tidak berperan sebagai inang patogen maupun parasit. Persyaratan lainnya adalah harus sesuai bukaan mulut larva, warna yang cerah sehingga mudah dilihat oleh larva, dan bergerak/ berenang aktif yang merangsang larva untuk memakannya.
2. Syarat Kandungan Gizi (Nutrisi)
6
Tabel 1 Perbandingan DHA/ EPA pada kopepoda dengan naupli Artemia yang diperkaya (Dhert 1999)
Jenis Kopepoda
Berat Kering DHA (mg/g)
Berat Kering EPA (mg/g)
DHA:EPA
Pseudocalanus acuspes 24.3 21.5 1.1
Pseudocalanus acuspes 25.8 31.6 0.8
Acartia longiremis 20.6 17.5 1.2
Calanus glacialis 24.4 20.0 1.2
Calanus finmarchicus 30.9 23.1 1.3
Pseudocalanus sp. 31.8 22.1 1.4
Temora longicornis 31.9 18.4 1.7
Zooplankton liar (temperate) 32.9 21.1 1.6
Centropages hamatis 37.7 17.2 2.2
Zooplankton liar (tropic) 32.0 13.0 2.5
Rata-rata 29 21 1.5
Naupli Artemia 16–28 10–28 0.5–1.4
3. Syarat Operasional Pengelolaan
Persyaratan ini menyangkut aspek kemudahan-kemudahan terutama apabila pembenihan tersebut akan diusahakan secara masal. Karena, segi operasional menuntut ketersediaan kultur yang konsisten, mudah melakukan pembudidayaannya secara masal melalui prosedur yang sederhana dengan biaya murah, dan mudah dalam pengelolaannya.
Ketertarikan para peneliti untuk mengkultur kopepoda dalam skala besar sebagai pakan alami diawali dengan penelitian di laboratorium tentang berbagai aspek biologinya. Penelitian terhadap kopepoda pertama kali dilakukan adalah oleh Marshall & Orr di tahun 1972 pada species Calanus finmarchicus yang populasinya sangat melimpah di Atlantik Utara. Penelitian tersebut lebih lanjut dikembangkan oleh Kinne (1977), serta Paffenhöfer & Harris (1979).
7
‘seabream’ (Pagrus major). Di Hawai kopepoda Euterpina acutifrons telah sukses dikultur dan di pakai sebagai pakan alami untuk larva ikan ‘mahi-mahi’ (Coryphaena hippurus). Dari percobaan diketahui bahwa larva ikan ternyata lebih memilih naupli kopepoda (Kraul 1990). Namun, tingkat kelangsungan hidup larva masih rendah pada minggu pertama. Diduga hal ini disebabkan adanya toksisitas media, kualitas air yang rendah atau kehadiran kontaminan berupa mikroorganisme yang merugikan.
Para akuakulturis Thailand berhasil membesarkan larva “red snapper” (Lutjanus argentimaculatus) dan kepiting bakau (Scylla serrata) dengan menggunakan teknik “green-water” dan pemberian pakan alami berupa kopepoda (Singhagraiwan & Doi, 1993). Pada awalnya usaha untuk membesarkan jenis ikan dan kepiting bakau tersebut menggunakan rotifers sebagai pakan alami, namun mengakibatkan tingkat mortalitas larva mencapai 100%. Melalui serangkaia n percobaan dengan menggunakan kopepoda dari alam seperti Acartia, Pseudodiaptomus, Oithona, dan Longipedia yang diberikan pada larva saat mencapai umur 3 - 8 hari dalam tangki yang mengandung media “Green-water”, kemudian rotifer diberikan pada saat umur larva mencapai 6 hari, sedangkan naupli Artemia diberikan pada umur 10 hari, diketahui bahwa dalam kandungan usus larva ikan mengandung 88% naupli kopepoda saat larva mencapai umur 15 hari.
Selanjutnya, Doi et al. (1994) mengembangkan kopepoda Acartia dengan mengkulturnya secara masal di luar ruangan, dan diberikan pada larva Lutjanus argentimaculatus. Dari penelitiannya didapatkan hasil bahwa, naupli Arcatia
8
D'Abramo & Lovell (1991) dalam penelitiannya melaporkan bahwa defisiensi pakan terhadap nutrisi esensial merupakan penyebab utama tingginya tingkat mortalitas pada larva dan juvenile ikan. Menurut penelitian yang dilakukan oleh Moreno et al. (1979) diketahui bahwa kopepoda memiliki kelengkapan nutrisi yang dibutuhkan oleh larva pada masa awal perkembangannya, terutama sekali kaya akan asam lemak 16:0, 16:1, 20:5n-3 dan 22:6n-3. Kemampuan larva dalam mensintesis nutrient tersebut (terutama 22:6n-3), membuat larva ikan lebih menyukai naupli kopepoda sebagai makanan (Nanton & Castell 1999).
Dari beberapa penelitian juga diketahui, bahwa kopepoda memiliki pergerakan aktif yang mampu menarik perhatian larva dan benih ikan untuk memakannya, mudah dicerna oleh ikan, dan relatif kaya akan zat gizi seperti asam-asam amino, vitamin-vitamin (vitamin-vitamin C) dan asam-asam lemak terutama asam ikosapentanoat (C20:5ω3) dan
asam dekoheksanoat (C22:6ω3) yang berguna bagi ikan (Poulet & William 1991). Di
samping itu kopepoda juga memiliki berbagai macam ukuran (naupli-kopepodit-dewasa) yang cocok untuk pakan larva pada berbagai stadia, sehingga hanya diperlukan satu kultur zooplankton saja untuk berbagai ukuran larva ikan/ udang. Disamping itu kopepoda juga banyak mengandung nutrisi lainnya seperti enzim dan karotenoid (tergantung pada jenis) yang juga dibutuhkan oleh larva dalam masa perkembangannya (Toledo et al. 1999).
Menurut Treece & Davis (2000), di alam larva dan juvenil ikan/ krustase laut mengkonsumsi telur-telur dan naupli kopepoda pada awal kehidupannya. Hal ini karena beberapa spesies kopepoda memiliki ukuran naupli yang sangat kecil (lebih kecil daripada rotifer). Di samping itu kopepoda mengandung asam lemak esensial seperti PUFA dan HUFA, serta nutrisi esensial lainnya yang dapat menunjang perkembangan dan pertumbuhan larva ikan dan udang laut. Kenyataan tersebut telah diujikan oleh Ludwig (1999), Marte (2000), Treece & Davis (2000), Semmens & Knuckey (2001) dan ADC (2001) dalam suatu penelitian terhadap larva ikan “red-snapper”, “turbot”, “grouper” dan “dhufish”.
9
sehingga merangsang larva-larva ikan tersebut untuk memangsanya, serta memiliki kandungan nutrisi yang dibutuhkan untuk pertumbuhannya. Keistimewaan lain yang dimiliki oleh kopepoda adalah ditemukannya kandungan n-3 (HUFA) dua kali lebih besar dari rotifers (Tabel 2).
Tabel 2 Komposisi asam lemak (%) beberapa jenis pakan alami yang biasa diberikan pada stadium awal larva ikan Epinephelus coioides (Toledo et al. 1999 dalam Marte 2000).
Jenis Asam Lemak Pseudodiaptomus (harpatikoida) Acartia (kalanoida) Oithona (siklopoida) Brachionus (rotifer)
∑ Jenuh
∑ Tak jenuh
∑ n-6
∑ n-3
∑ n-3 HUFA n—3/n-6 DHA/EPA 14:0 16:0 16:1 18:0 18:1 18:2n-6 18:3n-6 18:3n-3 18:4n-3 20:1 20:2n-6 20:4n-6 20:4n-3 20:5n-3 22:0 22:1 22:5n-6 22:5n-3 22:6n-3 24:0 42.86 15.33 7.72 29.55 23.75 3.83 1.37 8.97 24.33 8.22 4.94 5.15 2.15 0.46 3.45 1.97 0.46 0.41 1.71 0.57 9.24 0.33 0.23 1.79 0.89 12.70 0.36 44.17 8.84 8.14 36.01 34.48 4.42 2.64 4.54 26.68 2.85 8.26 4.53 2.35 0.32 0.99 0.43 0.26 0.37 2.33 0.20 5,32 0.41 0,27 1,07 0,77 10,14 0,54 63.01 15.95 1.60 12.18 10.74 2.65 1.28 10.88 32.49 6.43 12.45 7.30 1.28 0.37 0.47 0.67 1.50 0.24 1.35 0.22 4.22 0.48 0.13 0.33 0.69 5.42 0.75 39.94 29.76 10.50 13.88 13.35 1.11 0.02 4.34 28.38 13.28 5.10 12.22 6.07 0.50 0.16 0.17 2.61 0.12 3.64 0.46 8.26 0.10 0.59 - 4.39 0.17 0.23
Namun demikian, kultur masal kopepoda hingga saat ini masih terdapat beberapa kendala. Secara alami, kepadatan kopepoda tidak seperti pada rotifer atau mikroalgae, dan disamping itu kopepoda lebih sensitif pada penanganan dan persyaratan kualitas airnya. Kopepoda ’filter-feeding’ seperti Acartia tonsa membutuhkan volume air yang besar dan mampu menghasilkan 530 telur tiap liter, sedangkan Tisbe holothuriae menghasilkan 100.000 nauplii perliter yang dikultur dalam skala kecil dalam wadah berukuran 3 liter ( Støttrup & Norsker 1997; Støttrup et al. 1998).
10
sehingga ditemukan jenis yang tepat (cocok) sebagai pakan alami, khususnya dalam budidaya laut (marikultur). Di Indonesia dari sekian banyak jenis kopepoda, Apocyclops sp. memiliki potensi untuk dikembangkan sebagai organisme pakan alami bagi usaha pembenihan. Sebagaimana penelitian yang dilakukan beberapa negara tersebut di atas, obyek yang perlu diteliti adalah menyangkut struktur dan pola reproduksi (biologi reproduksi). Hal ini dikarenakan kedua aspek tersebut merupakan aspek mendasar (langkah awal) dalam mengungkap potensi Apocyclops sp. sebagai alternatif pakan alami di masa mendatang.
Biologi Kopepoda Apocyclops sp.
1. Sistematika kopepoda Apocyclops sp.
Secara umum Apocyclops sp. dewasa dapat dilihat dengan mata telanjang, namun untuk dapat membedakan jantan dan betina serta naupliusnya dengan menggunakan mikroskop stereoskopik (pembesaran 7x – 40x). Sedangkan untuk keperluan pengamatan anatomi kopepoda Apocyclops sp. membutuhkan mikroskop dengan skala pembesaran lebih besar (40x – 400x).
Klasifikasi kopepoda Apocyclops sp. menurut Linberg (1954) dalam Sugeha (1996) adalah sebagai berikut :
Klas : Crustacea Sub-klas : Copepoda Ordo : Cyclopoida Famili : Cyclopidae Genus : Apocyclops
Species : Apocyclops sp. Cf. A. borneoensis
11
Naupli 1 Naupli 2 Naupli 3
Naupli 4 Naupli 5 Naupli 6
Perbedaan utama antara tahap nauplius dengan tahap kopepodit yaitu, pada tahap nauplius belum dapat dibedakan antara jantan dan betinanya, serta metasoma dan urosoma. Pada tahap kopepodit perbedaan tersebut sudah mulai tampak. Metasoma tersusun atas segmen kepala dan segmen toraks, sedangkan pada urosoma terdiri atas segmen genital, segmen abdominal, dan cabang ekor (Sugeha 1996).
12
Kopepodit 1 Kopepodit 2 Kopepodit 3
Kopepodit 4 Kopepodit 5 Dewasa (? )
Gambar 3. Tahap perkembangan kopepodit Apocyclops sp. (Pembesaran 400 x).
13
Siklopoida betina memiliki sepasang kantung telur dan biasanya dengan jumlah telur yang cenderung sama (Steiddinger & Walker 1984). Telur siklopoida umumnya terbungkus selaput sebagai hasil sekskresi saluran telur dan berfungsi sebagai ruang pengeraman (Gambar 5).
Gambar 5. Kantung telur kopepoda siklopoida betina (http:// www.uni- oldenburg.de /zoomorphplogy/biology 2000, downloaded, 12 Desember 2003).
Mata tunggal Nauplius Antenna ke-1 dan ke-2
Maksilia ke-1 dan ke-2 Maksiliped
Empat pasang kaki renang biromous
Kantung telur
Gambar 4. Anatomi kopepoda siklopoid (Newell & Newell 1963 dalam Asngadi 1996).
14
Telur-telur kemudian menetas menjadi nauplii (Gambar 6) dan akan melalui 12 tahap dalam siklus kehidupannya (Goldman & Horne 1983).
Gambar 6. Nauplii kopepoda siklopoida (http://www.uni-oldenburg.de /zoomorphplogy/biology 2000, downloaded, 12 Desember 2003).
2. Kebiasaan makanan kopepoda siklopoida
Kopepoda siklopoida umumnya memakan fitoplankton dengan menyaringnya melalui rambut-rambut (setae) halus yang tumbuh pada appendiks tertentu yang mengelilingi mulut (maksilia), atau biasanya dengan cara langsung menangkap fitoplankton dengan kaki-kaki renangnya, seperti pada jenis Thermocyclops sp., Eucyclops sp. dan Apocyclops sp. (Gambar 7).
Gambar 7 Organ penyaring makanan (filter) pada kopepoda (Raymont 1980).
Nannochloropsis oculata
Chaetoceros sp.
15
3. Habitat
Menurut Raymont (1980), dari total 70% species planktonik yang hidup di
perairan 5% diantaranya adalah kopepoda siklopoida. Siklopoida tersebar hampir di seluruh perairan mulai dari kedalaman laut sampai pada ketiggian di gunung Himalaya (Gambar 8). Peta penyebaran kopepoda siklopoida di laut, menurut Shuvalov (1975) dalam Raymont (1980) terdapat di seluruh perairan, dimulai dari laut Atlantik Utara, Pasifik Utara, Artic, Mediteranian, Laut Hitam, Laut Merah, dan wilayah lautan tropis, serta wilayah perairan laut bagian selatan bumi. Siklopoida dapat di temukan diseluruh lapisan air, sedangkan harpatikoida umumnya terdapat di dasar perairan dan kalanoida di bagian lapisan atas atau permukaan air.
4. Ekologi kopepoda Apocyclops sp.
Apocyclops sp. merupakan jenis kopepoda siklopoida yang banyak dijumpai di perairan tropis, khususnya tambak-tambak air payau di wilayah Kota Bitung (sekitar 30 km arah Manado) Sulawesi Utara (Rumengan et al. 1998). Kondisi suhu perairan tambak berkisar antara 26 -27 oC di pagi hari (pukul 02.00 WITA) dan 32 oC – 34 oC di siang hari (pukul 14.00 WITA). Sedangkan salinitas perairan berkisar antara < 20 – 42 ppt (Mogea 1995). Selanjutnya dikatakan oleh Mogea (1995), bahwa tingginya
dataran tinggi
sungai estuari
Permukaan laut
Laut dalam
16
salinitas pada saat bulan mati disebabkan karena penguapan yang tinggi. Perbedaan kepadatan tertinggi kopepoda di lokasi perairan tersebut terjadi pada bulan November dan Desember yakni pada perbani akhir dan kepadatan terendah pada saat bulan mati. Kepadatan yang berbeda kopepoda di perairan muara Manembo-nembo Kota Bitung tersebut diduga disebabkan oleh faktor-faktor ketersediaan makanan, kondisi lingkungan perairan, dan kehadiran predator. Jenis-jenis fitoplankton yang umum ditemukan adalah dari jenis diatom dan dinoflagellata.
Mikroalga Tetraselmis sp., Chlorella sp., dan Nannochloropsis oculata
Mikroalga umumnya diproduksi masal sebagai pakan untuk zooplankton (rotifer, kopepoda, Artemia dan lain-lain) dan sebagai pakan alami pada tahap awal masa perkembangan larva ikan dan udang (Coutteau dalam Lavens & Sorgeloos 1996). Disamping penggunaannya dalam metode “green-water” untuk pemeliharaan larva dalam wadah (tangki) terkontrol, yang diyakini oleh para ahli memiliki kemampuan dalam mempertahankan kualitas air, penyumbang nutrisi bagi larva dan kontrol mikroba.
Brown (2001) melaporkan bahwa di Australia penggunaan mikroalga menjadi faktor kunci dalam produksi larva tiram (mutiara dan pasifik), udang, ‘barramundi’, dan juvenile abalone, serta species-species penting lainya. Selama bebrapa tahun terakhir, lebih dari seratus jenis mikroalga telah diuji coba sebagai pakan alami untuk larva, namun tidak lebih dari 20 jenis saja yang diketahui baik sebagai pakan dan secara luas digunakan pada pembenihan (hatchery) di seluruh dunia. Selanjutnya dikatakan oleh Brown (2001), bahwa mikroalga sebagai pakan memiliki syarat harus dapat dicerna (paling tidak berukuran 1 – 15 mikron untuk jenis ‘filter feeder), mudah diserap, cepat bertumbuh, gampang dikultur masal, dan juga stabil dalam situasi fluktuasi suhu, cahaya dan faktor-faktor lainnya pada kondisi sistem atau model kultur yang dipakai di hatchery. Pada akhirnya, mikroalga pakan tersebut harus memiliki komposisi nutrisi atau zat gizi yang baik dan tidak mengandung atau membawa toksin (racun).
17
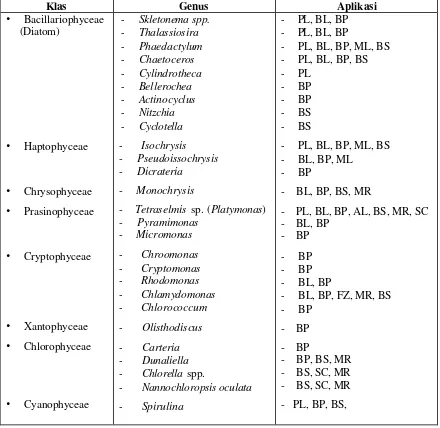
Tabel 3 Mikroalga yang umum dikultur secara masal sebagai pakan alami di panti-panti pembenihan ikan (Coutteau dalam Lavens & Sorgeloos 1996; De Pauw & Persoone 1988).
Klas Genus Aplikasi
• Bacillariophyceae (Diatom) • Haptophyceae • Chrysophyceae • Prasinophyceae • Cryptophyceae • Xantophyceae • Chlorophyceae • Cyanophyceae
- Skletonema spp.
- Thalassiosira - Phaedactylum - Chaetoceros - Cylindrotheca - Bellerochea - Actinocyclus - Nitzchia - Cyclotella - Isochrysis
- Pseudoissochrysis
- Dicrateria
- Monochrysis
- Tetraselmis sp. (Platymonas)
- Pyramimonas
- Micromonas
- Chroomonas - Cryptomonas - Rhodomonas - Chlamydomonas - Chlorococcum - Olisthodiscus - Carteria - Dunaliella
- Chlorella spp.
- Nannochloropsis oculata
- Spirulina
- PL, BL, BP
- PL, BL, BP
- PL, BL, BP, ML, BS
- PL, BL, BP, BS
- PL
- BP
- BP
- BS
- BS
- PL, BL, BP, ML, BS
- BL, BP, ML
- BP
- BL, BP, BS, MR
- PL, BL, BP, AL, BS, MR, SC - BL, BP
- BP
- BP
- BP
- BL, BP
- BL, BP, FZ, MR, BS
- BP
- BP - BP
- BP, BS, MR - BS, SC, MR - BS, SC, MR - PL, BP, BS,
Keterangan :
PL, Larva udang penaid; BL, larva moluska (bivalve); ML, larva udang air tawar; BP, postlarva moluska (bivalve); AL, larva abalone; MR, rotifer (Brachionus); BS, Artemia; SC, kopepoda laut; FZ, zooplankton air tawar.
Menurut Coutteau dalam Lavens & Sorgeloos (1996), produksi mikroalga dalam skala besar (kultur masal) secara umum menggunakan beberapa metode berikut , yaitu : 1. Metode di dalam/di luar ruangan (“indoor/outdoor”);
18
Adapun kelebihan dan kelemahan beberapa metode kultur mikroalga pakan disajikan pada Tabel 4 berikut ini :
Tabel 4 Kelebihan dan kelemahan beberapa metode kultur mikroalga (Coutteau dalam Lavens & Sorgeloos 1996).
Metode Kultur Kelebihan Kelemahan
Indoor (dalam ruangan) Terkontrol Mahal
Outdoor (luar ruangan) Murah Kurang terkontrol
Terbuka (open) Murah Mudah terkontaminasi
Tertutup (closed) Kontaminan dapat dideteksi (terkontrol)
Mahal
Axenic Terprediksi, Sukar, mahal
Non-axenic Murah, mudah
pengoperasiannya
-
Batch Mudah, Kurang efisien, kualitas
kurang konsisten Kontinu Efisien, otomatis, laju
produksi tinggi tiap skala waktu, kualitas sel yang dihasilkan sangat konsisten
Sukar, biasanya hanya pada produksi skala kecil, peralatan yang digunakan mahal,
kompleks. Semi-kontinu Mudah, efisien pada item
tertentu
Kualitas sel yang dihasilkan tidak menentu, kurang
19
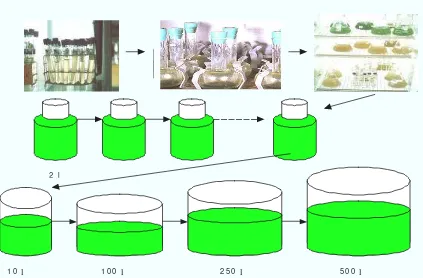
Gambar 9 Metode Batch Untuk Kultur Mikroalga (Lee & Tamaru 1983 dalam Lavens & Sorgeloos 1986).
1 . Tet raselmis sp.
Tetraselmis sp. merupakan mikroalga yang tergolong sebagai alga biru-hijau (Cyanophyceae) yang memiliki flagella sehingga dapat bergerak aktif (Gambar 10). Menurut Isnansetyo & Kurniastuty (1995) klasifikasi Tetraselmis sp. adalah sebagai berikut :
Filum : Chlorophyta Klas : Prasinophyceae Ordo : Pyramimonadales Genus : Tetraselmis
Species : T. chuii, T. tetrathele, T. suecica.
2 5 0 ml
2 l
l 1 0 0 l
20
Adapun morfologi dan karaketristik mikroalga Tetraselmis spp. antara lain adalah: • Merupakan alga bersel tunggal dengan empat buah flagella yang berwarna hijau
(green flagella) sehingga mampu bergerak aktif.
• Khlorofil merupakan pigmen yang dominan dikandungnya sehingga mikroalga ini berwarana hijau dengan dipenuhi plastida kloroplast.
• Tetraselmis sp. memiliki ukuran sel sebesar 9 – 14 milimikron (Marini 2002). • Dinding sel terbentuk dari selulosa dan pektosa.
• pH optimum 6.9 – 8.0 (Marini 2002)
• Memiliki kisaran toleransi salinitas antara 15 – 36 ppt.
• Kisaran suhu untuk pertumbuhannya adalah 15o – 36o C. Sedangkan optimum suhunya adalah 20° - 24o C.
[image:34.596.217.379.368.509.2]• Kondisi pencahayaan berkisar antara 1.000 – 20.000 lux (Marini 2002). • Reproduksi secara akseksual (mitosis) dan dapat juga secara seksual (meosis).
Gambar 10 Mikroalga Tetraselmis sp. 2. Chlorella sp.
Chlorella sp. merupakan alga hijau yang terdapat di perairan tawar maupun laut.
Klasifikasi Cholrella sp. menurut Bold dan Wayn (1985) dalam Isnansetyo dan Kurniastuty (1995) adalah sebagai berikut :
21
Chlorella yang hidup di perairan laut antara lain adalah : Chlorella minutissima,
C. vulgaris, C. pyrenoidosa, dan C. virginica. Beberapa sifat morfologis dan karakteristik Chlorella sp. adalah sebagai berikut :
• Bentuk sel Chlorella bulat atau oval yang merupakan mikroalga bersel tunggal (“unicellular”), namun tidak jarang dijumpai dalam keadaan bergerombol.
• Berwarna hijau karena pigmen klorofil yang dikandungnya, dinding selnya keras terdiri dari selulosa dan pektin.
• Chlorella memiliki ukuran sel sebesar 2 – 8 milimikron (Marini 2002).
• Sel Chlorella mampu bergerak, namun sangat lambat sehingga dalam pengamatan mikroskop seolah-olah tak bergerak.
• Chlorella sp. merupakan mikroalga yang bersifat kosmopolit.
• Mikroalga ini mampu tumbuh pada kisaran salinitas 0 – 35 ppt. Tetapi salinitas optimum untuk pertumbuhannya berkisar antara 10 – 20 ppt.
• Mikroalga ini masih dapat bertahan hidup hingga suhu 40o C, namun tidak dapat bertumbuh. Kisaran optimum suhu untuk pertumbuhannya berkisar antara 25o – 30o C.
[image:35.596.223.381.477.604.2]• Bereproduksi secara aseksual yaitu dengan pembelahan sel (mitosis), akan tetapi dapat pula dengan pemisahan autosporanya (meosis).
Gambar 11 Mikroalga Chlorella sp.
3. Nannochloropsis oculata
22
Klasifikasi mikroalga Nannochloropsis oculata menurut Marini (2002) adalah : Filum : Chlorophyta
Klas : Eustigmatophyceae Ordo : Pyramimonadales Genus : Nannochloropsis Species : N. oculata.
Beberapa ciri morfologis dan karakteristik N. oculata antara lain adalah :
• Alga ini dikenal juga sebagai Chlorella-laut (marine-chlorellas), namun memiliki flagella.
• Berwarna hijau gelap dengan dinding sel tebal dan memiliki ukuran 2 – 4 milimikron (Marini 2002).
• N. oculata memiliki kandungan omega-3 HUFA (berkisar antara 16-42%) yang didominasi EPA, dan sedikit DHA. Dari studi yang dilakukan oleh Okauchi et al. (1990) diketahui bahwa kandungan EPA yang paling tinggi dicapai pada 7 hari setelah kultur.
• N. oculata juga mengandung vitamin B12 yang sangat dibutuhkan oleh larva
dimasa pertumbuhannya untuk bertahan hidup dan perlindungan terhadap penyakit.
• pH optimum untuk pertumbuhannya berkisar antara 7 – 8.4 (Marini 2002).
• Suhu pertumbuhan berkisar antara 20o – 31o C , sedangkan suhu optimumnya adalah 24o C (Marini 2002).
• Salinitas optimum yang diinginkan mikroalga ini adalah 22 – 25 ppt.
[image:36.596.242.405.576.692.2]• Kondisi pencahayaan (iluminasi) berkisar antara 4.000 – 5.000 lux (Marini 2002).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Sam Ratulangi, Manado. Kegiatan penelitian dilakukan selama 270 hari kerja yang terbagi dalam 2 tahap. Tahap I berlangsung selama 150 hari dari September 2002 hingga Pebruari 2003 dan tahap II, yang berlangsung selama 120 hari dari bulan Mei hingga September 2003.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah: kopepoda siklopoida Apocyclops sp., mikroalga Tetraselmis sp., Chlorella sp., dan Nannochloropsis oculata,
filtrat air laut bersalinitas 20 ppt, air suling, dan medium Hirata. Adapun peralatan yang digunakan adalah: tabung reaksi, beker glas, labu erlenmeyer, mikroskop coumpond stereoskopik model XN Japan (pembesaran 7 – 40x), mikroskop olympus Tokyo 219998 (pembesaran 40 – 400x), refraktometer PIKA Tokyo S – 10, jaring plankton berukuran mata jaring 40 milimikron, galon/ jerigen kapasitas 20 – 25 l air, pipet, haemacytometer, aspirator dan kertas saring GF/D Whatman, stoples, botol kultur, gelas ukur, kapas, alumunium foil, otoklaf, hand counter, pengaduk, refraktometer, aerator, sumbmersible aquarium pump, aspirator dan kertas saring, pemanas akuarium (heater), blower, dan slang akuarium.
Desain Rancangan Penelitian
Penelitian dirancang melalui metode penelitian laboratorium (’experimental laboratory’) dan didesain dengan menggunakan rancangan percobaan (Mattjik & Sumertajaya 2000). Kegiatan penelitian dilakukan dalam dua tahap, yaitu tahap I, berupa kegiatan pra-penelitian, dan tahap II, berupa kegiatan penelitian pada aspek perkembangan stadia dan beberapa karakteristik biologi reproduksi Apocyclops sp. Tahap I
Penelitian tahap I (pra-penelitian) bertujuan untuk mendapatkan galur murni F2
24
Tahap pra-penelitian dilakukan dengan mengikuti prosedur atau langkah-langkah kegiatan sebagai berikut:
1. Mengkaji beberapa aspek penelitian terdahulu tentang kopepoda siklopoida Apocyclops sp. Cf. A. borneoensis melalui kegiatan studi literatur (Lampiran 6). 2. Identifikasi ulang jenis species kopepoda siklopoida Apocyclops sp. Cf.
Apocyclops borneoensis yang diambil dari pertambakkan ikan bandeng (Chanos chanos) di desa Manembo-nembo kota Bitung Sulawesi Utara (Lampiran 1). Proses ini dilakukan karena adanya kekosongan stok kultur murni Apocyclops sp. di Laboratorium Bioteknologi Kelautan FPIK Unsrat Manado.
2. Kultur mikroalga Tetraselmis sp., Chlorella sp. dan N. oculata sebagai stok pakan kopepoda Apocyclops sp. (Lampiran 2).
3. Penyediaan stok kopepoda untuk hewan uji (Lampiran 3).
4. Aklimatisasi stok kopepoda masing-masing pada suhu 24±1oC, 28 ±1 oC, dan 32±1oC, dan diberi pakan mikroalga Tetraselmis sp., Chlorella, dan N. oculata (Lampiran 3).
5. Pemilihan bakal induk kopepoda jantan dan betina siap bertelur dengan perbandingan empat ekor jantan dengan seekor betina yang dimasukkan ke dalam 50 buah tabung yang berisi air laut sebanyak 2 ml yang bersalinitas 20 ppt, pada masing-masing suhu dan sumber pakan yang berbeda.
Tahap II
Pada tahap ini, penelitian bertujuan untuk mengkaji ada tidaknya pengaruh interaksi perlakuan yang diberikan (suhu dan sumber pakan) dan pengaruh faktor suhu serta sumber pakan yang tepat (layak) untuk pertumbuhan dan perkembangan Apocyclops sp. dilihat dari beberapa karakteristik reproduksinya (biologi reproduksi),
yaitu: fekunditas total, rentang hidup dan kemampuan pelepasan telur, kemampuan menetas, kemampuan kopulasi, kisaran waktu aktivitas reproduksi, rasio seks, dan waktu perkembangan perstadia.
Pada tahap II, pelaksanaan penelitian dilakukan dengan mengikuti prosedur sebagai berikut ini:
25
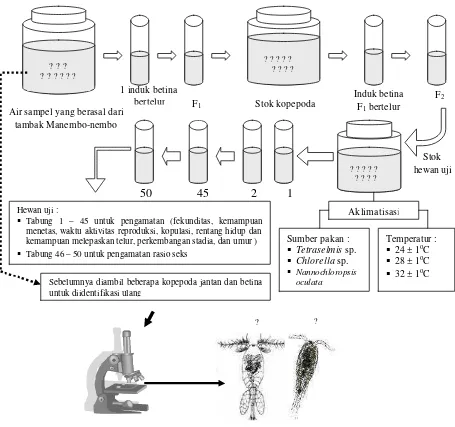
Hewan uji :
§ Tabung 1 – 45 untuk pengamatan (fekunditas, kemampuan menetas, waktu aktivitas reproduksi, kopulasi, rentang hidup dan kemampuan melepaskan telur, perkembangan stadia, dan umur )
§ Tabung 46 – 50 untuk pengamatan rasio seks
adalah jenis pakan yang terdiri dari tiga taraf, yaitu : Tetraselmis sp., Chlorella, dan N. oculata.
b. Pembuatan 50 unit percobaan berdasarkan pola perlakuan ya ng diberikan dan variabel yang diamati.
c. Unit percobaan berupa tabung kultur yang masing-masing tabung diisikan hewan uji berupa satu ekor induk betina siap bertelur dengan dua ekor induk jantan. d. Mengamati dan mengukur respon struktur perkembangan stadia dan pola
reproduksi berdasarkan variabel yang telah ditetapkan sebelumnya.
Secara umum prosedur penelitian tahap I dan II diilustrasikan pada gambar 13 berikut ini:
50 45 2 1
?
?
Stok hewan uji
F2
Induk betina F1 bertelur
1 induk betina
bertelur Stok kopepoda
? ? ? ? ?? ? ? ?
? ? ? ? ? ? ? ? ?
Air sampel yang berasal dari tambak Manembo-nembo
F1
[image:39.596.71.526.292.719.2]Sebelumnya diambil beberapa kopepoda jantan dan betina untuk diidentifikasi ulang
Gambar 13. Identifikasi dan penyediaan stok hewan uji
Temperatur : § 24 ± 1oC § 28 ± 1oC § 32 ± 1oC Sumber pakan :
§ Tetraselmis sp. § Chlorella sp. § Nannochloropsis
oculata
Aklimatisasi ? ? ? ? ?
26
Metode Penelitian
1. Penyediaan bahan dan peralatan
Kegiatan ini meliputi pembersihan serta sterilisasi bahan dan peralatan. Wadah kultur yang digunakan berupa tabung reaksi, labu-labu erlenmeyer, stoples dan peralatan lainnya seperti pipet, gelas ukur, cawan arloji yang sebelumnya disterilisasi terlebih dahulu dengan otoklaf.
Air laut yang digunakan sebagai media kultur diperoleh dari perairan Teluk Manado dengan salinitas 33 ppt. Air laut ditampung dalam galon dengan kapasitas 20 – 25 liter dan dibiarkan selama 48 jam kemudian disimpan dalam ruangan tanpa cahaya. Hal ini dimaksud untuk menghentikan laju proses fotosintesis di dalamnya.
Air laut tersebut selanjutnya disaring (filtrasi) dan kemudian dibuat sesuai dengan salinitas yang diinginkan (20 ppt) melalui proses pengenceran dengan penambahan air aqua. Air laut yang telah difiltrasi tersebut kemudian disterilisasi dengan otoklaf pada suhu 1210C dan ditampung dalam wadah (labu 1000 ml) sebagai stok. Filtrat air laut ini lah yang dijadikan sebagai media kultur untuk mikroalga dan hewan uji.
2. Kultur pakan alami sebagai sumber pakan kopepoda
a) Jenis mikroalga yang dipakai sebagai sumber pakan untuk kopepoda siklopoida Apocyclops sp. adalah Tetraselmis sp., Chlorella, dan Nannochloropsis oculata
yang diambil dari stok kultur murni pada Laboratorium Bioteknologi Kelautan. Ruang laboratorium tempat penelitian dilengkapi dengan alat pendingin (AC) dengan suhu 24o C, dan pada lemari kultur dipasang lampu TL 20 watt dengan intensitas cahaya 1,2 K.lux sebagai alat penerang yang berfungsi juga sebagai sumber cahaya untuk mikroalga melakukan fotosintesis. Sedangkan media kultur yang digunakan untuk mikroalga tersebut adalah medium Hirata.
27
[image:41.596.171.424.164.365.2]erlenmeyer ditambah medium kultur hingga mencapai 250 ml. Langkah tersebut terus dilakukan pada labu ukuran 500 ml hingga 1000 ml. Media diaerasi dan ditempatkan di dalam rak kultur di bawah cahaya lampu TL 20 watt pada ruangan yang dilengkapi alat pendingin AC dengan suhu 24oC.
Gambar 14 Ruang kultur mikroalga 3. Persiapan Hewan Uji (Kultur Apocyclops sp.)
a. Hewan uji berupa kopepoda siklopoida diambil dari lokasi tambak di desa Manembo-nembo, Bitung Sulawesi Utara.
b. Dari sampel air tambak Manembo-nembo, diambil beberapa kopepoda jantan dan betina untuk diidentifikasi kembali jenisnya (Apocyclops sp.). Proses identifikasi didasarkan pada Lindberg (1954) dan Sugeha (1996).
c. Setelah diketahui pasti bahwa kopepoda tersebut adalah jenis Apocyclops sp., kemudian diambil 10 kopepoda betina dewasa siap bertelur (C5 – C6).
d. Ditaruh dalam tabung reaksi (10 tabung) dengan perbandingan dua ekor jantan untuk satu ekor betina dan dibiarkan sampai terjadi kopulasi.
e. Setelah terjadi pelepasan telur dan penetasan (“hatching”) induk diangkat dengan menggunakan pipet.
f. Naupli (F1) dibiarkan hingga mencapai dewasa (C5 – C6) dan dipisahkan antara
jantan dan betinanya.
g. Kopepoda dewasa dari F1 tersebut kemudiaan dibiarkan saling kawin (kopulasi)
untuk menghasilkan turunan F2nya.
28
i. Aklimatisasi stok kopepoda masing-masing pada suhu 24 ± 1oC, 28±1 oC, dan 32±1 oC, dan diberi pakan mikroalga Tetraselmis sp., Chlorella, dan N. oculata. j. Stok Apocyclops sp. kemudian dikultur dalam tiga wadah (stoples) berbeda pada
suhu yang berbeda (24±10C, 28±10C, dan 32±10C), salinitas 20 ppt, dan diberi pakan berupa mikroalga Tetraselmis sp., Chlorella spp., dan N. oculata sebanyak 1 x 105 sel/ ml.
k. Untuk meminimalkan fluktuasi suhu, maka wadah dimasukkan dalam bak fiber yang diberi pemanas (’heater’) dengan pengatur suhu dan pompa air akuarium (‘submersible aquarium pump’).
4. Pelaksanaan penelitian
Penenelitian terhadap struktur dan pola reproduksi Apocyclops sp. pada prinsipnya mengikuti prosedur (langkah-langkah) penelitian sebelumnya yang dilakukan oleh Sugeha, 1996; Regah, 1996; Midi, 1996; Asngadi, 1996; Mogea, 1996; Kumolontang, 1996; Wulur, 1997; Posumah, 1998; dan Mandik, 1999. Namun semua penelitian masih diarahkan hanya pada satu kondisi suhu saja yaitu 24±1oC dan satu sumber pakan, yaitu mikroalga seperti Tetraselmis sp., N. oculata, Dunaliella dan atau Chlorella.
Satu ekor induk betina dan dua ekor jantan diambil dari stok hewan uji yang siap bertelur dimasukkan ke dalam tabung (tabung 1 – tabung 50) yang berisi 1 ml media kultur (air laut) dengan salinitas 20 ppt masing-masing pada suhu yang berbeda (24±1oC, 28±1oC, dan 32±1oC). Tabung 1 – 45 adalah untuk pengamatan : fekunditas total, kemampuan menetas, kemampuan pelepasan telur, kemampuan kopulasi dan kisaran waktu aktivitas reproduksi, umur (rentang waktu) dan perkembangan stadia kopepoda, sedangkan tabung 46 - 50 adalah untuk pengamatan rasio seks (gambar 13). Kopepoda Apocyclops sp. diberi pakan berupa mikroalga Tetraselmis sp., Chlorella sp. dan N. oculata dengan kepadatan 1 x 105 sel/ ml (Asngadi, 1996; Wulur, 1997; dan Posumah, 1998). Selanjutnya diamati dan diukur sesuai dengan variabel yang ditentukan.
5. Variabel dan Pengukuran
29
a. Fekunditas total dan Kemampuan Telur Menetas
Fekunditas pada Apocyclops sp. adalah jumlah telur yang dihasilkan oleh induk betina dalam satu tahap fertilasi. Pengukuran fekunditas total dilakukan untuk mengetahui jumlah total telur yang dimiliki oleh kopepoda betina setelah kopulasi berlangsung. Nauplii yang berhasil menetas dan telur-telur yang tidak menetas (infertil) dari peristiwa penetasan dihitung. Jumlah naupli dan telur infertil tersebut dihitung secara langsung dengan bantuan mikroskop dan “hand counter”. Adapun periode pengamatan terhadap fekunditas total dan kemampuan menetas dilakukan setiap hari pada tiap kali penetasan. Pengukuran kemampuan menetas dilakukan dengan menghitung jumlah telur-telur yang berhasil menetas setelah dilepaskan oleh induk betina dan telur-telur yang tidak menetas. Adapun pengamatan terhadap variabel ini dilakukan setiap hari setiap kali terjadi penetasan.
b. Kemampuan Pelepasan Telur
Kemampuan pelepasan telur adalah kemampuan maksimal induk kopepoda betina dalam melepaskan kantung telur (setelah melakukan kopulasi) selama hidupnya. Pengamatan terhadap kemampuan pelepasan telur tersebut dilakukan setiap hari yang dimulai pada saat induk pertama kali melepaskan kantung telur. Adapun data yang dicatat adalah tanggal kopulasi dan tanggal pelepasan kantung telur. Kegiatan ini dihentikan setelah induk tidak lagi membawa kantung telur. Hal ini diasumsikan bahwa cadangan spermatofor (dari induk jantan) dalam tubuh induk betina telah habis.
c. Frekwensi Kopulasi dan Kisaran Waktu Aktivitas Reproduksi
Frekwensi kopulasi dilakukan untuk menghitung berapa kali kopepoda betina melakukan kopulasi selama hidupnya. Sedangkan pengukuran aktivitas reproduksi dimaksudkan untuk mengetahui kisaran waktu yang digunakan oleh kopepoda betina saat mulai reproduksi (kopulasi - penetasan).
d. Rasio Seks
30
e. Rentang Hidup (”lifespan)
Rentang hidup (‘lifespan) adalah waktu atau umur selama hidup Apocyclops sp. dimulai saat pertama kali menetas sampai mati. Pengamatan terhadap parameter ini dilakukan setiap hari dimulai sejak hewan uji ditetaskan sampai mati. Adapun data yang dicatat adalah tanggal penetasan dan tangal kematian hewan uji.
f. Waktu Perkembangan Perstadia
Waktu perkembangan perstadia kopepoda adalah lamanya (umur dalam hari) kopepoda Apocyclops sp. dalam melewati masing-masing satu siklus stadia hidupnya, yaitu dimulai saat kopepoda memasuki stadia na upli (N1 - N6) mencapai
stadia kopepodit (C1 – C5) dan saat kopepoda mencapai stadia dewasa hingga siap
melakukan kopulasi. Pengukuran ini meliputi hal-hal berikut ini, yaitu :
a. Stadia nauplius (N1 – N6); lama waktu (hari) yang dibutuhkan oleh kopepoda
untuk berkembang masa nauplius I – nauplius VI.
b. Stadia kopepodit (C1 – C5); lama waktu (hari)yang dibutuhkan oleh
kopepoda dari masa kopepodit I – kopepodit 5.
c. Stadia dewasa; lama waktu (hari) yang dibutuhkan oleh kopepoda pada saat matang telur (C5) – siap kopulasi (waktu pertama kali melepasakan telur).
6. Teknik Pengumpulan Data
Teknik pengumpulan data dilakukan terhadap variabel yang diamati sampai satu siklus hidup kopepoda Apocyclops sp. (”lifespan”). Adapun teknik pengumpulan data yang dilakukan terhadap variabel yang diamati adalah sebagai berikut :
a. Fekunditas total dan kemampuan menetas diperoleh dari telur yang berhasil menetas (naupli) dan telur-telur yang tidak menetas. Hasil penjumlahan selanjutnya dibagi dengan jumlah unit percobaan untuk mendapatkan rata-rata fekunditas total dari tiap pelepasan.
b. Rentang hidup (’lifespan’) dan kemampuan pelepasan telur dilakukan setiap terjadi kopulasi kemudian data dikumpulkan dan dikelompokkan menurut kemampuan pelepasan telurnya, serta dibuat distribusi frekuensinya.
31
waktu reproduksi dibuat dengan menarik simpangan baku rata-rata saat bereproduksi.
d. Rasio seks Apocyclops sp. diperoleh dengan cara menghitung jumlah/ banyaknya kopepoda betina betina dalam satu induk. Adapun data yang diambil adalah dengan cara membagi jumlah seluruh kopepoda betina dengan jumlah total kopepoda dalam satu induk kemudian dipersentasikan.
e. Umur kopepoda per stadia diperoleh dengan menghitung jumlah/ banyaknya hari yang dilalui oleh tiap stadia perkembangannya.
7. Pengendalian dan Pengelolaan
Sebelum digunakan, medium kultur terlebih dahulu diaerasi minimal selama 24 jam. Hal ini dimaksud untuk mengeluarkan gas-gas yang mungkin masih terikat dalam volume air. Temperatur pada penelitian ini dipertahankan dengan mesin AC untuk suhu 24±1oC, sedangkan untuk suhu 28±1oC, dan 32 ±1oC menggunakan pemanas (’heater’) yang dilengkapi dengan sensor pengatur suhu. Untuk mempertahankan kelarutan oksigen (DO) pada media kultur setiap labu kultur diberi aerasi. Untuk mencegah kotoran sebagai kontaminan, maka wadah kultur disimpan dalam rak-rak dan diberi penutup berupa plastik (PVC) transparan. Selama penelitian berlangsung, unit pengamatan diberi penerangan lampu TL (neon) dengan kekuatan 20 watt.
Analisis Data
HASIL DAN PEMBAHASAN
Tahap 1
Galur murni (F2) kopepoda
Dari stok sampel kopepoda Apocyclops sp. yang telah diidentifikasi, 50 ekor induk betina siap bertelur semuanya mampu menghasilkan turunan (F1) pada kondisi
salinitas media kultur 20 ppt, suhu ruangan laboratorium 24±1oC dan pakan berupa mikroalga Tetraselmis sp. Dari 50 ekor induk betina siap bertelur (stok F1), hanya 48
ekor induk yang mampu menghasilkan turunan (F2). Turunan F2 selanjutnya dijadikan
stok hewan uji untuk penelitian tahap ke II.
Aklimatisasi stok hewan uji
Pada kondisi suhu 24±1oC, 28±1oC dan 32±1oC, dan sumber pakan berupa mikroalga Tetraselmis sp., Chlorella sp., dan Nannochloropsis oculata dengan salinitas media kultur 20 ppt, naupli F2 kopepoda Apocyclops sp. mampu tumbuh dan
berkembang dengan baik hingga mencapai dewasa dan siap untuk dijadikan hewan uji.
Tahap II
Fekunditas Total dan Kemampuan Penetasan Telur
33
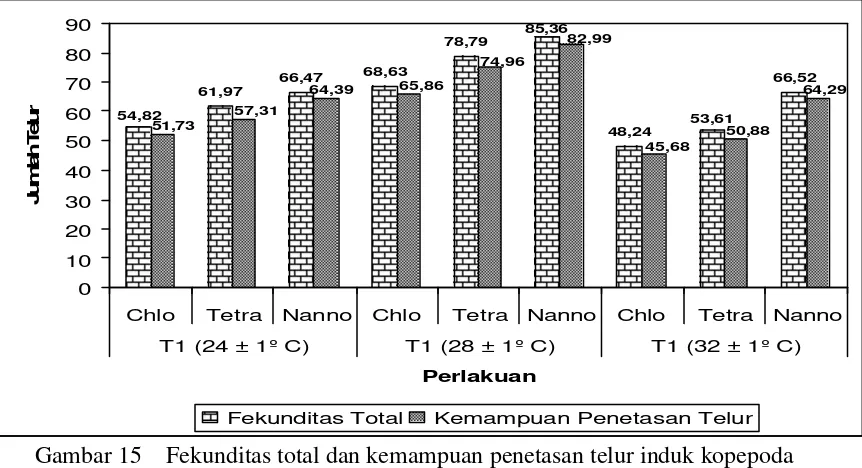
Tabel 5 Fekunditas total, kemampuan penetasan telur dan rasio telur yang menetas (”Hatching Ratio / HR”) per induk betina kopepoda Apocyclops sp. pada suhu dan sumber pakan berbeda.
T1 (24±1 o
C) T2 (28±1 o
C) T3 (32±1 o
C)
Chlo Tetra Nanno Chlo Tetra Nanno Chlo Tetra Nanno
Rata-rata Fekunditas
Total (butir)
54.82 61.97 66.47 68.63 78.79 85.36 48.24 53.61 66.52
Rata-rata Kemampuan Penetasan Telur
(butir)
51.73 57.31 64.39 65.86 74.96 82.99 45.68 50.88 64.29
Hatching Ratio
(%) 94.36 92.48 96.87 95.96 95.14 97.22 94.69 94.91 96.65
Keterangan :
- Chlo : mikroalga Chlorella sp. - Tetra : mikroalga Tetraselmis sp.
- Nanno : mikroalga Nannochloropsis oculata.
Dari Tabel 5 terlihat bahwa, fekunditas total dan kemampuan penetasan telur perinduk Apocyclops sp. pada perlakuan suhu T2 (28 ± 1oC) memiliki nilai total rata-rata
yang tinggi. Kemudian diikuti pada perlakuan suhu T1 (24 ± 1oC), dan T3 (32 ± 1oC).
Lebih lanjut Gambar 14 mengilustrasikan grafik fekunditas total rata-rata dan jumlah rata-rata telur yang menetas (kemampuan penetasan telur) dari induk betina kopepoda.
61,97 66,47 68,63 78,79 48,24 66,52 54,82 85,36 53,61 50,88 64,39 45,68 51,73 57,31 65,86 64,29 74,96 82,99 0 10 20 30 40 50 60 70 80 90
Chlo Tetra Nanno Chlo Tetra Nanno Chlo Tetra Nanno
T1 (24 ± 1º C) T1 (28 ± 1º C) T1 (32 ± 1º C)
Perlakuan
Jumlah Telur
Fekunditas Total Kemampuan Penetasan Telur
34
Gambar 15 memperlihatkan fekunditas total rata-rata tertinggi sebanyak 85.36 butir telur dan jumlah telur yang mampu menetas sebanyak 82,99 butir, dengan rasio telur menetas (HR) sebesar 97.22% pada induk Apocyclops sp. dengan perlakuan suhu 28±1oC dan diberi pakan mikroalga Nannochloropsis oculata. Selanjutnya berturut-turut adalah induk kopepoda yang diberi pakan mikroalga Chlorella sp. sebanyak 68.63 dan 65.86 butir telur dengan HR 95.96%, dan Tetraselmis sp. sebanyak 78.79 dan 74.96 butir telur dengan HR 95.14%.
Selanjutnya melalui pengujian statistik dengan RAL faktorial terhadap fekunditas total dan kemampuan penetasan telur per induk kopepoda Apocyclops sp. dengan menggunakan aplikasi komputer program SAS menunjukkan bahwa, pengaruh interaksi tidak nyata, sedangkan pengaruh utama faktor T (suhu) dan faktor P (sumber pakan) memberikan pengaruh yang sangat nyata (Lampiran 7). Hal ini berarti ada respon fekunditas dan kemampuan penetasan telur terhadap ke tiga faktor suhu (T1, T2,
T3) dan sumber pakan yang dicobakan (Chlorela sp., Tetraselmis sp., N. oculata).
Untuk melihat secara jelas hasil percobaan ini dapat dilihat grafik yang menghubungkan faktor utama perlakuan antara suhu dan sumber pakan terhadap fekunditas dan kemampuan penetasan telur kopepoda Apocyclops sp. pada Gambar 16 dan 17 berikut ini.
48.24 68.63
54.82 66.47
66.52 85.36
53.61 78.79
61.97
45 50 55 60 65 70 75 80 85 90
T1 T2 T3
Suhu
jumlah rata-rata fekunditas total (%)
[image:48.596.110.493.462.673.2]Ch Na Te
35
51.72
65.85
45.67 82.99
64.39
64.29
50.88 74.96
57.30
45 50 55 60 65 70 75 80 85
T1 T2 T3
Suhu
Jumlah rata-rata telur menetas (%)
Ch Na Te
Gambar 17 Pengaruh suhu dan sumber pakan berbeda terhadap kemampuan penetasan telur induk kopepoda.
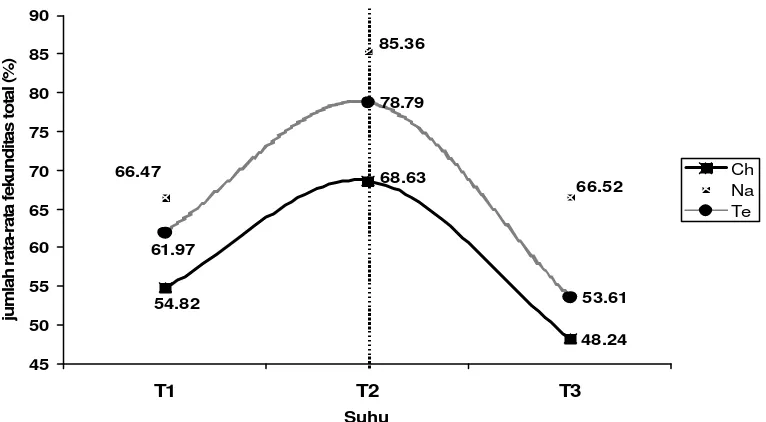
Dari Gambar 16 dan 17 terlihat bahwa secara umum induk kopepoda yang diberi pakan mikroalga N. oculata memberikan nilai rata-rata total yang lebih tinggi dibanding induk yang diberi pakan Tetraselmis sp. maupun Chlorella sp. pada semua perlakuan suhu (T1, T2 dan T3). Dalam grafik terlihat juga bahwa induk yang diberi pakan
N. oculata pada suhu T2 mempunyai nilai rata-rata tertinggi untuk fekunditas dan
kemampua n penetasan telurnya. Hal ini menunjukkan bahwa induk kopepoda memberikan respon fekunditas dan kemampuan penetasan telur yang paling baik adalah pada perlakuan suhu 28±1oC dan pemberian pakan berupa mikroalga N. oculata.
Garis pada grafik yang sejajar menunjukkan bahwa tidak adanya interaksi antara perlakuan suhu dan sumber pakan yang diberikan (TP). Pengaruh interaksi antara suhudan sumber pakan yang merupakan rata-rata selisih (perbedaan) respon pola fekunditas dan kemampuan penetasan telur induk kopepoda di antara pengaruh sederhana suatu faktor (faktor suhu atau pakan yang diberikan) setelah diuji ternyata tidak berbeda nyata. Hal ini berarti bahwa pengaruh sederhana dari faktor suhu atau pakan yang diberikan dianggap homogen (sama) sehingga perbedaan yang ada disebabkan oleh faktor galat percobaan (kesalahan pengukuran).
36
72,25% dan 70,37%. Sedangkan sisanya (1 – R2) 0,2775 atau 27,75% dan 0,2963 atau 29,63% disebabkan oleh galat percobaan. Dengan kata lain, faktor suhu dan pemberian pakan memberikan nilai keragaman nilai rata-rata total fekunditas sekitar 72,25% dan kemampuan penetasan telur induk kopepoda sekitar 70,37%, sedangkan 27,75% dan 29,36% disebabkan oleh adanya faktor lainnya yang tidak diperhatikan (luput) dalam percobaan ini.
Pada uji lanjut terhadap faktor-faktor utama suhu dan pemberikan pakan mikroalga terhadap fekunditas total dan kemampuan penetasan telur perinduk kopepoda dengan menggunakan ”Duncan Multiple Range Test” (Lampiran 8) diperoleh hasil bahwa, rata -rata faktor suhu dan pemberian pakan seluruhnya menunjukkan perbedaan yang sangat nyata. Dimana faktor suhu T2 dan pakan N. oculata memberikan nilai
rata-rata paling tinggi. Hal ini berarti bahwa pada suhu T2 dan pemberian pakan berupa
mikroalga N. oculata memberikan rata-rata fekunditas total dan kemampuan penetasan telur perinduk kopepoda tertinggi. Atau dalam pengertian lain bahwa pola fekunditas dan kemampuan penetasan telur (’hatching rate’) induk kopepoda memberikan respon dengan rata-rata yang lebih tinggi pada kondisi suhu T2 dan pakan N. oculata
dibandingkan suhu T1 dan T3.
37 0 20 40 60 80 100 120 Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%)
Kop I Kop II Kop III Kop IV Kop V
T1
Jumlah telur rata-rata fekunditas, telur menetas
(Hatching/ H) dan HR (%)
[image:51.596.88.505.499.699.2]Chlo Tetra Nanno
Gambar 18 Kopulasi, fekunditas, ‘hatching’ dan ‘HR’ kopepoda pada T1 (24±1oC)
0 20 40 60 80 100 120 Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%)
Kop I Kop II Kop III Kop IV Kop V
T2
Jumlah rata-rata fekunditas, telur menetas (H)
dan HR (%)
Chlo Tetra Nanno
Gambar 19 Kopulasi, fekunditas, ‘hatching’ dan ‘HR’ kopepoda pada T2 (28±1oC)
0 20 40 60 80 100 120 Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%) Fek H HR(%)
Kop I Kop II Kop III Kop IV Kop V
T3
Jumlah rata-rata fekunditas, telur menetas (H) dan
HR (%)
Chlo Tetra Nanno
38
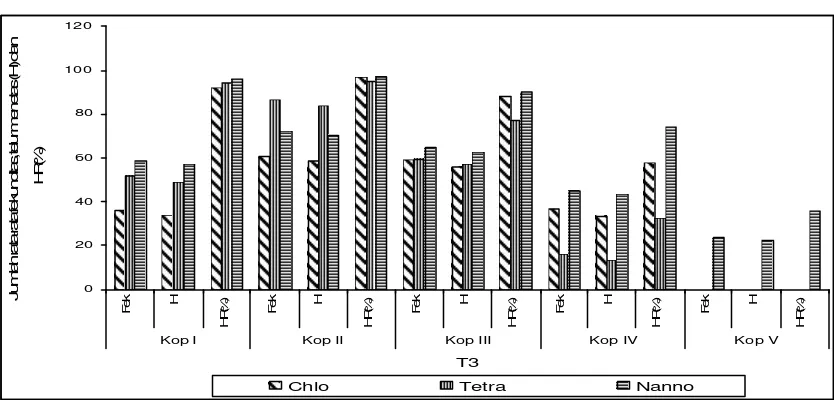
Dari ketiga Gambar tersebut terlihat bahwa Apocyclops sp. termasuk kopepoda yang aktif bereproduksi. Pada penelitian ini diketahui bahwa kopepoda Apocyclops sp. mampu melakukan 1 – 4 kali bahkan 1 – 5 kali kopulasi sepanjang hidupnya. Dalam penelitian ini diketahui juga bahwa induk kopepoda yang paling aktif melakukan 1 – 5 kali kopulasi adalah induk yang diberi perlakuan suhu T2 (28 ± 1oC) dan diberi
pakan mikroalga berupa N. oculata. Rumengan et al. (1998) melaporkan bahwa Apocyclops sp. adalah salah satu jenis kopepoda yang banyak dijumpai di perairan
tropis yang memiliki kemampuan bereproduksi yang cukup tinggi. Semasa hidupnya (”lifespan”) Apocyclops sp. mampu menghasilkan telur sebanyak 70 sampai 448 butir dengan tiga sampai empat kali masa pemijahan (kopulasi).
Dari Gambar grafik tersebut terlihat adanya variasi fekunditas dan kemampuan telur menetas, dimana rata-rata tertinggi terjadi pada kopulasi II dan semakin menurun pada kopulasi selanjutnya. Hal ini menyatakan bahwa pada kopulasi II merupakan puncak produktivitas tertinggi dalam masa