PENAPISAN ANTIBAKTERI DAN INHIBITOR
TOPOISOMERASE I DARI Xylocarpus granatum
DEWI KARTIKA SARI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul “Penapisan Antibakteri dan Inhibitor Topoisomerase I dari Xylocarpus granatum” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2008
Abstrak
DEWI KARTIKA SARI. Penapisan Antibakteri dan Inhibitor Topoisomerase I dari Xylocarpus granatum. Dibimbing oleh LINAWATI HARDJITO dan PURWANTININGSIH SUGITA.
Kajian ilmiah tanaman obat yang memiliki aktivitas antibakteri dan antikanker (sitotoksik) intensif diteliti. Hal ini disebabkan banyaknya permintaan masyarakat terhadap bahan obat yang berasal dari alam yang memiliki beberapa keuntungan diantaranya aman dikonsumsi dan relatif tidak ada efek sampingnya. Salah satu tanaman pesisir yang memiliki aktivitas antibakteri dan sitotoksik adalah Xylocarpus granatum. Penelitian ini secara umum bertujuan adalah mengetahui bagian tanaman Xylocarpus granatum (akar, batang, daun, daging buah dan biji) yang memiliki aktivitas terbaik terhadap antibakteri dan inhibitor topoisomerase I.
Tanaman Xylocarpus granatum diperoleh dari Pulau Bakau, desa Muara Kintap Kabupaten Tanah Laut Kalimantan Selatan. Metode yang digunakan pada pengujian aktivitas antibakteri adalah difusi agar dengan teknik agar tuang dan pengujian antikanker menggunakan enzim DNA topoisomerase I dari TopoGen, serta comptothecin sebagai kontrol positif.
Hasil penelitian menunjukkan bahwa ekstrak kasar Xylocarpus granatum dapat menghambat enzim topoisomerase I pada konsentrasi 50 :g/ml, kecuali pada ekstrak akar heksana. Ekstrak metanol dari akar, batang, daun, daging buah dan biji Xylocarpus granatum mengandung senyawa alkaloid, flavonoid dan tanin sedangkan saponin hanya pada ekstrak biji, serta ekstrak yang dapat menghambat pertumbuhan bakteri non-klinis S. aureus dan E. coli adalah ekstrak akar, batang,
biji dan daging buah. MIC topoisomerase I dari ekstrak metanol batang Xylocarpus granatum adalah 25 :g/ml. Fraksi alkaloid, flavonoid dan tanin dari
Abstract
DEWI KARTIKA SARI. Antibacterial and Inhibitor Topoisomerase I Screening from Extract of Xylocarpus granatum Supervised by LINAWATI HARDJITO and PURWANTININGSIH SUGITA.
Plants having biological activites have been studied intensively due to the demand of natural medicines. One of coastal plants having antibacterial and cytotoxic activity is Xylocarpus granatum. This paper presented antibacterial and topoisomerase I inhibitor activities of Xylocarpus granatum extract. The antibacterial activity was assyed using agar diffusion method and topoisomerase I inhibitor activity was carried out using topoisomerase drug screening kit from TopoGen.
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan, karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan IPB
PENAPISAN ANTIBAKTERI DAN INHIBITOR
TOPOISOMERASE I DARI Xylocarpus granatum
DEWI KARTIKA SARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Teknologi Hasil Perairan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Xylocarpus granatum Nama : Dewi Kartika Sari NRP : C351050011
Disetujui
Komisi Pembimbing
Dr.Ir. Linawati Hardjito, M.Sc. Dr.Dra. Purwantiningsih Sugita, M.S. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Teknologi Hasil Perairan
Dr.Ir. Sri Purwaningsih, M.Si Prof.Dr.Ir. Khairil Anwar Notodiputro, MS.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala kurniaNya sehingga tesis ini selesai. Penelitian dilaksanakan sejak bulan Agustus 2006 sampai Juli 2007, dengan judul Penapisan Antibakteri dan Inhibitor Topoisomerase I dari Xylocarpus granatum. Sumber dana penelitian ini berasal dari Hibah Penelitian Tim Pascasarjana (HPTP) tahun anggaran 2006-2007 a/n Dr.Ir. Linawati Hardjito, M.Sc.
Terima kasih penulis ucapkan kepada ibu Dr.Ir. Linawati Hardjito, M.Sc. dan ibu Dr.Dra. Purwantiningsih Sugita, M.S. selaku pembimbing yang telah memberikan saran dan kemudahan kepada penulis hingga tesis ini dapat diselesaikan, serta ibu Dr.Ir. Yulin Lestari yang telah bersedia menjadi dosen penguji dan memberikan saran dalam perbaikan penulisan tesis ini. Rekan-rekan S2 THP angkatan 2005 dan 2006 atas kebersamaan dan dorongan semangat kepada penulis dalam menyelesaikan tesis ini. Lulut, Erna, Wiwit, Dian, Lucy, Lutfi dan Ian atas kerjasamanya selama penelitian di Laboratorium. Ungkapan terima kasih tak terhingga juga disampaikan kepada kedua orang tuaku abah H. Anwar Fauzie (alm), mama Hj. Marliah Chairul, suamiku Ir. Ari Ropian, ananda Mutia Dea Wijayanti dan Devi Damayanti serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Akhir kata penulis menyadari bahwa tulisan ini masih jauh dari sempurna. Penulis mengharapkan kritik dan saran untuk penyempurnaan isi tesis ini sehingga menjadi lebih baik. Semoga tesis ini bermanfaat bagi pihak yang memerlukannya.
Bogor, Januari 2008
Penulis dilahirkan di Hulu Sungai Selatan Kalimantan Selatan pada tanggal 11 Maret 1968 dari abah H. Anwar Fauzie (alm) dan mama Hj. Marliah Chairul. Penulis merupakan putri ketiga dari lima bersaudara.
Pendidikan sarjana (S1) ditempuh pada Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan Universitas Lambung Mangkurat Banjarbaru, masuk tahun 1986 dan lulus pada tahun 1991. Pada tahun 1997, penulis melanjutkan pendidikan S2 pada Program Studi Teknologi Hasil Pertanian Program Pascasarjana Universitas Brawijaya Malang dan selesai pada tahun 1999. Tahun 2005 penulis kembali menempuh pendidikan S2 pada Departemen Teknologi Hasil Perairan Institut Pertanian Bogor dengan beasiswa dari BPPS (pemerintah melalui Ditjen DIKTI).
Penulis bekerja sebagai tenaga edukatif pada Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan, Universitas Lambung Mangkurat Banjarbaru sejak tahun 1994 sampai sekarang.
Halaman
2.2. Pemanfaatan dan Kandungan Bahan Aktif X. granatum ... 6
2.2.1. Alkaloid ... 7
3.3.1. Ekstraksi komponen aktif ... 19
3.3.2. Pembersihan ekstrak kasar ... 20
3.3.3. Pengujian aktivitas inhibitor topoisomerase I ... 21
3.3.4. Pengujian fitokimia ... 21
3.3.5. Pengujian antibakteri ... 21
3.3.6. Penapisan ekstrak kasar ... 22
4. HASIL DAN PEMBAHASAN ... 25
4.1. Ekstraksi X. granatum ... 25
4.2. Aktivitas Inhibitor Topoisomerase I ... 26
4.3. Pengujian Fitokimia Ekstrak Kasar Metanol X. granatum ... 29
4.4. Aktivitas Antibakteri Ekstrak Kasar Metanol X. granatum ... 30
4.7. Uji Antibakteri Fraksi Aktif Ekstrak Metanol Batang X. granatum 35 5. KESIMPULAN DAN SARAN ... 39 DAFTAR PUSTAKA ... 40 LAMPIRAN ... 45
Halaman 1 Penapisan fitokimia serbuk simplisia biji X. granatum ... 7 2 Beberapa pelarut organik dan sifat fisiknya ... 10 3 Hasil ekstraksi X. granatum ... 25 4 Uji inhibisi enzim DNA topoisomerase I dari ekstrak kasar
X. granatum (50 :g/ml) ... 27 5 Hasil uji fitokimia ekstrak kasar metanol X. granatum ... 29 6 Diameter hambatan uji antibakteri ekstrak kasar metanol X. granatum 30 7 Hasil uji MIC ekstrak kasar metanol batang X. granatum terhadap
enzim DNA topoisomerase I ... 32 8 Hasil penapisan ekstrak kasar metanol batang X. granatum ... 33 9 Penapisan senyawa kimia ekstrak kasar metanol batang
X. granatum ... 34 10 Hasil penapisan fraksi alkaloid, flavonoid dan tanin ekstrak metanol
batang X. granatum ... 34 11 Diameter hambatan uji antibakteri fraksi aktif ekstrak metanol batang
X. granatum ... 35
Halaman
1 Road map penelitian X. granatum ... 2
2 Habitat tanaman X. granatum ... 4
3 Akar dan daun X. granatum ... 5
4 Buah (biji & daging buah) X. granatum ... 5
5 Batang dan bunga X. granatum ... 5
6 Struktur dinding sel bakteri Gram positif dan Gram negatif ... 12
7 Mekanisme kerja antibiotik pada sel bakteri ... 13
8 Struktur inhibitor topoisomerase I ... 16
9 Diagram alir keseluruhan tahapan penelitian penapisan antibakteri dan inhibitor topoisomerase I dari X. granatum ... 19
10 Proses ekstraksi bahan aktif ... 20
11 Pengujian aktivitas antibakteri ... 22
12 Penapisan ekstrak kasar dan pemurnian alkaloid ... 23
13 Pemurnian flavonoid ... 24
14 Pemurnian tanin ... 24
15 Hasil elektroforesis uji inhibisi enzim DNA topoisomerase I ekstrak kasar X. granatum pada konsentrasi 50 µg/ml ... 27
16 Hasil elektroforesis uji MIC ekstrak kasar metanol batang X. granatum terhadap enzim DNA topoisomerase I ... 32
Halaman
1 Prosedur ekstraksi bahan aktif ... 45
2 Prosedur pengujian aktivitas inhibitor topoisomerase I ... 46
3 Visualisasi gel agarose dengan marker dan kontrol ... 48
4 Prosedur pengujian fitokimia ... 49
5 Tahapan pengujian antibakteri ... 54
6 Sampel X. granatum ... 55
7 Filtrat akar, batang, daun, daging buah dan biji X. granatum dalam pelarut heksana, etil asetat dan metanol ... 56
8 Pengujian fitokimia pada ekstrak kasar metanol X. granatum ... 57
9 Diameter hambatan (mm) uji antibakteri ekstrak kasar metanol X. granatum ... 58
10 Penapisan ekstrak kasar metanol X. granatum ... 59
11 Penapisan fraksi alkaloid, flavonoid dan tanin ekstrak metanol X. granatum ... 60
12 Diameter hambatan (mm) uji antibakteri fraksi aktif dari ekstrak metanol X. granatum ... 61
1.1. Latar Belakang
Indonesia sebagai negara tropis dengan wilayah yang cukup besar, memiliki keanekaragaman sumberdaya pesisir dan laut yang tinggi dan dapat menjadi sumber berbagai produk yang bermanfaat baik untuk industri farmasi, kimia, kosmetik, pertanian dan sebagainya. Salah satu sumber daya pesisir yang telah banyak dimanfaatkan secara tradisional baik sebagai obat maupun kosmetik adalah tanaman bakau (Xylocarpus granatum), yang merupakan tanaman pesisir yang hidup di hutan mangrove. Biji Xylocarpus granatum oleh masyarakat pesisir terutama suku Bugis digunakan sebagai bahan pembuatan bedak. Di Thailand biji Xylocarpus granatum dimanfaatkan sebagai obat disentri (Suragih 2002), dan sebagai obat diare, kolera serta pembersih luka (Aksornkoae 1993) serta abu dari biji ini untuk mengobati gatal bila dicampur dengan sulfur dan minyak kelapa. Minyak dari ekstrak biji dicampur dengan tepung beras digunakan sebagai masker wajah untuk mengobati jerawat dan cairan minyaknya untuk mengobati diare dan disentri (Sabine 1999).
Menurut Suragih (2002), X. granatum mengandung tanin yang bersifat sebagai antimikroba. Selanjutnya menurut Yulia (2003), ekstrak metanol biji X. granatum dapat digunakan sebagai tabir surya/sunscreen. Suhartini (2003) menyatakan bahwa ekstrak metanol biji X. granatum memberikan hambatan terhadap bakteri Escherichia coli. Staphylococcus aureus, Vibrio carchariae dan Salmonella thyposa.
2.1. Deskripsi X. granatum
X. granatum merupakan salah satu tumbuhan pesisir jenis pohon yang
hidup di hutan mangrove yang biasanya dikenal dengan nama cannon ball
mangrove (AIMS 2002). X. granatum disebut juga kacang monkey-puzzle,
memiliki beberapa nama daerah yaitu nyirih, nyireh dan niri batu. Tumbuhan ini
memiliki daun berwarna hijau (panjang 10 cm dan lebar 4 cm), daun berbentuk
oval dan menebal pada pangkal yang bertemu dengan cabang, bunga berwarna
putih dan berukuran kecil, serta buahnya memiliki ukuran seperti jeruk besar yang
terdiri dari 12-18 biji (Thomlinson 1986). Pohon X. granatum dapat tumbuh
hingga ketinggian 25 m, tergantung pada kondisi lingkungan (Semesi dan Howell
1992). Habitat dan bagian tanaman X. granatum yaitu akar, daun, buah (biji dan
daging buah), batang dan bunga disajikan pada Gambar 2, 3, 4, dan 5.
Gambar 3 Akar dan daun X. granatum
Gambar 4 Buah (biji dan daging buah) X. granatum
Gambar 5 Batang dan bunga X. granatum
Menurut Suragih (2002) klasifikasi X.granatum adalah sebagai berikut:
Kingdom : Plantae
Subkingdom : Trecheobionta
Superdivisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliosida
Subklas : Rosidae
Ordo : Sapindales
Family : Meliaceae
Genus : Xylocarpus
Species : Xylocarpus granatum
Nama Lain : Carapa granatum Alston
Sistem perakaran X. granatum berada di atas tanah, pada tanaman
muda sering tidak terlihat. Kulit kayu lunak, padat dan ringan, berwarna coklat
terang hingga oranye yang disebabkan karena pengelupasan kulit kayu.
Tumbuhan X. granatum menyebar di perairan tropis dan tidak mengelompok pada
daerah tertentu (Thomlinson 1986).
X. granatum memiliki akar yang menyangga pada bagian dasar batang dan
berbentuk pita, daun berbentuk oval dan tebal pada bagian yang bertemu dengan
ranting. Bunganya berukuran kecil dan berwarna merah muda. X. granatum
memiliki buah yang keras, terbungkus seperti kapsul dengan jumlah biji berkisar
antara 12 hingga 18 yang bersatu erat dan bila matang berwarna coklat-keemasan.
Kulit kayunya berwarna merah muda-oranye lembut serta berbintik-bintik/burik
(AIMS 2002).
2.2. Pemanfaatan dan Kandungan Bahan Aktif X. granatum
Menurut Lim (2001), kayu X. granatum dimanfaatkan sebagai bahan
untuk membuat kapal, perabotan rumah tangga dan kayu bakar. Kulitnya
dapat disamak untuk selanjutnya digunakan dalam membuat pakaian dan
bahan pewarna kuning tua/jingga. Akarnya dimanfaatkan sebagai obat untuk
menyembuhkan penyakit kolera dan disentri. Biji X. granatum oleh masyarakat
pesisir terutama suku Bugis digunakan sebagai bahan pembuatan bedak.
Di Thailand biji X. granatum dimanfaatkan sebagai obat disentri (Suragih 2002),
dan sebagai obat diare, kolera serta pembersih luka (Aksornkoae 1993) serta abu
dari biji ini untuk mengobati gatal bila dicampur dengan sulfur dan minyak
kelapa. Minyak dari ekstrak biji dicampur dengan tepung beras digunakan
sebagai masker wajah untuk mengobati jerawat dan cairan minyaknya untuk
mengobati diare dan disentri (Sabine 1999).
Yulia (2003) menyatakan bahwa ekstrak metanol biji X. granatum dapat
digunakan sebagai tabir surya/sunscreen. Menurut Suhartini (2003), Minimum
Inhibitory Consentration (MIC) ekstrak metanol X. granatum terhadap bakteri
E.coli dan S.aureus didapatkan pada konsentrasi 20 µg/ml, dengan hambatan
berturut-turut 14 dan 9 mm. Sedangkan terhadap V. carchariae dan S. thyposa
Penapisan fitokimia bertujuan untuk mengetahui kandungan bahan aktif
atau golongan senyawa yang terdapat X. granatum. Hasil penapisan fitokimia
serbuk simplisia biji X. granatum disajikan pada Tabel 1.
Tabel 1. Penapisan fitokimia serbuk simplisia biji X. granatum
Golongan senyawa Pereaksi Hasil
Alkaloid Dragendorff, reaksi pengendapan
-Flavonoid serbuk Mg + HCl + amil alkohol +
Saponin uji busa +
Tanin besi (III) klorida
pereaksi Steasny
+ +
Kuinon NaOH 1 N
-Steroid/triterpensia Liebermen - Burchard +
Sumber: Suragih (2002)
Menurut Darusman et al. (1995), umumnya zat antimikrobial alami dari
sumber hayati laut merupakan hasil metabolit sekunder dari berbagai kelompok
alkaloid, terpenoid, flavonoid dan juga berasal dari senyawa metabolit primer
seperti peptida.
2.2.1. Alkaloid
Alkaloid adalah senyawa organik mengandung nitrogen yang banyak
ditemui pada tumbuhan. Nitrogen dalam alkaloid terdapat dalam bentuk amina
primer, sekunder dan tersier, bahkan alkaloid dengan amina kuaterner masih
ditemui di alam. Menurut Bruneton (1993), alkaloid merupakan senyawa organik
siklik yang mengandung atom nitrogen, umumnya merupakan bagian dari cincin
heterosiklik (sebagai gugus amina atau amida) dan bersifat basa. Alkaloid sebagai
basa, tidak larut atau hanya larut sebagian dalam air, larut dalam pelarut non
polar, pelarut organik agak polar dan hidroalkohol. Alkaloid dalam bentuk garam
umumnya larut dalam air dan alkohol tetapi tidak larut dalam pelarut organik.
2.2.2. Flavonoid
Menurut Suradikusumah (1989), flavonoid merupakan senyawa fenol
terbesar di alam mengandung 15 atom karbon tersusun dalam konfigurasi
Markham (1998) menyatakan bahwa flavonoid di alam terdapat dalam dua
bentuk yaitu flavonoid aglikon (flavonoid tanpa gula terikat) dan flavonoid
glikosida (flavonoid dengan gula terikat). Flavonoid glikosida umumnya larut
dalam air, sebaliknya flavonoid aglikon lebih mudah larut dalam pelarut seperti
eter dan polifenol. Menurut Suradikusumah (1989) flavonoid pada tumbuhan
terikat dengan gula sebagai glikosida. Senyawa yang dapat digunakan sebagai
pelarut dalam mengekstraksi flavonoid adalah senyawa polar seperti
etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, air dan
sebagainya.
2.2.3. Tanin
Menurut Harborne (1987), tanin merupakan senyawa polifenol yang
tersebar luas, terutama pada tumbuhan berpembuluh. Selanjutnya menurut
Robinson (1995) tanin terbagi dalam dua kelompok yaitu tanin terhidrolisis dan
tanin terkondensasi. Tanin termasuk senyawa polar dan dapat diekstraksi
menggunakan pelarut polar.
Harismah (2002) menyatakan bahwa tanin dapat memberikan warna
coklat, hal ini disebabkan oleh struktur tanin dengan ikatan rangkap dua
yang terkonjugasi pada polifenol sebagai kromofor/pengemban warna dan adanya
gugus OH sebagai auksokrom/pengikat warna. Senyawa tanin memiliki aktivitas
antibakteri dan antivirus. Sifat antibakteri tanin diakibatkan oleh gugus pirogalol
dan gugus galoil, sedangkan sifat penghambatan terhadap virus ditentukan
oleh struktur tersier persenyawaan gugus katekol atau pirogalol dengan gugus
galoilnya.
2.2.4. Saponin
Menurut Robinson (1995) saponin merupakan senyawa gula yang
memiliki gugus eter terikat pada atom karbon anomer. Saponin termasuk
golongan glikosida baik dari triterpena maupun sterol karena adanya ikatan gula
aglikonnya yang berupa senyawa sapogenin. Saponin bersifat tidak berwarna,
berbentuk kristal, sering mempunyai titik lebur tinggi, optis aktif pada konsentrasi
2.3. Ekstraksi Komponen Aktif
Ekstraksi merupakan suatu proses yang secara selektif mengambil zat
terlarut dari campuran dengan bantuan pelarut (Achmadi 1992). Proses ekstraksi
pada dasarnya dibedakan menjadi dua fase yaitu: (1) fase pencucian, sel-sel
yang dirusak atau terusakkan dengan proses penghalusan langsung kontak
dengan bahan pelarut. Komponen sel yang terdapat di permukaan lebih mudah
diambil/tercuci. Pada fase ini sebagian bahan aktif berpindah ke dalam bahan
pelarut. Semakin halus serbuk bahan baku, semakin optimal jalannya proses
pencucian. (2) fase ekstraksi, untuk melarutkan komponen dalam sel yang tidak
terluka, pelarut harus masuk ke dalamnya. Mengalirnya bahan pelarut ke dalam
ruang sel menyebabkan protoplasma membengkak, pecah dan komponen aktif
tersebut terlarut, mengikuti sifat difusi melalui ruang antarmisel. Gaya yang
bekerja adalah perbedaan konsentrasi antara larutan dalam sel dengan cairan
ekstraksi yang mula-mula tanpa bahan aktif. Bahan kandungan sel akan mencapai
cairan sebelah luar sampai terbentuk suatu keseimbangan konsentrasi antara
larutan dalam dan luar sel. Seberapa jauh komponen aktif dapat diangkut
melintasi membran sel, tergantung dari lubang pori bahan (Voigt 1994).
Menurut Hostetman et al. (1997), secara umum ekstraksi dilakukan secara
berturut-turut mulai dengan pelarut non-polar (heksana atau kloroform) lalu
dengan pelarut yang semi polar (etil asetat atau dietil eter), kemudian dengan
pelarut polar (metanol atau etanol). Dengan demikian akan diperoleh ekstrak
kasar yang mengandung berturut-turut senyawa non-polar, semi polar dan
senyawa polar. Markham (1988) menyatakan bahwa komponen yang terbawa
pada proses ekstraksi adalah komponen yang berpolaritas sesuai dengan
pelarutnya.
Ekstraksi terdiri dari tahap penghancuran sampel, maserasi, penyaringan
dan evaporasi. Penghancuran bertujuan untuk memperkecil ukuran partikel
sehingga meningkatkan kontak antara bahan dengan pelarutnya. Maserasi adalah
proses perendaman sampel dalam pelarut dengan waktu tertentu sehingga
senyawa dalam sampel larut dalam pelarut tersebut dan umumnya proses maserasi
Pengadukan dimaksudkan untuk mencapai waktu ekstraksi yang lebih
singkat. Teknik ekstraksi didasarkan pada kenyataan bahwa jika suatu zat dapat
larut dalam dua fase yang tercampur, maka zat itu dapat dialihkan dari satu fase
ke-fase lainnya dengan mengocoknya bersama-sama. Beberapa pertimbangan
dalam memilih pelarut yaitu:
1) pelarut polar akan melarutkan senyawa polar dan pelarut non-polar akan
melarutkan senyawa non-polar,
2) pelarut organik cenderung melarutkan senyawa organik,
3) air cenderung melarutkan senyawa anorganik dan garam dari asam maupun
basa organik,
4) asam-asam organik yang larut dalam pelarut organik dapat diekstraksi ke
dalam air dengan menggunakan basa (NaOH, Na2CO3dan NaHCO3).
Memilih pelarut yang akan dipakai harus memperhatikan sifat kandungan
kimia (metabolit) yang akan diekstrak. Sifat yang penting adalah sifat kepolaran
dan gugus polar pada senyawa yang akan diekstrak seperti gugus OH-, COOH -dan lain-lain. Dengan mengetahui sifat metabolit dari bahan yang akan
diekstraksi maka dapat dipilih pelarut yang sesuai berdasarkan kepolarannya.
Senyawa polar lebih mudah larut dalam pelarut polar dan senyawa non-polar lebih
mudah larut dalam pelarut non-polar. Derajat kepolaran bergantung pada
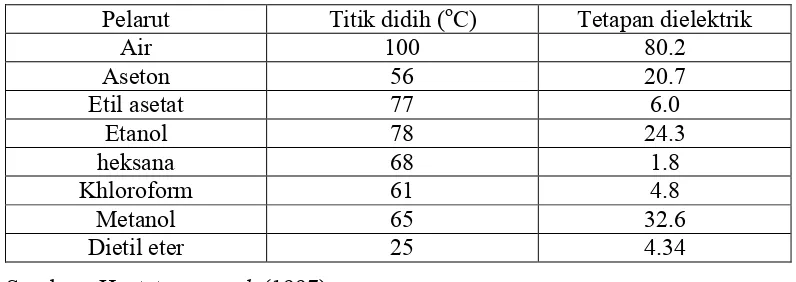
ketetapan dielektrik, makin besar tetapan dielektrik makin polar pelarut tersebut.
Tabel 2 menyajikan beberapa pelarut organik dan sifat fisiknya.
Tabel 2. Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih (oC) Tetapan dielektrik
Penyaringan bertujuan memisahkan sampel dengan senyawa bioaktif
yang larut dalam pelarutnya. Evaporasi dilakukan untuk menguapkan pelarut
sehingga ekstrak dapat terpisah dengan pelarutnya dan dilakukan pada suhu
30-40oC untuk mengurangi kerusakan senyawa aktif pada suhu tinggi. Hasil ekstraksi dipengaruhi oleh beberapa faktor yaitu kondisi alamiah bahan alam,
metode ekstraksi yang digunakan, ukuran partikel serta kondisi dan lama
penyimpanan sampel.
2.4. Antibakteri
Senyawa antibakteri adalah zat yang dapat menghambat pertumbuhan
bakteri dan dapat digunakan untuk pengobatan infeksi pada manusia, hewan dan
tumbuhan. Menurut Herbert (1988) dalam Murhadi (2002) senyawa antibakteri
yang berasal dari tanaman sebagian besar diketahui sebagai metabolit sekunder
dari golongan fenolik, terpen dalam minyak atsiri dan alkaloid.
Metabolit-metabolit sekunder tersebut sebagian besar dibiosintesis dari Metabolit-metabolit primer
seperti asam-asam amino, asetil ko-A dan metabolit antara.
Menurut Schnack et al. (1990), berdasarkan cara kerjanya antibakteri
dibedakan menjadi bakteriostatik dan bakterisida. Antibakteri bakteriostatik
bekerja dengan cara menghambat perbanyakan populasi bakteri dan tidak
mematikan, sedangkan bakterisida bekerja membunuh bakteri. Bakteriostatik
dapat bertindak sebagai bakterisida pada konsentrasi tinggi. Dwijoseputro (1990)
menyatakan bahwa antibakteri dikategorikan berspektrum luas bila efektif
terhadap banyak jenis bakteri, sedangkan antibakteri berspektrum sempit hanya
efektif terhadap bakteri tertentu.
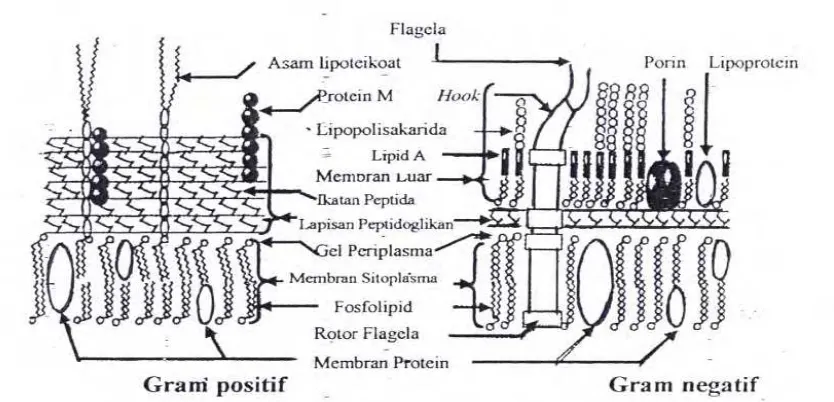
Dinding sel bakteri Gram positif berbeda dengan dinding sel bakteri
Gram negatif. Menurut Madigan et al. (1999), dinding sel bakteri Gram positif
mengandung 90% peptidoglikan serta lapisan tipis asam teikoat dan asam
teikuronat yang bermuatan negatif. Pada bakteri Gram negatif lapisan luar
dinding sel ada yang mengandung 5-20 % peptidoglikan, selain itu terdiri dari
protein, lipopolisakarida dan lipoprotein. Lapisan ini merupakan lapisan lipid
kedua yang disebut lipopolisakarida (LPS), tersusun tidak hanya terdiri dari
fosfolipid saja tetapi juga mengandung polisakarida dan protein. Struktur dinding
Gambar 6 Struktur dinding sel bakteri Gram positif dan Gram negatif (Williams et al. 1996)
Penggunaan senyawa antibakteri alami memiliki keuntungan karena lebih
aman jika dikonsumsi dibandingkan dengan senyawa sintetik. Penggunaan
senyawa sintetik dapat menimbulkan kerugian bagi kesehatan karena senyawa
tersebut merupakan bahan kimia dimana efek sampingnya tidak terdeteksi dengan
cepat (terakumulasi dalam tubuh). Karena alasan tersebut maka pemanfaatan
senyawa antibakteri alami berkembang luas sebagai pengganti zat antimikroba
sintetik baik untuk bahan pangan maupun bidang farmasi.
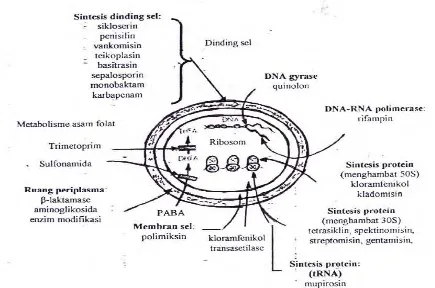
Madigan et al. (1999) menyatakan bahwa pengaruh komponen antibakteri
terhadap sel bakteri dapat menyebabkan kerusakan sel yang berlanjut pada
kematian. Kerusakan sel yang ditimbulkan komponen antibakteri dapat bersifat
mikrosidal (kerusakan bersifat tetap) atau mikrostatik (kerusakan yang dapat pulih
kembali). Suatu komponen akan bersifat mikrosidal atau mikrostatik tergantung
pada konsentarasi komponen dan kultur mikroba yang digunakan. Menurut
Pelczar dan Chan (1986), kerja antibakteri dipengaruhi berbagai faktor antara lain
konsentrasi zat antibakteri, spesies bakteri, jumlah bakteri dan pH lingkungan.
Menurut Davidson dan Branen (1993), penghambatan aktivitas mikroba
oleh komponen bioaktif tanaman dapat disebabkan oleh beberapa faktor, antara
lain: (1) gangguan pada senyawa penyusun dinding sel, (2) peningkatan
permeabilitas membran sel yang menyebabkan kehilangan komponen penyusun
material genetik. Selanjutnya menurut Kanazawa et al. (1995), terjadinya proses
penghambatan antimikroba karena pelekatan senyawa antimikroba pada
permukaan sel mikroba atau senyawa tersebut berdifusi ke dalam sel mikroba.
Mekanisme kerja antibiotik pada sel bakteri disajikan pada Gambar 7.
Gambar 7 Mekanisme kerja antibiotik pada sel bakteri(Williams et al. 1996)
2.5. Mekanisme Kanker
Material genetik disusun oleh asam nukleat yaitu Asam Deoksiribonukleat
(DNA) dan Asam Ribonukleat (RNA). DNA merupakan bahan dasar penyusun
gen dan berperan menentukan sifat-sifat organisme.
Proses perubahan biologi dan fisiologi sel karena perubahan gen dalam
kromosom mengakibatkan peningkatan/perbanyakan sel secara tidak teratur.
Menurut Cotran et al. (1994), gen yang mula-mula mengalami perubahan adalah
proto-ancogene dan tumor supressor gene. Perubahan dalam kromosom dapat
berupa perubahan numerik, misalnya sebagian kromosom hilang dan perubahan
struktur kromosom. Sel yang mengalami rangsangan terus-menerus oleh bahan
karsinogen menyebabkan sel terinisiasi atau mengalami mutasi yang
perubahan ekspresi gen (protein abnormal). Griffits et al. (1993) dan Herba
(2003) menyatakan bahwa kanker merupakan suatu penyakit yang disebabkan
oleh pertumbuhan sel-sel jaringan tubuh yang tidak normal dan tak terkontrol.
Ketidaknormalan tersebut dikarenakan sel telah termutasi atau telah terjadi
perubahan struktur DNA, sehingga sel mengalami perubahan baik bentuk,
ukuran, maupun fungsinya. Selanjutnya menurut Siswandono dan Soekardjo
(1995), mutasi sel terjadi kekeliruan DNA karena terpotong, tersubstitusi,
pengaturan kembali, adisi dan integrasi bahan genetik ke dalam sel, dan
perubahan ekspresi gen.
Menurut Zakaria (2001), satu sel saja yang mengalami kerusakan genetik
atau telah mengalami 5-10 kali mutasi DNA sudah cukup menghasilkan jaringan
kanker atau neoplasma dan mutasi gen ini dipacu oleh keberadaan suatu
bahan asing yang masuk ke dalam tubuh. Perubahan material genetik atau disebut
juga mutasi gen dapat terjadi melalui berbagai mekanisme yaitu, (1) kesalahan
replikasi yang terjadi pada saat sel-sel aus digantikan sel-sel baru, (2) mutasi pada
galur sel yang mengalami kesalahan genetika yang diturunkan dari gen orang tua,
(3) adanya faktor eksternal yang dapat mengubah struktur DNA.
Menurut para ahli kanker 80-85% penyakit kanker berasal dari luar tubuh
(eksogen) dan 10-15% karena faktor endogen yang berupa faktor keturunan dan
kesalahan replikasi sel. Sel kanker yang terdapat dalam tubuh karena faktor
genetik/keturunan dapat menjadi ganas karena pengaruh faktor luar seperti
makanan yang mengandung karsinogen, radiasi, infeksi virus dan polusi udara.
Mangan (2003) menyatakan bahwa pencegahan terhadap kanker dapat dilakukan,
terutama yang berasal dari luar tubuh yaitu dengan melakukan gaya hidup
sehat dan menjauhi faktor-faktor resiko terserang kanker. Selanjutnya menurut
Karyadi (2002), faktor-faktor luar tersebut dapat menjadi promotor untuk
menimbulkan keganasan yang secara tidak langsung menimbulkan tumor
atau kanker.
Miller (2005) menyatakan bahwa tahap-tahap penting pembentukan sel
kanker, yaitu (1) inisiasi, yaitu terjadinya perubahan pada DNA atau mutasi gen
yang disebabkan oleh berbagai faktor, (2) promosi yang meliputi perkembangan
(penyusupan ke jaringan sekitar), (4) metastatis yaitu penyebaran melalui
pembuluh darah dan pembuluh getah bening. Tahap penyebaran sel kanker
dimulai ketika sel individu memisah dan memasuki aliran darah untuk
menemukan tempat berkembang di dalam tubuh.
2.6. Inhibitor Topoisomerase I
Penggunan komponen kimia yang memiliki aktivitas antitumor dapat
berpengaruh negatif terhadap pertumbuhan sel tumor. Mekanisme aktivitas
antitumor melalui dua cara yaitu (1) langsung membunuh sel, dilakukan secara
in vitro, dan (2) secara tidak langsung yaitu dengan menggertak sistem imum,
dilakukan secara in vivo.
Menurut Suffnes dan Pezzuto (1991), uji antikanker secara in vitro
bertujuan untuk melihat kemampuan sitotoksik, antara lain dengan melihat
interaksinya dengan DNA. Salah satu uji yang didasarkan pada interaksi dengan
DNA dilakukan dengan cara melihat kemampuan senyawa uji untuk menghambat
enzim topoisomerase I yang digunakan pada replikasi DNA. Hsiang (1995)
Pommier (1993) dalam Sukardiman et al. (2002) menyatakan bahwa enzim DNA
topoisomerase I adalah enzim yang mempunyai fungsi cukup penting dalam
proses intraseluler dari sel kanker antara lain berperan dalam proses replikasi,
transkripsi, rekombinasi DNA dan proses proliferasi dari sel kanker.
Pencegahan kanker dengan senyawa alami diharapkan dapat mencegah
tahap awal karsinogenesis dan relatif bebas dari efek samping. Herba (2003)
menyatakan bahwa tanaman obat dengan sifat alamiahnya akan meningkatkan
daya tahan tubuh penderita terutama sel-sel yang berada di sekitar kanker.
Senyawa-senyawa aktif tanaman obat juga akan meredam keganasan racun-racun
yang dikeluarkan sel-sel kanker (antitoksik), menghambat pertumbuhan sel
kanker (sitostatika), memutus pasokan zat-zat makanan dan oksigen ke jaringan
kanker dengan cara menghentikan aliran darah ke sel kanker. Dan jika sudah
terjadi pendarahan pada kanker maka zat aktif yang terdapat pada tanaman obat
dapat menghentikan pendarahan (hemostatik). Selain itu tanaman obat juga
memiliki sifat anti inflamasi, antipiretik dan analgesik. Senyawa-senyawa aktif
tanaman obat akan bekerja serentak dalam memerangi kanker sehingga lama
Menurut Murakami et al. (1998), suatu senyawa bioaktif yang bersifat
sitotoksik umumnya bersifat nukleofilik, sehingga dapat memblok ikatan kovalen
antara derivat karsinogen yang elektrofilik dengan DNA. Hsiang (1989) dan
Joseph (1989) menyatakan bahwa dengan dihambatnya aktivitas enzim DNA
topoisomerase oleh senyawa inhibitor, maka proses terjadinya ikatan antara enzim
dengan DNA sel kanker semakin lama, sehingga akan terbentuk Protein Linked
DNA Breaks (PLDB) akibatnya terjadi kerusakaan DNA sel kanker dan
selanjutnya berpengaruh terhadap proses replikasi sel yang diakhiri dengan
kematian sel kanker. Selanjutnya menurut Volk dan Wheeler (1988) gangguan
terhadap pembentukan asam nukleat disebabkan oleh komponen bioaktif
berinteraksi dengan, (1) benang helik ganda DNA sehingga mencegah replikasi
dan transkripsi, (2) polimerase yang mengakibatkan hambatan terhadap aktivitas
enzim yang berperan pada biosintesis DNA dan RNA, sehingga menghambat
pertumbuhan dan pembelahan sel.
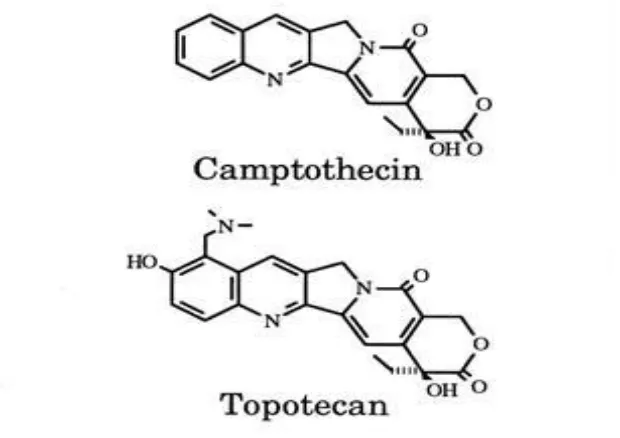
Yanagihara et al. (2005) menyatakan bahwa enzim DNA topoisomerase I
adalah target molekuler dari beberapa zat antikanker yang potensial, dengan
demikian inhibitor dari enzim ini potensial untuk obat antikanker. Comptothecin
dan Topotecan merupakan contoh inhibitor enzim DNA topoisomerase I dan
strukturnya disajikan pada Gambar 7.
3.1. Waktu dan tempat Penelitian
Penelitian telah dilaksanakan dari bulan Agustus 2006 sampai Juli 2007, bertempat di Laboratorium Bioteknologi Hasil Perairan Departemen Teknologi Hasil Perairan Institut Pertanian Bogor.
3.2. Bahan dan Peralatan
3.2.1. Bahan
Bahan utama yang digunakan pada penelitian ini adalah tanaman
X. granatum terdiri dari akar, batang, daun, daging buah dan biji yang diperoleh dari Pulau Bakau, desa Muara Kintap Kabupaten Tanah Laut Kalimantan Selatan.
Bahan kimia yang digunakan dalam penelitian ini adalah heksana, etil asetat dan metanol untuk ekstraksi senyawa bioaktif X. granatum. Pengujian aktivitas antibakteri menggunakan bakteri S. aureus dan E. coli (klinis dan non klinis), media Mueller Hinton, paper disc, ekstrak metanol X. granatum, kloramfenikol dan ampisilin sebagai kontrol positif.
Uji fitokimia meliputi uji alkaloid menggunakan kloroform, amonia, pereaksi Dragendorff (kalium tetraiodobismutat), Meyer (kalium tetraiodomerkurat) dan Wagner (iodium dalam kalium iodida). Uji saponin menggunakan akuades, uji flavonoid menggunakan H2SO4 pekat dan uji tanin menggunakan FeCl3. Penapisan ekstrak kasar menggunakan CHCl3, H2SO4, MeOH dan NH3OH. Penapisan alkaloid menggunakan EtOH, NH3OH, CHCl3 danHCl. Flavonoid penapisannya menggunakan akuades panas, heksana, CHCl3, Et2O, dan butanol. Penapisan tanin menggunakan heksana, aseton, akuades, asam
askorbat, CHCl3dan EtOAc.
Pengujian aktivitas inhibitor topoisomerase I menggunakan gel agarosa
3.2.2. Peralatan
Alat-alat yang digunakan yaitu timbangan digital dan peralatan gelas. Alat
untuk ekstraksi senyawa bioaktif yaitu waring blender, hot plate, pengaduk magnit, erlemenyer, evaporator vakum.
Elektroforesis digunakan untuk pengujian aktivitas inhibitor topoisomerase I. Pengujian aktivitas antibakteri menggunakan tabung reaksi, vortex, cawan petri, lemari pendingin, inkubator.
3.3. Prosedur Penelitian
Penelitian penapisan antibakteri dan inhibitor topoisomerase I dari
X. granatum terdiri dari beberapa tahap yaitu:
1) ekstraksi senyawa bioaktif akar, batang, daun, daging buah dan biji
X. granatum dengan pelarut heksana, etil asetat dan metanol,
2) pengujian inhibitor topoisomerase I terhadap semua ekstrak kasar
X. granatum,
3) pengujian fitokimia dan antibakteri terhadap ekstrak kasar metanol akar, batang, daun, daging buah dan biji X. granatum,
4) penentuan minimum inhibitor topoisomerase I terhadap ekstrak kasar metanol batang X. granatum,
5) penapisan senyawa kimia dari ekstrak metanol batang X. granatum,
6) penapisan fraksi alkaloid, flavonoid dan tanin dari ekstrak metanol batang
X. granatum,
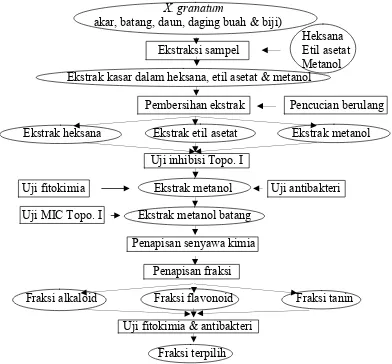
7) pengujian aktivitas antibakteri dari fraksi alkaloid, flavonoid dan tanin ekstrak metanol batang X. granatum. Diagram alir keseluruhan tahapan penelitian
penapisan antibakteri dan inhibitor topoisomerase I dari X. granatum
X. granatum
akar, batang, daun, daging buah & biji)
Heksana Ekstraksi sampel Etil asetat
Metanol Ekstrak kasar dalam heksana, etil asetat & metanol
Pembersihan ekstrak Pencucian berulang
Ekstrak heksana Ekstrak etil asetat Ekstrak metanol
Uji inhibisi Topo. I
Uji fitokimia Ekstrak metanol Uji antibakteri
Uji MIC Topo. I Ekstrak metanol batang
Penapisan senyawa kimia
Penapisan fraksi
Fraksi alkaloid Fraksi flavonoid Fraksi tanin
Uji fitokimia & antibakteri
Fraksi terpilih
Gambar 9 Diagram alir keseluruhan tahapan penelitian penapisan antibakteri dan inhibitor topoisomerase I dari X. granatum
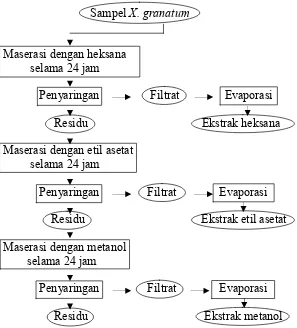
3.3.1. Ekstraksi komponen aktif
Ekstraksi komponen aktif dari X. granatum menggunakan tiga macam pelarut berdasarkan tingkat kepolarannya yaitu heksana (non polar), etil asetat (semi polar) dan metanol (polar). Proses ekstraksi senyawa aktif dari tanaman
Sampel X. granatum
Maserasi dengan heksana selama 24 jam
Penyaringan Filtrat Evaporasi
Residu Ekstrak heksana
Maserasi dengan etil asetat selama 24 jam
Penyaringan Filtrat Evaporasi
Residu Ekstrak etil asetat
Maserasi dengan metanol selama 24 jam
Penyaringan Filtrat Evaporasi
Residu Ekstrak metanol
Gambar 10 Proses ekstraksi bahan aktif (Hostetman et al. 1997)
3.3.2. Pembersihan ekstrak kasar
Teknik pembersihan ekstrak dilakukan dengan cara menambahkan pelarut asal pada ekstrak dan dilakukan partisi secara berulang sampai tidak didapatkan residu pada kertas saring. Prosedur kerja pembersihan ekstrak X. granatum (akar, batang, daun, daging buah dan biji) adalah sebagai berikut:
1) ekstrak hasil evaporasi dicuci dengan menambahkan pelarutnya dengan perbandingan ekstrak dan pelarut 1:2 atau ekstrak sampai terendam,
dihomogenkan dengan seker selama 1 jam dan selanjutnya didiamkan selama 24 jam dalam lemari pendingin (suhu 5oC) dan didapatkan 2 bagian terpisah yaitu bagian filtrat dan residu,
3) ekstrak yang diperoleh dicuci ulang dengan menambahkan pelarutnya kembali dan langkah selanjutnya sama dengan pencucian pertama, pencucian
dilakukan minimal 3 kali,
3.3.3. Pengujian aktivitas inhibitor topoisomerase I
Ekstrak X. granatum (akar, batang, daun, daging buah dan biji) dalam pelarut heksana, etil asetat dan metanol dilakukan uji inhibisi enzim DNA topoisomerase I. Pengujian antikanker secara in vitro bertujuan untuk melihat kemampuan sitotoksik ekstrak dalam menghambat enzim DNA topoisomerase I. Prosedur pengujian aktivitas inhibitor topoisomerase I disajikan pada Lampiran 2 dan visualisasi gel agarose dengan marker serta kontrol pada Lampiran 3.
3.3.4. Pengujian fitokimia
Uji fitokimia merupakan salah satu cara untuk mengetahui kandungan metabolit sekunder pada suatu ekstrak tanaman atau merupakan uji pendahuluan untuk mengetahui keberadaan senyawa kimia spesifik seperti senyawa alkaloid, fenol (termasuk flavonoid), tanin, dan saponin. Prinsip dan prosedur pengujian alkaloid, flavonoid, tanin dan saponin disajikan pada Lampiran 4.
3.3.5. Pengujian antibakteri
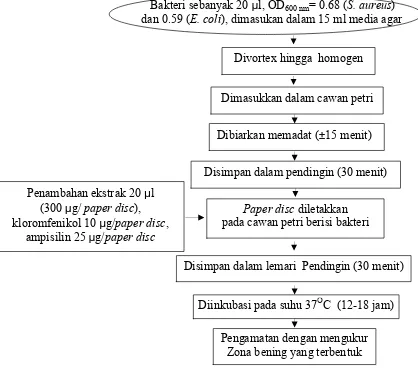
Pengujian aktivitas antibakteri ekstrak metanol X. granatum (akar, batang, daun, daging buah dan biji) terdiri dari tahap persiapan dan pembuatan media, penyegaran bakteri uji dan uji aktivitas antibakteri. Metode yang digunakan pada pengujian aktivitas antibakteri adalah metode difusi agar dengan teknik agar tuang. Prinsip metode ini, yaitu ekstrak akan berdifusi langsung dalam media agar yang telah mengandung bakteri uji. Bakteri uji yang digunakan adalah S.
aureus (bakteri Gram positif) dan E. coli (bakteri Gram negatif). Uji aktivitas antibakteri ekstrak metanol X. granatum pada Gambar 11 dan tahapan pengujian
Divortex hingga homogen
Dimasukkan dalam cawanpetri
Dibiarkan memadat (±15 menit)
Disimpan dalam pendingin (30 menit) Penambahan ekstrak 20 µl
(300 µg/ paper disc), kloromfenikol 10 µg/paper disc,
ampisilin 25 µg/paper disc
Diinkubasi pada suhu 37OC (12-18 jam) Disimpan dalam lemari Pendingin (30 menit)
Pengamatan dengan mengukur Zona bening yang terbentuk
Paper disc diletakkan pada cawan petri berisi bakteri Bakteri sebanyak 20 µl, OD600 nm= 0.68 (S. aureus) dan 0.59 (E. coli), dimasukan dalam 15 ml media agar
Gambar 11 Pengujian aktivitas antibakteri (Schlegel dan Schmidt 1994)
3.3.6. Penapisan ekstrak kasar
Penapisan ekstrak kasar metanol batang X. granatum untuk target pemurnian senyawa kimia, dengan metode spesifik yaitu penggunaan pelarut yang tepat dengan tujuan untuk menghilangkan komponen pengotor dan mendapatkan fraksi murni.
memerlukan waktu isolasi yang lama. Diagram alir penapisan, pemurnian alkaloid, flavonoid dan tanin ekstrak metanol batang X. granatum disajikan pada
Gambar 12, 13 dan 14.
Ekstrak kasar
Maserasi selama 24 jam dalam metanol dan air (4:1)
Penyaringan
Filtrat
Evaporasi suhu 40oC sampai 1/10 volume awal
Pengasaman dengan asam sulfat 2M (pH 3-4)
Ekstraksi 3x dengan kloroform
Lapisan kloroform Lapisan air-asam
Evaporasi Pembasaan dengan amoniak (pH 10)
Ekstrak pertengahan polar/ Ekstraksi 2x EPP/Fraksi alkaloid kloroform-metanol (3:1)
Lapisan kloroform dan metanol Lapisan air-basa
Evaporasi Ekstraksi dengan metanol Ekstrak basa/EB
Ekstrak polar/EP
Ekstrak metanol batang
Pelarutan dengan akuades panas
Penyaringan
Residu Filtrat
Partisi dengan heksana
Partisi dengan kloroform
Partisi dengan etanol
Partisi dengan etil asetat
Partisi dengan butanol
Fraksi butanol
Fraksi flavonoid Evaporasi
Gambar 13 Pemurnian flavonoid (Budzianowski 1985)
Ekstrak metanol batang
Partisi dengan heksana
Fraksi heksana
Ekstraksi dengan
aseton dan air (7:3) + asam askorbat 0,1%
Filtrat Residu
Evaporasi
Ekstrak
Partisi dengan kloroform
Partisi dengan etil asetat
Fraksi etil asetat Evaporasi Fraksi tanin
4.1. Ekstraksi X. granatum
Ekstraksi terhadap bahan tanaman bertujuan untuk memisahkan senyawa
bioaktif tanaman (biasanya dari senyawa tunggal atau kelompok senyawa).
Sebelum dilakukan proses ekstraksi sampel dikecilkan ukurannya untuk
memudahkan kontak dengan pelarut sehingga diharapkan semakin banyak
senyawa bioaktif yang dapat terekstrak. Sampel X. granatum yang telah
mengalami pengecilan ukuran disajikan pada Lampiran 6.
Rendemen merupakan perbandingan berat ekstrak yang diperoleh dengan
berat awal sampel yang digunakan. Rendemen menyatakan efektivitas pelarut
tertentu terhadap bahan dalam suatu sistem ekstraksi, tetapi tidak menunjukkan
tingkat aktivitas ekstrak tersebut. Hasil ekstraksi akar, batang, daun, biji dan
daging buah X. granatum dalam pelarut heksana, etil asetat dan metanol disajikan
pada Tabel 3 dan filtrat yang diperoleh pada Lampiran 7.
Tabel 3 Hasil ekstraksi X. granatum
Tabel 3 menunjukkan bahwa berat ekstrak yang diperoleh dipengaruhi
oleh jenis pelarut yang digunakan. Menurut Markham (1988), komponen yang
terbawa pada proses ekstraksi adalah komponen yang berpolaritas sesuai dengan
pelarutnya. Jenis pelarut yang digunakan mempengaruhi jumlah rendemen
dibandingkan menggunakan pelarut etil asetat (semi polar) dan heksana (non
polar), hal ini disebabkan pelarut metanol dapat memecah sel dan mengekstrak
bahan sampai ke bagian dalam sel.
Menurut Sukardiman et al. (2002), pelarut metanol adalah pelarut yang
dapat melarutkan seluruh kandungan kimia dari sampel yang bersifat polar
maupun non polar, karena komponen-komponen tersebut saling terkait satu
dengan lainnya melalui gugus fungsional sehingga komponen kimia yang ada
pada sampel tanaman obat dapat tersari secara sempurna. Urutan hasil rendemen
X. granatum dari beberapa bagian tanaman dengan menggunakan pelarut metanol
dari yang terkecil, yaitu: daging buah 3.97%; daun 6.75%; akar 12.54% biji
15.60% dan batang 22.42%.
Pemilihan pelarut dalam proses ekstraksi harus memperhatikan sifat
kandungan kimia bahan yang akan diekstrak. Dengan mengetahui sifat metabolit
yang akan diekstrak dapat dipilih pelarut yang sesuai berdasarkan kepolaran
zatnya. Menurut Bruneton (1993), alkaloid sebagai basa larut dalam pelarut non
polar seperti heksana dan kloroform. Selanjutnya menurut Harbonne (1987), etil
asetat mampu mengekstrak senyawa fenol dan terpenoid sedangkan metanol
mampu mengekstrak senyawa alkaloid kuartener, komponen fenolik, karotenoid
dan tanin.
Selesai ekstraksi, proses dilanjutkan dengan pembersihan ekstrak yang
bertujuan untuk menghilangkan pengotor yang dapat menghambat pemurnian.
Residu yang diperoleh antara lain berupa lemak, lilin dan lain-lain.
4.2. Aktivitas Inhibitor Topoisomerase I
Aktivitas inhibisi dari ekstrak tanaman ditandai dengan adanya
perubahan bentuk supercoiled DNA dari substrat menjadi bentuk relaxed DNA,
dimana pita dari DNA hasil reaksi dapat dicocokan dengan pita DNA dari marker.
Pengujian aktivitas inhibitor topoisomerase I dilakukan untuk semua bagian
tanaman X. granatum yaitu ekstrak akar, batang, daun, biji dan daging buah dalam
pelarut heksana, etil asetat dan metanol. Hasil uji topoisomerase I menunjukkan
ekstrak kasar X. granatum pada konsentrasi 50 <g/ml dapat menghambat enzim
enzim topoisomerase I. Uji inhibisi enzim DNA topoisomerase I dari ekstrak
kasar X. granatum disajikan pada Tabel 4 dan Gambar 15.
Tabel 4 Uji inhibisi enzim DNA topoisomerase I dari ekstrak kasar X. granatum (50 <g/ml)
Jenis sampel (kering) Jenis pelarut Inhibisi topoisomerase I
heksana - ekstrak kasar X. granatum pada konsentrasi 50 <g/ml
Topoisomerase I Drug Screening Kit dari TopoGen dapat mendeteksi
senyawa pada ekstrak yang bersifat poison yaitu mampu menstabilkan
ikatan enzim dan substrat (nicked intermediate) yang diindikasikan dengan
peningkatan open circular (OC) DNA pada gel, seperti ditunjukkan pada kontrol
sumur no 5 (Topo I + DNA + camptothecin). Ekstrak kasar X. granatum yang
bersifat poison yaitu ekstrak etil asetat akar (no 7a), ekstrak heksana dan etil asetat
batang (no 6b dan 7b), ekstrak heksana, etil asetat dan metanol daun (no 6c, 7c
Keterangan : 1. Topo I + DNA, 2. Marker supercoiled DNA, 3. Topo I + DNA + pelarut, 4. Marker relaxed DNA, 5. Topo I + DNA + camptothecin, 6. Ekstrak heksana, 7. Ekstrak etil asetat, 8. Ekstrak metanol, a) akar, b) batang, c) daun, d) daging buah, e) biji
dan 8c), ekstrak etil asetat daging buah (no 7d), ekstrak heksana dan etil asetat
biji (no 6e dan 7e). Senyawa pada ekstrak bersifat katalitik ditunjukkan dengan
dihambatnya aktivitas relaksasi yang ditandai tetap utuhnya substrat, tetap
berbentuk supercoiled DNA atau tidak terbentuk relaxed DNA, seperti
ditunjukkan pada kontrol sumur no 2 (marker supercoiled DNA). Ekstrak kasar
X. granatum yang bersifat katalitik yaitu ekstrak metanol akar dan batang (no 8a
dan 8b), ekstrak heksana dan metanol daging buah (no 6d dan 8d), serta ekstrak
metanol biji (no 8e). Sedangkan ekstrak heksana akar tidak dapat menghambat
enzim topoisomerase I, terlihat dengan terbentuknya relaxed DNA seperti kontrol
no 1 (Topo I + DNA) dan kontrol no 4 (marker relaxed DNA).
Jenis pengujian inhibitor topoisomerase I pada ekstrak X. granatum adalah
prescreen test yaitu untuk mengetahui apakah suatu senyawa merupakan senyawa
bioaktif, dengan mekanisme penghambatan langsung membunuh sel kanker secara
in vitro. Menurut Sukardiman et al. (2002), senyawa yang memiliki hambatan
terhadap aktivitas enzim DNA topoisomerase sebagian besar menyebabkan
kematian sel kanker dengan cara menginduksi/apoptosis dimana sel kanker akan
mati dengan memakan sesama sel kanker, sehingga pada aplikasi kliniknya nanti
diharapkan akan lebih selektif yaitu hanya membunuh sel kankernya saja tanpa
membunuh sel normal.
Menurut Putri (2004), salah satu cara untuk menguji kemampuan inhibisi
suatu senyawa terhadap topoisomerase I yaitu dengan menguji kemampuan
senyawa itu dalam menghambat pertumbuhan S. cerevisiae. Selanjutnya menurut
Dewick (2001), golongan alkaloid yaitu irinotecan dan camptothecin dapat
menghambat pertumbuhan S. cerevisiae dengan mekanisme kerja sebagai
inhibitor enzim topoisomerase I, yaitu dengan cara mengikat dan menstabilkan
komplek kovalen DNA-topoisomerase. Sutaryadi (1991) menyatakan bahwa
golongan alkaloid yang bersifat antitumor antara lain pirosilisin, isokinolin,
benzofenantridin, indol, sefalotaksus dan camptothecin.
Akiyama (1987) menyatakan genistein merupakan golongan flavonoid
yang banyak digunakan sebagai standar dalam menganalisis inhibitor dari tirosin
kinase. Menurut Murakani et al. (1999), quarsetin dan kaemferol termasuk
sebagai senyawa antikanker. Selanjutnya menurut Mangan (2003), quarsetin
berfungsi menghambat proliferasi sel leukimia dan sel ovari manusia secara
in vitro.
4.3. Pengujian Fitokimia Ekstrak Kasar Metanol X. granatum
Menurut Suhartini (2003), ekstrak metanol biji X. granatum mengandung
bahan antibakteri. Selanjutnya Hardjito dan Kingston (2004) melaporkan bahwa
ekstrak metanol X. granatum memiliki aktivitas sitotoksik terhadap sel kanker
rahim A2780. Berdasarkan hasil penelitian sebelumnya dan rendemen yang
dihasilkan pada penelitian ini paling tinggi maka dipilih ekstrak metanol
X. granatum untuk tahap pengujian selanjutnya.
Pengujian fitokimia merupakan uji kualitatif awal terhadap ekstrak kasar
untuk mengetahui jenis senyawa metabolit sekunder/golongan senyawa yang
terkandung pada ekstrak. Golongan senyawa dalam ekstrak dapat ditentukan
dengan mengamati perubahan warna dan terbentuknya endapan setelah
ditambahkan pereaksi yang spesifik untuk setiap uji kualitatif. Uji fitokimia
ekstrak kasar metanol X. granatum disajikan pada Tabel 5 dan Lampiran 8.
Tabel 5 Hasil uji fitokimia ekstrak kasar metanol X. granatum
Uji fitokimia Ekstrak kasar metanol X. granatum
Akar Batang Daun Biji Daging buah 1. Alkaloid
Tabel 5 menunjukkan bahwa uji fitokimia ekstrak kasar metanol akar,
batang, daun, biji dan daging buah X. granatum mengandung senyawa kimia
golongan alkaloid, flavonoid dan tanin. Sedangkan senyawa golongan saponin
hanya ditemukan pada ekstrak biji X. granatum. Bioaktivitas tanaman sangat
dipengaruhi oleh kandungan senyawa kimia yang terdapat dalam bahan
dan perbedaan kandungan senyawa kimia menunjukan perbedaan aktifitas
4.4. Aktivitas Antibakteri Ekstrak Kasar Metanol X. granatum
Uji aktivitas antibakteri bertujuan untuk melihat ada tidaknya aktivitas
antibakteri pada semua ekstrak X. granatum. Pengujian dilakukan dengan
membuat larutan stok 0.015 g ekstrak dalam 1 ml pelarutnya (metanol). Dari stok yang dibuat diambil 20 µl untuk menghasilkan konsentrasi ekstrak 300 µg/paper disc.
Kontrol positif yang digunakan dalam pengujian antibakteri adalah kloramfenikol pada konsentrasi 10 µg/paper disc dari larutan stok 0.0005 g dalam 1 ml akuades steril. Bakteri uji yang digunakan adalah bakteri non-klinis, koleksi Lab. Bioteknologi THP, IPB. Inokulum sebanyak 20 µl OD600 nm= 0.68 untuk
S. aureus (Gram positif) dan OD600 nm= 0.59 untuk E. coli (Gram negatif), yang
diperoleh dari inkubasi selama 18 jam pada suhu 37oC.
Menurut Schlegel dan Schmidt (1994), aktifitas antibakteri ditandai
dengan terbentuknya zona bening disekitar paper disc yang telah mengandung
bahan aktif. Ukuran zona hambat dipengaruhi oleh beberapa faktor yaitu
mikroorganisme uji (strain dan fisiologi bakteri uji), medium kultur, metode uji
serta kecepatan difusi zat. Diameter hambatan ekstrak kasar metanol X. granatum
terhadap bakteri S. aureus dan E. coli non-klinis disajikan pada Tabel 6
dan Lampiran 9.
Tabel 6 Diameter hambatan uji antibakteri ekstrak kasar metanol X. granatum
Ekstrak (300 µg/paper disc) dan kloramfenikol (10 µg/paper disc) Bakteri uji Diameter hambatan (mm)
Akar K Batang K Daun K Biji K D.buah K
Tabel 6 menunjukkan bahwa ekstrak kasar metanol X. granatum yang
dapat menghambat bakteri uji adalah akar, batang, biji dan daging buah sedangkan
pada daun tidak memiliki aktivitas antibakteri. Diameter hambatan uji antibakteri
dan 7 mm untuk E. coli. Menurut metode CDS (Calibrated Dichotomous
Sensitivity), jika diameter hambat yang terbentuk lebih besar atau sama dengan
6 mm maka ekstrak dikategorikan memiliki aktivitas antibakteri, sebaliknya
jika diameter hambat lebih kecil dari 6 mm atau tidak terbentuk maka ekstrak
tersebut tidak memiliki aktivitas sebagai antibakteri (Bell 1984). Antibakteri
dikategorikan sangat kuat jika daerah hambatnya lebih besar dari 20 mm, kuat jika
daerah hambat 10-20 mm, sedang jika daerah hambat 5-10 mm. Daerah hambat
lebih kecil dari 5 mm artinya kekuatan antibakteri yang dimiliki zat tersebut
sangat lemah (Suryawiria 1978). Merujuk pada metode tersebut maka ekstrak
kasar metanol batang X. granatum dikategorikan memiliki aktivitas antibakteri
sedang.
Zona hambat dari kloramfenikol mempunyai diameter lebih besar
dibandingkan diameter zona hambat dari ekstrak X. granatum, walaupun
konsentrasi yang digunakan lebih rendah dari konsentrasi ekstrak. Kloramfenikol
merupakan zat antibakteri murni, sehingga dalam konsentrasi kecil dapat
menghambat pertumbuhan bakteri dengan kekuatan tinggi. Sedangkan ekstrak
X. granatum yang digunakan masih merupakan ekstrak kasar (crude extract).
Menurut Raphael (1987), kloramfenikol merupakan antibiotik aminoglikosida,
yaitu antibiotik bakteriostatik yang tidak membunuh bakteri melainkan
menghambat sintesis protein yang sangat diperlukan dalam perbanyakan dan
pembelahan sel bakteri.
4.5. Penentuan Minimum Inhibitory Concentration (MIC)Topoisomerase I
Hasil penelitian menunjukkan bahwa ekstrak metanol batang X. granatum
memberikan rendemen paling besar yaitu 22.42% dan dapat menghambat
enzim topoisomerase I serta memiliki aktivitas antibakteri terhadap S. aureus dan
E. coli. Dengan alasan tersebut ekstrak metanol batang X. granatum dipilih
untuk pengujian lanjut penentuan Minimum Inhibitory Concentration (MIC)
topoisomerase I, penapisan ekstrak kasar untuk target pemurnian senyawa kimia
dan pengujian aktivitas antibakteri pada fraksi aktif.
Penentuan MIC bertujuan untuk mengetahui konsentrasi terkecil dari
uji MIC ekstrak kasar metanol batang X. granatum terhadap enzim DNA
topoisomerase I disajikan pada Tabel 7 dan Gambar 16.
Tabel 7 Hasil uji MIC ekstrak kasar metanol batang X. granatum terhadap enzim DNA topoisomerase I
Jenis ekstrak Konsentrasi (<g/ml)
Aktivitas inhibisi topoisomerase I
5
-10
-Metanol batang X. granatum 25 +
50 +
75 +
100 +
Gambar 16 Hasil elektroforesis uji MIC ekstrak kasar metanol batang X. granatum terhadap enzim DNA topoisomerase I
Hasil pengujian MIC menunjukkan bahwa konsentrasi ekstrak 5 dan
10 <g/ml tidak dapat menghambat kerja enzim topo I, terlihat dengan
terbentuknya relaks DNA seperti pada kontrol no 1 dan no 4. Konsentrasi
ekstrak 25 <g/ml bersifat poison artinya mampu menstabilkan ikatan enzim dan
substrat dan terjadi peningkatan open circular (OC) DNA pada gel, seperti
ditunjukkan pada kontrol no 5. Konsentrasi ekstrak 50, 75 dan 100 <g/ml bersifat
katalitik ditunjukkan dengan substrat DNA tetap utuh berbentuk supercoiled
DNA dan tidak terbentuk relaxed DNA karena terhambatnya aktivitas relaksasi,
seperti pada kontrol no 2.
Ikatan inhibitor dengan enzim dapat mengubah kemampuan enzim
dalam mengikat substrat, sehingga mengubah kemampuan daya katalisator enzim.
Hal ini disebabkan karena struktur enzim yang sudah berikatan dengan inhibitor
mengalami perubahan fisik dan kimiawi sedemikian rupa sehingga aktivitas
Keterangan : 1. Topo I + DNA, 2. Marker supercoiledDNA, 3. Topo I + DNA + pelarut, 4. Marker relaxed DNA, 5. Topo I + DNA + camptothecin, 6.a) Ekstrak metanol batang
X. granatum 5 <g/ml, b) 10 <g/ml, c) 25 <g/ml, d) 50 <g/ml, e) 75 <g/ml, f) 100 <g/ml
hayatinya menjadi terhambat. Menurut Yanagihara et al. (2005), inhibitor
topoisomerase bekerja sebagai racun topoisomerase yaitu mengubah enzim
topoisomerase menjadi toksin yang berpotensi menyebabkan kematian sel.
Semua sel membutuhkan topoisomerase tetapi sel kanker tumbuh dengan cepat
dan membutuhkan lebih banyak enzim ini. Dengan dihambatnya enzim
topoisomerase maka obat kanker akan lebih selektif yaitu lebih banyak
menghancurkan sel kanker dari pada sel sehat.
Menurut Zahir (1996), senyawa flavonoid dikatakan efektif sebagai
inhibitor enzim topoisomerase bila memiliki nilai MIC kurang dari 10 <g/ml.
Selanjutnya Menurut Swanson dan Pezzuto (1990) dalam Sukardiman et al.
(2002), bila suatu zat memiliki aktivitas inhibisi terhadap enzim DNA
topoisomerase, maka zat tersebut berpotensi sebagai antikanker jika nilai MED
(minimum efficient dose) 20 µg/ml. MIC ekstrak metanol batang X. granatum
terhadap topoisomerase I adalah 25 <g/ml, hal ini disebabkan ekstrak yang
digunakan masih kasar atau belum murni. Untuk konfirmasi perlu dilakukan uji
MIC pada konsentrasi 15 dan 20 <g/ml.
4.6. Penapisan Ekstrak Kasar Metanol Batang X. granatum
Penapisan ekstrak kasar metanol batang X. granatum dilakukan untuk
target pemurnian senyawa kimia. Hasil penapisan ekstrak metanol batang
X. granatum disajikan pada Tabel 8 dan 9 serta Lampiran 10.
Tabel 8 Hasil penapisan ekstrak kasar metanol batang X. granatum
Jenis EPP = Ekstrak polar pertengahan EP = Ekstrak polar (fase metanol)
Hasil penapisan ekstrak metanol batang X. granatum menunjukkan
rendemen tertinggi pada ekstrak polar/EP yaitu 84.99 %. Ekstrak yang hanya
mengandung alkaloid terdapat pada ekstrak pertengahan polar/EPP (fase
kloroform). Menurut Wikipedia (2007), pelarut kloroform merupakan salah satu
Tabel 9 Penapisan senyawa kimia ekstrak metanol batang X. granatum
Jenis uji Jenis ekstrak
EK EPP EB EP
Ekstrak basa/EB dan ekstrak polar/EP masih belum murni karena senyawa
flavonoid dan tanin masih tercampur, sehingga dilakukan penapisan ekstrak lebih
lanjut dan ekstrak yang diperoleh dilakukan pengujian fitokimia untuk mengetahui
kemurnian fraksi. Hasil penapisan fraksi alkaloid, flavonoid dan tanin ekstrak
metanolbatang X. granatum pada Tabel 10 dan Lampiran 11.
Tabel 10 Hasil penapisan fraksi alkaloid, flavonoid dan tanin ekstrak metanol batang X. granatum
Jenis uji Jenis fraksi
Fraksi alkaloid Fraksi flavonoid Fraksi tanin 1. Alkaloid
Ekstrak metanol batang X. granatum yang memiliki aktivitas antibakteri,
dari hasil penapisan ekstrak didapatkan fraksi alkaloid, flavonoid dan tanin.
Mekanisme kerja aktivitas antibakteri fraksi dari X. granatum, diduga dengan
menghambat sintesis peptidoglikan yang berperan dalam pembentukan dinding sel
bakteri, merusak membran sel dan keluarnya substansi sel seperti protein dan
asam nukleat yang berakibat sel berangsur-angsur mati.
Menurut Darusman et al. (1995), zat antimikroba alami dari sumberdaya
pesisir dan laut merupakan hasil metabolit sekunder dari kelompok senyawa
fenol/fenolik, alkaloid, terpenoid, dan juga berasal dari senyawa metabolit primer
seperti peptida. Selanjutnya Menurut Davidson dan Branen (1993), senyawa
flavonoid termasuk kelompok fenolik yang memiliki aktivitas antibakteri, dengan
mekanisme kerja merusak membran sel dari mikroorganisme. Bagian membran
permeabilitas membran sel bakteri. Kim et al. (1995) menyatakan bahwa reaksi
antara komponen membran fosfolipid dengan senyawa fenolik mengakibatkan
perubahan komposisi fosfolipid membran, yang diikuti dengan pembengkakan sel,
selanjutnya terjadi kerusakan membran sitoplasma dan mengakibatkan keluarnya
kandungan intraseluler sel.
4.7. Uji Antibakteri Fraksi Aktif Ekstrak Metanol Batang X. granatum
Bakteri uji yang digunakan untuk pengujian aktivitas antibakteri dari
fraksi aktif ekstrak metanol batang X. granatum adalah bakteri E. coli non-klinis,
E. coli dan S. aureus klinis. Hasil pengukuran diameter hambatan dari fraksi aktif
ekstrak metanolbatang X. granatum disajikan pada Tabel 11.
Tabel 11 Diameter hambatan uji antibakteri fraksi aktif ekstrak metanol batang X. granatum
Fraksi (300µg/paperdisc) dan ampisilin (25µg/paper disc) Bakteri uji Diameter hambatan (mm)
Alkaloid A Flavonoid A Tanin A
batang X. granatum menggunakan kontrol positif ampisilin karena kloramfenikol
menyebabkan efek idiosyncratic aplastic anemia, sehingga kloramfenikol tidak
aman dan tidak diizinkan digunakan pada manusia dan hewan (FDA 2004).
Idiosyncratic aplastic anemia merupakan suatu penyakit yang menyebabkan
sumsum tulang berhenti memproduksi sel darah merah dan sel darah putih
(SEO Consulting 2007).
Ampisilin bekerja dengan cara menghambat sintesis peptidoglikan,
akibatnya dinding sel menjadi lemah dan karena tekanan turgor dari dalam
menyebabkan dinding sel pecah/lisis sehingga bakteri mengalami kematian.
bakteri sehingga akan terjadi lisis yang menyebabkan bakteri tidak mampu
bertahan hidup.
Pemilihan antibiotik ampisilin dalam pengujian antibakteri kurang tepat
jika ingin melihat hubungan aktivitas antibakteri dengan inhibitor topoisomerase
I, karena mekanisme kerja ampisilin lebih kepada penghambatan sintesis
peptidoglikan yang berperan dalam pembentukan dinding sel. Menurut Williams
et al. (1996), antibiotik yang berfungsi dalam penghambatan sintesis protein yaitu
kloramfenikol, kladomisin, tetrasiklin, spektinomisin, streptomisin, gentamisin
dan mupirosin. Sedangkan antibiotik yang bersifat menghambat enzim
DNA-RNA polimerase yaitu rifampin.
Bakteri E. coli klinis bersifat resisten terhadap ampisilin (ditunjukkan
pada Tabel 11), diindikasikan dengan tidak terbentuk zona bening, bakteri tetap
tumbuh/bakteri tidak dapat dihambat pertumbuhannya, sedangkan S. aureus klinis
bersifat tidak resisten pada konsentrasi ampisilin 25 µg/paper disc. Keadaan ini
terjadi karena adanya perbedaan senyawa penyusun struktur dinding sel. Dinding
sel E. coli (bakteri Gram negatif) selain memiliki lapisan peptidoglikan juga ada
lapisan tambahan pada dinding sel yang disebut membran luar yang berfungsi
sebagai penghalang masuknya senyawa-senyawa yang tidak diperlukan sel
bakteri. Sebaliknya struktur dinding sel S. aureus (bakteri Gram positif) relatif
sederhana sehingga lebih sensitif terhadap komponen antibakteri.
Menurut Madigan et al. (2003), sebagian besar dinding sel bakteri Gram
positif mengandung 90% peptidoglikan serta lapisan tipis asam teikoat dan
mengandung protein M yang merupakan molekul panjang dengan lipoteikoat
membentuk mikrofibril yang memudahkan pelekatan antibakteri. Dinding sel
bakteri Gram negatif mengandung tiga polimer yang terletak diluar lapisan
peptidoglikan yaitu lipoprotein, porin matrik dan lipopolisakarida. Selanjutnya
menurut Williams et al. (1996), membran luar pada bakteri Gram negatif terdiri
dari lapisan lipopolisakarida (LPS) yang terikat satu sama lain dengan kation
divalent Ca++ dan Mg++, berfungsi sebagai penghalang masuknya
senyawa-senyawa yang tidak diperlukan sel (bakteriosin, enzim dan senyawa-senyawa hidrofobik).
Fraksi flavonoid dan tanin dari ekstrak metanol batang X. granatum dapat
terjadi karena bakteri E. coli klinis yang digunakan diambil dari pasien yang
terinfeksi bakteri tersebut dan terseleksi menghadapi antibiotik sehingga bersifat
resisten terhadap bahan aktif yang mengandung senyawa antibakteri.
Ekstrak metanol batang X. granatum yang terdiri dari fraksi alkaloid,
flavonoid dan tanin menunjukkan aktivitas antibakteri dan diduga juga sebagai
inhibitor topoisomerase I. Menurut Sukardiman et al. (2002), senyawa bahan
alam yang memiliki aktivitas antikanker dan memiliki target molekul enzim DNA
topoisomerase antara lain termasuk golongan alkaloid, glikosida dan flavonoid.
Agarrado (2002) menyatakan bahwa alkaloid mempunyai aktivitas biologi
sebagai antibakteri dan antikanker, sehingga dapat digunakan sebagai bahan obat.
Menurut Frederick et al. (2003), alkaloid dapat menginduksi apoptosis pada sel
kanker manusia. Selanjutnya menurut Alexandrova et al. (2000) dalam Dardanela
(2005), alkaloid dominan mempunyai khasiat obat sebagai penghambat enzim
tirosin kinase dan mematikan sel abnormal seperti kanker.
Harborne (1987) menyatakan bahwa flavonoid berfungsi sebagai antivirus
dan memiliki aktivitas sitotoksik dengan cara membentuk senyawa kompleks
dengan protein melalui ikatan hidrogen sehingga dapat menghambat kerja enzim.
Menurut Robinson (1995), senyawa tanin memiliki aktivitas antioksidan,
menghambat pertumbuhan tumor, menghambat enzim reverse transkriptase
dan DNA topoisomerase. Selanjutnya menurut Harismah (2002), sifat antibakteri
tanin diakibatkan oleh gugus pirogalol dan gugus galoil. Suragih (2002)
menyatakan bahwa katekin, leukoantosianin dan asam galat merupakan senyawa
tanin yang terdapat pada biji X. granatum yang berperan sebagai antibakteri.
Dari hasil penelitian sebelumnya dapat disimpulkan bahwa aktivitas
antibakteri dan inhibitor topoisomerase I ekstrak X. granatum disebabkan oleh
kandungan senyawa aktif yaitu alkaloid, flavonoid dan tanin. Senyawa antibakteri
ada hubungannya dengan inhibitor topoisomerase I, karena memiliki mekanisme
yang sama yaitu mengganggu sintesis protein dan asam nukleat, sehingga dapat
menekan pertumbuhan atau proliferasi sel kanker. Biosintesis protein dan asam
nukleat selalu berkaitan, karena itu senyawa antibiotik yang menghambat sintesis
DNA, secara langsung menghambat sintesis protein. Sebaliknya bila sintesis