GAMBARAN RESPON KEBAL AYAM PETELUR
TERHADAP VAKSIN INAKTIF AVIAN INFLUENZA H5N1
MONOVALEN (
CLADE
2.3.2) DAN BIVALEN (
CLADE
2.1.3
DAN 2.3.2)
DEDEK HARYANTO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Gambaran Respon Kebal Ayam Petelur terhadap Vaksin Inaktif Avian Influenza H5N1 Monovalen (clade 2.3.2) dan Bivalen (clade 2.3.2 dan 2.1.3) adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2014
Dedek Haryanto
NIM B04100094
ABSTRAK
DEDEK HARYANTO. Gambaran Respon Kebal Ayam Petelur terhadap Vaksin Inaktif Avian Influenza H5N1 Monovalen (clade 2.3.2) dan Bivalen (clade 2.3.2 dan 2.1.3). Dibimbing oleh RETNO D. SOEJOEDONO dan NI LUH PUTU IKA MAYASARI.
Virus Avian Influenza (AI) H5N1 clade 2.3.2 terdeteksi di Indonesia pada tahun 2012. Kementerian Pertanian Indonesia mengeluarkan kebijakan pembuatan vaksin monovalen (AI H5N1 clade 2.3.2) dan bivalen (AI H5N1 clade 2.3.2 dan 2.1.3) untuk mengurangi kerugian yang diakibatkan oleh virus AI H5N1 clade
2.3.2 dan AI H5N1 clade 2.1.3 pada unggas (ayam dan itik). Penelitian ini bertujuan mengukur respon kebal ayam petelur yang divaksinasi AI H5N1 inaktif monovalen dan bivalen. Penelitian ini menggunakan ayam petelur sebanyak 135 ekor yang dibagi menjadi 3 kelompok. Masing-masing kelompok sebanyak 45 ekor. Vaksinasi dilakukan pada hari ke-10 dan 31. Koleksi serum ayam petelur dilakukan sebanyak 6 kali (hari ke-17, 28, 31, 38, 45 dan 52). Hasil pengukuran titer antibodi menggunakan uji Hambatan Aglutinasi (HI) memperlihatkan pemberian vaksin monovalen mampu memberikan perlindungan terhadap antigen AI H5N1 clade 2.3.2 sampai level protektif dan pemberian vaksin bivalen mampu menginduksi pembentukan antibodi terhadap antigen AI H5N1 clade 2.3.2 dan AI H5N1 clade 2.1.3 sampai level protektif.
Kata kunci: Avian Influenza, bivalen, monovalen, vaksin
ABSTRAC
DEDEK HARYANTO. Immune Response of Chickens against Inactivated Avian Influenza Vaccine H5N1 Monovalen (clade 2.3.2) and Bivalen (clade 2.3.2 and 2.1.3). Supervised by RETNO D. SOEJOEDONO dan NI LUH PUTU IKA MAYASARI.
Avian Influenza (AI) virus H5N1 clade 2.3.2 was detected in Indonesia in 2012. The Indonesian Ministry of Agriculture issued policy of making monovalent and bivalent vaccines to minimize losses caused by AI H5N1 clade 2.3.2 and clade
2.1.3 in poultry (chickens and ducks). This research aimed to measure the immune response of chickens which were vaccinated monovalent vaccine (AI H5N1 clade
2.3.2) and bivalent vaccine (AI H5N1 clade 2.3.2 and 2.1.3). This research conducted by dividing 135 chickens into 3 groups and each group contained 45 chickens. Vaccination was performed on day 10 and 31. Serum collection was done as many as 6 times (on day 17, 28, 31, 38, 45 and 52). Antibody titer was measured using Haemaglution Inhibition (HI) test. HI titer of monovalent vaccine showed protective level when measured using antigent AI H5N1 clade 2.3.2. Bivalent vaccine was able to induce protective levels of antibody against antigent AI H5N1 clade 2.3.2 and 2.1.3.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
GAMBARAN RESPON KEBAL AYAM PETELUR
TERHADAP VAKSIN INAKTIF AVIAN INFLUENZA H5N1
MONOVALEN (
CLADE
2.3.2) DAN BIVALEN (
CLADE
2.1.3
DAN 2.3.2)
DEDEK HARYANTO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Gambaran Respon Kebal Ayam Petelur terhadap Vaksin Inaktif Avian Influenza H5N1 Monovalen (clade 2.3.2) dan Bivalen (clade 2.1.3 dan 2.3.2)
Nama : Dedek Haryanto
NIM : B04100094
Disetujui oleh
Tanggal Lulus:
Prof Dr Drh Retno D. Soejoedono MS Pembimbing I
Dr Drh Ni Luh Putu Ika Mayasari Pembimbing II
Diketahui oleh
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak Juni 2013 hingga April 2014 ini adalah Gambaran Respon Kebal Ayam Petelur terhadap Vaksin Inaktif Avian Influenza H5N1 Monovalen (clade 2.3.2) dan Bivalen (clade 2.3.2 dan 2.1.3).
Terima kasih penulis ucapkan kepada Prof Dr Drh Retno D. Soejeodono dan Dr Drh Ni Luh Putu Ika Mayasari selaku pembimbing, Dr Drh Sri Murtini, MSi yang telah memberikan kesempatan untuk melakukan penelitian dibagian Mikrobiologi Medik FKH IPB, Prof Dr Drh Muhamad Agus Setiadi selaku pembimbing akademik serta rekan sepenelitian Ahmad Mustofa. Disamping itu, penghargaan penulis sampaikan kepada Mas Wahyu, Pak Nur, Pak Lukman, Mbak Selin, Mbak Pupi beserta seluruh staf di Bagian Mikrobiologi Medik yang lain. Ungkapan terima kasih juga disampaikan kepada ayahanda Sumpeno, ibuda Painah, Kakanda Sutrisno, Kakanda Sutarno, Ayunda Erna Wati, Ayunda Erni, Adinda Hermin Rahayu Pertiwi serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2014
Dedek Haryanto
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
MATERI DAN METODE 2 Waktu dan Tempat Penelitian 2
Alat dan Bahan 2
Rancangan Percobaan 2
Pengambilan Darah dan Evaluasi Titer Antibodi 3
Pembuatan Suspensi Sel Darah Merah 1% 4
Uji Haemaglutinasi (HA) Mikrotitrasi 4
Uji Hambatan Aglutinasi (HI) Mikrotitrasi 5
Analisis Data 5
HASIL DAN PEMBAHASAN 6
SIMPULAN 11
DAFTAR PUSTAKA 12
DAFTAR TABEL
1. Rancangan percobaan 3
2. Rataan titer antibodi yang diuji dengan antigen AI H5N1 clade 2.3.2 6 3. Rataan titer antibodi yang diuji dengan antigen AI H5N1 clade 2.1.3 8
DAFTAR GAMBAR
1. Rataan titer antibodi yang diuji dengan antigen AI H5N1 clade 2.3.2 7 2. Rataan titer antibodi yang diuji dengan antigen AI H5N1 clade 2.1.3 8 3. Rataan titer antibodi kelompok monovalen yang diuji dengan antigen
AI H5N1 clade 2.1.3 dan 2.3.2 9
4. Rataan titer antibodi kelompok bivalen yang diuji dengan antigen
1
PENDAHULUAN
Latar Belakang
Avian Influenza (AI) adalah penyakit yang disebabkan oleh virus Influenza subtipe A. Virus AI dapat menyebabkan gangguan pernafasan sampai kematian pada unggas dan mamalia. Induk semang alami dari penyakit ini adalah bebek liar dan unggas air. Wabah penyakit AI di Indonesia telah diidentifikasi sejak tahun 2003 (Dharmayanti et al. 2004). Virus AI dapat menginfeksi ayam ras petelur, ayam pedaging, burung puyuh dan itik (Dharmayanti et al. 2006). Unggas yang terinfeksi virus AI memperlihatkan gejala klinis berupa penurunan konsumsi pakan, diare, tremor dan penurunan produksi telur (Withworth et al. 2007).
Usaha peternakan ayam petelur merupakan sektor peternakan yang paling banyak merasakan dampak wabah AI di Indonesia. Peternak ayam petelur yang terdapat di Indonesia pada tahun 2012 berjumlah 202 perusahaan dengan total populasi 139 juta ekor (BPS 2012a). Populasi ayam petelur tersebut dapat memproduksi telur sebanyak 1.4 juta ton/tahun (BPS 2012b). Wabah virus AI menimbulkan dampak ekonomi diantaranya adalah menurunnya jumlah peternak, menurunnya skala usaha dan menurunnya pendapatan dari memelihara unggas. Koordinasi Komite Nasional Flu Burung dan Kesiapsiagaan Menghadapi Pandemi Influenza (Komnas FBPI) memperkirakan besarnya kerugian akibat wabah AI dari 2004 – 2008 sebesar 4.3 triliun, diluar kerugian hilangnya kesempatan kerja dan berkurangnya konsumsi protein (Basuno 2008).
Wabah AI menyebabkan ratusan ribu itik mati di daerah Jawa Tengah, Yogyakarta dan Jawa Timur yang disebabkan oleh virus AI H5N1 clade 2.3.2 (Wibawa et al. 2012). Virus tersebut merupakan subtipe clade baru yang ditemukan di Indonesia. Virus AI yang diisolasi dari itik pada tahun 2012, setelah dilakukan analisis filogenetik memperlihatkan bahwa virus AI H5N1 clade 2.3.2 merupakan introduksi dari Vietnam (Dharmayanti et al. 2013). Virus AI yang selama ini sering menjadi wabah di Indonesia yang diisolasi dari unggas dan manusia merupakan virus AI H5N1 clade 2.1.1, 2.1.2, dan 2.1.3 (WHO 2011). Virus AI H5N1 clade 2.3.2 sedang aktif bersirkulasi di Indonesia, namun kewaspadaan terhadap virus AI H5N1 clade 2.1.3 harus tetap ditingkatkan karena virus ini terbukti telah banyak menimbulkan kematian pada unggas. Virus AI H5N1 clade 2.1.3 dan clade 2.3.2 yang bersirkulasi di Indonesia membutuhkan perhatian yang serius karena virus ini bersifat patogen dan zoonosis (Dharmayanti
et al. 2013).
Pada tanggal 3 Januari 2013, Direktorat Jenderal Peternakan dan Kesehatan Hewan mengeluarkan keputusan nomor: 03051/PD 620/F/01/2013 mengenai vaksinasi pada itik dan unggas. Penanganan dan pencegahan virus AI yang beredar di Indonesia dilakukan melalui penyediaan vaksin AI. Vaksin yang diproduksi yaitu vaksin monovalen dan bivalen yang berasal dari virus AI H5N1
clade 2.1.3 atau clade 2.3.2 (BPPP 2013). Vaksin ini diharapkan mampu melindungi itik dan ayam komersial dari serangan virus AI H5N1 clade 2.3.2 dan
2
Tujuan
Penelitian ini dilakukan untuk mengukur respon tanggap kebal ayam petelur yang divaksinasi dengan vaksin inaktif AI H5N1 monovalen (clade 2.3.2) dan bivalen (clade 2.1.3 dan 2.3.2).
Manfaat
Penelitian ini diharapkan mampu memberikan informasi tentang respon tanggap kebal ayam petelur yang divaksinasi dengan vaksin inaktif AI H5N1 monovalen (clade 2.3.2) dan bivalen (clade 2.1.3 dan 2.3.2).
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Juli 2013 – April 2014. Penelitian ini berupa percobaan laboratorium dan lapangan yang dilakukan di Laboratorium Terpadu Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner dan kandang hewan percobaan Unit Pengelola Hewan Laboratorium Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat dan Bahan
Bahan yang digunakan untuk melakukan penelitian ini adalah suspensi sel darah merah 5% dan 1%, NaCl Fisiologis, Na-sitrat 3.8%, alkohol 70%, antigen AI H5NI clade 2.1.3 dan clade 2.3.2 sebagai virus standar 4 HAU, larutan
Posphate Buffer Saline (PBS) dan vaksin uji monovalen dan bivalen.
Alat yang digunakan yaitu tabung standar 10 ml, syringe 1 ml dan 3 ml, lemari pendingin, micropippete, microplate, pippete tip, microtube 1.5ml, kapas, kandang litter, rak tabung mikro, ice pack, cooler box dan alat sentrifus Haereus®.
Rancangan Percobaan
3
Tabel 1 Rancangan percobaan
Pengambilan Darah dan Evaluasi Titer Antibodi
Anak ayam (DOC) diambil darahnya untuk uji Hambatan Aglutinasi (HI) yang digunakan untuk menghitung titer antibodi asal induk. Pengambilan darah untuk koleksi serum dilakukan pada hari ke-17, 28, 31, 38, 45 dan 52. Darah dibawa ke laboratorium Terpadu bagian Mikrobiologi Medik FKH-IPB. Darah dibiarkan dalam syringe dengan posisi horizontal dan disimpan di suhu ruang penelitian, kemudian 20 ekor DOC diambil darah intrakardial untuk diperiksa antibodi asal induk
7 Pemisahaan dan penandaan untuk masing-masing kelompok
Kelompok monovalen dan bivalen Kelompok kontrol 10 Vaksinasi:
1. Kelompok monovalen divaksinasi dengan vaksin monovalen (AI H5N1 clade 2.3.2) melalui rute subkutan dengan dosis 0.2 ml/ekor
2. Kelompok bivalen divaksinasi dengan vaksin bivalen (AI H5N1 clade 2.3.2 dan 2.1.3) melalui rute subkutan dengan dosis 0.2 ml/ekor
17 dan 28
Pengambilan darah pada setiap kelompok vaksinasi masing-masing 10 ekor ayam
Pengambilan darah kelompok kontrol sebanyak 10 ekor ayam 31 Pengambilan darah sebelum vaksinasi
masing-masing 10 ekor. Vaksinasi :
1. Kelompok monovalen divaksinasi dengan vaksin monovalen (AI H5N1 clade 2.3.2) melalui rute intramuskular dengan dosis 0.5 ml/ekor
2. Kelompok bivalen divaksinasi dengan vaksin bivalen (AI H5N1 clade 2.3.2 dan 2.1.3) melalui rute intramuskular dengan dosis 0.5 ml/ekor
Pengambilan darah pada setiap kelompok vaksinasi masing-masing 10 ekor ayam
4
Pembuatan Suspensi Sel Darah Merah 1%
Darah utuh ayam (whole blood) ditambahkan antikoagulan Natrium Sitrat 3.8% dengan perbandingan 4:1, kemudian disentrifugasi pada kecepatan 1500 rpm (Heareus®) selama 10 menit. Supernatan yang terbentuk dibuang, sedangkan sel darah merah yang mengendap dicuci atau dibilas NaCl fisiologis dengan volume yang sama, kemudian disentrifugasi kembali. Pencucian dilakukan sebanyak 3 kali. Hasilnya didapatkan sel darah merah dengan konsentrasi 100%, kemudian dilakukan pengenceran dengan penambahan NaCl fisiologis secara bertingkat menjadi 50%, 5% dan 1%. Suspensi sel darah merah 1% digunakan untuk uji Haemaglutinasi (HA) dan Hambatan Aglutinasi (HI).
Uji Haemaglutinasi (HA) Mikrotitrasi
Uji Haemaglutinasi (HA) menggunakan metode HA standar yang ditetapkan OIE (OIE 2014). Posphate Buffer Saline (PBS) sebanyak 25 µ l dimasukkan ke sumur microplate berdasar V dari baris A – E di kolom 2 – 12 dan baris F di kolom 1 – 12. Suspensi antigen (AI H5N1 clade 2.1.3 atau clade 2.3.2) sebanyak 50 µl dimasukkan ke sumur A1 sampai E1. Antigen dari sumur A1 sampai E1 sebanyak 25 µ l dipindahkan ke sumur A2 sampai E2 menggunakan pipet multichanel lalu dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali. PBS sebanyak 25 µ l dimasukan ke dalam sumur B2 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran 10 kali, selanjutnya dari B2 dikeluarkan sebanyak 25 µ l sehingga pengenceran pada sumur B2 menjadi 1/3. PBS sebanyak 75 µ l dimasukkan ke dalam sumur C2 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali, selanjutnya dari C2 dikeluarkan sebanyak 75 µl sehingga pengenceran pada sumur C2 menjadi 1/5. PBS sebanyak 125 µl dipipet ke dalam sumur D2 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran 10 kali, selanjutnya dari D2 dikeluarkan sebanyak 125 µ l sehingga pengenceran pada sumur tersebut menjadi 1/7. PBS sebanyak 175 µ l dipipet ke dalam sumur E2 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali, selanjutnya dari E2 dikeluarkan sebanyak 175 µl sehingga pengenceran pada sumur tersebut menjadi 1/9. Suspensi dari kolom A2 sampai ke E2 dipipet menggunakan tips yang baru sebanyak 25 µl ke dalam A3 sampai E3 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali. Suspensi dari kolom A3 sampai E3 sebanyak 25 µl dipindahkan ke dalam kolom A4 sampai E4 dan dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali. Langkah ini diulangi hingga kolom A12 sampai E12. Suspensi yang telah homogen pada kolom A12 sampai E12 dibuang sebanyak 25 µ l. PBS sebanyak 25 µ l dimasukkan ke dalam sumur baris A – F di kolom 1 – 12. Suspensi sel darah merah 1% sebanyak 25 µ l ditambahkan ke dalam sumur baris A – F di kolom 1 – 12. Plate digoyang untuk menghomogenkan campuran larutan selama 10 detik, kemudian plate diinkubasi selama 30 menit pada suhu ruang. Hasil uji HA dibaca dengan cara memiringkan
5
Uji Hambatan Aglutinasi (HI) Mikrotitrasi
Uji Hambatan Aglutinasi (HI) menggunakan metode HI standar yang ditetapkan OIE (OIE 2014). PBS sebanyak 25 µ l dimasukan ke dalam sumur
microplate berdasar V dari baris A – H dikolom 1 – 12. Serum ayam sebanyak 25 µ l dimasukkan ke dalam sumur A1 – F1, kemudian dihomogenkan dengan cara menghisap dan mengeluarkan campuran sebanyak 10 kali. Suspensi di sumur A1 – F1 dipindahkan ke sumur A2 – F2 sebanyak 25 µl, kemudian dihomogenkan. Langkah ini diulangi hingga sumur A12 – F12, kemudian suspensi yang telah homogen disumur A12 – F12 dibuang sebanyak 25 µl. Suspensi antigen AI H5N1
clade 2.1.3 atau clade 2.3.2 sebanyak 25 µ l dimasukkan ke dalam sumur dari baris A – G dikolom 1 – 12 dan diinkubasi pada suhu ruang selama 30 menit. PBS sebanyak 25 µl dimasukkan ke dalam sumur H1 – H12. Suspensi sel darah merah 1% sebanyak 25 µ l dimasukkan ke dalam semua sumur. Plate digoyang selama 10 detik untuk menghomogenkan larutan dan diinkubasi pada suhu ruang selama 30 menit. Hasil diamati setelah semua kontrol positif memperlihatkan adanya reaksi hambatan aglutinasi. Hasil uji HI dibaca dengan cara memiringkan microplate 45º. Sumur yang memperlihatkan aglutinasi (penggumpalan sel darah merah) seperti pada kontrol negatif (sumur G1 – G12) dinyatakan negatif HI. Sumur yang memperlihatkan endapan seperti pada sumur kontrol positif (sumur H1 – H12) dinyatakan positif HI. Batas akhir pada pengenceran tertinggi yang menghambat aglutinasi secara sempurna disebut dengan “end point”.
Rataan titer antibodi dihitung dengan menggunakan rumus:
log2 GMT = (log2 t1)(S1)+(log2 t2)(S2) +…. (log2 tn)(Sn)
N
Keterangan: N = Jumlah serum yang diamati
T = Tinggi titer antibodi pada pengenceran tertinggi (yang masih dapat menghambat aglutinasi sel darah merah)
S = Jumlah contoh serum yang bertiter t n = Sampel ke-n.
GMT = Geometric Mean Titre (Rataan titer antibodi)
Analisis Data
6
HASIL DAN PEMBAHASAN
Antibodi Asal Induk
Titer antibodi asal induk yang diuji dengan metode Hambatan Aglutinasi (HI) dengan menggunakan antigen AI H5N1 clade 2.3.2 dan AI H5N1 clade 2.1.3 diperoleh rataan titer antibodi masing-masing yaitu 5.67 log2 dan 3.65 log2 (Tabel 2 dan Tabel 3). Rataan titer antibodi asal induk yang diuji dengan antigen AI H5N1 clade 2.3.2 cukup protektif terhadap virus AI. Menurut OIE (2014) titer AI protektif terhadap virus AI jika titer HI mencapai 4 log2. Antibodi yang terukur pada hari pertama berasal dari induk ayam (antibodi asal induk). Induk ayam dapat menurunkan antibodi ke anaknya melalui kuning telur. Antibodi asal induk yang terdapat pada kuning telur kemudian diserap oleh embrio ayam melalui sistem sirkulasi darah (Hamal 2006).
Titer antibodi kelompok kontrol yang diuji dengan antigen AI H5N1 clade
2.3.2 dan clade 2.1.3 (Tabel 2 dan Tabel 3) merupakan antibodi asal induk. Antibodi asal induk yang terbentuk diduga berasal dari vaksinasi menggunakan antigen AI H5N1 clade 2.1.3 pada induk ayam. Hal ini dapat terlihat dari perbedaan titer antibodi yang terukur saat diuji dengan antigen AI H5N1 clade
2.1.3 dan clade 2.3.2. Titer antibodi kelompok kontrol yang diuji dengan antigen AI H5N1 clade 2.3.2 lebih rendah dibandingkan dengan antigen AI H5N1 clade
2.1.3. Titer antibodi yang diuji dengan antigen AI H5N1 clade 2.1.3 dapat bertahan di level protektif hingga hari ke-28, kemudian menurun hingga tidak terdeteksi pada hari ke-52. Hal ini sesuai dengan karakteristik antibodi asal induk yang hanya dapat bertahan selama 4 minggu (OIE 2010). Titer antibodi kelompok kontrol yang terukur dengan menggunakan antigen penguji AI H5N1 clade 2.3.2 diduga akibat adanya reaksi silang.
Antibodi Ayam Kelompok Monovalen dan Bivalen yang Diuji dengan Antigen AI H5N1 clade 2.3.2
Tabel 2 Rataan titer antibodi ayam yang diuji dengan antigen AI H5N1 clade 2.3.2
7
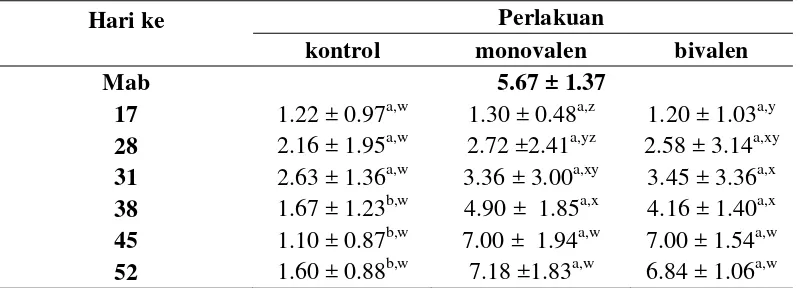
Titer antibodi kelompok monovalen dan bivalen mengalami penurunan pada hari ke-17, kemudian meningkat pada hari ke-28 dan 31, dengan nilai titer antibodi pada kelompok yang sama berbeda nyata (P<0.05). Penurunan titer antibodi pada perlakuan monovalen dan bivalen disebabkan adanya proses netralisasi oleh antibodi asal induk. Menurut Prabowo (2003) antibodi asal induk ayam yang tinggi pada anak ayam dapat menetralisasi antigen vaksin. Peningkatan titer antibodi kelompok monovalen dan bivalen disebabkan oleh sistem pertahanan imun mulai bekerja membentuk antibodi terhadap antigen AI H5N1
clade 2.3.2. Peningkatan titer antibodi pada hari ke-28 dan ke-31 belum cukup protektif. Hal ini diduga akibat efek adjuvant yang terdapat pada vaksin. Menurut Suartha et al. (2011) adjuvant yang terdapat pada vaksin berperan membentuk granuloma atau depot antigen sehingga antigen vaksin dikeluarkan secara perlahan untuk memicu respon imun yang lebih lama.
Titer antibodi pada kelompok monovalen dan bivalen mengalami peningkatan pada hari ke-38, 45 dan 52 dengan nilai titer antibodi masing-masing kelompok berbeda nyata (P<0.05). Kelompok monovalen mencapai level protektif pada hari ke-38 dengan titer antibodi 4.9 log2 dan mencapai nilai tertinggi pada hari ke-52 yaitu 7.18 log2. Kelompok bivalen mencapai level protektif pada hari ke-38 dengan titer antibodi 4.16 log2 dan mencapai nilai tertinggi pada hari ke-45 yaitu 7 log2. Peningkatan titer antibodi hasil vaksinasi ke-2 lebih cepat jika dibandingkan vaksinasi ke-1 pada kelompok monovalen dan juga bivalen. Menurut Wibawan dan Soejoedono (2003) vaksinasi ke-2 akan menginduksi kekebalan sekunder sehingga pembentukan antibodinya lebih cepat.
Vaksin monovalen dan bivalen yang digunakan pada penelitian ini, mampu menginduksi pembentukan antibodi sampai level protektif. Berdasarkan analisis data yang dilakukan, respon titer antibodi terhadap vaksin monovalen dan bivalen (Tabel 2) dengan menggunakan antigen penguji yang sama (homolog) tidak berbeda nyata (P>0.05). Respon pembentukan antibodi akibat vaksin monovalen dan bivalen tidak berbeda nyata disebabkan antigen penguji yang digunakan dan
Gambar 1 Rataan titer antibodi yang diuji dengan antigen AI H5N1 clade 2.3.2 Kelompok monovalen (■), bivalen (▲) dan kontrol(♦)
8
antigen yang terdapat pada kedua vaksin tersebut menggunakan jenis antigen yang sama. Vaksin AI H5N1 yang diuji dengan antigen yang sama (homolog) mampu menginduksi pembentukan antibodi hingga level protektif (Sudarisman 2006; Soejoedono et al. 2008; Suartha et al. 2012; Tang et al. 2014).
Antibodi Ayam Kelompok Monovalen dan Bivalen yang Diuji dengan Antigen AI H5N1 clade 2.1.3
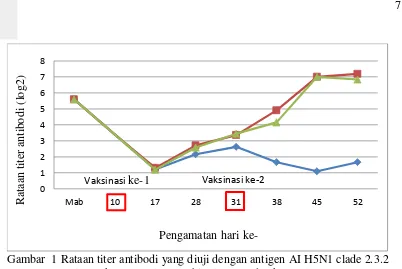
Titer antibodi kelompok bivalen dan monovalen cenderung menurun pada hari ke-17 hingga ke-52 dengan kisaran nilai titer antibodi masing-masing kelompok 4 – 5 log2 dan 2 – 4 log2. Titer antibodi yang terukur di kelompok bivalen diduga akibat respon imun yang diinduksi oleh antigen AI H5N1 clade
2.1.3 yang berasal vaksin. Titer antibodi yang terukur di kelompok monovalen diduga diakibatkan antibodi asal induk yang dibawa oleh DOC (Day Old Chickens). Faktor lain yang mungkin mempengaruhi yaitu reaksi silang antigen Tabel 3 Rataan titer antibodi ayam yang diuji dengan antigen AI H5N1 clade Mab: maternal antibodi, huruf superscript (a,b) yang berbeda pada baris yang sama menyatakan adanya perbedaan nyata pada taraf P< 0.05, huruf superscript (w,x,y,z) yang berbeda pada kolom yang sama menyatakan adanya perbedaan nyata pada taraf P< 0.05.
9 terhadap antibodi. Mekanisme reaksi silang terjadi karena epitop antigen dapat mengikat paratop antibodi (Culang 2013). Menurut Wibawan dan Soejoedono (2003) tubuh akan merespon antigen dengan membentuk antibodi sesuai dengan
epitop yang terdapat pada antigen tersebut.
Titer antibodi ayam kelompok bivalen yang diuji dengan antigen AI H5N1 clade 2.1.3 (Tabel 3) setelah vaksinasi ke-1 dan ke-2 memiliki pola yang sama. Titer antibodi yang terukur setelah vaksinasi 1 meningkat pada hari ke-17, kemudian menurun kembali pada hari ke-28 dan 31. Titer antibodi yang terukur setelah vaksinasi ke-2 meningkat pada hari ke-38, kemudian menurun kembali pada hari ke-45. Peningkatan titer antibodi pada kelompok bivalen diakibatkan oleh vaksin yang digunakan mengandung antigen AI H5N1 clade
2.1.3 sehingga ayam telah membentuk antibodi terhadap antigen AI H5N1 clade
2.1.3. Penurunan titer antibodi setelah vaksinasi disebabkan oleh adanya waktu paruh antibodi (Malole 1988).
Titer antibodi kelompok monovalen yang terukur lebih rendah dibandingkan dengan kelompok bivalen bila diuji dengan antigen AI H5N1 clade
2.1.3. Hal ini disebabkan evaluasi titer antibodi kelompok monovalen menggunakan jenis antigen penguji (AI H5N1 clade 2.1.3) yang berbeda dengan antigen (AI H5N1 clade 2.3.2) yang terdapat pada vaksin monovalen. Titer antibodi kelompok bivalen lebih tinggi, hal ini disebabkan antigen asal vaksin dan antigen penguji menggunakan jenis antigen yang sama. Titer antibodi yang diuji dengan antigen yang sama (homolog) nilainya lebih tinggi bila dibandingkan dengan diuji menggunakan antigen yang berbeda (heterolog) (Suartha et al. 2012).
Perbandingan Titer Antibodi Kelompok Monovalen yang Diuji dengan Antigen AI H5N1 clade 2.1.3 dan AI H5N1 clade 2.3.2
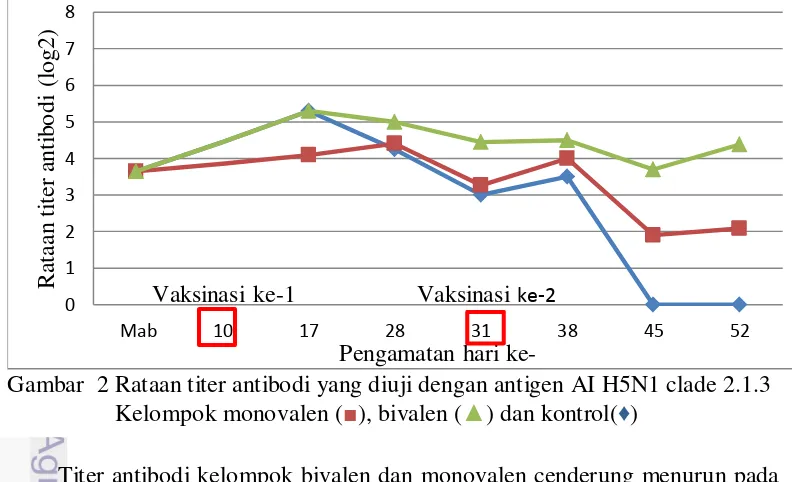
Gambar 3 Rataan titer antibodi kelompok monovalen
Antigen AI H5N1 clade 2.1.3 (■) dan antigen AI H5N1 clade 2.3.2 (♦)
10
Hasil evaluasi titer antibodi akibat vaksinasi yang menggunakan antigen AI H5N1 dipengaruhi oleh berbagai faktor diantaranya faktor individu (respon imun dan umur), penggunaan vaksin (frekuensi, dosis dan adjuvant) dan antigen (dosis dan genetik) (Kilany et al. 2011). Titer antibodi ayam kelompok monovalen yang diuji dengan antigen homolog (AI H5N1 clade 2.3.2) dan antigen heterolog (AI H5N1 clade 2.1.3) ditampilkan pada Gambar 3. Titer antibodi yang diuji dengan antigen yang sama (homolog) setelah vaksinasi ke-1 dan ke-2 meningkat setiap pengujiannya. Titer antibodi yang diuji dengan antigen yang berbeda (heterolog) setelah vaksinasi ke-1 dan ke-2 meningkat hingga hari ke-38, kemudian menurun. Titer antibodi yang diuji dengan antigen heterolog lebih rendah dibandingkan dengan antigen homolognya (Sudarisman 2006; Soejoedono et al. 2008; Suartha et al. 2012; Tang et al. 2014). Perbedaan pola titer antibodi yang terukur diakibatkan oleh antigen yang digunakan memiliki protein haemaglutinin (H) yang berbeda. Menurut Dharmayanti et al. (2013) virus AI H5N1 clade 2.3.2 yang beredar di Indonesia memiliki karakteristik molekuler haemaglutinin yang berbeda dengan virus AI H5N1 clade 2.1.3 yang selama ini beredar di Indonesia. Analisis keragaman sekuen antara isolat AI H5N1 clade
2.3.2 dan clade 2.1.3 memiliki tingkat keragaman yang rendah yaitu 90.9% – 90.4%. Kedua virus tersebut juga memiliki perbedaan pada daerah pemotongan H (cleavage site). Virus AI H5N1 clade 2.1.3 memiliki pola cleavage site
PQRESRRKKR sedangkan virus AI H5N1 clade 2.3.2 polanya PQRERRRKR (Choi et al. 2013; Andhesfa 2014). Tingkat patogenitas virus AI H5N1 dipangaruhi oleh pola cleavage site protein haemaglutinin (Zang et al. 2012). Pada awal infeksi, protein H akan berikatan dengan reseptor asam sialik sel inang kemudian membelah menjadi H1 dan H2. Protein H1 akan berikatan dengan reseptor dan merupakan target utama untuk timbulnya respon imun, sedangkan protein H2 akan memfasilitasi fusi antara amplop virus dengan dinding sel inang (Hamilton 2012).
Perbandingan Titer Antibodi Kelompok Bivalen yang Diuji dengan Antigen AI H5N1 clade 2.1.3 dan AI H5N1 clade 2.3.2
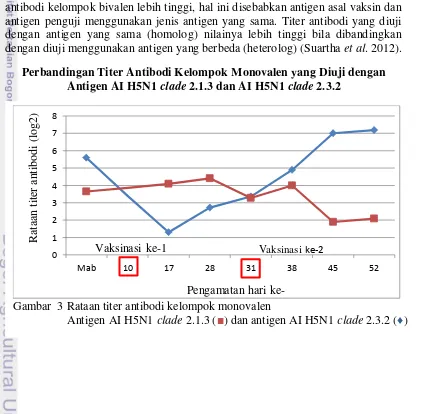
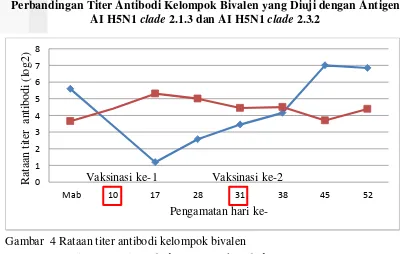
Gambar 4 Rataan titer antibodi kelompok bivalen
11 Hasil pengukuran titer antibodi kelompok bivalen yang diuji dengan antigen AI H5N1 clade 2.3.2 dan antigen AI H5N1 clade 2.1.3 ditampilkan pada Gambar 4. Titer antibodi kelompok bivalen yang diuji dengan kedua antigen tersebut mampu menginduksi antibodi hingga ke level protektif. Titer antibodi yang diuji dengan antigen AI H5N1 clade 2.3.2 cenderung mengalami peningkatan setelah vaksinasi ke-1 maupun ke-2. Titer antibodi yang diuji dengan antigen AI H5N1 clade 2.1.3 setelah vaksinasi ke-1 dan ke-2 meningkat, kemudian menurun. Menurut Kilany (2011) keberhasilan vaksinasi ditentukan oleh faktor individu, vaksin yang digunakan dan antigen penguji untuk evaluasi titer antibodi. Perbedaan pola titer antibodi yang terbentuk diduga akibat adanya pengaruh komposisi antigen yang terdapat pada vaksin dan antigen penguji yang digunakan. Antigen AI H5N1 clade 2.3.2 dan AI H5N1 clade 2.1.3 memiliki perbedaan pada protein haemaglutinin (H) (Dharmayanti et al. 2013).
Vaksin monovalen dan bivalen pada penelitian ini dapat menginduksi antibodi hingga mencapai level protektif jika diuji dengan tipe antigen yang sama (homolog). Kecocokan protein H pada antigen penguji dengan antigen yang terdapat pada vaksin memiliki korelasi yang erat dengan hasil uji efikasi (Cha 2013). Menurut Sudarisman (2006) vaksin AI H5N1 yang diuji dengan antigen yang sama (homolog) mampu menginduksi antibodi mencapai level protektif dan mampu menahan infeksi virus lapang. Penggunaan vaksin yang cocok dengan virus yang bersirkulasi dapat mencegah kegagalan vaksinasi (Tian et al. 2010). Antibodi yang terbentuk di kelompok monovalen dan bivalen akibat vaksinasi pada penelitian ini, diharapkan mampu melindung ayam dari serangan virus AI di lapang. Kriteria vaksin yang harus dipenuhi dalam percobaan laboratorium dan lapang diantaranya menghentikan virus shedding pada ayam yang telah divaksinasi, melindungi dan meningkatkan resistensi dari serangan virus lapang (Capua et al. 2004).
Antigen yang digunakan untuk uji HI pada evaluasi titer antibodi akibat paparan virus AI H5N1 lebih baik menggunakan jenis antigen yang sama (homolog). Titer antibodi ayam yang diuji dengan jenis yang berbeda akan menghasilkan nilai yang berbeda. Titer antibodi ayam yang diuji dengan antigen berbeda (heterolog) nilainya akan lebih rendah dibandingkan dengan antigen yang sama (homolog) (Suartha et al. 2012).
SIMPULAN
Pemberian vaksin monovalen (AI H5N1 clade 2.3.2) mampu menginduksi pembentukan antibodi sampai level protektif jika diuji dengan antigen homolog (AI H5N1 clade 2.3.2). Pemberian vaksin bivalen (AI H5N1 clade 2.3.2 dan clade
12
SARAN
Kemampuan vaksin melindungi ayam dari serangan virus AI H5N1 dilapang dan tingkat keamanan vaksin masih harus diuji dengan melakukan uji tantang dan shedding virus.
DAFTAR PUSTAKA
Andesfha E, Ramlah, Natih KKN, Djusa ER, Muncharini. 2014. Identifikasi molekuler dinamika genetik virus Avian Influenza subtipe H5N1 clade
2.1.3 dan 2.3.2 [Internet]. [diunduh pada 15 jun 2014]. Tersedia pada
http://artikeledp.file.wordpress.com/2014/05identifikas-molekul- dinamika-
genetik-virus-avian-influenza-subtipe-h5n1-clade-2-1-3-dan-2-3-2_ernes.pdf.
Basuno E. 2008. Review dampak wabah dan kebijakan pengendalian Avian Influenza di Indonesia. JAKP. 6(4):314-334.
[BPS] Badan Pusat Statistik (ID). 2012a. Jumlah perusahaan ayam petelur menurut kegiatan utama tahun 2000-2012 [Internet]. [diunduh pada 20 des 2013]. Tersedia pada http://www.bps.go.id/tab_sub/view.php kat=3&tabel=1&daftar=1&id_subyek=24¬ab=8.
[BPS] Badan Pusat Statistik (ID). 2012b. Produksi telur unggas dan susu sapi menurut provinsi [Internet]. [diunduh pada 20 des 2013]. Tersedia pada http://www.bps.go.id/tab_sub/view.php?kat=3&tabel=1&daftar=1&id_suby ek=24¬ab=14.
[BPPP] Badan Penelitian dan Pengembangan Pertanian (ID). 2013. Badan Penelitian dan Pengembangan Pertanian kembangkan vaccine seed virus H5N1 clade 2.3.2 [Internet]. [diunduh 5 jun 2014]. Tersedia pada http://www.litbang.deptan.go.id/berita/one/1670/.
Capua I, Terreging G, Cattoli G, Toffan A. 2004. Increased resistance of vaccinated turkey to experimental infection with H7N3 Low Pathogenicity Avian Influenza. Avian Pathol. 3(2):158-163.
Cha RM, Smith D, Sheperd E, Davis CT, Donis R, Nguyen T, Nguyen HD, Do HT, Inui K, Suarez LD et al. 2013. Suboptimal protection against H5N1 highly pathogenic avian viruses from Vietnam in ducks vaccinated with influenza poultry vaccines commercial. Vaccine.31:4953-4960.
Culang IS, Kunik V, Ofran Y. 2013. The Structural basic antigen antibody recognition. Front Immunol. 4(1): 1-13.
Choi CG. Kang HM, Jeon WJ, Choi KS, Kim KI, Soang BM, Lee HS, Kim JH, Lee YJ. 2013. Characterization of clade 2.3.2.1 H5N1 higly pathogenic avian influenza virus isolated from hild birds Mandarin duck and Eurasian Eagle Owl in 2010 in Korea. Viruses. 5:1153-1174.
Dharmayanti NLPI, Damayanti R, Wiyono A, Indriani R, Darminto. 2004. Identifikasi virus isolat Indonesia dengan metode reverse transcriptase polymerase chain reaction. JITV. 9(2):136-142.
13
Dharmayanti NLPI, Hartawan R, Hewajuli DA, Hardiman, Wibawa H, Pudjiatmomo. 2013. Karakteristik molekular dan patogenitas virus H5N1
clade 2.3.2 asal Indonesia. JITV. 18(2):99-113.
Hamal KR, Burgess SC, Pevzner IY, Erf GF. 2006. Maternal antibodi transfer from dam to their egg yolks, egg whites, and chicks in meat lines of chickens. Poult Sci. 85(1):1364-1372.
Hamilton BS,Whittaker GR, Daniel S. 2012. Influenza virus mediated membrane fusion determinants of haemaglutinin fusogenic activity and experimental approaches for asseshing virus fusion. Viruses. 4:1144-1168
Kilany WH, Abdelwahab EM, Arafa AS, Selim A, Safwat M, Nawar AA, Erfan AM, Hassan MK, Aly MM, Hafez HM. 2011. Protective efficacy of H5 inactivated vaccines in meat turkey poults after challenge with Egyptian variant highly pathogenic avian influenza H5N1 virus. Vet Microbiol.150:28-34.
Malole MBM. 1988. Virologi. Bogor (ID): Pusat Antar Universitas Pr.
[OIE] Office International des Epizootis World Organization (FR). 2010. Terrestrial animal health code [internet].[diunduh 20 Des 2013]; 2(4). Tersedia pada: http://www.oie.int/doc/ged/D10905.PDF.
[OIE] Office International des Epizootis World Organization (FR). 2014. Avian Influenza manual of diagnostic test and vaccine for terrestrial animal. [internet].[diunduh 20 Des 2013]; 2(2.3.4). Tersedia pada: http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.03.04_AI. pdf.
Prabowo D. 2003. Maternal antibodi anak ayam pelung yang divaksinasi dengan vaksin ND kombinasi. JIPI. 5(1):11-18.
Suartha IN, Wibawan IWT, Wirata IW, Putra IGNN, Dewi IGRK, Mahardika IGNK. 2011. Pemilihan adjuvant pada vaksin Avian Influenza. J Kedokter Hew. 5(2):49-52.
Suartha IN, Wirata IW, Putra IGNN, Dewi IGRK, Anthara IMS, Wibawan IWT, Mahardika IGNK. 2012.Vaksin polivalen untuk mencegah flu burung. J Vet.
13(2):113-117.
Sudarisman. 2006. Pengaruh penggunaan vaksin H5N1 dan H5N2 virus Avian Influenza pada peternakan unggas di daerah Jawa Barat. Cakrawala baru iptek menuju revitalisasi Peternaakan. Seminar Nasional Teknologi Peternakan dan Veteriner; 2006 Sept 5-6; Bogor, Indonesia. Bogor (ID). Puslitbangnak. hlm 766-773.
Soejoedono RD, Murtini S, Mahardika IGK, Wibawan IWT. 2008. Prospek pemanfaatan telur ayam berkhasiat anti virus Avian Influenza dalam usaha pengendalian Flu Burung dengan pendekatan pengebalan pasif. JIPI.
13(3):158-163.
Tian G, Zeng X, Li Y, Shi J, Chen H. 2010. Protective efficacy of the H5 inactivated vaccine againist different higly pathogenic H5N1 Avian Influenza virus isolate in China and Vietnam. Avian Dis. 54:287-289. Tang Y, Lu J, Wu P, Liu Z, Tian Z, Zha G, Chen H, Wang QU, Wang QI Hou F
14
[WHO] World Health Organization (CH). 2011. H5N1 evolution working group toward unfield nomenclature system for Higly Pathogenik Avian Influnza H5N1[internet].[diunduh 20 des 2013]. Tersedia pada http://www.who.int/influenza/gisrs_laboratory/h5n1_nomenclature/en/. Wibawan IWT, Soejodono RD. 2003. Diktat imunologi. Bogor (ID): IPB Pr. Wibawa H, Bingham J, Nuradji H, Lowther S, Payne J, Herper J, Wong F, Lunt,
Juhaidi A, Middleton D et al. 2012. The pathobiology of two Indonesian H5N1 Avian Influenza virus respresenting different clade 2.1 sublineages in chickens and ducks. Comp Immunol Microbiol Infect Dis. 36(2):175-191. Withworth D, Scoot N, Taejh M, Phil H. 2007. Wild bird and Avian Influenza.
Roma (IT): Food Agriculture Organization of United Nation.
15
RIWAYAT HIDUP
Penulis lahir pada tanggal 2 April 1991 di Kabupaten Lampung Utara, Lampung. Penulis merupakan putra ke lima dari lima bersaudara pasangan Bapak Sumpeno dan Ibu Painah. Pada tahun 2010 terdaftar sebagai mahasiswa di Fakultas Kedokteran Hewan, Institut Pertanian Bogor melalui jalur USMI. Pendidikan formal yang pernah ditempuh penulis sebelumnya yaitu SD Negeri 09 Bukit Kemuning pada tahun 1998, SMP Negeri 01 Bukit Kemuning tahun 2004, dan SMA Negeri 01 Bukit Kemuning pada tahun 2007. Penulis mendapatkan Beasiswa Bidik Misi dari tahun 2010 – 2014. Selama masa perkuliahan, penulis aktif dalam berbagai lembaga kemahasiswaan. beberapa kelembaga kemahasiswaan yang pernah diikuti penulis yaitu Ketua Komisi IV Dewan Perwakilan Mahasiswa Tingkat Persiapan Bersama IPB, Islamic Student Center,