SKRIPSI
ELNY FITRI
PEMERIKSAAN KUALITAS BEBERAPA
SEDIAAN TABLET NIFEDIPIN YANG
BEREDAR DI MALANG
PROGRAM STUDI FARMASI
FAKULTAS ILMU KESEHATAN
i
Lembar Pengesahan
PEMERIKSAAN KUALITAS BEBERAPA SEDIAAN
TABLET NIFEDIPIN YANG BEREDAR DI MALANG
SKRIPSI
Dibuat untuk memenuhi syarat mencapai gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Ilmu Kesehatan
Universitas Muhammadiyah Malang 2011
Oleh:
Elny Fitri NIM: 07040064
Disetujui Oleh:
Pembimbing I Pembimbing II
ii
Lembar Pengujian
PEMERIKSAAN KUALITAS BEBERAPA SEDIAAN
TABLET NIFEDIPIN YANG BEREDAR DI MALANG
SKRIPSI
Telah diuji dan dipertahankan di depan tim penguji pada tanggal 27 juli 2011
Oleh : ELNY FITRI NIM : 07040064
Tim Penguji
Penguji I Penguji II
Dra. Uswatun Chasanah, Apt., M.Kes. Dr. H. Achmad Radjaram, Apt. NIP UMM.11407040448
Penguji III Penguji IV
iii
KATA PENGANTAR
Assalamu’alaikum Wr.Wb.
Alhamdulillahirobil’aalamin segala puji dan syukur penulis panjatkan kehadirat Allah SWT, yang senatiasa melimpahkan rahmat taufik dan
hidayah-Nya, sehingga penulis akhirnya dapat menyelesaikan tugas akhir ini yang berjudul
“Pemeriksaan Kualitas Beberapa Sediaan Tablet Nifedipin yang Beredar di Malang”sebagai persyaratan untuk menyelesaikan studi Fakultas Ilmu Kesehatan Program Studi Farmasi Universitas Muhammadiyah Malang tepat pada waktunya.
Penulis menyadari bahwa penulisan tugas akhir ini terselesaikan karena
adanya bantuan baik moril maupun materiil dari berbagai pihak, oleh karena itu
pada kesempatan ini penulis dengan rasa tulus ikhlas ingin menyampaikan ucapan
terima kasih yang tak terhingga dan penghargaan setinggi-tingginya kepada:
1. Ibu Tri Lestari Handayani, M.Kep., Sp.Mat., Dekan Fakultas Ilmu
Kesehatan Universitas Muhammadiyah Malang yang telah memberikan
kesempatan untuk mengikuti program sarjana.
2. Ibu Hidajah Rachmawati, Ssi., Apt., Sp.FRS., Ketua Program Studi
Farmasi dan selaku Dosen Wali yang senantiasa dengan sabar memberikan
bimbingan, nasehat, semangat serta dukungan baik moril maupun materil
selama saya menimba ilmu di Program Studi Farmasi Universitas
Muhammadiyah Malang.
3. Ibu Dra. Uswatun Chasanah, Apt., M.Kes., selaku Pembimbing I dan
Bapak Dr. H. Achmad Radjaram, Apt., selaku Pembimbing II yang telah
membantu, membimbing dan mengarahkan penulis dengan penuh
kesabaran kebaikkan, kebijaksanaan serta ketulusan hati yang dengan rela
meluangkan waktu ditengah kesibukkan beliau sehingga penulis tidak
patah semangat saat kesulitan dalam menyelesaikan tugas akhir ini, sejak
persiapan sampai dengan selesainya tugas akhir ini.
4. Ibu Dra. Lilik Yusetyani, Apt., Sp.FRS., dan Ibu Ika Ratna Hidayati,
iv
keramahan dan ketulusan hati, yang selalu memberikan masukkan, arahan
yang membangun demi tercapainya kesempurnaan tugas akhir ini.
5. Bapak Drs. H. Achmad Inoni, Apt., yang senatiasa memberikan
bimbingan, nasehat dan motivasi selama menimba ilmu di Program Studi
Farmasi Universitas Muhammadiyah Malang.
6. Ibu Dra. Lilik Yusetyani, Apt., Sp.FRS., selaku Kepala Laboratorium
Teknologi Sediaan Farmasi yang telah memberikan kesempatan untuk
menggunakan fasilitas laboratorium dalam menyelesaikan tugas akhir.
7. Ibu Siti Rofida, S.Si., Apt., Ibu Sovia Aprina Basuki, S.Farm., Apt., Ibu
Dian Ermawati, S.Farm., Apt., Ibu Arina Swastika Maulita, S.Farm., Apt.,
dan Ibu Engrid Juni A., S.Farm., Apt., terimakasih yang sebesar-besarnya
atas bimbingan, nasehat dan motivasi selama perkuliahan sampai akhirnya
saya dapat menyelesaikan pendidikan sarjana di Program Studi Farmasi
Universitas Muhammadiyah Malang.
8. Seluruh staf pengajar Program Studi Farmasi Universitas Muhammadiyah
Malang yang dengan ketulusan hatinya telah mendidik dan berbagi ilmu
pengetahuan hingga akhirnya saya dapat menyelesaikan pendidikan
sarjana.
9. Mba Susi, Mba Sri dan Mas Ferdy selaku staf Laboratorium Kimia
Terpadu dan Laboratorium Teknologi Sediaan Farmasi yang selalu
memberikan motivasi dan banyak membantu saya.
10. Ayahanda dan Ibunda tersayang, Ayahanda Arnila, SE., MM dan Ibunda
Elta Ridha yang selalu memberikan semangat dan motivasi tiada henti
serta selalu mendoakan Ananda sehingga akhirnya Ananda dapat
menyelesaikan studi ini. Ananda berjanji akan selalu memberikan yang
terbaik untuk Ayahanda dan Ibunda tersayang.
11. Ade-adeku tersayang, Arta Rahman, Aulia Spanita, Ziqri Sulaiman yang
selalu memberikan semangat serta sedia menemaniku dan menghiburku
disaat menghadapi kesulitan. Semoga kita semua dapat membuat
v
berguna bagi agama, bangsa dan negara, serta dapat meraih sukses baik di
dunia maupun di akhirat kelak.
12. Neneku tersayang, yang selalu mendoakan Ananda dan memberikan
nasehat kepadaku.
13. Rekan-rekan yang membantu penulis dalam penelitian ini Ahmad, Andri,
Angy, Evi, Fahnyah, Ina, Ira, Iklima, Yoga, Mba Amel, Mertojoyo FC
(Abi, Aga, Bangkit, Cupal, Hendra dan Rizal) dan TK (Fidel, Rian, Dony)
serta seluruh rekan yang tidak dapat disebutkan satu per satu.
14. Teman-temanku Farmasi 2007, persahabatan yang telah kita bina selama 4
tahun ini, canda serta tawa yang tak kan pernah terlupakan. Kalian adalah
motivasi bagiku. Gapailah impian kalian.
Penulis menyadari dengan sepenuhnya bahwa tugas akhir ini masih jauh
dari kesempurnaan, mengingat berbagai keterbatasan, terutama pengetahuan,
pengalaman, waktu, serta tenaga yang dimiliki. Oleh karena itu, kritik dan saran
yang sifatnya membangun sangat penulis harapkan demi kemajuan dan
perbaikkan kearah yang lebih sempurna.
Akhir kata, semoga tugas akhir ini dapat memberikan manfaat yang cukup
berarti bagi penulis, pembaca serta dapat menyumbang dalam upaya
pengembangan ilmu pengetahuan dan teknologi khususnya dalam bidang farmasi
dan kesehatan pada umumnya. Dan kepada semua pihak yang disebutkan diatas
semoga Allah SWT membalas kebaikan Bapak, Ibu, dan Saudara sekalian. Amin.
Wassalamu’alaikum Wr.Wb.
Malang, 19 Juli 2011
Penulis
vi
RINGKASAN
“PEMERIKSAAN KUALITAS BEBERAPA SEDIAAN TABLET NIFEDIPIN YANG BEREDAR DI MALANG”
Nifedipin merupakan CCB (calcium channel blockers) turunan
phenyldihidropyridine yang digunakan untuk pengobatan hipertensi serta angina pektoris. Dalam sistem klasifikasi biofarmaseutik (BCS) nifedipin tergolong kelas dua yaitu obat dengan kelarutan rendah, namun permeabilitas terhadap membran baik dan merupakan salah satu obat esensial nasional di Indonesia yang memperlihatkan kualitas dan efektivitas yang rendah dilihat dari segi disolusinya. Berbagai penelitian telah dilakukan dengan tujuan untuk meningkatkan laju disolusi dari nifedipin. Berdasarkan data spesialite obat yang beredar di Indonesia (ISO 2009) terdapat 21 macam produk non generik yang mengandung nifedipin (ISFI, 2009). Sediaan tablet yang berkualitas dapat ditinjau dari berbagai aspek selain dari segi ketersediaan hayati (bioavailabilitas) obat, kualitas obat juga ditinjau dari aspek dimana tablet harus memenuhi kriteria yang dipersyaratkan Farmakope. Kualitas produk sediaan tablet nifedipin yang beredar di pasaran tentunya sangat bervariasi karena adanya faktor-faktor yang mempengaruhinya antara lain perbedaan bahan baku obat, prosedur manufaktur serta bahan-bahan tambahan dalam formulasi antar pabrik. Berdasarkan hal tersebut, maka peneliti tertarik untuk melakukan penelitian guna untuk mengetahui apakah beberapa sediaan tablet nifedipin yang beredar di Malang baik yang diproduksi oleh pabrik PMA, PMDN dan PMDN Generik telah memenuhi persyaratan.
vii
besar dari F tabel. Hal ini menunjukkan adanya perbedaan bermakna antar ketiga produk sehingga dilanjutkan dengan uji Tukey HSD (Honestly Significant Difference Test). Untuk keseragaman kandungan tablet nifedipin produk PMA dengan PMDN tidak terdapat perbedaan bermakna sedangkan PMA dengan PMDN Generik dan PMDN dengan PMDN Generik terdapat perbedaan bermakna. Untuk keseragaman bobot, waktu hancur dan disolusi tablet nifedipin produk PMA dengan PMDN, PMA dengan PMDN Generik dan PMDN dengan PMDN Generik memiliki perbedaan yang bermakna.
viii
ABSTRACT
QUALITY EXAMINATION OF SOME DOSAGE NIFEDIPINE TABLETS CIRCULATED IN MALANG
There has been quality examinations of some dosage nifedipine tablets produced by foreign, domestic and generic national factories circulated in Malang. This research is to determine whether some dosage nifedipine tablets produced by foreign, domestic and generic national factories circulated in Malang meet the requirements.
Samples of 100 tablets were taken from three different factories with same batch number and issuing date from every factory. The quality examination parameters were uniformity of weight, uniformity of content, disintegration and dissolution test.
The result this research shows that all products meet the requirements for uniformity of weight, uniformity of content, disintegration and dissolution test stated by Pharmacopoeia Indonesia edition IV and United Stated Pharmacopeia XXXII.
ix
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
RINGKASAN ... iv
ABSTRAK ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan Penelitian ... 2
1.4 Hipotesis ... 2
1.5 Manfaat Penelitian ... 2
BAB 2 TINJAUAN PUSTAKA ... 3
2.1 Nifedipin ... 3
2.2 Tablet ... 5
2.3 Pemeriksaan Kualitas Tablet Nifedipin... 5
2.3.1 Pemeriksaan Keseragaman Bobot ... 5
2.3.2 Pemeriksaan Keseragaman Kandungan ... 6
2.3.3 Pemeriksaan Waktu Hancur ... 6
2.3.4 Uji Disolusi ... 6
2.4 Obat Generik dan Non Generik (Merek Dagang) ... 8
BAB 3 KERANGKA KONSEPTUAL ... 10
3.1 Uraian Kerangka Konseptual ... 10
3.2 Alur Kerangka Konseptual ... 11
BAB 4 METODOLOGI PENELITIAN ... 12
4.1 Bahan Penelitian ... 12
4.2 Alat Penelitian ... 12
4.3 Rancangan Penelitian ... 12
x
4.3.2 Populasi dan Sampel ... 12
4.3.3 Waktu dan Tempat Pelaksanaan ... 13
4.4 Metode Penelitian ... 13
4.4.1 Kerangka Kerja ... 13
4.4.2 Pemeriksaan Kualitas Tablet Nifedipin ... 14
4.4.3 Analisis Statistik... 16
BAB 5 HASIL PENELITIAN ... 18
5.1 Pengambilan Sampel ... 18
5.2 Pemeriksaan Kualitas Tablet Nifedipin ... 18
5.2.1 Pemeriksaan Keseragaman Bobot ... 18
5.2.2 Pemeriksaan Keseragaman Kandungan ... 21
5.2.3 Pemeriksaan Waktu Hancur ... 22
5.2.4 Uji Disolusi ... 23
BAB 6 PEMBAHASAN ... 26
BAB 7 KESIMPULAN DAN SARAN ... 31
DAFTAR PUSTAKA ... 32
xi
DAFTAR TABEL
Tabel Halaman
V.1 Data Pemeriksaan Keseragaman Bobot Tablet Nifedipin ... 19
V.2 Absorban Larutan Nifedipin dalam Cairan Lambung Buatan tanpa Pepsin ... 21
V.3 Data Pemeriksaan Keseragaman Kandungan Tablet Nifedipin ... 22
V.4 Data Pemeriksaan Waktu Hancur Tablet Nifedipin ... 23
xii
DAFTAR GAMBAR
Gambar Halaman
2.1 Rumus Struktur Nifedipin ... 4
2.2 Hubungan Antara Disolusi dan Proses Absorpsi ... 7
3.3 Skema Kerangka Konseptual ... 11
4.4 Skema Kerangka Kerja ... 13
5.1 Spektra Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin ... 20
5.2 Kurva Baku Larutan Nifedipin dalam Media Cairan Lambung Buatan Tanpa Pepsin ... 21
xiii
DAFTAR LAMPIRAN
Lampiran Halaman
1. Daftar Riwayat Hidup ...35
2. Surat Pernyataan ... 36
3. Sertifikat Baku Pembanding Farmakope Indonesia ... 37
4. Profil Sampel Tablet Nifedipin 10 mg yang Diperiksa ... 38
5. Perhitungan Penyimpangan Bobot Tablet Nifedipin PMDN ... 39
6. Perhitungan Penyimpangan Bobot Tablet Nifedipin PMA ... 40
7. Perhitungan Penyimpangan Bobot Tablet Nifedipin PMDN Generik 41 8. Data Penentuan Kurva Baku Nifedipin BPFI ... 42
9. Data Absorbansi Pemeriksaan Kandungan Tablet Nifedipin ... 43
10. Perhitungan Penetapan Kandungan Tablet Nifedipin PMDN ... 44
11. Perhitungan Penetapan Kandungan Tablet Nifedipin PMA ... 46
12. Perhitungan Penetapan Kandungan Tablet Nifedipin PMDN Generik ... 48
13. Perhitungan Persen Nifedipin Terlarut PMDN ... 50
14. Data Absorbansi Uji Disolusi Tablet Nifedipin PMDN ... 51
15. Perhitungan Persen Nifedipin Terlarut PMA ... 52
16. Data Absorbansi Uji Disolusi Tablet Nifedipin PMA ... 53
17. Perhitungan Persen Nifedipin Terlarut PMDN Generik ... 54
18. Data Absorbansi Uji Disolusi Tablet Nifedipin PMDN Generik ... 55
19. Hasil Analisis Statistik dengan Program SPSS 17 ... 56
xiv
D
AFTAR PUSTAKAAlderborn, G., 2002, Tablets and Compaction, in: Aulton, M. E., (ed.),
Pharmaceutics, The Science of Dosage Form Design, Second Edition, New York: Churchill Livingstone, p. 404-412.
Ansel, H.C.,1989. Introduction to Pharmaceutical dosage Form, Terjemahan : Farida Ibrahim, Pengantar Bentuk Sediaan Farmasi, Edisi Keempat, Universitas Indonesia Press: Jakarta, hal. 125, 201, 244-259.
Banker, G.S., Anderson.N.R., 1986, Tablet, in : Lachman,L.,H.A.Lieberman, J. L. Kanig.(ed.), Teori dan Praktek Farmasi Industri, Edisi Ketiga, Vol. 2 Jakarta: Universitas Indonesia Press, hal.651-663.
BPOM, 2004. Pedoman Uji Bioekivalensi, Jakarta: Departemen Kesehatan Republik Indonesia, hal. 5, 18.
BPOM, 2009. Petunjuk Operasional Penerapan Cara Pembuatan Obat yang
Baik, Jakarta: Departemen Kesehatan Republik Indonesia, hal. 589. Bühler, V., 1998. Generic Drug Formulations, 2nd Ed, Germany: Laboratories
of BASF AG.
Depkes, RI. 1995. Farmakope Indonesia IV. Jakarta: Departemen Kesehatan Republik Indonesia, hal. 4-5,515, 611, 999, 1083, 1086.
Depkes, RI. 2008. Daftar Obat Esensial Nasional. Jakarta: Departemen Kesehatan Republik Indonesia.
Florey, K., 1989, Analytical Profiles of Drug Substances, Vol.18, California: Academic Press. Inc., p. 221-280.
Gunawan, G.S. (ed.), 2007. Farmakologi dan Terapi Edisi Kelima, Jakarta: Gaya Baru, hal. 342,359.
Hermann, M.A., Devissaguet, Aiache, M.J. 1993. Biofarmasi, Edisi 2, Surabaya: Airlangga University Press, hal. 13, 294, 377.
ISFI, 2009. Informasi Spesialite Obat Indonesia, Vol. 44, Jakarta: Ikatan Sarjana Farmasi Indonesia, hal. 248-251.
xv
Sciences 16th Edition, Volume 2. Easton: Mack Publishing Company. p.
1559.
Kurniawan, Sulaiman. 2009. Teknologi Sediaan Farmasi Edisi I.Yogyakarta : Graha Ilmu, hal. 3.
Lund, W. 1994. The Pharmaceutical Codex, 12nd edition, London: Pharmaceutical Press. p. 975.
Mutschler, E. 1999. Dinamika Obat, Edisi kelima. Bandung: Institut Teknologi Bandung, hal. 477.
Puspitasari, I., 2006. Cerdas Mengenali Penyakit dan Obat. Yogyakarta: B-first, hal. 4.
Sugiyono, 2009. Metode Penelitian Kuantitatif, Kualitatif dan R & D. Bandung: Alfabeta. hal. 81-82, 215-217.
Sulistyowati, D., 2008. Pengaruh Penambahan PEG 6000 Terhadap Sifat Fisik dan Disolusi Tablet Nifedipin. Surakarta: Universitas Muhammadiyah Surakarta.
Sweetman, C.S. (ed.), 2009. Martindale The Complete Drug Reference, 36th Edition, London: The Pharmaceutical Press, p. 1154, 1350.
Shargel, L., Andrew, B. C., 2005. Biofarmasetika dan Farmakokinetika Terapan. Edisi Kedua. Surabaya: Airlangga University Press, hal: 95. Sheth, B. B., Bandelin, F. J., and Shangraw, R. F. 1980. Compressed Tablet, in:
Lieberman H. A., Lachman L., Pharmaceutical Dosage Forms Tablets,
Vol. 1. New York: Marcel Dekker Inc. p. 114.
Siregar Charles, J.P., Wikarsa, S., 2010. Teknologi Farmasi Sediaan Tablet.
Jakarta: EGC, hal. 55, 159,160, 377, 403, 407, 420, 421.
Siswandono, Bambang, S., 1995. Kimia Medisinal. Surabaya: Airlangga University Press, hal. 338-339.
Swarbrick, J., (ed.), 2010. Absorption of Drugs, In: Encyclopedia of Pharmaceutical Technology, Third Edition, Vol.1, North Carolina: PharmaceuTech, Inc., p. 29.
xvi
Tjay, T.H., Rahardja, K., 2008. Obat-Obat Penting, Edisi Keenam Cetakan Kedua, Jakarta: PT. Alex Media Komputindo, hal. 13-15, 527.
Vippagunta, S., Maul, K., Tallavajhala, S., Grant, D., 2002. Solid State Characterization of Nifedipine Solid Dispersions, International Journal of Pharmaceutics, Volume 236. p. 111-123.
SKRIPSI
ELNY FITRI
PEMERIKSAAN KUALITAS BEBERAPA
SEDIAAN TABLET NIFEDIPIN YANG
BEREDAR DI MALANG
PROGRAM STUDI FARMASI
FAKULTAS ILMU KESEHATAN
2
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Obat merupakan komponen yang sangat penting dalam pelayanan
kesehatan. Intervensi obat diperlukan dalam sebagian besar upaya kesehatan baik
upaya preventif, kuratif dan rehabilitatif. Obat merupakan komponen biaya
terbesar dalam pelayanan kesehatan yakni dapat mencapai hingga 70% dari total
biaya pelayanan kesehatan. Penanganan dan pencegahan berbagai penyakit
khususnya penyakit kardiovaskular tidak dapat dilepaskan dari tindakan terapi
dengan obat atau farmakoterapi (DepKes RI, 2000). Obat-obat jantung khususnya
nifedipin yang beredar di pasaran ada dalam berbagai bentuk sediaan, diantaranya
dalam bentuk tablet. Tablet yang beredar di pasaran diharapkan terjamin
kualitasnya. Hal ini dikarenakan kualitas dapat dijadikan dasar acuan untuk
menetapkan kebenaran khasiat (efficacy) dan keamanan (safety) dari suatu produk obat.
Nifedipin merupakan CCB (calcium channel blockers) turunan
phenyldihidropyridine yang digunakan untuk pengobatan hipertensi serta untuk pencegahan dan pengobatan angina pektoris (Siswandono & Bambang, 1995).
Nifedipin termasuk bahan obat yang dalam sistem klasifikasi biofarmaseutik
(BCS) tergolong kelas dua yaitu obat dengan kelarutan rendah, namun
permeabilitas terhadap membran baik dan merupakan salah satu obat esensial
nasional di Indonesia yang memperlihatkan kualitas dan efektivitas yang rendah
dilihat dari segi disolusinya (BPOM, 2004). Obat yang memiliki profil disolusi
yang baik akan memberikan bioavailabilitas yang baik karena ketersediaan
farmaseutik dari obat tersebut tinggi, namun bioavailabilitas akan menurun untuk
obat-obatan yang mempunyai profil disolusi yang buruk.
Berdasarkan data spesialite obat yang beredar di Indonesia (ISO 2009)
terdapat 21 macam nama dagang (non generik) produk obat yang mengandung
nifedipin (ISFI, 2009). Produk sediaan tablet nifedipin yang beredar di pasaran
mempunyai kualitas yang sangat bervariasi karena adanya faktor-faktor yang
3
atau ukuran partikel), bahan-bahan tambahan yang digunakan dalam proses
formulasi serta prosedur manufaktur dari sediaan obat tersebut. Sediaan tablet
yang berkualitas dapat ditinjau dari berbagai aspek antara lain dari segi
ketersediaan hayati (bioavailabilitas) obat, selain itu kualitas juga ditinjau dari
aspek teknologi yang meliputi stabilitas fisik dan kimia dimana tablet harus
memenuhi kriteria yang dipersyaratkan Farmakope.
Banyak literatur mengatakan bahwa sifat fisika kimia dari zat aktif,
perbedaan dalam prosedur manufaktur serta bahan-bahan tambahan dalam
formulasi berpengaruh terhadap kualitas sediaan tablet khususnya menyangkut
laju disolusi dari zat aktif yang tentunya mempengaruhi bioavailabilitas.
Berdasarkan hal tersebut, maka peneliti tertarik untuk melakukan penelitian guna
untuk mengetahui apakah beberapa sediaan tablet nifedipin yang beredar di
Malang baik yang diproduksi oleh pabrik PMA, PMDN dan PMDN Generik telah
memenuhi persyaratan.
1.2 Rumusan Masalah
Apakah beberapa sediaan tablet nifedipin yang beredar di Malang baik
yang diproduksi oleh pabrik PMA, PMDN dan PMDN Generik telah memenuhi
persyaratan yang tertera pada Farmakope Indonesia edisi IV dan United Stated
Pharmacopeia XXXII?
1.3 Tujuan Penelitian
Untuk mengetahui kualitas beberapa sediaan tablet nifedipin yang
diproduksi pabrik PMA, PMDN dan PMDN Generik yang beredar di Malang.
1.4 Hipotesis
Terdapat perbedaan kualitas sediaan tablet nifedipin yang diproduksi
pabrik PMA, PMDN dan PMDN Generik yang beredar di Malang.
1.5 Manfaat Penelitian
Dengan didapatkannya data kualitas beberapa sediaan tablet nifedipin
yang diproduksi pabrik PMA, PMDN dan PMDN Generik yang beredar di
Malang, maka diharapkan dapat melindungi masyarakat dari kemungkinan
4
BAB 2
TINJAUAN PUSTAKA
2.1 Nifedipin
Nifedipin merupakan salah satu obat yang digunakan untuk pengobatan
hipertensi serta untuk pencegahan dan pengobatan angina pektoris dengan
mekanisme kerja menghambat influks Ca2+ (calcium channel blockers) melalui saluran kalsium, terutama melalui voltage dependent channel pada membran sel jantung dan sel otot polos. Ca2+ ekstraseluler diperlukan otot jantung, begitu pula
nodus SA dan AV juga terutama tergantung pada Ca2+ untuk automatisitas dan
konduksinya. Dengan demikian terhadap otot polos pembuluh darah, nifedipin
akan menimbulkan vasodilatasi sehingga terjadi penurunan resistensi perifer dan
tekanan darah. Nifedipin sering digunakan dibandingkan penghambat saluran
kalsium lainnya, karena nifedipin merupakan golongan dihidropiridin bersifat
vaskuloselektif dengan selektivitas yang tinggi (Gunawan, 2007). Nifedipin
diindikasikan untuk vasodilatasi terutama digunakan pada hipertensi esensial
(ringan atau sedang), juga pada angina variant berdasarkan efeknya terhadap
jantung yang relatif ringan, tidak berkhasiat inotrop negatif. Pada angina stabil
hanya digunakan bila β - blockers dikontraindikasikan atau kurang efektif (Tjay &
Rahardja, 2008).
Pada pemberian oral kadar darah tertinggi obat dicapai dalam 20-45 menit,
waktu paronya ± 2-5 jam, dengan masa kerja ± 8-12 jam (Siswandono &
Bambang, 1995). Resorpsinya dari usus baik (90%), tetapi bioavailabilitas
rata-rata hanya 60% karena mengalami FPE (first pass effect), dimana dalam hati akan dirombak menjadi metabolit inaktif yang dieksresikan lewat kemih (90%) dan
tinja (10%) (Tjay & Rahardja, 2008). Dosis nifedipin biasanya 30-60 mg/hari
(Mutschler, 1999).
Efek samping yang paling umum dari nifedipin terkait dengan khasiatnya
sebagai vasodilator yakni pusing, sakit kepala, hipotensi, edema perifer,
takikardia, dan jantung berdebar (Sweetman, 2009). Pada pasien dengan penyakit
5
(Gunawan, 2007). Nifedipin tersedia dalam bentuk sediaan tablet 5 mg dan 10 mg
(BPOM, 2000).
Nifedipin merupakan derivat phenylpyridine yang relatif sensitif terhadap paparan cahaya, yang dapat teurai menjadi derivat nitrosophenylpyridine bila kontak dengan cahaya matahari serta juga dapat terurai menjadi derivat
nitrophenylpyridine apabila kontak dengan sinar ultraviolet (Sweetman, 2009). Nifedipin mempunyai spektrum serapan maksimum pada daerah ultraviolet dalam
larutan asam dan basa pada panjang gelombang 238 nm dan 340 nm sedangkan
dalam metanol pada panjang gelombang 235 nm dan 340 nm. Semua percobaan
dengan larutan nifedipin harus dilakukan di bawah cahaya merah, cahaya kuning
atau lampu natrium (Ali, 1989). Nifedipin mempunyai bobot molekul 346,30
dengan titik lebur 171° - 175°C dan larut pada suhu 20°C dalam aseton (250 g/l),
metilen klorida (160 g/l), kloroform (140 g/l), etil asetat (50 g/l), metanol (26 g/l),
etanol (17 g/l) namun praktis tidak larut dalam air (Ali, 1989). Menurut sistem
klasifikasi biofarmaseutik (BCS), nifedipin tergolong kelas dua yaitu obat dengan
kelarutan rendah, namun permeabilitas terhadap membran baik (BPOM, 2004).
Berbagai penelitian telah dilakukan dengan tujuan untuk meningkatkan laju
disolusi dari nifedipin diantaranya dengan memberi pra-perlakuan pada bahan
baku zat aktif dengan membuat dispersi padat (Vippagunta, 2002) dan dengan
penambahan PEG 6000 saat proses granulasi (Sulistyowati, 2008). Nifedipin
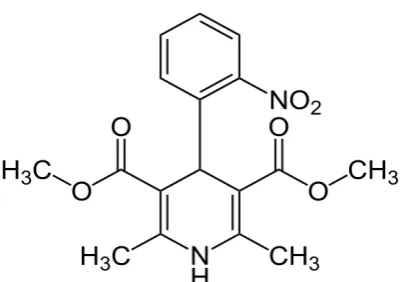
mempunyai rumus molekul C17H18N2O6, sedangkan rumus struktur ditunjukkan
[image:22.595.208.410.558.699.2]pada pada gambar 2.1.
6
2.2 Tablet
Menurut Farmakope Indonesia edisi IV, tablet adalah sediaan padat
mengandung bahan obat dengan atau tanpa bahan pengisi (DepKes RI, 1995).
Dari sudut pandang farmaseutika bentuk sediaan padat pada umumnya lebih stabil
daripada bentuk cair, sehingga bentuk sediaan padat lebih cocok untuk obat-obat
yang kurang stabil (Ansel, 1989).
Apabila pemakaian obat harus secara oral, baik ditelan, ditempatkan dalam
rongga mulut tanpa ditelan, dikunyah dulu baru ditelan, atau hanya dihisap maka
bentuk sediaan tablet yang paling sering digunakan. Selain tablet yang diberikan
melalui oral, terdapat juga tablet yang diberikan melalui rektal, vaginal,
implantasi-transdermal dan sebagainya. Dewasa ini diperkirakan paling tidak 40%
dari seluruh obat diracik dalam bentuk tablet.
Tablet terdapat dalam berbagai ragam bentuk, ukuran, bobot, kekerasan,
ketebalan, sifat disolusi dan disintegrasi, tergantung pada cara pemakaian tablet
dan metode pembuatannya. Tablet umumnya memiliki diameter 5-17 mm,
sedangkan bobot tablet 0,1-1 gram (Voight, 1995).
Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan
tablet kempa. Sebagian besar tablet dibuat dengan cara pengempaan. Tablet
kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul
menggunakan cetakan baja. Tablet cetak dibuat dengan cara menekan massa
serbuk lembab dengan tekanan rendah ke dalam lubang cetakan dimana kepadatan
tablet tergantung pada ikatan kristal yang terbentuk selama proses pengeringan
selanjutnya dan tidak tergantung pada kekuatan tekanan yang diberikan (DepKes
RI, 1995).
2.3 Pemeriksaan Kualitas Tablet Nifedipin 2.3.1 Pemeriksaan Keseragaman Bobot
Pada tablet yang didesain mengandung sejumlah obat didalam sejumlah
formula, berat tablet yang dibuat harus secara rutin diukur untuk membantu
memastikan bahwa setiap tablet mengandung sejumlah zat aktif yang tepat
(Banker & Anderson, 1986). Keseragaman bobot bukan merupakan indikasi yang
cukup dari keseragaman kandungan jika zat aktif merupakan bagian kecil dari
7
2.3.2 Pemeriksaan Keseragaman Kandungan
Untuk mengevaluasi kemanjuran suatu tablet, jumlah zat aktif dalam tablet
harus dipantau pada setiap tablet atau batch. Hal ini umumnya dilakukan dengan cara analisis kimiawi (Voight, 1995). Farmakope mensyaratkan bahwa tablet
bersalut dan tablet yang mengandung zat aktif 50 mg atau kurang, dan bobot zat
aktif lebih kecil dari 50% bobot sediaan, harus memenuhi syarat uji keseragaman
kandungan (DepKes RI, 1995). Menurut USP XXXII, kapsul nifedipin
mengandung tidak kurang dari 90 % dan tidak lebih dari 110 % nifedipin
(C17H18N2O6) dari jumlah yang tertera pada etiket (USP, 2009).
2.3.3 Pemeriksaan Waktu Hancur
Bagi tablet, langkah penting pertama sebelum melarut adalah pecahnya
tablet menjadi partikel-partikel kecil atau granul-granul (Banker & Anderson,
1986). Waktu hancur adalah waktu yang diperlukan tablet untuk hancur menjadi
partikel dibawah kondisi yang ditetapkan (King, 1980). Pada umumnya waktu
hancur akan mempengaruhi laju pelarutan zat aktif (Hermann dkk, 1993). Sebagai
medium biasanya digunakan air atau cairan pencernaan buatan bersuhu 37°C,
dimana pengujian dilakukan pada kondisi yang sedapat mungkin mendekati
situasi fisiologis (Voight, 1995). Waktu hancur tablet dapat dianggap sebagai
kriteria untuk memprediksi penyerapan obat secara in vitro (Swarbrick, 2010). Menurut USP, tablet tidak bersalut mempunyai standar waktu hancur paling
rendah 5 menit, akan tetapi kebanyakkan tablet tidak bersalut memiliki waktu
hancur 30 menit (Banker & Anderson, 1986).
2.3.4 Uji Disolusi
Bahan obat dalam bentuk sediaan farmaseutik solid yang diberikan peroral
yaitu tablet setelah dikonsumsi seseorang akan terlepas dari sediaannya dan
mengalami disolusi dalam media biologis diikuti dengan absorpsi zat aktif ke
dalam sirkulasi sistemik dalam tubuh melalui suatu rangkaian proses yang dapat
8
Gambar 2.2 Hubungan Antara Disolusi dan Proses Absorpsi (Hermann dkk, 1993)
Berdasarkan skema diatas, kemampuan obat berada dalam tubuh atau
ketersediaan hayati dari produk sediaan farmaseutik solid yang diberikan peroral
sangat besar tergantung pada adanya obat dalam keadaan melarut, maka
karakteristik disolusi merupakan sifat yang penting dari produk obat (Ansel,
1989). Disolusi merupakan proses dimana suatu bahan kimia atau obat menjadi
terlarut dalam suatu pelarut (Shargel, 2005). Jika bentuk sediaan farmaseutik yang
diberikan peroral masuk dan berada di saluran cerna dalam bentuk sediaan solid,
ada dua kemungkinan yang dapat terjadi untuk tahap pembatasan kecepatan zat
aktif dalam sirkulasi. Pertama, bentuk sediaan solid harus terdisintegrasi dan zat
aktif larut dalam media cair dan kemudian melewati membran saluran cerna. Zat
aktif yang mudah larut akan cenderung cepat melarut, membuat tahap pembatasan
kecepatan, yakni difusi pasif dan transpor aktif zat aktif, untuk absorpsi melalui
membran saluran cerna. Sebaliknya, kecepatan absorpsi zat aktif yang sukar larut
akan dibatasi oleh laju disolusi zat aktif yang tidak larut atau juga dapat dibatasi
oleh kecepatan disintegrasi bentuk sediaan (Siregar & Wikarsa, 2010).
Maka seringkali laju disolusi bahan obat sangat kecil bila dibandingkan
dengan laju absorpsinya sehingga laju disolusi merupakan tahap penentu
kecepatan (rate limiting step) dalam proses absorpsi (Shargel, 2005). Kecepatan disolusi suatu senyawa tergantung pada beberapa parameter, diantaranya
(Hermann dkk, 1993):
Karakteristik fisika-kimia bahan obat
Tablet Agregat Partikel
Zat aktif terlarut
Zat aktif terserap
Penghancuran I Penghancuran II
Pelarutan Pelarutan
9
Luas permukaan yang berubah antara senyawa dan cairan pelarut
Sifat cairan pelarutan (pH, kekentalan, tegangan permukaan)
Parameter yang berkaitan dengan alat (suhu dan volume cairan uji serta
pengadukan)
Untuk obat yang kelarutan dalam air terbatas, disolusi akan lebih berarti
daripada waktu hancur. Dalam banyak hal, kecepatan disolusi dapat dikorelasikan
dengan ketersediaan hayati zat aktif (DepKes RI, 1995). Bioavailabilitas
(ketersediaan hayati) dapat ditentukan secara in vitro dalam laboratorium dengan mengukur laju disolusi zat aktif dalam waktu tertentu (dissolution rate). Untuk laju disolusi nifedipin kapsul setelah waktu 20 menit harus larut tidak kurang 80%
(Q) C17H18N2O6 dari jumlah yang tertera pada etiket, dengan media disolusi
berupa cairan lambung buatan tanpa pepsin (USP, 2009).
2.4 Obat Generik dan Non Generik (Merek Dagang)
Kebijakan Obat Nasional mengamanatkan bahwa upaya peningkatan mutu
pelayanan kesehatan, jaminan ketersediaan obat yang aman, bermanfaat serta
bermutu dalam jumlah dan jenis yang cukup, keterjangkauan serta akses obat bagi
seluruh masyarakat merupakan tanggung jawab pemerintah. Pemerintah Indonesia
telah memberikan perhatian serius dalam pencegahan dan penanggulangan
penyakit tidak menular termasuk hipertensi. Hal ini dapat dilihat dengan
dibentuknya Direktorat Pengendalian Penyakit Tidak Menular berdasarkan
Peraturan Menteri Kesehatan No. 1575 Tahun 2005 dalam melaksanakan
pencegahan dan penanggulangan penyakit jantung dan pembuluh darah termasuk
hipertensi, diabetes mellitus dan penyakit metabolik, kanker, penyakit kronik dan
penyakit generatif lainnya serta gangguan akibat kecelakaan dan cedera. Dalam
pencegahan dan penanggulangan hipertensi berbagai upaya juga telah dilakukan,
diantaranya pemerintah mengambil kebijakan untuk memproduksi obat generik
diantaranya seperti nifedipin, captopril dan hidroklortiazid.
Obat generik adalah salah satu kebijakkan pemerintah dalam rangka
meningkatkan keterjangkauan pelayanan kesehatan bagi masyarakat luas
khususnya dalam hal daya beli obat, dimana obat dipasarkan dengan nama bahan
aktifnya terutama untuk obat-obatan yang banyak dibutuhkan masyarakat. Obat
10
RI, 2008). Memang bukan pemerintah langsung yang memproduksinya, tetapi
melalui perusahaan-perusahaan milik negara atau milik swasta yang bersedia
memproduksinya. Biaya produksi ditekan seminimal mungkin, namun tetap harus
memenuhi persyaratan CPOB (Cara Pembuatan Obat yang Baik).
Pemasaran obat generik tidak memerlukan biaya promosi (iklan atau
seminar), kalaupun ada iklan untuk obat generik, sifatnya massal dan dilakukan
oleh pemerintah yang dikenal dengan iklan layanan masyarakat, maka harga obat
dapat ditekan sehingga produsen (pabrik obat) tetap punya keuntungan, begitu
pula konsumen mampu membeli dengan harga terjangkau.
Obat paten atau spesialite (non generik) adalah obat milik suatu perusahaan dengan nama khas yang dilindungi hukum, yaitu merek terdaftar atau
proprietary name (Tjay & Rahardja, 2008). Biaya yang dikeluarkan produsen untuk menghasilkan obat paten, lebih dari 50% merupakan biaya non produksi
salah satunya biaya pemasaran untuk mempromosikan masing-masing produknya,
maka harga obat dengan nama dagang umumnya relatif lebih mahal dibandingkan
11
BAB 3
KERANGKA KONSEPTUAL
3.1 Uraian Kerangka Konseptual
Sampai saat ini, banyak sekali penelitian bioavailabilitas diantaranya
bioavailabilitas secara in vitro diterapkan khususnya untuk sediaan padat berupa tablet yang mengandung bahan obat yang mempunyai kelarutan rendah yang
diberikan secara oral namun dimaksudkan untuk memberikan efek sistemik. Obat
yang memiliki profil disolusi yang baik akan memberikan bioavailabilitas yang
baik karena ketersediaan farmaseutik dari obat tersebut tinggi, namun
bioavailabilitas akan menurun untuk obat-obatan yang mempunyai profil disolusi
yang buruk. Sediaan tablet yang berkualitas dapat ditinjau dari berbagai aspek
antara lain dari dari segi ketersediaan hayati (bioavailabilitas) obat, selain itu
kualitas obat juga ditinjau dari aspek teknologi yang meliputi stabilitas fisik dan
kimia dimana tablet harus memenuhi kriteria yang dipersyaratkan Farmakope.
Nifedipin merupakan CCB (calcium channel blockers) golongan dihidropiridin bersifat vaskuloselektif dengan selektivitas tinggi yang digunakan
pada pengobatan hipertensi serta angina pektoris. Dalam sistem klasifikasi
biofarmaseutik (BCS), nifedipin tergolong kelas dua yaitu obat dengan kelarutan
rendah, namun permeabilitas terhadap membran baik dan termasuk salah satu obat
esensial nasional di Indonesia yang memperlihatkan kualitas dan efektivitas yang
rendah dilihat dari segi disolusinya (BPOM, 2004). Berbagai penelitian telah
dilakukan dengan tujuan untuk meningkatkan kelarutan dan laju disolusi dari
nifedipin diantaranya dengan memodifikasi sifat-sifat fisika kimia, menambahkan
bahan-bahan peningkat kelarutan maupun membentuk senyawa komplek. Bahan
obat tertentu bila diformulasi dan dibuat secara berbeda menjadi bentuk sediaan
padat cenderung mempunyai laju disolusi yang bervariasi sehingga mengalami
perbedaan bioavailabilitas (Ansel, 1989). Berdasarkan data tersebut, maka
dilakukan penelitian guna untuk mengetahui apakah beberapa sediaan tablet
nifedipin yang beredar di Malang baik yang diproduksi oleh pabrik PMA, PMDN
12
keseragaman kandungan, waktu hancur dan uji disolusi seperti yang tertera pada
Farmakope Indonesia edisi IV dan United Stated Pharmacopeia XXXII.
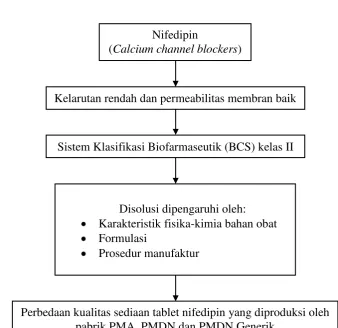
[image:29.595.139.478.167.495.2]3.2 Alur Kerangka Konseptual
Gambar 3.3 Skema Kerangka Konseptual Sistem Klasifikasi Biofarmaseutik (BCS) kelas II
Nifedipin
(Calcium channel blockers)
Disolusi dipengaruhi oleh: Karakteristik fisika-kimia bahan obat Formulasi
Prosedur manufaktur
Perbedaan kualitas sediaan tablet nifedipin yang diproduksi oleh pabrik PMA, PMDN dan PMDN Generik
13
BAB 4
METODE PENELITIAN
4.1 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah nifedipin (Baku
Pembanding Farmakope Indonesia), tablet nifedipin dari tiga pabrik yang berbeda
(PMA, PMDN dan PMDN Generik), asam klorida p.a (E. Merck), natrium klorida
p.a (E. Merck), metanol p.a (E. Merck) dan air suling.
4.2 Alat Penelitian
Alat-alat yang digunakan pada penelitian ini adalah single beam
spektrofotometri UV-Vis (Shimadzu UV-1240), alat uji disolusi: dissolution tester, alat uji waktu hancur: disintegration tester 2 cavity, pH meter (Crison), neraca analitik (Mettler Toledo), beaker glass, labu ukur, pipet volume, milipore
membran filter 0,45 mikron, dan alat laboratorium lainnya.
4.3 Rancangan Penelitian
Penelitian ini dilaksanakan dengan metodologi penelitian eksperimental
dengan membandingkan kualitas sediaan tablet yang mengandung nifedipin 10
mg yang beredar diMalang baik generik dan non generik (nama dagang) dari tiga
pabrik yang berbeda PMA, PMDN dan PMDN Generik yang meliputi
keseragaman bobot, keseragaman kandungan, waktu hancur dan uji disolusi.
4.3.1 Variabel Penelitian
Variabel bebas : Tablet nifedipin generik (PMDN Generik) dan non
generik (PMA dan PMDN).
Variabel terikat : Kualitas tablet meliputi keseragaman bobot,
keseragaman kandungan, waktu hancur dan uji disolusi.
4.3.2 Populasi dan Sampel
Populasi adalah tablet nifedipin yang beredar di Malang (PMA, PMDN
dan PMDN Generik) dengan kandungan zat aktif 10 mg per tablet. Pengambilan
sampel tablet nifedipin dari tiga pabrik yang berbeda (PMA, PMDN dan PMDN
14
Randomized Sampling dengan jumlah sampel sesuai dengan jumlah tablet yang diperlukan untuk pemeriksaan.
4.3.3 Waktu dan Tempat Pelaksanaan
Penelitian dilakukan selama 3 bulan bertempat di Laboratorium Teknologi
Sediaan Farmasi dan Laboratorium Kimia Terpadu Universitas Muhammadiyah
Malang.
4.4 Metode Penelitian 4.4.1 Kerangka Kerja
Kerangka kerja yang dilakukan dalam penelitian ini dapat dilihat pada
gambar 4.4.
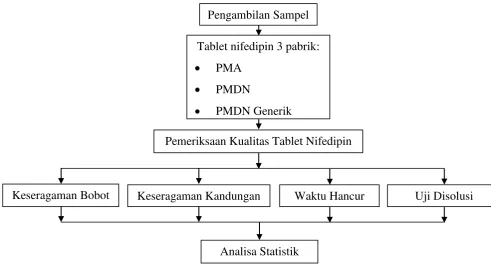
[image:31.595.76.568.321.589.2]
Gambar 4.4 Skema Kerangka Kerja Pengambilan Sampel
Tablet nifedipin 3 pabrik:
PMA
PMDN
PMDN Generik
Pemeriksaan Kualitas Tablet Nifedipin
Waktu Hancur
Keseragaman Bobot Uji Disolusi
15
4.4.2 Pemeriksaan Kualitas Tablet Nifedipin
Pemeriksaan kualitas tablet nifedipin yang dilakukan meliputi
keseragaman bobot,keseragaman kandungan, waktu hancur dan uji disolusi.
4.4.2.1Pemeriksaan Keseragaman Bobot
Untuk produk yang mengandung zat aktif 50 mg atau lebih yang
merupakan 50 % atau lebih dari bobot satuan sediaan, maka uji keseragaman
sediaan dilakukan dengan cara keseragaman bobot (DepKes, 1995). Prosedur
pemeriksaan keseragaman bobot adalah:
Ditimbang seksama 10 tablet satu per satu dan hitung bobot rata-rata. Dari
hasil pemeriksaan keseragaman kandungan, dihitung jumlah zat aktif dari
masing-masing 10 tablet dengan anggapan zat aktif terdistribusi homogen.
4.4.2.2 Pemeriksaan Keseragaman Kandungan
1. Penentuan Panjang Gelombang Maksimum Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Panjang gelombang maksimum ditentukan menggunakan larutan baku
kerja nifedipin 8,0 µg/ml diamati dengan single beam spektrofotometri UV-Vis
pada panjang gelombang 200 sampai 300 nm. Pada larutan baku kerja tersebut
dilakukan pengamatan nilai absorbansi terhadap panjang gelombang sehingga
panjang gelombang maksimum dapat diketahui.
2. Pembuatan Kurva Baku Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Pembuatan kurva baku terlebih dahulu diawali dengan pembuatan larutan
baku induk (500,0 µg/ml) dengan cara ditimbang nifedipin BPFI sebanyak 50,0
mg, dipindahkan secara kuantitatif ke dalam labu ukur 100,0 ml, ditambahkan
metanol hingga garis tanda dan dikocok homogen. Kemudian larutan baku induk
(500,0 µg/ml) tersebut dipipet 5,0 ml dan dimasukkan ke dalam labu ukur 50,0
ml, diencerkan dengan cairan lambung buatan tanpa pepsin hingga garis tanda
sehingga diperoleh larutan baku induk (50,0 µg/ml). Kemudian dilanjutkan
dengan pembuatan larutan baku kerja nifedipin yang dibuat dengan cara dipipet
16
masing-masing dimasukkan ke dalam labu ukur 25,0 ml, ditambahkan cairan
lambung buatan tanpa pepsin sampai garis tanda, lalu dikocok homogen.
Diperoleh larutan baku kerja dengan kadar 1; 2; 4; 6; 8; 10; dan 12 µg/ml yang
diamati absorbannya pada panjang gelombang maksimum dan sebagai blanko
cairan lambung buatan tanpa pepsin. Data yang diperoleh dibuat kurva absorbansi
terhadap kadar.
3. Keseragaman Kandungan
Tablet bersalut dan tablet yang mengandung zat aktif 50 mg atau kurang,
dan bobot zat aktif lebih kecil dari 50% bobot sediaan harus memenuhi uji
keseragaman kandungan (Depkes RI, 1995). Adapun prosedur pemeriksaan
keseragaman kandungan tablet sebagai berikut:
Sejumlah 10 tablet yang telah memenuhi keseragaman bobot digerus
sampai homogen. Ditimbang sejumlah serbuk yang setara dengan 10 mg nifedipin
sebanyak 5 kali. Masing-masing serbuk tablet tersebut dimasukkan ke dalam labu
ukur 10,0 ml dan ditambah metanol hingga garis tanda lalu dikocok. Larutan
tersebut disaring dengan milipore membran filter 0,45 mikron kemudian dipipet
1,0 ml dan dimasukkan dalam labu ukur 100,0 ml, ditambahkan cairan lambung
buatan tanpa pepsin hingga garis tanda sehingga diperoleh larutan konsentrasi
10,0 µg/ml. Sebagai larutan standar dipakai larutan baku kerja 10,0 ppm.
Absorban larutan diamati dengan menggunakan Spektrofotometri UV-Vis pada λ
maksimum. Sebagai blanko digunakan cairan lambung buatan tanpa pepsin.
4.4.2.3Pemeriksaan Waktu Hancur
Uji ini dimaksudkan untuk menetapkan kesesuaian batas waktu hancur
yang tertera dalam masing-masing monografi. Untuk menetapkan waktu hancur
dari tablet nifedipin dapat menggunakan alat Disintegration tester 2 cavity dengan prosedur sebagai berikut (Depkes RI, 1995):
Untuk tablet tidak bersalut. Dimasukkan 1 tablet ke dalam masing-masing
tabung dari keranjang, lalu dimasukkan satu cakram pada tiap tabung dan
dijalankan alat. Gerakan turun naik keranjang dalam cairan media pada frekuensi
yang tetap antara 29 hingga 32 kali per menit dan gunakan air suhu 37°C ± 2°C
17
Pada akhir batas waktu seperti yang tertera pada monografi diangkat keranjang
dan amati semua tablet (semua tablet harus hancur sempurna). Untuk tablet
bersalut bukan enterik. Dimasukkan 1 tablet ke dalam masing-masing tabung dari
keranjang, bila tablet mempunyai penyalut luar yang dapat larut, celupkan
keranjang dalam air pada suhu kamar selama 5 menit kemudian dimasukkan
cakram pada tiap tabung dan jalankan alat, gunakan cairan lambung buatan
bersuhu 37°C ± 2°C sebagai media. Setelah alat dijalankan selama 30 menit,
angkat keranjang dan amati semua tablet (semua tablet harus hancur sempurna).
Bila 1 tablet atau 2 tablet tidak hancur sempurna, ulangi pengujian dengan 12
tablet lainnya, tidak kurang 16 dari 18 tablet yang diuji harus hancur sempurna.
4.4.2.4Uji Disolusi
Untuk mengukur laju disolusi tablet dilakukan dengan menggunakan
Dissolution tester, dengan prosedur sebagai berikut (Depkes RI, 1995):
Sebanyak 900,0 ml cairan lambung buatan tanpa pepsin sebagai media
disolusi dimasukkan ke dalam wadah, biarkan media disolusi hingga suhu 37°C ±
0,5°C. Apabila suhu telah tercapai, dimasukkan 1 tablet ke dalam wadah dan
segera dijalankan alat dengan kecepatan seperti yang tertera dalam masing-masing
monografi dengan kecepatan 50 putaran per menit. Pada interval waktu 5, 10, 15
dan 20 menit larutan dipipet sebanyak 10,0 ml. Kemudian disaring melalui
milipore membran filter 0,45 mikron. Setiap kali setelah pengambilan cuplikan,
media disolusi diganti dengan cairan lambung buatan tanpa pepsin sebanyak
volume yang diambil. Kemudian absorban masing-masing cuplikan diamati
dengan menggunakan spektrofotometri UV-Vis pada panjang gelombang
maksimum. Konsentrasi nifedipin yang terlarut setiap interval waktu, didapatkan
dengan memasukkan data absorban kedalam persamaan kurva baku. Untuk blanko
digunakan cairan lambung buatan tanpa pepsin. Pengujian disolusi dilakukan
terhadap 6 tablet.
4.4.3 Analisis Statistik
Data hasil pemeriksaan kualitas tablet yang mengandung nifedipin 10 mg
18
keseragaman bobot, keseragaman kandungan, waktu hancur dan uji disolusi,
dianalisa dengan One Way Anova (Analisys of Variances).
Untuk mengetahui apakah ada perbedaan bermakna secara signifikan pada
masing-masing tablet nifedipin generik dan non generik (nama dagang) dari tiga
pabrik yang berbeda (PMA, PMDN dan PMDN Generik) dengan membandingkan
harga F hitung yang diperoleh dengan harga F tabel pada tingkat signifikan (α =
0,05). Apabila diperoleh harga F hitung lebih besar dari F tabel, maka dapat
disimpulkan bahwa ada perbedaan bemakna antar tablet-tablet nifedipin tersebut,
19
BAB 5
HASIL PENELITIAN
5.1 Pengambilan Sampel
Pengambilan sampel tablet nifedipin dilakukan dengan membeli tablet
nifedipin di apotik yang ada di Malang sebanyak 100 tablet untuk masing-masing
produk baik PMA, PMDN dan PMDN Generik dengan ketentuan tablet nifedipin
yang diambil dari satu pabrik mempunyai nomor batch dan waktu edar yang sama. Profil sampel dapat dilihat pada Lampiran 4.
5.2 Pemeriksaan Kualitas Tablet Nifedipin
Data Pemeriksaan kualitas tablet nifedipin meliputi keseragaman bobot,
keseragaman kandungan, waktu hancur dan uji disolusi.
5.2.1 Pemeriksaan Keseragaman Bobot
Hasil pemeriksaan menunjukkan bahwa bobot tablet nifedipin dari ketiga
produk (PMA, PMDN dan PMDN Generik) yang diperiksa memenuhi persyaratan
keseragaman bobot yang tercantum pada Farmakope Indonesia edisi IV yaitu
persyaratan keseragaman bobot dipenuhi jika jumlah zat aktif dalam
masing-masing dari 10 satuan sediaan terletak antara 85,0 % - 115,0 % dari jumlah yang
tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan 6,0 %
(DepKes, 1995). Data hasil pemeriksaan keseragaman bobot tablet nifedipin dapat
20
Tabel V.1 Data Pemeriksaan Keseragaman Bobot Tablet Nifedipin
Replikasi
Bobot Tablet (gram)
PMA PMDN PMDN Generik
1 0,224 0,315 0,327
2 0,230 0,314 0,322
3 0,229 0,318 0,326
4 0,234 0,319 0,327
5 0,227 0,316 0,327
6 0,228 0,313 0,322
7 0,229 0,318 0,327
8 0,224 0,316 0,324
9 0,238 0,315 0,330
10 0,234 0,313 0,324
Rata-rata ± SD 0,230 ± 0,004 0,316 ± 0,002 0,326 ± 0,003
RSD 1,74 0,63 0,61
Dari hasil analisis statistik dengan analisis varian (Anova) dalam bentuk one way didapatkan harga F hitung (2676,717) lebih besar dibandingkan F tabel (2,96) pada tingkat signifikan (α = 0,05). Hal ini menunjukkan adanya perbedaan
bermakna antar produk (PMA, PMDN dan PMDN Generik), maka analisis
dilanjutkan dengan uji Tukey HSD (Honestly Significant Difference Test) dan diperoleh produk PMA dengan PMDN, PMA dengan PMDN Generik dan PMDN
dengan PMDN Generik memiliki perbedaan yang bermakna. Data hasil analisis
statistik pemeriksaan keseragaman bobot tablet nifedipin dapat dilihat pada
21
5.2.2 Pemeriksaan Keseragaman Kandungan
5.2.2.1 Penentuan Panjang Gelombang Maksimum Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Hasil pengamatan nilai absorbansi nifedipin dalam media cairan lambung
buatan tanpa pepsin pada panjang gelombang 200 sampai 300 nm dapat dilihat
pada Gambar 5.1.
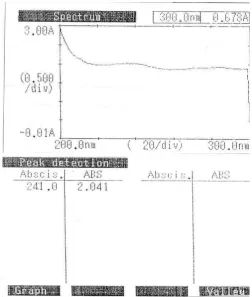
Gambar 5.1 Spektra Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Dari Gambar 5.1 dapat dilihat bahwa pada panjang gelombang 241,0 nm
larutan baku kerja nifedipin 8,0 µg/ml memberikan nilai serapan yang maksimum
yaitu 2,041.
5.2.2.2Pembuatan Kurva Baku Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Kurva baku dibuat dengan 7 konsentrasi larutan baku kerja nifedipin yang
diamati serapannya pada panjang gelombang maksimum 241,0 nm yang diperoleh
[image:38.595.216.469.240.538.2]22
Tabel V.2 Absorban Larutan Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
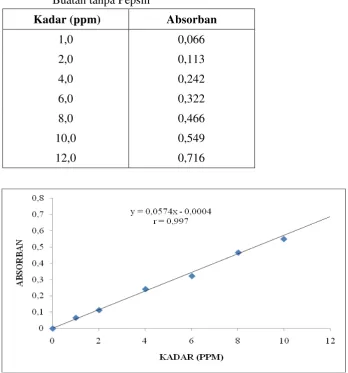
Kadar (ppm) Absorban
1,0 0,066
2,0 0,113
4,0 0,242
6,0 0,322
8,0 0,466
10,0 0,549
12,0 0,716
Gambar 5.2 Kurva Baku Larutan Nifedipin dalam Media Cairan Lambung Buatan tanpa Pepsin
Dari hasil perhitungan diperoleh data persamaan regresi Y =
0,0574x-0,0004 dengan koefisien korelasi (r) = 0,997, dimana kriteria penerimaan untuk
korelasi adalah ≥ 0,98 (BPOM, 2004).
5.2.2.3 Keseragaman Kandungan
Hasil pemeriksaan menunjukkan bahwa tablet nifedipin dari ketiga produk
(PMA, PMDN dan PMDN Generik) yang diperiksa memenuhi persyaratan
keseragaman kandungan yang tercantum pada Farmakope Indonesia edisi IV dan
United Stated Pharmacopeia XXXII yaitu mengandung tidak kurang dari 90 % dan tidak lebih dari 110 % nifedipin (C17H18N2O6) dari jumlah yang tertera pada
[image:39.595.146.495.106.480.2]23
yaitu kurang dari 6,0% (DepKes, 1995). Data hasil pemeriksaan keseragaman
[image:40.595.148.484.148.336.2]kandungan tablet nifedipin dapat dilihat pada Tabel V.3.
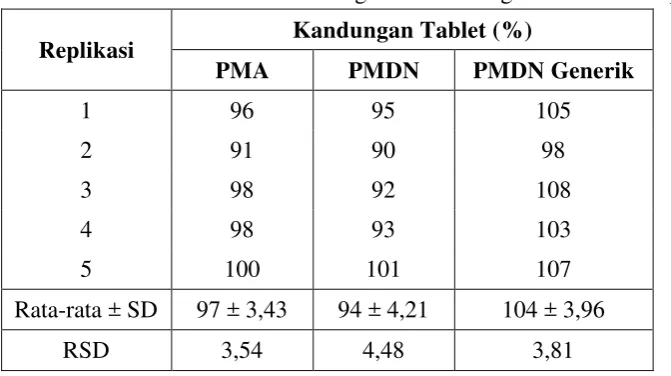
Tabel V.3 Data Pemeriksaan Keseragaman Kandungan Tablet Nifedipin
Replikasi Kandungan Tablet (%)
PMA PMDN PMDN Generik
1 96 95 105
2 91 90 98
3 98 92 108
4 98 93 103
5 100 101 107
Rata-rata ± SD 97 ± 3,43 94 ± 4,21 104 ± 3,96
RSD 3,54 4,48 3,81
Dari hasil analisis statistik dengan analisis varian (Anova) dalam bentuk one way didapatkan harga F hitung (9,044) lebih besar dibandingkan F tabel (3,88) pada tingkat signifikan (α = 0,05). Hal ini menunjukkan adanya perbedaan
bermakna antar produk (PMA, PMDN dan PMDN Generik), maka analisis
dilanjutkan dengan uji Tukey HSD (Honestly Significant Difference Test) dan diperoleh produk PMA dengan PMDN tidak terdapat perbedaan bermakna
sedangkan PMA dengan PMDN Generik dan PMDN dengan PMDN Generik
terdapat perbedaan bermakna. Data hasil analisis statistik pemeriksaan
keseragaman kandungan tablet nifedipin dapat dilihat pada lampiran 19.
5.2.3 Pemeriksaan Waktu Hancur
Hasil pemeriksaan menunjukkan bahwa tablet nifedipin dari ketiga produk
(PMA, PMDN dan PMDN Generik) yang diperiksa memenuhi persyaratan waktu
hancur yang tercantum pada Farmakope Indonesia edisi IV. Data hasil
24
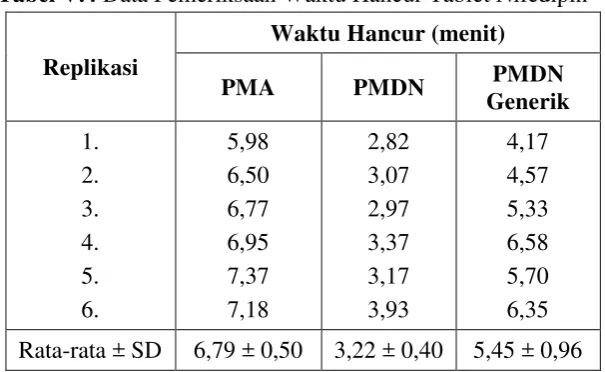
Tabel V.4 Data Pemeriksaan Waktu Hancur Tablet Nifedipin
Replikasi
Waktu Hancur (menit) PMA PMDN PMDN
Generik 1. 2. 3. 4. 5. 6. 5,98 6,50 6,77 6,95 7,37 7,18 2,82 3,07 2,97 3,37 3,17 3,93 4,17 4,57 5,33 6,58 5,70 6,35
Rata-rata ± SD 6,79 ± 0,50 3,22 ± 0,40 5,45 ± 0,96
Dari hasil analisis statistik dengan analisis varian (Anova) dalam bentuk one way didapatkan harga F hitung (44,306) lebih besar dibandingkan F tabel (3,68) pada tingkat signifikan (α = 0,05). Hal ini menunjukkan adanya perbedaan
bermakna antar produk (PMA, PMDN dan PMDN Generik), maka analisis
dilanjutkan dengan uji Tukey HSD (Honestly Significant Difference Test) dan diperoleh bahwa produk PMA dengan PMDN, PMA dengan PMDN Generik dan
PMDN dengan PMDN Generik memiliki perbedaan yang bermakna. Data hasil
analisis statistik pemeriksaan waktu hancur tablet nifedipin dapat dilihat pada
lampiran 19.
5.2.4 Uji Disolusi
Hasil uji disolusi menunjukkan bahwa tablet nifedipin dari ketiga produk
(PMA, PMDN dan PMDN Generik) yang diuji memenuhi persyaratan uji disolusi
yang tercantum pada United Stated Pharmacopeia XXXII yaitu tidak kurang dari (Q) 80% + 5% terlarut dalam waktu 20 menit (USP, 2009). Data hasil uji disolusi
25
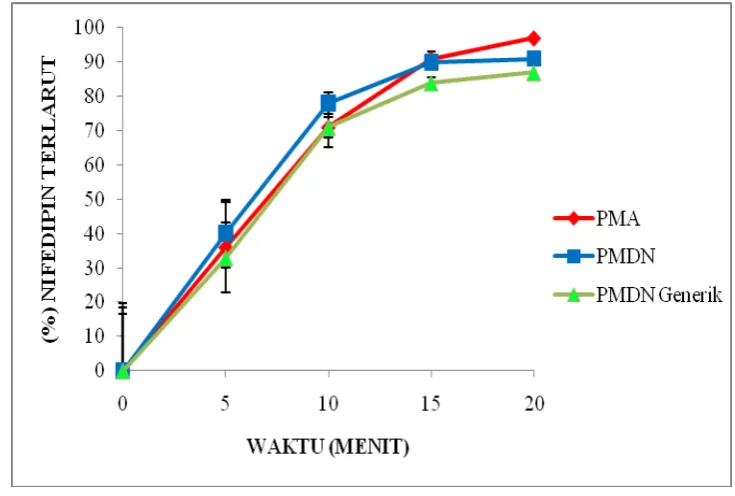
Tabel V.5 Data Persen nifedipin terlarut
Waktu Sampling
(menit)
(%) Nifedipin Terlarut
PMA PMDN PMDN Generik
5 10 15 20
36 ± 18,28 % 71 ± 13,19 % 91 ± 5,89 % 97 ± 1,97 %
40 ± 19,78 % 78 ± 9,83 % 90 ± 3,20 % 91 ± 1,52 %
33 ± 16,59 % 71 ± 10,31 % 84 ± 2,88 % 87 ± 1,52 % Keterangan: Hasil rata-rata 6 kali replikasi
Adapun profil dari hasil uji disolusi dari ketiga produk (PMA, PMDN dan
PMDN Generik) dapat dilihat pada Gambar 5.3.
Gambar 5.3 Profil Disolusi Tablet Nifedipin
Dari Gambar 5.3 terlihat bahwa produk PMA, PMDN dan PMDN Generik
mempunyai profil disolusi yang hampir sama meskipun secara statistik produk
PMA, PMDN dan PMDN Generik berbeda makna dimanadengan analisis varian
(Anova) dalam bentuk one way didapatkan harga F hitung (44,902) lebih besar dibandingkan F tabel (3,68) pada tingkat signifikan (α = 0,05) dan dengan uji
Tukey HSD (Honestly Significant Difference Test) diperoleh bahwa produk PMA dengan PMDN, PMA dengan PMDN Generik dan PMDN dengan PMDN Generik
memiliki perbedaan yang bermakna. Beberapa faktor yang menyebabkan
[image:42.595.146.514.293.541.2]26
baku obat, perbedaan dalam prosedur manufaktur serta bahan-bahan tambahan
27
BAB 6 PEMBAHASAN
Telah dilakukan penelitian terhadap kualitas beberapa sediaan tablet yang
mengandung nifedipin 10 mg yang beredar di Malang baik generik maupun non
generik (nama dagang) dari tiga pabrik yang berbeda (PMA, PMDN dan PMDN
Generik). Nifedipin termasuk bahan obat yang dalam sistem klasifikasi
biofarmaseutik (BCS) tergolong kelas dua yaitu obat dengan kelarutan rendah,
namun permeabilitas terhadap membran baik. Sediaan tablet yang berkualitas
dapat ditinjau dari berbagai aspek selain dari segi ketersediaan hayati
(bioavailabilitas) obat, kualitas obat juga ditinjau dari aspek dimana tablet harus
memenuhi kriteria yang dipersyaratkan Farmakope. Produk sediaan tablet
nifedipin yang beredar mempunyai kualitas yang bervariasi. Perbedaan kualitas
dari tiap produk adalah multifaktorial, antara lain dikarenakan perbedaan bahan
baku obat, bahan-bahan tambahan yang digunakan dalam proses formulasi serta
prosedur manufaktur dari masing-masing pabrik. Kualitas dapat dijadikan dasar
acuan untuk menetapkan kebenaran khasiat (efficacy) dan keamanan (safety) dari suatu produk obat. Penelitian ini dilakukan untuk mengetahui apakah beberapa
sediaan tablet nifedipin yang beredar di Malang baik yang diproduksi oleh pabrik
PMA, PMDN dan PMDN Generik telah memenuhi persyaratan keseragaman
bobot, keseragaman kandungan, waktu hancur dan uji disolusi seperti yang tertera
pada Farmakope Indonesia edisi IV dan United Stated Pharmacopeia XXXII. Pengambilan sampel tablet nifedipin dilakukan dengan membeli tablet
nifedipin di apotik yang ada di Malang sebanyak 100 tablet untuk masing-masing
produk baik PMA, PMDN dan PMDN Generik dengan ketentuan tablet nifedipin
yang diambil dari satu pabrik mempunyai nomor batch dan waktu edar yang sama. Profil sampel dapat dilihat pada Lampiran 4.
Pemeriksaan keseragaman bobot tablet nifedipin dilakukan dengan
menimbang 10 tablet satu per satu dan dihitung bobot rata-ratanya. Setelah
dilakukan penimbangan terhadap tablet nifedipin dari ketiga produk diperoleh
28
0,002 gram dan produk PMDN Generik 0,326 ± 0,003 gram, dengan simpangan
baku relatif kurang dari 6,0 %. Data hasil pemeriksaan keseragaman bobot tablet
nifedipin dari ketiga produk dapat dilihat pada Tabel V.1. Hasil pemeriksaan
menunjukkan bahwa bobot tablet nifedipin dari ketiga produk (PMA, PMDN dan
PMDN Generik) telah memenuhi persyaratan keseragaman bobot seperti yang
tertera pada Farmakope Indonesia edisi IV yaitu persyaratan keseragaman bobot
dipenuhi jika jumlah zat aktif dalam masing-masing dari 10 satuan sediaan
terletak antara 85,0 % - 115 % dari jumlah yang tertera pada etiket dan simpangan
baku relatif kurang dari atau sama dengan 6,0 %. Dari hasil perhitungan statistik
menggunakan SPSS (Statistical Product and Service Solution) tipe 17 dengan analisis varian (Anova) dalam bentuk one way anova diperoleh F hitung (2676,717) lebih besar dari F tabel (2,96) dengan tingkat signifikan (α = 0,05)
yang menunjukkan adanya perbedaan bermakna dari ketiga produk. Untuk
mengetahui produk yang berbeda makna maka analisis dilanjutkan dengan uji
Tukey HSD (Honestly Significant Difference Test) dan diperoleh hasil antara produk PMA dengan PMDN, PMA dengan PMDN Generik dan PMDN dengan
PMDN Generik memiliki perbedaan yang bermakna. Data hasil analisis statistik
pemeriksaan keseragaman bobot tablet nifedipin dapat dilihat pada lampiran 19.
Dengan demikian perbedaan bahan baku obat, prosedur manufaktur serta
bahan-bahan tambahan-bahan dalam formulasi antar pabrik memberikan pengaruh yang
bermakna terhadap keseragaman bobot tablet nifedipin.
Pemeriksaan keseragaman kandungan tablet nifedipin diawali dengan
penentuan panjang gelombang maksimum nifedipin (Baku Pembanding
Farmakope Indonesia) dengan menggunakan larutan baku kerja 8,0 µg/ml yang
diamati dengan single beam spektrofotometri UV-Vis pada panjang gelombang
200 sampai 300 nm, dan absorban tertinggi diperoleh pada panjang gelombang
241,0 nm. Setelah itu dilanjutkan dengan pembuatan kurva baku menggunakan
larutan baku kerja nifedipin yang diamati absorbannya pada λ maksimum. Dari
hasil perhitungan diperoleh data persamaan garis regresi yaitu y = 0,0574x-0,0004
dengan koefisien korelasi r = 0,997, dimana kriteria penerimaan untuk korelasi
adalah ≥ 0,98 (BPOM, 2004). Dari 10 tablet yang telah memenuhi keseragaman
29
dengan 10 mg nifedipin sebanyak 5 kali. Masing-masing serbuk tablet tersebut
dimasukkan ke dalam labu ukur 10,0 ml dan ditambah metanol hingga garis tanda
lalu dikocok. Larutan tersebut disaring dengan milipore membran filter 0,45
mikron kemudian dipipet 1,0 ml dan dimasukkan dalam labu ukur 100,0 ml,
ditambahkan cairan lambung buatan tanpa pepsin hingga garis tanda sehingga
diperoleh larutan konsentrasi 10,0 µg/ml. Dari pemeriksaan diperoleh kandungan
rata-rata nifedipin per tablet produk PMA 97 ± 3,43 %, produk PMDN94 ± 4,21
% dan produk PMDN Generik 104 ± 3,96 %. Hasil pemeriksaan keseragaman
kandungan tablet nifedipin menunjukkan bahwa tablet nifedipin dari ketiga
produk baik PMA, PMDN dan PMDN Generik telah memenuhi persyaratan
seperti yang tertera pada Farmakope Indonesia edisi IV dan United Stated Pharmacopeia XXXII yaitu mengandung tidak kurang dari 90 % dan tidak lebih dari 110 % nifedipin (C17H18N2O6) dari jumlah yang tertera pada etiket dengan
simpangan baku relatif kurang dari 6%. Data hasil pemeriksaan keseragaman
kandungan tablet nifedipin dari ketiga produk dapat dilihat pada Tabel V.3. Hasil
perhitungan statistik menggunakan SPSS (Statistical Product and Service Solution) tipe 17 dengan analisis varian (Anova) dalam bentuk one way anova diperoleh F hitung (9,044) lebih besar dari F tabel (3,88) dengan tingkat signifikan
(α = 0,05) yang menunjukkan adanya perbedaan bermakna dari ketiga produk.
Untuk mengetahui produk yang berbeda makna maka analisis dilanjutkan dengan
uji Tukey HSD (Honestly Significant Difference Test) dan diperoleh hasil produk PMA dengan PMDN tidak terdapat perbedaan bermakna sedangkan PMA dengan
PMDN Generik dan PMDN dengan PMDN Generik terdapat perbedaan
bermakna. Data hasil analisis statistik pemeriksaan keseragaman kandungan tablet
nifedipin dari ketiga produk dapat dilihat pada lampiran 19. Dengan demikian
perbedaan bahan baku obat, prosedur manufaktur serta bahan-bahan tambahan
dalam formulasi antar pabrik memberikan pengaruh yang bermakna terhadap
keseragaman kandungan tablet nifedipin.
Pemeriksaan waktu hancur tablet nifedipin dilakukan dengan alat
Disintegration tester 2 cavity menggunakan 6 tablet dimana masing-masing 1 tablet dimasukkan ke dalam tabung dari keranjang, lalu dimasukkan satu cakram
30
sempurna, tablet dari produk PMAmemerlukan waktu 6,79 ± 0,50 menit, produk
PMDNmemerlukan waktu 3,22 ± 0,40 menit sedangkan produk PMDN Generik
memerlukan waktu 5,45 ± 0,96 menit. Hasil pemeriksaan menunjukkan bahwa
tablet nifedipin dari ketiga produk (PMA, PMDN dan PMDN Generik) telah
memenuhi persyaratan waktu hancur seperti yang tertera pada Farmakope
Indonesia edisi IV. Data hasil pemeriksaan waktu hancur tablet nifedipin dari
ketiga produk dapat dilihat pada Tabel V.4. Hasil perhitungan statistik
menggunakan SPSS (Statistical Product and Service Solution) tipe 17 dengan analisis varian (Anova) dalam bentuk one way anovadiperoleh F hitung (44,306) lebih besar dari F tabel (3,68) dengan tingkat signifikan (α = 0,05) yang
menunjukkan adanya perbedaan bermakna dari ketiga produk. Untuk mengetahui
produk yang berbeda makna maka analisis dilanjutkan dengan uji Tukey HSD
(Honestly Significant Difference Test) dan diperoleh hasil bahwa produk PMA dengan PMDN, PMA dengan PMDN Generik dan PMDN dengan PMDN Generik
memiliki perbedaan yang bermakna sehingga dengan demikian perbedaan bahan
baku obat, prosedur manufaktur serta bahan-bahan tambahan dalam formulasi
antar pabrik memberikan pengaruh yang bermakna terhadap waktu hancur tablet
nifedipin. Data hasil analisis statistik pemeriksaan waktu hancur tablet nifedipin
dari ketiga produk dapat dilihat pada lampiran 19.
Uji disolusi merupakan suatu prosedur tetap dalam Cara Pembuatan Obat
yang Baik (CPOB) yang menjamin kualitas produk obat. Pengujian laju disolusi
menggunakan alat Dissolution tester yang dilakukan terhadap 6 tablet. Tablet nifedipin 10 mg dimasukkan ke dalam wadah yang berisi 900,0 ml cairan
lambung buatan tanpa pepsin bersuhu 37°C ± 0,5°C dan kemudian paddle diputar
dengan kecepatan 50 putaran per menit. Pada interval waktu 5, 10, 15 dan 20
menit larutan dipipet sebanyak 10,0 ml dan selanjutnya disaring melalui milipore
membran filter 0,45 mikron. Volume media disolusi diusahakan tetap dengan
menambahkan cairan lambung buatan tanpa pepsin sebanyak 10,0 ml setelah
pemipetan. Setiap cuplikan diamati absorbannya dengan menggunakan single
beam spektrofotometri UV-Vis pada panjang gelombang 241,0 nm dan sebagai
blanko digunakan cairan lambung buatan tanpa pepsin. Dari data hasil uji disolusi