ISOTERM ADSORPSI ION Ni(II) dan Zn(II) PADA MATERIAL ALGAChaetocerossp YANG DIMODIFIKASI DENGAN
PELAPISAN SILIKA-MAGNETIT (Skripsi)
Oleh MUSRIFATUN
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
ADSORPTION ISOTERMS Ni (II) and Zn (II) ION OF THE MATERIAL ALGAEChaetocerossp ARE MODIFIED
BY COATING SILICA-MAGNETITE
By Musrifatun
Adsorption process has been carried Ni (II) and Zn (II) ion on the adsorbent silica algae (AS), and algae silica-magnetite (AS-magnetite). Identification the functional groups of the AS, and AS-magnetite performed using an infrared spectrophotometer(IR). The addition of a new absorption located at 2924.09 cm-1
wavenumber derived from the C-H stretching vibration absorption of the (-CH2)
aliphatic, indicate that silica Chaetocerossp algae biomass hibridisation has been
successfully conducted in the AS and AS-magnetite. Crystal structure analysis performed using XRD instrumentation. Diffraction peaks stated that the AS is experiencing changes in the structure of non-crystalline form of the base turned into crystals of magnetite have been added to the AS-magnetite. Adsorption analysis kinetics of Ni (II) and Zn (II) in the AS, and AS-magnetite tends to follow pseudo second order kinetics model with the k2 respectively 0.473 and
0.838 mmol g-1 min-1 for ions Ni (II) then for ions Zn (II) are 0.166 and 0.545 mmol g-1 min-1. Adsorption isotherms of Ni (II) and Zn (II) in the AS and AS-magnetite tend to follow the model isoterm FreundlichKfvalue respectively 1.252
and 1, 258 g mol-1for ions Ni (II), and 0.685 and 0.717 mol g-1for Zn (II) ions.
ABSTRAK
ISOTERM ADSORPSI ION Ni(II) dan Zn(II) PADA MATERIAL ALGAChaetocerossp YANG DIMODIFIKASI DENGAN
PELAPISAN SILIKA-MAGNETIT
Oleh Musrifatun
Telah dilakukan proses adsorpsi ion Ni(II) dan Zn(II) terhadap adsorben alga silika (AS), dan alga silika-magnetit (magnetit). Identifikasi gugus fungsi AS, dan AS-magnetit dilakukan dengan menggunakan spektrofotometer inframerah (IR). Adanya
tambahan serapan baru yang terdapat pada bilangan gelombang 2924,09 cm-1 yang
berasal dari serapan vibrasi ulur C-H dari (-CH2) alifatik menunjukkan bahwa
hibridasasi silika dengan biomassa algaChaetocerossp telah berhasil dilakukan pada
AS maupun AS-magnetit. Analisis struktur kristal dilakukan menggunakan instrumentasi XRD. Puncak-puncak difraksi menyatakan bahwa AS mengalami perubahan struktur dari bentuk dasar non-kristal berubah menjadi kristal magnetit setelah ditambahkan magnetit pada AS-magnetit. Data kinetika adsorpsi ion Ni(II) dan Zn(II) pada AS, dan AS-magnetit cenderung mengikuti model kinetika pseudo orde dua dengank2masing-masing 0,473 dan 0,838 g mmol-1menit-1untuk ion Ni(II)
kemudian untuk ion Zn(II) adalah 0,166 dan 0,545 g mmol-1 menit-1. Isoterm adsorpsi ion Ni(II) dan Zn(II) pada AS dan AS-magnetit cenderung mengikuti model isoterm Freundlich dengan nilai Kf masing-masing 1,252 dan 1,258 mol g-1untuk ion
Ni(II), untuk ion Zn(II) adalah 0,685 dan 0,717 mol g-1.
ISOTERM ADSORPSI ION Ni(II) dan Zn(II) PADA MATERIAL ALGAChaetocerossp YANG DIMODIFIKASI DENGAN
PELAPISAN SILIKA-MAGNETIT
Oleh
MUSRIFATUN
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Judul Laporan : ISOTERM ADSORBSI ION Ni(II) dan Zn(II) PADA MATERIAL ALGAChaetocerossp YANG DIMODIFIKASI DENGAN PELAPISAN SILIKA-MAGNETIT
Nama Mahasiswa : Musrifatun
Nomor Pokok Mahasiswa : 0817011044
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Buhani, M.Si. Dian Septiani Pratama, M.Si
NIP 196904161994032003 NIP197104151995121001
2. Ketua Jurusan Kimia
Andi Setiawan, Ph.D.
MENGESAHKAN
1. Tim Penguji
Ketua :Dr. Buhani, M.Si. …………....
Sekretaris : Dian Septiani Pratama, M.Si …………....
Penguji
Bukan Pembimbing :Prof. Suharso, Ph.D. …………....
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D.
NIP 196905301995121001
RIWAYAT HIDUP
Penulis dilahirkan di Gunung Raya, pada tanggal 10 April 1989, sebagai anak keempat dari enam bersaudara, putri dari Buhadi dan Sutiyem.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SDN 1 Titiwangi Lampung Selatan, diselesaikan pada tahun 2001. Sekolah Menengah Pertama (SMP) di SMPN 1 Candipuro Lampung Selatan diselesaikan pada tahun 2005, dan Sekolah Menengah Atas (SMA) di SMAN 1 Sidomulyo Lampung Selatan, diselesaikan pada tahun 2008. Tahun 2008, penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA Unila melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Pada bulan Juli-Agustus 2011 Penulis melaksanakan KKN (Kuliah Kerja Nyata) di desa Kaliawi kecamatan Negeri Besar Way Kanan.
Motto
Kebanggaan yang terbesar adalah bukan tidak pernah gagal,
tetapi bangkit kembali setiap kali kita jatuh.
_Confusius_
Tak perlu iri atas kemampuan orang lain, jika mereka bisa, kamu
juga bisa. Jangan remehkan dirimu, kamu kuat dari yang kamu
bayangkan.
_Musrifatun _
Cintailah kekasihmu sekedarnya saja, siapa tahu nanti akan jadi
musuhmu. Dan bencilah musuhmu sekedarnya saja, siapa tahu
nanti akan jadi kekasihmu.
_Ali bin Abi Thalib_
Pendidikan bukanlah persiapan untuk hidup sebab pendidikan
yang sesungguhnya adalah kehidupan itu sendiri.
Kupersembahkan karya sederhana ini kepada :
ALLAH S.W.T
Kedua orang tuaku,
Bapak dan Ibu yang telah memberikan kasih dan sayang dan cintanya
dalam semangat dan doa-doa indah untukku
Kakak-kakakku Tersayang
Supratmi, Tatik Mujiati, dan Rimba Wati
Adik-adikku Tersayang
Agung Hadi Prayitno dan Nanda Hadi Permana
Keponakan-keponakanku tercinta
Maman Suryaman, Rendy Andreansyah, Puji Lestari, Septiani
Herawati
Seluruh sahabat terbaikku
Seseorang yang akan mendampingiku kelak
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah Puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul"Isoterm adsorpsi Ion Ni(II) dan Zn(II) Pada Malerial Alga Chaetocerosspyang Dimodifikasi Dengan Pelapisan Silika-Magnetit" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah
SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir
dikehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih
setulus-tulusnya kepada :
1. Ibu Dr. Buhani, M.Si., selaku pembimbing I penelitian yang telah banyak memberikan na saran, nasihat, ilmu,, motivasi, perhatian, serta kesabaran
2. Ibu Dian Septiani Pratama, M.Si., selaku pembimbing II penelitian yang telah
memberikan kritik, saran dan arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Bapak Prof. Suharso, Ph.D, selaku penguji penelitian dan Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung yang telah memberikan semangat, kritik, saran dan arahan kepada penulis sehingga
skripsi ini terselesaikan dengan baik.
4. Ibu Dra Fifi Martasih, M.S., selaku Pembimbing Akademik atas kesediaannya
utuk memberikan bimbingan, bantuan, nasehat dan informasi yang bermanfaat kepada penulis.
5. Bapak Andi Setiawan, Ph.D., selaku ketua Jurusan Kimia FMIPA Unila.
6. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
7. Kedua orang tuaku yang sangat aku cintai. Bapakku Buhadi yang selalu
menjadi Pahlawan dalam hidupku, menjadi penyemangatku dan selalu
menjadi inspirasiku. Terima kasih pak atas do’amu yang tak putus dan segala
bentuk pengorbananmu . Ibuku Sutiyem yang selalu setia menjadi sahabatku dalam suka dan duka. Ibu yang selalu ada saat aku kesusaahan, pemberi semangat saat aku terpuruk, pembangkit saat aku terjatuh. Ibu yang selalu
memberikan kasih sayang, sabar mengahadapi aku dan selalu mendoakanku setiap waktu. Terima kasih bu atas nasehat dan senyum manis yang selalu
8. Kedua adikku yang sangat aku sayangi, Agung hadi Prayitno dan Nanda Hadi
Permana, terima kasih ya Le atas doanya dan dukungan kalian. Kalian adalah adik-adik terbaiku. Sayangnya mbak ga akan pernah luntur buat kalian.
9. Ketiga Mbakku tersayang, Supratmi, Tatik Mujiati, dan Rimbawati yang
selalu mendo’akanku dan memberi dukungan untukku.Ingin rasanya
berkuumpul kembali seperti yang dulu. Terima kasih atas kasih sayang kalian
untukku.
10. Mas Edi Susworo, Terimakasih atasdo’a dan dukungan yang selelu diberikan
kepada ku sampai saat ini.
11. Keluarga Besar Bapak Sumardi dan Ibu Wasri yang rela membagi kasih
sayangnya untukku. Terimakasih atas perhatian dan do’a kalian semua yang
tak pernah putus untukku.
12. Sahabat-sahabat terbaikku yang selalu rela membagi waktunya untuk mendengarkan ceritaku. Santi, Ana Sri Lestari, S.Pt (Anul), Rati Pramita
Anggarani, S.Pt (Sumirat), Meta (memet), Wanti.
13. Teman-teman Wisma Dewi beserta pelengkapnya, Santi, Anul, Sumirat, Aan,
Wanti, Memet, Irke, Neka, Iya, Tata, Tory, Gigih, Bejo, Trisna, Nanda, Nando. Terima kasih atas segala bentuk perhatian kalian kawan.
14. Teman-teman seperjuangan penelitianku Albert Ferdinand P, S.Si, dan Dewa
Putu Suryani (Copet) terima kasih ya atas segala bantuan kalian dan semangat, sukses selalu ya.
Umam, Dwiyanto, Siska, Sherly, Mersi, Rina, Padli. Terimakasih telah
menjadi teman yang mau membantuku. Tetep semangat ya kawan.
16. Teman berburu kesempatan, Mbak Tice ’07, Shoffa, Puji, Adek, Ramdhan,
Siti, Eny, Leny. Semoga perburuan kita tidak sia-sia kawan
17. Teman-teman Kimia 2008 : Miftahudin Ramli, S.Si, Albert Ferdinand P, S.Si, Ani Sulistriani, S.Si, Sundari Riawati, S.Si, Eliana Sari, S.Si, Ni Putu Y, S.Si,
Dewi, Nita, Shoffa, Kiki, Vivi, Putri, Siti, Mifta, Wanti, Eny, Leny, Evi, Ayu, Novi, Adek, Candra, Retno, Dewa, Nuro, Rudi, Eko, Riki, Puji, Mychel,
Idrus, Raffel, Robby, Majid, Amin, Ricardo, Subari, Arif A, Tb, Ruzki, Ramdhan, Nanda, Via, Gareth, Mute, Dipa, Reina, Diana, Andre, Arif R, Eldes, kalian adalah teman-teman terhebat yang pernah aku dapatkan.
Terimakasih untuk pertemanan ini, kalian yang terbaik, aku sayang kalian kawan-kawanku.
18. Teman-teman KKN ku yang hebat-hebat. Aulya Adha Dini, S.Ked, Ari, Mia,
Faheri, Ferly, Dicky, Eren, Anggun, Adhel, Edi, Angga, Asrul. Kalian adalah keluarga baruku, terimakasih kawan atas kekeluargaan kalian.
19. Para Karyawan yang berpengaruh dalam penyusunan skripsi ini, Mas Nomo, Mbak Nora, Mbak Liza, Mbak Iin, Mbak Wiwit, Mbak Eka, Mbak Hade, Mbak Putri. Terimakasih atas bantuannya ya, semoga kalian sukses selalu.
20. Kakak-kakak Kimia 2005, 2006, 2007 dan adik-adik kimia 2009, 2010, 2011 dan 2012 FMIPA Unila terima kasih atas segala dukungannya.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan.
Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, 8 November 2012 Penulis
1
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Berkembangnya ilmu pengetahuan dan teknologi menimbulkan banyaknya metode untuk mengurangi konsentrasi ion logam berat, antara lain metode presipitasi,
koagulasi, kompleksasi, ekstraksi pelarut, pemisahan membran, pertukaran ion, dan adsorpsi. Dari beberapa metode tersebut, metode adsorpsi merupakan metode yang
paling banyak digunakan dalam menyerap ion logam dari larutan (Buhaniet al., 2010). Metode adsorpsi ini memiliki kelebihan dari metode yang lain karena prosesnya lebih sederhana, biayanya relatif murah, ramah lingkungan (Gupta and Bhattacharyya, 2006) dan tidak adanya efek samping zat beracun (Blaiset al., 2000).
Proses adsorpsi diharapkan dapat mengambil ion-ion logam berat dari larutan. Metode adsorpsi umumnya berdasarkan interaksi logam dengan gugus fungsional yang ada pada permukaan adsorben melalui interaksi pembentukan kompleks dan biasanya terjadi pada permukaan padatan yang kaya akan gugus fungsional seperti: -OH, -NH, -SH, dan –COOH (Stum and Morgan, 1996).
Beberapa material yang sering digunakan sebagai adsorben dalam penanganan limbah
2
(Seki and Suzuki, 1998) dan mikroalga (Cervanteset al., 2001). Alga merupakan suatu mikroorganisme yang dapat dimanfaatkan dalam sistem adsorpsi yang
digunakan dalam proses pengambilan logam-logam berat dari perairan seperti Timbal (Pb), Kromium (Cr), Tembaga (Cu), Cadmium (Cd), Nikel (Ni), dan Seng (Zn) yang
telah banyak dilakukan oleh peneliti terdahulu. Jenis-jenis alga tertentu telah ditemukan mempunyai kemampuan yang cukup tinggi untuk mengadsorpsi ion-ion
logam dalam keadaan hidup atau dalam sel mati (biomassa). Biomassa (sel mati) dari beberapa spesies alga digunakan untuk menghilangkan ion-ion logam dari lingkungan
perairan (Harris and Rammelow, 1990).
Untuk meningkatkan kestabilan biomassa alga sebagai adsorben, maka dilakukan imobilisasi dengan matriks pendukung seperti silika gel. Silika gel merupakan salah
satu adsorben yang paling sering digunakan dalam proses adsorpsi. Hal ini
disebabkan oleh mudahnya silika diproduksi dan sifat permukaan (struktur geometri pori dan sifat kimia pada permukaan) dan dapat dengan mudah dimodifikasi
(Fahmiati dkk., 2004). Silika gel memiliki gugus silanol dan gugus siloksan tanpa pemodifikasian terlebih dahulu namun dapat juga mengadsorpsi ion logam (Sriyanti dkk., 2001). Namun, silika gel diketahui memiliki kapasitas dan selektivitas adsorpsi yang rendah apabila diinteraksikan dengan ion logam berat (Nuzula, 2004 ; Airoldi and Ararki, 2001).
3
permukaan silika dengan magnetit secarain-situ. Lapisan permukaan silika diharapkan berfungsi sebagai perisai terhadap pengaruh lingkungan, sehingga magnetit lebih stabil. Selain itu, pelapisan nanopartikel magnetit dengan silika menjadi salah satu cara pendekatan yang menjanjikan dan penting dalam
perkembangan teknologi nanopartikel magnetit. Pertama, karena silika yang melapisi permukaan nanopartikel magnetit menghalangi gaya tarik-menarik magnetit dipolar
antarpartikel, sehingga terbentuk partikel yang mudah terdispersi di dalam media cair dan terlindungi dari kerusakan dalam suasana asam. Kedua, terdapatnya gugus silanol dalam jumlah besar pada lapisan silika mempermudah aktivasi magnetit.
Gugus silanol menjadi tempat berikatnya berbagai gugus fungsi seperti karbonil, biotin, avidin, dan molekul lainnya sehingga memudahkan aplikasi magnetit terutama
di bidang biomedis. Di samping itu lapisan silika memberikan sifatinertyang berguna bagi aplikasi pada sistem biologis (Pankhurstet al., 2003; Deng, 2005). Metode ini merupakan salah satu teknik yang dapat mengatasi adanya gumpalan
padatan tersuspensi dalam limbah industri yang diolah (Jeon, 2011; Penget al., 2010; Linet al., 2011).
Pada penelitian ini akan dilakukan modifikasi biomassa alga dengan silika gel sebagai
matriks yang telah dilapisi magnetit. Penggabungan biomassa alga dengan matrik silika melalui teknik sol-gel diharapkan dapat mempertahankan keaktifan
gugus-gugus fungsi yang terdapat pada biomassa sehingga lebih efektif dalam
4
yang bersifat asam lunak, sedangkan Ni bersifat asam madya. Logam Ni dan Zn pada
konsentrasi yang tinggi dapat bersifat toksik dan cenderung terakumulasi pada organisme (Akotoet al., 2008). Akumulasi tersebut dapat berdampak pada rantai makanan sehingga mempengaruhi kesehatan manusia (El-Kammaret al., 2009).
Material hasil modifikasi silika alga dengan pelapisan silika magnetit dikarakterisasi menggunakan spektrofotometer inframerah untuk mengetahui perubahan gugus
fungsi. Difraktometer Sinar-X untuk mengetahui struktur kristal magnetit, sedangkan percobaan adsorpsi dengan metode bacth, kadar ion logam dianalisis dengan
Spektrofotometer Serapan Atom.
B. Tujuan Penelitian
Berdasarkan latar belakang masalah yang telah dipaparkan sebelumnya, tujuan dari penelitian ini yaitu:
1. Mempelajari cara sintesisdan karakterisasi material alga, alga-silika, dan alga yang dilapisi silika-magnetit.
2. Menentukan laju dan isoterm adsorpsi ion Ni(II) dan Zn(II) pada material alga-silika, dan alga-silika-magnetit.
C. Manfaat Penelitian
5
II. TINJAUAN PUSTAKA
A. Biomassa Alga
Alga merupakan mikroorganisme yang mendominasi lingkungan akuatik, bersel
tunggal, berkoloni, dan ada juga yang multi sel. Alga dapat dimanfaatkan sebagai biomassa, hasil-hasil peneliti terdahulu menyatakan bahwa gugus-gugus fungsional yang terdapat dalam biomassa berperan dalam adsorpsi logam. Berbagai jenis alga
terdapat di lautan, antara lain alga hijau, alga coklat dan alga merah. Ditinjau secara biologi, alga merupakan tumbuhan yang berklorofil, terdiri dari satu atau banyak sel
dan berbentuk koloni. Alga memiliki banyak kandungan didalamnya seperti bahan-bahan organik yakni polisakarida, hormon, vitamin, mineral dan juga senyawa bioaktif (Setiawan, 2004). Chaetocerossp merupakan salah satu jenis alga yang termasuk spesies alga coklat (phaeophyceae). Warna alga coklat disebabkan adanya pigmen coklat (fukosantin), yang secara dominan menyelubungi warna hijau dari
6
Gugus fungsi yang terdapat dalam alga mampu melakukan pengikatan dengan ion
logam. Gugus fungsi tersebut terutama adalah gugus karboksil, hidroksil, sulfudril, amino, iomodazol, sulfat, dan sulfonat yang terdapat didalam dinding sel dalam
sitoplasma (Putra, 2006). Adsorpsi ion logam terjadi karena terdapatnya berbagai jenis gugus fungsi yang terdapat pada sel hidup atau mati yaitu gugus karboksil, hidroksil, dan sulfat. Akan tetapi kemampuan alga dalam menyerap ion-ion logam
sangat dibatasi oleh beberapa kelemahan seperti ukurannya yang sangat kecil, berat jenisnya yang rendah dan mudah rusak karena terdegradasi oleh mikroorganisme lain.
Untuk mengatasi kelemahan tersebut berbagai upaya dilakukan, diantaranya dengan mengimmobilisasi biomassanya. Immobilisasi biomassa dapat dilakukan dengan mengunakan silika gel (Harris and Ramelow,1990).
Syarat suatu bahan sebagai matrik pendukung antara lain (1) mempunyai sisi aktif terutama mengandung gugus aktif yang reaktif, (2) mempunyai permukaan yang luas, (3) memiliki kapasitas pengikatan yang tinggi, (4) mempunyai daya tahan yang baik
terhadap perubahan-perubahan pelarut kimia. Beberapa matrik pendukung yang dapat digunakan sebagai pengimmobilisasi antara lain: poli etil akrilat, etilen glikol,
dimetakrilat (Latifah, 1998) dan silika gel (Buhani, 2003). Menurut Lanet al., 1998, peningkatan adsorpsi biomassa alga dengan mengimobilisasi melalui enkapsulasi silika gel dapat mempertahankan dan meningkatkan keefektifan gugus fungsi,
7
Dalam pengolahan limbah industri yang mengandung logam berat, pemanfaatan alga
baik dalam bentuk biomassa bebas maupun yang terimmobilisasi sebagai biosorben tidak diragukan lagi, karena metode ini sangat efisien, biaya relatif murah, hasil
samping tidak berbahaya, biosorben dapat diregenerasi, dan ion logam yang teradsorpsi dapatdi-recoverykembali (Volesky, 1998).
B. Silika Gel
Silika gel merupakan silika amorf yang tersusun dari tetrahedral SiO4yang tersusun
secara tidak beraturan dan beragregasi membentuk kerangka tiga dimensi yang
terbentuk karena kondensasi asam orthosilikat. Struktur satuan mineral silika pada dasarnya mengandung kation Si4+yang terkoordinasi secara tetrahedral dengan anion
O2-. Rumus kimia silika gel secara umum adalah SiO2•xH2O (Oscik, 1982).
Silika gel memiliki sifat permukaan yang kompleks, gugus hidroksil yang tersebar tak
berurutan dan masing-masing gugus terhidrasi denga satu atau beberapa molekul air. Meskipun gugus siloksan juga terdapat dipermukaan silika gel, namun adsorpsi
spesifik pada material ini lebih tergantung pada gugus hidroksil (Oscik, 1982).
Kemampuan adsorpsi silika gel dipengaruhi oleh adanya situs aktif pada
permukaannya yakni berupa gugus silanol (Si-OH) dan gugus siloksan (Si-O-Si). Sifat adsorpsi silika gel ditentukan oleh orientasi dari ujung tempat gugus hidroksi yang berkombinasi (Hartono dkk., 2002).
Pada kehidupan kita saat ini, silika gel digunakan sebagai matriks pendukung. Tong
8
dengan ukuran-ukuran mesh tertentu dan berfungsi sebagai adsorben yang baik untuk
metode kolom serta penggunaan kembali setelah disimpan dalam keadaan kering selama beberapa tahun. Silika banyak digunakan karena memiliki beberapa kelebihan yaitu sangat inert, hidrofilik dan biaya sintesis rendah. Di samping itu, bahan ini mempunyai kestabilan termal dan mekanik cukup tinggi, relatif tidak mengembang dalam pelarut organik jika dibandingkan dengan padatan polimer organik (Ghoulet al., 1996).
Adapun kelemahan dari penggunaan silika gel adalah rendahnya efektivitas dan selektivitas permukaan dalam berinteraksi dengan ion logam berat sehingga silika gel tidak mampu berfungsi sebagai adsorben yang efektif yang ada hanya berupa gugus silanol (Si-OH) dan siloksan (Si-O-Si). Akan tetapi kekurangan ini dapat diatasi dengan memodifikasi permukaan dengan menggunakan situs aktif yang sesuai untuk mengadsorpsi ion logam berat yang dikehendaki (Nuzula, 2004).
C. Magnetit (Fe3O4)
Magnetit atau oksida besi hitam merupakan oksida besi yang paling kuat sifat
magnetitisnya (Teja and Koh, 2008). Magnetit yang berukuran nano banyak
dimanfaatkan pada proses-proses industri (misalnya sebagai tinta cetak, pigmen pada kosmetik) dan pada penanganan masalah-masalah lingkungan (misalnya sebagai
9
kimia Fe3O4dan mempunyai struktur spinel dengan sel unit kubik yang terdiri dari 32
ion oksigen, celah-celahnya ditempati oleh ion Fe2+dan Fe3+. Nanopartikel magnetit sangat intensif dikembangkan karena sifatnya yang menarik dalam aplikasinya di
berbagai bidang, seperti fluida dan gel magnetit, katalis, pigmen pewarna, dan
diagnosa medik. Beberapa sifat nanopartikel magnetit ini bergantung pada ukurannya. Magnetit ini akan bersifat superparamagnetitik ketika ukuran suatu partikel
magnetitisnya di bawah 10 nm pada suhu ruang, artinya bahwa energi termal dapat menghalangi anisotropi energi penghalang dari sebuah nanopartikel tunggal. Karena
itu, sintesis nanopartikel yang seragam dengan mengatur ukurannya menjadi salah satu kunci masalah dalam ruang lingkup sintesis ini (Hook and Hall, 1991).
D. Logam Berat
Logam berat merupakan elemen yang berbahaya di permukaan bumi. Logam berat merupakan salah satu sumber polusi lingkungan, dimana logam berat dapat ditransfer
dalam jangkauan yang sangat jauh di lingkungan, selanjutnya berpotensi mengganggu kehidupan biota lingkungan dan ahirnya berpengaruh terhadap kesehatan manusia
walaupun dalam jangka waktu yang lama dan jauh dari sumber polusi utamanya (Suhendrayatna, 2001). Beberapa faktor yang mempengaruhi aktivitas keracunan setiap jenis logam antara lain: bentuk senyawa dari logam tersebut, daya kelarutan
10
Adapun sifat-sifat logam berat menurut Sasongko (2002) yaitu:
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaannya secara alami sulit terurai atau berubah.
2. Dapat terakumulasi dalam organisme termasuk kerang dan ikan, yang nantinya dapat membahayakan kesehatan manusia yang mengkonsumsinya.
3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi dari
konsentrasi logam dalam air.
1. Logam Seng (Zn)
Seng adalah unsur kimia dengan lambang Zn, dengan nomor atom 30 dan massa relatif 65,39. Seng tidak diperoleh bebas di alam, melainkan dalam bentuk terikat. Mineral yang mengandung seng di alam bebas antara lain kelamin, franklinit,
smithsonit, willenit, dan zinkit. Seng merupakan logam putih kebiruan dan logam ini cukup reaktif. Seng melebur pada 410°C dan mendidih pada 906°C (Cotton dan Wilkinson, 1989). Seng dilepaskan ke lingkungan oleh proses alam, namun sebagian besar berasal dari kegiatan manusia seperti pertambangan, produksi baja, pembakaran
batu bara, dan pembakaran sampah. Sebagian besar seng di dalam tanah tetap terikat pada partikel tanah. Toksisitas akut yang ditimbulkan oleh seng adalah kekeringan tenggorokan, batuk, kelemahan, menggigil, demam, mual dan muntah (Widowati
11
2. Logam Nikel (Ni)
Nikel adalah logam putih perak yang keras, bersifat liat, dapat ditempa dan sangat kukuh. Logam ini melebur pada 1455oC dan bersifat sedikit magnetitis. Dalam tabel
periodik unsur kimia, Ni menempati posisi dengan nomor atom (NA) 28 dan mempunyai bobot atau berat atom (BA) 58,71 (Svehla, 1990). Unsur Ni
berhubungan dengan batuan basa yang disebut norit. Ni ditemukan dalam mineral
pentlandit, dalam bentuk lempeng-lempeng halus dan butiran kecil bersama pyrhotin dan kalkopirit. Ni biasanya terdapat dalam tanah yang terletak di atas batuan basa
(Cotton dan Wilkinson, 1989). Ni banyak digunakan dalam industri pembuatan baterai listrik, penyepuhan listrik, kontak listrik dan alat sejenis serta katalis. Ni juga dilepaskan ketika terjadi gasifikasi batu bara. Peleburan dan penggunaan dalam
industri cenderung meningkatkan kadarnya dalam lingkungan. Ni dapat bersifat sebagai karsinogen. Kanker hidung merupakan jenis neoplasma utama, akan tetapi Ni juga menginduksi kanker paru-paru, laring, lambung, dan ginjal. Logam ini dapat
menimbulkan hipersensitivitas terhadap kulit. Reaksi ini biasanya muncul setelah kontak dengan barang logam yang mengandung Ni, misalnya uang logam dan
perhiasan (Lu, 1995).
E. Proses Sol Gel
Sol-gel adalah suatu suspensi koloid dari partikel silika yang digelkan ke bentuk padatan. Sol adalah suspensi dari partikel koloid pada suatu cairan atau molekul
12
Proses sol-gel berlangsung melalui langkah-langkah sebagai berikut : 1. Hidrolisis dan kondensasi
2. Gelation(transisi sol-gel)
3. Aging(pertumbuhan gel)
4. Drying(pengeringan)
Melalui polimerisasi kondensasi akan terbentuk dimer, trimer, dan seterusnya sehingga membentuk bola-bola polimer. Sampai pada ukuran tertentu (diameter sekitar 1,5 nm) dan disebut sebagai partikel silika primer. Gugus silanol permukaan partikel bola polimer yang berdekatan akan mengalami kondensasi disertai pelepasan air sampai terbentuk partikel sekunder dengan diameter sekitar 4,5 nm. Pada tahap ini larutan sudah mulai menjadi gel ditandai dengan bertambahnya viskositas. Gel yang dihasillkan masih sangat lunak dan tidak kaku yang disebutalkogel(Farook and
Ravendran, 2000).
Tahap selanjutnya adalah proses pembentukan gel. Pada tahap ini, kondensasi antara bola-bola polimer terus berlangsung membentuk ikatan siloksan menyebabkan menurunnya jari-jari partikel sekunder dari 4,5 nm menjadi 4 nm dan akan teramati penyusutanalkogelyang diikuti dengan berlangsungnya eliminasi larutan garam
(Jamarun, 2000).
Tahap akhir pembentukan silika gel adalahxerogelyang merupakan fasa silika yang
13
SiO2•xH2O (Enymiaet al., 1998). Produk akhir yang dihasilkan berupa bahan amorf
dan keras yang disebut silika gel kering (Kalapathyet al., 2000).
Tetraetilortosilikat (TEOS) memiliki rumus kimia Si(OC2H5)4. Pada proses sol-gel,
bahan dasar yang digunakan untuk membuat sol dapat berupa logam alkoksida sepetri TEOS. TEOS mudah terhidrolisis oleh air dan mudah digantikan oleh gugus OH. Selanjutnya silanol (SI-OH) direaksikan antara keduanya atau direaksikan dengan
gugus alkoksida non-hidrolisis untuk membentuk ikatan siloksan (Si-O-Si) dan mulailah terbentuk jaringan silika.
Gambar 1.Struktur TEOS (Brinker and Scherer, 1990)
Reaksi pada proses sol-gel dapat dilihat pada persamaan berikut:
• Reaksi Hidrolisis
14
• Reaksi Polikondensasi
≡Si-OH + HO-Si→ ≡Si-O-Si≡ + H2O
≡Si-OH + RO-Si→ ≡Si-O-Si≡ + ROH (Prassas, 2002).
Jaringan silika amorf 3 dimensi (3D) dapat terbentuk pada temperatur ruang. Viskositas secara kontinu meningkat dimana pada saat itu larutan akan menjadi gel.
Parameter yang berpengaruh pada reaksi adalah pH, kandungan air, konsentrasi, temperatur dan kondisi pengeringan (Prassas, 2002).
F. Adsorpsi
Adsorpsi adalah akumulasi partikel pada permukaan. Zat yang mengadsorpsi disebut adsorben sedangkan yang teradsorpsi disebut adsorbat. Adsorpsi yang terjadi antara
adsorben dengan adsorbat dapat dibedakan dengan adsorpsi fisika (physisorption)dan adsorpsi kimia (chemsisorption). Jika adsorbat dan permukaan adsorben berinteraksi
hanya dengan gaya van der walls, maka yang terjadi adalah adsorpsi fisika. Molekul yang teradsorpsi terikat secara lemah pada permukaan dan panas adsorpsi rendah sehingga naiknya temperatur ditandai dengan turunnya jumlah adsorpsi. Dalam
adsorpsi kimia partikel molekulnya pada permukaan dan membentuk ikatan kimia kovalen (Atkins, 1997).
Adsorpsi merupakan fenomena yang terjadi pada permukaan. Adsorpsi secara umum
didefinisikan sebagai akumulasi sejumlah molekul, ion atau atom yang terjadi pada batas antara dua fasa. Adsorpsi menyangkut akumulasi atau pemutusan substansi
15
yang menyerap disebut adsorben dan fasa yang terserap disebut adsorbat.
Kebanyakan adsorben adalah bahan-bahan yang memiliki pori karena berlangsung terutama pada dinding-dinding pori atau letak-letak tertentu didalam adsorben
(Alberty and Daniel, 1987). Menurut Oscik (1982), adsorpsi merupakan proses akumulasi adsorbat pada permukaan adsorben yang disebabkan oleh gaya tarik antar molekul atau suatu akibat dari medan gaya pada permukaan padatan (adsorben) yang
menarik molekul-molekul gas, uap atau cairan.
Gaya tarik-menarik dari suatu padatan dibedakan menjadi dua jenis gaya, yaitu gaya fisika dan gaya kimia yang masing-masing menghasilkan adsorpsi fisika
(physisorption)dan adsorpsi kimia(chemisorption)(Oscik, 1982). Adsorpsi fisika adalah proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya van der Waals, sedangkan adsorpsi kimia terjadi jika
interaksi adsorben dan adsorbat melibatkan pembentukan ikatan kimia. Dalam proses adsorpsi melibatkan berbagai macam gaya yakni gaya van der Waals, gaya
elektrostatik, ikatan hidrogen serta ikatan kovalen (Martell and Hancock, 1996).
16
Kelarutan adsorbat dalam pelarut umumnya substansi hidrofilik sukar teradsorpsi dalam larutan encer (Shaw, 1983).
1. Kinetika adsorpsi
Kinetika kimia mencakup suatu pembahasan tentang kecepatan (laju) reaksi dan bagaimana proses reaksi berlangsung. Laju reaksi merupakan laju yang diperoleh dari perubahan konsentrasi reaktan dalam suatu satuan waktu pada persamaan reaksi kimia yang mengalami kesetimbangan. Laju reaksi bergantung pada konsentrasi reaktan, tekanan, temperatur dan pengaruh katalis (Oxtoby, 1990).
Analisa kinetika didasarkan pada kinetika reaksi terutama pseudo orde pertama atau mekanisme pseudo pertama bertingkat. Untuk meneliti mekanisme adsorpsi, konstanta kecepatan reaksi sorpsi kimia untuk ion-ion logam, digunakan persamaan sistem pseudo orde pertama oleh Lagergren dan sistem pseudo orde kedua (Buhani et al., 2010). Persamaan pseudo orde satu adalah persamaan yang biasa digunakan
untuk menggambarkan adsorpsi dan ditentukan dengan persamaan berikut:
)
Dimana qeadalah jumlah ion logam yang teradsorpsi pada keadaan setimbang
(mg g-1), qtadalah jumlah ion logam yang teradsorpsi pada waktu tertentu (mg g-1), t
17
Persamaan dapat diintegrasi dengan memakai kondisi-kondisi batas qt= 0 pada t = 0
dan qt=qtpada t=t, persamaan menjadi:
t
Model persamaan pseudo orde dua dapat dinyatakan dalam bentuk :
2
Dengan qeadalah jumlah ion logam yang teradsorpsi pada keadaan setimbang
(mg g-1), qtadalah jumlah ion logam yang teradsorpsi pada waktu tertentu (mg g-1), k2
adalah konstanta laju pseudo orde kedua (dalam g mmol-1menit-1). Setelah integrasi dan penggunaan kondisi-kondisi batas qt=0 pada t =0 dan qt=qtpada t=t, persamaan
linier dapat diperoleh sebagai berikut :
e
Laju penyerapan awal, h (mg g-1menit) sedangkan t = 0 dapat didefinisikan sebagai berikut :
(5) Laju adsorpsi awal (h), kapasitas adsorpsi kesetimbangan (qe) dan konstanta laju
pseudo orde dua (k2) dapat ditentukan secara eksperimen dari slop dan intersep plot
18
2. Kapasitas adsorpsi
Kesetimbangan adsorpsi yaitu suatu penjabaran secara matematika suatu kondisi isotermal yang khusus untuk setiap sorbat/sorben. Jadi untuk masing-masing bahan penyerap (adsorben) dan bahan yang diserap (adsorbat) memiliki kesetimbangan adsorpsi tersendiri dimana jumlah zat yang diserap merupakan fungsi konsentrasi pada temperatur tetap (Husin and Rosnelly, 2005).
Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
a. Model isoterm adsorpsi Langmuir
Model kinetika adsorpsi Langmuir ini berdasarkan pada asumsi sebagai berikut: laju adsorpsi akan bergantung pada faktor ukuran dan struktur molekul adsorbat, sifat pelarut dan porositas adsorben, situs pada permukaan yang homogen dan adsorpsi terjadi secaramonolayer. Proses adsorpsi heterogen memiliki dua tahap, yaitu: (a)
perpindahan adsorbat dari fasa larutan ke permukaan adsorben dan (b) adsorpsi pada permukaan adsorben. Tahap pertama akan bergantung pada sifat pelarut dan adsorbat yang terkontrol (Oscik, 1982).
19
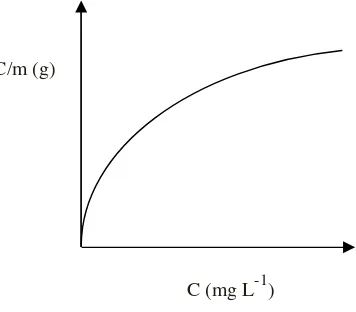
Persamaan isoterm adsorpsi Langmuir tersebut ditulis dalam bentuk persamaan linier yaitu sebagai berikut:
(6)
Dengan C adalah konsentrasi kesetimbangan (mg L-1), m adalah jumlah logam yang teradsorpsi per gram adsorben pada konsentrasi C (mmol g-1),badalah jumlah ion
logam yang teradsorpsi saat keadaan jenuh (kapasitas adsorpsi) (mg g-1) danK adalah konstanta kesetimbangan adsorpsi (L mol-1). Dari kurva linier hubungan antara C/m versus C maka dapat ditentukan nilai b dari kemiringan (slop) dan K dari intersep kurva (Oscik, 1982).
Adapun grafik isoterm adsorpsi Langmuir diperlihatkan pada Gambar 2.
Gambar 2. Isoterm adsorpsi Langmuir (Husin and Rosnelly, 2005)
Berdasarkan harga energi adsorpsinya, fenomena adsorpsi diperkirakan terjadi akibat adanya gaya-gaya yang tidak setimbang pada batas antar permukaan, sehingga
1
bK
C m
C
b
= +
C/m (g)
20
mengakibatkan perubahan jumlah molekul, atom atau ion. Proses adsorpsi melibatkan berbagai gaya yaitu: gaya Van der Waals, ikatan hidrogen, gaya
elektrostatik (ikatan ionik), dan ikatan kovalen koordinasi, maka dapat diperkirakan jenis adsorpsi yang terjadi (Adamson and Gast, 1990). Adsorpsi fisika (fisisorpsi) melibatkan gaya antarmolekular diantaranya gaya Van der Waals dan ikatan hidrogen. Sedangkan adsorpsi kimia (kemisorpsi) melibatkan ikatan kovalen
koordinasi akibat pemakaian bersama pasangan elektron oleh adsorbat dan adsorben (Oscik, 1982).
b. Model isoterm adsorpsi Freundlich
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian
permukaan adalah heterogen dimana tidak semua permukaan adsorben mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan adsorbat yang
terbentuk pada permukaan adsorben adalahmultilayer. Hal tersebut berkaitan dengan
ciri-ciri dari adsorpsi secara fisika dimana adsorpsi dapat terjadi pada banyak lapisan (multilayer) (Husin and Rosnelly, 2005).
Adapun bentuk persamaan linier Freundlich adalah sebagai berikut :
(7)
Dengan qeadalah jumlah ion logam yang teradsorpsi per gram adsorben (mmol g-1),
Ceadalah konsentrasi setimbang adsorbat dalam fase larutan (mg L-1),kfadalah
21
faktor kapasitas Freundlich (mol g-1), dan n adalah faktor intensitas Freundlich
(Rousseau, 1987).
G. Karakterisasi
1. Spektrofotometer Inframerah (IR)
Spektrofotometri IR merupakan suatu metode yang mengamati interaksi molekul
dengan radiasi elektromagnetitik yang berada pada daerah panjang gelombang 0,75– 1.000 μ m atau pada bilangan gelombang 13.000–10 cm-1dengan menggunakan suatu alat yaitu Spektrofotometer IR.
Konsep radiasi inframerah adalah mendispersikan radiasi matahari dengan prisma. Ternyata pada daerah sesudah sinar merah menunjukkan adanya kenaikan temperatur
tertinggi yang berarti pada daerah panjang gelombang radiasi tersebut banyak kalori. 1) Absorpsi terhadap radiasi inframerah dapat menyebabkan eksitasi molekul ke
tingkat energi vibrasi yang lebih tinggi dan besarnya absorpsi adalah
terkuantitasi
2) Vibrasi yang normal mempunyai frekuensi sama dengan frekuensi radiasi elektromagnetitik yang diserap
3) Proses absorpsi (spektra IR) hanya dapat terjadi apabila terdapat perubahan baik nilai maupun arah dari momen dua kutub ikatan
22
diterangkan dengan menggunakan molekul sederhana yang terdiri dari dua atom
dengan ikatan kovalen (Khopkar, 2003).
2. Spektrofotometer Serapan Atom (SSA)
Dalam proses adsorpsi, keberhasilan pembuatan adsorben tercetak ion dapat dilihat menggunakan SSA. Adsorben yang telah tercetak ion diharapkan mengandung konsentrasi ion logam yang kecil. SSA juga dapat digunakan untuk mengetahui kadar ion logam yang teradsorpsi maupun yang terdapat dalam adsorben. Ion logam yang teradsorpsi dihitung secara kuantitatif berdasarkan selisih konsentrasi ion logam sebelum dan sesudah adsorpsi (Yuliasari, 2003).
Metode SSA berprinsip pada absorbsi cahaya oleh atom. Atom-atom menyerap
cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh energi yang lebih banyak, suatu atom dinaikkan tingkat energinya dari
keadaan dasar ke tingkat eksitasi. Kita dapat memilih di antara panjang gelombang ini yang menghasilkan garis spektrum yang tajam dan dengan intensitas maksimum. Prinsip dasar SSA adalah sebagai berikut:
1. Pada SSA terjadi penyerapan sumber radiasi (sinar tampak atau ultraviolet) oleh atom-atom netral dalam keadaan gas yang berada dalam nyala.
2. Untuk jadi atom netral dalam keadaan gas butuh perlakuan khusus dipanaskan pada suhu tinggi.
23
Pada dasarnya hubungan antara absorpsi atom dengan konsentrasi di dalam metode SSA dapat dinyatakan dengan hukum Lambert-Beer, yaitu secara matematik persamaannya adalah sebagai berikut:
Keterangan:
Io : Interaksi cahaya yang datang (mula-mula)
I : Interaksi cahaya yang ditransmisikan
a : Absorpsotivitas, yang besarnya sama untuk sistem atau larutan yang sama (g/L)
b : Panjang jalan cahaya atau tebalnya medium penyerap yang besarnya tetap untuk alat yang sama (cm)
c : Konsentrasi atom yang mengabsorpsi A : Absorbansi = log Io/I
Dari persamaan di atas, nilai absorbansi sebanding dengan konsentrasi untuk panjang
jalan penyerapan dan panjang gelombang tertentu. Ada dua cara untuk mengetahui konsentrasi cuplikan yang telah diketahui nilai absorbansinya yaitu:
1. Cara deret waktu dengan membandingkan nilai absorbansi terhadap Kurva
kalibrasi dari standar-standar yang diketahui.
24
perpotongan grafik terhadap sumbu dengan konsentrasi dari data absorbansi (Ismono, 1984).
3. Spektrofotometer Difraksi Sinar-X (XRD)
Karakterisasi struktur kristal dan fasa kristalin dapat ditentukan dengan alat
difraktometer sinar-X (XRD). Sinar-X terjadi bila suatu sasaran logam ditumbuki oleh berkas elektron yang berenergi tinggi, kemudian elektron-elektron tersebut mengalami pengurangan kecepatan dengan cepat dan energi kinetik elektron yang
menumbuk sebagian besar diubah menjadi panas, dan kurang dari 1 persen diubah menjadi sinar-X atau disebut dengan foton.
Analisis menggunakan alat difraktometer sinar-X didasarkan pada pola difraksi dari
paduan atau senyawa yang dihasilkan oleh proses difraksi, ukuran panjang
gelombang sinar-X harus tidak berbeda jauh dengan jarak antar atom di dalam kristal, sehingga pola berulang dari kisi kristal akan berfungsi seolah-olah seperti kisi
difraksi untuk panjang gelombang sinar-X.
Sinar-X yang didifraksikan oleh setiap kristal mineral bersifat spesifik, dan
bergantung bagaimana atom menyusun kisi kristal mineral tersebut serta bagaimana atom sejenis tersusun. Ketika sinar-X menumbuk sampel dan terdifraksi, maka jarak
antar atom pada lapisan permukaan kristal dapat ditentukan berdasarkan hukum Bragg, yaitu:
25
Dimana n adalah bilangan bulat dan merupakan tingkat difraksi sinar-X,λadalah panjang gelombang yang dihasilkan oleh katoda yang digunakan, seperti Cu Kα=
1,5414 Å, sedangkan d merupakan jarak antara batas lapisan permukaan, danθ
26
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan April sampai Agustus 2012 di Laboratorium Kimia Anorganik dan Laboratorium Biokimia FMIPA Universitas Lampung. Pengambilan algaChaetocerossp di Balai Budidaya Laut (BBL) Lampung.
B. Alat dan Bahan
Peralatan yang digunakan pada penelitian ini antara lain alat-alat gelas
laboratorium, gelas plastik, pengaduk magnetit, termometer, oven, pH indikator universal,shaker, kertas saringWhatmanNo.42, spektrofotometerIR, SSA, dan
XRD.
Bahan-bahan digunakan pada penelitian ini adalah TEOS, biomassa alga
Chaetocerossp,etanol p.a merck, etanol teknis, akuades, NH3, HCl,
27
C. Prosedur Penelitian
1. Penyiapan Biomassa Alga
Biomassa alga diperoleh dari isolasi algaChaetocerossp yang dihasilkan dari pembudidayaan dalam skala laboratorium di Balai Budidaya Laut (BBL)
Lampung. Biomassa alga yang dihasilkan dalam bentuk nata, dinetralkan dengan menggunakan aquades hingga pH≈7, dan dikeringkan pada suhu ruang selama
3-4 hari. Kemudian alga yang sudah kering digerus sampai halus dan dioven pada suhu 40ºC selama 2-3 jam hingga berat konstan.
2. Sintesis Alga-Silika (AS)
Larutan A, sebanyak 1:1 larutan TEOS (4 mL) dan akuades (4 mL) dicampur dalam wadah plastik, kemudian ditambahkan HCl 0,1M hingga pH 2, diaduk dengan pengaduk magnet sampai larutan tersebut homogen. Larutan B, sebanyak 4 mL etanol dengan variasi biomassa alga yaitu 0,4 ; 0,6 ; dan 0,8 gramdiaduk hingga terbentuk gel. Gel basah yang terbentuk didiamkan selama 24 jam kemudian dicuci dengan etanol dan akuades sampai pH≈7dikeringkan menggunakan oven dengan suhu 40oC sampai berat konstan. Material yang dihasilkan digunakan untuk uji adsorpsi.
3. Sintesis Alga-Silika-Magnetit (AS-magnetit)
Larutan A, sebanyak 1:1 larutan TEOS (4 mL) dan akuades (4 mL) ditambahkan magnetit dengan variasi konsentrasi yaitu: 50, 100, dan 200 mg, lalu ditambahkan
beberapa tetes HCl 0,1 M hingga pH 2. Diaduk dengan pengaduk magnet sampai larutan tersebut homogen. Larutan B, terdiri dari 4 mL etanol ditambah dengan
28
larutan dicampur hingga terbentuk gel. Gel basah yang terbentuk didiamkan
selama 24 jam kemudian dicuci dengan etanol dan akuades sampai pH≈7, dikeringkan menggunakan oven dengan suhu 40oC sampai berat konstan
selanjutnya digerus dengan ukuran 100-200 mesh. Material yang dihasilkan digunakan untuk uji adsorpsi.
4. Karakterisasi Material
Untuk mengetahui perubahan gugus-gugus fungsional utama dalam material alga, AS dan AS-magnetit dilakukan analisis dengan spektrofotometerIR. Untuk
mengetahui struktur kristal dari magnetit, silika-magnetit, AS, dan AS-magnetit dilakukan karakterisasi menggunakan spektrofotometer XRD. Untuk menentukan kadar ion logam yang teradsorpsi pada material AS, dan AS-magnetit dilakukan analisis menggunakanspektrofotometer SSA.
5. Uji Adsorpsi a. Waktu Interaksi
29
b. Isoterm Adsorpsi
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan maka dapat disimpulkan bahwa: 1. Laju adsorpsi ion Ni(II) dan Zn(II) oleh AS, dan AS-magnetit cenderung
mengikuti pseudo orde dua dengan nilaik2masing-masing 0,473 dan 0,838 g
mmol-1menit-1untuk logam Ni(II) serta 0,166 dan 0,545 g mmol-1menit-1 untuk logam Zn(II)
2. Isoterm adsorpsi ion Ni(II) dan Zn(II) olehAS dan AS-magnetit cenderung mengikuti model isoterm Freundlich dengan nilaiKfmasing-masing 1.252 dan
1,258 mol g-1untuk ion Ni(II) serta 0,685 dan 0,717 mol g-1untuk Zn(II).
B. Saran
Pada penelitian lebih lanjut disarankan:
1. Variasi konsentrasi ion Ni(II) dan Zn(II) terhadap AS-magnetit ditambahkan karena ion logam yang teradsorpsi oleh optimumnya.
2. Perlu dilakukan pengujian lebih lanjut terhadap adsorpsi ion Ni(II) dan Zn(II) oleh AS, dan AS-magnetit menggunakan metode kontinyu sehingga dapat