PENDAHULUAN
Xilitol (disebut juga sebagai gula alkohol atau polialkohol) merupakan pemanis alami yang terdapat pada sayuran dan buah-buahan seperti wortel, kembang kol selada, bawang, pisang, strowberi, raspberry, plum kuning, dan apel. Xilitol juga diproduksi dalam tubuh manusia sebanyak 15 g/hari sebagai senyawa antara (intermediate) dalam metabolisme glukosa (Jaffe 1978; Saha 1997; Kiet et al. 2006). Xilitol mempunyai tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya (40%) lebih rendah dari kelompok karbohidrat lainnya. Xilitol merupakan gula berkarbon 5 yang tidak dapat difermentasi oleh bakteri Streptococcus mutans penyebab kerusakan gigi, sehingga bersifat nonkariogenik yang aman untuk kesehatan gigi (Uhari et al. 1996; Sampaio et al. 2003).
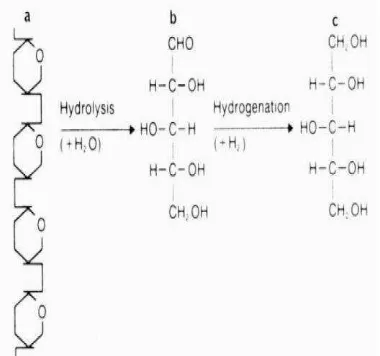
Secara ekonomi xilitol mempunyai harga tinggi yaitu: 5-7$ US per pon, dengan pangsa pasar yang luas yaitu dapat diaplikasikan di bidang kesehatan dan industri bahan makanan, akan tetapi ketersediaan xilitol dalam perdagangan masih rendah. Xilitol tersebar sangat luas di alam dan dapat diperoleh dengan cara ekstraksi langsung melalui sumber yang mengandung xilitol seperti buah-buahan dan sayuran. Namun kandungan xilitolnya rendah, yaitu kurang dari 1% sehingga tidak praktis dan ekonomis untuk memproduksi xilitol melalui metode tersebut (Vandeska et al. 1996; Sampaio et al. 2003). Produksi xilitol secara komersial dilakukan melalui proses hidrogenasi xilosa (C5H10O5) pada suhu dan tekanan yang tinggi (suhu 80-140oC, tekanan 50 atmosfer) dengan bantuan katalis. Pembuatan xilitol melalui proses ini memerlukan biaya yang cukup tinggi karena selain diperlukan energi yang tinggi juga bahan baku utamanya adalah xilosa murni, serta xilitol yang dihasilkan pun masih memerlukan pemurnian yang ekstensif untuk memenuhi standar pemakaian pada industri makanan dan obat-obatan yang menyebabkan meningkatnya biaya produksi (Rao et al. 2006).
Biaya produksi xilitol yang mahal melalui proses hidrogenasi xilosa, serta kebutuhan energi yang tinggi, menyebabkan diperlukannya proses bioteknologi dengan memanfaatkan mikroorganisme sebagai alternatif untuk mengganti proses produksi kimia yang diharapkan lebih ekonomis, dan
lebih singkat agar dapat mengurangi biaya produksi dan mengurangi pemakaian energi.
Berdasarkan laporan berbagai hasil penelitian, diperoleh informasi bahwa mikroorganisme yang terbaik dalam memproduksi xilitol adalah khamir terutama genus Candida. Hasil penelitian Tom Granstrom (2002) menunjukkan bahwa Candida tropicalis adalah penghasil xilitol terbaik dengan produktivitas 5,7 gram xilitol per liter. Produksi xilitol optimum secara fermentasi dapat ditentukan oleh biokonversi xilosa menjadi xilitol melalui metabolisme yang dilakukan oleh khamir, serta parameter optimum yang digunakan, seperti pH, temperatur, konsentrasi substrat, konsentrasi ko-substrat, dan aerasi. Di dalam penelitian ini akan dikaji faktor konsentrasi xilosa sebagai substrat dan glukosa sebagai ko-substrat, dengan menggunakan khamir golongan Candida, yaitu Candida tropicalis.
Penelitian ini bertujuan menentukan waktu inkubasi optimum untuk panen sel Candida tropicalis dan produksi xilitol, serta kondisi lingkungan optimum untuk memproduksi xilitol, meliputi konsentrasi substrat dan ko-substrat. Hipotesis dari penelitian ini adalah diperoleh kondisi optimum untuk memproduksi xilitol, dan diharapkan dengan penambahan ko-substrat berupa glukosa pada media xilosa dapat meningkatkan produksi xilitol. Semakin tinggi konsentrasi xilosa, maka semakin banyak biomasa sel Candida tropicalis yang dihasilkan, dan semakin tinggi xilitol yang dihasilkan. Manfaat dari penelitian ini, dapat digunakan sebagai acuan untuk memproduksi xilitol dengan menggunakan hidrolisat ampas tebu, sebagai substrat utama pada media fermentasi.
TINJAUAN PUSTAKA
Xilitol
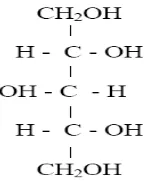
Xilitol merupakan gula berkarbon 5 (Gambar 1) yang tidak dapat difermentasi oleh bakteri S. mutans penyebab kerusakan gigi, sehingga bersifat nonkariogenik yang aman untuk kesehatan gigi (Uhari et al. 1996; Sampaio et al. 2003). Xilitol mempunyai tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya (40%) lebih rendah dari kelompok karbohidrat lainnya.
PENDAHULUAN
Xilitol (disebut juga sebagai gula alkohol atau polialkohol) merupakan pemanis alami yang terdapat pada sayuran dan buah-buahan seperti wortel, kembang kol selada, bawang, pisang, strowberi, raspberry, plum kuning, dan apel. Xilitol juga diproduksi dalam tubuh manusia sebanyak 15 g/hari sebagai senyawa antara (intermediate) dalam metabolisme glukosa (Jaffe 1978; Saha 1997; Kiet et al. 2006). Xilitol mempunyai tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya (40%) lebih rendah dari kelompok karbohidrat lainnya. Xilitol merupakan gula berkarbon 5 yang tidak dapat difermentasi oleh bakteri Streptococcus mutans penyebab kerusakan gigi, sehingga bersifat nonkariogenik yang aman untuk kesehatan gigi (Uhari et al. 1996; Sampaio et al. 2003).
Secara ekonomi xilitol mempunyai harga tinggi yaitu: 5-7$ US per pon, dengan pangsa pasar yang luas yaitu dapat diaplikasikan di bidang kesehatan dan industri bahan makanan, akan tetapi ketersediaan xilitol dalam perdagangan masih rendah. Xilitol tersebar sangat luas di alam dan dapat diperoleh dengan cara ekstraksi langsung melalui sumber yang mengandung xilitol seperti buah-buahan dan sayuran. Namun kandungan xilitolnya rendah, yaitu kurang dari 1% sehingga tidak praktis dan ekonomis untuk memproduksi xilitol melalui metode tersebut (Vandeska et al. 1996; Sampaio et al. 2003). Produksi xilitol secara komersial dilakukan melalui proses hidrogenasi xilosa (C5H10O5) pada suhu dan tekanan yang tinggi (suhu 80-140oC, tekanan 50 atmosfer) dengan bantuan katalis. Pembuatan xilitol melalui proses ini memerlukan biaya yang cukup tinggi karena selain diperlukan energi yang tinggi juga bahan baku utamanya adalah xilosa murni, serta xilitol yang dihasilkan pun masih memerlukan pemurnian yang ekstensif untuk memenuhi standar pemakaian pada industri makanan dan obat-obatan yang menyebabkan meningkatnya biaya produksi (Rao et al. 2006).
Biaya produksi xilitol yang mahal melalui proses hidrogenasi xilosa, serta kebutuhan energi yang tinggi, menyebabkan diperlukannya proses bioteknologi dengan memanfaatkan mikroorganisme sebagai alternatif untuk mengganti proses produksi kimia yang diharapkan lebih ekonomis, dan
lebih singkat agar dapat mengurangi biaya produksi dan mengurangi pemakaian energi.
Berdasarkan laporan berbagai hasil penelitian, diperoleh informasi bahwa mikroorganisme yang terbaik dalam memproduksi xilitol adalah khamir terutama genus Candida. Hasil penelitian Tom Granstrom (2002) menunjukkan bahwa Candida tropicalis adalah penghasil xilitol terbaik dengan produktivitas 5,7 gram xilitol per liter. Produksi xilitol optimum secara fermentasi dapat ditentukan oleh biokonversi xilosa menjadi xilitol melalui metabolisme yang dilakukan oleh khamir, serta parameter optimum yang digunakan, seperti pH, temperatur, konsentrasi substrat, konsentrasi ko-substrat, dan aerasi. Di dalam penelitian ini akan dikaji faktor konsentrasi xilosa sebagai substrat dan glukosa sebagai ko-substrat, dengan menggunakan khamir golongan Candida, yaitu Candida tropicalis.
Penelitian ini bertujuan menentukan waktu inkubasi optimum untuk panen sel Candida tropicalis dan produksi xilitol, serta kondisi lingkungan optimum untuk memproduksi xilitol, meliputi konsentrasi substrat dan ko-substrat. Hipotesis dari penelitian ini adalah diperoleh kondisi optimum untuk memproduksi xilitol, dan diharapkan dengan penambahan ko-substrat berupa glukosa pada media xilosa dapat meningkatkan produksi xilitol. Semakin tinggi konsentrasi xilosa, maka semakin banyak biomasa sel Candida tropicalis yang dihasilkan, dan semakin tinggi xilitol yang dihasilkan. Manfaat dari penelitian ini, dapat digunakan sebagai acuan untuk memproduksi xilitol dengan menggunakan hidrolisat ampas tebu, sebagai substrat utama pada media fermentasi.
TINJAUAN PUSTAKA
Xilitol
Xilitol merupakan gula berkarbon 5 (Gambar 1) yang tidak dapat difermentasi oleh bakteri S. mutans penyebab kerusakan gigi, sehingga bersifat nonkariogenik yang aman untuk kesehatan gigi (Uhari et al. 1996; Sampaio et al. 2003). Xilitol mempunyai tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya (40%) lebih rendah dari kelompok karbohidrat lainnya.
2
Gambar 1 Struktur kimia xilitol.
Sifat-sifat tersebut sangat baik untuk pengembangan produk pangan maupun produk farmasi. Salah satu produk makanan yang menggunakan xilitol adalah permen karet. Hampir sebagian besar sekitar 80%, produk permen karet di Negara Finlandia menggunakan bahan pemanis xilitol, begitu juga di Negara Jepang, xilitol termasuk salah satu dari 12 komponen bahan pangan yang dapat memberikan efek menyehatkan tubuh (Foods for Specified Health Use) atau kini lebih dikenal dengan istilah pangan fungsional.
Xilitol dapat diaplikasikan pada industri farmasi, produk perawatan kesehatan, dan industri bahan makanan (Gurgel et al. 1995). Secara famakologi, xilitol mempunyai peran untuk mencegah kerusakan gigi, infeksi telinga pada anak-anak, dan sebagai pengganti gula untuk pasien diabetes (Kiet et al. 2006; Rao et al. 2006). Xilitol merupakan sumber karbohidrat yang dapat dimetabolisme oleh tubuh tanpa melibatkan insulin serta secara lambat diserap oleh tubuh, sehingga ideal digunakan untuk pasien penderita diabetes yang sangat tergantung pada ketersediaan insulin (Emodi 1978; Tochampa et al. 2005). Selain itu xilitol juga banyak digunakan pada berbagai produk kesehatan gigi, seperti pasta gigi (Kiet et al. 2006).
Produksi Xilitol oleh Mikrob
Produksi xilitol yang pernah dilakukan selama ini masih belum efisien dan efektif untuk menghasilkan xilitol dalam skala besar dengan harga yang relatif murah. Salah satu cara yang sering dilakukan yaitu secara komersial melalui proses hidrogenasi xilosa (C5H10O5), pada suhu dan tekanan yang tinggi (suhu 80-140oC, tekanan 50 atmosfer) seperti yang disajikan pada Gambar 2, dengan bantuan katalis. Pembuatan xilitol melalui proses ini memerlukan biaya yang cukup tinggi karena selain diperlukan energi yang tinggi, bahan baku utamanya adalah xilosa murni, serta xilitol yang dihasilkan pun
masih memerlukan pemurnian yang ekstensif untuk memenuhi standar pemakaian pada industri makanan dan obat-obatan yang menyebabkan meningkatnya biaya produksi (Rao et al. 2006).
Prosedur bioteknologi dengan menggunakan mikroorganisme merupakan salah satu alternatif untuk menghasilkan xilitol dan diharapkan dapat lebih ekonomis dari segi biaya produksi dan pemakaian energi. Proses ini dilakukan untuk mengganti proses produksi xilitol secara kimia yang terbilang relatif mahal. Selain itu, xilitol dapat diproduksi dengan memanfaatkan hidrolisat hemiselulosa (xilan) sebagai pengganti xilosa murni yang dapat mengurangi biaya untuk pemisahan dan pemurnian (Sampaio et al. 2003). Beberapa tanaman yang dapat digunakan sebagai sumber xilan adalah padi, gandum, jerami, tongkol jagung, dan ampas tebu (Vandeska et al. 1996).
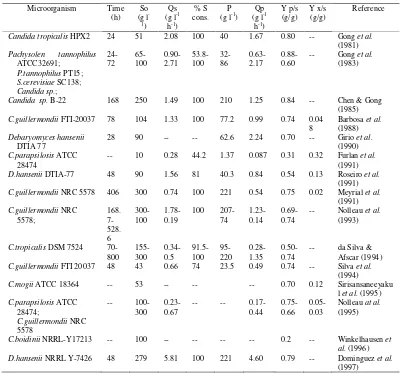
Mikroorganisme yang digunakan untuk memproduksi xilitol, diantaranya: bakteri, jamur, dan khamir. Khamir adalah salah satu mikrob yang bertanggung jawab dalam biokonversi xilosa menjadi xilitol terutama dari genus Candida (Candida guilliermondi, C. tropicalis, C pelliculosa, C. parapsilosis), dan spesies lainnya yaitu Debaryomyces hansenii, Saccharomyces sp, dan Pennicillium sp (Vandeska et al. 1995; Carvalho et al. 2000; Ko et al. 2006; Diz et al. 2002; Onishi dan Suzuki 1969; Sampaio et al. 2003). Beberapa spesies khamir yang digunakan untuk memproduksi xilitol disajikan pada Tabel 1.
3
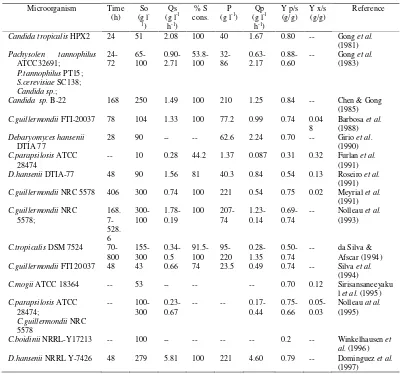
Tabel 1 Produksi xilitol oleh mikroorganisme dalam media xilosa atau campuran gula komersial (Parajo et al. 1998).
Microorganism Time (h)
So (g l -1)
Qs (g l-1
h-1)
% S cons.
P (g l-1)
Qp (g l-1
h-1)
Y p/s (g/g)
Y x/s (g/g)
Reference
Candida tropicalis HPX2 24 51 2.08 100 40 1.67 0.80 -- Gong et al.
(1981)
Pachysolen tannophilus
ATCC32691; 24-72 65-100 0.90-2.71 53.8-100 32-86 0.63-2.17 0.88-0.60
-- Gong et al.
(1983)
P.tannophilus PT15;
S.cerevisiae SC138;
Candida sp.;
Candida sp. B-22 168 250 1.49 100 210 1.25 0.84 -- Chen & Gong (1985)
C.guillermondii FTI-20037 78 104 1.33 100 77.2 0.99 0.74 0.04 8
Barbosa et al.
(1988)
Debaryomyces hansenii
DTIA 77
28 90 -- -- 62.6 2.24 0.70 -- Girio et al.
(1990)
C.parapsilosis ATCC 28474
-- 10 0.28 44.2 1.37 0.087 0.31 0.32 Furlan et al.
(1991)
D.hansenii DTIA-77 48 90 1.56 81 40.3 0.84 0.54 0.13 Roseiro et al.
(1991)
C.guillermondii NRC 5578 406 300 0.74 100 221 0.54 0.75 0.02 Meyrial et al.
(1991)
C.guillermondii NRC 5578; 168. 7-528. 6 300-100 1.78-0.19
100 207-74
1.23-0.14
0.69-0.74
-- Nolleau et al.
(1993)
C.tropicalis DSM 7524 70-800 155-300 0.34-0.5 91.5-100 95-220 0.28-1.35 0.50-0.74
-- da Silva & Afscar (1994)
C.guillermondii FTI 20037 48 43 0.66 74 23.5 0.49 0.74 -- Silva et al.
(1994)
C.mogii ATCC 18364 -- 53 -- -- -- 0.70 0.12 Sirisansaneeyaku l et al. (1995)
C.parapsilosis ATCC 28474;
-- 100-300
0.23-0.67
-- -- 0.17-0.44
0.75-0.66
0.05-0.03
Nolleau at al.
(1995)
C.guillermondii NRC 5578
C.boidinii NRRL-Y17213 -- 100 -- -- -- -- 0.2 -- Winkelhausen et al. (1996)
D.hansenii NRRL Y-7426 48 279 5.81 100 221 4.60 0.79 -- Dominguez et al.
(1997)
Keterangan : So, konsentrasi substrat awal; Qs, kecepatan konsumsi substrat volumetrik; S% cons, persentase konsumsi substrat; P, konsentrasi xilitol maksimum; Qp, produktivitas xilitol volumetrik; Y p/s, product yield; Y x/s, biomass yield; µmax, kecepatan pertumbuhan maksimum.
Pemilihan spesies khamir sebagai penghasil xilitol terbaik telah banyak dilakukan dalam berbagai penelitian. Gong et al. (1983) membandingkan kemampuan dari
Candida, Saccharomyces dan
Schizosaccharomyces dengan spesies yang berbeda untuk mengikat gula pentosa dan menghasilkan xilitol sebagai produk fermentasi, bahkan dalam spesies yang tidak dapat menggunakan xilosa untuk pertumbuhannya. Amaral-Collaco et al. (1989); Vandeska et al. (1995) memilih Debaryomyces hansenii dan Candida boidinii sebagai penghasil xilitol. Sirisansaneeyakul et al. (1995) membandingkan 11 spesies khamir dan memilih Candida mogii sebagai penghasil xilitol yang paling menjanjikan. Dominguez et al. (1996) menggunakan 6 spesies khamir (Candida, Pachysolen dan
Debaryomyces), dan D.hansenii
menghasilkan 106 g/L xilitol dengan produktivitas volumetrik 2.21 g xilitol l-1 h-1 dan product yield (Y produk/substrat) sebesar 0.71 g/g.
4
Produksi xilitol dengan menggunakan bakteri juga dilakukan oleh Yoshitake et al. (1973) yaitu Enterobacter dan menghasilkan xilitol sebesar 33.3 g/L di dalam media fermentasi yang berisi 100 g/L xilosa. Selain itu produksi dengan menggunakan jamur, juga pernah dilakukan oleh Chiang dan Knight (1961), yaitu Penicillium, Aspergillus, Rhizopus, Gliocladium, Byssochamys, Myrothecium, dan Neurospora spp. Dahiya (1991) melakukan penelitian dengan menggunakan kultur Petromyces albertensis, dan menghasilkan xilitol sebesar 39.8 g/L dalam 100 g/L xilosa. Walaupun xilitol juga dapat dihasilkan oleh jamur, tetapi khamir merupakan penghasil xilitol terbaik. Menurut Sampaio et al. (2003) berdasarkan hasil penelitiannya menyatakan bahwa xilitol yang dihasilkan oleh jamur sebesar 0.14-0.52 g/L pada konsentrasi xilosa 11.50 g/L dengan waktu inkubasi 96 jam, dan masih lebih rendah jika dibandingkan dengan khamir, yaitu sebesar 16-17 g/L pada 30 g/L konsentrasi xilosa dengan waktu inkubasi 48 jam.
Produksi Xilitol oleh Sel Khamir Candida Produksi xilitol dengan menggunakan mikroorganisme merupakan metode alternatif yang dapat menghemat biaya serta pemakaian energi. Mikrob yang berperan dalam biokonversi xilosa menjadi xilitol yaitu khamir, terutama dari genus Candida. Candida merupakan kelompok makhluk hidup eukariot bersel tunggal (uniseluler) yang umumnya melakukan reproduksi vegetatif dengan tunas dan mempunyai fase
pertumbuhan yang sama dengan khamir. Penyebaran Candida sangat berlimpah di alam, namun umumnya Candida diisolasi dari tanah, air laut, produk fermentasi, dan hewan berdarah dingin. Sedikit sekali Candida yang diisolasi dari manusia dan hewan berdarah panas. Beberapa jenis Candida digolongkan sebagai khamir yang patogen termasuk C.tropicalis dan C.albicans (Hurley 1979). C.tropicalis memiliki taksonomi dengan Kingdom: Fungi, Filum: Deuteromycotina, Famili: Tarulopsidaceae, Genus: Candida, Spesies: C.tropicalis.
Hasil penelitian Gong et al. (1981) yang membandingkan 10 spesies khamir menemukan bahwa C.tropicalis adalah penghasil xilitol terbaik, hasil yang sama juga diperoleh dari penelitian yang dilakukan oleh Barbosa et al. (1988), yang menggunakan 44 spesies khamir yang berperan dalam biokonversi xilosa menjadi xilitol, dan menyatakan bahwa C.guilliermondii dan C.tropicalis sebagai penghasil xilitol terbaik.
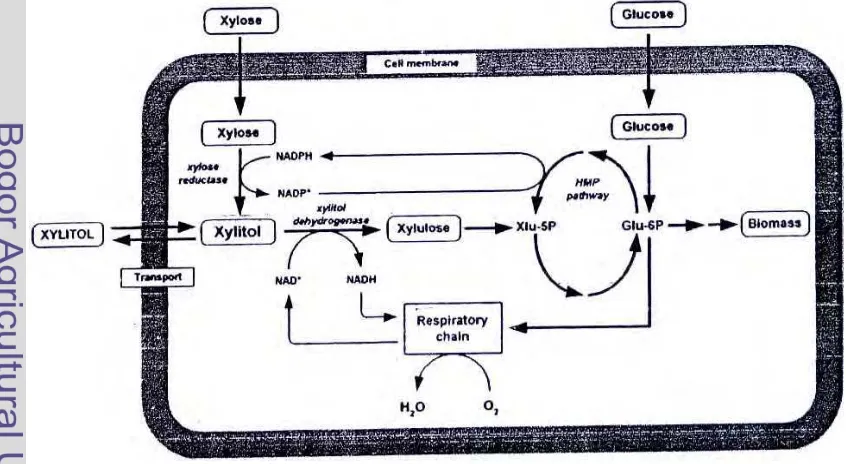
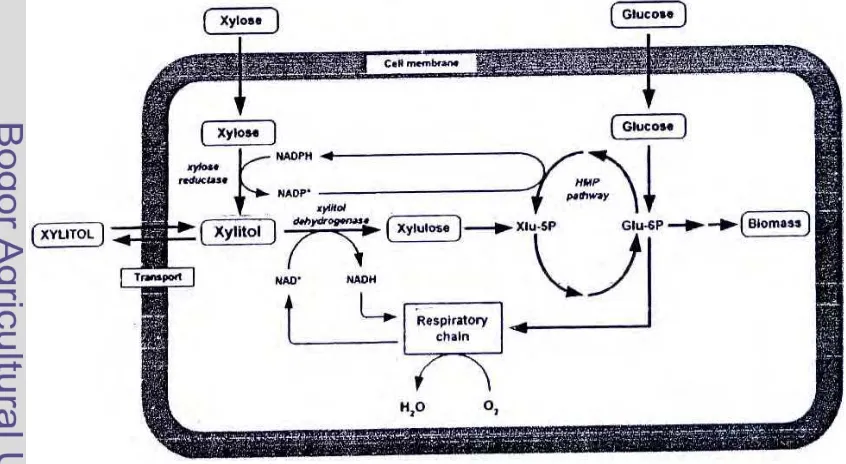
Sel khamir Candida mengalami metabolisme seperti yang disajikan pada Gambar 3. Candida memiliki kemampuan untuk mengkonversi xilosa menjadi D-xilulosa melalui reaksi oksidoreduktif yang terdiri atas dua rangkaian reaksi. Xilosa adalah gula pentosa utama yang terdapat di dalam lignoselulosa. Tidak seperti mikroorganisme prokariotik, yang mempunyai isomerase xilosa, tapi sebagian besar Candida melakukan proses asimilasi xilosa, seperti C. tropicalis, yang menggunakan D- xilosa melalui dua reaksi oksidoreduktif enzimatik dengan xylose
5
reductase (XR) dan xylitol dehydrogenase (XDH).
Xilosa reduktase (XR) dengan koenzim NADH atau NADPH mengkatalisis reduksi D- xilosa menjadi xilitol. Xilitol yang dihasilkan sebagian diekskresi keluar sel sebagai produk utama, dan sebagian lagi dimetabolisme lebih lanjut oleh XDH dengan koenzim NAD yang mengkatalisis oksidasi xilitol menjadi D-xilulosa. D-Xilulosa diubah menjadi D-xilulosa 5-fosfat oleh enzim xilulosa kinase, dan kemudian masuk ke dalam siklus heksosa monofosfat yang kemudian digunakan untuk pertumbuhan sel dan regenerasi NADH/NADPH. Secara keseluruhan efisiensi asimilasi xilosa terjadi karena adanya aktivitas dari XR dan XDH (Ko et al. 2006).
Siklus ini juga menunjukkan asimilasi glukosa oleh Candida sebagai ko-substrat. Glukosa merupakan sumber karbon yang lebih mudah dimetabolisme oleh sel. Sehingga keberadaan glukosa dapat berperan untuk regenerasi koenzim NADPH/NADH dan peningkatan biomasa sel melalui glukosa-6-fosfat (Glu-6P); akibatnya siklus heksosa monofosfat (HMP) yang menghasilkan Glu-6P dari xilulosa melalui xilulosa-5-fosfat menurun (Tochampa et al. 2005). Sehingga konsumsi xilitol oleh sel berkurang dan lebih banyak yang diekskresikan sebagai produk.
Idealnya, akumulasi xilitol di dalam sel dan ekskresi sebagai produk ekstraseluler dapat meningkatkan xilitol, karena tidak ada xilitol yang diubah menjadi xilulosa. Menurut Hallborn et al. (1994) penambahan glukosa sebagai ko-substrat dalam media fermentasi dapat menaikkan produk xilitol. Akan tetapi semakin tinggi konsentrasi ko-substrat (glukosa) maka dapat menghambat transport xilosa ke dalam sel, akibatnya dapat menurunkan produksi xilitol (Tochampa et al. 2005).
Produksi xilitol yang diperoleh melalui metabolisme khamir dalam hal ini adalah Candida tropicalis dipengaruhi oleh beberapa faktor, yaitu pH, temperatur, konsentrasi substrat, konsentrasi ko-substrat, dan aerasi. Menurut Yulianto (2001) derajat keasaman (pH) medium telah diketahui mempengaruhi pertumbuhan sel dan pengaruhnya bervariasi diantara spesies khamir. Membran sel yang tidak sepenuhnya permeabel terhadap ion hidrogen menyebabkan pH intraseluler berbeda dengan pH medium. Disamping itu pH juga menentukan kelarutan beberapa komponen di dalam medium sehingga
modifikasi pH dapat mengakibatkan pengendapan nutrien dan menjadi tidak dapat diasimilasi oleh khamir. Penurunan kerja khamir dalam fermentasi juga dapat terjadi ketika dalam mediumnya tidak ada kontrol pH (Girio et al. 1990, Silva et al. 1996).
Kemampuan khamir untuk memproduksi xilitol terjadi pada temperatur antara 24-45oC dan temperatur optimum biasanya pada batas 28-30oC (Parajo et al. 1998). Barbosa et al. (1988), di dalam eksperimennya dengan C. guilliermondii melaporkan bahwa pertumbuhan maksimum terjadi pada temperatur 35oC dan konsentrasi xilitol maksimum yang dihasilkan pada batas 30-35oC.
Konsentrasi substrat (xilosa) juga sangat berpengaruh dalam produksi xilitol. Konsentrasi substrat yang rendah dapat menurunkan hasil produksinya, karena substrat (xilosa) digunakan sebagai sumber karbon untuk pertumbuhan sel. Semakin besar konsentrasi substrat (xilosa) maka semakin besar produksi xilitolnya. Konsentrasi tertinggi xilitol dengan menggunakan galur mutan Candida sp diperoleh 205 g xilitol per liter dari 249 g/L xilosa dengan product yield-nya (Y p/s) sebesar 0.82 g/g (Chen dan Gong 1985). Sedangkan dengan Candida guilliermondii dihasilkan 221 g xilitol per liter dari 300 g/L xilosa menghasilkan Y p/s sebesar 0.79 g/g (Meyrial et al. 1991). Candida tropicalis menghasilkan 84.5 g xilitol per liter dari 150 g/L xilosa menghasilkan Y p/s sebesar 0.56 g/g (Yahashi et al. 1996).
6
Faktor yang terakhir yaitu aerasi. Aerasi merupakan faktor yang penting karena ketersediaan oksigen di dalam media dapat mempengaruhi pertumbuhan khamir, kecepatan pengambilan substrat, dan kecepatan pembentukan produk (Wahyuni et al. 2004). Menurut Horitsu et al. (1992); Nolleau et al. (1993), kondisi aerasi untuk produktivitas optimum tergantung pada konsentrasi substrat. Pembentukan xilitol biasanya terjadi di bawah kondisi oksigen yang terbatas dengan tujuan mengakumulasi NADH karena keberadaan oksigen yang berlebihan akan menurunkan aktivitas NADH yang berakibat pada menurunnya akumulasi produksi xilitol (Winkelhausen dan Kuzmanova 1998).
Kurva Pertumbuhan Mikrob
Pertumbuhan adalah penambahan secara teratur semua komponen sel suatu jasad. Pertumbuhan juga diartikan pertambahan jumlah sel, yang berarti juga pertambahan jumlah organisme, misalnya pertumbuhan yang terjadi pada suatu kultur mikrob. Pembelahan atau perbanyakan sel pada jasad bersel tunggal (uniseluler) merupakan pertambahan jumlah individu, misalnya pembelahan sel pada bakteri akan menghasilkan pertambahan jumlah sel bakteri itu sendiri. Pembelahan sel pada jasad bersel banyak (multiseluler) tidak menghasilkan pertambahan jumlah individunya, tetapi hanya merupakan pembentukan jaringan atau bertambah besar jasadnya. Dalam membahas pertumbuhan mikrob harus dibedakan antara pertumbuhan masing-masing individu sel dan pertumbuhan kelompok sel atau pertumbuhan populasi.
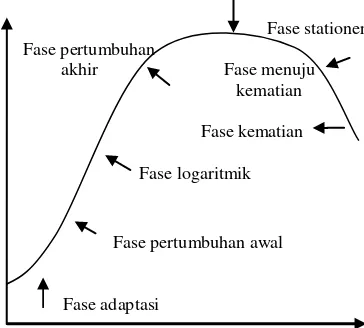
Suatu bakteri yang dimasukkan ke dalam medium baru yang sesuai akan tumbuh memperbanyak diri. Jika pada waktu-waktu tertentu jumlah bakteri dihitung dan dibuat grafik hubungan antara jumlah bakteri dengan waktu maka akan diperoleh suatu grafik atau kurva pertumbuhan (Gambar 4).
Pola pertumbuhan yang disajikan pada Gambar 4 menunjukkan pertumbuhan mikrob yang terbagi menjadi beberapa fase, yaitu fase permulaan (adaptasi), fase pertumbuhan awal, fase pertumbuhan logaritma (eksponensial), fase pertumbuhan akhir, fase stationer maksimum, fase kematian dipercepat, dan fase kematian logaritma.
Fase adaptasi (permulaan) yaitu bakteri baru menyesuaikan diri dengan lingkungan yang baru, sehingga sel belum membelah diri. Lama fase adaptasi ini
dipengaruhi oleh media dan lingkungan pertumbuhan, serta jumlah inokulum. Fase adaptasi mungkin berjalan lambat karena beberapa sebab, misalnya kultur dipindahkan dari media yang kaya nutrisi ke media yang kandungan nutrisinya terbatas. Sel mikrob mulai membelah diri pada fase pertumbuhan yang dipercepat, tetapi waktu generasinya masih panjang. Fase permulaan sampai fase pertumbuhan dipercepat sering disebut lag phase. Kecepatan sel membelah diri paling cepat terdapat pada fase pertumbuhan logaritma atau pertumbuhan eksponensial dengan waktu generasi pendek dan konstan. Selama fase logaritma, metabolisme sel paling aktif, sintesis bahan sel sangat cepat dengan jumlah konstan sampai nutrien habis atau terjadinya penimbunan hasil metabolisme yang menyebabkan terhambatnya pertumbuhan. Selanjutnya pada fase pertumbuhan yang mulai terhambat, kecepatan pembelahan sel berkurang dan jumlah sel yang mati mulai bertambah.
Fase stasioner maksimum, jumlah sel yang mati semakin meningkat sampai terjadi jumlah sel hidup hasil pembelahan sama dengan jumlah sel yang mati, sehingga jumlah sel hidup konstan, seolah-olah tidak terjadi pertumbuhan (pertumbuhan nol). Kecepatan kematian sel pada fase kematian yang dipercepat terus meningkat sedang kecepatan pembelahan sel nol, sampai pada fase kematian logaritma maka kecepatan kematian sel mencapai maksimal, sehingga jumlah sel hidup menurun dengan cepat seperti deret ukur. Walaupun demikian penurunan jumlah sel hidup tidak mencapai nol, dalam jumlah minimum tertentu sel mikrob akan tetap bertahan sangat lama dalam medium tersebut.
Fase stationer Fase pertumbuhan
akhir Fase menuju kematian
Fase kematian
Fase logaritmik
Fase pertumbuhan awal
Fase adaptasi
7
BAHAN DAN METODE
Bahan dan Alat
Sel khamir yang digunakan adalah Candida tropicalis yang berasal dari koleksi kultur LIPI Cibinong. Bahan-bahan yang digunakan dalam pembuatan media YM dan fermentasi adalah xilosa murni, glukosa, HCl, ekstrak khamir, ekstrak malt, bakto pepton, agar, KH2PO4, K2HPO4, MgSO4.7H2O, dan aquades steril. Bahan-bahan yang digunakan untuk pengukuran kadar xilitol adalah kit D-sorbitol/D-xilitol, serta bahan-bahan yang lain seperti aquabides, kapas berlemak, kain kasa, es batu, dan alkohol teknis 95%.
Alat-alat yang digunakan adalah tabung reaksi, jarum ose, labu Erlenmeyer, gelas ukur 100 mL, pipet mikro, pipet tetes, kertas aluminium foil, plastik wrap, magnetic stirrer, autoklaf,
dan
laminar air flow. Pengukuran kadar xilitol menggunakan spektrofotometer, tabung Eppendorf, dan vortex. Serta alat-alat lain seperti sentrifuse, stopwatch, inkubator, lemari pendingin, pH meter, neraca analitik, dan shaker.Metode Penelitian
Pelaksanaan penelitian meliputi peremajaan kultur sel khamir C.tropicalis, pembuatan media, pembuatan stok kultur sel khamir C.tropicalis, pembuatan kurva pertumbuhan sel khamir C.tropicalis, pembuatan kurva produksi untuk optimasi waktu inkubasi, optimasi konsentrasi xilosa, dan ko-substrat serta penentuan biomassa sel khamir C.tropicalis dengan variasi konsentrasi ko-substrat dalam kondisi optimum.
Peremajaan Kultur Sel Khamir Candida tropicalis
Prosedur ini dilakukan menurut metode Rao et al. (2005). Sel khamir C.tropicalis dibiakkan dalam media agar miring Yeast Malt (YM) yang telah disterilisasi pada suhu 121oC, dan tekanan 1 atm selama 15 menit, kemudian diinkubasi selama 18-24 jam pada suhu 370C. Komposisi media YM, yaitu 3 g/L ekstrak khamir, 3 g/L ekstrak malt, 5 g/L bakto pepton, 20 g/L glukosa dan 20 g/L agar. Peremajaan dilakukan setiap 4 minggu sekali.
Pembuatan Media
Media yang digunakan dalam penelitian ini, antara lain: media YM, media
inokulum dan media fermentasi (Metode Rao et al. 2005). Media YM cair dibuat sebanyak 10 mL dalam labu Erlenmeyer 50 mL dengan komposisi 3 g/L ekstrak khamir, 3 g/L ekstrak malt, 5 g/L bakto pepton, 20 g/L glukosa.
Media inokulum dilakukan dengan metode Rao et al. 2005. Sebanyak 10 mL di dalam 50 mL labu Erlenmeyer dengan komposisi (g/L): xilosa 30, ekstrak khamir 10; pepton 20; K2HPO4 0,5; KH2PO4 0,5; MgSO4.7H2O 0.5, dan ammonium sulfat 2 dengan pH 5. Media fermentasi memiliki komposisi yang sama dengan media inokulum. Media fermentasi C.tropicalis terdiri atas dua jenis, yaitu mengandung xilosa dan campuran xilosa dengan glukosa.
Pembuatan Stok Kultur Sel Khamir
Sel khamir C.tropicalis diambil 1 ose dan dipindahkan ke dalam labu Erlenmeyer 50 mL yang berisi 10 mL media YM cair, kemudian diinkubasi bergoyang selama 18 jam dengan kecepatan 120 rpm, dan suhu 30oC. Setelah 18 jam sebanyak 1% sel C.tropicalis dipindahkan ke dalam labu Erlenmeyer 50 mL yang berisi 10 mL media inokulum dengan komposisi (g/L): xilosa 30; ekstrak khamir 10; pepton 20; K2HPO4 0,5; KH2PO4 0,5, MgSO4.7H2O 0.5, dan ammonium sulfat 2. pH 5 dan diinkubasi bergoyang selama 18 jam dengan kecepatan 120 rpm pada suhu 30oC. Setelah 18 jam sebanyak 1% sel C.tropicalis dalam media inokulum siap dipindahkan ke dalam media fermentasi untuk proses optimasi. Setiap melakukan proses optimasi, sel C.tropicalis dipanen terlebih dahulu dalam media YM cair dan media inkolum.
Pembuatan Kurva Pertumbuhan dan Kurva Produksi Xilitol
8
pertumbuhan dan kurva produksi yang menunjukkan waktu optimum produksi xilitol.
Optimasi Konsentrasi Substrat (Xilosa)
Prosedur dilakukan menurut metode Eken dan Cavusoglu (1998). Sebanyak 1% Sel C.tropicalis dari inokulum dimasukkan ke dalam media fermentasi xilosa. Media fermentasi dibuat dengan variasi konsentrasi substrat berkisar antara 30-110g/L, yaitu 30, 50, 70, 90 dan 110 g/L. Media diperlakukan pada pH 5, kecepatan pengocokan 120 rpm, dan suhu 30oC. Sel khamir C.tropicalis ditumbuhkan pada media fermentasi sebanyak 50 mL dalam labu Erlenmeyer 125 mL dengan waktu inkubasi optimum yang diperoleh dari percobaan sebelumnya yaitu 48 jam, kemudian diukur kadar xilitol pada panjang gelombang 492 nm.
Optimasi Konsentrasi Ko-substrat (Glukosa)
Pada percobaan sebelumnya telah diperoleh waktu inkubasi dan konsentrasi xilosa optimum untuk produksi xilitol. Selain itu konsentrasi ko-substrat juga diperlukan untuk meningkatkan produksi xilitol. Sehingga perlu dilakukan optimasi konsentrasi ko-substrat. Ko-substrat yang digunakan yaitu glukosa.
Prosedur dilakukan menurut metode Yulianto et al. (2006). C.tropicalis ditumbuhkan pada media fermentasi campuran xilosa dengan glukosa. Sebanyak 50 mL di dalam labu Erlenmeyer 125 mL, dengan komposisi (g/L): ekstrak khamir 10; pepton 20; K2HPO4 0.5; KH2PO4 0.5; MgSO4.7H2O 0.5 dan ammonium sulfat 2, kemudian ditambahkan campuran xilosa dan glukosa dengan perbandingan 6:1, 6:2, 6:3, dan 6:4 (%), yaitu dengan penambahan glukosa berkisar 12 – 48 g/L pada konsentrasi xilosa optimum. Setelah itu media diperlakukan pada pH 5, suhu 30oC kecepatan pengocokan 120 rpm, dengan waktu inkubasi 48 jam. Konsentrasi substrat yang digunakan adalah konsentrasi xilosa optimum yang telah diperoleh dari percobaan sebelumnya. Kemudian diukur kadar xilitolnya pada panjang gelombang 492 nm.
Penentuan Kadar Xilitol dengan Metode Kit (Roche)
Pengukuran kadar xilitol dilakukan menggunakan metode spektrofotometri (metode Kit D-sorbitol/D-xilitol dari Roche). Metode ini dilakukan di dalam tabung
Eppendorf. Sebanyak 0.6 mL dimasukkan larutan 1 dalam tabung Eppendorf, kemudian ditambahkan larutan 2 sebanyak 0.2 mL, larutan 3 sebanyak 0.2 mL, sampel yang telah diencerkan sebesar 50x sebanyak 0.1 mL, dan aquabides sebanyak 1.9 mL, kemudian divortex agar homogen. Setelah itu dibiarkan selama 2 menit, kemudian diukur absorbansinya pada panjang gelombang 492 nm, setelah 2 menit dilakukan pengukuran kembali. Pengukuran yang dilakukan disebut sebagai absorban pertama. Kemudian ditambahkan larutan 4 sebanyak 0.05 mL dan dibiarkan selama 30 menit, setelah itu diukur kembali absorbansinya. Kemudian setiap interval 5 menit dari menit ke-30 hingga menit ke-55, dilakukan 5 kali pengukuran. Pengukuran ini disebut absorbansi kedua. Konsentrasi xilitol yang terukur, diperoleh sesuai dengan perhitungan yang terdapat pada Kit (Lampiran 5). Larutan yang digunakan disajikan pada Lampiran 2.
Biomasa Sel Khamir Candida tropicalis pada Variasi Konsentrasi Xilosa dan Ko-substrat (Glukosa)
Prosedur yang dilakukan sama seperti pembuatan kurva pertumbuhan. Media fermentasi yang digunakan yaitu media yang mengandung 70 g/L xilosa sebagai kontrol, variasi campuran konsentrasi xilosa dan ko-substrat (glukosa) dengan perbandingan 6:1, 6:2, 6:3, dan 6:4 (%). Masing-masing dibuat di dalam labu Erlenmeyer 125 mL sebanyak 50 mL. Setelah itu diinkubasi selama 48 jam, dengan kecepatan pengocokan 120 rpm, pada suhu 30oC. Pengukuran nilai optical density (OD) dilakukan setiap 12 jam sekali pada panjang gelombang 600 nm. Dari data percobaan ini diperoleh 5 data kurva pertumbuhan pada konsentrasi media yang berbeda-beda.
HASIL DAN PEMBAHASAN
Pertumbuhan Sel Candida tropicalis dan Produksi Xilitol
8
pertumbuhan dan kurva produksi yang menunjukkan waktu optimum produksi xilitol.
Optimasi Konsentrasi Substrat (Xilosa)
Prosedur dilakukan menurut metode Eken dan Cavusoglu (1998). Sebanyak 1% Sel C.tropicalis dari inokulum dimasukkan ke dalam media fermentasi xilosa. Media fermentasi dibuat dengan variasi konsentrasi substrat berkisar antara 30-110g/L, yaitu 30, 50, 70, 90 dan 110 g/L. Media diperlakukan pada pH 5, kecepatan pengocokan 120 rpm, dan suhu 30oC. Sel khamir C.tropicalis ditumbuhkan pada media fermentasi sebanyak 50 mL dalam labu Erlenmeyer 125 mL dengan waktu inkubasi optimum yang diperoleh dari percobaan sebelumnya yaitu 48 jam, kemudian diukur kadar xilitol pada panjang gelombang 492 nm.
Optimasi Konsentrasi Ko-substrat (Glukosa)
Pada percobaan sebelumnya telah diperoleh waktu inkubasi dan konsentrasi xilosa optimum untuk produksi xilitol. Selain itu konsentrasi ko-substrat juga diperlukan untuk meningkatkan produksi xilitol. Sehingga perlu dilakukan optimasi konsentrasi ko-substrat. Ko-substrat yang digunakan yaitu glukosa.
Prosedur dilakukan menurut metode Yulianto et al. (2006). C.tropicalis ditumbuhkan pada media fermentasi campuran xilosa dengan glukosa. Sebanyak 50 mL di dalam labu Erlenmeyer 125 mL, dengan komposisi (g/L): ekstrak khamir 10; pepton 20; K2HPO4 0.5; KH2PO4 0.5; MgSO4.7H2O 0.5 dan ammonium sulfat 2, kemudian ditambahkan campuran xilosa dan glukosa dengan perbandingan 6:1, 6:2, 6:3, dan 6:4 (%), yaitu dengan penambahan glukosa berkisar 12 – 48 g/L pada konsentrasi xilosa optimum. Setelah itu media diperlakukan pada pH 5, suhu 30oC kecepatan pengocokan 120 rpm, dengan waktu inkubasi 48 jam. Konsentrasi substrat yang digunakan adalah konsentrasi xilosa optimum yang telah diperoleh dari percobaan sebelumnya. Kemudian diukur kadar xilitolnya pada panjang gelombang 492 nm.
Penentuan Kadar Xilitol dengan Metode Kit (Roche)
Pengukuran kadar xilitol dilakukan menggunakan metode spektrofotometri (metode Kit D-sorbitol/D-xilitol dari Roche). Metode ini dilakukan di dalam tabung
Eppendorf. Sebanyak 0.6 mL dimasukkan larutan 1 dalam tabung Eppendorf, kemudian ditambahkan larutan 2 sebanyak 0.2 mL, larutan 3 sebanyak 0.2 mL, sampel yang telah diencerkan sebesar 50x sebanyak 0.1 mL, dan aquabides sebanyak 1.9 mL, kemudian divortex agar homogen. Setelah itu dibiarkan selama 2 menit, kemudian diukur absorbansinya pada panjang gelombang 492 nm, setelah 2 menit dilakukan pengukuran kembali. Pengukuran yang dilakukan disebut sebagai absorban pertama. Kemudian ditambahkan larutan 4 sebanyak 0.05 mL dan dibiarkan selama 30 menit, setelah itu diukur kembali absorbansinya. Kemudian setiap interval 5 menit dari menit ke-30 hingga menit ke-55, dilakukan 5 kali pengukuran. Pengukuran ini disebut absorbansi kedua. Konsentrasi xilitol yang terukur, diperoleh sesuai dengan perhitungan yang terdapat pada Kit (Lampiran 5). Larutan yang digunakan disajikan pada Lampiran 2.
Biomasa Sel Khamir Candida tropicalis pada Variasi Konsentrasi Xilosa dan Ko-substrat (Glukosa)
Prosedur yang dilakukan sama seperti pembuatan kurva pertumbuhan. Media fermentasi yang digunakan yaitu media yang mengandung 70 g/L xilosa sebagai kontrol, variasi campuran konsentrasi xilosa dan ko-substrat (glukosa) dengan perbandingan 6:1, 6:2, 6:3, dan 6:4 (%). Masing-masing dibuat di dalam labu Erlenmeyer 125 mL sebanyak 50 mL. Setelah itu diinkubasi selama 48 jam, dengan kecepatan pengocokan 120 rpm, pada suhu 30oC. Pengukuran nilai optical density (OD) dilakukan setiap 12 jam sekali pada panjang gelombang 600 nm. Dari data percobaan ini diperoleh 5 data kurva pertumbuhan pada konsentrasi media yang berbeda-beda.
HASIL DAN PEMBAHASAN
Pertumbuhan Sel Candida tropicalis dan Produksi Xilitol
9
mengandung asam amino yang lengkap & vitamin (B kompleks). Pepton menurut Fathir (2009) mampu menyediakan nutrien esensial untuk metabolisme bakteri. Selain itu media YM juga mengandung glukosa yang berperan sebagai sumber karbon bagi Candida.
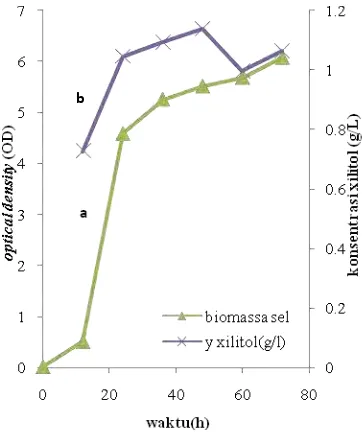
Penelitian ini dimulai dari pembuatan kurva pertumbuhan Candida tropicalis dengan menggunakan media Yeast Malt (YM). Pembuatan kurva pertumbuhan dilakukan untuk menentukan waktu inkubasi pertumbuhan optimal sel khamir Candida tropicalis. Pertumbuhan sel paling aktif ketika berada pada fase log, yaitu fase disaat metabolisme sel paling aktif serta sintesis bahan sel sangat cepat dengan jumlah konstan sampai nutrien habis atau terjadinya penimbunan hasil metabolisme yang menyebabkan terhambatnya pertumbuhan, sehingga pertumbuhan sel berada pada fase stationer, kemudian menuju pada fase kematian. Tetapi pada penelitian ini, kurva pertumbuhan yang diperoleh tidak sampai berada pada fase kematian, tetapi hanya sampai pada persimpangan antara fase log dengan fase stationer. Pembuatan kurva pertumbuhan dilakukan dengan pengamatan setiap 12 jam sekali sampai jam ke-72, karena kecepatan pertumbuhan khamir lebih lambat dibandingkan dengan bakteri yang membelah setiap 2 jam sekali.
Berdasarkan hasil penelitian, diperoleh pola pertumbuhan yang sigmoid (Gambar 5a), yang sama dengan pola pertumbuhan mikroorganisme pada umumnya. Gambar 5a menunjukkan bahwa fase adaptasi (lag phase) berada pada jam ke-0 hingga jam ke-12, fase log (eksponensial) berada pada kisaran jam ke-12 hingga jam ke-24. Pertumbuhan sel mulai lambat ketika memasuki fase pertumbuhan akhir yaitu dimulai pada jam ke-24.
Fase-fase pada pola pertumbuhan mikroorganisme juga menunjukkan hasil metabolitnya. Metabolit primer dihasilkan oleh sel ketika berada pada fase log, dan xilitol dalam penelitian ini merupakan hasil metabolisme primer khamir, sedangkan metabolit sekunder dihasilkan ketika sel berada pada fase stationer. Pertumbuhan sel maksimal ketika berada pada fase log, sehingga pada fase ini dihasilkan sel khamir C. tropicalis dalam jumlah yang besar, yang berkorelasi positif terhadap xilitol yang akan dihasilkan, ketika diproduksi pada media fermentasi. Semakin besar konsentrasi sel maka xilitol yang dihasilkan juga semakin besar, sehingga waktu inkubasi 18 jam
merupakan waktu inkubasi yang mewakili fase log untuk pertumbuhan Candida tropicalis, dan pada waktu ini sel berada dalam kondisi yang sangat aktif untuk membelah.
Kurva pertumbuhan Candida topicalis menunjukkan bahwa pertumbuhan khamir cukup lambat, bahkan pada jam ke-72 masih mengalami peningkatan, sehingga tidak dapat dipastikan waktu ketika memasuki fase stationer, yaitu fase pada saat jumlah sel hidup sama dengan jumlah sel yang mati atau pertumbuhan sama dengan nol. Setelah memasuki fase pertumbuhan akhir, pertumbuhan Candida tropicalis semakin lambat, hal ini menunjukkan bahwa nutrisi yang disediakan oleh media YM mengalami penurunan, ditambah lagi dengan adanya penimbunan hasil metabolisme. Sehingga dapat dikatakan bahwa pada Candida, pertumbuhan optimal sel berada pada fase log.
Berdasarkan hasil penentuan kurva produksi xilitol yang disajikan pada Gambar 5, menunjukkan bahwa produksi xilitol berkorelasi positif terhadap pertumbuhan sel khamir C.tropicalis. Semakin besar biomasa sel maka semakin besar juga xilitol yang dihasilkan (Gambar 5b). Tetapi pada waktu inkubasi jam ke-60 xilitol yang dihasilkan sudah mengalami penurunan, walaupun pada jam ke-72 mengalami peningkatan yang tidak terlalu tinggi.
Gambar 5 Pembentukan biomasa sel Candida tropicalis (a) dan produksi xilitol (b).
10
Menurut Yulianto (2001), tipe fermentasi ini dikenal sebagai pertumbuhan associated. Berdasarkan hasil percobaan menunjukkan bahwa produksi xilitol tertinggi pada fermentasi yang dilakukan oleh Candida tropicalis yaitu pada jam ke-48 sebesar 1.14 g/L, dan hasil terendah sebesar 0.73 g/L pada jam ke-12. Waktu inkubasi dengan produksi xilitol tertinggi digunakan sebagai waktu inkubasi optimum untuk produksi xilitol.
Konsentrasi Xilosa Optimum dalam Produksi Xilitol
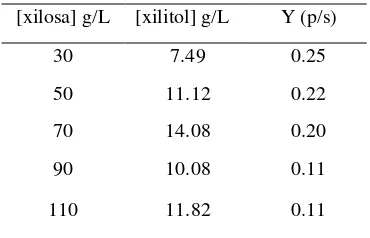
Hasil produksi xilitol pada media fermentasi Candida tropicalis pada konsentrasi xilosa 30g/L, 50g/L, 70 g/L, 90 g/L, dan 110 g/L dengan waktu inkubasi 48 jam, disajikan pada Tabel 2. Berdasarkan hasil percobaan dapat menunjukkan product yield dan efisiensi biokonversi xilosa menjadi xilitol. Efesiensi biokonversi xilosa menjadi xilitol optimum dihasilkan pada konsentrasi xilosa 70 g/L, sebesar 14.08 g/L dengan product yield (Y p/s) sebesar 0.20 g/g, sedangkan pada konsentrasi 90 g/L dan 110 g/L biokonversi xilitolnya lebih rendah dibandingkan dengan konsentrasi xilosa 70g/L, yaitu 10.08g/L (Y p/s = 0.11g/g) dan 11.82 g/L (Y p/s = 0.11 g/g). Akan tetapi jika dilihat dari product yield konsentrasi xilosa 30 g/L paling tinggi yaitu sebesar 0.25 g/g meskipun biokonversinya kecil, hanya sebesar 7.49 g/L. Sedangkan penelitian yang dilakukan oleh Eken dan Cavusoglu (1998) menggunakan konsentrasi xilosa 50-100g/L, dihasilkan produksi xilitol tertinggi pada konsentrasi xilosa 50g/L, yaitu sebesar 13 g/L (Y p/s = 0.260 g/g xilosa).
Hasil penelitian ini menunjukkan bahwa biokonversi xilosa menjadi xilitol meningkat pada kisaran 30-70 g/L xilosa dengan product yield tertinggi pada konsentrasi xilosa 30 g/L, sehingga pada penelitian ini konsentrasi xilosa yang baik untuk memproduksi xilitol pada kisaran 30-70 g/L xilosa, sedangkan pada konsentrasi lebih dari 90 g/L, biokonversi dan product yield-nya rendah. Menurut Meyrial et al. (1991) untuk spesies Candida yang lain yaitu Candida guilliermondii, produksi xilitol tertinggi pada kisaran 20 – 50 g/L xilosa atau 5-10 g/L konsentrasi xilosa untuk Candida mogii (Sirisansaneeyakul et al. 1995).
Konsentrasi xilosa berkisar antara 30-110 g/L didasarkan pada literatur, bahwa xilosa memiliki batas maksimum penggunaan, jika melewati batas optimal
maka xilosa akan menjadi inhibitor bagi produksi xilitol. Menurut Meyrial et al. (1991) konsentrasi xilosa antara 150-200 g/L dapat menjadi inhibitor bagi produksi xilitol untuk C. guilliermondii dan C. boidinii. Xilosa dapat menurunkan produktivitas dan menghambat produksi xilitol pada konsentrasi xilosa yang meningkat dari 100 – 150 g/L, karena adanya penimbunan hasil metabolisme (Thonart et al. 1987; Meyrial et al. 1991; Vandeska et al. 1995). Menurut penelitian yang dilakukan oleh Prior et al. (1989), bahwa selama fermentasi xilosa oleh Candida sp, selain dihasilkan produk (xilitol) dan biomasa, juga terbentuk produk samping seperti etanol dan asam asetat. Keadaan ini tidak menguntungkan karena dapat menurunkan product yield.
Xilitol dihasilkan dari biokonversi xilosa menjadi xilitol, dan besarnya xilitol yang dihasilkan dipengaruhi oleh beberapa faktor, yaitu konsentrasi substrat dan ko-substrat, pH, temperatur, aerasi (Sanchez et al. 2004) dan yang paling penting adalah kemampuan Candida tropicalis dalam mengkonversi xilosa menjadi xilitol dengan bantuan enzim XR (Xilose Reductase) juga dipengaruhi kondisi lingkungan asal sel khamir Candida tropicalis. Walaupun konsentrasi substrat besar, tetapi jika kemampuan dari mikroorganisme untuk mengkonversi rendah, maka efisiensi penggunaan substrat (xilosa) pun tidak optimal.
Tabel 2 Data produksi xilitol pada variasi konsentrasi xilosa
[xilosa] g/L [xilitol] g/L Y (p/s)
30 7.49 0.25
50 11.12 0.22
70 14.08 0.20
90 10.08 0.11
110 11.82 0.11
Y p/s = product yield (g xilitol dihasilkan / g xilosa yang dikonsumsi)
Konsentrasi Ko-substrat (Glukosa) Optimum dalam Produksi Xilitol
11
dapat digunakan untuk menyediakan koenzim (NADH/NADPH) dan suplai energi untuk kehidupan sel Candida tropicalis (Hallborn et al. 1994).
Hasil penelitian yang disajikan pada Tabel 3 menunjukkan bahwa penambahan ko-substrat berupa senyawa glukosa (heksosa) sebesar 12 - 48 g/L pada media fermentasi xilosa, hanya menghasilkan xilitol 1.43 - 4.81 g/L. Sementara pada kontrol (xilosa saja) mencapai 14.08 g/L. Hasil ini memperkuat penelitian yang dilakukan oleh Yulianto (2006) bahwa penambahan ko-substrat berupa glukosa menurunkan produksi xilitol dan produknya hanya 27.5 – 31,1 g/L. Sementara pada kontrol (xilosa saja) mencapai 43.4 /L. Penurunan rasio 6:1% sampai 6:4%, mengurangi produksi xilitol dari 4.81 g/L menjadi 1.43 g/L. Hasil penelitian juga menunjukkan rasio substrat dan ko-substrat yang paling tinggi produksi xilitolnya yaitu 6:1%, sebesar 4.81 g/L, dengan penambahan konsentrasi glukosa 12 g/L.
Penambahan kadar glukosa sampai 48g/L sebagai ko-substrat ke dalam substrat xilosa 70g/L tidak meningkatkan produksi xilitol, tetapi hanya meningkatkan biomasa sel pada inkubasi 48 jam dengan optical density (OD) berkisar 2.316 - 3.192 ketika rasio xilosa dan glukosa diubah dari 6:1% menjadi 6:4%. Hasil ini sejalan dengan hasil penelitian Silva et al. (1996) yang melaporkan efisiensi konversi xilosa menjadi xilitol oleh C.guilliermondii hanya sebesar 45% ketika ditumbuhkan pada media yang mengandung glukosa 1.5% dan xilosa 6.5%, tetapi dapat meningkat sampai 66% jika tanpa glukosa.
Tabel 3 Data produksi xilitol pada konsentrasi xilosa 70g/L dengan penambahan variasi [glukosa]
Hasil percobaan pada Gambar 6 menunjukkan bahwa penurunan xilitol signifikan terjadi dari rasio 6:1% menuju 6:2%, dan terlihat bahwa penambahan ko-substrat tidak mempengaruhi terjadinya peningkatan produksi xilitol. Menurut Yahashi et al. (1996) glukosa akan menghambat penggunaan xilosa sampai ketersediaan glukosa habis, kemudian sel akan menggunakan xilosa untuk pertumbuhan sel dan produksi xilitol. Selain itu, Yulianto (2006) mengungkapkan penelitian yang dilakukan oleh Prior et al. (1989) bahwa selama fermentasi xilosa oleh Candida tropicalis, selain dihasilkan xilitol dan biomassa sel, juga terbentuk produk samping seperti etanol dan asam asetat. Keadaan ini tidak menguntungkan karena dapat menurunkan produksi xilitol. Yulianto (2006) juga menyatakan bahwa penambahan glukosa yang semakin tinggi juga dapat meningkatkan produksi etanol. Keadaan ini menyebabkan arah pembentukan produk utama (xilitol) menjadi berkurang, karena glukosa-6-fosfat (Glu-6P) dalam lintasan heksosa monofosfat untuk menghasilkan NADH/NADPH yang digunakan untuk biokonversi xilosa menjadi xilitol, digunakan untuk pembentukan etanol. Sehingga semakin tinggi konsentrasi glukosa yang ditambahkan maka konsumsi xilosa akan semakin terhambat dan xilitol yang dihasilkan semakin berkurang.
Gambar 6 Produksi xilitol optimum oleh
Candida tropicalis pada
konsentrasi xilosa 70 g/L dengan penambahan variasi [glukosa]. Rasio
xilosa:glukosa
[glukosa] g/L
[xilitol] g/L
6:0 0 14.08
6:1 12 4.81
6:2 24 1.43
6:3 36 1.98
12
Hasil penelitian yang disajikan pada Gambar 7 menunjukkan pertumbuhan sel sejalan dengan konsentrasi glukosa yang digunakan, dan hal ini sesuai dengan peran ko-substrat untuk meningkatkan biomasa sel. Yahashi et al. (1996); Halborn et al. (1994) mengungkapkan bahwa glukosa dipilih sebagai sumber karbon, karena digunakan lebih cepat dan lebih mudah oleh khamir dibandingkan xilosa untuk pertumbuhan sel. Selain itu, glukosa dimetabolisme kembali pada lintasan pentosa fosfat menghasilkan NADPH yang digunakan untuk reduksi xilosa menjadi xilitol, serta untuk suplai energi dalam pemeliharaan metabolisme sel. Menurut Yahashi et al. (1996) konsentrasi sel lebih tinggi pada substrat glukosa dibandingkan dengan menggunakan substrat xilosa, fermentasi selama 9.5 jam dihasilkan 11g/L dan xilosa selama 12 jam menghasilkan 8.4 g/L. Semakin tinggi glukosa yang ditambahkan maka pertumbuhan sel Candida tropicalis semakin besar.
Berdasarkan hasil penelitian dapat disimpulkan bahwa konsentrasi glukosa optimum yang digunakan sebagai ko-substrat, yaitu 12 g/L untuk kadar xilosa 70g/L, dan penambahan kadar glukosa sampai 48 g/L cenderung menurunkan produksi xilitol. Hal ini disebabkan terhambatnya konsumsi xilosa sehingga produksi xilitol menjadi lambat. Tochampa et al. (2005) menyatakan bahwa konsentrasi glukosa yang tinggi dapat menghambat transport xilosa ke dalam sel, sehingga mengakibatkan efisiensi biokonversi xilosa menjadi xilitol juga terhambat.
Gambar 7 Pembentukan biomasa sel Candida tropicalis pada rasio xilosa : glukosa 6:1 – 6:4(%) selama 48 jam inkubasi.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian diperoleh kondisi optimum untuk produksi xilitol, yaitu waktu inkubasi optimum 48 jam, konsentrasi xilosa yang baik untuk memproduksi xilitol pada kisaran 30-70 g/L dengan product yield tertinggi pada konsentrasi xilosa 30 g/L (Y p/s = 0.25 g/g) dan rasio optimum xilosa dan glukosa 6:1% menghasilkan xilitol sebesar 4.81 g/L, dengan penambahan glukosa sebesar 12 g/L.
Hasil penelitian menunjukkan rasio xilosa dan glukosa tertinggi yaitu 6:1 %, akan tetapi xilitol yang dihasilkan masih lebih rendah jika dibandingkan dengan kontrol (xilosa saja). Sehingga dapat disimpulkan bahwa penambahan ko-substrat berupa glukosa pada media xilosa tidak meningkatkan produksi xilitol, tetapi berperan untuk meningkatkan biomasa sel.
Saran
Penelitian lanjutan dengan cara penambahan ko-substrat yang lain seperti arabinosa perlu dilakukan untuk mengetahui pengaruh sebagai ko-substrat terhadap produksi xilitol dengan menggunakan kondisi optimum yang sama, sehingga dapat digunakan sebagai acuan memproduksi xilitol dengan media hidrolisat ampas tebu. Selain itu untuk mengetahui kadar xilitol yang dihasilkan lebih tinggi atau lebih rendah dari penelitian diatas perlu dilakukan penambahan kadar ko-substrat berupa glukosa dengan konsentrasi dibawah 12 g/L dengan kondisi optimum yang sama.
DAFTAR PUSTAKA
Ahmed Z. 2001. Production of natural and rate pentoses using microorganisms and their enzymes. Electronic Journal of Biotechnology 4:2.
Barbosa MFS, Medeiros MB, Mancilha LM, Schneider H, Lee H. 1988. Screening of yeast for production of xylitol from D-xylose and some factor which affect xylitol yield in Candida guillirmondii. J Ind Microbial 3: 241-251.
OPTIMASI KONSENTRASI XILOSA DAN GLUKOSA
UNTUK PRODUKSI XILITOL
OLEH
Candida tropicalis
PUSPA JULISTIA PUSPITA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
12
Hasil penelitian yang disajikan pada Gambar 7 menunjukkan pertumbuhan sel sejalan dengan konsentrasi glukosa yang digunakan, dan hal ini sesuai dengan peran ko-substrat untuk meningkatkan biomasa sel. Yahashi et al. (1996); Halborn et al. (1994) mengungkapkan bahwa glukosa dipilih sebagai sumber karbon, karena digunakan lebih cepat dan lebih mudah oleh khamir dibandingkan xilosa untuk pertumbuhan sel. Selain itu, glukosa dimetabolisme kembali pada lintasan pentosa fosfat menghasilkan NADPH yang digunakan untuk reduksi xilosa menjadi xilitol, serta untuk suplai energi dalam pemeliharaan metabolisme sel. Menurut Yahashi et al. (1996) konsentrasi sel lebih tinggi pada substrat glukosa dibandingkan dengan menggunakan substrat xilosa, fermentasi selama 9.5 jam dihasilkan 11g/L dan xilosa selama 12 jam menghasilkan 8.4 g/L. Semakin tinggi glukosa yang ditambahkan maka pertumbuhan sel Candida tropicalis semakin besar.
Berdasarkan hasil penelitian dapat disimpulkan bahwa konsentrasi glukosa optimum yang digunakan sebagai ko-substrat, yaitu 12 g/L untuk kadar xilosa 70g/L, dan penambahan kadar glukosa sampai 48 g/L cenderung menurunkan produksi xilitol. Hal ini disebabkan terhambatnya konsumsi xilosa sehingga produksi xilitol menjadi lambat. Tochampa et al. (2005) menyatakan bahwa konsentrasi glukosa yang tinggi dapat menghambat transport xilosa ke dalam sel, sehingga mengakibatkan efisiensi biokonversi xilosa menjadi xilitol juga terhambat.
Gambar 7 Pembentukan biomasa sel Candida tropicalis pada rasio xilosa : glukosa 6:1 – 6:4(%) selama 48 jam inkubasi.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian diperoleh kondisi optimum untuk produksi xilitol, yaitu waktu inkubasi optimum 48 jam, konsentrasi xilosa yang baik untuk memproduksi xilitol pada kisaran 30-70 g/L dengan product yield tertinggi pada konsentrasi xilosa 30 g/L (Y p/s = 0.25 g/g) dan rasio optimum xilosa dan glukosa 6:1% menghasilkan xilitol sebesar 4.81 g/L, dengan penambahan glukosa sebesar 12 g/L.
Hasil penelitian menunjukkan rasio xilosa dan glukosa tertinggi yaitu 6:1 %, akan tetapi xilitol yang dihasilkan masih lebih rendah jika dibandingkan dengan kontrol (xilosa saja). Sehingga dapat disimpulkan bahwa penambahan ko-substrat berupa glukosa pada media xilosa tidak meningkatkan produksi xilitol, tetapi berperan untuk meningkatkan biomasa sel.
Saran
Penelitian lanjutan dengan cara penambahan ko-substrat yang lain seperti arabinosa perlu dilakukan untuk mengetahui pengaruh sebagai ko-substrat terhadap produksi xilitol dengan menggunakan kondisi optimum yang sama, sehingga dapat digunakan sebagai acuan memproduksi xilitol dengan media hidrolisat ampas tebu. Selain itu untuk mengetahui kadar xilitol yang dihasilkan lebih tinggi atau lebih rendah dari penelitian diatas perlu dilakukan penambahan kadar ko-substrat berupa glukosa dengan konsentrasi dibawah 12 g/L dengan kondisi optimum yang sama.
DAFTAR PUSTAKA
Ahmed Z. 2001. Production of natural and rate pentoses using microorganisms and their enzymes. Electronic Journal of Biotechnology 4:2.
Barbosa MFS, Medeiros MB, Mancilha LM, Schneider H, Lee H. 1988. Screening of yeast for production of xylitol from D-xylose and some factor which affect xylitol yield in Candida guillirmondii. J Ind Microbial 3: 241-251.
13
immobilized Candida cells on xylitol production from sugarcane bagasse. Z. Naturforsch 55c: 213-217.
Chen LF, Gong CS. 1985. Fermentation of sugarcane bagasse hemicelluloses hydrolysates to xylitol by hydrolysates-acclimatized yeast. Journal of Food Science 50: 226-228.
Chiang C, Knight SG. 1961. Metabolism of D-xylose by moulds. Nature 188:79-81.
Dahiya JS. 1991. Xylitol production by Petromyces albertensis grown on containing D-xylose. Can J Microbiol 37: 14-18.
Diz J, Jose MC, Herminia D, Juan C Parajo. 2002. Xylitol production from Eucalyptus wood hydrolysates in low-cost fermentation media. Food Technol Biotechnol 40: 191-197.
Eken SN, Cavusoglu H. 1998. Fermentative performance of Candida tropicalis Kuen 1022 yeast for D-xylose and sunflower seed hull hydrolysate in xilitol production. Journal of Engineering and Enviromental Science 23: 433-438.
Emodi A. 1978. Xylitol its properties and food applications. Food Technol 32: 20-32.
Fathir F. 2009. Media pertumbuhan mikroba.
[terhubung berkala].
http://fuadfathir.multiply.com/journa l/item/2 [14 Sept 2009].
Girio FM, Peito MA, Amaral-Collaco MT. 1990. In Biomass for Energy and Industry, Vol 2, eds Grassi G, Gosse G, dos Santos, G lsevier Applied Science.
Gong CS, Chen LF, Tsao GT. 1981. Quantitative production of xylitol from D-xylose by a high xylitol producing yeast mutant Candida tropicalis HXP2. Biotechnology Letters 3: 130-135.
Granstrom T. 2002. Biotechnological production of xylitol with Candida yeasts [thesis]. Helsinki: University of Technology, Finland.
Gurgel PV, Mancilha IM, Pecanha RP, Siqueira JFM. 1995. Xylitol recovery from fermented sugarcane bagasse hydrolysate. Bioresource Technology 52: 219-223.
Hallborn J et al. 1994. The influence of co-substrate and aeration on xylitol formation on recombinant
Saccharomyces cerevisiae
expressing the XYL 1 gen. Appl Microbial Biotechnol 42:326-333.
Horitsu H et al. 1992. Production of xylitol from D-xylose by Candida tropicalis: Optimization of production rate. Biotechnology of Bioengineering 40: 1085-1091
Hurley R. 1979. The pathogenic Candida species and diseases caused by Candida in man. J Biol Chem 20: 231-235.
Jaffe GM. 1978. Xylitol – a specialty sweetener. Sugar y Azucar 93:36-42.
Kiet A, Milgrom P, Rothen M. 2006. Xylitol, sweeteners, and dental caries. Pediatric Dentistry 28: 154-163.
Ko BS, Kim J, Kim JH. 2006. Production of xylitol from D-xylose by a xylitol dehydrogenase gene-disrupted mutant of Candida tropicalis.
Applied Enviromental and
Microbiology 72: 4207–4213.
Meyrial V, Delgenes JP, Moletta R, Navarro JM. 1991. Xylitol production from D-xylose by Candida guilliermondii: Fermentation Behavior. Biotechnology Letters 13: 281-286.
Nolleau V, Preziosi-Belloy L, Delgenes JP, Navarro JM. 1993. Xylitol production from xylose by two yeast strains. Curr Microbiol 27: 191-197.
14
Parajo JC, Herminia D, Jose MD. 1998. Biotechnological production of xylitol. Part 2: Operation in culture media made with commercial sugars. Bioresource Technology 65: 203-212.
Prior BA, Kilian SG, Du Preez JC. 1989. Fermentation of D-xylose by yeast Candida shehatae dan Pichia stipitis: Prospects and problems. Process Biochemistry 24: 21-32.
Rao RS, Jyothi CP, Prakasam RS, Sarma PN, Rao LV. 2006. Xylitol production from corn fiber and sugarcane bagasse hydrolysate by Candida tropicalis. Bioresource Technology 97: 1974-1978.
Saha BC, Bothast RJ. 1997. Fuels and chemicals from biomass, ch17, microbial production of xylitol. American Chemical Society 307-319
.
Sampaio et al. 2003. Screening of filamentous fungi for production of xylitol from D-xylose. Brazilian Journal of Microbiology 34: 325-328.
Sanchez S, V Bravo, AJ Moya, E Castro, F Camacho. 2004. Influence of temperature on fermentation of D-xylose by Pachysolen tannophilus to produce ethanol and xylitol. Process Biochemistry 39: 673-679.
Silva SS, Roberto IC, Felipe MGA, Machilha IM. 1996. Batch fermentation of xylose for xylitol production in stirred tank bioreactor. Process Biochemistry 31: 549-553.
Sirisansaneeyakul S, Staniszewski M, Rizzi M. 1995. Screening of yeast for production of xylitol from D-xylose. Jerment. Bioeng 80: 565-570.
Thonart P, Gomez J, Foucart M, Paquot M. 1987. Medicine Faculty Landbouww. Rjksuniversitant Gent 52: 1517-1528.
Tochampa et al. 2005. A model of xylitol production by the yeast Candida
mogii. Bioprocess Biosyst Eng 28: 175-183.
Uhari M, Kontiokori T, Koskela M, Niemela M. 1996. Xylitol chewing gum in prevention of acute otitis media: double blind randomized trial. Br Med J 313: 1180-1184.
Vandeska E, Amartey S, Kuzmanova S, Jeffries TW. 1995. Effect of environmental conditions on production of xylitol by Candida boidinii. J Microbiol Biotechnol 11: 3-8.
Vandeska E, Amartey S, Kuzmanova S, Jeffries T. 1996. Feed-batch culture for xylitol production by Candida boidinii. Process Biochemistry 31: 265-270
Yahashi Y et al. 1996. Production of xylitol from D-xylose by Candida tropicalis the effect of D-glucose feeding. Journal of Fermentation and Bioengineering 81: 148-152.
Yoshitake J, H Ishizki, M Shimamura, T Iami. 1973. Xylitol production by Enterobacter species. Agri Biol Chem 37: 2261-2267.
Yulianto WA. 2001. Pengaruh pH, kadar xilosa dan kadar glukosa terhadap produksi xilitol oleh Candida shehatae WAY 08. Jurnal Teknologi dan Industri Pangan 12: 156-162.
Yulianto WA, KR Kuswanto, Tranggono, Retno I. 2006. Kinetika fermentasi pada produksi xilitol dengan penambahan arabinosa dan glukosa sebagai ko-substrat oleh Candida shehatae WAY 08. Jurnal Teknologi dan Industri Pangan 16: 215-221.
Wahyuni, Susilowati A, Setyaningsih R. 2004. Optimasi produksi xilitol dengan variasi konsentrasi hidrolisat hemiselulosa baggase oleh Candida tropicalis.J Biofarm 2:29-34.
OPTIMASI KONSENTRASI XILOSA DAN GLUKOSA
UNTUK PRODUKSI XILITOL
OLEH
Candida tropicalis
PUSPA JULISTIA PUSPITA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
PUSPA JULISTIA PUSPITA. Optimasi Konsentrasi Xilosa dan Glukosa untuk
Produksi Xilitol oleh
Candida tropicalis
. Dibimbing oleh LAKSMI
AMBARSARI dan SURYANI.
Penelitian ini bertujuan menentukan waktu inkubasi optimum untuk panen
sel
C.tropicalis
dan produksi xilitol, serta kondisi lingkungan optimum untuk
memproduksi xilitol, meliputi konsentrasi substrat dan ko-substrat. Dalam
penelitian ini dilakukan 2 tipe optimasi, yaitu variasi konsentrasi xilosa 50-110
g/L, dan rasio xilosa dan glukosa antara 6:1
–
6:4 (%). Fermentasi dilakukan pada
suhu 30
0C dalam 125 mL labu Erlenmeyer dengan kecepatan pengocokan 120
rpm selama 48 jam. Pengukuran kadar xilitol ditentukan dengan metode
spektofotometer menggunakan kit D-sorbitol/D-xilitol. Hasil penelitian
menunjukkan bahwa konsentrasi xilosa yang baik untuk memproduksi xilitol pada
kisaran 30
–
70 g/L dengan
product yield
tertinggi pada konsentrasi xilosa 30 g/L
(Y produk/substrat = 0.25 g/g) dan rasio optimum xilosa dan glukosa sebesar 6:1
(%) menghasilkan xilitol sebesar 4.81 g/L, dengan penambahan glukosa sebesar
12 g/L. Penambahan glukosa sebagai ko-substrat 12 - 48 g/L pada media
fermentasi tidak meningkatkan produksi xilitol, tetapi berperan untuk
meningkatkan biomasa sel.
ABSTRACT
PUSPA JULISTIA PUSPITA. Optimization of Xylose and Glucose Concentration
for Xylitol Production by
Candida tropicalis
. Under direction of LAKSMI
AMBARSARI and SURYANI.
The objectives of this research were to determine the optimum time of
incubation to harvest cell of
Candida tropicalis
and xylitol production, and
optimum environtment condition to produce xylitol as well, including substrate
and co-substrate concentration. In this research, were done optimization of xylose
concentration
50-110 g/L and ratio of xylose and glucose between 6:1-6:4 (%).
Fermentation was carried out at 30
0C in 125 mL Erlenmeyer flask at 120 rpm for
48 hours. Xylitol concentration was measured by spectrophotometre method
(D-sorbytol/D-xylitol kit). The research result showed that good xylose concentration
to produce xylitol be in 30-70 g/L with highest product yield of xylose
concentration be 30 g/L (Y product/substrate = 0.25 g/g) and the optimum ratio of
xylose and glucose be 6:1 (%) which produces 4.81 g/L of xylitol, with addition
of glucose was 12 g/L. The adding of glucose as co-substrate 12
–
48 g/L in the
fermentation media could not increase xylitol production, but it has role to
increase the cell biomass.
OPTIMASI KONSENTRASI XILOSA DAN GLUKOSA
UNTUK PRODUKSI XILITOL
OLEH
Candida tropicalis
PUSPA JULISTIA PUSPITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokima
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Optimasi Konsentrasi Xilosa dan Glukosa untuk Produksi
Xilitol oleh
Candida tropicalis
Nama
: Puspa Julistia Puspita
NIM
: G84052095
Disetujui
Dr. Laksmi Ambarsari, MS. Dr. Suryani, M.Si.
Ketua Anggota
Diketahui
Dr. I. Made Artika, M. App. Sc
Ketua Departemen Biokimia
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas
segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan
salam semoga selalu tercurah kepada Nabi Muhammad SAW, keluarga, sahabat,
dan para pengikutnya sampai akhir zaman. Judul penelitian yang dipilih adalah
Optimasi Konsentrasi Xilosa dan Glukosa untuk Produksi Xilitol oleh
Candida
tropicalis
. Penelitian ini telah dilakukan dari bulan April 2009 sampai dengan
Agustus 2009 di Laboratorium Departemen Biokimia IPB.
Ucapan terima kasih penulis sampaikan kepada Dr. Laksmi Ambarsari, MS.
dan Dr. Suryani, M.Si. sebagai pembimbing yang telah memberikan saran, kritik,
dan bimbingannya. Ucapan terima kasih juga penulis sampaikan kepada keluarga
atas segala doa, kasih sayang, dan dukungan morilnya serta kepada semua pihak
yang telah membantu secara langsung maupun tidak langsung penyelesaian karya
ilmiah ini.
Penulis menyadari masih terdapat banyak kekurangan dalam penulisan
karya ilmiah ini. Oleh karena itu, penulis sangat mengharapkan kritik dan saran
dari berbagai pihak. Semoga karya ilmiah ini bermanfaat bagi kita semua. Amin.
Bogor, Januari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Curup pada tanggal 17 Juli 1987 dari pasangan Supeno
Agus Cahyono dan Elly Yulfriza. Penulis merupakan putri ketiga dari tiga
bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 1 Curup dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih mayor Biokimia, Fakultas Matematika da
![Gambar 6 Produksi xilitol optimum oleh Candida tropicalis pada konsentrasi xilosa 70 g/L dengan penambahan variasi [glukosa]](https://thumb-ap.123doks.com/thumbv2/123dok/720593.363003/13.595.327.507.480.696/gambar-produksi-candida-tropicalis-konsentrasi-penambahan-variasi-glukosa.webp)