PENAMBAHAN GLUKOSA SEBAGAI KOSUBSTRAT DAN
PENGARUHNYA TERHADAP PRODUKSI XILITOL
OLEH Candida guilliermondii
STEFFANUS GOZALES
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
2
ABSTRAK
STEFFANUS GOZALES. Penambahan Glukosa sebagai Kosubstrat dan
Pengaruhnya terhadap Produksi Xilitol oleh Candida guilliermondii. Dibimbing
oleh LAKSMI AMBARSARI dan SURYANI.
Xilitol merupakan gula alkohol berkarbon lima yang banyak digunakan di
berbagai bidang. Xilitol dapat diproduksi dengan ekstraksi langsung dari
buah-buahan dan sayur-sayuran, serta sintesis kimia yang mahal dan boros energi. Oleh
karena itu dibutuhkan teknik produksi alternatif yang lebih murah dengan
memanfaatkan mikroba. Penelitian bertujuan menentukan waktu inkubasi
optimum untuk pertumbuhan biomassa sel C. guilliermondii dan produksi xilitol,
serta menentukan variasi glukosa:xilosa yang optimum. Fermentasi dilakukan
pada suhu 30
0C dengan kecepatan 120 rpm. Variasi rasio yang digunakan adalah
(glukosa:xilosa) 1:25, 1:12, 1:5, 1:2.5. Kadar xilitol diukur menggunakan
spektrofotometer dengan Kit D-sorbitol/D-xilitol. Hasil penelitian menunjukkan
fase eksponensial dari pertumbuhan sel C. guilliermondii terdapat pada inkubasi
jam ke-12 sampai 36, dan waktu inkubasi optimum untuk memperoleh kadar
xilitol tertinggi adalah 72 jam. Variasi rasio glukosa:xilosa yang terbaik adalah
rasio 1:5 dengan konsentrasi glukosa 9 g/L dan konsentrasi xilosa 45 g/L. Kadar
xilitol yang diperoleh dari rasio tersebut sebesar 2.85 g/L sedangkan xilitol yang
diperoleh dari media kontrol, yaitu media yang mengandung hanya xilosa 45 g/L
adalah 0.57 g/L, dengan demikian penambahan glukosa sebagai kosubstrat ke
dalam media fermentasi dapat meningkatkan produksi xilitol.
3
ABSTRACT
STEFFANUS GOZALES. Addition of Glucose as Co-substrate and its Effect on
Xylitol Production by Candida guilliermondii. Under direction of LAKSMI
AMBARSARI dan SURYANI.
Xylitol is a five-carbon sugar alcohol and used commercially in various
fields. Xylitol can be produced by solid-liquid extraction from fruits and
vegetables, also chemical synthesis which is expensive and energy-intensive.
Therefore, an alternative inexpensive production techniques is required, one of
them is using microorganism. The purposes of this research were to determine the
optimum incubation time for the growth of C. guilliermondii, and xylitol
production, also to determine the best ratio variation of glucose:xylose.
Fermentation was carried out at 30
0C with shaking speed 120 rpm. Ratio variation
used in this research were (glucose:xylose) 1:25, 1:12, 1:5, 1:2.5. Xylitol
concentration was measured with spectrophotometer based on
D-sorbitol/D-xylose Kit. The results showed the log phase of the growth of C. guilliermondii at
12-36 hour, and the optimum incubation time to obtain the highest amount of
xylitol at 72 hour. The best variation ratio of glucose:xylose is 1:5 with initial
glucose concentration 9 g/L and xylose concentration 45 g/L. Xylitol obtained
from ratio 1:5 was 2.85 g/L while xylitol obtained from control medium, which is
the medium that contained only xylose 45 g/L was 0.57 g/L, thus the addition of
glucose to fermentation medium can increase the production of xylitol.
4
PENAMBAHAN GLUKOSA SEBAGAI KOSUBSTRAT DAN
PENGARUHNYA TERHADAP PRODUKSI XILITOL
OLEH Candida guilliermondii
STEFFANUS GOZALES
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
5
Judul
Skripsi
:
Penambahan Glukosa sebagai Kosubstrat dan
Pengaruhnya terhadap Produksi Xilitol oleh Candida
guilliermondii
Nama :
Steffanus
Gozales
NIM :
G84050297
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS. Dr. Suryani, M.Sc.
Ketua Anggota
Diketahui
Dr. I. Made Artika, M. App. Sc
Ketua Departemen Biokimia
6
PRAKATA
Puji-pujian serta syukur yang tak terhingga penulis haturkan ke hadirat
Tuhan Yang Maha Kuasa atas segala berkat dan karunia-Nya sehingga penulis
dapat menyelesaikan penulisan skripsi berjudul Penambahan Glukosa sebagai
Kosubstrat dan Pengaruhnya terhadap Produksi Xilitol oleh Candida
guilliermondii. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh
gelar Sarjana Sains pada Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor. Penelitian dilakukan mulai dari
bulan Mei 2009 sampai dengan Agustus 2009 di Laboratorium Departemen
Biokimia IPB.
Penulisan skripsi ini juga dapat berlangsung dengan baik karena adanya
dukungan moril maupun materiil dari berbagai pihak. Oleh karena itu pada
kesempatan ini penulis mengucapkan terima kasih sebesar-besarnya kepada Dr.
Laksmi Ambarsari, MS. dan Dr. Suryani, M.Sc. sebagai dosen yang telah
memberikan saran, kritik, dan bimbingannya. Ucapan terima kasih juga penulis
sampaikan kepada keluarga tercinta atas doa, dukungan, dan kasih sayang, dan
kepada teman-teman tim peneliti xilitol (Siska dan Puspa). Penulis berharap agar
skripsi ini dapat bermanfaat bagi pihak yang memerlukannya.
Bogor, Oktober 2010
7
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 29 Desember 1987. Penulis
adalah anak pertama dari pasangan Markus Wijaya dan Rosalina. Penulis
memiliki saudara kandung yaitu Griselda Agnes Gozales.
Penulis menyelesaikan pendidikan Sekolah Menengah Atas (SMA) di
SMAK 2 BPK Penabur Jakarta (2002-2005). Pada tahun 2005 penulis diterima di
Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru
(SPMB). Pada tahun 2006 setelah menyelesaikan masa TPB di IPB penulis
diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
Selama di IPB, penulis pernah aktif menjadi anggota Keluarga Mahasiswa
Katholik IPB (KeMaKI) (2006-2009), anggota tim penyanyi Agria Swara dalam
acara Studium Generale oleh Dr. H. Susilo Bambang Yudhoyono, MA dalam
rangka Grand Launching Program Doktoral Manajemen Bisnis IPB (2006),
panitia Natal Civa (2006), anggota seksi dokumentasi dalam Konser Tahunan
Agria Swara “Vox Versatilus” (2006), anggota penyanyi dalam tim “Agria Swara
Goes to Hungary” (2007), ketua konser Agria Swara “A Golden Journey” (2007),
anggota tim penyanyi dalam konser kemerdekaan bersama Twilight Orchestra
(2007), staff Departemen PSDM Agria Swara (2007-2008), koordinator seksi
latihan dan penyanyi dalam Konser Tahunan Agria Swara “Rhine-Danubian
Cruise” (2008), anggota tim penyanyi dalam konser “Terima Kasih Pemuda”
bersama Twilight Orchestra dalam rangka Hari Raya Sumpah Pemuda (2008), dan
anggota seksi latihan dalam Konser Tahunan Agria Swara “Eulogy to the Joy of
Singing” (2009). Selain itu, penulis pernah melakukan Praktik Lapang (PL) di PT.
Indofood Sukses Makmur, Tbk (2008).
8
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Xilitol ... 1
Produksi Xilitol oleh Mikrob ... 3
Efek Penambahan Glukosa sebagai Kosubstrat ... 4
Pertumbuhan Mikrob ... 5
BAHAN DAN METODE
Alat dan Bahan ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Pertumbuhan Biomassa Sel ... 7
Produksi Xilitol ... 8
Rasio Glukosa:Xilosa Optimum ... 8
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 11
LAMPIRAN ... 15
9
Halaman
1
Struktur kimia xilitol ... 1
2
Metode produksi xilitol ... 2
3
Skema awal fermentasi xilosa oleh C. guilliermondii ... 3
4
Kurva pertumbuhan mikrob ... 5
5
Hubungan antara waktu inkubasi dengan absorbansi biomassa sel (kurva
merah) dan produksi xilitol (kurva biru). ... 7
6
Hubungan antara variasi rasio glukosa:xilosa dengan konsentrasi xilitol
(g/L) ... 9
7
Skema metabolisme glukosa dan xilosa pada khamir ... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2
Persiapan bahan pengukuran kadar xilitol (Metode Roche) ... 17
3
Data kurva pertumbuhan dan kurva produksi ... 18
4
Data kurva produksi ... 19
5
Data variasi rasio glukosa:xilosa ... 20
PENDAHULUAN
Xilitol (disebut juga gula alkohol atau polialkohol) merupakan pemanis alami yang2
terdapat pada sayuran dan buah-buahan seperti wortel, kembang kol, selada, bawang bayam, pisang, stroberi, raspberry, plum, kuning, dan apel. Xilitol juga diproduksi oleh tubuh sebanyak 15 g/hari sebagai senyawa antara dalam metabolisme glukosa. Xilitol mempunyai tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya 40% lebih rendah dari kelompok karbohidrat lainnya (Ly et al. 2006). Xilitol merupakan gula berkarbon lima yang tidak dapat difermentasi oleh bakteri Streptococcus
mutans penyebab kerusakan gigi, sehingga
bersifat nonkariogenik yang aman untuk kesehatan gigi (Sampaio et al. 2003). Secara farmakologi, xilitol mempunyai peran untuk mencegah kerusakan gigi, infeksi telinga pada anak-anak, dan sebagai pengganti gula untuk pasien diabetes (Cao et al. 1994). Pada industri bahan makanan, xilitol digunakan sebagai bahan utama untuk pembuatan permen, permen karet (chewing gums), dan minuman ringan. Selain itu, xilitol juga banyak digunakan pada produk-produk kesehatan gigi, seperti pasta gigi (Ly et al. 2006).
Secara ekonomi, xilitol mempunyai harga jual yang tinggi dan mempunyai kegunaan pada bidang kesehatan, farmasi, dan industri makanan. Harganya yang mahal menyebabkan ketersediaan xilitol dalam dunia perdagangan masih rendah, sedangkan permintaan xilitol semakin meningkat dan aplikasi xilitol pun semakin luas. Selama ini, teknik produksi xilitol yang paling umum digunakan adalah secara kimiawi dengan teknik hidrogenasi xilosa. Produksi xilitol melalui proses ini memerlukan biaya yang tinggi. Selain diperlukan energi yang tinggi, bahan baku utama yang digunakan dalam proses tersebut adalah xilosa murni yang menghasilkan xilitol yang masih memerlukan proses pemurnian. Proses produksi ini membuat harga xilitol menjadi mahal serta boros energi (Soleimani et al. 2006).
Mahal dan borosnya proses hidrogenasi xilosa menyebabkan diperlukannya upaya untuk meningkatkan produksi xilitol dengan harga yang murah dan hemat energi. Produksi xilitol dengan proses bioteknologi melalui fermentasi dengan memanfaatkan mikrob merupakan salah satu cara yang diharapkan dapat memberikan hasil yang lebih ekonomis dibandingkan secara kimiawi (Rao et al. 2006).
Penelitian ini menggunakan mikrob khamir spesies Candida guilliermondii yang merupakan salah satu mikrob khamir
penghasil xilitol terbaik (Silva et al. 2007; Rosa et al. 1998). Keberhasilan biokonversi xilosa menjadi xilitol secara fermentasi bergantung pada beberapa faktor, misalnya suhu, pH, kondisi aerasi, konsentrasi substrat, dan keberadaan gula lain selain xilosa seperti glukosa.
Penelitian bertujuan menentukan waktu inkubasi optimum untuk pertumbuhan biomassa sel C. guilliermondii dan produksi xilitol, serta menentukan konsentrasi glukosa optimum yang ditambahkan ke dalam media fermentasi. Hipotesis dari penelitian ini adalah penambahan glukosa sebagai kosubstrat dengan rasio konsentrasi glukosa:xilosa yang optimum dapat meningkatkan produksi xilitol. Hasil penelitian diharapkan dapat menambahkan informasi tentang produksi xilitol menggunakan sel khamir (khususnya khamir C. guilliermondii). Selain itu hasil penelitian juga diharapkan dapat memberikan informasi konsentrasi glukosa optimum yang perlu ditambahkan untuk meningkatkan produksi xilitol.
TINJAUAN PUSTAKA
XilitolXilitol termasuk senyawa poliol yang mempunyai tingkat kemanisan setara dengan sukrosa (Gambar 1). Xilitol juga merupakan senyawa antara pada metabolisme karbohidrat mamalia. Beberapa studi telah menunjukkan efek yang menguntungkan dari xilitol sebagai pemanis ketika digunakan sebagai senyawa tunggal atau terformulasi dalam kombinasi dengan gula lainnya dalam yoghurt, selai, dan makanan beku (Ly et al. 2006)..
Tingkat pertumbuhan bakteri S. mutans pada air liur dan plak dapat dikurangi dengan konsumsi xilitol. Selain itu, xilitol dapat mengurangi kemungkinan transmisi S. mutans dari ibu ke anak (Lynch & Milgrom 2003). Kebutuhan xilitol yang terus meningkat diikuti dengan kemampuan xilitol yang secara
3
Gambar 2 Metode produksi xilitol (Parajo et al. 1998). fungsional memperluas aplikasi xilitol untuk
meningkatkan kesehatan gigi (Peldyak & Makinen 2002). Efek lainnya yang terkait dengan pemasukkan xilitol secara oral meliputi remineralisasi gigi, penebalan kristal mineral pada lapisan dalam enamel gigi, dan stimulasi diekskresikannya air liur tanpa menurunkan pH (Miake et al. 2003). Sebagai komponen dalam pasta gigi, xilitol mempunyai kemampuan untuk mengembalikan kelembaban mulut (Milgrom
et al. 2009). Beberapa sifat lain dari xilitol
antara lain mudah larut dalam air, tahan terhadap panas, tidak mudah mengalami karamelisasi (cocok untuk pembuatan jenis roti tertentu), memberikan sensasi dingin seperti mentol (Ahmed 2001), dan menghasilkan energi hanya 2.4 kkalori/g (cocok bagi penderita kegemukan/obesitas). Obesitas dapat dihindari dengan konsumsi reguler dari xilitol (Parajo et al. 1998).
Alasan mengapa xilitol dapat digunakan oleh penderita diabetes disebabkan oleh beberapa hal, yaitu xilitol diserap secara lambat oleh sistem pencernaan, langkah awal metabolisme dari xilitol tidak bergantung pada hormon insulin, dan xilitol tidak menimbulkan perubahan besar pada konsentrasi gula dalam darah (Soleimani et al. 2006; Ly et al. 2006). Selain itu, xilitol juga mempunyai potensi sebagai penyembuh osteoporosis (Mattila et al. 2001). Xilitol mempunyai banyak kelebihan sebagai komposisi makanan atau zat aditif, contohnya xilitol tidak mengalami reaksi Maillard yang bersifat merusak yang mengakibatkan efek
darkening dan penurunan nilai nutrisi dari
protein karena hancurnya asam amino dalam protein tersebut (Rangaswamy 2003; Soleimani et al. 2006). Xilitol juga dapat digunakan sebagai agen penstabil selama ekstraksi protein untuk menghindari denaturasi protein (Maloney & Amburdkar 1989).
Banyak penelitian yang dilakukan berfokus pada produksi xilitol dari xilosa. Sebelumnya produksi xilitol dianggap sebagai produk samping dalam fermentasi etanol dari xilosa. Awal dilakukannya penelitian yang berfokus pada xilitol adalah penapisan sejumlah mikroorganisme yang didasarkan pada potensi produksi xilitol. Selain itu karena sifat-sifat xilitol yang unik, permintaan pasar dari xilitol pun mulai meningkat dan penelitian-penelitian yang berfokus pada xilitol mulai banyak dilakukan (Winkelhausen & Kuzmanova 1998).
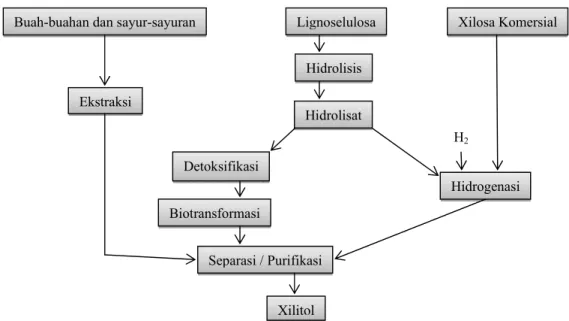
Produksi xilitol dapat dicapai melalui tiga metode, yaitu ekstraksi padat-cair, sintesis kimia, dan bioteknologi (Gambar 2). Xilitol dapat diekstraksi dari sumber-sumber yang mengandung xilitol seperti buah-buahan dan sayur-sayuran tetapi dalam proporsi yang sangat kecil (kurang dari 0.01 % g/g) (Pepper & Olinger 1988). Metode kedua yaitu dengan proses sintesis kimia (hidrogenasi xilosa) yang membutuhkan biaya produksi yang mahal (membutuhkan xilosa murni), kebutuhan energi yang tinggi (suhu 80-140oC dan tekanan 50 atm), dan membutuhkan katalis logam nikel dalam prosesnya (Soleimani et al. 2006). Metode ketiga Buah-buahan dan sayur-sayuran Lignoselulosa Xilosa Komersial
Ekstraksi Hidrolisis Hidrolisat Hidrogenasi H2 Detoksifikasi Biotransformasi Separasi / Purifikasi Xilitol
4
menggunakan pendekatan bioteknologi dengan proses fermentasi oleh mikrob, contohya khamir C. guilliermondii, yang diharapkan dapat menutupi kekurangan-kekurangan yang terdapat pada kedua metode di atas.
Limbah-limbah dari industri Pertanian dan perhutanan umumnya terdiri atas material lignoselulosa. Ketersediaan dan melimpahnya produk-produk perhutanan dan residu-residu pertanian yang dapat diperbaharui menawarkan penggunaan xilosa sebagai bahan utama untuk memproduksi xilitol. Xilosa dan arabinosa menyusun 95% hemiselulosa arabino-xilan pada jaringan tanaman. Gula pentosa menyusun sekitar 19-33%, 10-12%, dan 40% pada kayu-kayu keras, kayu-kayu lunak, dan residu pertanian (Winkelhausen & Kuzmanova 1998). Beberapa sumber xilosa yang berasal dari residu-residu pertanian adalah beras jerami (Roberto et al. 1996). Substrat xilosa yang paling banyak digunakan dalam skala industri pada saat ini berasal dari hidrolisat ampas tebu yang juga mengandung berbagai macam gula seperti glukosa, arabinosa, dan lain-lain (Alves et al. 1998; Lee et al. 1996; Sene et al. 2001; Rodrigues et al. 2003; Silva et al. 2004). Gula selain xilosa yang terkandung dalam ampas tebu tersebut berpengaruh terhadap biokonversi xilosa menjadi xilitol.
Produksi Xilitol oleh Mikrob Mikrob yang mempunyai aktivitas dalam melakukan biokonversi xilosa menjadi xilitol adalah khamir, bakteri, dan fungi. Pemilihan khamir sebagai penghasil xilitol terbaik telah banyak dilakukan dalam berbagai penelitian. Menurut Saha dan Bothast (1997), spesies khamir yang dapat memproduksi xilitol adalah C. guilliermondii, Candida tropicalis,
Candida pelliculosa, Candida boidinii, dan
genus dari Saccharomyces, Debaryomyces,
Pichia, Hansenula, Torulopsis, Kloeckera, Trichosporon, Cyptococcus, Rhodotorula, Monilia, Kluyveromyces, Pachysolen, Ambrosiozyma, dan Torula. Berdasarkan
laporan hasil-hasil penelitian, diperoleh informasi bahwa mikroorganisme terbaik dalam memproduksi xilitol adalah khamir dari genus Candida (C. guilliermondii, C.
tropicalis, C. pelliculosa, Candida parapsilosis) (Carvalho et al. 2000; Sampaio et al. 2003).
Khamir dapat mengkonversi xilosa menjadi xilulosa melalui reaksi redoks yang melibatkan dua rangkaian reaksi. Enzim yang mengkatalis reaksi pertama yaitu enzim
Xylose Reductase (XR) yang bekerja
menggunakan kofaktor NADPH atau NADH untuk mengkonversi xilosa menjadi senyawa antara xilitol (Gambar 3). Reaksi selanjutnya xilitol ditransformasi menjadi xilulosa oleh enzim Xylitol Dehydrogenase (XDH) dengan kofaktor NAD+ atau NADP+ (Hahn-Hägerdal
et al. 1994).
Spesies khamir yang berbeda mempunyai kemampuan yang berbeda-beda dalam memfermentasi xilosa menjadi xilitol atau etanol. Yablochkova et al. (2001) menyatakan kemampuan khamir untuk memproduksi xilitol atau etanol berdasarkan pada aktivitas enzim XR. Jenis khamir yang mempunyai aktivitas enzim XR yang bergantung pada kofaktor NADPH dan NADH tidak dapat mengakumulasi xilitol melainkan memproduksi etanol, contohnya Pichia
stipitis, C. shehatae, dan Pachysolen tannophilus. Jenis khamir yang mempunyai
aktivitas enzim XR yang hanya bergantung pada NADPH dapat mengakumulasi xilitol, contohnya C. guilliermondii, C. tropicalis, dan C. parapsilosis.
Menurut Ooi et al. (2002), C.
guilliermondii dan C. tropicalis yang
ditumbuhkan dalam media yang mengandung
Gambar 3 Skema awal fermentasi xilosa oleh C. guilliermondii (Barbosa et al. 1988).
Xilitol
Xilosa Xilulosa
Xilosa
Reduktase Dehidrogenase Xilitol
Xilulosa Kinase Xilulosa-5-fosfat Jalur Pentosa Fosfat Rantai respirasi
5
xilosa 2% b/v menghasilkan xilitol dengan
product yield (Y p/s) berturut-turut sebesar
84-86% dan 63-68%. Dalam penelitian yang dilakukan Rosa et al. (1998), sebanyak 66.4 g/L xilosa habis dikonsumsi oleh C.
guilliermondii selama fermentasi 48 jam
untuk menghasilkan xilitol sebesar 43 g/L dengan produktivitas volumetrik (Qp) 0.9 g/Lh, dan menurutnya C. guilliermondii dan
C. tropicalis merupakan khamir penghasil
xilitol terbaik. Meyrial et al. (1991) menghasilkan xilitol sebesar 221 g/L dari 300 g/L xilosa dengan product yield (Y p/s) sebesar 0.75 g/g menggunakan C.
guilliermondii. Vandeska et al. (1995) di
dalam penelitiannya memilih menggunakan
D. hansenii dan C. boidini sebagai penghasil
xilitol.
Contoh beberapa spesies bakteri yang dapat menghasilkan xilitol yaitu Enterobacter
liquifaciens, Corynebacterium sp., dan Mycobacterium smegmatis (Horitsu et al.
1992). Yoshitake et al. (1973) dalam penelitiannya menggunakan Enterobacter menghasilkan xilitol sebesar 33.3 g/L dalam media yang mengandung 100 g/L xilosa. Rangaswamy (2003) memperoleh product
yield (Y p/s) tertinggi menggunakan Corynebacterium sp. sebesar 0.57 g/g dengan
konsentrasi xilosa mula-mula 75 g/L.
Penelitian yang dilakukan oleh Dahiya (1991) menggunakan fungi Petromyces
albertensis menghasilkan xilitol sebesar 39.8
g/L setelah 10 hari fermentasi pada media yang mengandung konsentrasi xilosa mula-mula 100 g/L. Ueng dan Gong (1982) mengamati kadar xilitol yang rendah dalam fermentasi menggunakan Mucor sp. pada hidrolisat ampas tebu. Selain itu, Chiang dan Knight (1961) melaporkan bahwa Penicillium,
Aspergillus, Rhizopus, Byssochlamys, Glicoladium, Myrothecium, dan Neurospora
sp. merupakan jenis fungi yang mempunyai kemampuan untuk memproduksi xilitol dalam kadar yang rendah dari sumber karbon xilosa.
Efek Penambahan Glukosa sebagai Kosubstrat
Efek berlawanan telah dilaporkan pada fermentasi xilosa menjadi xilitol oleh khamir ketika dilakukan penambahan glukosa sebagai kosubstrat ke dalam media fermentasi. Yahashi et al. (1996) mengamati bahwa C.
tropicalis menghasilkan xilitol 84.5 g/L dan
memakai sebagian substrat untuk pertumbuhan jika digunakan media yang hanya mengandung xilosa sebagai sumber karbon utama (pada konsentrasi 150 g/L).
Penambahan glukosa sebagai tambahan sumber karbon meningkatkan proses keseluruhan, tetapi penambahan glukosa berikutnya justru mengurangi pemakaian xilosa dan produktivitas xilitol akibat pembentukan hasil samping seperti ribitol dan gliserol. Yahashi et al. (1996) mengamati efek menguntungkan akibat penambahan glukosa pada produksi xilitol oleh sel C. tropicalis yang telah diimobilisasi. Xilosa dapat dikonversi menjadi xilitol lebih efisien dengan adanya penambahan glukosa sebagai kosubstrat karena glukosa dipakai oleh sel untuk pertumbuhan. Pemakaian glukosa lebih cepat dibandingkan dengan pemakaian xilosa yang menyebabkan regenerasi NADPH yang lebih cepat melalui jalur pentosa fosfat (Lee et
al. 1996). Semakin banyak glukosa yang
ditambahkan ke dalam media akan memperbanyak regenerasi NADPH sehingga dapat meningkatkan biokonversi xilosa menjadi xilitol.
Pengaruh penambahan glukosa pada C.
tropicalis tidak sama dengan pengaruh
penambahan glukosa pada C. guilliermondii, begitu juga dengan khamir lain. Silva et al. (1996) menyatakan bahwa penambahan glukosa pada media yang mengandung xilosa murni mengurangi produktivitas xilitol oleh
C. guilliermondii. Penemuan ini berdasarkan
pada fakta bahwa penambahan glukosa dapat menghambat induksi enzim XR pada C.
guilliermondii oleh xilosa, dan intensitas
hambatan tersebut terkait dengan jumlah glukosa yang ditambahkan pada media (Sugai & Delgenes 1995; Silva et al. 2007). Ooi et al. (2002) menemukan bahwa konsumsi xilosa oleh C. guilliermondii dan C. tropicalis pada media xilosa yang mengandung glukosa sebagai kosubstrat memerlukan waktu yang lebih lama dibandingkan dengan konsumsi xilosa pada media yang tidak mengandung glukosa. Hal ini menunjukkan bahwa penggunaan glukosa lebih diutamakan daripada xilosa dan dengan demikian memperpanjang waktu biokonversi xilosa menjadi xilitol. Sebaliknya, Rosa et al. (1998) menemukan peningkatan produksi xilitol oleh
C. guilliermondii pada media sintetik yang
mengandung 60 g/L xilosa dan 5 g/L glukosa, dan menurut Felipe et al. (1993), peningkatan tersebut berhubungan dengan rasio konsentrasi glukosa:xilosa yang terdapat pada media.
Penggunaan xilosa dan glukosa secara bersamaan diamati oleh Tavares et al. (2000) selama kultivasi Debaryomyces hansenii dalam media sintetik. Represi katabolit pada
6
asimilasi xilosa oleh glukosa terjadi ketika ditambahkan konsentrasi glukosa dengan rasio glukosa:xilosa 1:10 ke dalam media, dimana terjadi peningkatan product yield (Y p/s) sebesar 30%. Efek menguntungkan dari glukosa pada biokonversi xilosa menjadi xilitol juga telah diamati oleh Preziosi-Belloy
et al. (1997) selama kultivasi C. parapsilosis
pada media sintetik dengan rasio glukosa:xilosa 1:2.5. Pada kasus ini, terjadi reduksi waktu fermentasi dan peningkatan
product yield (Y p/s) sebesar 19%
dibandingkan dengan media yang tidak mengandung glukosa.
Pertumbuhan Mikrob
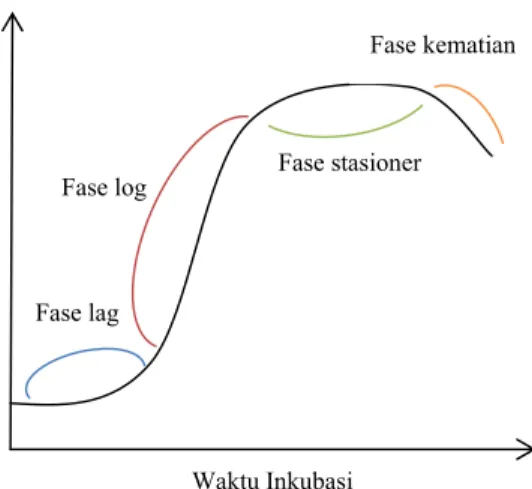
Pertumbuhan mikrob terbagi menjadi empat fase yang masing-masing memiliki ciri pertumbuhan yang berbeda (Gambar 4). Pertumbuhan mikrob secara umum terlihat pada kurva pertumbuhan, yaitu kurva antara waktu inkubasi dengan nilai log jumlah organisme. Inokulum yang dipindahkan ke suatu media baru akan mengalami adaptasi terlebih dahulu pada kondisi media baru. Tahap yang disebut fase lag ini membutuhkan waktu sehingga pada kurva pertumbuhan terlihat stagnan. Media dengan nutrisi yang semakin lengkap akan mempercepat fase lag yang berarti mempercepat proses memasuki fase eksponensial (Pelczar & Chan 2008).
Sel mikrob kemudian memasuki tahap pembelahan biner dengan laju konstan. Fase pertumbuhan ini disebut sebagai fase eksponensial atau fase log, karena menunjukkan kenaikan dalam bentuk garis linear lurus dalam kurva pertumbuhan. Pembelahan ini mengikuti pola geometrik yaitu dihasilkannya 2n sel baru setelah melalui satuan waktu yang disebut sebagai waktu generasi. Kondisi ini juga disebut sebagai pertumbuhan seimbang, karena terjadi laju pertumbuhan dan aktivitas metabolik yang konstan (Pelczar & Chan 2008). Kondisi ini berlanjut hingga sumber karbon dan energi di media telah habis. Kondisi ini berbeda-beda pada kondisi substrat yang memberikan laju pertumbuhan yang berbeda pula.
Kondisi nutrisi media yang semakin berkurang serta mulai jenuhnya kondisi media dengan metabolit sekunder yang bersifat toksik membuat sel baru yang bertumbuh menjadi sebanding dengan banyaknya sel yang mati, sehingga jumlah sel hidup menjadi tetap. Fase ini disebut sebagai fase stasioner dan terlihat sebagai garis lurus pada kurva pertumbuhan. Fase pertumbuhan mikrob diakhiri dengan fase kematian ketika akhirnya
jumlah sel yang mati melebihi jumlah terbentuknya sel baru (Pelczar & Chan 2008).
Sel yang dipindahkan ke media baru akan mengalami fase lag dan lama fase lag ini ditentukan dari usia sel yang dipindahkan. Apabila sel berasal dari fase stasioner, maka banyak sel yang sudah mati akan terbawa yang akan mempengaruhi turbiditas. Selain itu, sel hidup di dalamnya membutuhkan waktu lama untuk pemulihan dari kondisi toksik lingkungan di media lama, seperti adanya kondisi asam, basa, atau alkohol (White 2007). Apabila berasal dari fase lag, sel masih belum aktif membelah karena masih berada dalam proses pembesaran ukuran sel (Pelczar & Chan 2008). Sel yang berada pada fase eksponensial atau log berada pada kondisi yang aktif membelah dan responsif. Kondisi ini merupakan kondisi sel yang telah berukuran besar dan telah siap untuk melakukan pertumbuhan dan pembelahan sel. Hal ini didukung pernyataan White (2007) bahwa lama fase lag pada media baru dapat diminimalkan menggunakan kultur sel dari fase eksponensial.
Berbagai macam teknik dapat digunakan untuk mengukur pertumbuhan biomassa sel dan dapat dipilih sesuai dengan tujuan pengukuran. Beberapa cara pengukuran pertumbuhan tersebut adalah pengukuran turbiditas, penghitungan total sel, dan penghitungan sel hidup (White 2007).
Pengukuran tercepat yang sering diaplikasikan adalah pengukuran dengan metode turbiditas (kekeruhan) dengan spektrofotometer. Prinsip pengukurannya adalah mengukur jumlah cahaya yang diserap oleh organisme dalam sampel. Hasil yang diperoleh mewakili
Fase lag
Fase log Fase stasioner
Fase kematian
Waktu Inkubasi
Gambar 4 Kurva pertumbuhan mikrob.
7
biomassa mikrob yang ada.
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan adalah tabung reaksi, pipet tetes, pipet Mohr, autopipet, bulb, bunsen, neraca analitik, stopwatch, labu Erlenmeyer, labu ukur, gelas ukur, cawan Petri, autoklaf, laminar flow, inkubator, rotary
shaker, jarum ose, spektrofotometer, kuvet,
lemari es, aluminium foil, magnetic stirrer, pH meter, sentrifus, tabung sentrifus, tabung Eppendorf, vorteks, dan kertas saring.
Bahan-bahan yang digunakan adalah xilosa, glukosa, akuades, akuabides steril, C.
guilliermondii, ekstrak khamir, ekstrak malt,
bakto pepton, agar, (NH4)2SO4, CaCl2.2H2O, K2HPO4, KH2PO4, kit D-sorbitol/D-xilitol, kapas berlemak, alkohol, dan kain kasa.
Metode Penelitian
Pengukuran Kurva Pertumbuhan dengan Metode Turbidimetri
Penelitian ini menggunakan sel C.
guilliermondii yang dibiakkan pada agar
miring ekstrak malt dan dibekukan pada suhu 4oC. Pengukuran kurva pertumbuhan dilakukan menggunakan media Yeast Malt (YM) cair dengan komposisi ekstrak khamir 3 g/L, ekstrak malt 3 g/L, bakto pepton 5 g/L, dan glukosa 20 g/L. Kultur C. guilliermondii sebanyak satu ose diinokulasikan ke dalam media YM cair pada pH 5, selanjutnya diinkubasi di atas rotary shaker pada suhu 30oC dengan kecepatan 120 rpm. Kultur diinkubasi sampai 84 jam dan setiap 12 jam dilakukan pengambilan sampel sebanyak 1 mL untuk mengukur OD kultur. Sampel 1 mL tersebut diencerkan dengan media YM cair sebanyak 2 mL secara aseptik. Sebagai blanko juga digunakan media YM cair. Pengukuran OD dilakukan menggunakan spektrofotometer pada panjang gelombang 600 nm.
Persiapan Inokulum (Silva et al. 2007) Inokulum sebanyak 50 mL disiapkan dalam labu Erlenmeyer 125 mL dengan komposisi (g/L): xilosa 45; ekstrak khamir 10; pepton 20; (NH4)2SO4 2; CaCl2.2H2O 0.1; K2HPO4 0,5; dan KH2PO4 0.5.
Pengukuran Kurva Produksi
Pengukuran kurva produksi dilakukan pada inokulum. Kultur C. guilliermondii dibiakkan pada media YM cair pada suhu 30oC dengan kecepatan 120 rpm selama 18 jam. Selanjutnya kultur C. guilliermondii
diinokulasikan ke media inokulum pada pH 5 dan diinkubasi pada suhu 30oC dengan kecepatan 120 rpm. Inkubasi dilakukan selama 84 jam dan diambil sampel sebanyak 3 mL setiap 12 jam. Sampel tersebut disentrifus pada kecepatan 5000 g selama 15 menit. Supernatan yang dihasilkan diukur kadar xilitolnya dengan kit D-sorbitol/D-xilitol. Pengaruh Konsentrasi Glukosa Terhadap Produksi Xilitol
Sebanyak empat buah labu Erlenmeyer digunakan untuk pembuatan media fermentasi dengan komposisi yang sama dengan pembuatan media inokulum pada pH 5. Untuk melihat efek penambahan glukosa pada biokonversi xilosa menjadi xilitol oleh C.
guilliermondii dilakukan penambahan glukosa
pada media fermentasi dengan perbandingan glukosa:xilosa yaitu: 1:25 (glukosa 1.8 g/L), 1:12 (glukosa 3.75 g/L), 1:5 (glukosa 9 g/L), dan 1:2.5 (glukosa 18 g/L) dengan kondisi inkubasi pada suhu 300C dan kecepatan 120 rpm. Sebagai kontrol digunakan media yang tidak ditambahkan glukosa. Pengukuran kurva produksi dilakukan dengan pengambilan sampel sebanyak 3 mL pada saat jam ke-72. Sampel tersebut disentrifus pada kecepatan 5000 g selama 15 menit. Supernatan yang dihasilkan diukur kadar xilitolnya dengan kit D-sorbitol/D-xilitol.
Pengukuran Kadar Xilitol dengan Metode Kolorimetri
Pengukuran kadar xilitol dalam penelitian ini dilakukan dengan spektrofotometer (kit D-sorbitol/D-xilitol dari Roche). Sebanyak dua tabung sentrifus yang sudah ditutup dengan aluminium foil pada seluruh sisi disiapkan dan dilabel dengan blanko dan sampel. Sebanyak 0.6 mL larutan 1, 0.2 mL larutan 2, dan 0.2 mL larutan 3 ditambahkan ke dalam masing-masing tabung. Komposisi masing-masing-masing-masing larutan terdapat pada Lampiran 2. Sebanyak 0.1 mL supernatan kultur ditambahkan ke dalam tabung sentrifus yang berlabel sampel. Lalu pada masing-masing tabung ditambahkan akuabides steril sebanyak 2 mL pada blanko, dan 1.9 mL pada sampel. Selanjutnya masing-masing campuran diukur absorbansinya (A1) pada panjang gelombang 492 nm, lalu dibiarkan sampai dua menit dan diukur lagi absorbansinya. Jika selisih nilai A1 pada kedua pengukuran absorbansi lebih dari 0.01 maka tabung berisi sampel harus dikurangi zat pereduksinya. Jika selisih A1 kurang dari 0.01 maka langsung ditambahkan dengan 0.05 mL larutan 4 sehingga didapat
8
volume akhir 3.05 mL untuk masing-masing tabung. Campuran didiamkan selama 30 menit. Setelah itu diukur absorbansinya (A2) pada panjang gelombang 492 nm. Jika reaksi tidak berhenti selama 30 menit, diukur lagi absorbansinya pada selang interval 5 menit sampai perubahan absorbansi stabil. Selanjutnya dihitung ∆A dengan persamaan:
Setelah itu ditentukan konsentrasinya dengan persamaan:
Keterangan:
c = konsentrasi xilitol pada sampel (g/L) V = volume akhir (mL)
MW = molecular weight (g/mol) v = volume sampel (mL) d = jalur cahaya (cm)
ε = koefisien ekstensi senyawa INT-formazan pada 492 nm
= 19.9 (L/mmol cm)
HASIL DAN PEMBAHASAN
Pertumbuhan Biomassa SelPengetahuan tentang siklus pertumbuhan
C. guilliermondii diperlukan untuk
mengetahui karakteristik pertumbuhan C.
guilliermondii untuk mempermudah kultivasi
mikrob ke dalam suatu media, penyimpanan kultur, dan penggantian media. Kultivasi C.
guilliermondii pada media membutuhkan
komposisi media dan kondisi inkubasi yang tepat. Kedua faktor tersebut bervariasi tergantung dari mikrob yang ditumbuhkan dan tujuan fermentasi. Umumnya media harus mengandung unsur-unsur yang diperlukan untuk metabolisme sel yaitu berupa unsur makro seperti C, H O, N, P dan unsur-unsur mikro misalnya kalsium. Media yang digunakan untuk menumbuhkan mikrob harus disterilisasi terlebih dahulu untuk mencegah kemungkinan tumbuhnya mikrob lain yang tidak diinginkan. Adanya mikrob lain pada media dapat menghambat pertumbuhan mikrob yang diinginkan karena terjadi kompetisi antar spesies mikrob untuk memperebutkan nutrisi yang terdapat dalam media.
Penentuan karakteristik pertumbuhan sel
C. guilliermondii dilakukan pada media YM
yang mengandung glukosa, ekstrak malt, ekstrak khamir, dan bakto pepton. Glukosa pada media digunakan sebagai sumber karbon oleh sel, sedangkan ekstrak khamir, ekstrak
malt, dan bakto pepton digunakan sebagai sumber nitrogen. Ekstrak khamir terbuat dari ragi pengembang roti atau pembuat alkohol, serta mengandung asam amino lengkap dan vitamin B kompleks. Bakto pepton mampu menyediakan nutrien esensial untuk metabolisme khamir.
Pertumbuhan C. guilliermondii yang ditumbuhkan dalam media YM dapat diukur secara turbidimetri menggunakan spektofotometer pada panjang gelombang 600 nm. Metode turbidimetri dilakukan dengan prinsip mengukur kenaikan biomassa sel. Cahaya yang dibiaskan sumber cahaya akan diserap oleh sel sehingga semakin tinggi pertumbuhan sel akan memberikan nilai absorbansi yang lebih besar. Sel khamir pada umumnya dapat menyerap cahaya optimum dengan panjang gelombang 600 nm.
Kurva pertumbuhan menunjukkan informasi tentang fase-fase pertumbuhan biomassa sel C. guilliermondii. Istilah pertumbuhan dari mikrob mengacu pada pertumbuhan populasi mikrob secara total, bukan dari suatu pertumbuhan individu organisme saja (Pelczar & Chan 2008). Pembuatan kurva pertumbuhan dilakukan dengan pengamatan setiap 12 jam sekali sampai jam ke-84, karena kecepatan pertumbuhan sel khamir lebih lambat daripada sel bakteri yang membelah setiap dua jam sekali. Selain itu, dari berbagai literatur yang diperoleh, waktu fermentasi yang digunakan
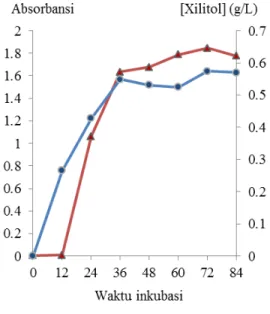
Gambar 5 Hubungan antara waktu inkubasi dengan absorbansi biomassa sel (kurva merah) dan produksi xilitol (kurva biru).
9
umumnya antara 72 sampai 96 jam. Dari Gambar 5 dapat dilihat bahwa pada 12 jam pertama pertumbuhan biomassa sel yang terdeteksi sangatlah kecil yang mengindikasikan sel sedang berada dalam fase lag. Pertumbuhan biomassa sel pada fase lag cenderung lambat karena adanya adaptasi terhadap media YM. Pada fase ini tidak terjadi kenaikan jumlah sel, namun peningkatan ukuran atau besar sel.
Fase eksponensial (log) dari C.
guilliermondii terlihat pada jam ke-12 sampai
36 dimana sel menggunakan sumber karbon dan bahan-bahan lainnya yang terdapat di dalam media YM untuk bertumbuh. Hal tersebut dapat dilihat pada Gambar 5 dimana terdapat kenaikan kurva yang signifikan. Peningkatan terjadi akibat adanya pembelahan biner sel yang meningkatkan jumlah sel hidup sehingga semakin banyak cahaya dari spektrofotometer yang diserap yang membuat nilai absorbansi lebih besar. Setelah jam ke-36, kurva pertumbuhan menunjukkan laju pertumbuhan biomassa sel C. guilliermondii yang semakin rendah. Pada fase ini terjadi pertumbuhan biomassa sel yang sebanding dengan kematian sel, sehingga jumlah sel yang hidup cenderung konstan. Hal ini disebabkan oleh menurunnya jumlah nutrisi yang terdapat pada media YM, ditambah dengan adanya penimbunan hasil metabolisme seperti xilitol atau etanol yang dapat menghambat pertumbuhan sel.
Berdasarkan kurva pertumbuhan yang diperoleh dapat ditentukan waktu inkubasi pada media YM yang optimum ketika C.
guilliermondii berada pada tengah-tengah fase
eksponensial antara jam ke-12 sampai 24, yaitu selama 18 jam. Pada fase ini, sel C.
guilliermondii membelah dengan cepat dan
konstan mengikuti kurva logaritmik dan dianggap siap untuk dipindahkan ke media inokulum. Data berupa waktu inkubasi optimal selama 18 jam digunakan sebagai referensi apabila diperlukan peremajaan kultur
C. guilliermondii.
Produksi Xilitol
Peremajaan kultur C. guilliermondii pada media YM dilakukan sebelum fermentasi untuk mendapatkan sel C. guilliermondii yang berada pada tahap eksponensial. Selanjutnya sel C. guilliermondii dari media YM diinokulasikan ke dalam media baru (inokulum). Media yang digunakan untuk menumbuhkan biomassa sel (media YM) tidak sama dengan media fermentasi dan inokulum. Inokulum mengandung xilosa yang
bertujuan menyesuaikan sel C. guilliermondii terhadap substrat xilosa. Selain itu, inokulasi
C. guilliermondii ke dalam media xilosa juga
dilakukan untuk memperoleh informasi saat sel C. guilliermondii akan menghasilkan kadar xilitol tertinggi yang dapat dilihat dalam bentuk kurva produksi (Gambar 5). Menurut Carvalho et al. (2007), penambahan ammonium sulfat ke dalam media dapat membantu konsumsi xilosa dan produksi xilitol oleh C. guilliermondii. Penambahan CaCl2.2H2O ke dalam media bertujuan untuk memenuhi kebutuhan unsur mikro dari pertumbuhan C. guilliermondii.
Kurva produksi yang diperoleh dari hasil penelitian mempunyai pola kurva yang mirip dengan kurva pertumbuhan, yang menunjukkan meningkatnya biomassa sel C.
Guilliermondii seiring dengan meningkatnya
konsentrasi xilitol yang dihasilkan. Produksi xilitol tertinggi dihasilkan pada jam ke-72, sebesar 0.57 g/L. Hasil ini mendukung penelitian yang dilakukan Silva dan Felipe (2006) yang menemukan penurunan konsentrasi xilitol yang dihasilkan setelah jam ke-72, bertepatan dengan habisnya xilosa pada media. Selain itu, Felipe et al. (1995) juga menyatakan sel khamir dapat mengasimilasi xilitol ketika xilosa pada media sudah habis dikonsumsi. Menurut Yulianto (2001), tipe fermentasi yang berkorelasi positif seperti ini dikenal sebagai pertumbuhan associated. Tipe fermentasi ini menunjukkan bahwa xilitol yang dihasilkan pada fase log merupakan metabolit primer, karena terlibat langsung dalam metabolisme sel, sedangkan metabolit sekunder dihasilkan ketika sel berada pada fase stasioner.
Rasio Glukosa:Xilosa Optimum Setelah diperoleh data kurva pertumbuhan biomassa sel dan kurva produksi xilitol oleh
C. guilliermondii, dilakukan variasi rasio
glukosa:xilosa pada media fermentasi. Media fermentasi yang digunakan mempunyai komposisi yang sama dengan inokulum dengan penambahan glukosa. Tujuan dari pengerjaan ini adalah menentukan konsentrasi glukosa optimum yang perlu ditambahkan ke dalam media fermentasi untuk meningkatkan produksi xilitol. Kultur sel C. guilliermondii yang diinokulasikan ke media fermentasi berasal dari inokulum yang diinkubasi selama 18 jam.
Penggunaan rasio glukosa:xilosa 1:25 sampai 1:2.5 didasarkan pada fakta bahwa rasio glukosa:xilosa yang terkandung di dalam hidrolisat ampas tebu umumnya adalah 1:25
10
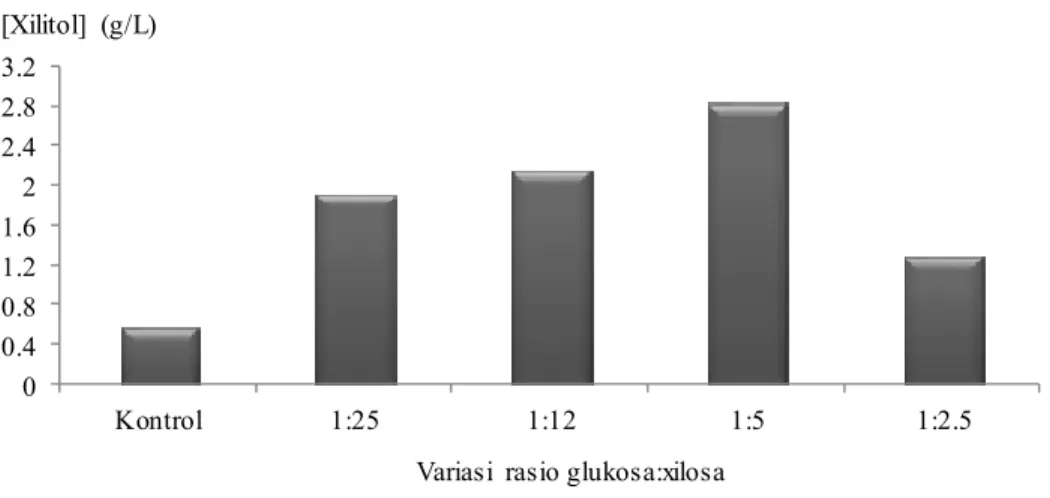
(Silva et al. 2007). Peningkatan rasio sampai 1:2.5 dilakukan untuk melihat pengaruh penambahan glukosa terhadap produksi xilitol dalam media sintetik. Xilitol yang dihasilkan dari variasi rasio glukosa:xilosa 1:25, 1:12, 1:5, 1:2.5 berturut-turut adalah 1.94, 2.18, 2.85, 1.29 g/L (Gambar 6). Hasil pengamatan menjelaskan bahwa rasio glukosa:xilosa 1:5 menghasilkan konsentrasi xilitol paling tinggi, yaitu sebesar 2.85 g/L. Berdasarkan hasil tersebut, terjadi peningkatan produksi xilitol lima kali lipat dari media yang hanya mengandung xilosa 45 g/L (kontrol), yaitu sebesar 0.57 g/L. Product yield (Y p/s) xilitol dari rasio glukosa:xilosa 1:5 adalah 6.32 %, sedangkan pada kontrol sebesar 1.28 % (Tabel 1). Jika dilihat dari hasil tersebut, penambahan glukosa sebagai kosubstrat dapat meningkatkan konsentrasi xilitol yang dihasilkan. Penelitian Silva et al. (2007) menggunakan media yang mengandung glukosa:xilosa 1:5 (glukosa 9 g/L: xilosa 45 g/L) juga menghasilkan xilitol dengan konsentrasi terbesar (26.9 g/L xilitol) dibandingkan dengan variasi glukosa:xilosa yang lain. Jika dibandingkan dengan hasil di atas, xilitol yang dihasilkan dalam penelitian ini lebih kecil. Hal tersebut kemungkinan disebabkan oleh perbedaan kultur C.
guilliermondii yang digunakan.
Berdasarkan hasil penelitian, terdapat peningkatan produksi xilitol dari rasio glukosa:xilosa 1:25 sampai 1:5 (Gambar 6). Hal ini menunjukkan semakin besar konsentrasi glukosa yang ditambahkan ke dalam media fermentasi semakin besar pula kadar xilitol yang dihasilkan. Penelitian yang dilakukan oleh Silva dan Felipe (2006) juga menemukan peningkatan product yield (Y p/s)
dan produktivitas volumetrik (Qp) pada rasio glukosa:xilosa 1:5 berturut-turut sebesar 15.69 % dan 23.26 % dibandingkan dengan rasio glukosa:xilosa 1:25. Glukosa dapat meningkatkan produksi xilitol karena glukosa membantu regenerasi kofaktor NADPH dan meningkatkan biomassa sel. Meskipun demikian, terdapat penurunan produksi xilitol yang signifikan dari rasio konsentrasi glukosa:xilosa 1:5 ke rasio 1:2.5 (Gambar 6). Hal ini menjelaskan terdapat batas tertentu dimana penambahan glukosa dengan konsentrasi yang besar justru menurunkan produksi xilitol. Berdasarkan hasil penelitian, penambahan glukosa lebih besar dari rasio glukosa:xilosa 1:5 menurunkan produksi xilitol. Hal tersebut disebabkan karena penggunaan glukosa dengan konsentrasi tinggi justru tidak membantu meningkatkan produksi xilitol tetapi membantu produksi etanol(Sene et al. 2001; Silva & Felipe 2006). Selain itu, penambahan glukosa dalam konsentrasi besar juga dapat menghambat transpor xilosa ke dalam sel (Tochampa et al. 2005). Penambahan glukosa lebih kecil dari rasio 1:25 mungkin akan memberikan hasil produksi xilitol yang tidak jauh berbeda dibandingkan dengan kontrol yang tidak 0 0.4 0.8 1.2 1.6 2 2.4 2.8 3.2 Kontrol 1:25 1:12 1:5 1:2.5 [Xilitol] (g/L)
Variasi rasio glukosa:xilosa
Gambar 6 Hubungan antara variasi rasio glukosa:xilosa dengan konsentrasi xilitol (g/L).
Tabel 1 Variasi rasio glukosa:xilosa Glukosa:Xilosa Glukosa g/L Xilitol g/L Y p/s %
Kontrol - 0.57 1.28
1:25 1.80 1.94 4.30
1:12 3.75 2.18 4.85
1:5 9.00 2.85 6.32
1:2.5 18.00 1.29 2.88
Y p/s = product yield (g xilitol yang dihasilkan / g xilosa yang dikonsumsi)
11
mengandung glukosa sama sekali.
Hasil penelitian yang dilakukan oleh Puspita (2009) menggunakan C. tropicalis menyatakan bahwa penambahan glukosa ke dalam media fermentasi menurunkan produksi xilitol tetapi meningkatkan biomassa sel. Dalam penelitian tersebut, terjadi penurunan produksi xilitol yang signifikan dari 14.08 g/L menjadi 1.87 g/L pada rasio glukosa:xilosa 0:6 (kontrol) sampai 4:6. Porsi glukosa pada variasi rasio yang digunakan dalam penelitian tersebut lebih besar dari porsi glukosa yang digunakan dalam penelitian ini. Hal ini semakin mendukung pernyataan bahwa penambahan glukosa dalam konsentrasi yang besar tidak membantu meningkatkan produksi xilitol tetapi membantu produksi etanol.
Menurut Lee et al. (1996) dan Nolleau et
al. (1995), enzim XR dari C. guilliermondii
terbukti hanya bergantung pada NADPH, sedangkan aktivitas enzim XDH yang teramati cenderung lebih menggunakan NAD+ (Gambar 7). Dalam kondisi oksigen yang terbatas, xilitol diekskresikan paling maksimal, karena kofaktor NADH tidak dapat sepenuhnya dioksidasi kembali menjadi NAD+ oleh rantai respirasi (Sene et al. 2001; Soleimani et al. 2006). Hasil dari ketidakseimbangan reaksi redoks tersebut turut membantu akumulasi xilitol pada metabolisme sel C. guilliermondii karena terbatasnya NAD+ yang dibutuhkan oleh enzim XDH untuk mengkonversi xilitol menjadi xilulosa. Xilitol berlebih yang
terakumulasi di dalam sel akan ditranspor keluar sel (Gambar 7).
Penelitian yang dilakukan oleh Kastner et
al. (2001), Sene et al. (2001), Silva et al.
(2007), dan Walther et al. (2001) menemukan adanya produk samping berupa etanol selama fermentasi dengan sel C. guilliermondii menggunakan media campuran xilosa dan glukosa. Jumlah etanol yang dihasilkan semakin banyak seiring dengan meningkatnya konsentrasi glukosa yang ditambahkan ke dalam media fermentasi. Hal ini mengindikasikan etanol berasal dari metabolisme glukosa. Meningkatnya etanol merupakan suatu pertanda bahwa glukosa yang terdapat pada media fermentasi digunakan oleh sel untuk pertumbuhan. Etanol dihasilkan sebagai produk akhir dari fermentasi piruvat dimana NADH yang dihasilkan dari glikolisis dioksidasi kembali menjadi NAD+ untuk digunakan lagi dalam glikolisis.
Menurut Sene et al. (2001), dalam kondisi mikroaerobik glukosa digunakan oleh C.
guilliermondii untuk pertumbuhan sel
sehingga pada akhirnya meningkatkan produksi xilitol. Hal ini juga didukung oleh Lee et al. (1996) yang menyatakan bahwa glukosa cenderung dikonsumsi pertama kali sampai habis sebelum xilosa dan metabolisme glukosa tidak dipengaruhi oleh adanya xilosa pada media fermentasi. Peningkatan biomassa sel dapat menginduksi enzim-enzim yang digunakan dalam produksi xilitol. Selain itu, stimulasi metabolisme xilosa oleh glukosa Gambar 7 Skema metabolisme glukosa dan xilosa pada khamir (Tochampa et al. 2005).
Xilosa
Xilosa
Xilitol Xilitol Xilulosa Membran sel Transpor Rantai respirasi Biomassa Glukosa Glukosa
12
juga dapat dijelaskan berkat adanya regenerasi kofaktor NADPH melalui jalur pentosa fosfat, karena kofaktor tersebut esensial untuk reduksi enzimatik xilosa menjadi xilitol (Silva & Felipe 2006).
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil penelitian yang diperoleh, fase eksponensial dari pertumbuhan
C. guilliermondii adalah 12-36 jam, dan
waktu inkubasi yang optimum untuk memperoleh kadar xilitol tertinggi adalah 72 jam, sebesar 0.57 g/L. Penambahan glukosa sebagai kosubstrat yang paling optimum terdapat pada variasi glukosa:xilosa 1:5 dengan kadar xilitol tertinggi sebesar 2.85 g/L dan product yield xilitol sebesar 6.32 %. Hasil tersebut lebih banyak jika dibandingkan dengan kultur tanpa penambahan glukosa (kontrol), yaitu sebesar 0.57 g/L dengan
product yield xilitol sebesar 1.28 %. Dari
kedua hasil tersebut dapat disimpulkan bahwa penambahan glukosa sebagai kosubstrat ke dalam media fermentasi dapat meningkatkan produksi xilitol.
Saran
Perlu dilakukan penelitian lanjutan berupa penambahan kosubstrat selain glukosa, seperti mannosa, fruktosa atau galaktosa untuk mengetahui pengaruhnya terhadap produksi xilitol. Selain itu diperlukan juga penelitian lanjutan yang melihat pengaruh produk samping yang dihasilkan dari biokonversi xilosa menjadi xilitol oleh C. guilliermondii seperti asam asetat, etanol, dan karbon dioksida terhadap produksi xilitol.
DAFTAR PUSTAKA
Ahmed Z. 2001. Production of natural and rate pentoses using microorganisms and their enzymes. Electronic J
Biotech 4:2.
Alves LA, Felipe MGA, Almedia e Silva JB, Silva SS, Prata AMR. 1998. Pretreatment of sugarcane bagasse hemicellulose hydrolysate for xylitol production by Candida
guilliermondii. Appl Biochem
Biotechnol vol 70-72: hlm 89-98.
Cao N-J, Tang R, Gong CS, Chen LF. 1994. The effect of cell density on the
production of xylitol from D-xylose by yeast. Appl Biochem and Biotech vol 45-46: hlm 515-519.
Carvalho W, Silva SS, Vitolo M, Felipe MGA, Manchilha IM. 2000. Use of immobilized Candida cells on xylitol production from sugarcane bagasse.
Z. Naturforsch 55c: 213-217.
Carvalho W, Canilha L, Silva da SS. 2007. Semi-continuous xylitol production in sugarcane bagasse hydrolysate: effect of nutritional supplementation.
Brazilian J Pharma Sci 43.
Chiang C, Knight SG. 1962. Metabolism of D-xylose by moulds. Nature 188:79-81.
Dahiya JS. 1991. Xylitol production by
Petromyces albertensis grown on
medium containing D-xylose. Can J
Microbiol 37:14-18.
Felipe MGA, Mancilha IM, Vitolo M, Roberto IC, Silve SS, Rosa SA. 1993. Preparation of xylitol by fermentation of a hydrolyzate of hemicelluloses obtained from sugarcane bagasse. Arq Biol Technol 36:103-114.
Felipe MGA, Vieira DC, Vitolo M, Silva SS, Roberto IC, Mancilha IM, Rosa SAM. 1995. Effect of acetic acid on xylose fermentation to xylitol by
Candida guilliermondii. J Basic Microbiol 35:171-177.
Hahn-Hägerdal B, Jeppson H, Skoog K, Prior BA. 1994. Biochemistry and physiology of xylose fermentation by yeast. Enz Microb Technol 16:933-943.
Hallborn J, Meinander NQ, Hahn-Hägerdal B, Gorwa F, Pentilla M, Keränen S. 1994. The influence of cosubstrate and aeration on xylitol formation on recombinant Saccharomyces cereviceae expressing the XYL1
gene. Appl Microbiol Biotechnol 42:326-333.
Horitsu H, Yahashi Y, Takamizawa K, Kawai K, Suzuki T, Watanabe N. 1992. Production of xylitol from D-xylose
13
by Candida tropicalis: optimization of production rate. Biotech and
Bioengi 40:1085-1091.
Kastner JR, Eitman MA, Sarah AL. 2001. Glucose repression of xylitol production in Candida tropicalis
mixed-sugar fermentations.
Biotechnol lett 23:1663-1667.
Lee H, Sopher CR, Yaau KYF. 1996. Induction of xylose reductase and xylitol dehydrogenase activities on mixed sugars in Candida
guilliermondii. J Chem Technol Biotechnol 66:375-379.
Ly KA, Milgrom P, Rothen M. 2006. Xylitol, sweetener, and dental caries. Pediatr
Dentistry 28:154-163.
Lynch H, Milgrom PJ. 2003. Xylitol and dental caries: an overview for clinicians. California Dental Association 31:205-209.
Maloney PC, Amburdkar SV. 1989. Functional reconstitution of prokaryote and eukaryote membrane-proteins. Arch of Biochem and
Biophysics. 269:1-10.
Mattila P, Svanberg M, Knuutila M. 2001. Increased bone volume and bone mineral content in xylitol-fed aged rats. Gerontology 47:300-305. Meyrial V, Delgenes J-P, Moletta R, Navarro
JM. 1991. Xylitol production from D-xylose by Candida guilliermondii: fermentation behaviour. Biotechnol
Lett 13:281-286.
Miake Y, Saeki Y, Takahashi M, Yanagisawa T. 2003. Remineralization of xylitol on demineralised enamel. J Electron
Microscopy 52:471-476.
Milgrom P, Ly KA, Ohnmar K, Mancl L, Roberts M, Briand K, Gancio MJ. 2009. Xylitol pediatric topical oral syrup to prevent dental caries. Arch
Pediatr Adolesc Med 163:601-607.
Nolleau V, Preziosi-Belloy L, Navarro JM. 1995. The reduction of xylose to xylitol by Candida guilliermondii and Candida parapsilosis: incidence
of oxygen and pH. Biotechnol Lett 17:417-422.
Ooi BG, Le TTB, Markuszewski BM. 2002. The effects of glucose on the yeast conversion of xylose into xylitol by
Candida guilliermondii and Candida tropicalis. Electron J Environ Agric Food Chem 1:189-202.
Parajo JC, Dominguez H, Dominguez JM. 1998. Biotechnological Production of xylitol part 1: interest of xylitol and fundamentals of its biosynthesis.
Biores technol 65:191-201.
Pelczar MJ, Chan ECS. 2008. Dasar-dasar
Mikrobiologi. Hadioetomo RS, Imas
T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of
Microbiology.
Peldyak J, Makinen KK. 2002. Xylitol for caries prevention. J Dental Hygiene 76:276-85.
Pepper T, Olinger PM. (1988). Xylitol in sugar-free confections. Food Technol 42:98-106
Preziosi-Belloy L, Nolleau V, Navarro JM. 1997. Fermentation of hemicellulosic sugars and sugar mixtures to xylitol by Candida parapsilosis. Enz
Microbial Technol 21:124-129.
Puspita JP. 2009. Optimasi Konsentrasi Xilosa dan Glukosa untuk Produksi Xilitol oleh Candida tropicalis [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Rangaswamy S. 2003. Xylitol production
from D-xylose by facultative anaerobic bacteria [disertasi]. Virginia: Doctor of Philosophy, Virginia polytechnic institute.
Rao RS, Jyothi P, Prakasham RS, Sarma PN, Rao LV. 2006. Xylitol production from corn fiber and sugarcane bagasse hydrolysates by Candida
tropicalis. Biores Technol
14
Roberto IC, Sato S, Mancilha IM. 1996. Effect of inoculum level on xylitol production from rice straw hemicellulose hydrolysate by
Candida guilliermondii. J Indust Microbiol 16:348-350.
Rodrigues RCLB, Felipe MGA, Roberto IC, Vitolo M. 2003. Batch xylitol production by Candida
guilliermondii FTI 20037 from
sugarcane bagasse hemicellulosic hydrolysate at controlled pH values.
Bioprocess Biosystems Eng
26:103-107.
Rosa SMA, Felipe MGA, Silva SS, Vitolo M. 1998. Xylose reductase production by Candida guilliermondii. Appl
Biochem Biotechnol vol 70-72: hlm
127-135.
Saha BC, Bothast RJ. 1997. Fuels and chemicals from biomass. ACS
symposium series 666:307-319.
American chemical society.
Sampaio FC, Silveira WB, Chaves-Alves VM, Passos FML, Coelho JLC. 2003. Screening of filamentous fungi for production of xylitol from D-xylose.
Brazilian J Microbiol 34:325-328.
Sene L, Converti A, Zilli M, Felipe MGA, Silva SS. 2001. Metabolic study of the adaptation of the yeast Candida
guilliermondii to sugarcane bagasse
hydrolysate. Appl Microbiol Biotechnol 57:738-743.
Silva DDV, Felipe MGA. 2006. Effect of glucose:xylose ratio on xylose reductase and xylitol dehydrogenase activities from Candida
guilliermondii in sugarcane bagasse
hydrolysate. J Chem Technol Biotechnol 81:1294-1300.
Silva DDV, Felipe MGA, Mancilha IM, Paula FP. 2004. Biotechnological production of xylitol from lignocellulosic materials. Bioforum
Europe 8:56-57.
Silva DDV, Mancilha IM, Silva SS, Felipe MGA. 2007. Improvement of Biotechnological Xylitol Production by Glucose During Cultive of
Candida guilliermondii in Sugarcane
Bagasse Hydrolysate. Brazilian Arch
of Biol and Technol 50:207-215.
Silva SS, Roberto IC, Felipe MGA, Mancilha IM. 1996. Batch fermentation of xylose for xylitol production in stirred tank bioreactor. Process
Biochem 31:549-553.
Soleimani M, Tabil L, Panigrahi S. 2006. Bio-production of polyalcohol (xylitol) from lignocellulosic resources: a review. Dept Agri Biores Eng 06- 106.
Sugai JK, Delgenes J-P. 1995. Catabolite repression of inductin to aldose reductase, activity and utilization of mixed hemicellulosic sugars in
Candida guilliermondii. Current Microbiol 31:239-244.
Tavares JM, Duarte LC, Amaral-Collaco MT, Girio FM. 2000. The influence of hexoses addition on the fermentation of D-xylose in D. hansenii under continuous cultivation. Enz
Microbial Technol 26:743-747.
Tochampa W, Sirisansaneeyakul S, Vanichsriratana W, Srinophakun P, Bakker HHC, Christi Y. 2005. A model of xylitol production by yeast
Candida mogii. J Bioprocess Biosyst Eng 28:175-183.
Ueng PP, Gong CS. 1982. Ethanol production from pentoses and sugarcane bagasse hemicellulose hydrolysate by Mucor and Fusarium species. Enz Microb
Technol 4:169-171.
Vandeska E, Amartey S, Kuzmanova S, Jeffries TW. 1995. Effect of environmental conditions on production of xylitol by Candida
boidinii. J Microbiol Biotechnol
11:3-8.
Walther T, Hensirisak P, Agblevor FA. 2001. The influence of aeration and hemicellulosic sugars on xylitol production by Candida tropicalis.
15
White D. 2007. The Physiology and
Biochemistry of Prokaryotes. Ed
ke-3. New York: Oxford University Pr. Winkelhausen E, Kuzmanova S. 1998.
Microbial conversion of D-xylose to xylitol. J Ferment and Bioengi 86:1-14.
Yablochkova EN, Bolotnikova OI, Mikhailova NP, Nemova NN, Ginak AI. 2001. The activity of xylose reductase and xylitol dehydrogenase in yeasts. Microbiol 72:414-417. Yahashi Y, Horitsu H, Kawai K, Suzuki T,
Takamizawa K. 1996. Production of xylitol from D-xylose by Candida
tropicalis: the effect of D-glucose
feeding. J Ferm Technol 81:148-152. Yoshitake J, Ishizaki H, Shimamura M, Imai
T. 1973. Xylitol production by an
Enterobacter species. Agri Biol Chem 37:2261-2267.
Yulianto WA. 2001. Pengaruh pH, kadar xilosa, dan kadar glukosa terhadap produksi xilitol oleh Candida
shehatae WAY 08. J Tekno dan Industri Pangan 12:156-162.