KAPASITAS ANTIOKSIDAN BAWANG DAYAK (Eleutherine palmifolia)
DALAM BENTUK SEGAR, SIMPLISIA DAN KERIPIK, PADA PELARUT
NONPOLAR, SEMIPOLAR DAN POLAR
SKRIPSI
ALIA MUSTIKA NUR
F24070071
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
ANTIOXIDANT CAPACITY OF BAWANG DAYAK (Eleutherine palmifolia) IN FRESH, SIMPLISIA AND CHIPS FORM ON NONPOLAR, SEMIPOLAR AND POLAR SOLVENTS
Alia Mustika Nur and Made Astawan
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
Phone: +62856731969, E-mail: [email protected]
ABSTRACT
Bawang dayak (Eleutherine palmifolia) is a red bulb plant from Central Kalimantan, which has bioactive compounds such as phenols, flavonoids, alkaloids, glycosides and tannins. The existence of bioactive compounds become parameter of antioxidant activity of this red bulb. The study showed antioxidant capacity of bawang dayak in fresh form, simplisia (dried) form and chips form, which were extracted by the solvent hexane, ethyl acetate, methanol, ethanol and water. Antioxidant capacity was measured by DPPH method and rancimat method. Phytochemical screening was conducted to determine the bioactive compounds of bawang dayak in each form for every solvent. Based on DPPH method, bawang dayak in fresh form was extracted with ethyl acetate had the highest antioxidant capacity value that is 227.0% equal to 1.02 mg AEAC/mg extract. Simplisia form which was extracted with ethanol had antioxidant capacity value 51.8% equal to 0.21 mg AEAC/mg extract. Chips form was extracted with ethylacetate and ethanol had the highest antioxidant capacity values 57.5% and 46.5% which were equal to 0.24 mg AEAC/ mg extract and 0.18 mg AEAC/ mg extract. The induction time of ethylacetate fresh extract, ethanol simplisia extract and ethylacetate chip extract based on measurement with rancimat method, were 3.7 hours, 2.8 hours and 2.6 hours. All of extract had higher induction time than tocoferol. Besides, the measurement of phenolic content resulted that methanol fresh extract, ethanol simplisia extract and methanol chip extract had 4.29 mg GAE/100 mg extract, 3.52 mg GAE/ 100 mg extract and 3.38 mg GAE/100 mg extract.Vitamin C (ascorbic acid) on fresh bawang dayak was quite high, reaching 61.5mg/100gram, whereas vitamin C on simplicia and chip were decreased, respectively 41.0 mg/100 gram and 22.0 mg/100gram due to the heating process. The Ethylacetate fresh extract contains of alkaloid , phenolic, flavonoids, triterpenoids, steroids and glycosides compounds, while the ethanol simplscia extract and ethylacetate chip extract contains of alkaloids, saponins, tannins, phenolics, flavonoids, triterpenoids, steroids and glycosides compounds.
Alia Mustika Nur. F24070071. Kapasitas Antioksidan Bawang Dayak (Eleutherine palmifolia) dalam Bentuk Segar, Simplisia dan Keripik, pada Pelarut Nonpolar, Semipolar dan Polar. Di bawah bimbingan Made Astawan. 2011
RINGKASAN
Banyak sekali jenis tanaman Indonesia yang diduga memiliki khasiat bagi kesehatan, tetapi belum termanfaatkan secara optimal. Hal ini disebabkan secara ilmiah masih sedikit sekali informasi tentang kandungan senyawa bioaktif yang terdapat pada tanaman tersebut. Bawang Dayak (Eleutherine palmifolia) adalah salah satu jenis tanaman yang berkhasiat bagi kesehatan dan banyak ditemukan di daerah kalimantan. Secara empiris diketahui tanaman ini dapat menyembuhkan penyakit kanker usus, kanker payudara, diabetes melitus, hipertensi, menurunkan kolesterol, obat bisul, stroke
dan sakit perut sesudah melahirkan. Khasiat dari tanaman bawang dayak di antaranya sebagai antikanker payudara, mencegah penyakit jantung, immunostimulant, antinflamasi, antitumor serta anti
bleeding agent (Saptowalyono 2007).
Komponen antioksidan memiliki peranan penting bagi perlindungan kesehatan tubuh Penggunaan antioksidan alami saat ini dianggap lebih aman karena diperoleh dari ekstrak tanaman. Antioksidan alami yang terdapat pada tanaman antara lain kelompok flavonoid berupa senyawa polifenol. Pada penelitian ini dilakukan pengujian kapasitas antioksidan dari bawang dayak dalam bentuk umbi bawang dayak segar, simplisia dan keripik dengan menggunakan lima jenis pelarut yang berbeda yaitu heksan, etilasetat, etanol, metanol dan air. Metode pengujian yang dilakukan menggunakan metode DPPH (1,1-diphenyl-2-picrylhydrazil) dan metode rancimat untuk mengukur stabilitas oksidatif pada tiga ekstrak sampel terbaik. Selanjutnya dilakukan uji pendukung seperti pengukuran jumlah total fenol, kadar vitamin C dan uji kualitatif fitokimia untuk ekstrak umbi bawang dayak segar, simplisia dan keripik.
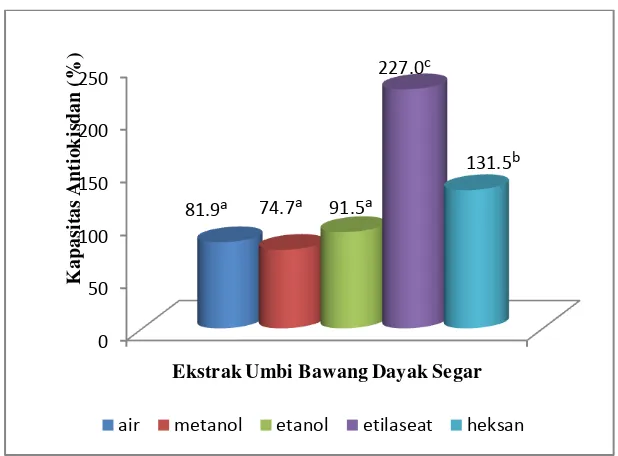
Berdasarkan hasil pengujian dengan metode DPPH, diketahui bahwa ekstrak etilasetat umbi bawang dayak segar memiliki nilai kapasitas antioksidan paling tinggi dan berbeda sangat nyata (p<0.01) dibandingkan dengan pelarut heksan, metanol, etanol dan air. Ekstrak etanol simplisia memiliki kapasitas antioksidan paling tinggi dan sangat berbeda nyata (p<0.01) dengan pelarut heksan, etilasetat, metanol dan air. Keripik yang diekstrak dengan pelarut etanol dan etilasetat menghasilkan nilai kapasitas antioksidan paling tinggi tetapi tidak berbeda nyata (p>0.01).
Nilai kapasitas antioksidan dapat dibandingkan dengan aktivitas asam askorbat, dimana nilai
aktivitas antioksidan di dalam ekstrak etilasetat umbi bawang dayak segar setara dengan 1.02 mg AEAC/mg ekstrak, ekstrak etanol simplisia setara dengan 0.21 mg AEAC/ mg ekstrak dan
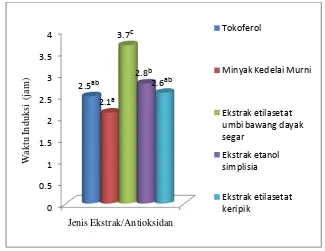
ekstrak etilasetat keripik dan ekstrak etanol keripik setara dengan 0.24 mg AEAC/ mg ekstrak dan 0.18 mg AEAC/ mg ekstrak. Setelah dilakukan pengujian terhadap kestabilan oksidatif dengan metode rancimat, maka diperoleh waktu induksi untuk ekstrak etilasetat umbi bawang dayak segar, ekstrak etanol simplisia dan ekstrak etilasetat keripik. Waktu induksi ekstrak etilasetat umbi bawang dayak segar sebesar 3.7 jam, ekstrak etanol simplsia sebesar 2.8 jam dan ekstrak etilasetat keripik sebesar 2.6 jam.
Pengukuran jumlah total fenol dilakukan dengan mereaksikan setiap ekstrak sampel dengan pereaksi Folin-ciocalteau. Hasil dari pengukuran ini diperoleh bahwa ekstrak metanol umbi bawang dayak segar, ekstrak etanol simplisia dan ekstrak metanol keripik memiliki total fenol paling tinggi. Nilai total fenol ekstrak metanol umbi bawang dayak segar, ekstrak etanol simplisia dan ekstrak metanol keripik masing-masing adalah 4.29 mg GAE/100 mg ekstrak, 3.52 mg GAE/ 100 mg ekstrak dan 3.38 mg GAE/100 mg ekstrak.
ekstrak etilasetat umbi bawang dayak segar dan ekstrak etilasetat keripik tidak hanya didukung oleh adanya senyawa fenol, akan tetapi ada senyawa antioksidan lain yang terekstrak pada pelarut etilasetat untuk umbi bawang dayak segar dan keripik. Senyawa antioksidan tersebut adalah betakaroten, triterpenoid dan tokoferol, dimana senyawa-senyawa tersebut cenderung larut dalam pelarut nonpolar.
Pengukuran kadar vitamin C dilakukan dengan menggunakan metode Idiometri. Nilai kadar vitamin C ekstrak umbi bawang dayak segar 61.5 mg/100 gram, ekstrak simplisia 41.0 mg/100 gram dan ekstrak keripik 22.0 mg/100gram. Penurunan nilai kadar vitamin C untuk ektrak simplisia dan ekstrak keripik disebabkan adanya perlakuan suhu selama pengolahan. Terjadi interaksi antara suhu pengolahan dengan jumlah kapasitas antioksidan umbi bawang dayak segar, simplisia dan keripik. Hal ini terbukti dengan menurunnya jumlah kapasitas antioksidan, kestabilan oksidatif , total fenol dan kadar vitamin C umbi bawang dayak segar setelah dilakukan pengolahan menjadi simplisia dan keripik. Penurunan jumlah ini menunjukan bahwa senyawa antioksidan yang terdapat dalam umbi bawang dayak tidak tahan terhadap suhu tinggi. Selain itu, penggunaan jenis pelarut yang berbeda menghasilkan jumlah kapasitas antioksidan dan total fenol yang berbeda-beda. Setiap jenis pelarut memiliki sensitivitas terhadap suatu senyawa tertentu di dalam suatu bahan.
KAPASITAS ANTIOKSIDAN BAWANG DAYAK (Eleutherine palmifolia) DALAM BENTUK SEGAR, SIMPLISIA DAN KERIPIK, PADA PELARUT NONPOLAR, SEMIPOLAR DAN
POLAR
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ALIA MUSTIKA NUR F24070071
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kapasitas Antioksidan Bawang Dayak (Eleutherine palmifolia) dalam Bentuk Segar,Simplisia dan Keripik, pada Pelarut Nonpolar, Semipolar dan Polar
Nama : Alia Mustika Nur NIM : F24070071
Menyetujui,
Dosen Pembimbing
(Prof. Dr. Ir. Made Astawan, MS) NIP. 19620202.198703.1.004
Mengetahui:
Plt. Ketua Departemen Ilmu dan Teknologi Pangan
(Dr. Ir. Nurheni Sri Palupi, M.Si) NIP 19610802 198703 2 002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Kapasitas Antioksidan Bawang Dayak (Eleutherine palmifolia) dalam Bentuk Segar, Simplisia dan Keripik, pada Pelarut Nonpolar, Semipolar dan Polar adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 18 Agustus 2011
Yang membuat pernyataan
BIODATA PENULIS
Alia Mustika Nur lahir di Pandeglang, 08 Oktober 1989 dari pasangan Syarifudin dan Aas Tafriasih sebagai anak ke empat dari empat bersaudara. Pendidikan Sekolah Dasar ditempuh dari tahun 1995-2001 di SDN Purwaraja 02 Pandeglang, kemudian melanjutkan Sekolah Menegah Pertama di MTS MA Pusat Menes sampai tahun 2004. Pada tahun 2007 penulis menamatkan Sekolah Menengah Ke atas dari SMAN 1 Pandeglang. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada tahun 2007 melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan mayor Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama menjalani perkuliahan di IPB, Penulis aktif dalam beberapa organisasi kemahasiswaan, yaitu staff Departemen Pengembangan Sumber Daya Manusia (PSDM) BEM TPB IPB, anggota Himpunan Mahasiswa Banten (KMB), anggota Himpunanan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA), panitia seminar PLASMA (2009). Penulis juga mendapatkan dana hibah dari Dikti melalui program PKM di bidang kewirausahaan dan di bidang penelitian pada tahun 2009-2010. Sebagai tugas akhir, penulis melakukan penelitian dengan judul “Kapasitas Antioksidan Bawang Dayak (Eleutherine palmifolia) dalam Bentuk Segar, Simplisia dan Keripik, pada Pelarut Nonpolar, Semipolar dan Polar” di bawah bimbingan Prof. Dr. Ir. Made Astawan, MS.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT yang senantiasa memberikan ridho dan pertolongan-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini. Penulisan skripsi ini disusun berdasarkan hasil penelitian untuk memenuhi salah satu syarat memperoleh gelar sarjana pada Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Tema yang dipilih dalam peneilitan ini adalah kapasitas antiokisdan dengan judul “ Kapasitas Antioksidan Bawang Dayak (Eleutherine palmifolia) dalam Bentuk Segar, Simplisia dan Keripik, pada Pelarut Nonpolar, Semipolar dan Polar. Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu dalam penyelesaian skripsi ini, yaitu:
1. Prof. Dr. Ir. Made Astawan, MS selaku dosen pembimbing akademik yang telah memberi bimbingan dan saran selama penyusunan skripsi ini.
2. Keluarga tercinta : Mamah dan Bapak, Kakak- kakakku Neng, Ana, Aan dan Arya . Terima kasih atas doa dan motivasi yang selalu diberikan selama penulis menyelesaikan penelitian dan skripsi ini.
3. Ibu Andi Erly. Terima kasih atas bantuan dana, waktu, perhatian, dukungan dan doa yang telah diberikan selama penelitian berlangsung.
4. Dosen penguji Dr. Ir. Hanifah Nuryani Lioe, M.Si dan Dr. Ir. Yadi Haryadi, MSc. Terima kasih atas kesediaan waktu serta saran yang telah diberikan.
5. Rina Ristyawati (alm). Terima kasih atas segala kebaikan yang selalu diberikan.
6. Sahabat-sahabat seperjuangan, Suriah Anggraeni, Renny Permatasari, Dhina Novitri, Annisa S Larasati, Lia Septiani, Meilly Kusuma Dewi, Michael Devega, Yohana Maria Leoni, Irwan Permadi, Chyntia DNS, Yolanda silvia dan Sarah tsaqqofa. Terimakasih atas kebersamaan, dukungan dan saran yang selalu diberikan kepada penulis selama penelitian dan penyusunan skripsi ini.
7. Keluarga besar ITP 44 yang selalu kompak. Terima kasih atas dukungan, bantuan dan kerjasamanya selama masa perkuliahan di ITP.
8. Seluruh teknisi laboratorium Ilmu dan Teknologi Pangan, Pak Wahid, Pak Taufik, Pak Yahya, Pak Sobirin, Mba Yane. Terima kasih atas bantuan selama penulis menyelesaikan penelitian. 9. Seluruh karyawan UPT ITP yang telah membantu dan memberikan informasi kepada penulis
selama kuliah di ITP.
10. Keluarga besar Pondok Nuansa Sakinah, Fauzia Trianastiti, PNS angkatan 43, Salis, Anis, Lena dan Nadia.
11. Semua pihak yang telah banyak membantu dalam penulisan skripsi yang tidak bisa penulis sebutkan satu-persatu.
Akhirnya penulis berharap semoga skripsi ini dapat bermanfaat dan memberikan kontribusi terhadap perkembangan ilmu pengetahuan di bidang teknologi pangan. Terima kasih.
Bogor, 18 Agustus 2011
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A.Latar Belakang ... 1
B. Tujuan Penelitian ... 2
C. Manfaat Penelitian... 2
II. TINJAUAN PUSTAKA ... 3
A.Bawang Dayak (Eleutherine palmifolia) ... 3
B. Antioksidan dan Pengukurannya ... 5
C. Vitamin C ... 7
D.Fitokimia ... 7
III. METODE PENELITIAN ... 10
A.Bahan dan Alat ... 10
1. Bahan... 10
2. Alat ... 10
B. Metode Penelitian ... 10
1. Persiapan Sampel ... 10
2. Ekstraksi Sampel ... 10
3. Analisis Proksimat ... 11
a. Kadar air ... 11
b. Kadar Abu ... 11
c. Kadar Lemak ... 11
d. Kadar Protein ... 12
e. Kadar Karbohidrat ... 12
4. Analisis Kimia ... 13
a. Kapasitas Antioksidan Metode DPPH ... 13
b. Kapasitas Antioksidan Metode Rancimat ... 13
c. Uji Total Fenol ... 13
d. Uji Kadar Vitamin C ... 14
5. Uji Kualitatif Fitokimia ... 14
6. Rancangan Percobaan ... 16
IV. HASIL DAN PEMBAHASAN ... 17
A.Persiapan Sampel dan Ekstraksi ... 17
B. Rendemen Ekstrak... 18
C. Analisis Proksimat... 20
D.Karakteristik Fisik Hasil Ekstraksi ... 20
E. Kapasitas Antioksidan Metode DPPH ... 22
F. Aktivitas Antioksidan Metode Rancimat ... 27
G.Total Fenol ... 29
H. Kadar Vitamin C ... 32
J. Hubungan Kapasitas Antioksidan, Total Fenol dan Kadar Vitamin C Sebagai Radikal Scavenger Pada Umbi Bawang Dayak Segar, Simplisia
Dan Keripik ... 35
V. SIMPULAN DAN SARAN ... 37
A.Simpulan ... 37
B. Saran ... 38
DAFTAR PUSTAKA ... 39
vi DAFTAR TABEL
Halaman
Tabel 1. Fitokimia Umbi Bawang Dayak (Eleutherine palmifolia) ... 4
Tabel 2. Rendemen Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik 19
Tabel 3. Proksimat Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 20
Tabel 4. Karakteristik Fisik Warna Ekstraksi Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 21
Tabel 5. Hasil Uji Fitokimia Ekstrak Umbi Bawang Dayak Segar ... 34
Tabel 6. Hasil Uji Fitokimia Ekstrak Simplisia Bawang Dayak ... 34
vi DAFTAR GAMBAR
Halaman
Gambar 1. Bawang Dayak (Eleutherine palmifolia) ... 4
Gambar 2. Umbi Bawang Dayak ... 18
Gambar 3. Simplisia Bawang Dayak ... 18
Gambar 4. Keripik Bawang Dayak ... 18
Gambar 5. Ekstrak Umbi Bawang Dayak Segar ... 21
Gambar 6. Ekstrak Simplisia Bawang Dayak ... 22
Gambar 7. Ekstrak Keripik Bawang Dayak... 22
Gambar 8. Kapasitas Antioksidan Ekstrak Umbi Bawang Dayak Segar ... 23
Gambar 9. Kapasitas Antioksidan Ekstrak Simplisia ... 24
Gambar 10. Kapasitas Antioksidan Ekstrak Keripik ... 24
Gambar 11. Nilai AEAC Ekstrak Umbi Bawang Dayak Segar ... 26
Gambar 12 Nilai AEAC Ekstrak Simplisia Bawang Dayak ... 27
Gambar 13. Nilai AEAC Ekstrak Keripik Bawang Dayak ... 27
Gambar 14. Waktu Induksi Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 28
Gambar 15. Total Fenol Ekstrak Umbi Bawang Dayak Segar ... 30
Gambar 16 Total Fenol Ekstrak Simplisia Bawang Dayak ... 30
Gambar 17. Total Fenol Ekstrak Keripik Bawang Dayak ... 31
vii DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data Proksimat Umbi Bawang Dayak Segar... 43
Lampiran 2. Data Proksimat Simplisia. ... 45
Lampiran 3. Data Proksimat Keripik ... 47
Lampiran 4. Data Kapasitas Antioksidan Umbi Bawang Dayak Segar ... 49
Lampiran 5. Data Kapasitas Antioksidan Simplisia Bawang Dayak ... 50
Lampiran 6. Data Kapasitas Antioksidan Keripik Bawang Dayak ... 51
Lampiran 7. Data Kurva Asam Askorbat ... 52
Lampiran 8. Data AEAC Umbi Bawang Dayak Segar ... 53
Lampiran 9. Data AEAC Simplisia Bawang Dayak ... 54
Lampiran 10. Data AEAC Keripik Bawang Dayak ... 55
Lampiran 11a.Uji ANOVA Kapasitas Antioksidan Metode DPPH Terhadap Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 56
Lampiran 11b.Uji Lanjut Beda Duncan Kapasitas Antioksidan Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 57
Lampiran 12a.Uji ANOVA AEAC Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik` ... 59
Lampiran 12b. Uji Lanjut Beda Duncan AEAC Ekstrak Umbi Bawang Dayak Segar Simplisia dan Keripik ... 60
Lampiran 13. Data Waktu Induksi Ekstrak Etilasetat Umbi Bawang Dayak Segar Metode Rancimat ... 62
Lampiran 14. Data Waktu Induksi Ekstrak Simplisia Metode Rancimat ... 64
Lampiran 15. Data Waktu Induksi Ekstrak Keripik Metode Rancimat ... 66
Lampiran 16. Data Waktu Induksi Kontrol Minyak Kedelai Murni Metode Rancimat 68
Lampiran 17. Data Waktu Induksi Tokoferol Metode Rancimat ... 69
Lampiran 18. Waktu Induksi Ekstrak Umbi Bawang Dayak Segar, Simplisia Dan Keripik ... 71
Lampiran 19. Uji ANOVA dan Uji Lanjut Beda Duncan Aktivitas Antioskidan Metode Rancimat ... 72
Lampiran 20. Data Kurva Standar Asam Galat ... 73
Lampiran 21. Data Total Fenol Umbi Bawang Dayak Segar ... 74
Lampiran 22. Data Total Fenol Simplisia Bawang Dayak ... 75
Lampiran 23. Data Total Fenol keripikBawang Daya ... 76
Lampiran 24. Uji ANOVA Total Fenol Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 77
Lampiran 25. Uji Lanjut Beda Duncan Total Fenol Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 78
Lampiran 26. Data Kadar Vitamin C Umbi Bawang Dayak Segar, Simplisia dan Keripik ... 80
1
I. PENDAHULUAN
A. LATAR BELAKANG
Wilayah Indonesia memiliki keanekaragaman hayati (biodiversity) yang melimpah untuk jenis tanaman yang diduga memiliki khasiat sebagai obat. Pemanfaatan bahan yang bersifat alami telah menjadi isu back to nature dan cenderung menjadi pilihan bagi masyarakat Indonesia. Selain itu, krisis ekonomi yang berkepanjangan serta biaya pengobatan yang relatif mahal membuat masyarakat Indonesia beralih ke pengobatan secara tradisional. Banyak sekali jenis tanaman Indonesia yang diduga memiliki khasiat bagi kesehatan, tetapi belum termanfaatkan secara optimal. Hal ini disebabkan secara ilmiah masih sedikit sekali informasi tentang kandungan senyawa bioaktif yang terdapat pada tanaman tersebut.
Bawang Dayak (Eleutherine palmifolia) adalah salah satu jenis tanaman yang berkhasiat bagi kesehatan. Tanaman ini banyak ditemukan di daerah Kalimantan. Penduduk lokal di daerah tersebut sudah menggunakan tanaman ini sebagai obat tradisional. Bagian yang dapat dimanfaatkan pada tanaman ini adalah umbinya. Khasiat dari tanaman bawang dayak di antaranya sebagai antikanker payudara, mencegah penyakit jantung, immunostimulant, antinflamasi, antitumor serta anti bleeding agent (Saptowalyono 2007).
Secara empiris diketahui tanaman ini dapat menyembuhkan penyakit kanker usus, kanker payudara, diabetes melitus, hipertensi, menurunkan kolesterol, obat bisul, stroke dan sakit perut sesudah melahirkan. Kenyataan yang ada di masyarakat lokal merupakan bukti bahwa tanaman ini merupakan tanaman obat multifungsi yang sangat bermanfaat sehingga penelitian dan pengembangan lebih lanjut sangat diperlukan untuk kepentingan masyarakat (Galingging 2007).
Bawang dayak mengandung senyawa naphtoquinonens dan turunannya seperti elecanacine,
eleutherine, eleutherol, eleuthernone (Hara et al. 1997). Naphtoquinones dikenal sebagai antimikroba, antifungal, antivirial dan antiparasitik. Selain itu, naphtoquinones memiliki bioaktivitas sebagai antikanker dan antioksidan yang biasanya terdapat di dalam sel vakuola dalam bentuk glikosida (Babula et al. 2005). Pemanfaatan bawang dayak sebagai salah satu sumber antioksidan masih belum banyak diteliti.
Komponen antioksidan memiliki peranan penting bagi perlindungan kesehatan tubuh. Para ahli berpendapat bahwa antioksidan mampu mereduksi risiko penyakit kronis seperti kanker dan penyakit jantung. Penggunaan antioksidan alami saat ini dianggap lebih aman karena antioksidan alami diperoleh dari ekstrak tanaman. Antioksidan alami yang terdapat pada tanaman antara lain kelompok flavonoid berupa senyawa polifenol. Oleh karena itu, penelitian tentang antioksidan alami yang meliputi pencarian sumber, cara ekstraksi, isolasi dan pengujian aktivitas senyawa bioaktifnya telah banyak dilakukan.
2
B. TUJUAN PENELITIAN
Penelitian ini secara umum bertujuan untuk mengukur kapasitas antioksidan ekstrak umbi bawang dayak segar, ekstrak simplisia dan ekstrak keripik dalam pelarut heksan, metanol, etanol, etilasetat dan air, sedangkan tujuan khususnya antara lain:
1. Mengidentifikasi jenis pelarut yang menghasilkan jumlah kapasitas antioksidan tertinggi 2. Mengevaluasi pengaruh pengolahan umbi bawang dayak segar menjadi simplisa dan keripik
terhadap kapasitas antioksidannya.
C. MANFAAT PENELITIAN
Hasil penelitian ini diharapkan berguna untuk:
1. Memberikan informasi ilmiah tentang nilai kapasitas antioksidan umbi bawang dayak segar, simplisia dan keripik sehingga dapat dimanfaatkan oleh masyarakat luas
2. Memberikan informasi mengenai jenis dan kandungan senyawa bioaktif pada umbi bawang dayak segar, simplisia dan keripik sehingga dapat diketahui pemanfaatannya bagi kesehatan tubuh.
3
II. TINJAUAN PUSTAKA
A.
BAWANG DAYAK
Bawang Dayak (Eleutherine palmifolia) adalah salah satu jenis tanaman yang berkhasiat bagi kesehatan. Tanaman ini banyak ditemukan di daerah Kalimantan. Penduduk lokal di daerah tersebut sudah menggunakan tanaman ini sebagai obat tradisional. Bagian yang dapat dimanfaatkan pada tanaman ini adalah umbinya. Nama lain dari bawang dayak antara lain Eleutherine americana, E. bulbosa, E. subaphyla, E. citriodora, E. guatemalensis, E. latifolia, E. longifolia, E. plicata dan E. anomala (Anonim 2009). Di Indonesia, tanaman ini juga dikenal dengan nama bawang mekah, bawang hantu, bawang sabrang dan bawang arab.
Taksonomi Bawang Dayak (Eleutherine palmifolia) Kingdom : Plantae
Subkingdom : Tracheobinota Super Divisi : Spermatophyta Divisi : Magnoliophyta Kelas : Liliopsida Sub Kelas : Liliidae Ordo : Liliales Famili : Iridaceae Genus : Eleutherine
Spesies : Eleutherine americana Merr
Tanaman ini banyak terdapat di daerah pegunungan antara 600 sampai 1500 m di atas permukaan laut. Penanamannya mudah dibudidayakan, tidak tergantung musim dan dalam waktu 2 hingga 3 bulan setelah tanam sudah dapat dipanen (Saptowalyono 2007). Ciri spesifik dari tanaman ini adalah umbinya yang berwarna merah menyala dengan permukaan yang sangat licin, letak daun berpasangan dengan komposisi daun bersirip ganda dan bunganya berwarna putih. Tipe pertulangan daunnya sejajar dengan tepi daun licin dan bentuknya seperti pita bergaris. Selain digunakan sebagai tanaman obat, tanaman ini juga bisa digunakan sebagai tanaman hias karena memiliki bunga yang berwarna putih (Galingging 2007). Bentuk dan warna bawang dayak dapat dilihat pada Gambar 1.
4 Gambar 1. Bawang Dayak (Eleutherine palmifolia)
Umbi bawang dayak mengandung senyawa-senyawa turunan anthrakinon yang mempunyai daya pencahar, yaitu senyawa-senyawa eleutheurin, isoeleutherin dan senyawa-senyawa sejenisnya, senyawa-senyawa-senyawa-senyawa lakton yang disebut eleutherol dan senyawa turunan
pyron yang disebut eleutherinol (Komura et al. 1983). Adapun senyawa bioaktif yang terdapat dalam umbi bawang dayak terdiri dari senyawa alkaloid, steroid, glikosida, flavonoid, fenolik, saponin, triterpenoid, tanin (Galingging 2007) dan kuinon (Nawawi et al. 2007). Tabel 1 menunjukan kandungan fitokimia tanaman umbi bawang dayak.
Tabel 1. Fitokimia Umbi Bawang Dayak (Eleutherine palmifolia)
Jenis fitokimia Hasil uji
Alkaloid ++++
Saponin -
Glikosida ++
Flavonoid ++
Fenolik ++
Steroid ++++
Tanin ++
Sumber: Galingging 2007
Keterangan: - = negatif; + = positif lemah; ++ = positif; +++ = positif kuat; ++++ = positif kuat sekali.
5 Hasil penelitian Nawawi et al. (2007) menunjukan bahwa karakteristik simplisia bawang dayak memiliki kadar abu total 1.4%, abu larut air 4.2%, abu tidak larut asam 1.7%, sari larut etanol 2.7% dan sari larut air 2%. Selain itu, diperoleh hasil kadar air simplisia 6%, nilai tersebut memenuhi standar persyaratan kadar air simplisia secara umum yaitu kurang dari 10%. Hasil uji fitokimia simplisia bawang dayak menunjukkan hasil positif untuk alkaloid (endapan merah), kuinon (endapan merah kecoklatan), tanin (warna merah), flavonoid (endapan kuning), steroid atau triterpenoid (warna merah), dan hasil negatif pada saponin (tidak berbentuk busa) (Nawawi et al. 2007).
B.
ANTIOKSIDAN DAN PENGUKURANNYA
Radikal bebas (free radical) adalah molekul atau gugus atom yang tidak memiliki pasangan elektron pada orbit terluarnya. Akibatnya radikal bebas biasanya bersifat tidak stabil dan sangat reaktif karena berusaha untuk berpasangan dengan molekul atau atom lain. Senyawa radikal bebas dapat terbentuk akibat proses kimia yang terjadi dalam tubuh, seperti proses oksidasi, olahraga berlebihan dan peradangan. Selain itu, senyawa radikal bebas juga bisa terbentuk ketika komponen makanan diubah menjadi energi melalui proses metabolisme yang mana sering terjadi kebocoran elektron. Kondisi seperti ini sangat mudah menyebabkan terjadinya pembentukan radikal bebas seperti anion superoksida dan hidroksil. Pembentukan senyawa radikal bebas tidak hanya terjadi dari proses kimia, akan tetapi bisa terbentuk dari senyawa lain yang sebenarnya bukan bersifat radikal bebas dan mudah berubah menjadi radikal bebas. Kelompok senyawa tersebut sering diistilahkan sebagai Reactive Oxygen Species (ROS) (Winarsi 2007).
ROS merupakan senyawa turunan oksigen yang lebih reaktif. Senyawa ini akan mencapai kestabilan dengan menerima elektron dari molekul lain atau mentransfer elektron yang tidak berpasangan ke molekul lain. Senyawa ROS yang tidak memiliki pasangan elektron meliputi anion superoksida (O2·−), radikal hidroksil (OH·), radikal peroksil (ROO·)
dan radikal hidroperoksil (HOO·), sedangkan senyawa ROS yang memiliki pasangan elektron adalah hidrogen peroksida (H2O2), asam hipoklorous (HOCl) dan anion peroksinitrit
(ONOO-). Apabila jumlah ROS melebihi jumlah antioksidan dalam tubuh, maka kelebihannya akan menyerang komponen lipid, protein, maupun DNA sehingga mengakibatkan kerusakan-kerusakan yang disebut stress oksidatif. Secara alami, ROS terbentuk dari hasil proses metabolisme dan sel tubuh telah memiliki beberapa mekanisme perlindungan untuk mencegah terbentuknya ROS atau detoksifikasi ROS. Mekanisme ini menggunakan molekul yang disebut dengan antioksidan (Wu dan Arthur 2003).
Antioksidan adalah suatu substansi yang pada konsentrasi rendah dapat mencegah atau memperlambat proses oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif sehingga kerusakan sel akan dihambat. Senyawa ini memiliki berat molekul kecil tetapi mampu menginaktivasi berkembangnya reaksi oksidasi dengan cara mencegah terbentuknya radikal. Antioksidan pada umumnya terdapat secara alami pada tanaman dan memiliki peranan penting bagi perlindungan kesehatan tubuh. Senyawa ini dapat mencegah kerusakan oksidatif dan mengurangi risiko penyakit (Dimitrios 2006). Tubuh manusia memiliki sistem antioksidan untuk menangkal reaktivitas radikal bebas yang secara kontinu dibentuk oleh diri sendiri, contohnya superoxide dismutase (SOD), catalase (CAT) dan
glutathion peroxidase (GPx).
6 antioksidan di baris kedua (antioksidan sekunder) dan (3) pertahanan antioksidan di baris ketiga (antioksidan tersier). Enzim SOD , CAT, GPx, dan beberapa mineral (Se, Mn, Cu, Zn) menjadi senyawa antioksidan di pertahanan pertama. Antioksidan ini bekerja mencegah pembentukan radikal bebas baru dengan cara mengubah radikal bebas yang ada menjadi molekul yang kurang mempunyai dampak negatif.
Pertahanan antioksidan di barisan kedua bekerja dengan cara mengkelat logam yang bertindak sebagai prooksidan, menangkap radikal dan mencegah terjadinya reaksi berantai, senyawanya antara lain Glutathione (GSH), vitamin C, asam urat, albumin, bilirubin, vitamin E (α-tokoferol), karotenoid dan flavonoid. Pertahanan antioksidan di baris ketiga adalah golongan enzim untuk memperbaiki kerusakan DNA, protein, oksidasi lemak dan peroksida serta menghentikan rantai propagasi pada peroksil lipid. Enzim-enzim ini adalah lipase, protease, enzim yang memperbaiki DNA, transferase dan methionine sulphoxide reductase (Gupta dan Sharma 2006)
Sumber-sumber antioksidan dapat dikelompokkan menjadi dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Beberapa contoh antioksidan sintetik antara lain butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), propyl gallate (PG), tert-butylhydroquinone (TBHQ), sedangkan yang termasuk antioksidan alami antara lain fenol, polifenol, flavonoid, α-tokoferol, karotenoid dan antosianin. Komponen fenolik seperti flavonoid, asam fenolik atau ditermen fenolik adalah senyawa-senyawa dominan yang berpotensi sebagai antioksidan (Kiselova et al. 2006), berperan dalam menangkal dan menetralkan radikal bebas, meredam terbentuknya singlet oksigen dan triplet oksigen atau secara langsung mendekomposisi peroksida (Javanmardi et al. 2003)
Berbagai macam metode untuk pengukuran aktivitas antioksidan telah banyak digunakan untuk melihat dan membandingkan aktivitas antioksidan pada berbagai macam sumber antioksidan. Beberapa metode pengukuran aktivitas antioksidan yang dapat digunakan antara lain metode beta karoten, metode linoleat, metode terkonjugasi, metode tiosianat, metode rancimat dan metode DPPH. Pengujian antioksidan dengan DPPH
merupakan salah satu metode yang sederhana dengan menggunakan radikal 1,1-diphenyl-2-picrylhydrazil sebagai senyawa pendeteksi. DPPH merupakan senyawa
radikal bebas yang bersifat stabil sehingga dapat bereaksi dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH tereduksi (Molyneux 2004). Pengukuran aktivitas antioksidan dengan DPPH menggunakan alat spektrofotometer pada panjang gelombang 517nm.
Prinsip dari metode DPPH ini, atom hidrogen dari sutau senyawa antioksidan akan membuat larutan DPPH menjadi tidak berwarna yang dapat diukur menggunakan spektrofotometer akibat terbentuknya DPPH tereduksi (DPPH-H) (Sharma dan Bhat 2009). Apabila larutan DPPH direaksikan dengan senyawa antioksidan, maka akan terjadi perubahan warna dari ungu menjadi kuning (Molyneux 2004). Semakin tinggi kemampuan suatu senyawa antioksidan dalam meredam radikal DPPH, maka warna yang dihasilkan akan semakin kuning dan mendekati jernih. Hal ini ditandai dengan semakin kecilnya nilai absorbansi yang terukur pada spektrofotometer.
ion-7 ion hasil oksidasi. Ion-ion ini akan menghasilkan nilai konduktivitas tertentu yang diukur di dalam air bebas ion.
Aktivitas antioksidan dengan metode rancimat ditentukan dengan menghitung waktu induksinya. Semakin lama waktu induksi, maka sampel yang diuji memiliki aktivitas antioksidan yang baik. Reaksi antioksidan minyak akan menghasilkan senyawa ionik yang volatil. Senyawa ionik ini dialirkan pada air bebas ion dan senyawa tersebut akan mengubah konduktivitas listrik dari air bebas ion (Tensiska et al. 2003). Waktu saat terjadinya peningkatan konduktivitas listrik secara cepat ditentukan sebagai waktu induksi.
C.
VITAMIN C
Vitamin C atau asam askorbat adalah vitamin yang larut dalam air, mempunyai sifat yang asam dan sifat pereduksi yang kuat. Struktur kimianya terdiri dari rantai 6 atom C dan kedudukannya tidak stabil (C6H8O6), karena mudah bereaksi dengan O2 di udara menjadi
asam dehidroaskorbat. Vitamin C merupakan fresh food vitamin karena sumber utamanya adalah buah-buahan dan sayuran segar. Asam askorbat pada tumbuhan merupakan metabolit sekunder, karena terbentuk dari glukosa melalui jalur asam D-glukoronat dan L-gulonat (Safaryani et al. 2007).
Sifat asam askorbat adalah mudah berubah akibat oksidasi namun stabil jika merupakan kristal murni. Selain itu, asam askorbat mudah rusak oleh pH, cahaya dan temperatur. Penggunaan suhu yang tinggi dengan waktu yang lama akan menurunkan jumlah asam askorbatnya. Bentuk asam askorbat yang ada di alam adalah L-asam askorbat. Asam L-askorbat dengan adanya enzim asam askorbat oksidase akan teroksidasi menjadi asam L-dehidroaskorbat. Asam ini secara kimia juga sangat labil dan mengalami perubahan lebih lanjut menjadi asam L-diketogulonat yang tidak lagi memiliki keaktifan sebagai asam askorbat. Suasana basa menyebabkan asam L-diketogulonat teroksidasi menjadi asam oksalat dan asam L-treonat( Safaryani et al. 2007).
Manfaat asam askorbat bagi kesehatan yaitu sebagai antioksidan, antiatherogenik, antikarsinogenik dan immunomodulator. Asam askorbat merupakan sumber antioksidan yang sangat baik dalam tubuh yang secara alami melindungi tubuh dari serangan oksidatif akibat radikal bebas. Selain itu, asam askorbat juga berfungsi untuk mengurangi risiko kanker lambung dan mencegah kanker kolektral. Asam askorbat bekerja secara sinergis dengan vitamin E untuk menangkal radikal bebas. Sebagai senyawa peredam radikal bebas, asam askorbat dapat langsung bereaksi dengan anion superoksida, radikal hidroksil, oksigen singlet dan lipid peroksida. Selain itu, asam askorbat akan mendonorkan satu elektron membentuk semidehidroaskorbat yang tidak bersifat reaktif dan selanjutnya mengalami reaksi disproporsionasi membentuk dehidroaskorbat yang bersifat tidak stabil. Dehidroaskorbat akan terdegradasi membentuk asam oksalat dan asam treonat. Oleh karena kemampuanya sebagai penghambat radikal bebas, maka peranannya sangat penting dalam menjaga integritas membran sel (Suhartono et al. 2007).
D.
FITOKIMIA
8 metabolit sekunder dari tumbuhan. Metabolit sekunder pada tanaman antara lain saponin, flavonoid, fenol, alkaloid, steroid, terpenoid dan tanin.
Analisis fitokimia biasanya digunakan untuk merujuk pada senyawa yang ditemukan pada tumbuhan yang tidak dibutuhkan untuk fungsi normal tubuh, tetapi memiliki efek yang menguntungkan bagi kesehatan atau memiliki peran aktif bagi pencegahan penyakit. Hal inilah yang menjelaskan mengapa orang-orang lebih tertarik mengisolasi metabolit sekunder daripada metabolit primernya. Senyawa aktif ini dapat bermanfaat sebagai antioksidan dan mencegah kanker serta penyakit jantung.
Beberapa studi pada manusia dan hewan membuktikan bahwa zat-zat kombinasi fitokimia di dalam tubuh memiliki fungsi tertentu yang berguna bagi kesehatan. Kombinasinya antara lain menghasilkan enzim-enzim sebagai penangkal racun, merangsang sistem pertahanan tubuh, menimbulkan efek antibakteri, antivirus dan antioksidan serta dapat menimbulkan efek antikanker. Sampai saat ini sudah banyak jenis fitokimia yang ditemukan dan jumlahnya begitu banyak. Agar memudahkan dalam mempelajarinya, maka dilakukan penggolongan senyawa fitokimia. Adapun golongan senyawa fitokimia dapat dibagi sebagai berikut: alkaloid, saponin, flavonoid, tannin, fenol, triterpenoid dan steroid.
1.
Alkaloid
Alkaloid adalah senyawa yang bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam bentuk gabungan sebagai bagian dari sistem siklik (Harborne 1987). Alkaloid pada tumbuhan dipercaya sebagai hasil metabolisme dan merupakan sumber nitrogen. Kebanyakan alkaloid berbentuk kristal dan hanya sedikit yang berupa cairan pada suhu kamar. Kebasaan nitrogen menyebabkan senyawa tersebut mudah mengalami dekomposisi terutama oleh sinar dengan adanya oksigen (Lenny 2006).
2.
Saponin
Saponin merupakan senyawa dalam bentuk glikosida yang tersebar luas pada tumbuhan tingkat tinggi. Saponin membentuk larutan koloidal dalam air dan membentuk busa jika dikocok dan tidak hilang dengan penambahan asam (Harborne 1996). Saponin memiliki rasa pahit menusuk dan menyebabkan bersin serta iritasi pada selaput lendir.
3.
Tanin
Tanin merupakan senyawa yang memiliki jumlah gugus hidroksi fenolik yang banyak pada tumbuh-tumbuhan. Tanin dapat berfungsi sebagai antioksidan karena kemampuannya dalam menstabilkan fraksi lipid dan keaktifannya dalam penghambatan lipoksigenase (Zeuthen dan Sorensen 2003).
4.
Fenolik
Senyawa fenolik telah diketahui memiliki berbagai efek biologis seperti aktivitas antioksidan melalui mekanisme sebagai pereduksi, penangkap radikal bebas, pengkelat logam, peredam terbentuknya singlet oksigen serta pendonor elektron (Karadeniz et al.
9 Williams 2000). Setiap tumbuh-tumbuhan memiliki struktur komponen fenolik yang berbeda. Ada komponen fenolik yang memliki gugus –OH banyak dan ada pula komponen fenolik yang memiliki gugus –OH yang sedikit. Gugus –OH berperan dalam proses transfer elektron untuk menstabilkan dan meredam radikal bebas.
5.
Flavonoid
Flavonoid merupakan salah satu dari kelompok senyawa fenolik yang dapat ditemukan di buah dan sayur. Flavonoid telah diteliti memiliki berbagai aktivitas biologis seperti antikanker, antiviral, antiinflamasi, mengurangi risiko penyakit kardiovaskuler dan penangkap radikal bebas. Kekuatan aktivitas antioksidan dari flavonoid bergantung pada jumlah dan posisi dari gugus -OH yang terdapat pada molekul. Semakin banyak gugus -OH pada flavonoid, maka aktivitas antiradikalnya semakin tinggi. Adanya gugus orto-katekol (3„4„-OH) pada cincin B flavonoid merupakan faktor penentu kapasitas antioksidan yang tinggi (Amic et al. 2003).
6.
Triterpenoid/ Steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isopropana dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu
skualena. Senyawa ini berstruktur siklik, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Triterpenoid merupakan senyawa berbentuk kristal dan bertitik leleh tinggi. Uji yang banyak digunakan adalah reaksi Licberman-Burchard (anhidrat asetat- H2SO4)
yang dengan kebanyakan triterpena dan sterol memberikan warna hijau-biru (Harborne 1987).
7.
Glikosida
10
III. METODE PENELITIAN
A.
BAHAN DAN ALAT
1.
Bahan
Umbi bawang dayak segar, simplisia, keripik, metanol, etanol, etilasetat, heksan, air destilata, toluen, H2SO4 pekat, H2BO3 3%, NaOH-5%, Na2S2O3.5H2O, NaOH, indikator
MRB, indikator PP, pereaksi DPPH 0,5 mM, asam askorbat standar, pereaksi Folin-Ciocalteau 50%, asam galat, Na2C2O3 2%, pereaksi Meyer, pereaksi Dragendorff,
pereaksi Bouchardat, pereaksi Molish dan gas nitrogen (N2).
2.
Alat
Labu didih, tabung Bidwell-Sterling, cawan porselin, tanur, oven, alat Soxhlet, kertas saring, alat destilasi protein, hot plate, shaker, labu Erlenmeyer, gelas ukur, gelas piala, tabung reaksi bertutup, rotary evaporator, spektrofotometer, vacuum evaporator, alat rancimat, timbangan analitik.
B.
METODE PENELITIAN
Penelitian ini dibagi menjadi enam tahap, yaitu: (1) persiapan sampel, (2) ekstraksi sampel, (3) analisis proksimat, (4) analisis aktivitas antioksidan, (5) uji kualitatiffitokimia dan (6) rancangan percobaan
1.
Persiapan Sampel
Umbi bawang dayak yang telah dipanen, langsung dicuci bersih dan disimpan dalam refrigerator untuk memperlambat proses pembusukan. Pembuatan simplisia bawang dayak dilakukan dengan merajang bawang sehingga diperoleh ketebalan 1-2 mm, dikeringkan dengan oven pada suhu 50oC selama 6 jam lalu didinginkan dan dikemas dalam kantung plastik. Pembuatan simplisia dengan cara pengeringan harus dilakukan dengan cepat, tetapi pada suhu yang tidak terlalu tinggi. Pengeringan yang dilakukan pada suhu terlalu tinggi akan mengakibatkan perubahan kimia pada kandungan senyawa aktifnya. Keripik bawang dayak dibuat dengan merendam lembaran umbi bawang dayak dalam larutan garam 12% selama 12 jam, lalu dikeringkan dalam oven pada suhu 70oC selama 4 jam. Setelah itu didinginkan dan dikemas dalam kantung plastik. Perendaman lembaran bawang dayak bertujuan untuk mengurangi rasa sepat.
2.
Ekstraksi Sampel
11 sampel dikumpulkan dan diuapkan dengan rotary evaporator pada suhu 40°C untuk mendapatkan ekstraknya.
3.
Analisis Proksimat (AOAC 1995)
Pengukuran nilai proksimat meliputi kadar air dengan metode distilasi, kadar abu dengan metode pengabuan kering, kadar lemak dengan metode ekstraksi Soxhlet , kadar protein dengan metode mikro Kjeldhal dan kadar karbohidrat by difference.
a. Pengukuran Kadar Air Metode Distilasi
Labu didih dan tabung Bidwell-Sterling dikeringkan dalam oven bersuhu 1050C, lalu didinginkan dalam desikator. Sampel sebanyak 3 gram ditimbang dan dimasukan ke dalam labu didih yang telah didinginkan dan ditambahkan 60-80 ml toluen. Selanjutnya, sampel direfluks dengan suhu rendah selama 45 menit. Setelah selesai, volume air yang terdestilasi dibaca. Untuk mengetahui faktor destilasi, maka dilakukan prosedur analisis seperti di atas dengan menggunakan sampel air. Kadar air sampel dapat dihitung dengan menggunakan rumus sebagai berikut:
Kadar air =Vs
Ws x FD x 100%
dimana: Ws = berat contoh (g)
Vs = volume air yang didestilasi dari contoh (ml) FD = faktor destilasi (g/ml)
Faktor destilasi (FD) dihitung dengan rumus berikut:
FD =W
dimana: W = berat air yang akan didestilasi (g) V = volume air yang terdestilasi (ml)
b. Pengukuran Kadar Abu Metode Pengabuan Kering
Cawan aluminium kosong dimasukan ke dalam oven selama 3 jam, kemudian dimasukan ke dalam desikator selama 15 menit dan ditimbang. Sampel yang telah dihaluskan dengan blender ditimbang sebanyak 5 gram dan dimasukan ke dalam cawan pengabuan yang telah diketahui berat konstannya. Sampel dimasukan ke dalam tanur dengan suhu 5000C selama 6 jam. Sampel didinginkan ke dalam desikator selam 15 menit, lalu ditimbang. Kadar abu sampel dapat dihitung dengan menggunakan rumus sebagai berikut:
Kadar abu ( g/100 g bahan basah) =W 1−W 2
W X 100, atau
Kadar abu (g/100 g bahan kering)= kadar abu (bb )
(100−kadar air bb ) X 100
Dimana: W = bobot contoh sebelum diabukan (g)
W1 = bobot contoh + cawan sesudah diabukan (g) W2 = bobot cawan kosong (g)
c. Pengukuran Kadar Lemak Metode Ekstraksi Soxhlet
12 kertas saring bebas lemak sebanyak 5 gram. Sampel dan kertas saring diletakkan pada alat ekstraksi Soxhlet, kemudian alat kondensor dipasang di atasnya dan labu lemak di bawahnya. Refluks dilakukan minimal 5 jam dengan pelarut heksan sehingga pelarut yang turun kembali ke labu lemak berwarna jernih. Pelarut yang ada di dalam labu lemak didestilasi dan pelarutnya ditampung. Labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 1050C, kemudian didinginkan dalam desikator dan ditimbang. Kadar lemak sampel dapat diketahui dengan menggunakan rumus sebagai berikut:
Kadar lemak ( g/100 g bahan basah) =W 1−W 2
W 0 X 100
Kadar lemak ( g/100 g bahan kering) = kadar lemak (bb )
100−kadar air bb 100
Dimana: W0 = bobot contoh (g)
W1 = bobot labu lemak+ lemak hasil ekstraksi (g) W2 = bobot labu lemak kosong (g)
d. Pengukuran Kadar Protein Metode Mikro Kjeldhal
Sampel yang telah dihaluskan dengan blender ditimbang sebanyak 5 gram dan dimasukkan ke dalam labu Kjeldhal, kemudian sampel dalam labu ditambahkan 1.9± 0.1 gram K2SO4, 40± 10 mg HgO, 6.7 ± 0.1 ml H2SO4. Sampel
didihkan selama 1-1,5 jam sampai cairan menjadi jernih, kemudian didinginkan dan ditambahkan sejumlah kecil air perlahan-lahan. Isi labu dipindahkan ke dalam alat destilasi, kemudian labu dicuci dan dibilas 5-6 kali dengan 1-2 ml air. Air cucian dipindahkan kedalam alat destilasi. Labu Erlenmeyer 125 ml yang berisi 5 ml H2BO3 dan 2-4 tetes indikator MRB (metilen red blue) diletakkan di bawah
kondensor (ujung tabung harus terendam dalam larutan H2BO3). Sampel
ditambahkan 8-10 ml NaOH-Na2S2O3, kemudian dilakukan destilasi sampai
tertampung kira-kira 15 ml destilat yang berwarna hijau dalam labu Erlenmeyer. Tabung kondensor dibilas dengan air dan ditampung bilasannya dalam labu Erlenmeyer yang sama. Isi Erlenmeyer diencerkan kira-kira 50 ml kemudian dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna dari hijau menjadi ungu. Persentase kadar nitrogen dalam sampel dapat dihitung dengan menggunakan rumus sebagai berikut:
% N= ml HCL contoh−ml HCL blanko x N HCl x 14,007
mg contoh 100
Kadar Protein (g/100g bahan basah) = %N X Faktor konversi Kadar Protein (g/100g bahan kering) = kadar protein (bb )
(100−kadar air bb ) 100
e. Pengukuran Kadar Karbohidrat Secara “ by Difference”
Kadar karbohidrat dihitung secara by difference yang nilainya merupakan pengurangan 100% kandungan gizi sampel dengan kadar air, protein, abu dan lemak. Nilainya dapat ditentukan dengan rumus sebagai berikut:
13
4.
ANALISIS AKTIVITAS ANTIOKSIDAN
Pengujiannya meliputi uji kapasitas antioksidan menggunakan metode DPPH (Sharma dan Bhat 2009) dan metode Rancimat (Beirao dan Bernardo-Gill 2005), pengukuran jumlah total fenol (Strycharz dan Shetty 2002) dan kadar vitamin C (Sudarmadji et al. 1981)
a. Kapasitas Antioksidan Metode DPPH (Sharma dan Bhat 2009)
Sebanyak 1 ml larutan sampel atau standar dimasukan ke dalam tabung reaksi, lalu ditambahkan 7 ml metanol (sebagai blanko adalah 8 ml metanol). Suspensi tersebut kemudian ditambahkan 2 ml larutan DPPH 0.5 mM dan dihomogenkan dengan menggunakan vortex. Seluruh reaksi dilakukan pada ruang gelap. Campuran tersebut diinkubasi selama 30 menit pada suhu ruang, kemudian diukur absorbansinya pada panjang gelombang 517 nm. Kapasitas antioksidan dinyatakan dalam bentuk presentase penghambatan terhadap radikal DPPH dengan perhitungan sebagai berikut:
� � � � � (%) =( � � −� � )
� � 100%
Aktivitas antioksidan dinyatakan dalam bentuk AEAC (Ascorbic Acid Equivalent Antioxidant Capacity), yaitu dengan menggunakan asam askorbat sebagai standar antioksidan.
b. Aktivitas Antioksidan Metode Rancimat (Modifikasi Metode Beirao dan Bernardo-Gill 2005)
Sebanyak 10 mg ekstrak umbi bawang dayak segar, ekstrak simplisia dan ekstrak keripik masing- masing dimasukkan ke dalam gelas piala berisi 10 ml minyak yang mempunyai ikatan rangkap banyak seperti minyak kedelai (konsentrasi akhirnya 1000 ppm). Minyak yang dipakai harus berada dalam keadaan murni. Larutan tersebut diaduk sampai homogen. Masing-masing dari larutan diambil sebanyak 3 gram dan dimasukan ke dalam alat rancimat dengan suhu 1200C. Kontrol yang digunakan adalah minyak kedelai. Selain itu, antioksidan tokoferol sebanyak 1000 ppm juga ditambahkan ke dalam minyak dengan prosedur yang sama sebagai faktor pembanding. Aktivitas antioksidan dinyatakan dalam waktu induksi.
c. Pengukuran Jumlah Total Fenol ( Strycharz dan Shetty 2002)
Pembuatan kurva standar dilakukan dengan melakukan seri pengenceran asam galat dari stok asam galat. Masing-masing seri pengenceran ditambahkan 0.5 ml etanol 95%, 2.5 ml aquades dan 2.5 ml perekasi Folin-Ciocalteau. Sebanyak 0.5 ml Na2CO3 2% ditambahkan dan divortex hingga rata. Seri pengenceran
disimpan dalam ruang gelap selama 1 jam serta dibaca absorbansinya dengan spektrofotometer pada panjang gelombang 725 nm untuk dibuat kurva standar asam galat.
Sebanyak 0.5 ml filtrat sampel ditambahkan 0.5 ml etanol 95%, 2.5 ml aquades dan 2.5 ml perekasi Folin-Ciocalteau. Campuran larutan tersebut
didiamkan selama 5 menit kemudian ditambahkan 0.5 ml Na2CO3 2%. Selanjutnya
14 pada panjang gelombang 725 nm. Hasil absorbansi diplotkan dengan kurva standar asam galat untuk diperoleh konsentrasinya. Nilai total fenol dihitung dalam satuan mg GAE/ 100ml.
d. Pengukuran Kadar Vitamin C Metode Titrasi Iodin (Sudarmadji et al. 1981) Sebanyak 10 gram umbi bawang dayak segar yang telah dihancurkan dan 5 g bubuk simplisia dan keripik, masing- masing dimasukkan ke dalam labu takar 100 ml dan ditambahkan dengan aquades sampai 100 ml dan dipisahkan filtratnya dengan kertas saring. Sebanyak 5 ml filtrat tersebut dimasukkan ke dalam labu Erlenmeyer dan ditambahkan 1 ml larutan amilum 1%. Campuran dititrasi dengan 0.01 N standar iodin sampai larutan berwarna biru. Kadar vitamin C sampel dapat dihitung dengan rumus sebagai berikut:
Kadar Vitamin C (mg/100 gram)= � � 0.88 ��� 100
Dimana : P = faktor pengenceran
W = berat awal sampel (gram)
ml iod = jumlah iod yang dipakai (ml)
5.
UJI KUALITATIF FITOKIMIA
a. Pengujian Steroid (Harbone 1987)
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2 jam. Filtrat diuapkan dalam cawan penguap. Pada sisi ditambahkan 2 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Timbul warna ungu atau merah kemudian berubah menjadi biru hijau menunjukkan positif (+) adanya steroida/triterpenoida. Apabila tidak timbul warna merah dan biru hijau, maka sampel menunjukkan hasil negatif (-) untuk steroid/ triterpenoid.
b. Pengujian Saponin (Materia Medika Indonesia 1995)
Sebanyak 0,5g serbuk simplisia dimasukkan ke dalam tabung reaksid an ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10cm. Setelah itu, ditambahkan 1 tetes larutan asam klorida 2N. Apabila buih tidak hilang, menunjukkan positif (+) adanya saponin, akan tetapi apabila buihnya hilang berarati menunjukkan hasil negatif (-) untuk saponin.
c. Pengujian Alkaloid (Materia Medika Indonesia 1995)
Sebanyak 0,5g serbuk simplisia ditimbang kemudian ditambahkan 1 ml asam klorida 2N dan 9ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. Diambil 3 tetes filtrat lalu ditambahkan 2 tetes pereaksi Meyer b. Diambil 3 tetes filtrat lalu ditambahkan 2 tetes pereaksi Bouchardat c. Diambil 3 tetes filtrat lalu ditambahkan 2 tetes pereaksi Dragendorff.
15 d. Pengujian Tanin (Materia Medika Indonesia 1995)
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1-2 tetes pereaksi besi (III) klorida. Apabila timbul warna biru atau kehitaman berarti menunjukkan positif (+) adanya tanin. Akan tetapi, apabila warna biru atau kehitaman tidak muncul, maka sampel menunjukkan hasil negatif (-) untuk senyawa tanin.
e. Pengujian Fenol (Materia Medika Indonesia 1995)
Sampel sebanyak 0,5 gram ditambahkan dengan 2 ml metanol. Larutan kemudian didinginkan dan disaring. Filtrat yang dihasilkan, dicampur dengan NaOH 10% dan dipanaskan. Apabila timbul warna merah pada sampel, maka positif (+) menghasilkan senyawa fenol dan apabila tidak timbul warna merah berarti menunjukkan hasil negatif (-) untuk senyawa fenol.
f. Pengujian Golongan Flavonoid (Materia Medika Indonesia 1995)
Larutan Percobaan: sebanyak 0,5 g serbuk simplisia disari dengan 10 ml metanol lalu direfluks selama 10 menit, disaring panas panas melalui kertas saring, filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambah 5 ml n-heksan, dikocok hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40°C, sisa dilarutkan dalam etil asetat, disaring.
Cara Percobaan:
a. Sebanyak 1 ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1-2 ml etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 ml asam klorida 2 N, didiamkan selama satu menit. Ditambahkan 10 ml asam klorida pekat, jika dalam waktu 2-5 menit terjadi warna merah yang intensif maka positif (-) menunjukkan adanya flavonoida dan apabila tidak terbentuk warna merah, maka menunjukkan hasil negatif (-) untuk senyawa flavonoid.
b. Sebanyak 1 ml larutan percobaaan diuapkan hingga kering, sisanya dilarutkan dalam 1 ml etanol 96%, ditambahkan 0,1 g magnesium dan 10 tetes asam klorida pekat, terjadi warna merah jingga sampai merah ungu intensif maka positif (+) menunjukkan adanya flavonoida dan apabila tidak terbentuk warna merah jingga sampai merah ungu, maka menunjukkan hasil negatif (-) untuk senyawa flavonoid.
g. Pengujian glikosida (Materia Medika Indonesia 1995)
16 positif (+) adanya senyawa glikosida. Akan tetapi, apabila tidak terbentuk cincin warna ungu maka sampel menunjukkan hasil negatif (-) untuk senyawa glikosida.
6.
RANCANGAN PERCOBAAN
Rancangan percobaan penelitian untuk mengetahui kapasitas antioksidan adalah rancangan acak lengakap faktorial dengan 2 faktor. Faktor yang diterapkan adalah (1) jenis bahan, yaitu umbi bawang dayak segar, simplisia dan keripik , (2) pelarut, yaitu air, heksan, etilasetat, etanol dan metanol. Model rancangan penelitian adalah sebagai berikut:
Yij = µ + Ai + Bj + (AB)ij +
ε
ijKeterangan :
Yij = nilai pengamatan pada perlakuan ke-i kelompok ke-j µ = pengaruh rata-rata umum
Ai = pengaruh jenis sampel taraf ke-i Bi = pengaruh jenis pelarut taraf ke-j
(AB)ij = pengaruh kombinasi jenis sampel dan jenis pelarut
ε
ij = pengaruh galat percobaan pada perlakuan ke –i kelompok ke-j17
IV. HASIL DAN PEMBAHASAN
A.
PERSIAPAN SAMPEL DAN EKSTRAKSI
Penelitian tentang umbi bawang dayak ini dilakukan tidak hanya dalam bentuk umbi segarnya (Gambar 2) yang mengandung berbagai macam komponen bioaktif, akan tetapi juga dilakukan pada bentuk olahannya berupa simplisia (Gambar 3) dan keripik (Gambar 4). Simplisia adalah bahan alami dari tanaman yang telah dikeringkan. Keripik dijadikan sebagai salah satu pengolahan bawang dayak untuk mendapatkan pangan fungsional yang memiliki kandungan senyawa antioksidan yang baik. Pengolahan simplisia dan keripik dikeringkan menggunakan oven dengan perbedaan suhu dan waktu, dimana simplisia membutuhkan waktu selama 6 jam pada suhu 500C sedangkan keripik membutuhkan waktu 4 jam pada suhu 700C.
Ekstraksi merupakan proses penarikan komponen atau zat aktif dari suatu campuran padatan atau cairan dengan menggunakan pelarut tertentu. Kontak antara pelarut dan bahan secara intensif, menyebabkan komponen aktif pada campuran akan berpindah ke dalam pelarut (Gamse 2002). Proses ekstraksi pada penelitian ini menggunakan teknik maserasi, yaitu merendam sampel yang akan diekstrak dengan pelarutnya. Lama waktu ekstraksi adalah 24 jam pada suhu 370C yang disimpan dalam shaker. Maserasi merupakan metode yang cukup sederhana karena tidak memerlukan pemanasan sehingga dapat mencegah rusaknya kandungan senyawa metabolit sekunder yang tidak tahan terhadap suhu tinggi.
Pemilihan pelarut merupakan salah satu faktor yang dapat menentukan kesempurnaan proses ekstraksi. Pelarut yang digunakan pada proses ekstraksi harus dapat menarik komponen aktif dari campuran dalam sampel. Faktor-faktor yang harus diperhatikan dalam memilih pelarut di antarnya selektivitas, kemampuan pelarut untuk mengekstraksi, tidak bersifat racun, mudah diuapkan dan relatif murah (Gamse 2002). Pelarut yang digunakan dalam proses ekstraksi dapat menembus pori-pori bahan padat sehingga bahan yang ingin diekstrak dapat dengan mudah tertarik.
Pada penelitian ini digunakan lima jenis pelarut yang berbeda berdasarakan tingkat kepolarannya, yaitu heksan (nonpolar), etilasetat (semipolar), metanol (polar), etanol (polar) serta air (polar). Pemilihan ke lima jenis pelarut ini bertujuan untuk mengetahui polaritas senyawa bioaktif dari bawang dayak. Prinsip dari proses ekstraksi adalah like dissolves like, artinya suatu pelarut akan mengisolasi komponen yang memiliki sifat yang sama dengan pelarutnya. Oleh karena itu, pelarut nonpolar akan mengekstrak komponen yang bersifat nonpolar , dan bahan yang bersifat polar akan diekstrak oleh pelarut yang bersifat polar.
Proses ekstraksi dilakukan selama tiga kali untuk masing-masing bahan. Hal ini dilakukan untuk mendapatkan senyawa bioaktif yang lebih maksimal. Penghilangan pelarut dilakukan dengan menggunakan rotary evaporator pada suhu 400C, kemudian dipekatkan dengan gas nitrogen (N2). Hasil dari pemekatan ini ditimbang kemudian dihitung
perbandingan berat ekstrak dengan berat awal sampel yang diekstrak, sehingga diperoleh nilai rendemen ekstraknya.
Proses pemekatan hasil ekstraksi untuk sampel yang diekstrak dengan pelarut air dilakukan dengan cara yang berbeda dengan pelarut-pelarut lainnya. Proses pemekatannya tidak menggunakan rotary evaporator dan gas N2, akan tetapi proses pemekatannya
18 namun dengan waktu yang lebih singkat tidak mengurangi keaktifan dari senyawa bioaktif yang terkandung di dalam ekstrak air umbi bawang dayak segar, ekstrak air simplisia dan ekstrak air keripik.
Gambar 2. Umbi Bawang Dayak Segar
Gambar 3. Simplisia Bawang Dayak
Gambar 4. Keripik Bawang Dayak
B.
RENDEMEN
EKSTRAK
UMBI
BAWANG
DAYAK
SEGAR,
SIMPLISIA DAN KERIPIK
19 Hasil perhitungan menunjukkan bahwa rendemen terendah untuk ekstrak umbi bawang dayak segar, ekstrak simplisia dan ekstrak keripik berasal dari ekstrak hasil maserasi dengan pelarut heksan, sedangkan rendemen tertinggi terdapat pada sampel yang diekstrak oleh pelarut air. Perbedaan nilai rendemen ini disebabkan oleh perbedaan jenis pelarut yang digunakan. Pelarut yang berbeda akan melarutkan senyawa-senyawa yang berbeda tergantung tingkat kepolarannya. Senyawa yang bersifat polar akan larut dalam pelarut yang bersifat polar, sedangkan senyawa yang bersifat nonpolar akan larut dalam pelarut yang bersifat nonpolar. Hal ini sesuai dengan konsep like dissolve like dimana zat akan terlarut dan terekstrak dengan baik apabila pelarut yang digunakan memiliki tingkat kepolaran yang sama. Oleh sebab itu, jumlah ekstrak yang dihasilkan dari suatu bahan, tergantung jenis pelarut yang digunakan.
Tabel 2. Rendemen Ekstrak Umbi Bawang Dayak Segar, Simplisia dan Keripik Jenis Pelarut Rendemen Ekstrak (g/100gram)
Bawang dayak segar Simplisia keripik
Heksan 0.78 1.58 1.29
Etilasetat 1.81 4.50 2.98
Etanol 9.08 3.73 4.00
Metanol 5.89 6.58 6.58
Air 30.29 16.26 26.24
.
Selain itu, berdasarkan hasil perhitungan rendemennya, komponen polar yang terdapat pada umbi bawang dayak segar, simplisia dan keripik jumlahnya cukup tinggi, sedangkan komponen nonpolarnya sangat rendah. Tingginya nilai rendemen bawang dayak segar dengan pelarut etanol dibandingkan dengan rendemen simplisia dan keripik yang sama-sama diekstrak dengan pelarut etanol dikarenakan adanya makromolekul lain seperti gula sederhana (monosakarida) dan oligosakarida yang dapat terekstrak oleh pelarut etanol pada umbi bawang dayak segar. Kandungan karbohidrat monosakarida dan oligosakarida yang terdapat pada umbi bawang dayak segar jumlahnya lebih banyak dibandingkan dengan simplisia dan keripik.
Pelarut air pada umbi bawang dayak segar, simplisia dan keripik menghasilkan nilai rendemen paling tinggi dibandingkan dengan pelarut heksan, etilasetat, etanol dan metanol. Apabila dihitung dari berat solid yang diekstrak, maka simplisia dan keripik memiliki nilai berat solid yang lebih besar dibandingkan dengan berat solid umbi bawang dayak segar. Akan tetapi, nilai rendemen umbi bawang dayak segar dengan pelarut air jauh lebih tinggi dibandingkan dengan simplisia dan keripik yang diekstrak dengan pelarut air. Hal ini disebabkan karena pada saat penyaringan dengan menggunakan kertas saring, filtrat ekstrak simplisia dan keripik. tidak turun secara sempurna pada kertas saring dan cenderung tertahan oleh serbuk-serbuk simplisia dan keripik. Pada saat proses ekstraksi, umbi bawang dayak segar diekstrak dalam bentuk hancuran kecil dan bukan dalam bentuk serbuk seperti pada simplisia dan keripik.
20 banyak. Oleh karena itu, pengujian tentang kapasitas antioksidan, total fenol , kadar vitamin C dan senyawa bioaktif yang bersifat antioksidan akan dievaluasi dengan melakukan uji fitokimia secara kualitatif.
C.
ANALISIS
PROKSIMAT
UMBI
BAWANG
DAYAK SEGAR,
SIMPLISIA DAN KERIPIK
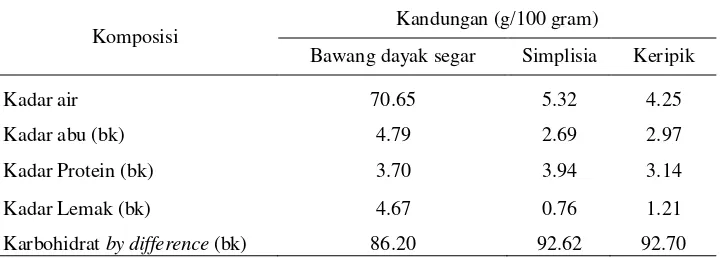
[image:34.595.161.522.236.365.2]Pengujian kadar air, abu, lemak, protein dan karbohidrat dilakukan terhadap umbi bawang dayak segar, simplisia dan keripik. Tabel 3 menunjukan hasil analisis proksimat umbi bawang dayak segar, simplisia dan keripik.
Tabel 3. Proksimat Umbi Bawang Dayak Segar, Simplisia dan Keripik
Komposisi Kandungan (g/100 gram)
Bawang dayak segar Simplisia Keripik
Kadar air 70.65 5.32 4.25
Kadar abu (bk) 4.79 2.69 2.97
Kadar Protein (bk) 3.70 3.94 3.14
Kadar Lemak (bk) 4.67 0.76 1.21
Karbohidrat by difference (bk) 86.20 92.62 92.70 Nilai kadar air dari umbi bawang dayak segar lebih tinggi daripada simplisia dan keripik. Pengeringan umbi bawang dayak segar menjadi keripik dan simplisia akan menurunkan nilai dari kadar airnya. Hal ini dikarenakan sebagian air akan menguap saat pengeringan menggunakan oven. Nilai kadar air simplisia dengan keripik memberikan hasil yang tidak terlalu berbeda walaupun penggunaan suhu pengolahannya berbeda. Waktu pengeringan pada keripik lebih cepat yaitu selama 4 jam pada suhu 700C dibandingkan dengan simplisia yaitu 6 jam pada suhu 500C.
Karbohidrat dan protein pada tanaman sangatlah penting karena memberikan nilai gizi. Nilai kadar protein untuk masing-masing sampel hampir sama walaupun terdapat perbedaan pengolahan. Hal ini berarti bahwa protein yang terdapat dalam umbi bawang dayak tidak rusak oleh adanya pemanasan. Tingginya nilai karbohidrat untuk semua sampel dikarenakan tanaman bawang dayak menyimpan glukosa sebagai sumber energi.
Nilai kadar abu umbi bawang dayak segar lebih tinggi dibandingkan dengan simplisia dan keripik. Rendahnya nilai kadar abu pada bawang dayak setelah pengeringan dikarenakan beberapa mineral hilang selama proses pengeringan dengan oven. Selain kadar abu yang menurun selama proses pengeringan, nilai kadar lemak untuk simplisia dan keripik juga mengalami penurunan. Data dan hasil perhitungan analisis proksimat umbi bawang dayak segar, simplsia dan keripik tercantum pada Lampiran 1-3.
D.
KARAKTERISTIK FISIK HASIL EKSTRAKSI UMBI BAWANG
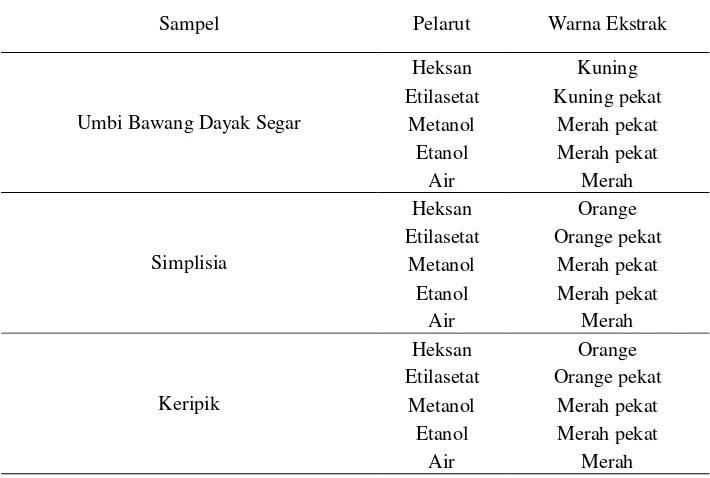
DAYAK SEGAR, SIMPLISIA DAN KERIPIK
21 Senyawa karotenoid adalah kelompok pigmen dan antioksidan alami yang dapat meredam radikal bebas, yang menyebabkan warna kuning orange dan merah pada tanaman (Panjaitan et al. 2003). Karotenoid seperti betakaroten merupakan prekursor vitamin A dan berfungsi sebagai antioksidan alami.
Tabel 4. Karakteristik Fisik Warna Ekstraksi Umbi Bawang Dayak Segar, Simplisia dan Keripik
Sampel Pelarut Warna Ekstrak
Umbi Bawang Dayak Segar
Heksan Kuning
Etilasetat Kuning pekat Metanol Merah pekat
Etanol Merah pekat
Air Merah
Simplisia
Heksan Orange
Etilasetat Orange pekat Metanol Merah pekat Etanol Merah pekat
Air Merah
Keripik
Heksan Orange
Etilasetat Orange pekat Metanol Merah pekat Etanol Merah pekat
Air Merah
Warna merah yang dihasilkan oleh pelarut polar (metanol, etanol dan air) diduga disebabkan adanya senyawa antosianin pada umbi bawang dayak segar, simplisia dan keripik. Warna merah yang dihasilkan dari proses ekstraksi menggunakan pelarut polar dapat mengindikasikan adanya aktivitas antioksidan yang tinggi karena mengandung senyawa antosianin (Einbond et al. 2004). Antosianin adalah pigmen alami yang tersebar secara luas di alam. Senyawa antosianin merupakan subkelas dari flavonoid dan memberikan warna merah, ungu dan biru pada banyak bunga, buah-buahan dan sayuran. Stabilitas warna dari antosianin sangat dipengaruhi oleh pH, jenis pelarut, temperatur, oksigen, cahaya dan enzim (Rein 2005).
22 Gambar 5. Ekstrak Umbi Bawang Dayak Segar
Gambar 6. Ekstrak Simplisia Umbi Bawang Dayak
Gambar 7. Ekstrak Keripik Umbi Bawang Dayak
E.
KAPASITAS ANTIOKSIDAN UMBI BAWANG DAYAK SEGAR,
SIMPLISIA DAN KERIPIK METODE DPPH
Pengujian kapasitas antioksidan umbi bawang dayak segar, simplisia dan keripik dilakukan terhadap hasil ekstrak dari ke lima jenis pelarut yaitu heksan, etilasetat, etanol, metanol dan air. Masing-masing ekstrak diuji aktivitas antioksidannya berdasarkan kemampuannya meredam radikal bebas DPPH. Pada prinsipnya, atom hidrogen dari suatu senyawa antioksidan akan membuat larutan DPPH menjadi tidak berwarna yang dapat diukur menggunakan spektrofotometer akibat terbentuknya DPPH tereduksi (DPPH-H) (Sharma dan Bhat 2009).
Metode DPPH mengukur kemampuan suatu senyawa antioksidan dalam menangkap radikal bebas. Kemampuan penangkapan radikal berhubungan dengan kemampuan
Heksan
Etilasetat
Metanol
Etanol
Air
Heksan
Heksan
Etilasetat Etilasetat
Air
Air Metanol
Metanol
Etanol
[image:36.595.202.433.413.546.2]23 komponen senyawa antioksidan dalam menyumbangkan elektron atau hidrogen. Setiap molekul yang dapat menyumbangkan elektron atau hidrogen akan bereaksi dan akan memudarkan warna DPPH. Intensitas warna DPPH akan berubah dari ungu menjadi kuning oleh elektron yang berasal dari senyawa antioksidan. Perubahan warna tersebut disebabkan oleh reaksi antara radikal bebas DPPH dengan satu atom hidrogen yang dilepaskan senyawa yang terkandung dalam bahan uji untuk membentuk senyawa 1,1-diphenil-2-pikrilhidrazin
(DPPH-H) yang berwarna kuning. Pada metode ini, absorbansi yang diukur adalah absorbansi larutan DPPH sisa yang tidak bereaksi dengan senyawa antioksidan.
[image:37.595.182.491.396.624.2]Hasil analisis kapasi