AMPLIFIKASI GEN Pup1 DAN UJI MORFOLOGI PERAKARAN TANAMAN PADI PADA KONDISI DEFISIENSI FOSFOR
TUHFAH AMALIAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Amplifikasi gen Pup1 dan Uji Morfologi Perakaran Tanaman Padi Pada Kondisi Defisiensi Fosfor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
TUHFAH AMALIAH. Amplifikasi Gen Pup1 dan Uji Morfologi Tanaman Padi Pada Kondisi Defisiensi Fosfor. Dibimbing oleh SURYANI dan JOKO PRASETIYONO.
Kondisi lahan Indonesia yang sekitar 25% mengalami defisiensi fosfor membuat tanaman padi di Indonesia mengalami defisiensi P. Pemetaan gen yang terpaut dengan defisiensi P terdapat pada kromosom 12 pada tanaman padi yaitu gen Pup1. Pada penelitian ini telah dilakukan amplifikasi gen Pup1 pada galur padi BC2F6 hasil persilangan antara Batur dan Situ Bagendit dengan Kasalath dan
NIL. Serta dilakukan uji morfologi perakaran untuk melihat keefektifan hasil persilangan. Hasil uji morfologi perakaran dilakukan dengan menggunakan larutan Yoshida dengan 4 perlakuan berbeda (0.5 P, 10 P, 0.5 P+45 ppm Al dan 10 P+ 45 ppm Al). Hasilnya diuji dengan uji ANOVA dan uji Dunnet. Berdasarkan hasil analisis molekuler dengan menggunakan primer K29-1 menunjukkan keseluruhan tanaman hasil persilangan memiliki kemiripan dengan tetua Kasalath dan NIL-C443 sebagai donor Pup1. Hasil uji ANOVA dan uji Dunnet menunjukkan adanya perbedaan morfologi akar antara tanaman hasil persilangan dengan tetua tidak toleran defisiensi P yakni Batur dan Situ Bagendit. Kata kunci: Kasalath, NIL-C443, defisiensi fosfor, gen Pup1, morfologi perakaran
ABSTRACT
TUHFAH AMALIAH. Amplification Pup1 and Test Root Morphology of Rice With Alumunium Stress. Supervised by SURYANI and JOKO PRASETIYONO.
About 25% of Indonesia's land conditions has phosphorus deficiency. Its makes rice plants in Indonesia deficient of phosphorus. Genes mapping are adrift with P deficiency on chromosome 12 at the gene Pup1 rice. This research has been conducted on gene amplification of BC2F6 Pup1 on rice lines from backcross
between Batur and Situ Bagendit with Kasalath and NIL-C443. The root morphology has been done observe the effectiveness of the cross. Root morphology test results by using a solution of Yoshida with 4 different treatment (0.5 P, 10 P, 0.5 P+45 ppm Al. dan 10 P+ 45 ppm Al). The results are tested by ANOVA test and Dunnet test. Based on the results of molecular analysis using primers K29-1 shows the overall results of crossbreeding plants have similarities with elders Kasalath and NIL-C443 as Pup1 donor. The ANOVA test and Dunnet’s results indicate the presence of root morphological differences between plants from crosses with P deficiency intolerant inheritence, Batur and Situ Bagendit.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AMPLIFIKASI GEN Pup1 DAN UJI MORFOLOGI PERAKARAN TANAMAN PADI PADA KONDISI DEFISENSI FOSFOR
TUHFAH AMALIAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Amplifikasi Gen Pup1 dan Uji Morfologi Perakaran Tanaman Padi Pada Kondisi Defisiensi Fosfor
Nama : Tuhfah Amaliah NIM : G84090066
Disetujui oleh
Dr. Suryani, S.P,M.Sc Pembimbing I
Dr. Joko Prasetiyono, M.Si Pembimbing II
Diketahui oleh
Dr. Ir. I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan menyusun karya ilmiah ini, serta shalawat dan salam semoga tercurahkan pada Rasulullah SAW. Ucapan terima kasih penulis sampaikan kepada Dr. Suryani S.P.,M.Sc dan Dr. Joko Prasetiyono M.Si, selaku ketua dan anggota pembimbing skripsi yang telah dilaksanakan di laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Cimanggu-Bogor. Penulis juga menyampaikan terima kasih kepada orang tua, keluarga atas segala doa, kasih sayang, dan motivasinya. Serta kepada Kiki, Vita, Hilda, Sisca, Siska, dan teman-teman Biokimia 46 yang senantiasa memberikan bimbingan, doa, dan bantuannya sehingga penelitian ini dapat diselesaikan dengan baik.
Penulis menyadari masih banyak kekurangan dalam karya ilmiah ini. Semoga karya ilmiah ini dapat bermanfaat bagi pengembangan ilmu pengetahuan khususnya bidang biokimia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
METODE 2
Waktu dan Tempat Penelitian 2
Bahan 2
Alat 3
Prosedur Analisis Data 3
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 10
SIMPULAN DAN SARAN 11
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
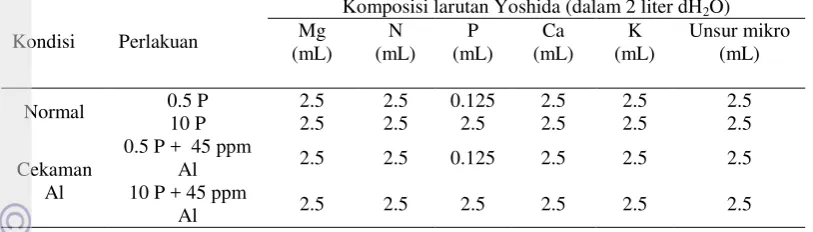
1. Komposisi larutan Yoshida 5
2. Hasil spektrofotometer DNA hasil isolasi 6
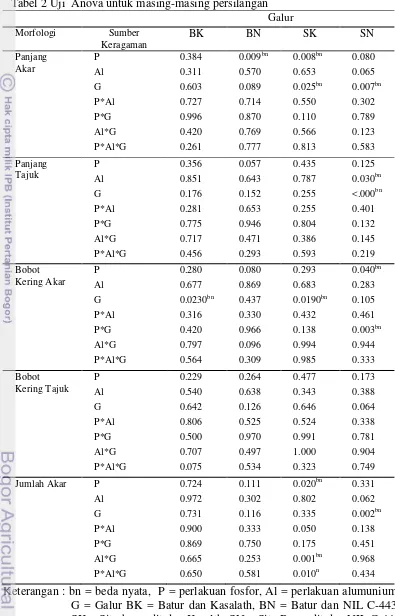
3. Hasil uji Anova terhadap masing-masing persilangan 9
DAFTAR GAMBAR
1. Elektroforegram beberapa DNA templat hasil isolasi DNA 6 2. Elektroforegram PAGE 8% persilangan NIL C-443 dan Batur 63. Elektroforegram PAGE 8% persilangan Kasalath dan Batur 7
DAFTAR LAMPIRAN
1. Komposisi larutan yang digunakan dalam penelitian 152. Elektroforegam persilangan Situ Bagendit dan Kasalath dan NIL-C443 16
3. Hasil uji Dunnet hasil persilangan Batur dengan Kasalath 17
4. Hasil uji Dunnet hasil persilangan Batur dengan NIL-C443 18
5. Hasil uji Dunnet hasil persilangan Situ Bagendit dengan Kasalath 19
PENDAHULUAN
Beras merupakan komoditas pangan yang sangat strategis karena merupakan makanan pokok utama bagi masyarakat. Konsumsi beras per kapita per tahun pada tahun 2010 adalah sebesar 139,15 Kg dan tahun 2014 akan mencapai angka 33.013.214 ton. Untuk itu diperlukan upaya khusus dalam peningkatan produktivitas dan perluasan areal tanam maupun perluasan baku lahan (BPS 2008). Indonesia memiliki luas daratan sekitar 191.093.132 ha (BPS 2008) dan sekitar 25% dari keseluruhan daratannya didominasi oleh tanah ultisol (Subagyo et al. 2004 dalam Prasetyo dan Suriadikarta 2006). Umumnya tanah ini mempunyai potensi keracunan Alumunium (Al) dan miskin kandungan bahan organik (Prasetyo dan Suriadikarta 2006). Al pada tanah ultisol ini akan mengikat fosfor pada tanah sehingga sulit untuk diserap oleh tanaman.
Fosfor (P) sendiri ditemukan pada tanaman sebagai pembentuk asam nukleat, fosfolipid, koenzim NAD dan NADP dan yang paling penting sebagai konstituen pembentuk ATP. Unsur P diambil tanaman dalam bentuk ion ortofosfat primer dan sekunder (H2PO4-atau HPO42-) (Chesworth et al. 1998). Tanaman yang
mengalami defiensi P daunnya tidak akan tumbuh baik dan akan ditemukan pigmentasi antosianin berwarna ungu atau merah. Selain itu pertumbuhan tanaman akan terhambat dan mengurangi pertumbuhan biji dan mengurangi jumlah anakan (pada tanaman padi) (Chesworth et al. 1998).
Pup1 (P uptake1) merupakan gen yang mengendalikan pengambilan P dari tanah dengan cara mengatur perpanjangan akar pada tanaman. Selain Pup1 ditemukan juga gen-gen lain yang mengatur transportasi P, penyimpanan P, dan efisiensi penggunaan P (Ismail et al. 2007). Masing-masing mekanisme tersebut melibatkan banyak gen. Kerja gen-gen tersebut dipengaruhi oleh gen-gen lainnya. Seperti gen yang mengatur cekaman terhadap alumunium, besi, dan keracunan garam.
Penelitian yang mengeksplorasi keberadaan gen-gen yang mengatur toleransi terhadap defisiensi P sudah dimulai pada satu dekade terakhir. Menurut Wissuwa et al (1998) marka yang terpaut dengan sifat defisiensi P pada persilangan Nipponbare (sensitif) dan Kasalath (toleran) diperoleh dengan menggunakan marka RFLP (Restriction Fragment Length Polymorphism). Ni et al (1998), Wissuwa et al (2001, 2002) melanjutkan studi toleransi terhadap defisiensi P dengan mempersempit posisi Pup1 pada kromosom 12.
2
Ketika disilangkan dengan tanaman padi yang tidak toleran defisiensi P (Nipponbare), hasilnya memberikan peningkatan penangkapan P (P-uptake) sebesar 170% dan peningkatan hasil jumlah bulir sebesar 250% pada kondisi kurang P dengan memanfaatkan sifat toleran defisiensi P dari Kasalath tersebut (Wissuwa dan Ae 2000).
Penelitian ini selain bertujuan untuk melihat keberadaan gen Pup1 pada tanaman padi juga untuk melihat keefektifan keberadaan gen ini pada tanaman padi hasil persilangan antara Batur dengan Kasalath, Batur dengan NIL-C443, Situ Bagendit dengan Kasalath, dan Situ Bagendit dengan NIL-C443 generasi BC2F6 dengan melihat morfologi perakarannya. Keberadaan gen Pup1 diketahui
dengan menggunakan marka mikrosatelit. Marka mikrosatelit atau dikenal dengan nama simple sequence repeat/SSR mempunyai derajat polimorfisme yang tinggi (Highly polymophic). Selain itu SSR dapat digunakan untuk mempelajari genotip individu, dengan mendeteksi suatu segmen DNA yang mengandung pola perulangan sederhana dari basa nitrogen (Mullis dan Faloona 1987). Sehingga dapat digunakan untuk menentukan keberadaan Pup1 pada tanaman padi. Morfologi akar dilihat dengan memberikan perlakuan cekaman alumunium pada tanaman padi tersebut. Manfaat penelitian ini adalah untuk mempermudah melihat keberadaan gen Pup1 pada tanaman padi. Uji morfologi perakaran dapat digunakan sebagai salah satu indikator ekspresi gen Pup1 secara fenotip.
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Februari hingga Juni 2013. Bertempat di laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Jalan Tentara Pelajar No.3A, Bogor.
Bahan
3 Alat
Alat-alat yang digunakan adalah penangas air, inkubator, pipet mikro, oven, microfuge Beckman, neraca analitik, autoklaf, vorteks, perangkat elektroforesis, ice maker, kertas aluminium, bak tumbuh padi, infraboard, kertas saring, alat-alat gelas, plate PCR, mesin pendingin dan mesin PCR PTC-100.
Prosedur Analisis Data
Isolasi DNA Padi (Dellaporta et al. 1983)
Isolasi diawali dengan pengambilan sampel daun padi yang masih muda. Pengambilan daun padi dilakukan dengan memotong bagian daun padi. Selanjutnya daun yang telah dipotong dimasukkan ke dalam tabung Eppendorf yang telah diberi label berdasarkan nomor pada pot. Tabung Eppendorf yang telah berisi daun disimpan di dalam freezer untuk selanjutnya dibekukan dengan nitrogen cair.
Selanjutnya daun padi digerus dan ditambahkan 750 µL bufer ekstraksi. Bufer ekstraksi terdiri atas 100 mL Tris-HCl (pH 8), 100 mL NaCl, 100 mL EDTA (pH 8,0), SDS 12,5 g dan ditambahkan akuades (dH2O) hingga volume
akhir mencapai 1000 mL. Setelah itu dipanaskan di dalam water bath selama 20 menit dengan suhu 650C.
Campuran kloroform : isoamilalkohol sebanyak 750 µL dengan perbandingan 24:1 v/v ditambahkan setelah inkubasi 20 menit. Tabung Eppendorf selanjutnya dikocok hingga homogen dan dilakukan sentrifus dengan kecepatan 12.000 rpm selama 15 menit. Lapisan atas dipipet dengan hati-hati dan dipindahkan kedalam tabung Eppendorf yang baru dan ditambahkan etanol absolut sebanyak 750 µL. Selanjutnya diinkubasi dalam freezer selama 1 jam. Larutan DNA dan etanol absolut yang telah diinkubasi selanjutnya disentrifus selama 15 menit 12.000 rpm. Hasil sentrifus berupa pelet dicuci dengan etanol 70% sebanyak 750 µL dan disentrifus kembali dengan kecepatan 12.000 rpm selama 10 menit. Supernatan dibuang dan tabung yang berisi pelet dikeringkan selama 1 hari. Pelet yang telah kering dilarutkan dengan 50 µL air ultrapure untuk selanjutnya dianalisis.
Analisis Kualitatif dan Kuantitatif DNA Padi (Sambrook et al. 2001)
Kualitas DNA padi diuji dengan menggunakan teknik elektroforesis gel agarosa 1%. Agarosa 1% dibuat dengan menambahkan 1 gram agarosa dengan 100 ml 10 x TBE dan dipanaskan dalam microwave sampai agarosa larut. Selanjutnya larutan agarosa dituang dalam cetakan sampai mengeras. Sebanyak 3µL DNA padi hasil isolasi ditambahkan dengan loading dye sebanyak 5µL. Kemudian dimasukkan ke dalam sumur gel agarosa. Elektroforesis dilakukan selama 1 jam dengan menggunakan bufer 0.5 x TBE. Deteksi pita DNA dengan merendam agarosa selama 10 menit dalam EtBr dan direndam air selama 10 menit. Selanjutnya hasil isolasi DNA dilihat dengan menggunakan mesin ChemiDoc.
4
Amplifikasi gen Pup1 dengan PCR
Amplifikasi gen Pup1 dengan menggunakan primer SSR yaitu primer K29-1. Sampel DNA yang diamplifikasi sebanyak 98 buah yaitu DNA hasil persilangan Batur x Kasalath (BK), Batur x NIL-C443 (BN). Situ Bagendit x Kasalath (SK), dan Situ bagendit x NIL-C443 (SN), Campuran reaksi PCR (untuk 1 x reaksi) terdiri atas 10 x bufer PCR dengan MgCl sebanyak 2 µL, dNTPs sebanyak 2 µL, GC Rich sebanyak 1 µl, ddH2O sebanyak 9 µL, dan Taq
polimerase sebanyak 1 µL. Ke dalam plate PCR dimasukkan 3 µL DNA template dan 2 µL primer. Reaksi amplifikasi dilakukan dengan mesin PCR. Tahapan pada program tersebut diawali dengan denaturasi dengan suhu 94oC selama 5 menit.. Tahap pertama pada suhu 94oC selama 1 menit. Tahap kedua berlangsung selama 1 menit dengan suhu 55oC. Tahap terakhir dengan suhu 72oC selama 2 menit. Tahap selanjutnya adalah ekstensi akhir. Tahap ini berlangsung selama 7 menit dengan suhu 72oC. Hasil PCR ini disimpan dalam suhu 40C sampai siap digunakan untuk elektroforesis.
Elektroforesis Hasil Ampilifikasi Gen Pup1 (Sambrook et al. 2001)
Elektroforesis dilakukan dengan menggunakan Poliakrilamid Gel Elektroforesis (PAGE). Gel dibuat dari 60 mL larutan PAGE 8%, 600 µL APS berguna untuk penentuan ukuran DNA. Untuk mendeteksi gen Pup1 dilakukan pewarnaan dengan pewarna perak.
Pewarnaan dilakukan dengan merendam gel yang telah dilepas dari kaca dengan larutan perak yang terdiri atas 0.4 g Perak Nitrat dalam 300 mL ddH2O
selama 8 menit. Selanjutnya gel direndam dalam larutan NaOH dan formaldehid (4 gr NaOH dalam 300 mL ddH2O ditambahkan 2 mL formaldehid). Perendaman
dilakukan sampai pita pada gel dapat diamati.
Uji Morfologi Perakaran Dengan Cekaman Alumunium (Yoshida et al. 1976) Tanaman padi hasil persilangan yaitu BC2F6, yang diuji dikecambahkan
5 Tabel 1. Komposisi larutan Yoshida
Kondisi Perlakuan
Komposisi larutan Yoshida (dalam 2 liter dH2O)
Mg
Analisis hasil pengamatan dilakukan dengan menggunakan rancangan acak lengkap. Data yang diperoleh berasal dari 3 kali ulangan dan 4 perlakuan, yaitu kondisi normal 0.5 P dan 10 P serta kondisi cekaman Al 0.5 + 45 ppm Al dan 10 P + 45 ppm Al, maka unit percobaan akan ada sebanyak 12 unit percobaan. Bentuk model linear dapat dituliskan sebagai berikut :
Yij= µ + τi+ εij digunakan untuk melihat dalam perlakuan yang diberikan terdapat perbedaan atau tidak. Sedangkan untuk uji lanjutan dilakukan uji Dunnet. Uji Dunnet biasa dilakukan untuk membandingkan antara sampel dengan kontrol.
HASIL DAN PEMBAHASAN
Hasil
Hasil Isolasi DNA Padi
Hasil isolasi DNA padi persilangan diuji keberadaannya dengan menggunakan agarosa 1% dan divisualisasikan dengan menggunakan EtBr. Hasil analisis kualitatif DNA padi hasil persilangan terlihat pada Gambar 1. DNA padi pada gambar merupakan padi persilangan antara Batur dan NIL-C443 (BN). Smear terlihat pada sumur 1-16, sedangkan pada sumur 2 tidak terdapat smear.
6
Gambar 1 Elektroforegram beberapa DNA daun padi persilangan Batur dan NIL C-443 hasil isolasi (lajur 1-16 ).
Tabel 2 Konsentrasi DNA hasil isolasi
Sampel 260 280 260μ 280 Konsentrasi ( g/mL)
BN1 0.164 0.155 1.032 801.327
BN3 0.088 0.044 1.981 438.114
BN4 0.065 0.051 1.266 324.133
BN5 0.075 0.053 1.419 373.002
BN6 0.041 0.036 1.140 203.159
BN7 0.151 0.083 1.821 753.192
BN8 0.026 0.023 1.151 129.542
BN14 0.116 0.081 1.421 578.354
BN15 0.059 0.039 1.534 298.548
BN16 0.026 0.024 1.054 128.603
Amplifikasi Gen Pup1
Amplifikasi gen Pup1 dilakukan untuk mengkonfirmasi keberadaan gen Pup1 pada DNA padi hasil persilangan. Hasil amplifikasi kemudian diseparasi dengan teknik elektroforesis vertikal dengan menggunakan gel poliakrilamid 8%. Hasil elektroforesis diwarnai dengan menggunakan pewarna nitrat perak (Gambar 2 dan 3).
Gambar 2 Elektroforegam persilangan NIL-C443 dan Batur. Marker: DNA 100 bp, lajur 1 (BT) padi Batur; lajur 2 (kas): padi Kasalath; lajur 3 (NIL) padi NIL C-443, lajur 4 (NIP) padi Nipponbare; lajur 5-28 (1-23) padi persilangan NIL-C443 dan Batur.
Gen
7
Gambar 3 Elektroforegam persilangan NIL-C443 dan Batur. Marker: DNA 100 bp, lajur 1 (BT) padi Batur; lajur 2 (kas): padi Kasalath; lajur 3 (NIL) padi NIL C-443, lajur 4 (NIP) padi Nipponbare; lajur 5-27 (1-22) padi persilangan Kasalath dan Batur.
Hasil amplifikasi gen Pup1 pada persilangan Batur dengan NIL-C443 (BN) disajikan pada Gambar 2. Hasil amplifikasi menunjukkan bahwa keseluruhan sampel mengikuti tetua Kasalath. Pita pada sampel (BN) sebanyak 23 pita menunjukkan kesamaan dengan pita pada padi Kasalath. Hal yang sama ditunjukkan oleh hasil persilangan Batur dengan Kasalath (BK). Keseluruhan sampel menunjukkan kemiripan dengan padi Kasalath.
Morfologi perakaran tanaman padi hasil persilangan dengan cekaman Alumunium
Pengamatan terhadap morfologi perakaran tanaman padi hasil persilangan dilakukan untuk melihat keefektifan persilangan. Masing-masing padi hasil persilangan diberi perlakuan dengan kondisi yang sama. Tanaman padi ditumbuhkan dalam bak berisi larutan Yoshida dengan konsentrasi yang berbeda-beda, yaitu 0.5 P, 10 P, 0.5 P+45 ppm Al. dan 10 P+45 ppm Al. Tetua yang digunakan sebagai pembanding adalah tetua yang tidak toleran terhadap defisiensi P, yaitu Batur dan Situ Bagendit. Perbedaan nyata terlihat pada tabel jika nilai uji F < 0.005, sedangkan bila nilai uji F >0.005 sampel dikatakan tidak berbeda nyata. Perbedaan dilihat dengan membandingkan antara masing-masing galur hasil persilangan dalam satu perlakuan dan masing-masing galur hasil persilangan dengan perlakuan yang berbeda.
Hasil Uji F terhadap hasil persilangan Batur dengan Kasalath berdasarkan panjang akar tidak berbeda nyata (Tabel 2). Begitu pula berdasarkan panjang tajuk dan jumlah akar. Hal berbeda ditunjukkan pada bobot kering akar dan bobot kering tajuk. Hasil uji F menunjukkan bahwa pada bobot kering akar, terdapat perbedaan nyata antara masing-masing galur (0.023). Selain itu dilakukan uji lanjutan yaitu uji Dunnet. Hasil uji Dunnet untuk persilangan Batur dengan Kasalath dilampirkan pada Lampiran 3. Uji Dunnet dilakukan dengan membandingkan antara galur hasil persilangan dengan tetua Batur. Hasil uji Dunnet menunjukkan perbedaan nyata terlihat pada galur BK nomor 10 dengan nilai uji Dunnet 23.361 berdasarkan bobot kering akar.
Gen
8
Sedangkan pada persilangan Batur dengan NIL-C443 (BN). Berbeda dengan persilangan Batur dengan Kasalath, perbedaan nyata terlihat pada panjang akar. Perbedaan nyata terlihat pada sumber keragaman dengan perlakuan dengan fosfor (P) dengan nilai F sebesar 0.009 pada panjang akar. Hasil uji Dunnet pada persilangan Batur dengan NIL-C443 (Lampiran 4) menunjukkan adanya perbedaan nyata pada panjang akar antara tetua Batur dengan BN nomor 7 (10.884) dan BN nomor 18 (11.654). Sedangkan pada persilangan Batur dengan NIL-C443 (BN). Berbeda dengan persilangan Batur dengan Kasalath, perbedaan nyata terlihat pada panjang akar. Perbedaan nyata terlihat pada sumber keragaman dengan perlakuan dengan fosfor (P) dengan nilai F sebesar 0.009 pada panjang akar. Hasil uji Dunnet pada persilangan Batur dengan NIL-C443 (Lampiran 4) menunjukkan adanya perbedaan nyata pada panjang akar antara tetua Batur dengan BN nomor 7 (10.884) dan BN nomor 18 (11.654).
Sedangkan pada persilangan Batur dengan NIL-C443 (BN). Berbeda dengan persilangan Batur dengan Kasalath, perbedaan nyata terlihat pada panjang akar. Perbedaan nyata terlihat pada sumber keragaman dengan perlakuan dengan fosfor (P) dengan nilai F sebesar 0.009 pada panjang akar. Hasil uji Dunnet pada persilangan Batur dengan NIL-C443 (Lampiran 4) menunjukkan adanya perbedaan nyata pada panjang akar antara tetua Batur dengan BN nomor 7 (10.884) dan BN nomor 18 (11.654).
Uji Anova di Tabel 2 juga menunjukkan hasil pengamatan pada persilangan Situ Bagendit dengan Kasalath (SK). Didalam uji ini terlihat perbedaan nyata terlihat pada panjang akar dengan sumber keragaman perlakuan P dan dengan sumber keragaman perbandingan anatara perlakuan fosfor dengan perlakuan cekaman alumunium. Perbedaan nyata lain terlihat pada bobot kering akar dengan sumber keragaman pada galur hasil persilangan (G) dengan nilai uji F sebesar 0.0190 . Jumlah akar juga terlihat berbeda nyata pada sumber keragaman antar perlakuan P (0.020), antara perlakuan fosfor dengan cekaman alumunium (0.001) dan antar semua perlakuan dengan galur hasil persilangan (0.010). Hasil uji Dunnet pada Lampiran 5 menunjukkan bahwa pada bobot akar perbedaan nyata terlihat antara SK nomor 23 (22.560) dengan tetua Situ Bagendit. Sedangkan pada bobot kering tajuk antara SK 14 (30.472) berbeda nyata dengan tetua.
9 hasil persilangan juga berbeda nyata dengan tetua, yaitu NIL (8.880), SN 13 (8.249), SN 14 (9.249), SN 21 (12.556) dan SN 22 (9.313).
Tabel 2 Uji Anova untuk masing-masing persilangan Galur
10
P*Al = pengaruh perlakuan terhadap kelompok perlakuan P dan kelompok perlakuan Al, P*G = pengaruh perlakuan terhadap kelompok perlakuan P dan kelompok galur, Al*G = pengaruh perlakuan terhadap kelompok perlakuan Al dan kelompok galur, P*Al*G = pengaruh perlakuan terhadap kelompok perlakuan Al, P dan galur.
Pembahasan
Hasil Isolasi DNA Padi
Metode yang digunakan saat isolasi DNA adalah metode mini-preparation atau miniprep yang mengacu pada metode Dellaporta (1983). Isolasi ini lazim digunakan untuk isolasi DNA. Elekroforesis hasil isolasi dilakukan dengan menggunakan agarosa 1%. Hasil elektroforesis terlihat pada Gambar 1. Agarosa biasa digunakan untuk memisahkan DNA ataupun protein. Untuk agarosa 1% besar pori-porinya sekitar 100 nm sampai 200-500 nm. Agarosa memiliki resolusi pemisahan yang lebih rendah dibandingan dengan poliakrilamid, tetapi memiliki kisaran pemisahan yang lebih besar. Oleh karena itu untuk uji kualitatif DNA lebih baik menggunakan agarosa, karena kisaran DNA biasanya antara 50 sampai 20.000 bp (Sambrook et al. 2001). Semakin kecil konsentrasi agarose yang digunakan, memberikan resolusi yang lebih baik untuk fragmen DNA berukuran besar. Konsentrasi gel yang lebih tinggi mengurangi kecepatan migrasi fragmen DNA berukuran besar tetapi lebih baik dalam memisahkan fragmen DNA berukuran kecil (Lee dan Bahaman 2010).
Selanjutnya dilakukan pengujian kuantitas DNA pada panjang gelombang 260 dan 280. Kemurnian DNA dapat dilihat dari nilai absorbansi 260: 280. Hasil kemurnian sampel hasil persilangan menunjukkan bahwa pada sampel masih terdapat zat pengotor. Nilai absorbansi 260: 280 berkisar antara 1.0322-1.8909. Menurut Sambrook et al (2001) DNA dikatakan murni jika 260: 280 berada dalam kisaran 1,8-2,0. Jika nilai dibawah 1.8 maka sampel kemungkinan masih terkontaminasi RNA sedangkan jika diatas 2.0 maka masih terkontaminasi protein. Hasil pengukuran kuantitas DNA menunjukkan konsentrasi DNA sampel padi hasil persilangan berkisar antara 128.603-801.327 g/ml. Proses PCR dengan menggunakan marka SSR tidak memerlukan jumlah DNA yang besar. Jumlah yang dibutuhkan berkisar antara 0.5-50 ng. Selain itu, marka SSR dapat menggunakan DNA dengan kualitas rendah sampai sedang (Acquaah 2007).
Gen Pup1 Hasil Amplifikasi PCR
11 Hasil amplifikasi menunjukkan bahwa keseluruhan hasil persilangan memiliki kesamaan dengan tetua Kasalath dan NIL-C443. Hasil elektroforesis (Gambar 2 dan 3) menunjukkan pada tanaman sampel, yaitu hasil persilangan antara Kasalath dan NIL-C443 dengan Batur dan Situ Bagendit seluruhnya mengikuti tetua Kasalath dan NIL-C443. Hal ini menunjukkan bahwa hasil persilangan tidak mengikuti keterwarisan hukum Mendell dan memiliki genotipe yang sama. Sehingga persilangan berikutnya hanya dipilih satu galur saja.
Penggunaan marka molekuler ini membuat proses persilangan menjadi lebih singkat. Biasanya untuk mendapatkan galur-galur yang homogen diperlukan persilangan sampai BC5 atau BC6, sedangkan dengan teknologi
marka ini persilangan cukup hanya sampai BC2 atau BC3 saja dengan hasil yang
akurat. Teknologi marka molekuler juga memberikan kepastian keberadaan segmen gen yang diinginkan(Prasetiyono 2011).
Morfologi perakaran tanaman padi hasil persilangan dengan cekaman Alumunium
Konsentrasi fosfor pada tanaman dapat mempengaruhi laju fotosintesis. Sejumlah fosfor digunakan untuk dapat meneruskan proses fiksasi karbon, satu molekul fosfor digunakan untuk tiga CO2, membentuk triosafosfat. Jumlah fosfor
yang sedikit dapat memberikan pengaruh negatif untuk siklus Calvin, dapat pula dikatakan bahwa kondisi defisiensi fosfor dapat mengurangi efisensi fotosintesis pada tanaman (Wissuwa et al. 2005). Hasil penelitian Horst et al. (2001) menunjukkan kemampuan akar untuk lebih mengekplorasi volume tanah sebagai salah satu mekanisme akar untuk menghadapi kondisi defisensi fosfor. Hal ini mengakibatkan pengambilan fosfor dari dalam tanah menjadi lebih efektif. Beberapa penelitian menunjukkan adanya pertambahan panjang akar lateral pada tanaman kacang (Lynch dan Brown 2001) dan arabidopsis (Ticconi et al. 2004). Hal yang sama juga ditunjukkan tanaman padi (Wissuwa 2005). Perluasan kontak antara permukaan akar dengan tanah akan meningkatkan efisiensi penangkapan fosfor (Kochian et al. 2004). Hasil penelitian Wissuwa et al (2001, 2002) menunjukkan gen yang berpengaruh terhadap defisiensi P adalah Pup1, yang terletak di kromosom 12 pada tanaman padi.
Padi Kasalath (dari India) bisa dimanfaatkan sebagai sumber gen Pup1. Padi Kasalath merupakan padi lahan kering yang tahan kering, akan tetapi tidak toleran terhadap keracunan aluminium dan tidak tahan terhadap serangan blas. Oleh karena itu dilakukan pemindahan segmen tersebut dari padi Kasalath ke padi yang sering dibudidayakan di Indonesia melalui persilangan biasa dan diseleksi menggunakan marka molekuler (Prasetyono 2011). Hasil persilangan ini diuji keefektifannya dengan cekaman alumunium. Sebagai penyedia unsur hara digunakan larutan Yoshida.
12
persilangan Situ Bagendit dengan NIL-C443 berbeda nyata pada panjang tajuk, bobot kering akar, dan jumlah akar.
Perbedaan diamati terutama pada bagian akar, karena gen Pup1 pada tanaman padi berperan dalam proses pengambilan P yang bekerja pada bagian akar. Gen ini diketahui berpengaruh terhadap luas permukaan akar sehingga penjerapan P lebih efisien. Gen Pup1 ini tidak bekerja sendiri namun bekerja bersamaan dengan gen lain. Seperti gen-gen yang terlibat dalam toleransi terhadap keracunan Aluminium (Alt genes), keracunan besi, keracunan garam (Ismail et al 2007). Hasil penelitian menunjukkan hal yang berbeda dengan penelitian Ismail et al pada tahun 2007. Berdasarkan penelitian sebelumnya (Ismail et al. 2007), diketahui bahwa tanaman padi yang mempunya gen Pup1 memiliki bobot kering akar yang lebih tinggi dibandingkan tanaman padi yang tidak mempunyai gen Pup1. Sedangkan panjang akar tidak berhubungan dengan gen Pup1. Hal ini kemungkinan dapat dikarenakan perbedaan sampel yang digunakan pada penelitian ini dengan penelitiana Ismail et al. (2007). Penelitian sebelumnya menggunakan perbandingan antara Kasalath dengan NIL C-443. Sedangkan penelitian ini menggunakan persilangan antar keduanya dengan padi Batur dan Situ Bagendit.
SIMPULAN DAN SARAN
Simpulan
Gen Pup1 telah berhasil diamplifikasi. Ukuran pita yang dihasilkan berkisar pada 200 bp. Sehingga dapat dikatakan bahwa semua tanaman hasil persilangan memiliki gen Pup1. Sedangkan berdasarkan uji morfologi perakaran terhadap hasil persilangan dengan tetua yang tidak toleran, tanaman hasil persilangan memiliki morfologi perakaran yang lebih baik. Beberapa tanaman hasil persilangan memilki bobot kering akar, bobot kering tajuk, panjang akar dan panjang tajuk yang lebih tinggi dibandingkan tetua yang tidak toleran.
Saran
Perlu dilakukan penyederhanaan metode perlakuan dengan larutan Yoshida, sehingga dapat mempermudah proses pengamatan.
13 Lee AV, Bahaman AR. 2010. Modified gel preparation for distinct DNA fragment analysis in agarose gel electrophoresis. Tropical Biomedicine 27: 351–354. Chesworth JM, T Stuchbury, JR Scaife. 1998. An Introduction to Agricultural
Biochemistry. London: Chapman and Hall.
Chin JH, R Gamuyao, C Dalid, M Bustamam, J Prasetiyono, S Moeljopawiro, M Wissuwa,S Heuer. 2011. Developing rice with high yield under phosphorus deficiency: Pup1 sequence to application. Plant Physiology 156: 1202–1216
Dellaporta SL, Wood J, Hicks JB. 1983. A plant DNA minipreparation. Plant Mol Biol Rep 1:19-21.
Horst WJ, Kamh M, Jibrin JM, Chude VO. Agronomic measures for increasing P availability to crops. Plant and Soil 237: 211–223.
Ismail AM, S Heuer, MJ Thomson, M Wissuwa. 2007. Genetic and genomic approaches to develop rice germplasm for problem soils. Plant Mol Biol DOI 10.1007/s11103-007-9215-2.
Lynch JP, Brown KM. 2001.Top soil for aging :an architectural adaptation of plants to low phosphorus availability. Plant and Soil 237: 225–237.
Mullis KB, Faloona FA. 1987. Specific synthesis of DNA in vitro by Polymerase catalysed chain reaction. Methods in Enzymology 155:335-350
Ni JJ, P Wu, D.Senadhira, N.Huang. 1λλ8. Mapping QTL’s for phosphorus deficiency tolerance in rice (Oryza sativa L.). Theor Appl Genet 97:1361-1369.
Prasetiyono J. 2011. Galur Pup1 bisa menekan penggunaan pupuk P. Sinartani : 4-7.
Prasetyo BH, DA Suriadikarta. 2006. Karakteristik, potensi, dan teknologi pengelolaan tanah ultisol untuk pengembangan pertanian lahan kering di Indonesia. J Litbang Pertanian 25 (2) : 40-46.
Sambrook J, Fritsch EF, Maniatis T. 2001. Molecular Cloning A Laboratory Manual Third Edition. New York: Cold Spring Harbor Laboratory.
Santoso TJ, Syafaruddin. 2011. Optimasi teknik isolasi dan puriffikasi DNA yang efisien dan efektif pada kemiri sunan (Reultalis trisperma (Balnco)) Airy Shaw). Jurnal Littri 1:11-17
Ticconi CA, Delatorre CA, Lahner B, Salt DE, Abel S. 2004. Arabidopsi sp reveals a phosphate-sensitive check point in root development. The Plant Journal 37: 801–814.
Wissuwa M, Gloria G, AM Ismail. 2005. Is root growth under phosphorus deficiency affected by source or sink limitations?. Journal of Experimental Botany 417: 1943–1950.
Wissuwa M, JN. Wegner, N Ae, M Yano. 2002. Substitution mapping of Pup1: a major QTL increasing phosphorus uptake of rice from a phosphorus-deficient soil. Theor Appl Genet 105 : 890-897.
Wissuwa M, M Yano, N Ae. 1998. Mapping of QTLs for phosphorus-deficiency tolerance in rice (Oryza sativa L.) Theor Appl Genet 97: 777-783
14
Wissuwa M. 2005. Combining a modelling with a genetic approach in establishing associations between genetic and physiological effects in relation to phosphorus uptake. Plant and Soil 269: 56-68.
Wissuwa M, N Ae. 2001. Further characterization of two QTLs that increase phosphorus uptake of rice (Oryza sativa L.) under phosphorus deficiency. Plant Soil 237: 275-286.
15 LAMPIRAN
Lampiran 1 Komposisi larutan yang digunakan dalam penelitian Komposisi buffer ekstrak 1000 mL
Bahan-bahan Jumlah
1 M Tris-HCL pH 8 100 mL
5 M NaCl 100 µL
0.5 M EDTA pH 8 100 µL
SDS 12.5 g
Akuades (dH2O) ditambahkan hingga volume akhir (1000 ml)
Komposisi gel akrilamid untuk 1 kali running
Bahan-bahan Jumlah
Larutan PAGE 8% 60 mL
APS 10 % 600 µL
TEMED 60 µL
Komposisi APS 10 %
Bahan-bahan Jumlah
APS dH2O
1 gram 10 mL
Komposisi larutan PAGE 8% untuk 1 liter
Bahan-bahan Jumlah
TBE 10x 50 mL
PAGE 40% 200 mL
Akuades 750 mL
Komposisi larutan PAGE 40 % untuk 1 liter
Bahan-bahan Jumlah
akrilamid -bis akrilamid 20 g
380 gram 20 gram
Komposisi 10 x TBE untuk 1 liter
Bahan-bahan Jumlah
Tris 108 gram
EDTA 9,2 gram
16
17 Lampiran 3 Hasil Uji Dunnet Terhadap Persilangan Batur dan Kasalath
No Galur Uji Dunnet
Panjang akar
Panjang tajuk
Bobot kering akar
Bobot kering
tajuk Jumlah akar
1 Batur
2 Kasalath 6.353 7.971 10.400 1.029 4.205
3 BK1 6.193 4.285 8.626 1.707 2.905
4 BK2 5.974 5.262 9.539 1.620 2.278
5 BK3 5.203 5.259 8.526 1.278 3.242
6 BK4 6.775 5.547 12.354 0.910 3.648
7 BK5 3.866 2.958 11.808 1.842 3.869
8 BK6 7.774 6.952 8.946 1.493 2.346
9 BK7 6.326 6.512 9.640 1.094 3.944
10 BK8 6.041 4.762 12.038 0.836 1.964
11 BK9 4.928 4.246 14.150 1.652 2.217
12 BK10 3.436 5.307 23.361 *** 3.390 2.930
13 BK11 7.517 7.689 8.502 0.837 1.564
14 BK12 4.786 1.740 10.640 0.994 1.914
15 BK13 5.836 4.442 14.040 1.593 2.854
16 BK14 8.603 7.604 8.502 0.837 2.791
17 BK15 7.775 6.031 8.500 1.116 2.841
18 BK16 6.252 6.040 12.093 1.176 3.201
19 BK17 4.816 4.757 11.639 0.994 1.791
20 BK18 4.796 6.174 14.870 1.509 2.367
21 BK19 5.218 5.551 15.204 1.620 2.701
22 BK20 4.057 5.002 16.777 1.742 5.063
18
Lampiran 4 Hasil Uji Dunnet Terhadap Persilangan Batur dan NIL-C443
19 Lampiran 5 Hasil Uji Dunnet Terhadap Persilangan Situ Bagendit dan Kasalath
20
Lampiran 6 Hasil Uji Dunnet Terhadap Persilangan Situ Bagendit dan Kasalath
21
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 8 Agustus 1991 dari ayah Ali Nurdin dan Ibu Tsamrotul Bashiroh. Penulis merupakan putri satu-satunya dari keluarga. Penulis menyelesaikan pendidikan menengah atas di SMAN 3 Bogor tahun 2009. Pada tahun yang sama, penulis meneruskan pendidikan di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis mengikuti organisasi kampus sebagai anggota dari Biologi Molekuler CREBS (Community of Reasearch and Education in Biochemistry) tahun 2010-2011 dan 2011-2012. Penulis juga mengkuti beberapa kepanitiaan. Diantaranya yaitu, sebagai anggota publikasi, dekorasi dan dokumentasi (PDD) Lomba Karya Ilmiah Populer 2010, anggota PDD seminar Kesehatan dan Launching buku Pengantar Penelitian Biokimia 2011, ketua hubungan masyarakat seminar Kesehatan dan Keselamatan Kerja 2011, ketua PDD Lomba Karya Ilmiah Populer 2011, anggota acara Masa Pengenalan Departemen Biokimia 2011, dan ketua pertandingan dan perwasitan Biochemistry Champions League 2011.