i
KARAKTERISASI FAKTOR TRANSKRIPSI HD-ZIP UNTUK
KETAHANAN KEKERINGAN DAN INTRODUKSI GEN-GEN PENYANDI
LINTASAN BIOSINTESIS ASAM SALISILAT UNTUK KETAHANAN
PENYAKIT BLAS PADA TANAMAN PADI
SIGIT PURWANTOMO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Biologi
PROGRAM STUDI BIOLOGI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii
Judul : KARAKTERISASI FAKTOR TRANSKRIPSI HD-ZIP
UNTUK KETAHANAN KEKERINGAN DAN INTRODUKSI GEN-GEN PENYANDI LINTASAN BIOSINTESIS ASAM SALISILAT UNTUK KETAHANAN PENYAKIT BLAS PADA TANAMAN PADI
Nama : SIGIT PURWANTOMO
NRP : P17600013
Program Studi : BIOLOGI
Disetujui,
Komisi Pembimbing
Prof. Dr.Ir. Antonius Suwanto, M.Sc Ketua
Prof. Dr.Ir. Alex Hartana Anggota
Prof. Dr.Ir. Maggy T Suhartono Anggota
Dr.Ir. Inez H Slamet-Loedin Anggota
Diketahui
Ketua Program Studi Biologi
Dr. Ir. Dedy Duryadi Solihin, DEA
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, M.Sc
iii
KATA PENGANTAR
Puji syukur dipanjatkan kehadirat Allah SWT yang Maha Kuasa sehingga pada akhirnya penelitian dengan judul KARAKTERISASI FAKTOR TRANSKRIPSI HD-ZIP UNTUK KETAHANAN KEKERINGAN DAN INTRODUKSI GEN-GEN PENYANDI LINTASAN BIOSINTESIS ASAM SALISILAT UNTUK KETAHANAN PENYAKIT BLAS PADA TANAMAN PADI dapat diselesaikan. Penelitian ini sebagian besar dibiayai oleh KNAW (Dutch Royal Academy of Sciences).
Sebagian disertasi ini telah diajukan pada jurnal Anales Bogoriense dengan judul “The expression of drought-repressed rice homeobox gene Oshox4 controls reduction of cell size and cell number”. Di sampng itu, sebagian disertasi ini telah diajukan pula pada jurnal Plant Molecular Biology dengan judul “Annotation of the homeodomain-leucinezipper (HD-Zip) family I, II and III from rice and functional analysis of the HD-Zip family I member Oshox4.”
Pertama-tama saya mengucapkan terima kasih yang mendalam kepada Bapak Prof. Dr. Ir. Antonius Suwanto, M.Sc. Bimbingan, saran, dan dorongan semangat selama saya melakukan studi program doktor ini tidak akan pernah sekalipun saya lupakan. Ucapan terima kasih saya tujukan untuk Bapak Prof. Dr. Ir. Alex Hartana yang telah memberikan dasar genetika kepada saya selama saya sekolah di IPB. Di samping itu, saran, kritikan, dan masukan dari Bapak telah memberi dorongan positif pada desertasi saya akan selalu diingat. Terima kasih saya ucapkan untuk Ibu Prof. Dr. Ir. Maggy T Suhartono untuk waktu yang dicurahkan dalam memberi masukan pada desertasi saya. Saran Ibu untuk memberikan desertasi saya dibaca oleh orang lain di luar ilmu yang saya tekuni ini sangat membantu memperbaiki alur berpikir saya. Hal ini akan selalu saya ingat. Terima kasih saya tujukan kepada Ibu Dr. Ir. Inez H Slamet Loedin. Pengalaman saya bekerja dan usaha Ibu Inez untuk mendorong semangat belajar saya tidak cukup untuk digambarkan dalam kalimat ini. Ibu Inez telah memberikan dasar bagi saya untuk bekerja di laboratorium biologi molekuler dan mengenalkan saya kepada teman-teman peneliti di luar negeri. Semuanya ini senantiasa tidak akan hilang dari ingatan. Terima kasih kepada Bapak Dr. Dedy Duryadi Solihin atas dorongan semangat kepada saya. Ucapan terima saya tujukan untuk Ibu Dr. Utut Widiastuti, Bapak Dr. Sony Suharsono, dan Bapak Dr. M Jusuf, serta Bapak Dr. Sugiono Moeljopawiro untuk masukan dan kritik yang telah diberikan.
iv
saya. Terima kasih ditujukan untuk Huub Loffler sebagai koordinator BIORIN KNAW yang telah memberikan dorongan kepada saya. Terima kasih saya ungkapkan untuk Andi Utama, Diah Retno, dan Ibu Sukendah untuk waktu yang diberikan dalam membaca disertasi saya ini dan sekaligus membantu proses editing. Usaha yang membantu saya mengedit pada disertasi ini akan selalu saya ingat dan tidak akan terlupakan. Akhirnya kepada teman-teman di Biotek LIPI dan di IPB yang tidak dapat saya sebutkan satu-persatu, saya mengucapkan terima kasih yang mendalam untuk semua yang telah diberikan selama saya menempuh S3 ini.
Pada desempatan ini, ucapan terima kasih saya ungkapkan kepada keluarga, Ibu-Bapak, Mamak, Mimi-Apa, Mbak Cici-Mas Gun, Iwit-Dewi, Uni, Teh Ina-A Iwan, Teh Ely-A Didi, Hendra-Ika, dan Dindin-Nia yang memberi banyak dorongan untuk saya selama belajar di Belanda dan IPB ini. Terima kasih untuk Aay, ucapan terima kasih tidak cukup hanya diungkapkan dalam dua kata “terima” dan “kasih”. Terima kasih untuk mendukung pilihan saya belajar S-3 di Leiden dan IPB.
Jakarta, 2007
v
RIWAYAT HIDUP
vi
2 Tujuan dan manfaat penelitian ... 2.1 Tujuan penelitian ... 4
2.2 Manfaat penelitian ... 5
TINJAUAN PUSTAKA 1 Kekeringan 1.1 Budidaya padi dan kekeringan ... 7
1.2 Cekaman kekeringan: respon tanaman dan upaya rekayasa genetika untuk meningkatkan toleransi tanaman ... 10
1.3 Identifikasi gen potensial untuk padi tahan kering ... 17
2 HD-Zip (Homeodomain Leucine Zipper) ... 18
3 Asam salisilat 21 3.1 Asam salisilat pada tanaman ………. 22
3.2 Asam salisilat pada mikroorganisme ... 24
3.3 Sinyal dengan perantara asam salisilat ... 24
3.4 Introduksi gen-gen penyandi lintasan asam salisilat asal bakteri ... 27
BAHAN DAN METODE 1 Waktu dan tempat penelitian ... 29
2 Bahan penelitian ... 29
3 Metodologi penelitian ... 31
3.1 Karakterisasi Gen HD-Zip padi responsif kekeringan ... 31
3.1.1 Penapisan HD-Zip yang merespon kekeringan ... 31
3.1.2 Karakterisasi gen HD-Zip yang responsif kekeringan ... 33
A Meningkatkan ekspresi gen Oshox4 di bawah kendali promoter konstitutif 35S dari CaMV ... 33
A.1 Konstruksi 35S-Oshox4 ... 33
A.2 Transformasi 35S-Oshox4 ke tanaman padi dan Arabidopsis ... 34
A.2.1 Transformasi 35S-Oshox4 ke tanaman padi ... 34
A.2.2 Transformasi 35S-Oshox4 ke Arabidopsis ... 36
A.3 Uji kekeringan tanaman transgenik Arabidopsis 35S-Oshox4 ... 36
B Menurunkan ekspresi gen Oshox4 menggunakan RNAi ... 37
B.1 Konstruksi vektor RNAi-Oshox4 ... 37
B.2 Transformasi RNAi-Oshox4 ke tanaman padi ………. 38
B.3 Analisis penurunan ekspresi Oshox4 ... 39
C Melihat pola ekspresi gen Oshox4 ... 39
vii
C.2 Penggandaan plasmid dan transformasi
Agrobacterium ke tanaman padi dan Arabidopsis …... 40
C.3 Analisis ekspresi gen GUS ………... 40
C.4 Analisis ekspresi gen Oshox4 in silico ... 41
3.2 Introduksi gen-gen entC dan pmsB ke dalam tanaman padi .... 41
3.2.1 Konstruksi plasmid pC1300 yang mengandung gen entC dan pmsB ... 41
3.2.2 Transformasi konstruksi gen PSA ke tanaman padi Nipponbare ... 42
3.2.3 Analisis molekular ekspresi gen entC dan pmsB pada tanaman padi transgenik Nipponbare ... 43
3.2.4 Pengukuran asam salisilat dan asam salisilat glukosida ... 43
HASIL DAN PEMBAHASAN 1 Hasil penelitian karakterisasi gen HD-Zip 1.1 Penapisan gen HD-Zip tanaman padi yang merespon cekaman 45 1.2 Respon gen HD-Zip padi terhadap cekaman abiotik ……….. 45
1.3 Karakterisasi gen HD-Zip yang responsif kekeringan ………. 51
1.4 Peningkatan ekspresi gen Oshox4 di bawah kendali promoter konstitutif 35S dari CaMV ……… 52
1.4.1 Fenotipe tanaman padi dengan ekspresi gen Oshox4 yang meningkat ………. 52
1.4.2 Uji kekeringan pada tanaman Arabidopsis yang mengandung 35S- Oshox4 ………. 58
1.5 Penurunan ekspresi gen Oshox4 menggunakan RNAi-Oshox4 59 1.6 Analisis pola ekspresi gen Oshox4 ………... 60
2 Hasil penelitian introduksi gen penyandi lintasan biosintesis asam salisilat ke tanaman padi 2.1 Analisis Northern gen hph ……… 62
2.2 Analisis Northern gen entC ……….. 62
2.3 Analisis Southern gen pmsB ………. 63
2.4 Kandungan asam salisilat ………. 64
3 Pembahasan 3.1 Penapisan gen HD-Zip tanaman padi yang merespon cekaman 65 3.2 Karakterisasi gen HD-Zip yang responsif kekeringan ……….. 66
viii
DAFTAR TABEL
Halaman
1 Target urutan nukleotida dari HD-Zip berupa
pseudopalindromic ... 20 2 Jenis kultivar padi yang dipakai dalam percobaan cekaman
abiotik ... 30 3 Jenis bakteri yang dipakai pada percobaan kloning dan
transformasi ... 30 4 Daftar plasmid yang digunakan pada konstruksi gen ……… 30
5 Perunut yang digunakan ……… 30
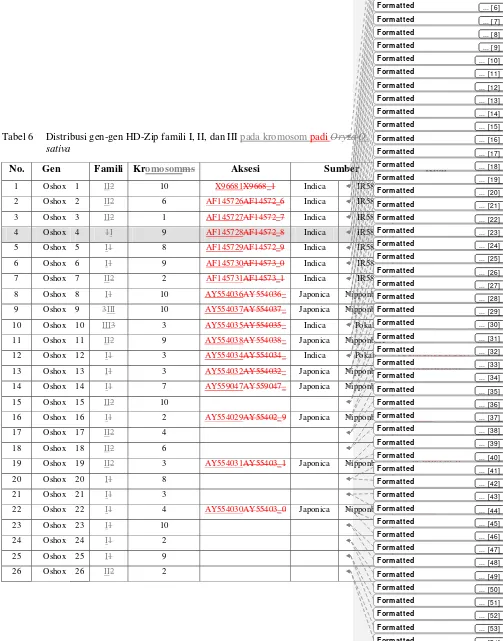
6 Distribusi gen-gen HD-Zip Famili I, II, dan III Oryza sativa …... 46 7 Respons sejumlah gen Oshox terhadap cekaman abiotik pada
tanaman padi ………. 49
8 Pencarian esxpressed sequence tag (EST) menggunakan cDNA
gen Oshox4 ……… 53
9 Ekspresi GUS pada tanaman transgenik pOshox4-GUS saat
ix
DAFTAR GAMBAR
Halaman
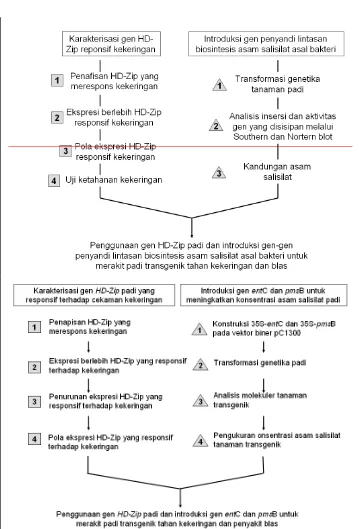
1 Diagram alur penelitian karakterisasi gen regulator HD-Zip untuk ketahanan kekeringan dan introduksi gen-gen penyandi lintasan biosintesis SA berasal dari bakteri untuk ketahanan penyakit blas.
Garis titik-titik merupakan tujuan jangka panjang. ... 6 2 Mekanisme toleransi kekeringan dan respon tanaman saat terpapar
kekeringan (Bartels & Sunkar 2004). Tanda panah menunjukkan arah pengaruh; kotak: bentuk respon sel; +: memberi pengaruh meningkatkan; -: memberi pengaruh menurunkan; ROS: spesies
oksigen reaktif. Kotak menggambarkan proses dalam sel. ... 9 3 Penerimaan dan respon sel saat terpapar cekaman kekeringan.
Kekeringan akan mengubah komposisi protein regulator atau fungsional sel untuk keperluan adaptasi sel (Yamaguchi-Shinozaki
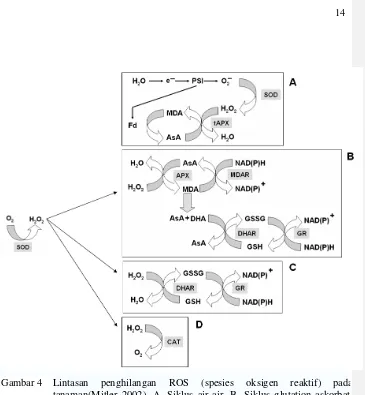
et al. 1997). ... 11 4 Lintasan penghilangan ROS (spesies oksigen reaktif) pada
tanaman (Mitler 2002). A. Siklus air-air. B. Siklus glutation-askorbat. C. Siklus glutation peroksidase (GPX). D. Katalase (CAT). PSI: fotosistem I; SOD: superoksida dismutase; MDA: monodihidroaskorbat; AsA: askorbat; tAPX: tilakoid APX; DHA dihidroaskorbat; MDAR: MDA reduktase; GSH: glutation; GSSG: glutation teroksidasi; DHAR: DHA reduktase; GR: glutation
reduktase. ... 13 5 Sistem dua komponen pada Escherichia coli dan Saccharomyces
serevisiae (Kultz & Burg 1998). Huruf miring menunjukkan gen
yang dipengaruhi. ... 15 6 Urutan asam amino dari protein homeodomain Drosophila
melanogaster antp (http://www.biosci.ki.se). Daerah dengan tanda segitiga terbalik merupakan asam amino yang juga dimiliki oleh
gen yang mengandung homeobox lainnya. ... 19 7 Model struktur protein HD-Zip. A. Protein HD-Zip terdiri dari dua
motif. Motif HD berperan dalam pengikatan DNA pada ujung terminal N, sementara leucine zipper pada ujung terminal C berfungsi untuk dimerisasi. B. Model struktur pengikatan HD-Zip
dengan DNA (http://w3.uniroma1.it/centricnr-can/edocs/ire1.htm). 19 8 Ringkasan biosintesis asam salisilat. Tanda panah memperlihatkan
alternatif sintesis asam salisilat pada tanaman. Tanda panah putus-putus merupakan sintesis asam salisilat pada mikroorganisme melalui konversi langsung asam korismat menjadi asam salisilat. Tanda panah dengan titik-titik adalah lintasan produk perantara yang dapat dipakai untuk mensintesis asam salisilat pada
mikroganisme. ……….………. 22
9 Ringkasan peran asam salisilat dalam mengaktifkan sejumlah gen dan protein.→: arah pengaruh; ┴ : arah yang dihambat; ↵: bentuk
x
10 Tahapan yang dilakukan dalam penelitian. Penelitian mempunyai dua bagian yang terdiri dari penggunaan HD-Zip (kotak) dan introduksi gen penyandi lintasan biosintesis asam salisilat asal
bakteri (segitiga) untuk pembuatan padi transgenik. ... 31 11 Peta restriksi dari konstruksi untuk meningkatkan ekspresi gen
Oshox4. 2 x 35S promoter: promoter ganda yang terdiri dari dua buah promoter 35S, Oshox4: daerah cDNA Oshox4 pada koordinat
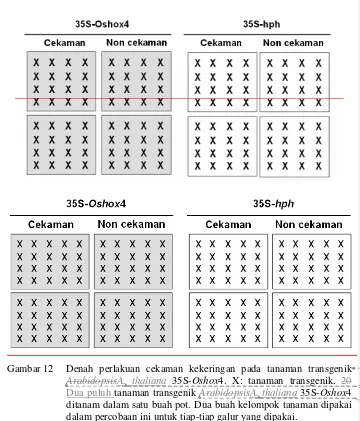
1-1197, 35S terminator: polyA dari 35S. ... 34 12 Denah perlakuan cekaman kekeringan pada tanaman transgenik
Arabidopsis 35S-Oshox4. X: tanaman transgenik. 20 tanaman transgenik Arabidopsis 35S-Oshox4 ditanam dalam satu buah pot. Dua buah kelompok tanaman dipakai dalam percobaan ini untuk
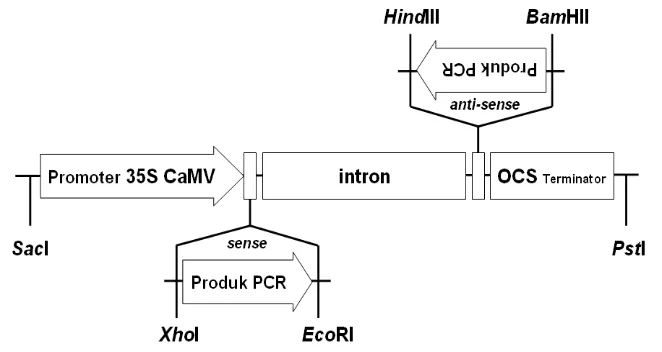
tiap-tiap galur yang dipakai. ... 37 13 Konstruksi vektor untuk menurunkan ekspresi Oshox4. Produk
PCR sebesar 400 bp disisipkan sebagai sense pada sisi XhoI/EcoRI dan anti-sense pada sisi HindIII/BamHI pada vektor pHannibal. Cassette pHannibal SacI/PstI selanjutnya disisipkan pada vektor
biner pC1300. ………..………. 38
14 Konstruksi T-DNA pda vektor pC1391Z mengandung promoter Oshox4. Promoter Oshox4 disisipkan pada sisi HindIII/NcoI. mcs: multiple cloning site, hph: hygromisin fosfotransferase, nos ter: terminator dari nofalin sintase, GUS: gen glukuronidase, RB: batas
kanan, LB: batas kiri.………. 40
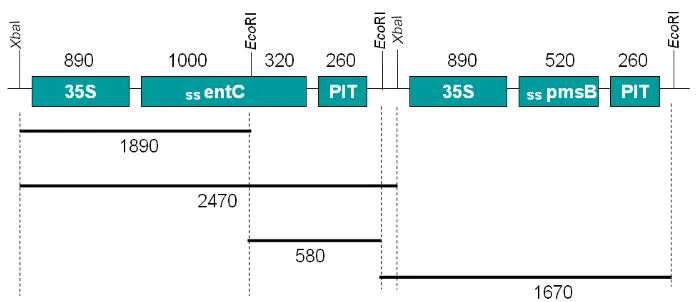
15 Peta restriksi dan konstruksi gen penyandi lintasan biosintesis asam salisilat asal bakteri. 35S: promoter 35S dari CaMV, ss: small subunit dari Rubisco, entC: gen penyandi isokorismat sintase dari E. Coli, pmsB: gen penyandi isokorismat piruvat liase dari Pseudomonas fluorescens, PIT: terminator dari gen inhibitor proteinase kentang, angka menunjukkan ukuran nukleotida apabila
dipotong dengan restriksi enzim tertentu. ... 42 16 Analisis Northern blot pada 5 kultivar padi pada saat kekeringan
menggunakan gen salT sebagai penanda. Tanda panah
menunjukkan terjadinya induksi gen salT pada tingkat transkripsi.
j: jam ………... 47
17 Transkripsi gen Oshsp16.9 Oryza sativa: perlakuan kejut-panas diberikan selama 2 jam pada suhu 42oC menggunakan analisis Northern. NB: Nipponbare; TP: Taipei. NB: Nipponbare; TP:
Taipei; -: tanpa perlakuan kejut-panas; +: perlakuan kejut-panas... 47 18 Blot Northern gen Oshox3 tanaman padi saat terpapar cekaman
kejut panas. NB: Nipponbare, TP: Taipei, +: perlakuan kejut-panas
42oC selama 2 jam, -: kontrol tanaman tanpa perlakuan. ………….. 48 19 Pola transkripsi HD-Zip Oshox19 pada cekaman kekeringan. Tanda
panah menunjukkan adanya induksi. ………. 48 20 Pola transkripsi HD-Zip Oshox6 pada saat terpapar kekeringan.
Tanda panah menunjukkan pola transkripsi terepresi. ……….. 48 21 Blot Northern gen Oshox3 tanaman padi saat terpapar cekaman
perendaman. NB: Nipponbare, TP: Taipei, +: perendaman selama 4
xi
22 Pola transkripsi HD-Zip Oshox23 pada cekaman kekeringan. …… 49 23 Pola transkripsi HD-Zip Oshox4 pada cekaman perendaman. Panah
memperlihatkan induksi pada perendaman. NB: Nipponbare; Oshsp16.9: protein kejut panas Oryza sativa; perendaman selama 4
jam. ……… 50
24 Analisis Northern blot pada 5 kultivar padi pada saat kekeringan pada Oshox4. Tanda panah menunjukkan terjadinya represi gen
Oshox4 di tingkat transkripsi………. 50 25 Pola transkripsi HD-Zip Oshox4 pada cekaman kejut-panas. Panah
memperlihatkan represi pada kejut-panas. NB: Nipponbare; Oshsp16.9: protein kejut panas Oryza sativa; kejut-panas pada
42oC selama 4 jam. ……….. 51
26 Skema pola ekson-intron Oshox4. Besarnya daerah ekson-intron
ditunjukkan oleh angka yang menunjukkan jumlah nukleotida. …. 51 27 Homeodomain dan motif leucine zipper pada Oshox4. (A) Urutan
asam amino daerah homeodomain Oshox4. Tiga heliks alfa Antennapedia (Antp) dari Drosophila ditunjukkan dengan garis. Residu protein yang umum dimiliki ditunjukkan dengan (Δ) warna hitam, sedangkan kesamaan Oshox4 dan Antp ditunjukkan dengan tanda (-). (B) Urutan asam amino daerah leucine-zipper dari Oshox4. Motif leucine yang berulang diperbandingkan dengan basic leucine zipper (bZip) dari C/EBP mamalia yang ditunjukkan dengan garis, sementara lokasi leusin diperlihatkan dengan tanda (L). (C) Homeodomain dan motif leucine zipper Oshox4. Posisi tiga heliks alfa dari homeodomain diletakkan pada kotak dan asam
amino leusin pada urutan asam amino protein. ………. 52 28 Fenotipe padi transgenik kultivar Nipponbare hasil transformasi
menggunakan konstruksi Oshox4 yang dikontrol oleh promoter 35S. A. Verifikasi Northern pada tanaman dengan ekspresi Oshox4 yang meningkat. B adalah kontrol tanaman mengandung konstruksi pDR5-GUS. C. Kelompok transgenik dengan tingkat Oshox4 yang meningkat dengan fenotipe pertumbuhan vegetatif sedang, dan D.
fenotipe pertumbuhan vegetatif tereduksi berat. ……….. 54 29 Analisis panjang ruas batang. Daerah berwarna gelap pada A dan
B adalah 35S::Oshox4, sementara daerah berwarna putih pada A dan B adalah kontrol. C (sayatan transversal) dan D (sayatan longitudinal) pada ruas batang kontrol. E dan F adalah sayatan transversal dan longitudinal ruas batang padi transgenik yang mengandung konstruksi 35S-Oshox4. Anak panah menunjukkan daerah sel yang diukur. Angka 1,2, dan 3 menunjukkan posisi ruas
batang yang diamati. ……… 55
30 Panjang daun bendera tanaman dengan Oshox4 yang berlebih. A. Panjang daun bendera; B. Panjang sel longitudinal dari daun bendera. C. Sayatan longitudinal daun bendera kontrol. D Sayatan
xii
31 Fenotipe malai. A: Lemna/palea kontrol; B: Organ reproduksi kontrol; C: Polen kontrol (panah menunjukkan bentuk pollen normal). D: Lemna/palea Oshox4; E: Organ reproduksi 35S-Oshox4; F: Polen 35S-Oshox4 (panah menunjukkan bentuk polen normal); G: Jumlah bunga yang dihasilkan tiap malai dan jumlah bunga yang tidak menjadi biji (hampa), 35S-Oshox4 ditandai dengan warna abu-abu; H: Perbandingan panjang selubung daun dari daun bendera pada ruas batang pertama, ruas batang pertama ditandai dengan warna putih; I: perbandingan ukuran sumbu penikel, cabang primer dan sekunder, 35S-Oshox4 ditandai dengan
warna abu-abu……… 57
32 Fenotipe tanaman 35S-Oshox4 pada umur 2, 4, dan 10 bulan…….. 58 33 Pengujian ketahanan kekeringan Arabidopsis mengandung
35S-Oshox4 (AT1-10) dibanding kontrol (K-). ……… 59 34 Analisis Northern tanaman transgenik mengandung konstruksi
RNAi menggunakan konstruksi Hannibal. A. Analisis Northern tanaman mengandung konstruksi PO4 dan T1 tanaman 35S-Oshox4. B. Analisis Northern tanaman transgenik Nipponbare mengandung konstruksi RNAi-Oshox4. Angka atau kode
menunjukkan asal kalus. ……….. 60
35 Lokasi ekspresi gen GUS yang dikendalikan oleh promoter Oshox4 pada jaringan tanaman padi kultivar Nipponbare. A. Jaringan daun. B. Jaringan daun setelah diberikan perlakuan cekaman kekeringan 24 jam. C. Kecambah padi. D. Akar dengan potongan longitudinal. E. Akar dengan potongan transversal. F. Jaringan pembuluh pada daun. G. Lema dan palea. H. Potongan longitudinal benih padi. I. Embrio padi. V: jaringan pembuluh. SC: skutelum. PH: pembuluh
floem. ……….. 61
36 Northern blot dari tanaman padi mengandung konstruksi asam salisilat asal mikrob dengan menggunakan higromisin
fosfotransferase (hph) sebagai penanda. Angka menunjukkan nomor kalus dan huruf di belakang nomer kalus yang menunjukkan
pemisahan kalus. ……….. 63
37 Northern blot menggunakan penanda entC pada tanaman padi transgenik Nipponbare mengandung biosintesis asam salisilat asal bakteri. Angka menunjukkan nomor kalus dan huruf di belakang nomer kalus yang menunjukkan pemisahan kalus. Angka yang
tidak diikuti oleh kode huruf menunjukkan individu tanaman……. 63 38 Southern blot dari tanaman transgenik padi mengandung
konstruksi asam salisilat asal bakteri dengan menggunakan pmsB sebagai pelacak. Angka menunjukkan nomor kalus dan huruf di
belakang nomer kalus yang menunjukkan pemisahan kalus. …... 64 39 Kandungan asam salisilat (SA) pada bibit padi berumur 2 minggu.
SA ditunjukkan dengan warna putih, sedangkan SAG ditunjukkan
xiii
40 Model hipotetik Oshox4. Ekspresi Oshox4 dikontrol oleh cekaman lingkungan yang berakibat pada elongasi dan jumlah sel serta penundaan penuaan jaringan. -: merepresi; +: menginduksi; o: tidak mempengaruhi; →: arah pengaruh; --- : pengaruh tidak
langsung; titik-titik: pengaruh logis kekeringan. ……….. 69 41 Keterkaitan gen Oshox4 dan kandungan asam salisilat untuk
meningkatkan ketahanan padi terhadap kekeringan dan penyakit blas. ---: pengaruh Oshox4 dan asam salisilat dari tanaman; ….:
xiv
DAFTAR SINGKATAN
35S-hph: konstruksi gen resistensi antibiotik higromisin (higromisin fosfotransferase) di bawah kendali promoter 35S dari CaMV 35S-Oshox4: konstruksi cDNA Oshox4 di bawah kontrol promoter 35S dari
CaMV
ABA: abscisic acid (asam absisat) ABF: ABA binding factor
ABRE: ABA responsive element
Ac/Ds: elemen loncat association/dissociation dari jagung AP2: apetala2
AREB: ABA responsive element binding as-1: activating sequence 1
AtHK1: Arabidopsis thaliana histidine kinase 1
BA: Asam benzoate
BA2H: Asam benzoat 2-hidroksilase
bZip: basic leucine zipper
CaM: kalmodulin
CBF: C-repeat/dehydration responsive element binding factor
CBL: calciuneurin B-like
CDPK: calcium dependent protein kinase
CE: coupling element
CIPK: CBL interacting protein kinase
cor15a: cold-regulated 15A
CRT: C-repeat
DNA: asam deoksiribonukleat
DR5-GUS konstruksi gen GUS yang dikontrol oleh promoter DR5 DRE: dehydration responsive element
DREB: dehydration responsive element binding EDTA: ethylene diamine tetracetic acid
Em1a: elemen respons ABA pada promoter gen Em (early methionine labelled polypeptide) dari gandum (Triticum aesticum) dengan sekuens GACACGTGGC
Em1b: elemen respons ABA pada promoter gen Em (early methionine labelled polypeptide) dari gandum (Triticum aesticum)
CACACGTGCC
EmBP: DNA binding protein dari kelas b-Zip yang berikatan dengan gen Em
entC: gen penyandi isokorismat sintase dari Escherichia coli EnvZ: osmosensor pada sistem dua komponen Escherichia coli EREBP: ethylene responsive element binding protein
FAO: Food and Agriculture Organization
GS: glukosil salisilat
GST: glutation S-transferase GNT35: GST Nucotiana tabaccum HD: homeodomain
xv
HD-GLABRA2: kelompok anggota homeodomain HD-knotted1: kelompok anggota homeodomain
HD-Zip: homeodomain leucine zipper
HOG1: high osmolarity glycerol 1
HOT(D): 13-hidroksi oktadekatri(di)enoik HPOT(D): 13-hidroksiperoksi-oktadekatri(di)enoik
HR: respon hipersensitif
HVA1: barley (Hordeum vulgare) aleuron LEA protein
ICS: isokorismat synthase
IPL: isokorismat piruvat liase
IRRI: International Rice Research Institute
JA: asam jasmonat
kn1: gen homeobox yang pertama kali diidentifikasi berasal dari tanaman (Zea mays)
KNOX: kelompok anggota homeodomain
LEA: late embryonic abundant
Lti78: low-temperature-induced LTRE: low temperature responsive element
MADS-box: faktor transkripsi pada perkembangan bunga MAPK: mitogen activated protein kinase
MAPKK: MAPK kinase
MAPKKK: MAPK kinase kinase
MSA: metil asam salisilat
nahG: gen penyandi salisilat hidroksilase pada Psudomonas putida NHI1: NPR-homolog 1
NIM1: nama lain untuk NPR1 NPR1: non-expresser of PR genes 1
OmpR: regulator respons pada sistem dua komponen Escherichia coli OSBZ8: Oryza sativa b-Zip padi yang terinduksi kuat oleh ABA Oshox: Oryza sativa homeobox
OsZIP-1a: homolog EMBP1
otsA: penyandi biosintesis trehalose dari Escherichia coli otsB: penyandi biosintesis trehalose dari Escherichia coli
p5cs: pyrroline-5-carboxylate reductase
PCR: polymerase chain reaction
PHD-finger: plant homeodomain finger
pmsB: gen penyandi isokorismat piruvat liase dari Pseudomonas fluorescens
PO4 konstruksi promoter Oshox4 yang difusikan dengan gen GUS PR: pathogenesis related protein
PR: pathogenesis related protein
rab18: responsive ABA 18
rd28A: responsive to dehydration
rd29A: responive dehydration29A
RNA: asam ribonukleat
RNAi: RNA interference
RNAi-Oshox4: konstruksi RNAi untuk menekan transkripsi gen Oshox4
xvi
SA GTase: UDP-glukosa SA glukosiltransferase
SA: salicylic acid
SABP: SA binding protein
sacB: gen penyandi fruktan dari Bacillus subtilis SAG: SA 2-O-β-D-glukosida
SAR: systemic acquired resistance
SCOF-1: faktor transkripsi dari kedelai SDS: sodium dodecyl sulfate
sid1: SA-induced defence
SLN1: homolog OmpR pada sistem dua komponen Saccharomyces cereviseae
SNI1: suppressor of npr1 inducible SSDB: sequence specific DNA-binding
SSK1: homolog OmpR pada sistem dua komponen Saccharomyces cereviseae
TAIL: thermal asymmetric interlaced TALE: 3-aa acid loop extension
T-DNA: utas nukleotida yang merupakan bagian dari sistem penginduksi tumor yang dimiliki oleh Agrobacterium tumefaciens yang terintegrasi dalam genom tanaman
TF: faktor transkripsi
TGA: faktor transkripsi anggota dari bZIP
TMV: tobacco mosaic virus
Vahox1: HD-Zip tomat yang berperan dalam program cell death WRKY: kelas faktor transkripsi yang ditandai dengan urutan asam
1 Latar belakang
Padi (Oryza sativa L.) merupakan salah satu tanaman pangan pokok
penting dunia yang dikonsumsi oleh sekitar tiga miliar penduduk dunia. Di Indonesia padi merupakan tanaman yang bernilai strategis karena lebih dari 50% dari total kalori penduduk Indonesia berasal dari padi (beras). Oleh karena itu Faktor tersebut yang menyebabkan padi dibudidayakan secara intensif baik melalui usaha intensifikasi maupun ekstensifikasi. Dua dari 23 spesies genus
Oryza yaitu Oryza O. sativa dan Oryza glaberrima merupakan spesies yang
dibudidayakan sejak lama (Ge et al. 1999). Di Indonesia, produksi padi
ditingkatkan dari tahun ke tahun, dari 1.76 ton/ha pada tahun 1961 menjadi 4.57 ton/ha pada tahun 2005. Sejumlah kultivar dari spesies ini telah dikembangkan pada lahan budidaya sawah antara lain melalui penggunaan IR36 pada tahun 1976, PB 42 dan Cisadane di tahun 1980, IR64 padasaat tahun 1985, dan Mamberamo pada tahun 1995.
Usaha intensifikasi dengan penggunaan kultivar-kultivar tersebut merupakan salah satu faktor yang mengantarkan Indonesia pada swasembada beras pada tahun 1984. Seiring dengan berjalannya waktu, usaha intensifikasi dengan kultivar terbatas, dandan luasan lahan sawah yang tetap tidak dapat memenuhi kebutuhan konsumsi beras di Indonesia yang terus meningkat. Konsumsi beras di Indonesia pada tahun 2000 mencapai 30.8 juta ton dan diprediksi pada tahun 2020 akan menjadi 42.3 juta ton. Dengan kondisi tersebut, Indonesia harus mengimpor beras untuk mencukupi kebutuhan beras nasional. Impor beras pada akhir 2005 telah mencapai 70 ribu ton (BPS 2005).. Jika produksi beras nasional konstan tiap tahun dan lahan pertanian sekitar 0.1 juta ha, maka untuk mencukupi kebutuhan beras tersebut diperlukan lahan baru sekitar 600 juta (BPS, 2005).
Pada saat ini lahan sawah sudah jenuh oleh sistem pertanaman yang sudah ada, sehingga upaya untuk meningkatkan produksi padi nasional sebaiknya diarahkan pada areal tanam di lahan-lahan marginal dengan sistem pertanian padi padi lahan kering, gogo, dan gogorancah (perpaduan sistem gogo dan sawah). Masalahnya, lahan-lahan marginal yang ada biasanya mempunyai kendala dalam
Formatted: Spanish (Mexico)
ketersediaan air yang berpotensi untuk terpaparnya tanaman padi oleh kondisi kekeringan.
Kira-kira 90% budidaya padi dipengaruhi oleh kekeringan yn.ang dapat Terpaparnya padi oleh kondisi kekeringan bisa berakibat pada menurunnya produktivitas. Untuk menjaga produktivitas padi di lahan-lahan tersebut perlu dikembangkan kultivar yang beradaptasi dengan lahan kering dan bermenghasilkan produksi tinggi. Pemuliaan konvensional dengan bantuan marka molekular atau melalui rekayasa genetika telah dikembangkan untuk mendapatkan varietas padi tahan kekeringan (O’toole 2004). Caranya adalah dengan mengintroduksi sifat tahan kering melalui protein fungsional dengan tujuan mengatur dan melindungi metabolisme sel padi serta mendetoksifikasi senyawa beracun selama tanaman padi tercekam terpapar kekeringan.
Pendekatan lain yang potensial untuk dikembangkan guna mendapatkan padi tahan kekeringan adalah dengan mengontrol gen protein regulator yaitu gen protein yang berperan dalam mengatur ekspresi protein gen fungsional. Dengan mengontrol gen protein regulator diharapkan dapat mengatur ekspresi sejumlah gen protein fungsional atau regulator lain yang berada di bawah kendali gen protein regulator tersebut. Salah satu keluarga gen protein regulator yang hanya terdapat pada tanaman adalah gen yang mengkode protein homeodomain leucine zipper (HD-Zip). Protein HD-Zip dicirikan oleh adanya homeodomain yang berdampingan langsung dengan motif leusin zipper. yang berulang. Protein HD-Zip merupakan faktor transkripsi yang memiliki peran penting pada tanaman dalam merespon sinyal lingkungan (Schena et al. 1993), termasuk salah satunya sinyal terhadap kekeringan.
Berkaitan dengan tanaman padi, sejumlah gen HD-Zip padi telah diidentifikasi (Meijer et al. 2000). Salah satu gen dari famili HD-Zip II padi, yaitu
gen Oshox1 diperkirakan berfungsi dalam perkembangan tanaman antara lain
sebagai penentu spesifikasi sel pada perkembangan jaringan pembuluh (Scarpella
et al. 2000; Scarpella et al. 2002). Walaupun demikian, respon gen-gen HD-Zip
padi pada saat mengalami cekaman abiotik, misal: kekeringan, belum pernah dievaluasi. Oleh sebab itu perlu dilakukan karakterisasi gGen HD-Zip padi yang
Formatted: Spanish (Mexico)
Formatted: Spanish (Mexico)
Formatted: Spanish (Mexico)
memiliki potensi untuk dimanfaatkan pada program perbaikan genetik tanaman padi tahan kekeringan. Sampai saat ini belum pernah dilakukan kKarakterisasi dan analisis fungsional untuk memahami fungsi dari gen-gen famili HD-Zip.sampai saat ini belum pernah dilakukan. Untuk mengetahui fungsi gen dalam suatu tanaman dapat dipelajari melalui 3 metode yaitu dengan meningkatan tingkat ekspresinya (over expression), menghilangkan ekspresi (knockout), dan
mengidentifikasi pola ekspresi gen tersebut.
Meskipun metode kontrol protein regulator gen HD-Zip diharapkan dapat mengatasi akibat buruk yang ditimbulkan oleh kondisi kekeringan, namun dibutuhkan pendekatan lain untuk mengembangan sistem pertahanan tanaman padi pada saat terpapar kekeringan. Cekaman kekeringan mengakibatkan tanaman padi rentan terhadap cekaman lain termasuk cekaman biotik, misalnya penyakit blas. Kondisi tanah yang aerob, kekeringan, dan kandungan nitrogen yang tinggi
pada tanah merupakan kondisi ideal bagi berkembangnya Magnaporthe grisea.
Magnaporthe grisea merupakan cendawan yang menyebabkan bertanggung jawab
pada munculnya penyakit blas. Penyakit blas menyerang sampai 12% dari luas
areal padi di Indonesia (Utami et al. 2005). Oleh sebab itu penyakit blas
merupakan penyakit penting pada areal pertanian padi sistem sawah dan gogo. Ketahanan tanaman padi terhadap penyakit blas, terutama pada saat kondisi kekeringan, dapat ditingkatkan melalui kontrol sinyal yang berperan dalam mekanisme pertahanan biotik seperti asam salisilat (SA). Hasil penelitian yang ada menunjukkan bahwa kandungan asam salisilat pada padi berkorelasi positif dengan ketahanan terhadap serangan blas (Silverman et al. 1995). Pada
tanaman dan mikroorganisme, asam salisilat atau produk perantaranya disintesis melalui beberapa lintasan metabolime. Asam salisilat dapat dibentuk melalui lintasan fenilalanin atau asam korismat. Lintasan biosintesis asam salisilat melalui isokorismat adalah lintasan penting untuk ketahanan tanaman terhadap cekaman biotik (Wildermuth et al. 2001). Jika produksi asam salisilat melalui isokorismat
dapat ditingkatkan maka diharapkan ketahanan tanaman padi dapat meningkat. Asam salisilat dapat diproduksi dengan mengubah asam korismat menjadi isokorismat oleh enzim isokorismat sintase yang selanjutnya dikonversi menjadi asam salisilat oleh enzim isokorismat piruvat liase.
Formatted: Swedish (Sweden)
Formatted: Swedish (Sweden)
Sejumlah mikroorganisme memiliki gen yang mengkode kedua enzim tersebut. Escherichia E. coli memiliki gen entC yang menyandi enzim
iso-korismat sintase sedangkan Pseudomonas fluorescens memiliki gen pmsB yang
menyandi iso-korismat piruvat liase. Masing-masing gen tersebut memerlukan promoter tanaman agar dapat terekspresi pada sel tanaman. Introduksi kedua gen tersebut ke dalam tembakau di bawah kendali promoter virus tanaman memperlihatkan peningkatan ketahanan terhadap penyakit pada tembakau transgenik (Verberne et al. 2000). Konstruksi gen yang menyandi kedua enzim ini
telah tersedia untuk penelitian, sehingga . Dengan demikian, gen-gen iso-korismat sintase dan iso-korismat piruvat liase dapat ditransformasikan ke dalam tanaman padi dan ekspresinya diharapkan dapat meningkatkan konsentrasitingkat asam salisilat pada tanaman padi. Tingkat asam salisilat yang tinggi diharapkan dapat menjadi pembatas terhadapcegah serangan penyakit blas pada padi.
2 Tujuan dan manfaat penelitian
2.1 Tujuan penelitian
Secara umum, tujuan penelitian ini adalah meningkatkan ketahanan tanaman padi terhadap kekeringan dan penyakit blas dengan menganalisis fungsi gen famili HD-Zip padi yang respon terhadap kondisi kekeringan dan mengintroduksi gen-gen penyandi lintasan biosintesis asam salisilat untuk ketahanan terhadap penyakit blas. Perakitan tanaman padi yang tahan kekeringan dan penyakit blas diharapkan dapat membantu pengembangan penanaman padi dengan sistem lahan kering pada lahan marginal. Dampak dari perluasan penanaman padi di lahan-lahan marginal ini akan meningkatkan produksi beras nasional dan mengurangi jumlah impor beras.
Sedangkan tujuan khusus penelitian ini adalah untuk: (i) mengkarakterisasi salah satu gen tanaman padi keluarga HD-Zip yang diketahui memperlihatkan respon saat padi tercekamterpapar kekeringan setelah dilakukan penapisan gen-gen HD-Zip padi yang merespon cekaman kekeringan; (ii) mengintroduksi gen-gen penyandi lintasan biosintesis asam salisilat yang berasal dari bakteri ke dalam genom tanaman padi.
Formatted: Font: Not Bold
Untuk merealisasikan tujuan tersebut dilakukan serangkaian percobaan dilakukan yang meliputi: (1) penapisan gen HD-Zip yang merespon kekeringan, (2) peningkatkan ekspresi (overexpression) gen Oshox4 yang merupakan salah
satu gen HD-Zip di bawah kendali promoter konstitutif 35S dari CaMV, (3) penghilangan (knockout) atau penurunan (knockdown) ekspresi gen Oshox4
menggunakan RNAi, (4) studi pola ekspresi gen Oshox4, (5) transformasi
gen-gen penyandi lintasan biosintesis asam salisilat yaitu gen-gen entC dan gen pmsB ke
tanaman padi, (6) analisis integrasi dan ekspresi gen entC dan gen pmsB pada
level transkripsi dengan analisis Southern dan Northern, dan (7) analisis kandungan asam salisilat pada tanaman trangenik. Secara keseluruhan diagram alur penelitian disajikan pada Gambar 1.
2.2 Manfaat penelitian
Manfaat yang diperoleh dari hasil penelitian karakterisasi gen-gen famili HD-Zip terhadap cekaman kekeringan adalah tersedianya informasi tentang gen HD-Zip yang responsif terhadap cekaman kekeringan. Manfaat lebih jauh adalah diperoleh sumber gen yang dapat digunakan sebagai gen donor untuk merakit padi transgenik yang tahan kekeringan.
TINJAUAN PUSTAKA
1 Kekeringan
1.1 Budidaya padi dan kekeringan
Tanaman padi telah dibudidayakan di berbagai kondisi lingkungan seperti sawah tadah hujan, air-dalam, pasang surut, ladang atau/ gogo, dan sawah irigasi (FAO 2004). Tanaman padi yang dibudidayakan saat ini adalah hasil evolusi tanaman padi semiakuatik (O’toole 2004). Proses seleksi buatan dan seleksi alam telah memungkinkan padi dibudidayakan pada lahan kering dan basah. Budidaya padi lahan kering meliputi budidaya padi ladang dan gogo, sedangkan budidaya lahan basah meliputi budidaya padi di sawah, rawa, lebak, dan air-dalam. Istilah ladang dipakai untuk sistem pada pertanian lahan berpindah yang menghendaki adanya pembukaan lahan pada awal siklusnya, sedangkan sistem gogo tidak mengenal pembukaan lahan. Sistem gogo dan sawah dapat dipadukan menjadi sistem gogorancah.
Pada sistem padi sawah, air merupakan kebutuhan mutlak. Sumber air pada sawah dapat berasal dari irigasi, tadah hujan, pasang surut, rawa pasang surut, dan lebak. Luas areal pertanaman padi di Indonesia diperkirakan 11 juta hektar meliputi 69% sawah beririgasi, 16% lahan tadah hujan, dan 15% sawah pasang surut (Suprapto 2002). Kira-kira 16-20% dari total luas areal pertanaman padi di Indonesia tersebut rentan terhadap cekaman kekeringan (Pandey & Bhandari 2006). Kekeringan merupakan masalah utama pada budidaya padi sistem sawah tadah hujan dan gogo. Kekeringan juga dapat mengancam sawah irigasi yang terjadi akibat meningkatnya tingkat kerusakan di daerah aliran sungai yang berpengaruh pada ketersediaan air irigasi sepanjang tahun. Sistem budidaya padi air-dalam juga rentan kekeringan jika pada saat bibit tidak segera mendapat air.
definisi kekeringan (Jodo 1995) sehingga kekeringan tidak selalu berhubungan dengan kurangnya curah hujan.
Kekeringan memberi pengaruh pada tekanan osmosis sel tanaman (Shinozaki & Yamaguchi-Shinozaki 1997). Cekaman kekeringan memiliki pengaruh yang nyata pada penurunan produktivitas tanaman. Kekeringan dapat mengancam budidaya padi pada fase vegetatif dan generatif. Tinggi tanaman, jumlah anakan, dan luas daun adalah hal yang terpengaruh jika cekaman kekeringan terjadi pada fase vegetatif. Penurunan jumlah malai dapat terjadi apabila padi terpapar kekeringan pada fase generatif. Cekaman kekeringan terjadi apabila jumlah air yang terbatas telah berpotensi untuk mengakibatkan kerusakan pada proses fisiologi. Kondisi ini mempengaruhi sifat fisik tanah, komposisi hara tanah, dan interaksi biologi tanaman padi dengan hama, penyakit, dan tanaman lainnya. Kondisi tanah yang aerobik, cekaman kekeringan, dan kandungan nitrat tinggi merupakan kondisi ideal bagi berkembangnya penyakit blas yang disebabkan oleh Magnaporthe grisea.
Tanaman akan memberikan respon yang berbeda-beda bila dihadapkan pada kondisi yang kurang menguntungkan bagi lingkungan tumbuhnya. Ada sekelompok tanaman yang mampu bertahan sementara kelompok lainya tidak bisa bertahan pada kondisi cekaman yang sama. Ketahanan terhadap kekeringan dapat berarti kestabilan hasil atau kemampuan bertahan pada kondisi kekeringan (Price
et al. 2002). Strategi tahan yang dikembangkan dapat dikelompokkan menjadi
tiga, yaitu melarikan diri (escape), menghindar (avoidance), dan toleran membiarkan diri terpaparterhadap cekaman (tolerance). Tanaman tidak terpapar
cekaman kekeringan pada strategi escape dan avoidance karena tanaman mampu
Gambar 2 Mekanisme toleransi kekeringan dan respon tanaman saat terpapar kekeringan (Bartels & Sunkar 2005). Tanda panah menunjukkan arah pengaruh; kotak: bentuk respon sel; +: memberi pengaruh meningkatkan; -: memberi pengaruh menurunkan; ROS: spesies oksigen reaktif. Kotak menggambarkan proses dalam sel.
Padi tahan kering yang ideal adalah padi yang memberikan hasil panen lebih tinggi dibandingkan padi lain apabila terpapar pada cekaman kekeringan dan tetap berpenampilan baik bila tidak ada cekaman kekeringan (Fukai & Cooper 1995). Sifat yang terdapat pada padi tahan kering dapat dibedakan menjadi sifat yang secara konstitutif terekspresi atau sifat yang responsif hanya bila ada kekeringan (Blum 2002; Blum 2005). Sifat konstitutif tidak dipengaruhi oleh ada tidaknya cekaman. Sifat responsif muncul pada saat tanaman terkena cekaman kekeringan dan merupakan proses adaptasi tanaman. Yang tTermasuk sifat yang konstitutif adalah pemrbungaan, akar, sifat permukaan daun, kemampuan tetap hijau, dan kandungan karbohidrat dan nitrogen batang. Beberapa sifat yang termasuk responsif adalah munculnya senyawa dan protein pelindung dari keracunan akibat kekeringan serta perubahan komposisi ekspresi protein.
1.2 Cekaman kekeringan: respon tanaman dan upaya rekayasa genetika untuk meningkatkan toleransi tanaman
Sejumlah faktor menentukan bentuk respon padi terhadap kekeringan. Faktor-faktor tersebut adalah genotipe, tahap perkembangan, dan tipe sel. Bentuk respon faktor tersebut ditentukan oleh jumlah air yang hilang dan laju kehilangan air (Bray 1993; Bray 1997). Laju kehilangan air yang lambat diperlukan untuk mengurangi proses kerusakan sel sehingga memungkinkan tanaman dapat kembali pada kondisi semula. Tiga aspek penting dalam kemampuan tanaman untuk kembali ke kondisi semula adalah (1) homeostatis ion; kontrol kerusakan, perbaikan, (2) detoksifikasi akibat cekaman; dan (3) kontrol pertumbuhan (Zhu 2002). Laju kehilangan air yang cepat berakibat pada hilangnya kemampuan sel untuk kembali pada kondisi fisiologi normal.
Kekeringan memberikan cekaman osmotik yang mempengaruhi tekanan turgor sel dan cekaman oksidatif. Keseimbangan ion intraseluler menjadi terganggu pada saat terjadi cekaman kekeringan. Sel akan mensintesis senyawa tertentu yang berfungsi menyeimbangkan tekanan. Sel juga akan menghasilkan protein yang mampu melindungi sel dari keracunan dan memperbaiki kerusakan sel pada saat yang sama. Disamping itu, sel akan mengaktifkan atau menon-aktifkan sejumlah gen untuk merespon cekaman kekeringan yang diterimanya. Gen dengan pola ekpresi yang responsif merupakan gen yang terlibat dalam mekanisme adaptif padi terhadap kekeringan. Hasil respon ekspresi gen mempunyai fungsi dalam mekanisme mentolerir cekaman dan juga mengatur ekspresi dan penyampaian sinyal ketahanan terhadap cekaman kekeringan (Yamaguchi-Shinozaki & Shinozaki 2005). Sejumlah gen yang teraktivasi umumnya terkait dengan fungsi perbaikan dan kontrol kerusakan serta detoksifikasi (Zhu 2002). Toleransi cekaman kekeringan juga melibatkan represi dari sejumlah gen. Transkripsi dari gen-gen yang terlibat dalam fotosintesis pada tanaman Craterostigma plantagineum dilaporkan mengalami penurunan ekspresi
pada saat tanaman terpapar kekeringan (Ingram & Bartels 1996). Proses ini diperlukan untuk proses toleransi tanaman terhadap cekaman kekeringan.
protein yang berfungsi langsung dalam melindungsi sel (protein fungsional). Kelompok kedua adalah gen yang menyandi protein yang mengatur ekspresi gen lain pada saat cekaman kekeringan (protein regulator) (Yamaguchi-Shinozaki et
al. 2002). Apabila intensitas cekaman kekeringan yang diteriman sel meleibihi
batas kemampuan yang dapat diterimanya maka sel akan menghancurkan dirinya sendiri melalui apoptosis.
Gambar 3 Penerimaan dan respon sel saat terpapar cekaman kekeringan.Kekeringan akan mengubah komposisi protein regulator atau fungsional sel untuk keperluan adaptasi sel (Shinozaki & Yamaguchi-Shinozaki 1997).
Proses adaptasi terhadap cekaman diawali dengan pengindraan dan penyampaian sinyal secara berurutan yang dikategorikan sebagai proses jangka pendek. Lokasi subseluler dari reseptor dan jumlah reseptor yang terlibat dalam pengindraan cekaman kekeringan masih belum jelas (Ingram & Bartels 1996; Bray 1997). Respon jangka pendek memiliki peran dalam respon jangka panjang (Chaves et al. 2003). Respon jangka panjang dapat berbentuk antara lain
penggulungan daun, pengurangan laju respirasi, dan elongasi akar.
Cekaman oksidatif sebagai akibat cekaman kekeringan mengakibatkan peningkatan unsur senyawaspecies reaktif oksigen (ROS) (Vranova et al. 2002).
karbohidrat, dan asam nukleat (Blokhina et al. 2003). Dalam kondisi ini
dibutuhkan protein yang berperan dalam mekanisme detoksifikasi dan proteksi sel. Tanaman memiliki sejumlah enzim dan antioksidan yang berfungsi menetralkan ROS (Rodriguez & Redman 2005). Peningkatan ROS akan diubah oleh sejumlah enzim seperti katalase dan askorbat peroksidase sehingga jumlahnya menurun pada saat cekaman abiotik (Mittler 2002) (Gambar 4). Superoksida dismutase (SOD) pertama sekali mengkonversi O2- menjadi H2O2. Askorbat peroksidase (APX), GPX, dan CAT selanjutnya akan mendetoksifikasi H2O2. Askorbat (AsA) dibutuhkan oleh APX sementara glutation (GSH) dibutuhkan oleh GPX untuk regenerasi siklus pda gambar 4A-4C. Siklus ini menggunakan elektrron yang dihasilkan dari fotosintesis (4A) atau NAD(P)H Ekspresi superoksida dismutase pada alfalfa (Medicago sativa L.) transgenik
mampu meningkatkan toleransi terhadap cekaman kekeringan (Samis et al. 2002).
Ekspresi katalase katE dari Escherichia E. coli pada kloroplas tembakau mampu
menahan laju hilangnya klorofil pada saat kekeringan (Miyagawa et al. 2000). Lintasan penyampaian sinyal cekaman kekeringan dimulai dari penerimaan sinyal. Sinyal akan diteruskan oleh caraka ke dua. Caraka ke dua pada proses ini adalah inositol fosfat dan unsur ROS. Caraka ke dua memiliki peran antara lain mengatur kadar Ca+2 intraseluler, mengawali proses fosforilasi protein target yang
terlibat dalam fungsi proteksi, dan juga mengontrol faktor transkripsi (Xiong et al.
2002; Boudsocq & Lauriere 2005). Kekeringan akan menaikkan konsentrasi kalsium bebas di sitosol ([Ca+2]
Cyt) melalui ROS. Kondisi ini merangsang
pembukaan saluran kalsium pada membran vakuola (Finkelstein et al. 2002).
Perubahan kalsium ditingkat seluler diterima oleh protein pengikat kalsium dan sensor molekul. Perubahan ini mampu menginduksi sejumlah gen antara lain gen
p5cs, rab18 (Lang & Palva 1992; Lang et al. 1994), dan Iti78 (Knight et al. 1997).
Sensor Ca+2 tumbuhan antara lain adalah kalmodulin (CaM) (Zielinski 1998; Snedden & Fromm 1997; Luan et al. 2002), protein kinase yang mengandung
domain CaM (CDPK) (Sanders et al. 2002), dan calcineurin B-like (CBL). Sensor
kalsium mempunyai pola pengaturan yang berbeda pada respon cekaman kekeringan, salinitas, dan suhu rendah (Cheong et al. 2003). CDPK berfungsi
sebagai sensor dan kinase. CaM dan CBL merupakan protein yang mengikatCa+2.
Keduanya berfungsi melalui interaksi dengan protein target. Protein kinase yang berinteraksi dengan CBL (CIPK) adalah protein target dari CBL (Luan et al.
2002). Calcineurin B merupakan homolog sensor kalsium SOS3 dari yeast
berperan pada ketahanan salinitas (Liu & Zhu 1998). CBL1 merupakan regulator positif untuk kekeringan dan salinitas. CBL1 juga menjadi regulator negatif untuk suhu rendah. CIPK3 diidentifikasi berperan dalam hubungan-lintas interaksi antara asam absisat (ABA) dan lintasan transduksi sinyal abiotik (Kim et al.
Gambar 4 Lintasan penghilangan ROS (spesies oksigen reaktif) pada tanaman(Mitler 2002). A. Siklus air-air. B. Siklus glutation-askorbat C. Siklus glutation peroksidase (GPX). D. Katalase (CAT). PSI fotosistem I; SOD: superoksida dismutase; MDA monodihidroaskorbat; AsA: askorbat; tAPX: tilakoid APX; DHA dihidroaskorbat; MDAR: MDA reduktase; GSH: glutation; GSSG glutation teroksidasi; DHAR: DHA reduktase; GR: glutation reduktase.
Lintasan penyampaian sinyal cekaman kekeringan dimulai dari penerimaan sinyal. Sinyal akan diteruskan oleh caraka kedua. Caraka kedua pada proses ini adalah inositol fosfat dan unsur ROS. Caraka kedua memiliki peran antara lain mengatur kadar Ca+2 intraseluler, mengawali proses fosforilasi protein target yang
terlibat dalam fungsi proteksi, dan juga mengontrol faktor transkripsi (Xiong et al.
2002; Boudsocq & Lauriere 2005). Kekeringan akan menaikkan konsentrasi kalsium bebas di sitosol ([Ca+2]
Cyt) melalui ROS. Kondisi ini merangsang
Perubahan kalsium ditingkat seluler diterima oleh protein pengikat kalsium dan sensor molekul. Perubahan ini mampu menginduksi sejumlah gen antara lain gen
p5cs, rab18 (Lang & Palva 1992; Lang et al. 1994), dan Iti78 (Knight et al. 1997).
Sensor Ca+2 tumbuhan antara lain adalah kalmodulin (CaM) (Zielinski 1998; Snedden & Fromm 1997; Luan et al. 2002), protein kinase yang mengandung
domain CaM (CDPK) (Sanders et al. 2002), dan calcineurin B-like (CBL). Sensor
kalsium mempunyai pola pengaturan yang berbeda pada respon cekaman kekeringan, salinitas, dan suhu rendah (Cheong et al. 2003). CDPK berfungsi
sebagai sensor dan kinase. CaM dan CBL merupakan protein yang mengikatCa+2. Keduanya berfungsi melalui interaksi dengan protein target. Protein kinase yang berinteraksi dengan CBL (CIPK) adalah protein target dari CBL (Luan et al.
2002). Calcineurin B merupakan homolog sensor kalsium SOS3 dari yeast
berperan pada ketahanan salinitas (Liu & Zhu 1998). CBL1 merupakan regulator positif untuk kekeringan dan salinitas. CBL1 juga menjadi regulator negatif untuk suhu rendah. CIPK3 diidentifikasi berperan dalam hubungan-lintas interaksi antara asam absisat (ABA) dan lintasan transduksi sinyal abiotik (Kim et al.
2003).
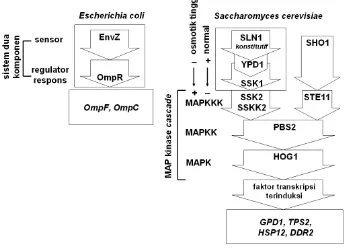
Sel dapat menerima cekaman kekeringan dengan menggunakan sistem dua komponen (Gambar 5). Sistem dua komponen pada Escherichia E. coli terdiri dari
osmosensor EnvZ dan regulator respon OmpR. Keduanya mentransmisikan
informasi cekaman osmotik dari permukaan sel. Sistem dua komponen pada eukariotik memiliki sinyal tambahan berupa modul mitogen-activated protein
kinase (MAPK). Modul ini dibutuhkan untuk membawa informasi tentang
cekaman osmotik ke tingkat ekspresi gen. Homologi sistem dua komponen pada kapang terdiri dari osmosensor SLN1, protein penyambung YPD1, dan respon regulator SSK1. Pada kondisi osmotik normal, SLN1 aktif secara konstitutif dan memfosforilasi regulator respon SSK1. SSK1 yang aktif akibat fosforilasi akan menekan aktivitas dua MAPKKK yaitu SSK2 dan SSKK2. Represi ini menon-aktifkan modul MAPK sehingga high osmolarity glycerol 1 (HOG1) menjadi
Arabidopsis thaliana (AtHK1). Sel tumbuhan yang mengkerut akibat cekaman osmotik menjadi rangsangan mekanik. Protein AtHK1 diduga merupakan osmosensor yang mengontrol sinyal cekaman pada modul MAPK (Urao & Yamaguchi-Shinozaki 2002).
Gen responsif cekaman kekeringan dapat memiliki elemen cis dan atau trans
(Ingram & Bartels 1996; Shinozaki et al. 2003; Rabbani et al. 2003). Beberapa
gen-gen terinduksi ABA mempunyai elemen cis- yang responsif terhadap ABA
(ABRE; ACGTGG/TC) pada daerah promoter (Bonetta & McCourt 1998). Beberapa faktor basic regionleucine zipper (bZIP) EmBP1, OSBZ8, dan
osZIP-1a yang berikatan dengan ABRE telah diisolasi (Ko & Kamada 2002). Promoter gandum HVA1 mempunyai elemen CE3 (ACGCGTGTCCTG)) dan ABRE. Elemen CE menginduksi ekspresi gen melalui ABA (Shen & Ho 1995). Walaupun demikian, urutan basa A/GCGT tidak mutlak diperlukan sebagai bagian dari CE (Rogers & Rogers 1992; Shen & Ho 1995; Kao et al. 1996; Hobo
et al. 1999). Jumlah salinan ABRE dapat meningkatkan respon gen oleh ABA
(Skriver et al. 1991). Promoter gandum Em memiliki dua motif ABRE yaitu
Em1a dan Em1b yang memiliki peran besar dalam aktivasi gen (Guiltinan et al.
1990). Gen dengan ABRE pada daerah promoter akan diaktifkan oleh faktor
trans. AREB1, AREB2, dan AREB3 merupakan faktor transkripsi dari tipe bZIP
yang berperan sebagai protein yang berikatan dengan ABRE pada rd29B (Uno et
al. 2000). Protein lain yang identik dengan AREB1 dan AREB2 adalah ABF
(Choi et al. 2000).
Gambar 5 Sistem dua komponen pada Escherichia E. coli dan Saccharomyces serevisiae (Kultz & Burg 1998). Huruf miring menunjukkan gen yang
dipengaruhi.
Gen responsif cekaman kekeringan dapat memiliki elemen cis dan atau
trans (Ingram & Bartels 1996; Shinozaki et al. 2003; Rabbani et al. 2003).
Beberapa gen-gen terinduksi ABA mempunyai elemen cis- yang responifresponsif
terhadap ABA (ABRE; ACGTGG/TC) pada daerah promoter (Bonetta & McCourt 1998). Beberapa faktor basic region leucine zipper (bZIP) EmBP1,
OSBZ8, dan osZIP-1a yang berikatan dengan ABRE telah diisolasi (Ko & Kamada 2002). Promoter gandum HVA1 mempunyai elemen CE3 (ACGCGTGTCCTG)) dan ABRE. Elemen CE menginduksi ekspresi gen melalui ABA (Shen & Ho 1995). Walaupun demikian, urutan basa A/GCGT tidak mutlak diperlukan sebagai bagian dari CE (Rogers & Rogers 1992; Shen & Ho 1995; Kao
et al. 1996; Hobo et al. 1999). Jumlah salinan ABRE dapat meningkatkan respon
ABRE yaitu Em1a dan Em1b yang memiliki peran besar dalam aktivasi gen (Guiltinan et al. 1990). Gen dengan ABRE pada daerah promoter akan diaktifkan
oleh faktor trans. AREB1, AREB2, dan AREB3 merupakan faktor transkripsi dari
tipe bZIP yang berperan sebagai protein yang berikatan dengan ABRE pada
rd29B (Uno et al. 2000). Protein lain yang identik dengan AREB1 dan AREB2
adalah ABF (Choi et al. 2000).
Sejumlah gen seperti cor15a dan rd29A terinduksi melalui lintasan
yang tidak melibatkan ABA. Promoter gen-gen tersebut memiliki urutan basa khusus yang merespon kekeringan DRE (TACCGACAT). Elemen cis dengan
motif yang serupa dengan G/ACCGAC ditemukan pada CRT dan LTRE (Baker et
al. 1994; Jiang et al. 1996; Thomashow 1999). CRT dan LTRE merupakan
elemen yang berperan pada respon suhu rendah. Gen yang mengandung elemen
cis DRE akan diaktifkan oleh faktor transkripsi yang berikatan dengan daerah
tersebut yaitu DREB/CBF (Stockinger et al. 1997; Liu et al. 1998). Peningkatan
tingkat ekspresi protein AP2/EREBP CBF-1 dapat meningkatkan toleransi terhadap dingin dan DREB1a dapat meningkatkan toleransi terhadap kekeringan atau salinitas atau dingin pada ArabidopsisA.thaliana (Jaglo-Ottosen et al. 1998;
Kasuga et al. 1999; Yamaguchi-Shinozaki & Shinozaki 2001).
Tanaman akan memproduksi osmoprotektan pada sel saat terjadi cekaman. Osmoprotektan berfungsi menjaga sel dari ROS. Osmoprotektan seperti trehalosa dan fruktan dihasilkan oleh beberapa mikroorganisme. Introduksi gen penyandi osmoprotektan asal mikrob dapat meningkatkan ketahanan terhadap kekeringan. Akumulasi trehalose pada padi transgenik menunjukkan peningkatan tingkat
toleransi terhadap cekaman kekeringan. Gen-gen yang diintroduksi adalah penyandi lintasan biosintesis trehalosa otsA dan otsB dari Escherichia E. coli (Wu
& Garg 2003). Ekspresi gen penyandi fruktan SacB dari Bacillus subtilis
meningkatkan ketahanan terhadap kekeringan pada tembakau transgenik (Pilon-Smits et al. 1995). Introduksi osmoprotektan yang lain seperti glisin betain dan
prolin juga mampu meningkatkan ketahanan tanaman terhadap cekaman kekeringan. Tanaman transgenik ArabidopsisA. thaliana mengandung gen penyandi biosintesis glisin betain mampu meningkatkan toleransi tanaman saat cekaman abiotik (Chen & Murata 2002). Peningkatan kandungan prolin pada padi
transgenik mampu memperbaiki ketahanan terhadap kekeringan (Cheng et al.
2001).
Hormon tumbuhan asam absisat (ABA) akan meningkat pada waktu terjadi cekaman kekeringan. Kenaikan tingkat konsentrasi ABA selama kekeringan terjadi karena ekspresi sejumlah gen yang mengatur biosintesis ABA (Xiong et al. 2002). ABA dapat mengaktifkan sejumlah gen (Leung & Giraudat
1998). Beberapa gen memperlihatkan respon kekeringan tanpa melalui sinyal ABA. Terdapat dua sinyal transduksi yang melibatkan ABA dan dua sinyal lainnya tidak melibatkan ABA pada respon tanaman terhadap cekaman kekeringan (Shinozaki & Yamaguchi-Shinozaki 1997). Lintasan yang tidak melibatkan ABA diperkirakan terekspresi lebih dahulu dibandingkan lintasan yang melibatkan ABA (Narusaka et al. 2003; Dubouzet et al. 2003).
1.3 Identifikasi gen potensial untuk padi tahan kering
Beberapa ciri fisiologi dan morfologi tanaman padi untuk bertahan pada saat cekaman kekeringan telah diidentifikasi (Fukai & Kamoshita 2005). Penundaan waktu berbunga, warna hijau dari daun yang lebih dominan, dan pembentukan malai setelah periode kering merupakan ciri penting untuk tanaman padi yang mampu bertahan dari cekaman kekeringan apabila cekaman datang pada fase vegetatif. Sedangkan ciri penting tanaman padi tahan cekaman kekeringan jika kekeringan menyerang pada fase generatif antara lain adalah waktu berbunga yang lebih awal, tidak ada penundaan waktu berbunga, kandungan air yang tinggi pada daun, dan sedikit jumlah daun yang mati. Identifikasi sifat tahan kering dapat dipakai sebagai dasar untuk mencari gen-gen yang terlibat dalam mekanisme tahan kering.
Pencarian sifat yang berperan penting dalam ketahanan kekeringan dari tanaman padi dapat dilakukan dengan mempelajari fungsi gen yang terlibat. Fungsi gen dipelajari dengan meningkatan tingkat ekspresinya (overexpression),
menghilangkan ekspresi (knockout), dan mengidentifikasi pola ekspresi gen
tersebut. Gen yang terlibat dapat diidentifikasi dengan pendekatan genetika
yang dapat memperlihatkan hilangnya ekspresi atau meningkatkan ekspresi suatu gen. Gen potensial dapat ditapis melalui tanaman hasil mutasi yang didapat. Pendekatan yang kedua adalah dengan mengisolasi gen yang diduga memiliki fungsi pada mekanisme kekeringan.
Tanaman dapat dimutasi menggunakan proses penyisipan T-DNA yang sifatnya acak pada kromosom padi. Kombinasi dengan Ac/Ds transposon memungkinkan percepatan koleksi mutan yang dihasilkan (Jin et al. 2004).
Daerah pembatas kanan atau kiri dari T-DNA Agrobacterium tumefaciens biasa dipakai sebagai penanda. Beberapa cara telah dilaporkan dapat mengetahui daerah yang disisip oleh T-DNA, antara lain dengan plasmid resque, inverse PCR
(Triglia et al. 1988; Does et al. 1991), atau TAIL (thermal asymmetric interlaced)
PCR (Liu & Whittieret al. 1995). Penggunaan pustaka cDNA telah dilakukan untuk mengidentifikasi sejumlah gen novel yang responsif saat terjadi cekaman
kekeringan pada padi Indica (Reddy et al. 2002). Selain itu, teknologi microarray
cDNA telah dilakukan untuk mengetahui ekspresi gen yang responsif pada saat cekaman kekeringan (Yamaguchi-Shinozaki et al. 2003). Teknik penapisan
diferensial telah dipakai untuk mengisolasi gen yang terinduksi kekeringan (Ingram & Bartels 1996).
2 HD-Zip (Homeodomain Leucine Zipper)
Gen HD-Zip merupakan gen yang mengkode protein HD-Zip yang berfungsi sebagai faktor transkripsi. Faktor transkripsi adalah urutan khusus asam amino yang mampu berikatan dengan DNA untuk mengontrol proses penempelan RNA polymerase pada DNA sehingga akan mengontrol proses transkripsi suatu gen (de Sauza et al. 2003). Identifikasi faktor transkripsi didasarkan pada domain khusus
dan daerah yang berperan dalam DNA-binding atau oligomerisasi (Liu et al.
1999). Faktor transkripsi dapat dikelompokkan menjadi tiga kelas yaitu faktor transkripsi umum, faktor transkripsi upstream, dan faktor transkripsi inducible.
Faktor transkripsi umum bersifat ubiquitous dan terlibat dalam pembentukan
komplek inisiasi awal pada daerah core-promoter di sekitar daerah awal
merupakan protein yang berikatan pada daerah upstream dari inisiasi transkripsi yang berfungsi untuk menginduksi atau menghambat proses transkripsi. Faktor transkripsi inducible adalah protein seperti faktor transkripsi upstream yang dapat
mengalami aktivasi atau penghambatan untuk ekspresinya sendiri.
Transkripsi menjadi langkah awal untuk ekspresi dan pengaturan tingkat ekspresi. Kontrol ekspresi gen pada tanaman merupakan hal esensial untuk regulasi proses biologi seperti pembentukan bagian tanaman, perkembangan, diferensiasi, dan respon terhadap beragam sinyal lingkungan (Yanasigawa 1998). Kontrol pada faktor transkripsi merupakan strategi yang menjanjikan untuk perbaikan toleran terhadap cekaman. Strategi ini memungkinkan pengaturan dengan kisaran luas atas sejumlah gen target. Ekspresi yang meningkat dari faktor transkripsi kedelai SCOF-1 dari famili zinc finger mampu meningkatkan toleransi
dingin pada tembakau transgenik tanpa mempengaruhi pertumbuhan normal dan sekaligus juga meningkatkan toleransi beku pada ArabidopsisA. thaliana transgenik.
Gambar 6 Urutan asam amino dari protein homeodomain Drosophila melanogaster antp (http://www.biosci.ki.se). Daerah dengan tanda
segitiga terbalik merupakan asam amino yang juga dimiliki oleh gen yang mengandung homeobox lainnya.
HD-Zip merupakan anggota dari kelompok homeodomain. Anggota lain dari kelompok homeodomain adalah plant HD finger (PHD-finger), HD GLABRA2
(HD-Zip IV), HD-Knotted1 (HD-KN1) atau KNOX (knotted-like homeobox) (Ito
et al. 2001), dan HD-BELL (Bel1-like) (Yang et al. 2002). HD-BELL dan KNOX
dapat dikelompokkan ke dalam kelas super TALE (3-aa acid loop extention).
Homeodomain memiliki fungsi pada proses penempelan DNA dan terdiri dari tiga heliks alfa (Gambar 7). Heliks alfa pertama membentuk posisi memutar terhadap heliks alfa kedua. Heliks alfa kedua akan membelok terhadap heliks alfa ketiga. Heliks alfa ketiga selanjutnya bersambungan dengan peptida yang mengandung
Formatted: Swedish (Sweden)
motif leusin zipper. Heliks alfa ke tiga memiliki peranan dalam pengenalan dan
penempelan daerah tertentu pada lekukan DNA. Heliks alfa kedua dan pertama akan memperkuat penempelan tersebut. Gen knotted1 (kn1) dari jagung
merupakan gen homeobox yang pertama diidentifikasi pada tanaman (Vollbrecht
et al. 1991).
Gambar 7 Model struktur protein HD-Zip. A. Protein HD-Zip terdiri dari dua motif. Motif HD berperan dalam pengikatan DNA pada ujung terminal N, sementara leucine zipper pada ujung terminal C berfungsi
untuk dimerisasi. B. Model struktur pengikatan HD-Zip dengan DNA (http://w3.uniroma1.it/centricnr-can/edocs/ire1.htm).
Motif leusin zipper yang bersambungan dengan homeodomain pada HD-Zip dinamakan daerah leucine zipper. Keberadaan leusin yang berulang pada urutan
tertentu menunjukkan fungsi untuk pembentukan gulungan yang bergelung untuk membentuk dimer (Sessa et al. 1993). Daerah dengan motif leusin mengandung
empat sampai lima leusin dengan motif khusus. Masing-masing leusin dipisahkan oleh enam asam amino. Dua buah protein HD-Zip akan membentuk dimer pada daerah motif membentuk gulungan yang bergelung. Dimer yang terbentuk seolah-olah akan membentuk zipper. Pembentukan zipper merupakan syarat awal untuk
proses penempelan DNA. Dua buah protein HD-Zip perlu berikatan membentuk dimer untuk dapat berfungsi. Protein dari kelas yang sama dapat membentuk homodimer atau heterodimer (Meijer et al. 1997).
HD-Zip diklasifikasikan menjadi empat famili yaitu I, II, III dan IV. Famili I-IV mampu mengenali pola urutan DNA tertentu yang akan diikatnya dalam bentuk pseudopalindromic (Tabel 1). Protein HD-Zip merupakan faktor
transkripsi. Protein HD-Zip akan berikatan sebagai dimer pada daerah pengenalan
pseudopalindromic (Tabel 1). Famili I dan II memiliki pseudopalindromic yang
mirip CAATNATTG kecuali pada daerah tengah (N) yaitu (A/T) pada famili I dan (G/C) pada famili II (Sessa et al. 1993; Meijer et al. 2000). Famili III
mengenali urutan DNA GTAAT(G/C)ATTAC dan TAAATG(C/T)A akan dikenali oleh famili IV (Sessa et al. 1998; Abe et al. 2001; Ohashi-Ito & Fukuda
2003).
Tabel 1 Target urutan nukleotidasekuens dari HD-Zip berupa psudopalindromic
HD-Zip Pseudopalindromic
Famili I CAAT(A/T)ATTG*
Famili II CAAT(G/C)ATTG*
Famili III GTAAT(G/C)ATTAC*
Famili IV CATT(A/T)AATG**
*Meijer et al. 2000
**Tron et al. 2001
Protein HD-Zip famili I dan II dibedakan berdasarkan jumlah asam amino leusin pada daerah leucine zipper. Jumlah leusin Famili I lebih banyak daripada Famili II (Meijer et al. 2000). Di samping itu, pada famili I dan II memiliki pola
intron-ekson khusus (Hendriksson et al. 2005). Famili III dan IV memiliki domain
START setelah daerah HD-Zip (Schrick et al. 2004). Famili IV memiliki motif
zipper loop zipper (Nakamura et al. 2006).
Protein HD-Zip diduga memiliki peran khusus dalam proses perkembangan yang berhubungan dengan sinyal lingkungan (Schena & Davis 1992; Meijer et al.
2000). Peran HD-Zip ini telah diidentifikasi pada beberapa tanaman seperti
Arabidopsis A. thaliana (Ruberti et al. 1991), Oryza O. sativa (Meijer et al.
1997), C. eraterostigma plantigineum (Frank et al. 1998), dan Physcomitrella
patens (Sakakibara et al. 2001). Ekspresi gen Athb6, Athb7, dan Athb12 (HD-Zip
I) dari ArabidopsisA. thalianadiinduksi oleh cekaman kekeringan (Söderman et
al. 1996; Lee & Chun 1998; Söderman et al. 1999). Beberapa gen HD-Zip Ceraterostigma plantagineum menunjukkan respon terhadap kekeringan (Frank et al. 1998; Deng et al. 2002). Pada tanaman padi yang memiliki sejumlah gen
HD-Zip, baru satu gen HD-Zip padi yang telah dikarakterisasi. Oshox1 (HD-Zip II)
padi diperkirakan berfungsi dalam perkembangan tanaman antara lain sebagai
penentu spesifikasi sel pada perkembangan jaringan pembuluh (Scarpella et al.
2000; Scarpella et al. 2002). Sejumlah gen-gen HD-Zip padi diperkirakan
memperlihatkan respon terhadap sinyal lingkungan antra lain kekeringan.
3 Asam salisilat (SA)
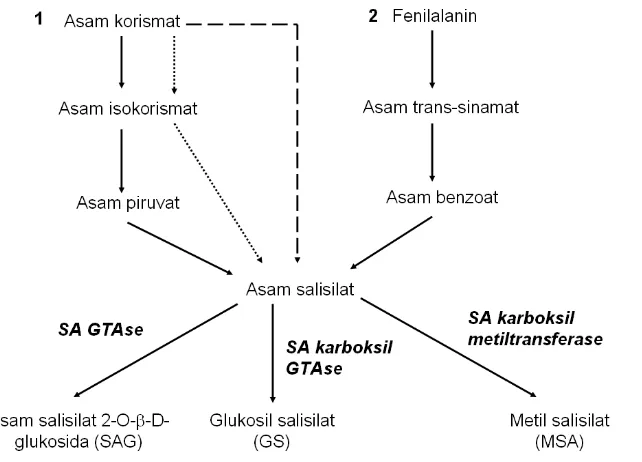
Tanaman dan mikroorganisme dapat mensintesis atau menghasilkan produk perantara asam salisilat melalui beberapa lintasan (Gambar 8). Asam salisilat dapat dibentuk melalui lintasan fenilalanin atau asam korismat pada tanaman. Produk perantara pembentukan asam salisilat menggunakan asam korismat dapat ditemui pada mikroorganisme seperti Pseudomonas P. fluorescens dan
Escherichia E. coli. Mikroorganisme Yarsinia enterocolitica mampu
mengkonversi langsung asam korismat menjadi asam salisilat.
Gambar 8 Ringkasan biosintesis asam salisilat. Tanda panah memperlihatkan alternatif sintesis asam salisilat pada tanaman. Tanda panah putus-putus merupakan sintesis asam salisilat pada mikroorganisme melalui konversi langsung asam korismat menjadi asam salisilat. Tanda panah dengan titik-titik adalah lintasan produk perantara yang dapat dipakai untuk mensintesis asam salisilat pada mikroganisme.
Formatted: Swedish (Sweden)
3.1 Asam salisilat pada tanaman
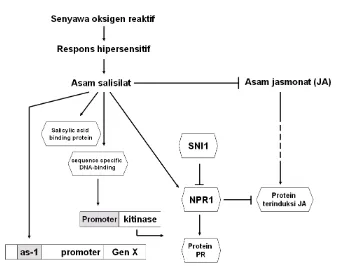
Hormon tanaman asam salisilat (SA) memiliki peran penting dalam penguatan ketahanan sistemik (SAR). Tingkat Konsentrasi SA berkorelasi dengan penginduksian beberapa protein yang berhubungan dengan ketahanan terhadap serangan patogen (protein PR) (Gaffney et al. 1993; Sticher et al. 1997).
Peningkatan SA berkorelasi dengan resistensi terhadap virus dan induksi PR1 (Chen et al. 1995). Tanaman transgenik tembakau (Gaffney et al. 1993),
transgenik padi (Yang et al. 2004), dan transgenik Arabidopsis A. thaliana mengandung gen nahG memperlihatkan hilangnya resistensi lokal maupun SAR
dalam melawan infeksi patogen karena tanaman transgenik mengandung ekspresi gen nahG tidak mampu membentuk SA.
SA tersedia dalam tanaman sebagai asam bebas dan metabolit terkonjugasi melalui metilasi, hidroksilasi, dan glukosilasi. SA diperkirakan lebih aktif bergerak dalam bentuk asam bebas pada tembakau karena keberadaannya dalam floem (Enyedi et al. 1992). SA yang disintesis pada tembakau yang terinokulasi
TMV akan terglukosilasi dan termetilasi. Konjugat terglukosilasi memiliki bentuk SA 2-O-β-D-glukosida (SAG) dan glukosil salisilat (GS), dan metal salisilat
(MSA) yang bersifat volatil. Pembentukan senyawa SA terkonjugasi, SA dan SAG, dirangsang oleh adanya infeksi pathogen dan tingkat konsentrasi SA (Lee & Raskin 1999). UDP-glukosa SA glukosiltransferase (SA GTase) bertanggung jawab untuk pembuatan SAG. UDP-glukosa SA karboksil GTase berperan dalam pembentukan GS. SA-karboksil metiltransferase mengontrol pembentukan MSA dari SA (Zubieta et al. 2003). Terdapat dua lintasan alternatif produksi SA pada
tanaman (Gambar 86). SA dapat dibuat dari fenilalanin melalui asam sinamat dan asam benzoat (BA) pada tembakau sehat atau yang terinfeksi TMV (Yalpani et al.
1993). Asam benzoat 2-hidroksilase (BA2H) bertanggung jawab dalam konversi BA menjadi SA (Enyedi et al. 1992; Silverman et al. 1995).
SA pada ArabidopsisA. thaliana dapat disintesis dari korismat. Lintasan ini dipelajari melalui analisis mutan sid. Mutan ArabidopsisA. thaliana sid1
(SA-induced defence 1) dan sid2 mengandung mutasi pada gen isokorismat sintase.
Konsentrasi SA tidak dapat meningkat selama infeksi pathogen akibat mutasi ini
Formatted: Spanish (Mexico)
Formatted: Spanish (Mexico)
Formatted: Font: I talic, Spanish (Mexico)
Formatted: Spanish (Mexico)
Formatted: Spanish (Mexico)