OSMOTIC DEHYDRATION OF SLICE OF MANGO ARUMANIS
(
Mangifera indica
L.) WITH CHITOSAN-COATING
Miftahul Jannah* and Leopold O. Nelwan**
*Under Graduate Student at Department of Mechanical and Biosystem Engineering, Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus,
PO Box 220, Bogor, West Java, Indonesia. e-mail: mita.TEPers@gmail.com
**Lecturer at Department of Mechanical and Biosystem Engineering, Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220,
Bogor, West Java, Indonesia.
ABSTRACT
Osmotic dehydration with sugar solution as the osmo-active substance was commonly applied to fruits, for example the mango. The objective of this research was to investigate the effect of Chitosan-coating, temperature and concentration of solution on Water Loss (WL) and Solid Gain (SG) during osmotic dehydration of mango. The treatment of solution temperatures of 30 oC and 50 oC and solution concentrations of 42 oBrix, 54 oBrix and 66 oBrix were applied to this research. The
variable of the mass of the sample, moisture content, solid content, and the volume of the sample were measured during this research. Measurement was done at minute 0, 30, 60, 90, 120, 180, 240, and 300. The sample non-coating, high temperature and high concentration of the solution increases WL, while the use of chitosan, low temperature and high concentration of the solution decreases SG. The largest values of PR was 12.2 at E1T1C3 treatment (using the chitosan, solution temperature 30 oC, and concentration of the solution 66 oBrix) with the WL values was 49.65 % and the SG values was 4.05 %. Azuara’s model was suitable for modeling the WL and SG on the osmotic dehydration of mango slices.
I.
PENDAHULUAN
A.
LATAR BELAKANG
Mangga (Mangifera indica L.) merupakan salah satu dari komoditas unggulan buah tropika Indonesia. Dilihat dari sisi aroma, bau ataupun rasanya sangat digemari baik dikonsumsi secara segar ataupun dalam bentuk produk olahan industri. Berdasarkan data dari Departemen Pertanian, produksi mangga pada tahun 2010 mencapai 1.29 juta ton. Besarnya jumlah mangga pada tahun tersebut membanjiri pasar hanya pada bulan-bulan tertentu saja. Hal ini dikarenakan buah mangga termasuk buah musiman dimana produksinya akan melimpah pada waktu panen dan menjadi langka pada waktu di luar musim panen. Selain itu buah mangga termasuk bahan pangan yang mudah rusak (perishable) sehingga umur simpannya relatif pendek. Diubahnya buah mangga menjadi produk olahan industri agar dapat mempertahankan cita rasa dan komposisi produk itu sendiri selama mungkin tanpa adanya penurunan mutu produk. Produk olahan mangga tetap dapat dikonsumsi pada saat kapanpun, sehingga nilai tambahnya juga meningkat.
Secara umum buah-buahan mempunyai masa penyimpanan (shelf life) yang pendek atau relatif cepat mengalami perubahan fisiologis, kimia, dan fisik sehingga mutu buah akan turun dan mengalami kerusakan. Oleh karena itu diperlukan upaya-upaya untuk dapat memperpanjang masa penyimpanan yaitu salah satunya dengan cara mengawetkan buah mangga tersebut. Teknologi pengawetan terus berjalan seiring dengan meningkatnya kebutuhan manusia akan adanya ketersediaan pangan. Cara pengawetan yang paling mudah dan telah dikenal sejak dahulu yaitu pengeringan.
Pengeringan merupakan pengawetan secara fisik dengan cara menurunkan aktivitas air (Aw) melalui pengurangan kadar air pada makanan sampai pada kadar tertentu dimana tidak terjadi aktivitas mikroorganisme perusak pangan. Proses pengeringan dapat menggunakan sinar matahari maupun menggunakan mesin-mesin pengering. Pemanfaatan sinar matahari dapat menekan biaya sehingga proses ini dengan mudah ditemui pada masyarakat tradisional misalnya untuk pengeringan ikan maupun pengeringan padi. Tetapi metode pengeringan ini sangat tergantung pada cuaca dan kurang cocok dalam pengeringan buah-buahan karena dapat menurunkan mutu produk. Pemanfaatan mesin pengering banyak digunakan dalam skala industri maupun laboratorium, kelebihannya yaitu tidak tergantung cuaca dan prosesnya lebih bisa dikontrol. Akan tetapi energi yang dibutuhkan untuk proses pengeringan sangat besar.
Salah satu teknologi alternatif untuk pengeringan buah-buahan adalah pengeringan osmotik. Pada proses pengeringan osmotik, buah-buahan dimasukkan ke dalam suatu media osmotik yang mempunyai konsentrasi zat terlarut yang lebih besar dibandingkan konsentrasi zat terlarut pada bahan yang akan dikeringkan sehingga air keluar dari bahan ke arah media melalui dinding sel yang berperilaku sebagai membran semipermeabel untuk menyeimbangkan tekanan osmotik. Akibat pemindahan massa air dari bahan tanpa perubahan fase ialah bertahannya mutu produk, dalam hal ini mencakup warna, aroma, tekstur buah, serta meningkatkan rasa buah kering. Pada pengeringan osmotik tidak memerlukan energi yang besar, karena untuk mengeluarkan air dari bahan tidak memerlukan panas laten untuk mengubah fase air dari bahan tersebut.
Beberapa variabel dapat mempengaruhi kinerja dari proses pengeringan. Rasio kinerja dari proses pengeringan osmotik dinyatakan pada perbandingan Water Loss (WL) terhadap Solid Gain (SG). Salah satu faktor yang dapat mempengaruhi proses pengeringan ialah suhu. Suhu yang tinggi dapat meningkatkan proses pengeringan (Lenart & Lewicki, 1990), tetapi suhu di atas 50 oC dapat menyebabkan terjadinya browning dan menurunkan cita rasa dari produk (Videv et al, 1990). Transfer massa khususnya proses kehilangan air juga dipengaruhi oleh konsentrasi larutan osmotik (Rahman & Lamb, 1990). Menurut Camirand et al. (1992), rasio kinerja dari proses pengeringan dapat ditingkatkan dengan pemberian lapisan (edible coating) seperti pencelupan irisan mangga dalam kalsium alginat. Fungsi dari pelapisan adalah mencegah terjadinya aliran padatan terlarut dari larutan osmotik ke dalam produk. Selain itu edible coating juga dapat bertindak sebagai membran semipermeabel, sehingga dapat meningkatkan water loss dan menurunkan solid gain. Oleh karena itu perlu dilakukan penelitian mengenai pengaruh suhu, konsentrasi larutan osmotik, serta pemberian edible coating terhadap pengeringan osmotik pada buah, misalnya pada buah mangga, agar diperoleh kinerja pengeringan osmotik yang maksimum terhadap buah mangga.
B.
TUJUAN
Tujuan dari penelitian ini yaitu:
1. Mengukur perubahan Water Loss dan Solid Gain akibat pemberian edible coating, perbedaan suhu larutan dan konsentrasi larutan osmotik pada irisan buah mangga yang dikeringkan dengan teknik pengeringan osmotik.
2. Membuat model Water Loss dan Solid Gain pada pengeringan osmotik irisan buah mangga dengan menggunakan model Azuara.
II.
TINJAUAN PUSTAKA
A.
KARAKTERISTIK BUAH MANGGA
Mangga berasal dari sekitar perbatasan India dengan Burma dan menyebar ke Asia Tenggara semenjak 1500 tahun yang lalu. Nama buah ini berasal dari Malayalam maanga dan dipadankan dalam bahasa Indonesia menjadi mangga. Kata ini dibawa ke Eropa oleh orang-orang Portugis dan diserap menjadi manga (bahasa Portugis), mango (bahasa Inggris) dan lain-lain. Nama ilmiahnya yaitu Mangifera indica L. yang mengandung arti: “(pohon) yang berbuah mangga, berasal dari India”.
Klasifikasi ilmiah dari buah mangga yaitu: Kingdom : Plantae
Filum : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Sapindales
Famili : Anacardiaceae
Genus : Mangifera
Spesies : Mangifera indica L.
Pohon mangga termasuk tumbuhan tingkat tinggi yang struktur batangnya (habitus) termasuk kelompok arboreus, yaitu tumbuhan berkayu yang mempunyai tinggi batang lebih dari 5 m. Tinggi pohon mangga bisa mencapai 10-40 m (Wikipedia, 2011).
Bunga mangga merupakan bunga majemuk yang berkarang dalam malai bercabang banyak di ujung ranting. Karangan bunga biasanya berbulu, tetapi sebagian ada juga yang gundul, kuning kehijauan, dan panjang mencapai 40 cm. Bunga majemuk ini terdiri dari sumbu utama yang mempunyai banyak cabang utama. Setiap cabang utama ini mempunyai banyak cabang-cabang, yakni cabang kedua. Ada kemungkinan cabang bunga kedua ini mempunyai suatu kelompok yang terdiri dari 3 bunga atau mempunyai cabang tiga. Setiap kelompok tiga bunga terdiri dari tiga kuntum bunga dan setiap kuntum bertangkai pendek dengan daun kecil. Jumlah bunga pada setiap bunga majemuk bisa mencapai 1000-6000. Bunga-bunga dalam karangan berkelamin campuran, ada yang jantan dan ada pula yang hermafrodit (berkelamin dua). Besarnya bunga lebih kurang 6-8 mm. Bunga jantan lebih banyak daripada bunga hermafrodit, dan jumlah bunga hermafrodit inilah yang menentukan terbentuknya buah. Persentase bunga hermafrodit bermacam-macam, tergantung dari varietasnya, yaitu antara 1.25% - 77.9%, sementara bunga yang mempunyai bakal buah normal kira-kira 5 - 10%. Pembungaan pada tanaman mangga terjadi 1 ½ - 2 bulan sesudah musim kering dimulai. Waktu yang diperlukan pembungaan dan pembuahan kurang lebih 4 bulan kering dan selama waktu tersebut ada 15 hari hujan merata. Curah hujan yang sesuai untuk pertumbuhan tanaman mangga adalah kurang dari 60 mm/bulan dengan 4 – 6 bulan kering (Wikipedia, 2011).
Mangga mempunyai kulit buah agak tebal berbintik-bintik kelenjar, berwarna hijau, kekuningan atau kemerahan bila masak. Ciri-ciri daging buah masak yaitu berwarna merah jingga, kuning atau krem, berserabut atau tidak, manis sampai masam dengan banyak air, berbau kuat sampai lemah, penebalan lapisan ‘bedak’, pemunculan bintik coklat pada 2/3 lebih bagian panjang buah dan menghasilkan nada tinggi jika buah diketuk dengan jari. Biji berwarna putih, gepeng memanjang tertutup endokarp yang tebal, mengayu dan berserat.
Pati yang terakumulasi selama proses pematangan buah ternyata kadarnya berkurang tajam pada saat buah matang, dimana ukuran granula pati yang ada di dalam kloroplas mengecil (Seymour et al., 1993). Hilangnya pati diiringi dengan kenaikan kadar amilase setelah proses pematangan selesai. Sebagai akibat hidrolisis pati, maka kadar gula juga meningkat selama pematangan, dimana gula yang terbentuk adalah fruktosa, glukosa dan sukrosa yang menggantikan monosakarida. Pada kebanyakan varietas mangga ternyata fruktosa ditemukan paling dominan. Seymour et al. (1993) menyatakan bahwa kadar TPT buah mangga yang mendekati tingkat kematangan akan semakin meningkat. Dengan meningkatnya kadar gula maka meningkat pula rasa manis pada buah mangga.
Pracaya (1990) menyatakan bahwa waktu berbunga buah mangga di pulau Jawa lebih kurang terjadi pada bulan Juli-Agustus, sedangkan musim panen terjadi pada bulan September-Desember. Pracaya (1985) juga menyatakan buah mangga sudah dapat dikatakan tua jika telah berumur > 79 hari, karena telah mencapai tingkat perkembangan maksimal dan proses pematangan yang sempurna.
Terdapat perbedaan karakteristik fisik dan kimia untuk tiap jenis buah mangga. Hasil analisa sebuah penelitian mengenai karakteristik beberapa varietas mangga lokal dapat dilihat pada Tabel 1.
Tabel 1. Hasil analisa proksimat pada beberapa varietas buah mangga masak
Varietas Kadar air
(%)
TSS
(oBrix)
TAT
(oBrix)
Vit. C
(mg/100 g)
Total gula
(%)
Rasio gula dan
asam
Gedong 82.86 16.00 0.12 7.21 17.28 144.71
Arumanis 81.05 14.77 0.89 2.32 17.42 19.57
Manalagi 81.90 16.20 0.63 4.29 17.36 27.56
Cengkir 84.30 14.93 0.26 5.08 16.04 61.71
Golek 85.38 13.90 0.11 4.52 17.87 162.50
Sumber: Yulianingsih dan Laksmi (1988)
Mangga merupakan buah klimakterik dengan umur simpan 6 – 8 hari pada suhu kamar yaitu 25±2oC dan RH 85±5% (Jagatiani et al. 1988). Menurut Yuniarti dan Suhardi (1989) buah mangga golek yang dipanen pada umur 92 hari setelah pembungaan akan mencapai tingkat kematangan optimal setelah disimpan 8 hari pada suhu kamar. Broto et al. (1989) menyatakan bahwa mangga arumanis rata-rata terjadi pematangan secara penuh setelah pemanenan pada hari ke-8 pada kondisi suhu kamar 23-25oC dan RH 70-80%. Mangga cengkir yang dipanen pada stadia ketuaan komersil hanya tahan simpan selama 8 hari (Pratikno dan Sosrodiharjo, 1989).
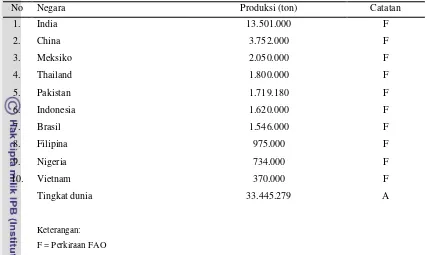
Tabel 2. Sepuluh produsen mangga terbesar pada tahun 2007
No Negara Produksi (ton) Catatan
1. India 13.501.000 F
2. China 3.752.000 F
3. Meksiko 2.050.000 F
4. Thailand 1.800.000 F
5. Pakistan 1.719.180 F
6. Indonesia 1.620.000 F
7. Brasil 1.546.000 F
8. Filipina 975.000 F
9. Nigeria 734.000 F
10. Vietnam 370.000 F
Tingkat dunia 33.445.279 A
Keterangan:
F = Perkiraan FAO
A = data gabungan (resmi, tak resmi, dan atau hasil perhitungan)
Sumber: Food and Agricultural Organization of United Nations: Economic And Social Department: The Statistical Division.
Salah satu varietas buah mangga yang banyak disukai untuk dikonsumsi ialah mangga arumanis (Gambar 1). Bentuk buahnya gemuk terkesan banyak daging buahnya, berparuh sedikit, dan ujungnya meruncing. Pangkal buah berwarna merah orange keunguan, sedangkan bagian lainnya berwarna hijau kebiruan. Mangga ini memiliki kulit yang tidak begitu tebal, berbintik kelenjar berwarna keputihan, jika tua terkesan mengkilap. Daging buahnya tebal, berwarna kuning kemerah-merahan, dagingnya lembut, sedikit berserat, dan tidak begitu banyak mengandung air. Rasanya manis segar, tetapi pada bagian ujungnya terkadang sedikit asam. Bijinya kecil, lonjong pipih, dan panjangnya antara 12-14 cm. Panjang buahnya berkisar 13~16 cm, dan rata-rata berat per buah berkisar 450 g. Mampu berbuah maksimal, bisa mencapai 60 kg/pohon (Agrobuah, 2011).
Gambar 1. Buah mangga varietas arumanis
B.
PENGERINGAN OSMOTIK
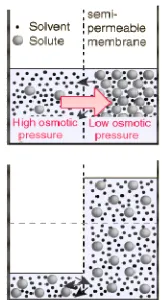
Osmosis merupakan suatu proses dimana suatu liquid dapat melewati suatu membran semipermeabel secara langsung. Apabila terdapat dua larutan yang memiliki konsentrasi zat terlarut yang berbeda dipisahkan oleh suatu membran semipermeabel, maka akan terjadi perpindahan air dari larutan hipotonik (larutan dengan konsetrasi zat terlarut yang lebih rendah) ke larutan hipertonik (larutan dengan konsentrasi zat terlarut yang lebih tinggi). Misalnya yang terjadi dalam kasus dua buah liquid yang dipisahkan dengan suatu membran semipermeabel (Gambar 2) dimana pada salah satu kaki berisi pelarut murni misalnya air sebagai larutan hipotonik, dan satu kaki yang lain berisi larutan gula sebagai larutan hipertonik.
Gambar 2. Proses osmosis dua liquid
Pori dalam membran semipermeabel terlalu kecil untuk dapat dilewati oleh molekul zat terlarut misalnya gula, tetapi cukup besar untuk dilewati molekul air. Molekul air dari larutan maupun dari pelarut murni secara random dapat melewati membran semipermeabel. Akan tetapi laju pergerakan molekul air dari air-larutan dengan laju pergerakan molekul air dari larutan-air ditentukan oleh besarnya entropi dan tekanan yang diaplikasikan ke salah satu kaki. Karena entropi larutan adalah lebih besar dibandingkan dengan entropi pelarut murni maka secara spontan laju molekul air yang melewati air-larutan akan lebih cepat dibandingkan dengan laju molekul air dari larutan-air. Oleh sebab itu bila kita membiarkan kedua larutan untuk selang waktu tertentu maka ketinggian permukaan larutan pada salah satu kaki akan mengalami kenaikan. Proses ini akan terus berlangsung sampai ketinggian “h” mencapai tinggi tertentu dimana pada ketinggian tersebut tekanan larutan memiliki tekanan yang dapat menyeimbangkan laju pergerakan molekul air dari larutan-air dan air-larutan. Tekanan inilah yang disebut sebagai tekanan osmotik.
Gambar 3. Pergerakan air karena perbedaan tekanan osmotik
Sumber : belajarkimia.com
Membran semipermeabel
Larutan gula
Pelarut murni (air)
Proses osmosis dapat juga diaplikasikan pada proses pengeringan pangan. Meningkatkan kualitas produk makanan yang diawetkan, memberikan kisaran kadar air dan zat terlarut bahan yang diinginkan untuk proses pengolahan selanjutnya, meminimalisasi stress pada bahan akibat panas dan mengurangi input energi pada pengeringan konvensional merupakan beberapa keuntungan dari pengeringan osmotik dalam proses stabilisasi konvensional (Chottanom et al., 2005). Pengeringan osmotik dilakukan dengan menciptakan lapisan semipermeabel dengan cara merendam produk ke dalam larutan gula, larutan garam, sorbitol, gliserol, dan sebagainya sebelum proses pengeringan. Proses ini biasa dilakukan dalam pembuatan produk pangan semi basah. Selanjutnya produk dikeringkan dengan penjemuran atau pengeringan buatan. Proses pengeringan osmosis dapat digunakan untuk perlakuan pengeringan awal yang dapat menurunkan kadar air bahan sampai 50% dari kadar air awal bahan (Karathanos et al., 1995). Metode pengeringan osmotik dikombinasikan dengan pengeringan udara terbukti mampu menghasilkan buah kering awet dengan kadar air sekitar 14%, sehingga kerusakan kimiawi, biologis dan enzimatis dapat dihindari. Perendaman irisan daging buah mangga kweni dalam larutan gula 60 oBrix selama 10 jam, kemudian dikeringkan pada suhu 55
o
C dan kelembaban 60% selama 9 jam menghasilkan manisan mangga kweni kering, berpenampilan menarik, warna kuning merata, manis, dan memiliki kadar air optimum yaitu 14.41% (Broto, 2003).
Pengeringan osmotik melibatkan dua aliran material yang berlawanan arah dan terjadi secara simultan, yaitu keluarnya air dari jaringan produk ke larutan osmotik dan aliran padatan terlarut dari larutan osmotik ke dalam jaringan produk. Laju kehilangan air dari jaringan produk dipengaruhi oleh beberapa faktor diantaranya suhu, komposisi dan konsentrasi larutan osmotik, fase kontak, karakteristik produk, perlakuan awal terhadap produk, ukuran dan bentuk geometri produk, tingkat pengadukan, dan lamanya proses pengeringan (Khan et al., 2008).
Suhu memberikan pengaruh positif (sebanding) dengan kehilangan air dan kenaikan padatan pada buah mangga dengan perlakuan pengeringan osmotik. Pada buah nanas yang telah dilakukan pengeringan osmotik selama 6 jam, dengan suhu 30, 40 and 50 ºC dalam larutan hipertonik (60% sukrosa), menunjukkan bahwa penurunan kadar air nanas mempunyai fungsi linier terhadap suhu perendaman. Makin tinggi suhu, makin turun kadar air nanas, kadar sukrosa dalam buah makin tinggi (Ramalo dan Mascheroni, 2005).
Jenis dan konsentrasi larutan osmotik sangat mempengaruhi laju pengeringan dan mutu yang dihasilkan. Karathanos et al. (1995) menemukan bahwa larutan glukosa dengan konsentrasi 45% memberikan laju kehilangan air yang paling tinggi dibandingkan dengan konsentrasi larutan 30% dan 15%. Kalsium klorida umumnya digunakan pada konsentrasi 0.5 – 1.0% sebagai tambahan pada bahan osmosis yang sebenarnya, terutama untuk menguatkan struktur jaringan sayuran atau buah-buahan. Natrium klorida sangat cepat menghasilkan efek pengeringan osmosis, tetapi mempunyai kelemahan yaitu molekul NaCl cepat mempenetrasi bahan dan mengubah rasa. Akibat adanya perubahan organoleptik, maka disarankan untuk menggunakan konsentrasi 10% bagi sayuran, dan 1 - 3% sebagai tambahan pada media osmosis utama untuk mengeringkan buah-buahan. Larutan NaCl juga telah ditemukan mempunyai efek inhibitor terhadap aktifitas polyphenol oksidase (Lenart, 1996). Sukrosa dianggap merupakan bahan osmosis yang terbaik, kehadiran sukrosa pada permukaan bahan yang dikeringkan membantu menghalangi kontak dengan oksigen yang berakibat terhadap penurunan laju pencoklatan enzimatik (enzymatic browning). Sukrosa lebih dapat diterima jika ditinjau dari segi rasa, tetapi rasa manis dapat tidak cocok digunakan bagi sayur-sayuran. Maltodekstrin dan sirup pati dianjurkan untuk menurunkan kadar air sayur-sayuran dan buah-buahan terutama jika efek kemanisan yang diakibatkan oleh sukrosa pada produk akhir tidak diinginkan.
maksimum diperoleh pada kondisi suhu larutan 46 oC dan konsentrasi larutan 65.5 oBrix untuk sampel yang tidak dilapisi alginat. Untuk sampel yang dilapisi alginat, rasio kinerja maksimum diperoleh pada perlakuan suhu larutan 44 oC dan konsentrasi larutan 65.5 oBrix. Rasio kinerja maksimum yang diperoleh masing-masing perlakuan tersebut yaitu 5.16 dan 9.51, sehingga pemberian alginat pada sampel dapat meningkatkan kehilangan air dan menurunkan pemasukan padatan terlarut pada sampel.
C.
EDIBLE COATING
Polimer biodegradable adalah molekul-molekul besar yang dapat dihancurkan atau diurai mikroorganisme, khususnya bakteri dan jamur. Salah satu metode yang sedang dikembangkan adalah kemasan edible, yaitu kemasan yang dapat dimakan, antara lain dengan teknik coating (lapisan). Teknik ini sering disebut sebagai edible film dan/atau edible coating. Coating diaplikasikan dan dibentuk secara langsung pada produk yang dikemas. Sedangkan film dibentuk menyerupai lapisan tipis terlebih dahulu, kemudian diaplikasikan ke produk makanan yang dikemas.
Edible film / coating merupakan lapisan tipis dan kontinyu, terbuat dari bahan-bahan yang dapat dimakan, dengan melapisi komponen makanan atau diletakkan di antara komponen makanan. Lapisan ini berfungsi sebagai penahan (barrier) yang baik untuk perpindahan massa (kelembaban, lipid, cahaya, zat terlarut, gas O2 dan CO2,sebagai bahan tambahan, serta dapat mencegah hilangnya
senyawa-senyawa volatile pada aroma atau rasa khas suatu produk pangan. Sehingga kemasan edible film/coating harus memiliki sifat diantaranya:
(1) Menahan kehilangan kelembaban produk.
(2) Memiliki permeabilitas selektif terhadap gas tertentu.
(3) Mengendalikan perpindahan padatan terlarut untuk memepertahankan warna pigmen alami dan gizi.
(4) Menjadi pembawa bahan aditif seperti pewarna, pengawet dan penambah aroma yang memperbaiki mutu bahan pangan.
Aplikasi edible film/coating dapat digunakan pada potongan buah atau sayuran dengan cara pencelupan, pembuihan, penyemprotan, penetesan, dan penetesan terkendali. Cara aplikasinya tergantung pada jumlah, ukuran, sifat produk dan hasil yang diinginkan. Bahan dasar pembuatan edible film/coating dapat digolongkan menjadi tiga kelompok, yaitu hidrokoloid (protein, polisakarida, turunan selulosa, alginat, pektin, dan pati), lipida (asam lemak, wax, asilgliserol), serta campuran (hidrokoloid dan lemak).
Edible film/coating dapat diklasifikasikan berdasarkan kemungkinan penggunaannya dan jenis film yang sesuai, yang dapat dilihat pada Tabel 3.
Penggunaan Jenis edible film/coating yang sesuai
Menghambat penyerapan uap air Lipida, komposit
Menghambat penyerapan gas Hidrokoloid, lipida, atau komposit
Menghambat penyerapan minyak dan lemak Hidrokoloid
Menghambat penyerapan zat-zat larut Hidrokoloid, lipida, atau komposit
Meningkatkan kekuatan struktur atau memberi kemudahan penanganan
Hidrokoloid, lipida, atau komposit
Menahan zat-zat volatile Hidrokoloid, lipida, atau komposit
Pembawa bahan tambahan makanan Hidrokoloid, lipida, atau komposit
Sumber : Donhowe dan Fennema (1994) dalam Krochta etal. (1994)
Salah satu jenis edible coating ialah kitosan. Kitosan merupakan bahan pelapis berupa polisakarida yang berasal dari limbah pengolahan udang (Crustaceae). Misalnya limbah padat pengolahan yang terdiri atas kulit, kaki dan kepala, dapat mencapai hingga 40% dari total produksi udang. Untuk memperoleh kitin dari cangkang udang melibatkan proses-proses pemisahan protein (deproteinasi) dan pemisahan mineral (demineralisasi), sedangkan untuk mendapatkan kitosan dilanjutkan dengan proses deasetilasi dengan menggunakan basa kuat NaOH atau KOH. Dalam chitosan terdapat unsur butylosar yang bermanfaat bagi tubuh manusia. Butylosar yang telah didapatkan itu hanya larut dalam asam encer dan cairan tubuh manusia. Zat itu merupakan satu-satunya selulosa yang dapat dimakan, mempunyai muatan positif yang kuat, dan dapat mengikat muatan negatif dari senyawa lain. Selain itu, zat ini mudah mengalami degradasi secara biologis dan tidak beracun. Kitosan sangat berpotensi untuk dijadikan sebagai bahan pengawet makanan, karena kitosan memiliki polikation bermuatan positif sehingga dapat menghambat pertumbuhan mikroba (Wardaniati, 2009) dan mampu berikatan dengan senyawa-senyawa yang bermuatan negatif seperti protein, polisakarida, asam nukleat, logam berat dan lain-lain (Murtini dkk, 2008). Selain itu, molekul kitosan memiliki gugus N yang mampu membentuk senyawa amino yang merupakan komponen pembentukan protein dan memiliki atom H pada gugus amina yang memudahkan kitosan berinteraksi dengan air melalui ikatan hidrogen (Rochima, 2009).
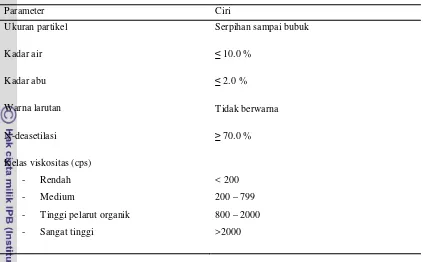
Tabel 4. Spesifikasi kitosan niaga
Parameter Ciri
Ukuran partikel Serpihan sampai bubuk
Kadar air ≤ 10.0 %
Kadar abu ≤ 2.0 %
Warna larutan Tidak berwarna
N-deasetilasi ≥ 70.0 %
Kelas viskositas (cps)
- Rendah
- Medium
- Tinggi pelarut organik
- Sangat tinggi
< 200
200 – 799
800 – 2000
>2000
Sumber: Purwatiningsih S et al., 2009
III.
METODOLOGI PENELITIAN
A.
WAKTU DAN LOKASI PENELITIAN
Penelitian dilakukan pada bulan Juli 2011 hingga Agustus 2011 di Laboratorium Energi dan Listrik Pertanian serta Laboratorium Pindah Panas dan Massa, Departemen Teknik Mesin dan Biosistem, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
B.
RANCANGAN PENELITIAN
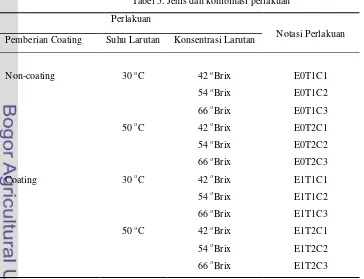
Perlakuan yang digunakan dalam penelitian terdiri dari:
Perlakuan 1: E0 = tanpa menggunakan kitosan (chitosan)
E1 = menggunakan kitosan (chitosan) sebagai pelapis (edible coating) Perlakuan 2: T1 = suhu larutan osmotik 30 oC
T2 = suhu larutan osmotik 50 oC
Perlakuan 3: C1 = konsentrasi larutan osmotik 42 oBrix C2 = konsentrasi larutan osmotik 54 oBrix C3 = konsentrasi larutan osmotik 66 oBrix
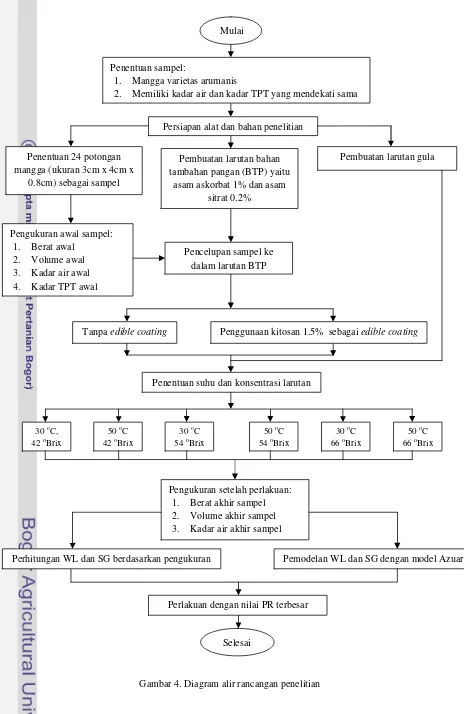
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan faktorial dengan 3 perlakuan dengan masing-masing 2 dan 3 taraf perlakuan. Jadi, dari ketiga jenis perlakuan yang berbeda akan diperoleh 12 kombinasi perlakuan yang dapat dilihat pada Tabel 5. Sedangkan diagram alir rancangan penelitian terdapat pada Gambar 4.
Tabel 5. Jenis dan kombinasi perlakuan
Perlakuan
Notasi Perlakuan Pemberian Coating Suhu Larutan Konsentrasi Larutan
Non-coating 30 oC 42 oBrix E0T1C1
54 oBrix E0T1C2 66 oBrix E0T1C3
50 oC 42 oBrix E0T2C1
54 oBrix E0T2C2 66 oBrix E0T2C3
Coating 30 oC 42 oBrix E1T1C1
54 oBrix E1T1C2 66 oBrix E1T1C3
50 oC 42 oBrix E1T2C1
Gambar 4. Diagram alir rancangan penelitian
30 oC, 42 oBrix
50 oC 42 oBrix
Tanpa edible coating Penggunaan kitosan 1.5% sebagai edible coating Mulai
Penentuan sampel:
1. Mangga varietas arumanis
2. Memiliki kadar air dan kadar TPT yang mendekati sama
Persiapan alat dan bahan penelitian
Penentuan 24 potongan mangga (ukuran 3cm x 4cm x
0.8cm) sebagai sampel
Pembuatan larutan bahan tambahan pangan (BTP) yaitu
asam askorbat 1% dan asam sitrat 0.2%
Pembuatan larutan gula
Pengukuran awal sampel: 1. Berat awal
2. Volume awal 3. Kadar air awal 4. Kadar TPT awal
Pencelupan sampel ke dalam larutan BTP
Penentuan suhu dan konsentrasi larutan
30 oC 54 oBrix
50 oC 54 oBrix
30 oC 66 oBrix
50 oC 66 oBrix
Pengukuran setelah perlakuan: 1. Berat akhir sampel 2. Volume akhir sampel 3. Kadar air akhir sampel
Perhitungan WL dan SG berdasarkan pengukuran Pemodelan WL dan SG dengan model Azuara
Perlakuan dengan nilai PR terbesar
C.
BAHAN DAN ALAT
1. Bahan
Bahan utama sebagai sampel dalam penelitian adalah buah mangga yang telah dipotong dengan ukuran panjang 3 cm, lebar 4 cm dan tebal 0.8 cm.Buah mangga yang digunakan jenisnya sama untuk setiap perlakuan, yaitu buah mangga arumanis yang diupayakan mempunyai umur panen yang sama. Dalam penelitian ini, indikator yang digunakan adalah kadar air awal dan kadar TPT dari buah mangga mendekati sama. Bahan tambahan lainnya yaitu larutan osmotik berupa campuran antara gula dan aquades; larutan asam askorbat 1% b/v dan asam sitrat 0.2% b/v; dan kitosan 1.5% b/v sebagai edible coating. Larutan kitosan diperoleh dari laboratorium biotek, Fakultas Perikanan dan Ilmu Kelautan, IPB. Cara pembuatannya yaitu kitosan sebanyak 15 gram dilarutkan dengan 1 liter larutan asam asetat 2%.
2. Alat
Peralatan yang digunakan dalam penelitian di antaranya:
a. Osmotic Dehydrator
Berupa panci terbuat dari baja tahan karat (stainless steel) yang dirangkai dengan elemen pemanas (heater), termostat, pengaduk (stirer), dan saringan sampel. Heater yang digunakan sebanyak 2 unit dengan daya masing-masing sebesar 1000 Watt. Termostat berfungsi mengontrol suhu larutan osmotik agar konstan selama pengukuran. Stirer digunakan untuk menggerakkan/mengaduk larutan osmotik agar panas yang diterima dapat merata ke semua sisi wadah. Stirer digerakkan oleh motor DC dengan kecepatan putar 125 RPM. Saringan sampel terbuat dari stainless steel. Saringan digunakan sebagai wadah potongan buah mangga agar mudah dalam pengambilan potongan buah mangga yang akan ditimbang. Foto dan keterangan alat dapat dilihat pada Gambar 4.
b. Drying oven, cawan, tray, dan penjepit cawan c. Refraktometer
d. Timbangan digital e. Desikator
f. Gelas ukur g. Pipet tetes h. Pinset i. Pisau j. Mortar k. Stopwatch
(a)
(b)
Gambar 5. (a) Komponen-komponen pada osmotic dehydrator, (b) Bagian dalam osmotic dehydrator
D.
METODE PENELITIAN
1. Pembuatan Larutan Osmotik
Larutan osmotik yang digunakan adalah campuran dari gula dan aquades. Konsentrasi larutan osmotik yang digunakan pada penelitian terdiri dari larutan gula 42 oBrix, 54 oBrix, dan 66 oBrix. Misalnya dalam pembuatan larutan gula 42 oBrix, gula putih dilarutkan dengan sejumlah aquades. Kemudian diukur kadar TPT (total padatan terlarut) dengan menggunakan refraktometer. Jika angka menunjukkan < 42 oBrix maka ditambahkan gula ke dalam larutan, dan sebaliknya ditambahkan aquades jika angka menunjukkan > 42 oBrix. Begitu pula dalam pembuatan larutan gula 54 oBrix dan 66 oBrix menggunakan prosedur yang sama, akan tetapi dengan angka oBrix yang berbeda.
Insulator Batang stirer
Tombol pengatur suhu pada termostat
Penyangga panci pemanas Pompa stirer
Tombol “on-off”
2. Prosedur Penelitian Pengeringan Osmotik
Langkah kerja dalam pengeringan osmotik adalah sebagai berikut:
a. Mangga dicuci, dibersihkan, dikupas kulitnya, dan dipotong dengan ukuran panjang x lebar x tebal yaitu 3 cm x 4 cm x 0.8 cm.
b. Semua potongan mangga ditimbang untuk mengetahui berat awal keseluruhan.
c. Semua potongan mangga dicelupkan ke dalam larutan asam askorbat 1% b/v dan asam sitrat 0.2% b/v selama 60 detik.
d. Dari semua potongan mangga diambil secara acak 24 potongan mangga sebagai sampel pengukuran berat sampel, kadar air, dan volume sampel untuk tiap waktu pengukuran. Waktu pengukuran terdiri dari pengukuran pada menit ke-0, 30, 60, 90, 120, 180, 240, dan 300. Masing-masing waktu pengukuran terdapat tiga sampel yang diukur.
e. Masing-masing sampel (24 potongan mangga) ditimbang berat awalnya dan diukur volume awalnya.
f. Untuk sampel dengan perlakuan menggunakan edible coating, sampel dicelupkan ke dalam larutan kitosan 1.5% b/v selama 30 detik, kemudian diangin-anginkan.
g. Untuk mengetahui kadar air dan kadar TPT awal mangga (sebelum pengeringan osmotik) dilakukan pegukuran pada ketiga sampel untuk menit ke-0. Masing-masing sampel dipotong menjadi dua bagian, yaitu satu bagian untuk pengukuran kadar air dan satu bagian lagi untuk pengukuran kadar TPT.
h. Sampel yang lain dimasukkan ke dalam saringan.
i. Larutan osmotik dimasukkan ke dalam panci heater. Perbandingan berat sampel dengan larutan osmotik yaitu 1 : 15. Selanjutnya heater dinyalakan dan tombol pada termostat diatur sesuai suhu yang akan digunakan.
j. Saringan yang berisi sampel dimasukkan ke dalam panci heater hingga seluruh sampel terendam dalam larutan gula. Kemudian panci ditutup dan stirer dinyalakan pada kecepatan putar 125 rpm. k. Pengeringan osmotik dilakukan selama 5 jam. Diambil masing-masing 3 sampel untuk dilakukan
pengukuran berat sampel, kadar air dan volume sampel tiap 30 menit untuk 2 jam pertama dan tiap 60 menit untuk 3 jam berikutnya. Setiap sebelum dilakukan pengukuran, sampel harus dikeringkan dengan cara dilap dengan menggunakan kertas saring.
E.
PENGAMATAN
1. Kadar Air (Metode Oven)
Pengukuran kadar air sampel (potongan buah mangga) dilakukan secara tidak langsung dengan menggunakan metode oven. Langkah awal dalam pengukuran kadar air sampel dengan mengeringkan cawan kosong di dalam oven bersuhu 105 oC selama 15 menit kemudian didinginkan dalam desikator dan ditimbang.
= 100% ... (1)
Dimana: m = kadar air sampel dalam basis basah (%b.b.) a = berat sampel sebelum dikeringkan (gram) b = berat sampel setelah dikeringkan (gram)
2. Total Padatan Terlarut (TPT)
Kadar TPT larutan osmotik dan sampel diukur dengan menggunakan hand refractometer yang berskala 0~32 oBrix. Brix merupakan jumlah zat padat semu yang larut (dalam gram) setiap 100 gram larutan. Refraktometer dikalibrasi dengan cara meneteskan aquades pada lensa refraktometer hingga menunjukkan angka 0 oBrix. Untuk pengukuran kadar TPT larutan osmotik dapat dilakukan dengan meneteskan larutan ke lensa refraktometer. Sedangkan pengukuran kadar TPT sampel dilakukan dengan mengekstrak sampel terlebih dahulu dengan menggunakan mortar. Setelah itu, ekstrak dari sampel diletakkan di atas lensa refraktometer. Refraktometer dibidik untuk membaca angka pengukuran kadar TPT.
3. Volume Sampel (cm3)
Gelas ukur diisi dengan larutan gula sesuai dengan kadar brix dari sampel setinggi ho. Kemudian sampel dimasukkan ke dalam gelas ukur tersebut hingga semua bagian dari sampel tercelup ke dalam larutan dan tinggi muka larutan menjadi h1 ml. Selisih tinggi muka larutan setelah dan sebelum sampel dimasukkan merupakan volume dari sampel tersebut (dapat dilihat pada Persamaan 2).
= ℎ − ℎ ... (2)
Dimana: V = volume sampel (cm3)
h0 = tinggi muka larutan sebelum sampel dimasukkan
h1 = tinggi muka larutan setelah sampel dimasukkan
Penyusutan volume sampel ( V) dihitung dengan menggunakan Persamaan 3.
% = − 100% ... (3)
Dimana: Vt = volume sampel pada waktu t (cm3)
V0 = volume sampel pada waktu ke-0 menit (cm 3
)
Tanda (-) menunjukkan adanya pengurangan volume sampel.
4. Water Loss (WL) dan Solid Gain (SG)
= − ... (4)
!" = # # ... (5)
Dimana: w = berat sampel pada waktu ke-0 menit (gram) w% = berat sampel pada waktu t (gram)
m = Kadar air sampel pada waktu ke-0 menit (%b.b.) m%= Kadar air sampel pada waktu t (%b.b.)
5. Rasio Kinerja/Performance Ratio (PR)
Rasio kinerja (performance ratio = PR) dari proses pengeringan osmotik dapat dihitung dengan membandingkan jumlah air yang keluar dari sampel terhadap padatan terlarut yang masuk ke sampel (Persamaan 6).
'( = )*+, ...,... (6)
6. Pemodelan dalam Pengeringan Osmotik
Peleg (1988) mengusulkan model empiris untuk menggambarkan kinetika penyerapan air selama rehidrasi, yaitu:
- = -.± 012 03 ... (7)
Dimana M adalah kadar air pada waktu t (%b.k.), Mi adalah kadar air awal (%b.k.), K1 adalah
parameter kinetik dan K2 adalah parameter lain yang terkait dengan kadar air keseimbangan (Meq).
Ketika t →∞, kadar air keseimbangan dapat dihitung dengan:
-45= -. ± 03 ... (8)
Persamaan 7 dapat dilinierkan menjadi:
6 67= 8 + 8: ; ... (9)
Azuara et al. (1992) menghitung Water Loss dan Solid Gain selama pengeringan osmotik melalui persamaan dengan dua parameter yang diperoleh dari kesetimbangan massa.
= +1 . )*=
2 +1 =
)*= 1 >12
... (10)
!" = +3 . +,=
2 +3 =
+,= 1 >32
... (11)
)*= +1 . )*= + )*= ... (12)
+,= +3 . +,= + +,= ... (13)
Dimana: S1 = konstanta yang berkaitan dengan water loss
S2 = konstanta yang berkaitan dengan solid gain
IV.
HASIL DAN PEMBAHASAN
A.
KADAR AIR SAMPEL
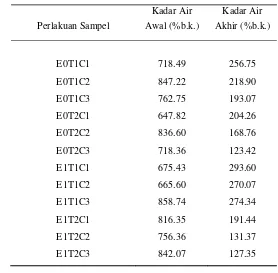
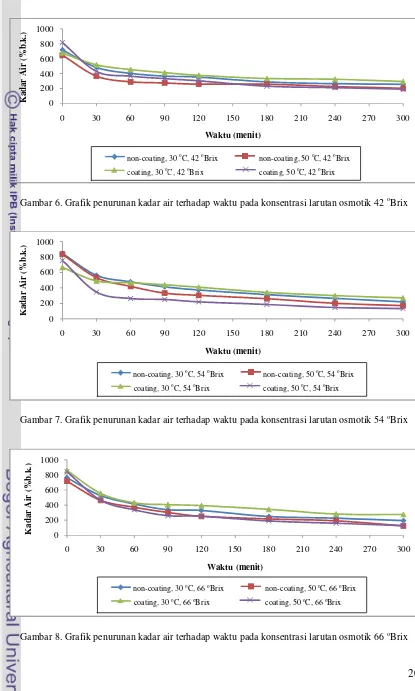
Pengukuran kadar air sampel dilakukan sebelum pengeringan osmotik, selama pengeringan osmotik dan setelah pengeringan osmotik. Pengukuran kadar air sampel sebelum pengeringan osmotik dilakukan untuk memperoleh kadar air awal dari sampel. Sampel untuk tiap perlakuan memiliki kadar air awal yang berbeda-beda yaitu berkisar antara 647.82~858.74 %b.k. Setelah sampel dimasukkan ke dalam larutan gula selama 5 jam, terjadi penurunan kadar air. Adanya perbedaan konsentrasi zat terlarut antara sampel dan larutan gula menyebabkan adanya perbedaan tekanan osmotik antara air dalam jaringan sampel dengan larutan gula. Hal ini yang menyebabkan keluarnya sejumlah air dari jaringan sampel ke larutan gula, sehingga terjadi penurunan kadar air sampel untuk selang waktu tertentu selama proses pengeringan osmotik. Kadar air akhir sampel yang diperoleh berbeda-beda sesuai dengan perlakuan yang diberikan (dapat dilihat pada Tabel 6).
Tabel 6. Kadar air awal dan kadar air akhir sampel (dalam basis kering) selama pengukuran
Perlakuan Sampel
Kadar Air Awal (%b.k.)
Kadar Air Akhir (%b.k.)
E0T1C1 718.49 256.75
E0T1C2 847.22 218.90
E0T1C3 762.75 193.07
E0T2C1 647.82 204.26
E0T2C2 836.60 168.76
E0T2C3 718.36 123.42
E1T1C1 675.43 293.60
E1T1C2 665.60 270.07
E1T1C3 858.74 274.34
E1T2C1 816.35 191.44
E1T2C2 756.36 131.37
E1T2C3 842.07 127.35
sampel yang semakin lambat dan mencapai kondisi kesetimbangan. Grafik penurunan massa sampel terhadap waktu dapat dilihat pada Lampiran 4.
Gambar 6. Grafik penurunan kadar air terhadap waktu pada konsentrasi larutan osmotik 42 oBrix
Gambar 7. Grafik penurunan kadar air terhadap waktu pada konsentrasi larutan osmotik 54 oBrix
Gambar 8. Grafik penurunan kadar air terhadap waktu pada konsentrasi larutan osmotik 66 oBrix
0 200 400 600 800 1000
0 30 60 90 120 150 180 210 240 270 300
K a d a r A ir (% b .k .) Waktu (menit) 0 200 400 600 800 1000
0 30 60 90 120 150 180 210 240 270 300
K a d a r A ir (% b .k .) Waktu (menit) 0 200 400 600 800 1000
0 30 60 90 120 150 180 210 240 270 300
K a d a r A ir (% b .k .) Waktu (menit)
non-coating, 30 oC, 66 oBrix non-coating, 50 oC, 66 oBrix
coating, 30 oC, 66 oBrix coating, 50 oC, 66 oBrix non-coating, 30 oC, 42 oBrix non-coating, 50 oC, 42 oBrix
coating, 30 oC, 42 oBrix coating, 50 oC, 42 oBrix
non-coating, 30 oC, 54 oBrix non-coating, 50 oC, 54 oBrix
Tabel 6 menunjukkan bahwa perlakuan E1T2C3 (menggunakan kitosan, suhu larutan 50 oC dan konsentrasi larutan 66 oBrix) memiliki kadar air akhir yang rendah yaitu 127.35 %b.k. dengan penurunan kadar air yang paling tinggi dari kadar air awalnya. Sedangkan kadar air akhir yang paling tinggi terjadi pada perlakuan E1T1C1 (menggunakan kitosan, suhu larutan 30 oC dan konsentrasi larutan 42 oBrix) sebesar 293.60 %b.k.
Penggunaan kitosan sebagai coating mempengaruhi penurunan kadar air sampel. Adanya kitosan dapat menghambat pergerakan air keluar dari sampel. Pada perlakuan suhu 30 oC, sampel yang menggunakan kitosan memiliki penurunan kadar air yang lebih rendah dibandingkan sampel yang tidak menggunakan kitosan. Sedangkan pada perlakuan suhu 50 oC, sampel yang menggunakan kitosan memiliki penurunan kadar air yang lebih tinggi dibandingkan sampel yang tidak menggunakan kitosan. Pada suhu yang tinggi molekul-molekul yang terdapat dalam larutan gula bergerak dengan cepat dan tidak teratur. Molekul-molekul gula bergerak mendekati permukaan sampel, sehingga terjadi perbedaan konsentrasi zat terlarut yang besar antara jaringan sampel dan sekitar permukaan sampel. Oleh karena itu, air dalam jaringan sampel akan cepat dan banyak keluar ke larutan gula.
Kenaikan suhu larutan dapat meningkatkan penurunan kadar air sampel. Suhu larutan yang tinggi dapat meningkatkan pindah panas dari larutan ke permukaan dan pusat sampel. Perpindahan panas ini meningkatkan pergerakan molekul air pada sampel sehingga mempercepat perpindahan massa air dari pusat sampel ke permukaan sampel dan dari permukaan sampel ke larutan gula. Akan tetapi suhu yang terlalu tinggi dapat menyebabkan terjadinya browning pada sampel.
Hal selanjutnya yang mempengaruhi penurunan kadar air sampel adalah konsentrasi larutan osmotik. Semakin tinggi konsentrasi larutan maka semakin tinggi pula penurunan kadar air dari sampel. Pada proses osmosis, air akan bergerak dari larutan hipotonik ke larutan hipertonik. Kedua larutan ini dibedakan atas konsentrasi zat terlarut dalam pelarutnya, dalam percobaan ini gula sebagai zat terlarut dan air sebagai zat pelarut. Jika perbedaan konsentrasi gula semakin besar maka perbedaan tekanan osmotik antara sampel dengan larutan osmotik akan semakin besar. Perbedaan tekanan osmotik yang menyebabkan perpindahan air dari jaringan sampel ke larutan osmotik akan terjadi semakin cepat.
Tabel 7. Nilai parameter pengeringan dari perhitungan model Peleg
Perlakuan Sampel K1 K2 R2
E0T1C1 0.053 0.00203 0.984
E0T1C2 0.053 0.00150 0.972
E0T1C3 0.056 0.00163 0.976
E0T2C1 0.031 0.00223 0.993
E0T2C2 0.043 0.00141 0.980
E0T2C3 0.055 0.00161 0.972
E1T1C1 0.089 0.00243 0.972
E1T1C2 0.118 0.00232 0.931
E1T1C3 0.039 0.00163 0.985
E1T2C1 0.030 0.00154 0.990
E1T2C2 0.024 0.00156 0.993
Nilai K1 merupakan parameter kinetik yang mempengaruhi laju perpindahan massa air dari
sampel ke larutan osmotik. Nilai K1 berbanding terbalik dengan perpindahan massa air dan sangat
bergantung pada suhu larutan osmotik. Semakin tinggi suhu larutan osmotik maka nilai K1 semakin
kecil. Begitu juga dengan nilai K2 menurun pada suhu larutan yang tinggi. Nilai K2 merupakan
parameter yang terkait dengan kadar air kesetimbangan pada waktu yang tak hingga. Koefisien determinasi (R2) dari model Peleg memiliki kisaran nilai antara 0.931~0.990 (dapat dilihat pada Tabel 7), sehingga model Peleg memiliki kelayakan yang tinggi untuk menghitung nilai parameter kadar air dari pengeringan osmotik mangga.
B.
PENYUSUTAN VOLUME
Volume dari sampel terdiri dari volume air dan volume padatan. Adanya sejumlah air yang keluar dari sampel dapat menyebabkan adanya perubahan volume sampel. Volume sampel diukur dari volume awal sampel untuk masing-masing perlakuan. Berdasarkan Gambar 9, 10 dan 11, penyusutan volume sampel akan meningkat terhadap waktu. Gambar 11 memiliki grafik yang lebih curam dibandingkan dengan gambar lainnya. Hal ini menunjukkan bahwa laju penyusutan volume untuk perlakuan konsentrasi 66 oBrix lebih cepat jika dibandingkan dengan perlakuan konsentrasi 42 oBrix dan 54 oBrix.
Perlakuan yang diberikan pada sampel dapat mempengaruhi penyusutan volume sampel. Pemberian kitosan, suhu larutan yang rendah dan konsentrasi larutan yang rendah dapat menurunkan penyusutan volume. Sebaliknya, sampel yang tidak diberi kitosan, suhu larutan yang tinggi dan konsentrasi larutan yang tinggi akan mengalami peningkatan dalam penyusutan volume. Kitosan dapat bertindak sebagai membran yang melapisi permukaan dari sampel, sehingga kitosan pada sampel dapat mempertahankan bentuk dari sampel tersebut. Suhu larutan yang rendah dan konsentrasi larutan yang rendah dapat menurunkan intensitas keluarnya air dari sampel. Jika air yang keluar dari sampel sedikit, maka penyusutan volume yang terjadi akan rendah. Penyusutan volume terendah terjadi pada perlakuan E0T2C1 (tanpa kitosan, suhu larutan 50 oC, dan konsentrasi larutan 42 oBrix) dan penyusutan volume tertinggi terjadi pada perlakuan E0T2C3 (tanpa kitosan, suhu larutan 50 oC, dan konsentrasi larutan 66 oBrix). Data penyusutan volume sampel untuk semua perlakuan dapat dilihat pada Lampiran 3.
Gambar 9. Grafik penyusutan volume terhadap waktu pada konsentrasi larutan osmotik 42 oBrix
0 10 20 30 40 50 60
0 30 60 90 120 150 180 210 240 270 300
P en y u su ta n V o lu m e (% V /V ) Waktu (menit)
non-coating, 30 oC, 42 oBrix non-coating, 50 oC, 42 oBrix
Gambar 10. Grafik penyusutan volume terhadap waktu pada konsentrasi larutan osmotik 54 oBrix
Gambar 11. Grafik penyusutan volume terhadap waktu pada konsentrasi larutan osmotik 66 oBrix
C.
TINGKAT KEHILANGAN AIR/
WATER LOSS
(WL)
Semakin tinggi nilai WL maka menunjukkan tingginya tingkat kehilangan air pada sampel. Dari data yang diperoleh, nilai WL yang paling tinggi terjadi pada perlakuan E1T2C3 (menggunakan kitosan, suhu larutan 50 oC dan konsentrasi larutan 66 oBrix) yaitu 64.68 %, sedangkan nilai WL yang paling rendah terjadi pada perlakuan E1T1C1 (menggunakan kitosan, suhu larutan 30 oC dan konsentrasi larutan 42 oBrix) yaitu sebesar 27.70 %. Hal ini menunjukkan tingginya nilai persentase WL berbanding terbalik dengan kadar air akhir dari sampel. Kadar air akhir sampel yang rendah menunjukkan sampel mengalami banyak kehilangan air sehingga nilai WL tinggi, dan sebaliknya kadar air akhir sampel yang masih tinggi berarti sampel mengalami sedikit kehilangan air sehingga nilai WL rendah. Oleh karena itu, faktor-faktor yang menyebabkan tinggi-rendahnya kadar air juga menyebabkan tinggi-rendahnya tingkat kehilangan air pada sampel selama proses pengeringan osmotik.
Meningkatnya nilai WL dipengaruhi oleh pemberian kitosan pada sampel. Sampel yang diberi kitosan pada perlakuan suhu 30 oC memiliki nilai WL yang lebih rendah dibandingkan dengan sampel
0 10 20 30 40 50 60
0 30 60 90 120 150 180 210 240 270 300
P en y u su ta n V o lu m e (% V /V ) Waktu (menit) 0 10 20 30 40 50 60
0 30 60 90 120 150 180 210 240 270 300
P en y u su ta n V o lu m e (% V /V ) Waktu (menit)
non-coating, 30 oC, 66 oBrix non-coating, 50 oC, 66 oBrix
coating, 30 oC, 66 oBrix coating, 50 oC, 66 oBrix non-coating, 30 oC, 54 oBrix non-coating, 50 oC, 54 oBrix
tanpakitosan pada perlakuan suhu yang sama. Hal ini menunjukkan bahwa pemberian kitosan dapat menurunkan tingkat kehilangan air pada sampel sehingga nilai WL menjadi rendah. Perlakuan selanjutnya yaitu perbedaan suhu larutan osmotik. Dari perlakuan suhu larutan 30 oC dan suhu larutan 50 oC, diperoleh bahwa nilai WL untuk perlakuan suhu larutan 30 oC lebih rendah dari pada nilai WL untuk perlakuan suhu larutan 50 oC. Jadi, semakin tinggi suhu maka tingkat kehilangan air pada sampel juga semakin tinggi. Adanya perbedaan konsentrasi larutan osmotik yang digunakan juga mempengaruhi nilai WL. Dari Gambar 12, 13 dan 14 diperoleh bahwa semakin tinggi konsentrasi larutan maka nilai WL semakin tinggi dan bentuk grafik semakin curam. Dapat disimpulkan bahwa semakin tinggi konsentrasi larutan maka laju kehilangan air semakin cepat dan tingkat kehilangan air pada sampel semakin tinggi.
Gambar 12. Grafik kenaikan WL terhadap waktu untuk konsentrasi larutan 42 oBrix
Gambar 13. Grafik kenaikan WL terhadap waktu untuk konsentrasi larutan 54 oBrix
0 10 20 30 40 50 60 70
0 30 60 90 120 150 180 210 240 270 300
W
L
(%
)
Waktu (menit)
0 10 20 30 40 50 60 70
0 30 60 90 120 150 180 210 240 270 300
W
L
(%
)
Waktu (menit)
non-coating, 30 oC, 42 oBrix non-coating, 50 oC, 42 oBrix
coating, 30 oC, 42 oBrix coating, 50 oC, 42 oBrix
non-coating, 30 oC, 54 oBrix non-coating, 50 oC, 54 oBrix
Gambar 14. Grafik kenaikan WL terhadap waktu untuk konsentrasi larutan 66 oBrix
Peningkatan WL pada menit-menit awal percobaan sangat besar dan peningkatan tidak terjadi secara signifikan pada akhir waktu percobaan. Dapat dilihat pada Gambar 12, 13 dan 14, dimana bentuk grafik meningkat tajam dan semakin landai pada menit-menit berikutnya. Bentuk grafik akan menjadi konstan hingga mencapai nilai WL∞ untuk waktu yang tak hingga (kondisi kesetimbangan). Besarnya angka WL∞ juga dipengaruhi oleh adanya pemberian kitosan, suhu larutan dan konsentrasi larutan. Tanpa pemberian kitosan, suhu larutan yang tinggi dan konsentrasi yang tinggi akan meningkatkan WL∞. Nilai WL∞ dapat dilihat pada Tabel 8.
Tabel 8. Nilai parameter dan koefisien determinasi dari perhitungan WL dengan menggunakan model Azuara
Perlakuan Sampel WL∞ S1 R2
E0T1C1 34.48 0.030 0.963
E0T1C2 50.00 0.013 0.968
E0T1C3 55.56 0.021 0.978
E0T2C1 34.48 0.039 0.978
E0T2C2 58.82 0.021 0.974
E0T2C3 66.67 0.017 0.961
E1T1C1 28.57 0.045 0.987
E1T1C2 40.00 0.026 0.954
E1T1C3 55.56 0.029 0.982
E1T2C1 55.56 0.034 0.979
E1T2C2 62.50 0.037 0.977
E1T2C3 71.43 0.026 0.974
0 10 20 30 40 50 60 70
0 30 60 90 120 150 180 210 240 270 300
W
L
(%
)
Waktu (menit)
non-coating, 30 oC, 66 oBrix non-coating, 50 oC, 66 oBrix
Gambar 15. Grafik kenaikan WL terhadap waktu untuk masing-masing perlakuan berdasarkan perhitungan dengan menggunakan model Azuara
Koefisien determinasi (R2) dari model Azuara untuk perhitungan nilai WL memiliki kisaran nilai antara 0.954~0.987, sehingga persamaan pada model Azuara layak untuk menghitung nilai WL pada pengeringan osmotik irisan buah mangga. Untuk mengukur tingkat validasi dari model Azuara, maka dilakukan penggabungan antara grafik WL hasil pengukuran dan grafik WL hasil perhitungan dengan menggunakan model Azuara (terdapat pada Lampiran 5). Penggabungan kedua grafik tersebut dapat dilihat bahwa WL hasil pengukuran mendekati sama dengan WL hasil perhitungan. Walaupun tidak semua titik-titik pada pengukuran berhimpit dengan garis grafik WL hasil perhitungan.
D.
PERTAMBAHAN PADATAN TERLARUT/
SOLID GAIN
(SG)
Pengeringan osmotik melibatkan dua aliran material yang berlawanan arah dan terjadi secara simultan, yaitu keluarnya air dari jaringan sampel ke larutan osmotik dan aliran padatan terlarut dari larutan osmotik ke dalam jaringan sampel. Nilai SG merupakan parameter yang menunjukkan banyaknya jumlah padatan terlarut yang masuk ke dalam sampel. Semakin tinggi nilai SG maka jumlah padatan terlarut yang masuk ke dalam sampel semakin banyak. Sebaliknya, semakin rendah nilai SG maka jumlah padatan terlarut yang masuk ke dalam sampel semakin sedikit. Dalam pengeringan osmotik diupayakan nilai SG serendah mungkin, karena padatan terlarut yang masuk ke sampel dapat mempengaruhi rasa dari sampel terutama tingkat kemanisan dari sampel.
Dari data yang diperoleh, nilai SG yang paling tinggi terjadi pada perlakuan E0T2C1 (tanpa kitosan, suhu larutan 50 oC, dan konsentrasi larutan 42 oBrix) yaitu 12.75%. Sedangkan nilai SG yang paling rendah terjadi pada perlakuan E1T1C3 (menggunakan kitosan, suhu larutan 30 oC, dan konsentrasi larutan 66 oBrix) sebesar 4.05%. Peningkatan kehilangan air dari sampel tidak selalu diikuti dengan peningkatan jumlah padatan terlarut yang masuk ke dalam sampel.
Nilai SG juga dipengaruhi oleh pemberian kitosan, suhu larutan, dan konsentrasi dari larutan osmotik. Pemberian coating berupa kitosan pada sampel dapat menurunkan nilai SG. Fungsi dari kitosan yaitu sebagai membran yang dapat menghalangi masuknya padatan terlarut dari larutan osmotik ke jaringan sampel. Nilai SG pada perlakuan suhu 30 oC lebih rendah dari pada nilai SG pada
0 10 20 30 40 50 60 70
0 30 60 90 120 150 180 210 240 270 300
W
L
(%
)
Waktu ( menit)
non-coating, 30 oC, 42 oBrix non-coating, 30 oC, 54 oBrix non-coating, 30 oC, 66 oBrix
non-coating, 50 oC, 42 oBrix non-coating, 50 oC, 54 oBrix non-coating, 50 oC, 66 oBrix coating, 30 oC, 42 oBrix coating, 30 oC, 54 oBrix coating, 30 oC, 66 oBrix
perlakuan suhu 50 oC, dimana kondisi perlakuan yang lain adalah sama. Jadi, semakin tinggi suhu menyebabkan nilai SG semakin tinggi. Pori dalam membran semipermeabel terlalu kecil untuk dapat dilewati oleh molekul gula, tetapi cukup besar untuk dilewati molekul air. Dengan adanya peningkatan suhu larutan dapat memperbesar pori dalam membran semipermeabel, sehingga memungkinkan molekul gula dapat lebih banyak masuk ke dalam jaringan sampel. Tingkat konsentrasi larutan berbanding terbalik dengan kenaikan nilai SG. Semakin tinggi konsentrasi larutan maka nilai SG semakin rendah, tetapi laju kenaikan nilai SG semakin cepat. Larutan dengan konsentrasi zat terlarut yang lebih tinggi mempunyai molekul-molekul gula yang lebih banyak. Molekul-molekul gula tersebut bergerak acak mendekati sampel dan membentuk membrane pada permukaan sampel. Membran ini dapat berfungsi mencegah masuknya padatan terlarut ke dalam jaringan sampel.
Gambar 16. Grafik kenaikan SG terhadap waktu untuk konsentrasi larutan 42 oBrix
Gambar 17. Grafik kenaikan SG terhadap waktu untuk konsentrasi larutan 54 oBrix
Gambar 18. Grafik kenaikan SG terhadap waktu untuk konsentrasi larutan 66 oBrix
0 5 10 15
0 30 60 90 120 150 180 210 240 270 300
S
G
(%
)
Waktu (menit)
0 5 10 15
0 30 60 90 120 150 180 210 240 270 300
S
G
(%
)
Waktu (menit)
0 5 10 15
0 30 60 90 120 150 180 210 240 270 300
S
G
(%
)
Waktu (menit)
non-coating, 30 oC, 66 oBrix non-coating, 50 oC, 66 oBrix
coating, 30 oC, 66 oBrix coating, 50 oC, 66 oBrix non-coating, 30 oC, 42 oBrix non-coating, 50 oC, 42 oBrix
coating, 30 oC, 42 oBrix coating, 50 oC, 42 oBrix
non-coating, 30 oC, 54 oBrix non-coating, 50 oC, 54 oBrix
Tabel 9. Nilai parameter dan koefisien determinasi dari perhitungan SG dengan menggunakan model Azuara
Perlakuan Sampel SG∞ S2 R2
E0T1C1 11.49 0.014 0.969
E0T1C2 11.76 0.013 0.944
E0T1C3 10.10 0.011 0.962
E0T2C1 12.99 0.033 0.955
E0T2C2 13.70 0.009 0.903
E0T2C3 8.77 0.018 0.940
E1T1C1 11.76 0.005 0.984
E1T1C2 10.64 0.002 0.932
E1T1C3 4.37 0.027 0.917
E1T2C1 9.90 0.017 0.935
E1T2C2 11.24 0.026 0.978
E1T2C3 8.85 0.023 0.928
Pengukuran SG pada saat percobaan tidak diukur secara langsung. Nilai SG diperoleh dari pengurangan berat total sampel terhadap berat air yang terkandung dalam sampel. Nilai yang diperoleh dihitung dengan Persamaan 5. Koefisien determinasi (R2) untuk perhitungan nilai SG dengan menggunakan model Azuara memiliki kisaran nilai 0.917~0.984. Penggabungan grafik SG hasil pengukuran dengan grafik hasil perhitungan model Azuara akan menunjukkan validasi dari model. Banyak nilai SG hasil pengukuran berada di atas dan di bawah grafik SG hasil perhitungan model Azuara. Penggabungan kedua grafik tersebut dapat dilihat pada Lampiran 6.
Gambar 19. Grafik kenaikan SG terhadap waktu untuk masing-masing perlakuan berdasarkan perhitungan dengan menggunakan model Azuara
0 2 4 6 8 10 12
0 30 60 90 120 150 180 210 240 270 300
S
G
(%
)
Waktu (menit)
non-coating, 30 oC, 42 oBrix non-coating, 30 oC, 54 oBrix non-coating, 30 oC, 66 oBrix
non-coating, 50 oC, 42 oBrix non-coating, 50 oC, 54 oBrix non-coating, 50 oC, 66 oBrix coating, 30 oC, 42 oBrix coating, 30 oC, 54 oBrix coating, 30 oC, 66 oBrix
Seperti halnya Water Loss, grafik nilai SG juga berbentuk curam pada waktu awal percobaan dan makin landai pada waktu akhir percobaan hingga mencapai nilai SG maksimum untuk waktu yang tak hingga yang dinotasikan dengan SG∞. Nilai SG∞ juga dipengaruhi oleh pemberian kitosan, suhu dan konsentrasi larutan. Pemberian kitosan dan konsentrasi larutan yang tinggi akan menurunkan nilai SG∞, sedangkan suhu larutan yang tinggi dapat meningkatkan SG∞. Nilai SG∞ dapat dilihat pada Tabel 9.
E.
RASIO KINERJA/
PERFORMANCE RATIO (PR)
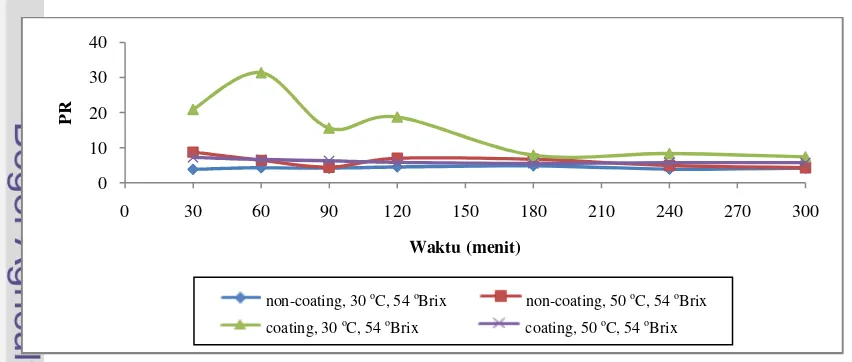
[image:30.595.104.530.520.701.2]Performance Ratio (PR) merupakan tingkat kinerja dari proses pengeringan osmotik. Nilai PR yang tinggi menunjukkan proses pengeringan berjalan efektif. Untuk meningkatkan nilai PR, maka nilai WL harus ditingkatkan dan nilai SG yang diperoleh seminimal mungkin. Dari Gambar 20, 21 dan 22 dapat dikatakan bahwa sebagian besar nilai PR konstan tiap waktunya, walaupun ada beberapa nilai PR yang berfluktuatif.
Gambar 20.Grafik rasio kinerja pengeringan osmotik pada konsentrasi larutan osmotik 42 oBrix
Gambar 21.Grafik rasio kinerja pengeringan osmotik pada konsentrasi larutan osmotik 54 oBrix
0 10 20 30 40
0 30 60 90 120 150 180 210 240 270 300
P
R
Waktu (menit)
0 10 20 30 40
0 30 60 90 120 150 180 210 240 270 300
P
R
Waktu (menit)
non-coating, 30 oC, 42 oBrix non-coating, 50 oC, 42 oBrix
coating, 30 oC, 42 oBrix coating, 50 oC, 42 oBrix
non-coating, 30 oC, 54 oBrix non-coating, 50 oC, 54 oBrix
Gambar 22.Grafik rasio kinerja pengeringan osmotik pada konsentrasi larutan osmotik 66 oBrix
Pada Tabel 10 terdapat nilai PR untuk masing-masing perlakuan pada waktu akhir proses pengeringan osmotik. Diperoleh bahwa nilai PR terbesar yaitu 12.2 terdapat pada perlakuan E1T1C3 (menggunakan kitosan, suhu larutan 30 oC, dan konsentrasi larutan 66 oBrix).
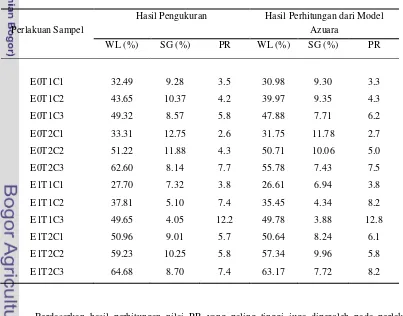
Tabel 10. Nilai Performance Ratio (PR) dari hasil pengukuran dan perhitungan model Azuara untuk masing-masing perlakuan
Perlakuan Sampel
Hasil Pengukuran Hasil Perhitungan dari Model Azuara
WL (%) SG (%) PR WL (%) SG (%) PR
E0T1C1 32.49 9.28 3.5 30.98 9.30 3.3
E0T1C2 43.65 10.37 4.2 39.97 9.35 4.3
E0T1C3 49.32 8.57 5.8 47.88 7.71 6.2
E0T2C1 33.31 12.75 2.6 31.75 11.78 2.7
E0T2C2 51.22 11.88 4.3 50.71 10.06 5.0
E0T2C3 62.60 8.14 7.7 55.78 7.43 7.5
E1T1C1 27.70 7.32 3.8 26.61 6.94 3.8
E1T1C2 37.81 5.10 7.4 35.45 4.34 8.2
E1T1C3 49.65 4.05 12.2 49.78 3.88 12.8
E1T2C1 50.96 9.01 5.7 50.64 8.24 6.1
E1T2C2 59.23 10.25 5.8 57.34 9.96 5.8
E1T2C3 64.68 8.70 7.4 63.17 7.72 8.2
Berdasarkan hasil perhitungan nilai PR yang paling tinggi juga diperoleh pada perlakuan E1T1C3 yaitu 12.8. Jadi dapat dikatakan bahwa nilai PR dari hasil pengukuran tidak berbeda jauh dengan nilai PR hasil perhitungan dengan model Azuara.
0 10 20 30 40
0 30 60 90 120 150 180 210 240 270 300
P
R
Waktu (menit)
non-coating, 30 oC, 66 oBrix non-coating, 50 oC, 66 oBrix
V.
PENUTUP
A.
KESIMPULAN
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Perlakuan sampel tanpa kitosan, suhu yang tinggi dan konsentrasi larutan yang tinggi menyebabkan kadar air akhir sampel menjadi rendah. Sebaliknya penggunaan kitosan, suhu yang rendah dan konsentrasi yang rendah menyebabkan kadar air akhir sampel masih tinggi.
2. Perlakuan sampel tanpa kitosan, suhu yang tinggi dan konsentrasi larutan yang tinggi menyebabkan nilai water loss menjadi tinggi. Sebaliknya penggunaan kitosan, suhu yang rendah dan konsentrasi yang rendah menyebabkan nilai water loss rendah.
3. Sampel yang tidak diberi kitosan, suhu yang tinggi dan konsentrasi larutan yang rendah menyebabkan nilai solid gain menjadi tinggi. Sebaliknya sampel yang diberi kitosan, suhu yang rendah dan konsentrasi larutan yang tinggi menyebabkan nilai solid gain rendah.
4. Penyusutan volume dapat meningkat pada perlakuan tanpa pemberian kitosan pada sampel, suhu larutan yang tinggi dan konsentrasi larutan yang tinggi. Sebaliknya, penyusutan volume menurun jika sampel diberi kitosan, suhu larutan rendah dan konsentrasi larutan rendah.
5. Perlakuan terbaik yang mempunyai nilai (PR) paling tinggi berdasarkan penelitian ini adalah perlakuan E1T1C3 (menggunakan kitosan, suhu larutan 30 oC, dan konsentrasi larutan 66 oBrix) dengan nilai PR sebesar 12.2.
6. Model Azuara dapat dikatakan layak dalam memodelkan water loss dan solid gain dalam pengeringan osmotik irisan buah mangga.
B.
SARAN
PENGERINGA
ARUMANIS (
Man
FAK
GAN OSMOTIK PADA IRISAN BUAH
angifera indica
L.) DENGAN PELAPIS
SKRIPSI
MIFTAHUL JANNAH
F14070128
FAKULTAS TEKNOLOGI PERTANIA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
AH MANGGA
PISAN KITOSAN
DAFTAR PUSTAKA
Agrobuah. 2011. Mangga Arumanis/Pelem Gadung. Alamat URL: http://agrobuah.com/tag/mangga-arumanis. [20 September 2011].
Baldwin EA. 1994. Edible coatings for fresh fruits and vegetables: past, present and future. In : Krochta JM, Baldwin EA, Nisperos-Carriedo MO (Eds.). Edible Coatings and Films to Improve Food Quality. Lancaster. Technomic Pub. Co. Inc.
Broto W. 2003. Mangga: Budi Daya. Pascapanen. dan Tata Niaganya. Jakarta: Agromedia Pustaka.
Broto W, SD Sabari dan Siswadi. 1989. Penundaan pematangan buah mangga (Mangifera indica L.) arumanis dengan pembungkusan rapat per buah dalam kantong plastik. Dalam: Faizal A. 1997. Pengawetan Segar Buah Mangga [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
Camirand et al. 1992. Properties of some edible carbohydrate polymer coatings for potential use in osmotic dehydration. Carbohydrate Pol., 17(1): 39-49.
Chottaom et al. 2005. Moisture desorption isotherms for fresh and osmotically treated mangoes. Pakistan Journal of Biological Science 8(2): 239-243.
El-Ghaouth A, Ponnampalan R, Castaigne F, Arul J. 1992. Chitosan coating to extend storage life of tomatoes. HortScience 27 : 1016-1018.
Krochta JM. EA Baldwin. dan MO Nisperos-Carriedo. 1994. Edible Coating and Film to Improve Food Quality. Technomic Publishing Company. New York. NY.
FAO. 2007. Data Produsen Mangga. Dalam: http://id.wikipedia.org/wiki/Mangga. [20 Feb 2011].
Indigomorie. Tekanan Osmotik. http://belajarkimia.com/tekanan-osmotik/. [20 Feb 2011].
Jagatiani J et al. 1988. Tropical Fruit Processing. Academic Press. Inc. New York.
Karathanos VT, AE Kostrapoulos, and GD Saravacos. 1995. Air drying kinetics of osmoticalily dehydrated fruits. Drying Technology 13(5-7): 1503-1521.
Kementrian Pertanian Indonesia. 2008. Basis data pertanian. Alamat URL: http://aplikasi.deptan.go.id/bdsp/hasil_kom.asp. [31 Okt 2011].
Khan MAM, Ahrne´ L, Oliveira JC, and Oliveira FAR. 2008. Prediction of water and soluble solids concentration during osmotic dehydration of mango. Food and Bioproducts Processing 86:7-13.
Lenart A and PP Lewicki. 1990. Osmotic dehydration of apples at high temperature. In: Mujumbar, A.S. (ed.) Drying ´89. Bristol: Hemisphere.
Lenart A. 1996. Osmo convective of fruits and vegetables: Technology and applications. Drying Technology 14(2): 391-413.
Monteiro H et al. 2003. Maximization of the performance ratio of osmotic dehydration of mango cubes. Proc. Interamer. Soc. Trop. Hort. 47:200-202.
Murtini JT, Dwiyitno dan Yusma. 2008. Penurunan kandungan kolesterol pada cumi-cumi dengan
kitosan larut asam dan pengepresan. Prosiding Seminar Nasional Tahunan V Hasil Kelautan
Nisperos-Carriedo MO. 1994. Edible coating and film based on polysaccharides In Krochta JM, Baldwin EA, Nisperos-Carriedo MO, (Eds.) Edible Coatings And Films to Improve Food Quality. Lancaster. Technomic Pub. Co. Inc.
Pracaya (a). 1985. Bertanam mangga. Dalam: Leonard S. 2001. Mempelajari Beberapa Teknologi Olah Minimal pada Buah Mangga Arumanis (Mangifera Indica L.) [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
Pracaya (b). 1990. Bertanam mangga. Dalam: Leonard S. 2001. Mempelajari Beberapa Teknologi Olah Minimal pada Buah Mangga Arumanis (Mangifera Indica L.) [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
Pratikno, Sosrodiharjo. 1989. Dalam: Faizal A. 1997. Pengawetan Segar Buah Mangga [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
Rahman MS and J Lamb. Osmotic dehydration of pineapple. 1990. J. Food Sci. Techn., 27(3): 150-152. Statsoft. 1995. Statistica for Windows [Computer program manual]. Tulsa: StatSoft.
Ramalo LA, Mascheroni RH. 2005. Rate of water loss and sugar uptake during the osmotic dehydration of pineapple. Brazilian Archives Of Biology And Technology An International Journal 48: 761-770.
Rochima E. 2009. Karakterisasi kitin dan kitosan asal limbah rajungan Cirebon Jawa Barat. Alamat URL: resources.unpad.ac.id/unpad.../Makalah-5.Karakterisasi%20kitin.pdf [9 Nov 2011].
Seymour GB et al. 1993. Biochemistry of fruit ripening. Dalam: Leonard S. 2001. Mempelajari Beberapa Teknologi Olah Minimal pada Buah Mangga Arumanis (Mangifera Indica L.) [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
Souza JS et al. 2007. Optimization of osmotic dehydration of tomatoes in a ternary system followed by air-drying. Journal of Food Engineering 83: 501-509.
Sugita P et al. 2009. Kitosan Sumber Biomaterial Masa Depan. Bogor: IPB Press.
Videv K, S Tanchev, RC Sharma, and VK Joshi. 1990. Effect of sugar syrup concentration and temperature on the rate of osmotic dehydration of apples. J. Food Sci. Techn., 27(5): 307-308.
Wardaniati RA dan Sugiyani S. 2009. Pembuatan chitosan dari kulit udang dan aplikasinya untuk pengawetan bakso. Alamat URL: http://eprints.undip.ac.id/1718/1/makalah_penelitian_fix.pdf [9 Nov 2011].
Yulianingsih, Laksmi DS. 1988. Analisa sifat fisik dan kimia buah mangga. Dalam: Faizal A. 1997. Pengawetan Segar Buah Mangga [skripsi]. Bogor: Fakultas Teknologi Pertanian. IPB.
PENGERINGA
ARUMANIS (
Man
FAK
GAN OSMOTIK PADA IRISAN BUAH
angifera indica
L.) DENGAN PELAPIS
SKRIPSI
MIFTAHUL JANNAH
F14070128
FAKULTAS TEKNOLOGI PERTANIA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
AH MANGGA
PISAN KITOSAN
OSMOTIC DEHYDRATION OF SLICE OF MANGO ARUMANIS
(
Mangifera indica
L.) WITH CHITOSAN-COATING
Miftahul Jannah* and Leopold O. Nelwan**
*Under Graduate Student at Department of Mechanical and Biosystem Engineering, Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, IPB Darmaga Campus,
PO Box 220, Bogor, West Java, Indonesia. e-mail: mita.TEPers@gmail.com