IDENTIFIKASI CENDAWAN ENDOFIT ASAL TANAMAN
OBAT JATI BELANDA (
Guazuma
ulmifolia
) SERTA
PENAPISAN POTENSI ANTIBAKTERINYA
RANI PARAWITASARI DEN KA’A
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RANI PARAWITASARI DEN KA’A. Identifikasi Cendawan Endofit Asal Tanaman Obat Jati Belanda (Guazuma ulmifolia) serta Penapisan Potensi Antibakterinya. Dibimbing oleh UTUT WIDYASTUTI dan NAMPIAH SUKARNO.
Cendawan endofit ialah mikroorganisme yang hidup di dalam jaringan sehat tanaman inangnya tanpa menyebabkan penyakit. Cendawan endofit tumbuh pada setiap tumbuhan, termasuk tanaman obat jati belanda secara intraseluler dan/atau interseluler. Jati belanda merupakan salah satu tanaman obat di Indonesia yang mengandung senyawa antimikroba, termasuk antibakteri. Penelitian ini bertujuan untuk mengidentifikasi tiga cendawan endofit asal jati belanda secara morfologi dan molekuler, serta menapis potensi antibakterinya menggunakan ekstrak miselia dengan pelarut metanol terhadap bakteri uji Escherichia coli flora normal,
Escherichia coli Enteropatogenik (EPEC) K1-1, Staphylococcus aureus, Pseudomonas aeruginosa, dan Bacillus subtilis. Ketiga cendawan endofit tersebut ialah JBba3, JBba4, dan JBa5. Berdasarkan karakteristik morfologi, isolat JBba3 teridentifikasi sebagai Rhizopycnis sp.1, JBa5 ialah Rhizopycnis sp.2, sedangkan isolat JBba4 ialah Colletotrichum sp. Hasil identifikasi menggunakan ruas ITS rDNA menunjukkan bahwa isolat JBba3 dan JBa5 ialah Rhizopycnis vagum, sedangkan isolat JBba4 ialah Colletotrichum sp. Semua isolat tidak menghambat pertumbuhan E. coli flora normal. Isolat Rhizopycnis sp.1 dan Rhizopycnis sp.2 tidak menghambat pertumbuhan semua bakteri uji. Isolat Colletotrichum sp. menghambat pertumbuhan bakteri EPEC K1-1 dan P. aeruginosa dengan rata-rata diameter zona hambat masing-masing sebesar 13.0 dan 6.7 mm. Kemampuan antibakteri dari ekstrak miselia dengan pelaut metanol isolat Colletotrichum
sp. sama dengan antibiotik cefotaxime sebagai kontrol positif pada dua konsentrasi yang diuji, yaitu 8 dan 64 µg/ml.
Kata kunci: cendawan endofit, potensi antibakteri, identifikasi, Colletotrichum, Rhizopycnis Guazuma ulmifolia
ABSTRACT
RANI PARAWITASARI DEN KA’A. Identification of Endophytic Fungi Isolated from Jati Belanda (Guazuma ulmifolia) Medicinal Plant and Screening Their Antibacterial Potency. Supervised by UTUT WIDYASTUTI and NAMPIAH SUKARNO.
Endophytic fungi are microorganisms living in healthy tissue of their host plants without causing disease. Endophytic fungi live in every plant, including jati belanda medicinal plant intracellulary and/or intercellulary. Jati belanda (Guazuma ulmifolia) is one of Indonesia medicinal plants. The plant produced antimicrobe substances, including antibacteria. This research aimed to identify three endophytic fungi isolated from jati belanda morphologically and molecularly, and to screen their antibacterial potency by using mycelial extracts obtained with methanol solvent against microflora Escherichia coli, Enteropathogenic Escherichia coli (EPEC) K1-1,
Staphylococcus aureus, Pseudomonas aeruginosa, and Bacillus subtilis as tested bacteria. The three endophytic fungi were JBba3, JBba4, and JBa5. Based on morphological characteristics, fungal isolate JBba3 identified as Rhizopycnis sp.1, JBa5 was Rhizopycnis sp.2, whereas JBba4 was Colletotrichum sp. Identification results by using ITS rDNA region showed that isolates JBba3 and JBa5 were Rhizopycnisvagum, meanwhile isolate JBba4 was Colletotrichum sp. All three isolates tested did not inhibit the growth of the microflora E. coli. Isolates Rhizopycnis sp.1 and Rhizopycnis sp.2 did not inhibit the growth of all bacteria tested. Isolate Colletotrichum sp. inhibited the growth of EPEC K1-1 and P. aeruginosa with diameters zone of inhibition were 13.0 and 6.7 mm, respectively. Antibacterial potencies of Colletotrichum sp. mycelial extract were similar with cefotaxime antibiotic as positive control on two concentrations tested, which were 8 and 64 µg/ml.
Keywords: endophytic fungi, antibacterial potency, identification, Colletotrichum, Rhizopycnis,
IDENTIFIKASI CENDAWAN ENDOFIT ASAL TANAMAN
OBAT JATI BELANDA (
Guazuma
ulmifolia
) SERTA
PENAPISAN POTENSI ANTIBAKTERINYA
RANI PARAWITASARI DEN KA’A
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
:
Identifikasi Cendawan Endofit Asal Tanaman Obat Jati
Belanda (
Guazuma ulmifolia
) serta Penapisan Potensi
Antibakterinya
Nama
:
Rani Parawitasari Den Ka’a
NIM :
G34080043
Disetujui,
Pembimbing I
Dr. Ir. Utut Widyastuti, M.Si.
NIP 19640517 198903 2 001
Pembimbing II
Dr. Ir. Nampiah Sukarno
NIP 19590504 198703 2 001
Diketahui,
Ketua Departemen Biologi
Dr. Ir. Iman Rusmana, M.Si.
NIP 19650720 199103 1 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Penelitian dengan judul “Identifikasi Cendawan Endofit Asal Tanaman Obat Jati Belanda (Guazuma ulmifolia) serta Penapisan Potensi Antibakterinya” ini dilakukan mulai Februari 2012 sampai dengan Desember 2012 di Laboratorium Biorin, Gedung Pusat Antar Universitas, PPSHB, Institut Pertanian Bogor. Penelitian ini didanai oleh Dr. Ir. Utut Widyastuti, M.Si. dan Dr. Ir. Nampiah Sukarno. Oleh karena itu, saya ucapkan terima kasih.
Terima kasih penulis ucapkan kepada Dr. Ir. Utut Widyastuti, M.Si. dan Dr. Ir. Nampiah Sukarno atas bimbingan dan arahan yang diberikan. Penulis juga mengucapkan terima kasih kepada Dr. Ignatius Muhadiono selaku dosen penguji wakil komisi pendidikan yang telah bersedia menguji dan memberikan saran saat ujian dan penulisan karya ilmiah. Penulis mengucapkan terima kasih kepada ayahanda Ramli Den Ka’a, Ibunda Haryani, kakak Randi Haris Den Ka’a, dan adik Reni Triani Den Ka’a untuk segala pengorbanan, doa dan dukungan. Terima kasih kepada Rezana Falachi atas segala dukungannya. Terima kasih kepada Dikti yang telah memberikan dana penelitian kepada Dr. Utut Widyastuti dan Dr. dr. Sri Budiarti yang telah memberikan isolat bakteri uji dari Laboratorium Mikrobiologi, Departemen Biologi, IPB. Terima kasih kepada PPSHB IPB yang telah memberikan fasilitas penelitian. Ungkapan terima kasih juga disampaikan kepada rekan-rekan di laboratorium Biorin (Gina, Latifah, Nurul, Kak Nurul, Kak Fajri, Kak Ophie, Kak Lia, Kak Delih, Kak Fany, Mbak Tri, dan Mbak Pepy) dan Departemen Biologi (Delfi, Rina, Agus H, Dyah, Uun, dan Dirga) atas bantuan dan saran selama penulis melakukan penelitian ini.
Penulis berharap semoga karya tulis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Mei 2013
Rani Parawitasari Den Ka’a
RIWAYAT HIDUP
Penulis dilahirkan di Makassar, Provinsi Sulawesi Selatan dari pasangan Ramli Den Ka’a dan Haryani. Penulis merupakan anak kedua dari tiga bersaudara. Penulis menyelesaikan pendidikan di TK Negeri Pembina Mataram pada tahun 1996, SD Negeri 16 Mataram pada tahun 2002, SMP Negeri 6 Mataram pada tahun 2005, dan SMA Negeri 5 Mataram pada tahun 2008. Setelah itu, penulis melanjutkan pendidikan tinggi di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE ... 1
Waktu dan Tempat ... 1
Alat dan Bahan ... 1
Penyiapan Kultur Cendawan Endofit ... 2
Identifikasi Secara Morfologi ... 2
Identifikasi Secara Molekuler... 2
Penapisan Potensi Antibakteri ... 2
HASIL ... 4
Identifikasi Secara Morfologi ... 4
Identifikasi Secara Molekuler... 6
Penapisan Potensi Antibakteri ... 6
PEMBAHASAN ... 8
SIMPULAN ... 10
SARAN ... 10
UCAPAN TERIMA KASIH... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hasil identifikasi secara mikroskopis isolat JBba3, JBba4, dan JBa5 ... 4
2 Hasil analisis bioinformatika menggunakan megaBLAST dari NCBI ... 6
3 Hasil penapisan antibakteri isolat JBba3, JBba4, dan JBa5 terhadap E. coli flora normal pada hari ke-3 setelah inkubasi ... 6
4 Hasil penapisan antibakteri isolat JBba3, JBba4, dan JBa5 terhadap empat bakteri uji pada hari ke-3 setelah inkubasi ... 7
5 Rata-rata diameter zona bening yang dibentuk oleh ekstrak miselia dari isolat JBba4 menggunakan metanol, cefotaxime, dan pelarut metanol terhadap bakteri uji ... 7
6 Hasil analisis Independent-Samples T Test antara ekstrak menggunakan metanol dari isolat JBba4 dengan kontrol positif pada konsentrasi 8 dan 64 µg/ml ... 7
DAFTAR GAMBAR
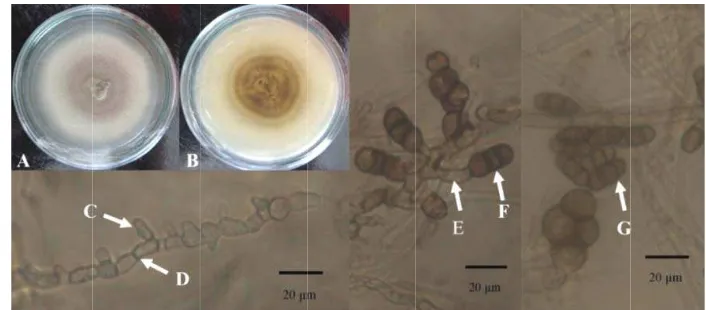
Halaman 1 Morfologi Rhizopycnis sp.1 (isolat JBba3): (A) koloni tampak atas, (B) koloni tampak bawah, (C) penjuluran hifa, (D) hifa septat, (E) konidiofor, (F-G) konidia. Perbesaran 1000×. Skala bar 20 µm. ... 52 Morfologi Colletotrichum sp. (isolat JBba4): (A) koloni tampak atas, (B) koloni tampak bawah, (C-D) apresoria perbesaran 1000×, (E) hifa septat perbesaran 1000×, (F) konidia perbesaran 600×. Skala bar 20 µm. ... 5
3 Morfologi Rhizopycnis sp.2 (isolat JBa5): (A) koloni tampak atas, (B) koloni tampak bawah, (C-D) klamidospora tersusun seperti rantai perbesaran 1000× dan 600×, (E) klamidospora perbesaran 1000×, (F) penjuluran hifa perbesaran 1000×, (G) hifa septat perbesaran 1000×. Pewarnaan dengan lactophenol cotton blue. Skala bar 20 µm. ... 5
4 Amplikon ruas ITS yang memperlihatkan kualitas pita tunggal berukuran ±600 pb pada gel agarosa 1%: (M) Marker 1 Kb ladder, (ba4) JBba4, (ba3) JBba3, dan (a5) JBa5. ... 6
5 Penapisan aktifitas antibakteri isolat JBba4: (A) uji terhadap EPEC K1-1, (B) uji terhadap P. aeruginosa, (C) kontrol negatif terhadap E. coli flora normal, (D) kontrol negatif EPEC K1-1 terhadap metanol, (E) kontrol negatif P. aeruginosa terhadap metanol, (F) kontrol negatif E. coli flora normal terhadap metanol. Pengamatan pada hari ke-3 inkubasi. Keterangan gambar ditunjukkan oleh tanda panah. ... 7
DAFTAR LAMPIRAN
Halaman 1 Cara membuat larutan CTAB 2% ... 142 Cara membuat larutan TAE 1× dari stok larutan TAE 50×... 15
3 Cara membuat larutan antibiotik cefotaxime 8 µg/ml dan 64 µg/ml ... 16
PENDAHULUAN
Latar BelakangCendawan endofit ialah mikroorganisme yang menghabiskan seluruh atau sebagian siklus hidupnya mengkolonisasi jaringan sehat inangnya secara interseluler dan atau intraseluler, tanpa adanya gejala yang terlihat dari luar. Mikroorganisme endofit dapat berupa cendawan, bakteri, dan aktinomiset (Chanway 1996; Ren & Wen 2001). Menurut Strobel dan Daisy (2003) terdapat 300.000 spesies tumbuhan di bumi dan tiap spesiesnya merupakan inang bagi satu atau lebih endofit. Cendawan endofit dalam satu inang, bahkan dalam satu organ tumbuhan dapat memiliki keragaman spesies yang sangat tinggi. Keragaman spesies atau strain biasanya berhubungan dengan keragaman bioaktif yang dihasilkan. Rakotoniriana et al. (2008) berhasil mengisolasi 45 cendawan endofit dengan karakter morfologi yang berbeda-beda dari daun Centellaasiatica.
Menurut Zhao etal. (2011), cendawan endofit pada tumbuhan merupakan sumber komponen bioaktif alami yang penting dan baru, salah satunya berupa zat antimikroba. Tumbuhan yang sering dieksplorasi cendawan endofitnya sebagai sumber zat antimikroba tersebut ialah tanaman obat, termasuk jati belanda. Tanaman obat telah diketahui sebagai inang yang baik bagi berbagai cendawan endofit (Hongsheng et al. 2010). Pemanfaatan sumberdaya yang baru ini dimungkinkan oleh kemampuan beberapa endofit menghasilkan komponen bioaktif yang sama atau mirip dengan inangnya (Ren & Wen 2001). Metabolit sekunder asal cendawan endofit memiliki aktifitas biologi dengan spektrum luas dan dikelompokkan dalam beberapa kategori, seperti alkaloid, steroid, terpenoid, quinon, alifatik, fenol dan asam fenola (Hua etal. 2006).
Jati Belanda merupakan salah satu tanaman obat di Indonesia yang penggunaanya telah digunakan secara turun-temurun. Daun jati belanda secara tradisional dimanfaatkan sebagai pelangsing tubuh karena mengandung komponen bioaktif berupa tanin, musilago, dan saponin (Dewoto 2007; Iswantini et al. 2011). Selain sebagai pelangsing tubuh, saponin dan tanin juga diketahui memiliki kemampuan sebagai antibakteri (Poeloengan & Praptiwi 2010).
Manfaat cendawan endofit yang potensial tersebut dapat dimanfaatkan untuk mengobati penyakit infeksi, terutama yang
disebabkan oleh bakteri patogen. Sejumlah bakteri patogen telah mengalami resistensi terhadap antibiotik, contohnya adalah resistensi Staphylococcus aureus terhadap oxacillin, tetrasiklin, dan trimetoprim (Shittu
et al. 2011). Oleh karena itu, perlu dilakukan identifikasi cendawan endofit asal tanaman obat dan penapisannya terhadap bakteri patogen. Identifikasi cendawan endofit dapat dilakukan dengan dua cara, yaitu secara morfologi dan molekuler. Kebanyakan cendawan endofit adalah cendawan yang sedikit menghasilkan spora, bahkan tidak menghasilkan spora sama sekali. Sehingga apabila melalui identifikasi secara morfologi belum dapat terkarakterisasi, maka perlu dilakukan identifikasi secara molekuler melalui ruas ITS rDNA (Schoch etal. 2012). Keragaman cendawan endofit asal tanaman obat sebagai sumber penghasil antibakteri sangat tinggi, namun belum banyak penelitian terhadap cendawan endofit tersebut terutama di Indonesia.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi karakteristik morfologi dan molekuler cendawan endofit asal jati belanda (Guazuma ulmifolia), sertapenapisan potensi antibakterinya.
BAHAN DAN METODE
Waktu dan TempatPenelitian ini dilaksanakan mulai bulan Februari sampai Desember 2012, bertempat di laboratorium BIORIN, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Institut Pertanian Bogor.
Alat dan Bahan
Bahan-bahan yang digunakan meliputi tiga isolat cendawan endofit (JBba3, JBba4, dan JBa5) koleksi PPSHB IPB, serta bakteri
Escherichia coli flora normal, Escherichia coli Enteropatogenik K1-1 (EPEC K1-1),
Penyiapan Kultur Cendawan Endofit Sebanyak tiga isolat cendawan endofit (JBba3, JBba4, dan JBa5) diremajakan pada media agar miring Potato Dextrose Agar
(PDA) dan disimpan sebagai stok pada suhu 27 °C. Selanjutnya, setiap isolat diremajakan pada media PDA di dalam cawan Petri untuk digunakan pada penapisan isolat cendawan endofit. Lamanya tahap peremajaan pada media PDA yaitu 7 hari.
Identifikasi secara Morfologi
Identifikasi dilakukan terhadap tiga isolat cendawan endofit asal tanama obat jati belanda (Guazuma ulmifolia) yaitu JBba3, JBba4, dan JBa5. Morfologi makroskopis yang diamati meliputi warna koloni, tekstur koloni (halus seperti kapas, seperti bulu, atau seperti beludru), diameter hari ke-7 pada media PDA, permukaan koloni (granular, seperti tepung, menggunung, atau licin), dan warna balik koloni. Siapan Riddle setiap isolat dibuat untuk memudahkan pengamatan struktur mikroskopis cendawan, yaitu menggunakan mikroskop Olympus BX51 yang dilengkapi dengan kamera digital. Strutkur mikroskopis yang diamati meliputi struktur miselia, konidiofor, konidia, apresoria, dan klamidospora. Identifikasi morfologi cendawan yang dilakukan mengacu pada Pitt dan Hocking (1997), Barnett dan Hunter (1998), Hong et al. (2000), Girlanda et al. (2002), Armengol et al. (2003), dan Weir
et al. (2012).
Identifikasi secara Molekuler
Isolat-isolat cendawan endofit dari media PDA dipindahkan ke media PDB untuk diagitasi menggunakan inkubator bergoyang berkecepatan 120 rpm selama 7 hari. Molekul DNA total diekstraksi dari miselium menggunakan metode CTAB Sambrook et al. (1989) yang telah dimodifikasi, yaitu tanpa penambahan β-Mercaptoethanol.
Kualitas molekul DNA hasil isolasi diperiksa dengan elektroforesis gel agarosa 1% yang dijalankan pada tegangan 100 V selama 30 menit dalam larutan penyangga TAE 1× (Lampiran 2). Selanjutnya gel agarosa direndam di dalam larutan EtBr 0.5 mg/l selama 15 menit dan dibilas dengan akuades, sehingga DNA dapat divisualisasikan menggunakan UV transluminator. Sampel yang menampilkan pita tunggal pada gel agarosa 1% dapat digunakan untuk amplifikasi ruas ITS
(InternalTranscribedSpacers) menggunakan mesin PCR (PolymeraseChainReaction).
Amplifikasi ruas ITS dilakukan menggunakan primer ITS 1 (5’-CCGTAGGTGAACCTGCGG-3’) dan primer ITS 4 (5’-TCCTCCGCTTATTGATATGC-3’). Komposisi campuran PCR dalam volume
10 l terdiri atas sampel DNA dengan
konsentrasi sebesar ± 100 ng/ml, primer
reverse dan primer forward (1 pmol/µl) masing-masing 0.3 l, dNTP 2 mM sebanyak 1 l, Taqpolymerase 5 U/µl sebanyak 0.2 l, buffer (+MgCl2) 10× sebanyak 1 l, dan
ddH2O sebanyak 6.2 l. Reaksi PCR
dilakukan dengan kondisi denaturasi awal pada suhu 95 oC selama 5 menit. Tahap berikutnya berupa 35 siklus yang terdiri atas denaturasi pada suhu 94 oC selama 30 detik,
annealing pada suhu 52 oC selama 30 detik,
dan pemanjangan ruas DNA pada suhu 72 oC selama 1 menit. Terakhir yaitu tahap pemanjangan akhir ruas DNA pada suhu 72
o
C selama 10 menit. Kualitas amplikon diperiksa dengan elektroforesis gel agarosa 1% dalam larutan penyangga TAE 1× dan difoto sebagai dokumentasi. Setelah amplifikasi ruas ITS, masing-masing sampel diperbanyak menjadi 6× reaksi dan dikirim ke PT. Genetika Science Indonesia untuk disekuensing.
Runutan nukleotida hasil sekuensing setiap sampel diedit dan disejajarkan menggunakan ClustalW Multiple Alignment
yang terdapat dalam BioEdit Sequence Alignment Editor versi 7.0.9.1. Hasil pensejajaran nukleotida setiap sampel kemudian ditelusuri spesies atau genusnya dengan membandingkan runutan nukleotida sampel dengan runutan nukleotida yang ada dalam database NCBI (National Center for Biotechnology). Hasil BLASTndengan jurnal yang telah dipublikasikan dijadikan acuan penentuan spesies atau genus masing-masing sampel.
Penapisan Potensi Antibakteri
Sebanyak tiga isolat cendawan endofit asal jati belanda (JBba3, JBba4, dan JBa5) diuji aktifitas antagonisnya terhadap EPEC K1-1, Staphylococcus aureus, Pseudomonas aeruginosa, dan Bacillus subtilis. Penapisan potensi antibakteri dilakukan terhadap bakteri
Penapisan potensi antibakteri isolat JBba3, JBba4, dan JBa5 terhadap E. coli flora normal dilakukan untuk memastikan bahwa antibakteri yang dihasilkan oleh cendawan endofit tidak mematikan E.coli flora normal.
E. coli flora normal diinokulasikan ke dalam 4 ml media Luria Bertani Broth (LBB), selanjutnya diinkubasi di dalam inkubator bergoyang berkecepatan 248 rpm pada suhu 37 °C selama semalam. Kepadatan koloni yang digunakan untuk penapisan potensi antibakteri sebesar 105-108 CFU/ml yang
dibaca pada panjang gelombang 600 nm. Selanjutnya sebanyak 50 µl biakan bakteri dipipet dan diteteskan ke cawan Petri berdiameter 6 cm berisi media Luria Bertani Agar (LBA). Biakan disebar dengan batang penggesek. Pada bagian tengah media diletakkan kultur cendawan berumur 7 hari dengan diameter 1 cm. Uji untuk setiap isolat cendawan endofit dilakukan triplo. Zona hambat diamati pada hari ke-1, ke-2, dan ke-3 setelah diinkubasi suhu 37 °C. Isolat cendawan yang tidak membunuh E. coli flora normal digunakan pada tahap penapisan berikutnya.
Penapisan potensi antibakteri menggunakan uji antagonis dilakukan terhadap kandidat isolat cendawan endofit yang tidak membentuk zona hambat terhadap
E. coli flora normal. Kandidat isolat cendawan endofit diuji terhadap empat bakteri patogen, yaitu EPEC K1-1, P. aeruginosa, B. subtilis, dan S. aureus. Pada tahap ini, pengujian terhadap E. coli flora normal dijadikan sebagai kontrol negatif. Metode penapisan potensi antibakteri pada tahap ini sama dengan metode penapisan sebelumnya (terhadap E. coli flora normal). Zona hambat diamati pada hari ke-1, ke-2, dan ke-3 setelah diinkubasi suhu 37 °C.
Penapisan potensi antibakteri menggunakan ekstrak cendawan menggunakan metanol dengan metode difusi kertas cakram dilakukan sebagai uji lanjutan dari metode penapisan dengan metode uji antagonis. Kandidat isolatnya yaitu yang menunjukkan adanya aktifitas antibakteri terhadap bakteri patogen. Penapisan ini dilakukan dengan menumbuhkan cendawan terlebih dahulu pada media PDB sebanyak 100 ml untuk diagitasi menggunakan inkubator bergoyang pada suhu 28 °C selama 14 hari. Miselia diambil dengan cara filtrasi menggunakan kertas saring dan vakum. Setelah itu miselium digerus menggunakan mortar steril dengan menambahkan nitrogen cair sedikit demi sedikit. Hasil penggerusan
dipindahkan ke dalam botol kaca dan dilarutkan dengan metanol absolut sebanyak 40 ml untuk proses maserasi ekstrak metabolit sekunder. Setelah itu, botol berisi sampel diagitasi menggunakan shaker pada suhu ruang. Setiap 24 jam maserat (biomassa) dipisahkan dari residu menggunakan kertas saring, kemudian maserat dilarutkan kembali dalam metanol murni dan diagitasi kembali pada suhu ruang. Proses tersebut diulangi sebanyak 3 kali. Perolehan residu dikumpulkan dalam satu tabung dan dipekatkan (hingga tersisa ± 5 ml) dengan menguapkan sebagian besar metanol absolut pada suhu 40 °C menggunakan rotavapor (rotary vacuum evaporator). Ekstrak cendawan menggunakan metanol yang telah dipekatkan digunakan untuk penapisan terhadap setiap bakteri uji.
Bakteri uji yang digunakan pada penapisan akhir ini diperoleh dengan metode yang sama seperti pada dua penapisan potensi antibakteri sebelumnya. Penapisan dilakukan secara aseptik dengan mengambil 50 µl biakan bakteri dan diteteskan ke cawan Petri berdiameter 9 cm yang berisi media LBA. Biakan disebar menggunakan batang penggesek, kemudian kertas cakram berdiameter 1 cm diletakkan di atas media untuk ditetesi 100 µl ekstrak metanol 100% yang telah dipekatkan.
Pelarut metanol yang diteteskan pada kertas cakram dan ekstrak cendawan menggunakan metanol yang diuji terhadap E.
coli flora normal digunakan sebagai kontrol negatif. Cefotaxime merupakan antibiotik dengan kemampuan daya hambat yang bersifat broad spectrum, sehingga dapat digunakan sebagai kontrol positif. Berdasarkan Pierce-Hendry dan Dennis (2010), cefotaxime dengan konsentrasi 8 dan 64 µg/ml dapat menekan pertumbuhan bakteri (Lampiran 3).
Seluruh perlakuan dibuat triplo dan diinkubasi pada suhu 37 °C pada tiga hari pertama, sedangkan pada sebelas hari berikutnya diinkubasi pada suhu ruang. Pengamatan zona hambat dilakukan pada hari ke-3, ke-7, ke-10, dan ke-14 inkubasi. Selain itu, rata-rata diameter zona hambatnya juga dihitung.
HASIL
Identifikasi secara MorfologiBerdasarkan ciri-ciri morfologi yang dijabarkan pada Tabel 1, isolat JBba3 teridentifikasi sebagai genus Rhizopycnis.
Isolat JBa5 tidak menghasilkan konidia, namun menghasilkan struktur klamidospora yang khas untuk genus Rhizopycnis, oleh karena itu isolat tersebut diidentifikasi sebagai genus Rhizopycnis. Sementara itu, isolat JBba4 teridentifikasi sebagai genus
Colletotrichum (Tabel 1). Tabel 1 Hasil identifikasi secara mikroskopis isolat JBba3, JBba4, dan JBa5
Isolat Karateristik mikroskopis Genus Spesies
JBba3 Diameter koloni hari ke-7 pada media PDA sebesar 5 cm (inkubasi suhu ruang); warna koloni atas abu dan putih; warna balik koloni hijau tua dan putih; tekstur seperti beludru; hifa berseptat, beberapa membengkak dengan warna gelap; memiliki konidia dengan septat yang melintang berjumlah 1-2, berwarna cokelat tua, berbentuk fusiform (seperti gelendong), dan panjangnya 21-26 µm (Gambar 1)
Rhizopycnis Rhizopycnis sp.1
JBba4 Diameter koloni hari ke-7 pada media PDA sebesar 6 cm (inkubasi suhu ruang); warna koloni atas putih keabuan, warna balik koloni hijau tua, cokelat, dan putih; permukaan koloni menggunung; tekstrur halus seperti kapas; hifa berseptat; apresoria bersel tunggal, berwarna cokelat tua, berbentuk tidak teratur (ireguler), mempunyai struktur berbentuk bulat dan menonjol di bagian tengah; konidia berbentuk silinder, ujung membulat, tidak berseptat, hialin, dan panjangnya 20-30 µm (Gambar 2)
Colletotrichum Colletotrichum sp.
JBa5 Diameter koloni hari ke-7 pada media PDA sebesar 4 cm (inkubasi suhu ruang); warna koloni atas abu putih, warna balik koloni hitam, hijau tua, dan putih; tekstur halus seperti kapas; hifa berseptat; mempunyai struktur klamidospora berwarna gelap dan tersusun seperti rantai yang merupakan ciri khas Rhizopycnis (Girlanda et al. 2002) (Gambar 3)
G
G
G
Gambar 1 Mo ba 10
Gambar 2 Mor baw perb
Gambar 3 Mo baw klam perb
orfologi Rhizop
awah, (C) penju 000×. Skala bar
rfologi Colleto
wah, (C-D) apre besaran 600×. S
orfologi Rhizop
wah, (C-D) kla midospora per rbesaran 1000×
pycnis sp.1 (iso uluran hifa, (D r 20 µm.
otrichum sp. (is esoria perbesar Skala bar 20 µ
pycnis sp.2 (iso amidospora ter rbesaran 1000× ×. Pewarnaan d
olat JBba3): (A D) hifa septat, (
solat JBba4): (A ran 1000×, (E)
m.
olat JBa5): (A rsusun seperti ×, (F) penjulura dengan lactoph
A) koloni tamp (E) konidiofor
A) koloni tamp hifa septat per
A) koloni tamp rantai perbes an hifa perbesa
enol cotton blu
pak atas, (B) k , (F-G) konidia
pak atas, (B) k rbesaran 1000×
ak atas, (B) ko aran 1000× da aran 1000×, (G
ue. Skala bar 2
koloni tampak a. Perbesaran
koloni tampak ×, (F) konidia
oloni tampak an 600×, (E) G) hifa septat
Identifikasi Secara Molekuler
Identifikasi ketiga isolat cendawan menggunakan primer ITS1 dan ITS4 yang bersifat universal. Amplikon menunjukkan pita tunggal dan tebal pada gel mempunyai ukuran sekitar 600 pb (Gambar 4). Hasil analisis runutan basa amplikon menggunakan program BLASTn menunjukkan bahwa
homologi dari isolat JBba3, JBba4, dan JBa5 secara berturut-turut teridentifiksai sebagai
Rhizopycnis vagum, Colletotrichum sp., dan
Rhizopycnis vagum dengan homologi 99%, 96%, dan 99%. (Tabel 2; Lampiran 4). Ketiga isolat cendawan endofit tersebut termasuk dalam filum Ascomycota.
Gambar 4 Amplikon ruas ITS yang memperlihatkan kualitas pita tunggal berukuran ±600 pb pada gel agarosa 1%: (M) Marker 1 Kb ladder, (ba4) JBba4, (ba3) JBba3, dan (a5) JBa5. Tabel 2 Hasil analisis bioinformatika menggunakan megaBLAST dari NCBI
Isolat Homologi No. Akses Skor Query
coverage E value
Max ident
JBba3 Rhizopycnis vagum isolat
REF096 JN859316.1 952 99% 0.0 98%
JBba4 Colletotrichum sp. IP-53 DQ780415.1 972 96% 0.0 99% JBa5 Rhizopycnis vagum isolat
REF096 JN859316.1 955 99% 0.0 99%
Penapisan Potensi Antibakteri
Berdasarkan penapisan potensi antibakteri awal terhadap E. coli flora normal diketahui bahwa ketiga isolat cendawan endofit yang diuji tidak mempengaruhi pertumbuhan bakteri tersebut, sehingga digunakan untuk pengujian terhadap bakteri patogen (Tabel 3).
Hasil penapisan potensi antibakteri terhadap bakteri patogen (EPEC K1-1, S.
aureus, P. aeruginosa, dan B. subtilis) menunjukkan bahwa hanya isolat JBba4 yang menunjukkan adanya potensi antibakteri terhadap EPEC K1-1 dan P. aeruginosa
(Tabel 4), sedangkan isolat JBba3 dan JBa5 tidak memiliki kemampuan antibakteri terhadap semua bakteri uji. Berdasarkan hasil penapisan tersebut, maka hanya isolat JBba4 yang diekstrak metabolit sekundernya dan diuji potensi antibakterinya dengan metode difusi cakram.
Ekstrak isolat JBba4 menggunakan metanol menekan pertumbuhan EPEC K1-1
dan P. aeruginosa (Gambar 5). Rata-rata diameter zona hambatnya berturut-turut
sebesar 13 dan 6.7 mm. Pertumbuhan E. coli
flora normal tidak terhambat oleh ekstrak isolat JBba4 menggunakan metanol, pelarut metanol, dan, antibiotik standar cefotaxime
konsentrasi 8 µg/ml (Tabel 5). Diameter zona hambat yang terbentuk konsisten dari hari ke-3 sampai ke-14 inkubasi.
Berdasarkan hasil analisis dari
Independent-Samples T Test, kemampuan pembentukan zona hambat isolat JBba4 terhadap EPEC K1-1 tidak berbeda nyata dengan kemampuan antibiotik standar
cefotaxime pada konsentrasi 8 dan 64 µg/ml. Hasil yang sama juga dijumpai pada efek zona hambat oleh isolat JBba4 terhadap P. aeruginosa. Kemampuan isolat JBba4 dalam menekan pertumbuhan P. aeruginosa sama dengan efektifitas antibiotik standar
cefotaxime pada konsentrasi 8 dan 64 µg/ml (Tabel 5).
Tabel 3 Hasil penapisan antibakteri isolat JBba3, JBba4, dan JBa5 terhadap E. coli flora normal pada hari ke-3 setelah inkubasi
Bakteri uji Kode isolat
JBba3 JBba4 JBa5
E. coli flora normal - - - Keterangan: - = tidak ada potensi antibakteri.
750 pb
Tabel 4 Hasil penapisan antibakteri isolat JBba3, JBba4, dan JBa5 terhadap empat bakteri uji pada hari ke-3 setelah inkubasi
Kode isolat
Bakteri uji
E. coli flora normal
(Kontrol -) EPEC K1-1 S. aureus P. aeruginosa B. subtilis
JBba3 - - - - -
JBba4 - + - + -
JBa5 - - -
Keterangan: - = tidak ada potensi antibakteri, + = ada potensi antibakteri.
Gambar 5 Penapisan aktifitas antibakteri isolat JBba4: (A) uji terhadap EPEC K1-1, (B) uji terhadap P. aeruginosa, (C) kontrol negatif terhadap E. coli flora normal, (D) kontrol negatif EPEC K1-1 terhadap metanol, (E) kontrol negatif P. aeruginosa terhadap metanol, (F) kontrol negatif E. coli flora normal terhadap metanol. Pengamatan pada hari ke-3 inkubasi. Keterangan gambar ditunjukkan oleh tanda panah.
Tabel 5 Rata-rata diameter zona bening yang dibentuk oleh ekstrak miselia dari isolat JBba4 menggunakan metanol, cefotaxime, dan pelarut metanol terhadap bakteri uji
Perlakuan
Rata-rata diameter zona bening (mm)
E. coli flora
normal EPEC K1-1 P. aeruginosa Ekstrak isolat JBba4 menggunakan metanol 0 13.0 ± 1.0 12.7 ± 1.2
Cefotaxime 8 µg/mL 0 25.5 ± 3.1 9.2 ± 8.1
Cefotaxime 64 µg/mL 13.7 ± 2.1 28.7 ± 3.6 19.3 ± 1.2
Metanol 100% 0 0 0
Keterangan: Rata-rata diameter zona bening yang terbentuk konsisten pada tiap selang waktu pengamatan hari ke-3, ke-7, ke-10, dan ke-14 setelah inkubasi.
Tabel 6 Hasil analisis Independent-Samples T Test antara ekstrak menggunakan metanol dari isolat JBba4 dengan kontrol positif pada konsentrasi 8 dan 64 µg/ml
Perbandingan diameter zona hambat terhadap EPEC K1-1 Signifikansi Ekstrak isolat JBba4 menggunakan
metanol
Cefotaxime 8 µg/ml 0.105
Cefotaxime 64 µg/ml 0.148
Perbandingan diameter zona hambat terhadap P. aeruginosa Signifikansi Ekstrak isolat JBba4 menggunakan
metanol
Cefotaxime 8 µg/ml 0.480
PEMBAHASAN
Karakteristik morfologi isolat JBba3 mengacu pada genus Rhizopycnis, spesies
Rhizopycnis sp.1. Isolat JBba3 menghasilkan struktur konidia berwarna cokelat tua sehingga memudahkan identifikasi. Berbeda dengan isolat JBa5 yang teridentifikasi sebagai genus yang sama, namun tidak menghasilkan struktur reproduksi aseksual pada media yang sama. Armengol et al.
(2003) melaporkan bahwa dari sepuluh isolat
Rhizopycnis vagum asal tanaman melon, terdapat beberapa isolat yang menghasilkan konidia dan terdapat pula isolat yang tidak menghasilkan konidia pada media PDA yang mengandung 0.5 mg/ml streptomisin sulfat. Pada penelitian tersebut, Rhizopycnis vagum
yang tidak bersporulasi pada media PDA ditumbuhkan pada berbagai media dan perlakuan untuk menginduksi pembentukan konidia, yaitu melalui inkubasi kultur cendawan pada suhu 25-27 °C di bawah near ultra violet (NUV) dan menumbuhkan cendawan pada media V-8juice agar (V8A), serta potongan akar melon steril pada media
water agar. Induksi spora menghasilkan banyak konidia pada perlakuan dengan NUV dan media water agar, namun hanya sedikit konidia yang terbentuk pada media V8A dan PDA, sehingga ketiadaan konidia pada isolat JBa5 dapat disebabkan oleh tidak dilakukannya perlakuan induksi spora.
Berdasarkan laporan Girlanda et al. (2002) dan Armengol et al. (2003), ciri
Rhizopycnis vagum selain menghasilkan konidia ialah membentuk mikrosklerotia pada isolat yang jarang bersporulasi pada akar inang; sering membentuk klamidospora berwarna cokelat yang tersusun dalam rantai panjang atau pendek. Rhizopycnis vagum
diketahui sebagai patogen pada melon (Cucumis melo) dan semangka (Citrullus lanatus). Gejala yang ditimbulkan meliputi busuk pada akar, perubahan warna akar, dan menurunkan laju pertumbuhan melon di perkebunan California dan Spanyol (Aegerter
et al. 2000; Armengol et al. 2003). Selain sebagai patogen, Rhizopycnis vagum juga dilaporkan sebagai cendawan endofit pada tanaman obat Dioscorea zingiberensis yang memiliki aktifitas antibakteri terhadap
Escherichia coli, Xanthomonas vesicatoria, dan Bacillus subtilis (Xu et al. 2008). Keberadaan Rhizopycnis vagum sebagai cendawan endofit dilaporkan juga oleh Girlanda et al. (2002), yang merupakan dark sterile mycelia yang membentuk struktur
mikrosklerotia di dalam jaringan korteks akar,
Rosmanirus officinalis sebagai inangnya. Berdasarkan karakteristik morfologi, isolat JBba4 ialah genus Colletotrichum¸ spesies Colletotrichum sp. Terdapat beberapa persamaan dan perbedaan antara
Colletotrichum sp. isolat JBba4 dengan
Colletotrichum yang dideskripsikan oleh Pitt dan Hocking (1985), serta Colletotrichum sp. asal tanaman obat Artemisia annua yang dideskripsikan oleh Hong et al. (2000). Persamaan ciri-ciri konidia; bersel tunggal, hialin, berbentuk silindris, nonseptat, ujung membulat, dan lurus. Persamaan ciri-ciri koloni tampak atas; berwana putih dan abu. Persamaan ciri-ciri apresoria; bersel tunggal, warna cokelat tua, bentuk tidak teratur (ireguler), seringkali mempunyai struktur berbentuk bulat dan menonjol. Perbedaan konidia; berbentuk elips dan melengkung, ukuran 4.0-5.1 × 11.8-15.2 µm. Perbedaan koloni tampak bawah; berwarna abu dan hijau tua.
Genus Colletotrichum lebih dikenal secara luas sebagai cendawan patogen, khususnya spesies Colletotrichum capsici
sebagai penyebab penyakit busuk buah pada cabai. Menurut Promputtha et al. (2007), genus Colletotrichum diketahui sebagai cendawan endofit yang umum ditemukan pada tumbuhan. Wu et al. (2012) mengidentifikasi 145 isolat cendawan endofit asal Taxus chinensis var. mairei dan menemukan bahwa
Colletotrichum merupakan salah satu genus yang dominan ditemukan sebagai endofit. Peran lain Colletotrichum di alam telah dilaporkan oleh Promputtha et al. (2007), berdasarkan analisis hubungan filogeni ditemukan bahwa genus Colletotrichum
merupakan endofit yang memiliki kemampuan saprofitik pada tanaman
Magnolia liliifera. Hal tersebut mengindikasikan bahwa cendawan endofit,
Colletotrichum dapat mengubah strategi ekologinya saat kematian jaringan inang.
sudah terbentuk pada hari ke-13 setelah inokulasi, sedangkan pada isolat JBa5 hanya ditemukan struktur klamidospora pada umur 28 hari. Perbedaan yang teramati dapat disebabkan oleh perbedaan fase pertumbuhan dan hilangnya atau menurunnya kemampuan menghasilkan konidia dari spesies
Rhizopycnis sp.2 pada media PDA.
Rhizopycnis vagum dan Colletotrichum
dikenal luas sebagai cendawan patogen, namun tiga isolat cendawan dalam penelitian ini (JBba3, JBba4, dan JBa5) telah diisolasi dari jaringan tanaman yang sehat.
Menurut Schoch et al. (2012), identifikasi molekuler cendawan pada tingkat spesies umumnya dilakukan dengan menganalisis ruas Internal Transcribed Spacer (ITS) rDNA, yaitu menggunakan primer ITS 1 dan ITS 4. Ruas ITS merupakan ruas berulang yang terdapat dalam jumlah banyak (high copy number). Ruas ITS memiliki tingkat keberhasilan paling tinggi untuk identifikasi cendawan, selain itu ruas ITS mampu mengkarakterisasi intra- dan interspesies dengan jelas karena variasi genetiknya yang tinggi (hypervariable). Ruas ITS biasanya mengacu pada ITS 1, ITS 2, dan gen 5.8S rRNA.
Jati belanda menghasilkan metabolit sekunder berupa musilago, alkaloid, flavonoid, saponin, tanin, dan steroid. Metanol dapat melarutkan senyawa alkaloid, flavonoid, tanin, dan saponin pada proses ekstraksi tanaman jati belanda (Dewoto 2007; Iswantini
et al. 2011). Pemilihan pelarut yang tepat sangat penting, karena menurut Dewoto (2007), jenis pelarut yang digunakan dalam proses ekstraksi dapat mempengaruhi ekstrak yang diproduksi karena adanya perbedaan kelarutan zat aktif. Berdasarkan uji fitokimia yang dilakukan oleh Iswantini et al. (2011), komponen bioaktif yang dominan ditemukan di dalam jati belanda adalah tanin dan flavonoid. Oleh sebab itu, diduga pembentukan zona hambat pada koloni bakteri uji EPEC K1-1 dan P. aeruginosa
kemungkinan disebabkan oleh tanin dan flavonoid atau komponen bioaktif lainnya yang mungkin dihasilkan oleh isolat JBba4.
Beberapa peneliti telah melaporkan kemampuan antibakteri oleh tanin dan flavonoid. Ajizah (2004) mengekstrak daun
Psidium guajava yang diduga mengandung tanin, setelah diuji secara in vitro diketahui bahwa ekstrak daun tersebut memiliki aktivitas antibakteri terhadap Salmonella typhimurium. Selain itu, senyawa flavonoid asal daun Terminalia muelleri telah berhasil
diisolasi, diidentifikasi, dan diuji oleh Ariyanti
et al. (2013). Senyawa flavonoid dari daun
Terminalia muelleri dilaporkan memiliki daya hambat terhadap Staphylococcus epidermidis
dan Pseudomonas aeruginosa. Sejumlah senyawa bioaktif yang berperan sebagai antibakteri telah dirangkum dari berbagai hasil penelitian oleh Hongsheng et al. (2010). Berdasarkan hasil rangkuman tersebut diketahui bahwa senyawa bioaktif berupa kelompok alkaloid, flavonoid, peptida, fenol, quinon, steroid, dan terpenoid mampu menghambat petumbuhan sejumlah bakteri patogen.
Antibiotik yang biasa digunakan untuk menyembuhkan penyakit infeksi yang disebabkan oleh bakteri gram negatif dan positif ialah golongan β-laktam, namun penggunaannya yang tidak tepat dan berulang telah membentuk mekanisme resistensi oleh bakteri-bakteri tersebut. Salah satu mekanisme resistensi yang terbentuk ialah adanya gen pengkode enzim β-laktamase yang dapat terkandung di dalam plasmid maupun kromosom bakteri (Vignoli et al. 2005; Lastovetska 2012), sehingga diperlukan pemilihan antibiotik yang tepat sebagai kontrol positif. Antibiotik golongan β-laktam terdiri atas empat kelas yang dibedakan berdasarkan aktifitas spektrum dan afinitas pengikatan targetnya. Keempat kelas tersebut ialah penisilin, sefalosporin, monobaktam, dan karbapenem. Cefotaxime merupakan antibiotik generasi ke-3 dari kelas sefalosporin yang memiliki aktifitas antimikroba terhadap enterobakteria dan stabilitas yang lebih tinggi terhadap hidrolisis β-laktamase, sehingga mampu membunuh bakteri yang memiliki mekanisme resistensi terhadap antibiotik golongan β-laktam lainnya (Lastovetska 2012).
Dua isolat cendawan endofit yang tidak menunjukkan adanya aktifitas antibakteri adalah JBba3 dan JBa5. Keduanya berasal dari spesies yang sama berdasarkan identifikasi molekuler, yaitu Rhizopycnis vagum. Sementara itu, isolat JBba4 yang menunjukkan aktifitas antibakteri berasal dari spesies Colletotrichum sp. Ren dan Wen (2001) melaporkan bahwa Colletotrichum sp. yang diisolasi dari tanaman obat Artemisia annua menghasilkan beberapa metabolit sekunder seperti senyawa turunan indol yang baru, yaitu 6-isoprenylindole-3-carboxylic acid, senyawa tersebut menunjukkan aktifitas antibakteri terhadap Bacillus subtilis,
melaporkan bahwa Colletotrichum sp. asal tanaman obat Artemisia annua menghasilkan tiga senyawa bioaktif baru dan tiga senyawa turunan ergosterol yang mampu menghambat pertumbuhan Bacillus subtilis, Staphylococcus aureus, Pseudomonas sp., dan Sarcina lutea. Cendawan endofit diduga mengandung komponen bioaktif yang sama dengan inangnya (Ren & Wen 2001). Contohnya yaitu cendawan endofit Pestalotiopsis microspora menghasilkan senyawa antikanker taxol yang sama dengan tanaman inangnya,
Taxus wallachiana (Strobel et al. 1996).
Metabolit sekunder merupakan senyawa yang seringkali dihasilkan oleh kelompok organisme tertentu pada suatu bagian dari siklus hidupnya. Organisme yang biasanya memproduksi metabolit sekunder yaitu tumbuhan, bakteri, dan cendawan. Metabolit sekunder berasal dari beberapa prekursor yang dibentuk selama metabolisme primer. Metabolit sekunder cenderung diakumulasi dan diproduksi terus-menerus, namun tidak didegradasi. Selain itu, metabolit sekunder seringkali aktif secara biologis, yaitu memiliki efek terhadap organisme lain. (Kendrick 1992).
Pembentukan diameter zona hambat selalu lebih besar terhadap EPEC K1-1, baik pada perlakuan ekstrak isolat JBba4 menggunakan metanol maupun cefotaxime
konsentrasi 8 dan 64 µg/ml. Hal ini dapat disebabkan oleh struktur dinding sel bakteri Gram negatif (EPEC K1-1) yang lebih tipis dibandingkan dengan bakteri Gram positif (P. aeruginosa), sehingga menyebabkannya lebih rentan terhadap antibiotik. Selain itu, diameter zona hambat yang terbentuk oleh kontrol positif berbanding lurus dengan konsentrasi
cefotaxime. Semakin tinggi konsentrasi
cefotaxime yang diberikan, maka akan semakin besar diameter zona hambatnya. Nilai signifikansi di atas 0.05 menunjukkan bahwa penghambatan pertumbuhan kedua bakteri patogen oleh ekstrak isolat JBba4 menggunakan pelarut metanol sama dengan kemampuan penghambatan cefotaxime, baik pada konsentrasi 8 maupun 64 µg/ml. Ekstrak isolat JBba4 dapat dijadikan sebagai sumber antibakteri yang lebih baik, karena tidak menghambat pertumbuhan E. coli flora normal, dibandingkan dengan cefotaxime yang dapat membunuh flora normal pada konsentrasi 64 µg/ml.
Terdapat beberapa faktor dalam penelitian ini yang menyebabkan kecilnya pembentukan diameter zona hambat oleh isolat JBba4 dibandingkan dengan cefotaxime.
Faktor pertama yaitu tingkat kemurnian ekstrak; ekstrak isolat JBba4 menggunakan metanol merupakan ekstrak kasar, sehingga metabolit asal isolat JBba4 berpotensi memiliki kemampuan antibakteri yang lebih besar dibandingkan cefotaxime. Faktor kedua yaitu fase pertumbuhan; produksi metabolit sekunder terjadi setelah fase eksponensial (fase menurun), sehingga umur kultur cendawan yang digunakan untuk penapisan antibakteri berpengaruh terhadap produksi metabolit sekundernya. Faktor ketiga yaitu sekresi metabolit sekunder; terdapat kemungkinan bahwa sebagian besar metabolit yang dihasilkan oleh cendawan bersifat ekstraseluler, sehingga konsentrasi metabolit pada miselia rendah.
SIMPULAN
Isolat JBba3 dan JBa5 teridentifikasi sebagai spesies yang sama, yaitu Rhizopycnis vagum. Sementara itu, isolat JBba4 teridentifikasi sebagai spesies Colletotrichum
sp. Ekstrak miselia isolat JBba4 mengguanakan metanol dapat menghambat pertumbuhan bakteri EPEC K1-1 dan
Pseudomona aeruginosa dengan daya hambat yang sama dengan antibiotik cefotaxime, baik pada konsentrasi 8 maupun 64 µg/ml.
SARAN
Perlu dilakukan penapisan lanjutan menggunakan ekstrak cendawan endofit dengan jenis pelarut lainnya dalam berbagai konsentrasi, sehingga dapat dibandingkan efektifitas potensi antibakterinya.
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada Cinta Rohani B. Ginting yang telah membantu menyediakan isolat-isolat cendawan endofit dan Dr.dr. Sri Budiarti yang telah menyediakan isolat-isolat bakteri uji. Penelitian ini didsanai dari dana penelitian Hibah Kerjasama Internasional Tahun 2010 a.n. Dr. Utut Widyastuti.DAFTAR PUSTAKA
Aegerter BJ, Gordon TR, Davis RM. 2000.Occurrence and pathogenicity of fungi associated with melon root rot and vine decline in California. Plant Disease
Ajizah A. 2010. Sensitivitas Salmonella typhimurium terhadap ekstrak daun
Psidium guajava L. Bioscientiae
[internet]. [diunduh 7 Feb 2103]; 1(1):31-38. Tersedia pada: http: //bioscientiae.unlam.ac.id/v1n1.htm Ariyanti DA, Anam K, Kusrini D. 2013.
Identifikasi senyawa flavonoid dari daun ketapang kencana (Terminalia muelleri Benth.) dan uji aktivitas sebagai antibakteri penyebab bau badan. Chem Info [internet]. [diunduh 7 Feb 2103]; 1(1):94-100. Tersedia pada:http://ejournal-s1.undip.ac.id/ index.php/kimia/article/view/1858 Armengol J, Vicent A, Martinez-Culebras P,
Bruton BD, Garcia-Jimenes J. 2003. Identification, occurrence, and pathogenicity of Rhizopycnis vagum on muskmelon in Spain. Plant Pathol
52(1):68-73.doi:10.1046/j.1365-3059. 2003.00796.x
Barnett HL, Hunter BB. 1998. Illustrated Genera of Imperfect Fungi. 4th Ed. New Jersey (US): Prentice Hall Chanway CP. 1996. Endophytes: they’re not
just fungi!. Can J Bot 74(3):321-322.doi: 10.1139/b96-040
Dewoto HR. 2007. Pengembangan obat tradisional Indonesia menjadi fitofarmaka. Maj Kedokt Indones
[internet]. [diunduh 31 Jan 2103]; 57(7):205-211. Tersedia pada:
indonesia.digitaljournals.org/index.ph p/.../520
Girlanda M, Ghignone S, Luppi AN. Diversity of sterile root-associated fungi of two Mediterranean plants. 2002. New Phytol 155(3):481-498.doi:10.1046/j. 1469-8137.2002.00474.x
Hong L, Wen XZ, Jun CM, Jun H, Ren XT. 2000. New bioactive metabolites produced by Colletotrichum sp., an endophytic fungus in Artemisia annua.
Plant Sci 151(1):67-73.doi:10.1016 /S0168-9452
Hongsheng Y, Lei Z, Lin L, Chengjian Z, Lei G, Wenchao L, Peixin S, Luping Q. 2010. Recent developments and future prospects of antimicrobial metabolites produced by endophytes. Microbiol Res 165:437-449.doi:10.1016/j.micres. 2009.11.009
Hua WZ, Yong CS, Ren XT. 2006. Biology and chemistry of endophytes. Nat Prod Rep 23:753-771.doi:10.1039/b609472b Iswantini D, Silitonga RF, Martatilofa E,
Darusman LK. 2011. Zingiber cassumunar, Guazuma ulmifolia, and
Murraya paniculata extracts as antiobesity: in vitro inhibitory effect on pancreatic lipase activity. Hayati J Biosci 18(1):6-10.doi:10.4308/hjb.18.1 .6
Kendrick B. 1992. The Fifth Kingdom. 2nd Ed. Waterloo (CA): Mycologue
Lastovetska O. 2012. Surveillance of extended-spectrum cephalosporin- and carbapenem- resistance in Escherichia coli from the Greater Toronto Area (GTA), Ontario, Canada [tesis]. Toronto: Laboratory Medicine and Pathobiology Univerity of Toronto Pierce-Hendry SA, Dennis F. 2010. Bacterial
culture and antibiotic susceptibility testing. Compendium:E1-E5
Pitt JI, Hocking AD. 1985. Fungi and Food Spoilage. Sydney (AU): Academic Pr Poeloengan M, Praptiwi. 2010. Uji aktivitas
antibakteri ekstrak kulit buah manggis (Garcinia mangostana Linn). Media Litbang Kesehatan [internet]. [diunduh 7 Feb 2103]; 20(2):65-69. Tersedia pada: http://ejournal.litbang.depkes. go.id/index.php/MPK/article/view/784
Promputtha I, Lumyong S, Dhanasekaran V, McKenzie EH, Hyde KD, Jeewon R. 2007. A phylogenetic evaluation of whether endophytes become saprotrophs at host senescence.
Microbial Ecol 53:579-590.doi: 10.1007/s00248-006-9117-x
Rakotoniriana EF, Munaut F, Decock C,
Randriamampionona D, Andriambololoniaina M, Rakotomalala
T, Rakotonrina EJ, Rabemanantsoa C, Cheuk K, Ratsimamanga SU et al. 2008. Endophytic fungi from leaves of
Centella asiatica: occurrence and potential interactions within leaves.
Antonie van Leeuwenhoek 93:27-36.doi:10.1007/s10482-007-9176-0 Ren XT, Wen XZ. 2001. Endophytes: a rich
Sambrook J, Fritsch EF, Maniatis T. 1989.
Molecular cloning a laboratory manual. 2nd Ed. New York (US): Cold Spring Harbor Lab Pr
Schoch CL, Seifert KA, Huhndorf S, Robert V, Spouge JL, Levesque CA, Chen W, Fungal Barcoding Consortium. 2012. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for fungi. PNAS 109(16):6241-6246.doi:10.1073/pnas.1 117018109
Shittu AO, Okon K, Adesida S, Oyedara O, Witte W, Strommenger B, Layer F, Nubel U. 2011. Antibiotic resistence and molecular epidemiology of
Staphylococcus aureus in Nigeria.
BMC Microbiol 11(92):1-8.doi:10.1186/1471-2180-11-92 Strobel G, Yang X, Sears J, Kramer R, Sidhu
RS, Hess WM. 1996. Taxol from
Pestalotiopsis microspora, an endophytic fungus of Taxus wallachiana. Microbiology 142(2): 435-440.doi:10.1099/13500872-142-2-435
Strobel G, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiol Mol Biol Rev
67(4):491-502.doi:10.1128/MMBR.67. 4.491-502.2003
Vignoli et al. 2005. Enteropathogenic
Escherichia coli strains carrying genes encoding the PER-2 and TEM-116 extended-spectrum β-lactamases isolated from children with diarrhea in Uruguay. J Clinical Microbiol 43(6): 2940-2943.doi:10.1128/JCM43.6.2940 -2943.2005
Weir BS, Johnston PR, Damm U. 2012. The
Colletotrichum gloeosporioides species complex. Studies Mycol 73(1):115-180.doi:10.3114/sim0011
Wu L, Han T, Li W, Jia M, Xue L, Rahman K, Qin L. 2012. Geographic and tissue influences on endophytic fungal communities of Taxus chinensis var.
mairei in China. Curr Microbiol
66(1)40-48.doi:10.1007/s00284-012-0235-z.Xu et al. 2008. Fungal endophytes from Dioscorea zingiberensis rhizomes and their antibacterial activity. Lett Appl Microbiol 46:68-72
Lampiran 1 Cara membuat larutan CTAB 2%
Komposisi:
Cetyl Trimethyl-Ammonium Bromide 2 g ddH2O 100 ml
Cara membuat larutan CTAB:
1. Sebanyak 2 g CTAB dimasukkan ke dalam labu Erlenmeyer 100 ml 2. Sebanyak 100 ml ddH2O ditambahakan ke dalam labu Erlenmeyer
Lampiran 2 Cara membuat larutan TAE 1× dari stok larutan TAE 50×: Komposisi stok TAE 50× dalam 1 l:
1. Tris-base 242 g
2. Asetat (asam asetat 100%) 57.1 ml 3. EDTA (5 M sodium EDTA) 100 ml
Cara membuat larutan TAE 1× dalam 1 l:
1. Sebanyak 20 ml stok TAE 50× dimasukkan ke dalam labu Erlenmeyer 1000 ml 2. Sebanyak 980 ml ddH2O ditambahakan ke dalam labu Erlenmeyer
Lampiran 3 Cara membuat larutan antibiotik cefotaxime 8 µg/ml dan 64 µg/ml Komposisi:
Cefotaxime 1 g ddH2O 10 ml
Cara membuat:
1. Sebanyak 1 g cefotaxime dilarutkan ke dalam 10 ml ddH2O menggunakan siringe
sehingga diperoleh larutan stok dengan konsentrasi 100000 µg/ml
2. Sebanyak 4 µl stok cefotaxime diambil menggunakan siringe dan disaring menggunakan kertas milipore (diameter 0.22 µm) ke dalam Labu Erlenmeyer berisi 50 ml ddH2O,
sehingga diperoleh konsentrasi larutan sebesar 8 µg/ml
3. Sebanyak 32 µl stok cefotaxime diambil menggunakan siringe dan disaring menggunakan kertas milipore dalam Labu Erlenmeyer berisi 50 ml ddH2O, sehingga diperoleh
konsentrasi larutan sebesar 64 µg/ml
4. Larutan disimpan di dalam kulkas selama semalam sebelum digunakan
Contoh perhitungan:
1. Cefotaxime konsentrasi 8 µg/ml
2. Cefotaxime konsentrasi 64 µg/ml
V1 × M1 = V2 × M2
X × 100000 µg/ml = 50 ml × 8 µg/ml X = 400 ml : 100000 µg/ml
X = 0.004 ml X = 4 µl
X × 100000 µg/ml = 50 ml × 64 µg/ml
X = 0.032 ml
X = 3200 ml : 100000 µg/ml
Lampiran 4 Hasil analisis bioinformatika menggunakan megaBLAST dari NCBI 1. Homologi isolat JBba3 dan JBa5
Rhizopycnis vagum isolate REF096 18S ribosomal RNA gene, partial sequence; internal
transcribed spacer 1, 5.8S ribosomal RNA gene, and internal transcribed spacer 2, complete sequence; and 28S ribosomal RNA gene, partial sequence
GenBank: JN859316.1 FASTA Graphics Go to:
LOCUS JN859316 573 bp DNA linear PLN 19-MAR-2012 DEFINITION Rhizopycnis vagum isolate REF096 18S ribosomal RNA gene, partial sequence; internal transcribed spacer 1, 5.8S ribosomal RNA gene,
and internal transcribed spacer 2, N VERSION JN859316.1 GI:380003951 KEYWORDS .
SOURCE Rhizopycnis vagum
ORGANISM Rhizopycnis vagum
Eukaryota; Fungi; Dikarya; Ascomycota; mitosporic Ascomycota; Rhizopycnis.
REFERENCE 1 (bases 1 to 573)
AUTHORS Knapp,D.G., Pintye,A. and Kovacs,G.M.
TITLE The dark side is not fastidious - dark septate endophytic fungi of native and invasive plants of semiarid sandy areas
JOURNAL PLoS ONE 7 (2), E32570 (2012) PUBMED 22393417
REMARK Publication Status: Online-Only REFERENCE 2 (bases 1 to 573)
AUTHORS Knapp,D.G., Pintye,A. and Kovacs,G.M. TITLE Direct Submission
JOURNAL Submitted (14-OCT-2011) Department of Plant Anatomy, Eotvos Lorand University, Pazmany Peter Setany 1/C, Budapest 1117, Hungary
FEATURES Location/Qualifiers source 1..573
/organism="Rhizopycnis vagum" /mol_type="genomic DNA" /isolate="REF096"
/isolation_source="plant root" /host="Juniperus communis" /db_xref="taxon:66823" /tissue_type="mycelia"
/country="Hungary: Fulophaza" /lat_lon="46.86 N 19.42 E" /collection_date="2008"
rRNA <1..61
/product="18S ribosomal RNA" misc_RNA 62..201
/product="internal transcribed spacer 1" rRNA 202..357
/product="5.8S ribosomal RNA" misc_RNA 358..515
/product="internal transcribed spacer 2" rRNA 516..>573
/product="28S ribosomal RNA" ORIGIN
1 aattagagga agtaaaagtc gtaacaaggt ttccgtaggt gaacctgcgg aaggatcatt 61 aacgatttcg gtgtaaaaaa ccgttttcta cctatgtcta cgcgtaccac ttgtttcctc 121 ggggggcttg ccccccgcta ggacccttta tcaaaccttt ttgtaatagc agtcagcgtc 181 tgatactaag ttaattatta aaactttcaa caatggatct cttggttctg gcatcgatga 241 agaacgcagc gaaatgcgat aagtagtgtg aattgcagaa ttcagtgaat catcgaatct 301 ttgaacgcac attgcgcccc ttggtattcc atggggcatg cctgttcgag cgtcatttga 361 accctcaagc tctgcttggt gttgggtgtt tgtcccgcca ttgcgcgtgg actcgcctta 421 aagcaattgg cagccatgta atccggcttt gagcgcagca cattgcgtac tctctactgg 481 gacatgggca tccagaagcc ttattttttt actcttgacc tcggatcagg tagggatacc 541 cgctgaactt aagcatatca ataagcggag gaa
2. Homologi isolat JBba4
Colletotrichum sp. IP-53 18S ribosomal RNA gene, partial sequence; internal transcribed
spacer 1, 5.8S ribosomal RNA gene, and internal transcribed spacer 2, complete sequence; and 28S ribosomal RNA gene, partial sequence
GenBank: DQ780415.1 FASTA Graphics PopSet
LOCUS DQ780415 554 bp DNA linear PLN 13-AUG-2006 DEFINITION Colletotrichum sp. IP-53 18S ribosomal RNA gene, partial sequence; internal transcribed spacer 1, 5.8S ribosomal RNA gene, and
internal transcribed spacer 2, complete sequence; and 28S ribosomal RNA gene, partial sequence.
ACCESSION DQ780415
VERSION DQ780415.1 GI:111379269 KEYWORDS .
SOURCE Colletotrichum sp. IP-53 ORGANISM Colletotrichum sp. IP-53
Eukaryota; Fungi; Dikarya; Ascomycota; Pezizomycotina;
Sordariomycetes; Hypocreomycetidae; Glomerellales; Glomerellaceae; mitosporic Glomerellaceae; Colletotrichum.
REFERENCE 1 (bases 1 to 554)
AUTHORS Promputtha,I., Lumyong,S., Dhanasekaran,V., McKenzie,E.H.C., Hyde,K.D. and Jeewon,R.
TITLE A phylogenetic evaluation of whether endophytes become saprotrophs at host senescence
JOURNAL Microb. Ecol. (2006) In press REFERENCE 2 (bases 1 to 554)
AUTHORS Promputtha,I. TITLE Direct Submission
JOURNAL Submitted (15-JUN-2006) Biology, Faculty of Science, Chiang Mai University, Hauy Kaew Road, Muang, Chiang Mai 50200, Thailand FEATURES Location/Qualifiers
source 1..554
/organism="Colletotrichum sp. IP-53" /mol_type="genomic DNA"
/isolate="Endophyte 53" /db_xref="taxon:397763"
/note="PCR_primers=fwd_name: ITS5, rev_name: ITS4" misc_RNA <1..>554
/note="contains 18S ribosomal RNA, internal transcribed spacer 1, 5.8S ribosomal RNA, internal transcribed spacer 2, and 28S ribosomal RNA"
ORIGIN
61 catgttgctt cggcggtcgg ccccccgggc ccccggcccc gctcacgcgg ggcgtccgcc 121 ggaggataac caaactctga tttaacgacg tttcttctga gtggcacaag caaataatca 181 aaacttttaa caacggatct cttggttctg gcatcgatga agaacgcagc gaaatgcgat 241 aagtaatgtg aattgcagaa ttcagtgaat catcgaatct ttgaacgcac attgcgcccg 301 ccagcattct ggcgggcatg cctgttcgag cgtcatttca accctcaagc actgcttggt 361 gttggggctc tacggttgac gtaggccccc aaaactagtg gcggaccctc tcggagcctc 421 ctttgcgtag taacttttgt ctcgcactgg gattcggagg gattctagcc gttaaacccc 481 caattttcta aaggttgacc tcggatcagg taggaatacc cgctgaactt aagcatatca 541 ataagcggag gaaa